Область техники
[0001] Настоящее изобретение относится к способу получения композиций натуральных синих антоцианинсодержащих красителей путем селективного выделения фракций молекул антоцианина из соков и экстрактов антоцианинсодержащих овощей и плодов.
Уровень техники
[0002] В пищевой промышленности растет интерес к замещению натуральными красителями синтетических материалов для окрашивания пищевых продуктов.
[0003] Одной из проблем замещения синтетических красителей натуральными красителями является идентификация натуральных красителей, обеспечивающих цветовые характеристики, аналогичные таковым, обеспеченным синтетическими красителями.
[0004] До настоящего времени не найдены натуральные красители, обеспечивающие те же цветовые характеристики, что и синтетический синий краситель FD&C Blue No.1. Отсутствие подходящих натуральных красителей зеленовато-синего цветового тона также сделало проблематичным получение желаемых натуральных красителей зеленого цветового тона смешиванием натурального синего и желтого красителей. В качестве натурального синего красителя используют голубую спирулину, синевато-зеленый материал, полученный из водорослей, но он не обеспечивает такие же цветовые характеристики, как у FD&C Blue No.1.
[0005] Антоцианины представляют водорастворимые соединения, находящиеся в вакуолях клеток плодов, овощей и лепестков цветов, и иногда корней, листьев, стеблей, и коры растений. По меньшей мере от части в виду широкой доступности соков и экстрактов антоцианинсодержащих овощей и плодов, их используют в качестве натуральных пищевых красителей и получают композиции красителей, в частности натуральные красители, красного, пурпурного и синего цветовых тонов.
[0006] Антоцианин содержит антоцианидин (агликон) переэтерифицированный одной или более молекулой сахара (гликон(ы)) с получением гликозида. Молекулы сахара могут быть присоединены в C-3, C-5, C-7, C-3', C-4' и/или C-5' позициях. Примеры молекул сахара, присутствующих в структурах антоцианина, представляют арабинозу, галактозу, глюкозу, рамнозу, рутинозу, самбубиозу, софорозу и ксилозу.
[0007] Также антоцианины могут быть ацилированны, то есть, они могут иметь одну или более молекулу, переэтерифицированную молекулой сахара, как правило, в 6-позиции моносахарида, но также потенциально во 2-, 3- или 4-позициях. Самые распространенные ацильные единицы включают таковые, полученные из кумариновой кислоты, феруловой кислоты, кофеиновой кислоты, синаповой кислоты, галлиевой кислоты, малоновой кислоты, уксусной кислоты, яблочной кислоты, янтарной кислоты, ванилиновой кислоты и щавелевой кислоты.
[0008] Структура антоцианидина представлена ниже в форме флавилиевых катионов, которые представляют первичную форму в кислых условиях. Антоцианидин может быть замещен водородом, гидроксильной и/или метоксильной группами в различных позициях:
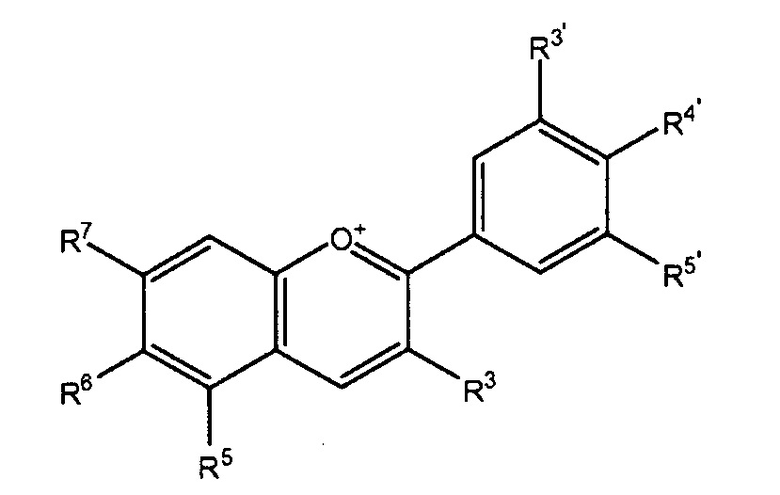
где R3 представляет H или OH,
R5 представляет H, OH или OCH3,
R6 представляет H или OH,
R7 представляет OH или OCH3,
R3' представляет H, OH или OCH3,
R4' представляет OH или OCH3 и
R5' представляет H, OH или OCH3.
[0009] Самые распространенные в природе антоцианидины представляют следующие структуры:
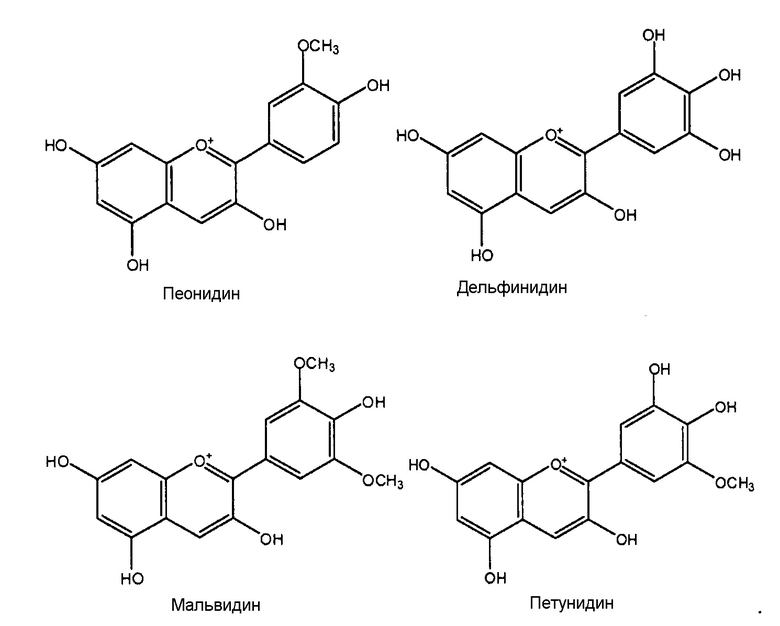
[0010] Следовательно, класс соединений, известных как антоцианины, включает огромное количество структурно различных соединений на основе различий первичной структуры, гликозилированных и ацилированных моделей.
[0011] Известные растительные источники антоцианинов включают: (1) овощи, такие как краснокочанная капуста, фиолетовый сладкий картофель, синий картофель, красный картофель, красный редис, черная морковь, фиолетовая морковь, фиолетовая кукуруза, красная кукуруза, красный лук, фиолетовая брокколи, красная брокколи, фиолетовая цветная капуста, корень ревеня, черные бобы, красный листовой салат, черный рис и баклажаны; и (2) плоды, такие как клубника, малина, клюква, брусника, красный виноград, яблоки, черная смородина, красная смородина, вишня, голубика, бузина, черника, водяника, ежевика, арония, крыжовник, асаи, нектарин, персик, слива, апельсин-королек и синие томаты. Каждый источник антоцианина содержит различные количества нескольких, отличающихся видов антоцианинов с от 15 до 30 структурно отличающихся молекул антоцианинов, являющихся обычными для данного растительного источника.
[0012] В результате изменения pH происходит изменение характеристик цвета соков и экстрактов антоцианинсодержащих овощей и плодов. Как правило, антоцианинсодержащие соки и экстракты имеют красный цветового тона при низком pH, и цветовой тон сдвигается в сторону фиолетового при повышении pH. Только несколько соков и экстрактов имеют синий цветового тона при дальнейшем повышении pH.
[0013] Изменение цвета антоцианинсодержащих соков и экстрактов в результате изменения pH зависит от множества вторичных структур антоцианинов, которые могут существовать в равновесии с первичной структурой флавилиевых катионов в водном растворе. В случае, когда pH изменяется, относительные количества различных равновесных структур изменяются. При данном pH может преобладать одна или более структурная форма, при этом другие присутствуют в малых количествах или не присутствуют вообще. Например, при очень низком pH, преобладает форма флавилиевых катионов. При повышении pH молекулы в форме флавилиевых катионов могут быть депротеинированы и превращены в форму карбиноловых псевдооснований, которая далее может быть превращена через потерю молекулы воды и протона в формы нейтральных и ионизированных хиноидных оснований, соответственно, и далее в форму халкона. Эти трансформации уменьшают число молекул в форме флавилиевых катионов и увеличивают количество других равновесных форм в разной степени. Следовательно, различные равновесные структуры существуют в различных относительных количествах при более высоком pH по сравнению с более низким pH. Каждая структурная форма антоцианина может по разному поглощать свет, в результате приводя к различному восприятию цвета, включая отсутствие цвета. Следовательно, при изменении pH раствора изменяются относительные количества различных структурных форм, что в результате в свою очередь может привести к изменению цвета раствора.
[0014] Каждая отдельная молекула антоцианина характеризуется своим собственным набором равновесных молекулярных структур и константой равновесия для реакций трансформации одной структуры в другую. Например, реакция трансформации одной равновесной структуры антоцианина в другую может иметь конкретную константу кислотной диссоциации Ka, связанную с ней. Реакция также может рассматриваться относительно логарифмической постоянной pKa, которая определена как - log10 Ka.
[0015] Структуры флавилиевых катионов и хиноидных оснований имеют сопряженные связи, соединяющие все три кольца молекул антоцианина. Пространственные делокализованные pi связи позволяют флавилиевым катионам и хиноидному основанию поглощать видимый свет, что в результате приводит к восприятию цветового тона красного флавилиевых катионов при низком pH и фиолетового или синего цветового тона ионизированного хиноидного основания при более высоком pH. Напротив, структуры карбинолового псевдооснования и халкона не имеют делокализованных pi связей, соединяющих все три кольца, и бесцветны или имеют желтоватый цвет.
[0016] Модель замещения антоцианинов также оказывает воздействие на цвет. Например, как правило, наблюдается изменение цветового тона от розового к фиолетовому, когда атомы водорода замещают гидроксильными группами. Аналогично, наблюдается воздействие на цвет количества и типа гликозильных (сахарных) единиц и ацильных единиц. Однако эти феномены в настоящее время не до конца понятны и предсказуемы.
[0017] Дополнительно, межмолекулярные и внутримолекулярные взаимодействия также оказывают воздействие на цвет антоцианина. Один и тот же антоцианин может иметь различные цветовые тони в зависимости от других присутствующих молекул. Например, считается, что ацильные группы на сахарах антоцианина могут увеличивать и защищать флавилиевые катионы в C-2 позиции от нуклеофильной атаки. Следовательно, это внутримолекулярное взаимодействие предотвращает образование бесцветной структуры карбинольного псевдоснования. Аналогично, считается, что молекулы антоцианина самоассоциируются, что подтверждается тем фактом, что увеличение в два раза концентрации антоцианина может вызвать 300-кратное увеличение цветности и может изменить цветовой тон наряду с насыщенностью. Предполагается, что эта самоассоциация аналогична внутримолекулярной упаковке и предотвращает нуклеофильную атаку и образование структуры карбинольного псевдоснования.
[0018] Хотя известно, что каждый из таких факторов, как pH, химическая структура антоцианина, схемы замещения, меж- и внутримолекулярные взаимодействия, оказывает воздействие на наблюдаемый цвет соков и экстрактов антоцианинсодержащих овощей и плодов, не до конца понятно, как эти факторы воздействуют на изменение цвета, то есть, не предсказуема конкретная причина и эффект.
[0019] Например, отдельные молекулы антоцианина отделяют при использовании ВЭЖХ, но разделение проводят всегда при низком pH, и цветовые характеристики отдельных антоцианинов анализируют при низком pH. Аналогично, изучалось влияние pH на цветовые характеристики соков и экстрактов антоцианинсодержащих овощей и плодов, но в этих исследованиях анализировали комплексную смесь антоцианинов, естественным образом присутствующих в соках и экстрактах. Однако в настоящее время не до конца понятно и не может быть предсказано, как изменение pH влияет на цветовые характеристики отдельных молекул антоцианинов или фракций антоцианинов, выделенных из натуральных источников. В предшествующем уровне техники указывается, что число и тип заместителей, например, сахарные и ацильные группы, влияют на цвет; однако, не указывается, как эти заместители влияют на цвет при изменении pH. Наконец, хотя в предшествующем уровне техники предполагается, что различные меж- и внутри-молекулярные взаимодействия влияют на цвет, не указывается, как изменение pH влияют на эти меж- и внутри-молекулярные взаимодействия и в конечном итоге на наблюдаемый цвет антоцианинов.
[0020] В WO 2009/100165 A2 описывается способ отделения антоцианинов от других фенольных молекул в соках антоцианинсодержащих плодов и овощей. В WO 2009/100165 A2 не описывается селективное отделение фракций молекул антоцианина, исходя из разницы зарядов и полярности молекул, с получением фракций с заданным цветом, который отличается от цвета антоцианинсодержащего сока.
[0021] Выделение отдельных антоцианинов при использовании аналитической шкалы описано в J. Chromatography A., 1148 (2007), 38-45. Отделение проводят при низком pH, то есть pH менее чем 2, при использовании ВЭЖХ, что способствует определению отдельных антоцианинов. Этот способ позволяет отделить молекулы антоцианина для определения, а не получения фракций со смесями антоцианинов.
[0022] В WO 2004/012526 описывается раствор синего красителя из антоцианинов краснокочанной капусты при pH 7,9, который используют в сахарном сиропе для покрытия сердцевин кондитерских изделий. Антоцианины краснокочанной капусты не выделяют во фракции.
[0023] В предшествующем уровне техники отсутствуют примеры антоцианинсодержащих красителей, содержащих фракции молекул антоцианина, выделенных из соков и экстрактов антоцианинсодержащих овощей и плодов при выбранном рН, исходя из разницы в заряде и полярности молекул. Дополнительно, не описаны фракции антоцианина, обеспечивающие отличающиеся цветовые характеристики, иные, чем таковые, обеспеченные источником из соков и экстрактов. В частности, в предшествующем уровне техники не описываются натуральные синие антоцианинсодержащие красители, обеспечивающие цветовые характеристики, аналогичные таковым, обеспеченным синтетическим синим красителем FD&C Blue No.1.
[0024] Продолжает существовать потребность в широкой палитре натуральных красителей, доступных для окрашивания пищевых продуктов. Продолжает существовать потребность в натуральных синих красителях, обеспечивающих цветовые характеристики, аналогичные таковым, обеспеченным синтетическим FD&C Blue No.1. Следовательно, существует потребность в способе получения таких синих натуральных красителей из соков и экстрактов антоцианинсодержащих овощей и плодов.
Сущность изобретения
[0025] Настоящее изобретение относится к способу получения композиций натуральных синих антоцианинсодержащих красителей, обеспечивающих цветовые характеристики, аналогичные таковым синтетического синего красителя FD&C Blue No.1. Натуральный синий антоцианинсодержащий краситель получают из соков и экстрактов антоцианинсодержащих овощей и плодов выделением фракций, содержащих смесь молекул антоцианина при выбранном рН, исходя из разницы в заряде и полярности молекул антоцианинов.
[0026] В одном варианте воплощения настоящее изобретение относится к способу выделения фракции антоцианинов из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций, включающий:
a) загрузку в ионообменную колонну сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций;
b) селективное выделение антоцианинов в ионообменной колонне, исходя из разницы заряда и полярности молекул антоцианина, растворителем с выбранным рН, где уровень рН составляет по меньшей мере около 2; и
c) выбор одной или более фракции или комбинации фракций, содержащих выделенные антоцианины, такие как выделенные антоцианины в одной фракции или комбинации фракций, когда они в форме водного раствора при pH 8,0 имеют максимальное поглощение от 615 нм до 635 нм. Выбранная антоцианинсодержащая фракция или комбинация фракций содержит выделенные антоцианины, которые обеспечивают цветовые характеристики, близкие к таковым, обеспеченным FD&C Blue No.1, но отличающиеся, то есть, фракционированная подсовокупность из таковых сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций.
Краткое описание чертежей
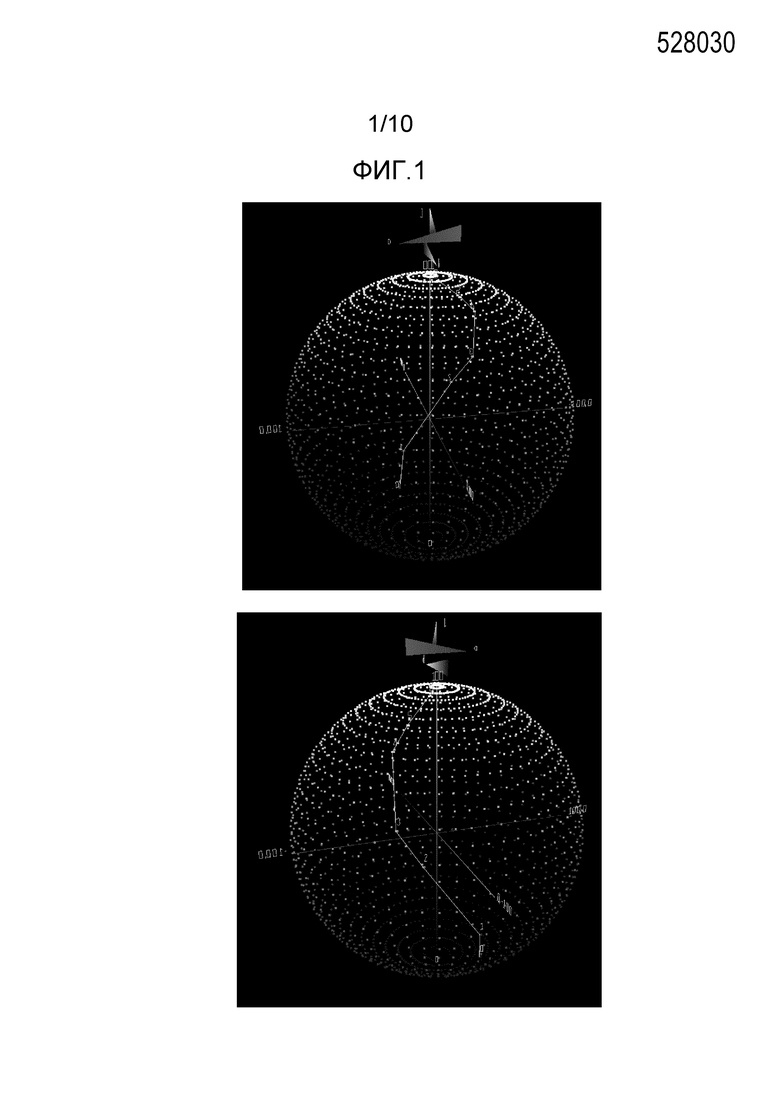
[0027] На Фиг.1 представлены два вида в перспективе трехмерного изображения характеристик цвета, обеспеченных FD&C Blue No.1, в CIE 1976 CIELAB L*a*b* цветовом пространстве, как функции концентрации в водном растворе.
[0028] На Фиг.2 представлены два вида в перспективе трехмерного изображения характеристик цвета, обеспеченных FD&C Blue No.1, в CIE 1976 CIELCH L*C*h° цветовом пространстве, как функции концентрации в водном растворе.
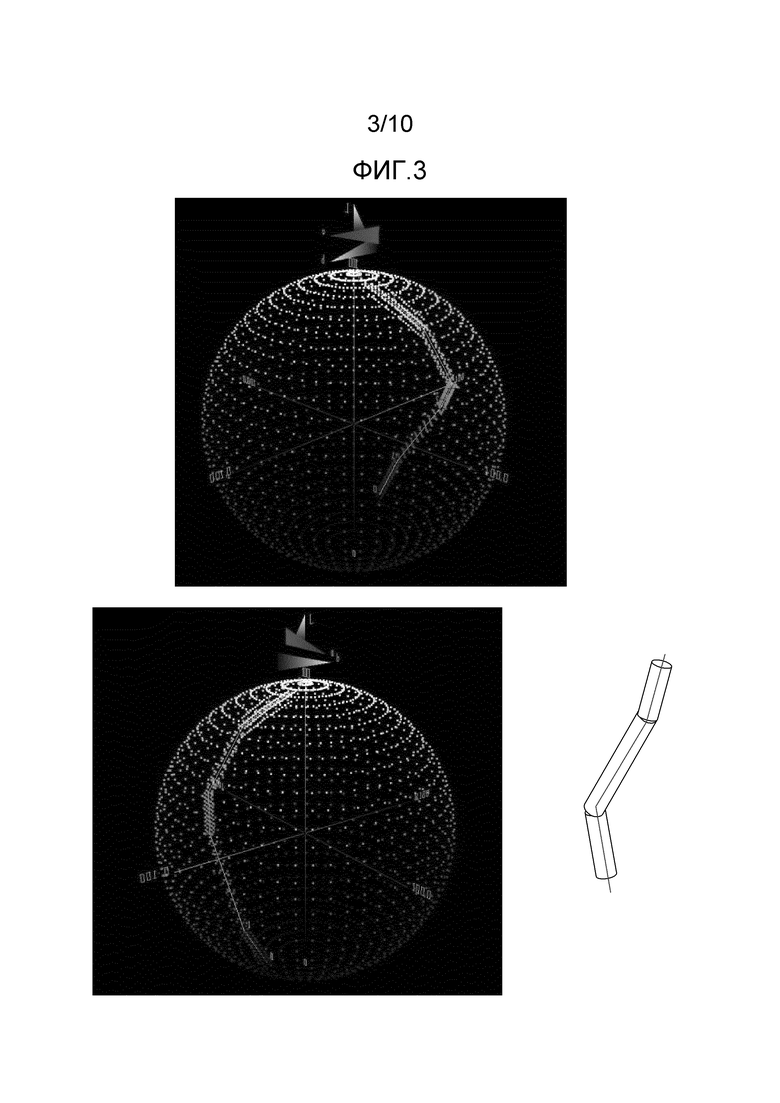
[0029] На Фиг.3 представлены два вида в перспективе области в CIE 1976 CIELAB L*a*b* цветового пространства цветов, отличающихся от цветов, обеспеченных FD&C Blue No.1, при ΔE 3 или менее и иллюстрация сегментной трубы, определенной по данным цветового пространства.
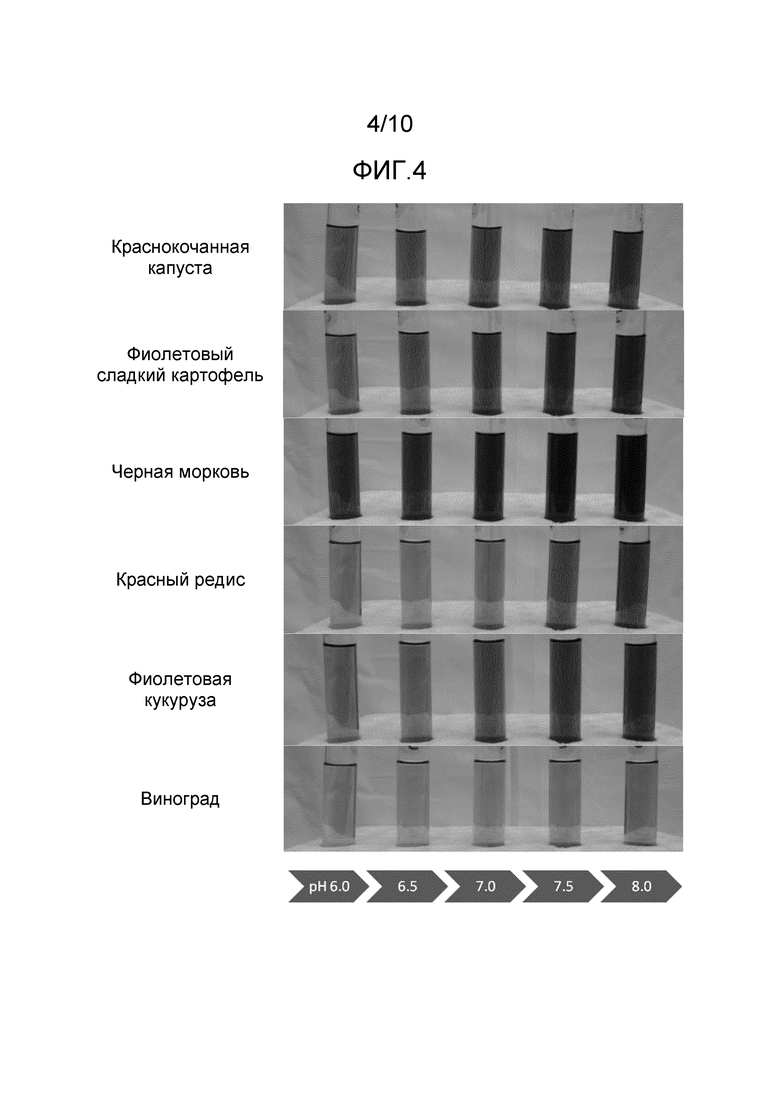
[0030] На Фиг.4 представлено сравнение цветов, обеспеченных экстрактами плодов и овощей в водном растворе при различных показателях pH.
[0031] На Фиг.5 представлены два вида в перспективе трехмерного изображения характеристик цвета, обеспеченных FD&C Blue No.1, в CIE 1976 CIELAB L*a*b* цветовом пространстве, как функции концентрации в водном растворе наряду с областью цветов, отличающихся от цветов, обеспеченных FD&C Blue No.1 при ΔE 3 или менее, и также представлены два вида в перспективе трехмерного изображения характеристик цвета, обеспеченных синим из спирулины, как функции концентрации в водном растворе (белая линия ближе к x-оси).
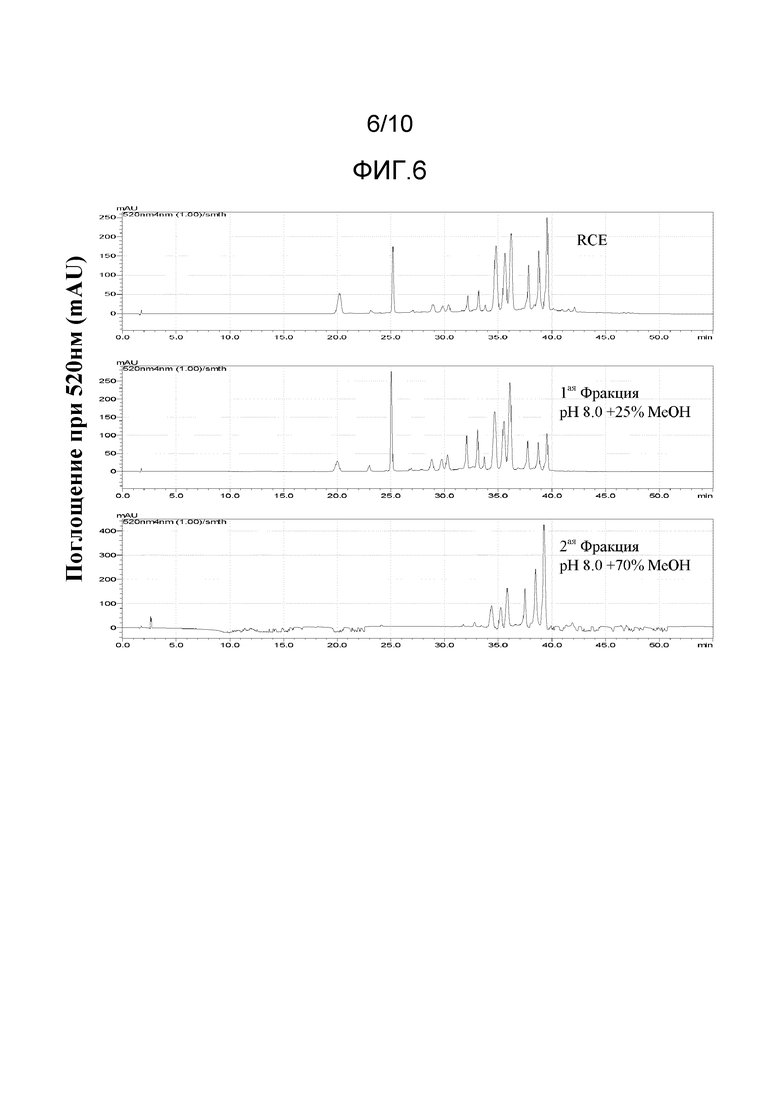
[0032] На Фиг.6 представлены ВЭЖХ хроматограммы при 520 нм раствора экстракта краснокочанной капусты и двух фракций, выделенных из раствора экстракта краснокочанной капусты при использовании колонны с сильной катионообменной смолой.
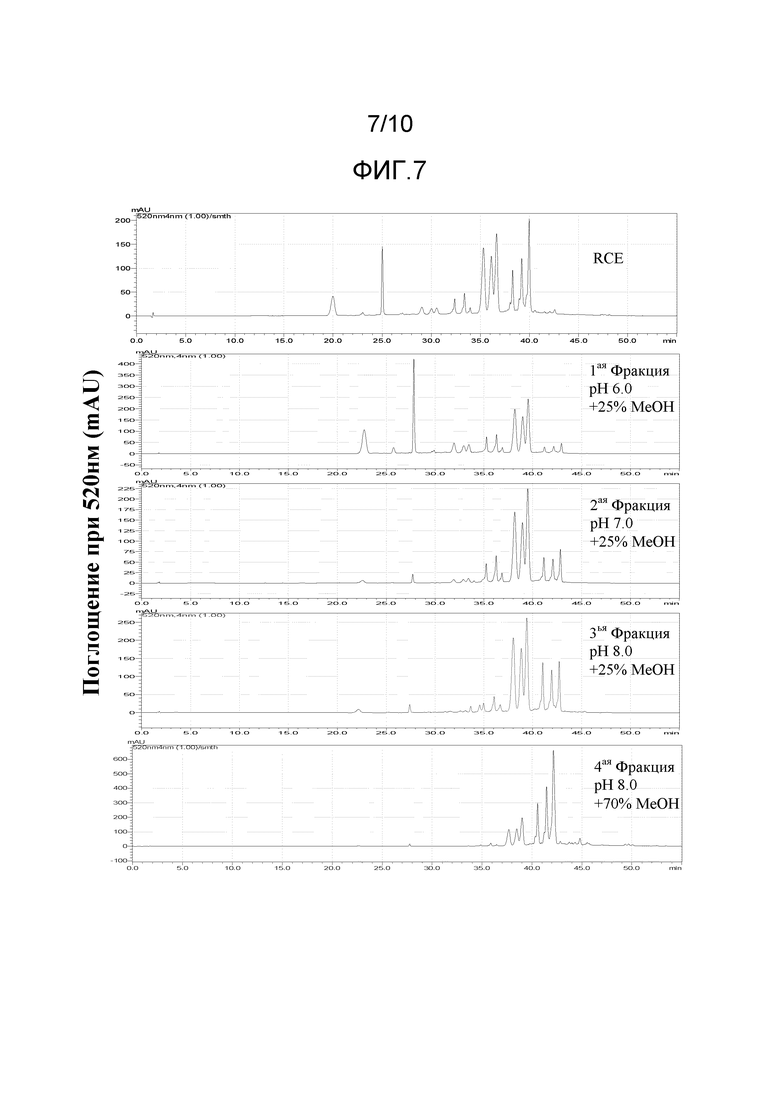
[0033] На Фиг.7 представлены ВЭЖХ хроматограммы при 520 нм раствора экстракта краснокочанной капусты и четырех фракций, выделенных из раствора экстракта краснокочанной капусты при использовании колонны с сильной катионообменной смолой.
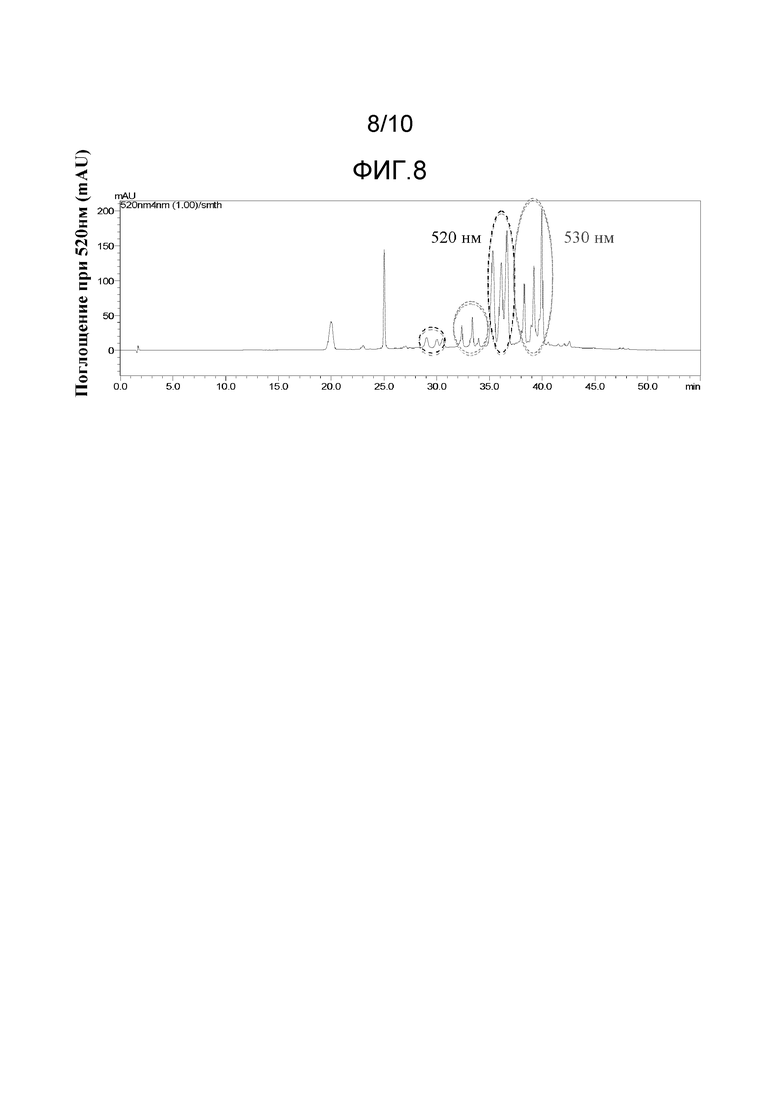
[0034] На Фиг.8 представлены ВЭЖХ хроматограммы при 520 нм раствора экстракта краснокочанной капусты, дающие две группы пиков, как целевые для выделения. Эти две группы пиков, выделили как «520-нм Фракция» и «530-нм Фракция».
[0035] На Фиг.9 представлено визуальное сравнение цветов, обеспеченных при использовании 520-нм и 530-нм Фракций при различных показателях pH. Также Фиг.9 позволяет провести визуальное сравнение цветов, обеспеченных при использовании 520-нм и 530-нм Фракций с цветом кондитерского изделия, глазированного сахарным сиропом окрашенным FD&C Blue No.1.
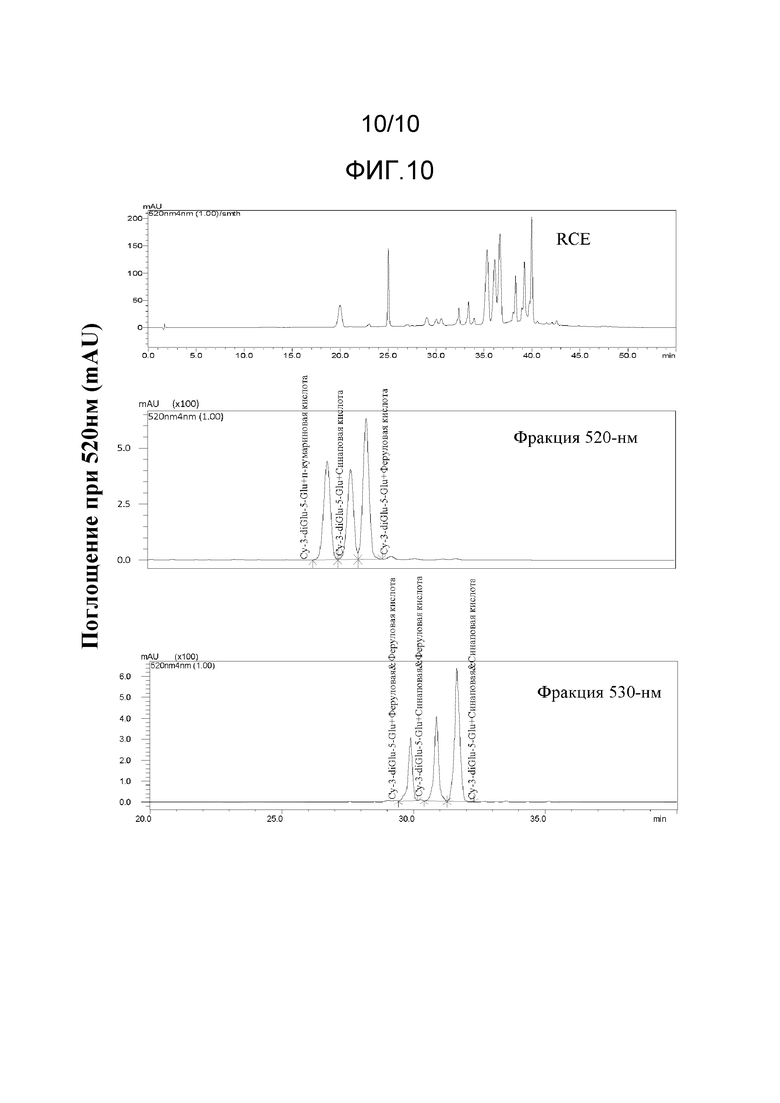
[0036] На Фиг.10 представлены ВЭЖХ хроматограммы при 520 нм раствора экстракта краснокочанной капусты и двух фракций, выделенных из раствора экстракта краснокочанной капусты при использовании полупрепаративной ВЭЖХ. На Фиг.10 показано, что каждая из 520-нм и 530-нм Фракции содержит три различных соединения антоцианина и определяет наличие функциональных групп и сахаров на соединениях антоцианина.
Подробное описание изобретения
[0037] В настоящее время соки и экстракты антоцианинсодержащих овощей и плодов используют в качестве натуральных пищевых красителей и для получения композиций красителей, в частности, композиций натуральных красителей красного, фиолетового и синего цветовых тонов. Соки и экстракты содержат смесь всех молекул антоцианинов, естественным образом присутствующих в овощных и плодовых источниках, вместе со множеством соединений других классов. Следовательно, доступные в настоящее время антоцианинсодержащие красители ограничены цветами, связанными со смесями антоцианинов, которые естественным образом присутствуют в овощных и плодовых источниках. Настоящее изобретение относится к способам выделения смесей молекул антоцианинов, отличающихся от комплексной смеси антоцианинов, естественным образом присутствующих в соках и экстрактах овощей и плодов. Способ включает выделение фракций молекул антоцианинов из комплексной смеси в соках и экстрактах овощей и плодов при выбранном рН, исходя из разницы в заряде и полярности молекул антоцианинов.
[0038] В одном аспекте настоящее изобретение относится к выделению фракций молекул антоцианина из соков и экстрактов антоцианинсодержащих овощей и плодов с получением композиций красителей, обеспечивающих специфические целевые цветовые характеристики, аналогичные таковым, обеспеченным синтетическим синим красителем FD&C Blue No.1. Используемый здесь термин обеспечивающий цветовые характеристики «аналогичные» FD&C Blue No.1, означает, что цвет более близок к характеристикам цвета, чем у любого другого натурального красителя, такого как, например, синий из спирулины.
[0039] Авторы настоящей патентной заявки обнаружили, что выделение антоцианинов растворителем при выбранном рН и разницы в полярности молекул антоцианина позволяет получить фракции, содержащие смеси антоцианинов, обеспечивающие цветовые характеристики, аналогичные таковым, обеспеченным синтетическим синим красителем FD&C Blue No.1. Каждый источник антоцианина содержит различные количества множества различных молекул антоцианинов, и каждая молекула может существовать в равновесии с одной или более вторичной структурой. Они могут отличаться по заряду и/или полярности от других молекул антоцианина и их равновесных молекулярных структур. Проводя выделение на основе разницы в заряде и полярности молекул антоцианина при выбранном рН, авторы настоящего изобретения смогли выделить из комплексной смеси антоцианинов фракции антоцианинов с различными спектральными характеристиками. Спектральные характеристики фракций отличаются и не очевидны от спектральных характеристик комплексной смеси антоцианинов, присутствующих в соке или экстракте. Авторы настоящего изобретения обнаружили, что выявленные фракции антоцианина, обеспечивают цветовые характеристики более близкие к таковым, обеспеченным синтетическим FD&C Blue No.1, чем обеспеченные любым известным натуральным синим красителем, включая синий из спирулины.
[0040] Сок антоцианинсодержащих овощей или плодов может быть получен прессованием с выделением жидкости из плодов или овощей. Экстракт антоцианинсодержащих овощей или плодов может быть получен промывкой измельченных плодов или овощей растворителем (например, вода, спирт). Соки и экстракты содержат антоцианины наряду с другими естественным образом присутствующими соединениями, включая, например, углеводы, кислоты, флавоноиды, ионы металлов, фенольные кислоты, сложные эфиры фенольных кислот и витамины. Используемый здесь термин «сок или экстракт овощей или плодов» является эквивалентом списка терминов «овощной сок, сок плодов, экстракт овощей или экстракт плодов» и включает в объем понятия соки и экстракты, включая, например, восстановленные соки и экстракты, дезодорированные соки и экстракты, и соки и экстракты, подвергшиеся другим видам технологической обработки для удаления специфических или широких классов соединений.
[0041] Используемый здесь термин «Фракционирование» относится к процессу селективного отделения и выделения части антоцианинов из комплексной смеси антоцианинов в соке или экстракте антоцианинсодержащих овощей или плодов. Источник антоцианинов, используемых в способе по настоящему изобретению, представляет собой сок или экстракт антоцианинсодержащих овощей или плодов, который обеспечивает синий цветовой тон при высоких показателях pH. В некоторых вариантах выполнения изобретения, источник антоцианинов, используемых в способе по настоящему изобретению, представляет собой краснокочанную капусту, фиолетовый сладкий картофель, синий картофель, фиолетовую морковь или черную морковь или их комбинации.
[0042] Используемый здесь термин «фракция» относится к фракционированию продукта. Используемый здесь термин «фракция антоцианина» относится к смеси антоцианинов, отличающейся от смеси антоцианинов в антоцианинсодержащем соке или экстракте, из которого была выделена фракция. Фракции антоцианина выделяют из смеси сока или экстракта при выбранном рН, исходя из разницы в заряде и полярности различных присутствующих молекул антоцианина.
[0043] Используемый здесь термин «выбранный рН» относится к pH 2 или выше, например, pH в пределах от около 2 до около 9, в обоих контекстах, и в контексте выделения и в контексте проведения оценки характеристик цвета антоцианинов. В других вариантах выполнения изобретения, pH может составлять 3 или выше, 4 или выше, 5 или выше, 6 или выше, или 7 или выше, например, pH в одном из следующих соответствующих пределах, то есть, от около 3 до около 9, от около 4 до около 9, от около 5 до около 9, от около 6 до около 9 или от около 7 до около 9.
[0044] Используемый здесь термин «максимальное поглощение», «лямбда max» или «λmax» относится к длине волны в нанометрах, при которой максимальная фракция света поглощается веществом. Как правило, максимальное поглощение может быть использовано как собственное значение для сравнения веществ, прошедших измерение при использовании УФ/Видимой области спектрофотометра или колориметра.
[0045] Ссылка на «FD&C Blue No.1» включает различные названия, присвоенные идентичному синтетическому синему красителю, Brilliant Blue FCF и E133 согласно Европейской Комиссии (European Commission). Лямбда max FD&C Blue No.1 составляет 630 нм.
[0046] Используемый здесь термин «краситель» относится к любому веществу, придающему цвет за счет поглощения или рассеяния света при различной длине волны. Используемый здесь термин «натуральный краситель» относится к красителю, который существует в природе или его получают из природного источника. Используемый здесь термин «синий краситель» относится к красителю, отражающему свет с длиной волны в области 450-495 нанометров и имеющему максимальное поглощение в пределах от 615 до 635 нанометров. Используемый здесь термин «натуральный антоцианинсодержащий краситель» относится к натуральному красителю, содержащему антоцианины, полученные из растений.
[0047] Натуральный антоцианинсодержащий краситель представляет собой композицию, которая может содержать только антоцианины, которые были селективно выделены (например, выделенная смесь) или также может содержать другие растительные компоненты, носители, например, воду и/или инертные наполнители, известные для применения с красителями. Композиция может быть в форме твердого вещества, например, порошка, или жидкого раствора, например, водного раствора.
[0048] В одном варианте воплощения настоящее изобретение относится к способу выделения фракции антоцианинов из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций, включающему:
a) загрузку в ионообменную колонну сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций;
b) селективное выделение антоцианинов в ионообменной колонне, исходя из разницы в заряде и полярности молекул антоцианина, растворителем с выбранным рН; и
c) выбор одной или более фракции или комбинации фракций, содержащих выделенные антоцианины, такие как выделенные антоцианины в одной фракции или комбинации фракций, которые в форме водного раствора при pH 8,0 имеют максимальное поглощение от 615 нм до 635 нм.
В другом варианте выполнения изобретения, антоцианинсодержащую фракцию выделяют из сока или экстракта антоцианинсодержащих овощей или плодов растворителем с pH в пределах от около 2 до около 9, или в одном из следующих пределов, например, от около 3 до около 9, от около 4 до около 9, от около 5 до около 9, от около 6 до около 9 или от около 7 до около 9.
[0049] Используемый здесь термин «цветовой тон» относится к свойству цвета, которое дает название цвета, как таковое, например, красный, оранжево-красный, синий, фиолетовый и тому подобное.
[0050] Используемый здесь термин «цветность» относится к свойству цвета, указывающему чистоту цвета, где более высокая цветность ассоциируется с более чистым цветовым тоном и меньшим разбавлением белым, серым или черным.
[0051] Используемый здесь термин «насыщенность» относится к свойству цвета, указывающему на светлоту или темноту цвета, где более высокий показатель ассоциируется с более высокой светлотой.
[0052] Используемые здесь термины «цвет» и «цветовые характеристики» взаимозаменяемы и включают такие свойства цвета, как цветовой тон, цветность и насыщенность и для описания этих свойств используют параметры системы цветовой модели, такие как показатели Commission Internationale del'Eclairage CIE 1976 CIELAB цветового пространства L*a*b* и показатели CIELCH цветового пространства L*C*h°. Модели цвета CIELAB и CIELCH обеспечивают более равномерное восприятие цветовых пространств по сравнению с более ранними моделями цветами. Красители анализируют при использовании спектрофотометра, и показатели CIELAB L*a*b* и CIELCH L*C*h° рассчитывают по спектральным данным. Показатели L*a*b* и L*C*h° обеспечивают средства представления характеристик цвета и позволяют оценить величину разницы между двумя цветами. Представленные здесь показатели CIELAB L*a*b* и CIELCH L*C*h° во всех случаях, если не указано иное, рассчитывают по спектральным данным, полученным при использовании спектрофотометра Konica Minolta Spectrophotometer CM-3500d, работающего в режиме светопропускания со стандартным источником света CIE Standard Illuminant D65 и углом обзора 10 градусов.
[0053] Показатели L*a*b* состоят из системы координат, определенных трехмерной системой координат Cartesian. L* представляет собой координату насыщенности или светлости. L* обеспечивает шкалу светлости от черного (0 L* единиц) до белого (100 L* единиц) на вертикальной оси, a* и b* представляют координаты, относящиеся к обоим, и цветовому тону и цветности, a* обеспечивает шкалу от зелености (- a* единиц) до красноты (+ a* единиц) с нейтральным в центральной точке (0 a* единиц) на горизонтальной оси, b* обеспечивает шкалу от синевы (- b* единиц) до желтизны (+ b* единиц) с нейтральным в центральной точке (0 b* единиц) на второй горизонтальной оси, перпендикулярной первой горизонтальной оси. Три оси пересекаются, где L* имеет показатель 50, и a* и b* оба равны нулю.
[0054] Показатели L*C*h° состоят из системы координат, определенных трехмерной цилиндрической системой координат. L* представляет координату насыщенности или светлости. L* обеспечивает шкалу светлости от черного (0 L* единиц) до белого (100 L* единиц) на продольной оси. h° представляет координату цветового тона. h° определяют, как угол от 0° до 360° движущийся против часовой стрелки вокруг оси L*. Чистый красный имеет угол цветового тона 0°, чистый желтый имеет угол цветового тона 90°, чистый зеленый имеет угол цветового тона 180°, и чистый синий имеет угол цветового тона 270°. Координата C* представляет цветность и определяется как расстояние по радиусу от оси L*. C* обеспечивает шкалу от ахроматического, то есть, нейтрального белого, серого или черного на оси L* (0 C* единиц) до более чистого цветового тона при движении координат в направлении от оси L* (вплоть до 100 или более C* единиц). C* и h° могут быть рассчитаны из a* и b* при использовании Уравнений 1 и 2:

[0055] «Дельта E», «ΔEab*» или «ΔE» представляет собой измерение величины полного цветового различия между двумя цветами, представленными в CIELAB L*a*b* цветовом пространстве. Сообщается, что наблюдатель не может различить наблюдаемый цвет при любой разнице между двумя цветами, когда ΔE составляет около 2,3 или менее. ΔE двух различных цветов с показателями L*a*b* L*1a*1b*1 и L*2a*2b*2 рассчитывают при использовании Уравнения 3:
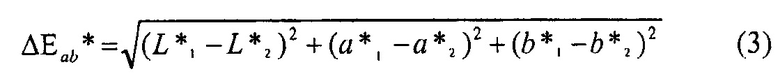
[0056] В Таблице 1 представлены показатели CIELAB L*a*b* и CIELCH L*C*h° FD&C Blue No.1 при семи различных концентрациях в водном растворе.
[0057] Эти показатели L*a*b* и L*C*h° для FD&C Blue No.1 представляют идеальные целевые показатели для альтернативного FD&C Blue No.1 натурального синего красителя. Предполагается, что натуральные синие красители с показателями L*a*b*, которые попадают в ΔE 2,3 или менее от этих целевых показателей, обеспечивают цветовые характеристики в достаточной степени схожие таковыми, обеспеченными FD&C Blue No.1, чтобы человеческий глаз не мог уловить различие в цвете, обеспеченном натуральным красителем по сравнению с синтетическим. Очевидно, что чем ближе показатели L*a*b* натурального синего красителя к целевым показателям синтетического (то есть, с получением на выходе меньшего показателя ΔE), тем лучше будет натуральный синий краситель заменять FD&C Blue No.1 в пищевых применениях.
[0058] На Фиг.1 представлены два вида в перспективе трехмерного изображения показателей L*a*b* для водных растворов FD&C Blue No.1 в семи концентрациях, представленных в Таблице 1, соединенные линейными сегментами. На Фиг.2 представлены два вида в перспективе трехмерного изображения показателей L*C*h° для водных растворов FD&C Blue No.1 в семи концентрациях, представленных в Таблице 1, соединенные линейными сегментами.
[0059] Для получения изображения характеристик цвета, обеспеченных FD&C Blue No.1 при любой концентрации в показателях L*a*b* и L*C*h° цветового пространства могут быть построены математические модели. Например, цветовые характеристики могут быть представлены линейной сегментной моделью, связывающей точечные значения L*a*b* или L*C*h° Таблицы 1. Линия (L), соединяющая две точки (P1 и P2), представляющая две различных концентрации FD&C Blue No.1 в L*a*b* пространстве, может быть рассчитана при использовании следующего Уравнения 4:
L = {P1+t* (P2-P1} 
где P1 представляет (L*1, a*1, b*1); P2 представляет (L*2, a*2, b*2); и t представляет любое не отрицательное вещественное число.
[0060] Соответственно, линейная сегментная модель для FD&C Blue No.1 в L*a*b* цветовом пространстве может быть интерполирована, исходя из показателей L*a*b* для семи различных точек концентраций при использовании Уравнения 4, как следующее:
Для концентраций от 500 до 1000 м.д., 0< t <1:
L* = 10,49+13,58 * t
a* = 15,82+-6,02 * t
b* = -44,99+-13,19 * t
Для концентраций от 100 до 500 м.д., 0< t <1:
L* = 24,07+28,36 * t
a* = 9,80+-39,37 * t
b* = -58,18+0,80 * t
Для концентраций от 50 and 100 м.д., 0< t <1:
L* = 52,43+11,21 * t
a* = -29,57+-14,14 * t
b* = -57,38+9,07 * t
Для концентраций от 10 до 50 м.д., 0< t <1:
L* = 63,64+20,61 * t
a* = -43,71+6,48 * t
b* = -48,31+24,89 * t
Для концентраций от 5 до 10 м.д., 0< t <1:
L* = 84,25+6,40 * t
a* = -37,23+12,83 * t
b* = -23,42+9,14 * t
Для концентраций от 1 до 5 м.д., 0< t <1:
L* = 90,65+7,04 * t
a* = -24,40+17,97 * t
b* = -14,28+10,71 * t
Линейная сегментная модель для FD&C Blue No.1 в L*a*b* пространстве представлена на Фиг.1.
[0061] Дополнительно, цвета с показателями L*a*b*, попадающие в специфические пределы ΔE FD&C Blue No.1 модели, могут быть математически смоделированы в L*a*b* цветовом пространстве. На Фиг.3 видно, что выбор специфического показателя ΔE, например, 3, в отношении FD&C Blue No.1 и построение графика ΔE в L*a*b* цветовом пространстве в результате приводит к получению туннеле подобной структуры вокруг FD&C Blue No.1 модели. Следует отметить, что любой цвет с показателем ΔE около 2,3 или менее из любой точки на модели не будет отличим от цвета, обеспеченного FD&C Blue No.1.
[0062] Для определения, попадает ли точка (X0) в L*a*b* цветовом пространстве в специфический показатель ΔE FD&C Blue No.1 модели, должно быть рассчитано минимальное расстояние dmin между точкой и моделью (представлено сегментной линией X1 - X2).
[0063] Для расчета d может быть использовано Уравнение 5,
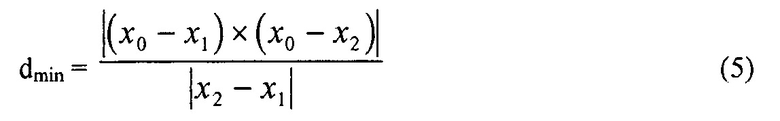
где x обозначает точку пересечения двух векторов, и вертикальные диаграммы определяют величину векторного выражения.
В случае, когда показатель dmin составляет менее чем или равное выбранному показателю ΔE, точка в L*a*b* цветовом пространстве попадает в специфический показатель ΔE FD&C Blue No.1 модели.
[0064] Например, может быть определено обеспечивает ли синий из спирулины цвет с ΔE 12 или менее сравнимый с цветом, обеспеченным FD&C Blue No.1. В Таблице 2 представлены цветовые характеристики, обеспеченные синим из спирулины – известным натуральным синим красителем при двух различных концентрациях в водном растворе:
X0 для 404,8 мг/л раствора Spirulina Blue в L*a*b* цветовом пространстве составляет:
X0 = (69,97, -29,69, -43,56)
X0 для 206 мг/л раствора Spirulina Blue в L*a*b* цветовом пространстве составляет:
X0 = (80,3, -23,97, -29,39)
X1 и X2 представляют две точки FD&C Blue No.1 модели при концентрации 10 м.д. и 50 м.д. в водном растворе, соответственно:
X1 = (63,64, -43,71, -48,31)
X2 = (84,25, -37,23, -23,24)
[0065] dmin, рассчитанное при использовании Уравнения 5, составляет 12,4 для 404,8 мг/л раствора Spirulina Blue и 14,4 для 206 мг/л раствора Spirulina Blue. Следовательно, раствор Spirulina Blue не обеспечивает цвет с ΔE 12 или менее сравнимый с цветом, обеспеченным FD&C Blue No.1 в водном растворе, как измерено против сегментной линии, определенной показателями L*a*b* для 10 м.д. и 50 м.д. FD&C Blue No.1 в водном растворе.
[0066] Спектральные характеристики множества различных растворов Spirulina Blue представлены в Таблице 3.
Данные для растворов спирулины
Данные для Spirulina Blue представлены в виде графика цвета на Фиг.5 по сравнению с данными для FD&C Blue No.l.
[0067] Различия между цветовыми характеристиками, обеспеченными синим из спирулины и FD&C Blue No.1, представлены на Фиг.5. На Фиг.5 представлена линейная сегментная модель характеристик цвета, обеспеченных FD&C Blue No.1 в L*a*b* цветовом пространстве при концентрациях от 1 м.д. до 1000 м.д. (миллионных долей) в водном растворе, с моделью, окруженной туннелем, представляющим область цветов, которые отличаются от цветов, обеспеченных Blue No.1, при ΔE 3 или менее. Также на Фиг.5 для сравнения представлена линейная сегментная модель характеристик цвета, обеспеченных синим из спирулины в L*a*b* цветовом пространстве в концентрации от 50 м.д. до 400 м.д. в водном растворе. Модель Spirulina Blue не пересекает Blue No.1 модель или не связанна с туннелем в какой-либо точке в L*a*b* цветовом пространстве.
[0068] Настоящее изобретение относится к натуральным синим антоцианинсодержащим красителям, полученным из овощей, плодов или их комбинаций, содержащим селективно выделенную смесь антоцианинов, где по меньшей мере одна концентрация красителя в форме водного раствора при pH 8,0 обеспечивает цветовые характеристики с показателем ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе. В других вариантах выполнения изобретения, показатель ΔE может составлять менее чем 11, 10, 9, 8, 7, 6, 5, 4 или 3. Если требуется, так же по меньшей мере одна концентрация красителя может быть измерена по множеству сегментных линий, определенных различными концентрациями FD&C Blue No.L в водном растворе, например, 1 и 5 м.д., 10 м.д. и 50 м.д., 50 м.д. и 100 м.д., 100 м.д. и 500 м.д., 500 м.д. и 1000 м.д., или любая комбинация, выбранная из них. Например, хотя и не требуется, по меньшей мере одна концентрация красителя может быть определена, как имеющая показатель ΔE 12 или менее для первой сегментной линии при от 5 м.д. до 10 м.д., показатель ΔE 8 или менее для сегментной линии при от 1 до 5 м.д. и показатель ΔE 12 или менее для сегментной линии при от 10 м.д. до 50 м.д. Однако если показатель ΔE используют для описания красителя по настоящему изобретению, то для определения красителя требуется только одна сегментная линия.
[0069] Хотя считается, что синий из спирулины, являющийся натуральным красителем, обеспечивает самое близкое соответствие цвета к FD&C Blue No.1, натуральный синий антоцианинсодержащий краситель, полученный из овощей, плодов или их комбинаций, содержащий селективно выделенную смесь антоцианинов, имеет лучшее совпадение цвета. В частности, когда по меньшей мере одна концентрация красителя присутствует в водном растворе при pH 8,0, то водный раствор красителя обеспечивает цветовые характеристики, совпадающие с FD&C Blue No.1 сегментной линией, исходя из серий водных растворов с различными концентрациями FD&C Blue No.1, определенными в L*a*b* цветовом пространстве, где соответствие означает, что по меньшей мере одна концентрация красителя в водном растворе при pH 8,0 имеет показатель ΔE, измеренный против сегментной линии FD&C Blue No.1, который, по меньшей мере на одну единицу меньше чем показатель ΔE для cегментной линии Spirulina Blue, определенной в том же самом L*a*b* цветовом пространстве, исходя из серий водных растворов с различными концентрациями Spirulina Blue, измеренными против сегментной линии FD&C Blue No.1. В других вариантах выполнения изобретения, показатель ΔE по меньшей мере одной концентрации красителя в водном растворе при pH 8,0, измеренный против сегментной линии FD&C Blue No.1, составляет по меньшей мере на 2, 3, 4, 5 или 6 единиц менее чем показатель ΔE для cегментной линии Spirulina Blue, измеренной против сегментной линии FD&C Blue No.1. В другом варианте выполнения изобретения, показатель ΔE по меньшей мере одной концентрации красителя в водном растворе при pH 8,0, измеренный против сегментной линии FD&C Blue No.1, составляет по меньшей мере на 7, 8, 9, 10 или 11 единиц менее, чем показатель ΔE для cегментной линии Spirulina Blue, измеренной против сегментной линии FD&C Blue No.1.
[0070] Провели анализ экстрактов различных антоцианинсодержащих плодов и овощей для определения источника антоцианинов, который позволяет обеспечить цветовые характеристики самые близкие к таковым, обеспеченным синтетическим синим красителем FD&C Blue No.1. На Фиг.4 представлено сравнение шести различных коммерчески доступных экстрактов краснокочанной капусты, фиолетового сладкого картофеля, черной моркови, красной редиски, фиолетовой кукурузы и винограда в водном растворе при пяти различных показателях pH. При визуальном сравнении видно, что антоцианины из красной редиски, фиолетовой кукурузы и винограда не обеспечивают тон синего цвета в водном растворе при любом pH в пределах от pH 6 до pH 8. Антоцианины из краснокочанной капусты, фиолетового сладкого картофеля и черной моркови обеспечивают тон синего цвета в водном растворе при более высоких значениях предела.
[0071] Любой сок или экстракт антоцианинсодержащих плодов или овощей, обеспечивающий тон синего цвета при высоких показателях pH, может быть использован в качестве источника антоцианинов для получения фракции(й) антоцианина по настоящему изобретению. В некоторых вариантах выполнения изобретения, фракцию антоцианина выделяют из экстракта краснокочанной капусты, фиолетового сладкого картофеля, синего картофеля, фиолетовой моркови или черной моркови или их комбинаций.
[0072] В одном варианте выполнения изобретения, способ включает селективное выделение антоцианинсодержащих фракций из экстракта краснокочанной капусты с получением натурального антоцианинсодержащего красителя, обеспечивающего характеристики аналогичные таковым, обеспеченным синтетическим FD&C Blue No.1.
[0073] Отобранные фракции содержащих антоцианин соков и экстрактов плодов и овощей могут быть выделены при использовании ионообменной колонны или колонны для полупрепаративной ВЭЖХ. Подходящая ионообменная среда включает катион- и ионообменную среду. Подходящие колонны для полупрепаративной ВЭЖХ включают C-18 колонны. В одном варианте выполнения изобретения, ионообменную колонну активируют растворителем, подходящим для ионообменной среды, перед загрузкой в нее сока или экстракта овощей или плодов.
[0074] Антоцианинсодержащую фракцию выделяют из смеси сока или экстракта антоцианинсодержащих овощей или плодов растворителем при pH по меньшей мере около 2, предпочтительно по меньшей мере около 4. В некоторых вариантах выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 2 до около 9. В другом варианте выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 3 до около 9. В другом варианте выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 4 до около 9. В другом варианте выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 5 до около 9. В других вариантах выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 6 до около 9. В другом варианте выполнения изобретения, фракцию антоцианинов выделяют растворителем при pH от около 7 до около 9.
[0075] Подходящие растворители для элюирования выбранных фракций включают метанол, ацетонитрил, воду и их смеси, в зависимости от полярности колоночной среды и растворимости антоцианинсодержащего сока или экстракта. В некоторых вариантах выполнения изобретения, растворитель представляет собой водный раствор метанола.
[0076] Подходящие агенты, которые могут быть добавлены в растворитель для регулирования pH, включают фосфат калия, гидроксид натрия и тому подобное.
[0077] В другом варианте воплощения настоящее изобретение относится к способу выделения второй фракции антоцианинов из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций, включающему:
a) селективное выделение антоцианинов в ионообменной колонне, исходя из разницы в заряде и полярности молекул антоцианина при использовании второго растворителя с выбранным рН, где уровень рН второго растворителя отличается от, предпочтительно выше чем уровень рН растворителя, используемого для элюирования первой фракции; и
b) выбор второй фракции или комбинации фракций, содержащих выделенные антоцианины, такие как выделенные антоцианины во второй фракции или комбинации фракций, которые в форме водного раствора при pH 8,0, обеспечивают цветовые характеристики, аналогичные таковым, обеспеченным FD&C Blue No.1, как измерено при максимальном поглощении от 615 нм до 635 нм. В этом варианте выполнения изобретения, первая фракция, которая может быть выделена при использовании первого растворителя с выбранным рН, такого как растворитель с pH по меньшей мере около 2, в ионообменной колонне, не обеспечивает смесь выделенных антоцианинов, которая в форме водного раствора при pH 8,0 обеспечивает цветовые характеристики, аналогичные таковым, обеспеченным FD&C Blue No.1, как измерено при максимальном поглощении от 615 нм до 635 нм. В одном варианте выполнения изобретения, выделенную вторую антоцианинсодержащую фракцию выделяют из сока или экстракта антоцианинсодержащих овощей или плодов растворителем с pH от около 2 до около 9, или в одном из следующих пределов с возрастающим предпочтением, например, от около 3 до около 9, от около 4 до около 9, от около 5 до около 9, от около 6 до около 9 или наиболее предпочтительно от около 7 до около 9.
Дополнительные фракции антоцианинов могут быть выделены при дополнительном фракционировании выделенной антоцианинсодержащей фракции при использовании ионообменной колонны или колонны для полупрепаративной ВЭЖХ. Подходящая ионообменная среда включает катион- и анионообменную среду. Подходящие колонны для полупрепаративной ВЭЖХ включают C-18 колонны.
Например, в другом варианте выполнения изобретения, способ фракционирования может дополнительно включать стадии:
c) загрузки выбранной одной фракции или комбинации фракций, содержащих выделенные антоцианины, в ионообменную колонну;
d) селективное выделение антоцианинов, загруженных в ионообменную колонну на стадии c), исходя из разницы в заряде и полярности молекул антоцианина, растворителем с выбранным рН; и
e) выбор одной фракции или комбинации фракций, содержащих выделенные антоцианины, выделенные на стадии d), таким образом, что выделенные антоцианины, выбранные на стадии e), когда находятся в форме водного раствора при pH 8,0, обеспечивают максимальное поглощение от 620 до 635 нм. Если требуется, то третья, четвертая и другие дополнительные антоцианинсодержащие фракции могут быть получены аналогичным образом. В другом варианте выполнения изобретения, антоцианины, выбранные на стадии e), по меньшей мере в одной концентрации в водном растворе при pH 8,0 обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
[0078] В другом варианте выполнения изобретения, стадия селективного выделения антоцианинов в ионообменной колонне, исходя из разницы заряда и полярности молекул антоцианинов, включает стадии (i) первую растворителем с выбранным рН с получением первой фракции и (ii) при использовании второго растворителя со вторым выбранным рН, причем уровень рН второго растворителя отличается от уровня рН первого растворителя, с получением последующей фракции, которая представляет собой одну фракцию, или множества последующих фракций, которые представляют собой комбинацию фракций, причем выделенные антоцианины в одной фракции или комбинации фракций, когда находятся по меньшей мере в одной концентрации в водном растворе при pH 8,0, обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
[0079] В другом варианте выполнения изобретения, стадия селективного выделения антоцианинов в ионообменной колонне, исходя из разницы заряда и полярности молекул антоцианинов, включает стадии (i) использования первого растворителя с выбранным рН, который представляет собой первый элюирующий растроритель, с получением первой фракции и (ii) использования одного или более последующих элюирующих растворителей с выбранным рН с получением одной фракции или комбинации фракций, причем каждый элюирующий растворитель отличается, и отличие может быть независимо выбрано из группы: pH, композиции растворителя и их комбинации. Предпочтительно выбранный рН первого элюирующего растворителя ниже выбранного рН одной или более последующей фракции. Предпочтительно выбранный рН составляет в пределах от около 2 до около 9, или в одном из следующих пределов с возрастающим предпочтением, например, от около 3 до около 9, от около 4 до около 9, от около 5 до около 9, от около 6 до около 9 или наиболее предпочтительно от около 7 до около 9. В другом варианте выполнения изобретения, выделенные антоцианины в одной фракции или комбинации фракций, находясь по меньшей мере в одной концентрации в форме водного раствора с pH 8,0, обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
[0080] Выделенные антоцианинсодержащие фракции могут быть использованы в качестве красителей или могут быть подвергнуты дополнительной технологической обработке, например, очистке, концентрированию, дезодорированию или стабилизации цвета.
[0081] Способ селективного выделения может быть осуществлен в масштабе, позволяющем получать коммерчески полезные количества натуральных синих красителей.
[0082] Натуральные синие антоцианинсодержащие красители, полученные способом по настоящему изобретению, могут быть нанесены на или введены во все типы пищевых продуктов, включая пищевые продукты для потребления человеком и кормовые продукты для потребления животными, напитки и фармацевтические продукты. Примеры пищевых продуктов включают кормовые продукты и лакомства для домашних животных, бакалейные товары (например, рис, зерновые и злаки), супы и соусы, кондитерские продукты (например, шоколад, все виды конфет с сахаром и без сахара, конфеты в виде батончиков, жевательная резинка и драже), десертные продукты (например, пудинг, фростинги, айсинги и топпинги), выпечные продукты (например, торты, печенье, вафли и печенье типа галет), молочные продукты (например, йогурт, взбитые сливки и сыр), напитки (например, напитки на основе молока, воды, соки, чаи и безалкогольные тонизирующие прохладительные напитки), закусочные продукты (например, крекеры, закуски в виде батончиков, крендельки и чипсы) и фармацевтические формы (например, таблетки, суспензии, жевательные таблетки и сиропы). Натуральный синий антоцианинсодержащий краситель также может быть введен в композиции пищевого красителя, пищевые покрытия и пищевые чернила. В одном варианте выполнения изобретения, синий антоцианинсодержащий краситель вводят в покрытия или чернила, наносимые на поверхность кондитерского продукта. В другом варианте выполнения изобретения, синий антоцианинсодержащий краситель вводят в покрытия или чернила, наносимые на поверхность кондитерского продукта, причем кондитерский продукт представляет собой сердцевину кондитерского изделия с мягким или твердым глазирующим покрытием на основе сахара. В другом варианте выполнения изобретения, синий антоцианинсодержащий краситель вводят в покрытия или чернила, наносимые на поверхность кондитерского продукта, причем кондитерский продукт представляет собой сердцевину кондитерского изделия с мягким или твердым глазирующим покрытием без сахара.
[0083] В одном варианте выполнения изобретения, раствор экстракта краснокочанной капусты фракционируют при использовании колонны с сильной катионообменной смолой. Первую фракцию элюируют 75 об.% м 0,1 M калий- фосфатным буфером при pH 8 и 25 об.% метанолом. Вторую фракцию элюируют 30 об.% 0,1 M калий-фосфатным буфером при pH 8 и 70 об.% метанолом.
[0084] В другом варианте выполнения изобретения, раствор экстракта краснокочанной капусты фракционируют при использовании колонны с сильной катионобменной смолой. Первую фракцию элюируют 75 об.% 0,1 M калий-фосфатным буфером при pH 6 и 25 об.% метанолом. Вторую фракцию элюируют 75 об.% 0,1 M калий-фосфатным буфером при pH pH 7 и 25 об.% метанолом. Третью фракцию элюируют 75 об.% 0,1 M калий-фосфатным буфером при pH 8 и 25 об.% метанолом. Четвертую фракцию элюируют 30 об.% 0,1 M калий-фосфатным буфером при pH 8 и 70 об.% метанолом.
[0085] В другом варианте выполнения изобретения, раствор экстракта краснокочанной капусты разделяют при использовании C-18 колонны для полупрепаративной ВЭЖХ.
[0086] Способ селективного выделения фракций антоцианинов из комплексных смесей антоцианинов из соков и экстрактов овощей и плодов, исходя из разницы заряда и полярности молекул антоцианинов, позволяет получить красители, обеспечивающие цветовые характеристики, которые отличаются от таковых, обеспеченных комплексными смесями.
[0087] Этот способ селективного выделения фракций антоцианинов из комплексных смесей антоцианинов, исходя из разницы полярности молекул антоцианинов, отвечает давно существующей потребности в средствах получения натуральных синих красителей, которые обеспечивают цветовые характеристики аналогичные таковым, обеспеченным синтетическим красителем FD&C Blue No.1.
[0088] Далее будут представлены конкретные варианты выполнения изобретения, со ссылкой на следующие Примеры. Следует понимать, что эти Примеры представлены только для иллюстрации настоящего изобретения и его варианты не выходят за рамки объема притязаний настоящего изобретения.
ПРИМЕР 1
Фракционирование экстракта краснокочанной капусты при использовании картриджа с сильной катионообменной смолой
[0089] SCX (сильная катионообменная смола Strong Cation Exchange) картридж для твердофазной экстракции от Phenomenex® (Torrance, CA) активировали при использовании чистого метанола. Картридж промыли при использовании 0,01 об.% подкисленной воды. Водный раствор экстракта краснокочанной капусты загрузили в картридж и промыли 0,01 об.% подкисленной водой. Через картридж пропустили калий-фосфатный буфер (0,1 M) при pH 8. Фракцию 1 элюировали и собрали при использовании 25 об.% забуференного водного раствора метанола при pH 8. Фракцию 2 элюировали и собрали при использовании 70 об.% забуференного водного раствора метанола при pH 8.
[0090] Фракции 1 и 2 подкислили 2-5 мл 88 об.% муравьиной кислоты. Метанол удалили при использовании ротационного испарителя.
[0091] Для удаления солей Фракцию 1 загрузили в C-18 картридж и элюировали 0,01 об.% подкисленной водой. Элюент собрали в 0,01 об.% подкисленную воду и выпарили остаточный метанол. Фракцию 2 также пропустили через C-18 картридж при использовании процедуры, представленной для Фракции 1.
[0092] Максимальное поглощение длин волн УФ/Видимой области и цветовые характеристики были обеспечены раствором экстракта краснокочанной капусты (RCE), Фракции 1 и 2 были подвергнуты анализу при различных показателях pH, как представлено ниже в Таблице 4.
Фракция 2 при pH 7,6 и pH 8,0 обеспечила показатели λmax самые близкие к таковым синтетического FD&C Blue No.1 (λmax = 630 нм), то есть, показатели λmax 616,40 и 619,40, соответственно.
Также для сравнения характеристик цвета, обеспеченных Фракцией 2 при pH 7,6 и pH 8,0, с таковыми обеспеченными синтетическим FD&C Blue No.1, могут быть рассчитаны показатели ΔE. Показатели ΔE представляют эквивалентные минимальным расстояниям между значениями цвета Фракции 2 в L*a*b* цветовом пространстве и FD&C Blue No.1 модели. Следовательно, Уравнение 5 используют для расчета dmin или показателей ΔE по следующим данным:
X0 для Фракции 2 при pH 7,6 в L*a*b* цветовом пространстве составляет:
X0 = (91,62, -4,17, -5,68)
X0 для Фракции 2 при pH 8,0 в L*a*b* цветовом пространстве составляет:
X0 = (91,56, -5,80, -5,81)
X1 и X2 представляют две точки FD&C Blue No.1 модели:
X1 = (90,65, -24,40, -14,28)
X2 = (97,69, -6,43, -3,57)
Рассчитанный dmin, или ΔE составил 6,7 для Фракции 2 при pH 7,6, и 6,0 для Фракции 2 при pH 8,0.
[0093] На Фиг.6 представлены хроматограммы ВЭЖХ при 520 нм раствора экстракта краснокочанной капусты (RCE) и Фракций 1 и 2. На Фиг.6 видно, что Фракция 2 имеет более высокую концентрацию пиков последнего элюирования по сравнению с раствором экстракта краснокочанной капусты.
ПРИМЕР 2
Фракционирование экстракта краснокочанной капусты при использовании картриджа с сильной катионообменной смолой и растворителей при различных высоких показателях pH
[0094] SCX (сильная катионообменная смола Strong Cation Exchange) картридж для твердофазной экстракции от Phenomenex® (Torrance, CA) активировали при использовании чистого метанола. Разбавленный 0,01 об.% подкисленной водой (10-15 мл) экстракт краснокочанной капусты загрузили в картридж и промыли 0,01 об.% подкисленной водой. Через картридж пропустили калий-фосфатный буфер (0,1 M) при pH 6. Фракцию 1 элюировали и собрали 25 об.% раствором метанола при pH 6. Через картридж пропустили калий-фосфатный буфер (0,1 M) при pH 7. Фракцию 2 элюировали и собрали 25 об.% раствором метанола при pH 7. Через картридж пропустили калий-фосфатный буфер (0,1 M) при pH 8. Фракцию 3 элюировали и собрали 25 об.% раствором метанола при pH 8. Фракцию 4 элюировали и собрали 70 об.% раствором метанола при pH 8.
[0095] Фракции 1-4 подкислили 20 об.% муравьиной кислотой. Метанол удалили при использовании ротационного испарителя.
[0096] Для вымывания солей Фракцию 1 загрузили в C-18 картридж и элюировали 0,01 об.% подкисленной водой. Элюент собрали в 0,01 об.% подкисленную воду и выпарили остаточный метанол. Фракции 2-4 также пропустили через C-18 картридж при использовании процедуры, представленной для Фракции 1.
[0097] Максимальное поглощение длин волн УФ/Видимой области и цветовые характеристики были обеспечены раствором экстракта краснокочанной капусты (RCE), Фракции 1 -4 были подвергнуты анализу при различных показателях pH, как представлено ниже в Таблице 5.
Фракция 4 при pH 8,0 обеспечила показатель λmax самый близкий к таковому синтетического FD&C Blue No.1 (λmax = 630 нм), то есть, показатель λmax 622,2.
Также для сравнения характеристик цвета, обеспеченных Фракцией 4 при pH 8,0, с таковыми обеспеченными синтетическим FD&C Blue No.1, может быть рассчитан показатель ΔE. Показатель ΔE представляет эквивалент минимального расстояния между значениями цвета Фракции 4 в L*a*b* цветовом пространстве и FD&C Blue No.1 модели. Следовательно, Уравнение 5 используют для расчета dmin или ΔE по следующим данным:
X0 для Фракции 4 при pH 8,0 в L*a*b* цветовом пространстве составляет:
X0 = (90,08, -7,87, -7,20)
X1 и X2 представляют две точки FD&C Blue No.1 модели:
X1 = (90,65, -24,40, -14,28)
X2 = (97,69, -6,43, -3,57)
Рассчитанный dmin, или ΔE, составил 6,7 для Фракции 4 при pH 8,0.
На Фиг.7 представлены хроматограммы ВЭЖХ при 520 нм водного экстракта краснокочанной капусты (RCE) и Фракций 1-4. На Фиг.7 видно, что Фракция 4 имеет более высокую концентрацию пиков последнего элюирования по сравнению с раствором экстракта краснокочанной капусты.
ПРИМЕР 3
Выделение групп пиков экстракта краснокочанной капусты при использовании полупрепаративной ВЭЖХ
[0098] Фракции, ассоциируемые с двумя специфическими группами пиков, как показано на хроматограммах на Фиг.8, могут быть выделены и собраны из раствора экстракта краснокочанной капусты при использовании полупрепаративной ВЭЖХ. Раствор экстракта краснокочанной капусты загрузили в C-18 картридж для полупрепаративной ВЭЖХ и две фракции, Фракцию 520-нм (λmax = 524 нм) и Фракцию 530-нм (λmax = 532 нм) элюировали при использовании кислого ацетонитрила и водного градиента. Остаточный ацетонитрил выпарили из каждой фракции при использовании ротационного испарителя.
[0099] Оценку цветовых характеристик провели после регулирования концентраций фракций и смешивания аликвот отдельных фракций с буфером с получением пяти аликвот при pH 6, 6,6, 7, 7,6, и 8. Максимальное поглощение длин волн УФ/Видимой области и цветовые характеристики аликвот Фракций 520-нм и 530-нм проанализировали, результаты представлены в Таблице 6.
Фракция 530-нм имела максимальное поглощение около 621 нм при pH 7,6 и pH 8,0 и обеспечила самый близкий к синтетическому FD&C Blue No.1 показатель (λmax = 630 нм).
Также для сравнения характеристик цвета, обеспеченных Фракцией 530-нм при pH 7,6 и pH 8,0 с таковыми обеспеченными синтетическим FD&C Blue No.1, могут быть рассчитаны показатели ΔE. Показатели ΔE представляют эквивалентные минимальным расстояниям между значениями цвета Фракции 530-нм в L*a*b* цветовом пространстве и FD&C Blue No.1 модели. Следовательно, Уравнение 5 используют для расчета dmin или ΔE, по следующим данным:
X0 для Фракции 530-нм при pH 7,6 в L*a*b* цветовом пространстве составляет:
X0 = (87,67, -5,44, -9,90)
X0 для Фракции 530-нм при pH 8,0 в L*a*b* цветовом пространстве составляет:
X0 = (86,39, -11,79, -11,98)
X1 и X2 представляют две точки FD&C Blue No.1 модели:
X1 = (84,25, -37,23, -23,42)
X2 = (90,65, -24,40, -14,28)
Рассчитанный dmin, или ΔE, составил 12,1 для Фракции 530-нм при pH 7,6, и 9,9 для Фракции 530-нм при pH 8,0.
[00100] На Фиг.9 представлено визуальное сравнение Фракций 520-нм и 530-нм при различных показателях pH. Концентрация Фракции 520-нм составила 107,7 мг/л (Cyn-3-glu), и концентрация Фракции 530-нм составила 55,6 мг/л (Cyn-3-glu). При нейтральном и более высоком pH видно, что Фракция 530-нм обеспечила от в два до в четыре раза большую цветность (как измерено при использовании C*) по сравнению с Фракцией 520-нм при половинной концентрации красителя.
[00101] На Фиг.10 представлены хроматограммы ВЭЖХ при 520 нм раствора экстракта краснокочанной капусты и Фракции 520-нм и 530-нм. На Фиг.10 видно, что каждая фракция содержит три различных соединения антоцианина.
СРАВНИТЕЛЬНЫЙ ПРИМЕР 1
[0100] Получили несколько разных концентраций раствора антоцианина краснокочанной капусты, как описано в Примерах WO 2004/012526 при pH 8,0. Для выделения и сбора выделенных антоцианинсодержащих красителей фракционирование не проводили. Максимальное поглощение полученных в результате растворов составило 610 нм. Такой цвет не считается приемлемым совпадением с цветом FD&C Blue No.1.
| название | год | авторы | номер документа |
|---|---|---|---|
| НАТУРАЛЬНЫЕ СИНИЕ АНТОЦИАНИН-СОДЕРЖАЩИЕ КРАСИТЕЛИ | 2014 |
|
RU2641830C2 |
| Композиции красителей на основе антоцианина и способы их применения | 2019 |
|
RU2795394C2 |
| КОМПОЗИЦИИ КРАСИТЕЛЕЙ И СПОСОБЫ ИХ ИСПОЛЬЗОВАНИЯ | 2016 |
|
RU2721836C2 |
| СТАБИЛИЗАЦИЯ НАТУРАЛЬНЫХ СИНИХ АНТОЦИАНСОДЕРЖАЩИХ КРАСИТЕЛЕЙ И ПРИГОТОВЛЕННЫХ ПРОДУКТОВ | 2014 |
|
RU2636761C2 |
| ОРАНЖЕВЫЕ И КРАСНЫЕ КРАСИТЕЛИ, СОДЕРЖАЩИЕ АНТОЦИАНИН | 2014 |
|
RU2652386C2 |
| КОРИЧНЕВЫЙ КРАСИТЕЛЬ, СОДЕРЖАЩИЙ АНТОЦИАНИН | 2014 |
|
RU2652141C2 |
| ТВЕРДОЕ ДРАЖЕРОВОЧНОЕ ПОКРЫТИЕ И СОДЕРЖАЩЕЕ ЕГО КОНДИТЕРСКОЕ ИЗДЕЛИЕ | 2014 |
|
RU2644581C2 |
| СВЕТОСТАБИЛЬНЫЕ ПРИРОДНЫЕ ЖЕЛТЫЕ КРАСЯЩИЕ СИСТЕМЫ В МАРИНОВАННЫХ И ФЕРМЕНТИРОВАННЫХ ОВОЩАХ | 2020 |
|
RU2830302C1 |
| КОМПОЗИЦИЯ С ЦВЕТОВЫМ МАРКЕРОМ | 2008 |
|
RU2465890C1 |
| ЗАЩИТА ОТ ОБЕСЦВЕЧИВАНИЯ КРАСИТЕЛЕЙ ИЗ НАТУРАЛЬНЫХ ИСТОЧНИКОВ, ИСПОЛЬЗУЕМЫХ В НАПИТКОВЫХ ПРОДУКТАХ | 2012 |
|
RU2556713C1 |



Настоящее изобретение относится к способу выделения фракций молекул антоцианинов из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций. Загружают в ионообменную колонну сок или экстракт антоцианинсодержащих овощей или плодов или их комбинации. Проводят селективное выделение антоцианинов в указанной колонне при использовании растворителя с выбранным рН, исходя из разницы в заряде и полярности молекул антоцианина. Выбирают одну фракцию или комбинацию фракций, содержащих выделенные антоцианины, которые, находясь в форме водного раствора при рН 8,0, имеют максимальное поглощение от 615 до 635 нм. Способ позволяет получить фракции, содержащие смеси антоцианинов, обеспечивающие цветовые характеристики, аналогичные таковым, обеспеченным синтетическим синим красителем FD&C Blue No.1. 16 з.п. ф-лы, 10 ил., 6 табл., 4 пр.
1. Способ выделения фракции антоцианинов из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций, включающий:
a) загрузку в ионообменную колонну сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций;
b) селективное выделение антоцианинов в ионообменной колонне, исходя из разницы в заряде и полярности молекул антоцианина при использовании растворителя с выбранным рН; и
c) выбор одной фракции или комбинации фракций, содержащих выделенные антоцианины, так, что выделенные антоцианины в одной фракции или комбинации фракций, когда они находятся в форме водного раствора при pH 8,0, имеют максимальное поглощение от 615 нм до 635 нм.
2. Способ по п. 1, в котором выделенные антоцианины в одной фракции или комбинации фракций по меньшей мере в одной концентрации в водном растворе при pH 8,0 обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
3. Способ по п. 1, в котором источник сока или экстракта антоцианинсодержащих овощей или плодов выбирают из группы, состоящей из краснокочанной капусты, фиолетового сладкого картофеля, синего картофеля, черной моркови, фиолетовой моркови и их комбинаций.
4. Способ по п. 3, в котором источник сока или экстракта антоцианинсодержащих овощей или плодов представляет собой краснокочанную капусту.
5. Способ по п. 1, в котором выбранная антоцианинсодержащая фракция выделена из сока или экстракта антоцианинсодержащих овощей или плодов или их комбинаций при использовании растворителя с выбранным рН от около 4 до около 9.
6. Способ по п. 1, в котором первую антоцианинсодержащую фракцию элюируют 25 об.% раствором метанола при pH 8, а последующую антоцианинсодержащую фракцию, то есть одну фракцию или множество последующих фракций, то есть комбинацию фракций, элюируют 70 об.% раствором метанола при pH 8.
7. Способ по п. 6, дополнительно включающий стадию очистки одной фракции или комбинации фракций.
8. Способ по п. 7, в котором выделенные антоцианины одной фракции или комбинации фракций по меньшей мере в одной концентрации в водном растворе при pH 8,0 обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
9. Способ по п. 1, в котором ионообменная колонна представляет собой катионообменную колонну.
10. Способ по п. 1, в котором стадия селективного выделения антоцианина в ионообменной колонне, исходя из разницы заряда и полярности молекул антоцианинов, включает стадии (i) использования первого растворителя с выбранным рН с получением первой фракции и (ii) затем использования второго растворителя с вторым выбранным рН, причем уровень рН второго растворителя отличается от уровня рН первого растворителя, с получением последующей фракции, которая представляет собой одну фракцию, или с получением множества последующих фракций, которые представляют собой комбинацию фракций, причем выделенные антоцианины в указанной одной фракции или комбинации фракций, когда находятся по меньшей мере в одной концентрации в водном растворе при pH 8,0, обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
11. Способ по п. 1, дополнительно включающий:
d) загрузку в ионообменную колонну выбранной одной фракции или комбинации фракций, содержащих выделенные антоцианины;
e) селективное выделение антоцианинов, загруженных в ионообменную колонну на стадии d), исходя из разницы в заряде и полярности молекул антоцианина при использовании растворителя с выбранным рН; и
f) выбор одной фракции или комбинации фракций, содержащих антоцианины, выделенные на стадии e), таким образом, что выбранные антоцианины на стадии f), когда находятся в форме водного раствора при pH 8,0, обеспечивают максимальное поглощение от 620 до 635 нм.
12. Способ по п. 11, в котором выделенные антоцианины, выбранные на стадии f), по меньшей мере в одной концентрации в водном растворе при pH 8,0 обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
13. Способ по п. 1, в котором стадия селективного выделения антоцианина в ионообменной колонне, исходя из разницы заряда и полярности молекул антоцианинов, включает стадии (i) первую при использовании растворителя с выбранным рН, который представляет собой первый элюирующий растворитель, с получением первой фракции и (ii) при использовании одного или более последующего элюирующего растворителя с выбранным рН с получением одной фракции или комбинации фракций, причем каждый элюирующий растворитель отличается и отличие может быть независимо выбрано из группы: pH, композиции растворителя.
14. Способ по п. 13, в котором выделенные антоцианины в одной фракции или комбинации фракций, когда находятся по меньшей мере в одной концентрации в водном растворе при pH 8,0, обеспечивают цветовые характеристики, имеющие показатель ΔE 12 или менее по сравнению с цветовыми характеристиками, определенными сегментной линией, определенной показателями L*a*b* 5 м.д. и 10 м.д. FD&C Blue No.1 в водном растворе.
15. Способ по п. 14, в котором первый элюирующий растворитель представляет собой смесь органического растворителя и воды с первой концентрацией органического растворителя, а последующий элюирующий растворитель, то есть вторая смесь органического растворителя и воды, имеет вторую концентрацию органического растворителя, причем первая концентрация отличается от второй концентрации.
16. Способ по п. 13, в котором первый элюирующий растворитель имеет выбранный рН, который отличается от выбранного pH последующего элюирующего растворителя.
17. Способ по п. 16, в котором выбранный рН первого элюирующего растворителя ниже выбранного рН последующего элюирующего растворителя.
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Колосоуборка | 1923 |
|
SU2009A1 |
| Способ обработки целлюлозных материалов, с целью тонкого измельчения или переведения в коллоидальный раствор | 1923 |
|
SU2005A1 |
| СПОСОБ ВЫДЕЛЕНИЯ БИОЛОГИЧЕСКИ АКТИВНЫХ АНТОЦИАНОВ | 2005 |
|
RU2302423C2 |
| БОЛОТОВ В.М., НЕЧАЕВ А.П., САРАФАНОВА Л.А | |||
| "Пищевые красители: классификация, свойства, анализ, применение", Санкт-Петербург, ГИОРД, 2008, с | |||
| Скоропечатный станок для печатания со стеклянных пластинок | 1922 |
|
SU35A1 |
Авторы
Даты
2017-08-28—Публикация
2014-03-14—Подача