Изобретение относится к биотехнологии.
Изобретение относится к получению новых штаммов Е. coli BL21 pET28b-inlBallele13, pET28b-inlBallele14, pET28b-inlBallele9, полученных трансформацией штамма Escherichia coli BL21 плазмидой BL21 -inlBallele13, pET28b-inlBallele14, pET28b-inlBallele9 - продуцентов рекомбинантного белка интерналин 321. Изобретение также относится к получению интерналина 321 с помощью указанных штаммов. Наработанный указанными штаммами интерналин В может применяться во многих сферах биологических и медицинских исследований, в частности при создании и изучении лекарственных средств-агонистов природных эукариотических рецепторов для регенерации мягких тканей и моделирования инфекционного процесса.
Рецептор фактора роста гепатоцитов (HGPR), известный также как c-Met, относится к трансмембранным тирозинкиназным рецепторам, регулирующим многие важные клеточные процессы, в том числе пролиферацию, миграцию и дифференциацию клеток человека. Данный рецептор экспрессируется в эпителиальных и мезенхимальных клетках многих органов, включая не только печень, но и кожу, поджелудочную железу, почки и красный костный мозг [1]. HGPR имеет внеклеточный аминоконцевой домен, ответственный за связывание с лигандом, и внутриклеточный домен, обладающий киназной активностью, которые соединяются трансмембранной альфа-спиралью. Первые 500 аминокислотных остатков (а.о.) внеклеточной части HFPR формируют Sema домен. PSI домен, следующий за Sema доменом, охватывает около 50 а.о. и включает 4 дисульфидные связи. Этот домен присоединяется к трансмембранной спирали посредством четырех IPT (immunoglobulin-plexin-transcription) доменов, которых относят к иммуноглобулинподобным доменам. Внутриклеточная часть включает в себя околомембранную последовательность, обуславливающую отрицательную регуляцию киназной активности, киназный домен, положительно модулирующий киназную активность посредством перекрестного фосфорилирования Туr1234 и Туr1235, и мультифункциональный сайт связывания, содержащий два связывающих тирозина 1349 и 1356, с которыми связываются внутриклеточные белки, преимущественно трансдукторы и адапторы сигнальных путей эукариотической клетки [2].
Как и многие другие тирозинкиназные рецепторы, HGPR относится к митогенным рецепторам. Активация HGPR его специфическим лигандом - фактором роста гепатоцитов (HGF) - является сигналом начала пролиферации клеток. HGF/HGFR зависимая пролиферация - ключевой момент в процессах регенерации печени и заживлении ран [3, 4]. HGPR вовлечен в регуляцию так называемого процесса рассеяния эпителиальных клеток, которое включает разрушение межклеточных контактов и миграцию клеток [5]. Клеточное рассеяние является одним из ключевых процессов при заживлении ран, а также в эмбриогенезе [6]. Это явление впервые продемонстрировано на MDCK клетках, подвергнутых обработке рекомбинантным лигандом HGF [7].
Активация рецептора HGFR происходит путем, типичным для большинства тирозинкиназных рецепторов. Связывание лиганда приводит к димеризации рецептора, киназные области двух рецепторов сближаются и автофосфорилируются за счет перекрестного фосфорилирования [8]. В случае HGPR рецептора фосфорилируются два тирозиновых остатка (положение 1234 и 1235), расположенных в пределах каталитической петли тирозинкиназного домена [9]. Каскадное фосфорилирование тирозинов в положениях 1349 и 1356 в карбоксильном конце приводит к формированию сайта узнавания для ряда эффекторных белков внутриклеточных сигнальных каскадов, включая адапторные белки GRB2 (Growth factor receptor-bound protein 2), SHC (Src homology-2-containing), CRK (v-crk sarcoma virus CT10 oncogene homology) и другие. В большинстве случаев они содержат высококонсервативные фосфотирозинсвязывающие домены: SH2-домены или РТВ-домены [8].
Нижестоящий ответ на активацию HGPR зависит от стереотипных сигнальных модуляторов, общих для всех тирозинкиназных рецепторов, главными из которых являются МАРК-зависимый сигнальный путь (Mitogen activated protein protein kinase), PI3K/Akt-зависимый сигнальный путь и STAT-зависимый сигнальный путь. Все эти пути направлены на то, чтобы передать информацию от рецептора к ядру, что приводит к изменению экспрессии соответствующих генов.
Сигнальный путь PI3K/Akt стимулирует выживание и рост клеток и включает активацию серин-треониновой киназы mTOR [8]. МАРК-каскадный путь ведет к пролиферации и прогрессированию клеточного цикла. Три компонента этого пути являются протеинкиназами, каждая из которых фосфорилирует последующую, таким образом передавая сигнал дальше к ядру. Последняя киназа Erk непосредственно входит в ядро и активирует факторы транскрипции, обуславливающие регуляцию большого числа генов [1]. Взаимодействие активированного HGPR с белком STAT3 приводит к фосфорилированию этого белка, димеризации и транслокации в ядро, где STAT3 действует как транскрипционный фактор, регулирующий гены, отвечающие за клеточную пролиферацию и дифференциацию.
Listeria monocytogenes - грамположительная бактерия, факультативный внутриклеточный паразит, вызывающий тяжелое заболевание, как у людей, так и у животных. L. monocytogenes инфицирует главным образом людей с иммунодефицитом, беременных, новорожденных и пожилых. Листерии относятся к энтеропатогенам, и инфекция преимущественно происходит через кишечник, куда возбудитель попадает с контаминированной пищей, приводя к бактериемии, сепсису, энцефалиту и абортам. Бактерия заражает как фагоциты, так и широкий спектр нефагоцитарных клеток. Активная инвазия в непрофессиональные фагоциты происходит благодаря активности двух факторов патогенности L. monocytogenes - белков семейства интерналинов: интерналина А и интерналина В (InlA и InlB) [10, 11]. Интерналины либо секретируются, либо являются закрепленно-поверхностными белками и все имеют общие черты в области N-конца, в то время как С-конец более вариабелен и часто состоит из различных сочетаний небольших доменов, размеры которых порядка 70-80 аминокислотных остатков [12].
Проникновение L. monocytogenes в различные эпителиальные и эндотелиальные клетки требует активации тирозинкиназного рецептора HGPR, которая осуществляется через связывание с белком семейства интерналинов (Интерналин В, InlB). InlB имеет массу 67 кДа и состоит из 630 аминокислот. В структуре белка за короткой cap областью следуют лейцин, богатые повторы (leucine-rich repeat, LRR) и IR-область. Эти три области составляют интерналиновый домен InlВ321 (аминокислоты 36-321). Область, содержащая cap и LRR, достаточна для связывания с рецептором [13], а фрагмент, содержащий и IR область, минимальный фрагмент, способный к активации рецептора [14]. Средняя часть, В-повторы, пока мало изученный домен, функции которого пока неясны. Область С-конца InlB содержит три тандемных повтора длиной около 80 остатков, начинающихся с GW-дипептида. Этот участок опосредует связывания белка с поверхностью бактерии, главным образом через нековалентное взаимодействие с липотейхоевыми кислотами, мембранно-закрепленных полимеров, присутствующих на поверхности грамположительных бактерий [15]. InlB может связываться с гликоаминогликанами, отрицательно заряженными полисахаридами, присутствующими на клеточной поверхности, через GW-повторы. Присутствие на клеточной поверхности гликоаминогликанов значительно повышает интерналинзависимую инвазию [16].
В процессе инфекции, вызываемой взаимодействием между InlB и поверхностным рецептором HGPR, сигнальные события приводят к перестройкам цитоскелета клетки млекопитающих и последующей интернализации бактерии [17]. Помимо интернализации клетки активация HGPR через InlB приводит к активации путей, описанных выше, таким образом, делая InlB аналогом эндогенного лиганда этого рецептора - фактора роста гепатоцитов HGF. Было отмечено, что растворимый, не связанный с бактериальной поверхностью InlB ведет себя скорее как фактор роста, чем инвазии, т.е. стимулируя внутриклеточный сигналинг, растворимый белок не вызывает значительных перестроек цитоскелета, связанных с формированием фагоцитарной чаши [15, 18]. Было показано, что InlB ведет к активации PI3/Akt-пути [19], МАРК и STAT3 путей [20].
Важно, что InlB не проявляет конкурентной способности по отношению к HGF при связывании с рецептором, что говорит об отсутствии конкурентной борьбы между лигандами за место связывания [13]. В исследовании [14], кристаллизовав комплекс между Inl В321 и HGPR, представлено, что первой зоной взаимодействия является контакт между LRR-областью белка и Ig1-доменом рецептора, а второй зоной - между IR-областью белка и 4 и 6 основанием Sema-домена α-цепи рецептора, в то время как взаимодействие HGF с рецептором затрагивает 2 и 3 основание Sema-домена α-цепи рецептора. Данная работа доказывает также, что второй контакт важен именно для активации рецептора, а первый для связывания белка с рецептором. Кроме того, для полноценной активации рецептора требуется полный белок, включающий GW-домен.
В последующих работах [14, 18] показано, что, меняя структуру белка InlB, можно менять активацию рецептора. В [18] определили две новые структуры InlB, антипараллельная, димерная конформация, в которой два промотора взаимодействуют через LRR-домен. Эта связь была обнаружен и в комплексе с рецептором. Разрушение этого контакта приводит к уменьшению способности активировать рецептор и нижележащие пути. Стабилизация связи посредством дисульфидных связей делает димерный вариант с высокой сигнальной активностью, который стимулирует клеточную пролиферацию. В другой работе [20] был сконструирован димер интерналинового домена InlB321 через связующий пептид. Продемонстрировано, что в сравнении с обычным доменом димер показал более высокую степень активации рецептора и стимулирует пролиферацию на уровне полноценного HGF. Изучение природных изолятов L. monocytogenes выявило существование вариантов интерналинового домена InlB, которые отличаются структурно - по наличию аминокислотных замен и функционально - по способности поддерживать вирулентность L. monocytogenes и активировать контролируемые c-Met сигнальные [21, 22].
Рассматривая потенциальные возможности использования рекомбинантных лигандов рецептора HGFR в терапии, можно выделить следующие преимущества InlB в сравнении с HGF:
1. Бактериальный белок InlB не имеет структурного сходства с HGF, что предполагает отсутствие потенциальных аутоиммунных реакций.
2. InlB не требует посттрансляционных модификаций, что значительно упрощает как получение очищенного препарата in vitro, так и возможности использования InlB в генотерапии.
3. Для InlB доступны структурные варианты, отличающиеся по степени активации рецептора HGFR (HGPR), что позволяет оптимизировать использование InlB.
4. Взаимодействие InlB с HGFR включает домены рецептора, альтернативные доменам, вовлеченным в связывание лиганда HGF, что позволяет использовать InlB в ситуациях, в которых невозможна активация рецептора эндогенным лигандом.
Сущностью настоящего изобретения является создание новых штаммов клеток Escherichia coli BL21, содержащих pET28b-inlBallele13, pET28b-inlBallele14, pET28b-inlBallele9, продуцирующих рекомбинантный белок - фрагмент InlB - интерналин 321, включающий полноценный рецепторсвязывающий интерналиновый домен белка InlB. Способность клеток Escherichia coli штамма BL21 pET28b-inlBallele13, pET28b-inlBallele14 или pET28b-inlBallele9 секретировать рекомбинантный интерналин 321 достигается при помощи генной модификации клеток Escherichia coli плазмидами pET28b (Последовательность №1), каждая из которых содержит аллель гена интерналинового домена inlBallele13 (Последовательность №2), inlBallele14 (Последовательность №3), inlBallele9 (Последовательность №4), соответствующие альтернативным вариантам белка.
Целью настоящего изобретения является создание коллекции уникальных клеточных штаммов, которые можно использовать для получения рекомбинантного интерналина 321, соответствующего определенному аллельному варианту гена. Эта задача является актуальной для современной фармакологической биотехнологии. Наработанный указанными штаммами интерналин В может применяться во многих сферах биологических и медицинских исследований, в частности при создании и изучении лекарственных средств-агонистов природных эукариотических рецепторов для регенерации мягких тканей и моделирования инфекционного процесса.
Поставленная задача решена получением новых штаммов Escherichia coli BL21 pET28b-inlBallele13, pET28b-inlBallele14 и pET28b-inlBallele9, трансформированных плазмидой pET28b-inlBallele13 (Последовательность №2), pET28b-inlBallele14 (Последовательность №3) или pET28b-inlBallele9 (Последовательность №4) соответственно и продуцирующих рекомбинантный белок интерналин В в количестве не менее 4 мкг очищенного рекомбинантного белка на 1 мл ростовой среды за 6 часов (по методике Лоури и Бредфорда). Полученный штамм обладает стабильными культуральными и морфологическими свойствами и в результате генной модификации обладает способностью продуцировать рекомбинантный интерналин 321.
Таким образом, техническим результатом, достигаемым при осуществлении изобретения, является получение вариантов белка интерналина В в количестве не менее 4 мкг очищенного рекомбинантного белка на 1 мл ростовой среды за 6 часов (по методике Лоури и Бредфорда). Кроме того, технический результат также заключается в получении стабильных штаммов, то есть штаммов, обладающих стабильными культуральными и морфологическими свойствами, и в результате генной модификации обладающих способностью продуцировать рекомбинантный интерналин 321.
Штамм E. coli BL21, содержащий плазмиду pET28b-inlBallele13 (Последовательность №2), pET28b-inlBallele14 (Последовательность №3) или pET28b-inlBallele9 (Последовательность №4), - продуцент рекомбинантного белка интерналина 321, характеризуется следующими признаками.
Культурально-морфологические признаки. Грамотрицательные прямые палочки с закругленными краями, размером 1.1-1.5×2.0-3.0 мкм, одиночные, спор и капсул не образуют. Колонии на питательном агаре LB гладкие, слабовыпуклые, с ровным краем. В жидких средах образуют равномерную муть. Штамм идентифицирован по Определителю Берги (1974) как штамм вида Escherichia coli.
Физико-биологические признаки. Типичные для Escherichia coli. Каталазоположительные. Оксидазоотрицательные. Факультативные анаэробы. Катаболизируют D-глюкозу, L-арабинозу, D-ксилозу, сахарозу, лактозу, мальтозу, маннит, D-маннозу, L-рамнозу, сорбит, тригаллозу с образованием кислоты (и газа). Не гидролизуют желатину, мочевину, индол (+), триптофандезаминаза (-), лизиндекарбоксилаза (+), рост в присутствии KCN (-), малонат не используют, пигмент не образуют. Реакция «Фогес-Проскауэра» отрицательная. Не образуют H2S. Не растут на цитратной среде «Симмонса».
Условия хранения штамма. Штамм хранится криоконсервированным при -70°С (до 6 месяцев) в 10%-ном растворе глицерина в питательной среде LB (Бакто-триптон - 10 г/л, дрожжевой экстракт - 5 г/л, хлористый натрий - 10 г/л, рН 6.8). Условия размножения штамма: штамм выращивают при 37°С в LB-бульоне. Все среды содержат канамицин в концентрации 100 мкг/мл.
Условия индукции целевого белка.
Индуктор - IPTG.
Основные свойства штамма
Является продуцентом интерналина 321, может быть использован для получения медицинских и ветеринарных препаратов на основе рекомбинантного интерналина 321.
Описание чертежей
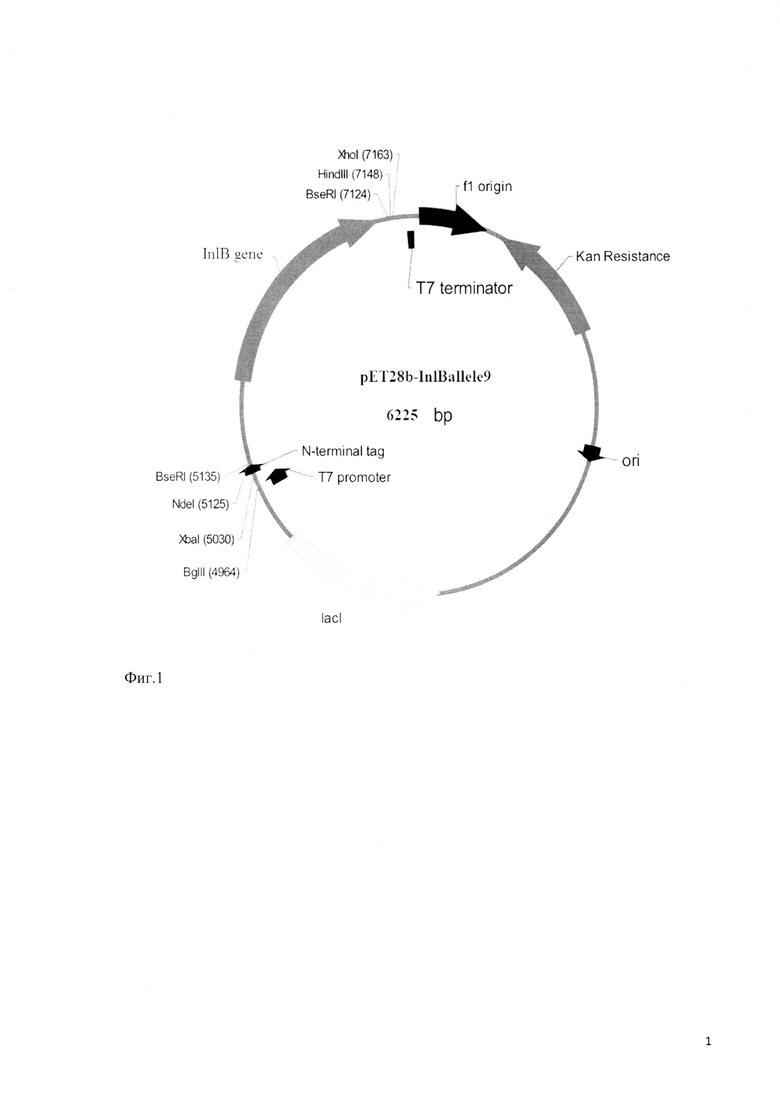
Фиг. 1 - генетическая карта плазмиды pET28b-inlBallele9.
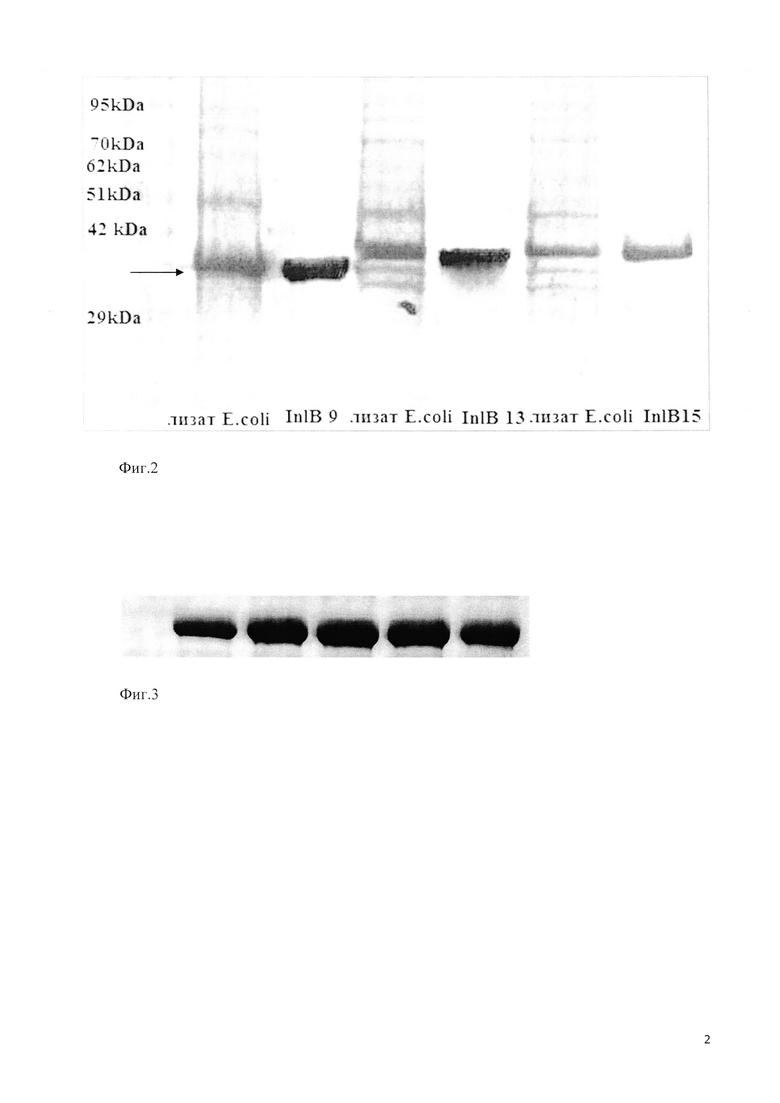
Фиг. 2 показывает результат анализа фракций, собранных после очистки рекомбинантных белков и лизиса бактериальных культур Escherichia coli BL21, содержащих плазмиды pET28b-inlBallele13, pET28b-inlBallele14 или pET28b-inlBallele9. Пропорциональные количества белка из каждой фракции анализировали с помощью ДСН-ПАГЭ в 10%-ном акриламидном геле с последующим окрашиванием геля красителем Coomassie Brilliant Blue (Serva). Для оценки молекулярной массы белков использовали маркер молекулярной массы Unstained Protein Molecular Weight Marker производства (Fermentas), крайняя дорожка слева. Стрелка указывает на положение в геле рекомбинантного белка интерналина 321. Кажущаяся молекулярная масса белка интерналина 321 составляет около 37 кДа и соответствует теоретически рассчитанной (36863 Да).
Фиг. 3 показывает результат анализа стабильности рекомбинантного белка интерналина В в процессе замораживания-оттаивания. Пропорциональные количества белка из каждой фракции анализировали с помощью ДСН-ПАГЭ в 10%-ном акриламидном геле с последующим окрашиванием геля красителем Coomassie Brilliant Blue (Serva). Для оценки молекулярной массы белков использовали маркер молекулярной массы Unstained Protein Molecular Weight Marker производства (Fermentas), крайняя дорожка слева. Стрелка указывает на положение в геле рекомбинантного белка интерналина 321. Белок интерналин 321 выдерживает замораживание при -85°С и последующее оттаивание.
Примеры осуществления настоящего изобретения
Пример 1. Процедура получения штамма бактерий E. coli BL21, продуцирующего рекомбинантный белок интерналина 321
Фрагмент гена inlB, кодирующий интерналиновый домен 321, синтезировали в полимеразной цепной реакции на матрице ДНК, полученной из стационарной культуры листерий [23]. В качестве ДНК матрицы использовались лизаты соответствующих штаммов листерий: VIMHA034 (14 аллель), VIMHA015 (9 аллель) и EGDe(13 аллель) (согласно [22]). В ПЦР использовали праймеры: InlBF 5'-aca-agc-gga-tcc-tat-cac-tgt-gcc-3' и InlBR 5'-tgt-aaa-gct-ttt-tca-gtg-gtt-ggg-3' («Синтол», Россия) с введенными сайтами рестрикции для BamHI и HindIII соответственно. ПЦР-продукты клонировали в вектор pGemT-Easy с помощью набора pGEM®-T Easy Vector Systems («Promega», США). Конструкции pGemT-Easy-InlBallele14, pGemT-Easy-InlBallele9 и pGemT-Easy-InlBallele13 траснформировали в штамм E. coli JM109 с использованием электропоратора GenPulsar Xcell Total System («Bio-Rad») при параметрах 25 μF, 2,5 kV, 200 Ω. Для выделения плазмидной ДНК из рекомбинантных штаммов использовали набор БиоСилика («Biosilica», Россия). Выделенные плазмидные ДНК очищали с помощью Wizard® SV Gel and PCR Clean-Up System («Promega», США). В дальнейшем ПЦР продукты переклонировали в вектор рЕТ28b(+) по сайтам рестрикции BamHI и HindIII, с последующей электропорацией конструкций pET28b-InlBallele14, pET28b-InlBallele13 и pET28b-InlBallele9 в штамм E. coli BL21. Плазмиды, полученные на последнем этапе, кодировали фрагменты интерналинового домена 321 слитые с 6 остатками гистидина (His-tag) на аминоконце белка.
Пример 2. Получение рекомбинантной плазмиды pET28b-inlBallele
В плазмиду рЕТ28b встраивали inlBallele13, inlBallele 14 или inlBallele9, содержащие последовательность областей, кодирующих интерналин 321, что обеспечивало экспрессию рекомбинантного белка интерналин 321 за счет эффективной транскрипции мРНК рекомбинантного гена; нетранслируемую область терминации транскрипции бактериального оперона, обеспечивающую эффективное окончание транскрипции; промотор РНК-полимеразы Т7, обеспечивающий индуцируемую экспрессию генов в клетках Е. coli; ген устойчивости к канамицину, обладающий сайтами узнавания для рестриктаз и содержащий последовательность, кодирующую His-tag; бактериальный участок инициации репликации типа ColE1, обеспечивающий репликацию плазмиды в штаммах E. coli.
Пример 3. Процедура получения рекомбинантного белка интерналина 321 в бактериальной системе экспрессии
Экспрессия полученной конструкции проходила под контролем встроенного в вектор фагового промотора. На всех этапах создания генных конструкций нуклеотидные последовательности анализировали методом секвенирования. Штаммы-продуценты рекомбинантного белка интерналина В высевали штрихом на чашку Петри с LB агаром, содержащую селективный антибиотик канамицин в концентрации 100 мкг/мл, и растили в течение 16-18 часов при температуре 37°С. С чашки Петри брали единичную колонию бактерий, инокулировали 1 мл жидкой среды LB, содержащей 100 мкг/мл канамицина, и растили при постоянном перемешивании и температуре 37°С в течение 16-18 часов. По 500 мкл ночной культуры штамма-продуцента переносили стерильной пипеткой в две 500-миллилитровые колбы, содержащие 50 мл жидкой среды LB, и растили при постоянном перемешивании и температуре 37°С в течение 3 часов, после чего индуцировали экспрессию рекомбинантного белка путем добавления изопропил-β-D-тиогалактозида (Fermentas) до конечной концентрации 0,02 мМ и бактерии растили при температуре 37°С в течение 3 часов. Клетки осаждали центрифугированием при 4200 об/мин и температуре 4°С в течение 15 минут, супернатант удаляли, а осадок промывали с использованием 20 мл фосфатно-солевого буфера (0,01 М фосфат натрия, 0,138 М NaCl, 0,0027 М КСl, рН 7,4), предварительно охлажденного до 4°С, и затем клетки осаждали центрифугированием при 4200 об/мин и температуре 4°С в течение 15 минут. Супернатант удаляли, а осадок клеток ресуспендировали в 1 мл буфера (0,01 М фосфат натрия, 0,138 М NaCl, 0,0027 М КСl, рН 7,4) и добавляли кристаллический лизоцим (Sigma) до конечной концентрации 10 мкг/мл. Далее суспензию бактериальных клеток гомогенизировали при помощи прибора SuperFastPrep. После чего проводилась очистка белка с использованием коммерческого набора Dynabeads® His-Tag Isolation and Pulldown, основанного на антителах, конъюгированных с магнитными наночастицами. Для удаления стабилизирующего буфера от наночастиц хорошо ресуспендированные частицы Dynabeads объемом 50 мкл помещали в микроцентрифужную пробирку, расположенную на магните. После осаждения частиц супернатант сливали, в пробирку добавляли полученный лизат, приготовленный в объеме 700 мкл фосфатно-солевого буфера (0,01 М фосфат натрия, 0,138 М NaCl, 0,0027 М КСl, рН 7,4), и инкубировали при постоянном перемешивании 10 минут. Пробирку помещали на магнит и после осаждения частиц, нагруженных белком, супернатант сливали. Для исключения неспецифического связывания проводили процедуру отмывки, добавляя 300 мкл Binding Wash Buffer (50 мМ фосфатного буфера, рН 8.0, 300 мМ NaCl, 0,01% Tween-20) к наночастицам, нагруженным рекомбинантным белком, хорошо ресуспендировали и после осаждения частиц, нагруженных рекомбинантным белком, супернатант сливали. Процедуру отмывки повторяли 4 раза. После промывания добавляли 100 мкл His-Elution Buffer (300 мМ имидазол, 50 мМ фосфатный буфер, рН 8.0, 300 мМ NaCl 0,01% Tween-20) и инкубировали при постоянном перемешивании 10 минут. После осаждения частиц на магните супернатант, содержащий белок, собирали в новую пробирку. Элюированный рекомбинантный белок замораживали и хранили при -80°С в аликвотах.
Пример 4. Процедура определения концентрации рекомбинантного белка интерналина 321 по Лоури и Бредфорду
Концентрацию рекомбинантного белка интерналина 321 определяли методом Лоури и Брэлфорда, используя набор Protein Assay Dye Reagent Concentrate. Для этого разводили красящий реагент в 5 раз дистиллированной водой. Готовили 5 разведений BSA в концентрации от 0,2 до 3 мг/мл. Смешивали 100 мкл каждого стандарта с 5 мл разведенного красящего реагента. Инкубировали смесь при комнатной температуре 5 мин, измеряли оптическую плотность при длине волне 595 нм с помощью бескюветного спектрофотометра «NanoVue Plus».
Основные характеристики клеток (по данным паспорта штамма):
1. Родовое и видовое название штамма-хозяина (реципиента) - Escherichia coli.
2. Номер или наименование штаммов: Escherichia coli BL21[pET28b-InlBallele14], Escherichia coli [pET28b-InlBallele13] и Escherichia coli [pET28b-InlBallele9].
3. Способ получения штамма: получен трансформацией.
4. Продукт, синтезируемый штаммами, интерналин 321.
5. Активность (продуктивность) штамма: 4 мкг очищенного рекомбинантного белка на 1 мл ростовой среды по данным.
6. Способ, условия и состав сред для длительного хранения штамма: среда LB+10% глицерина в ампулах при -80°С.
7. Способ, условия и состав сред для размножения штамма: среда LB, содержащая 100 мкг/мл канамицина.
8. Группа уровня риска штамма: I.
9. Генетические особенности штамма:
а. Генотип штамма хозяина (мутации, делеции, инверсии, наличие плазмид или профагов, устойчивость (чувствительность) к антибиотикам, фагам и т.д., прочие генетические особенности):
[F-, ompT, hsdSB (r-B, m-B), dcm, gal].
б. Описание рекомбинантной плазмиды:
Название плазмид: pET28b-InlBallele14, pET28b-InlBallele13 и pET28b-InlBallele9.
Размер плазмиды: 6225 пар нуклеотидов.
в. Сведения о векторе, на основе которого сконструирована плазмида:
Название вектора: рЕТ28b.
Размер вектора: 5368 п. н.
Полная нуклеотидная последовательность вектора рЕТ28b: Последовательность №1
Происхождение вектора и его основных генетических элементов:
вектор содержит:
- ген устойчивости к канамицину;
- промотор РНК-полимеразы Т7;
- бактериальный участок инициации репликации типа ColE1, обеспечивающий репликацию плазмиды в штаммах E. coli;
- содержит последовательность, кодирующую His-tag.
г. Сведения о клонированной ДНК:
Видовая принадлежность донорного организма: Listeria monocytogenes.
Размер клонированного фрагмента и включенные в его состав гены: 961 п. н.
Литература
1. Organ S.L., Tsao M.-S. An overview of the c-HGPR signaling pathway // Ther. Adv. Med. Oncol. 2011. Vol.3. P. 7-19.
2. Trusolino L., Bertotti A., Comoglio P.M. HGPR signalling: principles and functions in development, organ regeneration and cancer // Nat. Rev. Mol. Cell Biol. Nature Publishing Group, 2010. Vol.11, №12. P. 834-848.
3. TG, de Oliveira AG, Tobar N, Saad MJ, Moreira LR, Reis ER, Nicola EM, de Jorge GL, dos
TG, de Oliveira AG, Tobar N, Saad MJ, Moreira LR, Reis ER, Nicola EM, de Jorge GL, dos  RR, Boin IF, Teixeira AR. Liver regeneration followingpartial hepatectomy is improved by enhancing the HGF/Met axis and Akt and Erk pathways after low-power laser irradiation in rats. Lasers Med Sci. 2013 28:1511-1517.
RR, Boin IF, Teixeira AR. Liver regeneration followingpartial hepatectomy is improved by enhancing the HGF/Met axis and Akt and Erk pathways after low-power laser irradiation in rats. Lasers Med Sci. 2013 28:1511-1517.
4. Li JF, Duan HF, Wu CT, Zhang DJ, Deng Y, Yin HL, Han B, Gong HC, Wang HW, Wang YL. HGF accelerates wound healing by promoting the dedifferentiation of epidermal cells through β1-integrin/ILK pathway. Biomed Res Int. 2013; 2013:470418. doi: 10.1155/2013/470418.
5. Zhu H., Naujokas M. a, Park M. Receptor chimeras indicate that the HGPR tyrosine kinase mediates the motility and morphogenic responses of hepatocyte growth/scatter factor. // Cell Growth Differ. 1994. Vol. 5, №4. P. 359-366.
6. Bladt F. et al. Essential role for the c-HGPR receptor in the migration of myogenic precursor cells into the limb bud // Nature. Nature Publishing Group, 1995. P. 768-771.
7. Schmidt C. et al. Scatter factor/hepatocyte growth factor is essential for liver development. //Nature. 1995. Vol. 373, №6516. P. 699-702.
8. Alberts B. et al. Essential Cell Biology. 2009. 731 p.
9. Rodrigues G.A., Park M. Autophosphorylation modulates the kinase activity and oncogenic potential of the HGPR receptor tyrosine kinase // Oncogene. 1994. Vol. 9, №7. P. 2019-2027.
10. Dramsi S. et al. Entry of Listeria monocytogenes into hepatocytes requires expression of InIB, a surface protein of the internalin multigene family // Mol. Microbiol. 1995. Vol. 16, №2. P. 251-261.
11. Gaillard J.L. The inlAB locus mediates the entry of Listeria monocytogenes into hepatocytes in vivo // J. Exp. Med. 1996. Vol. 183, №2. P. 359-369.
12. Ebbes M. et al. Fold and function of the InlB B-repeat // J. Biol. Chem. 2011. Vol. 286. P. 15496-15506.
13. Shen Y. et al. InIB-dependent internalization of Listeria is mediated by the HGPR receptor tyrosine kinase // Cell. 2000. Vol. 103, №3. P. 501-510.
14. Niemann H.H. et al. Structure of the Human Receptor Tyrosine Kinase HGPR in Complex with the Listeria Invasion Protein InlB // Cell. 2007. Vol. 130, №2. P. 235-246.
15. Bierne H., Cossart P. InlB, a surface protein of Listeria monocytogenes that behaves as an invasin and a growth factor // J. Cell Sci. 2002. Vol. 115. P. 3357-3367.
16. Jonquieres R., Pizarro-Cerda J., Cossart P. Synergy between the N- and C-terminal domains of InlB for efficient invasion of non-phagocytic cells by Listeria monocytogenes // Mol. Microbiol. 2001. Vol. 42, №4. P. 955-965.
17. Pizarro-cerda J., Ku A. Entry of Listeria monocytogenes in Mammalian // Cold Spring Harb. Perspect. Med. 2012. Vol. 2, №11. P. 1-18.
18. Ferraris D.M. et al. Ligand-Mediated Dimerization of the HGPR Receptor Tyrosine Kinase by the Bacterial Invasion Protein InlB // J. Mol. Biol. Elsevier Ltd, 2010. Vol. 395, №3. P. 522-532.
19. Mansell A. et al. Internalin В Activates Nuclear Factor-??B via Ras, Phosphoinositide 3-Kinase, and Akt // J. Biol. Chem. 2001. Vol. 276, №5. P. 43597-43603.
20. Mungunsukh O. et al. A tandem repeat of a fragment of Listeria monocytogenes internalin В protein induces cell survival and proliferation // Am J Physiol Lung Cell Mol Physiol. 2010. Vol. 299, №58. P. L905-L914.
21. Voronina Olga L ⋅ Ryzhova Natalia N ⋅ Kunda Marina S ⋅ Kurnaeva Margarita A ⋅ Semenov Audrey N ⋅Aksenova Ekaterina I ⋅ Egorova Irina Yu ⋅ Kolbasov Denis V ⋅ Ermolaeva Svetlana A ⋅ Gintsburg Alexander L Diversity and Pathogenic Potential of Listeria monocytogenes Isolated from Environmental Sources in the Russian Federation Int J Mod Emg Res 2015, 5:5-13.
22. Adgamov R, Zaytseva E, Thiberge J-M, Brisse S, Ermolaeva S. Genetically related Listeria monocytogenes strains isolated from lethal human cases and wild animals. In Genetic Diversity of Microorganisms. Caliskan M (Ed). 2012, Part 2, 235-250, ISBN 978-953-51-0064-5. InTech, Croatia.
23. Карпова Т.И., Фирсова. Типирование Listeria monocytogenes на основе полиморфизма генов факторов патогенности Typing of Listeria monocytogenes on the Basis of Polymorphism of Genes // Клиническая микробиология и антимикробная химиотерапия. 2003. Vol. 5, №3. Р. 251-258.
| название | год | авторы | номер документа |
|---|---|---|---|
| Рекомбинантный интерналин В 321, полученный с помощью штамма Escherichia coli | 2018 |
|
RU2688422C1 |
| Способ дифференциации вирулентных штаммов Listeria monocytogenes от авирулентных штаммов с использованием поликлональных антител против факторов патогенности интерналина А (InlA) и интерналина В (InlB). | 2023 |
|
RU2808590C1 |
| Способ дифференциации Listeria monocytogenes от других видов Listeria spp. методом дот-блоттинга с использованием конъюгированных антител против фактора патогенности InlB | 2023 |
|
RU2812147C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК РЕТ3.54, КОДИРУЮЩАЯ ПОЛИПЕПТИД FN3.54, ВЗАИМОДЕЙСТВУЮЩИЙ С ФАКТОРОМ НЕКРОЗА ОПУХОЛЕЙ ЧЕЛОВЕКА, И ШТАММ БАКТЕРИЙ ESCHERICHIA COLI - ПРОДУЦЕНТ ПОЛИПЕПТИДА FN3.54, ВЗАИМОДЕЙСТВУЮЩЕГО С ФАКТОРОМ НЕКРОЗА ОПУХОЛЕЙ ЧЕЛОВЕКА | 2013 |
|
RU2531547C1 |
| Рекомбинантная плазмида pET21-TF7, обеспечивающая синтез модифицированного тканевого фактора, и штамм Escherichia coli BL21(DE3) pET21-TF7 - продуцент рекомбинантного тканевого фактора человека | 2020 |
|
RU2744592C1 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК L-HEP, ШТАММ ESCHERICHIA COLI ПРОДУЦЕНТ УКАЗАННОГО БЕЛКА И СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО БЕЛКА | 2019 |
|
RU2716975C1 |
| ПОЛИПЕПТИД С АНТИ-SARS-CoV-2 АКТИВНОСТЬЮ И ПРОЛОНГИРОВАННЫМ ВРЕМЕНЕМ ЦИРКУЛЯЦИИ В КРОВОТОКЕ | 2023 |
|
RU2822355C1 |
| ЛИТИЧЕСКАЯ ПРОТЕАЗА AlpA БАКТЕРИИ LYSOBACTER SP. XL1, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ЛИТИЧЕСКУЮ ПРОТЕАЗУ AlpA БАКТЕРИИ LYSOBACTER SP. XL1, И СПОСОБ ПОЛУЧЕНИЯ ЛИТИЧЕСКОЙ ПРОТЕАЗЫ AlpA БАКТЕРИИ LYSOBACTER SP. XL1 | 2009 |
|
RU2407782C2 |
| РЕКОМБИНАНТНАЯ ДНК, КОДИРУЮЩАЯ ФУНКЦИОНАЛЬНО АКТИВНЫЙ ГИБРИДНЫЙ БЕЛОК G17ACA-АЦИЛАЗЫ С ХИТИН-СВЯЗЫВАЮЩИМ ДОМЕНОМ (BrdG17ACA-cbd), РЕКОМБИНАНТНАЯ ПЛАЗМИДА pSVH0108, ОБЕСПЕЧИВАЮЩАЯ ЕГО СИНТЕЗ В КЛЕТКАХ Escherichia coli, И РЕКОМБИНАНТНЫЙ ШТАММ Escherichia coli BL21(DE3)/pSVH0108-ПРОДУЦЕНТ BrdG17ACA-cbd | 2006 |
|
RU2388826C2 |
| ЛИТИЧЕСКАЯ ПРОТЕАЗА AlpB БАКТЕРИИ Lysobacter sp. XLI, ФРАГМЕНТ ДНК, КОДИРУЮЩИЙ ЛИТИЧЕСКУЮ ПРОТЕАЗУ AlpB БАКТЕРИИ Lysobacter sp. XLI, И СПОСОБ ПОЛУЧЕНИЯ ЛИТИЧЕСКОЙ ПРОТЕАЗЫ AlpB БАКТЕРИИ Lysobacter sp. XLI | 2009 |
|
RU2408725C2 |







Изобретение относится к биотехнологии. Изобретение относится к получению новых штаммов Е. coli BL21 pET28b-inlBallele13, pET28b-inlBallele14, pET28b-inlBallele9, полученных трансформацией штамма Escherichia coli BL21 плазмидой BL21-inlBallele13, pET28b-inlBallele14 или pET28b-inlBallele9, - продуцентов рекомбинантного белка интерналин 321. Изобретение также относится к получению интерналина 321 с помощью указанных штаммов. Наработанный указанными штаммами интерналин В может применяться во многих сферах биологических и медицинских исследований, в частности при создании и изучении лекарственных средств-агонистов природных эукариотических рецепторов для регенерации мягких тканей и моделирования инфекционного процесса. 6 н.п. ф-лы, 3 ил., 4 пр.
1. Рекомбинантный белок интерналин 321 с последовательностью №5, №6 или №7.
2. Рекомбинантная плазмида pET28b-inlBallele, где inlBallele представляет собой inlBallele13, inlBallele 14 или inlBallele9, обеспечивающая экспрессию рекомбинантного белка интерналин 321 по п. 1, содержащая последовательность, кодирующую интерналин 321; нетранслируемую область терминации транскрипции бактериального оперона; промотор РНК-полимеразы Т7; ген устойчивости к канамицину; бактериальный участок инициации репликации типа ColEl.
3. Штамм Escherichia coli BL21 pET28b-inlBallele13, полученный трансформацией штамма Escherichia coli BL21 плазмидой pET28b-inlBallele13, - продуцент рекомбинантного белка интерналин 321 по п. 1.
4. Штамм Escherichia coli BL21 pET28b-inlBallele14, полученный трансформацией штамма Escherichia coli BL21 плазмидой pET28b-inlBallele14, - продуцент рекомбинантного белка интерналин 321 по п. 1.
5. Штамм Escherichia coli BL21 pET28b-inlBallele9, полученный трансформацией штамма Escherichia coli BL21 плазмидой pET28b-inlBallele9, - продуцент рекомбинантного белка интерналин 321 по п. 1.
6. Способ получения рекомбинантного белка интерналин 321 по п. 1, включающий выращивание клеток штамма Escherichia coli BL21[pET28b-inlBallele13], Escherichia coli BL21[pET28b-inlBallele14] или Escherichia coli BL21[pET28b-inlBallele9], индукцию синтеза белка интерналина 321, разрушение клеток, получение супернатанта, содержащего белок, очистку рекомбинантного белка с использованием коммерческого набора, основанного на антителах к гистидиновым повторам, конъюгированных с магнитными наночастицами.
Авторы
Даты
2017-10-26—Публикация
2017-05-05—Подача