Изобретение относится к области органической химии, а именно к способам получения функционально замещенных конденсированных гетероциклических молекул, содержащих иминолактонный фрагмент и три цианогруппы - 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1), которые могут быть использованы в тонком органическом синтезе, а также в качестве биологически активных соединений.
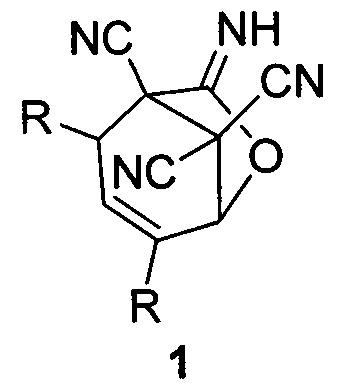
где R=СН3 (1a); R=С2Н5 (1б); R=С3Н7 (1в); R=С4Н9 (1г).
Известен способ получения структурного аналога соединений (1), а именно 4-ацетил-7-имино-2,2,5-триметил-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрила (2), заключающийся во взаимодействии в бензоле тетрацианоэтилена с енолизированным аддуктом конденсации изомасляного альдегида и ацетилацетона (С.П. Зильберг, О.Е. Насакин, П.М. Лукин, В.Л. Турханов, О.А. Дьяченко // Журнал органической химии. - 1988. - Т. 24. - Вып. 5. - С. 1014-1023).
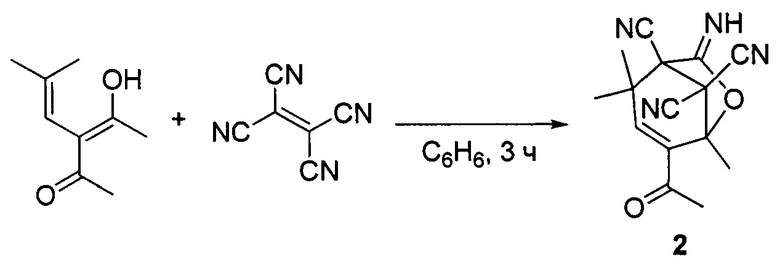
В литературе описан единственный способ получения 2,4-диалкил-7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1), а именно (1а), где R=СН3; (1б), где R=C2H5; (1в), где R=С3Н7, который является наиболее близким к заявленному решению и заключается в длительном выдерживании смеси тетрацианоэтилена, двукратного мольного избытка α,β-непредельного альдегида и нескольких капель концентрированной хлороводородной кислоты в 1,4-диоксане с последующим разбавлением реакционной массы водой и фильтрованием продукта. Выходы 50-72% (О.V. Ershov, А.V. Eremkin, Ya.S. Kajukov, О.E. Nasakin, V.A. Tafeenko, E.V. Nurieva // Tetrahedron Letters. - 2007. - Vol. 48. - №15. - P. 2803-2806).
Недостатками данного способа являются использование токсичного растворителя 1,4-диоксана (третий класс опасности в соответствии с ГОСТ 12.1.007-76), большой расход α,β-непредельных альдегидов, длительность осуществления синтеза, а также умеренные выходы получаемых продуктов.
Задачей данного изобретения является разработка усовершенствованного способа получения функционально замещенных конденсированных гетероциклических молекул, содержащих иминолактонный фрагмент и три цианогруппы - 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1).
Техническим результатом является усовершенствование способа получения 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1), значительное сокращение времени осуществления синтеза, повышение выходов получаемых продуктов и экологичности используемой процедуры.
Технический результат достигается тем, что получение 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1)
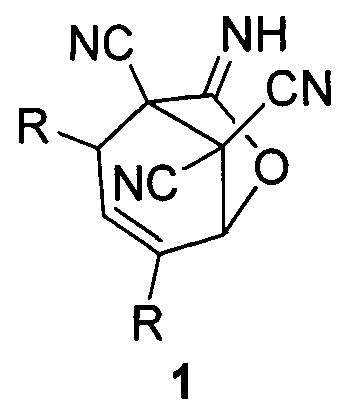
заключается в нагревании раствора тетрацианоэтилена и соответствующего α,β-непредельного альдегида в эквимолярных количествах в этилацетате при 50-55°С в присутствии каталитического количества бромисто-водородной кислоты. По окончании реакции растворитель упаривают, остаток растирают в охлажденном пропан-2-оле, образующийся осадок отфильтровывают.
Способ осуществляется по следующей схеме реакции:
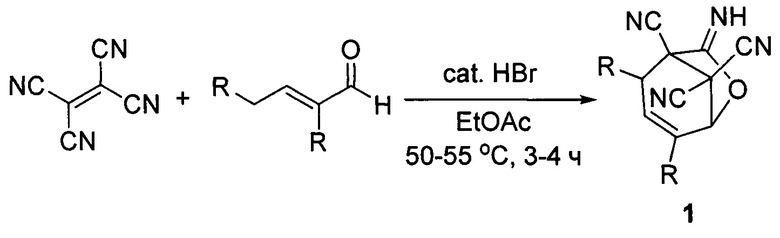
где R=СН3 (1a); R=С2Н5 (1б); R=С3Н7 (1в); R=С4Н9 (1г).
Сопоставительный анализ заявляемого решения с известным показывает, что предлагаемый способ является более эффективным, так как позволяет получать необходимые соединения (1) с более высокими выходами за меньший промежуток времени, что обусловлено применением более эффективного катализатора - –бромисто-водородной кислоты, а также более экологичным, так как не предусматривает использования токсичных растворителей. Метод характеризуется простотой исполнения и отсутствием специального оборудования. Ряд синтезированных соединений (1а-г) с различными заместителями демонстрирует универсальность заявляемого решения.
Используемые реагенты и растворители, а именно тетрацианоэтилен, бромисто-водородная кислота, этилацетат и пропан-2-ол, являются коммерчески доступными. α,β-Непредельные альдегиды могут быть легко получены с высокими выходами на основе реакции альдольно-кротоновой конденсации (В.А. Смит, А.Д. Дильман // Основы современного органического синтеза. - М.: Бином. Лаборатория знаний, 2009. - С. 203-232).
Строение полученных соединений подтверждается данными ИК- и ЯМР 1Н-спектроскопии, масс-спектрометрии.
Сущность изобретения заключается в описанном способе получения 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1):
0,001 моль (0,128 г) тетрацианоэтилена смешивают с 0,001 моль соответствующего α,β-непредельного альдегида в 2 мл этил ацетата, добавляют 2 капли концентрированной бромисто-водородной кислоты. Реакционную массу нагревают при 50-55°С на водяной бане при постоянном перемешивании. Полноту протекания реакции проверяют по отсутствию синего окрашивания гидрохинона (π-комплекс с тетрацианоэтиленом) под действием пробы реакционной массы. После завершения взаимодействия и охлаждения реакционной массы растворитель упаривают, смолообразный остаток растирают в охлажденном пропан-2-оле, образующийся осадок отфильтровывают, промывая на фильтре охлажденным пропан-2-олом.
Пример 1. Способ получения 7-имино-2,4-диметил-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрила (1а). Получали аналогично описанному способу с использованием в качестве α,β-непредельного альдегида 2-метилпент-2-еналя. Выход: 85%. Тпл=99-100°С. ИК-спектр, ν, см-1: 3305 (N-H); 2265 (C≡N); 1690 (C=N). Спектр ЯМР 1Н (DMSO-d6), δ, м.д. (J, Гц): 1.25 (3Н, д, J=6.8, СН3СН), 1.85 (3Н, с, СН3), 3.36 (1H, м, СН), 5.62 (1H, с, ОСН), 5.78 (1Н, с, =СН), 9.64 (1H, с, =NH). Масс-спектр EI, m/z (Iотн, %): 226 (2.3).
Пример 2. Способ получения 7-имино-2,4-диэтил-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрила (1б). Получали аналогично описанному способу с использованием в качестве α,β-непредельного альдегида 2-этилгекс-2-еналя. Выход: 91%. Тпл=124-125°С. ИК-спектр, ν, см-1: 3275 (N-H); 2263 (C≡N); 1691 (С=O). Спектр ЯМР 1H (DMSO-d6), δ, м.д. (J, Гц): 1.01 (3Н, т, J=7.9, СН3СН2), 1.12 (3Н, т, J=7.3, СН3СН2), 1.42 (1Н, м, СН2), 1.77 (1Н, м, CH2), 2.18 (2Н, к, J=7.3, СН3СН2), 3.13 (1Н, м, СН), 5.68 (1Н, с, ОСН), 5.90 (1Н, с, =СН), 9.71 (1Н, с, =NH). Масс-спектр EI, m/z (Iотн, %): 254 (2.7).
Пример 3. Способ получения 7-имино-2,4-дипропил-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрила (1в). Получали аналогично описанному способу с использованием в качестве α,β-непредельного альдегида 2-пропилгепт-2-еналя. Выход: 89%. Тпл=106-107°С. ИК-спектр, ν, см-1: 3290 (N-H); 2267 (С≡N); 1659 (С=O). Спектр ЯМР 1H (DMSO-d6), δ, м.д. (J, Гц): 0.86 (3Н, т, J=7.3, СН3СН2), 0.93 (3Н, т, J=7.3, СН3СН2), 1.33-1.77 (6Н, м, 3СН2), 2.12 (2Н, т, J=7.3, СН2), 3.17 (1Н, дд, J=5.9, 2.4, СН), 5.67 (1Н, с, ОСН), 5.90 (1Н, с, =СН), 9.72 (1Н, с, =NH). Масс-спектр EI, m/z (Iотн, %): 282 (2.7).
Пример 4. Способ получения 7-имино-2,4-дибутил-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрила (1г). Получали аналогично описанному способу с использованием в качестве α,β-непредельного альдегида 2-бутилокт-2-еналя. Выход: 83%. Тпл=79-80°С. ИК-спектр, ν, см-1: 3276 (N-H); 2256 (C≡N); 1714 (C=N). Спектр ЯМР 1Н (DMSO-d6), δ, м.д. (J, Гц): 0.86-0.92 (6Н, м, 2СН3); 1.21-1.60 (9Н, м, 5СН2); 1.67-1.75 (1Н, м, СН2); 2.14 (2Н, т, J=7.4, СН2С=С); 3.11-3.16 (1H, м, СН); 5.67 (1H, с, СНО); 5.89 (1Н, с, С=СН); 9.67 (1Н, с, NH). Масс-спектр EI, m/z (Iотн, %): 310 [М]+ (1.5), 41 (100).
Таким образом, предлагаемый усовершенствованный способ позволяет получить функционально замещенные конденсированные гетероциклические молекулы, содержащие иминолактонный фрагмент и три цианогруппы - 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1), которые могут быть использованы в тонком органическом синтезе, а также в качестве биологически активных соединений.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения 2-ацил(ароил)-7-имино-6-оксабицикло[3.2.1]октан-1,8,8-трикарбонитрилов | 2017 |
|
RU2657250C1 |
| СПОСОБ ПОЛУЧЕНИЯ 6-ИМИНО-2,7-ДИОКСАБИЦИКЛО[3.2.1]ОКТАН-4,4,5-ТРИКАРБОНИТРИЛОВ | 2014 |
|
RU2545459C1 |
| Способ получения замещенных 2-аминобута-1,3-диен-1,1,3-трикарбонитрилов | 2022 |
|
RU2792619C1 |
| СПОСОБ ПОЛУЧЕНИЯ (+)- И (-)-3-ОКСАБИЦИКЛО[3.3.0]ОКТ-6-ЕН-2-ОНОВ | 2008 |
|
RU2381221C2 |
| Способ получения производных фуро[3,4-c]пиридин-1(3H)-онов | 2018 |
|
RU2680017C1 |
| Способ получения производных фуро[3,4-с]пиридин-1(3Н)-онов | 2020 |
|
RU2738707C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЭТИЛ(2Е, 4Е)-5-ХЛОРПЕНТА-2,4-ДИЕНОАТА | 2016 |
|
RU2629665C1 |
| 1-имино-2,3,4,5-тетрагидро-1Н-пирроло[3,4-с]пиридин-3,4-дионов | 2016 |
|
RU2613967C1 |
| СПОСОБ ПОЛУЧЕНИЯ МЕТИЛ 3-АЦИЛ-4-ЦИАНО-5-(ДИЦИАНОМЕТИЛЕН)-2-ГИДРОКСИ-2,5-ДИГИДРО-1H-ПИРРОЛ-2-КАРБОКСИЛАТОВ | 2018 |
|
RU2700928C2 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 2-ОКСО-1,2-ДИГИДРОПИРИДИН-3,4-ДИКАРБОНИТРИЛОВ | 2015 |
|
RU2577526C1 |
Изобретение относится к области органической химии, а именно к способу получения функционально замещенных конденсированных гетероциклических молекул, содержащих иминолактонный фрагмент и три цианогруппы - 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1), где R=СН3 (1a); R=С2Н5 (1б); R=С3Н7 (1в); R=С4Н9 (1г), заключающемуся в том, что раствор тетрацианоэтилена и соответствующего α,β-непредельного альдегида в эквимолярных количествах нагревают в этилацетате при температуре 50-55°С в присутствии каталитического количества бромисто-водородной кислоты, по окончании реакции растворитель упаривают, остаток растирают в охлажденном пропан-2-оле, образующийся осадок отфильтровывают. Технический результат - повышение выхода до 83-91% и использование более экологичного растворителя. Полученные соединения могут быть использованы в тонком органическом синтезе, а также в качестве биологически активных соединений. 4 пр.
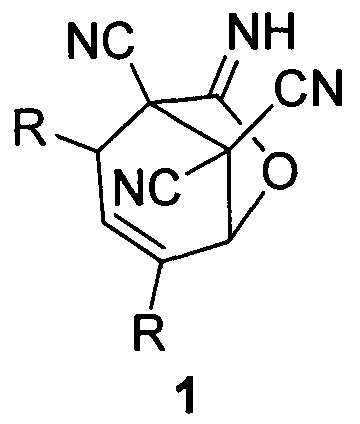
Способ получения 7-имино-6-оксабицикло[3.2.1]окт-3-ен-1,8,8-трикарбонитрилов общей формулы (1)
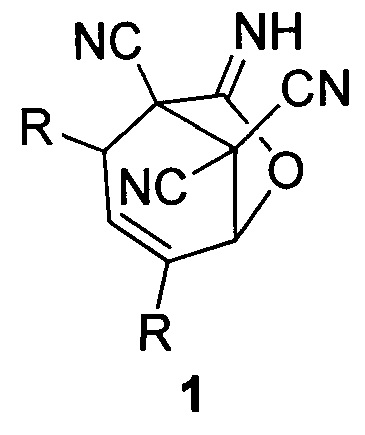
где R=СН3 (1a); R=С2Н5 (1б); R=С3Н7 (1в); R=С4Н9 (1г),
включающий нагревание раствора тетрацианоэтилена и соответствующего α,β-непредельного альдегида в эквимолярных количествах в этилацетате при 50-55°С в присутствии каталитического количества бромисто-водородной кислоты, по окончании реакции растворитель упаривают, остаток растирают в охлажденном пропан-2-оле, образующийся осадок отфильтровывают.
| O.V.Ershov et al | |||
| " Interaction of tetracyanoethylene witth a,b-unsaturated aldehydes.Synthesis of 2,4-dialkyl-7-imino-6-oxabicyclo-[3.2.1]oct-3-ene-1,8,8-tricarbonitriles", Tetrahedron Letters, 2007, v.48, no.15, p.2803-2806 | |||
| C.П.Зильберг et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Огнеупорная масса | 1982 |
|
SU1081150A1 |
Авторы
Даты
2017-12-08—Публикация
2017-03-14—Подача