Изобретение относится к области органической химии, а именно к области получения производных фуро[3,4-с]пиридинонов, конкретно, 2-галогенозамещенных фуро[3,4-с]пиридин-3(1H)-онов общей формулой (1)
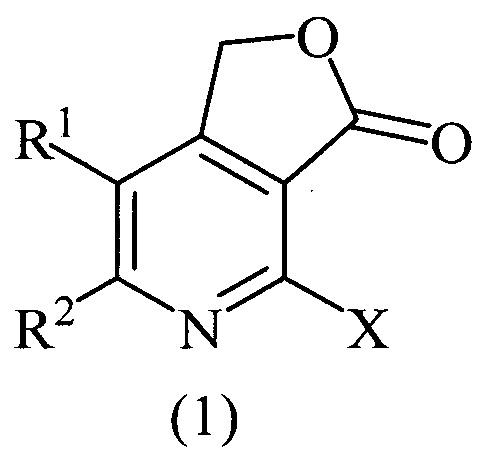
где X=Cl, R1=R2=СН3; X=Cl, R1=R2=С6Н5; X=Cl, R1+R2=(СН2)4; X=Br, R1=R2=СН3, которые могут найти применение в качестве веществ, используемых в потенциальном лечении или профилактике аутоиммунных и воспалительных заболеваний, неврологических и психиатрических расстройств, в которые вовлечены рецепторы орексинов.
Известен способ получения фуро[3,4-с]пиридин-3(1H)-она, заключающийся во взаимодействии 2-алкокси-3-хлоризоникотинонитрила с винилтрифторборатом калия, с последующим окислением получившегося 2-алкокси-3-винилизоникотинонитрила тетраоксидом осмия и преиодадом натрия, и дальнейшей восстановительной гетероциклизации борогидридом натрия с получением конечного продукта [WO 2015095442 A61K 31/445 Piperidinyloxy lactone orexin receptor antagonists]. В этой же работе предлагается получение фуро[3,4-с]пиридин-3(1H)-она реакцией метил 2-алкокси-3-бромизоникотината с трибутилвинилстанатом с получением метил 2-алкокси-3-винилизоникотината с последующим его окислением озоном до метил 2-алкоси-3-формилизоникотината и восстановительной гетероциклизацией в фуранон. Основными недостатками данных способов является использование труднодоступных реагентов, а также многостадийность и трудоемкость процессов.
Авторы [Lena G., Trapani J.A., Sutton V.R., Ciccone A., Browne K.A., Smyth M.J., Denny W.A., Spicer J.A. Dihydrofuro[3,4-c]pyridinones as Inhibitors of the Cytolytic Effects of the Pore-Forming Glycoprotein Perforin / Journal of Medicinal Chemistry, 2008, 51, 7614-7624] описывают способ получения 6-метил-4-хлорфуро[3,4-с]пиридин-3(1H)-она, заключающийся во взаимодействии 1-этоксипентан-2,4-диона с 2-цианоацетамидом с дальнейшим гидролизом и гетероциклизацией этоксиметильной и карбонитрильной функций образующегося 6-метил-2-оксо-4-(этоксиметил)-1,2-дигидропиридин-3-карбонитрила концентрированной соляной кислотой при температуре 120°С. Недостатком данного способа является отсутствие возможности введения заместителей в 5-ое положение пиридинового цикла.
Известен способ получения 4-хлорфуро[3,4-с]пиридин-3(1H)-она и его 5-метил- и 5-фенилзамещенных производных взаимодействием 4,6-дихлорпиримидин-5-карбонил хлорида с соответствующим пропаргиловым спиртом и дальнейшим микроволновым внутримолекулярным гетероциклоприсоединеним Дильса-Альдера промежуточно полученных алк-2-ин-1-ил 4,6-дихлорпиримидин-5-карбоксилатов [Shao В. Synthesis of fused bicyclic pyridines with microwave-assisted intramolecular hetero-Diels-Alder cycloaddition of acetylenic pyrimidines / Tetrahedron Letters, 2005, 46, 3423-3427; WO2005056524 A61K 31/4355; A61K 31/436; A61K 31/437; C07D 471/04; C07D 491/04 Therapeutic agents useful for treating pain]. Недостатком данного способа является отсутствие возможности введения заместителей в 6-ое положение пиридинового цикла.
Авторы [Не S., Mason R.P., Hunjan S., Mehta V.D., Arora V., Katipally R., Kulkarni P.V., Antich P.P. Development of novel l9F NMR pH indicators: synthesis and evaluation of a series of fluorinated vitamin В 6 analogues / Bioorganic and Medicinal Chemistry, 1998, 6, 1631-1639] описывают способ получения 7-гидрокси-6-метил-4-фторфуро[3,4-с]пиридин-3(1H)-она, характеризующийся окислением (2,2,8-триметил-6-фтор-4H-[1,3]диоксино[4,5-с]пиридин-5-ил)метанол оксидом марганца (IV) сначала до 2,2,8-триметил-6-фтор-4H-[1,3]диоксино[4,5-с]пиридин-5-карбальдегида, далее до соответствующей карбоновой кислоты с одновременной ее этерификацией в метаноле с получением метил 2,2,8-триметил-6-фтор-4H-[1,3]диоксино[4,5-с]пиридин-5-карбоксилат, последующий гидролиз и внутримолекулярная гетероциклизация которого приводит к конечному продукту. Основным недостатком данного способа является отсутствие возможности варьирования заместителей в 5-м и 6-м положениях пиридинового цикла.
Наиболее близким к заявляемому является способ получения 4,6-дихлорфуро[3,4-с]пиридин-3(1H)-она взаимодействием 2,6-дигидрокси-4-(метоксиметил)никотинонитрила с оксихлоридом фосфора, с последующим восстановительным гидролизом нитрильной функции образующегося 2,6-дихлор-4-(хлорметил)никотинонитрила диизобутилалюминия гидридом при температуре минус 78°С до 2,6-дихлор-4-(хлорметил)никотинальдегида и окислительным гидролизом хлоритом натрия хлорметильной группы и гетероциклизацией с альдегидной [Panda В., Basak S., Hazra А., Sarkar Т.K. A domino Michael-Dieckmann-Peterson approach to the synthesis of substituted hydroxyquinolines and hydroxyisoquinolines / Journal of Chemical Research, 2010, 34, 109-113]. Недостатком данного способа является наличие стадии, проведение которой необходимо при температуре минус 78°С, и многостадийность процесса.
Задачей данного изобретения является разработка способа получения производных фуро[3,4-с]пиридин-3(1H)-онов, которые могут найти применение в качестве веществ, используемых в потенциальном лечении или профилактике аутоиммунных и воспалительных заболеваний, неврологических и психиатрических расстройств, в которые вовлечены рецепторы орексинов.
Техническим результатом является разработка способа получения ранее неописанных в литературе производных фуро[3,4-с]пиридин-3(1H)-онов с выходом 64-74%.
Технический результат достигается тем, что способ получения производных фуро[3,4-с]пиридин-3(1H)-онов общей формулой (1)
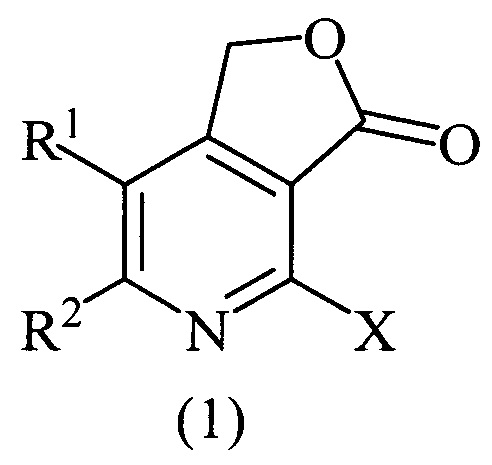
где X=Cl, R1=R2=СН3; X=Cl, R1=R2=С6Н5; X=Cl, R1+R2=(СН2)4; X=Br, R1=R2=СН3, согласно изобретению, включает взаимодействие 5,6-дизамещенных 2-галогенпиридин-3,4-дикарбоновых кислот с пропионовым ангидридом при нагревании в течение 10-12 часов, дальнейшее восстановление промежуточно получаемого 4-галогенфуро[3,4-с]пиридин-1,3-диона борогидридом натрия в течение 3-4 часов при комнатной температуре, с последующим упариванием реакционной массы на роторном испарителе под вакуумом, разбавлением остатка водой, нейтрализацией 10%-м водным раствором HCl, экстракцией этилацетатом, очисткой этилацетатных вытяжек колоночной хроматографией и перекристаллизацией продукта после хроматографии из пропан-2-ола.
Сопоставительный анализ заявляемого решения с известными показывает, что способ получения производных фуро[3,4-с]пиридин-3(1H)-онов отличается тем, что взаимодействием 5,6-дизамещенных 2-галогенпиридин-3,4-дикарбоновые кислоты с пропионовым ангидридом и борогидридом натрия. Кроме того, способ характеризуется меньшим количеством стадий и отсутствием необходимости протекания одной из стадий процесса при температуре минус 78°С.
Сущность изобретения заключается в описанном способе получения: раствор 5,6-дизамещенной 2-галогенпиридин-3,4-дикарбоновой кислоты в пропионовом ангидриде кипятят 10-12 часов.
По окончании реакции (ТСХ) реакционную массу упаривают на роторном испарителе под вакуумом. Остаток очищают колоночной хроматографией на силикагеле (элюент - этилацетат), объединенные этилацетатные фракции упаривают, полученный 4-хлорфуро[3,4-с]пиридин-1,3-дион сушат в вакуум-эксикаторе над CaCl2. Далее к охлажденному до 0°С раствору промежуточно полученного 4-хлорфуро[3,4-с]пиридин-1,3-диона в абсолютированном тетрагидрофуране в атмосфере аргона добавляют борогидрид натрия. Реакционную массу перемешивают 20 минут при температуре 0°С, затем еще 3-3.5 часа при комнатной температуре. По окончании реакции (ТСХ) реакционную массу упаривают на роторном испарителе под вакуумом. Остаток разбавляют водой, нейтрализуют 10%-м водным раствором HCl, экстрагируют этилацетатом. Этилацетатные вытяжки объединяют, промывают водой, насыщенным раствором NaCl, сушат над прокаленным Na2SO4, упаривают на роторном испарителе под вакуумом. Полученный продукт очищают колоночной хроматографией на силикагеле (элюент - этилацетат), остаток перекристаллизовывают из пропан-2-ола, сушат в вакуум-эксикаторе над CaCl2;.
Ниже приведены примеры осуществления изобретения.
Пример 1. Способ получения 6,7-диметил-4-хлорфуро[3,4-с]пиридин-3(1H)-она.
К 0.213 г (1 ммоль) 5,6-диметил-2-хлорпиридин-3,4-дикарбоновой кислоты добавляют 10 мл пропионового ангидрида и реакционную массу кипятят 10-12 часов. По окончании реакции (ТСХ) реакционную массу упаривают на роторном испарителе при пониженном давлении. Остаток очищают колоночной хроматографией на силикагеле 0.035-0.070 мм, 60  (элюент - этилацетат), объединенные этилацетатные фракции упаривают, полученный 6,7-диметил-4-хлорфуро[3,4-с]пиридин-1,3-дион сушат в вакуум-эксикаторе над CaCl2. Далее к охлажденному до 0°С раствору 0.213 г (1 ммоль) промежуточно полученного 6,7-диметил-4-хлорфуро[3,4-с]пиридин-1,3-диона в абсолютированном тетрагидрофуране в атмосфере аргона добавляют 0.046 г (1.2 ммоль) борогидрида натрия. Реакционную массу перемешивают 20 минут при температуре 0°С, затем еще 3-3.5 часа при комнатной температуре. По окончании реакции (ТСХ) реакционную массу упаривают на роторном испарителе при пониженном давлении. Остаток разбавляют водой, нейтрализуют 10%-м водным раствором HCl, экстрагируют этилацетатом (5 раз по 10 мл). Этилацетатные вытяжки объединяют, промывают водой, насыщенным раствором NaCl, сушат над прокаленным Na2SO4, упаривают на роторном испарителе при пониженном давлении. Полученный продукт очищают колоночной хроматографией на силикагеле 0.060-0.200 мм, 60
(элюент - этилацетат), объединенные этилацетатные фракции упаривают, полученный 6,7-диметил-4-хлорфуро[3,4-с]пиридин-1,3-дион сушат в вакуум-эксикаторе над CaCl2. Далее к охлажденному до 0°С раствору 0.213 г (1 ммоль) промежуточно полученного 6,7-диметил-4-хлорфуро[3,4-с]пиридин-1,3-диона в абсолютированном тетрагидрофуране в атмосфере аргона добавляют 0.046 г (1.2 ммоль) борогидрида натрия. Реакционную массу перемешивают 20 минут при температуре 0°С, затем еще 3-3.5 часа при комнатной температуре. По окончании реакции (ТСХ) реакционную массу упаривают на роторном испарителе при пониженном давлении. Остаток разбавляют водой, нейтрализуют 10%-м водным раствором HCl, экстрагируют этилацетатом (5 раз по 10 мл). Этилацетатные вытяжки объединяют, промывают водой, насыщенным раствором NaCl, сушат над прокаленным Na2SO4, упаривают на роторном испарителе при пониженном давлении. Полученный продукт очищают колоночной хроматографией на силикагеле 0.060-0.200 мм, 60  (элюент - этилацетат), остаток перекристаллизовывают из пропан-2-ола, сушат в вакуум-эксикаторе над CaCl2. Выход 0.136 г (69%), т.пл. 151-152°С. ИК спектр, ν, см-1: 1775, 1611, 1572. Спектр ЯМР 1Н (ДМСО-d6, 500.13 Гц), δ, м.д.: 2.22 с (3Н, СН3), 2.53 с (3Н, СН3), 5.40 с (2Н, СН2). Спектр ЯМР 13С (ДМСО-d6, 125.76 Гц), δ, м.д.: 13.34, 21.79, 68.12, 116.47, 125.90, 143.22, 158.76, 162.29, 166.95. Масс-спектр, m/z (Iотн., %): 197 (81) [М, 35Cl]+, 199 (26) [М, 37Cl]+. Найдено, %: С 55.11, Н 4.29, N 7.35. C9H8ClNO2. Вычислено, %: С 54.70, Н 4.08, N 7.09. М 197.62.
(элюент - этилацетат), остаток перекристаллизовывают из пропан-2-ола, сушат в вакуум-эксикаторе над CaCl2. Выход 0.136 г (69%), т.пл. 151-152°С. ИК спектр, ν, см-1: 1775, 1611, 1572. Спектр ЯМР 1Н (ДМСО-d6, 500.13 Гц), δ, м.д.: 2.22 с (3Н, СН3), 2.53 с (3Н, СН3), 5.40 с (2Н, СН2). Спектр ЯМР 13С (ДМСО-d6, 125.76 Гц), δ, м.д.: 13.34, 21.79, 68.12, 116.47, 125.90, 143.22, 158.76, 162.29, 166.95. Масс-спектр, m/z (Iотн., %): 197 (81) [М, 35Cl]+, 199 (26) [М, 37Cl]+. Найдено, %: С 55.11, Н 4.29, N 7.35. C9H8ClNO2. Вычислено, %: С 54.70, Н 4.08, N 7.09. М 197.62.
Пример 2. Способ получения 6,7-дифенил-4-хлорфуро[3,4-с]пиридин-3(1H)-она.
Способ осуществляют аналогично способу 1, отличающийся тем, что вместо 5,6-диметил-2-хлорпиридин-3,4-дикарбоновой кислоты используют 5,6-дифенил-2-хлорпиридин-3,4-дикарбоновую кислоту с образованием в качестве промежуточного соединения 6,7-дифенил-4-хлорфуро[3,4-с]пиридин-1,3-диона. Выход 0.235 г (73%), т.пл. 190-192°С. ИК спектр, ν, см-1: 1769, 1609, 1567. Спектр ЯМР 1Н (ДМСО-d6, 500.13 Гц), δ, м.д.: 5.35 с (2Н, СН2), 7.26-7.40 м (10Н, Ph). Спектр ЯМР 13С (ДМСО-d6, 125.76 Гц), δ, м.д.: 68.60, 117.94, 128.07, 128.57, 128.99, 129.10, 129.22, 129.68, 129.97, 133.83, 137.16, 145.36, 159.99, 160.51, 166.66. Масс-спектр, m/z (Iотн., %): 321 (69) [М, 35Cl]+, 323 (22) [М, 37Cl]+. Найдено, %: С 70.93, Н 3.76, N 4.35. C19H12ClNO2. Вычислено, %: С 70.93, Н 3.76, N 4.35.М 321.76.
Пример 3. Способ получения 4-хлор-6,7,8,9-тетрагидрофуро[3,4-с]хинолин-3(1H)-она.
Способ осуществляют аналогично способу 1, отличающийся тем, что вместо 5,6-диметил-2-хлорпиридин-3,4-дикарбоновой кислоты используют 2-хлор-5,6,7,8-тетрагидрохинолин-3,4-дикарбоновую кислоту с образованием в качестве промежуточного соединения 4-хлор-6,7,8,9-тетрагидрофуро[3,4-с]хинолин-1,3-диона. Выход 0.166 г (74%), т.пл. 163-164°С. ИК спектр, ν, см-1: 1774, 1599, 1572. Спектр ЯМР 1Н (ДМСО-d6, 500.13 Гц), δ, м.д.: 1.77-1.78 м (4Н, 2СН2), 2.67-2.70 с (2Н, СН2), 2.90-2.94 м (2Н, СН2), 5.38 с (2Н, СН2). Спектр ЯМР 13С (ДМСО-d6, 125.76 Гц), δ, м.д.: 20.89, 21.78, 23.50, 31.88, 67.83, 116.20, 126.74, 143.38, 159.12, 162.32, 166.85. Масс-спектр, m/z (Iотн., %): 223 (100) [М, 35Cl]+, 225 (34) [М, 37Cl]+. Найдено, %: С 55.97, Н 3.54, N 6.04. C11H10ClNO2. Вычислено, %: С 55.60, Н 3.39, N 5.89. М 223.66.
Пример 4. Способ получения 4-бром-6,7-диметилфуро[3,4-с]пиридин-3(1H)-она.
Способ осуществляют аналогично способу 1, отличающийся тем, что вместо 5,6-диметил-2-хлорпиридин-3,4-дикарбоновой кислоты используют 2-бром-5,6-диметилпиридин-3,4-дикарбоновую кислоту с образованием в качестве промежуточного соединения 4-бром-6,7-диметилфуро[3,4-с]пиридин-1,3-диона. Выход 0.155 г (64%), т.пл. 158-159°С. ИК спектр, ν, см-1: 1773, 1605, 1577. Спектр ЯМР 1Н (ДМСО-d6, 500.13 Гц), δ, м.д.: 2.21 с (3Н, СН3), 2.56 с (3Н, СН3), 5.39 с (2Н, СН2). Масс-спектр, m/z (Iотн., %): 241 (71) [М, 79Br]+, 243 (69) [М, 81Br]+. Найдено, %: С 44.89, Н 3.51, N 5.97. C9H8BrNO2. Вычислено, %: С 44.66, Н 3.33, N 5.79. М 242.07.
Таким образом, предлагаемый способ позволяет получить производные фуро[3,4-с]пиридин-3(1H)-она, которые могут найти применение в качестве веществ, используемых в потенциальном лечении или профилактике аутоиммунных и воспалительных заболеваний, неврологических и психиатрических расстройств, в которые вовлечены рецепторы орексинов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ получения производных (2-галогенпиридин-3,4-диил)диметанола | 2021 |
|
RU2768937C1 |
| Способ получения 4-галоген-1Н-пирроло[3,4-с]пиридин-1,3(2Н)-дионов | 2022 |
|
RU2790399C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 4-ГАЛОГЕН-3-ГИДРОКСИФУРО[3,4-c]ПИРИДИН-1(3Н)-ОНОВ | 2015 |
|
RU2574412C1 |
| 1-имино-2,3,4,5-тетрагидро-1Н-пирроло[3,4-с]пиридин-3,4-дионов | 2016 |
|
RU2613967C1 |
| Способ получения производных фуро[3,4-c]пиридин-1(3H)-онов | 2018 |
|
RU2680017C1 |
| СПОСОБ ПОЛУЧЕНИЯ 2-R-6-R-5-АРИЛ-ПИРРОЛО[3,4-с]КАРБАЗОЛ-1,3(2Н,6Н)-ДИОНОВ | 2009 |
|
RU2404983C1 |
| ЗАМЕЩЕННЫЕ ПИРИМИДИНТИОАЛКИЛЬНЫЕ ИЛИ АЛКИЛЭФИРНЫЕ СОЕДИНЕНИЯ И СПОСОБ ИНГИБИРОВАНИЯ ОБРАТНОЙ ТРАНСКРИПТАЗЫ ВИРУСОВ | 1996 |
|
RU2167155C2 |
| 2-ТИОЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИМИДАЗОЛА И ИХ ПРИМЕНЕНИЕ В ФАРМАЦЕВТИКЕ | 2003 |
|
RU2331638C2 |
| Четвертичные аммониевые соединения на основе производных пентаэритрита и пиридоксина, обладающие антибактериальной активностью | 2023 |
|
RU2811203C1 |
| Фотохромные производные 5'-гидроксиметил-6-нитро-1',3',3'-триметилспиро[2Н-1-бензопиран-2,2'-индолина] | 2019 |
|
RU2694904C1 |
Изобретение относится к способу получения производных фуро[3,4-с]пиридин-3(1H)-онов общей формулы (1), где X=Cl, R1=R2=СН3; X=Cl, R1=R2=С6Н5; X=Cl, R1+R2=(СН2)4; X=Br, R1=R2=СН3, который включает взаимодействие соответствующих 5,6-дизамещенных 2-галогенпиридин-3,4-дикарбоновых кислот с пропионовым ангидридом при нагревании в течение 10-12 часов и восстановление промежуточно получаемого 4-галогенфуро[3,4-с]пиридин-1,3-диона борогидридом натрия в течение 3-4 часов при комнатной температуре с последующим упариванием реакционной массы на роторном испарителе под вакуумом, разбавлением остатка водой, нейтрализацией 10%-ным водным раствором HCl, экстракцией этилацетатом, очисткой этилацетатных вытяжек колоночной хроматографией и перекристаллизацией продукта после хроматографии из пропан-2-ола. Технический результат – разработан способ получения новых производных соединений формулы (I), которые могут найти свое применение в медицине для лечения или профилактики аутоиммунных и воспалительных заболеваний, неврологических и психиатрических расстройств. 4 пр.
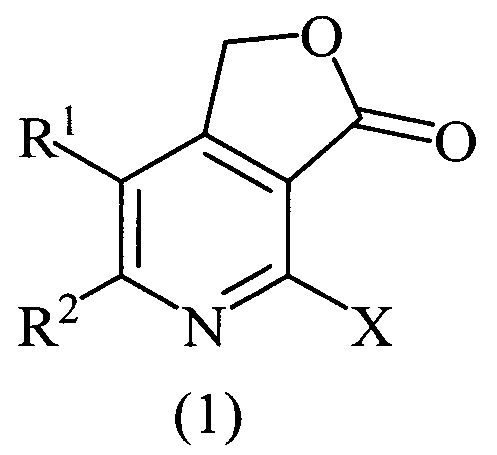
Способ получения производных фуро[3,4-с]пиридин-3(1H)-онов общей формулы (1)
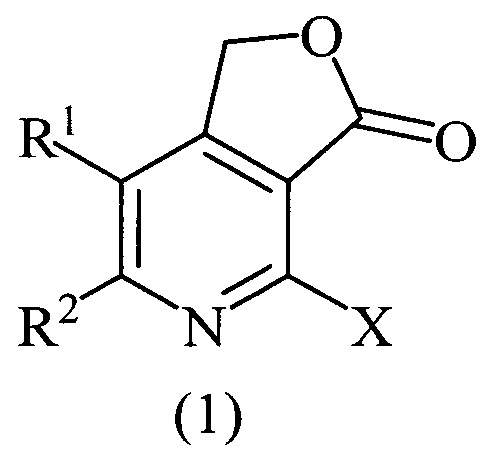
где X=Cl, R1=R2=СН3; X=Cl, R1=R2=С6Н5; X=Cl, R1+R2=(СН2)4; X=Br, R1=R2=СН3, включающий взаимодействие соответствующих 5,6-дизамещенных 2-галогенпиридин-3,4-дикарбоновых кислот с пропионовым ангидридом при нагревании в течение 10-12 часов и восстановление промежуточно получаемого 4-галогенфуро[3,4-с]пиридин-1,3-диона борогидридом натрия в течение 3-4 часов при комнатной температуре с последующим упариванием реакционной массы на роторном испарителе под вакуумом, разбавлением остатка водой, нейтрализацией 10%-ным водным раствором HCl, экстракцией этилацетатом, очисткой этилацетатных вытяжек колоночной хроматографией и перекристаллизацией продукта после хроматографии из пропан-2-ола.
| US 5908932 A1, 01.06.1999 | |||
| Gersande Lena et al | |||
| J | |||
| Mater | |||
| Chem., 2008 | |||
| Способ запрессовки не выдержавших гидравлической пробы отливок | 1923 |
|
SU51A1 |
| Прибор для равномерного смешения зерна и одновременного отбирания нескольких одинаковых по объему проб | 1921 |
|
SU23A1 |
| Реечный домкрат для подъема и установки телеграфных и телефонных столбов | 1927 |
|
SU7617A1 |
| WO 2005056524 A2, 23.06.2005 | |||
| Cappelli Andrea et al | |||
| J | |||
| Med | |||
| Chem., 2005 | |||
| Приспособление для автоматической односторонней разгрузки железнодорожных платформ | 1921 |
|
SU48A1 |
| Машина для переработки торфа на кирпичи и для укладки этих кирпичей на поле сушки | 1924 |
|
SU3564A1 |
| Способ получения производных фуро[3,4-c]пиридин-1(3H)-онов | 2018 |
|
RU2680017C1 |
| СПОСОБ ПОЛУЧЕНИЯ АЛКИЛЗАМЕЩЕННЫХ 4-ГАЛОГЕН-3-ГИДРОКСИФУРО[3,4-c]ПИРИДИН-1(3Н)-ОНОВ | 2015 |
|
RU2574412C1 |
Авторы
Даты
2020-12-15—Публикация
2020-06-02—Подача