Изобретение относится к области биотехнологии и ветеринарии, в частности средствам для лечения желудочно-кишечных заболеваний птицы.
При интенсивном ведении птицеводства в условиях промышленной технологии содержания птицы сохранение ее здоровья и профилактика заболеваний является решающим фактором получения высокой продуктивности.
Препараты для лечения и профилактики заболеваний желудочно-кишечного тракта имеют различную природу и состав, важно, чтобы они обеспечивали позитивное воздействие на физиологические, биохимические и иммунные реакции живого организма.
В настоящее время для решения указанных задач предлагается перорально вводить препараты, содержащие отдельные колонии микроорганизмов, в частности биопрепараты на основе молочнокислых микроорганизмов (ЕР 0097484, 1984, кл. А23С 1/05: ЕР 0043962, 1980, кл. А23С 19/086: US 4289888, 1979, кл. А23С 9/123). Препараты, как правило, содержат клетки бактерий, остатки культуральной жидкости (КЖ), жиры, белки, лактозу, камедь и другие добавки. Составы композиций определяются особенностями используемых микроорганизмов и характером поставленной задачи.
В комплексе мероприятий по борьбе с желудочно-кишечными болезнями бактериальной этиологии у молодняка сельскохозяйственных животных и птицы широкое применение нашли такие химиотерапевтические средства, как сульфаниламиды, антибиотики, нитрофураны. Лучший эффект достигается при применении комплексных препаратов. Известно, что широкий спектр антимикробной активности препаратов, как правило, достигается путем комбинирования нескольких лекарственных препаратов. При этом сочетание химических структур в композиции, насыщенность чужеродными для живого организма химическими соединениями порой вызывает побочные эффекты и снижение естественного иммунитета у сельскохозяйственных животных и птицы, снижает продуктивность и качество продукции.
Известно средство для лечения желудочно-кишечных болезней молодняка сельскохозяйственных животных и птицы "Тримеразин", содержащее в своем составе антибактериальные средства, мас. %: Сульфамеразин 10,0, Триметоприм 2,0, остальное - вспомогательное вещество [Справочник в 2 томах. T.I / И.Ф. Кленова, К.Л. Мальцев, Н.А. Яременко, И.А. Архипов. – М.: Сельхозиздат, 2004. - С. 241].
Применение этих препаратов не всегда дает положительный терапевтический эффект. Это может быть связано с развитием резистентности у возбудителей заболевания к данным препаратам. При этом сочетание химических структур в композиции, насыщенность чужеродными для живого организма химическими соединениями порой вызывает побочные эффекты и снижение естественного иммунитета животных и птицы, снижает продуктивность и качество продукции. В этом случае требуется тщательная проверка действия препарата, подбор и анализ полученных результатов.
Перечисленные выше лекарственные препараты имеют общие недостатки: получение их трудоемко и затратно, а получаемые результаты не всегда успешны и могут подавлять естественный иммунитет животных. Это отрицательно сказывается на их продуктивности.
Для более мягкого воздействия на микрофлору ЖКТ птицы и сохранения естественного уровня иммунного ответа организма при лечении ЖКТ птицы предлагается использовать кормовую добавку Пролизэр-БиоР. Данная кормовая добавка известна (RU 2347807 С1, 2009), получена на основе штамма E.coli "BioR.ProlyzeR-4L" (ВКПМ В-9843). Штамм не является генетически модифицированным и представляет собой эффективный продуцент лизина, одной из незаменимых аминокислот, необходимого для синтеза белка и повышения продуктивности птицы.
Способ получения кормовой добавки Пролизэр-БиоР включает культивирование указанного штамма на питательной среде в течение 6-12 часов до содержания микробных клеток 5×109-32×109 на 1 мл полученной биомассы. Полученную биомассу разливают во флаконы и подвергают сублимационной сушке.
Таким образом, предлагается применение кормовой добавки Пролизэр-БиоР в качестве средства для лечения и профилактики заболеваний ЖКТ птицы.
Предлагаемое новое применение известного средства позволит осуществлять более мягкое воздействие на организмы молодняка птицы при профилактике и лечении заболеваний ЖКТ птицы.
Новое качество известного средства не было описано ранее и не является вытекающим из его из ранее известных свойств. Кроме того, дополнительным преимуществом заявленного объекта является то, что применение указанной добавки в определенной степени снижает затраты и трудоемкость работы с птицей.
Изобретение иллюстрируется приведенным ниже описанием экспериментов.
Изучение влияния препарата Пролизэр-БиоР на продуктивность и сохранность цыплят-бройлеров, а также уровень иммунного ответа на вакцинацию против инфекционной бурсальной болезни (ИББ) и ньюкаслской болезни (НБ)
Пример
Исследования проводились в ГНУ ВНИВИП Россельхозакадемии в условиях вивария. Использовали цыплят-бройлеров суточного возраста кросса «РОСС 308». Срок содержания 35 дней. Использовали корма ПК-5, изготовленные на Гатчинском комбикормовом заводе. Доступ к кормам свободный.
Цыплята были разделены на 6 групп по 30 голов в каждой.
Перед посадкой цыплят все помещения и оборудование, предназначенные для проведения опыта, были тщательно вымыты и продезинфицированы (влажная и аэрозольная дезинфекция с использованием препарата «Вироцид»).
Цыплята всех групп были провакцинированы в суточном возрасте: 3 группы ассоциированной инактивированной вакциной «Авикрон-2» (ИББ + НБ) производства ГНУ ВНИВИП Россельхозакадемии против инфекционной бурсальной болезни и ньюкаслской болезни и 3 группы - живой вакциной против инфекционной бурсальной болезни (вакцина ТАБИК МБ из штамма «МБ» против инфекционной бурсальной болезни сухая живая. Организация-производитель «ABICBiologicalLaboratoriesLtd.» / «АБИК биологические лаборатории Лтд.», Израиль) и против ньюкаслской болезни(вакцина ТАБИК VH из штамма «VH» для профилактики ньюкаслской болезни сухая живая. Организация-производитель «ABICBiologicalLaboratoriesLtd.» / «АБИК биологические лаборатории Лтд.», Израиль) для предотвращения возможной контаминации вирусами и заболеваемости цыплят указанными болезнями в условиях инфекционного вивария. Инактивированную вакцину вводили в дозе 0,3 мл/гол., подкожно в области средней трети шеи в суточном возрасте с использованием полуавтоматических инъекторов Socorex. Вакцинация живыми вакцинами проводилась в соответствии с инструкциями по применению.
На время проведения опыта доступ в контрольные и опытные боксы был строго ограничен. Доступ был разрешен только специалисту-бактериологу для отбора проб и специально закрепленным сотрудникам для кормления цыплят, уборки помещения и взвешивания. Доступ сотрудников в боксы осуществлялся в одноразовой спецодежде и обуви и средствах индивидуальной защиты (трехслойные маски, перчатки) с целью предотвращения заноса микрофлоры извне и выноса микрофлоры из боксов с зараженными цыплятами. Переодевание осуществлялось в предбокснике, оборудованном бактерицидными лампами. Перед боксами расположены дезковрики.
Для содержания цыплят были задействованы 2 бокса в секции отдела микробиологии в инфекционном виварии. В каждом боксе находились 3 группы птицы, в одном - вакцинированные инактивированной вакциной, в другом - вакцинированные живыми вакцинами.
1 группа - контроль, инактивированная вакцина. Цыплята получали стандартный рацион.
2 группа - опыт, инактивированная вакцина. Цыплята получали стандартный рацион + препарат Биотроф, начиная с 4-х суток. Препарат скармливали с кормом в дозе 100 г на 100 кг корма.
3 группа - опыт, инактивированная вакцина. Цыплята получали стандартный рацион + препарат Пролизэр-БиоР, начиная с 4-х суток, каждые четыре дня в дозе 50×106 КОЕ на голову. Препарат выпаивали через канюлю в зоб в дозе 1 мл индивидуально каждой птице.
4 группа - контроль, живая вакцина. Цыплята получали стандартный рацион.
5 группа - опыт, живая вакцина. Цыплята получали стандартный рацион + препарат Биотроф, начиная с 4-х суток. Препарат скармливали с кормом в дозе 100 г на 100 кг корма.
6 группа - опыт, живая вакцина. Цыплята получали стандартный рацион + препарат Пролизэр-БиоР, начиная с 4-х суток, каждые четыре дня в дозе 50×106 КОЕ на голову. Препарат выпаивали через канюлю в зоб в дозе 1 мл индивидуально каждой птице.
Каждые 7 дней, начиная с первых суток, проводилось взвешивание цыплят на электронных весах марки ПВ-15 (производитель АО «Масса-К») по 20 голов от каждой группы. Каждые 7 дней проводили отбор проб смывов с клоаки для проведения бактериологического исследования. В первые сутки до вакцинации три цыпленка были убиты для отбора проб толстого кишечника, также по три незараженных цыпленка каждой группы были забиты для отбора проб кишечника на 21 и 28-е сутки.
В случае падежа цыплят проводили вскрытие трупов для патологоанатомического и бактериологического исследования.
При проведении бактериологических исследований первичные посевы исследуемого материала делали на простые питательные среды - мясопептонный бульон (МПБ), мясопептонный агар (МПА), на чашки с дифференциально-диагностической средой Эндо (для выделения энтеробактерий), на желточно-солевой или стафилококковый агар (для выделения стафилококков), на селенитовый бульон (как среду для накопления сальмонелл), среду Вильсон-Блера (для выделения клостридий). У выросших колоний изучали морфологические, культуральные, биохимические свойства.
При изучении морфологии колоний производили микроскопию мазков, окрашенных по Граму. Родовую и видовую дифференциацию и идентификацию культур проводили путем изучения ферментативных и биохимических свойств с использованием трехсахарного агара Олькеницкого, сред Клиглера, Ресселя, Симмонса, Кода, сред Гисса, реактива Эрлиха, тест-систем для биохимической идентификации энтеробактерий (СИБ), Энетротеста-24 и др. Видовую принадлежность культур сальмонелл устанавливали в реакции агглютинации на стекле с сальмонеллезными сыворотками.
Для проведения серологических исследований использовали Программу и наборы для обнаружения в иммуноферментном анализе (ИФА) антител к инфекционной бурсальной болезни (ИББ) BioChek, изготовитель: фирма ChromoTechLimited (Нидерланды), микропланшетный ридер SUNRISE (Tecan Austria GmbH, Австрия). Для выявления антител против ньюкаслской болезни в реакции задержки гемагглютинации (РЗГА) использовали антиген производства ООО «Кронвет».
Отбор проб крови для проведения серологических исследований производили из сердца в количестве не менее 10 проб от каждой группы. Кровь собирали в одноразовые шприцы. Шприцы с кровью прогревали в термостате при 37°С в течение 20-ти минут. Затем пробы крови отстаивали в холодильнике при +8°С в течение 4-х часов и сливали сыворотку в пробирки. Сыворотку в пробирках инактивировали на водяной бане при +56°С в течение 30 мин. Для исследования использовали сыворотку крови цыплят объемом не менее 0,2-0,3 см3.
Исследование проводили в соответствии с инструкцией по проведению ИФА с использованием наборов и программы BioChek.
Результаты серологических исследований выражали в обратных значениях титров.
Результаты исследований
1. Влияние препаратов на продуктивность цыплят-бройлеров (среднесуточный прирост живой массы, динамика живой массы).
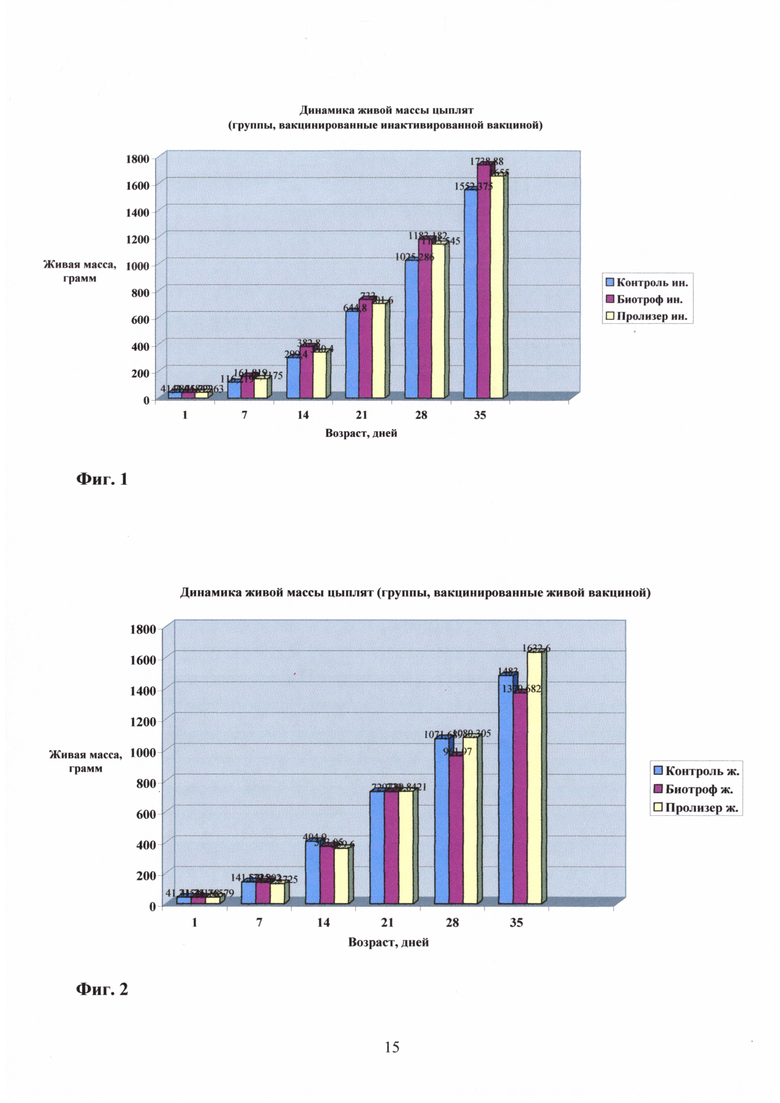
Живая масса. Взвешивание птицы проводили индивидуально на электронных весах в возрасте 1, 7, 14, 21, 28 и 35 дней. Данные по взвешиванию представлены в таблице 1 и на Фиг. 1 и 2.
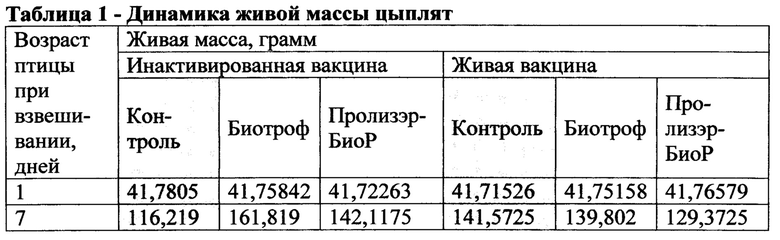

Из представленных данных видно, что цыплята обеих опытных групп (Биотроф и Пролизэр-БиоР), вакцинированные инактивированной вакциной, на протяжении всех сроков исследования имели более высокую живую массу, чем контрольная группа, не получавшая препарат (Фиг. 3-6). Цыплята, вакцинированные живой вакциной, получавшие Биотроф, имели на протяжении всех сроков исследования чуть более низкую массу, чем контрольная группа, вакцинированная живой вакциной. Цыплята, вакцинированные живой вакциной, получавшие Пролизэр-БиоР, в первые два срока исследования (7 и 14 дней) имели более низкую массу, чем контрольная группа, в два последних срока исследования (28 и 35 дней, перед убоем) имели живую массу более высокую, чем в контроле.
2. Влияние препаратов Биотроф и Пролизэр-БиоР на заболеваемость цыплят-бройлеров актуальными болезнями бактериальной этиологии на модели сальмонеллеза и колибактериоза.
В 21-суточном возрасте по 8 цыплят каждой их 6-ти групп были заражены культурами Escherichia coli, Salmonella enteritidis и Clostridium perfringens. Заражение проводили суточными бульонными культурами peros (выпаивание через канюлю в зоб) индивидуально каждую птицу однократно в дозе 1 млрд микробных клеток на голову. За зараженными цыплятами вели наблюдение, при падеже цыплят проводили вскрытие, патологоанатомическое и бактериологическое исследования. По окончании опыта (через 14 дней после заражения) было проведено взвешивание выживших цыплят, затем они были убиты, вскрыты, проведены патологоанатомическое и бактериологическое исследования.
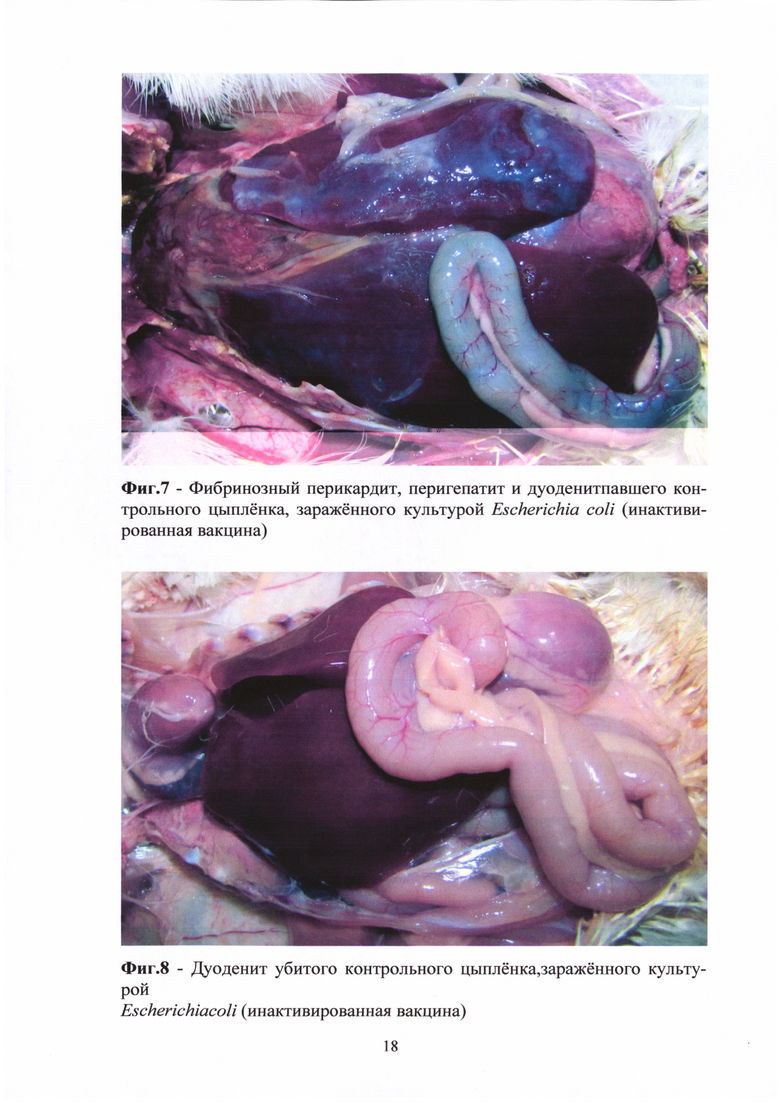
Все цыплята второй и третьей опытных групп (инактивированная вакцина, препараты Биотроф и Пролизэр-БиоР), зараженные культурами E.coli, S. enteritidis, Cl. perfringens, оставались живыми и клинически здоровыми на протяжении всего срока наблюдения. В контрольной группе на 12-е сутки пал один цыпленок, зараженный культурой E.coli. На вскрытии у цыпленка отмечены патологоанатомические изменения, характерные для колибактериоза - фибринозный перикардит и перигепатит, геморрагический дуоденит (Фиг. 7). При бактериологическом исследовании из внутренних органов (сердце, печень) выделена культура заражающего штамма.
Все цыплята пятой опытной группы (живая вакцина, препарат Биотроф), зараженные культурами E.coli, S. enteritidis, Cl. perfringens, оставались живыми и клинически здоровыми на протяжении всего срока наблюдения. В шестой опытной группе (живая вакцина, препарат Пролизэр-БиоР) на 10-е сутки после заражения пал один цыпленок, зараженный культурой S. enteritidis, а на 13-е сутки после заражения пал один цыпленок, зараженный культурой E.coli. В контрольной группе на 9-е сутки пал один цыпленок, зараженный культурой E.coli. На вскрытии у цыпленка отмечены патологоанатомические изменения, характерные для колибактериоза - фибринозный перикардит и перигепатит, геморрагический дуоденит. При бактериологическом исследовании из внутренних органов (сердце, печень) выделена культура заражающего штамма.
По окончании опыта (на 35-е сутки) все выжившие цыплят были убиты, вскрыты, проведено бактериологическое исследование.
У 4-х контрольных цыплят, вакцинированных инактивированной вакциной, зараженных E.coli, на вскрытии отмечен дуоденит (Фиг. 8).
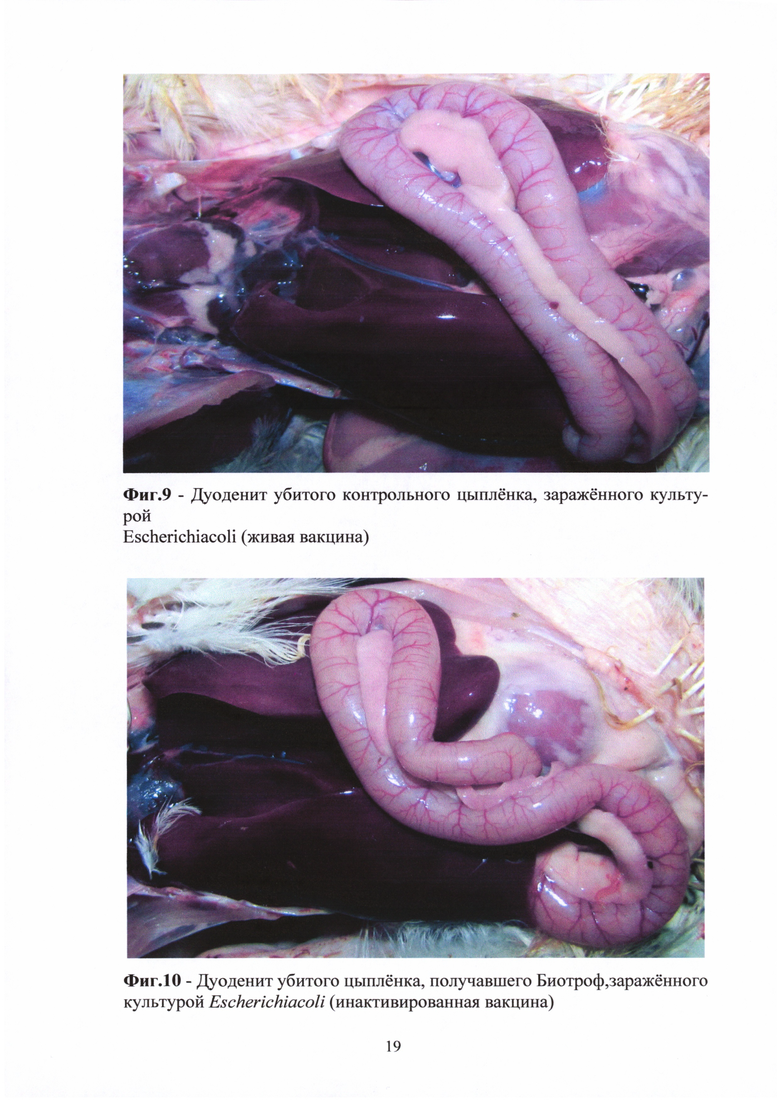
У контрольных цыплят, вакцинированных живой вакциной, зараженных E.coli и S. enteritidis, у всех на вскрытии отмечен дуоденит (Фиг. 9).
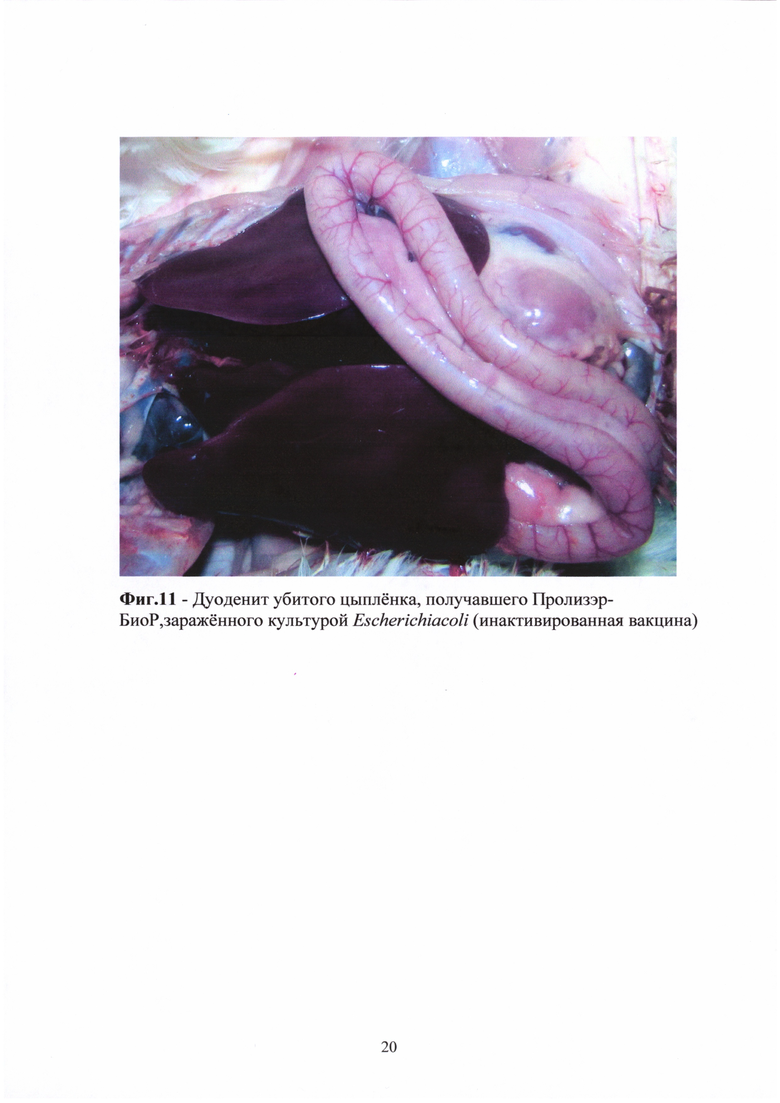
У нескольких цыплят каждой опытной группы, получавших Биотроф и Пролизэр-БиоР, вакцинированных инактивированной и живой вакциной, зараженных E.coli и S. enteritidis, также отмечены дуодениты (Фиг. 10-11).
При бактериологическом исследовании контрольных цыплят первой группы (инактивированная вакцина), зараженных культурой E.coli, культура E.coli выделена от 4-х цыплят (у одного из сердца и печени, у одного - из сердца, у двух - из печени.).
У опытных цыплят второй группы (инактивированная вакцина, Биотроф), зараженных E.coli, культура E.coli выделена от двух цыплят (у одного из сердца, у одного из печени). У опытных цыплят третьей группы (инактивированная вакцина, Пролизэр-БиоР), зараженных E.coli, культура E.coli выделена от двух цыплят (у одного из сердца и печени, у одного из печени).
При бактериологическом исследовании контрольных цыплят третьей группы (живая вакцина), зараженных культурой E.coli, культура E.coli выделена от 3-х цыплят (у одного из сердца и печени, у двух - из печени).
У опытных цыплят пятой группы (живая вакцина, Биотроф), зараженных E.coli, культура E.coli выделена от одного цыпленка (сердца). У опытных цыплят шестой группы (живая вакцина, Пролизэр-БиоР), зараженных E.coli, культура E.coli не выделена ни от одного цыпленка, все посевы стерильны.
При бактериологическом исследовании контрольных цыплят первой группы (инактивированная вакцина), зараженных культурой S. enteritidis, культура S. enteritidis выделена от 3-х цыплят (у одного из сердца и желчи, у двух - из желчи). Кроме того, от двух цыплят выделены культуры E.coli (у одного из сердца и желчи, у одного - из желчи).
У опытных цыплят второй группы (инактивированная вакцина, Биотроф), зараженных S. enteritidis, культуры S. enteritidis не выделены ни от одного цыпленка, но от одного цыпленка выделена культура E.coli (из желчи). У опытных цыплят третьей группы (инактивированная вакцина, Пролизэр-БиоР), зараженных S. enteritidis, культуры S. enteritidis не выделены ни от одного цыпленка, но от одного цыпленка выделена культура E.coli (из желчи).
При бактериологическом исследовании контрольных цыплят третьей группы (живая вакцина), зараженных культурой S. Enteritidis, культура S. Enteritidis выделена от одного цыпленка (из желчи). Кроме того, от одного цыпленка выделена культуры E.coli (из желчи).
У опытных цыплят пятой группы (живая вакцина, Биотроф), зараженных культурой S. Enteritidis, культуры S. Enteritidis не выделены ни от одного цыпленка, все посевы стерильны. У опытных цыплят шестой группы (живая вакцина, Пролизэр-БиоР), зараженных S. enteritidis, культуры S. enteritidis не выделены ни от одного цыпленка, но от одного цыпленка выделена культура E.coli (из желчи). Результаты бактериологических исследований представлены в таблице 2.
Из представленных в таблице данных видно, что в обеих контрольных группах (вакцинированных как инактивированной, так и живой вакциной) пало по одному цыпленку, зараженному культурой E.coli, и выделены 5 и 4 культуры E.coli от выживших цыплят. В то время как во всех четырех опытных группах, зараженных E.coli, ни одного цыпленка не пало и были выделены не более 2-х культур E.coli от цыплят в группе.
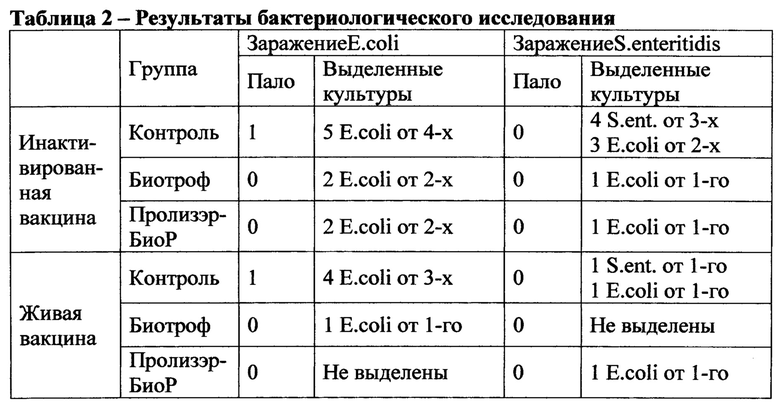
В обеих контрольных группах (вакцинированных как инактивированной, так и живой вакциной) цыплята, зараженные культурой Salmonellaenteritidis, не пали. Однако при бактериологическом исследовании от цыплят каждой контрольной группы (вакцинированной инактивированной и живой вакциной) выделены культуры S. enteritidis и E.coli. В то время как от цыплят ни одной опытной группы культуры сальмонелл не выделены, были выделены лишь не более одной культуры E.coli от группы.
Полученные данные указывают на то, что препараты Биотроф и Пролизэр-БиоР эффективны при экспериментальном заражении цыплят культурами Escherichiacoli и Salmonellaenteritidis. Зараженные этими культурами цыплята, получавшие препарат, были живы и клинически здоровы на протяжении всего срока наблюдения (14 дней), к убою имели более высокую живую массу (кроме 5-й опытной группы - Биотроф живая вакцина). В то время как среди контрольных цыплят наблюдался падеж цыплят, зараженных культурой Е.coli. При бактериологическом исследовании цыплят, от птиц обеих контрольных групп выделено большее количество культур E.coli, и выделены культуры S. enteritidis. От цыплят всех опытных группы культуры S. enteritidis не выделены, выделение культур E.coli меньше, чем от контрольных птиц. Следовательно, данные препараты (Биотроф и Пролизэр-БиоР) препятствуют инвазии заражающих штаммов в организм птиц.
Результаты серологических исследований
Сыворотки крови отбирали от каждой группы птицы в возрасте 1 сутки, 22, 29 и 36 дней. Сыворотки крови на наличие поствакцинальных антител против инфекционной бурсальной болезни исследовали с использованием иммуноферментного анализа. Результаты исследований представлены в таблице 3.
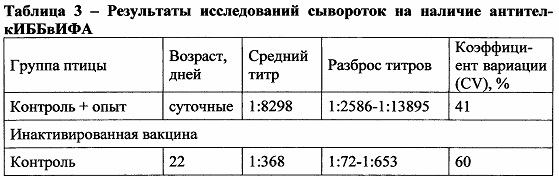

Из данных таблицы видно, что значения средних титров антител против ИББ в контрольной и опытных группах птицы, вакцинированной инактивированной вакциной, в возрасте 36 дней не имеют значительных различий и составляют 1:9052 (контроль), 1:8944 (Пролизэр-БиоР-опыт), 1:9112 (Биотроф-опыт) соответственно. Также незначительные различия имеют значения коэффициента вариации (CV), которые составляют 26, 21 и 23% соответственно.
Значения средних титров антител против ИББ в контрольной и опытных группах птицы, вакцинированной живой вакциной, в возрасте 36 дней также не имеют значительных различий и составляют 1:9360 (контроль), 1:9109 (Пролизэр-БиоР-опыт), 1:9032 (Биотроф-опыт) соответственно. Значения коэффициента вариации (CV), которые составляют 18, 14 и 20% соответственно также не имеют принципиальных различий.
Выводы
Полученные данные указывают на то, что препарат Пролизэр-БиоР положительно влияет на продуктивность цыплят-бройлеров. Цыплята опытных групп (кроме одной), получавшие препарат, имели более высокий прирост массы, чем контрольной. Препарат эффективен при экспериментальном заражении цыплят культурами Escherichiacoli и Salmonellaenteritidis. Зараженные этими культурами цыплята, получавшие препарат, были живы и клинически здоровы на протяжении всего срока наблюдения (14 дней), к убою имели более высокую живую массу, культуры заражающего штамма Salmonellaenteritidis не выделены (антиинвазивные свойства). В то время как среди контрольных цыплят наблюдался падеж, отмечены патологоанатомические признаки бактериальных болезней на вскрытии, из внутренних органов выделены культуры заражающих штаммов.
По результатам проведенных серологических исследований установлено, что введение в состав комбикормов препарата Пролизэр-БиоР не оказывает влияния на выработку поствакцинальных антител против инфекционной бурсальной болезни и ньюкаслской болезни как после применения инактивированных, так и после применения живых вакцин.
На основе полученных данных можно сделать вывод о том, что применение препарата Пролизэр-БиоР в птицеводстве перспективно.


Изобретение относится к биотехнологии и ветеринарии. Кормовая добавка Пролизэр-БиоР применяется в качестве средства для лечения и профилактики заболеваний желудочно-кищечного тракта птицы. Изобретение позволяет сохранить поголовье птицы и увеличить прирост живой массы. 11 ил., 3 табл.
Применение кормовой добавки Пролизэр-БиоР в качестве средства для лечения и профилактики заболеваний желудочно-кишечного тракта птицы.
Авторы
Даты
2017-12-21—Публикация
2016-12-16—Подача