Область техники, к которой относится изобретение
Настоящее изобретение относится к новым ДНК-аптамерам, способным специфически связываться с гельзолином (gelsolin) с высокой аффинностью, к использованию этого свойства аптамеров для оценки уровня гельзолина в заданном образце и очистки больших количеств немеченого гельзолина и его аналогов. В настоящее время для оценки уровня гельзолина в образце используют либо актин, как белок, связывающий гельзолин, либо антитела против гельзолина. Актин получают в первую очередь из мышечной ткани кролика или курицы. Производство антител также связано либо с использованием культур клеток млекопитающих, либо с использованием животных, включая кролика, мышь, козу, ламу, лошадь, курицу и т.д. Поэтому настоящее изобретение нацелено на попытку выявления уровня гельзолина в плазме и его очистки с помощью небольших молекул ДНК, тем самым устраняя необходимость использования разных животных/их тканей для получения белков, связывающих гельзолин, что является намного более дорогостоящим и социально неприемлемым способом в отличие от синтеза молекулы ДНК методом ПЦР in vitro. Эти аптамеры могут быть химически синтезированы и/или биохимически созданы с помощью ПЦР и/или произведены бактериями, используя простые инструменты и протоколы молекулярной биологии. Используя эту стратегию, массовое производство гельзолин-связывающего матрикса может быть осуществлено с гораздо меньшими затратами.
Уровень техники
Гельзолин - это шестидоменный (G1-G6) многофункциональный актинсвязывающий белок. У человека он существует в виде трех изоформ, которые включают в себя две цитоплазматические изоформы и одну внеклеточную изоформу, секретируемую в плазму. Все эти изоформы кодируются одним геном, расположенным у людей на 9 хромосоме. Основные функции гельзолина цитоплазмы связаны с деполимеризацией актина, а также c образованием ядра, которое, в первую очередь, регулируется кальцием, рН и фосфоинозитидами (Ashish et al, 2007; Garg et al, 2011; Peddada et al, 2013). Для инициирования полимеризации он связывается с двумя мономерами глобулярного актина (G-актина), а для влияния на функцию деполимеризации актина связывается с нитевидным актином (F-актином), разрывает нити, ослабляя нековалентные связи между мономерами актина, и остается прикрепленным к концу нити в качестве крышки, чтобы предотвратить последующее удлинение (Yin & Stull, 1999).
В плазме гельзолин, в первую очередь, участвует в быстром разрыве и удалении нитей актина, высвобождаемых в кровоток мертвыми клетками. Таким образом, плазменный гельзолин [pGSN] выполняет защитную роль, очищая кровоток от токсического циркулирующего нитевидного актина, попадающего в кровь вследствие некроза клеток (Lee & Galbraith, 1992). Кроме того, плазменный гельзолин также обладает способностью связывать различные провоспалительные и биоактивные молекулы в организме, в том числе лизофосфатидную кислоту, сфингозин 1-фосфат, фибронектин и активирующий тромбоциты фактор, которые действуют как медиаторы многих физиологических функций, в том числе заживления ран, неврологических событий, прогрессирования рака и ангиогенеза (Bucki et al, 2010; Lind & Janmey, 1984; Lind et al, 1988; Osborn et al, 2007). Было предположено, что pGSN изолирует эти биоактивные медиаторы воспаления и локализует воспалительные и иммунные реакции в местах повреждения. Помимо этих биологически активных молекул, pGSN обладает способностью связывать липиды на поверхности бактерий, липотейхоевую кислоту (LTA) и липополисахариды (LPS), которые присутствуют у грамположительных и грамотрицательных бактерий соответственно (Bucki et al, 2008; Bucki et al, 2005). Такое взаимодействие подрывает способность LTA и LPS опосредовать врожденные иммунные реакции хозяина (Bucki et al, 2008).
Человеческий плазменный гельзолин циркулирует в крови в концентрации примерно 200 мкг/мл (Osborn et al, 2008). Клиническое значение и важность для терапии этого белка были хорошо проиллюстрированы в моделях на животных, а также на пациентах с различными заболеваниями. Значительное снижение (20-50%) уровня гельзолина в плазме было задокументировано при различных заболеваниях или осложнениях, которые включают крупные и мелкие травмы, ожоги, острый респираторный дистресс-синдром (ARDS), острое повреждение легких, острые печеночные повреждения, операции, сепсис, гепатит, малярию, MODS (в том числе инфаркт миокарда, септический шок и мионекроз), аллогенную трансплантацию стволовых клеток и рассеянный склероз (Peddada et al, 2012). Кроме того, было установлено, что уровень плазменного гельзолина увеличивается у пациентов, выздоравливающих после болезни. Более того, было подтверждено, что перенасыщение экзогенным рекомбинантным гельзолином значительно повышает выживаемость в животных моделях при различных острых повреждениях (Lee et al, 2007).
В целом, все эти исследования, направленные на изучение корреляции уровня pGSN с выраженностью проблемы со здоровьем, а также клинические результаты позволяют предположить, что: 1) уровень pGSN снижается после клеточной травмы, либо из-за операции, воспаления или инфекции, и это снижение очень хорошо коррелирует со степенью клеточного повреждения, 2) уровень pGSN, упавший ниже критического уровня, значительно увеличивает риск смертности, поэтому, опираясь на уровни приема pGSN, экзогенный гельзолин может назначаться пациентам, имеющим критически низкий уровень pGSN, чтобы повысить их шансы на выживание. Таким образом, pGSN имеет огромный потенциал в качестве отличного прогностического биомаркера при разнообразных состояниях здоровья, а также терапевтически важного белка для улучшения состояния здоровья пациента.
Однако, не зная точного уровня гельзолина в плазме здоровых лиц, а также пациентов, заместительная терапия гельзолином не может быть реальностью. Существующие коммерческие наборы для определения уровня гельзолина в образце используют метод сэндвич-ИФА [иммуноферментный анализ]. Кратко, дно планшета иммуноферментного анализа покрывают специфическими антителами к гельзолину, которые затем используются для связывания гельзолина, присутствующего в контрольных и тестируемых образцах. Связанный гельзолин затем детектируется с помощью биотин-меченых антител против гельзолина и конъюгата стрептавидина с пероксидазой хрена. Тем не менее, все эти наборы предназначены только для научных исследований, но не для диагностических целей.
Кратко, можно резюмировать, что до сих пор в литературе не существует никакого доступного, точного и ускоренного метода диагностики, который может быть надежно использован для определения уровня плазменного гельзолина у людей и животных. Учитывая растущие потребности в измерении уровня плазменного гельзолина при разных заболеваниях или стрессовых состояниях и терапевтические возможности введения экзогенного гельзолина и/или его форм для улучшения состояния больного, роль аптамеров в количественной оценке и очистке гельзолина и его аналогов имеет большой преобразующий потенциал и до настоящего времени не была описана.
Цели изобретения
Таким образом, основной целью настоящего изобретения является создание новых и специфических ДНК-аптамеров, обладающих способностью связывать гельзолин, которые могут быть использованы для разработки протоколов количественной оценки и/или очистки гельзолина и его аналогов.
Другой целью настоящего изобретения является создание способа для оценки уровня гельзолина в образце с помощью новых разработанных ДНК-аптамеров и их модификаций.
Еще одной целью настоящего изобретения является разработка диагностических наборов для оценки уровня гельзолина в образце.
Еще одной целью настоящего изобретения является разработка новых ДНК-аптамеров и их модификаций, которые можно будет использовать при разработке/генерации аффинного матрикса для очистки гельзолина и его аналогов, в том числе немеченых.
Дополнительной целью настоящего изобретения является создание способа, посредством которого заявляемые ДНК-аптамеры могут специфически и прочно связываться с гельзолином, тем самым блокируя способность гельзолина связывать другие белки.
Раскрытие изобретения
Настоящее изобретение относится к идентификации и использованию ДНК-аптамеров, связывающих гельзолин, для оценки уровня гельзолина в заданном образце, и очистки меченого или немеченого гельзолина и его аналогов.
С целью преодоления ограничений, связанных с вариациями от партии к партии образцов антител и актина, используемых для подготовки наборов или протокола(ов) для определения гельзолина, был произведён скрининг библиотеки случайных ДНК-аптамеров для выявления аптамеров, способных связывать гельзолин [NCBI Reference Sequence: NP_000168.1] (SEQ ID NO: 1) или его N- и C-концевые половины, а именно G1-G3 и G4-G6 (SEQ ID NO: 2 и 3 соответственно). Олигонуклеотиды [аптамеры] были синтезированы методом ПЦР, очищены, и их способность связывать гельзолин и его аналоги была проверена экспериментально. Результаты показали, что некоторые ДНК-аптамеры связывают гельзолин и его аналоги с чувствительностью и специфичностью, сопоставимой с антителами против гельзолина (IgG или IgY) и актином. Главное преимущество этого процесса заключается в том, что ДНК-аптамеры могут быть легко получены по протоколам ПЦР и экстрагированы с высокой степенью чистоты. Также концентрации ДНК-аптамеров, которые являются относительно более стабильными, чем белки, могут контролироваться с высокой точностью. Это свойство может оказаться полезным в использовании ДНК-аптамеров в качестве покрытия или связующего материала в диагностических наборах для определения гельзолина, и/или при генерации аффинного матрикса для очистки немеченого гельзолина и его модификаций в большом объёме. Учитывая растущие потребности в измерении уровня плазменного гельзолина при разных заболеваниях или стрессовых состояниях, и терапевтический потенциал введения экзогенного гельзолина и/или его форм для улучшения состояния больного, роль аптамеров в количественной оценке и очистке гельзолина и его аналогов имеет большой преобразующий потенциал и до настоящего времени не была описана.
В варианте осуществления настоящего изобретения, свойство ДНК-аптамеров связывать гельзолин используется как инструмент в разработке приложений для количественной оценки уровня гельзолина в образцах, в том числе от людей и/или животных. Это свойство может быть расширено до разработки соответствующих диагностических наборов для определения гельзолина.
В другом варианте осуществления настоящего изобретения, свойство связывания аптамеров с гельзолином используется как инструмент в разработке приложений для очистки гельзолина и его аналогов из смеси.
В еще одном варианте осуществления настоящего изобретения, свойство связывания аптамеров с гельзолином используется для того, чтобы функционализовать стационарную фазу матрикса, используемого в хроматографии, при разработке протокола аффинной хроматографии для очистки гельзолина и его модификаций в большом объёме.
В другом варианте осуществления настоящего изобретения, свойство аптамеров специфически и прочно связываться с гельзолином было использовано, чтобы блокировать функционирование гельзолина в нежелательных путях, что говорит о терапевтическом потенциале этих аптамеров.
Последовательности различных ДНК-аптамеров, способных связывать гельзолин, представлены в SEQUENCE LISTING.txt и приведены в таблице ниже вместе с другими последовательностями, используемыми в изобретении:
Название – Гельзолин
Аббревиатура - GSN
QAGAPQGRVPEARPNSMVVEHPEFLKAGKEPGLQI
WRVEKFDLVPVPTNLYGDFFTGDAYVILKTVQLRN
GNLQYDLHYWLGNECSQDESGAAAIFTVQLDDYLN
GRAVQHREVQGFESATFLGYFKSGLKYKKGGVASG
FKHVVPNEVVVQRLFQVKGRRVVRATEVPVSWESF
NNGDCFILDLGNNIHQWCGSNSNRYERLKATQVSK
GIRDNERSGRARVHVSEEGTEPEAMLQVLGPKPAL
PAGTEDTAKEDAANRKLAKLYKVSNGAGTMSVSLV
ADENPFAQGALKSEDCFILDHGKDGKIFVWKGKQA
NTEERKAALKTASDFITKMDYPKQTQVSVLPEGGE
TPLFKQFFKNWRDPDQTDGLGLSYLSSHIANVERV
PFDAATLHTSTAMAAQHGMDDDGTGQKQIWRIEGS
NKVPVDPATYGQFYGGDSYIILYNYRHGGRQGQII
YNWQGAQSTQDEVAASAILTAQLDEELGGTPVQSR
VVQGKEPAHLMSLFGGKPMIIYKGGTSREGGQTAP
ASTRLFQVRANSAGATRAVEVLPKAGALNSNDAFV
LKTPSAAYLWVGTGASEAEKTGAQELLRVLRAQPV
QVAEGSEPDGFWEALGGKAAYRTSPRLKDKKMDAH
PPRLFACSNKIGRFVIEEVPGELMQEDLATDDVML
LDTWDQVFVWVGKDSQEEEKTEALTSAKRYIETDP
ANRDRRTPITVVKQGFEPPSFVGWFLGWDDDYWSV
DPLDRAMAELAA
[Белок]
Название – G1-G3
Аббревиатура – G1-G3
QAGAPQGRVPEARPNSMVVEHPEFLKAGKEPGLQI
WRVEKFDLVPVPTNLYGDFFTGDAYVILKTVQLRN
GNLQYDLHYWLGNECSQDESGAAAIFTVQLDDYLN
GRAVQHREVQGFESATFLGYFKSGLKYKKGGVASG
FKHVVPNEVVVQRLFQVKGRRVVRATEVPVSWESF
NNGDCFILDLGNNIHQWCGSNSNRYERLKATQVSK
GIRDNERSGRARVHVSEEGTEPEAMLQVLGPKPAL
PAGTEDTAKEDAANRKLAKLYKVSNGAGTMSVSLV
ADENPFAQGALKSEDCFILDHGKDGKIFVWKGKQA
NTEERKAALKTASDFITKMDYPKQTQVSVLPEGGE
TPLFKQFFKNWRD
[Белок]
Название – G4-G6
Аббревиатура – G4-G6
YIILYNYRHGGRQGQIIYNWQGAQSTQDEVAASAI
LTAQLDEELGGTPVQSRVVQGKEPAHLMSLFGGKP
MIIYKGGTSREGGQTAPASTRLFQVRANSAGATRA
VEVLPKAGALNSNDAFVLKTPSAAYLWVGTGASEA
EKTGAQELLRVLRAQPVQVAEGSEPDGFWEALGGK
AAYRTSPRLKDKKMDAHPPRLFACSNKIGRFVIEE
VPGELMQEDLATDDVMLLDTWDQVFVWVGKDSQEE
EKTEALTSAKRYIETDPANRDRRTPITVVKQGFEP
PSFVGWFLGWDDDYWSVDPLDRAMAELAA
agtacatgaccacttga
gtccttctcttcccta
Краткое описание сопроводительных чертежей
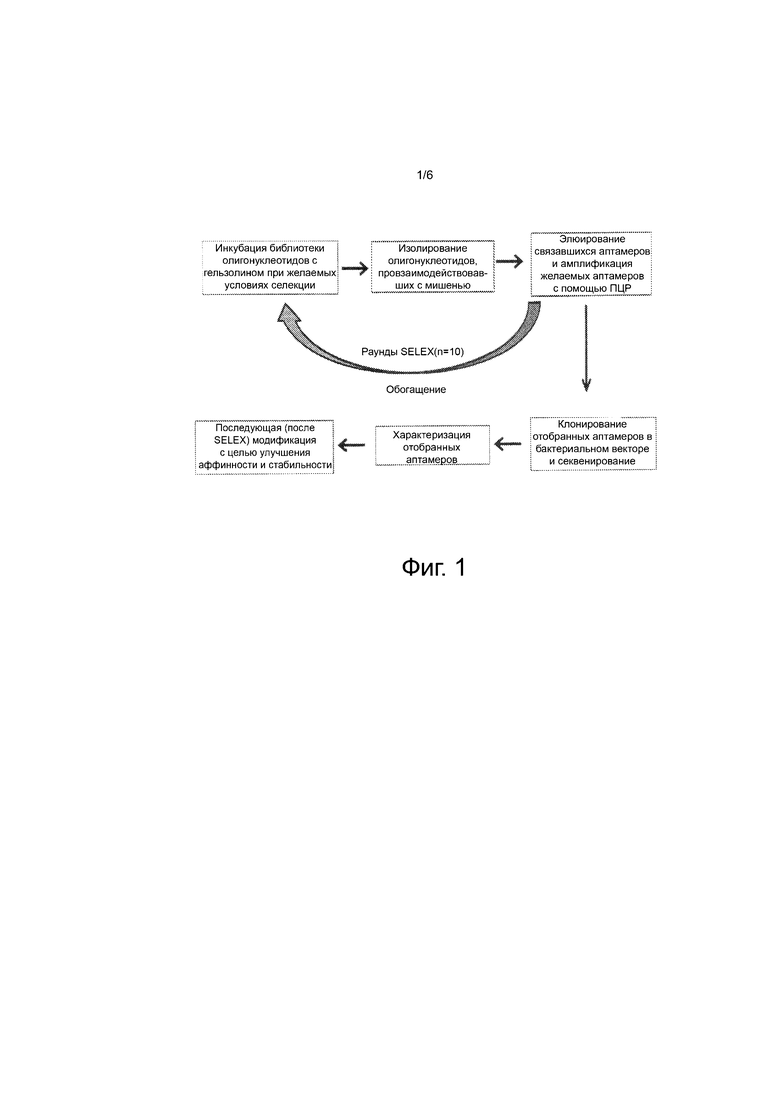
Фиг. 1 иллюстрирует схему, отражающую стратегию скрининга библиотеки аптамеров для выявления специфических аптамеров, способных связывать гельзолин. Этот протокол преследовал цель расширить список аптамеров, способных связывать гельзолин.
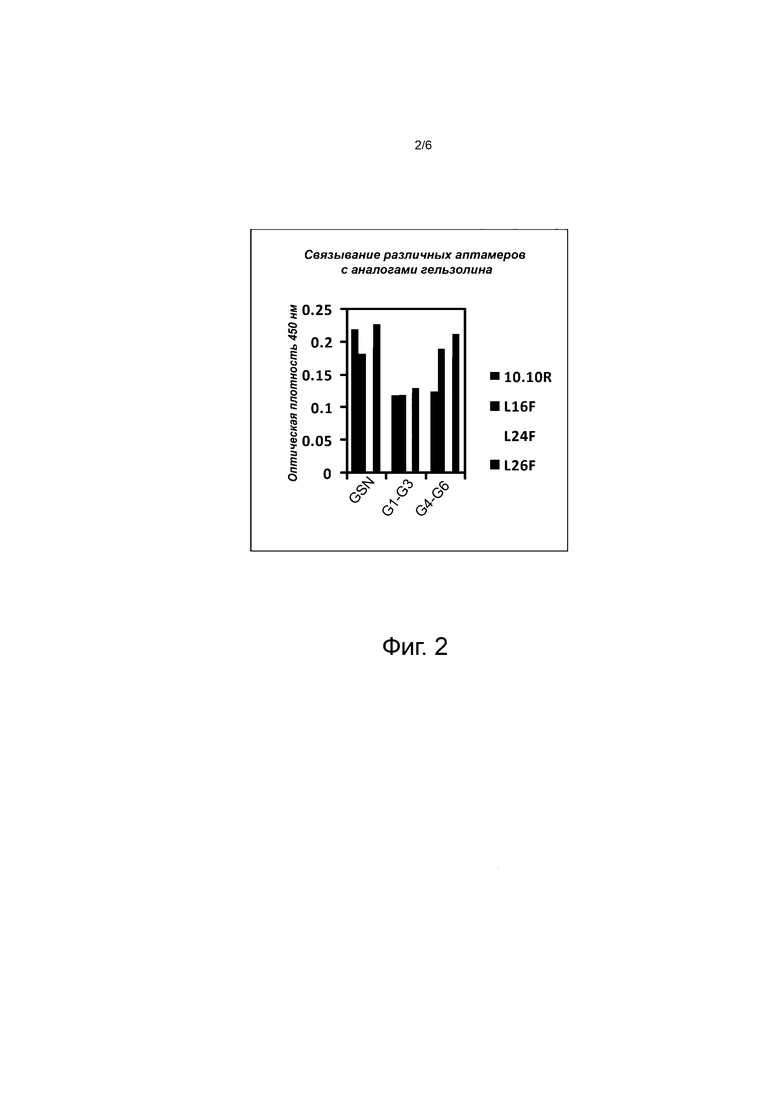
Фиг. 2 иллюстрирует связывающую способность различных аптамеров с гельзолином (GSN) и двумя его аналогами/половинами (G1-G3 и G4-G6) (SEQ ID No: 1, 2 и 3 соответственно). Показаны связывающие способности разных аптамеров, покрывающих дно лунок 96 –луночных планшетов для ИФА, с рекомбинантным гельзолином, определённые с помощью микротитровального анализа связывания. Основной результат, который демонстрирует эта фигура, заключается в том, что, гельзолин (GSN), G1-G3 и G4-G6 могут связываться со всеми заявляемыми аптамерами.
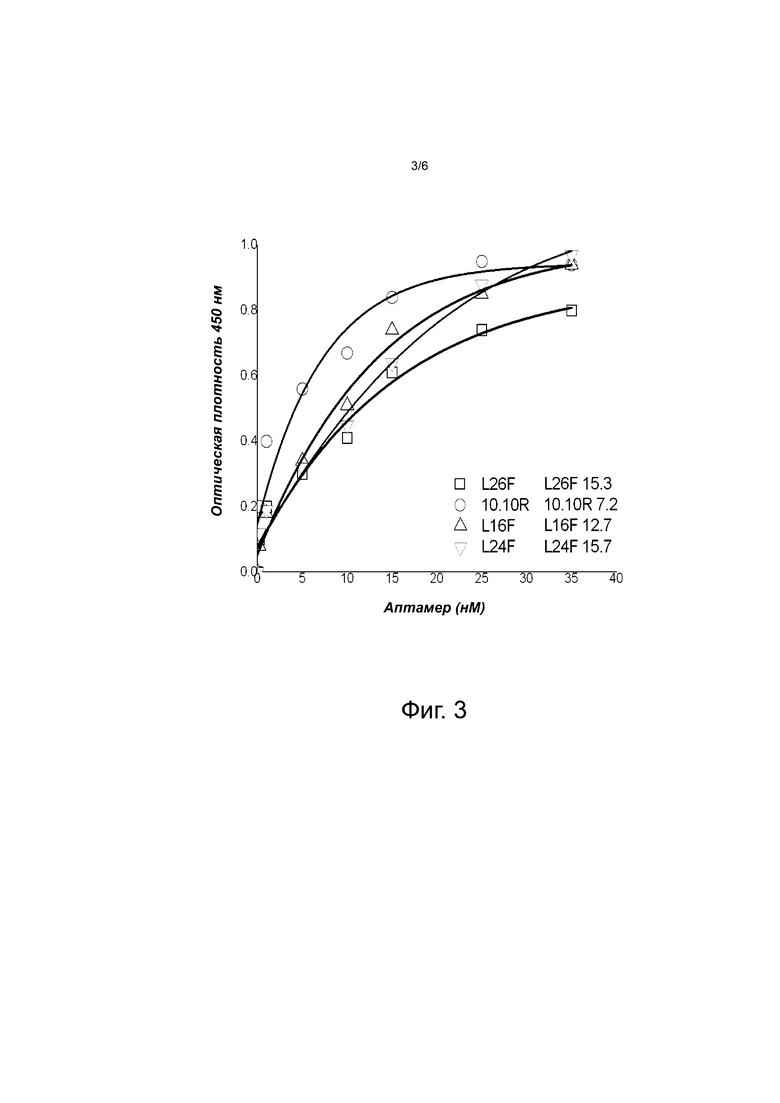
Фиг. 3 иллюстрирует связывающую способность аптамеров с гельзолином. Связывающие способности аптамеров с гельзолином были рассчитаны из кривой связывания аптамеров, покрывающих лунки планшета в различных концентрациях с фиксированной концентрацией гельзолина, определённой с помощью микротитровального анализа связывания. Ось x показывает концентрации заявляемых аптамеров в нМ (наномолях), а ось Y-оптическую плотность реакционной смеси, наблюдаемую экспериментально при 450 нм (нанометрах). Символы ☐, Δ, Ο и ∇ обозначают экспериментальные точки для разных используемых аптамеров. Значения рядом с аптамером - константы связывания (Kd) аптамера с гельзолином (GSN). Таким образом, результаты показывают, что L26F, 10.10R, L16F и L24F связываются с гельзолином с оцененными Kd, равными 15,3, 7.2, 12.7 и 15.7 нМ соответственно.
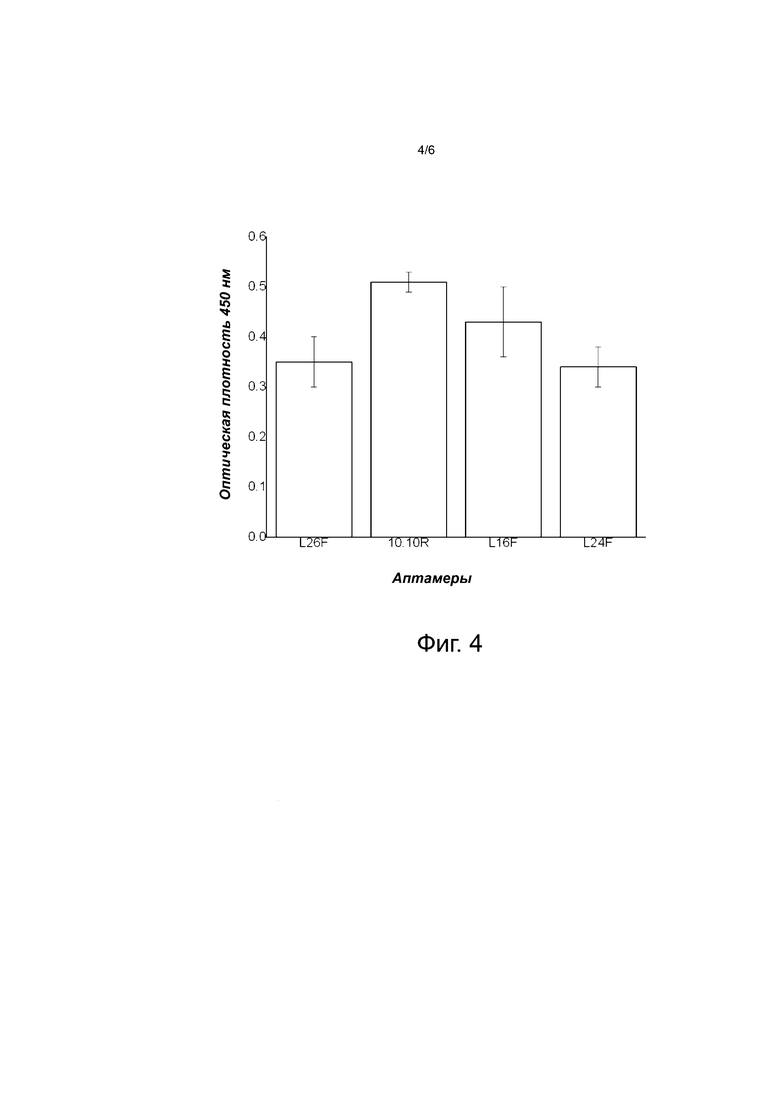
Фиг. 4 иллюстрирует связывание аптамеров с иммобилизованным гельзолином. Рекомбинантный гельзолин был нанесен на дно лунок планшета для ИФА и предоставлен возможности связывать аптамеры, меченные биотином. Связанные аптамеры затем были обнаружены с помощью конъюгата стрептавидина с пероксидазой хрена. На графике показано связывание выбранных аптамеров с иммобилизованным гельзолином. Очевидно, что заявляемые аптамеры могут связываться с иммобилизованным гельзолином, при этом L26F, L24F связываются с одинаковой эффективностью, и 10.10R связывается лучше по сравнению с L16F, который имеет промежуточную эффективность связывания. Эти результаты находятся в корреляции с результатами, демонстрирующими константы связывания, представленными на фиг. 3.
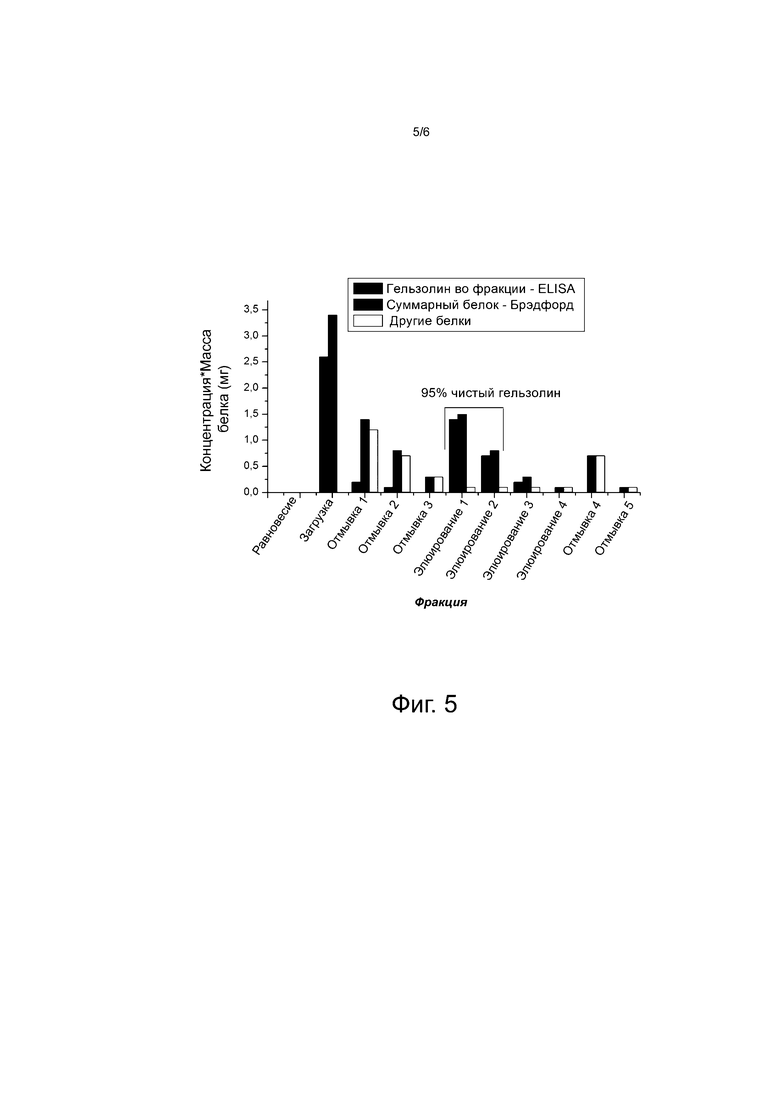
Фиг. 5 иллюстрирует очистку гельзолина, используя выбранные аптамеры, связанные с сефарозой. Результаты подтверждают, что используя заявленные аптамеры и подробно описанный протокол, можно получить гельзолин (GSN) 95% или более высокой чистоты.
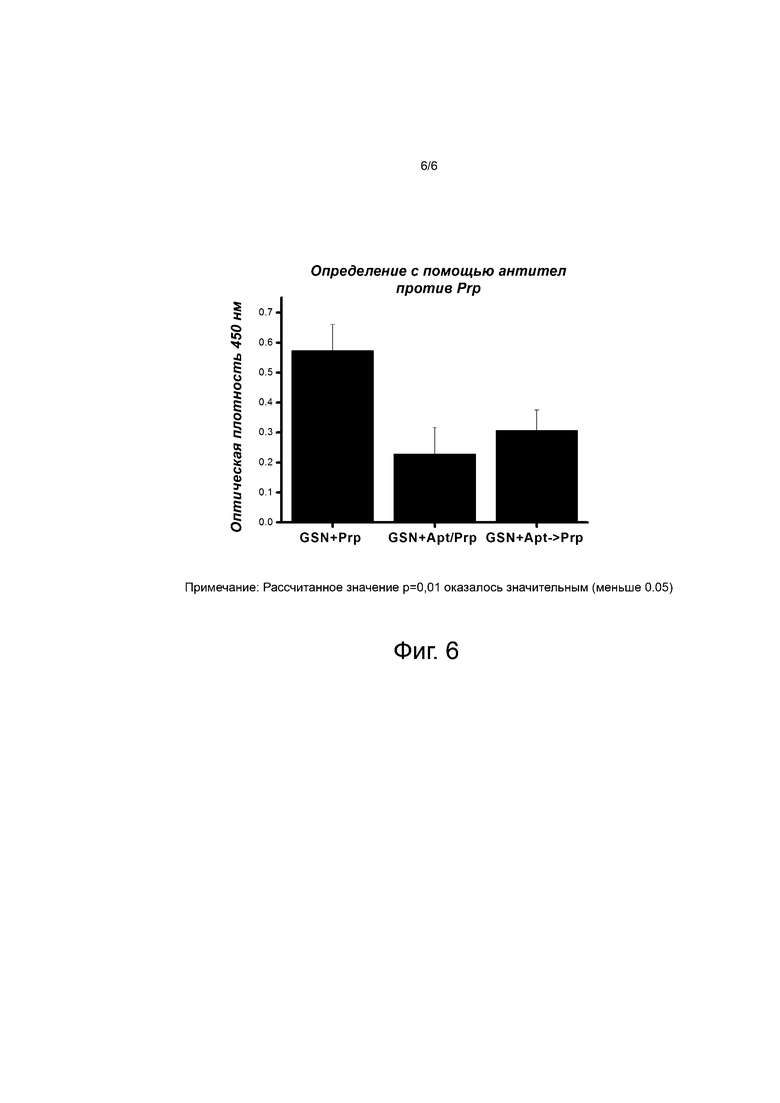
Фиг. 6 иллюстрирует, что выбранные аптамеры связываются с иммобилизованным гельзолином (GSN) и не позволяют ему связывать Prion, образуя белок Prp. GSN+Prp указывает на добавление Prion Prp белка (Prp)к гельзолину (GSN), иммобилизованному на планшете для ИФА при помощи покрытия моноклональными антителами против гельзолина; GSN+Apt/Prp указывает на добавление смеси Prp и одного из заявляемых аптамеров к иммобилизованному гельзолину; GSN+Apt->Prp указывает на добавление в начале Prp, а затем одного из заявляемых аптамеров к иммобилизованному гельзолину. Связанный Prp определяли с использованием анти- Prp антител кролика с последующим использованием вторичных антител к кроличьим антителам.
Список используемых сокращений
Осуществление изобретения
Снижение уровня плазменного гельзолина было зарегистрировано при различных заболеваниях, и присутствие экзогенного гельзолина в состоянии насыщения показало улучшение состояния на животных моделях ожогов и сепсиса. Можно предположить, что в будущем уровни гельзолина будут изучены для целого ряда медицинских случаев. Возможно, рекомбинантный гельзолин и его функциональные аналоги будут использоваться для терапевтических целей. Поэтому чрезвычайно важно предоставить новые объекты, которые могут связываться с гельзолином, а также разработать диагностический набор(ы) для определения плазменного гельзолина и способы очистки гельзолина и его аналогов. Новые ДНК-аптамеры, которые могут специфически и прочно связываться с гельзолином, помогут в разработке способов количественной оценки и очистки гельзолина и его аналогов, и в блокировании функционирования гельзолина в нежелательных путях, что предполагает потенциальную терапевтическую роль этих аптамеров. Здесь мы показываем, что эти аптамеры связываются с гельзолином и останавливают опосредованную гельзолином ассоциацию белка prion.
Настоящее изобретение описывает новые ДНК-аптамеры и способы использования их в качестве молекул, связывающих гельзолин. Настоящее изобретение впервые описывает специфические аптамеры, которые способны связываться с гельзолином.
Аптамеры представляют собой короткие ДНК/РНК/пептидные молекулы, которые могут специфически связываться с целевой молекулой (Pan & Clawson, 2009). Они обычно выявляются методом иррационального дизайна полинуклеотидов (SELEX) (систематическая Эволюция Лигандов путем Экспоненциального обогащения). Метод SELEX включает в себя экспонирование случайной библиотеки последовательностей перед специфической мишенью и амплификацию связавшихся молекул, которые затем подвергаются дополнительному раунду отбора. После нескольких раундов отбора специфические аптамеры, которые показали связывание с целевой молекулой, подвергаются различным модификациям для улучшения их аффинности и стабильности.
Гельзолин - это кальцийзависимый, многофункциональный актинсвязывающий белок, состоящий из шести доменов (G1-G6), который, как предполагается, возник вследствие события утроения с последующим дублированием исконного гена, кодирующего один домен (Kwiatkowski et al, 1986; Osborn et al, 2008). Он существует в трех изоформах, которые включают в себя две цитоплазматические изоформы и одну внеклеточную изоформу, секретируемую в плазму, все эти изоформы кодируются одним геном, расположенным у людей на 9 хромосоме. В разных тканях этот единственный ген подвергается альтернативной инициации транскрипции и селекции сайта сплайсинга, что приводит к различиям в аминоконцах изоформ (Kwiatkowski et al., 1988; Yin et al., 1984). Зрелый плазменный (секретируемый) гельзолин (плазменный GSN, образовавшийся после расщепления 27- основной аминоконцевой сигнальной последовательности) отличается от своего цитоплазматического аналога дополнительным уникальным начальным пептидом (24 аминокислоты) на своем N-конце (Kwiatkowski et al, 1986) и наличием дисульфидной связи, обеспечивающей дополнительную стабильность (Wen et al, 1996). Остальная часть полипептида идентична последовательности цитоплазматической формы (Kwiatkowski et al, 1986). Третья, менее существенная изоформа, называемая гельзолин-3, - несекретируемая форма, содержащая 11 дополнительных аминокислот на N-конце по сравнению с цитоплазматическим аналогом. В то время как цитоплазматический гельзолин экспрессируется в широком диапазоне тканей, гельзолин-3 экспрессируется преимущественно в олигодендроцитах в головном мозге, легких и яичке и участвует в ремоделировании миелина во время спирализации вокруг аксона (Vouyiouklis & Brophy, 1997). Плазменный GSN в основном продуцируется и секретируется в кровь мышечными клетками (Kwiatkowski et al, 1988).
Клиническое значение и важность для терапии плазменного гельзолина были хорошо проиллюстрированы в моделях на животных, а также на пациентах с различными заболеваниями. Значительное снижение уровня pGSN было задокументировано при различных заболеваниях: от мелких/крупных травм, инфекций до хронического воспаления (Peddada et al, 2012). Было показано, что пациенты с низким уровнем pGSN имеют более высокий уровень смертности, более длительное пребывание в больнице и в отделениях интенсивной терапии по сравнению со здоровым контролем. Было обнаружено, что уровень pGSN увеличивается у пациентов, выздоравливающих после болезней. Более того, было подтверждено, что перенасыщение экзогенным рекомбинантным гельзолином значительно повышает выживаемость в животных моделях при различных острых повреждениях (Lee et al, 2007). Однако, не зная точного уровня гельзолина в плазме здоровых лиц, а также пациентов, заместительная терапия гельзолином не может быть реальностью. До настоящего времени в литературе отсутствуют “диагностические методы” и, следовательно, наборы/протоколы, основанные на этих аптамерах, могут быть надежно использованы для определения уровня плазменного гельзолина у людей и животных для клинического применения.
Термин «диагностика», используемый в приведенном выше варианте осуществления, понимается, как процесс/метод определения значения данного объекта, которое могло бы помочь в выяснении причины/степени клинического состояния и, следовательно, может быть полезным для клинического применения, а также для исследовательских целей.
Фраза «данный образец», используемый в приведенном выше варианте осуществления, относится к любому биологическому образцу, который включает, но не ограничивается ими, кровь, сыворотку, плазму, мочу, слюну, полученную от человека или животных.
Фраза «плазменный гельзолин», используемый в приведенном выше варианте осуществления, относится к гельзолину, присутствующему в образце плазмы человека или животных.
Фраза «плазменный гельзолин», как использовано выше, относится к гельзолину, присутствующему в плазме человека/животного, который может быть смесью плазменной изоформы и других изоформ гельзолина, высвобождаемых в кровь вследствие клеточного некроза.
Плазменная изоформа гельзолина является изоформой гельзолина (белок), которая секретируется в кровь главным образом из мышечных клеток.
Фраза «клиническое применение» относится к знанию уровня гельзолина в данном образце человека/животного для определения наилучшей стратегии лечения человека/животного, из которого был получен данный «образец».
Используемый здесь термин “лечение” относится к подходу для получения полезных или желаемых результатов, включая клинические результаты. Полезные или желаемые клинические результаты могут включать, но не ограничиваются ими, облегчение или улучшение одного или нескольких симптомов или состояний, снижение степени заболевания, стабилизацию течения заболевания, замедление прогрессирования заболевания, а также увеличение продолжительности жизни по сравнению с ожидаемой продолжительностью жизни при отсутствии лечения.
Используемый здесь термин «функционализовать» относится к ковалентному связыванию ДНК-аптамеров на гранулах с диоксидом кремния/модифицированного диоксида кремния/агарозы/сефарозы посредством химической реакции.
Используемый здесь термин «аффинная хроматография» относится к связыванию и, таким образом, удержанию гельзолина из подвижной фазы на аптамерах в стационарной фазе хроматографического протокола.
Соответственно, основной вариант осуществления настоящего изобретения предоставляет новые ДНК-аптамеры, обозначенные как SEQ ID №№ 6-9.
В другом варианте осуществления настоящего изобретения предложены описанные здесь ДНК-аптамеры, способные связывать белок гельзолин, обозначенные как SEQ ID No. 1, или его аналоги, обозначенные как SEQ ID NO: 2 и 3.
В другом варианте осуществления настоящего изобретения предложены ДНК-аптамеры, описанные здесь, которые могут быть использованы для количественного определения уровня гельзолина в образце.
В другом варианте осуществления настоящего изобретения предложен способ количественного определения гельзолина в образце с использованием аптамеров, как описано здесь, где стадии включают:
[a] нанесение 1 мкг стрептавидина на подложку с использованием 100 мМ буфера NaHCO3, имеющего рН 9,2, в течение 10-12 ч при температуре 4°С;
[b] промывка покрытой подложки на стадии [a] PBS и блокирование 3% BSA в PBS в течение 2 часов с последующей промывкой PBS;
[с] иммобилизация 2 мкМ меченного биотином аптамера, выбранного из SEQ ID № 6-9, на подложку на стадии [b] с использованием ТЕ-буфера с рН 8, дополненного 2М NaCl, в течение 2 часов при комнатной температуре;
[d] промывка покрытой подложки на стадии [c] 2 раза PBS, содержащим 0,1% Tween-20;
[e] добавление гельзолина в диапазоне от 0,2 мкМ до 5 нМ или образца, разбавленного в буфере для селекции (selection buffer), содержащем 0,1% BSA, к подложке на стадии [d] и выдерживание в течение 2 часов;
[f] промывка покрытой подложки на стадии [e] 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением антител против гельзолина и инкубацией в течение 10-12 часов при 4°C;
[g] промывка подложки, полученной на стадии [f], 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением вторичных антител, конъюгированных с пероксидазой хрена, и инкубированием в течение 1 часа, а затем добавление субстрата для пероксидазы хрена;
[h] прекращение реакции стадии [g] после проявления синего цвета путём добавления 2М H2SO4 и измерение поглощения при 450 нм с целью определения количества присутствующего в образце гельзолина.
Еще один вариант осуществления настоящего изобретения обеспечивает способ количественного определения гельзолина в образце с использованием аптамеров, как описано здесь, где стадии включают:
[a] нанесение на подложку антител против гельзолина с использованием 100 мМ буфера NaHCO3, имеющего рН 9,2, в течение 10-12 часов при температуре 4°С;
[b] промывка покрытой подложки на стадии [a] PBS и блокирование 3% BSA в PBS в течение 2 часов с последующей промывкой PBS;
[c] добавление гельзолина в диапазоне от 0,2 мкМ до 5 нМ или образца, разбавленного в PBS, содержащем 0,1% BSA и 0,01% Tween-20, к подложке на стадии [b] и выдерживание в течение 2 часов при комнатной температуре;
[d] промывка покрытой подложки на стадии [c] 3 раза PBS, содержащим 0,1% Tween-20;
[e] добавление 1 мкМ меченного биотином аптамера, выбранного из SEQ ID № 6-9, разбавленного в буфере для селекции (selection buffer), содержащем 0,1% BSA, к подложке на стадии [d] и выдерживание в течение 2 часов;
[f] промывка покрытой подложки на стадии [e] 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением стрептавидина, конъюгированного с пероксидазой хрена, и инкубация в течение 1 часа с последующим добавлением субстрата для пероксидазы хрена;
[g] прекращение реакции стадии [f] после проявления синего цвета путём добавления 2M H2SO4 и измерение оптической плотности при 450 нм, с целью определения количества присутствующего в образце гельзолина.
Еще в одном варианте осуществления настоящего изобретения предложены ДНК-аптамеры, как описано здесь, которые могут быть использованы для очистки гельзолина из смеси.
Метод очистки гельзолина из смеси с помощью аптамеров, как описано здесь, где стадии включают:
[a] промывка CNBr активированных гранул Сефарозы ледяной дважды дистиллированной водой и добавление 10 мМ фосфата калия (pH 8) и 5'-фосфорилированных олигонуклеотидов для получения густой суспензии активированных гранул;
[b] перемешивание суспензии, полученной на стадии [a], при комнатной температуре в течение 14 часов и промывка 1 М фосфатом калия (pH 8), содержащим 1 М KCl;
[c] промывка гранул, полученных на стадии [b], водой, с последующим ресуспендированием в 10 мМ Трис-HCl (pH 8), содержащем 300 мМ NaCl, 1 мМ ЭДТА;
[d] выливание суспензии гранул, полученных на стадии [c], в колонку PD-10 и промывка тремя объемами колонки 40 мМ Трис-буфера с pH 8, содержащего 100 мМ NaCl и 2 мМ EGTA;
[e] добавление в колонку, полученную на стадии [d], клеточного лизата, содержащего гельзолин, с рН, доведенным до рН 8, и содержащим 2 мМ EGTA;
[f] промывка колонки на стадии [е], полученной после первоначальной загрузки, тремя объемами колонки 40 мМ Трис-буфера рН 8, содержащего 100 мМ NaCl и 3 мМ CaCl2;
[g] элюирование связанного гельзолина с колонки на стадии [f] добавлением 40 мМ Трис-буфера рН 8, содержащего 300 мМ NaCl и 20 мМ CaCl2.
В другом варианте осуществления настоящего изобретения предлагается набор для обнаружения гельзолина с использованием аптамеров, как описано здесь, где набор включает:
[a] твердую фазу, имеющую иммобилизованный на ней аптамер, выбранный из SEQ ID NO: 6-9;
[b] образец, содержащий гельзолин;
[c] детектирующие реагенты, содержащие антитела против гельзолина и вторичные антитела, конъюгированные с пероксидазой хрена, которые способны обнаруживать присутствие гельзолина.
Примеры
Следующие примеры приведены в качестве иллюстрации и поэтому не должны истолковываться как ограничение объема настоящего изобретения.
Пример 1. Идентификация ДНК-аптамеров, связывающих гельзолин
Производство рекомбинантного гельзолина и его аналогов:
Амплифицированный продукт кДНК-клона, полученный из NIH Mammalian Gene Collection- Human клона гена ID 4661084, расщепляли XbaI и XhoI и субклонировали в векторную основу pET303/CT-His (Invitrogen, NY, USA). Аналоги гельзолина генерировали сайт-направленным или делеционным мутагенезом, как описано ранее (Peddada et al, 2013). Последовательности субклонированной ДНК гельзолина подтверждали автоматическим секвенированием ДНК (Applied Biosystems, США). Полученные таким образом плазмиды использовали для трансформации E.coli BL21 (DE3), которая была коммерчески закуплена у M/s Invitrogen, USA, каталожный номер C6000-03, для экспрессии гетерологичного белка. Трансформированные бактерии, несущие pET303/Гельзолин и его мутанты, были депонированы в MTCC, Chandigarh, India, Международном Депозитарном Органе, признанном в соответствии с Будапештским договором, регистрационный номер MTCC5885 от 09/01/2014. Бактерии MTCC 5885 выращивали в бульоне LB (Merck, Германия) до плотности OD600 = 0,5 с последующей индукцией экспрессии рекомбинантного белка с 1 мМ изопропил-β-D-тиогалактозидом (IPTG) в течение 4-5 дополнительных часов. Выращенные белки очищали слабой анионообменной хроматографией (DE-52). Целевой белок иммобилизовали на CNBr активированные гранулы сефарозы следующим образом.
Связывание аффинного материала с гранулами сефарозы:
Белки (BSA и гельзолин) диализовали против буфера 100 мМ NaHCO3 с рН 9.0, и концентрацию оценивали путем измерения поглощения при 280 нм. CNBr активированную смолу оставляли для набухания в 1 мМ HCl в течение 15 мин при комнатной температуре и затем уравновешивали связывающим буфером (coupling buffer) (100 мМ NaHCO3, pH 9,0). После уравновешивания смолу немедленно переносили в раствор белка и инкубировали при перемешивании в течение ночи при 4°С. Гранулы собирали центрифугированием при 2000 х g в течение 1 мин и определяли концентрацию белка в надосадочной жидкости (она должна быть в 10 раз меньше, чем наблюдали на стадии 1). Гранулы промывали 3-4 раза связывающим буфером и затем инкубировали с блокирующим буфером, содержащим 1 М этаноламин в связывающем буфере в течение 2 часов при комнатной температуре. После инкубирования гранулы промывали 4 раза комбинацией буфера с низким рН и высоким рН и, наконец, 1XPBS, содержащим 0,01% азида натрия.
Скрининг для определения аптамеров против рекомбинантного гельзолина и его аналогов:
Коротко, 2 нмоль библиотеку 76 b олигонуклеотидов, включающую центральную область случайных нуклеотидов 30-mer (TriLink Biotechnologies, CA, USA), представляющую 1018 уникальных последовательностей, разводили в буфере для селекции (selection buffer) (25 мМ Трис-HCl, pH 8, 150 мМ NaCl , 2 мМ CaCl2, 5 мМ MgCl2 и 10 мМ KCl и 0,01% Tween20) и инкубировали при 94°С в течение 5 мин и выдерживали на льду в течение 10 мин с последующей инкубацией в течение 20 мин при комнатной температуре. Затем ДНК позволяли связываться с целевым белком (GSN), конъюгированным с гранулами сефарозы, в течение 1 часа при комнатной температуре. Полученную после элюирования ДНК очищали экстракцией фенолом-хлороформом, осаждали этанолом и ресуспендировали в 10 мкл ТЕ (10 мМ Трис-HCl, рН 8, 1 мМ ЭДТА). ДНК амплифицировали ПЦР в двух 50 мкл реакционных смесях, содержащих 2,5 ед. Taq ДНК-полимеразы, 1Х буфера Taq с (NH4)2SO4, 0,5 мкМ обоих селекционных праймеров (SEQ ID NO: 4 и 5), 2,5 мМ MgCl2, 0,2 мМ dNTP и 2,5 мкл матрицы (template). Условия амплификации составляли 2 минуты при 94°С, 15 циклов по 10 с при 94°С, 10 с при 62°С, 10 с при 72°С; 2 мин при 72°С. 90 мкл амплифицированной ДНК сначала подвергали отрицательной селекции с использованием гранул сефарозы, конъюгированных с BSA, а затем инкубировали с гранулами, конъюгированными с гельзолином, как ранее. После 10 циклов этого SELEX-метода (фиг. 1) обогащенную библиотеку аптамеров субклонировали с использованием набора для клонирования TOPO-TA (Invitrogen, NY, USA). Субклонированные аптамеры подвергали автоматическому секвенированию ДНК, и индивидуальные аптамеры амплифицировали с помощью ПЦР, как указано выше, для проверки способности связывать гельзолин и его аналоги микротитровальным анализом связывания.
Пример 2. Микротитровальный анализ связывания
Связывающую способность описанных здесь аптамеров (L26F, 10.10R, L16F и L24F) с рекомбинантным гельзолином и его N- и C-концевыми половинами [обозначенными, как SEQ ID NO: 2 и 3 соответственно] оценивали при помощи микротитровального анализа связывания (фиг. 2). (Последовательности аптамеров, связывающих гельзолин, обозначены SEQ ID № 6-9). Коротко, различные аптамеры (100 нМ) или актин (100 нМ), выделенный из куриных мышц (Peddada et al., 2013), использовали для покрытия 96-луночных планшетов для ИФА (ELISA) в TE (10 мМ Tris-HCl, pH 8, 1 мМ EDTA), дополненном 30% сульфатом аммония и 100 мМ буфере NaHCO3, рН 9,2, соответственно, в течение ночи при 4°С. Лунки промывали PBS и блокировали 300 мкл на лунку 3% BSA в фосфатно-буферном солевом растворе (PBS) в течение 2 часов при комнатной температуре. Лунки промывали PBS и давали возможность связываться со 100 нМ гельзолином, разведенным в буфере для селекции (selection buffer) в течение 2 ч при комнатной температуре. Затем лунки промывали 4 раза PBS, содержащим 0,1% Tween20 (PBS-T), и инкубировали с антителами против гельзолина в течение ночи при 4°C. Планшет промывали 4 раза PBS-T и инкубировали с вторичными антителами, конъюгированными с пероксидазой хрена при комнатной температуре в течение 30 мин, с последующим детектированием с использованием одношагового субстрата Ultra TMB (Pierce, Rockford, USA). Реакцию останавливали с помощью стоп-раствора (2М H2SO4) после того, как проявился синий цвет, и считывали поглощение при 450 нм с использованием микропланшетного ридера.
Пример 3. Определение аффинности аптамеров к гельзолину
Для определения аффинности различных аптамеров к гельзолину 1 мкг стрептавидина наносили на подложку с использованием 100 мМ буфера NaHCO3, имеющего рН 9,2, в течение 10-12 часов при температуре 4°С. Лунки промывали PBS и блокировали 3% BSA в PBS в течение 2 часов с последующей промывкой PBS. Аптамеры L26F (SEQ ID NO: 6), 10.10R (SEQ ID NO: 7), L16F (SEQ ID NO: 8) и L24F (SEQ ID NO: 9) иммобилизовывали в диапазоне концентраций от 100 нМ до 1,56 нМ на планшеты для ИФА (ELISA) с использованием Tris-EDTA, pH 8, дополненным 2М NaCl, в течение 2 часов. Лунки промывали PBS, содержащим 0,1% Tween 20, и давали возможность связываться со 100 нМ гельзолином, разведенным в буфере для селекции (selection buffer), в течение 2 часов при комнатной температуре. После промывки связанный гельзолин детектировали с использованием антител против гельзолина и вторичных антител, используя стандартные процедуры, как описано выше. Используя нелинейные аппроксимации точек экспериментальной кривой (фиг. 3), были определены значения констант диссоциации, Kd, аптамеров L26F, 10.10R, L16F и L24F для связывания с гельзолином, которые оказались равными: 15.3, 7.2, 12.7 и 15.7 нМ, соответственно. Аналогичные результаты были получены при использовании гидрофобной и/или гидрофильной поверхности, содержащей планшеты для ИФА (ELISA), что подтверждает равную эффективность иммобилизованных аптамеров связывать гельзолин и его аналоги из раствора.
Пример 4. Связывание аптамеров с иммобилизованным гельзолином.
На планшеты для ИФА (ELISА) наносили рекомбинантный гельзолин в концентрации 1,56 нМ в 100 мМ буфере NaHCO3, pH 9,2 при 4°С в течение ночи. Лунки промывали PBS и блокировали 300 мкл на лунку 3% BSA в PBS в течение 2 часов при комнатной температуре. Лунки промывали PBS и инкубировали с 50 нМ меченными биотином аптамерами, разведенными в буфере для селекции (selection buffer) в течение 2 ч при комнатной температуре. После промывки связанные аптамеры детектировали с использованием стрептавидин-пероксидазы хрена с использованием стандартных процедур (фиг. 4).
Пример 5. Связывание выбранных аптамеров с сефарозой и очистка гельзолина
Отобранные аптамеры связывали с гранулами сефарозы CL-2B с использованием протоколов активации и связывания CNBr, описанных ранее (Arndt-Jovin et al., 1975; Kadonaga & Tjian, 1986). Кратко, гранулы сефарозы активировали или дериватизировали с использованием CNBr, а затем промывали ледяной дважды дистиллированной водой и 10 мМ фосфатом калия (рН 8), и 5'-фосфорилированные олигонуклеотиды добавляли к густой суспензии активированных гранул. Смесь перемешивали при комнатной температуре в течение 14 часов и промывали 1М фосфатом калия (рН 8), 1 М KCl. Затем гранулы промывали водой, затем 10 мМ Трис-HCl (рН 8), содержащим 300 мМ NaCl, 1 мМ ЭДТА и 0,02% азида натрия. Функционализованные гранулы хранили при 10°С в последнем буфере.
Для экспериментов по очистке гельзолина суспензию гранул выливали в колонку PD-10 и промывали тремя объемами колонки 40 мМ Трис-буфера с pH 8, содержащего 100 мМ NaCl и 2 мМ EGTA. К этой колонке добавляли клеточный лизат с рН, доведенным до рН 8 и содержащим 2 мМ EGTA. После начальной загрузки колонку промывали 40 мМ Трис-буфером с pH 8, содержащим 100 мМ NaCl и 3 мМ CaCl2 (три объема колонки). В заключение, осуществляли элюирование добавлением 40 мМ Трис-буфера рН 8, содержащего 300 мМ NaCl и 20 мМ CaCl2. Каждую фракцию анализировали на наличие гельзолина. Результаты (фиг. 5) подтверждают, что гельзолин эффективно связывается с ДНК-иммобилизованной колонкой и элюируется при зондировании более высоких уровней ионов Ca2+. Окончательные условия загрузки и элюирования все еще разрабатываются для связывания и очистки гораздо более высоких уровней гельзолина. После элюирования гельзолина ДНК-сефарозу промывали 40 мМ буфером ацетата натрия с рН 4, содержащим 300 мМ NaCl. Колонку регенерировали промыванием 40 мМ буфером Tris pH 8, содержащим 100 мМ NaCl и 2 мМ EGTA, и предпринимали попытку второго цикла очистки. После промывки колонок 0,8 М NaCl и промывки колонок 10Х объемом 40 мМ Трис-буфера с pH 8, содержащим 100 мМ NaCl и 2 мМ ЭГТА, были сделаны пять раундов очистки с небольшой потерей эффективности в очистке немеченого гельзолина. Подобные профили очистки были получены после функционализации заявляемых аптамеров на других матриксах, как было проверено для агарозы, супердекса, сефадекса, сефакрила, сефакрила твердого текучего.
Пример 6. Отобранные аптамеры связываются с гельзолином и не позволяют ему связывать Prion, вызывая образование белка Prp
Гельзолин связывается с белком Prp и ускоряет образование прионов (неопубликованная работа). Используя структурный анализ данных и вестерн-блоттинг, мы подтвердили, что гельзолин непосредственно связывается с Prp. Позднее мы наблюдали, что аптамеры связываются с гельзолином (фиг. 6) и не позволяют ему связывать Prp, таким образом блокируя роль гельзолина в прогрессировании прионных заболеваний. В этих экспериментах ИФА (ELISA) проводили для того, чтобы проверить, может ли связывание аптамера (10.10R) с гельзолином ингибировать взаимодействие гельзолина с Prp. Сначала моноклональное антитело против гельзолина наносили на дно лунок для иммобилизации гельзолина (2 мкг/лунку). После промывки добавляли Prp и Аптамер + Prp (смесь). Кроме того, в некоторые лунки был добавлен аптамер с последующим добавлением PrP, так что аптамер и Prp в растворе могут конкурентно ингибировать их взаимодействие с гельзолином. Связанный Prp детектировали с использованием антитела против Prp (кролики, разведения 1: 1000), которые детектировали антителом против кроличьего IgG (1: 3000). Как упоминалось ранее, значения оптической плотности при 450 нм указывают степень связанного Prp, и результаты показали, что аптамер 10.10R может ингибировать взаимодействие гельзолина и Prp.
Преимущества изобретения
Хотя ранее сообщалось об использовании введения рекомбинантного гельзолина/его фрагментов для терапевтических целей при болезнях/состояниях здоровья, сопровождающихся гипогельзолинемией, не существует надежного и широко применяемого метода оценки уровня гельзолина или диагностического метода для терапевтических целей. Кроме того, создание эффективного протокола массового производства гельзолина (в частности, для конструкций, не содержащих никаких меток или групп для минимальной ступенчатой очистки) остается сложной задачей.
• Разработанные ДНК-аптамеры могут заменить потребность в антителах или актине, обеспечив экономическую эффективность и лучшую воспроизводимость результатов производства и на стадиях протокола без потери чувствительности и специфичности.
• Использование иммобилизованных аптамеров на хроматографическом материале для очистки гельзолина (или его аналогов), особенно после перепроизводства гельзолина или его аналогов, будет иметь существенное преимущество в очистке гельзолина, не содержащего аффинных меток, таких как his-tag, GST, MBP и т.д. В настоящее время минимальная ступенчатая очистка немеченого гельзолина осуществляется колонками, образованными иммобилизованными антигельзолиновыми антителами. Другая методология включает осаждение гельзолина с использованием сульфата аммония с последующим его аффинным связыванием на колонке DEAE, но этот способ требует 4-5 стадий, и существенными его недостатками являются значительная потеря белка и большая затрата времени в процессе извлечения из осажденного состояния.
Список литературы
Arndt-Jovin DJ, Jovin TM, Bahr W, Frischauf AM, Marquardt M (1975) Covalent attachment of DNA to agarose. Improved synthesis and use in affinity chromatography. European journal of biochemistry/FEBS 54: 411-418.
Ashish, Paine MS, Perryman PB, Yang L, Yin HL, Krueger JK (2007) Global structure changes associated with Ca2+ activation of full-length human plasma gelsolin. J Biol Chem 282: 25884-25892.
Bucki R, Byfield FJ, Kulakowska A, McCormick ME, Drozdowski W, Namiot Z, Hartung T, Janmey PA (2008) Extracellular gelsolin binds lipoteichoic acid and modulates cellular response to proinflammatory bacterial wall components. Journal of immunology 181: 4936-4944.
Bucki R, Georges PC, Espinassous Q, Funaki M, Pastore JJ, Chaby R, Janmey PA (2005) Inactivation of endotoxin by human plasma gelsolin. Biochemistry 44: 9590-9597.
Bucki R, Kulakowska A, Byfield FJ, Zendzian-Piotrowska M, Baranowski M, Marzec M, Winer JP, Ciccarelli NJ, Gorski J, Drozdowski W, Bittman R, Janmey PA (2010) Plasma gelsolin modulates cellular response to sphingosine 1-phosphate. American journal of physiology Cell physiology 299: C1516-1523.
Garg R, Peddada N, Sagar A, Nihalani D, Ashish (2011) Visual insight into how low pH alone can induce actin-severing ability in gelsolin under calcium-free conditions. J Biol Chem 286: 20387-20397.
Ito H, Kambe H, Kimura Y, Nakamura H, Hayashi E, Kishimoto T, Kishimoto S, Yamamoto H (1992) Depression of plasma gelsolin level during acute liver injury. Gastroenterology 102: 1686-1692.
Kadonaga JT, Tjian R (1986) Affinity purification of sequence-specific DNA binding proteins. Proceedings of the National Academy of Sciences of the United States of America 83: 5889-5893.
Kwiatkowski DJ, Mehl R, Izumo S, Nadal-Ginard B, Yin HL (1988) Muscle is the major source of plasma gelsolin. The Journal of biological chemistry 263: 8239-8243.
Kwiatkowski DJ, Stossel TP, Orkin SH, Mole JE, Colten HR, Yin HL (1986) Plasma and cytoplasmic gelsolins are encoded by a single gene and contain a duplicated actin-binding domain. Nature 323: 455-458.
Lee PS, Waxman AB, Cotich KL, Chung SW, Perrella MA, Stossel TP (2007) Plasma gelsolin is a marker and therapeutic agent in animal sepsis. Crit Care Med 35: 849-855.
Lee WM, Galbraith RM (1992) The extracellular actin-scavenger system and actin toxicity. N Engl J Med 326: 1335-1341.
Lind SE, Janmey PA (1984) Human plasma gelsolin binds to fibronectin. J Biol Chem 259: 13262-13266.
Lind SE, Smith DB, Janmey PA, Stossel TP (1988) Depression of gelsolin levels and detection of gelsolin-actin complexes in plasma of patients with acute lung injury. Am Rev Respir Dis 138: 429-434.
Lofberg M, Paunio T, Tahtela R, Kiuru S, Somer H (1998) Serum gelsolin and rhabdomyolysis. J Neurol Sci 157: 187-190.
Osborn TM, Dahlgren C, Hartwig JH, Stossel TP (2007) Modifications of cellular responses to lysophosphatidic acid and platelet-activating factor by plasma gelsolin. American journal of physiology Cell physiology 292: C1323-1330.
Osborn TM, Verdrengh M, Stossel TP, Tarkowski A, Bokarewa M (2008) Decreased levels of the gelsolin plasma isoform in patients with rheumatoid arthritis. Arthritis research & therapy 10: R117.
Pan W, Clawson GA (2009) The shorter the better: reducing fixed primer regions of oligonucleotide libraries for aptamer selection. Molecules 14: 1353-1369.
Peddada N, Sagar A, Ashish, Garg R (2012) Plasma gelsolin: a general prognostic marker of health. Med Hypotheses 78: 203-210.
Peddada N, Sagar A, Rathore YS, Choudhary V, Pattnaik UB, Khatri N, Garg R, Ashish (2013) Global shapes of F-actin depolymerization-competent minimal gelsolins: insight into the role of g2-g3 linker in pH/Ca2+ insensitivity of the first half. J Biol Chem 288: 28266-28282.
Smith DB, Janmey PA, Sherwood JA, Howard RJ, Lind SE (1988) Decreased plasma gelsolin levels in patients with Plasmodium falciparum malaria: a consequence of hemolysis? Blood 72: 214-218.
Suhler E, Lin W, Yin HL, Lee WM (1997) Decreased plasma gelsolin concentrations in acute liver failure, myocardial infarction, septic shock, and myonecrosis. Crit Care Med 25: 594-598.
Sun HQ, Yamamoto M, Mejillano M, Yin HL (1999) Gelsolin, a multifunctional actin regulatory protein. The Journal of biological chemistry 274: 33179-33182.
Vouyiouklis DA, Brophy PJ (1997) A novel gelsolin isoform expressed by oligodendrocytes in the central nervous system. Journal of neurochemistry 69: 995-1005.
Wen D, Corina K, Chow EP, Miller S, Janmey PA, Pepinsky RB (1996). The plasma and cytoplasmic forms of human gelsolin differ in disulfide structure. Biochemistry 35: 9700-9709.
Yin HL, Kwiatkowski DJ, Mole JE, Cole FS (1984) Structure and biosynthesis of cytoplasmic and secreted variants of gelsolin. J Biol Chem 259: 5271-5276.
Yin HL, Stull JT (1999) Proteins that regulate dynamic actin remodeling in response to membrane signaling minireview series. The Journal of biological chemistry 274: 32529-32530.
Yu FX, Zhou DM, Yin HL (1991) Chimeric and truncated gCap39 elucidate the requirements for actin filament severing and end capping by the gelsolin family of proteins. J Biol Chem 266: 19269-19275.
| название | год | авторы | номер документа |
|---|---|---|---|
| ДНК-аптамер, специфично связывающийся с белком Dickkopf-1 человека | 2023 |
|
RU2814580C1 |
| СПОСОБ ДЕТЕКЦИИ БЕЛКОВ В АМИЛОИДНОМ СОСТОЯНИИ И НАБОР ДЛЯ ДЕТЕКЦИИ БЕЛКОВ В АМИЛОИДНОМ СОСТОЯНИИ | 2012 |
|
RU2509155C1 |
| ДНК-аптамер, связывающий внеклеточный домен EGFR | 2018 |
|
RU2700097C1 |
| МЫШИНЫЕ МОНОКЛОНАЛЬНЫЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С АНТИГЕНОМ F1 ИЗ Yersinia pestis, СПОСОБ ИХ ПОЛУЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ, СПОСОБ И НАБОР ДЛЯ ДЕТЕКЦИИ Yersinia pestis | 2009 |
|
RU2420588C2 |
| АНТАГОНИСТЫ PCSK9 | 2009 |
|
RU2528735C2 |
| СПОСОБ ПОЛУЧЕНИЯ ТЕРАПЕВТИЧЕСКОГО АГЕНТА ДЛЯ ЛЕЧЕНИЯ КЛЕЩЕВОГО ЭНЦЕФАЛИТА | 2012 |
|
RU2501862C1 |
| АНТАГОНИСТЫ PCSK9 | 2014 |
|
RU2618869C2 |
| SDF-1-СВЯЗЫВАЮЩИЕ НУКЛЕИНОВЫЕ КИСЛОТЫ | 2007 |
|
RU2590709C2 |
| СПОСОБ И НАБОР ДЛЯ ВЫЯВЛЕНИЯ ГЕНА, КОДИРУЮЩЕГО МЕМБРАНОСВЯЗАННЫЙ БЕЛОК, ВЕКТОР (ВАРИАНТЫ) | 1999 |
|
RU2246538C2 |
| ГИБРИДОМА, ОБОЗНАЧЕННАЯ 199М, И МОНОКЛОНАЛЬНОЕ АНТИТЕЛО, СЕКРЕТИРОВАННОЕ ЭТОЙ ГИБРИДОМОЙ | 1997 |
|
RU2183671C2 |
Настоящее изобретение относится к новым ДНК-аптамерам, способным прочно и специфически связываться с гельзолином. Кроме того, изобретение относится к применению этих аптамеров для оценки уровня гельзолина в данном образце и для очистки немеченного гельзолина и его аналогов в большом объёме. Таким образом, настоящее изобретение исключает использование разных животных или их тканей для получения белков, связывающих гельзолин, которое является намного более дорогостоящим и социально неприемлемым способом в отличие от синтеза молекулы ДНК с помощью ПЦР in vitro. Используя эту стратегию, массовое производство гельзолин-связывающего матрикса может быть осуществлено с гораздо меньшими затратами. Кроме того, аптамеры могут быть использованы для блокирования связывания гельзолина с его партнерами для связывания с целью диагностического и/или терапевтического применения. 5 н. и 2 з.п. ф-лы, 6 ил., 6 пр.
1. ДНК-аптамеры, обозначенные SEQ ID № 6-9, связывающие белок-гельзолин, представленные SEQ ID No. 1, или его аналоги, представленные SEQ ID NO: 2 и 3.
2. ДНК-аптамеры по п. 1, полезные для количественного определения уровня гельзолина в образце.
3. Способ количественного определения гельзолина в образце с использованием ДНК-аптамеров, обозначенных SEQ ID № 6-9, по п. 1, включающий стадии:
[a] нанесение 1 мкг стрептавидина на подложку с использованием 100 мМ буфера NaHCO3, имеющего рН 9,2, в течение 10-12 ч при температуре 4°С;
[b] промывка покрытой подложки на стадии [a] PBS и блокирование 3% BSA в PBS в течение 2 часов с последующей промывкой PBS;
[с] иммобилизация 2 мкМ меченного биотином аптамера, выбранного из SEQ ID № 6-9, на подложку на стадии [b] с использованием ТЕ-буфера с рН 8, дополненного 2М NaCl, в течение 2 часов при комнатной температуре;
[d] промывка покрытой подложки на стадии [c] 2 раза PBS, содержащим 0,1% Tween-20;
[e] добавление гельзолина в диапазоне от 0,2 мкМ до 5 нМ или образца, разбавленного в буфере для селекции (selection buffer), содержащем 0,1% BSA, к подложке на стадии [d] и выдерживание в течение 2 часов;
[f] промывка покрытой подложки на стадии [e] 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением антител против гельзолина и инкубацией в течение 10-12 часов при 4ºC;
[g] промывка подложки, полученной на стадии [f], 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением вторичных антител, конъюгированных с пероксидазой хрена, и инкубированием в течение 1 часа, а затем добавление субстрата для пероксидазы хрена;
[h] прекращение реакции стадии [g] после проявления синего цвета путём добавления 2М H2SO4 и измерение поглощения при 450 нм с целью определения количества присутствующего в образце гельзолина.
4. Способ количественного определения гельзолина в образце с использованием аптамеров, обозначенных SEQ ID № 6-9, по п. 1, включающий стадии:
[a] нанесение на подложку антител против гельзолина с использованием 100 мМ буфера NaHCO3, имеющего рН 9,2, в течение 10-12 часов при температуре 4°С;
[b] промывка покрытой подложки на стадии [a] PBS и блокирование 3% BSA в PBS в течение 2 часов с последующей промывкой PBS;
[c] добавление гельзолина в диапазоне от 0,2 мкМ до 5 нМ или образца, разбавленного в PBS, содержащем 0,1% BSA и 0,01% Tween-20, к подложке на стадии [b] и выдерживание в течение 2 часов при комнатной температуре;
[d] промывка покрытой подложки на стадии [c] 3 раза PBS, содержащим 0,1% Tween-20;
[e] добавление 1 мкМ меченного биотином аптамера, выбранного из SEQ ID № 6-9, разбавленного в буфере для селекции (selection buffer), содержащем 0,1% BSA, к подложке на стадии [d] и выдерживание в течение 2 часов;
[f] промывка покрытой подложки на стадии [e] 4 раза PBS, содержащим 0,1% Tween-20, с последующим добавлением стрептавидина, конъюгированного с пероксидазой хрена, и инкубация в течение 1 часа с последующим добавлением субстрата для пероксидазы хрена;
[g] прекращение реакции стадии [f] после проявления синего цвета путём добавления 2M H2SO4 и измерение оптической плотности при 450 нм с целью определения количества присутствующего в образце гельзолина.
5. ДНК-аптамеры, обозначенные SEQ ID № 6-9, по п. 1, используемые для очистки гельзолина из смеси.
6. Способ очистки гельзолина из смеси с использованием аптамеров, обозначенных SEQ ID № 6-9, по п. 1, включающий стадии:
[a] промывка CNBr активированных гранул Сефарозы ледяной бидистиллированной водой, имеющей температуру в интервале 0-4оС, и добавление 10 мМ фосфата калия (pH 8) и 5'-фосфорилированных аптамеров для получения густой суспензии активированных гранул;
[b] перемешивание суспензии, полученной на стадии [a], при комнатной температуре в течение 14 часов и промывка 1 М фосфатом калия (pH 8), содержащим 1 М KCl;
[c] промывка гранул, полученных на стадии [b], водой, с последующим ресуспендированием в 10 мМ Трис-HCl (pH 8), содержащем 300 мМ NaCl, 1 мМ ЭДТА;
[d] выливание суспензии гранул, полученных на стадии [c], в колонку PD-10 и промывка тремя объемами колонки 40 мМ Трис-буфера с pH 8, содержащего 100 мМ NaCl и 2 мМ EGTA;
[e] добавление в колонку, полученную на стадии [d], клеточного лизата, содержащего гельзолин, с рН, доведенным до рН 8, и содержащим 2 мМ EGTA;
[f] промывка колонки на стадии [е], полученной после первоначальной загрузки, тремя объемами колонки 40 мМ Трис-буфера рН 8, содержащего 100 мМ NaCl и 3 мМ CaCl2;
[g] элюирование связанного гельзолина с колонки на стадии [f] добавлением 40 мМ Трис-буфера рН 8, содержащего 300 мМ NaCl и 20 мМ CaCl2.
7. Набор для обнаружения гельзолина с использованием ДНК-аптамеров, обозначенных SEQ ID № 6-9, по п.1, который включает:
[a] твердую фазу, имеющую иммобилизованный на ней аптамер, выбранный из SEQ ID № 6-9;
[b] образец, содержащий гельзолин, имеющий концентрацию 50-250 нг;
[c] детектирующие реагенты, содержащие антитела против гельзолина и вторичные антитела, конъюгированные с пероксидазой хрена, которые способны обнаруживать присутствие гельзолина.
| Способ регулирования пламенных печей | 1954 |
|
SU117150A1 |
| Sun H | |||
| Q | |||
| et al | |||
| Gelsolin, a multifunctional actin regulatory protein //Journal of Biological Chemistry | |||
| Металлический водоудерживающий щит висячей системы | 1922 |
|
SU1999A1 |
| - Vol | |||
| ТЕЛЕФОННЫЙ АППАРАТ, ОТЗЫВАЮЩИЙСЯ ТОЛЬКО НА ВХОДЯЩИЕ ТОКИ | 1920 |
|
SU274A1 |
| - n | |||
| Способ очищения сернокислого глинозема от железа | 1920 |
|
SU47A1 |
| - P | |||
| Приспособление для перевода стрелок с движущейся повозки | 1930 |
|
SU33179A1 |
Авторы
Даты
2018-02-08—Публикация
2015-10-05—Подача