Изобретение относится к биотехнологии и описывает сочетанный способ очистки и ренатурации белка G, который может использоваться при создании специфических иммунодиагностических и иммунопрофилактических средств.
Известны многочисленные методы очистки белков, включающие, в том числе, электроэлюцию из агарозных и полиакриламидных гелей, которые широко распространены в повседневной лабораторной практике [Михайлов А.Т., Симирский В.Н. Методы иммунохимического анализа в биологии развития. - М.: Наука, 1991. - 290 с., Финдлей Д.Б. Биологические мембраны: Методы / Под ред. Дж. Финдлея, У. Эванза. М.: Мир, 1990. С. 271-273]. Их популярность связана с возможностью наработать некоторые необходимые для исследователей количества белка и избегать при этом трудоемких этапов выделения индивидуальных белков как и фрагментов ДНК (для выделения последних электроэлюция применяется значительно чаще). При очистке белков электроэлюция может не только выступать в качестве единственного и самостоятельного метода выделения, но и дополняется в некоторых случаях хроматографией, дифференциальным осажденим и другими.
Известны ренатурационные способы, имеющие одно принципиальное сходство, которое заключается в разбавлении концентрированного раствора денатурированного белка специальными буферами, что сопровождается образованием нативной, биологически активной структурой полипептида [Richard R, Burgess 2009. Meth Enzym 463: 259-281].
К настоящему времени опубликованы многочисленные протоколы ренатурации отдельных белков способом, в основе которого лежит разведение ренатурационных растворов, однако, метод имеет несколько существенных недостатков [Cabrita LD, Bottomley SP. 2004. Biotech Ann Rev 10: 31-49]. Известна альтернативная техника перевода белков в растворы с низкой ионной силой, использующая диализ или ультрафильтрацию [Yoshii Н, Furuta Т, Yonehara Т, Ito D, Linko Y-Y, Linko P: Biosci Biotechnol Biochem 2000, 64:1159-1165].
Предложен ряд методических подходов, имеющих целью преодолеть концентрационный барьер [Li М, Poliakov A, Danielson UH, Su Z, Janson JC: Biotechnol Lett 2003, 5:1729-1734].
Однако все вышеуказанные методы приводят к агрегации, очень низкому выходу и сильному разбавлению конечного раствора.
Технический результат предлагаемого изобретения заключается в том, что не изменяется антигенная и функциональная активность белка, что сохраняет иммунобиологические и функциональные свойства очищенного белка и позволяет включать его в состав иммунохимических тест-систем.
Технический результат достигается путем получения очищенного белка при помощи препаративного электрофореза в денатурирующих условиях в присутствии додецилсульфата натрия с последующей ренатурацией в геле и электороэлюции биологически активного восстановленного белка, а ренатурация биологически активной третичной структуры белка G оценивается по восстановлению его антителсвязывающей способности в иммунохимических тестах.
Технический результат достигается тем, что лизированную бактериальную культуру, продуцировавшую белок G преимущественно в составе телец включения, центрифугируют в течение 15 мин при 1500×g. Полученный осадок переосаждают при тех же условиях при 10°С, ресуспендируют в растворе 8 М мочевины, содержащем 10 мM Трис-HCI (рН 8,0) и 1,5 мM ЭДТА и перемешивают длительное время для наиболее полного растворения. Полученную суспензию центрифугируют при 14000×g в течение 30 мин и 12°С. Отбирают надосадочную фракцию и используют ее для фракционирования белков при помощи препаративного электрофореза в полиакриламидном геле в редуцирующих условиях (ДСН-ПААГ). По завершении электрофореза гели подвергают экспресс окраске холодным 0,4 М раствором калия хлористого с целью экспресс-идентификации. Идентифицированную полосу белка G вырезают из геля и промывают денатурирующим буфером, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 1% Тритон Х-100, 6 М мочевину, 2 М тиомочевину в течение 1 час, после чего погружают гель в ренатурационный буфер, содержащий 20 мМ Трис (рН 8.0), 100 мМ NaCl, 2 мМ сульфобетаин, 1 мМ ЭДТА. Ренатурацию проводят при умеренном перемешивании емкости с гелем в течение 3 час при 20°С, буфер меняют три раза, строго контролируя его температуру, после чего промывают деионизованной водой и замораживают при - 80°С или жидким азотом. Гель измельчают в замороженном состоянии и проводят электроэлюцию ренатурированного белка в течение 2 час и силой тока 200 мА в буферном растворе, содержащем 10 мМ калий-фосфатный буфер (рН 7,5). Элюированный белок концентрируют ультрафильтрацией над мембраной YM-10 и диализуют против того же буфера, раствор меняют три раза. Полученный таким образом белок G представляет собой высокоочищенный препарат, обладающий присущими ему иммунобиологическими свойствами.
Изобретение иллюстрируется следующими фигурами:
Фиг. 1. Электрофорез препаратов белка G на различных этапах выделения.
Фиг. 2. Иммуноферментный анализ препаратов белка G.
Фиг. 3. Непрямой твердофазный иммуноферментный анализ препаратов белка G.
Фиг. 4. Электрофорез и иммуноблот белка G, обработанный различными иммуноглобулинами.
Фиг. 5. Определение иммунохимических свойств ренатурированного белка G при помощи дот-блота по схеме иммуноблота с электропереносом белков после электрофореза в ДСН-ПААГ.
Фиг. 6. Определение иммунохимических свойств ренатурированного белка G при помощи дот-блота.
Фиг. 7. Определение иммунохимических свойств ренатурированного белка G при помощи непрямого дот-блота с исключением возможного неспецифического взаимодействия конъюгатов и белка G.
Пример 1. Условия ренатурации белка G.
Применение электрофореза позволяет решить две задачи: во-первых, разделить сложную белковую смесь с выделением зоны, содержащей гомогенный белок, и, во-вторых, создать условия, ограничивающие подвижность молекул белка и предотвратить агрегацию в процессе ренатурации. Предварительные опыты показали, что приемлемое разрешение белков электрофорезом достигается при нанесении на препаративный мини-гель 250 мкл препарата белков, растворенных в 8 М мочевине. Маркировку геля проводят при помощи предокрашенных белковых маркеров молекулярных масс, которые вносят в отдельный колодец препаративного мини-геля. После одновременного разделения маркеров и образца, находящегося в препаративной части геля, полосу с маркерами отделяют, окрашивают препаративную часть отдельно, используя раствор хлористого калия, после чего сопоставляют разделенные части геля для точной идентификации положения белка G.
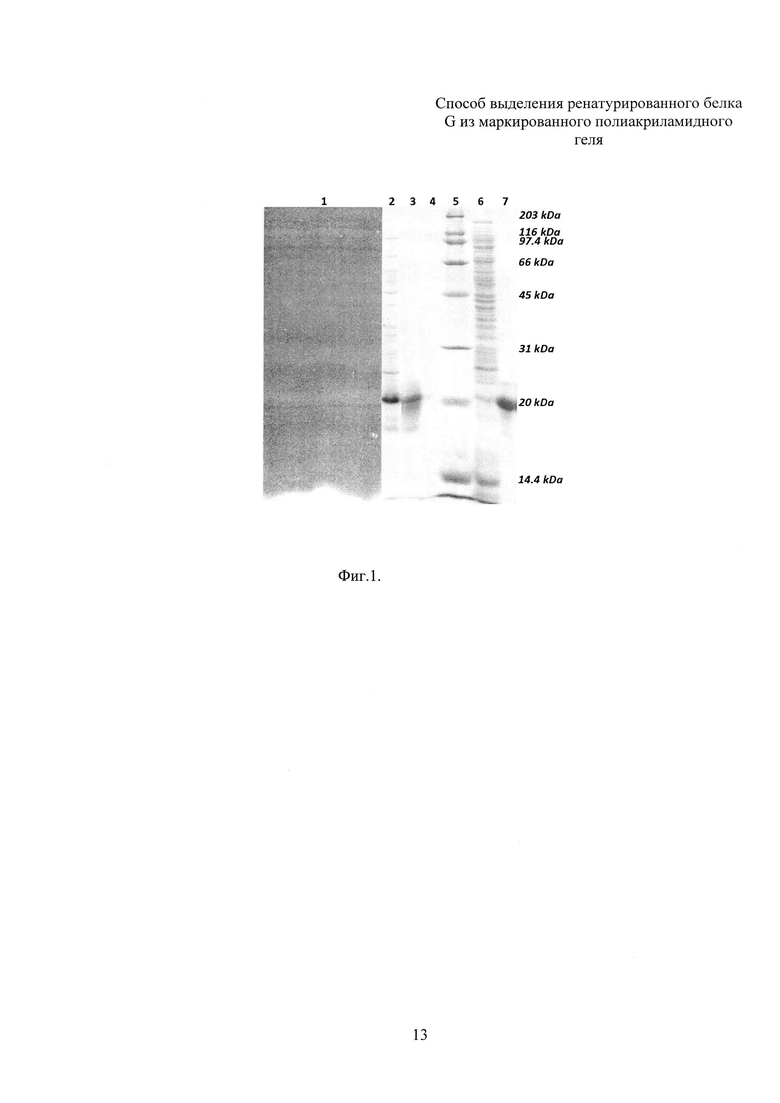
Для экспресс-окраски и идентификации термоденатурированного ДСН белка G, находящегося в составе геля, используют обработку холодным 0,4 М раствором калия хлористого (Фиг. 1, линия 1. Числами в верхней части фигуры обозначены линии: 1 - фрагмент геля, окрашенный хлористым калием после разделения клеточного лизата, содержащего белок G; 2 - клеточный лизат; 3 - белок G, ренатурированный и выделенный из фрагмента геля; 4 - препарат как в линии 3, разведенный в 15 раз; 5 - маркеры молекулярных масс, числовые значения приведены в правой части фигуры и выражены в килодальтонах; 6 - надосадочная фракция клеточного лизата, содержащая растворимые белки; 7 - белок G, выделенный из растворимой фракции клеточного лизата при помощи аффинной хроматографии на IgG Sepharose® 6 FF с привитыми иммуноглобулинами человека из нормальной сыворотки крови).
Идентифицированную полосу белка G вырезают из геля и насыщают буфером, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 1% Тритон Х-100, 6 М мочевину и 2 М тиомочевину в течение 1 час, при этом происходит удаление хлористого калия, замещение ДСН тритоном Х-100, а 6 М мочевина в составе буферного раствора поддерживает денатурирующие условия для молекул белка G. Гель помещают в ренатурационный буфер, содержащий 20 мМ Трис (рН 8.0), 100 мМ NaCl, 2 мМ сульфобетаин, 1 мМ ЭДТА. Ренатурацию проводят с контролем температуры в течение 3 час при 20°С при умеренном перемешивании емкости с гелем и трехкратной сменой буфера, после чего промывают деионизованной водой, замораживают, измельчают в замороженном состоянии и проводят электроэлюцию ренатурированного белка из диспергированного геля в течение 2 час и силой тока 200 мА в буферном растворе, содержащем 10 мМ калий-фосфатный буфер (рН 7,5). Результаты электроэлюции контролируют ДСН-ПААГ (Фиг. 1). Было выделено до 1,8 мг белка G после электрофореза в геле мини-формата с использованием аппарата MiniVE, GE Healthcare, ренатурации и электроэлюции. Функциональную активность очищенного и ренатурированного белка G в дальнейшем подтверждают иммуноферментным анализом и иммуноблотами.
Пример 2. Применение буферного раствора с увеличенной концентрацией денатурирующего компонента.
Электрофорез проводят как в примере 1, вместе с тем, для растворения препарата белков используют буфер состава - 125 мМ трис-HCl, рН 6,8, 4% додецилсульфата натрия (SDS), 20% глицерина, 10% 2-меркаптоэтанола и 0,02% бромфенолового синего. Растворение белков достигается прогреванием проб, суспензированных в этом буфере в объемном соотношении 1:1 в течение 15 мин [Laemmli, U.K. (1970). Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227 (5259): 680-685]. Определяют положение полосы белка G, вырезают ее из геля и помещают для насыщения в буферный раствор, содержащий 25 мМ Трис (рН 8.0-8.2), 1% Тритон Х-100 и 8 М мочевину в течение 1-2 час, в результате чего происходит удаление хлористого калия, введенного для обратимой окраски геля, замещение ДСН тритоном Х-100, а 8 М мочевина в составе денатурирующего буферного раствора поддерживает условия, при которых полипептидные цепи молекулы белка G находятся в «развернутом» состоянии. Гель с денатурированным белком помещают в ренатурационный буфер, содержащий 25 мМ Трис (рН 8.0), 150 мМ NaCl, 0,02% твин-80, 1 мМ ЭДТА и инкубируют при умеренном перемешивании буфера в емкости с гелем в течение 18 час при 12-14°С. Объем буфера должен не менее чем в 200 раз превосходить объем полоски геля. Полученные результаты аналогичны примеру 1.
Пример 3. Использование буферных растворов с компонентами, обеспечивающими тиол-дисульфидное равновесие.
Электрофорез проводят как в предыдущих примерах, однако, для обработки гелевых полос, содержащих белок G, используют буферные растворы, которые на этапе денатурации обеспечивают расщепление возможных дисульфидных связей между цистеинами полипептидной цепи, а на этапе ренатурации - их восстановление. Денатурирующий буфер содержит 20 мМ Трис (рН 8.0), 8 М мочевину, 0,3% саркозил, 20 мМ CHAPS и 10 мМ 2-меркаптоэтанол. Для ренатурации белка полоску геля помещают в 200-кратный избыток (по объему) буферного раствора, содержащего 20 мМ Трис (рН 8.0), 150 мМ натрия хлористого, 20 мМ CHAPS, 5 мМ цистеина и 50 мМ цистина. Перед этим этапом температура буферного раствора должна быть обязательно доведена до 18°С. Наличие в буфере цистеин/цистиновой пары, слабощелочная среда, умеренная температура и продолжительная инкубация (не менее 12 час) способствуют восстановлению дисульфижных связей. Полученные результаты аналогичны примеру 1.
Пример 4. Твердофазный иммуноферментный анализ.
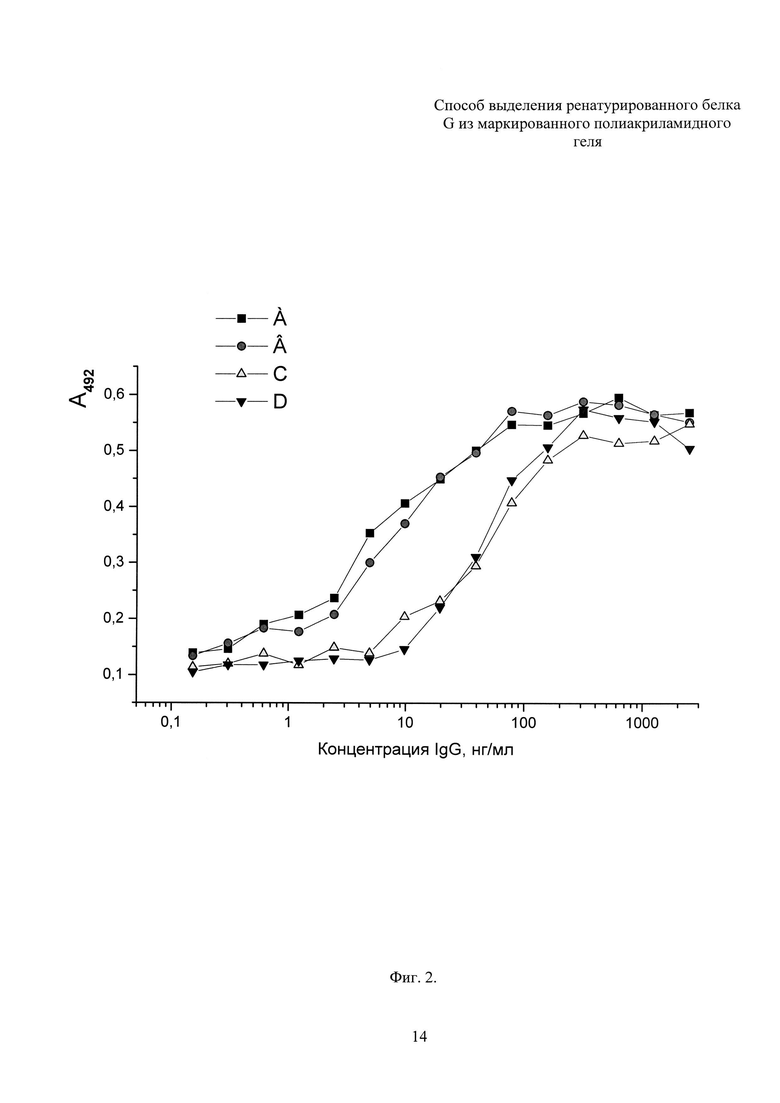
Планшеты (96 лунок) сенсибилизируют последовательным внесением в каждую лунку 100 мкл раствора, содержащего 0,1 М карбонатный буфер (рН 9,6) и 800 нг белка G с инкубацией при температуре 6°С в течение 18 час, после чего проводят четырехкратную промывку 10 мМ фосфатно-солевым буферным раствором (рН 7,2), содержащим 0,05% твина-20 (ФСБТ). Неспецифическую сорбцию блокируют 1% раствором бычьего сывороточного альбумина в ФСБТ в течение 2 час при 37°С, причем на этом этапе объем наполнения лунок составлял 120 мкл. Лунки промывают, как описано ранее, но трехкратно, после чего сразу же наполняют предварительно приготовленными растворами нормальных иммуноглобулинов кролика в ФСБТ. Иммуноглобулины разводят, начиная с наибольшей концентрации, составлявшей 2500 нг/мл с кратностью разведения 2,5. Последующие стадии анализа проводят аналогично с включением промежуточных промывок ФСБТ между каждой инкубацией. Этапы включали инкубацию с раствором биотинилированных антикроличьих F(ab)2 фрагментов антител (1:3000, 2 час, 37°С) в ФСБТ, с раствором стрептавидин-пероксидазы (1:4000, 1 час, 37°С), визуализацию субстратом и остановку реакции 2 М раствором серной кислоты. Субстратом служил 0,1% раствор о-фенилендиамина и 0,03% раствор перекиси водорода в 50 мМ цитрат-фосфатном буфере (рН 5,0) (Фиг. 2. Буквами в верхней части фигуры обозначены кривые: А, В - лунки сенсибилизированы белком G, очищенным аффинной хроматографией на IgG Sepharose® 6 FF с привитыми иммуноглобулинами человека из нормальной сыворотки крови; С, D - лунки сенсибилизированы белком G, ренатурированного и выделенного электроэлюцией из полиакриламидного геля). Титрование IgG на планшетах, сенсибилизированных различными препаратами белка G, представлено S-образными кривыми, горизонтальные участки которых в области высоких концентраций соответствуют области насыщения. Восходящие участки кривых А и В расположены в области концентраций IgG от 2,5 нг/мл до 80 нг/мл, для кривых С и D - от 10 нг/мл до 300 нг/мл. Принимая во внимание одинаковые номинальные концентрации белка G в препаратах, установленное различие концентрационных интервалов показывает сниженную долю функционально-активных молекул белка G в ренатурированном препарате по сравнению с белком G, очищенным аффинной хроматографией на IgG Sepharose® 6 FF с привитыми иммуноглобулинами человека из нормальной сыворотки крови.
Пример 5. Непрямой твердофазный иммуноферментный анализ.
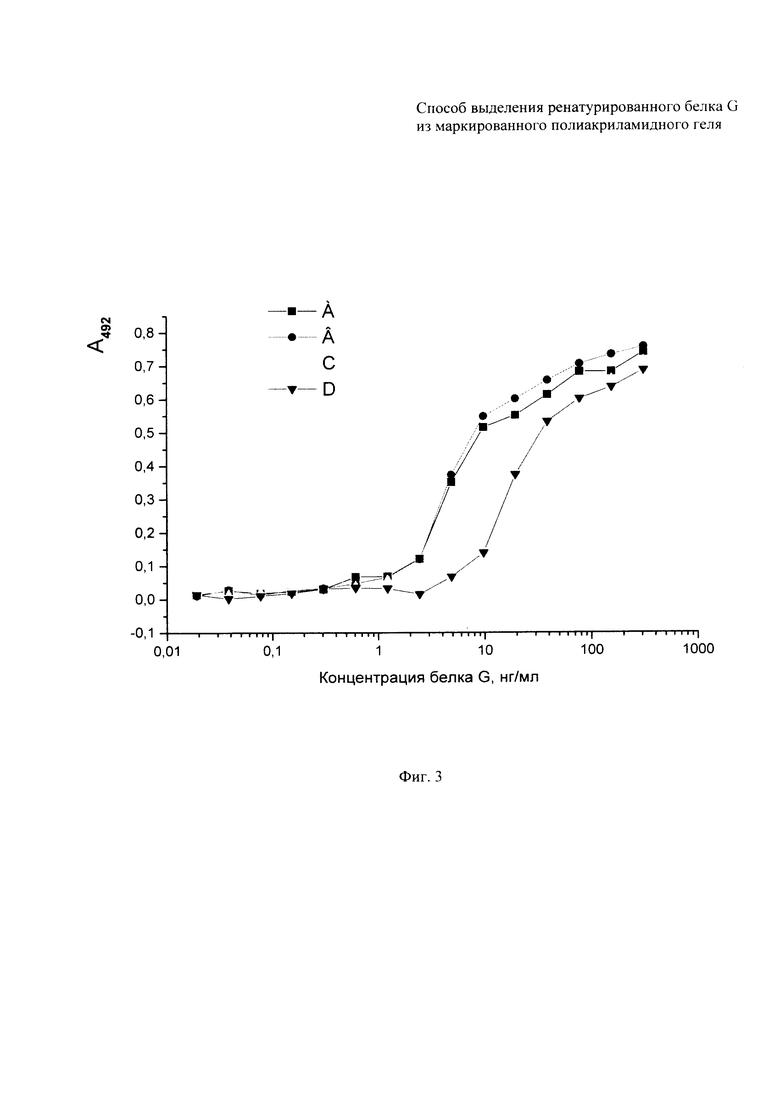
Для проведения непрямого твердофазного ИФА каждую лунку планшета (96 лунок) сенсибилизируют, заполняя 100 мкл раствора, содержащего 0,1 М карбонатный буфер (рН 9,6) и 500 нг иммуноглобулинов нормальной сыворотки кролика с инкубацией при температуре 6°С в течение 18 час, после чего проводят четырехкратную промывку ФСБТ. Неспецифическую сорбцию блокируют 1% раствором бычьего сывороточного альбумина в ФСБТ в течение 2 час при 37°С, причем на этом этапе объем наполнения лунок составлял 120 мкл. В последующем, этапы анализа проводят аналогично, с промежуточными промывками ФСБТ и включают инкубацию с приготовленными предварительно разведениями белка G (начиная с наибольшей концентрации 600 нг/мл), с кратностью 2,5, с раствором нормальной сыворотки мыши (1:350, 2 час, 37°С), раствором антимышиных антител, конъюгированных с пероксидазой хрена (1:4000, 2 час, 37°С), и субстратом. Раствор субстрата содержал 0,1% о-фенилендиамина и 0,03% перекиси водорода в 50 мМ цитрат-фосфатном буфере (рН 5,0). Реакцию останавливают 2 М раствором серной кислоты. (Фиг. 3 показывает, что белок G титруется и интервале концентраций от 10 нг/мл до 150 нг/мл для кривых А и В и от 20 нг/мл до 300 нг/мл для кривых С и D. Буквами в верхней части фигуры обозначены кривые титрования: А, В - белка G, очищенного аффинной хроматографией на IgG Sepharose® 6 FF с привитыми иммуноглобулинами человека из нормальной сыворотки крови; С, D - белка G, ренатурированного и выделенного электроэлюциией из полиакриламидного геля.) Различие интервалов титрования и их параллельный характер указывают на концентрационные, но не функциональные различия двух использованных препаратов белка G.
Пример 6. Иммуноблот.
Разделение очищенного белка G и предокрашенных маркеров проводили ДСН-электрофорезом в 12,5% полиакриламидном геле в редуцирующих условиях в режиме постоянного тока 20 мА. После завершения ДСН-ПААГ гель освобождали от стеклянных пластин и помещали на 15 мин в буферный раствор, содержащий 25 мМ трис основной, 192 мМ глицин, 0,1% SDS, 20% этанол (рН 8,3). Раствор в кювете с гелем периодически перемешивают. Гель с необходимыми прокладками помещают в устройство для переноса, накладывают на него нитроцеллюлозную мембрану со стороны анода, слои фильтровальной бумаги для уплотнения, предварительно увлажненные буфером, электроды и подключают ток. Перенос белков на нитроцеллюлозную мембрану проводят перпендикулярно первому направлению разделения при постоянном токе 400 мА и температуре 22°С, в течение 1 час, после чего мембрану осторожно извлекают и немедленно помещают в блокирующий раствор, содержащий 1% бычий сывороточный альбумин, или 5% обезжиренное молоко в ФСБТ. Подавление неспецифических взаимодействий проводят при перемешивании раствора на качалке в течение 2 час при 37°С. Для промывки мембран и разведения белков на каждом промежуточном этапе используют ФСБТ. Блокированную и промытую мембрану разрезают на части, каждую из которых инкубируют в отдельных кюветах с различными растворами нормальных сывороток в течение 2 час при 37°С, после чего промывают и инкубируют при тех же условиях с соответствующими растворами конъюгатов антивидовых антител с пероксидазой хрена. Далее промывают ФСБТ и помещают в раствор хромогенного субстрата, содержащего 3,3'-диаминобензидин (0,5 мг/мл), хлорид никеля (0,1 мг/мл), 0,03% Н2О2, 0,05 М Трис-HCl (рН 7,6). Перекись водорода добавляют после растворения всех компонентов субстрата и используют его немедленно, реакцию останавливают, промывая окрашенные фрагменты мембран дистиллированной водой (Фиг. 4. Числами в верхней части фигуры обозначены линии: 1, 2, 3, 4 - фрагменты мембран иммуноблота; 5 - фрагмент геля, окрашенный кумасси G-250; 3 - предокрашенные маркеры молекулярных масс, числовые значения приведены в правой части фигуры и выражены в килодальтонах, все остальные линии содержат очищенный белок G. Обработка мембран: линия 1 - сыворотка крови человека; линия 2 - сыворотка крови мышей; линия 4 - сыворотка крови кролика.). Анализ иммуноблотов позволяет сделать заключение о том, что белок G денатурируется в результате термообработки образцов в присутствии 0,1% ДСН буфера Лэмли перед электрофорезом, утрачивает способность связывать различные иммуноглобулины G и остается преимущественно в денатурированном состоянии после переноса на нитроцеллюлозную мембрану, что подтверждается чрезвычайно слабой окраской полос или ее отсутствием (Фиг. 4, линии 1, 2 и 4). В это же время, электрофореграмма (Фиг. 4, линия 5) указывает на значительное (не менее 1 мкг) количество белка G в линиях.
Пример 7. Дот-блот.
Для подготовки различных вариантов рабочей нитроцеллюлозной мембраны готовят ряд последовательных двукратных разведений белков «первого слоя», в качестве которых выступают белок G, или иммуноглобулины G нормальной сыворотки крови различных животных, в частности кролика и мыши. Растворы белков переносят в объеме 1 мкл каждого разведения рядами на поверхность размеченной мембраны. Мембрану сушат в течение 1 час при 23°С, после чего погружают в блокирующий раствор, содержащий 1% бычий сывороточный альбумин или 5% обезжиренное молоко в ФСБТ. Блокировку проводят на качалке в течение 2 час при 37°С. Для промывок мембран и разведения белков на каждом промежуточном этапе используют ФСБТ. Перечисленные этапы являются общими для всех проводок. На последующих этапах, в зависимости от схемы эксперимента, применяют различные последовательности инкубации мембран в растворах нормальных сывороток животных, белка G, конъюгатов различных антивидовых антител с пероксидазой хрена, как правило, в течение 2 час при 37°С с необходимыми промежуточными промывками ФСБТ. При длительных экспериментах, выходящих за пределы одного рабочего дня, этапы инкубации проводят в течение ночного времени, но при 6°С. Этап обработки субстратом является общим и завершающим для всех схем проводки: промытую мембрану помещают в раствор субстрата, содержащего 3,3'-диаминобензидин (0,5 мг/мл), хлорид никеля (0,1 мг/мл), 0,03% Н2О2, 0,05 М Трис-HCl (рН 7,6). После добавления перекиси водорода субстрат используют немедленно, реакцию останавливают, промывая мембрану дистиллированной водой. Описания всех использованных схем дот-блотов приведены на Фиг. 5. Числами в верхней части фигуры обозначены секторы нитроцеллюлозной мембраны с сорбированными белками в последовательных двукратных разведениях, начиная с наибольшей концентрации, составляющей 1000 мкг/мл (секторы 1 всех полос). Полосы с сорбированным белком G обозначены слева надписью «Белок G», полосы с сорбированным бычьим сывороточным альбумином обозначены слева надписью «Альбумин». Полосы, обозначенные справа как «А» и «В» вместе с прилегающими полосами «Альбумин», отличаются проводкой мембран.
Проводка А: этап 1 - сорбция белка G и альбумина, 1 час, 24°С; этап 2 - промывка ФСБТ; этап 3 - инкубация с блокирующим агентом, 2 час, 37°С; этап 4 - промывка ФСБТ; этап 5 - инкубация с раствором IgG мыши, 1 мкг/мл, 2 час, 37°С; этап 6 - промывка ФСБТ; этап 7 - инкубация с конъюгатами антимышиных антител с пероксидазой хрена, 2 час, 37°С; этап 8 - промывка ФСБТ; этап 9 - хромогенный субстрат.
Проводка В: этап 1 - сорбция белка G и альбумина, 1 час, 24°С; этап 2 - промывка ФСБТ; этап 3 - инкубация с блокирующим агентом, 2 час, 37°С; этап 4 - промывка ФСБТ; этап 5 - инкубация с раствором IgG кролика, 1 мкг/мл, 2 час, 37°С; этап 6 - промывка ФСБТ; этап 7 - инкубация с конъюгатами антикроличьих антител с пероксидазой хрена, 2 час, 37°С; этап 8 - промывка ФСБТ; этап 9 - хромогенный субстрат. Числами в верхней части фигуры обозначены участки нитроцеллюлозной мембраны с сорбированными иммуноглобулинами G (IgG) в последовательных двукратных разведениях, начиная с наибольшей концентрации IgG, составляющей 1000 мкг/мл (участки 1). Виды сорбированных на нитроцеллюлозную мембрану IgG обозначены в левой части фигуры.
Проводку мембран осуществляли следующим образом: этап 1 - сорбция IgG мыши или кролика, 1 час, 24°С; этап 2 - промывка ФСБТ; этап 3 - инкубация с блокирующим агентом, 2 час, 37°С; этап 4 - инкубация с раствором ренатурированного белка G, 1 мкг/мл, 2 час, 37°С; этап 5 - промывка ФСБТ; этап 6 - инкубация с растворами IgG: верхний ряд - IgG кролика, нижний ряд - IgG мыши, 1 мкг/мл, 18 час, 6°С; этап 7 - промывка ФСБТ; этап 8 - инкубация с конъюгированными с пероксидазой хрена антивидовыми антителами против IgG, использованных на этапе 6, 2 час, 37°С; этап 9 - промывка ФСБТ; этап 10 - хромогенный субстрат. Числами в верхней части фигуры обозначены секторы нитроцеллюлозной мембраны с сорбированными белками в последовательных двукратных разведениях, начиная с наибольшей концентрации, составляющей 1000 мкг/мл (секторы 1 всех полос). Полосы с сорбированными IgG мыши в составе сыворотки крови мышей также обозначены надписью слева. Полосы, обозначенные справа как «А», используют в проводке белок G, очищенный из растворимой фракции лизатов клеток Е. coli аффинной хроматографией при помощи IgG Sepharose 6В. Полосы «В» используют в проводке белок G, ренатурированный и выделенный электроэлюцией в настоящем исследовании.
Проводка полос «А» и «В» с сорбированными IgG кролика: этап 1 - сорбция IgG кролика, 1 час, 24°С; этап 2 - промывка ФСБТ; этап 3 - инкубация с блокирующим агентом, 2 час, 37°С; этап 4 - промывка ФСБТ; этап 5 - инкубация с растворами белка G: линия «А» - очищенного аффинной хроматографией, линия «В» - ренатурированного и выделенного электроэлюцией, 1 мкг/мл, 2 час, 37°С; этап 6 - промывка ФСБТ; этап 7 - инкубация с раствором нормальной сыворотки мышей (1:100), 2 час, 37°С; этап 8 - промывка ФСБТ; этап 9 - инкубация с конъюгатами антимышиных антител с пероксидазой хрена, 2 час, 37°С; этап 10 - промывка ФСБТ; этап 11 - хромогенный субстрат.
Проводка полос «А» и «В» с сорбированной нормальной сывороткой мышей (1:30): этап 1 - сорбция белков сыворотки, включая IgG мыши, 1 час, 24°С; этап 2 - промывка ФСБТ; этап 3 - инкубация с блокирующим агентом, 2 час, 37°С; этап 4 - промывка ФСБТ; этап 5 - инкубация с растворами белка G: линия «А» - очищенного аффинной хроматографией, линия «В» - ренатурированного и выделенного электроэлюцией, 1 мкг/мл, 2 час, 37°С; этап 6 - промывка ФСБТ; этап 7 - инкубация с раствором IgG кролика (1 мкг/мл), 2 час, 37°С; этап 8 - промывка ФСБТ; этап 9 - инкубация с биотинилированными F(ab)2 фрагментами антикроличьих антител, 2 час, 37°С; этап 10 - промывка ФСБТ; этап 11 - стрептавидин-пероксидаза (1:3000), 2 час, 37°С; этап 12 - промывка ФСБТ; этап 13 - хромогенный субстрат.
Для подтверждения свойств ренатурированного белка используют различные схемы последовательных иммунохимических взаимодействий (различные проводки). При схеме прямого дот-блота, как и в иммуноблоте (Фиг. 4), на нитроцеллюлозную мембрану первым слоем сорбируют очищенный, функционально активный ренатурированный белок G и после блокировки проводят через растворы различных антител, соответствующих антивидовых антител, конъюгированных с пероксидазой хрена и субстрата (Фиг. 5). Появление окрашенных пятен в 11 секторе для кроличьих антител и в 12 секторе для антител мыши соответствуют количествам белка G 0,98 нг и 0,49 нг в 1 мкл раствора, сорбированного на мембраны. Альбумин, использованный в качестве контроля в проводках А и В, не показывает окраски пятен даже при сорбции на мембрану 1000 нг белка (Фиг. 5). По сравнению с иммуноблотом (Фиг. 4) ренатурированный белок G в прямом варианте дот-блота проявляет способность связывать IgG кролика и мыши в концентрациях на три порядка меньше, чем белок G, термоденатурированный перед ДСН-электрофорезом.
В отличие от прямого дот-блота, новый вариант использует белок G в качестве «мостика», связывающего иммуноглобулины различных видов животных (Фиг. 6). В этом случае макромолекула белка G должна нести по крайней мере два центра связывания константных областей IgG, и проявление такой способности доказывает наличие функциональной активности белка G, подвергнутого ренатурации. Для подтверждения, в эксперименте на нитроцеллюлозную мембрану сорбируют различные виды иммуноглобулинов G, соответственно, кролика и мыши в последовательных двукратных разведениях от нулевого до 1:2048, что соответствует в последней, 12-й ступени концентрации 0,488 мкг/мл. Далее, IgG первого слоя взаимодействуют с белком G, к которому перекрестно присоединяют IgG мыши и кролика. Обработка соответствующими конъюгированными антивидовыми антителами и субстратом приводит к появлению окрашенных пятен, отчетливо различимых в шестом и седьмом разведениях, что доказывает наличие у ренатурированного белка G способности связывать IgG мыши и кролика. Расчеты показывают, что для связывания белка G необходимо сорбировать на мембрану в одном пятне не менее 30 нг антител (Фиг. 6, участки 6 и 7). Однако в этой схеме мы не можем исключить вероятность прямого взаимодействия антивидовых конъюгатов с сорбированным белком G первого слоя за счет оставшихся свободных мест связывания. Схема дот-блота, исключающая такую возможность, и его результаты приведены на Фиг. 7. Проводка отличается от предыдущего варианта тем, что на завершающих этапах вместо конъюгатов антивидовых антител используют биотинилированные F(ab)2 фрагменты антител, утратившие способность к взаимодействию с белком G вследствие удаления константной Fc области молекулы IgG. Окраска пятен на полосах А и В с сорбированной сывороткой мыши доказывает отсутствие неспецифического связывания конъюгата с белком G.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ сенсибилизации планшета для иммуноферментного анализа нерастворимыми белковыми антигенами | 2019 |
|
RU2732013C1 |
| ТЕСТ-СИСТЕМА ДЛЯ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2733379C1 |
| СПОСОБ ДИАГНОСТИКИ ВОЗБУДИТЕЛЕЙ ОСТРЫХ РЕСПИРАТОРНЫХ ВИРУСНЫХ ИНФЕКЦИЙ | 2019 |
|
RU2726797C1 |
| Способ получения активного начала вакцины против ротавирусной инфекции белка FliCVP6VP8 | 2017 |
|
RU2649132C1 |
| СПОСОБ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ, ОЧИСТКИ И СТАБИЛИЗАЦИИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, ПРИГОДНОГО ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2004 |
|
RU2278870C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА pET32a-TNF-Thy, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА α-ФАКТОР НЕКРОЗА ОПУХОЛЕЙ - ТИМОЗИН АЛЬФА 1, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21 (DE3)/pET32A-TNF-Thy - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА TNF-Thy, СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО БЕЛКА TNF-Thy И ЛЕКАРСТВЕННОЕ СРЕДСТВО | 2022 |
|
RU2809355C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА | 2001 |
|
RU2201962C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДНАЯ ДНК pHINS11, КОДИРУЮЩАЯ ГИБРИДНЫЙ БЕЛОК-ПРЕДШЕСТВЕННИК ИНСУЛИНА ЧЕЛОВЕКА, КЛЕТКА Escherichia coli, ТРАНСФОРМИРОВАННАЯ РЕКОМБИНАНТНОЙ ПЛАЗМИДНОЙ ДНК pHINS11, ШТАММ БАКТЕРИЙ Escherichia coli JM109/pHINS11 - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА-ПРЕДШЕСТВЕННИКА ИНСУЛИНА ЧЕЛОВЕКА И СПОСОБ ПОЛУЧЕНИЯ ИНСУЛИНА ЧЕЛОВЕКА | 2006 |
|
RU2354702C2 |
| РЕКОМБИНАНТНАЯ ПЛАЗМИДА PET32a-TNF-Thy, ОБЕСПЕЧИВАЮЩАЯ СИНТЕЗ ГИБРИДНОГО БЕЛКА α-ФАКТОР НЕКРОЗА ОПУХОЛЕЙ - ТИМОЗИН АЛЬФА 1, ШТАММ БАКТЕРИЙ ESCHERICHIA COLI BL21(DE3)/PET32A-THF-Thy - ПРОДУЦЕНТ ГИБРИДНОГО БЕЛКА TNF-Thy И СПОСОБ ПОЛУЧЕНИЯ ГИБРИДНОГО БЕЛКА TNF-Thy | 2022 |
|
RU2787531C1 |
| СПОСОБ ПРОМЫШЛЕННОГО ПОЛУЧЕНИЯ РЕКОМБИНАНТНОГО ИНСУЛИНА ЧЕЛОВЕКА | 2003 |
|
RU2232813C1 |




Изобретение относится к области биотехнологии. Предложен способ выделения ренатурированного белка G из маркированного полиакриламидного геля. Предложенный способ включает этапы маркирования положения белка G в составе полиакриламидного геля, отделения фрагмента маркированного геля, содержащего белок G, последовательной обработки фрагмента геля денатурирующим буферным раствором, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 1% Тритон Х-100, 6 М мочевину, 2 М тиомочевину, в течение 1 час и ренатурирующим буферным раствором, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 2 мМ сульфобетаина, 1 мМ ЭДТА, в течение 3 час при 20°С с трехкратной сменой буфера и завершающей электроэлюцией ренатурированного белка G из измельченного геля в буферном растворе, содержащем 10 мМ калий-фосфатный буфер (рН 7,5), в течение 2 часов и силой тока 200 мА. Предложенный способ может быть использован для выделения белка G, имеющего сохраненные иммунобиологические свойства. 7 ил., 7 пр.
Способ выделения ренатурированного белка G из маркированного полиакриламидного геля, включающий разделение субфракций бактериальной массы центрифугированием в течение 15 мин при 1500×g с последующим переосаждением полученного осадка при тех же условиях при 10°С, ресуспендированием в растворе 8 М мочевины, содержащем 10 мM Трис-HCl (рН 8,0) и 1,5 мM ЭДТА и длительным перемешиванием с финальным центрифугированием суспензии при 14000×g в течение 30 мин при 12°С для получения надосадочной фракции, отличающийся тем, что для денатурации и ренатурации используют белок G, иммобилизованный в составе полиакриламидного геля в редуцирующих условиях (ДСН-ПААГ) с маркированием положения белка G по завершении и отделением фрагмента маркированного геля, содержащего белок G с последующей последовательной обработкой фрагмента геля денатурирующим буферным раствором, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 1% Тритон Х-100, 6 М мочевину, 2 М тиомочевину в течение 1 час и ренатурирующим буферным раствором, содержащим 20 мМ Трис (рН 8.0), 100 мМ NaCl, 2 мМ сульфобетаина, 1 мМ ЭДТА в течение 3 час при 20°С с трехкратной сменой буфера и завершающей электроэлюцией ренатурированного белка G из измельченного геля в буферном растворе, содержащем 10 мМ калий-фосфатный буфер (рН 7,5) в течение 2 час и силой тока 200 мА.
| СПОСОБ ВЫДЕЛЕНИЯ БЕЛКА 39 кДа НАРУЖНОЙ МЕМБРАНЫ ВОЗБУДИТЕЛЯ МЕЛИОИДОЗА | 2002 |
|
RU2208445C1 |
| WO 1990000200 A1, 11.01.1990 | |||
| RU 2070888 C1, 27.12.1996 | |||
| СПОСОБ ПОЛУЧЕНИЯ, ВЫДЕЛЕНИЯ, ОЧИСТКИ И СТАБИЛИЗАЦИИ РЕКОМБИНАНТНОГО ГРАНУЛОЦИТАРНОГО КОЛОНИЕСТИМУЛИРУЮЩЕГО ФАКТОРА ЧЕЛОВЕКА, ПРИГОДНОГО ДЛЯ МЕДИЦИНСКОГО ПРИМЕНЕНИЯ, И ИММУНОБИОЛОГИЧЕСКОЕ СРЕДСТВО НА ЕГО ОСНОВЕ | 2004 |
|
RU2278870C2 |
| СПОСОБ ПОЛУЧЕНИЯ АКТИВНОГО ФРАГМЕНТА АЛЬФА-ФЕТОПРОТЕИНА ЧЕЛОВЕКА | 2010 |
|
RU2448116C2 |
| WO 2002057296 A1, 25.07.2002. | |||
Авторы
Даты
2018-03-01—Публикация
2016-03-30—Подача