Настоящая заявка связана и испрашивает приоритет согласно предварительной заявке на патент США №61/502811, поданной 29 июня 2011 года, под названием «Способ анализа клеточно-опосредованного иммунного ответа с повышенной чувствительностью», содержание которой в полном объеме включено в настоящий документ путем отсылки.
Область техники, к которой относится изобретение
Настоящее изобретение относится в целом к области иммунологических диагностических анализов, в том числе анализу для измерения клеточно-опосредованной иммунологической отвечаемости. В настоящем изобретении предлагается диагностика подвергания субъекта воздействию антигена на основе клеточно-опосредованной иммунологической отвечаемости с повышенной чувствительностью. Предусмотренный настоящей заявкой способ анализа может быть интегрирован в стандартную архитектуру патологии для обеспечения системы отчетов по диагностике и для содействия организации медицинского обслуживания.
Уровень техники
Библиографические подробности публикаций, на которые ссылается автор в данном описании, собраны в алфавитном порядке в конце описания.
Ссылки на любой уровень техники в данном описании не рассматриваются и не должны рассматриваться как подтверждение или любая форма предположения, что указанный уровень техники образует часть общеизвестного знания в любой стране.
Иммунологические диагностические анализы являются важными инструментами для выявления различных заболеваний. Эффективность этих видов анализов отчасти зависит от специфичности компонентов в иммунной системе. Несмотря на эту специфичность, иммунологические методы диагностики не обязательно всегда являются достаточно чувствительными для выявления вялотекущей инфекции или присутствия хронической инфекции низкого уровня, или у субъектов с активными или латентными течениями инфекционного заболевания. Существует потребность в разработке диагностических анализов с повышенной чувствительностью в отношении клеточно-опосредованной иммунологической отвечаемости.
Одна форма иммунологического диагностического анализа включает стимуляцию Т-клеток антигенами или митогенами в изолированной культуре клеток или в культуре цельной крови с последующим выявлением эффекторных молекул, таких как цитокины, продуцируемые стимулированными Т-клетками (также называемые как эффекторные Т-клетки). Эффекторные молекулы обычно выявляют с помощью методов, таких как ферментный иммуноанализ, мультиплексный анализ на основе микросфер, ELISpot и проточная цитометрия. Такие анализы являются полезными для выявления заболевание-специфических Т-клеточных ответов. Примером Т-клеточного анализа является QuantiFERON (Зарегистрированная торговая марка; Cellestis Limited). В другом анализе используются 15-мерные пептидные антигены для стимуляции Т-клеток. Однако пептиды такой длины, хотя и поддаются выявлению CD4+ Т-клетками, являются слишком длинными для выявления CD8+ Т-клетками.
Способность к быстрой оценке клеточно-опосредованного иммунитета и с высокой степенью чувствительности имеет важное клиническое значение. Особенно это относится к пациентами с нарушенной иммунной системой. Клиницисту необходимо понимать развитие течения заболевания и его действие на иммунную систему хозяина.
Тем не менее существует потребность в улучшении чувствительности способов анализа клеточно-опосредованной иммунологической отвечаемости у субъекта.
Раскрытие изобретения
В настоящей заявке предлагается способ выявления клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает инкубацию лимфоцитов от субъекта с пептидами, полученными из белкового антигена, при этом пептиды содержат комбинацию набора пептидов, каждого длиной примерно от 7 до 14 аминокислот, и набора пептидов длиной больше чем 15 аминокислот, которые охватывают весь белковый антиген или его часть, и затем скрининг на уровни эффекторных молекул, продуцированных активированными лимфоцитами.
Под «примерно от 7 до 14 аминокислот» понимается 7, 8, 9, 10, 11, 12, 13 или 14 аминокислот. Это рассматривается в настоящем документе как первый набор пептидов. Под «больше чем 15 аминокислот» понимается от 16 до полной длины белкового антигена, включая от 16 до 50 аминокислот. Это рассматривается как второй набор пептидов. Настоящий способ не должен ограничиваться тем, какой набор пептидов называется первым или вторым. Каждый набор содержит от по меньшей мере одного пептида до серий перекрывающихся пептидов.
Совместная инкубация пептидов, содержащих от 7 до 14 аминокислот, и пептидов, содержащих больше чем 15 аминокислот, полученных из белкового антигена, с лимфоцитами приводит к более чувствительному анализу, обеспечивающему более раннее выявление стимуляции лимфоцитов по сравнению с другим возможным способом. Повышенная чувствительность включает увеличенное, по меньшей мере, на 10% выявление эффекторных молекул по сравнению с совместной инкубацией с единственным пептидом в диапазоне от 7 до 14 аминокислот или в диапазоне >15 аминокислот, полученным из антигена или всего самого антигена. Способность к повышению чувствительности анализа клеточно-опосредованного иммунного ответа также допускает менее чувствительные средства выявления эффекторных молекул. Более того, величина клеточно-опосредованного иммунного ответа, выявленного в анализе, раскрытом в настоящем документе, может быть коррелирована с течением заболевания, прогрессированием и/или тяжестью. Таким образом, настоящее изобретение предлагает анализ клеточно-опосредованной иммунологической отвечаемости у субъекта.
Без ограничения настоящего изобретения какой-либо теорией или способом действия, два набора пептидов, от 7 до 14-мерные пептиды и >15-мерные пептиды, обеспечивают возможность выявления обоих видов Т-клеток, CD4+ и CD8+. CD4+ Т-клетки распознают >15-мерные пептиды и CD8+Т-клетки распознают от 7 до 14-мерные пептиды. Эти пептиды могут называться в настоящем документе как «CD4+ пептиды» (>15-мерные пептиды) или ''CD8+ пептиды'' (от 7 до 14-мерные пептиды).
Таким образом, в настоящем документе обеспечен способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта по меньшей мере с двумя наборами пептидов, первым набором, содержащим один или более пептидов длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим один или более пептидов длиной от 16 аминокислот или больше, которые охватывают весь белковый антиген или его часть, и измерение присутствия или повышения уровня иммунной эффекторной молекулы из иммунных клеток, при этом присутствие или уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости субъекта на антиген.
Предпочтительно, чтобы субъектом являлся человек и образец представлял собой неразбавленную цельную кровь. Альтернативно, образец представляет собой цельную кровь, содержание которой составляет примерно от 10% до 100% по объему подлежащего анализу образца, или составляет примерно от 50% до 100% по объему подлежащего анализу образца, или составляет примерно от 80% до 100% по объему подлежащего анализу образца. Объем образца может быть выражен в микролитрах или миллилитрах, например, от 0.5 мкл до 5 мл. Для удобства цельную кровь собирают в пробирку, содержащую гепарин, и иммунная эффекторная молекула представляет собой гамма-интерферон (IFN-γ). В целом, иммунные эффекторы выявляют с помощью специфичных к ним антител, например, с использованием метода твердофазного иммуноферментного анализа, ИФА (ELISA) или ELISpot.
Субъект может иметь инфекцию, вызванную патогенным агентом, выбранным из видов Mycobacterium, таких как Mycobacterium tuberculosis или туберкулез (ТВ), видов Staphylococcus, видов Streptococcus, видов Borrelia, Escherichia coli, видов Salmonella, видов Clostridium, видов Shigella, видов Proteus, видов Bacillus, вируса герпеса, вируса гепатита В или С, и вируса иммунодефицита человека (ВИЧ), или связанное с ними заболевание.
Субъект может альтернативно иметь заболевание, выбранное из целиакии, аутоиммунного диабета, очаговой алопеции, анкилозирующего спондилита, антифосфолипидного синдрома, аутоиммунной болезни Аддисона, рассеянного склероза, аутоиммунного заболевания надпочечников, аутоиммунной гемолитической анемии, аутоиммунного гепатита, аутоиммунного оофорита и орхита, болезни Бехчета, буллезного пемфигоида, кардиомиопатии, целиакии спру-дерматита, синдрома хронической усталости (CFIDS), хронической воспалительной демиелинизации, хронической воспалительной полинейропатии, синдрома Черга-Страусса, рубцующегося пемфигоида, CREST-синдрома, синдрома холодовой агглютинации, болезни Крона, герпетиформного дерматита, дискоидной волчанки, эссенциальной смешанной криоглобулинемии, фибромиалгии, гломерулонефрита, базедовой болезни, синдрома Гийена-Барре, тиреоидита Хашимото, идиопатического легочного фиброза, идиопатической тромбоцитопенической пурпуры (ITP), IgA-нефропатии, сахарного инсулинзависимого диабета (I типа), красного плоского лишая, волчанки, синдрома Меньера, смешанного заболевания соединительной ткани, рассеянного склероза, миастении гравис, миокардита, обыкновенной пузырчатки, пернициозной анемии, узелкового полиартериита, полихондрии, полигландулярных синдромов, ревматической полимиалгии, полимиозита и дерматомиозита, первичной агаммаглобулинемии, первичного билиарного цирроза, псориаза, феномена Рейно, синдрома Рейтера, ревматического полиартрита, ревматоидного артрита, саркоидоза, склеродермии, синдрома Шегрена, синдрома скованного человека, системной красной волчанки, болезни отсутствия пульса, височного артериита/гигантоклеточного артериита, язвенного колита, увеита, васкулита, витилиго и воспалительного заболевания кишечника.
Альтернативно, субъект может иметь рак, выбранный из протоонкогена ABL1, СПИД-ассоциированных злокачественных опухолей, невриномы слухового нерва, острого лимфоцитарного лейкоза, острого миелолейкоза, аденокистозной карциномы, адренокортикального рака, идиопатической миелоидной метаплазии, алопеции, альвеолярной саркомы мягких тканей, рака анального канала, ангиосаркомы, апластической анемии, астроцитомы, атаксии-телеангиэктазии, базально-клеточной карциномы (кожи), рака мочевого пузыря, рака костей, колоректального рака, глиомы ствола головного мозга, опухолей головного мозга и центральной нервной системы (CNS), рака молочной железы, опухолей CNS, карциноидных опухолей, рака шейки матки, опухолей головного мозга детей, детского рака, детского лейкоза, детской саркомы мягких тканей, хондросаркомы, хориокарциномы, хронического лимфолейкоза, хронического миелолейкоза, колоректального рака, кожной Т-клеточной лимфомы, возвышающейся дерматофибросаркомы, десмопластической мелко-круглоклеточной опухоли, протоковой карциномы, эндокринных злокачественных опухолей, рака эндометрия, эпендимомы, рака пищевода, саркомы Юинга, злокачественной опухоли внепеченочного желчного протока, злокачественной опухоли глаз, меланомы, ретинобластомы глаз, злокачественной опухоли фаллопиевых труб, анемии Фанкони, фибросаркомы, рака мочевого пузыря, рака желудка, злокачественной опухоли желудочно-кишечного тракта, гастроинтестинальной карциноидной опухоли, рака мочеполовой системы, опухолей из половых клеток, гестационно-трофобластической болезни, глиомы, гинекологических злокачественных опухолей, гематологических злокачественных опухолей, волосатоклеточного лейкоза, рака головы и шеи, рака печени, наследственного рака молочной железы, гистиоцитоза, болезни Ходжкина, папилломавируса человека, пузырного заноса, гиперкальцемии, рака гортанной части глотки, внутриглазной меланомы, рака островковых клеток, саркомы Калоши, рака почки, гистиоцитоза клеток Лангерганса, рака гортани, лейомиосаркомы, лейкоза, синдрома Ли-Фраумени, рака губ, липосаркомы, рака печени, рака легких, лимфостаза, лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, рака молочной железы мужчин, злокачественной палочковидной опухоли почек, медуллобластомы, меланомы, рака клеток Меркеля, мезотелиомы, метастазирующей злокачественной опухоли, рака полости рта, множественной эндокринной неоплазии, грибовидного микоза, миелодиспластического синдрома, миеломы, миелопролиферативных нарушений, злокачественной опухоли носа, носоглоточной злокачественной опухоли, аденосаркомы почки, нейробластомы, нейрофиброматоза, синдрома разрывов Неймегена, злокачественной опухоли кожи, не являющейся меланомой, немелкоклеточного рака легкого (NSCLC), злокачественных опухолей глаз, рака пищевода, рака ротовой полости, злокачественной опухоли ротовой части глотки, остеосаркомы, рака стомы яичников, рака поджелудочной железы, околоносовой злокачественной опухоли, рака паращитовидной железы, злокачественной опухоли околоушной железы, рака полового члена, периферийных нейроэктодермальных опухолей, рака гипофиза, истинной полицитемии, рака предстательной железы, редких злокачественных опухолей и ассоциированных нарушений, почечно-клеточной карциномы, ретинобластомы, рабдомиосаркомы, синдрома Ротмунда-Томсона, злокачественной опухоли слюнных желез, саркомы, шванномы, синдрома Сезари, рака кожи, мелкоклеточного рака легких (SCLC), злокачественной опухоли тонкой кишки, саркомы мягких тканей, опухоли спинного мозга, плоскоклеточной карциномы (кожи), рака желудка, синовиальной саркомы, злокачественной опухоли семенников, злокачественной опухоли тимуса, рака щитовидной железы, переходно-клеточного рака (мочевого пузыря), переходно-клеточного рака (почечной лоханки/мочеточника), трофобластной злокачественной опухоли, рака уретры, рака мочевыделительной системы, уроплакинов, саркомы матки, рака матки, рака влагалища, рака наружных женских половых органов, макроглобулинемии Вальденстрема и опухоли Вильмса.
Альтернативно, субъект может быть подвергнут воздействию токсического вещества белковой природы.
В указанных выше аспектах антиген представляет собой белок, полученный из патогенного агента, ассоциированного с заболеванием или раком, или представляет собой токсическое вещество.
Кроме того, предложен способ, позволяющий пользователю определять статус клеточно-опосредованной иммуннологической отвечаемости субъекта, при этом способ включает:
а) получение данных в форме уровней или концентраций иммунной эффекторной молекулы, которые относительно контроля обеспечивают корреляцию с состоянием клеточно-опосредованной иммуннологической отвечаемости у субъекта, посредством коммуникационной сети, при этом уровень иммунной эффекторной молекулы измеряют после подвергания лимфоцитов воздействию по меньшей мере двух наборов пептидов, первого набора, содержащего один или более пептидов длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего один или более пептидов длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть;
(b) обработку данных посредством одномерного или многомерного анализа для обеспечения величины иммунологической отвечаемости;
(c) определение статуса субъекта в соответствии с результатами величины иммунологической отвечаемости в сравнении с предварительно определенными величинами; и
(d) передачу показателя статуса субъекта пользователю посредством коммуникационной сети.
В одном варианте осуществления туберкулезный антиген представляет собой CFP10, ESAT-6, ТВ7.7 или ТВ37.6. В одном варианте осуществления субъект инфицирован ВИЧ. В одном варианте осуществления лимфоциты приводят в контакт с комбинацией CD4+и CD8+пептидов.
Краткое описание чертежей
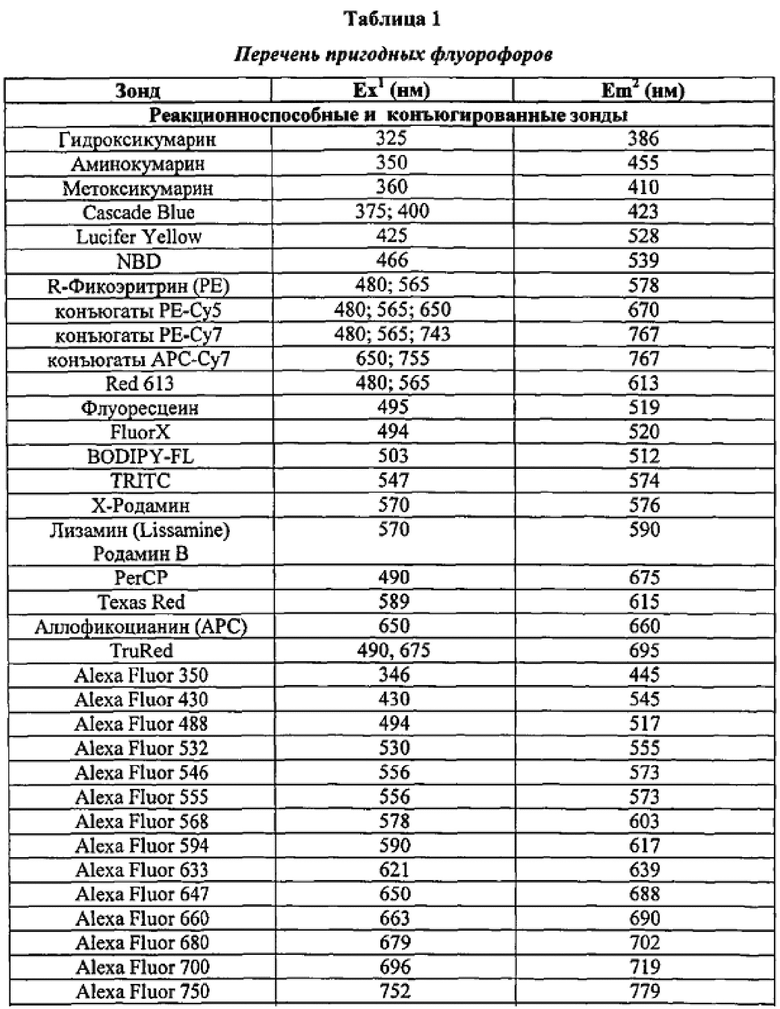
Фигура 1 представляет собой графическое изображение в форме гистограммы, показывающее средние ответы на QFN-TB или QFN-TB плюс один из трех пулов у всех оцениваемых субъектов (n=41). Показаны средние значения со стандартной погрешностью среднего. Значительное увеличение ответа наблюдалось при добавлении всех пептидных пулов (Р<0.001) [критерий Фридмана (Friedman test) с критерием множественных сравнений Данна (Dunn's multiple comparison test)]. Тест QFN-TB содержал CD4+ пептиды и пул из 10-мерных пептидов (CD8+ пептиды).
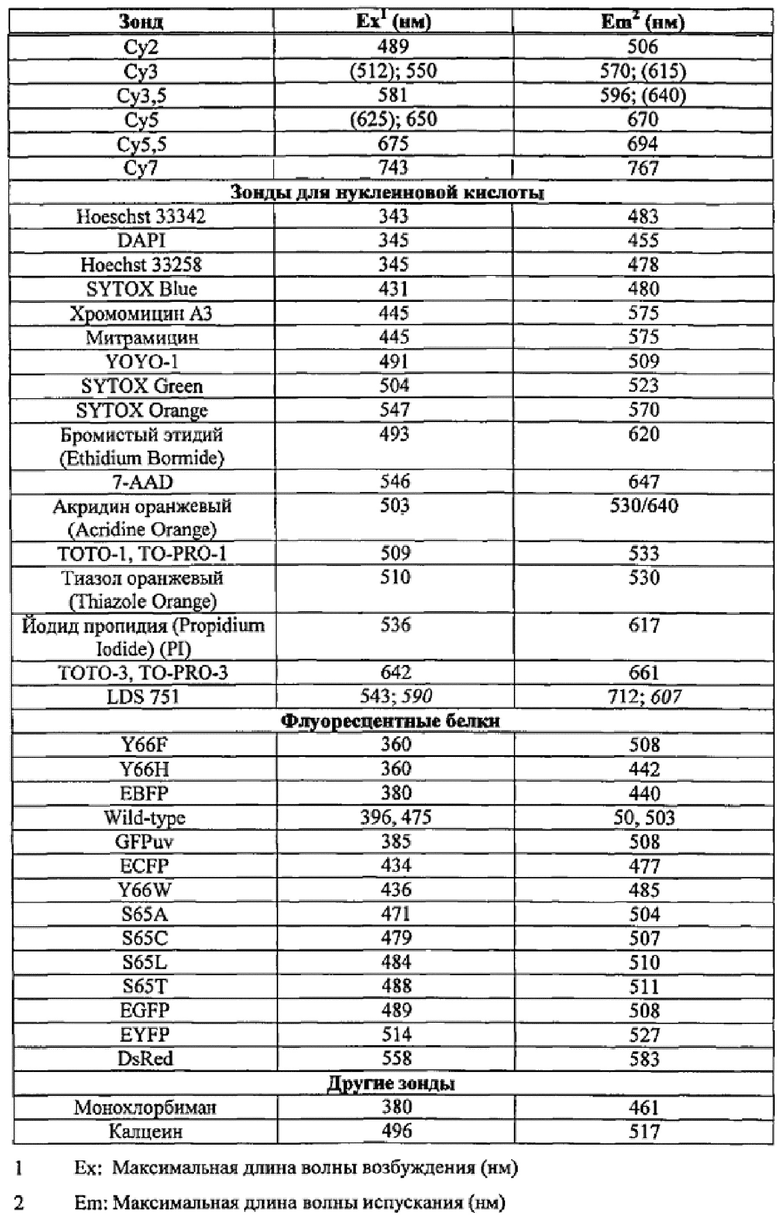
Фигура 2 представляет собой графическое изображение ответов IFN-γ в тесте QFT-CMV, содержащем 16-мерные пептиды для CMV антигена рр65 (CD4+ пептиды) с использованием Nil-пробирки без антигена CMV или только 16-мерные CD4+ пептиды; и комбинированный CMV CD4++CD8+пептид; и использование митогена в качестве контроля.
Подробное описание изобретения
По всему данному описанию, если контекст не требует иного, слово «содержать» или варианты, такие как «содержит» или «содержащий», следует понимать как подразумевающие включение указанного элемента или целого числа, или стадии способа, или группы элементов или целых чисел, или стадий способа, но не исключение любого другого элемента или целого числа, или стадии способа, или группы элементов или целых чисел, или стадий способа.
Используемые в настоящем описании формы единственного числа «a», «an» и «the» включают в себя множественное число, если только контекст не диктует четко иного. Так, например, ссылка на «Т-клетку» включает в себя одну Т-клетку, а также две или более Т-клеток; ссылка на «антиген» включает в себя один антиген, а также два или более антигенов; ссылка на «раскрытие сущности изобретения» включает в себя один или множество аспектов, представленных в настоящем изобретении; и так далее. Представленные в настоящем документе аспекты охвачены термином «изобретение». Все аспекты изобретения включены в объем формулы изобретения. Термины «Т-клетка» и «Т-лимфоциты» используются в настоящем документе взаимозаменяемо. «Иммунная клетка» включает лимфоцит, такой как Т-клетка.
Ссылка на «агент», «реагент», «молекулу» и «соединение» включает в себя отдельные единицы и комбинации двух или более таких единиц. «Комбинация» также включает в себя многокомпонентную, такую как двухкомпонентная, композицию, в которой агенты представлены отдельно и их применяют или дозируют отдельно, или смешивают вместе перед дозированием. Например, многокомпонентный набор для анализа может содержать серии перекрывающихся пептидов длиной примерно от 7 до 14 аминокислотных остатков и/или длиной больше чем 15 аминокислотных остатков, которые охватывают весь белковый антиген или его часть, в отношении которой клеточно-опосредованный иммунный ответ подлежит измерению. Таким образом, этот аспект настоящего изобретения включает агенты, высушенные и свободные или иммобилизованные на компартментную стенку или твердую подложку в наборе для анализа.
Настоящее изобретение предусматривает наборы пептидов. Термин «набор» может быть заменен другими терминами, такими как «пул», «группа», «серии», «коллекция», и подобными без отступления от раскрытого в настоящем документе способа изобретения. Каждый набор содержит, по меньшей мере, один пептид и включает в одном варианте осуществления серии перекрывающихся пептидов. Таким образом, первый набор может содержать серии перекрывающихся пептидов длиной от 7 до 14 аминокислотных остатков. Данные пептиды распознаются CD4+ Т-клетками (CD4+ пептиды). Второй набор может содержать серии перекрывающихся пептидов длиной больше чем 15 аминокислотных остатков. Данные пептиды распознаются CD8+ Т-клетками (CD8+ пептиды). Оба набора пептидов охватывают всю длину или часть белкового антигена. Кроме того, пептиды необязательно должны перекрываться или могут перекрываться одной аминокислотной или множеством аминокислот. Пептиды включают стержни пептидов, которые охватывают от 80-100% белкового антигена. От «80-100%» означает 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 или 100%.
Ссылка на серии перекрывающихся пептидов длиной примерно от 7 до 14 аминокислотных остатков, которые охватывают весь белковый антиген или его часть, означает пептид длиной примерно от 7 аминокислотных остатков до максимально 14 аминокислотных остатков, которые полностью перекрывают до 6 аминокислотных остатков белкового антигена от его Ν-концевой области до С-концевой области, или его часть. Таким образом, если длина заданного пептида составляет x аминокислотных остатков в длину, где x составляет примерно от 7 до 14, то область перекрывания между двумя последовательными пептидами составляет от х-1 до х-6. В одном варианте осуществления перекрывание каждого последующего пептида составляет х-1. Серии перекрывающихся пептидов длиной больше чем 15 аминокислотных остатков, также перекрывают весь белковый антиген или его часть, при этом каждый пептид составляет, по меньшей мере, 16 аминокислотных остатков в длину или вплоть до длины всего белкового антигена. В одном варианте осуществления пептид длиной больше чем 15 аминокислотных остатков, содержит от 16 до 50 аминокислот, например, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 аминокислотных остатков. Как указано выше, для пептидов отсутствует необходимость в перекрывании при условии, что имеется, по меньшей мере, один набор из одного или более пептидов, содержащих от 7 до 14 аминокислот, и другой набор по меньшей мере из одного пептида, содержащего более 15 аминокислот.
Настоящее изобретение включает случай, когда каждый пептид в сериях имеет одинаковую длину (т.е. x). Однако серии пептидов могут содержать смесь х1, х2, Xj …Xj пептидов, где каждый из x, пептидов имеет длину примерно от 7 до 14 аминокислотных остатков или больше чем 15 аминокислотных остатков в длину.
В настоящем документе предложен способ выявления клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает инкубацию лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и затем скрининг на уровни эффекторных молекул, продуцируемых активированными лимфоцитами.
Лимфоциты активируют путем совместной инкубации, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть.
Настоящее изобретение обеспечивает усиление продукции эффекторных молекул лимфоцитами, которые были подвергнуты воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть. Такие лимфоциты представляют собой «активированные» или «стимулированные» лимфоциты. Усиление возникает путем подвергания клеток воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть. Уровень ответа является больше, чем в присутствии всего антигена или пептида, полученного из антигена, который содержит меньше чем 7 аминокислот или больше чем 14 аминокислот. Это обеспечивает более чувствительный анализ для оценки клеточно-опосредованной иммунологической отвечаемости субъекта. Настоящее изобретение, таким образом, обеспечивает анализ для выявления, оценки или иного контроля клеточно-опосредованного ответа у субъекта путем измерения присутствия или уровня эффекторных молекул из Т-клеток, стимулированных, по меньшей мере, двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть. Анализ также обеспечивает более раннее выявление клеточно-опосредованной отвечаемости. В одном варианте осуществления анализ, представленный здесь, повышает чувствительность клеточно-опосредованного анализа, что может обеспечить возможность использования менее чувствительных анализов на обнаружение. Кроме того, предполагается, что степень или величина клеточно-опосредованного иммунного ответа может отражать или давать информацию о состоянии, прогрессировании и/или тяжести заболевания. Например, по магнитуде ответа можно определить, имеет ли субъект латентную или активную, или острую инфекцию, или заболевание.
Для удобства CD4+ и/или CD8+ пептиды разделены на отдельные пулы пептидов.
Без ограничения настоящего изобретения какой-либо теорией или способом действия, по меньшей мере, два набора пептидов обеспечивают возможность стимуляции обоих, CD4+ и CD8+, эпитопов. Пептиды могут называться в настоящем описании как «CD4+ пептиды'' (>15-мерные пептиды) или ''CD8+ пептиды'' (от 7 до 14-мерные пептиды).
Кроме того, в инкубационную смесь может быть добавлен дополнительный агент, например, для модулирования активности регуляторных Т-клеток (T-reg клеток). Последнее охватывает ингибирование супрессорной функции T-reg клеток. Агенты, которые модулируют T-reg клетки, охваченные в настоящем документе, включают лиганд CD25; смысловой или антисмысловой олигонуклеотид для генетического материала, кодирующего JAK1 или TYK2; нейтрализующее антитело; CpG-содержащий олигонуклеотид; олигонуклеотид, действующий в качестве агента, модулирующего функцию Toll-подобного рецептора (TLR); и другие модулирующие TLR агенты.
В конкретном варианте осуществления T-reg клетки представляют собой супрессорные клетки иммунного ответа, активность которых является ингибированной.
«CpG-молекула» означает олигонуклеотид, содержащий последовательность CpG или мотив.
Настоящее изобретение обеспечивает средства для определения отвечаемости клеточно-опосредованного иммунитета у субъекта и, в свою очередь, учит определению, индуцирует или связано ли заболевание или агент с иммуносупрессией. Способ также обеспечивает диагностику инфекционных заболеваний, патологических состояний, определение уровня иммунокомпетентности и оценку отвечаемости иммунных клеток на эндогенные или экзогенные агенты, а также оценку воздействия токсических веществ белковой природы. Анализ также обеспечивает скрининг субъектов, которые ранее подвергались воздействию конкретного антигена, такого как антиген, ассоциированный с заболеванием, инфекцией или заражением.
Соответственно, один аспект, представленный в настоящем документе, предполагает способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение уровня иммунной эффекторной молекулы, продуцируемой иммунными клетками, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной иммунологической отвечаемости субъекта.
Другим аспектом, рассматриваемым в настоящем документе, является способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение повышения уровня иммунной эффекторной молекулы от иммунных клеток, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости субъекта, при этом уровень отвечаемости является показателем присутствия или отсутствия, или уровня, или стадии заболевания или состояния, выбранного из перечня, включающего инфекцию, вызванную патогенным агентом, аутоиммунное заболевание, рак, воспалительное состояние и воздействие токсического белковоподобного агента.
Еще одним аспектом, предложенным в настоящем документе, является способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение повышения уровня иммунной эффекторной молекулы от иммунных клеток, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости, и является показателем присутствия или отсутствия, или уровня, или стадии заболевания, или состояния, выбранного из перечня, включающего инфекцию, вызванную патогенным агентом, аутоиммунное заболевание, рак, воспалительное состояние и воздействие токсического белковоподобного агента.
Еще другим аспектом, предложенным в настоящем описании, является анализ на выявление присутствия, отсутствия, уровня или стадии заболевания, или состояния у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение повышения уровня иммунной эффекторной молекулы от иммунных клеток, при этом уровень иммунной эффекторной молекулы является показателем заболевания или состояния.
Кроме того, настоящее изобретение предлагает способ определения, индуцирует ли агент иммуносупрессию у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта после подвергания воздействию агента, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение присутствия и уровня эффекторной молекулы от лимфоцитов, при этом уровень эффекторной молекулы определяет уровень иммуносупрессии, индуцированной агентом.
В соответствии с этим аспектом, агент может представлять собой лекарственное средство или токсическое вещество окружающей среды.
В одном варианте осуществления лимфоциты содержатся в образце крови. В одном варианте осуществления образец крови совместно стимулирован, по меньшей мере, двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть.
Кроме того, обеспечено применение, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, для изготовления набора для диагностики клеточно-опосредованной иммунологической отвечаемости с помощью способа, включающего инкубацию лимфоцитов с ограниченным количеством агониста и выявление присутствия или повышения уровня эффекторной молекулы.
В другом варианте осуществления предложен способ выявления, индуцирует ли заболевание иммуносупрессию у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, имеющего заболевание, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение присутствия или уровня иммунной эффекторной молекулы от лимфоцитов, при этом уровень иммунной эффекторной молекулы является показателем степени иммуносупрессии, индуцированной или ассоциированной с заболеванием.
Кроме того, обеспечено применение, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, для изготовления набора для диагностики клеточно-опосредованной иммунологической отвечаемости. Как правило, способ включает инкубацию лимфоцитов, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть.
Данное применение включает применение для выявления или контроля присутствия, отсутствия, уровня или стадии заболевания или состояния, такого как инфекция, вызванная патогенным агентом, аутоиммунное заболевание, рак, воспалительное состояние и/или подвергание воздействию лекарственного средства или токсического белковоподобного агента, такого как токсическое вещество окружающей среды. Измерение уровня «иммунной эффекторной молекулы» включает измерение уровня молекул одного или нескольких различных типов.
Кроме того, настоящее изобретение обеспечивает способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт регуляторной Т-клетки от субъекта с агентом, выбранным из (i) ингибитора супрессорных регуляторных Т-клеток; и (ii) активатора усиливающих иммунитет клеток или их субпопуляции; и последующее приведение в контакт Т-клеток, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение повышения уровня иммунной эффекторной молекулы из иммунных клеток, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости субъекта.
Примеры ингибиторов или модуляторов функции T-reg включают лиганды CD25, такие как, но без ограничения, поликлональное или моноклональное антитело к CD25, или его антиген-связывающий фрагмент, гуманизированные или деиммунизированные поликлональные или моноклональные антитела к CD25, или рекомбинатную, или синтетическую форму поликлональных или моноклональных антител. Другие примеры агентов включают смысловые или антисмысловые молекулы нуклеиновой кислоты, направленные на мРНК или ДНК (т.е. генетический материал), кодирующие тирозинкиназу 1 (JAK1) семейства Janus или тирозинкиназу 2 (TYK2), или низкомолекулярные ингибиторы белков JAK1 или TYK2. Ссылка на «малые молекулы» включает в себя иммуноглобулин новые рецепторы антигена (IgNAR), описанные в международной заявке на патент WO 2005/118629. Еще другие примеры пригодных агентов включают стимулирующие агенты, такие как молекулы CpG, которые действуют через Toll-подобные рецепторы (TLR) и/или другие механизмы. Таким образом, CpG-содержащие олигонуклеотиды и олигонуклеотиды, действующие в качестве TLR модулирующего агента, также, составляют часть настоящего изобретения.
Возможно использование одного типа агента, или двух, или более типов агентов для модулирования T-reg клеток. Например, анализ может быть проведен с лигандом CD25 и смысловым или антисмысловым олигонуклеотидом JAK1/TYK2; лигандом CD25 и модулирующим TLR агентом; смысловым или антисмысловым олигонуклеотидом JAK1/TYK2 и модулирующим TLR агентом; или лигандом CD25, смысловым или антисмысловым олигонуклеотидом JAK1/TYK2 и модулирующим TLR агентом. Или же используется только один тип агента. В другом альтернативном варианте используется содержащий CpG олигонуклеотид и модулирующий TLR агент.
Ссылка на «субъект» включает в себя человека или отличные от человека виды, в том числе приматы, сельскохозяйственные животные (например, овцы, коровы, свиньи, лошади, ослы, козы), лабораторные животные (например, мыши, крысы, кролики, морские свинки, хомяки), домашние животные (например, собаки, кошки), виды птиц (например, домашняя птица, вольерная птица), рептилии и земноводные. Настоящее изобретение может применяться для лечения человека, а также в ветеринарии для лечения сельскохозяйственных животных и диких животных, включая индустрии скачек на лошадях, собачьи и верблюжьи бега. Например, анализ по настоящему изобретению может быть легко проведен на лошадях перед и/или после тяжелого испытания (такого как скачки) для скрининга на признак вызываемого нагрузкой легочного кровотечения (EIPH). Все лошади проявляют некоторую форму EIPH до некоторой степени во время нагрузки. Однако субклинические формы EIPH могут быть сложными для выявления.
Ссылка на «человека» включает в себя конкретные популяции людей, такие как педиатрические, пожилые и ослабленные человеческие популяции, а также конкретные когорты или популяции людей конкретной этнической принадлежности.
В другом варианте осуществления субъектом является человек, и анализ клеточно-опосредованного иммунного ответа применяется в скрининге на отвечаемость на патогенные микроорганизмы, вирусы и паразиты, вероятность развития или контроль аутоиммунных состояний, целиакии, контроль ответа субъекта на онкологические проблемы и для определения присутствия любого иммунодефицитного состояния или иммуносупрессии. Последнее может возникнуть, например, из-за некоторых лекарственных средств, в том числе различных химиотерапевтических агентов. Или же подвергания воздействию белковоподобных токсических веществ и летучих соединений окружающей среды.
Иммунные эффекторные молекулы могут быть любыми из ряда молекул, которые продуцируются в ответ на клеточную активацию или стимуляцию антигеном. Хотя интерферон (IFN), такой как гамма-интерферон (IFN-γ), является особенно полезной иммунной эффекторной молекулой, другие включают ряд цитокинов, таких как интерлейкины (IL), например, IL-2, IL-4, IL-6, IL-6 (CXCL8), IL-10, IL-12, IL-13, IL-16 (LCF) или IL-17, IL-Ια (IL-1F1), IL-Ιβ (IL-1F2), IL-1rα (IL-1F3), фактор некроза опухоли-альфа (TNF-α), трансформирующий фактор роста бета (TGF-β), колониестимулирующий фактор (CSF), такой как гранулоцитарный (G)-CSF или гранулоцитарно-макрофагальный (GM)-CSF, компонент комплемента 5а (С5а), Groα (CXCL1), sICAM-1 (CD54), IP-10 (CXCL10), I-TAC (CXCL11), MCP-1 (CCL2), MIF (GIF), MIP-1α (CCL3), MIP-Ιβ (CCL4), RANTES (CCL5) или MIG (CXCL9).
Настоящее изобретение также обеспечивает способ измерения активности клеточно-опосредованного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептид охватывает весь белковый антиген или его часть, и измерение уровня иммунной эффекторной молекулы из иммунных клеток, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости субъекта.
Представленный в настоящем описании анализ обеспечивает выявление присутствия или отсутствия, или уровня, или стадии заболевания, или состояния у субъекта, такого как инфекция, вызванная патогенным агентом, аутоиммунное заболевание, рак, воздействие воспалительного агента, воздействие лекарственного средства, воздействие токсического белковоподобного агента, а также иммунодефицита или иммуносупрессии, индуцированной, например, заболеванием.
В одном варианте осуществления образец, взятый у субъекта, как правило, помещают в пробирку для сбора крови. Пробирка для сбора крови включает в себя пробирку для взятия крови или другой аналогичный сосуд. Для удобства, когда образец представляет собой цельную кровь, пробирка для сбора крови является гепаринизированной. Или же гепарин добавляют в пробирку после сбора крови.
Несмотря на то что цельная кровь является предпочтительным и наиболее удобным образцом, данное изобретение распространяется на другие образцы, содержащие иммунные клетки, такие как лимфатическая жидкость, церебральная жидкость, тканевая жидкость и респираторная жидкость, в том числе назальная и пульмонарная жидкость, а также образцы, которые были подвергнуты удалению клеток. Ссылка на «цельную кровь» включает в себя цельную кровь, которая не была разведена, например, тканевой культурой, средой, реагентами, вспомогательными веществами и т.д. В одном варианте осуществления термин «цельная кровь» включает в себя анализируемый образец (т.е. реакционную смесь), содержащий, по меньшей мере, 10% по объему цельной крови. Термин «по меньшей мере, 10% по объему» включает в себя объемы крови 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51, 52, 53, 54, 55, 56,57, 58, 59,60, 61,62, 63, 64, 65, 66, 67, 68, 69, 70, 71, 72, 73, 74, 75, 76, 77, 78, 79, 80, 81, 82, 83, 84, 85, 86, 87, 88, 89, 90, 91, 92, 93, 94, 95, 96, 97, 98, 99 и 100% по объему общего анализируемого объема реакционной смеси. Могут быть добавлены дополнительные агенты, такие как культуральная среда, ферменты, вспомогательные вещества, антиген и тому подобное без отступления от образца, содержащего «цельную кровь».
Объемы крови могут составлять примерно от 0.5 мкл до 200 мл. Примеры включают 0.5 мкл, 1.5 мкл, 10 мкл, 20 мкл, 50 мкл, 100 мкл, 500 мкл, 1 мл, 5 мл, 10 мл и 20 мл. Настоящее изобретение также обеспечивает использование акустического микропотока для улучшения смешивания компонентов в анализе. Акустический микропоток описан в международной заявке на патент No. PCT/AU01/00420 и в Petkovic-Duran et al. (2009) Biotechniques 47:827-834.
Таким образом, в настоящем документе предусматривается способ смешивания одного или более лимфоцитов и, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, в емкости, при этом способ включает обеспечение примерно от 0.5 мкл до 150 мкл жидкости, содержащей компоненты, в сосуде для того, чтобы установить разрыв непрерывности акустического импенданса, и применение акустического сигнала для того, чтоб вызвать перемешивание жидкости. Также может применяться второй акустический сигнал, при этом первый и второй сигналы имеют соответствующие частоты, каждая выбрана от примерно 1 Гц до примерно 20000 Гц чередующимся образом для достижения хаотического перемешивания жидкости.
Использование пробирок для сбора крови согласуется со стандартными автоматизированными лабораторными системами, и это позволяет проводить анализ в крупном масштабе и с произвольным порядком выборки. Пробирки для сбора крови также минимизируют затраты и уменьшают воздействие на лабораторию цельной крови и плазмы и, следовательно, снижают риск заражения персонала лаборатории патогенным агентом, таким как ВИЧ или вирус гепатита В (HBV), или вирус гепатита С (HCV).
Совмещение стадии инкубации с пробиркой для сбора крови является особенно эффективным и повышает чувствительность анализа, так как выполняет дополнительную функцию инкубации клеток в присутствии моносахарида, такого как декстроза или глюкоза.
Клетки клеточно-опосредованной иммунной системы теряют способность к формированию иммунного ответа в цельной крови через длительные периоды после взятия крови у субъекта и ответы без вмешательства часто значительно снижены или отсутствуют через 24 часа после взятия крови. Сокращение рабочего дня и необходимость в специальной пластиковой посуде допускает выполнение стимуляции клеточно-опосредованного иммунного ответа пептидными антигенами в местах оказания медицинской помощи, таких как офисы терапевтов, клиники, средства обслуживания амбулаторных больных и ветеринарные клиники или фермы. После завершения стимуляции антигеном необходимости в свежих и активных клетках больше не существует. Гамма-интерферон (IFN-γ) и другие цитокины или иммунные эффекторные молекулы стабильны в плазме и, таким образом, образец можно хранить или транспортировать без требований в отношении специальных условий или сжатых сроков.
Стадия инкубации может составлять от 1 до 50 часов, например, от 1 до 40 часов или от 8 до 24 часов, или период времени между ними, включая 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15,16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49 или 50 часов. Особенно подходящий период составляет 24 часа.
Возможность измерения клеточно-опосредованного иммунитета является важной для оценки способности субъекта отвечать на инфекцию, вызванную патогенным агентом, таким как микроорганизм или вирус, или паразит, для формирования аутоиммунного ответа, например, в аутоиммунном диабете, или для защиты от рака или других онкологических состояний, или для выявления воспалительного состояния, или для выявления воздействия или чувствительности субъекта к токсическому веществу, такому как бериллий. Кроме того, описанный в настоящем документе анализ обеспечивает выявление заболеваний, которые приводят к иммуносупрессии, или иммуносупрессии, вызванной лекарственными средствами. Соответственно, ссылка на «измерение клеточно-опосредованного иммунного ответа у субъекта» включает и охватывает иммунную диагностику инфекционных и аутоиммунных заболеваний, маркер иммунологической компетентности, а также маркер воспалительных заболеваний, рака и токсических агентов. Важным является определение комбинированной врожденной и/или адаптивной иммунологической отвечаемости. Кроме того, возможность использования малых объемов крови позволяет легко провести анализы, например, на педиатрических, пожилых или ослабленных популяциях. Анализ, описанный в настоящем документе, обеспечивает раннее выявление или более чувствительное выявление иммунологической отвечаемости.
В одном варианте осуществления заболевания, ведущие к иммуносупрессии, включают хроническую инфекцию и рак. Лекарственные средства, которые могут привести к иммуносупрессии, включают такие лекарственные средства, которые применяются для лечения ревматоидного артрита, рака и воспалительного заболевания кишечника.
Патогенные или инфекционные агенты включают бактерии, паразиты и вирусы. Примеры бактерий включают грамположительные и грамотрицательные микроорганизмы, такие как виды Mycobacterium, виды Staphylococcus, виды Streptococcus, Escherichia coli, виды Salmonella, виды Clostridium, виды Shigella, виды Proteus, виды Bacillus, виды Hemophilus, виды Borrelia, помимо прочего. Особенно полезной мишенью является Mycobacterium tuberculosis, а также состояния, возникающие вследствие инфекции, вызванной М. Tuberculosis, такие как туберкулез (ТВ). Примеры вирусов включают вирус гепатита (вирус гепатита В и вирус гепатита С), вирус герпеса и вирус иммунодефицита человека (ВИЧ), а также возникающие вследствие них заболевания. Паразиты включают виды Plasmodium, дерматомикоз, паразиты печени и тому подобное. Другие патогенные агенты включают эукариотические клетки, такие как дрожжи и грибы.
В одном варианте осуществления туберкулезный антиген представляет собой CFP10, ESAT-6, ТВ7.7 или ТВ37.6. В одном варианте осуществления субъект инфицирован ВИЧ.
Настоящее изобретение является особенно полезным для скрининга на подвергание воздействию М. tuberculosis. Таким образом, настоящее изобретение предлагает способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает приведение в контакт лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или часть, при этом антиген выбран из CFP10, ESAT-6, ТВ7.7 и ТВ37.6 из Mycobacterium tuberculosis, и измерение уровня иммунной эффекторной молекулы, продуцируемой иммунными клетками, при этом уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной иммунологической отвечаемости субъекта на М. tuberculosis.
CFP10 также известен как ESAT-6-подобный белок eesxB и секреторный антигенный белок MTSA-10. ESAT-6 представляет собой шесть-килодальтонный (kDa) ранний секреторный целевой антиген М. tuberculosis. Другие пригодные целевые белковые антигены М. tuberculosis включают ТВ7.7 и ТВ37.6.
Аутоиммунные заболевания, предполагаемые в настоящем документе для выявления, включают, среди прочего, очаговую алопецию, анкилозирующий спондилоартрит, антифосфолипидный синдром, аутоиммунную болезнь Аддисона, рассеянный склероз, аутоиммунное заболевание надпочечников, аутоиммунную гемолитическую анемию, аутоиммунный гепатит, аутоиммунный оофорит и орхит, болезнь Бехчета, буллезный пемфигоид, кардиомиопатию, целиакию спру-дерматит, синдром хронической усталости (CFIDS), хроническую воспалительную демиелинизацию, хроническую воспалительную полинейропатию, синдром Черга-Страусса, рубцующийся пемфигоид, CREST-синдром, синдром холодовой агглютинации, болезнь Крона, герпетиформный дерматит, дискоидную волчанку, эссенциальную смешанную криоглобулинемию, фибромиалгию, гломерулонефрит, базедову болезнь, синдром Гийена-Барре, тиреоидит Хашимото, идиопатический легочный фиброз, идиопатическую тромбоцитопеническую пурпуру (ITP), IgA-нефропатию, сахарный инсулинзависимый диабет (I типа), красный плоский лишай, волчанку, синдром Меньера, смешанное заболевание соединительной ткани, рассеянный склероз, миастению гравис, миокардит, обыкновенную пузырчатку, пернициозную анемию, узелковый полиартериит, полихондрию, полигландулярные синдромы, ревматическую полимиалгию, полимиозит и дерматомиозит, первичную агаммаглобулинемию, первичный билиарный цирроз, псориаз, феномен Рейно, синдром Рейтера, ревматический полиартрит, ревматоидный артрит, саркоидоз, склеродермию, синдром Шегрена, синдром скованного человека, системную красную волчанку, болезнь отсутствия пульса, височный артериит/гигантоклеточный артериит, язвенный колит, увеит, васкулит и витилиго.
В целом, важно оценить возможную или фактическую клеточно-опосредованную отвечаемость у субъектов, подвергнутых воздействию этих инфекционных единиц. Способ по настоящему изобретению может также применяться для выявления присутствия или отсутствия этих состояний, а также уровня или стадии заболевания.
Другие заболевания, которые могут привести к иммуносупрессии, включают воспалительные заболевания.
Примеры воспалительных заболеваний, предполагаемых настоящим изобретением, включают, но не ограничиваются такими заболеваниями и нарушениями, которые вызывают ответную реакцию в виде покраснения, опухания, боли и ощущения тепла в некоторых областях, что означает защиту тканей, подвергнутых повреждению или заболеванию. Воспалительные заболевания, которые можно лечить с использованием способов по настоящему изобретению, включают, но без ограничения, угри, ангину, артрит, аспирационную пневмонию, заболевание, эмпиему, гастроэнтерит, воспаление, желудочный грипп, некротизирующий энтероколит (NEC), воспалительное заболевание тазовых органов, фарингит, инфекционные заболевания тазовых органов (PID), плеврит, першение в горле, эритему, покраснение, боль в горле, желудочный грипп и инфекции мочевыводящих путей, хроническую воспалительную демиелинизирующую полинейропатию, хроническую воспалительную демиелинизирующую полирадикулонейропатию. В отношении применений, не относящихся к человеку, настоящее изобретение распространяется на выявление EIPH у лошадей и различных состояний у животных, таких как раковая болезнь у Тасманского дьявола.
Терапия рака также отчасти зависит от клеточно-опосредованного иммунитета и рак сам по себе или лекарственные средства, применяющиеся для лечения рака, могут привести к иммуносупрессии. Виды рака, рассматриваемые в настоящем документе, включают: группу заболеваний и нарушений, которые характеризуются неконтролируемым клеточным ростом (например, формирование опухоли) без какой-либо дифференцировки этих клеток на специализированные и иные клетки. Такие заболевания и нарушения включают ABL1 протоонкоген, СПИД-ассоциированные виды рака, акустическую невриному, острую лимфоцитарную лейкемию, острую миелоидную лейкемию, аденокистозную карциному, адренокортикальный рак, агногенную миелоидную метаплазию, алопецию, альвеолярную саркому мягких тканей, рак анального канала, ангиосаркому, апластическую анемию, астроцитому, атаксия-телеангиэктазию, базально-клеточную карциному (кожи), рак мочевого пузыря, рак костей, колоректальный рак, глиому ствола головного мозга, опухоли мозга и центральной нервной системы (CNS), рак молочной железы, опухоли CNS, карциноидные опухоли, рак шейки матки, детские опухоли головного мозга, детский рак, детский лейкоз, детскую саркому мягких тканей, хондросаркому, хориокарциному, хроническую лимфоцитарную лейкемию, хроническую миелоидную лейкемию, колоректальный рак, кожную Т-клеточную лимфому, возвышающуюся дерматофибросаркому, десмопластическую мелкокруглоклеточную опухоль, дуктальную карциному, рак эндокринной железы, рак эндометрия, эпендимому, рак пищевода, саркому Юинга, рак общего печеночного протока, рак глаз, глаз: меланому, ретинобластому, рак фаллопиевой трубы, анемию Фанкони, фибросаркому, рак желчного пузыря, рак желудка, рак ЖКТ, желудочно-кишечную карциноидную опухоль, урогенитальный рак, герминогенные опухоли, гестационную трофобластическую болезнь, глиому, злокачественные опухоли женских половых органов, гематологические злокачественные опухоли, волосатоклеточный лейкоз, рак головы и шеи, гепатоцеллюлярный рак, передаваемый по наследству рак молочной железы, гистиоцитоз, болезнь Ходжкина, вирус папилломы человека, доброкачественную гестационную трофобластическую болезнь, гиперкальцемию, рак гортанной части глотки, интраокулярную меланому, рак островковой клетки, саркому Капоши, рак почки, лангергансоклеточный гистиоцитоз, рак гортани, лейомиосаркому, лейкоз, синдром Ли-Фраумени, рак губы, липосаркома, рак печени, рак легкого, лимфедему, лимфому, лимфому Ходжкина, неходжскинскую лимфому, рак молочной железы у мужчин, злокачественную рабдоидную опухоль почки, медуллобластому, меланому, рак осязательной клетки, мезотелиому, метастатический рак, рак ротовой полости, множественные эндокринные неоплазии, фунгоидный микоз, миелодиспластический синдром, миелому, миелопролиферативные заболевания, назальный рак, назофарингеальный рак, нефробластому, нейробластому, нейрофиброматоз, синдром Ниймеген, немеланомный рак кожи, немелкоклеточный рак легкого (NSCLC), рак глаза, рак пищевода, рак полости рта, рак ротовой части глотки, остеосаркома, рак яичника стомы, рак поджелудочной железы, параназальный рак, паратиреоидный рак, рак околоушной железы, рак полового члена, периферическую нейроэктодермальную опухоль, гипофизарный рак, истинная полицитемия, рак предстательной железы, редкие виды рака и связанные нарушения, почечно-клеточная карцинома, ретинобластома, рабдомиосаркома, синдром Ротмунда-Томсона, рак слюнной железы, саркому, невриному, синдром Сезари, рак кожи, мелкоклеточный рак легкого (SCLC), рак тонкого кишечника, саркому мягких тканей, опухоли спинного мозга, плоскоклеточная карцинома (кожи), рак желудка, синовиальная саркома, тестикулярный рак, рак тимуса, тиреоидный рак, переходно-клеточный рак (мочевого пузыря), переходно-клеточный рак (почечной лоханки-/-мочеточника), трофобластический рак, уретральный рак, рак мочевыделительной системы, уроплакины, саркома матки, рак матки, вагинальный рак, рак вульвы, болезнь Вальденстрема, опухоль Вильмса.
В указанных выше аспектах антиген может быть получен из патогенного агента, быть ассоциированным с заболеванием или раком, или представлять собой токсическое вещество. Альтернативно, инфекция, заболевание, рак или токсическое вещество могут подавлять клеточно-опосредованный иммунитет, и в этом случае может быть использован любой антиген, воздействию которого ранее подвергался субъект.
Выявление иммунных эффекторных молекул может быть произведено по уровням белка или нуклеиновой кислоты. Следовательно, ссылка на «присутствие или уровень» иммунной эффекторной молекулы включает в себя прямые и косвенные данные. Например, высокие уровни мРНК цитокина являются косвенными данными, показывающими повышенные уровни цитокина.
Лиганды к иммунным эффекторам являются особенно полезными для выявления и/или количественного определения этих молекул. Антитела к иммунным эффекторам являются особенно полезными. Методики для анализов, рассматриваемые в настоящем документе, известны в данной области и включают, например, радиоиммунологический анализ, сэндвич-анализы, ELISA и ELISpot. Ссылка на «антитела» включает в себя части антител, маммалианизированные (например, гуманизированные) антитела, деиммунизированные антитела, рекомбинантные или синтетические антитела, а также гибридные и одноцепочечные антитела. Для кожных тестов у человека гуманизированные или деиммунизированные антитела особо предполагаются в настоящем документе для выявления эффекторных молекул.
Поликлональные и моноклональные антитела можно получить путем иммунизации иммунными эффекторными молекулами или их антигенными фрагментами, и любой тип может быть использован для иммунологических анализов. Способы получения обоих типов сыворотки хорошо известны в данной области. Поликлональные сыворотки являются менее предпочтительными, но их относительно легко получить путем инъекции пригодному лабораторному животному эффективного количества иммунного эффектора или его антигенной части, сбора сыворотки у животного и выделения специфической сыворотки любыми известными методами иммуносорбции. Несмотря на то что антитела, полученные этим способом, можно использовать практически в любом типе иммунологического анализа, как правило, они менее предпочтительны по причине возможной гетерогенности продукта.
Использование моноклональных антител в иммунологическом анализе является особенно полезным из-за возможности их получения в больших количествах и гомогенности продукта. Приготовление гибридных клеточных линий для выработки моноклональных антител, проведенное путем слияния иммортализованной клеточной линии с лимфоцитами, сенсибилизированными против иммуногенного препарата, может быть выполнено способами, хорошо известными опытным специалистам в данной области.
Другим представленным здесь аспектом, таким образом, является способ выявления иммунной эффекторной молекулы в образце, содержащем лимфоциты от субъекта, при этом способ включает приведение в контакт образца или аликвоты образца с антителом, специфичным в отношении иммунной эффекторной молекулы или ее антигенного фрагмента, в течение времени и в условиях, достаточных для образования комплекса антитело-эффектор, и затем выявление комплекса, при этом иммунная эффекторная молекула образуется после инкубации лимфоцитов, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть.
«Образец» включает в себя цельную кровь или ее фракцию, содержащую лимфоциты. Данный способ включает микропанели, макропанели и нанопанели на плоских или сферических твердых носителях. Микро- или макропанели являются пригодными. Кроме того, «образец» включает в себя образец малого объема примерно от 0.5 мкл до 1000 мкл, в том числе 5 мкл, 10 мкл, 20 мкл, 50 мкл и 100 мкл, а также большие объемы, такие как от 1 мл до примерно 200 мл, такие как 1 мл, 2 мл, 5 мл, 10 мл или 20 мл.
Существует широкий круг методов иммуноанализа, как можно видеть при обращении к патентам США №4016043, 4424279 и 4018653.
Ниже приводится описание одного типа анализа. Немеченое антитело иммобилизуется на твердом субстрате, и подлежащий тестированию на иммунные эффекторные молекулы (например, цитокин) образец приводят в контакт со связанной молекулой. После подходящего периода инкубации в течение периода времени, достаточного для возможности образования комплекса антитело - иммунная эффекторная молекула, затем добавляют второе антитело, специфичное к эффекторной молекуле, меченное репортерной молекулой, способной индуцировать определяемый сигнал, и инкубацию продолжают в течение времени, достаточного для образования другого комплекса антитело-эффектор-меченое антитело. Любой непрореагировавший материал отмывается, и присутствие эффекторной молекулы определяется по наблюдению сигнала, производимого репортерной молекулой. Результаты могут быть качественными путем простого наблюдения за видимым сигналом, или могут быть количественными путем сравнения с контрольным образцом, содержащим известные количества антигена. Данный обобщенный способ хорошо известен специалистам в данной области, и возможность небольших вариаций должна быть вполне очевидной.
В этих анализах первое антитело, обладающее специфичностью в отношении мгновенных иммунных эффекторов, ковалентно или пассивно связывается с твердой поверхностью. Твердая поверхность обычно представляет собой стекло или полимер, причем наиболее часто применяемыми полимерами являются целлюлоза, полиакриламид, нейлон, полистирол, поливинилхлорид или полипропилен. Твердые носители могут быть в форме пробирок, шариков, сфер, дисков микропланшетов или любой другой поверхностью, пригодной для проведения иммуноанализа. Процессы связывания хорошо известны в данной области и обычно состоят в перекрестном ковалентном связывании с помощью сшивающего агента или физической адсорбции, после чего комплекс полимер-антитело отмывают при подготовке для тестируемого образца. Затем аликвоту подлежащего тестированию образца добавляют к твердофазному комплексу и инкубируют в течение периода времени (например, 2-120 минут или в течение ночи, если это более удобно), который является достаточным, и в подходящих условиях (например, примерно от 20°C до примерно 40°C) для обеспечения связывания любой субъединицы, присутствующей в антителе. После периода инкубации твердую фазу субъединицы антитела отмывают и высушивают, и инкубируют со вторым антителом, специфичным в отношении части эффекторной молекулы. Второе антитело связано с репортерной молекулой, которую используют как показатель связывания второго антитела с эффекторной молекулой.
Имеется много вариантов для этого анализа. Одним особенно полезным вариантом является одновременный анализ, в котором все или многие из компонентов смешивают в основном одновременно. Кроме того, связывание антитела с цитокином может быть определено по связыванию меченого антитела, направленного на первое упомянутое антитело.
Под «репортерной молекулой», как применяется в настоящем описании, подразумевается молекула, которая по своей химической структуре обеспечивает аналитически определяемый сигнал, который позволяет определить антиген, связанный с антителом. Определение может быть качественным или количественным. В данном варианте анализа наиболее распространенные репортерные молекулы представляют собой ферменты, флуорофоры или содержащие радионуклиды молекулы (т.е. радиоизотопы) и хемилюминесцентные молекулы. Примеры пригодных флуорофоров представлены в Таблице 1. В случае иммуноферментного анализа фермент конъюгируют со вторым антителом, как правило, посредством глутаральдегида или периодата. Однако, как легко понять, существует большое разнообразие способов конъюгации, которые являются легкодоступными для специалиста в данной области. Обычно применяемые ферменты включают среди прочих пероксидазу хрена, глюкозоксидазу, бета-галактозидазу и щелочную фосфатазу. Субстраты, применяемые со специфическими ферментами, обычно выбираются для получения при гидролизе соответствующим ферментом определяемого изменения цвета. Примеры пригодных ферментов включают щелочную фосфатазу и пероксидазу. Возможно также применение флуорогенных субстратов, которые дают флуоресцирующий продукт в отличие от хромогенных субстратов, указанных выше. Во всех случаях меченное ферментом антитело добавляют к первому комплексу антитело-антиген и оставляют для связывания, а затем избыток реагента отмывают. Раствор, содержащий подходящий субстрат, затем добавляют к комплексу антитело-антиген-антитело. Субстрат взаимодействует с ферментом, связанным со вторым антителом, позволяя качественно оценить видимый сигнал, который может быть далее оценен количественно, обычно спектрофотометрически, что дает оценку количества антигена, который присутствует в образце. Снова, настоящее раскрытие распространяется преимущественно на одновременный анализ.
Альтернативно, флуоресцентные соединения, такие как флуоресцеин и родамин, могут быть химически присоединены к антителам без изменения их связывающей способности. При активации под действием освещения светом определенной длины волны антитело, меченное флуорохромом, поглощает световую энергию, индуцируя в молекуле состояние возбудимости, с последующим испусканием света характерного цвета, определяемого визуально с помощью светового микроскопа. Флуоресцентно меченному антителу дают связаться с первым комплексом антитело-антиген. После отмывания не связавшегося реагента оставшийся тройной комплекс затем подвергают действию света с подходящей длиной волны, и наблюдаемая флуоресценция указывает на присутствие представляющего интерес антигена. Иммунофлуоресцентный и иммуноферментный способы оба хорошо разработаны в данной области и особенно предпочтительны для настоящего способа. Однако могут быть также применены другие репортерные молекулы, такие как радиоизотопы, хемилюминисцентные или биолюминисцентные молекулы.
Существует ряд других систем обнаружения, которые могут использоваться, включая коллоидное золото, и все такие системы обнаружения охвачены настоящим изобретением.
В настоящем изобретении также рассматриваются генетические анализы, например, анализ методом полимеразной цепной реакции (PCR) для выявления продуктов экспрессии РНК генетической последовательности, кодирующей иммунный эффектор.
В одном варианте осуществления PCR выполняют с использованием пар праймеров, одна или обе из которых обычно мечены одинаковыми или различными репортерными молекулами, способными давать различимый сигнал. Использование флуорофоров является особенно полезным при осуществлении на практике настоящего изобретения. Примеры пригодных флуорофоров могут быть выбраны из перечня, представленного в Таблице 1. Другие метки включают люминесценцию и фосфоресценцию, а также инфракрасные красители. Эти красители или флуорофоры могут быть также использованы в качестве репортерных молекул для антител.
Любой пригодный способ анализа испускания флуоресценции охвачен в настоящем документе. В этом отношении, методики, представленные в настоящем документе, включают, но не ограничиваются 2-фотонной и 3-фотонной флуоресцентной спектроскопией с разрешением по времени, как, например, раскрыто Lakowicz et al. (1997) Biophys. J. 72:567, изображением времени жизни флуоресценции, как, например, раскрыто Eriksson et al. (1993) Biophys. J. 2:64, и резонансным переносом энергии флуоресценции, как, например, раскрыто Youvan et al. (1997) Biotechnology et elia 5:1-18.
Люминесценция и фосфоресценция, как известно в данной области, могут возникать от пригодной люминесцентной или фосфоресцентной метки, соответственно. В этом отношении могут быть использованы любые оптические средства идентификации, например, метка.
Инфракрасное излучение может возникать от пригодного инфракрасного красителя. Примеры инфракрасных красителей, которые могут быть использованы в настоящем изобретении, включают, но не ограничиваются красителями, раскрытыми в Lewis et al. (1999) Dyes Pigm. 42(2): 197, Tawa et al. Mater. Res. Soc. Symp.Proc.488 [Electrical, Optical and Magnetic Properties of Organic Solid-State Materials IV], 885-890, Daneshvar et al. (1999) J. Immunol. Methods 226(1-2):l 19-128, Rapaport et al. (1999) Appl. Phys. Lett. 74(3):329-331 и Durig et al. (1993) J. Raman Spectrosc. 24(5):281-285. Любой пригодный инфракрасный спектроскопический способ может быть использован для детального исследования инфракрасного красителя. Например, в этом отношении может быть использована инфракрасная спектроскопия на основе преобразования Фурье, например, описанная Rahman et al. (1998) J. Org. Chem. 63:6196.
Соответственно, электромагнитное рассеяние может возникать в результате дифракции, отражения, поляризации или преломления падающего электромагнитного излучения, в том числе света и рентгеновского излучения. Такое рассеяние может быть использовано для количественного определения уровня мРНК или уровня белка.
Проточная цитометрия является особенно полезной для анализа эмиссии флуорофора.
Как известно в данной области, проточная цитометрия представляет собой метод с высокой пропускной способностью, который включает быстрый анализ физических и химических характеристик частиц (например, меченой мРНК, ДНК или белков) по мере их прохождения через путь одного или более лазерных лучей при суспендировании в потоке жидкости. Так как каждая частица пересекает лазерный луч, рассеянный свет и флуоресцентный свет, испускаемый каждой клеткой или частицей, детектируется и регистрируется при помощи любого пригодного алгоритма слежения, например такого, который описан в настоящем документе.
Современный проточный цитометр способен выполнять эти задачи вплоть до 100000 клеток/частиц с-1. Посредством использования массива светофильтров и дихроичных зеркал, различные длины волн флуоресцентного излучения могут быть разделены и одновременно детектированы. К тому же может быть использовано несколько лазеров с различными длинами волн возбуждения. Таким образом, различные флуорофоры могут быть использованы для нацеливания и изучения, например, различных иммунных эффекторов внутри образца или иммунных эффекторов от множества субъектов.
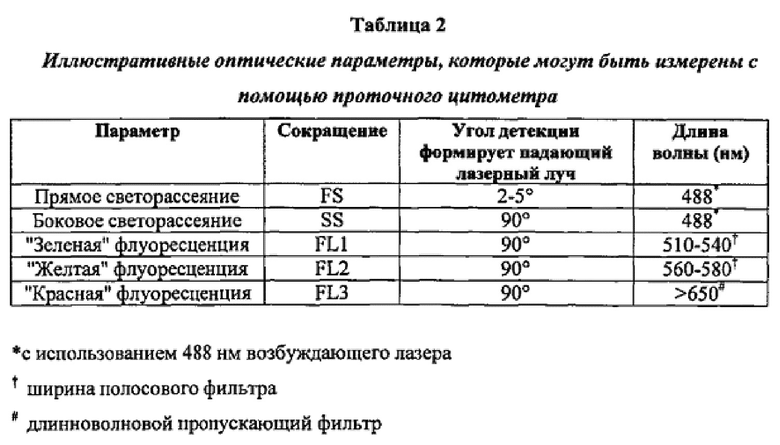
Пригодные проточные цитометры, которые могут быть использованы в способах по настоящему изобретению, включают такие, которые измеряют от пяти до девяти оптических параметров (смотри Таблицу 2) с использованием лазера однократного возбуждения, как правило, лазера с воздушным охлаждением на ионах аргона, работающего при 15 мВт на своей спектральной линии 488 нм. Более усовершенствованные проточные цитометры способны использовать лазеры с многократным возбуждением, такие как HeNe лазер (633 нм) или HeCd (325 нм) дополнительно к лазеру на ионах аргона (488 или 514 нм).
Например, Biggs et al. (1999) Cytometry J6:36-45 сконструировал проточный цитометр для определения 11 параметров с использованием трех возбуждающих лазеров и продемонстрировал использование девяти различимых флуорофоров дополнительно к измерениям прямого светорассеяния и бокового светорассеяния для целей иммунофенотипирования (т.е. классификации) частиц. Выбор параметров, которые могут быть соответствующим образом использованы, в большей степени зависит от коэффициентов экстинкции, квантовых выходов и степени перекрытия спектров между всеми флуорофорами (Malemed et al. (1990) ''Flow cytometry and sorting'', 2nd Ed., New York, Wiley-Liss). Будет понятно, что настоящее изобретение не ограничивается каким-либо конкретным цитометром или любым конкретным набором параметров. В этом отношении изобретение также предполагает использование вместо типового проточного цитометра изготовленный на микропроизводстве цитометр, например такой, который описан Fu et al. (1999) Nature Biotechnology 17:1109-1111.
Представленный в настоящем документе анализ может быть автоматизирован или полуавтоматизирован для скрининга с высокой пропускной способностью или для скрининга на ряд иммунных эффекторов от одного субъекта. Автоматизацией удобно управлять с помощью программного обеспечения для компьютеров.
Таким образом, настоящее изобретение также предусматривает системы на основе web-технологий и не на основе web-технологий, в которых данные по клеточно-опосредованной иммунологической отвечаемости субъекта предоставляются клиент-сервером или другой архитектурой платформы в центральный процессор, который анализирует и сравнивает с контролем, и при необходимости рассматривает другую информацию, такую как возраст пациента, пол, вес и другие медицинские показания, и затем предоставляет отчет, такой как, например, фактор риска заболевания, тяжесть или прогрессирование, или статус, или индекс вероятности развития заболевания. Таким образом, также обеспечен бизнес-метод, согласно которому кровь собирают в переносные пробирки, которые затем анализируют на клеточно-опосредованную иммунологическую отвечаемость в определенном месте, и результаты затем отправляют в форме электронного отчета посредством клиент-сервера или другой архитектуры платформы лицу, осуществляющему клиническое обслуживание.
Таким образом, компьютерное программное обеспечение, основанное на знаниях, и аппаратные средства также являются частью настоящего изобретения. Это способствует клиническому обслуживанию для выяснения, индуцировано или связано ли заболевание, включая инфекцию, рак, воспаление или лекарственное средство, или токсическое вещество, с иммуносупрессией.
Анализы, предлагаемые в настоящем изобретении, могут быть использованы в существующей или новой разработанной архитектуре, основанной на знаниях, или платформах, связанных с патологическими службами. Например, результаты анализов передаются посредством коммуникационной сети (например, сети Интернет) или телефонной связи в систему обработки данных, в которой алгоритм хранится и используется для генерации величины предсказательной апостериорной вероятности, которая переводится в индекс клеточно-опосредованной иммунологической отвечаемости или иммуносупрессии, который затем направляется конечному пользователю в форме диагностического или прогностического отчета. Этот отчет может также стать основой управления клиническим обслуживанием и персонализированной медицины.
Таким образом, анализ может быть представлен в форме набора или компьютерной системы, которая содержит реагенты, необходимые для детекции концентрации иммунной эффекторной молекулы после подвергания лимфоцитов воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и аппаратные средства компьютера и/или программное обеспечение для содействия определению и передачи отчетов клиницисту.
Например, настоящее изобретение предусматривает способ, позволяющий пользователю определять статус клеточно-опосредованной иммунологической отвечаемости субъекта, при этом способ включает:
(a) получение данных в форме уровней или концентраций иммунной эффекторной молекулы, которые относительно контроля обеспечивают корреляцию с состоянием клеточно-опосредованной иммунологической отвечаемости у субъекта, посредством коммуникационной сети, при этом уровень иммунной эффекторной молекулы измеряют после подвергания лимфоцитов воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть;
(b) обработку данных субъекта посредством одномерного или многомерного анализа для обеспечения величины иммунологической отвечаемости;
(c) определение статуса субъекта в соответствии с результатами величины иммунологической отвечаемости в сравнении с предварительно определенными величинами; и
(d) передачу показателя статуса субъекта пользователю посредством коммуникационной сети.
Ссылка на «одномерный» или «многомерный» анализ включает в себя алгоритм, который выполняет функцию одномерного или многомерного анализа. Соответственно, способ в целом также включает:
(a) наличие пользователя, определяющего данные с использованием станции на приемном конце линии; и
(b) передачу данных из конечной станции в базовую станцию посредством коммуникационной сети.
Базовая станция может включать первую и вторую системы обработки данных, и в этом случае способ включает:
(a) передачу данных в первую систему обработки данных;
(b) передачу данных во вторую систему обработки данных; и
(c) выполнение первой системой обработки данных функции одномерного или многомерного анализа для генерации величины клеточно-опосредованной иммунологической отвечаемости.
Способ может также включать:
(a) передачу результатов функции одномерного или многомерного анализа в первую систему обработки данных; и
(b) определение первой системой обработки данных статуса субъекта.
В этом случае способ также включает, по меньшей мере, одно из следующего:
(a) передачу данных между коммуникационной сетью и первой системой обработки данных через первый межсетевой экран; и
(b) передачу данных между первой и второй системами обработки данных через второй межсетевой экран.
Вторая система обработки данных может быть совмещена с базой данных, выполненной с возможностью хранения предварительно определенных данных, и/или функцией одномерного или многомерного анализа, при этом способ включает:
(а) запрос в базе данных для получения, по меньшей мере, выбранных предварительно определенных данных или доступа к функции одномерного или многомерного анализа из базы данных; и
(b) сравнение выбранных предварительно определенных данных с данными субъекта или генерация индекса предсказанной вероятности уровня клеточной иммунологической отвечаемости или иммуносупрессии.
Вторая система обработки данных может быть совмещена с базой данных, при этом способ включает хранение данных в базе данных.
Способ может также включать осуществление базовой станцией:
(a) определения информации по платежам, при этом информация по платежам дает информацию о совершении платежа пользователем; и
(b) выполнение сравнения в ответ на определение информации по платежам. Настоящее изобретение также обеспечивает базовую станцию для определения
статуса субъекта в отношении клеточно-опосредованной иммунологической отвечаемости или иммуносупрессии, при этом базовая станция включает:
(a) способ хранения;
(b) систему обработки данных, при этом система обработки данных выполнена с возможностью:
(c) получения данных субъекта от пользователя посредством коммуникационной сети, при этом данные включают уровни иммунной эффекторной молекулы, при этом уровень эффекторной молекулы относительно контроля обеспечивает корреляцию с состоянием клеточно-опосредованной иммунологической отвечаемости, при этом уровень иммунной эффекторной молекулы определяют после подвергания лимфоцитов воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной от 7 до 14 аминокислотных остатков, и/или второго набора, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть;
(d) выполнения алгоритмической функции, включая сравнение данных с предварительно определенными данными;
(e) определения статуса субъекта в соответствии с результатами алгоритмической функции, включая сравнение; и
(с) вывода показателя статуса субъекта пользователю посредством коммуникационной сети.
Система обработки данных может быть выполнена с возможностью получения данных от станции на приемном конце линии, выполненной с возможностью определения данных.
Система обработки данных может включать:
(a) первую систему обработки данных, выполненную с возможностью:
(i) получения данных; и
(ii) определения статуса субъекта в соответствии с результатами функции одномерного или многомерного анализа, включая сравнение данных; и
(b) вторую систему обработки данных, выполненную с возможностью:
(i) получения данных от системы обработки данных;
(ii) выполнения функции одномерного или многомерного анализа, включая сравнение; и
(iii) передачи результатов в первую систему обработки данных. Система обработки данных может быть совмещена с базой данных, при этом система обработки данных выполнена с возможностью хранения данных в базе данных.
В соответствии с данным вариантом осуществления уровни иммунной эффекторной молекулы могут быть определены отдельно или в сочетании с другими биомаркерами или индикаторами заболевания. «Измененный» уровень означает увеличение или повышение, или уменьшение, или понижение концентраций иммунной эффекторной молекулы.
Определение концентраций или уровней иммунной эффекторной молекулы дает возможность установить диагностическое правило, основанное на концентрациях относительно контролей. Альтернативно, диагностическое правило основано на применении алгоритма статистического и машинного обучения. Такой алгоритм использует взаимосвязи между эффекторной молекулой и статусом заболевания, наблюдаемым в данных режима обучения (с известным заболеванием или статусом клеточно-опосредованной иммунологической отвечаемости) для установления взаимосвязей, которые затем используются для предсказания статуса субъектов с неизвестным статусом. Может быть использован алгоритм, который обеспечивает индекс вероятности того, что субъект имеет определенный уровень клеточно-опосредованной иммунологической отвечаемости и/или заболевание. Алгоритм выполняет функцию одномерного или многомерного анализа.
Таким образом, настоящее изобретение обеспечивает диагностическое правило, основанное на применении алгоритмов статистического и машинного обучения. Такой алгоритм использует взаимосвязи между иммунной эффекторной молекулой и уровнем клеточно-опосредованной иммунологической отвечаемости или иммуносупрессии, наблюдаемым в данных режима обучения (с известным иммунным статусом), для установления взаимосвязей, которые затем используются для предсказания статуса пациентов с неизвестным иммунным статусом. Для практикующих врачей, опытных в области анализа данных, будет понятно, что много различных форм устанавливаемых взаимосвязей в данных режима обучения может быть использовано без существенного изменения настоящего изобретения.
К тому же настоящее изобретение предусматривает использование базы знаний данных режима обучения, содержащих уровни иммунной эффекторной молекулы от субъекта с известным уровнем клеточно-опосредованной иммунологической отвечаемости, для создания алгоритма, который при вводе данных второй базы знаний, содержащих уровни такой же иммунной эффекторной молекулы от субъекта с неизвестным уровнем иммунологической отвечаемости, обеспечивает индекс вероятности, предсказывающий природу клеточно-опосредованной иммунологической отвечаемости.
Термин «данные режима обучения» включает в себя информацию об уровнях иммунной эффекторной молекулы относительно контроля, при этом уровень иммунной эффекторной молекулы определяют после подвергания лимфоцитов воздействию, по меньшей мере, двух наборов пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго набора, содержащего по меньшей мере один пептид длиной 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть. «Контроль» включает в себя сравнение с уровнями иммунной эффекторной молекулы у субъекта с «нормальной» иммунологической отвечаемостью или может быть определенным статистически уровнем на основе испытаний.
Таким образом, термин «данные режима обучения» включает уровни иммунной эффекторной молекулы.
Уровни или концентрации иммунной эффекторной молекулы обеспечивают входные данные тестирования, называемые здесь как «данные второй базы знаний». Данные второй базы знаний рассматриваются относительно контроля или вводятся в алгоритм, созданный «данными первой базы знаний», который содержит информацию об уровнях иммунного эффектора у субъекта с известным иммунологическим статусом. Данные второй базы знаний получены от субъекта с неизвестным статусом в отношении клеточно-опосредованной иммунологической отвечаемости. Результат работы алгоритма или сравнение с контролем представляет собой вероятность или фактор риска, называемый здесь как «индекс вероятности», субъекта, имеющего определенный уровень иммунологической отвечаемости или иммуносупрессии.
Данные, полученные из уровней иммунной эффекторной молекулы, представляют собой входные данные. Ввод данных, содержащих уровни иммунного эффектора, сравнивают с контролем или вводят в алгоритм, который обеспечивает величину риска вероятности того, что субъект имеет, например, иммуносупрессивное состояние. Схема лечения также может контролироваться для выявления присутствия любой иммуносупрессии. Уровень иммуносупрессии может повышать риск для субъекта получения вторичной инфекции или обострения (например, во время терапии рака или лечения патогенной инфекции).
Как описано выше, способы диагностики иммунологической отвечаемости или иммуносупрессивного состояния путем определения степени, до которой субъект может повышать врожденный и/или адаптивный иммунный ответ посредством уровня иммунной эффекторной молекулы, обеспечивают данные второй базы знаний в алгоритме, созданном с помощью данных первой базы знаний или уровней такой же эффекторной молекулы у субъектов с известным иммунным статусом. Кроме того, обеспечены способы выявления иммунологической отвечаемости, включающие определение присутствия и/или скорости роста уровня иммунной эффекторной молекулы после стимуляции врожденной и/или адаптивной иммунной системы в образце от субъекта. Под «скоростью» понимается изменение концентрации эффекторной молекулы в образце от субъекта с течением времени.
Как указано выше, термин «образец», используемый здесь, означает любой образец, содержащий один или более лимфоцитов, включая, но без ограничения, цельную кровь, фракцию цельной крови, экстракты тканей и свежесобранные клетки.
Способ по настоящему изобретению может применяться для диагностики и определения стадии заболевания. Настоящее изобретение может также применяться для отслеживания прогрессирования состояния и для контроля, является ли конкретное лечение эффективным или нет. В частности, способ можно применять для контроля иммуносупрессии после хирургической операции, терапии рака или других, или лекарственных средств, или воздействия токсических веществ.
В одном варианте осуществления настоящее изобретение рассматривает способ контроля иммуносупрессии у субъекта, включающий:
(а) обеспечение образца от субъекта;
(b) определение уровня иммунной эффекторной молекулы после стимуляции, по меньшей мере, двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть;
при этом уровень иммунного эффектора относительно контроля обеспечивает корреляцию с состоянием клеточно-опосредованной иммунологической отвечаемости, и подвергание уровней алгоритму для обеспечения индекса вероятности того, что субъект имеет определенный уровень иммунологической отвечаемости; и
(c) повторение стадий (а) и (b) в более поздний момент времени, и сравнение результата стадии (b) с результатом стадии (с), при этом различие в индексе вероятности является показателем прогрессирования состояния у субъекта.
Ссылка на «алгоритм» или «алгоритмические функции», как указано выше, включает в себя выполнение функции одномерного или многомерного анализа. Ряд различных архитектур и платформ может быть реализован дополнительно к описанным выше. Следует учесть, что может быть использована любая форма архитектуры, пригодная для осуществления настоящего изобретения. Однако одной предпочтительной методикой является использование распределенных архитектур. В частности, ряд конечных станций может быть обеспечен в соответствующих географических местоположениях. Это может повысить эффективность системы путем уменьшения затрат на пропускную способность и требований, а также обеспечить то, что если одна базовая станция становится перегруженной или возникает неисправность, другие конечные станции могут принимать на себя. Это также позволяет распределить нагрузку или тому подобное для обеспечения доступа к системе в любое время.
В этом случае было бы необходимо убедиться в том, что базовая станция содержит такую же информацию и сигнатуру для того, чтобы можно было использовать различные конечные станции.
Следует учесть, что в одном примере конечные станции могут представлять собой портативные приборы, такие как PDA, мобильные телефоны или тому подобное, которые способны передавать данные субъекта на базовую станцию посредством коммуникационной сети, такой как сеть Интернет, и получать отчеты.
В указанных выше аспектах термин «данные» означает уровни или концентрации иммунного эффектора после стимуляции сериями перекрывающихся пептидов длиной примерно от 7 до 14 аминокислотных остатков, которые охватывают всю длину белкового антигена. «Коммуникационная сеть» включает в себя сеть Интернет и мобильную телефонную сеть, и телефонную наземную линию. При использовании сервера, сервер, как правило, представляет собой сервер-клиент или, в частности, простой объектный протокол доступа (SOAP).
Один аспект настоящего изобретения включает эксперименты, которые демонстрируют клеточно-опосредованную иммунологическую отвечаемость субъекта путем измерения отвечаемости, по меньшей мере, на два набора пептидов, первого набора, содержащего по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и второго пептида, содержащего по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть. В одном варианте осуществления один или более образцов, таких как образец периферической крови, обогащенной лейкоцитами фракции крови или бронхоальвеолярные выделения, могут быть получены от субъекта, у которого имеется или предполагается развитие конкретного заболевания (например, аутоиммунного заболевания, инфекции, вызванной патогенным агентом, или подвергание воздействию белковоподобного токсического вещества), и иммунная отвечаемость измеряется путем определения уровня эффекторных молекул из эффекторных Т-клеток (например, CD4+ Т-клеток и CD8+ Т-клеток).
Способы иммунного связывания включают способ выявления или количественного определения реакционноспособного компонента в образце, при этом способы требуют выявления или количественного определения любых иммунных комплексов, образовавшихся во время процесса связывания. В настоящем документе получают образец, в котором предполагают присутствие цитокина после стимуляции лимфоцитов, по меньшей мере, двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и приводят этот образец в контакт с антителом и затем детектируют или определяют количество иммунных комплексов, образовавшихся в этих специфических условиях.
Приведение в контакт выбранного биологического образца с антителом в эффективных условиях и в течение периода времени, достаточного для образования иммунных комплексов (первичных иммунных комплексов), обычно представляет собой добавление композиции к образцу и инкубацию смеси в течение длительного периода времени, достаточного для образования антителами иммунных комплексов, то есть связывания с любыми присутствующими эффекторными молекулами. После этого композицию образец-антитело, такую как срез ткани, планшет ELISA, метод иммуноферментных пятен (ELISpot), дот-блот или Вестерн-блот, обычно отмывают для удаления любых неспецифически связанных видов антител, оставляя для определения только те антитела, которые специфически связаны в первичных иммунных комплексах.
В конкретном варианте осуществления настоящее изобретение предлагает способ выявления присутствия, отсутствия, уровня или стадии заболевания или состояния у субъекта-человека, при этом способ включает приведение в контакт цельной крови, содержание которой составляет, по меньшей мере, 10% общего объема в реакционной смеси, по меньшей мере с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть, и измерение присутствия или повышения уровня иммунной эффекторной молекулы из Т-клеток, при этом присутствие или уровень иммунной эффекторной молекулы является показателем заболевания или состояния.
В дополнительном варианте осуществления настоящее изобретение предлагает наборы для использования с описанными выше способами. В одном варианте осуществления рассматривается набор для иммунологического анализа. В другом варианте осуществления рассматривается набор для анализа образца от субъекта, имеющего или у которого предполагают развитие металл- или химически-индуцированного заболевания. В более конкретном варианте осуществления рассматривается набор для анализа образца от субъекта, имеющего или у которого предполагается развитие заболевания. В одном варианте осуществления набор предназначен для оценки клеточно-опосредованной иммунологической отвечаемости субъекта до и после развития заболевания, или до или после приема субъектом лекарственного средства, или воздействия токсического вещества или загрязняющего вещества. Кроме того, в случае использования антигена, набор может также содержать конкретный антиген.
Реагенты для иммунологического анализа в наборе могут быть представлены в любой из разнообразных форм, включая такие детектируемые метки, которые ассоциированы или связаны с данным антителом или антигеном, и детектируемые метки, которые ассоциированы или присоединены к вторичному связывающему лиганду. Примерами вторичных лигандов являются такие вторичные антитела, которые обладают аффинностью связывания в отношении первого антитела или антигена, и вторичные антитела, которые обладают аффинностью связывания в отношении антитела человека.
Дополнительные пригодные реагенты для иммунологического анализа для применения в настоящих наборах включают двухкомпонентный реагент, который содержит вторичное антитело, которое обладает аффинностью связывания в отношении первого антитела или антигена, а также третье антитело, которое обладает аффинностью связывания в отношении второго антитела, при этом третье антитело связано с детектируемой меткой.
Наборы могут дополнительно содержать пригодную поделенную на аликвоты композицию антигена или эффекторной молекулы, меченой или немеченой, которая может применяться для построения калибровочной кривой для анализа на обнаружение.
Наборы могут содержать меченые антителом конъюгаты в полностью конъюгированной форме, в форме промежуточных соединений или в виде отдельных фрагментов, подлежащих конъюгации пользователем набора. Компоненты наборов могут быть упакованы в водной среде или в лиофилизированной форме.
Контейнеры для любого из наборов обычно включают, по меньшей мере, один флакон, тестируемую пробирку, колбу, бутылку, шприц или другие средства, в которые тестируемый агент, антитело или антиген могут быть помещены, и обычно подходящим образом поделены на аликвоты. В случаях, когда обеспечен второй или третий связывающий лиганд или дополнительный компонент, набор также обычно содержит второй, третий или другой дополнительный контейнер, в который этот лиганд или компонент может быть помещен. Кроме того, наборы, представленные в настоящем изобретении, обычно включают средства для содержания антитела, пептидов, полученных из антигена, и любые другие контейнеры для реагентов в закрытом исполнении для коммерческой продажи. Такие контейнеры могут включать инъекционные или изготовленные выдувным формованием пластиковые контейнеры, в которых содержатся требуемые флаконы.
Также в настоящем документе предлагается улучшенный анализ для выявления клеточно-опосредованного иммунного ответа или его уровня у субъекта, при этом анализ включает инкубацию лимфоцитов от субъекта с антигеном и выявление присутствия или повышения уровня эффекторных молекул, при этом улучшение включает инкубацию лимфоцитов, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым набором, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или его часть.
К тому же настоящее изобретение обеспечивает способ лечения субъекта, имеющего патогенную инфекцию, аутоиммунное нарушение или рак, или вероятность развития такого состояния или нарушения, при этом способ включает приведение в контакт источника лимфоцитов от субъекта, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков, и вторым пептидом, содержащим по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь белковый антиген или часть, и измерение присутствия или повышения уровня иммунной эффекторной молекулы из Т-клеток, при этом присутствие или уровень иммунной эффекторной молекулы является показателем уровня клеточно-опосредованной отвечаемости субъекта, что является показателем присутствия, отсутствия, уровня или стадии состояния или нарушения и последующее лечение состояния или нарушения.
Аспекты, предложенные в настоящем документе, далее описаны с помощью следующих неограничивающих Примеров.
Пример 1 Разработка способа анализа
Гепаринизированные образцы крови собирали в вакуумные пробирки с Li-Гепарином Vacuette [Зарегистрированная торговая марка] (Greiner Bio-one, Германия).
Аликвоты образцов крови инкубировали, по меньшей мере, с двумя наборами пептидов, первым набором, содержащим по меньшей мере один пептид длиной примерно от 7 до 14 аминокислотных остатков (распознающий CD8+ Т-клетки), и вторым набором, содержащим, по меньшей мере один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды (распознающие CD4+ Т-клетки) охватывают весь белковый антиген или его часть, при этом антиген выбран из М. tuberculosis CFP10, ESAT-6, ТВ7.7 и ТВ37.6.
В отдельных экспериментах перед инициированием инкубации в кровь добавляли глюкозу в различных концентрациях.
Стимулированные образцы крови инкубировали в течение от 1 до 48 часов, в том числе 16-24 часов в присутствии антигенных пептидов при 37°C, после чего плазму собирали над осажденными клетками крови. Количество гамма-интерферона (IFN-γ), присутствующего в каждом образце плазмы, затем количественно определяли с использованием Quantiferon-TB [Зарегистрированная торговая марка] ELISA (Cellestis Limited, Австралия) согласно инструкциям производителя. Образец IFN-γ альтернативно количественно определяли с использованием более чувствительного теста Quantiferon-TB Gold [Зарегистрированная торговая марка] ELISA (Cellestis Limited, Австралия) согласно инструкциям производителя.
Значения оптической плотности ELISA для стандартов IFN-γ, измеренные на каждом ELISA планшете, использовали для построения калибровочной кривой, из которой количество IFN-γ, присутствующего в каждом из тестируемых образцов плазмы, переводили в величины МЕ/мл.
Пример 2
Вторичные иммунные ответы в пробирках QuantiFERON-TB путем добавления CD8+ ТВ-специфических пептидов к CD4+ пептидам
Данные исследования проводили в группе из пациентов с клинически подтвержденной активной туберкулезной инфекцией. Пациентов тестировали с помощью существующего в настоящее время диагностического теста QuantiFERON-TB In-Tube. Пробирка QuantiFERON-TB содержит пулы пептидов, специфичных в отношении CD4+ Т-клеток (>15-мерные пептиды). Пациентов также тестировали с использованием модифицированной пробирки, в которую были добавлены пулы пептидов (10-мерные пептиды), специфичных в отношении CD8+ Т-клеток. Эти дополнительные пептиды тестировали как полный пул из 91 пептида, и как два пула меньшего размера. Эти пулы также добавляли в пробирки QuantiFERON-Nil в качестве контролей для оценки исходных ответов только на эти пептиды.
У пациентов с заболеванием активным ТВ-заболеванием добавление CD8+пептидов в пробирки QuantiFERON-TB вызвало 10% увеличение чувствительности по сравнению с существующим в настоящее время тестом QuantiFERON-TB.
Пример 3
Диагностика туберкулеза (ТВ) с использованием CF10 пептидных пулов
Целью данного Примера является тестирование способности антигенов ТВ, направленных на распознавание CD8+ Т-клетками (10-мерные пептиды), индуцировать продуцирование обнаруживаемых уровней IFN-γ в крови от пациента с активной ТВ инфекцией. Было сделано предположение о том, что использование пептидов, рестриктированных I классом комплекса гиперсовместимости (МНС) (названные «CD8+ пептиды»), отдельно или в сочетании с текущими пептидами будет улучшать чувствительность диагностики ТВ. Это особенно важно для ВИЧ-инфицированных индивидов, которые имеют пониженное число CD4+ Т-клеток.
Всего 91 пептидов, каждый длиной 10 аминокислот, покрывающих всю длину Mtb белка CFP10, объединяли вместе в три пула. Пул 1 содержал все 91 пептидов, Пул 2 содержал пептиды, покрывающие первую половину белка CFP10 (пептиды 1-45), и Пул 3 содержал пептиды, покрывающие вторую часть белка CFP10 (пептиды 46-91). Пулы тестировали по отдельности (добавляли в Nil пробирки) или в комбинации с текущей пробиркой с антигеном QFT-TB Gold.
Всего было набрано 63 пациента. Из них 50 пациентов имели положительный результат в тесте QuantiFERON-TB Gold In-tube. Было набрано 31 пациентов, у которых имелось активное ТВ заболевание, подтвержденное культурой (или клинические симптомы в одном случае), и у 19 набранных пациентов предполагался ТВ.
Информация о пациентах:
ТВ заболевание: 31 (один не подтвержден культурой)
ТВ предполагаемые: 19
ННС: 13
Всего пациентов: 63
Результаты показаны в Таблицах с 3 по 7 и на Фигуре 1 и показывают количественные результаты для пептидных пулов, тестированных в комбинации с пробиркой с антигеном QFT-TB Gold.


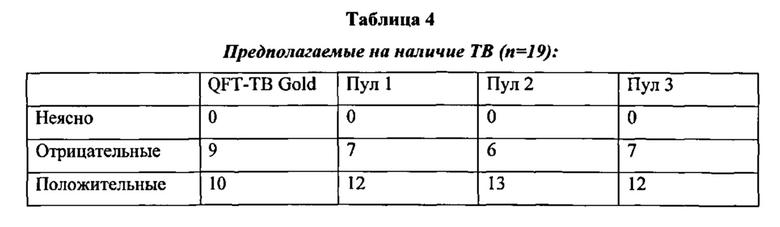
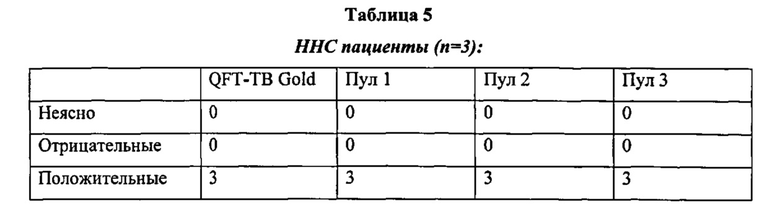
Количественный анализ выполняли для изучения эффектов добавления пулов CD8+ пептидов в существующие пробирки CD4+ пептидов в отношении усиления IFN-γ ответа по сравнению только с пробиркой с антигеном QFT-TB Gold. Усиление IFN-γ ответа определяли как >1.5-кратное увеличение результата QFN ТВ. Оцениваемые пациенты исключают тех пациентов, у которых ответ был превращен/возвращен к прежнему состоянию или когда не все образцы плазмы поддавались количественному обнаружению. Фигура 1 указывает средний ответ IFN-γ на QFT-TB отдельно или в комбинации с каждым пулом.



Эти данные указывают на то, что добавление CD8+ пептидов в текущий анализ QFT-TB Gold In Tube (который содержит CD4+ пептиды) вызывает 10% увеличение чувствительности анализа. Более того, данные указывают на то, что увеличение магнитуды ответа («усиление») больше чем в 1.5 раза, возникающее в результате добавления CD 8 пептидов, является только кажущимся, когда анализ выполняется на образцах от пациентов, полученных от субъектов с подтвержденным активным ТВ заболеванием. Эти данные указывают на то, что добавление CD8 пептидов в текущий анализ QFT-TB Gold In Tube различается между субъектами с активным по сравнению с латентным ТВ заболеванием.
Пример 4
Эффект CFP10 CD8+ пептидов на специфичность анализа
Целью данного Примера является изучение, вызывает ли добавление CFP10 CD8+ пептидов в QFT-TB Gold tube уменьшение специфичности анализа. Таким образом, пептидные пулы использовали в сочетании с анализом QFT-TB Gold In Tube (который содержит CD4+ пептиды) у популяции здоровых контрольных доноров, набранных из страны с низкими случаями возникновения ТВ (Мельбурн, Австралия).
Всего 91 пептидов, каждый длиной 10 аминокислот, покрывающих всю длину CFP10 Mtb белка, объединяли вместе в три пула. Пул 1 содержал пептиды, покрывающие первую половину CFP10 белка (пептиды 1-45), Пул 2 содержал пептиды, покрывающие вторую половину CFP10 белка (пептиды 46-91) и Пул 3 содержал все 91 пептидов.
Всего было набрано 92 субъектов. Их них 3 субъектов имели положительный результат теста QuantiFERON-TB Gold In Tube. Субъекты с отрицательным результатом теста QFT-TB не показали ответа на любые пептидные пулы. Результаты показаны в Таблицах 8 и 9.
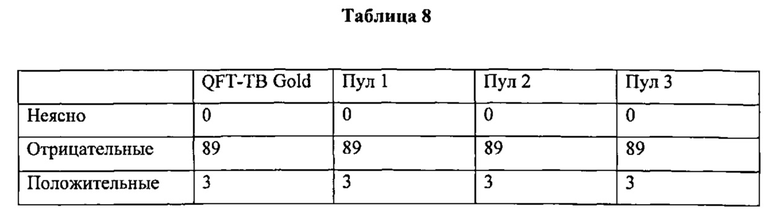
Из 3 доноров, имеющих положительный результат тестирования QFT-TB, усиления IFN-γ ответа не наблюдалось при добавлении пептидных пулов (>1.5 кратное увеличение результата QFN ТВ).

Эти данные указывают на то, что добавление CD8+ пептидов в текущий анализ QFT-TB Gold In Tube не оказывает отрицательного влияния на специфичность анализа.
Пример 5
Комбинация CMV 16-мерных CD4+ пептидов и CD8+ пептидов в анализе методом QFT-CMV
В этом Примере изучали, усиливает ли добавление CD8+ пептидов ответ в анализе QFT-CMV с использованием 16-мерного пептида из антигена рр65 CMV.
Кровь от трех здоровых доноров с положительным результатом серологического теста на цитомегаловирус CMV использовали в анализе QFT-CMV с добавлением 1) Nil-пробирки, содержащей 1 мкг/мл (конечная концентрация) 16-мерного пептида, и 2) пробирку QFT-CMV с добавлением 1 мкг/мл (конечная концентрация) 16-мерного пептида. Анализ выполняли согласно инструкциям производителя.
0/3 доноров отвечали только на 16-мерный пептид. 3/3 доноров отвечали на 16-мерный+С08+ - пептиды в анализе QFT-CMV. Результаты показаны графически на фигуре 1 ниже.
Не наблюдалось ответа на 16-мерный пептид у любого донора. Все доноры показали положительный ответ на 16-мерный пептид в комбинации с CD8+ пептидами в анализе QFT-CMV.
Опытным специалистам в данной области будет понятно, что описаны аспекты настоящего изобретения. Следует учесть, что изобретение охватывает все такие варианты и модификации. Изобретение также включает все стадии, признаки, композиции и соединения, на которые сделана ссылка или которые указаны в данном описании, индивидуально или вместе, и любые и все комбинации любых двух или более стадий или признаков.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ПРОГНОЗИРОВАНИЯ ПРИМЕНИМОСТИ БЕЛКОВ ИЛИ БЕЛКОВЫХ ФРАГМЕНТОВ ДЛЯ ИММУНОТЕРАПИИ | 2017 |
|
RU2782336C2 |
| АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЕ | 2018 |
|
RU2794945C2 |
| АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2016 |
|
RU2792042C2 |
| СПОСОБЫ ПРОГНОЗИРОВАНИЯ ПРИМЕНИМОСТИ СПЕЦИФИЧНЫХ ДЛЯ ЗАБОЛЕВАНИЯ АМИНОКИСЛОТНЫХ МОДИФИКАЦИЙ ДЛЯ ИММУНОТЕРАПИИ | 2018 |
|
RU2799341C2 |
| ЛЕЧЕНИЕ РАКА ПРИ ПОМОЩИ НАПРАВЛЕННЫХ НА МИШЕНЬ АНТИТЕЛ IN VIVO | 2011 |
|
RU2642305C2 |
| МОДИФИЦИРОВАННЫЕ ЭПИТОПЫ ДЛЯ УСИЛЕНИЯ ОТВЕТОВ CD4+ Т-КЛЕТОК | 2013 |
|
RU2724994C2 |
| Модифицированные клетки с химерным антигеновым рецептором для лечения рака, экспрессирующего CLDN6 | 2020 |
|
RU2826058C2 |
| ПРЕДСКАЗАНИЕ ИММУНОГЕННОСТИ Т-КЛЕТОЧНЫХ ЭПИТОПОВ | 2014 |
|
RU2724370C2 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ ПРЕЗЕНТАЦИИ МНОЖЕСТВЕННЫХ АНТИГЕНОВ, ОТНОСЯЩИЕСЯ К НЕЙ СПОСОБЫ И ПРИМЕНЕНИЯ | 2012 |
|
RU2619176C2 |
| ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ С МУТИРОВАННЫМИ КОСТИМУЛЯТОРНЫМИ ДОМЕНАМИ CD28 | 2018 |
|
RU2800922C2 |
Группа изобретений относится к медицине, а именно к иммунологии, и может быть использована для измерения активности клеточно-опосредованного иммунного ответа у субъекта. При этом проводят совместную инкубацию образца, включающего лимфоциты от субъекта, по меньшей мере, с двумя наборами пептидов, полученных из белкового антигена. Первый набор, распознающийся CD8+ лимфоцитами, содержит один пептид длиной от 7 до 14 аминокислотных остатков. Второй набор, распознающийся CD4+ лимфоцитами, содержит один пептид длиной от 16 аминокислотных остатков или больше. При этом пептиды охватывают весь указанный белковый антиген или его часть. Измеряют присутствие или повышение уровня иммунной эффекторной молекулы из эффекторных Т-клеток. Присутствие или уровень иммунной эффекторной молекулы для Т-клеток является показателем уровня клеточно-опосредованной отвечаемости субъекта. Также предложены применение и способ определения статуса активности клеточно-опосредованного иммунного ответа у субъекта. Группа изобретений позволяет измерить общий клеточно-опосредованный иммунный ответ от CD4+ и от CD8+ лимфоцитов, за счет повышения чувствительности и специфичности способа измерения. 3 н. и 21 з.п. ф-лы, 9 табл., 2 ил.,5 пр.
1. Способ измерения активности клеточно-опосредованного иммунного ответа у субъекта, при этом указанный способ включает совместную инкубацию образца, включающего лимфоциты от субъекта, по меньшей мере, с двумя наборами пептидов, полученных из белкового антигена, причем первый набор, распознающийся CD8+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 7 до 14 аминокислотных остатков, и второй набор, распознающийся CD4+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь указанный белковый антиген или его часть, и измерение присутствия или повышения уровня иммунной эффекторной молекулы из эффекторных Т-клеток, при этом присутствие или уровень иммунной эффекторной молекулы для Т-клеток является показателем уровня клеточно-опосредованной отвечаемости субъекта.
2. Способ по п. 1, в котором субъектом является человек.
3. Способ по п. 1, в котором эффекторные Т-клетки представляют собой CD4+ Т-клетки и CD8+ Т-клетки.
4. Способ по п. 1, в котором образец, включающий лимфоциты, представляет собой неразбавленную цельную кровь.
5. Способ по п. 1, в котором образец, включающий лимфоциты, представляет собой цельную кровь, которая составляет примерно от 10% до 100% по объему от образца, подлежащего анализу.
6. Способ по п. 5, в котором цельная кровь составляет примерно от 50% до 100% по объему от образца, подлежащего анализу.
7. Способ по п. 6, в котором цельная кровь составляет примерно от 80% до 100% по объему от образца, подлежащего анализу.
8. Способ по п. 4 или 5, в котором цельную кровь собирают в пробирку, содержащую гепарин.
9. Способ по п. 1, в котором иммунная эффекторная молекула представляет собой цитокин.
10. Способ по п. 9, в котором цитокин представляет собой гамма-интерферон (IFN-γ).
11. Способ по п. 1, в котором иммунную эффекторную молекулу выявляют с помощью антител, специфичных в отношении них.
12. Способ по п. 11, в котором иммунную эффекторную молекулу выявляют методом иммуноферментного анализа (ELISA).
13. Способ по п. 12, в котором иммунную эффекторную молекулу выявляют методом ELISpot.
14. Способ по п. 1, в котором субъект имеет инфекцию, вызванную патогенным агентом, выбранным из видов Mycobacterium, видов Staphylococcus, видов Streptococcus, видов Borrelia, Escherichia coli, видов Salmonella, видов Clostridium, видов Shigella, видов Proteus, видов Bacillus, вируса герпеса, вируса гепатита В или С и вируса иммунодефицита человека (ВИЧ), или заболевание, связанное с такими инфекциями.
15. Способ по п. 14, в котором заболевание представляет собой инфекцию, вызванную Mycobacterium tuberculosis, или туберкулез (ТВ).
16. Способ по п. 15, в котором антиген выбран из CFP10, ESAT-6, ТВ7.7 и ТВ37.6.
17. Способ по п. 1, в котором субъект имеет заболевание, выбранное из очаговой алопеции, анкилозирующего спондилита, антифосфолипидного синдрома, аутоиммунной болезни Аддисона, рассеянного склероза, аутоиммунного заболевания надпочечников, аутоиммунной гемолитической анемии, аутоиммунного гепатита, аутоиммунного оофорита и орхита, болезни Бехчета, буллезного пемфигоида, кардиомиопатии, целиакии спру-дерматита, синдрома хронической усталости (CFIDS), хронической воспалительной демиелинизации, хронической воспалительной полинейропатии, синдрома Чарга-Стросса, рубцующегося пемфигоида, CREST-синдрома, синдрома холодовой агглютинации, болезни Крона, герпетиформного дерматита, дискоидной волчанки, эссенциальной смешанной криоглобулинемии, фибромиалгии, гломерулонефрита, базедовой болезни, синдрома Гийена-Барре, тиреоидита Хашимото, идиопатического легочного фиброза, идиопатической тромбоцитопенической пурпуры (ITP), IgA-нефропатии, сахарного инсулинзависимого диабета (I типа), красного плоского лишая, волчанки, синдрома Меньера, рассеянного склероза, миастении гравис, миокардита, обыкновенной пузырчатки, пернициозной анемии, узелкового полиартериита, полихондрии, полигландулярных синдромов, ревматической полимиалгии, полимиозита и дерматомиозита, первичной агаммаглобулинемии, первичного билиарного цирроза, псориаза, феномена Рейно, синдрома Рейтера, ревматического полиартрита, ревматоидного артрита, саркоидоза, склеродермии, синдрома Шегрена, синдрома скованного человека, системной красной волчанки, болезни отсутствия пульса, височного артериита/гигантоклеточного артериита, язвенного колита, увеита, васкулита, витилиго и воспалительного заболевания кишечника.
18. Способ по п. 1, в котором субъект имеет целиакию.
19. Способ по п. 1, в котором субъект имеет аутоиммунный диабет.
20. Способ по п. 1, в котором субъект имеет рак, выбранный из протоонкогена ABL1, СПИД-ассоциированных злокачественных опухолей, невриномы слухового нерва, острого лимфоцитарного лейкоза, острого миелолейкоза, аденокистозной карциномы, адренокортикального рака, идиопатической миелоидной метаплазии, альвеолярной саркомы мягких тканей, рака анального канала, ангиосаркомы, апластической анемии, астроцитомы, атаксии-телеангиэктазии, базально-клеточной карциномы кожи, рака мочевого пузыря, рака костей, колоректального рака, глиомы ствола головного мозга, опухолей головного мозга и центральной нервной системы (CNS), рака молочной железы, опухолей CNS, карциноидных опухолей, рака шейки матки, хондросаркомы, хориокарциномы, хронического лимфолейкоза, хронического миелолейкоза, колоректального рака, кожной Т-клеточной лимфомы, возвышающейся дерматофибросаркомы, десмопластической мелко-круглоклеточной опухоли, протоковой карциномы, эндокринных злокачественных опухолей, рака эндометрия, эпендимомы, рака пищевода, саркомы Юинга, злокачественной опухоли внепеченочного желчного протока, злокачественной опухоли глаз, меланомы, ретинобластомы глаз, злокачественной опухоли фаллопиевых труб, анемии Фанкони, фибросаркомы, рака мочевого пузыря, рака желудка, злокачественной опухоли желудочно-кишечного тракта, гастроинтестинальной карциноидной опухоли, рака мочеполовой системы, опухолей из половых клеток, гестационно-трофобластической болезни, глиомы, гинекологических злокачественных опухолей, гематологических злокачественных опухолей, волосатоклеточного лейкоза, рака головы и шеи, рака печени, наследственного рака молочной железы, гистиоцитоза, болезни Ходжкина, папилломавируса человека, пузырного заноса, гиперкальцемии, рака гортанной части глотки, внутриглазной меланомы, рака островковых клеток, саркомы Капоши, рака почки, гистиоцитоза клеток Лангерганса, рака гортани, лейомиосаркомы, лейкоза, синдрома Ли-Фраумени, рака губ, липосаркомы, рака печени, рака легких, лимфостаза, лимфомы, лимфомы Ходжкина, неходжкинской лимфомы, рака молочной железы мужчин, злокачественной палочковидной опухоли почек, медуллобластомы, меланомы, рака клеток Меркеля, мезотелиомы, рака полости рта, множественной эндокринной неоплазии, грибовидного микоза, миелодиспластического синдрома, миеломы, миелопролиферативных нарушений, злокачественной опухоли носа, носоглоточной злокачественной опухоли, аденосаркомы почки, нейробластомы, нейрофиброматоза, синдрома разрывов Неймегена, злокачественной опухоли кожи, не являющейся меланомой, немелкоклеточного рака легкого (NSCLC), злокачественных опухолей глаз, рака пищевода, рака ротовой полости, злокачественной опухоли ротовой части глотки, остеосаркомы, рака стомы яичников, рака поджелудочной железы, околоносовой злокачественной опухоли, рака паращитовидной железы, злокачественной опухоли околоушной железы, рака полового члена, периферийных нейроэктодермальных опухолей, рака гипофиза, истинной полицитемии, рака предстательной железы, почечно-клеточной карциномы, ретинобластомы, рабдомиосаркомы, синдрома Ротмунда-Томсона, злокачественной опухоли слюнных желез, саркомы, шванномы, синдрома Сезари, рака кожи, мелкоклеточного рака легких (SCLC), злокачественной опухоли тонкой кишки, саркомы мягких тканей, опухоли спинного мозга, плоскоклеточной карциномы кожи, рака желудка, синовиальной саркомы, злокачественной опухоли семенников, злокачественной опухоли тимуса, рака щитовидной железы, переходно-клеточного рака мочевого пузыря, переходно-клеточного рака почечной лоханки или мочеточника, трофобластной злокачественной опухоли, рака уретры, рака мочевыделительной системы, уроплакинов, саркомы матки, рака матки, рака влагалища, рака наружных женских половых органов, макроглобулинемии Вальденстрема и опухоли Вильмса.
21. Способ по п. 1, в котором субъект был подвергнут воздействию белковоподобного токсического вещества.
22. Способ по любому из пп. с 1 по 21, в котором величина клеточно-опосредованного иммунного ответа коррелирует с состоянием, прогрессированием и/или тяжестью заболевания.
23. Применение, по меньшей мере, двух наборов пептидов, полученных из белкового антигена, причем первый набор, распознающийся CD8+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 7 до 14 аминокислотных остатков, и второй набор, распознающийся CD4+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь указанный белковый антиген или его часть, для изготовления набора для диагностики для измерения активности клеточно-опосредованного иммунного ответа у субъекта способом, состоящим в совместной инкубации наборов пептидов с образцом, включающим лимфоциты от субъекта, и измерении присутствия или повышения уровня иммунных эффекторных молекул из эффекторных Т-клеток.
24. Способ, позволяющий пользователю определить статус активности клеточно-опосредованного иммунного ответа у субъекта, при этом способ включает:
a. Получение от пользователя, посредством коммуникационной сети, данных в форме уровней или концентраций иммунной эффекторной молекулы из эффекторных Т-клеток, которые относительно контроля обеспечивают корреляцию с состоянием активности клеточно-опосредованного иммунного ответа у субъекта, при этом уровень эффекторной молекулы измеряют после совместной инкубации лимфоцитов от субъекта с, по меньшей мере, двумя наборами пептидов, полученных из белкового антигена, причем первый набор, распознающийся CD8+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 7 до 14 аминокислотных остатков, и второй набор, распознающийся CD4+ лимфоцитами, содержит, по меньшей мере, один пептид длиной от 16 аминокислотных остатков или больше, при этом пептиды охватывают весь указанный белковый антиген или его часть;
b. обработку данных субъекта посредством одномерного или многомерного анализа для обеспечения величины иммунологической отвечаемости;
c. определение статуса субъекта в соответствии с результатами величины иммунологической отвечаемости в сравнении с предварительно определенными величинами; и
d. передачу показателя статуса субъекта пользователю посредством коммуникационной сети.
| WO 2009121845 A2, 08.10.2009 | |||
| WO 2009129569 A1, 29.10.2009 | |||
| DEETZ C | |||
| et al., Gamma interferon secretion by human Vgamma2Vdelta2 T cells after stimulation with antibody against the T-cell receptor plus the Toll-Like receptor 2 agonist Pam3Cys, Infect Immun | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Устройство для определения спелости зерен и частей растений | 1987 |
|
SU1539635A1 |
| HART O.M | |||
| et al | |||
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
Авторы
Даты
2018-03-15—Публикация
2012-06-27—Подача