Настоящее изобретение имеет отношение к аминокислотным последовательностям, которые могут связываться с сывороточным альбумином.
В частности, настоящее изобретение имеет отношение к одиночным вариабельным доменам иммуноглобулина, и в частности одиночным вариабельным доменам тяжелой цепи иммуноглобулина, которые могут связываться с сывороточным альбумином.
Согласно настоящему описанию, одиночные вариабельные домены иммуноглобулина, предоставленные изобретением, предпочтительно являются такими, которые могут (по меньшей мере) связываться (и в частности, специфически связываться) с человеческим сывороточным альбумином. Более предпочтительно, как далее описано в этом документе, эти одиночные вариабельные домены иммуноглобулина предпочтительно также являются перекрестно-реагирующими (согласно настоящему описанию) между человеческим сывороточным альбумином и сывороточным альбумином, по меньшей мере, одного другого вида млекопитающих.
Изобретение также имеет отношение к белкам, полипептидам и другим конструкциям, соединениям, молекулам или химическим соединениям, содержащим, по меньшей мере, один из одиночных вариабельных доменов иммуноглобулина, связывающихся с сывороточным альбумином, которые описываются в этом документе.
Одиночные вариабельные домены иммуноглобулина также будут называться в данном описании при помощи аббревиатур “ISV’s” или “ISVD’s” (которые будут использоваться в описании взаимозаменяемым образом).
Одиночные вариабельные домены иммуноглобулина, связывающиеся с сывороточным альбумином, которые описываются в этом документе, также будут называться в описании “аминокислотные последовательности изобретения” или “вещества изобретения, связывающие сывороточный альбумин”. Как описывается далее в изобретении, вещества изобретения, связывающие альбумин, в частности, могут быть нанотелами (как описано далее).
Белки, полипептиды и другие конструкции, соединения, молекулы или химические соединения, которые содержат, по меньшей мере, одно из веществ изобретения, связывающих сывороточный альбумин, также будут называться в описании “соединениями изобретения” или “полипептидами изобретения”. Предпочтительно, соединения изобретения представляют собой белки или полипептиды и, в частности, могут быть слитыми белками.
Другие аспекты, варианты осуществления, характерные особенности, области применения и преимущества изобретения станут понятны специалистам на основании данного раскрытия.
В настоящей заявке аминокислотные остатки/положения в вариабельном домене тяжелой цепи иммуноглобулина будут обозначаться с использованием нумерации согласно Kabat. Для удобства на фиг. 1 представлена таблица, содержащая список некоторых аминокислотных положений, которые будут упоминаться в описании, и их нумерация в соответствии с некоторыми альтернативными системами нумерации (такими как Aho и IMGT. Примечание: если однозначно не указано иное, для настоящего раскрытия и пунктов формулы изобретения нумерация Kabat имеет решающее значение; другие системы нумерации приводятся только в качестве примера).
В отношении CDR’s, как хорошо известно в данной области техники, существует некоторое количество общепринятых способов для определения и описания CDR VH или VHH фрагмента, такие как определение по системе Kabat (которое основывается на вариабельности последовательности и является наиболее часто используемым) и по системе нумерации Chothia (которая основывается на расположении участков структурных петель). Например, можно сослаться на вебсайт http://www.bioinf.org.uk/abs/. Применительно к целям настоящего подробного описания и формулы изобретения, даже в том случае, когда CDR согласно Kabat также могут упоминаться, CDR наиболее предпочтительно определяются, исходя из определения Abm (которое основано на оксфордской программе молекулярного моделирования AbM антител), поскольку оно считается оптимальным компромиссом между определением по Kabat и Chothia. Снова можно сослаться на вебсайт http://www.bioinf.org.uk/abs/.
Соответственно, в настоящей заявке и формуле изобретения все CDR определяются в соответствии с методом Abm, если в данном описании точно не указано иное.
ISVD (и, в частности, нанотела), которые могут связываться с сывороточным альбумином и варианты их использования хорошо известны в данной области техники, например, из WO 2004/041865, WO 2006/122787, WO 2012/175400, WO 2015/173325 и PCT/EP2016/077973, которые описывают связывающиеся с сывороточным альбумином ISVD и их использование для увеличения времени полужизни в сыворотке крови (как определено в этих заявках) терапевтических соединений, молекул и структур. Например, WO 2006/122787 раскрывает в виде SEQ ID NO: 62 гуманизированное нанотело, связывающееся с сывороточным альбумином, называемое Alb-8 (смотри SEQ ID NO:1 в этом описании). WO 2012/175400 раскрывает в виде SEQ ID NO: 6 гуманизированное нанотело, связывающееся с сывороточным альбумином, называемое Alb-23D (смотри SEQ ID NO:2 в этом описании). Аминокислотные последовательности Alb-8 и Alb-23D и их CDR (которые являются одинаковыми для Alb-8 и Alb-23D) предоставляются в таблице A ниже в виде SEQ ID NO: 1, 2 и 3 - 8, соответственно.
Некоторые другие ссылки, раскрывающие ISVD против сывороточного альбумина, включают WO 2003/035694, WO 2004/003019, EP 2 139 918, WO 2011/006915 и WO 2014/111550.
Фиг. 3A и 3B показывают выравнивание Alb-8 (эталон), Alb-23D (эталон), SEQ ID NO: 18 (изобретение) и SEQ ID NO: 19 (изобретение).
Цель настоящего изобретения – предоставить улучшенные вещества, связывающие сывороточный альбумин, и в частности, связывающие сывороточный альбумин вещества, обладающие улучшенными свойствами по сравнению с известными в данной области техники веществами, связывающими сывороточный альбумин. В частности, целью изобретения является предоставление веществ, связывающих сывороточный альбумин, способных связываться с собачьим сывороточным альбумином и/или имеющих улучшенную перекрестную реактивность между человеческим сывороточным альбумином и собачьим сывороточным альбумином (т.е. по сравнению с веществами, связывающими сывороточный альбумин, предшествующего уровня техники, такими как Alb-8 и/или Alb-23D).
Таблица A. Alb-8, Alb-23D и их CDR
(WO 2006/122787; SEQ ID NO: 62)
(WO 2012/175400; SEQ ID NO: 6)
- SEQ ID NO: 1 и 2 имеют одинаковые CDR согласно Kabat. Однако, если CDR определяются согласно методу Abm, SEQ ID NO: 1 имеет CDR1, отличный от SEQ ID NO: 2 по сравнению с SEQ ID NO: 2, SEQ ID NO: 1 имеет S в положении 30 вместо R.
- SEQ ID NO:5 и SEQ ID NO:8 являются идентичными.
Все CDR определяются согласно методу Abm, если не указано иначе.
Таблица B. SEQ ID NO: 18 и 19 и их CDR
(дикий тип)
Все CDR определяются согласно методу Abm, если не указано иначе.
В общем, связывающиеся с сывороточным альбумином ISVD, предоставленные настоящим изобретением, являются вариантами последовательностей SEQ ID NO:18 и 19, в том смысле, что:
- они имеют одинаковые CDR (или в основном одинаковые CDR) как последовательность SEQ ID NO:18 и/или 19 (при условии, что, если CDRs определяются согласно Kabat, CDR2 может быть AISQNSIHTYYANSVKG (SEQ ID NO:10) или AISQNSIHTYYADSVKG (SEQ ID NO:11)); и
- они имеют в какой-то мере идентичность последовательности с последовательностью SEQ ID NO:18 и/или 19 (при этом степень идентичности последовательности представляет собой как описано в документе далее).
В частности, связывающиеся с сывороточным альбумином ISVD, предоставленные настоящим изобретением, в большинстве случаев будут иметь (ограниченное) число “аминокислотных различий” (как описано в этом документе) по сравнению с последовательностью SEQ ID NO:18 и/или 19. Эти аминокислотные различия могут присутствовать в CDR (при условии, что полученные в результате аминокислотные последовательности в таком виде сохраняют дополнительные свойства аминокислотных последовательностей изобретения, которые изложены в этом документе) и/или присутствуют в каркасных участках и, в частности, могут присутствовать в каркасных участках (как определено согласно Kabat и/или согласно Abm). Например и без ограничения, эти аминокислотные различия могут, например, быть гуманизирующими заменами, заменами, улучшающими экспрессию в желательной клетке-хозяине или организме-хозяине, заменами, улучшающими стабильность и/или устойчивость к деградации и/или протеазам, мутациями, которые уменьшают связывание предсуществующими антителами, и/или другими мутациями, которые имеют целью оптимизацию последовательности аминокислотных последовательностей изобретения; или любой подходящей комбинацией таких аминокислотных различий. См. раскрытие далее в этом документе.
В первом аспекте изобретение имеет отношение к ISVD, который может связываться (и в частности, специфически связываться) с человеческим сывороточным альбумином, и который имеет:
- CDR1 (согласно Kabat), который представляет собой аминокислотную последовательность TYVMG (SEQ ID NO: 9) или аминокислотную последовательность, имеющую 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 9; и
- CDR2 (согласно Kabat), который представляет собой аминокислотную последовательность AISQNSIHTYYANSVKG (SEQ ID NO:10) или AISQNSIHTYYADSVKG (SEQ ID NO:11) или аминокислотную последовательность, имеющую 3, 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 10 и/или SEQ ID NO:11; и
- CDR3 (согласно Kabat), который представляет собой аминокислотную последовательность SRFTSWYTADYEYDY (SEQ ID NO: 14) или аминокислотную последовательность, имеющую 3, 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 14.
В частности, связывающее сывороточный альбумин вещество согласно этому аспекту изобретения может быть (и предпочтительно является) как описано в этом документе далее.
В более конкретном аспекте изобретение имеет отношение к ISVD, который может связываться (и в частности, специфически связываться) с человеческим сывороточным альбумином, и который имеет:
- CDR1 (согласно Kabat), который представляет собой аминокислотную последовательность TYVMG (SEQ ID NO: 9); и
- CDR2 (согласно Kabat), который представляет собой аминокислотную последовательность AISQNSIHTYYANSVKG (SEQ ID NO:10) или AISQNSIHTYYADSVKG (SEQ ID NO:11); и
- CDR3 (согласно Kabat), который представляет собой аминокислотную последовательность SRFTSWYTADYEYDY (SEQ ID NO: 14).
И в этом случае связывающее сывороточный альбумин вещество согласно этому аспекту изобретения может быть (и предпочтительно является) как описано в этом документе далее.
В другом аспекте изобретение имеет отношение к ISVD, который может связываться (и в частности, специфически связываться) с человеческим сывороточным альбумином, и который имеет:
- CDR1 (согласно Abm), который представляет собой аминокислотную последовательность GGTFSTYVMG (SEQ ID NO: 12) или аминокислотную последовательность, имеющую 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 12; и
- CDR2 (согласно Abm), который представляет собой аминокислотную последовательность AISQNSIHTY (SEQ ID NO: 13) или аминокислотную последовательность, имеющую 3, 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 13; и
- CDR3 (согласно Abm), который представляет собой аминокислотную последовательность SRFTSWYTADYEYDY (SEQ ID NO: 14) или аминокислотную последовательность, имеющую 3, 2 или 1 аминокислотное различие(я) (как определено в описании) с аминокислотной последовательностью SEQ ID NO: 14.
В частности, связывающее сывороточный альбумин вещество согласно этому аспекту изобретения может быть (и предпочтительно является) как описано в этом документе далее.
В более конкретном аспекте изобретение имеет отношение к ISVD, который может связываться (и в частности, специфически связываться) с человеческим сывороточным альбумином, и который имеет:
- CDR1 (согласно Abm), который представляет собой аминокислотную последовательность GGTFSTYVMG (SEQ ID NO: 12); и
- CDR2 (согласно Abm), который представляет собой аминокислотную последовательность AISQNSIHTY (SEQ ID NO: 13); и
- CDR3 (согласно Abm), который представляет собой аминокислотную последовательность SRFTSWYTADYEYDY (SEQ ID NO: 14).
И в этом случае, связывающее сывороточный альбумин вещество согласно этому аспекту изобретения может быть (и предпочтительно является) как описано в этом документе далее.
В общем, связывающие сывороточный альбумин вещества согласно разным аспектам изобретения предпочтительно являются такими, которые имеют:
- степень идентичности последовательности с последовательностью SEQ ID NO: 18 и/или 19 (при этом CDR и любое C-концевое удлинение, которое может присутствовать, не принимаются во внимание при определении степени идентичности последовательности) по меньшей мере, 85%, предпочтительно, по меньшей мере, 90%, более предпочтительно, по меньшей мере, 95%;
и/или такими, которые имеют:
и/или имеют не более чем 7, предпочтительно не более чем 5, например, только 3, 2 или 1, “аминокислотных различий” (как определено в описании, и не принимая во внимание CDR и любое C-концевое удлинение, которое может присутствовать) с последовательностью SEQ ID NO: 18 и/или 19.
Связывающие сывороточный альбумин вещества согласно различным аспектам изобретения в целом предпочтительно являются такими веществами, которые могут связываться с человеческим сывороточным альбумином с константой диссоциации (KD) от 10-5 до 10-12 моль/литр или менее, и предпочтительно от 10-7 до 10-12 моль/литр или менее и более предпочтительно от 10-8 до 10-12 моль/литр, и/или с аффинностью связывания, по меньшей мере, 107 M-1, предпочтительно, по меньшей мере, 108 M-1, более предпочтительно по меньшей мере, 109 M-1, например, по меньшей мере, 1012 M-1, как определено при использовании ProteOn (см. Пример 1). Предпочтительно, связывающее сывороточный альбумин вещество изобретения будет связываться с желательным антигеном с аффинностью менее чем 500 нМ, предпочтительно менее чем 200 нМ, более предпочтительно менее чем 10 нМ, например, менее чем 500 pM, и в этом случае, как определено при использовании (снова можно сослаться на Пример 1).
Связывающие сывороточный альбумин вещества согласно различным аспектам изобретения также предпочтительно являются такими веществами, которые конкурируют с аминокислотной последовательностью SEQ ID NO:18 за связывание с (человеческим) сывороточным альбумином и/или которые “перекрестно блокируют” (как определено в описании) связывание аминокислотной SEQ ID NO:18 с (человеческим) сывороточным альбумином.
Таким образом, предпочтительно, связывающие альбумин вещества изобретения являются такими веществами, которые в основном связываются с теми же самыми аминокислотными остатками и/или эпитопом на человеческом сывороточном альбумине как SEQ ID NO:18, и даже более предпочтительно такими веществами, которые участвуют в одних и тех же взаимодействиях как SEQ ID NO:18. С этой целью, согласно конкретному, но не ограничивающему аспекту, связывающие альбумин вещества изобретения предпочтительно или имеют одинаковые CDR как последовательность SEQ ID NO:18, или по сравнению с последовательностью SEQ ID NO:18 предпочтительно содержат в пределах их CDR только такие мутации (такие как консервативные аминокислотные замены), которые по-прежнему позволяют им подвергаться тем же самым или в основном тем же самым взаимодействиям с человеческим сывороточным альбумином как SEQ ID NO:18.
Вещества, связывающие сывороточный альбумин, согласно различным аспектам изобретения, как правило, предпочтительно являются перекрестно-реагирующими между человеческим сывороточным альбумином и сывороточным альбумином, по меньшей мере, одного, предпочтительно, по меньшей мере, двух, более предпочтительно, по меньшей мере, трех и практически для всех следующих видов млекопитающих: собака, крыса, мышь, кролик, морская свинка, свинья, овца, корова и яванский макак. В частности, вещества, связывающие сывороточный альбумин, согласно различным аспектам изобретения могут быть такими, которые являются (по меньшей мере) перекрестно-реагирующими между человеческим сывороточным альбумином и собачьим сывороточным альбумином, и предпочтительно также между человеческим сывороточным альбумином и/или собачьим сывороточным альбумином с одной стороны, и, по меньшей мере, одним, предпочтительно, по меньшей мере двумя, более предпочтительно со всеми тремя из крысиного сывороточного альбумина, мышиного сывороточного альбумина и сывороточного альбумина яванского макака с другой стороны. В этом отношении, вещества изобретения, связывающие сывороточный альбумин, могут обладать улучшенной перекрестной реакционной способностью (в частности, между человеческим сывороточным альбумином с одной стороны и собачьим сывороточным альбумином с другой стороны) по сравнению с связывающими сывороточный альбумин веществами, которые имеют (в основном) те же самые CDR как Alb-11 и/или Alb-23D. Можно сослаться на результаты в экспериментальной части ниже.
Для справки, фиг. 5 предоставляет выравнивание сывороточного альбумина от разных видов млекопитающих (источник: http://macromoleculeinsights.com/albumin.php, нумерация аминокислот на фиг. 5 – это нумерация, использованная на указанной веб-странице). Для удобства, в последовательности человеческого сывороточного альбумина, участки аминокислот, которые предположительно являются частью предполагаемого эпитопа аминокислотных последовательностей изобретения, выделены. Не ограничиваясь каким-либо конкретным механизмом или гипотезой, предполагается, что аминокислотные последовательности изобретения являются (в основном) способными к связыванию (с одним или более аминокислотными остатками в этих пределах) с соответствующими участками аминокислотных остатков, которые присутствуют в аминокислотной последовательности тех сывороточных альбуминов млекопитающих, с которыми аминокислотные последовательности изобретения перекрестно-реагируют.
В общем, связывающее сывороточный альбумин вещество изобретения может считаться перекрестно-реагирующим между человеческим сывороточным альбумином и сывороточным альбумином одного из этих видов, в том случае, когда оно может связываться с человеческим сывороточным альбумином с аффинностью менее, чем 500 нM, предпочтительно менее чем 200 нM, более предпочтительно менее чем 10 нM; и также с сывороточным альбумином от указанных видов с аффинностью менее чем 500 нM, предпочтительно менее чем 200 нM, более предпочтительно менее чем 10 нM, и в этом случае и то и другое устанавливается при использовании ProteOn (см. Пример 1).
Связывающие сывороточный альбумин вещества согласно различным аспектам изобретения также предпочтительно являются такими, что:
они имеют время полужизни в сыворотке у человека (выраженное в виде t1/2 бета), которое составляет более 6 часов, предпочтительно более 12 часов, более предпочтительно более чем 24 часа, даже более предпочтительно более чем 72 часа; например, около одной недели, двух недель и вплоть до времени полужизни сывороточного альбумина у человека (которое по оценкам составляет около 19 дней);
и/или такими что:
когда оно соединяется с лекарственным веществом или структурой, оно обеспечивает полученному в результате полипептиду изобретения время полужизни в сыворотке у человека (выраженное в виде t1/2 бета), которое составляет более 6 часов, предпочтительно более чем 12 часов, более предпочтительно более чем 24 часа, еще более предпочтительно более чем 72 часа; например, около одной недели, двух недель и вплоть до времени полужизни сывороточного альбумина у человека (которое по оценкам составляет около 19 дней).
Время полужизни у видов млекопитающих, отличных от человека, наряду с другими факторами, будет главным образом зависеть от свойств связывания (таких как аффинность) связывающего альбумин вещества изобретения в отношении сывороточного альбумина от указанных видов млекопитающих, а также от времени полужизни интактного сывороточного альбумина у указанных видов. Согласно предпочтительному варианту осуществления изобретения, когда связывающее сывороточный альбумин вещество изобретения является перекрестно-реагирующим (как определено в описании) между человеческим сывороточным альбумином и сывороточным альбумином от других видов млекопитающих, тогда время полужизни связывающего сывороточный альбумин вещества изобретения (и/или соединения изобретения, содержащего связывающее сывороточный альбумин вещество), определенное у указанных видов, составляет предпочтительно, по меньшей мере, 5%, например, по меньшей мере, 10%, более предпочтительно, по меньшей мере, 25%, например, около 50% и по возможности до 100% от периода полужизни нативного сывороточного альбумина у указанных видов.
По сравнению с последовательностью SEQ ID NO:18 связывающие сывороточный альбумин вещества изобретения предпочтительно также содержат (по меньшей мере):
- одну или более гуманизирующих замен;
и/или
одну или более мутаций (т.е. аминокислотных замен, делеций или вставок, и в частности, замен), которые уменьшают связывание предсуществующими антителами;
и могут необязательно содержать одну или более дополнительных мутаций, как описано в этом документе.
Что касается подходящих гуманизирующих замен (и подходящих их комбинаций), можно сделать ссылку на WO 09/138519 (или в известном уровне техники по данным WO 09/138519) и WO 08/020079 (или в известном уровне техники по данным WO 08/020079), а также таблицы с A-3 по A-8 из WO 08/020079 (которые представляют собой списки возможных гуманизирующих замен). Некоторыми предпочтительными, но не ограничивающими примерами таких гуманизирующих замен являются Q108L и A14P или подходящие их комбинации. Такие гуманизирующие замены также могут быть подходящим образом скомбинированы с одной или более другими мутациями, как описано в этом документе (например, одной или более мутациями, уменьшающими связывание с предсуществующими антителами).
Что касается подходящих мутаций, которые могут уменьшать связывание предсуществующими антителами (и подходящих комбинаций таких мутаций), можно сослаться, например, на WO 2012/175741 и WO 2015/173325, а также, например, на WO 2013/024059 и WO 2016/118733. Как описано в этом документе, такие мутации могут содержать (подходящую комбинацию) одну или более аминокислотных замен, делеций или вставок (и, в частности, замен), при этом мутации часто будут находиться в так называемом C-концевом участке ISV. Например, такие мутации могут содержать мутации (и в частности замены) в одном или более из положений 11, 13, 14, 15, 40, 41, 42, 82, 82a, 82b, 83, 84, 85, 87, 88, 89, 103, 108 и/или мутации в одном или более положений в C-концевой VTVSS последовательности (т.е. положениях 109, 110, 111, 112 и 113), причем одна или более мутаций в положениях 11, 89, 110 и/или 112 являются особенно предпочтительными. Некоторыми предпочтительными неограничивающими примерами таких мутаций являются соответствующие замены (где это требуется), так что после замены в указанном положении присутствует один из следующих аминокислотных остатков: 11L, 11K, 11V, 14A, 14P, 41A, 41L, 41P, 41S, 41T, 42E, 42G, 87A, 87T, 89A, 89L, 89T, 108L, 110K, 110Q, 112K и/или 112Q (при этом 11L, 89A, 89L, 89T, 110K, 110Q, 112K и 112Q являются особенно предпочтительными); или любая подходящая комбинация таких замен, такая как, например и без ограничения: 11V в комбинации с 89L или 89T; 11V в комбинации с 110K или 110Q; или 11V в комбинации с 89L и 110K или 110Q. Такие мутации, которые уменьшают связывание предсуществующими антителами, также могут быть соответствующим образом скомбинированы с одной или более другими мутациями, как описано в этом документе (например, с одной или более гуманизирующими заменами).
При необходимости (как описывается далее и, в частности, когда вещество изобретения, связывающее сывороточный альбумин, присутствует на и/или образует C-концевую область соединения изобретения, в которой оно присутствует), для уменьшения связывания предсуществующими антителами, вещества изобретения, связывающие сывороточный альбумин (и, как описывается далее, также соединения изобретения) также могут содержать C-концевое удлинение (например, C-концевой остаток аланина). Как описано в WO 2012/175741, такое C-концевое удлинение уменьшает связывание предсуществующими антителами. Подходящее C-концевое удлинение в общем порядке может быть дополнительно описано в этом документе и может, в частности, иметь формулу -(X)n, в которой X может быть любой существующей в природе аминокислотой (но предпочтительно не цистеином), и n может быть 1, 2, 3, 4 или 5. Вновь можно сослаться на WO 2012/175741, а также, например, на WO 2015/173325, WO 2013/024059 и WO 2016/118733. Присутствие такого C-концевого удлинения также может быть подходящим образом скомбинировано с одной или более из числа других мутаций, описанных в этом документе (например, одной или более гуманизирующих замен и/или одной или более мутаций, уменьшающих связывание предсуществующими антителами).
Другие мутации, которые могут присутствовать в веществах изобретения, связывающих сывороточный альбумин, например и без ограничения, включают одну или более мутаций (в частности, замен), которые улучшают экспрессию в желательной клетке-хозяине или организме-хозяине, одну или более мутаций (и в частности, замен), которые улучшают стабильность и/или устойчивость к деградации и/или протеазам, и/или одну или более других мутаций, которые предназначаются для оптимизации аминокислотной последовательности изобретения (например, и без ограничения, одну или более мутаций, которые (дополнительно) уменьшают какую-либо тенденцию веществ, связывающих сывороточный альбумин, образовывать димеры); или любые подходящие комбинации таких мутаций.
Некоторыми неограничивающими примерами таких мутаций являются подходящие замены (в случае необходимости), такие, что после мутации в указанном положении присутствует один из следующих аминокислотных остатков: 16G, 49A, 61D, 74S, 75K, 76N, 82M и 83R; или любая подходящая комбинация таких замен (например, для того, чтобы сформировать SKN мотив в положениях 74-76). Также, при необходимости (как описано далее в этом документе), вещества изобретения, связывающие сывороточный альбумин, могут иметь D в положении 1 (т.е. E1D мутацию по сравнению с последовательностью SEQ ID NO:18 и/или 19), в частности, когда вещество изобретения, связывающее сывороточный альбумин, присутствует на и/или образует N-концевую область соединения изобретения, в котором которой оно присутствует. Такие мутации снова могут быть соответствующим образом скомбинированы с одной или более другими мутациями, описанными в документе (например, с одной или более гуманизирующими заменами и/или одной или более мутациями, уменьшающими связывание с предсуществующими антителами).
Другие мутации, которые могут присутствовать в аминокислотных последовательностях изобретения, станут очевидны специалистам, исходя из данного раскрытия.
Также возможно, что отдельная мутация (или подходящая комбинация мутаций) обеспечивает некоторые функциональные возможности или преимущества. Например, и без ограничения, гуманизирующая Q108L замена также может уменьшать связывание предсуществующими антителами.
Некоторые предпочтительные, но не ограничивающие примеры аминокислотных остатков (т.е. мутаций по сравнению с аминокислотной последовательностью SEQ ID NO:18), которые могут присутствовать в аминокислотных последовательностях изобретения (т.е. сами по себе или в подходящей комбинации) включают: 11V (т.е. L11V), 14P (т.е. A14P), 16G (т.е. D16G), 49A (т.е. S49A), 61D (т.е. N61D), 74S (т.е. D74S), 82M (т.е. L82M), 83R (т.е. K83R), 89L (т.е.V89L), 89T (т.е.V89T), 110K (например, T110K) или 110Q (например, T110Q); а также, где это необходимо (как далее описано в этом документе), 1D (например E1D) и/или C-концевое удлинение (X)n, как определено в этом документе (такое как 114A). Можно сделать ссылку на последовательности и мутации, показанные на фиг. 4A и 4B. Например, некоторые предпочтительные, но не ограничивающие примеры подходящих комбинаций таких аминокислотных остатков (т.е. мутаций по сравнению с аминокислотной последовательностью SEQ ID NO:18) включают:
- L11V,T14P,D16G,N61D,D74S,K83R,V89L
- L11V,T14P,D16G,D74S,L82M,K83R,V89L
- L11V,T14P,D16G,N61D,D74S,L82M,K83R,V89L
- L11V,T14P,D16G,S49A,D74S,K83R,V89L
- L11V,T14P,D16G,S49A,N61D,D74S,K83R,V89L
- L11V,T14P,D16G,S49A,D74S,L82M,K83R,V89L
- L11V,T14P,D16G,S49A,N61D,D74S,L82M,K83R,V89L
- L11V,T14P,D74S,K83R,V89L
и другие подходящие комбинации станут понятны специалистам, исходя из данного раскрытия.
Некоторыми предпочтительными, но не ограничивающими аминокислотными последовательностями изобретения являются такие, в которых (i) положение 11 представляет собой V, и положение 89 представляет собой L; (ii) положение 89 представляет собой T; (iii) положения 74-76 формируют SKN мотив; (iv) положение 11 представляет собой V, положение 89 представляет собой L, и положения 74-76 формируют SKN мотив; и (iv) положение 89 представляет собой T и положения 74-76 формируют SKN мотив; при этом аминокислотные последовательности изобретения являются такими, как описано далее в этом документе (и соответственно могут также содержать одну или более дополнительных аминокислотных мутаций, как описано в этом документе).
Некоторые предпочтительные, но не ограничивающие примеры аминокислотных последовательностей изобретения представлены на фиг. 2 как:
- SEQ ID NO: 18 - 26, которые являются примерами аминокислотных последовательностей изобретения без C-концевого удлинения аланином;
- SEQ ID NO: 27 - 35, которые являются примерами аминокислотных последовательностей изобретения с C-концевым удлинением (в каждом случае, примером может послужить C-концевое удлинение аланином, которое, в общем, является предпочтительным C-концевым удлинением); и
- SEQ ID NO: 36 - 44, которые являются примерами аминокислотных последовательностей изобретения без N-концевой E1D мутации).
Исходя из раскрытия, предоставленного в этом документе, специалисту будет понятно, что на практике:
- связывающие альбумин вещества изобретения с C-концевым удлинением (например, такие как SEQ ID NO: 27 - 35) часто будут использоваться как/присутствовать на C-концевом участке полипептидов изобретения (как определено в описании), в которых они имеются;
- связывающие альбумин вещества изобретения с E1D мутацией (такой как, в том числе SEQ ID NO: 36 - 44) часто будут использоваться как/присутствовать на C-концевом участке полипептидов изобретения, в которых они имеются;
- связывающие альбумин вещества изобретения без C-концевого удлинения и без E1D мутации (такой как, в том числе SEQ ID NO: 18 - 26) часто будут присутствовать где-нибудь в “середине” полипептида изобретения.
Каждая из аминокислотных последовательностей SEQ ID NO: 18 - 44, а также протеины, полипептиды и другие соединения и конструкции, содержащие таковые (как описано также в этом документе далее), формируют дополнительные аспекты настоящего изобретения.
В следующем аспекте изобретение имеет отношение к аминокислотной последовательности, которая представляет собой одну из аминокислотных последовательностей SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, SEQ ID NO:23, SEQ ID NO:24, SEQ ID NO:25, SEQ ID NO:26, SEQ ID NO:27, SEQ ID NO:28, SEQ ID NO:29, SEQ ID NO:30, SEQ ID NO:31, SEQ ID NO:32, SEQ ID NO:33, SEQ ID NO:34, SEQ ID NO:35, SEQ ID NO:36, SEQ ID NO:37, SEQ ID NO:38, SEQ ID NO:39, SEQ ID NO:40, SEQ ID NO:41, SEQ ID NO:42, SEQ ID NO:43, и/или SEQ ID NO:44; и каждая из этих аминокислотных последовательностей изобретения (а также полипептиды изобретения – как определено в описании – которые содержат такие аминокислотные последовательности изобретения) формируют дополнительный аспект настоящего изобретения.
Как также описано в этом документе, аминокислотные последовательности, предоставленные изобретением, являются протеинами, которые могут связываться и, в частности, специфически (как описано в этом документе) связываться с человеческим сывороточным альбумином. Таким образом, они могут использоваться как связывающие единицы или связывающие домены для связывания с (человеческим) сывороточным альбумином, например, чтобы обеспечить увеличение времени полужизни (как определено в этом документе) терапевтическим соединениям, молекулам или структурам. В отношении использования доменов, связывающих сывороточный альбумин, с целью увеличения времени полужизни терапевтических соединений, молекул или структур, можно сделать ссылку на WO 2004/041865, WO 2006/122787, EP 2 139 918, WO 2011/006915, WO 2012/175400 и/или WO 2014/111550. Вещества изобретения, связывающие сывороточный альбумин, могут в большинстве случаев использоваться в том же порядке и для тех же целей, как вещества, связывающие сывороточный альбумин, описанные в этих ссылках.
В некоторых дополнительных неограничивающих аспектах изобретение также имеет отношение к:
- белкам, полипептидам и другим конструкциям, молекулам или химическим соединениям, содержащим или состоящим в основном по меньшей мере из одного связывающего сывороточный альбумин вещества изобретения, как описано в этом документе (и в этом случае также называемым “соединения изобретения” или “полипептиды изобретения”);
- способам экспрессии/продуцирования связывающего сывороточный альбумин вещества изобретения и/или соединения изобретения;
- клетке-хозяину, организму-хозяину или другой системе экспрессии, которая может экспрессировать или продуцировать связывающее сывороточный альбумин вещество изобретения и/или соединение изобретения;
- композициям и продуктам (таким как фармацевтические композиции и продукты), содержащим вещество изобретения, связывающее сывороточный альбумин, и/или соединение изобретения;
- нуклеотидным последовательностям и нуклеиновым кислотам, таким как векторы (экспрессирующие), которые кодируют вещество изобретения, связывающее сывороточный альбумин, и/или соединения изобретения;
- использованию соединений изобретения и/или соединений изобретения, такому как использование соединения изобретения с целью увеличения времени полужизни (в сыворотке) терапевтических соединений, молекул или структур и терапевтическое и/или профилактическое использование соединения изобретения.
Эти и дополнительные аспекты, варианты осуществления, преимущества, сферы применения и варианты использования изобретения станут понятны из дальнейшего описания.
В настоящем подробном описании:
- термин “одиночный вариабельный домен иммуноглобулина” (также называется “ISV” или “ISVD”) обычно используется для упоминания вариабельных доменов иммуноглобулина (которые могут быть доменами тяжелой цепи или легкой цепи, включая VH, VHH или VL домены), которые могут образовывать функциональные участки связывания антигена без взаимодействия с другим вариабельным доменом (например, без VH/VL взаимодействия, как требуется между VH и VL доменами обычного 4-цепочечного моноклонального антитела). Примеры ISVD будут понятны специалистам и, например, включают нанотела (включая VHH, гуманизированный VHH и/или VHs, такие как камелизованные человеческие VHs), IgNAR, домены, (однодоменные) антитела (такие как dAbs™), которые являются VH доменами или которые происходят от VH домена и (однодоменные) антитела (такие как dAbs™), которые являются VL доменами или которые происходят от VL домена. Если в данном описании точно не упомянуто иное, ISVD, которые были основаны на и/или получены из вариабельных доменов тяжелой цепи (таких как VH или VHH домены), в большинстве случаев являются предпочтительными. Если в описании точно не указано иначе, наиболее предпочтительно ISVD является нанотелом;
- термин “нанотело” представляет собой, как описано в WO 2008/020079 или WO 2009/138519, и, таким образом, в конкретном аспекте в большинстве случаев обозначает VHH, гуманизированный VHH или камелизованный VH (такой как камелизованный человеческий VH) или в большинство случаев последовательность, оптимизированную VHH (такую как например, оптимизированную для химической устойчивости и/или растворимости, максимального перекрывания с известными человеческими каркасными участками и максимальной экспрессии). Следует отметить, что термины нанотело или нанотела являются зарегистрированными товарными знаками Ablynx N.V. и таким образом также могут называться Нанотело® и/или Нанотела®);
- как правило, если в описании точно не указано иначе, ISVD, нанотела, полипептиды, протеины и другие соединения и конструкции, упомянутые в описании, предназначаются для использования в профилактике или при лечении болезней или нарушений у человека (и/или необязательно также теплокровных животных и, в частности, млекопитающих). Таким образом, в большинстве случаев ISVD, нанотела, полипептиды, протеины и другие соединения и конструкции, описанные в этом документе, предпочтительно являются такими, что они могут использоваться в качестве, и/или могут быть частью (биологического) лекарственного средства или другого фармацевтически или терапевтически активного соединения и/или фармацевтического продукта или композиции. Такое лекарственное средство, соединение или продукт предпочтительно является таким, что оно пригодно для введения человеку, например, для профилактики или лечения нуждающегося в такой профилактике или лечении субъекта или, например, как часть клинических испытаний. Как описывается в этом документе далее, для этой цели подобное лекарственное средство или соединение может содержать другие молекулы, фрагменты или участки связывания помимо ISVD, предоставленных изобретением (которые, как также описано в этом документе, могут быть, например, одним или более другими дополнительными лекарственными веществами и/или одним или более другими веществами, которые оказывают влияние на фармакокинетические и фармакодинамические свойства биологического препарата на основе ISVD или нанотел, такого как их время полужизни). Подходящие примеры таких дополнительных терапевтических или других молекул будут понятны специалисту, и, например, обычно могут включать любой терапевтически активный белок, полипептид или другой домен связывания или единицу связывания, а также, например, модификации, такие как описанные на страницах 149 - 152 WO 2009/138159. Биологический препарат на основе ISVD или нанотела предпочтительно является терапевтическим или предназначается для использования в качестве терапевтического (что включает профилактику и диагностику) и для этой цели предпочтительно содержит, по меньшей мере, один ISVD против терапевтически значимой мишени (такой как, например, RANK-L, vWF, IgE, RSV, CXCR4, IL-23 или другие интерлейкины и т.д.). Что касается некоторых конкретных, но неограничивающих примеров таких биологических препаратов на основе ISVD или нанотел, можно сослаться на Примеры 8 - 18 и также, например, на различные заявки Ablynx N.V. (такие как, например и без ограничения, WO 2004/062551, WO 2006/122825, WO 2008/020079 и WO 2009/068627), а также, например, (и без ограничения) на такие заявки как WO 2006/038027, WO 2006/059108, WO 2007/063308, WO 2007/063311, WO 2007/066016 и WO 2007/085814. Также, как описано в этом документе, дополнительная молекула может быть ISVD или нанотелом, как описано в этом документе, направленным против (человеческого) сывороточного белка, такого как (человеческий) сывороточный альбумин, и такой ISVD или нанотело также могут найти терапевтическое применение, в частности, в и/или для увеличения времени полужизни TNF-связывающих веществ, описанных в этом документе. Для справки можно сделать ссылку, например, на WO 2004/041865, WO 2006/122787 и WO 2012/175400, которые в общем описывают использование нанотел, связывающих сывороточный альбумин, для увеличения времени полужизни. Кроме того, в настоящем подробном описании, если в описании явным образом не указано иначе, все термины, упоминаемые в описании, имеют значение, данное в WO 2009/138519 (или в предшествующем уровне техники, цитированном в WO 2009/138519) или WO 2008/020079 (или в предшествующем уровне техники, цитированном в WO 2008/020079). Также, в том случае, если метод или технический прием точно не описан в этом документе, он может быть осуществлен, как описано в WO 2009/138519 (или в предшествующем уровне техники, цитированном в WO 2009/138519) или WO 2008/020079 (или в предшествующем уровне техники, цитированном в WO 2008/020079). Также, как описано в этом документе, любой фармацевтический продукт или композиция, содержащая любой ISVD или соединение изобретения, может также содержать один или более дополнительных компонентов, широко известных для использования в фармацевтических продуктах или композициях (т.е. в зависимости от предполагаемой фармацевтической формы) и/или, например, один или более других соединений или активных веществ, предназначенных для терапевтического использования (т.е. чтобы обеспечить комбинированный продукт).
Кроме того, при использовании в настоящем подробном описании или пунктах формулы изобретения следующие термины имеют свое изначальное значение и/или в соответствующих случаях могут быть определены в порядке, описанном на страницах 62-75 WO 2009/138519: “агонист”, “антагонист”, “обратный агонист”, “неполярный, незаряженный аминокислотный остаток”, “полярный, незаряженный аминокислотный остаток”, “полярный, заряженный аминокислотный остаток”, “идентичность последовательности”, “точно такой же” и “аминокислотное различие” (когда речь идет о сравнении последовательности двух аминокислотных последовательностей), “(в) практически изолированной (форме)”, “домен”, “домен связывания”, “антигенная детерминанта (эпитоп)”, “эпитоп”, “против” или “направленные против” (антигена), “специфичность” и “время полужизни”. В дополнение к этому термины “модулирование” и “модулировать”, “сайт взаимодействия”, “специфический в отношении”, “перекрестно-блокировать”, “перекрестно-блокированный” и “перекрестное блокирование” и “практически независимый от pH” определены (и/или могут быть определены, как описано) на страницах 74-79 WO 2010/130832 Ablynx N.V. Кроме того, при ссылке на конструкцию, соединение, протеин или полипептид изобретения, термины подобные “моновалентный”, “бивалентный” (или “мультивалентный”), “биспецифический” (или “мультиспецифический”) и “бипаратопный” (или “мультипаратопный”) могут иметь значение, данное в WO 2009/138519, WO 2010/130832 или WO 2008/020079.
Термин “время полужизни” при использовании в описании в отношении ISVD, нанотела, биологического препарата на основе ISVD, биологического препарата на основе нанотела или любой другой аминокислотной последовательности, соединения или полипептида, упоминаемого в этом описании, может быть определен, как указано в параграфе o) на странице 57 WO 2008/020079 и, как упоминается там, относится к времени, за которое концентрация аминокислотной последовательности, соединения или полипептида в сыворотке уменьшается на 50% in vivo, например, вследствие деградации последовательности или соединения и/или выведения или секвестрации последовательности или соединения при помощи естественных механизмов. Период времени полужизни in vivo аминокислотной последовательности, соединения или полипептида изобретения может быть определен любым хорошо известным образом, например, с помощью фармакокинетического анализа. Подходящие методики известны специалисту в данной области техники, и могут, например, быть такими, как описано в параграфе o) на странице 57 WO 2008/020079. Как также упоминается в параграфе o) на странице 57 WO 2008/020079, время полужизни может выражаться при помощи таких параметров, как t1/2-альфа, t1/2-бета и площадь под кривой (AUC). В этом отношении следует отметить, что термин “время полужизни” при использовании в описании, в частности, относится к t1/2-бета или конечному периоду полувыведения (при этом t1/2-альфа и/или AUC или оба могут не рассматриваться). Можно сослаться, например, на экспериментальную часть ниже, а также справочные пособия, такие как Kenneth, A et al: Chemical Stability of Pharmaceuticals: A Handbook for Pharmacists и Peters et al, Pharmacokinetic analysis: A Practical Approach (1996). Можно сделать ссылку на "Pharmacokinetics", M Gibaldi & D Perron, опубликованную Marcel Dekker, 2nd Rev. edition (1982). Аналогичным образом, термины “увеличение времени полужизни” или “повышенное время полужизни” также являются такими, как определено в параграфе o) на странице 57 WO 2008/020079 и, в частности, относятся к увеличению t1/2-бета, с или без увеличения t1/2-альфа и/или AUC или того и другого.
Когда термин в описании не определен точно, он имеет свое общепринятое в данной области техники значение, понятное специалисту. Для справки можно сделать ссылку, например, на стандартные руководства, такие как Sambrook et al, "Molecular Cloning: A Laboratory Manual" (2nd.Ed.), Vols. 1-3, Cold Spring Harbor Laboratory Press (1989); F. Ausubel et al, eds., "Current protocols in molecular biology", Green Publishing и Wiley Interscience, New York (1987); Lewin, “Genes II”, John Wiley & Sons, New York, N.Y., (1985); Old et al., “Principles of Gene Manipulation: An Introduction to Genetic Engineering”, 2nd edition, University of California Press, Berkeley, CA (1981); Roitt et al., “Immunology” (6th. Ed.), Mosby/Elsevier, Edinburgh (2001); Roitt et al., Roitt’s Essential Immunology, 10th Ed. Blackwell Publishing, UK (2001); и Janeway et al., “Immunobiology” (6th Ed.), Garland Science Publishing/Churchill Livingstone, New York (2005), а также на общий уровень техники, упомянутый в описании.
Также, как уже отмечалось в описании, аминокислотные остатки нанотела пронумерованы согласно общей нумерации VH, предоставленной Kabat et al. (“Sequence of proteins of immunological interest”, US Public Health Services, NIH Bethesda, MD, Publication No. 91), применительно к VHH доменам от Верблюдовых в статье Riechmann и Muyldermans, J. Immunol. Methods 2000 Jun 23; 240 (1-2): 185-195. Согласно этой нумерации FR1 нанотела содержит аминокислотные остатки в положениях 1-30, CDR1 нанотела содержит аминокислотные остатки в положениях 31-35, FR2 нанотела содержит аминокислотные остатки в положениях 36-49, CDR2 нанотела содержит аминокислотные остатки в положениях 50-65, FR3 нанотела содержит аминокислотные остатки в положениях 66-94, CDR3 нанотела содержит аминокислотные остатки в положениях 95-102, и FR4 нанотела содержит аминокислотные остатки в положениях 103-113. [В этом отношении следует отметить, что – как хорошо известно в данной области техники для VH доменов и для VHH доменов – общее число аминокислотных остатков в каждом из CDR может варьировать и может не соответствовать общему числу аминокислотных остатков, указанных нумерацией Kabat (то есть, одно или более положений согласно нумерации Kabat может и не быть занято в действительной последовательности, или действительная последовательность может содержать больше аминокислотных остатков чем число, допускаемое Kabat нумерацией). Это означает, что в целом нумерация согласно Kabat может или может не соответствовать действительной нумерации аминокислотных остатков в действительной последовательности. В общем, однако, можно сказать что согласно нумерации Kabat и независимо от числа аминокислотных остатков в CDR, положение 1 согласно нумерации Kabat соответствует началу FR1 и наоборот, положение 36 согласно нумерации Kabat соответствует началу FR2 и наоборот, положение 66 согласно нумерации Kabat соответствует началу FR3 и наоборот, и положение 103 согласно нумерации Kabat соответствует началу FR4 и наоборот.].
Альтернативные методы нумерации аминокислотных остатков VH доменов, которые также могут применяться аналогичным образом к VHH доменам верблюдовых и к нанотелам, описаны Chothia et al. (Nature 342, 877-883 (1989)), так называемое “AbM определение” и так называемое “контактное определение”. Однако, настоящее описание, аспекты и фигуры будут сопровождаться нумерацией согласно Kabat применительно к VHH доменам по Riechmann и Muyldermans, если не указано иначе.
Следует отметить также, что фигуры, любой перечень последовательностей и экспериментальная часть/примеры даны не только для того, чтобы дополнительно проиллюстрировать изобретение и не должны интерпретироваться или истолковываться как ограничивающие рамки изобретения и/или прилагаемых пунктов формулы изобретения каким-либо образом, если в этом документе точно не указано иначе.
Как описано далее в этом документе, вещества изобретения, связывающие сывороточный альбумин, могут с преимуществом использоваться в качестве фрагмента, связывающей единицы или партнера для слияния для того, чтобы увеличить время полужизни терапевтических соединений, молекул или структур, таких как полипептиды, протеины, соединения (включая, без ограничения, малые молекулы) или другие терапевтические препараты.
Таким образом, в другом аспекте изобретение предоставляет полипептиды, протеины, конструкции, соединения или другие химические соединения, которые содержат или в основном состоят из вещества изобретения, связывающего сывороточный альбумин, и одной или более других аминокислотных последовательностей, (связывающих) доменов, единиц связывания или других фрагментов или химических структурных элементов.
В частности, изобретение предоставляет полипептиды, протеины, конструкции, соединения или другие химические соединения, которые содержат вещество изобретения, связывающее сывороточный альбумин, и один или более (например, один или два) терапевтических препаратов (которые могут быть одинаковыми или разными и могут, например, быть направлены против одной и той же мишени или разных мишеней, и в том случае, когда они направлены на одну и ту же мишень, они могут быть направлены на одни и те же или разные эпитопы, части, домены или субъединицы указанных мишеней), соответственно связанных друг с другом или напрямую или посредством одного или более подходящих линкеров или спейсеров. Такие полипептиды, протеины или конструкции могут, например, и без ограничения, быть слитым белком, как далее описывается в этом документе.
Изобретение, кроме того, имеет отношение к терапевтическому использованию таких полипептидов, протеинов, конструкций или соединений и к фармацевтическим композициям, содержащим такие полипептиды, протеины, конструкции или соединения.
В одном аспекте, по меньшей мере, одно лекарственное вещество содержит или в основном состоит из терапевтического протеина, полипептида, соединения, фактора или другой структуры. В предпочтительном варианте осуществления лекарственное вещество, направленное против желаемого антигена или мишени, способно связываться с желаемым антигеном (и, в частности, способно специфически связываться с желаемым антигеном), и/или способно взаимодействовать с желательной мишенью. В другом варианте осуществления, по меньшей мере, одно лекарственное вещество содержит или в основном состоит из терапевтического протеина или полипептида. В следующем варианте осуществления, по меньшей мере, одно лекарственное вещество содержит или в основном состоит из домена связывания или единицы связывания, такой как иммуноглобулин или последовательность иммуноглобулина (включая, но не ограничиваясь этим, фрагмент иммуноглобулина), например, антитело или фрагмент антитела (включая, но не ограничиваясь этим ScFv фрагмент), или другого подходящего белкового каркаса, такого как домены протеина A (такие как Affibodies™), тендамистат, фибронектин, липокалин, CTLA-4, T-клеточные рецепторы, сконструированные анкириновые повторы, авимеры и PDZ домены (Binz et al., Nat. Biotech 2005, Vol 23:1257), и молекулы связывания на основе ДНК или РНК, включая но не ограничиваясь этим ДНК или РНК аптамеры (Ulrich et al., Comb Chem High Throughput Screen 2006 9(8):619-32).
В еще одном аспекте, по меньшей мере, одно лекарственное вещество содержит или в основном состоит из вариабельного домена антитела, такого как тяжелая цепь вариабельного домена или легкая цепь вариабельного домена.
В предпочтительном аспекте, по меньшей мере, одно лекарственное вещество содержит или в основном состоит по меньшей мере из одного вариабельного домена иммуноглобулина, такого как доменное антитело, однодоменное антитело, “dAb” или нанотело (такое как VHH, гуманизированный VHH или камелизированный VH) или IgNAR домен.
В конкретном варианте осуществления по меньшей мере одно лекарственное вещество содержит или в основном состоит по меньшей мере из одного моновалентного нанотела или бивалентной, мультивалентной, биспецифической или мультиспецифической конструкции нанотела.
Полипептиды, (слитые) белки, конструкции или соединения, которые содержат вещество изобретения, связывающее сывороточный альбумин, и один или более терапевтических препаратов могут быть в большинстве случаев (приготовлены и использованы) как описано в предшествующем уровне техники, процитированном выше (например, WO 04/041865, WO 06/122787, WO 2012/175400 и WO 2015/173325; можно сослаться, например, на WO 2004/003019, EP 2 139 918, WO 2011/006915 и WO 2014/111550) со связывающим сывороточный альбумин веществом изобретения вместо увеличивающих время полужизни структур, описанных в указанных (ссылках).
Полипептиды, (слитые) белки, конструкции или соединения, которые содержат вещество изобретения, связывающее сывороточный альбумин, и один или более терапевтических препаратов, в большинстве случаев и предпочтительно будут иметь повышенное время полужизни (как описано в этом документе, и предпочтительно выраженное в виде t1/2-бета) по сравнению с лекарственным веществом или компонентами per se.
В общем, соединения, полипептиды, конструкции или слитые белки, описанные в этом документе, предпочтительно имеют время полужизни (и в этом случае, как описано в этом документе, предпочтительно выраженное в виде t1/2-бета), то есть по меньшей мере в 1,5 раза, предпочтительно по меньшей мере в 2 раза, например, по меньшей мере в 5 раз, например, по меньшей мере в 10 раз или более чем в 20 раз больше, чем время полужизни соответствующего лекарственного вещества самого по себе (измеренного или у человека или подходящего животного, такого как мышь или яванский макак).
Также, предпочтительно, любое подобное соединение, полипептид, слитый белок или конструкция имеет время полужизни (и в этом случае, как описано в этом документе, предпочтительно выраженное в виде t1/2-бета) у человека, повышенное более чем на 1 час, предпочтительно более чем на 2 часа, более предпочтительно более чем на 6 часов, например, более чем на 12 часов, по сравнению с временем полужизни соответствующего лекарственного вещества самого по себе.
Также, предпочтительно, соединение или полипептид изобретения имеет время полужизни (и в этом случае, как описано в этом документе, предпочтительно выраженное в виде t1/2-бета) у человека, которое составляет более чем 1 час, предпочтительно более чем 2 часа, более предпочтительно более чем 6 часов, например, более чем 12 часов, и например, около одного дня, двух дней, одной недели, двух недель и вплоть до времени полужизни сывороточного альбумина у человека (которое по оценкам составляет около 19 дней).
Как уже упоминалось, в одном аспекте вещество изобретения, связывающее сывороточный альбумин, используется для увеличения времени полужизни (одного или более) одиночных вариабельных доменов иммуноглобулина, таких как доменные антитела, однодоменные антитела, “dAb’s”, VHH или Нанотела (такие как VHH, гуманизированные VHH или камелизованные VH, такие как камелизованные человеческие VH).
Таким образом, один вариант осуществления изобретения имеет отношение к полипептиду, конструкции или слитому белку, который содержит вещество изобретения, связывающее сывороточный альбумин, и одну или более (например, одну или две) последовательностей одиночного вариабельного домена иммуноглобулина, которые соответствующим образом связаны друг с другом, или напрямую или необязательно через один или более подходящих линкеров или спейсеров. Как уже говорилось в описании, каждый такой одиночный вариабельный домен иммуноглобулина, присутствующий в подобном полипептиде, конструкции или слитом белке, может независимо быть доменным антителом, однодоменным антителом, “dAb’” или Нанотелом (таким как VHH, гуманизированный VHH или камелизованный VH, например, камелизованный человеческий VH); и согласно одному конкретному, но неограничивающему аспекту, по меньшей мере, один (и вплоть до всех) из этих одиночных вариабельных доменов иммуноглобулина содержит два или три дисульфидных мостика. Предпочтительно, все ISVDs, присутствующие в таком соединении изобретения, являются нанотелами.
Когда соединение изобретения имеет ISVD в его C-концевой области (такой как вещество изобретения, связывающее сывороточный альбумин, или ISVD, который направлен против терапевтической мишени), тогда указанный C-концевой ISVD (и таким образом, путем удлинения, всё соединение изобретения) предпочтительно имеет C-концевое удлинение в своей C-концевой области. Это C-концевое удлинение будет непосредственно связываться с последним C-концевым аминокислотным остатком ISVD, который обычно будет являться аминокислотным остатком в положении 113 согласно Kabat (только в том случае, если ISVD содержит одну или более аминокислотных делеций, так что последовательность ISVD кончается до положения 113). Таким образом, как правило, C-концевое удлинение будет непосредственно связано с C-концевой VTVSS последовательностью VTVSS (SEQ ID NO:15) C-концевого ISV (и таким образом, путем удлинения, с C-концевой TVTSS последовательностью соединения изобретения) или C-концевой последовательностью C-концевого ISVD, который соответствует C-концевой ISVD последовательности (например, в случаях, когда указанная C-концевая последовательность C-концевого ISVD содержит одну или более замен или делеций по сравнению с обычной VTVSS последовательностью, такой как T110K, T110Q, S112K или S112K).
Специалисту понятно, что в том случае, когда соединение изобретения имеет связывающее сывороточный альбумин вещество изобретения на своем C-конце, тогда указанное связывающее сывороточный альбумин вещество изобретения будет содержать в себе указанное C-концевое удлинение.
В основном, любое C-концевое удлинение, которое используется в описании (т.е. на C-конце соединения изобретения и/или на C-конце связывающего сывороточный альбумин вещества изобретения), может быть таким, как описано в WO 2012/174741 или WO 2015/173325 (можно сослаться, например, на WO 2103/024059 и WO2016/118733). В частности, C-концевое удлинение может иметь формулу (X)n, в которой n является 1 - 10, предпочтительно 1 - 5, например, 1, 2, 3, 4 или 5 (и предпочтительно 1 или 2, например, 1); и каждый X является (предпочтительно природного происхождения) аминокислотным остатком, который независимо выбирают из аминокислотных остатков природного происхождения (хотя согласно одному предпочтительному аспекту, оно не содержит остатков цистеина), и предпочтительно независимо выбирают из группы, состоящей из аланина (A), глицина (G), валина (V), лейцина (L) или изолейцина (I).
Согласно некоторым предпочтительным, но неограничивающим аспектам таких C-концевых удлинений X(n), X и n могут выглядеть следующим образом:
(a) n = 1 и X = Ala;
(b) n = 2 и каждый X = Ala;
(c) n = 3 и каждый X = Ala;
(d) n = 2 и по меньшей мере один X = Ala (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(e) n = 3 и по меньшей мере один X = Ala (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из аминокислотных остатков природного происхождения, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(f) n = 3 и по меньшей мере, два X = Ala (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(g) n = 1 и X = Gly;
(h) n = 2 и каждый X = Gly;
(i) n = 3 и каждый X = Gly;
(j) n = 2 и по меньшей мере один X = Gly (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(k) n = 3 и, по меньшей мере, one X = Gly (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(l) n = 3 и, по меньшей мере, два X = Gly (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
(m) n = 2 и каждый X = Ala или Gly;
(n) n = 3 и каждый X = Ala или Gly;
(o) n = 3 и, по меньшей мере, один X = Ala или Gly (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile); или
(p) n = 3 и, по меньшей мере, два X = Ala или Gly (при этом оставшийся аминокислотный остаток(и) X независимо выбирают из любых существующих в природе аминокислот, но предпочтительно независимо выбирают из Val, Leu и/или Ile);
при этом аспекты (a), (b), (c), (g), (h), (i), (m) и (n) являются особенно предпочтительными, причем аспекты, в которых n =1 или 2 являются предпочтительными, а аспекты, в которых n = 1 являются особенно предпочтительными.
Следует отметить, что предпочтительно, любое C-концевое удлинение, присутствующее в веществе изобретения, связывающем сывороточный альбумин, не содержит (свободного) остатка цистеина (за исключением случаев, когда указанный остаток цистеина используется или предназначается для дополнительной функционализации, например, для пегилирования).
Некоторыми отдельными, но неограничивающими примерами подходящих C-концевых удлинений являются следующие аминокислотные последовательности: A, AA, AAA, G, GG, GGG, AG, GA, AAG, AGG, AGA, GGA, GAA or GAG.
Предпочтительно также, когда соединение изобретения имеет ISVD на своем C-конце (например, вещество изобретения, связывающее сывороточный альбумин, или ISVD, который направлен против терапевтической мишени), тогда (по меньшей мере,) указанный C-концевой ISVD будет предпочтительно содержать, даже более предпочтительно в дополнение к C-концевому удлинению, как описано в этом документе, одну или более мутаций, которые уменьшают связывание предсуществующими антителами (т.е. как описано в документе в отношении вещества изобретения, связывающего сывороточный альбумин, и как в более широком смысле описано в WO 2012/175741 и WO 2015/173325 и также, например, в WO 2013/024059 и WO 2016/118733). В этом отношении специалисту будет понятно, что в случае, когда соединение изобретения имеет вещество изобретения, связывающее сывороточный альбумин, на его C-конце, тогда (по меньшей мере) указанное вещество изобретения, связывающее сывороточный альбумин, предпочтительно будет содержать такие мутации (т.е. предпочтительно в дополнение к C-концевому удлинению).
Конкретнее, согласно отдельному аспекту изобретения в том случае, когда соединение изобретения содержит два или более ISVD (например, вещество изобретения, связывающее сывороточный альбумин, и один или более ISVD против терапевтической мишени), тогда предпочтительно все эти ISVD содержат мутации, которые уменьшают связывание с предсуществующими антителами (и в этом случае, предпочтительно в дополнение к C-концевому удлинению, которое связывается с C-концевым ISVD, если соединение изобретения имеет ISVD на его C-конце).
Когда соединение изобретения имеет ISVD на его N-конце (например, вещество изобретения, связывающее сывороточный альбумин, или ISVD, который направлен против терапевтической мишени), тогда указанный N-концевой ISVD (и таким образом, через удлинение, все соединение изобретения) предпочтительно содержит D в положении 1. В этом отношении, специалисту понятно, что в случае, когда соединение изобретения имеет вещество изобретения, связывающее сывороточный альбумин, на его N-конце, тогда указанное вещество изобретения, связывающее сывороточный альбумин, будет предпочтительно иметь D в положении 1 (например, E1D мутацию по сравнению, например, с последовательностью SEQ ID NO:18 и/или 19, такой как, в аминокислотных последовательностях изобретения SEQ ID NO: 36 – 44).
В некоторых дополнительных аспектах изобретение имеет отношение к белку, полипептиду или другому соединению или конструкции, которая содержит или в основном состоит по меньшей мере, из одного (и предпочтительно одного единственного) вещества изобретения, связывающего сывороточный альбумин, и по меньшей мере, одного (например, одного, двух или трех) лекарственного вещества или структуры (в котором указанное вещество, связывающее сывороточный альбумин, и один или более терапевтических препаратов или структур связаны соответствующим образом, необязательно через один или более подходящих линкеров), при этом протеин, полипептид, соединение, конструкция является таким, что:
- когда он имеет ISVD на его C-конце, тогда (C-концевой ISVD указанного протеина) указанный протеин, полипептид, соединение, конструкция имеет C-концевое удлинение (X)n (как описано далее в этом документе) в его C-концевой области; и/или
- когда он имеет ISVD на его C-конце, тогда, по меньшей мере, указанный C-концевой ISVD содержит одну или более мутаций, которые уменьшают связывание предсуществующих антител (как описано далее в этом документе);
- когда он имеет ISVD на его N-конце, тогда (N-концевой ISVD указанного протеина) указанный протеин, полипептид, соединение, конструкция предпочтительно содержит D в положении 1; и/или
- в котором указанные ISVD в протеине, полипептиде или другом соединении также могут иметь ISVD в своей N-концевой области, в этом случае указанный N-концевой ISVD конец предпочтительно имеет D или E1D в положении 1;
- предпочтительно, практически все из ISVD, присутствующих в указанном протеине, полипептиде, соединении, конструкции содержат одну или более мутаций, которые уменьшают связывание предсуществующих антител (как описано далее в этом документе).
Согласно одному конкретному аспекту изобретения, все терапевтические молекулы, присутствующие в соединении изобретения, представляют собой ISVD (т.е. ISVDs против терапевтической мишени), и в частности ISVD, состоящие из тяжелой цепи, и, конкретнее, нанотела (т.е. нанотела против терапевтической мишени).
Например, и без ограничения, такие соединения изобретения могут включать:
- одну копию вещества изобретения, связывающего сывороточный альбумин, и один ISVD (и предпочтительно нанотело) против терапевтической мишени; или
- одну копию вещества изобретения, связывающего сывороточный альбумин, и два ISVD (и предпочтительно два нанотела) против терапевтической мишени (при этом ISVD может быть тем же самым или другим, и когда он является другим, он может быть направлен против той же самой мишени, против различных эпитопов на той же самой мишени или против различных терапевтических мишеней); или
- одну копию вещества изобретения, связывающего сывороточный альбумин, и три ISVD (и предпочтительно три нанотела) против терапевтической мишени (при этом ISVD может быть тем же самым или другим, и когда он является другим, он может быть направлен против той же самой мишени, против различных эпитопов на той же самой мишени или против различных терапевтических мишеней).
Некоторые неограничивающие примеры конструкций, слитых белков или полипептидов изобретения могут быть схематично представлены, как описано далее, в которых “[Alb]” представляет вещество изобретения, связывающее сывороточный альбумин, “[лекарственное вещество 1]” и “[лекарственное вещество 2]” представляют терапевтические молекулы (которая как упоминалось, каждая может независимо быть одиночным вариабельным доменом иммуноглобулина), “ - “ представляет подходящий линкер (который является необязательным; подходящими примерами являются 9GS и 35GS линкеры), и N-конец находится в левой части, а C-конец находится в правой части:
[Alb] - [лекарственное вещество 1]
[лекарственное вещество 1] - [Alb]-X(n)
[Alb] - [лекарственное вещество 1] - [лекарственное вещество 1]
[лекарственное вещество 1] - [лекарственное вещество 1] - [Alb]-X(n)
[лекарственное вещество 1] - [Alb] - [лекарственное вещество 1]
[Alb] - [лекарственное вещество 1] - [лекарственное вещество 2]
[лекарственное вещество 1] - [лекарственное вещество 2] - [Alb]-X(n)
[лекарственное вещество 1] - [Alb] - [лекарственное вещество 2]
В том случае, когда терапевтические молекулы представляют собой ISVD (и предпочтительно нанотела) против терапевтической мишени, предпочтительные, но не ограничивающие конструкции, слитые белки или полипептиды изобретения могут быть схематично представлены, как указано далее, где “[Alb]” представляет вещество изобретения, связывающее сывороточный альбумин, “[ терапевтический ISVD 1]” и “[ терапевтический ISVD 2]” представляют ISVD против терапевтической мишени (при этом ISVD может быть тем же самым или другим, и если он другой, он может быть направлен против той же самой мишени, против различных эпитопов на той же самой мишени или против различных терапевтических мишеней), “ - “ представляет подходящий линкер (который является необязательным), X(n) представляет C-концевое удлинение, как описано в этом документе, и N-конец находится в левой части, а C-конец находится в правой части:
[Alb] - [терапевтический ISVD 1] -X(n)
[терапевтический ISVD 1] - [Alb]-X(n)
[Alb] - [терапевтический ISVD 1] - [терапевтический ISVD 1] -X(n)
[терапевтический ISVD 1] - [терапевтический ISVD 1] - [Alb]-X(n)
[терапевтический ISVD 1] - [Alb] - [терапевтический ISVD 1] -X(n)
[Alb] - [терапевтический ISVD 1] - [терапевтический ISVD 2] -X(n)
[терапевтический ISVD 1] - [терапевтический ISVD 2] - [Alb]-X(n)
[терапевтический ISVD 1] - [Alb] - [терапевтический ISVD 2] -X(n)
Таким образом, в другом аспекте изобретение имеет отношение к мультиспецифической (и, в частности, биспецифической) конструкции нанотела, которая содержит связывающее сывороточный альбумин вещество изобретения и по меньшей мере одно другое нанотело (например, одно или два других нанотела, которые могут быть одинаковыми или разными), при этом указанное, по меньшей мере, одно другое нанотело предпочтительно направлено против желательной мишени (которая предпочтительно является терапевтической мишенью) и/или другое нанотело, которое является пригодным или подходящим для терапевтических, профилактических и/или диагностических целей. И в этом случае, связывающее сывороточный альбумин вещество изобретения и другие нанотела могут быть соответствующим образом связаны друг с другом или непосредственно или необязательно посредством одного или более подходящих линкеров или спейсеров.
Общее описание мультивалентных и мультиспецифических полипептидов, содержащих одно или более нанотел, и их препараты, также можно найти в Conrath et al., J. Biol. Chem., Vol. 276, 10. 7346-7350, 2001; Muyldermans, Reviews in Molecular Biotechnology 74 (2001), 277-302; а также, например, в WO 96/34103, WO 99/23221, WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
В виде иллюстрации, некоторые примеры соединений изобретения даны в SEQ ID NO:46 - 52, использующие анти-HER2-Нанотело SEQ ID NO: 45 в качестве характерного примера Нанотела анти-мишень, и при этом составляющие Нанотела находятся в разных положениях в соединении изобретения. Соединения SEQ ID NO: 46 - 49 являются примерами, иллюстрирующими двухвалентные биспецифические соединения изобретения, и соединения SEQ ID NO: 50 - 52 являются примерами, иллюстрирующими трехвалентные биспецифические соединения изобретения. В каждом случае, соединения содержат E1D мутацию и C-концевой остаток аланина, и содержат характерные, но неограничивающие примеры использования подходящих линкеров (т.е. 15GS линкер в SEQ ID NO:47 и 48 и или 5GS линкеры в SEQ ID NO:s 46 и 49 - 52).
Некоторые другие примеры некоторых отдельных мультиспецифических и/или мультивалентных полипептидов изобретения можно найти в заявках Ablynx N.V., упомянутых в описании. В частности, в отношении общего описания мультивалентных и мультиспецифических конструкций, содержащих по меньшей мере одно нанотело против сывороточного белка для увеличения времени полужизни, нуклеиновых кислот, кодирующих указанные конструкции, композиций, содержащих указанные конструкции, получение вышеупомянутых конструкций и вариантов применения вышеупомянутых конструкций, можно сослаться на международные заявки WO 04/041865 и WO 06/122787, упомянутые выше (связывающие сывороточный альбумин вещества изобретения, описанные в этом документе, могут в большинстве случаев использоваться аналогично для увеличения времени полужизни нанотел, описанных в этом документе, таких как Alb-8), а также общее описание и конкретные примеры таких конструкций даны, например, в WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Изобретение также имеет отношение к нуклеотидным последовательностям или нуклеиновым кислотам, которые кодируют вещества, связывающие альбумин, соединения или полипептиды изобретения. Изобретение дополнительно включает генетические конструкции, которые включают вышеупомянутые нуклеотидные последовательности или нуклеиновые кислоты и один или более элементов для генетических конструкций как таковых. Генетическая конструкция может иметь форму плазмиды или вектора. И в этом случае, такие конструкции могут представлять собой, как описано в опубликованных патентных заявках Ablynx N.V., таких как, например, WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Изобретение, кроме того, имеет отношение к хозяевам или клеткам-хозяевам, которые содержат такие нуклеотидные последовательности или нуклеиновые кислоты, и/или которые экспрессируют (или являются способными экспрессировать), связывающие альбумин вещества, соединения или полипептиды изобретения. И в этом случае, такие клетки-хозяева могут быть в основном описаны в опубликованных патентных заявках Ablynx N.V., таких как, например WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Изобретение также имеет отношение к способу получения связывающего альбумин вещества, соединения или полипептида изобретения, при этом способ включает культивирование или поддержание клетки-хозяина, как описано в этом документе, при таких условиях, что указанная клетка-хозяин продуцирует или экспрессирует связывающее альбумин вещество, соединение или полипептид изобретения, и необязательно дополнительно включает выделение связывающего альбумин вещества, соединения или полипептида изобретения, продуцированного таким способом. Опять же, такие способы могут быть осуществлены так, как в общем описано в опубликованных патентных заявках Ablynx N.V., таких как, например WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Изобретение также имеет отношение к фармацевтической композиции, содержащей по меньшей мере одно соединение или полипептид изобретения, и необязательно по меньшей мере один фармацевтически приемлемый носитель, разбавитель или эксципиент. Такие препараты, носители, эксципиенты и разбавители могут быть в основном такими, как описано в опубликованных патентных заявках Ablynx N.V., таких как, например WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Однако, поскольку соединения или полипептиды изобретения имеют увеличенное время полужизни, их предпочтительно вводят в кровоток. Собственно, они могут вводиться любым подходящим способом, обеспечивающим поступление соединения или полипептида изобретения в кровоток, например, внутривенно, путем инъекции или инфузии, или любым подходящим способом (включая пероральное введение, подкожное введение, внутримышечное введение, чрескожное введение, внутриназальное введение, введение через легкие и т.д.). Подходящие способы и пути введения понятны специалистам, например, также из опубликованных патентных заявок Ablynx N.V., таких как, например WO 04/041862, WO 2006/122786, WO 2008/020079, WO 2008/142164 или WO 2009/068627.
Таким образом, в другом аспекте изобретение имеет отношение к способу предотвращения и/или лечения по меньшей мере одного заболевания или нарушения, которое может быть предотвращено или которое можно лечить, используя соединение или полипептид изобретения, при этом данный способ включает введение нуждающемуся в этом субъекту фармацевтически активного количества соединения или полипептида изобретения и/или фармацевтической содержащей их композиции. Болезни или нарушения, которые можно предотвратить или лечить путем использования соединения или полипептида изобретения, как описано в этом документе, в большинстве случаев будут представлять собой такие же болезни или нарушения, которые можно предотвратить или лечить путем использования лекарственных веществ или молекул, которые представляют собой/присутствуют в соединении или полипептиде изобретения.
В контексте настоящего изобретения термин “профилактику и/или лечение” не только включает профилактику и/или лечение заболевания, но также в большинстве случаев включает профилактику начала заболевания, замедление или устранение прогрессирования заболевания, профилактику или замедление начала одного или более симптомов, связанных с заболеванием, уменьшение и/или облегчение одного или более симптомов, связанных с заболеванием, уменьшение тяжести и/или продолжительности заболевания и/или любых симптомов, связанных с ним и/или профилактику дальнейшего увеличения тяжести болезни и/или любых симптомов, связанных с ней, профилактику, уменьшение или устранение (изменение на противоположное направление развития) любого физиологического нарушения, вызванного болезнью и, в общем, любое фармакологическое воздействие, которое является полезным для пациента, подлежащего лечению.
Подлежащий лечению субъект может быть любым теплокровным животным, однако, в частности, является млекопитающим и, более конкретно, человеком. Как понятно специалисту, субъектом, нуждающимся в лечении, будет являться, в частности, индивидуум, страдающий от или имеющий риск развития болезней или нарушений, упомянутых в этом документе.
В другом варианте осуществления изобретение имеет отношение к методу иммунотерапии и, в частности, к пассивной иммунотерапии, при этом данный метод включает введение субъекту, страдающему от или имеющему риск развития болезней или нарушений, упомянутых в этом документе, фармацевтически активного количества соединения или полипептида изобретения и/или содержащей их фармацевтической композиции.
Соединение или полипептид изобретения и/или содержащие их композиции вводят в соответствии с режимом лечения, подходящим для предотвращения и/или лечения болезни или нарушения, которое необходимо предотвратить или лечить. Практикующий врач, как правило, способен определить подходящий режим лечения, зависящий от таких факторов как болезнь или нарушение, которое подлежит профилактике или лечению, тяжесть болезни, которую необходимо лечить, и/или тяжесть симптомов болезни, конкретный полипептид изобретения, который должен использоваться, определенный путь введения и фармацевтическая композиция, которая должна использоваться, возраст, пол, вес, диета, общее состояние пациента и подобные факторы, хорошо известные лечащему врачу.
Как правило, режим лечения будет включать введение одного или более соединений или полипептидов изобретения или одной или более содержащих их композиций в одном или более фармацевтически эффективных количествах или дозах. Специфическое(ие) количество(а) или дозы, которые следует вводить, могут быть определены лечащим врачом на основе приведенных выше факторов.
Как правило, для предотвращения и/или лечения болезней или нарушений, упомянутых в этом документе и в зависимости от конкретной болезни или нарушения, которое нужно лечить, эффективности и/или времени полужизни соединений или полипептидов изобретения, которые необходимо использовать, конкретного пути введения и определенной фармацевтической композиции или используемой композиции, соединения или полипептиды изобретения в большинстве случаев будут вводить в количестве в пределах от 1 грамма до 0,01 микрограмма на кг веса тела в день, предпочтительно в пределах от 0,1 грамма до 0, 1 микрограмма на кг веса тела в день, например, около 1, 10, 100 или 1000 микрограмм на кг веса тела в день, или в течение длительного времени (например, путем инфузии), в виде однократной ежедневной дозы или в виде нескольких дробных доз в течение дня. Как правило, лечащий врач способен определить подходящую ежедневную дозу, зависящую от упомянутых факторов. Также следует понимать, что в конкретных случаях лечащий врач может решить отклониться от этих количеств, например, исходя из факторов, процитированных выше, и его экспертной оценки. В общем, некоторое руководство относительно количества, которое следует вводить, может быть получено из количеств, обычно используемых при введении сравнимых общепринятых антител или фрагментов антител против той же самой мишени, вводимых тем же самым путем, однако, принимая во внимание различия в аффинности/авидности, эффективности, биорапределении, времени полужизни и сходных факторов хорошо известных специалисту.
Также поскольку соединения изобретения содержат связывающее сывороточный альбумин вещество изобретения с увеличенным временем полужизни, они не нуждаются в непрерывном введении (например, путем инфузии), но они могут быть введены с подходящими интервалами (которые должен определить специалист). Например, они могут вводиться (в подходящей дозе) один раз в два дня, один раз каждые четыре дня, один раз в неделю, один раз каждые две недели и в некоторых случаях один раз каждые четыре недели или даже менее часто, например, путем инъекции или инфузии.
Один аспект изобретения имеет отношение к фармацевтической композиции, содержащей по меньшей мере одно соединение или полипептид изобретения, при этом указанная композиция предназначена для введения в промежутке от одного раза в неделю до одного раза в течение 4 недель и, в частности, в промежутке от одного раза через каждые 7 дней до одного раза через каждые 21 день, например, один раз каждые 7 или 14 дней.
В большинстве случаев в упомянутом выше способе будет использоваться одиночный полипептид изобретения. Однако в рамки изобретения входит использование двух или более полипептидов изобретения в комбинации.
Полипептиды изобретения также могут использоваться в комбинации с одним или более дополнительными фармацевтически активными соединениями или структурами, т.е., в виде комбинированного режима лечения, что может приводить или не приводить к синергетическому эффекту. Опять же, лечащий врач будет способен выбрать такие дополнительные соединения или структуры, а также подходящие комбинированные режимы лечения, исходя из факторов перечисленных выше и его экспертной оценки.
В частности, полипептиды изобретения могут использоваться в комбинации с другими фармацевтически активными соединениями или структурами, которые используются или могут использоваться для предотвращения и/или лечения болезней и нарушений, которые можно предотвратить или лечить с помощью слитых белков или конструкций изобретения, и в результате чего синергетический эффект может быть получен или нет.
Как понятно лечащему врачу, эффективность режима лечения, использованного согласно изобретению, в отношении болезни или нарушения может быть определена и/или прослежена любым широко известным способом. Лечащий врач также будет способен, где это необходимо и/или в каждом конкретном случае, изменить или модифицировать конкретный режим лечения, для того, чтобы достичь желательного терапевтического эффекта, избежать, ограничить или уменьшить нежелательные побочные эффекты, и/или добиться подходящего баланса между достижением желательного терапевтического эффекта с одной стороны и избеганием, ограничением или уменьшением нежелательных побочных эффектов с другой стороны.
В общем случае, режим лечения будет применяться до достижения желательного терапевтического эффекта и/или в течение всего времени, пока желательный терапевтический эффект следует поддерживать. И в этом случае, это может быть определено лечащим врачом.
Другие аспекты, варианты осуществления, преимущества и практические применения изобретения станут понятны из дальнейшего описания.
Далее изобретение будет описываться с помощью следующих неограничивающих предпочтительных аспектов, примеров и фигур, при этом:
фиг. 1 – это таблица, содержащая список некоторых аминокислотных положений, которые будут упоминаться в описании, и их нумерация согласно некоторым альтернативным системам нумерации (таким как Aho и IMGT);
фиг. 2 перечисляет аминокислотные последовательности, упоминаемые в описании;
фиг. 3A и 3B показывают выравнивание последовательности SEQ ID NO:18 и 19 (изобретение) с последовательностями предшествующего уровня SEQ ID NO: 1 и 2;
фиг. 4 показывает выравнивание SEQ ID NO: 18 - 44;
фиг. 5 показывает выравнивание сывороточного альбумина от разных видов млекопитающих;
фиг. 6 - график, показывающий связывание SEQ ID NO:1 (эталон)-cMycHis6 с нанесенным HSA в присутствии связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение). 1,5 нМ SEQ ID NO:1-cMycHis6 и серия концентраций His6Flag3-SEQ ID NO:1 (эталон), Flag3His6-SEQ ID NO:19 (изобретение) или cAblys3-Flag3His6 (эталон) были проинкубированы на нанесенном HSA. Связанный SEQ ID NO:1-cMycHis6 обнаруживали с помощью козьих анти-cMyc и HRP-меченых кроличьих анти-козьих антител;
фиг. 7 - график, показывающий связывание HSA с FcRn в присутствии связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение). Гетеродимер человеческий FcRn-человеческий β2 микроглобулин был иммобилизирован на CM5 чипе. Связывание 1 мкM HSA в отсутствие или в присутствии 2 мкM нанотела в 50 мM NaPO4 + 150 мM NaCl + 0,05% Твин-20 pH 6.0 контролировали на приборе Biacore T100.
Полное содержание всех ссылок (включая библиографию, выданные патенты, опубликованные патентные заявки и совместные заявки на патент, находящиеся в рассмотрении), цитированных на всем протяжении этой заявки явным образом включены в данный документ посредством ссылки.
Экспериментальная часть
Пример 1. Аффинность в отношении сывороточного альбумина
Аффинность связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) в отношении человеческого (Sigma-Aldrich A3782), яванского макака (полученного своими силами), мышиного (Albumin Bioscience 2601), крысиного (Sigma-Aldrich A4538), кроличьего (Sigma-Aldrich A0764), морской свинки (Gentaur GPSA62), свиньи (Sigma-Aldrich A4414), овцы (Sigma-Aldrich A3264) и коровы (Sigma-Aldrich A3059) сывороточного альбумина (SA) измеряли посредством поверхностного плазмонного резонанса (SPR) на приборе ProteOn XPR36 (BioRad). Сывороточный альбумин был иммобилизирован посредством иммобилизации через амино-группу на GLC ProteOn чипе с использованием набора ProteOn Amine Coupling Kit (BioRad). Разные концентрации (300 нM, 100 нM, 33.3 нM, 11.1 нM, 3.7 нM и 1.23 нM) связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) инжектировали в HBS-P+ pH 7,4 буфере (GE Healthcare) при 45 мкл/мин в течение 120 сек с последующей диссоциацией в течение 900 сек. Не наблюдалось или наблюдалось очень низкое связывание связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) с SA кролика, свиньи, овцы и коровы. Аффинность вещества, связывающего сывороточный альбумин, SEQ ID NO:19 (изобретение) в отношении SA человека, яванского макака, крысы, мыши и морской свинки была выше по сравнению с соответствующими аффинностями связывающего сывороточный альбумин вещества SEQ ID NO:1. Результаты показаны в таблице 1 ниже, и показано, что связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение) является перекрестно-реактивным с SA собаки и свиньи.
Таблица 1. Кинетические параметры связывания вещества, связывающего сывороточный альбумин, SEQ ID NO:19 (изобретение) с SA от разных видов.
(изобретение)
(эталон)
(s-1M-1)
(s-1)
(M)
(s-1M-1)
(s-1)
(M)
Длительное время полужизни альбумина в крови объясняется в основном двумя свойствами: (i) большой размер (65 кДа) альбумина ограничивает его клубочковую фильтрацию, и (ii) альбумин связывается с FcRn при низком значении pH (pH 6), которое защищает альбумин от деградации в лизосомах после пассивного эндоцитоза в эндотелиальные и эпителиальные клетки путем рециклинга (возвращения) из ранней эндосомы назад во внеклеточную окружающую среду. Для того, чтобы связывающие альбумин нанотела обеспечить длительным временем полужизни посредством связывания альбумина и последующего рециклинга, они должны оставаться связанными с альбумином в пределах значений pH от 5,0 до 7,4. Скорость диссоциации связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) от HSA при pH 5, pH 6 и pH 7,4 была измерена на приборе ProteOn, как описано выше, включая связывающее сывороточный альбумин вещество SEQ ID NO:1 в качестве эталона. Связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение) и SEQ ID NO:1 (эталон) вводили при 500 нM и 300 нM соответственно в HBS-P+ pH 7.4 буфере. Буферы для диссоциации были следующие: 50 мM NaOAc/HOAc + 150 мM NaCl + 0.05 % Твин-20 pH 5,0, 50 мM NaOAc/HOAc + 150 мM NaCl + 0.05% Твин-20 pH 6.0 и HBS-P+ pH 7.4, соответственно. Диссоциацию анализировали в течение 2700 секунд. Скорость диссоциации для связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) значительно не изменялась в пределах значений pH от 5,0 до 7,4. Результаты показаны в таблице 2.
Таблица 2. Скорость диссоциации связывающего сывороточный альбумин вещества SEQ ID NO:19 (изобретение) от HSA при разных значениях pH.
Пример 2. Эпитоп
Связывание эпитопа анализировали в конкурентном анализе ELISA. Человеческий сывороточный альбумин наносили при 125 нг/мл в PBS при 4°C на ночь. После блокирования с помощью PBS + 1% казеин добавляли 1,5 нM связывающее сывороточный альбумин вещество [SEQ ID NO:1-cMycHis6] и серию концентраций конкурентов (His6Flag3-связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение), His6Flag3-SEQ ID NO:1 (эталон) в качестве положительного контроля или связывающее лизоцим куриного яйца однодоменное антитело cAblys3-Flag3His6 в качестве отрицательного контроля). Связанный SEQ ID NO:1 (эталон)-cMycHis6 обнаруживали с помощью козьих анти-cMyc (Abcam ab19234) и HRP-меченых кроличьих анти-козьих (Genway 18-511-244226) антител. Связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение) и SEQ ID NO:1 (эталон) не связываются с идентичными эпитопами на HSA (фиг. 6).
Пример 3. Вмешательство во взаимодействие между SA и FcRn
Для того, чтобы связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение) обеспечить длительным временем полужизни посредством связывания альбумина и последующего рециклинга, оно не должно вмешиваться в связывание альбумина с FcRn. Это было проанализировано в SPR на приборе T100 (GE Healthcare). Гетеродимер человеческий FcRn-человеческий β2 микроглобулин (Sino Biological CT009-H08H) был иммобилизирован на CM5 чипе посредством стандартной иммобилизации на аминогруппе (набор для иммобилизации на аминогруппе Biacore). Смесь 1 мкM HSA и 2 мкM Нанотела (His6Flag3-связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение), His6Flag3-SEQ ID NO:1 (эталон) или cAblys3-Flag3His6) в 50 мM NaPO4 + 150 мM NaCl + 0,05% Tвин-20 при pH 6, инжектировали со скоростью 10 мкл/мин в течение 120 сек, с последующей диссоциацией в течение 600 сек. Кривые связывания качественно сравнивали с кривой связывания 1 мкM HSA при отсутствии нанотела. Связывающее сывороточный альбумин вещество SEQ ID NO:19 (изобретение) не вмешивается в связывание HSA с FcRn (фиг. 7).
Пример 4. PK профиль у собаки
Исследовали фармакокинетику трехвалентной конструкции нанотела (SEQ ID NO:53) после однократного внутривенного введения собаке. Трехвалентная конструкция была получена в Pichia pastoris и включала два нанотела против респираторного синцитиального вируса (RSV) с альбумин-связывающим нанотелом SEQ ID NO:21 в C-концевой области (в котором три нанотела соединены друг с другом при помощи (Gly4Ser)7 линкеров).
Фармакокинетический профиль конструкции оценивался в фармакокинетическом исследовании (неперекрестное, с однократной дозой) на двенадцати здоровых кобелях породы бигль натощак (состояние здоровья было оценено в ходе медицинского осмотра до проведения исследования). Конструкцию вводили внутривенно.
Животные голодали (с непрерывным доступом к воде) в течение ночи перед введением дозы, а также перед сбором образцов крови перед введением дозировки и через 24, 168 и 336 часов после введения дозировки (общее время голодания составляло не более 24 часов). Пищу давали через 4 часа после введения дозировки или сразу после сбора крови через 24, 168 и 336 часов. Также регистрировали вес тела и прослеживали его в течение всего исследования.
1 мл цельной крови (или 2-3 мл до дозирования и через 24, 168 и 336 часов) для получения плазмы собирали из периферического кровеносного сосуда перед введением дозировки и через 5, 15, 30 минут и 1, 4, 8, 12, 24, 72, 168, 240, 336, 504 и 672 часов после первоначальной дозировки. Собранные для получения сыворотки образцы держали при комнатной температуре и давали свернуться. Кровь центрифугировали при 10000 об/мин в течение 2 минут на центрифуге с охлаждением (температура поддерживалась 4°C). Образцы замораживали в течение 30 минут после сбора до времени проведения анализа (включая измерение концентрации релевантной конструкции нанотела).
--->
SEQUENCE LISTING
<110> Ablynx NV
<120> Improved serum albumin binders
<130> 202810
<150> US62/446,988
<151> 2017-01-17
<160> 63
<170> PatentIn version 3.5
<210> 1
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> Reference
<400> 1
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Asn
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Ser Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Thr Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 2
<211> 115
<212> PRT
<213> Artificial Sequence
<220>
<223> Reference
<400> 2
Glu Val Gln Leu Leu Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Arg Ser Phe
20 25 30
Gly Met Ser Trp Val Arg Gln Ala Pro Gly Lys Gly Pro Glu Trp Val
35 40 45
Ser Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Ile Gly Gly Ser Leu Ser Arg Ser Ser Gln Gly Thr Leu Val Thr
100 105 110
Val Ser Ser
115
<210> 3
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR1 (Kabat)
<400> 3
Ser Phe Gly Met Ser
1 5
<210> 4
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR2 (Kabat)
<400> 4
Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 5
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR3 (Kabat/Abm)
<400> 5
Gly Gly Ser Leu Ser Arg
1 5
<210> 6
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR1 (Abm)
<400> 6
Gly Phe Thr Phe Arg Ser Phe Gly Met Ser
1 5 10
<210> 7
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR2 (Abm)
<400> 7
Ser Ile Ser Gly Ser Gly Ser Asp Thr Leu
1 5 10
<210> 8
<211> 6
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR3 (Kabat/Abm)
<400> 8
Gly Gly Ser Leu Ser Arg
1 5
<210> 9
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR1 (Kabat)
<400> 9
Thr Tyr Val Met Gly
1 5
<210> 10
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR2 (Kabat)
<400> 10
Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val Lys
1 5 10 15
Gly
<210> 11
<211> 17
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR2 (Kabat)
<400> 11
Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val Lys
1 5 10 15
Gly
<210> 12
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR1 (Abm)
<400> 12
Gly Gly Thr Phe Ser Thr Tyr Val Met Gly
1 5 10
<210> 13
<211> 10
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR2 (Abm)
<400> 13
Ala Ile Ser Gln Asn Ser Ile His Thr Tyr
1 5 10
<210> 14
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> CDR3 (Kabat/Abm)
<400> 14
Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp Tyr
1 5 10 15
<210> 15
<211> 5
<212> PRT
<213> Artificial Sequence
<220>
<223> C-terminal sequence
<400> 15
Val Thr Val Ser Ser
1 5
<210> 16
<211> 15
<212> PRT
<213> Artificial Sequence
<220>
<223> 15 GS linker
<400> 16
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10 15
<210> 17
<211> 35
<212> PRT
<213> Artificial Sequence
<220>
<223> 35 GS linker
<400> 17
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10 15
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
20 25 30
Gly Gly Ser
35
<210> 18
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 18
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Thr Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Asp Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 19
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 19
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 20
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 20
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 21
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 21
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 22
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 22
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 23
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 23
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 24
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 24
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 25
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 25
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 26
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 26
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 27
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 27
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Thr Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Asp Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 28
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 28
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 29
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 29
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 30
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 30
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 31
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 31
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 32
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 32
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 33
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 33
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 34
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 34
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 35
<211> 125
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 35
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
115 120 125
<210> 36
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 36
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Thr Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Asp Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 37
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 37
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 38
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 38
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 39
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 39
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 40
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 40
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 41
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 41
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 42
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 42
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 43
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 43
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 44
<211> 124
<212> PRT
<213> Artificial Sequence
<220>
<223> ISVD
<400> 44
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
115 120
<210> 45
<211> 118
<212> PRT
<213> Artificial Sequence
<220>
<223> anti-HER2-Nanobody
<400> 45
Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn
20 25 30
Thr Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Arg Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser
115
<210> 46
<211> 278
<212> PRT
<213> Artificial Sequence
<220>
<223> bivalent bispecific compound
<400> 46
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn
20 25 30
Thr Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Arg Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
145 150 155 160
Gly Gly Gly Val Val Gln Pro Gly Asp Ser Leu Arg Leu Ser Cys Ala
165 170 175
Ala Ser Gly Gly Thr Phe Ser Thr Tyr Val Met Gly Trp Phe Arg Gln
180 185 190
Ala Pro Gly Lys Glu Arg Glu Phe Val Ser Ala Ile Ser Gln Asn Ser
195 200 205
Ile His Thr Tyr Tyr Ala Asn Ser Val Lys Gly Arg Phe Thr Ile Ser
210 215 220
Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu Gln Leu Asn Ser Leu Arg
225 230 235 240
Pro Glu Asp Thr Ala Leu Tyr Tyr Cys Ala Ala Ser Arg Phe Thr Ser
245 250 255
Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
260 265 270
Val Thr Val Ser Ser Ala
275
<210> 47
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> bivalent bispecific compound
<400> 47
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn
20 25 30
Thr Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Arg Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val
130 135 140
Val Gln Pro Gly Asp Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly
145 150 155 160
Thr Phe Ser Thr Tyr Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys
165 170 175
Glu Arg Glu Phe Val Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr
180 185 190
Tyr Ala Asn Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser
195 200 205
Lys Asn Thr Val Tyr Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr
210 215 220
Ala Leu Tyr Tyr Cys Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala
225 230 235 240
Asp Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
245 250 255
Ser Ala
<210> 48
<211> 258
<212> PRT
<213> Artificial Sequence
<220>
<223> bivalent bispecific compound
<400> 48
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val
130 135 140
Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser
145 150 155 160
Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn Thr Met Gly Trp Tyr
165 170 175
Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala Leu Ile Ser Ser
180 185 190
Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile
195 200 205
Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu
210 215 220
Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys Arg Phe Arg Thr Ala
225 230 235 240
Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
245 250 255
Ser Ala
<210> 49
<211> 278
<212> PRT
<213> Artificial Sequence
<220>
<223> bivalent bispecific compound
<400> 49
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
145 150 155 160
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ser
165 170 175
Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn Thr
180 185 190
Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
195 200 205
Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys Arg
245 250 255
Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr Leu
260 265 270
Val Thr Val Ser Ser Ala
275
<210> 50
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> trivalent bispecific compound
<400> 50
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn
20 25 30
Thr Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Arg Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
145 150 155 160
Gly Gly Gly Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser Cys Ala
165 170 175
Ala Ser Gly Ile Thr Phe Ser Ile Asn Thr Met Gly Trp Tyr Arg Gln
180 185 190
Ala Pro Gly Lys Gln Arg Glu Leu Val Ala Leu Ile Ser Ser Ile Gly
195 200 205
Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg
210 215 220
Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro
225 230 235 240
Glu Asp Thr Ala Val Tyr Tyr Cys Lys Arg Phe Arg Thr Ala Ala Gln
245 250 255
Gly Thr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
260 265 270
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
275 280 285
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
290 295 300
Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro
305 310 315 320
Gly Asp Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser
325 330 335
Thr Tyr Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu
340 345 350
Phe Val Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn
355 360 365
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr
370 375 380
Val Tyr Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr
385 390 395 400
Tyr Cys Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu
405 410 415
Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
420 425 430
<210> 51
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> trivalent bispecific compound
<400> 51
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn
20 25 30
Thr Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val
35 40 45
Ala Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys
50 55 60
Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu
65 70 75 80
Gln Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys
85 90 95
Arg Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr
100 105 110
Leu Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
115 120 125
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
130 135 140
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser
145 150 155 160
Gly Gly Gly Val Val Gln Pro Gly Asp Ser Leu Arg Leu Ser Cys Ala
165 170 175
Ala Ser Gly Gly Thr Phe Ser Thr Tyr Val Met Gly Trp Phe Arg Gln
180 185 190
Ala Pro Gly Lys Glu Arg Glu Phe Val Ser Ala Ile Ser Gln Asn Ser
195 200 205
Ile His Thr Tyr Tyr Ala Asn Ser Val Lys Gly Arg Phe Thr Ile Ser
210 215 220
Arg Asp Asn Ser Lys Asn Thr Val Tyr Leu Gln Leu Asn Ser Leu Arg
225 230 235 240
Pro Glu Asp Thr Ala Leu Tyr Tyr Cys Ala Ala Ser Arg Phe Thr Ser
245 250 255
Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu
260 265 270
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
275 280 285
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
290 295 300
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
305 310 315 320
Gly Gly Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
325 330 335
Ser Gly Ile Thr Phe Ser Ile Asn Thr Met Gly Trp Tyr Arg Gln Ala
340 345 350
Pro Gly Lys Gln Arg Glu Leu Val Ala Leu Ile Ser Ser Ile Gly Asp
355 360 365
Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
370 375 380
Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
385 390 395 400
Asp Thr Ala Val Tyr Tyr Cys Lys Arg Phe Arg Thr Ala Ala Gln Gly
405 410 415
Thr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
420 425 430
<210> 52
<211> 431
<212> PRT
<213> Artificial Sequence
<220>
<223> trivalent bispecific compound
<400> 52
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Asp
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr Phe Ser Thr Tyr
20 25 30
Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr Ala Asn Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Leu Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp Tyr Glu Tyr Asp
100 105 110
Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
130 135 140
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu
145 150 155 160
Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Ala Gly Gly Ser
165 170 175
Leu Arg Leu Ser Cys Ala Ala Ser Gly Ile Thr Phe Ser Ile Asn Thr
180 185 190
Met Gly Trp Tyr Arg Gln Ala Pro Gly Lys Gln Arg Glu Leu Val Ala
195 200 205
Leu Ile Ser Ser Ile Gly Asp Thr Tyr Tyr Ala Asp Ser Val Lys Gly
210 215 220
Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr Leu Gln
225 230 235 240
Met Asn Ser Leu Lys Pro Glu Asp Thr Ala Val Tyr Tyr Cys Lys Arg
245 250 255
Phe Arg Thr Ala Ala Gln Gly Thr Asp Tyr Trp Gly Gln Gly Thr Leu
260 265 270
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
275 280 285
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
290 295 300
Gly Gly Ser Gly Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly
305 310 315 320
Gly Gly Leu Val Gln Ala Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala
325 330 335
Ser Gly Ile Thr Phe Ser Ile Asn Thr Met Gly Trp Tyr Arg Gln Ala
340 345 350
Pro Gly Lys Gln Arg Glu Leu Val Ala Leu Ile Ser Ser Ile Gly Asp
355 360 365
Thr Tyr Tyr Ala Asp Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp
370 375 380
Asn Ala Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Lys Pro Glu
385 390 395 400
Asp Thr Ala Val Tyr Tyr Cys Lys Arg Phe Arg Thr Ala Ala Gln Gly
405 410 415
Thr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
420 425 430
<210> 53
<211> 448
<212> PRT
<213> Artificial Sequence
<220>
<223> trivalent construct
<400> 53
Asp Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser Ser Tyr
20 25 30
Ala Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu Phe Val
35 40 45
Ala Ala Ile Ser Trp Ser Asp Gly Ser Thr Tyr Tyr Ala Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Val Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr Tyr Cys
85 90 95
Ala Ala Asp Leu Thr Ser Thr Asn Pro Gly Ser Tyr Ile Tyr Ile Trp
100 105 110
Ala Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Gly
115 120 125
Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly
130 135 140
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly
145 150 155 160
Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val Gln Pro
165 170 175
Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Arg Thr Phe Ser
180 185 190
Ser Tyr Ala Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu Arg Glu
195 200 205
Phe Val Ala Ala Ile Ser Trp Ser Asp Gly Ser Thr Tyr Tyr Ala Asp
210 215 220
Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr
225 230 235 240
Val Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala Leu Tyr
245 250 255
Tyr Cys Ala Ala Asp Leu Thr Ser Thr Asn Pro Gly Ser Tyr Ile Tyr
260 265 270
Ile Trp Ala Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser
275 280 285
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
290 295 300
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
305 310 315 320
Gly Gly Gly Ser Glu Val Gln Leu Val Glu Ser Gly Gly Gly Val Val
325 330 335
Gln Pro Gly Gly Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Gly Thr
340 345 350
Phe Ser Thr Tyr Val Met Gly Trp Phe Arg Gln Ala Pro Gly Lys Glu
355 360 365
Arg Glu Phe Val Ser Ala Ile Ser Gln Asn Ser Ile His Thr Tyr Tyr
370 375 380
Ala Asn Ser Val Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
385 390 395 400
Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Pro Glu Asp Thr Ala
405 410 415
Leu Tyr Tyr Cys Ala Ala Ser Arg Phe Thr Ser Trp Tyr Thr Ala Asp
420 425 430
Tyr Glu Tyr Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser
435 440 445
<210> 54
<211> 609
<212> PRT
<213> Homo sapiens
<400> 54
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Asp Ala His Lys Ser Glu Val Ala
20 25 30
His Arg Phe Lys Asp Leu Gly Glu Glu Asn Phe Lys Ala Leu Val Leu
35 40 45
Ile Ala Phe Ala Gln Tyr Leu Gln Gln Cys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys Thr Cys Val Ala Asp
65 70 75 80
Glu Ser Ala Glu Asn Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Thr Val Ala Thr Leu Arg Glu Thr Tyr Gly Glu Met Ala
100 105 110
Asp Cys Cys Ala Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Gln
115 120 125
His Lys Asp Asp Asn Pro Asn Leu Pro Arg Leu Val Arg Pro Glu Val
130 135 140
Asp Val Met Cys Thr Ala Phe His Asp Asn Glu Glu Thr Phe Leu Lys
145 150 155 160
Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Phe Phe Ala Lys Arg Tyr Lys Ala Ala Phe Thr Glu Cys
180 185 190
Cys Gln Ala Ala Asp Lys Ala Ala Cys Leu Leu Pro Lys Leu Asp Glu
195 200 205
Leu Arg Asp Glu Gly Lys Ala Ser Ser Ala Lys Gln Arg Leu Lys Cys
210 215 220
Ala Ser Leu Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala Trp Ala Val
225 230 235 240
Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Glu Phe Ala Glu Val Ser
245 250 255
Lys Leu Val Thr Asp Leu Thr Lys Val His Thr Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile
275 280 285
Cys Glu Asn Gln Asp Ser Ile Ser Ser Lys Leu Lys Glu Cys Cys Glu
290 295 300
Lys Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Val Glu Asn Asp
305 310 315 320
Glu Met Pro Ala Asp Leu Pro Ser Leu Ala Ala Asp Phe Val Glu Ser
325 330 335
Lys Asp Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Met Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Asp Tyr Ser Val Val
355 360 365
Leu Leu Leu Arg Leu Ala Lys Thr Tyr Glu Thr Thr Leu Glu Lys Cys
370 375 380
Cys Ala Ala Ala Asp Pro His Glu Cys Tyr Ala Lys Val Phe Asp Glu
385 390 395 400
Phe Lys Pro Leu Val Glu Glu Pro Gln Asn Leu Ile Lys Gln Asn Cys
405 410 415
Glu Leu Phe Glu Gln Leu Gly Glu Tyr Lys Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Val Ser Arg Asn Leu Gly Lys Val Gly Ser Lys Cys Cys Lys His
450 455 460
Pro Glu Ala Lys Arg Met Pro Cys Ala Glu Asp Tyr Leu Ser Val Val
465 470 475 480
Leu Asn Gln Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Asp Arg
485 490 495
Val Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe
500 505 510
Ser Ala Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala
515 520 525
Glu Thr Phe Thr Phe His Ala Asp Ile Cys Thr Leu Ser Glu Lys Glu
530 535 540
Arg Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Val Lys His Lys
545 550 555 560
Pro Lys Ala Thr Lys Glu Gln Leu Lys Ala Val Met Asp Asp Phe Ala
565 570 575
Ala Phe Val Glu Lys Cys Cys Lys Ala Asp Asp Lys Glu Thr Cys Phe
580 585 590
Ala Glu Glu Gly Lys Lys Leu Val Ala Ala Ser Gln Ala Ala Leu Gly
595 600 605
Leu
<210> 55
<211> 607
<212> PRT
<213> Mus musculus
<400> 55
Met Lys Trp Val Thr Phe Leu Leu Leu Leu Phe Val Ser Gly Ser Ala
1 5 10 15
Phe Ser Arg Gly Phe Arg Arg Glu Ala His Lys Ser Glu Ile Ala His
20 25 30
Arg Tyr Asn Asp Leu Gly Glu Gln His Phe Lys Gly Leu Val Leu Ile
35 40 45
Ala Phe Ser Gln Tyr Leu Gln Lys Cys Ser Tyr Asp Glu His Ala Lys
50 55 60
Leu Val Gln Glu Val Thr Asp Phe Ala Lys Thr Cys Val Ala Asp Glu
65 70 75 80
Ser Ala Ala Asn Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp Lys
85 90 95
Leu Cys Ala Ile Pro Asn Leu Arg Glu Asn Tyr Gly Glu Leu Ala Asp
100 105 110
Cys Cys Thr Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Gln His
115 120 125
Lys Asp Asp Asn Pro Ser Leu Pro Pro Phe Glu Arg Pro Glu Ala Glu
130 135 140
Ala Met Cys Thr Ser Phe Lys Glu Asn Pro Thr Thr Phe Met Gly His
145 150 155 160
Tyr Leu His Glu Val Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro Glu
165 170 175
Leu Leu Tyr Tyr Ala Glu Gln Tyr Asn Glu Ile Leu Thr Gln Cys Cys
180 185 190
Ala Glu Ala Asp Lys Glu Ser Cys Leu Thr Pro Lys Leu Asp Gly Val
195 200 205
Lys Glu Lys Ala Leu Val Ser Ser Val Arg Gln Arg Met Lys Cys Ser
210 215 220
Ser Met Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala Trp Ala Val Ala
225 230 235 240
Arg Leu Ser Gln Thr Phe Pro Asn Ala Asp Phe Ala Glu Ile Thr Lys
245 250 255
Leu Ala Thr Asp Leu Thr Lys Val Asn Lys Glu Cys Cys His Gly Asp
260 265 270
Leu Leu Glu Cys Ala Asp Asp Arg Ala Glu Leu Ala Lys Tyr Met Cys
275 280 285
Glu Asn Gln Ala Thr Ile Ser Ser Lys Leu Gln Thr Cys Cys Asp Lys
290 295 300
Pro Leu Leu Lys Lys Ala His Cys Leu Ser Glu Val Glu His Asp Thr
305 310 315 320
Met Pro Ala Asp Leu Pro Ala Ile Ala Ala Asp Phe Val Glu Asp Gln
325 330 335
Glu Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val Phe Leu Gly Thr
340 345 350
Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Asp Tyr Ser Val Ser Leu
355 360 365
Leu Leu Arg Leu Ala Lys Lys Tyr Glu Ala Thr Leu Glu Lys Cys Cys
370 375 380
Ala Glu Ala Asn Pro Pro Ala Cys Tyr Gly Thr Val Leu Ala Glu Phe
385 390 395 400
Gln Pro Leu Val Glu Glu Pro Lys Asn Leu Val Lys Thr Asn Cys Asp
405 410 415
Leu Tyr Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Ile Leu Val
420 425 430
Arg Tyr Thr Gln Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val Glu
435 440 445
Ala Ala Arg Asn Leu Gly Arg Val Gly Thr Lys Cys Cys Thr Leu Pro
450 455 460
Glu Asp Gln Arg Leu Pro Cys Val Glu Asp Tyr Leu Ser Ala Ile Leu
465 470 475 480
Asn Arg Val Cys Leu Leu His Glu Lys Thr Pro Val Ser Glu His Val
485 490 495
Thr Lys Cys Cys Ser Gly Ser Leu Val Glu Arg Arg Pro Cys Phe Ser
500 505 510
Ala Leu Thr Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Lys Ala Glu
515 520 525
Thr Phe Thr Phe His Ser Asp Ile Cys Thr Leu Pro Glu Lys Glu Lys
530 535 540
Gln Ile Lys Lys Gln Thr Ala Leu Ala Glu Leu Val Lys His Lys Pro
545 550 555 560
Lys Ala Thr Ala Glu Gln Leu Lys Thr Val Met Asp Asp Phe Ala Gln
565 570 575
Phe Leu Asp Thr Cys Cys Lys Ala Ala Asp Lys Asp Thr Cys Phe Ser
580 585 590
Thr Glu Gly Pro Asn Leu Val Thr Arg Cys Lys Asp Ala Leu Ala
595 600 605
<210> 56
<211> 608
<212> PRT
<213> Rattus norvegicus
<400> 56
Met Lys Trp Val Thr Phe Leu Leu Leu Leu Phe Ile Ser Gly Ser Ala
1 5 10 15
Phe Ser Arg Gly Val Phe Arg Arg Glu Ala His Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Lys Asp Leu Gly Glu Gln His Phe Lys Gly Leu Val Leu
35 40 45
Ile Ala Phe Ser Gln Tyr Leu Gln Lys Cys Pro Tyr Glu Glu His Ile
50 55 60
Lys Leu Val Gln Glu Val Thr Asp Phe Ala Lys Thr Cys Val Ala Asp
65 70 75 80
Glu Asn Ala Glu Asn Cys Asp Lys Ser Ile His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Ala Ile Pro Lys Leu Arg Asp Asn Tyr Gly Glu Leu Ala
100 105 110
Asp Cys Cys Ala Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Gln
115 120 125
His Lys Asp Asp Asn Pro Asn Leu Pro Pro Phe Gln Arg Pro Glu Ala
130 135 140
Glu Ala Met Cys Thr Ser Phe Gln Glu Asn Pro Thr Ser Phe Leu Gly
145 150 155 160
His Tyr Leu His Glu Val Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Tyr Tyr Ala Glu Lys Tyr Asn Glu Val Leu Thr Gln Cys
180 185 190
Cys Thr Glu Ser Asp Lys Ala Ala Cys Leu Thr Pro Lys Leu Asp Ala
195 200 205
Val Lys Glu Lys Ala Leu Val Ala Ala Val Arg Gln Arg Met Lys Cys
210 215 220
Ser Ser Met Gln Arg Phe Gly Glu Arg Ala Phe Lys Ala Trp Ala Val
225 230 235 240
Ala Arg Met Ser Gln Arg Phe Pro Asn Ala Glu Phe Ala Glu Ile Thr
245 250 255
Lys Leu Ala Thr Asp Leu Thr Lys Ile Asn Lys Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Glu Leu Ala Lys Tyr Met
275 280 285
Cys Glu Asn Gln Ala Thr Ile Ser Ser Lys Leu Gln Ala Cys Cys Asp
290 295 300
Lys Pro Val Leu Gln Lys Ser Gln Cys Leu Ala Glu Ile Glu His Asp
305 310 315 320
Asn Ile Pro Ala Asp Leu Pro Ser Ile Ala Ala Asp Phe Val Glu Asp
325 330 335
Lys Glu Val Cys Lys Asn Tyr Ala Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Thr Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Asp Tyr Ser Val Ser
355 360 365
Leu Leu Leu Arg Leu Ala Lys Lys Tyr Glu Ala Thr Leu Glu Lys Cys
370 375 380
Cys Ala Glu Gly Asp Pro Pro Ala Cys Tyr Gly Thr Val Leu Ala Glu
385 390 395 400
Phe Gln Pro Leu Val Glu Glu Pro Lys Asn Leu Val Lys Thr Asn Cys
405 410 415
Glu Leu Tyr Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Ile Leu
420 425 430
Val Arg Tyr Thr Gln Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Ala Ala Arg Asn Leu Gly Arg Val Gly Thr Lys Cys Cys Thr Leu
450 455 460
Pro Glu Ala Gln Arg Leu Pro Cys Val Glu Asp Tyr Leu Ser Ala Ile
465 470 475 480
Leu Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys
485 490 495
Val Thr Lys Cys Cys Ser Gly Ser Leu Val Glu Arg Arg Pro Cys Phe
500 505 510
Ser Ala Leu Thr Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Lys Ala
515 520 525
Glu Thr Phe Thr Phe His Ser Asp Ile Cys Thr Leu Pro Asp Lys Glu
530 535 540
Lys Gln Ile Lys Lys Gln Thr Ala Leu Ala Glu Leu Val Lys His Lys
545 550 555 560
Pro Lys Ala Thr Glu Asp Gln Leu Lys Thr Val Met Gly Asp Phe Ala
565 570 575
Gln Phe Val Asp Lys Cys Cys Lys Ala Ala Asp Lys Asp Asn Cys Phe
580 585 590
Ala Thr Glu Gly Pro Asn Leu Val Ala Arg Ser Lys Glu Ala Leu Ala
595 600 605
<210> 57
<211> 607
<212> PRT
<213> Bos taurus
<400> 57
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Leu Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Asp Thr His Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Lys Asp Leu Gly Glu Glu His Phe Lys Gly Leu Val Leu
35 40 45
Ile Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Asp Glu His Val
50 55 60
Lys Leu Val Asn Glu Leu Thr Glu Phe Ala Lys Thr Cys Val Ala Asp
65 70 75 80
Glu Ser His Ala Gly Cys Glu Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Glu Leu Cys Lys Val Ala Ser Leu Arg Glu Thr Tyr Gly Asp Met Ala
100 105 110
Asp Cys Cys Glu Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Ser
115 120 125
His Lys Asp Asp Ser Pro Asp Leu Pro Lys Leu Lys Pro Asp Pro Asn
130 135 140
Thr Leu Cys Asp Glu Phe Lys Ala Asp Glu Lys Lys Phe Trp Gly Lys
145 150 155 160
Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro Glu
165 170 175
Leu Leu Tyr Tyr Ala Asn Lys Tyr Asn Gly Val Phe Gln Glu Cys Cys
180 185 190
Gln Ala Glu Asp Lys Gly Ala Cys Leu Leu Pro Lys Ile Glu Thr Met
195 200 205
Arg Glu Lys Val Leu Thr Ser Ser Ala Arg Gln Arg Leu Arg Cys Ala
210 215 220
Ser Ile Gln Lys Phe Gly Glu Arg Ala Leu Lys Ala Trp Ser Val Ala
225 230 235 240
Arg Leu Ser Gln Lys Phe Pro Lys Ala Glu Phe Val Glu Val Thr Lys
245 250 255
Leu Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly Asp
260 265 270
Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile Cys
275 280 285
Asp Asn Gln Asp Thr Ile Ser Ser Lys Leu Lys Glu Cys Cys Asp Lys
290 295 300
Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Val Glu Lys Asp Ala
305 310 315 320
Ile Pro Glu Asn Leu Pro Pro Leu Thr Ala Asp Phe Ala Glu Asp Lys
325 330 335
Asp Val Cys Lys Asn Tyr Gln Glu Ala Lys Asp Ala Phe Leu Gly Ser
340 345 350
Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Glu Tyr Ala Val Ser Val
355 360 365
Leu Leu Arg Leu Ala Lys Glu Tyr Glu Ala Thr Leu Glu Glu Cys Cys
370 375 380
Ala Lys Asp Asp Pro His Ala Cys Tyr Ser Thr Val Phe Asp Lys Leu
385 390 395 400
Lys His Leu Val Asp Glu Pro Gln Asn Leu Ile Lys Gln Asn Cys Asp
405 410 415
Gln Phe Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Leu Ile Val
420 425 430
Arg Tyr Thr Arg Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val Glu
435 440 445
Val Ser Arg Ser Leu Gly Lys Val Gly Thr Arg Cys Cys Thr Lys Pro
450 455 460
Glu Ser Glu Arg Met Pro Cys Thr Glu Asp Tyr Leu Ser Leu Ile Leu
465 470 475 480
Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys Val
485 490 495
Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe Ser
500 505 510
Ala Leu Thr Pro Asp Glu Thr Tyr Val Pro Lys Ala Phe Asp Glu Lys
515 520 525
Leu Phe Thr Phe His Ala Asp Ile Cys Thr Leu Pro Asp Thr Glu Lys
530 535 540
Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Leu Lys His Lys Pro
545 550 555 560
Lys Ala Thr Glu Glu Gln Leu Lys Thr Val Met Glu Asn Phe Val Ala
565 570 575
Phe Val Asp Lys Cys Cys Ala Ala Asp Asp Lys Glu Ala Cys Phe Ala
580 585 590
Val Glu Gly Pro Lys Leu Val Val Ser Thr Gln Thr Ala Leu Ala
595 600 605
<210> 58
<211> 607
<212> PRT
<213> Sus scrofa
<400> 58
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Asp Thr Tyr Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Lys Asp Leu Gly Glu Gln Tyr Phe Lys Gly Leu Val Leu
35 40 45
Ile Ala Phe Ser Gln His Leu Gln Gln Cys Pro Tyr Glu Glu His Val
50 55 60
Lys Leu Val Arg Glu Val Thr Glu Phe Ala Lys Thr Cys Val Ala Asp
65 70 75 80
Glu Ser Ala Glu Asn Cys Asp Lys Ser Ile His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Ala Ile Pro Ser Leu Arg Glu His Tyr Gly Asp Leu Ala
100 105 110
Asp Cys Cys Glu Lys Glu Glu Pro Glu Arg Asn Glu Cys Phe Leu Gln
115 120 125
His Lys Asn Asp Asn Pro Asp Ile Pro Lys Leu Lys Pro Asp Pro Val
130 135 140
Ala Leu Cys Ala Asp Phe Gln Glu Asp Glu Gln Lys Phe Trp Gly Lys
145 150 155 160
Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro Glu
165 170 175
Leu Leu Tyr Tyr Ala Ile Ile Tyr Lys Asp Val Phe Ser Glu Cys Cys
180 185 190
Gln Ala Ala Asp Lys Ala Ala Cys Leu Leu Pro Lys Ile Glu His Leu
195 200 205
Arg Glu Lys Val Leu Thr Ser Ala Ala Lys Gln Arg Leu Lys Cys Ala
210 215 220
Ser Ile Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala Trp Ser Leu Ala
225 230 235 240
Arg Leu Ser Gln Arg Phe Pro Lys Ala Asp Phe Thr Glu Ile Ser Lys
245 250 255
Ile Val Thr Asp Leu Ala Lys Val His Lys Glu Cys Cys His Gly Asp
260 265 270
Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile Cys
275 280 285
Glu Asn Gln Asp Thr Ile Ser Thr Lys Leu Lys Glu Cys Cys Asp Lys
290 295 300
Pro Leu Leu Glu Lys Ser His Cys Ile Ala Glu Ala Lys Arg Asp Glu
305 310 315 320
Leu Pro Ala Asp Leu Asn Pro Leu Glu His Asp Phe Val Glu Asp Lys
325 330 335
Glu Val Cys Lys Asn Tyr Lys Glu Ala Lys His Val Phe Leu Gly Thr
340 345 350
Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Asp Tyr Ser Val Ser Leu
355 360 365
Leu Leu Arg Ile Ala Lys Ile Tyr Glu Ala Thr Leu Glu Asp Cys Cys
370 375 380
Ala Lys Glu Asp Pro Pro Ala Cys Tyr Ala Thr Val Phe Asp Lys Phe
385 390 395 400
Gln Pro Leu Val Asp Glu Pro Lys Asn Leu Ile Lys Gln Asn Cys Glu
405 410 415
Leu Phe Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Leu Ile Val
420 425 430
Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val Glu
435 440 445
Val Ala Arg Lys Leu Gly Leu Val Gly Ser Arg Cys Cys Lys Arg Pro
450 455 460
Glu Glu Glu Arg Leu Ser Cys Ala Glu Asp Tyr Leu Ser Leu Val Leu
465 470 475 480
Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys Val
485 490 495
Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe Ser
500 505 510
Ala Leu Thr Pro Asp Glu Thr Tyr Lys Pro Lys Glu Phe Val Glu Gly
515 520 525
Thr Phe Thr Phe His Ala Asp Leu Cys Thr Leu Pro Glu Asp Glu Lys
530 535 540
Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Leu Lys His Lys Pro
545 550 555 560
His Ala Thr Glu Glu Gln Leu Arg Thr Val Leu Gly Asn Phe Ala Ala
565 570 575
Phe Val Gln Lys Cys Cys Ala Ala Pro Asp His Glu Ala Cys Phe Ala
580 585 590
Val Glu Gly Pro Lys Phe Val Ile Glu Ile Arg Gly Ile Leu Ala
595 600 605
<210> 59
<211> 608
<212> PRT
<213> Canis lupus
<400> 59
Met Lys Trp Val Thr Phe Ile Ser Leu Phe Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Leu Val Arg Arg Glu Ala Tyr Lys Ser Glu Ile Ala
20 25 30
His Arg Tyr Asn Asp Leu Gly Glu Glu His Phe Arg Gly Leu Val Leu
35 40 45
Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Ala Lys Glu Val Thr Glu Phe Ala Lys Ala Cys Ala Ala Glu
65 70 75 80
Glu Ser Gly Ala Asn Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr Gly Asp Met Ala
100 105 110
Asp Cys Cys Glu Lys Gln Glu Pro Asp Arg Asn Glu Cys Phe Leu Ala
115 120 125
His Lys Asp Asp Asn Pro Gly Phe Pro Pro Leu Val Ala Pro Glu Pro
130 135 140
Asp Ala Leu Cys Ala Ala Phe Gln Asp Asn Glu Gln Leu Phe Leu Gly
145 150 155 160
Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Tyr Tyr Ala Gln Gln Tyr Lys Gly Val Phe Ala Glu Cys
180 185 190
Cys Gln Ala Ala Asp Lys Ala Ala Cys Leu Gly Pro Lys Ile Glu Ala
195 200 205
Leu Arg Glu Lys Val Leu Leu Ser Ser Ala Lys Glu Arg Phe Lys Cys
210 215 220
Ala Ser Leu Gln Lys Phe Gly Asp Arg Ala Phe Lys Ala Trp Ser Val
225 230 235 240
Ala Arg Leu Ser Gln Arg Phe Pro Lys Ala Asp Phe Ala Glu Ile Ser
245 250 255
Lys Val Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Met
275 280 285
Cys Glu Asn Gln Asp Ser Ile Ser Thr Lys Leu Lys Glu Cys Cys Asp
290 295 300
Lys Pro Val Leu Glu Lys Ser Gln Cys Leu Ala Glu Val Glu Arg Asp
305 310 315 320
Glu Leu Pro Gly Asp Leu Pro Ser Leu Ala Ala Asp Phe Val Glu Asp
325 330 335
Lys Glu Val Cys Lys Asn Tyr Gln Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Thr Phe Leu Tyr Glu Tyr Ala Arg Arg His Pro Glu Tyr Ser Val Ser
355 360 365
Leu Leu Leu Arg Leu Ala Lys Glu Tyr Glu Ala Thr Leu Glu Lys Cys
370 375 380
Cys Ala Thr Asp Asp Pro Pro Thr Cys Tyr Ala Lys Val Leu Asp Glu
385 390 395 400
Phe Lys Pro Leu Val Asp Glu Pro Gln Asn Leu Val Lys Thr Asn Cys
405 410 415
Glu Leu Phe Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Val Ser Arg Lys Leu Gly Lys Val Gly Thr Lys Cys Cys Lys Lys
450 455 460
Pro Glu Ser Glu Arg Met Ser Cys Ala Glu Asp Phe Leu Ser Val Val
465 470 475 480
Leu Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Arg
485 490 495
Val Thr Lys Cys Cys Ser Glu Ser Leu Val Asn Arg Arg Pro Cys Phe
500 505 510
Ser Gly Leu Glu Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala
515 520 525
Glu Thr Phe Thr Phe His Ala Asp Leu Cys Thr Leu Pro Glu Ala Glu
530 535 540
Lys Gln Val Lys Lys Gln Thr Ala Leu Val Glu Leu Leu Lys His Lys
545 550 555 560
Pro Lys Ala Thr Asp Glu Gln Leu Lys Thr Val Met Gly Asp Phe Gly
565 570 575
Ala Phe Val Glu Lys Cys Cys Ala Ala Glu Asn Lys Glu Gly Cys Phe
580 585 590
Ser Glu Glu Gly Pro Lys Leu Val Ala Ala Ala Gln Ala Ala Leu Val
595 600 605
<210> 60
<211> 608
<212> PRT
<213> Felis catus
<400> 60
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Leu Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Thr Arg Arg Glu Ala His Gln Ser Glu Ile Ala
20 25 30
His Arg Phe Asn Asp Leu Gly Glu Glu His Phe Arg Gly Leu Val Leu
35 40 45
Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys Gly Cys Val Ala Asp
65 70 75 80
Gln Ser Ala Ala Asn Cys Glu Lys Ser Leu His Glu Leu Leu Gly Asp
85 90 95
Lys Leu Cys Thr Val Ala Ser Leu Arg Asp Lys Tyr Gly Glu Met Ala
100 105 110
Asp Cys Cys Glu Lys Lys Glu Pro Glu Arg Asn Glu Cys Phe Leu Gln
115 120 125
His Lys Asp Asp Asn Pro Gly Phe Gly Gln Leu Val Thr Pro Glu Ala
130 135 140
Asp Ala Met Cys Thr Ala Phe His Glu Asn Glu Gln Arg Phe Leu Gly
145 150 155 160
Lys Tyr Leu Tyr Glu Ile Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Tyr Tyr Ala Glu Glu Tyr Lys Gly Val Phe Thr Glu Cys
180 185 190
Cys Glu Ala Ala Asp Lys Ala Ala Cys Leu Thr Pro Lys Val Asp Ala
195 200 205
Leu Arg Glu Lys Val Leu Ala Ser Ser Ala Lys Glu Arg Leu Lys Cys
210 215 220
Ala Ser Leu Gln Lys Phe Gly Glu Arg Ala Phe Lys Ala Trp Ser Val
225 230 235 240
Ala Arg Leu Ser Gln Lys Phe Pro Lys Ala Glu Phe Ala Glu Ile Ser
245 250 255
Lys Leu Val Thr Asp Leu Ala Lys Ile His Lys Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile
275 280 285
Cys Glu Asn Gln Asp Ser Ile Ser Thr Lys Leu Lys Glu Cys Cys Gly
290 295 300
Lys Pro Val Leu Glu Lys Ser His Cys Ile Ser Glu Val Glu Arg Asp
305 310 315 320
Glu Leu Pro Ala Asp Leu Pro Pro Leu Ala Val Asp Phe Val Glu Asp
325 330 335
Lys Glu Val Cys Lys Asn Tyr Gln Glu Ala Lys Asp Val Phe Leu Gly
340 345 350
Thr Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Glu Tyr Ser Val Ser
355 360 365
Leu Leu Leu Arg Leu Ala Lys Glu Tyr Glu Ala Thr Leu Glu Lys Cys
370 375 380
Cys Ala Thr Asp Asp Pro Pro Ala Cys Tyr Ala His Val Phe Asp Glu
385 390 395 400
Phe Lys Pro Leu Val Glu Glu Pro His Asn Leu Val Lys Thr Asn Cys
405 410 415
Glu Leu Phe Glu Lys Leu Gly Glu Tyr Gly Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Val Ser Arg Ser Leu Gly Lys Val Gly Ser Lys Cys Cys Thr His
450 455 460
Pro Glu Ala Glu Arg Leu Ser Cys Ala Glu Asp Tyr Leu Ser Val Val
465 470 475 480
Leu Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Arg
485 490 495
Val Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe
500 505 510
Ser Ala Leu Gln Val Asp Glu Thr Tyr Val Pro Lys Glu Phe Ser Ala
515 520 525
Glu Thr Phe Thr Phe His Ala Asp Leu Cys Thr Leu Pro Glu Ala Glu
530 535 540
Lys Gln Ile Lys Lys Gln Ser Ala Leu Val Glu Leu Leu Lys His Lys
545 550 555 560
Pro Lys Ala Thr Glu Glu Gln Leu Lys Thr Val Met Gly Asp Phe Gly
565 570 575
Ser Phe Val Asp Lys Cys Cys Ala Ala Glu Asp Lys Glu Ala Cys Phe
580 585 590
Ala Glu Glu Gly Pro Lys Leu Val Ala Ala Ala Gln Ala Ala Leu Ala
595 600 605
<210> 61
<211> 607
<212> PRT
<213> Ovis aries
<400> 61
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Leu Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Asp Thr His Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Asn Asp Leu Gly Glu Glu Asn Phe Gln Gly Leu Val Leu
35 40 45
Ile Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Asp Glu His Val
50 55 60
Lys Leu Val Lys Glu Leu Thr Glu Phe Ala Lys Thr Cys Val Ala Asp
65 70 75 80
Glu Ser His Ala Gly Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Glu Leu Cys Lys Val Ala Thr Leu Arg Glu Thr Tyr Gly Asp Met Ala
100 105 110
Asp Cys Cys Glu Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Asn
115 120 125
His Lys Asp Asp Ser Pro Asp Leu Pro Lys Leu Lys Pro Glu Pro Asp
130 135 140
Thr Leu Cys Ala Glu Phe Lys Ala Asp Glu Lys Lys Phe Trp Gly Lys
145 150 155 160
Tyr Leu Tyr Glu Val Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro Glu
165 170 175
Leu Leu Tyr Tyr Ala Asn Lys Tyr Asn Gly Val Phe Gln Glu Cys Cys
180 185 190
Gln Ala Glu Asp Lys Gly Ala Cys Leu Leu Pro Lys Ile Asp Ala Met
195 200 205
Arg Glu Lys Val Leu Ala Ser Ser Ala Arg Gln Arg Leu Arg Cys Ala
210 215 220
Ser Ile Gln Lys Phe Gly Glu Arg Ala Leu Lys Ala Trp Ser Val Ala
225 230 235 240
Arg Leu Ser Gln Lys Phe Pro Lys Ala Asp Phe Thr Asp Val Thr Lys
245 250 255
Ile Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly Asp
260 265 270
Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile Cys
275 280 285
Asp His Gln Asp Ala Leu Ser Ser Lys Leu Lys Glu Cys Cys Asp Lys
290 295 300
Pro Val Leu Glu Lys Ser His Cys Ile Ala Glu Val Asp Lys Asp Ala
305 310 315 320
Val Pro Glu Asn Leu Pro Pro Leu Thr Ala Asp Phe Ala Glu Asp Lys
325 330 335
Glu Val Cys Lys Asn Tyr Gln Glu Ala Lys Asp Val Phe Leu Gly Ser
340 345 350
Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Glu Tyr Ala Val Ser Val
355 360 365
Leu Leu Arg Leu Ala Lys Glu Tyr Glu Ala Thr Leu Glu Asp Cys Cys
370 375 380
Ala Lys Glu Asp Pro His Ala Cys Tyr Ala Thr Val Phe Asp Lys Leu
385 390 395 400
Lys His Leu Val Asp Glu Pro Gln Asn Leu Ile Lys Lys Asn Cys Glu
405 410 415
Leu Phe Glu Lys His Gly Glu Tyr Gly Phe Gln Asn Ala Leu Ile Val
420 425 430
Arg Tyr Thr Arg Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val Glu
435 440 445
Ile Ser Arg Ser Leu Gly Lys Val Gly Thr Lys Cys Cys Ala Lys Pro
450 455 460
Glu Ser Glu Arg Met Pro Cys Thr Glu Asp Tyr Leu Ser Leu Ile Leu
465 470 475 480
Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys Val
485 490 495
Thr Lys Cys Cys Thr Glu Ser Leu Val Asn Arg Arg Pro Cys Phe Ser
500 505 510
Asp Leu Thr Leu Asp Glu Thr Tyr Val Pro Lys Pro Phe Asp Glu Lys
515 520 525
Phe Phe Thr Phe His Ala Asp Ile Cys Thr Leu Pro Asp Thr Glu Lys
530 535 540
Gln Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Leu Lys His Lys Pro
545 550 555 560
Lys Ala Thr Asp Glu Gln Leu Lys Thr Val Met Glu Asn Phe Val Ala
565 570 575
Phe Val Asp Lys Cys Cys Ala Ala Asp Asp Lys Glu Gly Cys Phe Val
580 585 590
Leu Glu Gly Pro Lys Leu Val Ala Ser Thr Gln Ala Ala Leu Ala
595 600 605
<210> 62
<211> 607
<212> PRT
<213> Equus caballus
<400> 62
Met Lys Trp Val Thr Phe Val Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Leu Arg Arg Asp Thr His Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Asn Asp Leu Gly Glu Lys His Phe Lys Gly Leu Val Leu
35 40 45
Val Ala Phe Ser Gln Tyr Leu Gln Gln Cys Pro Phe Glu Asp His Val
50 55 60
Lys Leu Val Asn Glu Val Thr Glu Phe Ala Lys Lys Cys Ala Ala Asp
65 70 75 80
Glu Ser Ala Glu Asn Cys Asp Lys Ser Leu His Thr Leu Phe Gly Asp
85 90 95
Lys Leu Cys Thr Val Ala Thr Leu Arg Ala Thr Tyr Gly Glu Leu Ala
100 105 110
Asp Cys Cys Glu Lys Gln Glu Pro Glu Arg Asn Glu Cys Phe Leu Thr
115 120 125
His Lys Asp Asp His Pro Asn Leu Pro Lys Leu Lys Pro Glu Pro Asp
130 135 140
Ala Gln Cys Ala Ala Phe Gln Glu Asp Pro Asp Lys Phe Leu Gly Lys
145 150 155 160
Tyr Leu Tyr Glu Val Ala Arg Arg His Pro Tyr Phe Tyr Gly Pro Glu
165 170 175
Leu Leu Phe His Ala Glu Glu Tyr Lys Ala Asp Phe Thr Glu Cys Cys
180 185 190
Pro Ala Asp Asp Lys Leu Ala Cys Leu Ile Pro Lys Leu Asp Ala Leu
195 200 205
Lys Glu Arg Ile Leu Leu Ser Ser Ala Lys Glu Arg Leu Lys Cys Ser
210 215 220
Ser Phe Gln Asn Phe Gly Glu Arg Ala Val Lys Ala Trp Ser Val Ala
225 230 235 240
Arg Leu Ser Gln Lys Phe Pro Lys Ala Asp Phe Ala Glu Val Ser Lys
245 250 255
Ile Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly Asp
260 265 270
Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Ile Cys
275 280 285
Glu His Gln Asp Ser Ile Ser Gly Lys Leu Lys Ala Cys Cys Asp Lys
290 295 300
Pro Leu Leu Gln Lys Ser His Cys Ile Ala Glu Val Lys Glu Asp Asp
305 310 315 320
Leu Pro Ser Asp Leu Pro Ala Leu Ala Ala Asp Phe Ala Glu Asp Lys
325 330 335
Glu Ile Cys Lys His Tyr Lys Asp Ala Lys Asp Val Phe Leu Gly Thr
340 345 350
Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Asp Tyr Ser Val Ser Leu
355 360 365
Leu Leu Arg Ile Ala Lys Thr Tyr Glu Ala Thr Leu Glu Lys Cys Cys
370 375 380
Ala Glu Ala Asp Pro Pro Ala Cys Tyr Arg Thr Val Phe Asp Gln Phe
385 390 395 400
Thr Pro Leu Val Glu Glu Pro Lys Ser Leu Val Lys Lys Asn Cys Asp
405 410 415
Leu Phe Glu Glu Val Gly Glu Tyr Asp Phe Gln Asn Ala Leu Ile Val
420 425 430
Arg Tyr Thr Lys Lys Ala Pro Gln Val Ser Thr Pro Thr Leu Val Glu
435 440 445
Ile Gly Arg Thr Leu Gly Lys Val Gly Ser Arg Cys Cys Lys Leu Pro
450 455 460
Glu Ser Glu Arg Leu Pro Cys Ser Glu Asn His Leu Ala Leu Ala Leu
465 470 475 480
Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys Ile
485 490 495
Thr Lys Cys Cys Thr Asp Ser Leu Ala Glu Arg Arg Pro Cys Phe Ser
500 505 510
Ala Leu Glu Leu Asp Glu Gly Tyr Val Pro Lys Glu Phe Lys Ala Glu
515 520 525
Thr Phe Thr Phe His Ala Asp Ile Cys Thr Leu Pro Glu Asp Glu Lys
530 535 540
Gln Ile Lys Lys Gln Ser Ala Leu Ala Glu Leu Val Lys His Lys Pro
545 550 555 560
Lys Ala Thr Lys Glu Gln Leu Lys Thr Val Leu Gly Asn Phe Ser Ala
565 570 575
Phe Val Ala Lys Cys Cys Gly Arg Glu Asp Lys Glu Ala Cys Phe Ala
580 585 590
Glu Glu Gly Pro Lys Leu Val Ala Ser Ser Gln Leu Ala Leu Ala
595 600 605
<210> 63
<211> 608
<212> PRT
<213> Oryctolagus cuniculus
<400> 63
Met Lys Trp Val Thr Phe Ile Ser Leu Leu Phe Leu Phe Ser Ser Ala
1 5 10 15
Tyr Ser Arg Gly Val Phe Arg Arg Glu Ala His Lys Ser Glu Ile Ala
20 25 30
His Arg Phe Asn Asp Val Gly Glu Glu His Phe Ile Gly Leu Val Leu
35 40 45
Ile Thr Phe Ser Gln Tyr Leu Gln Lys Cys Pro Tyr Glu Glu His Ala
50 55 60
Lys Leu Val Lys Glu Val Thr Asp Leu Ala Lys Ala Cys Val Ala Asp
65 70 75 80
Glu Ser Ala Ala Asn Cys Asp Lys Ser Leu His Asp Ile Phe Gly Asp
85 90 95
Lys Ile Cys Ala Leu Pro Ser Leu Arg Asp Thr Tyr Gly Asp Val Ala
100 105 110
Asp Cys Cys Glu Lys Lys Glu Pro Glu Arg Asn Glu Cys Phe Leu His
115 120 125
His Lys Asp Asp Lys Pro Asp Leu Pro Pro Phe Ala Arg Pro Glu Ala
130 135 140
Asp Val Leu Cys Lys Ala Phe His Asp Asp Glu Lys Ala Phe Phe Gly
145 150 155 160
His Tyr Leu Tyr Glu Val Ala Arg Arg His Pro Tyr Phe Tyr Ala Pro
165 170 175
Glu Leu Leu Tyr Tyr Ala Gln Lys Tyr Lys Ala Ile Leu Thr Glu Cys
180 185 190
Cys Glu Ala Ala Asp Lys Gly Ala Cys Leu Thr Pro Lys Leu Asp Ala
195 200 205
Leu Glu Gly Lys Ser Leu Ile Ser Ala Ala Gln Glu Arg Leu Arg Cys
210 215 220
Ala Ser Ile Gln Lys Phe Gly Asp Arg Ala Tyr Lys Ala Trp Ala Leu
225 230 235 240
Val Arg Leu Ser Gln Arg Phe Pro Lys Ala Asp Phe Thr Asp Ile Ser
245 250 255
Lys Ile Val Thr Asp Leu Thr Lys Val His Lys Glu Cys Cys His Gly
260 265 270
Asp Leu Leu Glu Cys Ala Asp Asp Arg Ala Asp Leu Ala Lys Tyr Met
275 280 285
Cys Glu His Gln Glu Thr Ile Ser Ser His Leu Lys Glu Cys Cys Asp
290 295 300
Lys Pro Ile Leu Glu Lys Ala His Cys Ile Tyr Gly Leu His Asn Asp
305 310 315 320
Glu Thr Pro Ala Gly Leu Pro Ala Val Ala Glu Glu Phe Val Glu Asp
325 330 335
Lys Asp Val Cys Lys Asn Tyr Glu Glu Ala Lys Asp Leu Phe Leu Gly
340 345 350
Lys Phe Leu Tyr Glu Tyr Ser Arg Arg His Pro Asp Tyr Ser Val Val
355 360 365
Leu Leu Leu Arg Leu Gly Lys Ala Tyr Glu Ala Thr Leu Lys Lys Cys
370 375 380
Cys Ala Thr Asp Asp Pro His Ala Cys Tyr Ala Lys Val Leu Asp Glu
385 390 395 400
Phe Gln Pro Leu Val Asp Glu Pro Lys Asn Leu Val Lys Gln Asn Cys
405 410 415
Glu Leu Tyr Glu Gln Leu Gly Asp Tyr Asn Phe Gln Asn Ala Leu Leu
420 425 430
Val Arg Tyr Thr Lys Lys Val Pro Gln Val Ser Thr Pro Thr Leu Val
435 440 445
Glu Ile Ser Arg Ser Leu Gly Lys Val Gly Ser Lys Cys Cys Lys His
450 455 460
Pro Glu Ala Glu Arg Leu Pro Cys Val Glu Asp Tyr Leu Ser Val Val
465 470 475 480
Leu Asn Arg Leu Cys Val Leu His Glu Lys Thr Pro Val Ser Glu Lys
485 490 495
Val Thr Lys Cys Cys Ser Glu Ser Leu Val Asp Arg Arg Pro Cys Phe
500 505 510
Ser Ala Leu Gly Pro Asp Glu Thr Tyr Val Pro Lys Glu Phe Asn Ala
515 520 525
Glu Thr Phe Thr Phe His Ala Asp Ile Cys Thr Leu Pro Glu Thr Glu
530 535 540
Arg Lys Ile Lys Lys Gln Thr Ala Leu Val Glu Leu Val Lys His Lys
545 550 555 560
Pro His Ala Thr Asn Asp Gln Leu Lys Thr Val Val Gly Glu Phe Thr
565 570 575
Ala Leu Leu Asp Lys Cys Cys Ser Ala Glu Asp Lys Glu Ala Cys Phe
580 585 590
Ala Val Glu Gly Pro Lys Leu Val Glu Ser Ser Lys Ala Thr Leu Gly
595 600 605
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ СЫВОРОТОЧНЫЙ АЛЬБУМИН | 2018 |
|
RU2797270C2 |
| УЛУЧШЕННЫЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНА, СВЯЗЫВАЮЩИЕСЯ С СЫВОРОТОЧНЫМ АЛЬБУМИНОМ | 2017 |
|
RU2765384C2 |
| PD1/CTLA4-СВЯЗЫВАЮЩИЕ ВЕЩЕСТВА | 2016 |
|
RU2755724C2 |
| СВЯЗЫВАЮЩИЕ ADAMTS ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2781182C2 |
| ММР13-СВЯЗЫВАЮЩИЕ ИММУНОГЛОБУЛИНЫ | 2018 |
|
RU2784069C2 |
| УЛУЧШЕННЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНА | 2015 |
|
RU2746738C2 |
| УЛУЧШЕННЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНА | 2015 |
|
RU2809788C2 |
| УСОВЕРШЕНСТВОВАННЫЕ АГЕНТЫ, СВЯЗЫВАЮЩИЕ TNF | 2016 |
|
RU2774823C2 |
| ПОЛИПЕПТИДЫ, СОДЕРЖАЩИЕ ОДИНОЧНЫЕ ВАРИАБЕЛЬНЫЕ ДОМЕНЫ ИММУНОГЛОБУЛИНОВ, НАЦЕЛИВАЮЩИЕСЯ НА IL-13 И TSLP | 2020 |
|
RU2836310C1 |
| ПОЛИПЕПТИДЫ, СВЯЗЫВАЮЩИЕСЯ С ADAMTS5, MMP13 И АГГРЕКАНОМ | 2018 |
|
RU2786659C2 |
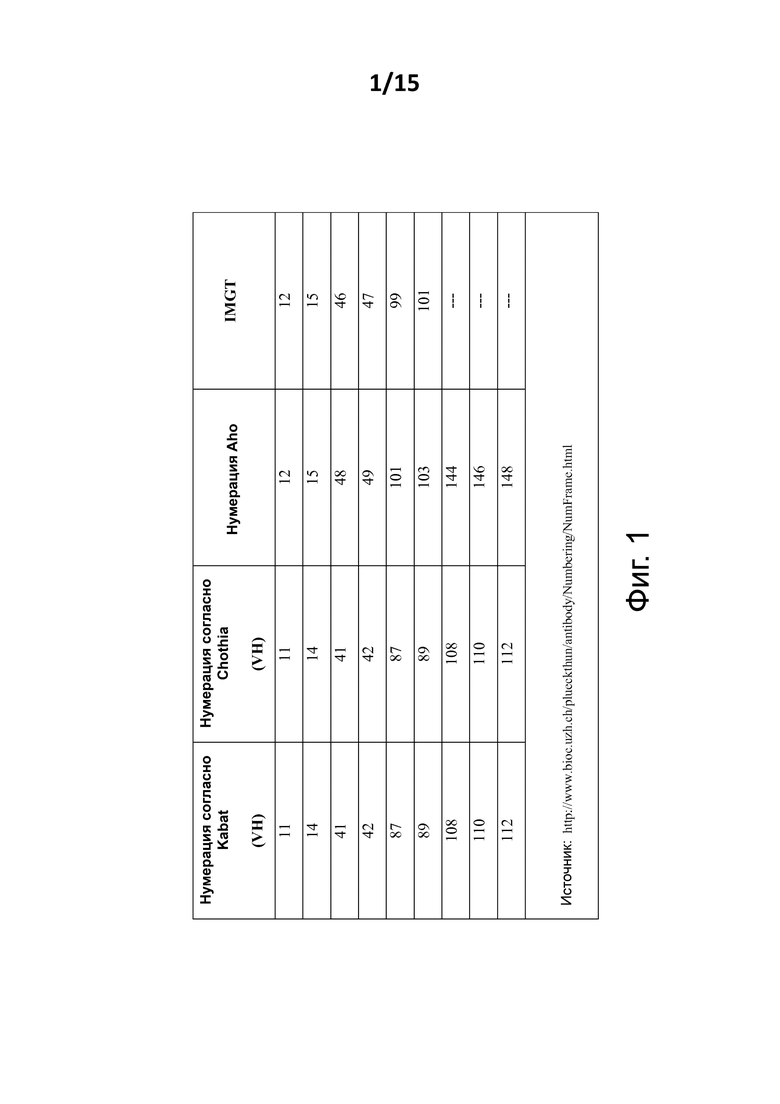

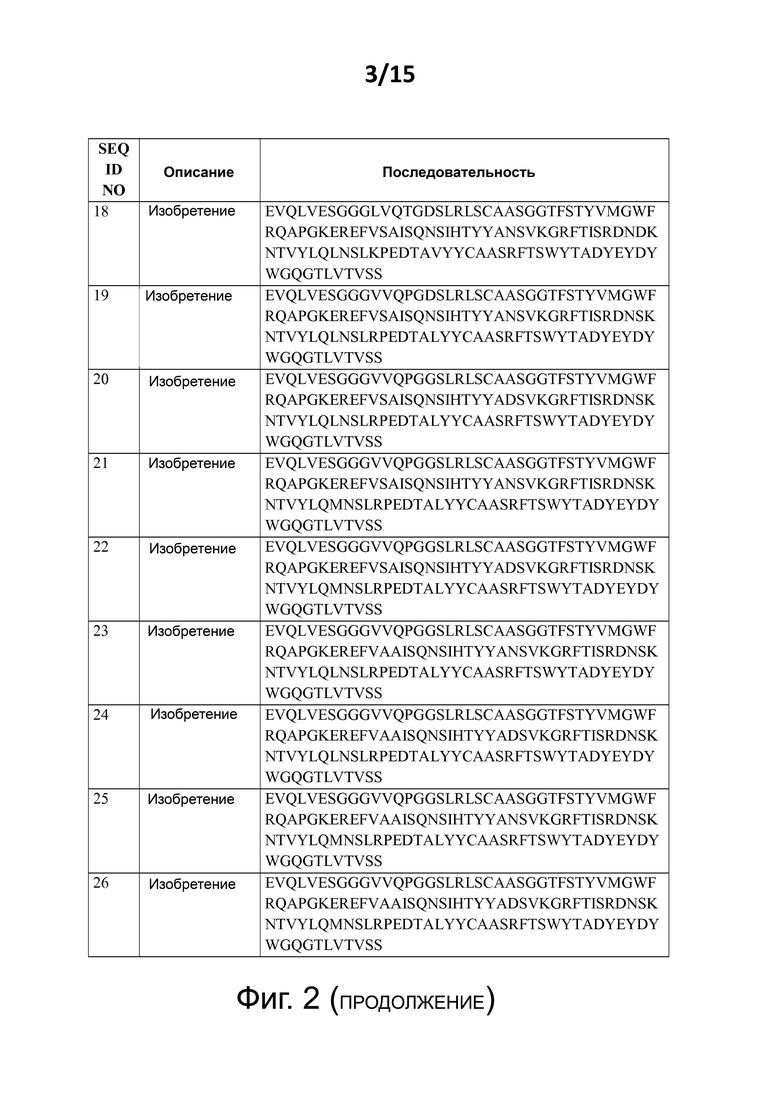
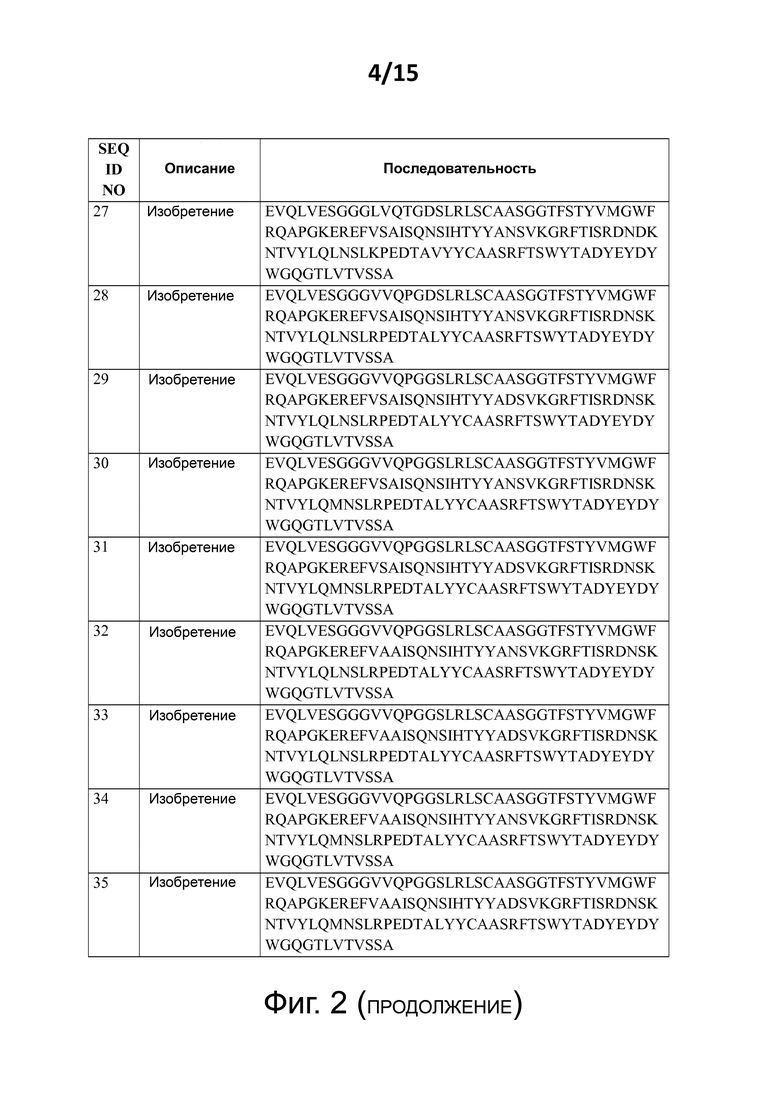
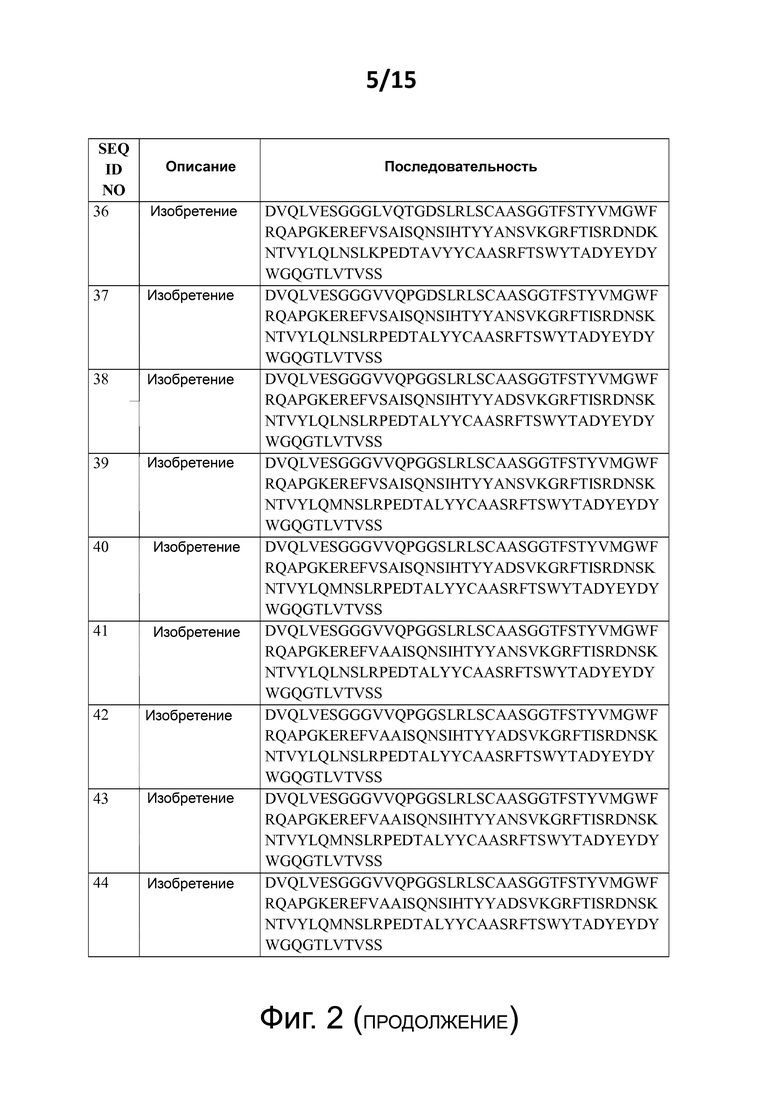



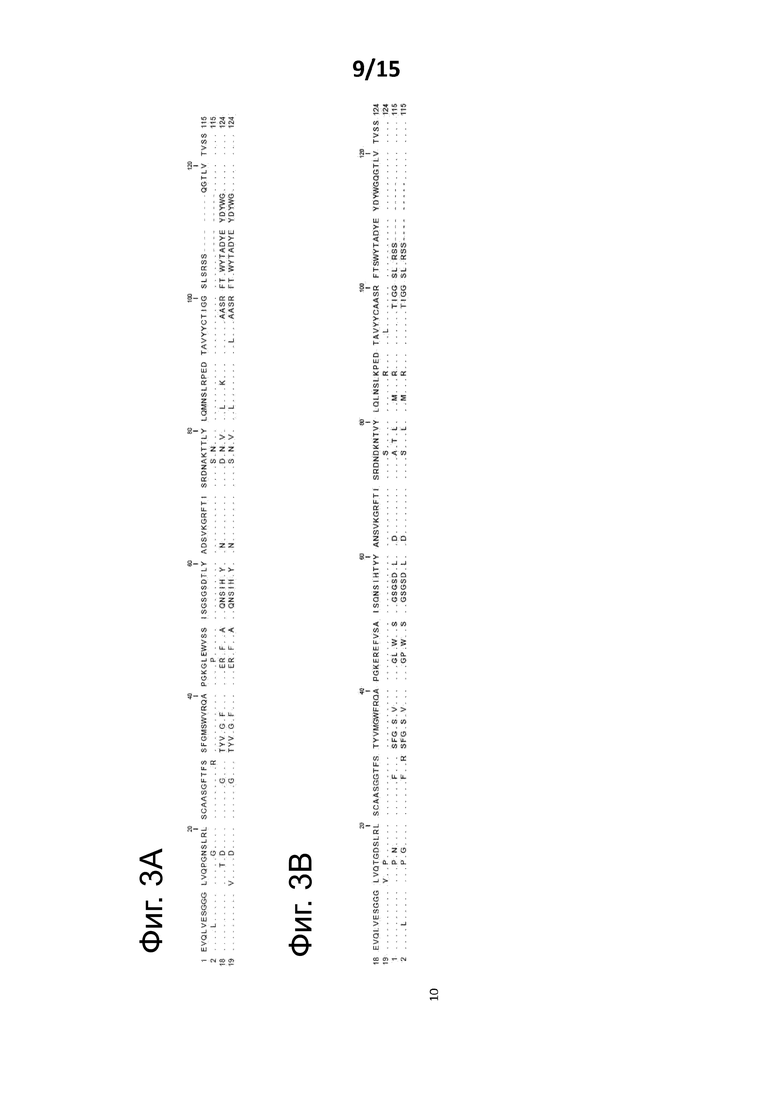




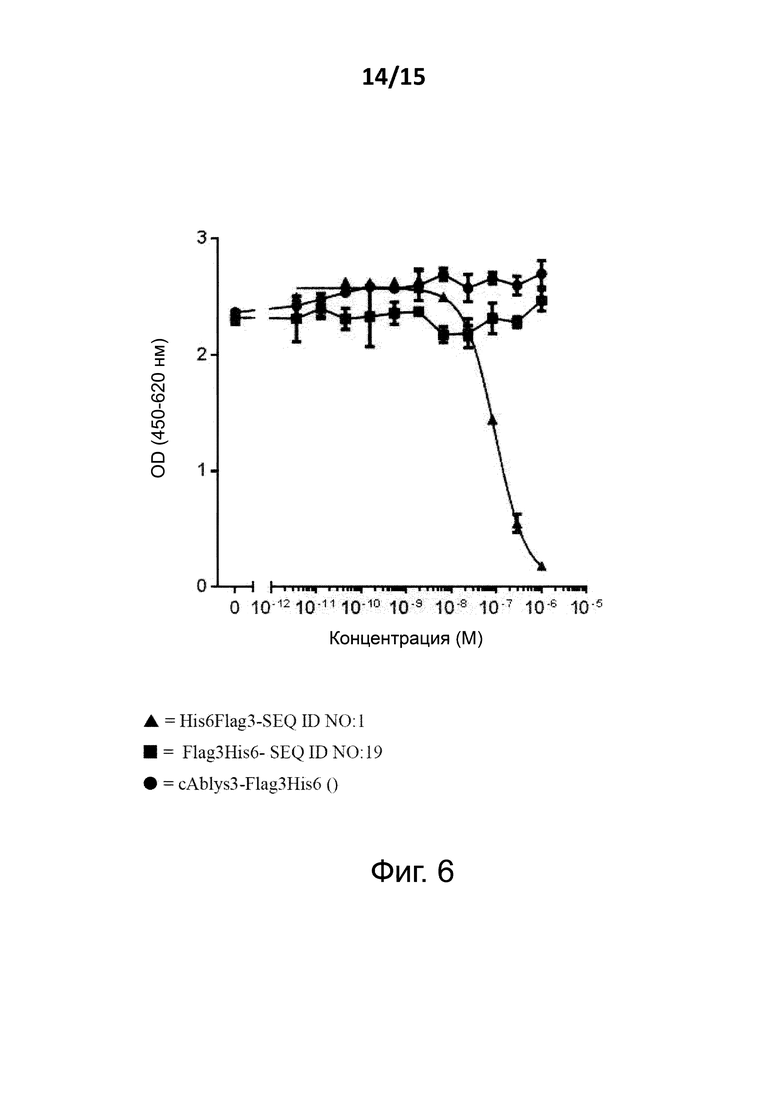
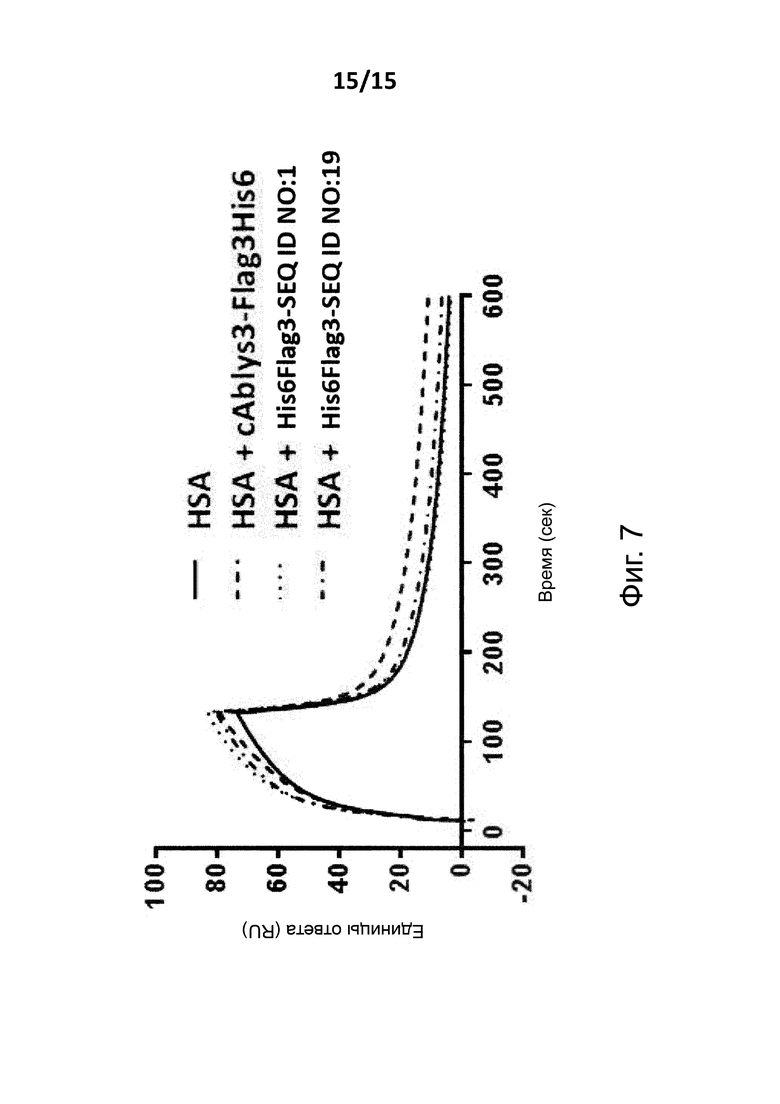
Изобретение относится к области биотехнологии, в частности к одиночному вариабельному домену иммуноглобулина, способному специфически связываться с человеческим сывороточным альбумином, способу его получения, а также к содержащей его конструкции и способу получения конструкции. Также раскрыта нуклеиновая кислота, кодирующая вышеуказанный домен, а также нуклеиновая кислота, кодирующая вышеуказанную конструкцию. Изобретение также относится к экспрессионной генетической конструкции и клетке-хозяину, содержащим вышеуказанную нуклеиновую кислоту. Изобретение эффективно для обеспечения увеличения времени полужизни терапевтическим соединениям, молекулам или структурам. 11 н. и 13 з.п. ф-лы, 7 ил., 2 табл., 4 пр.
1. Одиночный вариабельный домен иммуноглобулина, способный специфически связываться с человеческим сывороточным альбумином, имеющий аминокислотную последовательность, которая содержит:
- CDR1 согласно Abm аминокислотной последовательности SEQ ID NO: 12; и
- CDR2 согласно Abm аминокислотной последовательности SEQ ID NO: 13; и
- CDR3 согласно Abm аминокислотной последовательности SEQ ID NO: 14.
2. Одиночный вариабельный домен иммуноглобулина по п. 1, который может связываться с человеческим сывороточным альбумином с аффинностью менее чем 500 нM, как определено с помощью ProteOn.
3. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1 и 2, который представляет собой одиночный вариабельный домен тяжелой цепи иммуноглобулина.
4. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-3, который представляет собой VHH, гуманизированный VHH или камелизованный VH и, в частности, камелизованный человеческий VH.
5. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-4, который является таким, что
он имеет время полужизни в сыворотке у человека, выраженное как t1/2-бета, составляющее более чем 6 часов, предпочтительно более чем 12 часов, более предпочтительно более 24 часов, даже более предпочтительно более 72 часов;
и/или таким, что,
когда он связывается с лекарственным веществом или структурным элементом, это обеспечивает полученному в результате полипептиду изобретения время полужизни в сыворотке у человека, выраженное в виде t1/2-бета, составляющее более чем 6 часов, предпочтительно более чем 12 часов, более предпочтительно более 24 часов, даже более предпочтительно более 72 часов.
6. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-5, который имеет
степень идентичности последовательности с последовательностью SEQ ID NO: 18 и/или 19 по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% без учета CDR и любого C-концевого удлинения, которое может присутствовать, при определении степени идентичности последовательности;
и/или которая имеет
не более чем 7, предпочтительно не более 5, например, только 3, 2 или 1 аминокислотное отличие с последовательностью SEQ ID NO: 18 и/или 19 без учета CDR и любого C-концевого удлинения, которое может присутствовать,
где необязательно D или E1D имеется в положении 1 на конце N-концевого одиночного вариабельного домена иммуноглобулина.
7. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-6, который имеет
степень идентичности последовательности с последовательностью SEQ ID NO: 18 по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% без учета CDR и любого C-концевого удлинения, которое может присутствовать, при определении степени идентичности последовательности;
и/или который имеет
не более чем 7, предпочтительно не более 5, например, только 3, 2 или 1 аминокислотное отличие с последовательностью SEQ ID NO: 18 без учета CDR и любого C-концевого удлинения, которое может присутствовать.
8. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-6, который имеет
степень идентичности последовательности с последовательностью SEQ ID NO: 19 по меньшей мере 85%, предпочтительно по меньшей мере 90%, более предпочтительно по меньшей мере 95% без учета CDR и любого C-концевого удлинения, которое может присутствовать, при определении степени идентичности последовательности;
и/или который имеет
не более чем 7, предпочтительно не более 5, например, только 3, 2 или 1 аминокислотное отличие с последовательностью SEQ ID NO: 19 без учета CDR и любого C-концевого удлинения, которое может присутствовать.
9. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-8, который содержит по сравнению с последовательностью SEQ ID NO: 18 одну или более мутаций, уменьшающих связывание предсуществующими антителами.
10. Одиночный вариабельный домен иммуноглобулина по любому из пп. 1-9, который представляет собой VHH и который содержит по сравнению с последовательностью SEQ ID NO: 18 одну или более гуманизирующих замен.
11. Одиночный вариабельный домен иммуноглобулина, способный специфически связываться с человеческим сывороточным альбумином и который выбирают из SEQ ID NO: 18 – 44, где необязательно D или E1D имеется в положении 1 на конце N-концевого одиночного вариабельного домена иммуноглобулина.
12. Конструкция, которая способная специфически связываться с человеческим сывороточным альбумином, содержащая белок, полипептид или другую конструкцию, соединение, молекулу или химический структурный элемент и по меньшей мере одиночный вариабельный домен иммуноглобулина, способный специфически связываться с человеческим сывороточным альбумином,
отличающаяся тем, что
указанный одиночный вариабельный домен иммуноглобулина является одиночным вариабельным доменом иммуноглобулина по любому из пп. 1-11.
13. Конструкция по п. 12, которая содержит по меньшей мере одно лекарственное вещество или структурный элемент.
14. Конструкция по п. 12 или 13, которая представляет собой слитый белок.
15. Конструкция по любому из пп. 13-15, которая имеет время полужизни в сыворотке у человека, выраженное как t1/2-бета, составляющее более чем 6 часов, предпочтительно более чем 12 часов, более предпочтительно более 24 часов, даже более предпочтительно более 72 часов.
16. Конструкция по любому из пп. 12-15, которая является такой, что:
когда она имеет одиночный вариабельный домен иммуноглобулина на своей C-концевой области, тогда C-концевой одиночный вариабельный домен иммуноглобулина указанного белка, полипептида, соединения, конструкции имеет C-концевое удлинение (X)n на своем C-конце, в котором X может быть любой существующей в природе аминокислотой, но предпочтительно не цистеином, а n может быть 1, 2, 3, 4 или 5; и/или
когда она имеет одиночный вариабельный домен иммуноглобулина на своей C-концевой области, тогда, по меньшей мере, указанный C-концевой одиночный вариабельный домен иммуноглобулина содержит одну или более мутаций, которые уменьшают связывание предсуществующих антител; и/или
когда она имеет одиночный вариабельный домен иммуноглобулина на своей N-концевой области, тогда N-концевой одиночный вариабельный домен иммуноглобулина указанного белка, полипептида, соединения, конструкции предпочтительно содержит D в положении 1; и/или
в котором указанные одиночные вариабельные домены иммуноглобулина в белке, полипептиде или другом соединении также могут иметь одиночный вариабельный домен иммуноглобулина в своей N-концевой области, причем в этом случае конец указанного N-концевого одиночного вариабельного домена иммуноглобулина предпочтительно имеет D или E1D в положении 1; и/или
предпочтительно практически все из одиночных вариабельных доменов иммуноглобулина, присутствующих в указанном белке, полипептиде, соединении, конструкции содержат одну или более мутаций, которые уменьшают связывание предсуществующих антител.
17. Применение конструкции по любому из пп. 12-16 в качестве части фармацевтической композиции, где указанная конструкция содержит белок, полипептид или другую конструкцию, соединение, молекулу или химический структурный элемент, которые являются терапевтическими.
18. Нуклеиновая кислота, которая кодирует одиночный вариабельный домен иммуноглобулина по любому из пп. 1-11.
19. Нуклеиновая кислота, которая кодирует конструкцию по любому из пп. 12-16, где указанная конструкция является белковой или полипептидной конструкцией.
20. Экспрессионная генетическая конструкция, содержащая нуклеиновую кислоту по пп. 18 или 19.
21. Клетка-хозяин, которая экспрессирует одиночный вариабельный домен иммуноглобулина по любому из пп. 1-11, где указанная клетка-хозяин содержит экспрессионный вектор, содержащий нуклеиновую кислоту, кодирующую одиночный вариабельный домен иммуноглобулина по любому из пп. 1-11.
22. Способ получения одиночного вариабельного домена иммуноглобулина по любому из пп. 1-11, причем указанный способ включает культивирование или поддержание клетки-хозяина по п. 21 в условиях, при которых указанная клетка-хозяин продуцирует или экспрессирует одиночный вариабельный домен иммуноглобулина по любому из пп. 1-11 и необязательно дополнительно включающий выделение одиночного вариабельного домена иммуноглобулина по любому из пп. 1-11, полученного таким образом.
23. Клетка-хозяин, которая экспрессирует белковую конструкцию или полипептидную конструкцию по любому из пп. 12-16, где указанный хозяин содержит экспрессионный вектор, содержащий нуклеиновую кислоту, кодирующую белковую конструкцию или полипептидную конструкцию по любому из пп. 12-16.
24. Способ получения конструкции по любому из пп. 12-16, причем указанный способ включает культивирование или поддержание клетки-хозяина по п. 21 в условиях, при которых указанная клетка-хозяин продуцирует или экспрессирует конструкцию по любому из пп. 12-16, и необязательно дополнительно включающий выделение конструкции по любому из пп. 12-16, полученной таким образом.
| WO 2012175400, 27.12.2012 | |||
| WO 2008028977 A2, 13.03.2008 | |||
| US 2013129727 A1, 23.05.2013 | |||
| EA 200900955 A1, 30.04.2010 | |||
| US 2014186365 A1, 03.07.2014. |
Авторы
Даты
2023-02-03—Публикация
2018-01-17—Подача