Настоящее изобретение относится к синтетическим сурфактантам легких, предназначенным для лечения или профилактики респираторного дистресс-синдрома (RDS) у недоношенных детей и других нарушений дыхания.
Настоящее изобретение, в частности, относится к реконструированному сурфактанту, включающему комбинацию определенных аналогов нативного сурфактантного белка SP-C с аналогами нативного сурфактантного белка SP-B и фосфолипидную смесь.
Уровень техники
Человеческое легкое состоит из большого числа мелких воздушных мешочков, именуемых альвеолами, в которых происходит газообмен между кровью и воздушным пространством легких. У здоровых субъектов указанный обмен опосредован наличием белоксодержащего сурфактантного комплекса, который предотвращает коллапс легких в конце выдоха.
Сурфактантный комплекс легкого состоит главным образом из липида и содержит незначительные количества разных белков. Недостаточное количество указанного комплекса вызывает нарушение функции легкого. Такой синдром получил название респираторного дистресс-синдрома (RDS) и обычно характерен для недоношенных детей.
Указанный синдром можно эффективно лечить модифицированными природными сурфактантными составами, экстрагированными из легких животных.
Коммерчески доступными модифицированными сурфактантными составами являются, например, альфа-порактант (Curosurf™), выделяемый из легкого свиньи, салфактант (Infasurf™), экстрагируемый из лаважа легкого теленка, и берактант (Survanta™), химически модифицированный природный экстракт из легкого быка.
Основными компонентами указанных сурфактантных составов являются фосфолипиды, такие как 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC), (PG) и сурфактантные гидрофобные белки В и С (SP-B и SP-C).
Недостатки, присущие сурфактантным составам, выделяемым из тканей животных, такие как сложность процессов получения и стерилизации и возможное возникновение иммунных реакций, потребовали создания синтетических сурфактантов, имитирующих состав модифицированных природных сурфактантов.
Однако, как указано в научной литературе, ни один из синтетических сурфактантов, созданных до настоящего времени, не был таким же эффективным, как сурфактанты, экстрагированные у животных.
Такое положение дел можно объяснить тем, что существующие реконструированные сурфактанты, созданные до настоящего времени, не воспроизводят полный белковоподобный профиль модифицированных природных сурфактантов и включают только один белковоподобный (пептидный) компонент.
По вышеуказанным причинам в данной области, например, в публикациях WO 2008/044109, WO 2008/011559 и WO 2010/139442, были предложены реконструированные сурфактанты, включающие оба аналога нативных сурфактантных белков SP-B и SP-C.
Несмотря на имеющиеся достижения по-прежнему существует скептицизм относительно возможности создания реконструированных сурфактантов, обладающих такой же эффективностью с точки зрения растяжимости легких, что и сурфактанты, экстрагированные у животных, в частности, в отношении объема газа в легких и степени раскрытия альвеол в конце выдоха.
В данной связи автором настоящего изобретения было установлено, что, помимо белковоподобного профиля, для стабилизации альвеол в конце выдоха очень важное значение имеет композиция фосфолипидов.
В частности, автор настоящего изобретения обнаружил, что реконструированные сурфактанты, включающие репрезентативные аналоги белков В и С, описанные в WO 2008/044109, и фосфолипидную фракцию, экстрагированную из альфа-порактанта, которая характеризуется большим количеством ненасыщенных фосфолипидов, позволяют получить результаты, намного превышающие показатели альфа-порактанта в отношении дыхательного объема и объема газа в легких.
Поэтому большим достижением было бы создание реконструированных сурфактантов, включающих фосфолипидные смеси, позволяющие улучшить свойства таких сурфактантов в отношении растяжимости легких.
В публикации WO 2004/105726 описано использование липидной смеси, включающей полиненасыщенные фосфолипиды, с целью уменьшения вязкости синтетических сурфактантов.
Объектом настоящего изобретения является открытие того, что природная фракция с высоким содержанием ненасыщенных фосфолипидов, может быть успешно объединена с определенными аналогами нативного белка SP-C и определенными аналогами нативного белка SP-B с целью создания состава на основе реконструированных сурфактантов, обладающего свойствами, определяющими дыхательный объем и объем газа в легких, которые не хуже аналогичных свойств модифицированных природных сурфактантов, таких как альфа-порактант.
Сущность изобретения
Настоящее изобретение относится к реконструированному сурфактанту, включающему липидный носитель и комбинацию определенного полипептидного аналога нативного сурфактантного белка SP-C с определенным полипептидным аналогом нативного сурфактантного белка SP-B.
Настоящее изобретение, в частности, относится к реконструированному сурфактанту, включающему:
фосфолипидную смесь;
полипептидный аналог нативного сурфактантного белка SP-B; и
полипептидный аналог нативного сурфактантного белка SP-C, который представлен общей формулой:
IPSSPVHLKRLKLLLLLLLLILLLILGALLΩPGPLP (I)
где:
Ω означает аминокислоту, выбираемую из группы, состоящей из М или М, окисленного в положении атома серы, I, L и nL;
р означает 0 или 1;
при этом указанная фосфолипидная смесь включает:
i) DPPC в количестве 50% мас.;
ii) POPG в количестве 10% мас.; и
iii) природную фракцию ненасыщенных фосфолипидов в количестве 40% мас., по существу состоящую из:
30-50% POPC, 10-20% PLPC, 4-10% Р(:1)ОРС, 5-8% SLPC, 5-8% DOPC, 1-3% SAPC, 5-15% SOPC, 1-2% PAPC, 1-3% PDPC, 0-3,5% SOPE, 0-8% SAPE, 0-4% SLPE, 0-2,5% PLPE, 0-3,5% POPE, 0-2,0% LAPE, 0-2% DLPE, 0-10% PSM;
все количества, указанные в пунктах i), ii) и iii) вычислены на основании общей массы фосфолипидной смеси.
Настоящее изобретение также относится к фармацевтическим композициям, содержащим заявленный реконструированный сурфактант, используемый отдельно или в комбинации с одним или несколькими фармацевтически приемлемыми носителями.
Настоящее изобретение также относится к использованию заявленного реконструированного сурфактанта в качестве лекарственного средства.
Еще одним объектом изобретения является использование заявленного реконструированного сурфактанта для профилактики и/или лечения респираторного дистресс-синдрома (RDS) и других нарушений дыхания.
Кроме того, настоящее изобретение относится к использованию заявленного реконструированного сурфактанта для приготовления лекарственного средства, предназначенного для профилактики и/или лечения респираторного дистресс-синдрома (RDS) и других нарушений дыхания.
Настоящее изобретение также относится к способу профилактики и/или лечения респираторного дистресс-синдрома (RDS) и других нарушений дыхания, который включает введение субъекту, нуждающемуся в таком лечении, терапевтически эффективного количества реконструированного сурфактанта по настоящему изобретению.
Настоящее изобретение также относится к набору, включающему: а) реконструированный сурфактант по настоящему изобретению в форме порошка в виде первой стандартной лекарственной формы; b) фармацевтически приемлемый носитель в виде второй стандартной лекарственной формы; и с) емкость для указанных первой и второй лекарственных форм.
Краткое описание чертежей
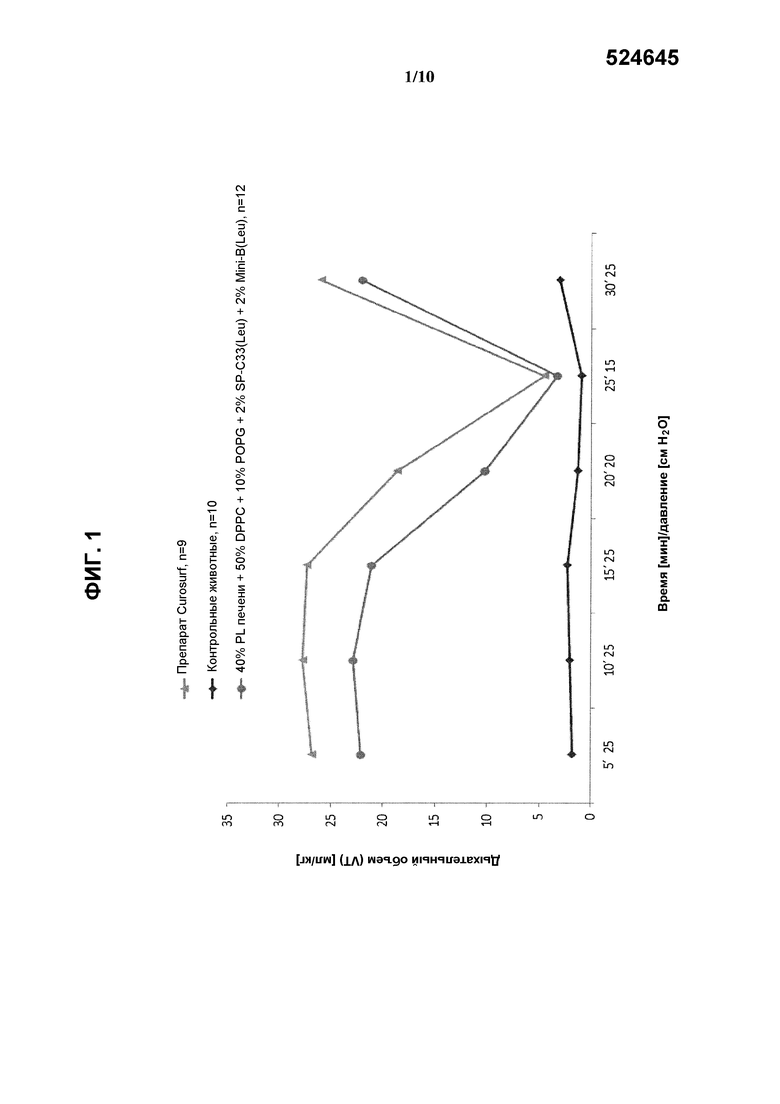
На фиг.1 показаны результаты измерения дыхательного объема (мл/кг) в зависимости от времени/давления при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% PC печени, по сравнению с препаратом Curosurf™ и контрольными образцами.
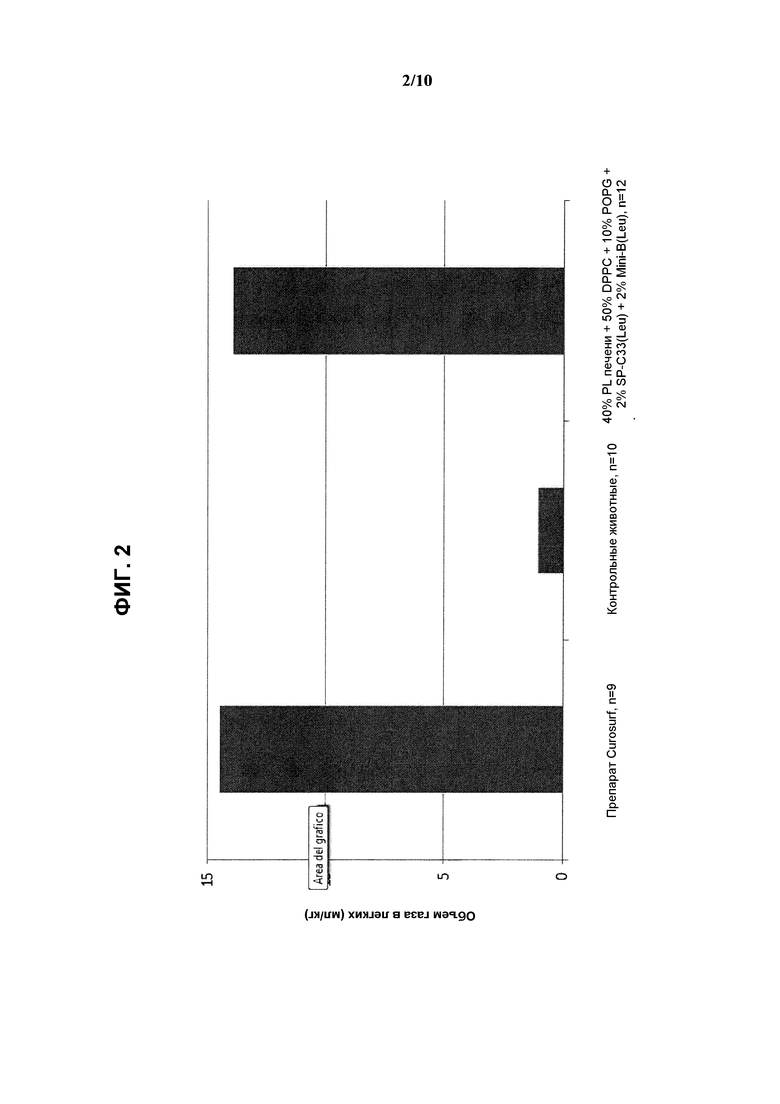
На фиг.2 показаны результаты измерения объема газа в легких (мл/кг) при использовании реконструированного сурфактанта, состоящего из 2% ох мини-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% PC печени, по сравнению с препаратом Curosurf™ и контрольными образцами.
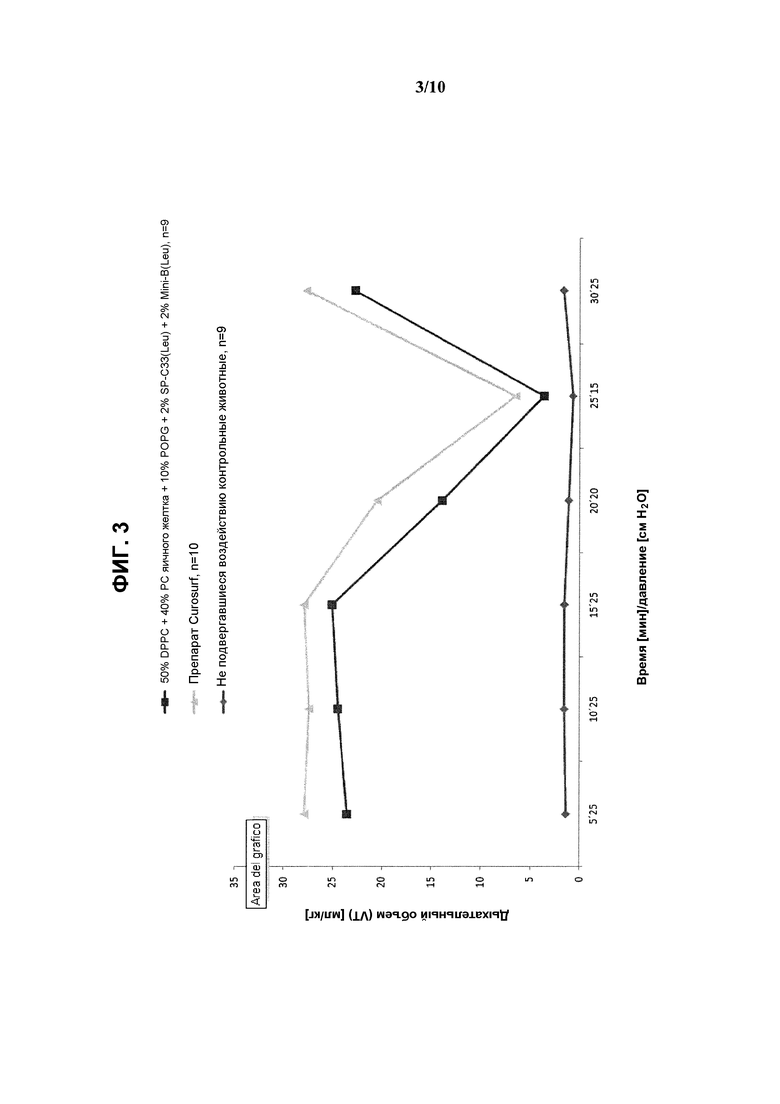
На фиг.3 показаны результаты измерения дыхательного объема (мл/кг) в зависимости от времени/давления при использовании сурфактанта, состоящего из 2% ох Mini-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% неочищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
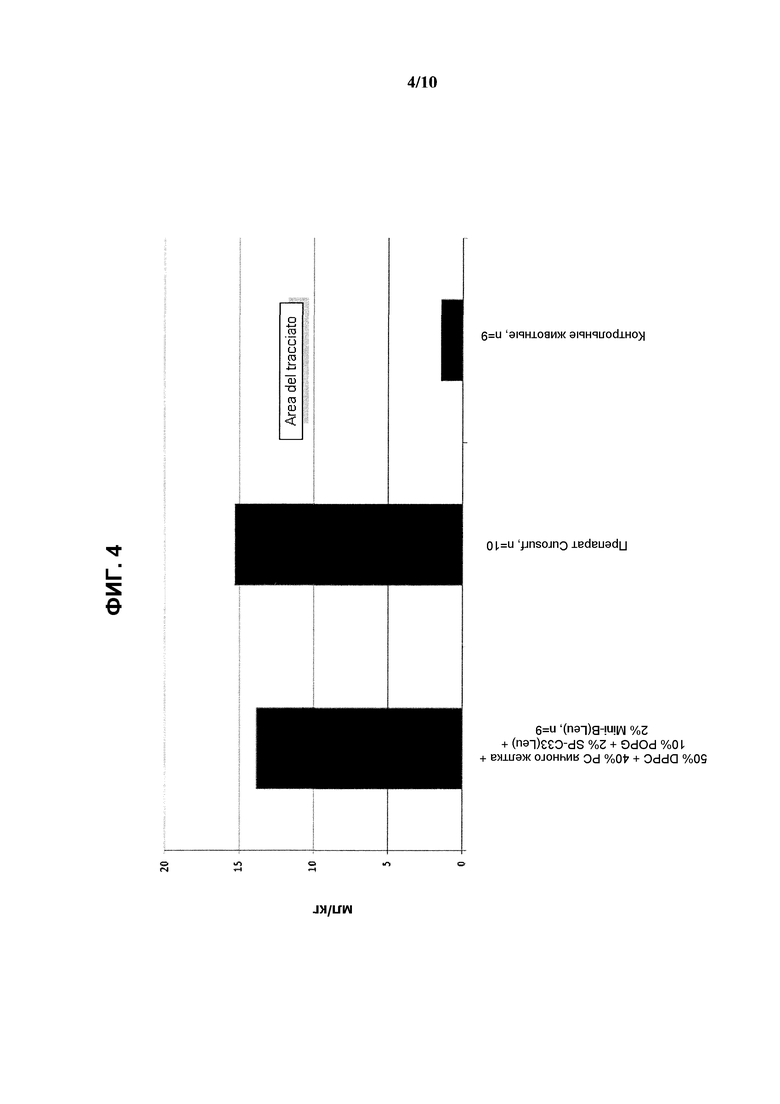
На фиг.4 показаны результаты измерения объема газа в легких (мл/кг) при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% неочищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
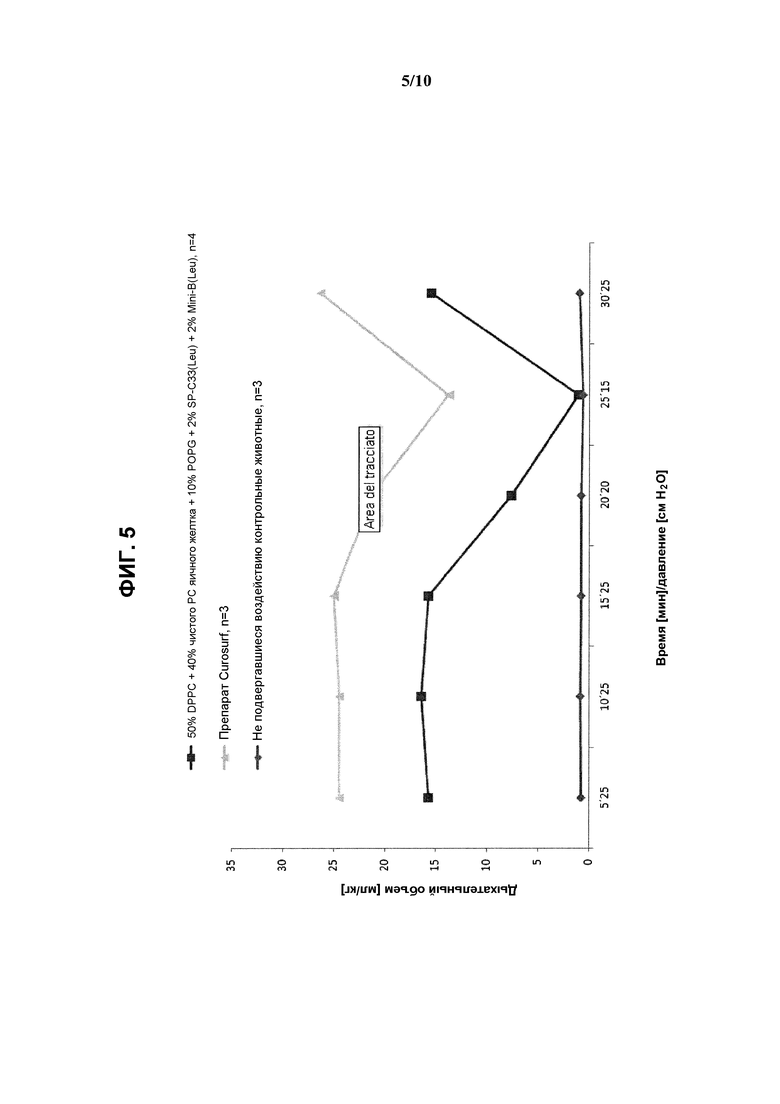
На фиг.5 показаны результаты измерения дыхательного объема (мл/кг) в зависимости от времени/давления при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
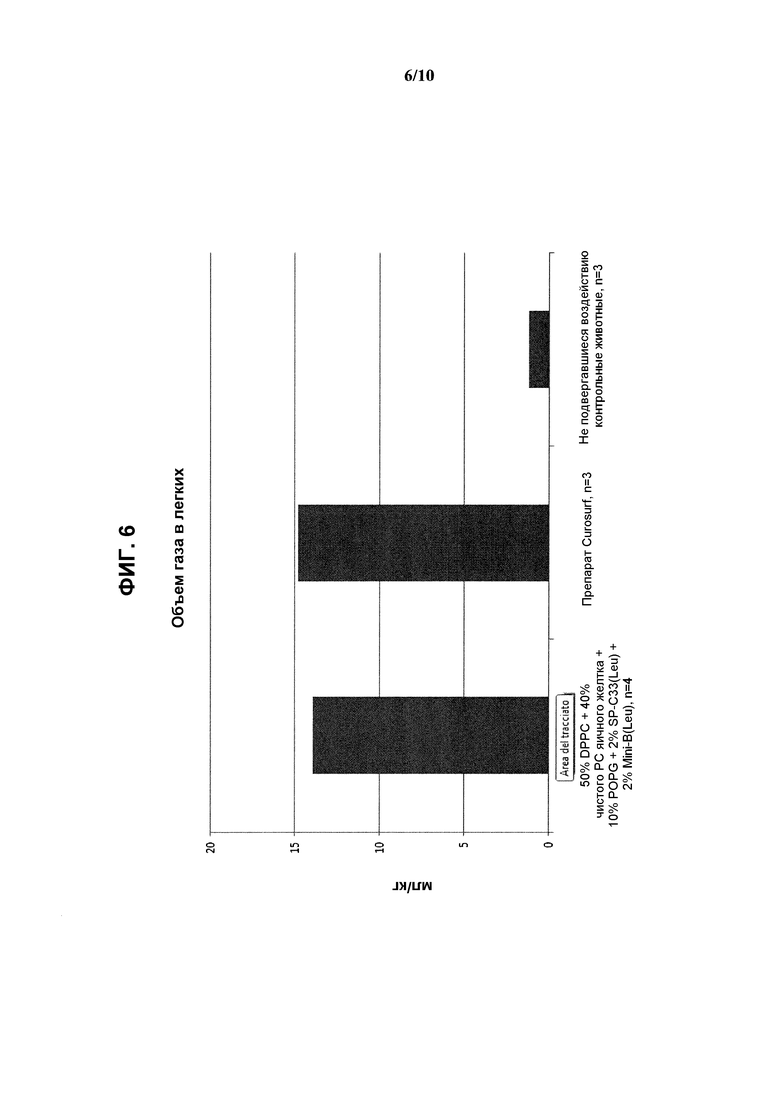
На фиг.6 показаны результаты измерения объема газа в легких (мл/кг) при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
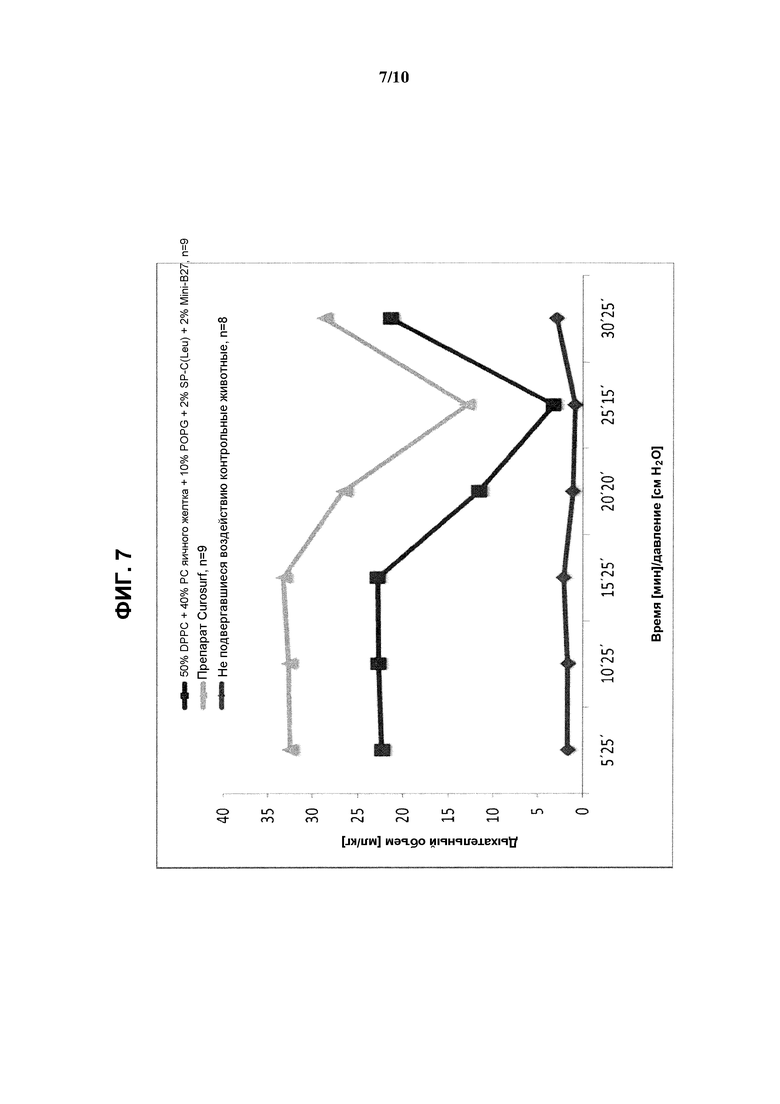
На фиг.7 показаны результаты измерения дыхательного объема (мл/кг) в зависимости от времени/давления при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В27 + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
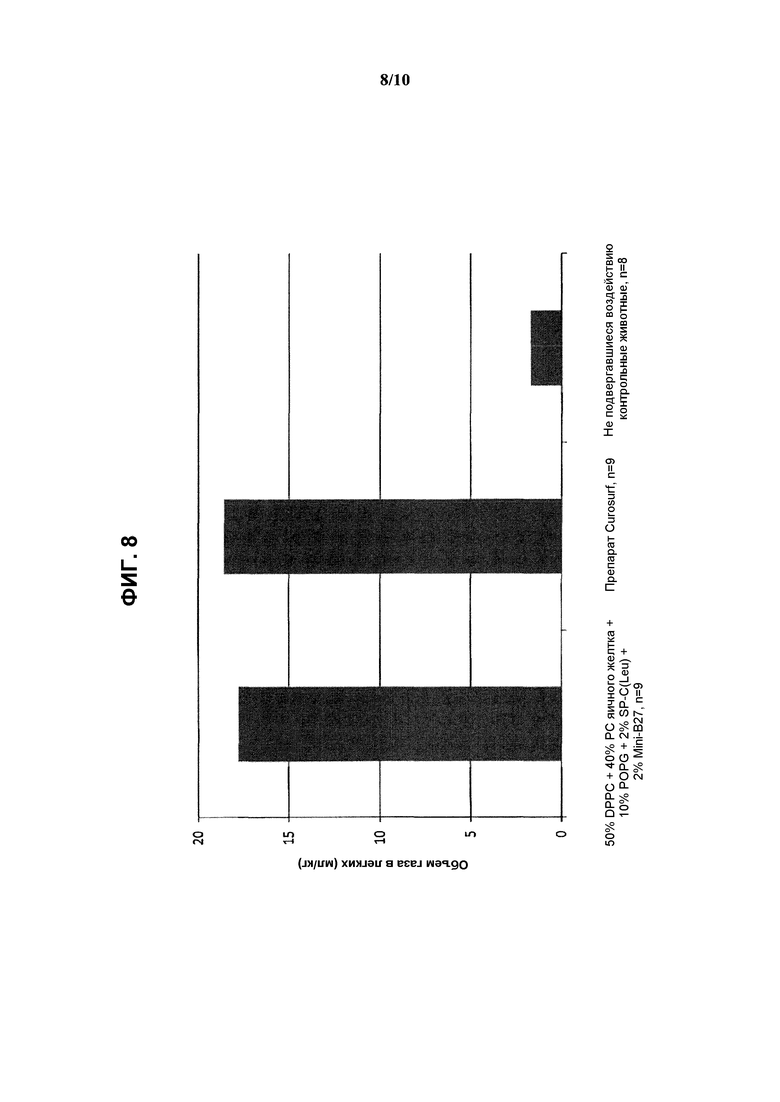
На фиг.8 показаны результаты измерения объема газа в легких (мл/кг) при использовании реконструированного сурфактанта, состоящего из 2% ох Mini-В27 + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
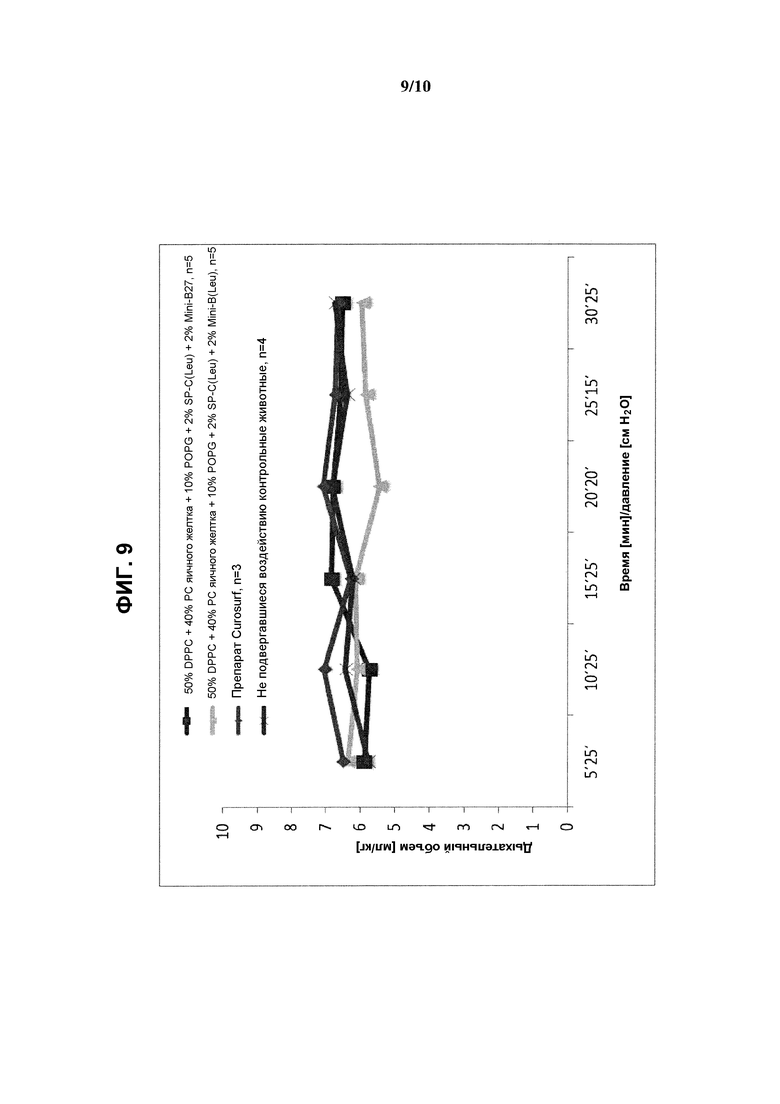
На фиг.9 показаны результаты измерения дыхательного объема (мл/кг) в эксперименте, выполненном при постоянном дыхательном объеме с использованием реконструированных сурфактантов, состоящих из 2% ох Mini-В(Leu) или ох Mini-В27 + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
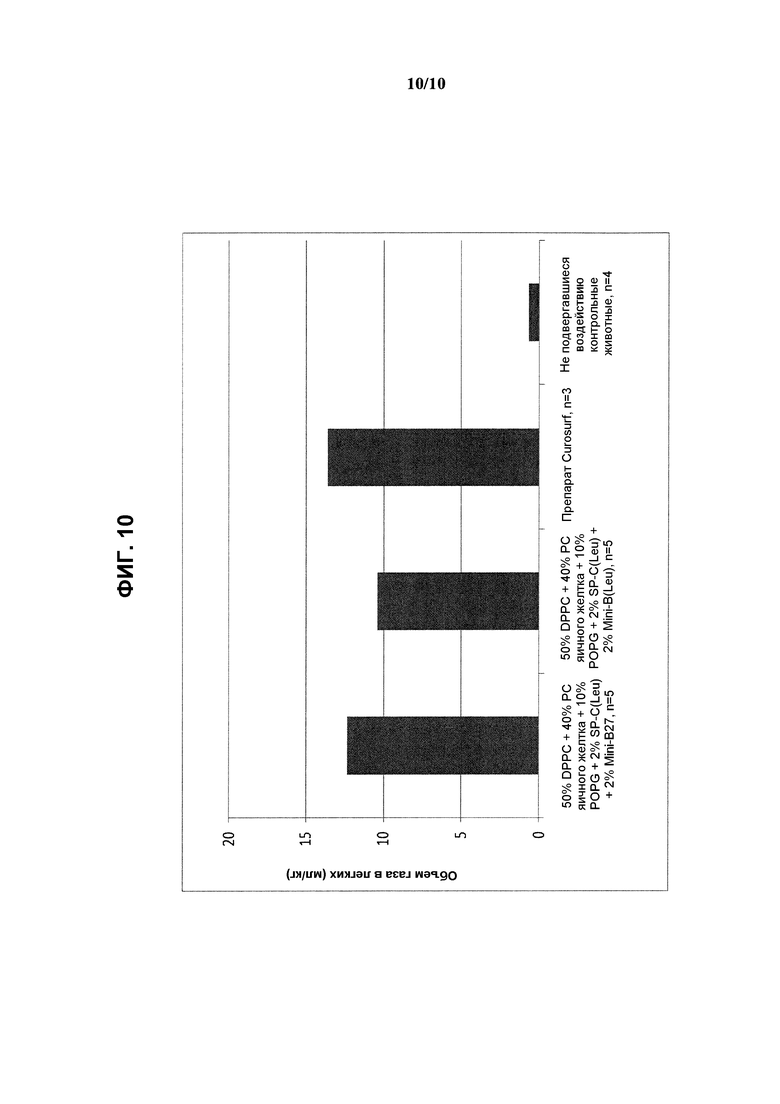
На фиг.10 показаны результаты измерения объема газа в легких (мл/кг) в эксперименте, выполненном при постоянном дыхательном объеме с использованием реконструированных сурфактантов, состоящих из 2% ох Mini-В(Leu) или ох Mini-В27 + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% очищенного РС яичного желтка, по сравнению с препаратом Curosurf™ и контрольными образцами.
Определения терминов
В настоящей заявке на патент термин ”реконструированный сурфактант” означает липидный носитель, к которому добавлены полипептидные аналоги сурфактантных белков, полученные методом рекомбинантных ДНК или методами синтеза.
Термин ”полипептидные аналоги нативного сурфактантного белка SP-C” означает полипептиды, содержащие аминокислотную последовательность, в которой, по сравнению с нативными белками, одна или несколько аминокислот отсутствуют или заменены другими аминокислотами при условии, что указанные полипептиды обладают активностью сурфактантов легких в смеси с липидным носителем, таким как, например, фосфолипидная смесь.
Термин ”полипептидные аналоги нативного сурфактантного белка SP-B” означает полипептиды, содержащие аминокислотную последовательность, в которой, по сравнению с нативными белками, одна или несколько аминокислот отсутствуют или заменены другими аминокислотами при условии, что указанные полипептиды обладают активностью сурфактантов легких в смеси с липидным носителем, таким как, например, фосфолипидная смесь.
Термин ”Mini-В” означает полипептид, состоящий из 34 остатков, включающих N-концевые остатки 8-25 и С-концевые остатки 63-78 нативного белка SP-B, структура которого была впервые показана на Web-сайте Калифорнийского института наносистем. Полная последовательность указанного полипептида затем была представлена в Банке данных белков RCSB.
В публикации Waring A.J. et al., J. Peptide Res. 2005, 66, 364-374 приведена более подробная информация о структуре и активности указанного полипептида.
Термин ”варианты” означает полипептидные аналоги пептида Mini-В, содержащего аминокислотную последовательность, в которой одна или несколько аминокислот заменены другими аминокислотами при условии, что указанные пептиды сохраняют активность Mini-В в смеси с липидным носителем.
Все аминокислотные остатки, указанные в настоящем описании изобретения, имеют природную L-конфигурацию, и последовательности, представленные в настоящем описании изобретения, приведены с использованием стандартных аббревиатур аминокислотных остатков, указанных в нижеследующей таблице 1.
Термин ”фосфолипиды” в значении, использованном в настоящем описании изобретения, означает класс липидов, состоящий из глицерина, фосфатной группы, нейтральной или цвиттерионной части в качестве определяющего компонента; одним исключением из данного правила является сфингомиелин, выделяемый из сфингозина вместо глицерина. Глицериновая часть или остаток сфингозина может быть этерифицирован длинноцепными жирными кислотами (С14-С22), которые в свою очередь могут быть насыщенными (например, миристиновая, пальмитиновая и стеариновая кислота), мононенасыщенными (например, олеиновая кислота) или полиненасыщенными (например, линолевая и арахидоновая кислота).
Классы и виды фосфолипидов, приведенных в настоящей заявке, указаны в нижеследующей таблице 2 вместе с использованными аббревиатурами.
- фосфатидилхолин: РС;
- фосфатидилэтаноламин: РЕ;
- фосфатидилглицерин: PG;
- фосфатидилинозит: PI;
- фосфатидилсерин: PS;
- сфингомиелин: SM;
- 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфохолин, известный как пальмитоилолеоилфосфатидилхолин: РОРС;
- 1-пальмитоил-2-линолеоил-sn-глицеро-3-фосфохолин, известный как пальмитоиллинолеоилфосфатидилхолин: PLРС;
- 1-пальмитолеоил-2-олеоил-sn-глицеро-3-фосфохолин, известный как пальмитолеоилолеоилфосфатидилхолин: Р(:1)ОРС;
- 1-стеароил-2-олеоил-sn-глицеро-3-фосфохолин, известный как стеароилолеоилфосфатидилхолин: SOPC;
- 1-стеароил-2-линолеоил-sn-глицеро-3-фосфохолин, известный как стеароиллинолеоилфосфатидилхолин: SLPC;
- 1-стеароил-2-арахидоноил-sn-глицеро-3-фосфохолин, известный как стеароиларахидоноилфосфохолин: SAPC;
- 1-пальмитоил-2-арахидоноил-sn-глицеро-3-фосфохолин, известный как пальмитоиларахидоноилфосфохолин: РАРС;
- 1,2-диолеоил-sn-глицеро-3-фосфохолин, известный как диолеоилфосфатидилхолин: DOPC;
- 1-пальмитоил-2-докозагексаеноил-sn-глицеро-3-фосфохолин, известный как пальмитоилдокозагексаеноилфосфатидилхолин: PDPC;
- 1,2-дипальмитоил-sn-глицеро-3-фосфоэтаноламин, известный как дипальмитоилфосфатидилэтаноламин: DPPE;
- 1-пальмитоил-2-линолеоил-sn-глицеро-3-фосфоэтаноламин, известный как пальмитоиллинолеоилфосфатидилэтаноламин: PLPE;
- 1-стеароил-2-олеоил-sn-глицеро-3-фосфоэтаноламин, известный как стеароилолеоилфосфатидилэтаноламин: SOPE;
- 1-стеароил-2-линолеоил-sn-глицеро-3-фосфоэтаноламин, известный как стеароиллинолеоилфосфатидилэтаноламин: SLPE;
- 1-стеароил-2-арахидоноил-sn-глицеро-3-фосфоэтаноламин, известный как стеароиларахидоноилфосфатадилэтаноламин: SAPE;
- 1-линолеоил-2-арахидоноил-sn-глицеро-3-фосфоэтаноламин, известный как линолеоиларахидоноилфосфатадилэтаноламин: LAPE;
- 1,2-дилинолеоил-sn-глицеро-3-фосфоэтаноламин, известный как дилинолеоилфосфатидилэтаноламин: DLPE;
- 1-пальмитоил-2-олеоил-sn-глицеро-3-фосфоглицерин, известный как пальмитоилолеоилфосфатидилглицерин: POPG;
- 1,2-диолеоил-sn-глицеро-3-фосфоглицерин, известный как диолеоилфосфатидилглицерин: DOPG;
- 1,2-дипальмитоил-sn-глицеро-3-фосфо-L-серин, известный как дипальмитоилфосфатидилсерин: DPPS;
- 1,2-дипальмитоил-sn-глицеро-3-фосфоглицерин, известный как дипальмитоилфосфатидилглицерин: DPPG;
- N-пальмитоил-D-сфингозилфосфорилхолин: PSM.
Выражение ”по существу состоящий из” означает, что природная фракция ненасыщенных фосфолипидов может включать другие компоненты в очень низких количествах (менее 0,1% мас./мас.), которые по существу не влияют на активность и свойства указанной фракции.
”Активность сурфактанта” в сурфактантном составе определяется как способность уменьшать поверхностное натяжение.
Эффективность in vitro экзогенных сурфактантных составов обычно определяют путем измерения способности уменьшать поверхностное натяжение при помощи соответствующего устройства, такого как уравновешивающее устройство Вильгельми и устройство для измерения пузырей, образованных сурфактантами.
Эффективность in vivo экзогенных сурфактантных составов обычно определяют, измеряя следующие параметры:
i) дыхательный объем, который является показателем растяжимости легких;
ii) объем газа в легких, который является показателем расширения альвеолярного воздуха или раскрытого состояния в конце выдоха и, следовательно, способности образовывать устойчивую фосфолипидную пленку в альвеолах в конце выдоха;
iii) объемная плотность альвеол представляет собой процентное значение общего объема альвеол в легком. Процентное значение вычисляют путем деления общего объема альвеол на общий объем легкого (альвеолы + ткань за исключением, например, бронхиол, сосудов) в соответствии с методом, описанным в абзаце 2.2.2 публикации Berggren P. et al., Respiration Physiology, 1999, 115, 45-33. Указанное значение подобно объему газа в легких, который измеряют для всего легкого, в то время как объемную плотность альвеол измеряют, используя гистологические срезы.
Термин ”терапевтически эффективное количество” в использованном здесь значении означает количество реконструированного сурфактанта, позволяющее предотвратить, избежать, ослабить или устранить респираторное заболевание или нарушение, ассоциированное с отсутствием или дисфункцией эндогенного сурфактанта.
Термин ”рекомбинантный”, использованный, например, применительно к клетке, нуклеиновой кислоте, белку или вектору, означает, что данная клетка, нуклеиновая кислота, белок или вектор были модифицированы путем введения гетерологичной нуклеиновой кислоты или белка либо путем изменения нативной нуклеиновой кислоты или белка.
В использованном здесь значении термин ”примерно” применительно к заданной величине означает изменчивость в пределах ±5%.
Подробное описание изобретения
Настоящее изобретение относится к реконструированному сурфактанту, включающему полипептидный аналог нативного сурфактантного белка SP-C формулы (I), полипептидный аналог нативного сурфактантного белка SP-B формулы (II) или (III) и фосфолипидную смесь, включающую природную фракцию с высоким содержанием ненасыщенных фосфолипидов.
Установлено, что свойства составов на основе указанных реконструированных сурфактантов, определяющие дыхательный объем и объем газа в легких, не уступают аналогичным свойствам модифицированных природных сурфактантов, таких как альфа-порактант.
В частности, было обнаружено, что, помимо белковоподобных компонентов, фосфолипидная композиция также имеет важное значение для стабилизации альвеол в конце выдоха у животных, у которых газообмен в легких происходит без положительного давления в конце выдоха (РЕЕР).
Кроме того, было обнаружено, что при использовании заявленной фосфолипидной смеси можно создать композиции с низкой вязкостью даже при использовании аналогов SP-B формулы (III), которые являются более короткими по сравнению с аналогами формулы (II), но позволяют получить вязкие составы при смешивании с простой фосфолипидной смесью DPPC и POPG.
Полипептидный аналог белка SP-C представлен общей формулой (I)
IPSSPVHLKRLKLLLLLLLLILLLILGALLΩpGpLp (I)
где:
Ω означает аминокислоту, выбираемую из группы, состоящей из М или М, окисленного в положении атома серы, I, L и nL, предпочтительно nL (норлейцин);
р означает 0 или 1.
Ниже приведены примеры полипептидов формулы (I):
IPSSPVHLKRLKLLLLLLLLILLLILGALLMGL (Ia)
IPSSPVHLKRLKLLLLLLLLILLLILGALLIGL (Ib)
IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (Ic)
IPSSPVHLKRLKLLLLLLLLILLLILGALLnLGL (Id)
IPSSPVHLKRLKLLLLLLLLILLLILGALL (Ie)
IPSSPVHLKRLKLLLLLLLLILLLILGALLL (If)
Полипептид (Ia) также известен в данной области как SP-C33.
В предпочтительном варианте осуществления изобретения полипептид общей формулы (I) является полипептидом (Ic), известным в данной области как SP-C33(Leu).
Аналог белка SP-B может быть выбран из разных полипептидов, соответствующих частям нативного белка или его вариантов.
В одном варианте осуществления изобретения аналог нативного белка SP-B является полипептидом, представленным нижеследующей общей формулой (II):
(FPθPLPY)fCΔLCRALIKRIQAΩIPKGGRΩLPQLVCRLVLΦCS (II)
где:
θ означает аминокислотный остаток, выбираемый из группы, состоящей из L, I и С, предпочтительно С; и
Δ означает аминокислотный остаток, выбираемый из группы, состоящей из W, I и L, предпочтительно W;
Ω означает аминокислотный остаток, независимо выбираемый из группы, состоящей из M, I, L и nL, предпочтительно L;
Φ означает аминокислотный остаток, выбираемый из группы, состоящей из R и Т, предпочтительно R;
f означает 0 или 1.
Ниже приведены полипептиды общей формулы (II), в которой f равно 0:
CWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIa)
CLLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIb)
CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIc)
CLLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IId)
Полипептиды (IIa), (IIb), (IIc) и (IId) предпочтительно могут иметь форму молекулы, связанной дисульфидной связью, в которой внутримолекулярная дисульфидная связь расположена между двумя остатками С в положениях 1 и 33 и/или между двумя остатками С в положениях 4 и 27.
Полипептид (IIa), связанный дисульфидной связью, определяется в данной области как Mini-В и его форма, связанная дисульфидной связью, определяется как окисленный Mini-В (см. публикацию Waring A.J. et al., J. Peptide Res. 2005, 66, 364-374.
Полипептид (IIc), который является особенно предпочтительным, определяется в публикации WO 2008/044109 как Mini-В(Leu) и его форма, связанная дисульфидной связью, определяется как ох Mini-В(Leu).
Ниже приведены полипептиды общей формулы (II), в которой f равно 1:
FPCPLPYCWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIe)
FPIPLPYCWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIf)
FPCPLPYCWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIg)
FPIPLPYCWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIh)
Указанные полипептиды предпочтительно могут иметь форму циклической молекулы, в которой связь расположена между остатками С в положениях 8 и 40 и/или между остатками С в положениях 11 и 34.
В другом варианте осуществления изобретения аналог нативного белка SP-B является полипептидом, представленным нижеследующей общей формулой (III):
XΔLΩRALIКRFNRYLTPQLVΩRLVLRΦΣq (III)
где:
Х означает аминокислотный остаток, выбираемый из группы, состоящей из С, А, G, L и I, предпочтительно С;
Δ означает аминокислотный остаток, выбираемый из группы, состоящей из W, L, nL (норлейцин) и I, предпочтительно W или L;
Φ означает аминокислотный остаток, выбираемый из группы, состоящей из С, А и G, L и I, предпочтительно С;
Σ означает аминокислотный остаток, выбираемый из группы, состоящей из S, G и А;
Ω означает аминокислоту, выбираемую из группы, состоящей из С, L и I, предпочтительно С; и
q означает 0 или 1.
Указанные полипептиды могут иметь форму циклической молекулы, в которой связь расположена между остатками С в положениях 1 и 27 и/или между остатками С в положениях 4 и 21.
Ниже приведены полипептиды, определяемые общей формулой (III):
CLLCRALIKRFNRYLTPQLVCRLVLRC (IIIa)
CWLCRALIKRFNRYLTPQLVCRLVLRC (IIIb)
ALLCRALIKRFNRYLTPQLVCRLVLRAA (IIIc)
GLLCRALIKRFNRYLTPQLVCRLVLRGG (IIId)
Предпочтительный полипептид является полипептидом формулы (IIIb) в форме молекулы, связанной дисульфидной связью, определяемой в настоящем описании изобретения как ох Mini-В27.
Полипептиды общих формул (I), (II) и (III) могут быть получены методами синтеза или методами рекомбинантных ДНК, хорошо известными специалистам в данной области.
Великолепный обзор многих существующих методов представлен в публикациях J.M. Steward and J.D. Young, “Solid Phase Peptide Synthesis”, W.H. Freeman Co., San Francisco, 1969, и J. Meienhofer, Hormonal Proteins and Peptides”, Vol. 2, p. 46, Academic Press (New York), 1983, где описан твердофазный синтез пептидов, и в публикации E. Schroder and K. Kubke “The Peptides”, Vol. 1, Academic Press (New York), 1965, где описан классический синтез в растворе. Полипептиды по настоящему изобретению могут быть также получены методом твердофазного синтеза, первоначально описанным в публикации Merrifield, in J. Am. Chem. Soc. 85: 2149-2154 (1963). С другими методами синтеза полипептидов можно ознакомиться, например, в публикации M. Bodanszky et al., Peptide Synthesis, John Wiley & Sons, 2d Ed., (1976), а также в других справочных материалах, известных специалистам в данной области.
Соответствующие защитные группы, используемые в таких методах синтеза, представлены в вышеуказанных публикациях, а также в публикации J.F.W. McOmie, Protective Groups in Organic Chemistry, Plenum Press, New York, NY (1973).
Например, полипептиды общей формулы (I) могут быть получены методом, описанным в публикации WO 00/47623.
Полипептиды общей формулы (II), где f равно 0, могут быть получены методами, описанными в публикации Waring A.J. et al., J. Peptide Res. 2005, 66, 364-374, или в публикации WO 2008/044109, и полипептиды общей формулы (II), где f равно 1, могут быть получены в соответствии с описанием, приведенным в публикации WO 2008/011559.
Полипептиды общей формулы (III) могут быть получены методаии, описанными в публикации WO 2009/018908.
Настоящее изобретение также относится к фармацевтически приемлемым солям полипептидов общих формул (I), (II) и (III) и их блокированных N- или С-концевых производных, полученных, например, путем ацетилирования и амидирования.
Фармацевтически приемлемые соли включают, например, соли хлористоводородной кислоты, уксусной кислоты и трифторуксусной кислоты.
Фосфолипид POPG может присутствовать в форме фармацевтически приемлемых солей, таких как, например соль натрия (POPG Na).
Полипептиды общей формулы (I) и полипептиды общей формулы (II) или (III) предпочтительно присутствуют в реконструированных сурфактантах по настоящему изобретению в постоянном количестве и количественном соотношении в виде фиксированной комбинации.
Содержание полипептидов общих формул (I) и (II) или (III) в реконструированном сурфактанте может изменяться. Каждый полипептид может присутствовать в количестве 0,5-10% в расчете на массу сурфактанта (мас./мас.), предпочтительно в количестве 1-5%, наиболее предпочтительно в количестве 1-3%.
Фосфолипидная смесь состоит из i) 50% мас. DPPC; ii) 10% мас. POPG и iii) 40% мас. природной фракции ненасыщенных фосфолипидов, при этом все количества i), ii) и iii) вычисляют в расчете на общую массу фосфолипидной смеси.
Природная фракция ненасыщенных фосфолипидов, в свою очередь, состоит в основном из 30-50% РОРС, 10-20% PLPC, 4-10% Р(:1)ОРС, 5-8% SLPC, 5-8% DOPC, 1-3% SAPC, 5-15% SOPC, 1-2% PAPC, 1-3% PDPC, 0-3,5% SOPE, 0-8% SAPE, 0-4% SLPE, 0-2,5% PLPE, 0-3,5% POPE, 0-2,0% LAPE, 0-2,0% DLPE, 0-10% PSM.
Сумма относительных количеств разных компонентов, составляющих указанную фракцию, должна быть равна 100%. Абсолютное количество указанных компонентов в общей массе фосфолипидной смеси может быть вычислено путем умножения каждого значения на 0,4.
Типичная композиция природной фракции ненасыщенных фосфолипидов может состоять из около 45% POPC, около 20% PLPC, около 6% P(:1)OPC, около 6% SLPC, около 6% DOPC, около 3% SAPC, около 10% SOPC, около 2% PAPC, около 2% PDPC в расчете на массу экстракта L-α-фосфатидилхолина.
Другая типичная композиция указанной фракции может состоять из около 35% POPC, около 20% PLPC, около 5% P(:1)OPC, около 5% SLPC, около 5% DOPC, около 1% SAPC, около 7% SOPC, около 1% PAPC, около 1% PDPC, около 2% SOPE, около 7% SAPE, около 3% SLPE, около 2% PLPE, около 2% POPE, около 2% LAPE, около 1% DLPE, около 1% PSM в расчете на массу экстракта L-α-фосфатидилхолина.
В одном варианте осуществления изобретения в качестве источника природной фракции ненасыщенных фосфолипидов могут быть использованы L-α-фосфатидилхолины разной степени чистоты, выделенные из яичного желтка (Sigma Аldrich Co., St. Louis, MO, USA).
Например, может быть успешно использован L-α-фосфатидилхолин, выделенный из яичного желтка, с чистотой более 99% мас./мас. Указанный L-α-фосфатидилхолин имеет в основном следующий состав: 40-50% POPC, 15-20% PLPC, 5-7% P(:1)OPC, 6-7% SLPC, 6-7% DOPC, 2-3% SAPC, 10-15% SOPC, 1-2% PAPC, 1-2% PDPC в расчете на массу экстракта L-α-фосфатидилхолина.
Также может быть использован L-α-фосфатидилхолин, выделенный из яичного желтка, с чистотой около 40% мас./мас., который имеет следующий состав: 30-40% POPC, 13-18% PLPC, 3-4% P(:1)OPC, 5-6% SLPC, 5-6% DOPC, 1-2% SAPC, 6-8% SOPC, 1-2% PAPC, 1-2% PDPC, 3-3,5% SOPE, 7-8% SAPE, 3,5-4,5% SLPE, 2-2,5% PLPE, 3-3,5% POPE, 1,5-2,0% LAPE, 1-2% DLPE, 0,5-1% PSM в расчете на массу экстракта L-α-фосфатидилхолина.
В качестве источника фракции ненасыщенных фосфолипидов может быть также использован L-α-фосфатидилхолин, выделенный из бычьей печени, с чистотой более 99% мас./мас. Альтернативно указанная фракция может быть выделена из других источников, таких как печень кролика, методами хроматографии, известными квалифицированному специалисту.
Теоретически фракция ненасыщенных фосфолипидов может быть также получена квалифицированным специалистом в данной области путем смешивания компонентов в соответствующем количестве.
Относительные количества фосфолипидов могут быть определены методами, известными в данной области, например, методом ЖХ-МС, описанным а публикации Miroslav L. et al., J. Chromatog. A 2011, 1218, 5146-5156.
В определенных вариантах осуществления изобретения реконструированный сурфактант может включать дополнительные компоненты, например, нейтральные липиды, такие как триацилглицерины, свободные жирные кислоты, холестерин и/или другие фосфолипиды, такие как лизофосфатидилхолины, лизофосфатидилэтаноламины, DPPS, DPPG и DOPE.
Реконструированный сурфактант по настоящему изобретению преимущественно включает 90-99% мас. фосфолипидной смеси, предпочтительно 92-98%, более предпочтительно 94-96% и 1-10% мас. от суммы пептида формулы (I) и пептида формулы (II), (III) или (IV), предпочтительно 2-8%, более предпочтительно 4-6%.
В одном варианте осуществления изобретения реконструированный сурфактант включает 96% мас. фосфолипидной смеси, 2% мас. полипептида общей формулы (I) и 2% мас. полипептида общей формулы (II).
В другом варианте осуществления изобретения реконструированный сурфактант включает 96% мас. фосфолипидной смеси, 2% мас. полипептида общей формулы (I) и 2% мас. полипептида общей формулы (III).
Эффективные дозы реконструированного сурфактанта по настоящему изобретению, предназначенные для лечения такого заболевания как RDS, рассмотренного в настоящем описании изобретения, изменяются в зависимости от многих факторов, в том числе от характера заболевания, способа введения, массы тела и физиологического состояния субъекта, а также от применения для профилактики или лечения.
Указанная доза обычно составляет от 0,01 мг до 10 г на кг массы тела, предпочтительно 0,1-1 г на кг массы тела, при этом частота введения может изменяться в зависимости от профилактического или терапевтического применения. Состав в количестве примерно 50 мг/кг, 100 мг/кг или 200 мг/кг обычно вводят в виде однократной дозы. В случае новорожденных обычно достаточно одного или двух введений.
Хотя требуемая доза может изменяться в зависимости от тяжести респираторного заболевания и/или других переменных факторов, квалифицированный специалист в данной области может определить оптимальные диапазоны эффективных доз.
Настоящее изобретение также относится к фармацевтическим составам, содержащим реконструированный сурфактант по настоящему изобретению.
Указанные составы преимущественно вводят в форме раствора, дисперсии, суспензии или сухого порошка. Указанные композиции предпочтительно содержат реконструированный сурфактант, растворенный или суспендированный в физиологически приемлемом растворителе или ресуспендирующем носителе, таком как вода или водный раствор физиологического раствора (0,9% мас./об. NaCl).
Составы по настоящему изобретению предпочтительно используют в форме суспензии в водном растворе, предпочтительно стерильном, которая может необязательно включать буферы, регулирующие значение рН, разбавители и другие приемлемые добавки.
Вязкость указанных составов преимущественно составляет менее 20 сантипуаз (сР), предпочтительно менее 15 сР, при определении обычным вискозиметром, имеющимся на рынке сбыта, методами, известными в данной области.
Указанные составы могут быть помещены в упаковку для однократного или многократного приема, например, в запаянные ампулы или флаконы, или могут храниться в замороженном или лиофилизированном состоянии, требующем только добавления стерильного жидкого носителя непосредственно перед применением.
Реконструированный сурфактант по настоящему изобретению поставляется в виде стерильной суспензии в водном растворе забуференного физиологического раствора в стеклянных флаконах для однократного применения.
Фармацетические составы могут быть получены стандартными методами, хорошо известными в фармацевтической промышленности. Такие методы включают стадию смешивания полипептидов и фосфолипидов в присутствии органического растворителя. Растворитель затем удаляют при помощи диализа или выпаривания в атмосфере азота и/или в вакууме либо при помощи соответствующих методов, хорошо известных квалифицированному специалисту в данной области, таких как лиофилизация и распылительная сушка.
Полученный порошок затем равномерно распределяют в жидких носителях или тонко измельченных твердых носителях либо в тех и других вместе.
Смесь полипептидов и фосфолипидов может быть стерилизована до удаления растворителя, например, при помощи стерильной фильтрации. В других определенных вариантах осуществления изобретения композицию реконструированного сурфактанта в конечном счете стерилизируют методами, хорошо известными в данной области.
Реконструированный сурфактант по настоящему изобретению вводят способом, известным квалифицированному специалисту, например, при помощи внутритрахеальной инстилляции (вливание, болюс или через катетер), аэрозоля или распыления.
Как указано в настоящем описании изобретения, в объем настоящего изобретения входит использование как концентрированных, так и разведенных сурфактантных составов, в зависимости от конкретного применения, рассмотренного далее. Концентрированные сурфактантные композиции обычно используют для введения в виде “болюса”, и разведенные сурфактантные композиции обычно используют для введения в виде “лаважа”.
При введении в виде “болюса” концентрация реконструированного сурфактанта, измеряемая в единицах массы на мл раствора или суспензии (после добавления жидкого носителя), находится в пределах 5-100 мг/мл, предпочтительно 20-80 мг/мл.
В предпочтительном варианте осуществления изобретения концентрация реконструированного сурфактанта при введении путем внутритрахеальной инстилляции в виде суспензии в физиологическом растворе (0,9% мас./об. хлорида натрия в воде) равна примерно 80 мг/мл.
При введении в виде лаважа концентрация типичного сурфактанта равна примерно 0,1-20 мг/мл, более предпочтительно примерно 0,5-10 мг/мл (в единицах мг сурфактанта на мл раствора или суспензии).
В зависимости от концентрации вязкость разведенных составов будет еще ниже.
При терапевтическом введении составы, содержащие реконструированный сурфактант по настоящему изобретению, могут быть введены отдельно или необязательно вместе с другими соединениями или композициями, используемыми для лечения респираторных заболеваний или нарушений. Например, при лечении субъекта от нарушения дыхания, вызванного бактериальной инфекцией, реконструированный сурфактант по настоящему изобретению может быть введен вместе с другим соединением, применяемым для лечения бактериальной инфекции, таким как антибиотик.
В определенных случаях, например, для предотвращения осложнений, таких как бронхолегочная дисплазия, реконструированный сурфактант по настоящему изобретению может быть введен вместе с кортикостероидами, такими как будесонид и дипропионат беклометазона.
В определенных вариантах осуществления изобретения реконструированный сурфактант по настоящему изобретению и ресуспендирующий носитель могут быть отдельно упакованы в общую приемлемую емкость. Такая отдельная упаковка компонентов в приемлемую емкость также определяется как набор.
Поэтому настоящее изобретение также относится к набору, включающему: а) реконструированный сурфактант по настоящему изобретению в форме порошка в первой стандартной лекарственной форме; b) фармацевтически приемлемый носитель во второй стандартной лекарственной форме; и с) емкость, содержащую первую и вторую стандартные лекарственные формы.
Фармацевтически приемлемый носитель предпочтительно является водным раствором физиологического раствора, более предпочтительно стерильным раствором.
Как указано в настоящем описании изобретения, существуют разные методы введения реконструированного сурфактанта и составов на его основе по настоящему изобретению, которые хорошо известны специалисту в данной области.
В зависимости от типа заболевания, например, при лечении ребенка или взрослого, страдающего респираторным дистресс-синдромом, могут быть применены разные методы лечения.
Сурфактант обычно вводят субъекту путем эндотрахеальной инстилляции (например, недоношенным детям) в условиях вентиляции легких при постоянном или перемежающемся положительном давлении (IPPV).
Альтернативно сурфактант может быть введен при помощи тонкого катетера, помещенного в трахею, при этом дыхание субъекта поддерживается при помощи специально разработанных назальных устройств, таких как маски, конические раструбы или трубки, в соответствии с методом, известным как назальное постоянное давление в дыхательных путях (nCPAP).
Применение последнего метода возможно только при использовании сурфактанта с низкой вязкостью, так как высокая вязкость затрудняет прохождение сурфактанта по тонкому катетеру.
В тех случаях, когда субъект страдает респираторным дистресс-синдромом, ассоциированным с воспалением легких, инфекционным поражением легких или повреждением легкого, может быть рекомендована конкретная схема лечения. В одном таком терапевтическом методе проводят однократный или многократный лаваж легких субъекта, используя сурфактантную композицию по настоящему изобретению.
Реконструированный сурфактант по настоящему изобретению предназначен для предотвращения, замедления, ослабления, прекращения или подавления развития симптомов или состояний, ассоциированных с респираторным заболеванием.
Реконструированный сурфактант, в частности, пригоден для профилактики и/или лечения респираторного дистресс-синдрома (RDS) у недоношенных детей или других заболеваний, обусловленных недостаточностью или дисфункцией сурфактанта, включая острое поражение легкого (ALI), RDS у взрослых (ARDS), синдром мекониевой аспирации (MAS) и бронхолегочную дисплазию (BPD).
Реконструированный сурфактант может быть использован для профилактики и/или лечения других нарушений дыхания, таких как хроническая обструктивная болезнь легких (COPD), астма, респираторная инфекция (например, пневмония, пневмоцистоз, муковисцидоз и респираторно-синцитиальный вирус), а также для лечения серозного отита (экссудативный отит).
Настоящее изобретение далее более подробно иллюстрировано нижеследующими примерами.
Примеры
Пример 1. Получение реконструированных сурфактантов
Материалы
Были приобретены фосфолипиды 1,2-дипальмитоил-sn-глицеро-3-фосфохолин (DPPC), 1-пальмитоил-2-олеил-sn-глицеро-3-фосфоглицерин (POPG), L-α-фосфатидилхолины, выделенные из яичного желтка, с чистотой более 99% (далее именуемый чистый РС яичного желтка) и с чистотой около 40% (далее именуемый неочищенный РС яичного желтка). Фракцию фосфатидилхолина, выделенную из печени кролика (далее именуемую РС печени), отделяли хроматографией в устройстве Lipidex-5000 в соответствии с описанием, приведенным в публикации Curstedt T., Analysis of molecular species of ether analogues of phosphatidylcholines from biological samples. Biochim. Biophys. Acta 1977; 489:79-88.
Полипептиды SP-C33(Leu) и ox-Mini-B(Leu) были получены в соответствии с описанием, приведенным в публикации WO 2008/044109, и полипептид ox Mini-B27 был получен в соответствии с описанием, приведенным в публикации WO 2009/018908.
Получение реконструированных сурфактантов
Фосфолипиды, растворенные в хлороформе/метаноле в соотношении 98:2 (об./об.), смешивали с DPPC:POPG:РС яичного желтка (РС печени) в массовом соотношении 50:10:40.
Соответствующие составы на основе реконструированных сурфактантов (сурфактанты А и В) были получены путем добавления каждого полипептида в количестве 2% мас. Полученные сурфактанты упаривали в атмосфере азота и ресуспендировали в 0,9% мас./мас. водном растворе NaCl при концентрации 80 мг/мл.
Пример 2. Эксперимент, выполненный in vivo с использованием реконструированного сурфактанта, полученного из 2% ox Mini-B(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% PL печени
Недоношенных новорожденных кроликов (внутриутробный возраст плода 27 дней) при рождении подвергали воздействию 200 мг/кг состава на основе реконструированного сурфактанта (80 мг/мл). Животные, которым вводили такую же дозу альфа-порактанта (Curosurf™), были использованы в качестве положительных образцов и не подвергавшиеся воздействию однопометные животные служили в качестве отрицательных контрольных образцов. Легкие новорожденных кроликов вентилировали в соответствии со стандартной процедурой максимального давления инсуффляции. Для раскрытия легких сначала в течение 1 минуты было создано давление, равное 35 см Н2О. После первоначального рекруитмента давление было снижено до 25 см Н2О в течение 15 минут и затем до 20 и 15 см Н2О. Наконец давление было снова повышено до 25 см Н2О в течение 5 минут, после чего легкие вентилировали еще 5 минут азотом и иссекали для измерения объема газа. Указанные эксперименты выполняли без РЕЕР. Показатели дыхательного объема и объема газа в легких приведены в виде средних значений.
Легкие фиксировали путем погружения в 4% нейтральный формалин, обезвоживали и помещали в парафин. Поперечные срезы окрашивали гематоксилином и эоксином. Объемную плотность альвеол измеряли при помощи компьютерного анализатора изображений, используя полную паренхиму в качестве эталонного объема.
Полученные результаты показывают, что при использовании реконструированного сурфактанта, включающего фосфолипидную смесь на основе PL печени, DPPC и POPG в качестве синтетических фосфолипидов, по 2% SP-C33(Leu) и ox Mini-B(Leu), были получены такие же показатели дыхательного объема (фиг.1) и объема газа в легких (фиг.2), что и при использовании Curosurf™. Кроме того, из нижеследующей таблицы 3 видно, что указанный реконструированный сурфактант обеспечил достижение такой же объемной плотности альвеол, что и Curosurf™, причем данный показатель значительно превосходит результат, полученный при использовании только смеси фосфолипидов.
#р<0,02-0,0002 во всех группах за исключением реконструированного сурфактанта
Пример 3. Эксперимент, выполненный in vivo с использованием реконструированного сурфактанта, полученного из 2% ox Mini-B(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% неочищенного РС яичного желтка
Данный эксперимент был выполнен в соответствии с описанием, приведенным в примере 2.
Показатели дыхательного объема и объема газа в легких приведены на фиг.3 и 4 в виде средних значений.
Полученные результаты показывают, что реконструированный сурфактант, содержащий фосфолипидную смесь, включающую 50% DPPC, 40% РС яичного желтка и 10% POPG, характеризуется такими же показателями дыхательного объема и объема газа в легких, что и Curosurf™.
Пример 4. Эксперимент, выполненный in vivo с использованием реконструированного сурфактанта, полученного из 2% ox Mini-B(Leu) + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% чистого РС яичного желтка
Данный эксперимент был выполнен в соответствии с описанием, приведенным в примере 2.
Показатели дыхательного объема и объема газа в легких приведены на фиг.5 и 6 в виде средних значений.
Полученные результаты показывают, что даже при использовании чистого РС яичного желтка соответствующий реконструированный сурфактант характеризовался такими же показателями объема газа в легких, что и Curosurf™ и несколько меньшим, хотя и незначительно, дыхательным объемом.
Пример 5. Эксперимент, выполненный in vivo с использованием реконструированного сурфактанта, полученного из 2% ox Mini-B27 + 2% SP-C33(Leu) + 50% DPPC + 10% POPG + 40% чистого РС яичного желтка
Данный эксперимент был выполнен в соответствии с описанием, приведенным в примере 2. Однако в качестве аналога SP-B вместо ox Mini-B(Leu) был использован ox Mini-B27.
Данный полипептид является более коротким аналогом ox Mini-B(Leu) и позволяет получить вязкий состав при смешивании с фосфолипидной смесью, состоящей из DPPC:POPG с соотношением 7:3 (мас./мас.).
Показатели дыхательного объема и объема газа в легких приведены на фиг.7 и 8 в виде средних значений.
Указанный реконструированный сурфактант обеспечил достижение несколько меньшего дыхательного объема по сравнению с Curosurf™ при одинаковых показателях объема газа в легких. Кроме того, соответствующий состав в виде водной суспензии при концентрации 80 мг/мл характеризовался низкой вязкостью.
Пример 6. Эксперимент, выполненный in vivo при постоянных дыхательных объемах
Недоношенных новорожденных кроликов (внутриутробный возраст плода 27 дней) при рождении подвергали воздействию 200 мг/кг разных сурфактантных составов (80 мг/мл). Животные, которым вводили такую же дозу состава Сurosurf™, были использованы в качестве положительных образцов и не подвергавшиеся воздействию однопометные животные служили в качестве отрицательных контрольных образцов. Легкие новорожденных кроликов вентилировали под индивидуально подобранным давлением для достижения стандартизированного дыхательного объема. Был использован постоянный дыхательный объем, равный 6 мл/кг.
Для раскрытия легких сначала в течение 1 минуты было создано давление, равное 35 см Н2О. После первоначального рекруитмента давление было снижено для поддержания дыхательного объема, равного 6-8 мл/кг, в течение 30 минут. Эксперименты были выполнены без РЕЕР.
Были исследованы следующие образцы:
1. 50% DPPC + 40% РС яичного желтка + 10% POPG + 2% SP-C33(Leu) + 2% Mini-B27.
2. 50% DPPC + 40% РС яичного желтка + 10% POPG + 2% Mini-B(Leu).
3. Curosurf™.
4. Не подвергавшиеся воздействию контрольные образцы.
Показатели дыхательного объема и объема газа в легких приведены на фиг.9 и 10 в виде средних значений.
Следует отметить, что составы на основе реконструированных сурфактантов, содержащие Mini-B27 или Mini-B(Leu), обеспечивали достижение таких же объемов газа в легких, что и Curosurf™, при выполнении экспериментов, в которых легкие животных вентилировали физиологическими дыхательными объемами (примерно 6 мл/кг) без РЕЕР.







Изобретение относится к области биотехнологии, конкретно к реконструированному сурфактанту, что может быть использовано в медицине. Получают реконструированный сурфактант, включающий фосфолипидную смесь и комбинацию определенных аналогов нативного сурфактантного белка SP-C с аналогами нативного сурфактантного белка SP-B, который используют в фармацевтических композициях и наборах для лечения или профилактики респираторного дистресс-синдрома у недоношенных младенцев и других нарушений дыхания. Изобретение позволяет осуществлять эффективную терапию заболеваний, обусловленных недостаточностью или дисфункцией сурфактанта. 4 н. и 7 з.п. ф-лы, 10 ил., 3 табл., 6 пр.
1. Реконструированный сурфактант, включающий:
(a) фосфолипидную смесь;
(b) полипептидный аналог нативного сурфактантного белка SP-B; и
(c) полипептидный аналог нативного сурфактантного белка SP-C, представленный формулой (I):
(SEQ ID NO:1)
IPSSPVHLKRLKLLLLLLLLILLLILGALLΩPGPLP (I)
где:
Ω означает аминокислоту, выбираемую из группы, состоящей из М или М, окисленного в положении атома серы, I, L и nL;
р означает 0 или 1;
при этом указанная фосфолипидная смеcь включает:
i) дипальмитоилфосфатидилхолин (DPPC) в количестве 50% мас.;
ii) пальмитоилолеоилфосфатидилглицерин (POPG) в количестве 10% мас.; и
iii) природную фракцию ненасыщенных фосфолипидов в количестве 40% мас., по существу состоящую из:
30-50% мас. пальмитоилолеоилфосфатидилхолина (POPC),
10-20% мас. пальмитоиллинолеоилфосфатидилхолина (PLPC),
4-10% мас. пальмитолеоилолеоилфосфатидилхолина (Р(:1)ОРС),
5-8% мас. стеароиллинолеоилфосфатидилхолина (SLPC),
5-8% мас. диолеоилфосфатидилхолина (DOPC),
1-3% мас. стеароиларахидоноилфосфохолина (SAPC),
5-15% мас. стеароилолеоилфосфатидилхолина (SOPC),
1-2% мас. пальмитоиларахидоноилфосфохолин (PAPC),
1-3% мас. пальмитоилдокозагексаеноилфосфатидилхолина (PDPC),
0-3,5% мас. стеароилолеоилфосфатидилэтаноламина (SOPE),
0-8% мас. стеароиларахидоноилфосфатадилэтаноламина (SAPE),
0-4% мас. стеароиллинолеоилфосфатидилэтаноламина (SLPE),
0-2,5% мас. пальмитоиллинолеоилфосфатидилэтаноламина (PLPE),
0-3,5% мас. 1-пальмитоил-2-олеоилфосфатидилэтаноламина (POPE),
0-2,0% мас. линолеоиларахидоноилфосфатадилэтаноламина (LAPE),
0-2,0% мас. дилинолеоилфосфатидилэтаноламин (DLPE),
0-10% мас. N-пальмитоил-D-сфингозилфосфорилхолина (PSM);
все количества, указанные в пунктах i), ii) и iii) вычислены на основании общей массы фосфолипидной смеси,
где полипептидный аналог нативного сурфактантного белка SP-B представлен формулой (II):
(SEQ ID NO:8)
(FPθPLPY)fCΔLCRALIKRIQAΩIPKGGRΩLPQLVCRLVLΦCS (II)
где:
θ означает аминокислотный остаток, выбираемый из группы, состоящей из L, I и С,
Δ означает аминокислотный остаток, выбираемый из группы, состоящей из W, I и L,
Ω означает аминокислотный остаток, независимо выбираемый из группы, состоящей из M, I, L и nL,
Φ означает аминокислотный остаток, выбираемый из группы, состоящей из R и Т,
f означает целое число, равное 0 или 1,
который, когда f равно 0, может быть в форме молекулы, связанной дисульфидной связью, в которой внутримолекулярная дисульфидная связь расположена между двумя остатками С в положениях 1 и 33 и/или между двумя остатками С в положениях 4 и 27, или
который, когда f равно 1, может быть в форме циклической молекулы, в которой связь расположена между остатками С в положениях 8 и 40 и/или между остатками С в положениях 11 и 34.
2. Реконструированный сурфактант по п.1, в котором полипептидный аналог нативного сурфактантного белка SP-C имеет последовательность, представленную формулой Ic:
(SEQ ID NO:4)
IPSSPVHLKRLKLLLLLLLLILLLILGALLLGL (Ic).
3. Реконструированный сурфактант по п.1, в котором полипептидный аналог формулы (II) представлен формулой (IIa), формулой (IIb), формулой (IIc) или формулой (IId):
(SEQ ID NO:9)
CWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIa)
(SEQ ID NO:10)
CLLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIb)
(SEQ ID NO:11)
CWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIc)
(SEQ ID NO:12)
CLLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IId)
который может быть в форме молекулы, связанной дисульфидной связью, в которой внутримолекулярная дисульфидная связь расположена между двумя остатками С в положениях 1 и 33 и/или между двумя остатками С в положениях 4 и 27.
4. Реконструированный сурфактант по п.1, в котором полипептидный аналог формулы (II) представлен формулой (IIe), формулой (IIf), формулой (IIg) или формулой (IIh):
(SEQ ID NO:13)
FPCPLPYCWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIe)
(SEQ ID NO:14)
FPIPLPYCWLCRALIKRIQAMIPKGGRMLPQLVCRLVLRCS (IIf)
(SEQ ID NO:15)
FPCPLPYCWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIg)
(SEQ ID NO:16)
FPIPLPYCWLCRALIKRIQALIPKGGRLLPQLVCRLVLRCS (IIh),
который может быть в форме циклической молекулы, в которой связь расположена между остатками С в положениях 8 и 40 и/или между остатками С в положениях 11 и 34.
5. Реконструированный сурфактант по любому из пп.1-4, в котором природная фракция ненасыщенных фосфолипидов является L-α-фосфатидилхолином, выделенным из яичного желтка.
6. Фармацевтический состав для лечения или профилактики респираторного дистресс-синдрома у недоношенных младенцев либо для лечения или профилактики других заболеваний, обусловленных недостаточностью или дисфункцией сурфактанта, содержащий эффективное количество реконструированного сурфактанта по любому из пп.1-5 и один или несколько фармацевтически приемлемых носителей.
7. Фармацевтический состав по п.6, где указанный состав находится в форме водной суспензии.
8. Фармацевтический состав по п.7, в котором реконструированный сурфактант присутствует в концентрации 5-100 мг/мл водной суспензии.
9. Набор для применения в лечении или профилактике респираторного дистресс-синдрома у недоношенных младенцев либо в лечении или профилактике других заболеваний, обусловленных недостаточностью или дисфункцией сурфактанта, включающий:
а) реконструированный сурфактант по любому из пп.1-5 в форме порошка в виде первой стандартной лекарственной формы;
b) фармацевтически приемлемый носитель в виде второй стандартной лекарственной формы; и
с) емкость для указанных первой и второй лекарственных форм.
10. Способ лечения или профилактики респираторного дистресс-синдрома у недоношенных младенцев либо для лечения или профилактики других заболеваний, обусловленных недостаточностью или дисфункцией сурфактанта, включающий введение эффективного количества реконструированного сурфактанта по любому из пп.1-5.
11. Способ по п.10, где указанное другое заболевание представляет собой респираторный дистресс-синдром у взрослых, синдром мекониевой аспирации и бронхолегочную дисплазию.
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Экономайзер | 1927 |
|
SU8039A1 |
| PELIZZI N | |||
| et al., Different electrospray tandem mass spectrometric approaches for rapid characterization of phospholipid classes of Curosurf, a natural pulmonary surfactant, Rapid Commun | |||
| Mass Spectrom., 2002, v.16, p.2215-2220, реферат, стр.2215-2219. | |||
Авторы
Даты
2018-05-31—Публикация
2013-11-20—Подача