Область техники
Изобретение относится к новым аминокислотам ряда изоксазола, содержащим аминогруппу в 5-ом положении гетероцикла, карбоксильную группу (или группу биоизостерную карбоксильной, в частности, фосфонатную) в 3-ом положении изоксазольного фрагмента и являющимся в силу своего строения конформационно-жесткими аналогами γ-аминомасляной кислоты (ГАМК), а также к способу их получения. Подобное расположение фармакофорных групп относительно конформационно-жесткого фрагмента позволяет зафиксировать новые конформации ГАМК, что может иметь перспективу с точки зрения поиска соединений с улучшенной селективностью по отношению к биомишеням ГАМК.
Уровень техники
ГАМК является важнейшим тормозным нейромедиатором центральной нервной системы (ЦНС) человека и млекопитающих; принимает участие в нейромедиаторных и метаболических процессах в мозге, играя ведущую роль в патогенезе тревоги, судорог и многих других патологических состояний ЦНС [Н. The rise of new GABA pharmacology // Neuropharmacology, 2011, Vol. 60, №7-8, P. 1042-1049].
The rise of new GABA pharmacology // Neuropharmacology, 2011, Vol. 60, №7-8, P. 1042-1049].
Интерес к синтезу конформационно-жестких (конформационно-ограниченных) аналогов ГАМК обусловлен тем, что соединения данной группы могут обладать высокой селективностью по отношению к отдельным биомишеням ГАМК. Создание конформационно-жестких аналогов природных физиологически-активных веществ (ФАВ) на основе соединений, содержащих ароматический гетероциклический фрагмент, является современным приемом медицинской химии по созданию селективных синтетических ФАВ [Giomi, D.; Cordero, F.M.; Machetti, F. In Comprehensive Heterocyclic Chemistry; Katritzky, A.R.; Ramsden, C.A.; Scriven, E.F.V.; Taylor, R.J.K, Eds.; Elsevier: Oxford, 2008; Vol. 4, 365]. Важную роль здесь играют изоксазолсодержащие соединения, поскольку они обладают разнообразной физиологической активностью, в частности 5-аминометилизоксазолы проявляют высокую агонистическую активность по отношению к ГАМК-рецепторам [P. Krogsgaard-Larsen, G.A. Johnston, D. Lodge, D.R. Curtis. A new class of GABA agonist. Nature, 1977, Vol. 268, P. 53-55; K. A Wafford, B. Ebert. Gaboxadol - a new awakening in sleep // Cur. Opin. Pharm. 2006, Vol. 6, P. 30-36].
Наиболее близкой к предлагаемому по технической сущности является 3-аминоизоксазолкарбоновая кислота 2 [A.P. Combs, В.М. Glass, R.B. Sparks, E.W. Yue. N-Hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase. Patent WO 2008/036653, 2008], содержащая изоксазольный фрагмент, синтез которой основан на реакции гетероциклизации метилового или этилового эфира 3-циано-2-метоксиакриловой кислоты 3 с гидроксимочевиной под действием металлического натрия с последующим кипячением образующегося метилового или этилового эфира 3-амино-5-метоксиизоксазололинкарбоновой кислоты 4 с концентрированной HCl [F. Lepage, В. Hublot, P.S. Adolphe. Preparation de derives de 3-aminoisoxazole et nouveaux 3-aminoisoxazoles intermediaries. Patent FR 2750425, 1998]. Образующийся в результате этих реакций этиловый эфир 3-аминоизоксазолкарбоновой кислоты 5 был подвергнут гидролизу гидроксидом лития в смеси растворителей ацетонитрил-вода [А.Р. Combs, В.М. Glass, R.B. Sparks, E.W. Yue. N-Hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase. Patent WO 2008/036653, 2008]. Исходный эфир 3 был получен реакцией конденсации диметил- или диэтилоксалата с ацетонитрилом под действием гидрида натрия [F. Lepage, В. Hublot, P.S. Adolphe. Preparation de derives de 3-aminoisoxazole et nouveaux 3-aminoisoxazoles intermediaries. Patent FR 2750425, 1998].
Существенным недостатком известного способа получения 3-аминоизоксазолкарбоновой кислоты 2, изложенного в работах [А.Р. Combs, В.М. Glass, R.B. Sparks, E.W. Yue. N-Hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase. [Patent WO 2008/036653, 2008; F. Lepage, B. Hublot, P.S.Adolphe. Preparation de derives de 3-aminoisoxazole et nouveaux 3-aminoisoxazoles intermediaries. Patent FR 2750425, 1998], является невозможность варьирования строения синтезируемой аминокислоты 2, т.е. указанным методом, например, нельзя получить аминокислоты, в которых аминогруппа была бы расположена в 5-ом положении гетероцикла, а карбоксильная группа - в 3-ом положении изоксазольного фрагмента, хотя аминокислоты с таким расположением фармакофорных групп перспективны с точки зрения поиска соединений с улучшенной селективностью по отношению к биомишеням ГАМК.
Таким образом, из анализа источников информации следует, что в настоящее время отсутствуют методы синтеза 5-аминоизоксазолкарбоновых кислот.
Другим недостатком известного метода синтеза изоксазолсодержащих аминокислот 2 является невозможность использования предложенных в работах подходов для получения биоизостерных (в частности, фосфоновых) конформационно-жестких аналогов ГАМК, т.к. используемое на стадии гетероциклизации взаимодействие метилового или этилового эфира 3-циано-2-метоксиакриловой кислоты 3 с гидроксимочевиной делает дальнейшее введение в получаемый гетероциклический фрагмент группы, биоизостерной карбоксильной (в частности, фосфонатной группы), принципиально невозможной при сохранении в структуре свободной аминогруппы.
На основании изучения источников информации можно сделать вывод о том, что в настоящее время отсутствуют методы синтеза биоизостерных (в частности, фосфоновых) конформационно-жестких аналогов ГАМК, содержащих изоксазольный фрагмент.
Раскрытие изобретения
Задачей настоящего изобретения является получение новых производных 5-аминоизоксазола - конформационно-жестких аналогов γ-аминомасляной кислоты и разработка способов их получения.
Поставленная задача достигается получением изоксазолсодержащей аминокислоты общей формулы 1:
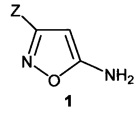 ,
,
где Z=СО2Н (формула 1а) и Z=РО3Н2 (формула 1b).
Также поставленная задача решается способом получения новых 5-аминоизоксазол-3-карбоновой кислоты (1а) и 5-аминоизоксазол-3-фосфоновой кислоты (1b), заключающимся в том, что замещенные сложноэфирной группой алкены обрабатываются 1,5-2,5-кратным избытком диизопропиламин и 1,5-3-кратным избытком тетранитрометана, образующиеся при этом нитроэфиры восстанавливаются не разрушающей изоксазольный фрагмент хемоселективной системой [Glatthar R., Hintermann S., Vranesic I-T., Fused Pyrimidinone Compounds as MGLUR Ligands. WO 2008/107418 2008; Yashin N.V., Averina E.B., Grishin Y.K., Kuznetsova T.S., Zefirov N.S. Reduction of 1-Nitrospiro[2.2]pentanecarboxylates: Convenient Synthesis of Novel Polyspirocyclic Cyclopropane Amino Acids. Synthesis 2006, 279-284], содержащей 2-20-кратный по отношению к нитроэфиру избыток восстановителя, с последующим гидролизом полученных аминоэфиров. Для получения производных 5-аминоизоксазола при Z=СО2Н в качестве замещенных сложноэфирной группой алкенов используют метиловый или трет-бутиловый эфиры акриловой кислоты, а для получения производных 5-аминоизоксазола при Z=РО3Н2 в качестве замещенного сложноэфирной группой алкена используют диэтиловый эфир винилфосфоновой кислоты. При этом способ включает использование в качестве хемоселективных систем для восстановления нитроэфиров 30-40% (по массе) суспензию цинка в уксусной кислоте, содержащую 5-15-кратный избыток цинка (восстановителя) по отношению к нитроэфиру, 30-50% мас. суспензию хлорида олова (II) в 96% об. водном этаноле, содержащую 5-20-кратный избыток хлорида олова (II) по отношению к нитроэфиру, 2-10% мас. раствор дитионита натрия в 30-70% об. водном метаноле, содержащий 2-10-кратный избыток дитионита натрия по отношению к нитроэфиру, а также использование 1-3% мас. раствора моногидрата гидроксида лития в смеси взятых в соотношении 3:1 тетрагидрофурана и воды, содержащего 5-10-кратный избыток гидроксида лития по отношению к аминоэфиру, или 30-65% мас. раствора уксусной кислоты, содержащего 50-100-кратный избыток уксусной кислоты по отношению к аминоэфиру в условиях микроволнового содействия для гидролиза аминоэфиров карбоновых кислот (Z=СО2Н) и 3-10-кратного избытка триметилсилилиодида с дальнейшей обработкой полученной смеси 75% об. раствором пропиленоксида в метаноле, содержащим 20-40 кратный избыток пропиленоксида по отношению к аминоэфиру для гидролиза аминоэфиров фосфоновых кислот (Z=PO3H2).
Техническим результатом изобретения является получение новых аминокислот, содержащих фрагмент 5-аминоизоксазола и изоксазолфосфоновый фрагмент - биоизостерных конформационно-жестких аналогов ГАМК. Полученные изоксазолсодержащие аминокислоты представляют собой конформационно-жесткие аналоги γ-аминомасляной кислоты, где фармакофорные группы (карбокси- и фосфонатная группа в 3-ем положении и аминогруппа в 5-ом положении) жестко закреплены относительно изоксазольного фрагмента. Получение соединений с ограниченной конформационной подвижностью может иметь хорошую перспективу с точки зрения поиска соединений с улучшенной селективностью по отношению к биомишеням ГАМК. В отличие от ациклических аналогов полученные аминокислоты имеют фиксированные конформации, что может обеспечить оптимальное связывание данных соединений с рецепторами ГАМК.
Осуществление изобретения
Все используемые реагенты являются коммерчески доступными, все процедуры, если не оговорено особо, осуществляли при комнатной температуре или температуре окружающей среды, то есть в диапазоне от 18 до 25°С; выпаривание растворителя осуществляли с использованием роторного испарителя, при пониженном давлении при температуре бани примерно 50°С; контроль за ходом реакции осуществляли при помощи тонкослойной хроматографии (ТСХ), и время реакции указано только для иллюстрации; структуру и чистоту всех выделенных соединений подтверждали, по меньшей мере, одним из следующих методов: ТСХ (пластины для ТСХ с предварительно нанесенным силикагелем 60 F254 Merck), масс-спектрометрия или ядерный магнитный резонанс (ЯМР). Выход продукта приведен только для иллюстрации. Колоночную флэш-хроматографию осуществляли, используя Merck силикагель 60 (230-400 меш ASTM). Масс-спектры высокого разрешения (HRMS) положительных ионов зарегистрированы на спектрометре Jeol GCMate II при энергии ионизации 70 eV. Спектры ЯМР регистрировали на приборах Bruker Avance-400 (рабочая частота 400.1 и 100.6 МГц для 1Н и 13С соответственно) и Agilent 400-MR (рабочая частота 400.0 и 100.6 МГц для 1Н и 13С соответственно), используя дейтерированный хлороформ (99,8% D), или метанол (99,8% D), или воду (99,9% D) в качестве растворителя, если не указано иное, относительно тетраметилсилана (TMS) в качестве внутреннего стандарта, миллионных долях (м.д.); обычные используемые сокращения следующие: с - синглет, д - дублет, т - триплет, кв - квартет, м - мультиплет, шир. - широкий и так далее. Химические символы имеют свои обычные значения: мкм (микрометр(ы)), мкл (микролитр(микролитры)), мкг (микрограмм(микрограммы)), М (моль(моли) на литр), л (литр(литры)), мл (миллилитр(миллилитры)), г (грамм(граммы)), мг (миллиграмм(миллиграммы)), моль(моли), ммоль (миллимоль(миллимоли)). Термин «гидролиз» означает химическую реакцию сложных эфиров с водой или иным(и) реагентом(ами) с образованием соответствующей кислоты [Laufer S., Margutti S., Fritz M. Substituted Isoxazoles as Potent Inhibitors of p38 MAP Kinase. Chem. Med. Chem. 2006, 197-207; Hao J., Reinhard M., Henry S., Seest E., Belvo M., Monn J. Simple conversion of fully protected amino to zwitterions. Tetrahedron Lett. 2012, 53, 1433-1434; Fadel A. A Useful Synthesis of 1-Aminocyclopropanephosphonic Acid from Cyclopropanone Acetal. J. Org. Chem. 1999, 64, 4953-4955].
Способ получения производных 5-аминоизоксазола в общем виде представляет собой 3-стадийный синтез, где на первой стадии в результате взаимодействия 10-20% диоксанового раствора тетранитрометана, взятого в 1.5-3 кратном избытке по отношению к замещенному сложноэфирной группой алкену, при охлаждении до (-5)-5°С по каплям добавляют третичный амин, взятый в 1.5-2.5 кратном избытке по отношению к замещенному сложноэфирной группой алкену. Полученную смесь перемешивают при охлаждении 3-10 мин, после чего добавляют замещенный сложноэфирной группой алкен. Затем охлаждение убирают и реакционную смесь продолжают перемешивать при комнатной температуре в течение 15-40 часов. Далее растворитель отгоняют при пониженном давлении, остаток выдерживают при 50±5°С при 1±0.5 мм рт. ст. в течение 1-3 часов. Полученный нитроэфир используют в следующей стадии без дополнительной очистки. В качестве третичных аминов могут быть использованы диизопропилэтиламин, триэтиламин, трибутиламин, пиридин.
На второй стадии синтеза интенсивно перемешивают смесь полученного нитроэфира и не разрушающей изоксазольный фрагмент хемоселективной системы, содержащей 2-20 кратный избыток восстановителя по отношению к нитроэфиру, в атмосфере аргона при температуре (-10)-0°С. В качестве восстановителя используют системы: 30-40 мас. % суспензию цинка в уксусной кислоте, 30-50% мас. раствор хлорида олова (II) в 96% об. водном этаноле или 2-10% мас. раствор дитионита натрия в 30-70% об. водном метаноле. Реакционную смесь перемешивают в течение 4-6 ч, затем, при необходимости, смесь фильтруют через бумажный фильтр, растворитель отгоняют при пониженном давлении, остаток растворяют в 15-30 мл хлороформа и промывают насыщенным раствором гидрокарбоната натрия до достижения рН 7-8. Водный раствор несколько раз экстрагируют хлороформом, полученный экстракт высушивают над MgSO4, растворитель отгоняют при пониженном давлении, остаток очищают фильтрованием через слой силикагеля. В результате реакции получают аминоэфир, который подвергают реакции гидролиза (3-я стадия). Спектр ЯМР полученного производного 5-аминоизоксазола регистрируют на приборах Bruker Avance-400 или Agilent 400-MR.
Соотношение компонентов, указанных в избытках, подразумевают мольное соотношение компонентов по отношению друг к другу.
Приведенные примеры конкретного осуществления изобретения приведены для предоставления специалистам в данной области техники полного описания проведения и применения анализа по изобретению, и подразумевают, что приведенные примеры не ограничивают предполагаемый авторами изобретения объем изобретения.
Пример 1. Получение 5-аминоизоксазол-3-карбоновой кислоты (1а)
Метиловый эфир 5-нитроизоксазол-3-карбоновой кислоты (6)
К раствору 0.30 мл (2.5 ммоль) тетранитрометана в 2 мл диоксана при охлаждении до 0°С добавили по каплям 0.26 г (2.0 ммоль) диизопропилэтиламина. Полученную смесь перемешивали при охлаждении 5 мин, после чего добавили 0.086 г (1.0 ммоль) метилового эфира акриловой кислоты. Затем охлаждение убрали и перемешивали реакционную смесь при комнатной температуре в течение 20 часов. Растворитель отогнали при пониженном давлении, остаток выдержали при 50°С при 1 мм рт. ст. в течение 2 часов, получили 0.15 г (87%) нитроэфира 6, который использовали в следующей стадии без дополнительной очистки.
Спектр 1Н ЯМР (CDCl3, δ м.д.): 4.05 (с, 3Н, СН3), 7.41 (с, 1H, СН).
Метиловый эфир 5-аминоизоксазол-3-карбоновой кислоты (7).
К интенсивно перемешиваемой смеси 80 мг (0.47 ммоль) 5-нитроизоксазола 6 и 0.6 мл (10.2 ммоль) уксусной кислоты в 4 мл изопропилового спирта в атмосфере аргона при температуре (-10) - 0°С быстро прибавили 296 мг (4.7 ммоль) цинка. Реакционную смесь перемешивали в течение 4 ч, затем отфильтровали через бумажный фильтр, растворитель отгоняли при пониженном давлении, остаток растворяли в 20 мл хлороформа и промывали насыщенным раствором гидрокарбоната натрия (до рН 8). Водный раствор экстрагировали CHCl3 (3×10 мл), экстракт сушили над MgSO4, растворитель отгоняли при пониженном давлении, остаток очищали фильтрованием через 5 мл силикагеля (элюент CHCl3). Получили 55 мг (82%) аминоэфира 7.
Спектр 1Н ЯМР (CDCl3, δ м.д.): 3.93 (с, 3Н, СН3), 4.63 (уш.с, 2H, NH2), 5.55 (с, 1H, СН). Спектр 13С ЯМР (CD3OD/CDCl3, δ, м.д.): 52.4 (СН3), 79.4 (СН), 156.8 (С), 161.1 (С), 171.1 (С). HRMS (ESI, m/z) рассчитано для C5H7N2O3+[М+Н]+, 143.0457; найдено, 143.0452.
5-Аминоизоксазол-3-карбоновая кислота (1а)
К раствору 50 мг (0.35 ммоль) аминоэфира 7 в 12 мл смеси ТГФ-вода (3:1) добавили одной порцией 145 мг (3.5 ммоль) LiOH⋅H2O. Смесь перемешивали при комнатной температуре в течение 5 ч, органический слой отделяли. В водный слой добавляли 0.2N раствор HCl до рН 5. Растворитель отгоняли при пониженном давлении. Получили 32 мг (71%) аминокислоты 1а.
Спектр 1Н ЯМР (D2O, δ м.д.): 5.39 (с, 1H, СН). Спектр 13С ЯМР (D2O, δ м.д.): 80.4 (СН), 162.3 (С), 167.2 (С=O), 171.1 (CNH2).
Пример 2. Получение 5-аминоизоксазол-3-карбоновой кислоты (1а)
Трет-Бутиловый эфир 5-нитроизоксазол-3-карбоновой кислоты (8)
К раствору 0.30 мл (2.5 ммоль) тетранитрометана в 2 мл диоксана при охлаждении до 0°С добавили по каплям 0.26 г (2.0 ммоль) диизопропилэтиламина. Полученную смесь дополнительно перемешивали при охлаждении 5 мин, после чего добавили 0.128 г (1.0 ммоль) трет-бутилового эфира акриловой кислоты. Затем охлаждение убрали и перемешивали реакционную смесь при комнатной температуре в течение 20 часов. Растворитель отогнали при пониженном давлении, остаток выдержали при 50°С при 1 мм рт. ст. в течение 2 часов, получили 0.180 г (84%) нитроэфира 8, который использовали в следующей стадии без дополнительной очистки.
Спектр 1H ЯМР (CDCl3, δ м.д.): 1.65 (с, 9Н, 3СН3), 7.34 (с, 1Н, СН).
Трет-Бутиловый эфир 5-аминоизоксазол-3-карбоновой кислоты (9)
К интенсивно перемешиваемой смеси 100 мг (0.47 ммоль) 5-нитроизоксазола 8 и 0.6 мл (10.2 ммоль) уксусной кислоты в 4 мл изопропилового спирта в атмосфере аргона при температуре (-10) - 0°С быстро прибавили 296 мг (4.7 ммоль) цинка. Реакционную смесь перемешивали в течение 4 ч, затем отфильтровали через бумажный фильтр, растворитель отгоняли при пониженном давлении, остаток растворяли в 20 мл хлороформа и промывали насыщенным раствором гидрокарбоната натрия (до рН 8). Водный раствор экстрагировали CHCl3 (3×10 мл), экстракт сушили над MgSO4, растворитель отгоняли при пониженном давлении, остаток очищали фильтрованием через 5 мл силикагеля (элюент CHCl3). Получили 75 мг (87%) аминоэфира 9.
Спектр 1Н ЯМР (CDCl3, δ м.д.): 1.59 (с, 9Н, 3СН3), 4.55 (уш.с, 2Н, NH2), 5.48 (с, 1H, СН). Спектр 13С ЯМР (CDCl3, δ, м.д.): 28.0 (3×СН3), 80.7 (СН), 83.2 (С), 158.8 (С), 159.5 (С), 169.4 (С). HRMS (ESI, mlz) рассчитано для C8H13N2O3+ [М+Н]+, 185.0926; найдено, 185.0921.
5-Аминоизоксазол-3-карбоновая кислота (1а)
К раствору 50 мг (0.27 ммоль) аминоэфира 9 в смеси 1.4 мл уксусной кислоты и 2.6 мл воды нагревали до 160°С в бытовой микроволновой печи в течение 3 мин. Реакционную смесь охлади до комнатной температуры, растворитель удаляли, остаток сушили в вакууме. Получили 17 мг (49%) аминокислоты 1а.
Спектр 1Н ЯМР (D2O, δ м.д.): 5.39 (с, 1H, СН). Спектр 13С ЯМР (D2O, δ м.д.): 80.4 (СН), 162.3 (С), 167.2 (С=O), 171.1 (CNH2).
Пример 3. Получение 5-аминоизоксазол-3-фосфоновой кислоты (1b)
Диэтиловый эфир 5-нитроизоксазол-3-фосфоновой кислоты (10)
К раствору 0.30 мл (2.5 ммоль) тетранитрометана в 2 мл диоксана при охлаждении до 0°С добавили по каплям 0.26 г (2.0 ммоль) диизопропилэтиламина. Полученную смесь дополнительно перемешивали при охлаждении 5 мин, после чего добавили 0.164 г (1.0 ммоль) диэтилового эфира фосфоновой кислоты. Затем охлаждение убрали и перемешивали реакционную смесь при комнатной температуре в течение 20 часов. Растворитель отогнали при пониженном давлении, остаток выдержали при 50°С при 1 мм рт. ст. в течение 2 часов, получили 0.22 г (88%) нитроэфира 10, который использовали в следующей стадии без дополнительной очистки.
Спектр 1H ЯМР (CDCl3, δ м.д.): 1.40 (т, 3J=7.2 Гц, 6Н, 2СН3), 4.26-4.35 (м, 4Н, 2СН2), 7.26 (с, 1H, СН). Спектр 31Р ЯМР (CDCl3, δ м.д.); -0.10.
Диэтиловый эфир 5-аминоизоксазол-3-фосфоновой кислоты (11)
К раствору 150 мг (0.6 ммоль) 5-нитроизоксазола 10 в 2 мл этанола при перемешивании постепенно прибавили 1.134 г (6 ммоль) хлорида олова (II). Реакционную смесь перемешивали в течение 4 ч. Растворитель отгоняли при пониженном давлении, остаток растворяли в 15 мл хлороформа и нейтрализовали насыщенным водным раствором гидрокарбоната натрия (до рН 7-8). Водный раствор экстрагировали CHCl3 (3×20 мл), объединенный органический экстракт сушили над MgSO4, растворитель отгоняли при пониженном давлении. Остаток очищали фильтрованием через 5 мл силикагеля (элюент CHCl3). Получили 120 мг (91%) аминоэфира 11.
Спектр 1Н ЯМР (CDCl3, δ м.д.): 1.37 (т, 3J=7,1 Гц, 6Н, 2СН3), 4.19-4.27 (м, 4Н, 2СН2), 4.94 (уш.с, 2Н, NH2), 5.41 (с, 1H, СН). Спектр 13С ЯМР (CDCl3, д, м.д.): 16.2 (2СН3), 63.5 (2СН2), 82.1 (СН), 156.6 (С), 169.9 (С). Спектр 31Р ЯМР (CDCl3, δ м.д.): 5.47. HRMS (ESI, mlz) рассчитано для C7H14N2O4P+ [М+Н]+, 221.0691; найдено, 221.0694.
5-Аминоизоксазол-3-фосфоновая кислота (1b)
В раствор 60 мг (0.28 ммоль) аминофосфоната 11 в атмосфере аргона добавили по каплям 336 мг (1.68 ммоль) триметилсилилиодида. Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Растворитель отгоняли при пониженном давлении, к остатку добавили 1.0 мл метанола и 3.0 мл пропиленоксида. Реакционную смесь охладили до 0-5°С. Выпавший осадок отфильтровали и промыли холодным метанолом (3×1 мл).
Выход 8 мг (17%) аминокислоты 1b.
Спектр 1Н ЯМР (D2O, δ м.д.): 5.50 (с, 1H, СН). Спектр 13С ЯМР (D2O, δ м.д.): 78.1 (СН), 164.5 (С), 172.6 (CNH2). Спектр 31Р ЯМР (D2O, δ м.д.): 15.22.
Пример 4. Получение 5-аминоизоксазол-3-карбоновой кислоты (1а) проводят аналогично примеру 1, при этом для восстановления 5-нитроизоксазола 6 используют 3-кратный избыток дитионита натрия в виде 5% раствора в метаноле.
Методом молекулярного докинга был проведен анализ возможных способов связывания различных стереоизомеров аминокислот 1а и 1b с рецептором ГАМКС. Модель сайта связывания ГАМК с рецептором была построена ранее и оптимизирована методом моделирования молекулярной динамики; согласно этим данным,карбоксильная группа ГАМК образует водородную связь с Tyr198 и солевой мостик с остатком Arg104, а протонированная аминогруппа - солевые мостики с остатками Glu194 и Glu196. Расположение изомеров аминокислот 1а и 1b в сайте связывания близко к способу связывания ГАМК, для всех изомеров реализуются указанные водородных связи, что позволяет ожидать сходного с ГАМК механизма действия на ГАМК-рецепторы.
Для синтезированных производных 5-аминоизоксазола 1а и 1b были проведены предварительные эксперименты по изучению психотропного действия. Эксперименты проводились на половозрелых крысах-самцах, выращенных в питомнике РАН «Рапполово». Для сравнения действия использовали фармацевтический препарат Феназепам в дозировке 1 мг/кг. Контрольная группа крыс получала воду для инъекций (1 мл/кг). Установлено, что при внутрибрюшинном введении соединений 1а и 1b в дозе 1 мг/кг для обоих соединений наблюдалось выраженное антиагрессивное действие, сопоставимое с действием Феназепама.
| название | год | авторы | номер документа |
|---|---|---|---|
| ПРОИЗВОДНЫЕ 5-АМИНОИЗОКСАЗОЛА - КОНФОРМАЦИОННО-ЖЕСТКИЕ АНАЛОГИ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ И СПОСОБ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2638530C2 |
| СПИРО[2.3]ГЕКСАНОВЫЕ АМИНОКИСЛОТЫ - КОНФОРМАЦИОННО-ЖЕСТКИЕ АНАЛОГИ γ-АМИНОМАСЛЯНОЙ КИСЛОТЫ - И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2016 |
|
RU2629357C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-АМИНОСПИРО[2.3]ГЕКСАН-1-КАРБОНОВОЙ КИСЛОТЫ | 2017 |
|
RU2659404C1 |
| ЗАМЕЩЁННЫЕ ИЗОКСАЗОЛЫ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ, ОБЛАДАЮЩИЕ ПРОТИВОВИРУСНОЙ АКТИВНОСТЬЮ, И СПОСОБ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2733945C2 |
| СПИРОЦИКЛИЧЕСКИЕ ЦИКЛОПРОПАНОВЫЕ АМИНОКИСЛОТЫ - АНАЛОГИ ГАММА-АМИНОМАСЛЯНОЙ КИСЛОТЫ, С ОГРАНИЧЕННОЙ КОНФОРМАЦИОННОЙ ПОДВИЖНОСТЬЮ И ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ НА ИХ ОСНОВЕ | 2011 |
|
RU2468000C2 |
| СПОСОБ ПОЛУЧЕНИЯ 5-ЗАМЕЩЁННЫХ 1,2,4-ТРИАЗОЛ-3-КАРБОНОВЫХ КИСЛОТ И ИХ ПРОИЗВОДНЫХ ИЗ УНИВЕРСАЛЬНОГО ПРЕДШЕСТВЕННИКА | 2015 |
|
RU2605414C1 |
| Пирроло[1,2-a]пиразин-содержащие лиганды транслокаторного белка 18 кДа, обладающие анксиолитической активностью | 2022 |
|
RU2812083C2 |
| БЕТА-ЦЕПОЧЕЧНЫЕ МИМЕТИКИ И ОТНОСЯЩИЕСЯ К НИМ СПОСОБЫ | 2003 |
|
RU2333213C2 |
| 1-АРИЛПИРРОЛО[1,2-A]ПИРАЗИН-3-КАРБОКСАМИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2572076C2 |
| ОКСА- И ТИАЗОЛПРОИЗВОДНЫЕ В КАЧЕСТВЕ АНТИДИАБЕТИЧЕСКИХ АГЕНТОВ И АГЕНТОВ ПРОТИВ ОЖИРЕНИЯ | 2000 |
|
RU2279427C2 |
Изобретение относится к способу получения 5-аминоизоксазол-3-карбоновой кислоты, который заключается в добавлении к метиловому или трет-бутиловому эфиру акриловой кислоты 1,5-2,5-кратного избытка диизопропилэтиламина и 1,5-3-кратного избытка тетранитрометана, далее образующиеся при этом нитроэфиры восстанавливают не разрушающей изоксазольный фрагмент хемоселективной системой, содержащей 2-20-кратный по отношению к нитроэфиру избыток восстановителя, с последующим гидролизом полученных аминоэфиров. Технический результат: разработан новый способ получения 5-аминоизоксазол-3-карбоновой кислоты, которая является конформационно-жестким аналогом γ-аминомасляной кислоты (ГАМК), что позволяет расширить круг синтетических аналогов γ-аминомасляной кислоты с ограниченной конформационной подвижностью, которые могут применяться в фармацевтической и медицинской химии как соединения с потенциальной физиологической активностью. 4 з.п. ф-лы, 4 пр.
1. Способ получения 5-аминоизоксазол-3-карбоновой кислоты, характеризующийся тем, что к метиловому или трет-бутиловому эфиру акриловой кислоты добавляют 1,5-2,5-кратный избыток диизопропилэтиламина и 1,5-3-кратный избыток тетранитрометана, образующиеся при этом нитроэфиры восстанавливают не разрушающей изоксазольный фрагмент хемоселективной системой, содержащей 2-20-кратный по отношению к нитроэфиру избыток восстановителя, с последующим гидролизом полученных аминоэфиров.
2. Способ по п. 1, отличающийся тем, что в качестве хемоселективной системы используют 30-40 мас. % суспензию цинка в уксусной кислоте, содержащую 5-15-кратный избыток цинка по отношению к нитроэфиру.
3. Способ по п. 1, отличающийся тем, что в качестве хемоселективной системы используют 30-50% мас. раствор хлорида олова (II) в 96% об. водном этаноле, содержащий 5-20-кратный избыток хлорида олова (II) по отношению к нитроэфиру.
4. Способ по п. 1, отличающийся тем, что в качестве хемоселективной системы используют 2-10% мас. раствор дитионита натрия в 30-70% об. водном метаноле, содержащий 2-10-кратный избыток дитионита натрия по отношению к нитроэфиру.
5. Способ по п. 1, заключающийся в том, что гидролиз аминоэфиров проводят в 1-3% мас. растворе моногидрата гидроксида лития в смеси взятых в соотношении 3:1 тетрагидрофурана и воды, содержащем 5-10-кратный избыток гидроксида лития по отношению к аминоэфиру, или в 30-65% мас. растворе уксусной кислоты, содержащем 50-100-кратный избыток уксусной кислоты по отношению к аминоэфиру, в условиях микроволнового содействия.
| СИСТЕМА ПОДАВЛЕНИЯ ВЛИЯНИЯ МАГНИТНОГО ПОЛЯ НА ДРЕЙФ НУЛЯ В ЗЕЕМАНОВСКИХ ЧЕТЫРЕХЧАСТОТНЫХ И КВАЗИЧЕТЫРЕХЧАСТОТНЫХ ЛАЗЕРНЫХ ГИРОСКОПАХ | 2020 |
|
RU2750425C1 |
| WO 2008036653 A2, 27.03.2008 | |||
| Приспособление для закрывания разгрузочных люков у железнодорожных полувагонов | 1934 |
|
SU43024A1 |
| Способ получения 3-амино-5-трет.бутилизоксазола | 1979 |
|
SU1003757A3 |
Авторы
Даты
2018-06-25—Публикация
2017-06-30—Подача