Область изобретения
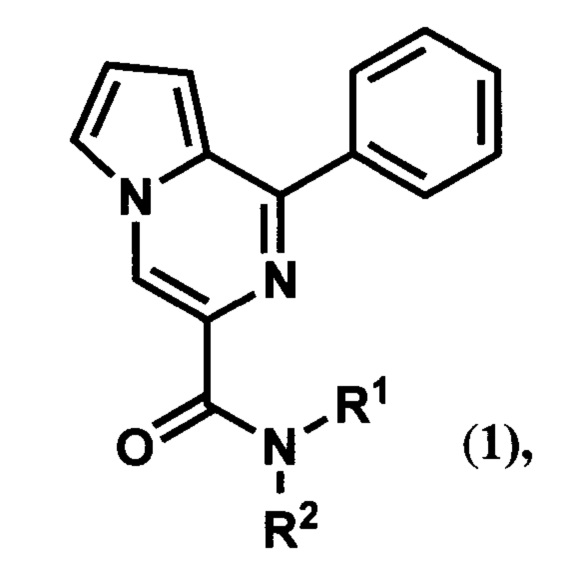
Изобретение относится к медицинской химии и фармакологии, а именно к области биологически активных соединений, конкретно к новой группе 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов общей формулы (1):
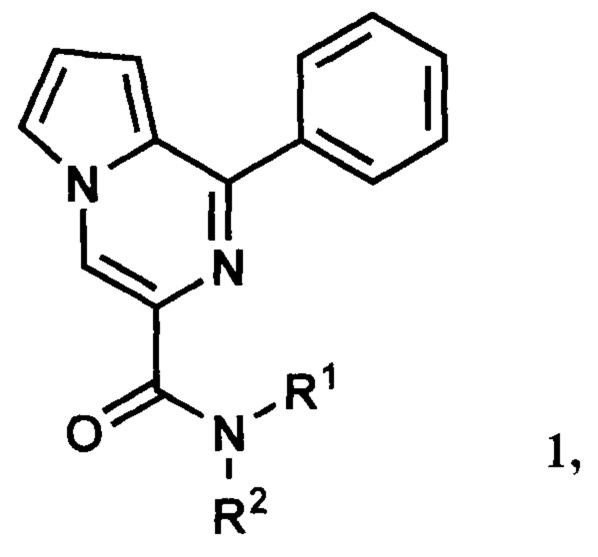
где R1 и R2 могут быть пропильными группами; или одновременно циклоалкановой группой; или если R1 является бензильной группой, то R2 может быть этильной или бензильной группой; или если R1 является атомом водорода, то R2 может быть бензгидрильной группой, 3,4-диметоксифенилэтильной группой, 3,4,5-триметоксибензильной группой или остатком аминокислот или их производных.
Заявляемые соединения обладают анксиолитической активностью.
Уровень техники
Стратегия фармакологической регуляции транслокаторного белка 18 кДа TSPO, разрабатываемая в России и в мировых фундаментальных исследованиях, рассматривается как научная основа для создания анксиолитиков, обладающих существенным превосходством над бензодиазепинами (G.V. Mokrov et al., Curr. Pharm. Des., 2020, 27, 217-237). Фармакотерапия этими агонистами ГАМКА-рецепторов осложняется побочными эффектами: седативным действием, миорелаксацией, нарушением памяти, привыканием и синдромом отмены (Е. Sanabria et al., Toxics, 2021, 9, 25.).
TSPO представляет собой белок-переносчик массой 18 кДа с пятью трансмембранными доменами, который локализуется на внешней митохондриальной мембране стероидпродуцирующих клеток нервной системы. Основной функцией TSPO является транспорт холестерина на внутреннюю мембрану митохондрий в качестве предшественника биосинтеза нейростероидов (R. Rupprecht et al., Nature Reviews Drug Discovery, 2010, 9, 971-988.). Нейростероиды имеют специфический сайт связывания на ГАМКА-рецепторе (Y. Sugasawa et al., Elife, 2020, 9, 1-32). Их агонистическое взаимодействие с этим сайтом увеличивает частоту открытия хлорного канала в ГАМКА-рецепторе, что усиливает тормозную передачу (R. Guennoun et al., Journal of Steroid Biochemistry and Molecular Biology, 2015, 146, 48-61.). Установлено, что анксиолитический эффект нейростероидов не сопровождается побочными эффектами бензодиазепинов (R. Rupprecht et al., Science, 2009, 325, 490-493).
Существо фармакологической регуляции TSPO заключается в аллостерической модуляции этого белка, приводящей к активации транслокации холестерина и усилению биосинтеза нейростероидов (Е. Da Pozzo et al., Curr. Mol. Med., 2012, 12, 426-442). Таким образом, лигандная активация TSPO обеспечивает анксиолитический эффект за счет включения эндогенных физиологических механизмов контроля анксиогенеза.
Недавние обзоры указывают на постоянный интерес к поиску новых лигандов TSPO в качестве потенциальных нейропсихотропных агентов (G.V. Mokrov et al., Curr. Pharm. Des., 2020, 27, 217-237; E. Barresi et al., Eur. J. Med. Chem., 2021, 209, 112924.). Синтез новых лигандов TSPO проводится в ФГБНУ «НИИ фармакологии имени В.В. Закусова» с целью поиска новых соединений с нейропсихотропной активностью с 2014 г. Эти исследования ведутся параллельно среди гетероциклических (G.V. Mokrov, et al., Bioorg. Med. Chem., 2015, 23, 3368-3378; G.V. Mokrov, et al., Med. Chem., 2022, 18, 497-508) и пептидных соединений (T.A. Gudasheva et al., Med. Chem., 2018, 15, 383-399; T.A. Gudasheva et al., Molecules, 2020, 25, 5132). На основе ядра пирроло[1,2-а]пиразина сконструирована группа новых гетероциклических TSPO-лигандов, среди которых получены высокоаффинные и TSPO-селективные соединения. В патенте РФ №2572076 описан класс лигандов TSPO, который относится к группе 1-арилпирроло[1,2-а]пиразин-3-карбоксамидов. Соединения ГМЛ-1 (N-бензил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамид) и ГМЛ-3 (N-бутил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамид) из этой группы, показали выраженную анксиолитическую активность в тестах «освещенное открытое поле» и «приподнятый крестообразный лабиринт» (С.Б. Середенин, Г.В. Мокров, Т.А. Гудашева, О.А. Деева, С.А. Ярков, М.А. Яркова, В.П. Жердев, К.В. Алексеев, А.Д. Дурнев, Г.Г. Незнамов. Патент РФ №2572076, 2015). Было доказано, что эффекты этих соединений обусловлены их взаимодействием с сайтом связывания белка TSPO. ГМЛ-1 и ГМЛ-3 обладают высоким сродством к TSPO (Ki=52 и 530 nM, соответственно), что было определено методом радиолигандных исследований (G.V. Mokrov, et al., Bioorg. Med. Chem., 2015, 23, 3368-3378). Позже было установлено, что соединения ГМЛ-1 и ГМЛ-3 обладают антидепрессивной и ноотропной активностью (С.Б. Середенин, М.А. Яркова, П.Ю. Поварнина, Г.В. Мокров, Т.А. Гудашева. Патент РФ №2699568, 2019), что выгодно отличает их от многих современных анксиолитических средств.
В патенте РФ №2734240 представлена группа N,1-дифенилпирроло[1,2-а]пиразин-3-карбоксамидов, в которой также были выявлены соединения, обладающие анксиолитическими свойствами (С.Б. Середенин, Г.В. Мокров, М.А. Яркова, А.С Пантилеев, Т.А. Гудашева. А.Д. Дурнев. Патент РФ №2734240, 2020). Наиболее активные соединения ГМЛ-11 (N-бензил-N,1-дифенилпирроло[1,2-а]пиразин-3-карбоксамид) и ГМЛ-21 (N-метил-N,1-дифенилпирроло[1,2-а]пиразин-3-карбоксамид) обладали противотревожным эффектом при внутрибрюшинном введении у грызунов в тесте «открытое поле» в условиях эмоционально-стрессового воздействия в очень низких дозах (0,001-0,1 мг/кг и 0,05-1,0 мг/кг, соответственно).
Соединения, описанные в вышеприведенных ссылках, не открывают и не предполагают структур патентуемых соединений.
Сущность изобретения
Целью настоящего изобретения является поиск новых биологически-активных соединений, обладающих анксиолитической активностью, в ряду новых лигандов TSPO с пирроло[1,2-а]пиразиновым ядром, обладающих высокой эффективностью и безопасностью, высоким теоретически сродством к белку TSPO согласно методам молекулярного моделирования и имеющих благоприятный профиль расчетных ADMET-параметров. В результате интенсивных исследований мы нашли, что эта цель может быть достигнута соединениями, относящимися к группе 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов общей формулы (1).
Соединения общей формулы (1), их свойства и способ получения в специальной и патентной литературе не описаны.
В качестве примеров соединений формулы (1) настоящего изобретения следует назвать:
1-фенил-N,N-дипропилпирроло[1,2-а]пиразин-3-карбоксамид (ГМЛ-12),
N-бензил-N-этил-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид (ГМЛ-101),
N-бензгидрил-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид (ГМЛ-102),
N,N-дибензид-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид (ГМЛ-103),
1-фенил-N-(3,4-диметоксифенилэтил)пирроло[1,2-а]пиразин-3-карбоксиамид (ГМЛ-104),
1-фенил-N-(3,4,5-триметоксибензил)пирроло[1,2-а]пиразин-3-карбоксиамид (ГМЛ-105),
метиловый эфир L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-106),
азепан-1-ил(1-фенилпирроло[1,2а]пиразин-3-ил)метанон (ГМЛ-107),
диэтиловый эфир L-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пентандионовой кислоты (ГМЛ-108),
диэтиловый эфир L-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)бутандионовой кислоты (ГМЛ-109),
метиловый эфир L-2-(1-фенилпирроло[1,2-а]пиразин-3 -карбоксиамидо)пропановой кислоты (ГМЛ-110),
этиловый эфир L-3-(1Н-индол-3-ил)-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пропановой кислоты (ГМЛ-111),
этиловый эфир D-3-(4-гидроксифенил)-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пропановой кислоты (ГМЛ-112),
L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-113).
Техническим результатом изобретения является расширение арсенала лекарственных средств для лечения заболеваний и состояний нервной системы, требующих применения средств, обладающих анксиолитической активностью.
Дизайн новых лигандов TSPO с пирроло[1,2-а]пиразиновым ядром
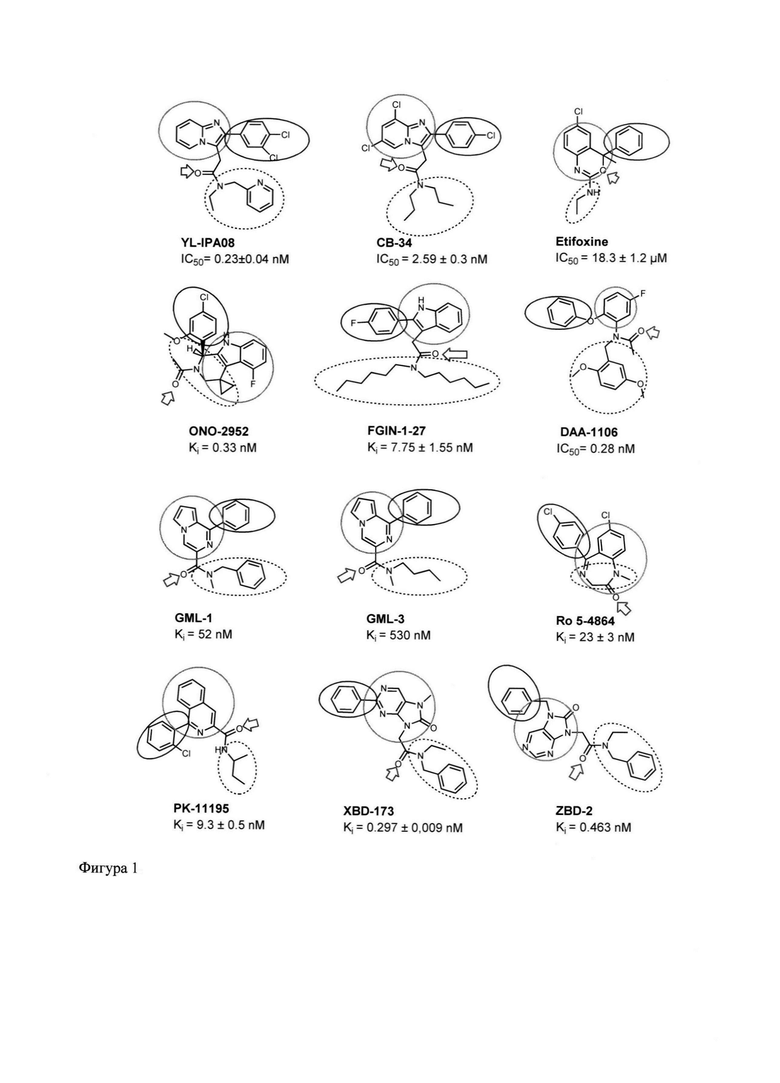
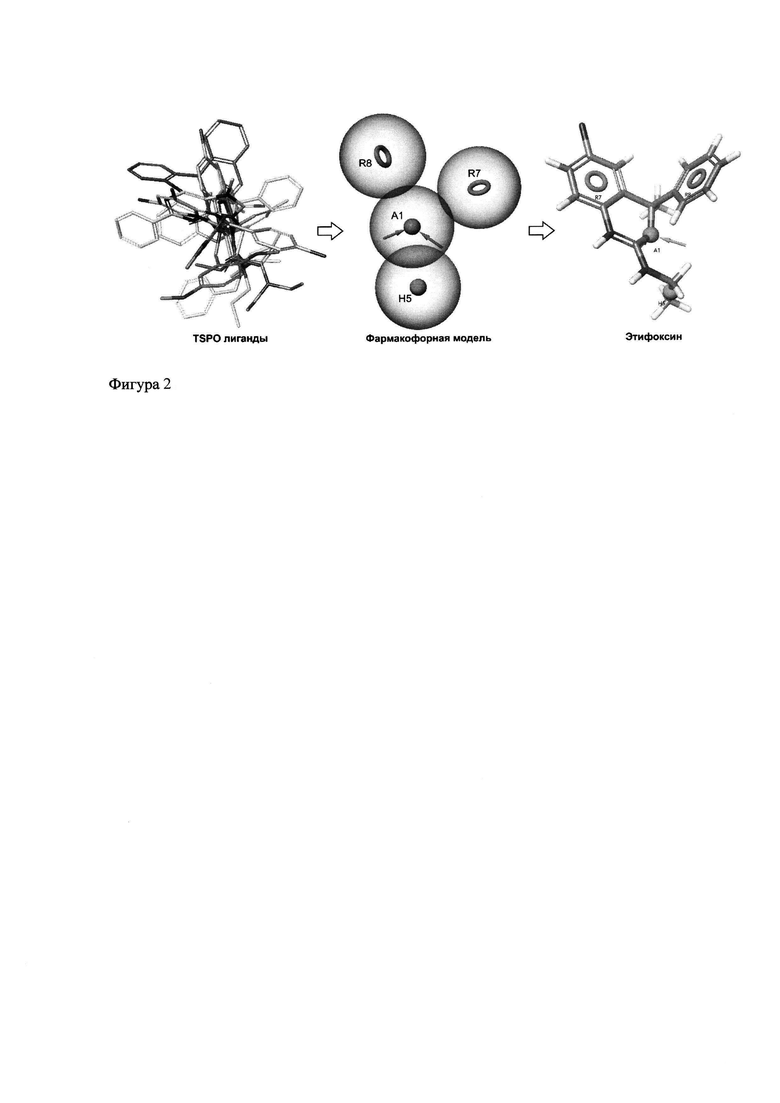
Для дизайна новых потенциальных лигандов TSPO было осуществлено несколько этапов молекулярного моделирования. На первом этапе была собрана библиотека наиболее перспективных известных лигандов TSPO, обладающих как наилучшими характеристиками связывания с рецептором, так и наиболее привлекательным спектром биологической активности (Фигура 1). Среди них производные имидазопиридина YL-IPA08 и СВ-34, бензоксазин Этифоксин, пиридоиндол ONO-2952, производное индола FGIN-1-27, арилоксианилид DAA-1106. производные пирролопиразина GML-1 и GML-3, бензодиазепин Ro 5-4864, изохинолин PK 11195 и производные пурина XBD-173 и ZBD-2.
С использованием этой библиотеки при помощи программного обеспечения Phase от Schrodinger была сгенерирована уточненная фармакофорная модель лигандов TSPO (Фигура 2). Алгоритм этой программы создает суперпозицию набора пространственных и электронных признаков молекул, включая гидрофобные области и ароматические ядра, доноры и акцепторы водородной связи, анионные и катионные центры и их векторное расположение.
Согласно визуализации расчетов полученная модель имеет следующие компоненты:
1. Две ароматические группы, одна из которых, как правило, гетероциклическая (R7 и R8).
2. Алифатическая или ароматическая гидрофобная группа (Н5).
3. Группа акцептора электронов (А1). В большинстве молекул находится между группами Н5 и R7/R8.
Для выбора новых молекул в группе 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов нами была сгенерирована библиотека соединений, в которых широко варьировалось строение группы NR1R2 с целью наиболее полного анализа перспективных соединений. В качестве аминов для этой группы использовались арилалкиламины, биароматические амины, алкоксиарилалкиламины, циклические насыщенные амины и различных аминокислоты и их производные.
Отбор молекул для синтеза осуществлялся на основании следующих критериев выбора:
1. Соответствие соединений вышеуказанной расчетной фармакофорной модели, сгенерированной в программе Phase. Наличие всех необходимых фармакофорных элементов.
2. Высокие значения теоретической аффинности соединений, вычисленные с использованием метода молекулярного докинга.
3. Благоприятный профиль расчетных ADMET-показателей (absorption, distribution, metabolism, excretion, toxicity - всасывание, распределение, метаболизм, выведение, токсичность) соединений.
Молекулярный докинг проводился с использованием структуры TSPO в комплексе с селективным лигандом РK-11195 (PDB ID: 2MGY) в программе Glide v8.1.
Белок подготавливали с помощью Schrodinger Protein Preparation Wizard с использованием стандартного протокола (Schrodinger Release 2015-2: LigPrep, Schrodinger, LLC, New York, NY, 2015.). Конформации лигандов рассчитывали в программе LigPrep. Координаты сетки (х 5.65; у 4.66; z 5.91; 20А) были отцентрированы по лиганду. Стыковку выполняли в Glide v8.1. с использованием стандартного протокола (Schrodinger Release 2015-4: Maestro, Version 10.4, Schrodinger, LLC, New York, NY, 2015.). Позы были визуализированы в Maestro 11.8, LogP был рассчитан в MarvinSketch 20.1 (ChemAxon Ltd., Венгрия). Для проверки протокола докинга было рассчитано среднеквадратичное отклонение положений атомов (RSMD) между исходным лигандом PK-11195 в белке TSPO и повторно состыкованным подготовленным PK-11195 в сетке. Значение RSMD составило  что позволило использовать этот протокол для прогнозирования связывания новых лигандов TSPO.
что позволило использовать этот протокол для прогнозирования связывания новых лигандов TSPO.
Параметры ADMET рассчитывались в программе QikProp v6.8 от Schrodinger. Среди ключевых характеристик оценивались следующие: молекулярный вес, дипольный момент, молекулярный объем, количество доноров и акцепторов водородных связей, ионизационный потенциал, параметры липофильности в различных системах, степень связываемости с белками плазмы крови, параметр проникновения через гематоэнцефалический барьер, аффинность к hERG-инному каналу, уровень проникновения через мембраны, соответствие «правилу 5» Липинского и «правилу 3» Йоргенсена, оральная биодоступность и ряд других.
Токсикологические параметры оценивались с использованием программы ADMETlab 2.0. Рассчитывался токсикологический риск соединений в тесте Эймса, острая токсичность у крыс, канцерогенный потенциал, воспалительные свойства по отношению к различным тканям и ряд других параметров.
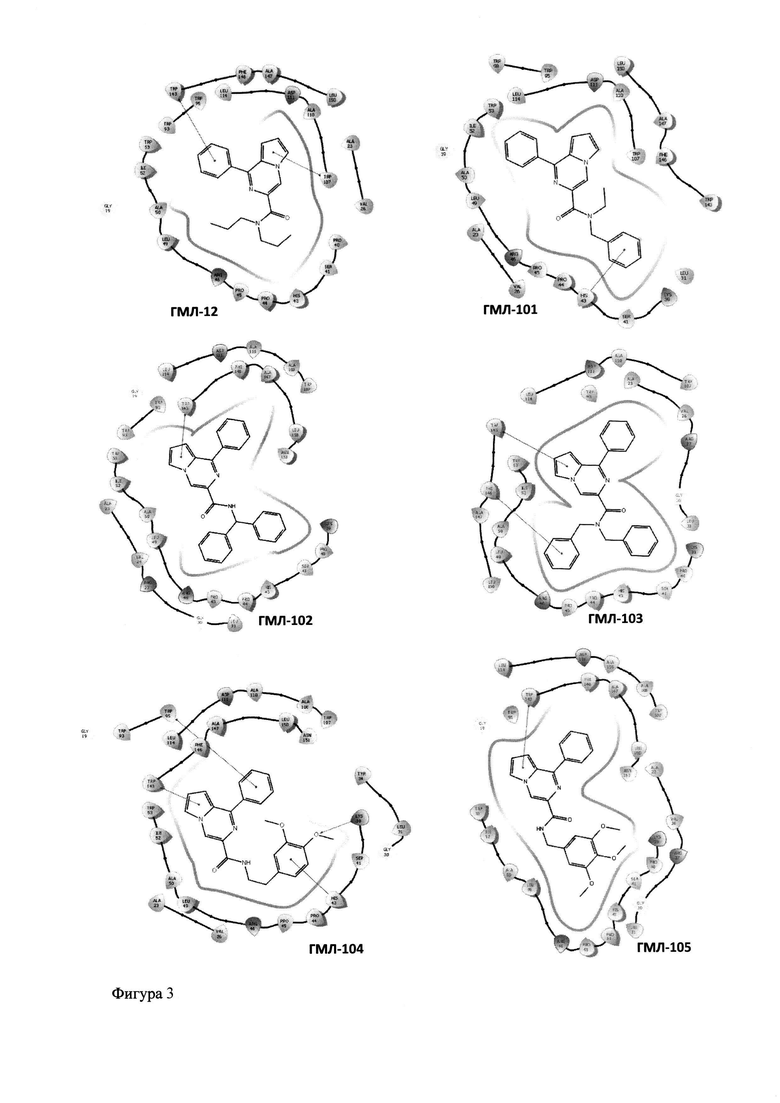
Отобранные по результатам молекулярного моделирования и результатам оценки расчетных параметров наиболее перспективные соединения представлены в таблицах 1 и 2. Все эти молекулы продемонстрировали высокую теоретическую аффинность по отношению активному центру TSPO. Скоринг функция DS (Docking score), определяющая энергию взаимодействия «лиганд-рецептор», для всех веществ была ниже значения -8 (Таблица 1). Среди ключевых взаимодействий «лиганд-рецептор» наблюдались следующие (Таблица 1, Фиг. 3, Фиг. 4): подавляющее большинство соединений имели π-π стэкинговое взаимодействие пиррольного или фенильного кольца с TRP143 (исключение - ГМЛ-101) и гидрофобное взаимодействие с последовательностью LEY49-TRP53 (исключение - ГМЛ-12). Около половины отобранных веществ имели гидрофобные взаимодействия с последовательностями TRP107-LEY114 и SER41-ARG46. Для ГМЛ-12 и ГМЛ-110 наблюдалось π-π стэкинговое взаимодействие с TRP107. У ГМЛ-101 фиксировалось π-катионное взаимодействие фенильной группы с HIS43, а у ГМЛ-103 - дополнительное π-π стэкинговое взаимодействие с РНЕ 146. Для диметоксипроизводного ГМЛ-104 наблюдалось π-катионное взаимодействие арильного цикла с HIS43; π-π стэкинг фенильной группы с TRP95 и водородная связь атома кислорода метоксигруппы с LYS39. Среди дополнительных взаимодействий соединений ГМЛ-106 и ГМЛ-110 фиксировалось полярное взаимодействие с последовательностью LYS39-ARG46. Наконец, у тирозин-содержащего ГМЛ-112 была выявлена водородная связь гидроксигруппы с SER41.
Результаты оценки основных ADMET-параметров отобранных соединений представлены в Таблице 2.
Значения молекулярного веса находились для всех веществ в пределах от 130 до 725 г/моль, что соответствует 95% лекарственных препаратов. Дипольные моменты соединений составляли от 4,0 до 8,4, что вписывается в рекомендуемые параметры для потенциальных лекарственных средств (от 1,0 до 12,5).
Липофильность соединений оценивалась путем расчета прежде всего параметра LogP (липофильность на разделе фаз октанол/вода). Известно, что лиганды TSPO, как правило, обладают достаточно высокими значениями липофильности (LogP не менее 3,5). Расчетные значения гидрофобности (LogP) новых соединений находились в диапазоне 37-6,5.
Следует отметить, что высокий коэффициент липофильности необходим для образования устойчивой π-π связи с остатками триптофана белка.
Уровень проникновения веществ через гематоэнцефалический барьер (LogBB) также находился в рекомендуемых пределах от -3,0 до 1,2.
Все новые соединения соответствовали правилам Липинского и Йоргенсена, определяющим необходимые требования к строению перорально активных лекарственных средств (расчетные значения для веществ не должны превышать 4 и 3 баллов, соответственно).
Оральная биодоступность новых соединений была максимально высокой (100% для всех веществ), за исключением соединения ГМЛ-113 (84%).
Расчетные параметры токсичности отобранных молекул свидетельствовали об их перспективности для разработки в качестве потенциальных лекарственных соединений. Все они по расчетам в тесте Эймса (за исключением соединения ГМЛ-104) и по расчетам острой токсичности у крыс при пероральном введении показали полное отсутствие этих видов токсичности (значения «---» и «- -»).
Краткое описание чертежей.
На фигуре 1 приведены классические синтетические лиганды TSPO с экспериментальными константами ингибирования. Ароматические ядра обведены зелеными окружностями, арильные заместители - синими окружностями, гидрофобные группы - черными пунктирными окружностями, электроноакцепторные группы показаны красными стрелками.
На фигуре 2 представлена фармакофорная модель лигандов TSPO, сгенерированная с использованием программы Phase. Оранжевые кольца R7 и R8 соответствуют ароматическим/гетероароматическим группам; розовая сфера А1 представляет электроноакцепторную группу; зеленая сфера Н5 представляет собой алифатическую или ароматическую гидрофобную группу. В качестве примера представлено соответствие фармакофорной модели молекулы этифоксина.
Фигура 3 - Результаты молекулярного докинга новых производных 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов (ГМЛ-12, ГМЛ-101 - ГМЛ-105) в активный сайт рецептора TSPO (PDB ID: 2MGY) в 2D-проекции.
Фигура 4 - Результаты молекулярного докинга новых производных 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов (ГМЛ-106 - ГМЛ-112) в активный сайт рецептора TSPO (PDB ID: 2MGY) в 2D-проекции
Синтез 1-фенилпирроло [1,2-а] пиразин-3-карбоксиамидов
Представляемые в настоящем изобретении соединения общей формулы (1) можно получить по следующей схеме:

1-Фенилпирроло[1,2-а]пиразин-3-карбоновую кислоту (2) получают в соответствии со схемой, представленной в патенте РФ №2572076. 1-Фенилпирроло[1,2-а]пиразин-3-карбоновую кислоту (2) вводят во взаимодействие с аминами (3) в хлористом метилене, в присутствии конденсирующих агентов - 1-гидроксибензотриазола и 1,3-дициклогексилкарбодиимида.
Строение веществ общей формулы (1) подтверждено данными спектров ЯМР 1Н, а их чистота - данными элементного анализа.
Для определения физико-химических характеристик полученных веществ использовали следующую аппаратуру:
температуры плавления определяли на приборе Optimelt МРА100 (Stanford Research Systems, США) в открытых капиллярах без корректировки;
строение целевых и промежуточных соединений устанавливали методами одномерной 1Н-, 13С- и двумерной (COSY - гомоядерная корреляция, HSQC - гетероядерная одноквантовая корреляция) ЯМР-спектроскопии. Спектры 1Н- и 13С-ЯМР регистрировали в шкале δ, м.д. на спектрометре Bruker FOURIER 300 HD (Bruker Corporation, Leipzig, Germany, 300 и 75 МГц для ядер 1Н- и 13С соответственно) в растворах DMSO-d6 и CDCl3, внутренний стандарт тетраметилсилан (0 м.д.). Константа спин-спинового взаимодействия J, Гц. Для обозначения резонансных сигналов использовали следующие сокращения: с - синглет, д - дублет, т - триплет, м - мультиплет;
тонкослойную хроматографию (ТСХ) выполняли на стеклянных силикагелевых пластинах DC Kieselgel 60 G/F254 (Merck, Германия) с обнаружением в УФ-свете.
Пример 1. Синтез 1-Фенил-N,N-дипропилпирроло[1,2-а]пиразин-3-карбоксамида (ГМЛ-12).
а. Этиловый эфир 2-азидоакриловой кислоты.
К суспензии 44 ммоль (2.86 г) азида натрия в 50 мл сухого ДМФА прибавляют раствор 20 ммоль этилового эфира 2,3-дибромпропановой кислоты в 30 мл сухого ДМФА при температуре 60°С. Реакционную смесь перемешивают при температуре 60°С в течение 60 минут, после чего охлаждают до комнатной температуры и разбавляют 100 мл воды. Продукт экстрагируют 3 раза по 100 мл гексана, объединенные органические растворы промывают 80 мл воды, профильтровывают через бумажный фильтр и упаривают досуха при 35°С. К остатку добавляют раствор 10 ммоль (1.5 г) DBU в 50 мл толуола, и смесь перемешивают в течение 40 минут при комнатной температуре, промывают 2 раза по 50 мл воды, профильтровывают через бумажный фильтр и упаривают досуха, получая 1.42 г продукта в виде желтого масла (выход 45%). Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.36 (т, 3 Н, СН3,3J=7.1); 4.31 (кв, 2 Н, CH2CH3, 3J=7.1); 5.35, 5.85 (оба с, по 1 Н, СН=).
б. 1-Фенилпиролло[1,2-а]пиразин-3-карбоновая кислота.
К раствору 10 ммоль (1.41 г) этилового эфира 2-акриловой кислоты в 15 мл сухого ДМФА прибавляют 11 ммоль (7.92 г) карбоната цезия и 10 ммоль (3.40 г) фенил-(2Н-пиррол-2-ил)метанона, и реакционную массу перемешивают при комнатной температуре в течение двух суток. Полученную смесь разбавляют 60 мл воды, и продукт экстрагируют 4 раза по 40 мл эфира. Объединенные эфирные растворы промывают 100 мл воды, профильтровывают через бумажный фильтр и упаривают досуха. К остатку добавляют 70 мл воды, 25 мл этилового спирта и 20 ммоль (0.80 г) едкого натра, смесь кипятят в течение часа, упаривают досуха, и остаток перекристаллизовывают из спирта. Светло-желтые кристаллы 1.44 г 54% Т. пл. 155-157°С. Найдено (%): С, 70.52; Н, 4.36; N, 11.86. C14H10N2O2. Вычислено (%): С, 70.58; Н, 4.23; N, 11.76. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 7.08 (м, 1 Н, Н(8)); 7.14 7.01 (м, 1 Н, Н(7)); 7.51-8.03 (м, 6 Н, Ph, Н(6)); 8.80 (с, 1 Н, Н(4)); 11.5 (уш. с, 1 Н, СООН). ИК-спектр (КВr), ν/см-1: 3496, 3142, 1627 (ОН, СН, (С=O)).
в. 1-Фенил-N,N-дипропилпирроло[1,2-а]пиразин-3-карбоксамид (ГМЛ-12).
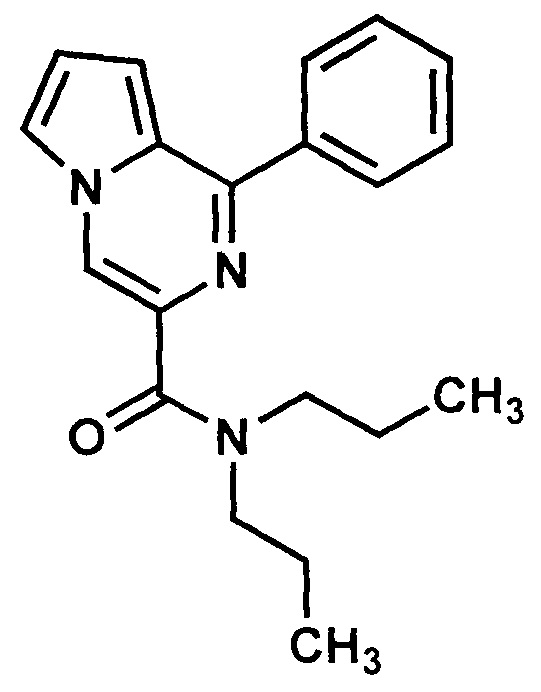
Раствор 2,2 ммоль (0,2 г) дипропиламина, 2,0 ммоль (0,48 г) 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и 2,2 ммоль (0,30 г) 1-гидроксибензотриазола в 20 мл хлористого метилена охлаждают до 0°С. К нему прибавляют раствор 2,4 ммоль (0,50 г) 1,3-дициклогексилкарбодиимида в 10 мл хлористого метилена, и смесь перемешивают при 0°С в течение 30 мин. Выпавший осадок отфильтровывают, фильтрат промывают два раза по 20 мл воды, сушат сульфатом натрия и упаривают досуха. Остаток при необходимости хроматографируют на силикагеле, используя в качестве элюента смесь этилацетата и гексана (1:1). Нужные фракции собирают и упаривают досуха, остаток перекристализовывают из этанола. Получают 0,45 г бледно-желтых кристаллов (выход 70%). Т. пл. 104-106°С. Найдено (%): С, 74.88; Н, 7.22; N, 12.90. C20H23N3O. Вычислено (%): С, 74.74; Н, 7.21; N, 13.07. Спектр ЯМР 1Н (CDCl3, δ, м.д.): 0.82, 1.00 (два т, по 3 Н, 2 СН3, J=6.9 Гц); 1.76 (м, 4 Н, 2 СН2СН3); 3.49, 3.68 (два т, по 2 Н, CH2NCH2, J=7.3 Гц); 6.97 (м, 1 Н, Н(8)); 7.00 (м, 1 Н, Н(7)); 7.49-7.59 (м, 4 Н, 3 PhH, Н(6)); 7.96-8.03 (м, 2 Н, 2PhH); 8.45 (с, 1 Н, Н(4)).
Пример 2. Синтез N-бензил-N-этил-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамида (ГМЛ-101).
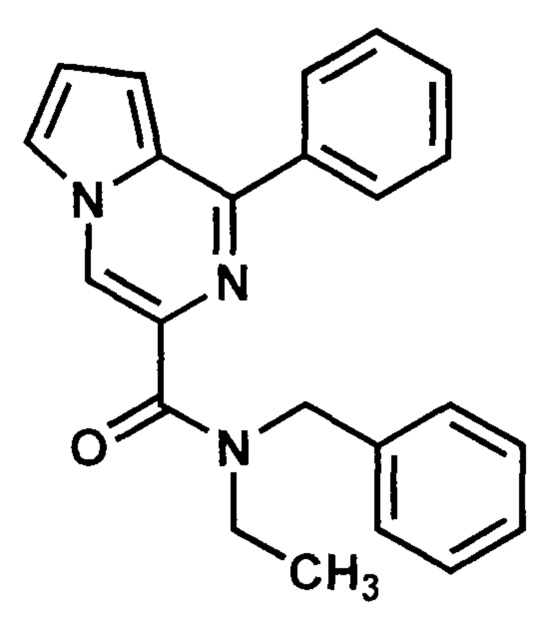
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и N-бензил-N-этиламина. Выход 80%, бледно-серый порошок Т. пл. 116-118°С. Найдено (%): С, 76.83; Н, 6.12; N, 11.98. C23H21N3O. Вычислено (%): С, 77.72; Н, 5.96; N, 11.82. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 1.27, (два т, по 3 Н, 2 СН3, 3J=7,1); 3.73 (м, 2 Н, СН2-СН3); 4,95 (два с, 2 Н, СН2-Ph); 6.98 (м, 1 Н, Н(8)); 7.01 (м, 1 Н, Н(7)); 7.27-8.01 (м, 11 Н, 2 Ph, Н(6)); 8.54 (с, 1 Н, Н(4)).
Пример 3. Синтез N-бензгидрил-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамида (ГМЛ-102).
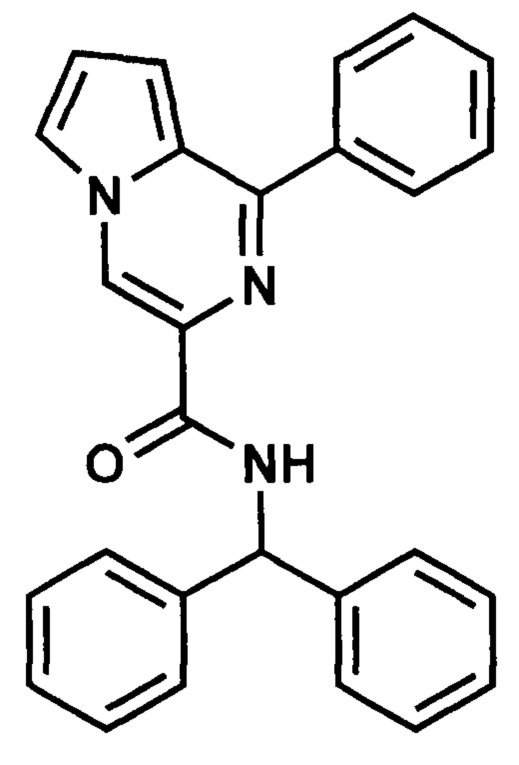
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и бензгидриламина. Выход 85%, желто-серые игольчатые кристаллы Т. пл. 150-152°С. Найдено (%): С, 80.67; Н, 5.63; N, 10.26. C27H21N3O. Вычислено (%): С, 80.37; Н, 5.25; N, 10.41. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 6.53 (м, 1 Н, СН); 7,00 (м, 1 Н, Н(8)); 7.04 (м, 1 Н, Н(7)); 7.27-7.55 (м, 16 Н, 3 Ph, Н(6)); 7.97 (м, 1Н, NH); 8.78 (м, 1 Н, Н(4)).
Пример 4. Синтез N,N-дибензил-1-фенилпирроло[1,2-а]пиразин-3-карбоксиамида (ГМЛ-103).
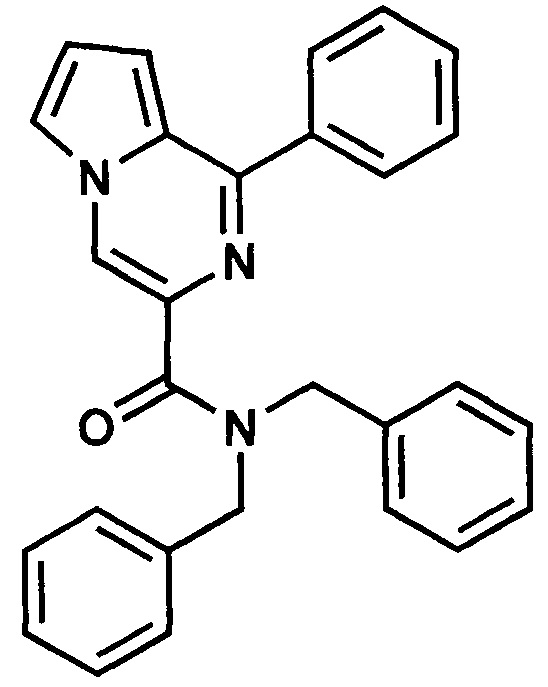
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и дибензиламина. Выход 70%, желтый порошок. Т. пл. 115-116°С. Найдено (%): С, 80.52; Н, 5.23; N, 10.12. C28H23N3O. Вычислено (%): С, 80.55; Н, 5.55; N, 10.06. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 4.74 (м, 2 Н, СН2); 5.17 (м, 2 Н, СН2); 6.99 (м, 1 Н, Н(8)); 7.02 (м, 1 Н, Н(7)); 7.36-7.93 (м, 16 Н, 3 Ph, Н(6)); 8.64 (с, 1 Н, Н(4)).
Пример 5. Синтез 1-фенил-N-(3,4-диметоксифенилэтил)пирроло[1,2-а]пиразин-3-карбоксиамида (ГМЛ-104).
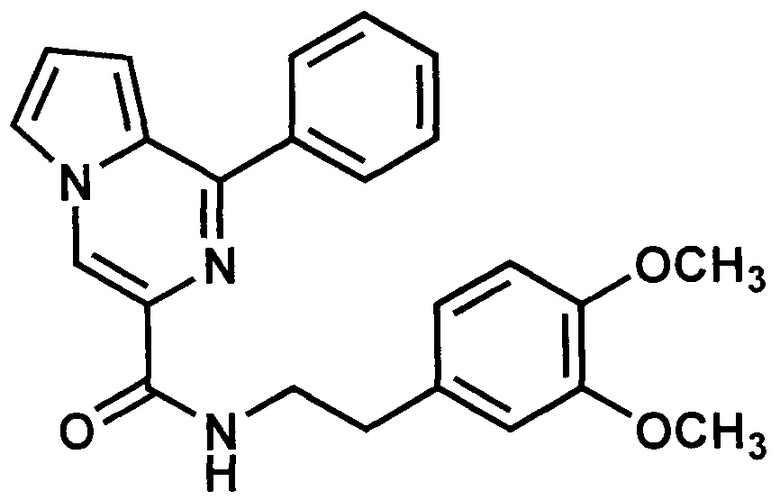
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и 3,4-диметоксифенилэтиламина. Выход 90%, светло-желтый порошок. Т. пл. 160-163°С. Найдено (%): С, 71.85; Н, 5.68; N, 10.52. C24H23N3O3. Вычислено (%): С, 71.80; Н, 5.77; N, 10.47. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 2.91 (м, 2 Н, СН2); 3.74 (м, 2 Н, СН2) 3.88 (м, 6 Н, 2СН3); 6.83 (м, 3Н, Ph,); 6.99 (м, 1 Н, Н(8)); 7.04 (м, 1 Н, Н(7)); 7.27-8.15 (м, 11 Н, 2 Ph, Н(6)); 8.74 (с, 1 Н, Н(4)).
Пример 6. Синтез 1-фенил-N-(3,4,5-триметоксибензил)пирроло[1,2-а]пиразин-3-карбоксиамида (ГМЛ-105).
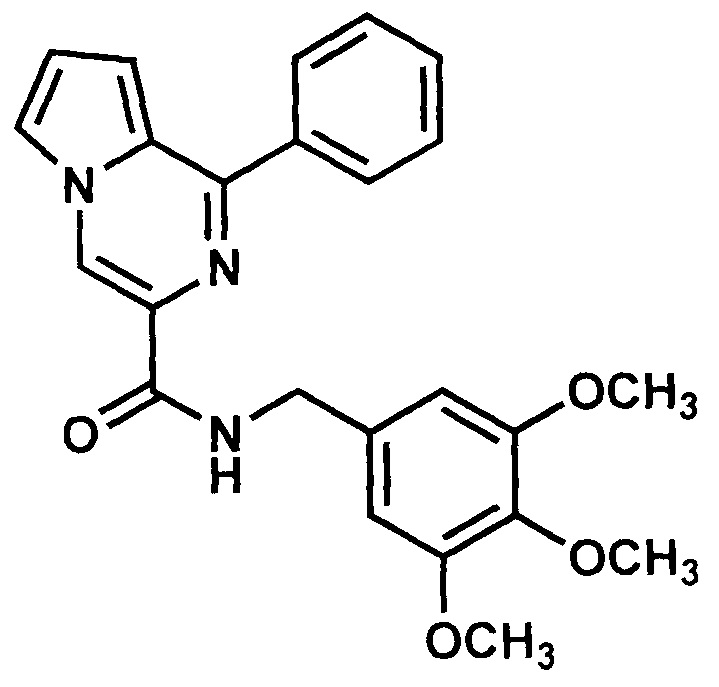
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и 3,4,5-триметоксибензиламина. Выход 80%, светло-желтый порошок. Т. пл. 180-183°С. Найдено (%): С, 69.27; Н, 5.72; N, 10.19. C24H23N3O4. Вычислено (%): С, 69.05; Н, 5.55; N, 10.07. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 3.87 (м, 9 Н, 3СН3); 4.65 (м, 2 Н, СН2); 6.62 (м, 2 Н, Ar); 7.02 (м, 1 Н, Н(8)); 7.04 (м, 1 Н, Н(7)); 7.27-8.03 (м, 6 Н, Ph, Н(6)); 8.81 (с, 1 Н, Н(4)).
Пример 7. Синтез метилового эфира L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-106).
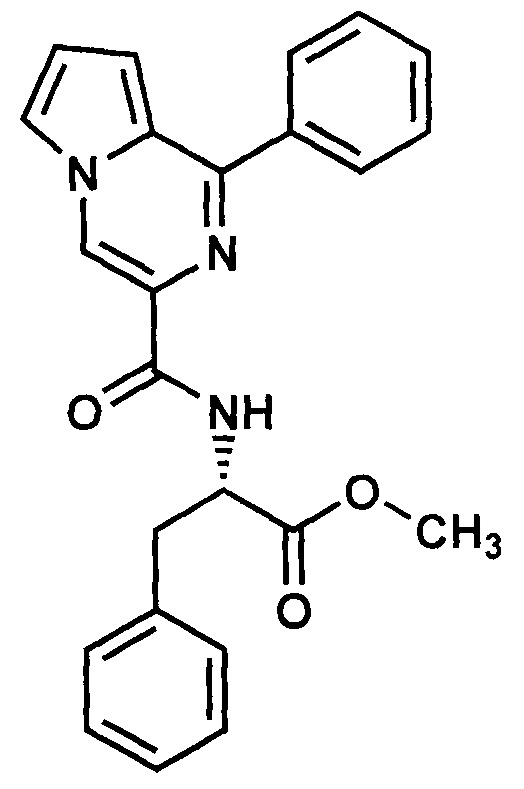
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и L-фенилаланина. Выход 85%, карамельные кристаллы. Т. пл. 120-121°С. Найдено (%): С, 72.12; Н, 5.42; N, 10.56. C24H21N3O3. Вычислено (%): С, 72.17; Н, 5.30; N, 10.52. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц): 3.27 (м, 2 Н, СН2); 3.75 (три с, 3 Н, СН3); 5.10 (м, 1 Н, СН); 6.99 (м, 1 Н, Н(8)); 7.06 (м, 1 Н, Н(7)); 7.55-7.95 (м, 11 Н, 2 Ph, Н(6)); 8.44 (м, 1 Н, NH); 8.71 (с, 1 Н, Н(4)).
Пример 8. Синтез азепан-1-ил(1-фенилпирроло[1,2а]пиразин-3-ил)метанона (ГМЛ-107).

Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и азепана. Выход 85%, карамельные кристаллы. Т. пл. 92-93°С. Найдено (%): С, 75.35; Н, 6.72; N, 13.12. C20H21N3O. Вычислено (%): С, 75.21; Н, 6.63; N, 13.16. Спектр ЯМР 1Н (CDCl3, δ, м.д.) 1.65 (с, 2 Н, СН2СН2); 1.86 (м, 2 Н, СН2-СН2); 3.71 (м, 2 Н, CH2-N); 3.86 (м, 2 Н, CH2-N); 6.97 (м, 1 Н, Н(8)); 6.99 (м, 1 Н, Н(7)); 7.52-7.97 (м, 6 Н, Ph, Н(6)); 8.4 (с, 1 Н, Н(4)).
Пример 9. Синтез диэтилового эфира L-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пентандионовой кислоты (ГМЛ-108).
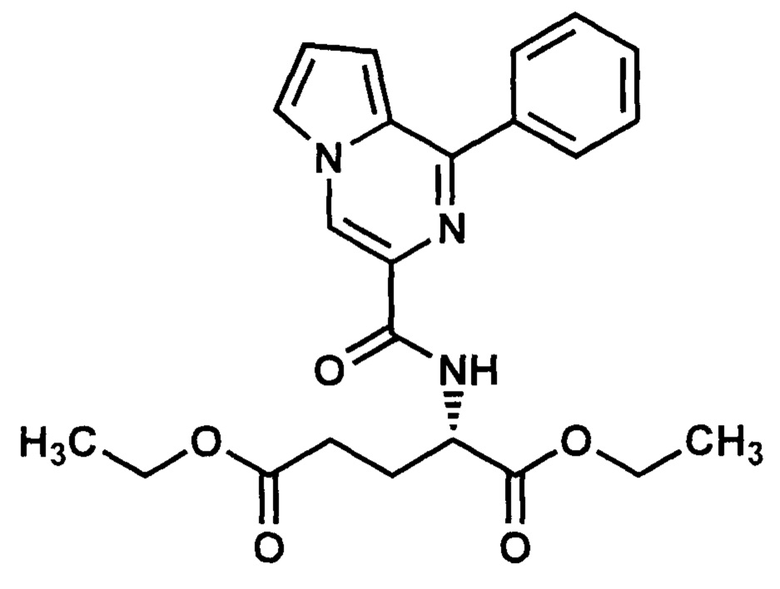
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и диэтилового эфира L-глутаминовой кислоты. Выход 65%, карамельные кристаллы. Т. пл. 59-60°С. Найдено (%): С, 65.30; Н, 5.98; N, 9.83. C23H25N3O5. Вычислено (%): С, 65.24; Н, 5.95; N, 9.92. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц) 1.2-1.3 (м, 6 Н, 2СН3); 2.0-2.4 (м, 4 Н, 2СН2-СН3); 4.09-4.11 (м, 2 Н, СН2-С(O)); 4.25-4.27 (м, 2 Н, СН2-СН2); 7.00-7.06 (д, 2 Н, Н(8), Н(7), J1=3.46); 7.55-8.0 (м, 6 Н, Ph, Н(6)); 8.74 (с, 1 Н, Н(4)).
Пример 10. Синтез диэтилового эфира L-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)бутандионовой кислоты (ГМЛ-109).
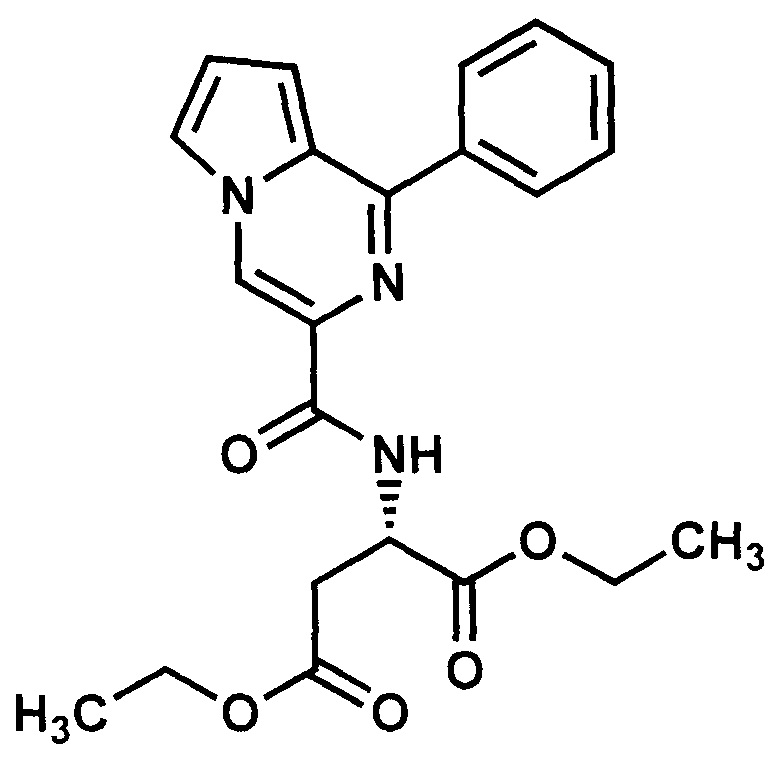
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и диэтилового эфира L-аспарагиновой кислоты. Выход 78%, желтые кристаллы. Т. пл. 42-43°С. Найдено (%): С, 64.30; Н, 5.74; N, 10.13. C22H23N3O5. Вычислено (%): С, 64.54; Н, 5.66; N, 10.26. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц) 1.24-1.3 (м, 6 Н, 3СН3); 3.01-3.11 (дд, 4 Н, СН2-С(O), J1=6.25 J2=7.20); 5.09-5.12 (м, 1Н, CH-NH), 7.99-7.06 (д, 2 Н, Н(8), Н(7), J1=3.46); 7.53-8.04 (м, 6 Н, Ph, Н(6)); 8.74-8.75 (с, 1 Н, Н(4)).
Пример 11. Синтез метилового эфира L-2-(1-фенилпирроло[1,2-а)пиразин-3-карбоксиамидо)пропановой кислоты (ГМЛ-110).
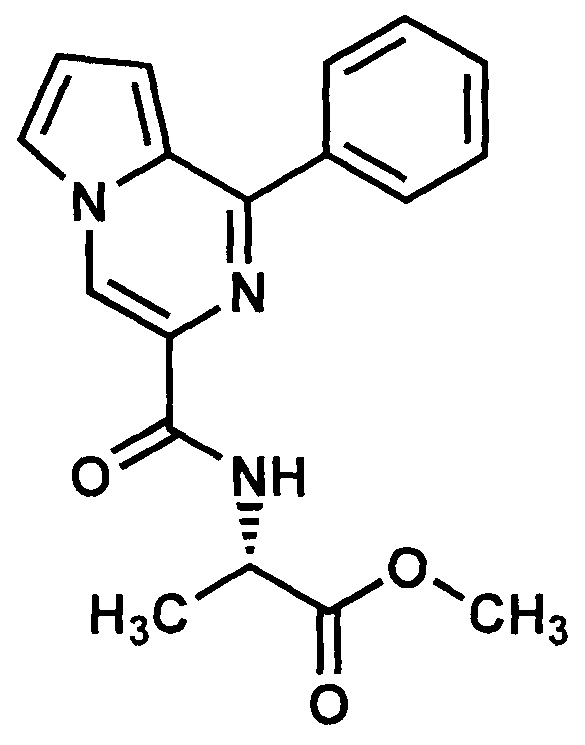
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и метилового эфира L-аланина. Выход 90%, желтые кристаллы. Т. пл. 128-130°С. Найдено (%): С, 66.79; Н, 5.74; N, 13.14. C18H17N3O3. Вычислено (%): С, 66.86; Н, 5.30; N, 13.00. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц) 1.57 (д, 3 Н, СН3 J=6,00); 3.80 (с, 3Н, ОСН3); 4.82-4.91 (м, 1Н, CH-NH,), 7.04-7.00 (м, 2 Н, Н(8), Н(7),); 7.55-8.43 (м, 6 Н, Ph, Н(6)); 8.75 (с, 1 Н, Н(4)).
Пример 12. Синтез этилового эфира L-3-(1Н-индол-3-ил)-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пропановой кислоты (ГМЛ-111).
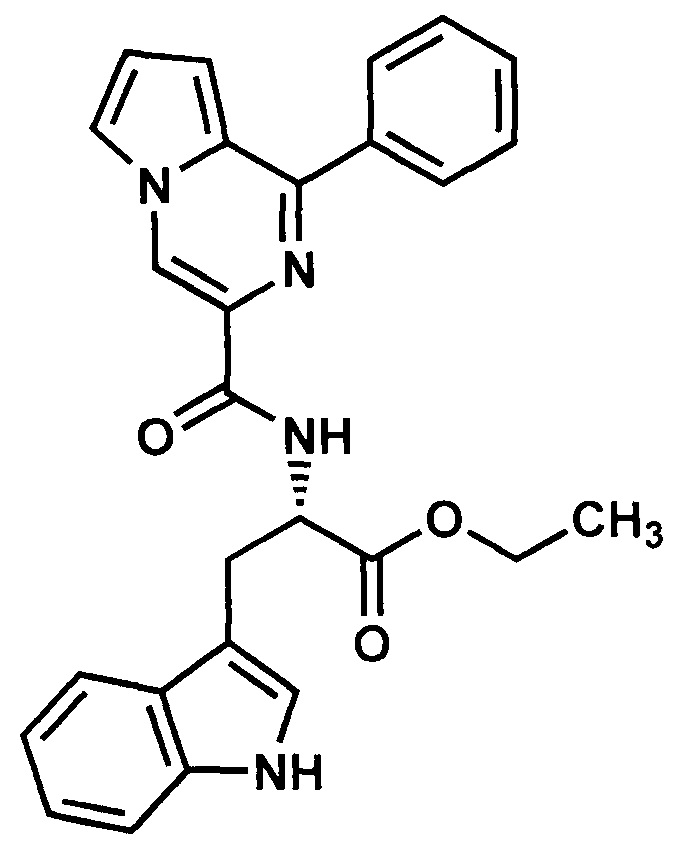
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и этилового эфира L-триптофана. Выход 80%, желтые кристаллы. Т. пл. 71-72°С. Найдено (%): С, 71.65; Н, 5.74; N, 12.40. C27H24N4O3. Вычислено (%): С, 71.67; Н, 5.35; N, 12.38. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц) 1.24 (м, 3Н, СН3); 3.45 (м, 2 Н, СН2-СН,); 3.69 (м, 2Н, СН2-СН3), 5.16 (м, 2Н, CH-N) 7.01-7.84 (м, 13Н, Н(8), Н(7), ind, Ph.); 8.54 (м, Н(6)); 8.71 (с, 1 Н, Н(4)).
Пример 13. Синтез этилового эфира D-3-(4-гидроксифенил)-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамидо)пропановой кислоты (ГМЛ-112).
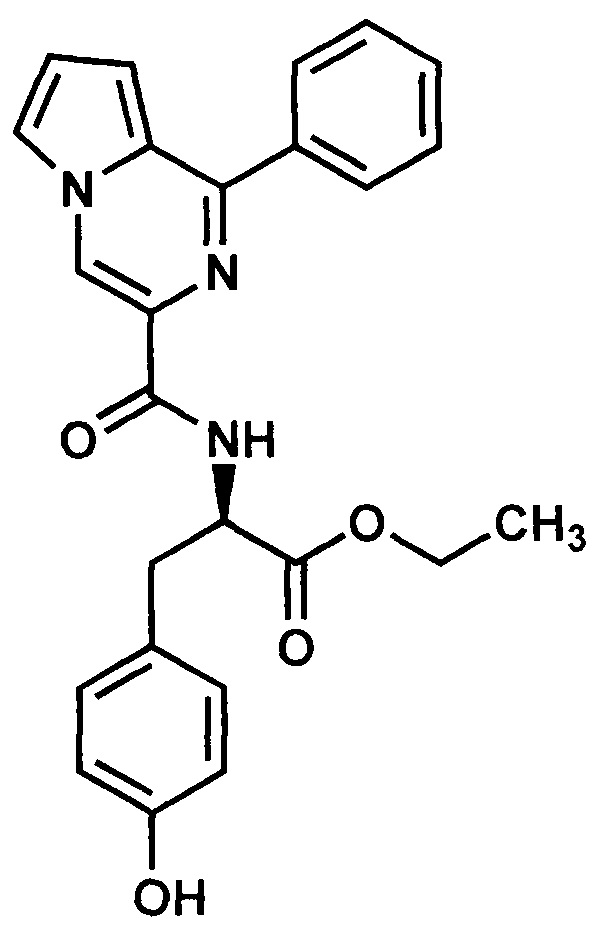
Получают в соответствии с примером 1 (пункт в) из 1-фенилпиролло[1,2-а]пиразин-3-карбоновой кислоты и этилового эфира D-тирозина. Выход 45%, желтые кристаллы. Т. пл. 174-176°С. Найдено (%): С, 69.95; Н, 5.36; N, 9.75. C25H23N3O4. Вычислено (%):С, 69.92; Н, 5.40; N, 9.78. Спектр ЯМР 1Н (CDCl3, δ, м.д., J/Гц) 1.26 (м, 3Н, СН3); 3.15-3.17 (м, 2 Н, CH2Ph,); 3.72-3.75 (м, 1Н, CH-N), 4.19-4.22 (м, 2Н, СН2-СН3),6.7-7.9 (м, 12Н, Н(8), Н(7), 2Ph.); 8.52-8.55 (м, Н(6)); 8.67-8.68 (с, 1 Н, Н(4)).
Пример 14. Синтез L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-113).
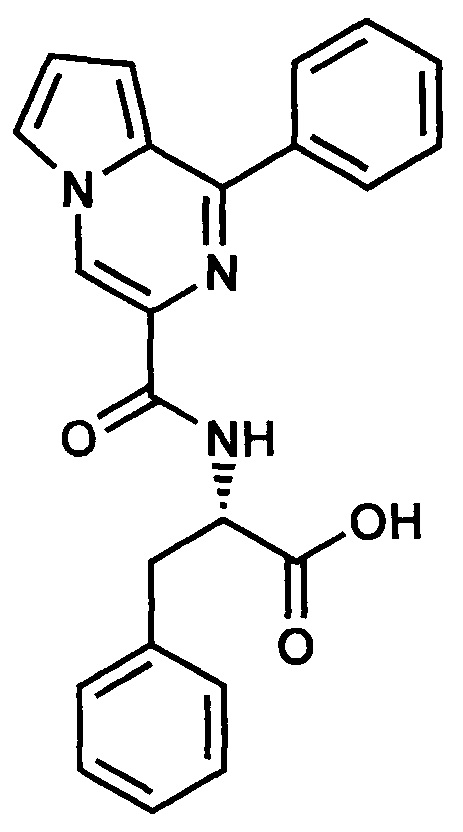
Растворяют 8.03 ммоль (3.21 г) метилового эфира L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-106) в смеси этилового и изопропилового спирта, добавляют гидроксид калия в 20 мл воды и кипятят с обратным холодильником 2 часа. Нейтрализуют реакционную массу лимонной кислотой и экстрагируют хлористым метиленом, затем упаривают досуха на роторном испарителе и перекристаллизовывают из этанола. Выход 1.71 г, 53.3%. Желтые кристаллы. Найдено (%): С, 71.45; Н, 5.16; N, 10.99. C23H19N3O3. Вычислено (%): С, 71.68; Н, 4.97; N, 10.90. Спектр ЯМР 1Н (DMSO-D6, δ, м.д.) 3.21 (м, 2 Н, СН2); 4.52 (м, 1 Н, СН); 7.06 (м, 2 Н, Н(7), Н(8)); 7.2-8.05 (м, 11 Н, 2 Ph, Н(6)); 8.53 (м, 1 Н, NH); 8.97 (с, 1 Н, Н(4)).
Результаты фармакологического изучения соединений.
Животные получены из питомника лабораторных животных "Пущино" при филиале Института биоорганической химии им. М.М. Шемякина и Ю.А. Овчинникова. Организацию и проведение работ осуществляли в соответствии с ГОСТ 33216-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами», ГОСТ 33215-2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», Директивой 2010/63/EU Европейского Парламента и Совета Европейского Союза от 22 сентября 2010 года по охране животных, используемых в научных целях, и правилами, утвержденными комиссией по биоэтике ФГБНУ «НИИ фармакологии имени В.В. Закусова».
Пример 15. Влияние заявляемых соединений на поведение мышей линии BALB/c в условиях эмоционально-стрессового воздействия в тесте «открытое поле».
В работе применена рекомендованная методика освещенного «открытого поля» (ОП), при котором перенос животного из темноты на ярко подсвеченную арену создает, помимо реакции на новую остановку, дополнительный стрессирующий фактор, основанный на естественном стремлении грызунов избегать ярко освещенных мест (Руководство по проведению доклинических исследований лекарственных средств. Часть первая / Под ред. А.Н. Миронова. М.: Гриф и К, 2012. 944 с.). В качестве тест-системы были использованы мыши инбредной линии BALB/c характеризующейся реакцией замирания в тесте «открытое поле» (С.Б. Середенин, А.А. Ведерников / Влияние психотропных препаратов на поведение инбредных мышей в условиях открытого поля / Бюлл. Эксп. Биол. Мед., 1979, 88(7), 38-40).
В исследовании использованы мыши-самцы инбредной линий BALB/c массой 19-25 г. Животные содержались в условиях лабораторного вивария в контролируемых условиях окружающей среды (20-24°С и 45-65% относительная влажность, 12-часовой цикл освещения, 10-ти кратная смена объема воздуха комнаты в час), в пластмассовых клетках с верхней крышкой из нержавеющей стали с обеспыленной подстилкой из деревянной стружки, по 20 мышей в каждой клетке, при постоянном доступе к экструдированному брикетированному корму и питьевой воде. Животные распределялись по группам рандомизированно, по критерию массы тела, с отклонением от среднего значения не более чем на ±10%. Перед опытом животных выдерживали в экспериментальной комнате в «домашних» клетках в течение 24 часов. В каждой группе было по 8 животных.
Для введения исследуемых соединений готовили их суспензию с Твин-80 и дистиллированной водой. Полученную смесь вводили мышам однократной внутрибрюшинной инъекцией.
Через 30 минут после внутрибрюшинного введения соединения животное сначала помещали на 1 мин в темную камеру, а затем - на периферию установки «Открытое поле», которая представляет собой белую круглую арену диаметром 1 метр с белыми бортами высотой 50 см. Освещение осуществляется бестеневыми лампами, расположенными в метре над поверхностью поля. Уровень освещенности составляет 3000 люкс. Все пространство арены равномерно разделено 4-мя концентрическими окружностями, которые в свою очередь разбиты радиусами на сектора так, что периферическая окружность состоит из 16 одинаковых криволинейных квадратов. Наблюдение за животным производили в течение 3 минут, раздельно фиксировали число пересеченных секторов на периферии (ПА и в центральных областях (ЦА) - 2/3 поля, число заходов в центр поля (Ц), а также число вертикальных стоек (ВА) и количество дефекаций (Д). Суммарное число пересеченных квадратов вместе с числом вертикальных стоек обозначали как общую активность (ОДА).
О наличии анксиолитического действия судили по выявлению активирующего эффекта на двигательную активность мышей линии BALB/c с фенотипической реакцией замирания в тесте ОП.
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (ANOVA, критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни). Данные в таблицах представлены в виде M(SD), где М-среднее арифметическое; SD-стандартное отклонение.
В тесте ОП анализировалась активность следующих соединений: ГМЛ-12, ГМЛ-101, ГМЛ-102, ГМЛ-103, ГМЛ-104, ГМЛ-105 и ГМЛ-106.
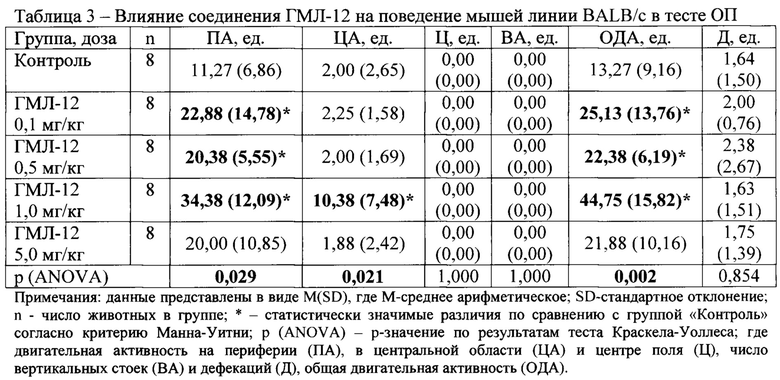
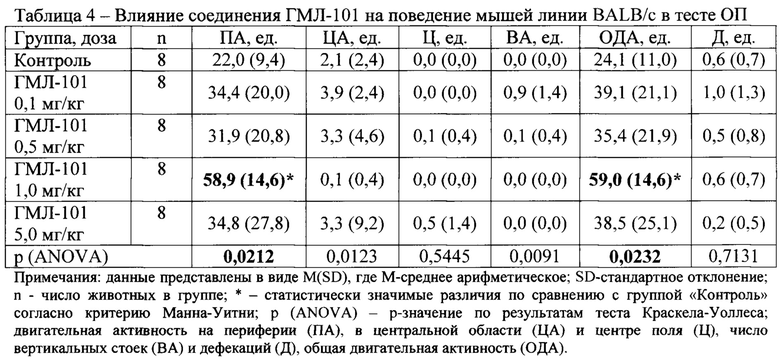
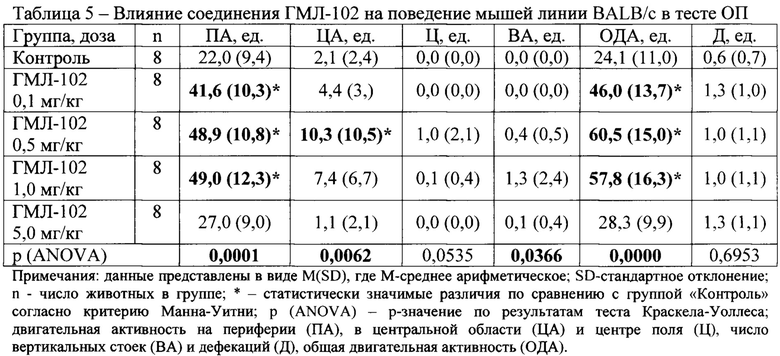
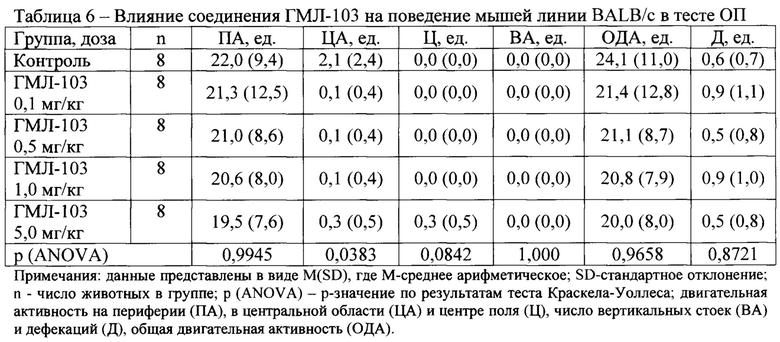
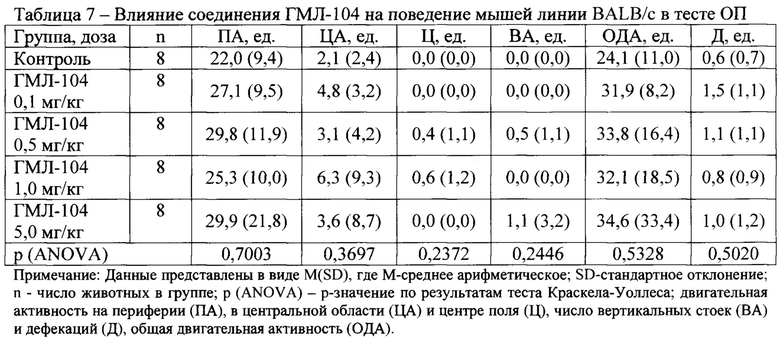
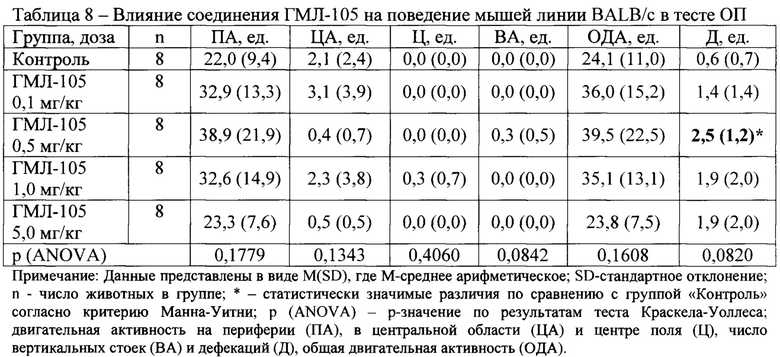
В условиях эмоционально-стрессового воздействия в тесте ОП при внутрибрюшинном введении у соединений ГМЛ-12 в дозах 0,1; 0,5 и 1,0 мг/кг (Таблица 3), ГМЛ-102 в дозах 0,1; 0,5 и 1,0 мг/кг (Таблица 5), ГМЛ-106 в дозах 1,0 и 5,0 мг/кг (Таблица 9) и ГМЛ-101 в дозе 1,0 мг/кг (Таблица 4) обнаружено статистически значимое повышение общей двигательной активности мышей линии BALB/c по сравнению с группой «Контроль», обусловленное, прежде всего, повышением периферической активности и, в некоторых случаях, центральной активности. У соединений ГМЛ-103, ГМЛ-104 и ГМЛ-105 в дозах 0,1; 0,5; 1,0 и 5,0 мг/кг не было выявлено статистически значимых изменений двигательной активности мышей BALB/c по сравнению с контрольной группой (Таблица 6-8). В то же время у соединений ГМЛ-104 в дозах 0,1-5,0 и ГМЛ-105 в дозах 0,1-1,0 мг/кг, а также у ГМЛ-101 в дозах 0,1-0,5 мг/кг наблюдалась тенденция к активности, так как в этих дозах они увеличивало общую двигательную активность в 1,5-1,7 раз.
Таким образом, показано, что в ряду изученных потенциальных TSPO-лигандов, соединения ГМЛ-12 и ГМЛ-102 при внутрибрюшинном способе введения обладают выраженным активирующим действием в широком диапазоне доз (0,1-1,0 мг/кг) у мышей BALB/c в тесте ОП. Данная активация происходила за счет увеличения периферической и центральной двигательной активности, что характерно для соединений, обладающих анксиолитическим действием.
Соединение ГМЛ-106 также проявляло значимую активность в дозах 1,0-5,0 мг/кг, а соединение ГМЛ-101 в дозе 1,0 мг/кг.

Пример 16. Влияние заявляемых соединений на поведение мышей ICR в тесте «приподнятый крестообразный лабиринт».
Установка для теста «приподнятый крестообразный лабиринт» (ПКЛ) для мышей выполнена из поливинилхлорида серого цвета и представляет собой две взаимопересекающиеся под прямым углом горизонтальные дорожки 65×5 см. Два противоположных отсека имеют непрозрачные вертикальные стенки высотой 15 см. Лабиринт приподнят от пола на 40 см. В месте перекрестья плоскостей находится открытая центральная платформа 5×5 см.
Эксперимент проводился в условиях дневного освещения. В начале тестирования животное помещалось в центр лабиринта, что давало возможность переместиться в темные, либо светлые рукава лабиринта в зависимости от преобладания тревоги (боязнь высоты, открытого пространства) или исследовательской активности (что побуждало животное выходить из «защищенных» рукавов).
Исследуемые соединения вводили внутрибрюшинно аутбредным мышам ICR в виде суспензии с Твин-80 и дистиллированной водой. В каждой группе было по 8 мышей.
Оценку поведения мышей в тесте ПКЛ проводили согласно Pellow и соавт. (S. Pellow et al., Neurosci. Meth J., 1985, 14, 149-167) через 30 мин после введения соединений. Фиксировали следующие показатели поведения животных в ПКЛ в течение 300 сек: время нахождения в открытых рукавах (ОР), время нахождения в закрытых рукавах (ЗР), число заходов в открытые рукава, число заходов в закрытые рукава, пребывание (в %) животных в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах лабиринта и число заходов (в %) в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта (Общ).
Статистическую обработку полученных результатов проводили, используя однофакторный дисперсионный анализ (критерий Краскела-Уоллиса) и непараметрический анализ для независимых переменных (U-критерий Манна-Уитни). Данные представлены в виде медианы и квартилей (Me - медиана, q25 - нижний квартиль, q75 - верхний квартиль).
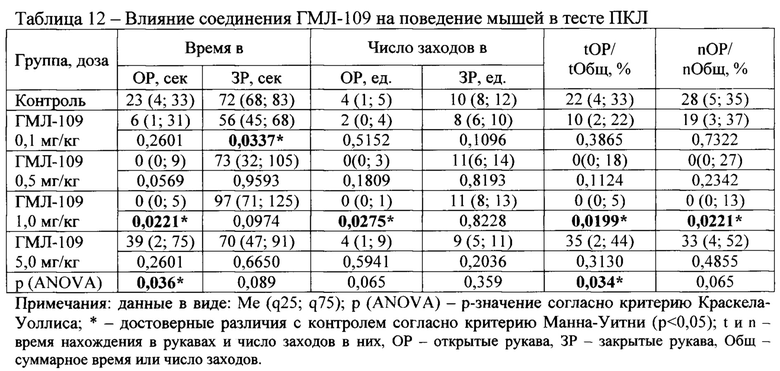
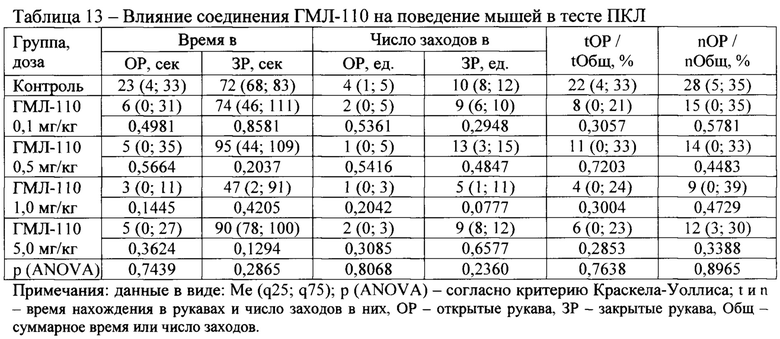
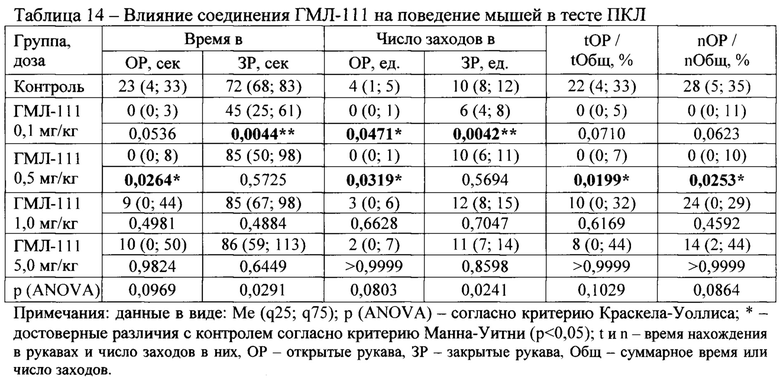
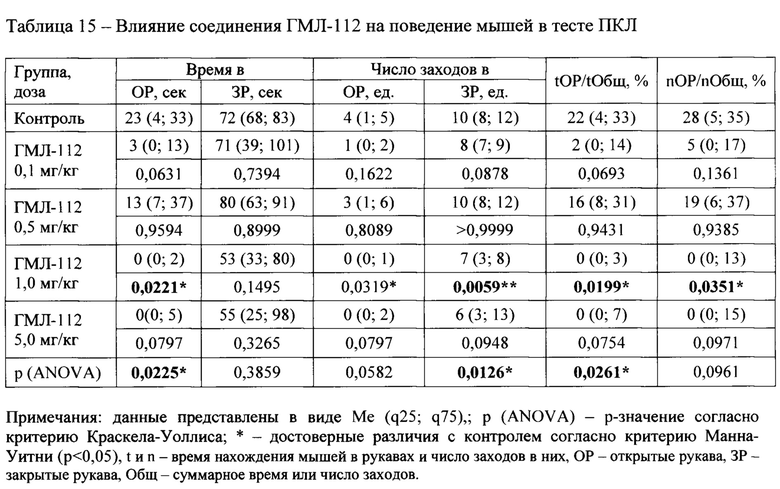
В тесте ПКЛ были исследованы следующие соединения: ГМЛ-107, ГМЛ-108, ГМЛ-109, ГМЛ-110, ГМЛ-111, ГМЛ-112, ГМЛ-113 и ГМЛ-102.
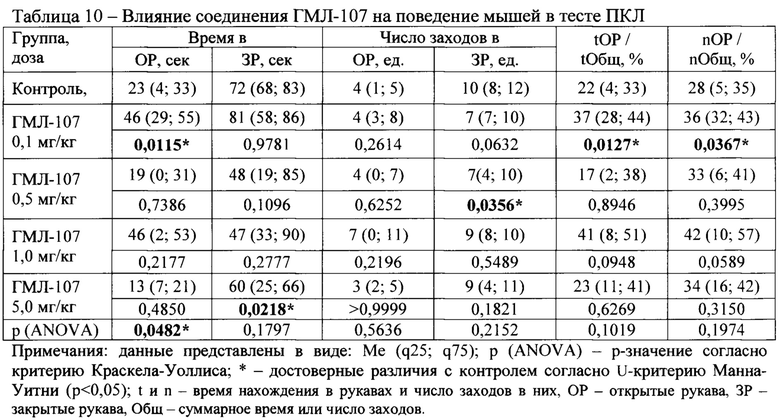
Установлено, что соединение ГМЛ-107 в дозе 0,1 мг/кг при внутрибрюшинном введении статистически значимо увеличивало время пребывания мышей ICR в открытых рукавах лабиринта, время пребывания в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах (tOP/tOбщ) и число заходов в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта (nOP/nОбщ) по сравнению с группой «Контроль», что считается основным критерием проявления анксиолитической активности (Таблица 10). В других изученных в интервалах доз 0,5-5,0 мг/кг соединение ГМЛ-107 не проявило значимой фармакологической активности. Тенденция к активности наблюдалась для соединения ГМЛ-107 в дозе 1,0 мг/кг, в которой отмечалось увеличение параметров tOP/tOбщ и nOP/nОбщ почти в два раза по сравнению со значениями в группе «Контроль».
Соединение ГМЛ-113 (Табл. 16) также проявило значимую активность в дозах 0,5-5,0 мг/кг, достоверно увеличивая значения обоих параметров tOP/tOбщ и nОР/nОбщ. Бензгидрильное производное ГМЛ-102, показавшее наилучшие значения активности в тесте ОП, подтвердило свою эффективность в тесте ПКЛ, обладая достоверной активностью во всех исследуемых дозах от 0,1 до 5,0 мг/кг по параметрам tOP/tOбщ и nOP/nОбщ (Таблица 17).
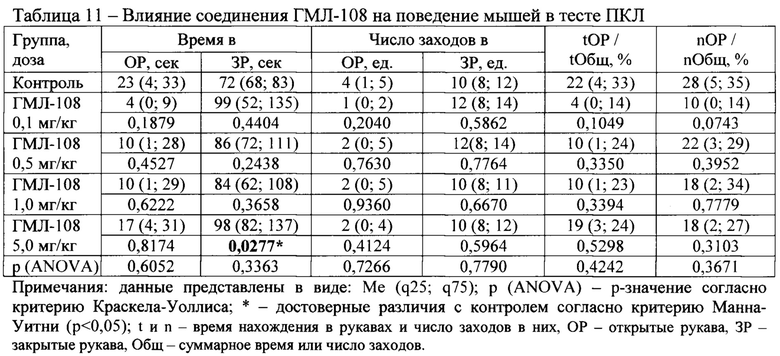
Соединения под шифром ГМЛ-108 и ГМЛ-110 ни в одной из изученных доз не влияли на поведение аутбредных мышей ICR в тесте ПКЛ (Таблица 11, Таблица 13).
Соединения ГМЛ-109 и ГМЛ-112 в дозе 1,0 мг/кг и соединение ГМЛ-111 в дозах 0,1 и 0,5 мг кг/кг статистически значимо по сравнению с контрольной группой уменьшали время пребывания мышей ICR в открытых рукавах лабиринта, число заходов в открытые рукава, время (%) пребывания в открытых рукавах по отношению к суммарному времени в открытых и закрытых рукавах и число (%) заходов в открытые рукава по отношению к суммарному числу заходов в открытые и закрытые рукава лабиринта (Таблица 12, Таблица 15, соответственно). Снижение двигательной и исследовательской активности мышей в тесте ПКЛ на фоне применения указанных соединений может свидетельствовать о наличии в спектре их фармакологической активности седативного или анксиогенного компонента, что в дальнейшем необходимо исследовать с использованием соответствующих методов анализа поведения.
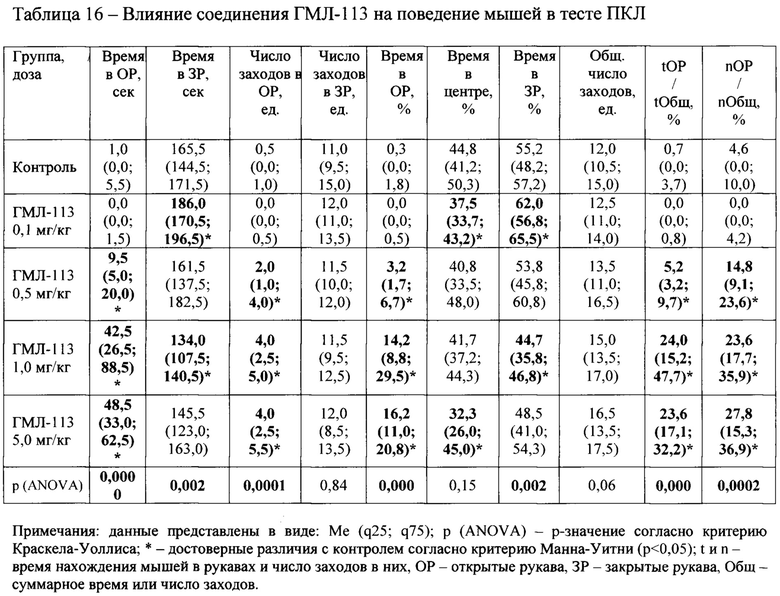
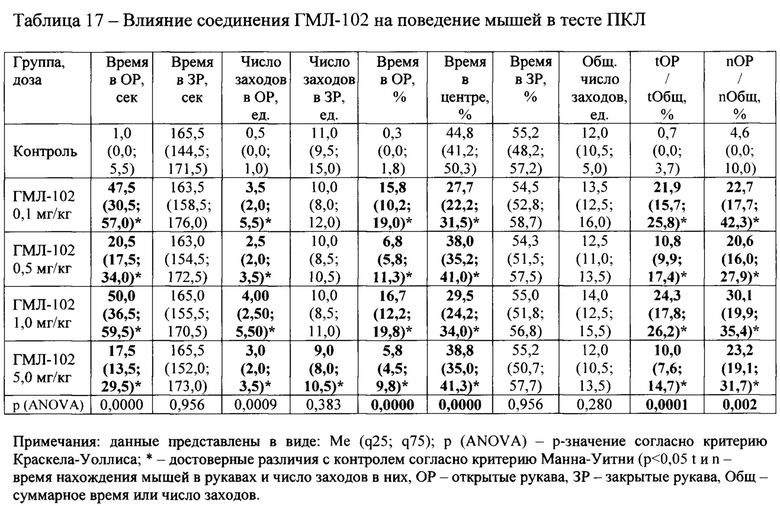
Анализ связи «структура-активность»
В таблице 18 приведено соотнесение результатов оценки анксиолитической активности новых соединений in vivo с некоторыми основными расчетными параметрами, такими как «Docking score» (характеристика энергии связывания «лиганд-рецептор» в молекулярном докинге), липофильность (LogP), общая оценка ADMET-профиля и показатель проникновения через гематоэнцефалический барьер (LogBB).
Хотя полной корреляции между перечисленными параметрами по результатам исследования не наблюдалось, отмечаются определенные закономерности по взаимосвязи биологической активности in vivo с рядом расчетных показателей. Так, в частности, соединения, показавшие наличие анксиолитической активности, обладали в целом более высокими значениями «Docking score» (среднее значение для активных составляет -9,62; для неактивных -9,15). Сходная зависимость наблюдается для показателя липофильности (LogP). В ряду активных соединений среднее значение LogP составляло 5,16, в то время как для веществ, не показавших положительного эффекта среднее LogP равнялось 4,77. Среди ADMET-показателей особую значимость в отношении наличия положительно in vivo эффекта показал параметр LogBB, характеризующий способность соединения проникать через гематоэнцефалический барьер. Установлено, что у веществ, проявивших анксиолитическое действие, среднее значение LogBB составило -0,33. У неактивных молекул среднее LogBB равняется -0,90, то есть их способность проникать через ГЭБ существенно ниже. При исключении из расчетов соединений ГМЛ-103 и ГМЛ-113, выбивающихся из общей закономерности, различие в средних значениях LogBB для активных и неактивных веществ еще более выраженное (-0,23 против -1,06). Эти результаты хорошо согласуются с тем фактом, что для достижения положительного анксиолитического действия соединение должно иметь способность в достаточной степени проникать через гематоэнцефалический барьер.
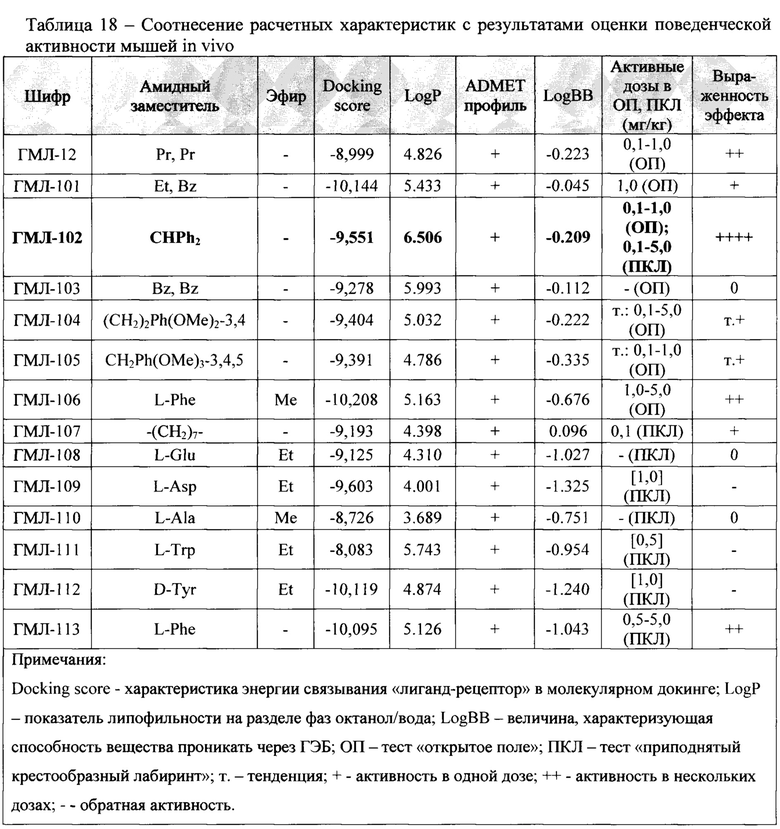
Лучшие результаты по биологической активности продемонстрировало бензгидрильное производное ГМЛ-102, показавшее наличие анксиолитического действия в широком интервале доз в обоих используемых тестах («ОП» и «ПКЛ»). Это соединение имеет одни из лучших расчетных параметров: значение DS=-9,55; высокую липофильность (LogPP=6,506); подходящее значение LogBB=-0,21. Активным также были диалкильное и циклоалкильное производные ГМЛ-12 и ГМЛ-107 с высокими значениями LogBB (-0,22 и 0,10 соответственно). Алкоксиарилалкильные соединения ГМЛ-104 и ГМЛ-105 имели лишь тенденцию к активности. Большинство аминокислотах производных показали отсутствие активности или даже анксиогенное действие. В ряду этих веществ были наименьшие значения LogBB (от -1,33 до -0,68). Исключением явились производные фенилаланина (ГМЛ-106 и ГМЛ-113). Оба этих соединения обладали анксиолитическим эффектом в нескольких дозах. Возможно это обусловлено включением какой-либо дополнительной биомишени в механизм их действия.
| название | год | авторы | номер документа |
|---|---|---|---|
| Дифенилпирроло[1,2-а]пиразин-3-карбоксамиды - соединения, обладающие нейропсихотропной активностью, способы их получения | 2018 |
|
RU2734240C2 |
| Лиганды транслокаторного белка TSPO, обладающие антидепрессивной и ноотропной активностью | 2015 |
|
RU2699568C2 |
| 1-АРИЛПИРРОЛО[1,2-A]ПИРАЗИН-3-КАРБОКСАМИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2572076C2 |
| Фармацевтическая композиция на основе N-бензил-N-метил-1-фенилпирроло [1,2-a] пиразин-3-карбоксамида | 2017 |
|
RU2689396C2 |
| Фармацевтическая композиция на основе N-бутил-N-метил-1-фенилпирроло[1,2-а]пиразин-3-карбоксамида | 2023 |
|
RU2811453C1 |
| ТРИПЕПТИД, ОБЛАДАЮЩИЙ НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2023 |
|
RU2823022C1 |
| Лейцилтриптофановые лиганды TSPO, обладающие анксиолитической активностью | 2020 |
|
RU2757476C2 |
| ЗАМЕЩЕННЫЕ ДИПЕПТИДЫ С НЕЙРОПСИХОТРОПНОЙ АКТИВНОСТЬЮ | 2014 |
|
RU2573823C2 |
| Дипептидные лиганды TSPO, обладающие нейропсихотропной активностью | 2018 |
|
RU2756772C2 |
| 2-ЗАМЕЩЕННЫЕ-1,2,4,5-ТЕТРАГИДРО-3H-ПИРРОЛО[1,2-a][1,4]ДИАЗЕПИН-3-ОНЫ | 2011 |
|
RU2472795C1 |

Изобретение относится к медицинской химии и фармакологии, а именно к биологически активным соединениям группы 1-фенилпирроло[1,2-а]пиразин-3-карбоксамидов, обладающим анксиолитической активностью. Раскрываются 1-Фенилпирроло[1,2-а]пиразин-3-карбоксамид общей формулы (1) и способ лечения заболеваний и состояний нервной системы, требующих применения средств, обладающих анксиолитической активностью, заключающийся во введении эффективного количества соединения общей формулы (1). В общей формуле (1) R1 и R2 могут быть пропильными группами; или фрагмент NR1R2 является азепановой группой; или если R1 является бензильной группой, то R2 может быть этильной или бензильной группой; или если R1 является атомом водорода, то R2 может быть бензгидрильной группой, 3,4-диметоксифенилэтильной группой, 3,4,5-триметоксибензильной группой, (S)-1-метокси-1-оксо-3-фенилпропан-2-ильной группой, (S)-1,5-диэтокси-1,5-диоксопентан-2-ильной группой, (S)-1,4-диэтокси-1,4-диоксобутан-2-ильной группой, (S)-1-метокси-1-оксопропан-2-ильной группой, (S)-1-этокси-3-(1H-индол-3-ил)-1-оксопропан-2-ильной группой, (R)-1-этокси-3-(4-гидроксифенил)-1-оксопропан-2-ильной группой, (S)-1-карбокси-2-фенилэтильной группой. Использование изобретения позволяет эффективно лечить заболевания и состояния нервной системы, требующие применения средств, обладающих анксиолитической активностью. 2 н. и 4 з.п. ф-лы, 4 ил., 18 табл., 16 пр.
1. 1-Фенилпирроло[1,2-а]пиразин-3-карбоксамид общей формулы (1):
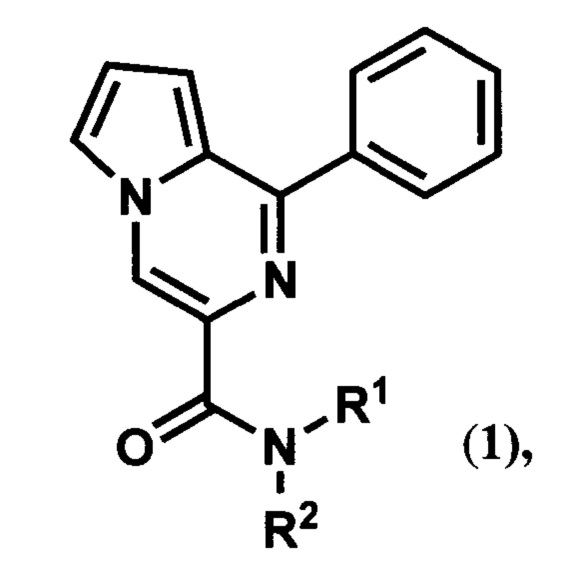
где R1 и R2 могут быть пропильными группами; или фрагмент NR1R2 является азепановой группой; или если R1 является бензильной группой, то R2 может быть этильной или бензильной группой; или если R1 является атомом водорода, то R2 может быть бензгидрильной группой, 3,4-диметоксифенилэтильной группой, 3,4,5-триметоксибензильной группой, (S)-1-метокси-1-оксо-3-фенилпропан-2-ильной группой, (S)-1,5 -диэтокси-1,5-диоксопентан-2-ильной группой, (S)-1,4-диэтокси-1,4-диоксобутан-2-ильной группой, (S)-1-метокси-1-оксопропан-2-ильной группой, (S)-1-этокси-3-(1H-индол-3-ил)-1-оксопропан-2-ильной группой, (R)-1-этокси-3-(4-гидроксифенил)-1-оксопропан-2-ильной группой, (S)-1-карбокси-2-фенилэтильной группой.
2. Соединение по п. 1, представляющее собой 1-фенил-N,N-дипропилпирроло[1,2-а]пиразин-3 -карбоксамид (ГМЛ-12).
3. Соединение по п. 1, представляющее собой N-бензгидрил-1-фенилпирроло[1,2-а] пиразин-3 -карбоксиамид (ГМЛ-102).
4. Соединение по п. 1, представляющее собой метиловый эфир L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-106).
5. Соединение по п. 1, представляющее собой L-3-фенил-2-(1-фенилпирроло[1,2-а]пиразин-3-карбоксиамид)пропановой кислоты (ГМЛ-113).
6. Способ лечения заболеваний и состояний нервной системы, требующих применения средств, обладающих анксиолитической активностью, заключающийся во введении эффективного количества соединения по пп. 1-5.
| 9-[2-(4-ИЗОПРОПИЛФЕНОКСИ)ЭТИЛ]АДЕНИН, ОБЛАДАЮЩИЙ АНТИДЕПРЕССАНТНЫМ И ПРОТИВОСТРЕССОРНЫМ ДЕЙСТВИЕМ | 2013 |
|
RU2529817C1 |
| Дифенилпирроло[1,2-а]пиразин-3-карбоксамиды - соединения, обладающие нейропсихотропной активностью, способы их получения | 2018 |
|
RU2734240C2 |
| АНКСИОЛИТИЧЕСКОЕ СРЕДСТВО | 2019 |
|
RU2700576C1 |
| Gaevaya, L.M | |||
| et al., Physicochemical Properties and Analytical Method Development for Drug Substance of GML-1, a Novel Original Anxiolytic Preparation | |||
| Pharm Chem J, 2018, vol | |||
| Устройство для устранения мешающего действия зажигательной электрической системы двигателей внутреннего сгорания на радиоприем | 1922 |
|
SU52A1 |
Авторы
Даты
2024-01-22—Публикация
2022-07-11—Подача