Изобретение относится к биотехнологии и может быть использовано для получения дифференцированных клеток HepaRG в составе сфероидов с высоким уровнем экспрессии основных цитохромов Р450 как модели печени человека, в частности, для доклинической оценки биотрансформации и гепатотоксичности лекарственных средств.
Клетки линии HepaRG обладают уникальной способностью дифференцироваться in vitro и приобретать основные характеристики зрелых гепатоцитов человека, включая экспрессию цитохромов семейства Р450, ферментов II фазы метаболизма, транспортеров и ядерных рецепторов [ S. et al. Stable expression, activity, and inducibility of cytochromes P450 in differentiated HepaRG cells. // Drug Metab. Dispos. 2010. Vol. 38, №3. P. 516-525].
S. et al. Stable expression, activity, and inducibility of cytochromes P450 in differentiated HepaRG cells. // Drug Metab. Dispos. 2010. Vol. 38, №3. P. 516-525].
Для дифференцировки и достижения оптимальной экспрессии ферментов метаболизма клетки HepaRG культивируют в высокой плотности (в монослое, 2D) в присутствии ДМСО (1-2% ДМСО). В таких условиях (в присутствии ДМСО), например, основной цитохром печени Сур3А4 не отвечает на воздействие стандартных индукторов, фенобарбитала и рифампицина, а при отмене ДМСО происходит значительное снижение активности и экспрессии цитохромов. Следовательно, необходим подбор условий культивирования для создания аккуратной модели, содержащей функциональные гепатоциты [ S. et al. Stable expression, activity, and inducibility of cytochromes P450 in differentiated HepaRG cells. // Drug Metab. Dispos. 2010. Vol. 38, №3. P. 516-525; LeCluyse E.L. et al. Organotypic liver culture models: meeting current challenges in toxicity testing. // Crit. Rev. Toxicol. 2012. Vol. 42, №6. P. 501-548].
S. et al. Stable expression, activity, and inducibility of cytochromes P450 in differentiated HepaRG cells. // Drug Metab. Dispos. 2010. Vol. 38, №3. P. 516-525; LeCluyse E.L. et al. Organotypic liver culture models: meeting current challenges in toxicity testing. // Crit. Rev. Toxicol. 2012. Vol. 42, №6. P. 501-548].
Один из подходов решения данной проблемы заключается в формировании органотипических трехмерных (3D) моделей. Данные модели в наибольшей степени отражают структурную организацию ткани (межклеточные контакты, полярность клеток и т.п.). Кроме того, биохимические, метаболические и сигнальные пути в клетках в составе таких моделей наиболее активны по сравнению с 2D моделями [LeCluyse E.L. et al. Organotypic liver culture models: meeting current challenges in toxicity testing. // Crit. Rev. Toxicol. 2012. Vol. 42, №6. P. 501-548; Takahashi Y. et al. Three-dimensional (3D) spheroid cultures improve the metabolic gene expression profiles of HepaRG cells. // Biosci. Rep. 2015]. Для поддержания и длительного сохранения функциональной активности 3D моделей печени используют несколько подходов или их сочетание: 1) культивируют сфероиды в средах со смесью факторов, гормонов, антиоксидантов без добавления сыворотки/компонентов животного происхождения (Biopredic, Life Technologies, PromoCell); 2) включают в состав сфероидов непаренхимные клетки печени (клетки эндотелия сосудов, звездчатые клетки, клетки Купфера и т.п.), способные формировать внеклеточный матрикс и выделять факторы роста, хемокины (Insphero); 3) используют внеклеточные матриксы и микробиореакторы с циркуляцией питательной среды [Bao J. et al. Serum-free medium and mesenchymal stromal cells enhance functionality and stabilize integrity of rat hepatocyte spheroids. // Cell Transplant. 2013. Vol. 22, №2. P. 299-308; Wang Z. et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. // J. Appl. Toxicol. 2015. Vol. 35, №8. P. 909-917; Materne E.-M., Tonevitsky A.G., Marx U. Chip-based liver equivalents for toxicity testing--organotypicalness versus cost-efficient high throughput. // Lab Chip. 2013. Vol. 13, №18. P. 3481-3495; Press A.T. et al. Cell type-specific delivery of short interfering RNAs by dye-functionalised theranostic nanoparticles. // Nat. Commun. 2014. Vol. 5. P. 5565.]. Протоколы формирования 3D моделей печени и способы поддержания их функциональной активности разнообразны и зависят от типа клеток и их происхождения (первичные гепатоциты человека или животных, клетки линии HepaRG и т.д.), а также от поставленных задач (анализ гепатотоксичности препаратов, создание модели фиброза, диабета и т.п.).
В патенте US 7456018 В2 описана линия гепатомы человека и условия культивирования. В изобретении представлен набор клеток, полученный из клонированных раковых клеток печени человека. Представленная клеточная культура подходит для использования в диагностических, терапевтических и профилактических целях, для исследований вирусных заболеваний. Клеточная линия HepaRG получена из гепатом и является примером клеточной линии, имеющей все характеристики линий, может быть инфицирована естественным путем паразитами, вирусами, имеет соответствующие клеткам печени морфологические характеристики, и обладает всеми биологическими функциями гепатоцита.
Клетки были выделены из опухоли печени, взятой у пациента, страдающего от гепатокарциномы и вирусного гепатита С.
Процесс культивирования включает в себя:
- фазу пролиферации клеток в культуральной среде, содержащей кортикостероиды в нетоксичной концентрации, которая способствует оптимальной дифференциации нормальных гепатоцитов человека;
- далее, достигнув полной конфлюентности, в фазу дифференцировки клеток добавление ДМСО в количестве, достаточном для индукции дифференцировки.
В патенте описано использование различных культуральных сред для получения, поддержания, пролиферации, дифференциации, трансфекции, инфецировании линии. Культуральная среда должна содержать, по крайней мере, один кортикостероид, преимущественно гидрокортизона гемисукцинат в нетоксичной концентрации, которая способствует оптимальной дифференциации нормальных гепатоцитов человека, для сохранения стабильности клеточной популяции. Для культивирования клеток HepaRG используют среду Вильямса Е, с 5 мкг/мл инсулина, 100 ед/мл пенициллина, 100 мкг/мл стрептомицина, 5,10 - 7 М гидрокортизона гемисукцината, 2 мМ/мл L-глутамина и 10% FCS.
Кариотип клеток HepaRG следует анализировать после 8 пассажей. Для изменения морфологии клеток при дифференциации используют среду, которую готовят из основной среды, содержащей только 5 мг/л инсулина и 10% FCS, 2% ДМСО и 5*10-5 М гидрокортизон гемисукцината. При культивировании после 2-4-х дней среда вызывает гибель более 90% клеток и морфология выживших клеток значительно изменяется.
Во время фазы пролиферации, клетки HepaRG образуют однородную популяцию с эпителиальным фенотипом (отсутствие регулярной структурной организации). После того как будет достигнута полная конфлюентность, клетки претерпевают значительные морфологические изменения. После четырех недель увеличивается число гранулированных гепатоцитов. Добавление ДМСО через две недели индуцирует полную морфологическую дифференциацию - происходит организация клеток в трабекулы, результаты сопоставимы с полученными в первичной культуре нормальных гепатоцитов, образующих структуры типа каналец.
В патенте приведены значения экспрессии основных генов клеток линии HepaRG. Более того, при сравнении были установлены соотносимые уровни экспрессии в человеческих гепатоцитах и клетках HepaRG.
Клетки HepaRG обладают активностью ферментов, связанных с функцией детоксикации на уровне, практически эквивалентном для нормальных гепатоцитов человека, за исключением декстрометорфана деметилазы, активность которой немного меньше.
Недостатком данной методики культивирования в присутствии ДМСО является отсутствие индкуции основного цитохрома печени Сур3А4 при добавлении фенобарбитала и рифампицина, а также отсутствие трехмерной структурной организации.
В патенте ЕР 2421954 A1 (WO 2010123357 А1) описано изобретение, включающее культуру клеточной линии человеческого гепатоцита и ее использование в биоискуственной системе печени (BAL). Эти системы используют для лечения пациентов, страдающих от недостаточности печени, что позволяют временно компенсировать потери гепатоцеллюлярной функции и содержат биореактор с функциональными клетками печени. Основная сложность - получение клеток с широким функциональным спектром метаболизма из недавно выделенных гепатоцитов человека, пригодных для успешного клинического применения в BAL. Авторами настоящего изобретения удалось разработать линию человеческих гепатоцитов с широким спектром метаболизма и функциональными возможностями.
В качестве культуры используют HepaRG, взятую из национальной коллекции культур микроорганизмов Института Пастера, (№1-2652). Клетки культивируют в виде 3D-образований. В фазу пролиферации гепатоциты культивируют в среде, предпочтительно содержащей сыворотку, гормоны, факторы роста и антибиотики. В фазе дифференцировки гепатоциты культивируют в среде, предпочтительно содержащей, по меньшей мере, 0,5 мМ глутамата, сыворотки, гормоны, факторы роста и антибиотики. Фаза дифференцировки клеток включает культивирование клеток в культуральной среде не содержащей ДМСО.
На этапе пролиферации клетки культивируют в виде монослоя или суспензии, далее в виде трехмерных моделей.
В патенте описана культуральная среда. Дифференцированные клетки имеют печень-специфическую метаболическую активность, характеризуемую следующими метаболическими параметрами:
- скорость элиминации аммиака должна составлять, по меньшей мере, 0,05 мкмоль/ч/мг белка;
- скорость производства мочевины должна составлять, по крайней мере, 0,003 мкмоль/ч/мг белка;
- скорость производства apoAl должна составлять, по крайней мере, 0,02 нг/ч/мг белка;
- скорость потребления лактата должна составлять, по меньшей мере, 0,02 мкмоль/ч/мг протеина.
- скорость производства альбумина должна составлять, по крайней мере, 1 нг/ч/мг белка.
Уровень экспрессии CPS в дифференцированных клетках должен составлять не более 20%, предпочтительно более 40% от уровня экспрессии 18S рРНК; уровень экспрессии GS более 250%, предпочтительно более 300%, уровень экспрессии CYP3A4 должен превышать 70%, предпочтительно более 100%.
Техническая задача, на решение которой направлено разработанное техническое решение, состоит в разработке способа дифференцировки клеток HepaRG для получения модели печени человека в виде сфероидов клеток HepaRG с высоким уровнем экспрессии основных цитохромов Р450.
Технический результат, получаемый при реализации разработанного способа, состоит в возможности исследования метаболизма и токсичности фармпрепаратов в клетках HepaRG.
Для достижения указанного технического результата предложено использовать способ дифференцировки и культивирования без добавления ДМСО и сыворотки.
Клетки линии HepaRG культивируют в полной питательной среде (ППС): William’s Е с добавлением L-глутамина (Gibco, США), 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США), 5 мкг/мл рекомбинантного инсулина человека (Gibco, США), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1% пенициллина/стрептомицина (Gibco, США), в CO2-инкубаторе (37°C, 95% воздуха, 5% СО2, относительная влажность 98%).
По достижении клетками конфлюентного монослоя для индукции дифференцировки в ППС вносят 2% ДМСО. Через 14 дней после начала дифференцировки формируют сфероиды, состоящие из 5000 клеток HepaRG, в ППС без ДМСО;
Сфероиды формируют в 96-луночных планшетах с низкой адгезией и U-образным дном в течение 5 дней.
После 5 дней формирования сфероиды переносят в бессывороточную питательную среду и инкубируют еще сутки. В состав бессывороточной питательной среды (БПС) входят: William’s Е с добавлением L-глутамина (Gibco, США), 1x Insulin-Transferrin-Selenium (ITS-G, Thermo Scientific, США), 1 μг/мл бычьего сывороточного альбумина (BSA, Sigma, Германия), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1х заменимых аминокислот (NEAA, Thermo Scientific, США), 1% пенициллина/стрептомицина (Gibco, США) [PromoCell (Hepatocyte Medium), Life Technologies (Hepatocyte Maintenance Supplement Pack)] [Bao J. et al. Serum-free medium and mesenchymal stromal cells enhance functionality and stabilize integrity of rat hepatocyte spheroids. // Cell Transplant. 2013. Vol. 22, №2. P. 299-308; Wang Z. et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. // J. Appl. Toxicol. 2015. Vol. 35, №8. P. 909-917].
Изобретение поясняется чертежами.
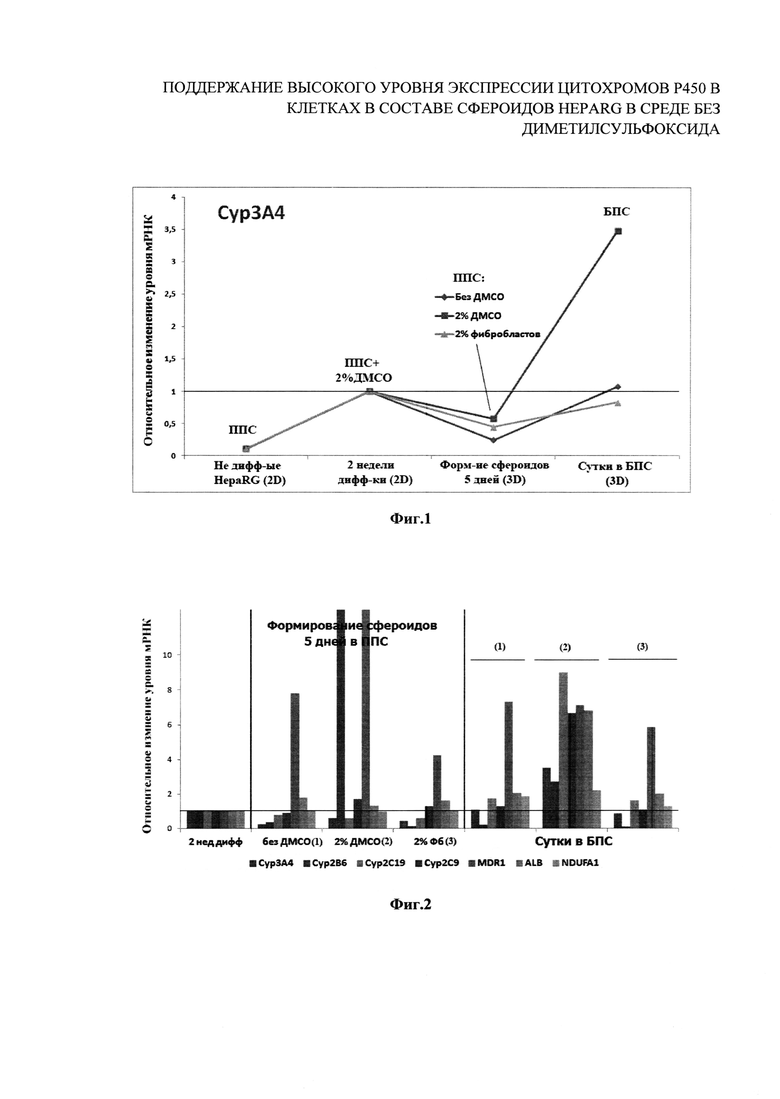
На фиг. 1 представлены результаты исследования уровня экспрессии цитохрома 3А4 при различных условиях дифференцировки и культивирования в бессывороточной питательной среде (БПС) и среде, содержащей сыворотку (ППС). В частности, на фиг. 1 представлен анализ уровня экспрессии цитохрома 3А4 (Сур3А4) в недифференцированных клетках HepaRG, культивируемых в монослое (2D), в дифференцированных в течение 2 недель в среде с 2% ДМСО клетках HepaRG (2D), в клетках в составе сфероидов, формировавшихся в течение 5 дней в планшете с низкой адгезией в ППС без ДМСО, с 2% ДМСО или 2% фибробластов, и в клетках в составе сфероидов после переноса их в БПС (без ДМСО и без сыворотки) на сутки. Изменение экспрессии Cyp3A4 рассчитывали относительно уровня экспрессии в дифференцированных клетках HepaRG.
На фиг. 2 представлены результаты исследования уровня экспрессии цитохромов при различных условиях дифференцировки и культивирования в бессывороточной питательной среде (БПС) и среде, содержащей сыворотку (ППС). В частности, фиг. 2 демонстрирует изменение экспрессии генов в клетках HepaRG при формировании сфероидов в ППС без ДМСО, с 2% ДМСО или 2% фибробластов (2ая секция) и дальнейшем переносе сформированных сфероидов на сутки в БПС (3я секция) относительно дифференцированных в течение 2 недель клеток HepaRG.
Изобретение поясняется примерами конкретного выполнения.
Пример 1. Исследование гепатотоксичности ксенобиотиков.
Клетки линии HepaRG культивировали в полной питательной среде (ППС): William’s Е с добавлением L-глутамина (Gibco, США), 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США), 5 мкг/мл рекомбинантного инсулина человека (Gibco, США), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1% пенициллина/стрептомицина (Gibco, США), в СО2-инкубаторе (37°C, 95% воздуха, 5% CO2, относительная влажность 98%).
По достижении клетками конфлюентного монослоя для индукции дифференцировки в ППС вносили 2% ДМСО. Через 14 дней после начала дифференцировки формировали сфероиды, состоящие из 5000 клеток HepaRG, в ППС без ДМСО.
Сфероиды формировали в 96-луночных планшетах с низкой адгезией и U-образным дном в течение 5 дней.
После 5 дней формирования сфероиды переносили в бессывороточную питательную среду и инкубировали еще сутки. В состав бессывороточной питательной среды (БПС) входят: William’s Е с добавлением L-глутамина (Gibco, США), 1x Insulin-Transferrin-Selenium (ITS-G, Thermo Scientific, США), 1 μг/мл бычьего сывороточного альбумина (BSA, Sigma, Германия), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1х заменимых аминокислот (NEAA, Thermo Scientific, США), 1% пенициллина/стрептомицина (Gibco, США) [PromoCell (Hepatocyte Medium), Life Technologies (Hepatocyte Maintenance Supplement Pack)] [Bao J. et al. Serum-free medium and mesenchymal stromal cells enhance functionality and stabilize integrity of rat hepatocyte spheroids. // Cell Transplant. 2013. Vol. 22, №2. P. 299-308; Wang Z. et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. // J. Appl. Toxicol. 2015. Vol. 35, №8. P. 909-917].
Полученные сфероиды культивировали в условиях замкнутого цикла циркуляции питательной среды с помощью микробиореактора (МБР) «Гомункулус» [Samatov T.R. et al. Modelling the metastatic cascade by in vitro microfluidic platforms. // Prog. Histochem. Cytochem. 2015. Vol. 49, №4. P. 21-29].
Инкубацию с ксенобиотиками (ацетаминофен, метформин и изониазид) проводили в течение 48 ч в бессывороточной питательной среде, состоящей из William’s Е (Gibco, США), 2 мМ L-глутамина (Gibco, США), 1 мг/мл альбумина сыворотки крови человека (Sigma, США), питательной добавки, состоящая из инсулина, трансферрина и селена (5.5 мкг/мл инсулина, Gibco, США), несущественных аминокислот (Gibco, США), 50 мкМ гидрокортизона гемисукцината (Sigma, США), 1% пенициллина/стрептомицина (Gibco, США).
Жизнеспособность клеток оценивали по способности живых клеток превращать растворимый желтый бромид 3-(4,5-диметилтиазол-2-ил)-2,5-тетразолия (МТТ) в нерастворимые пурпурно-синие внутриклеточные кристаллы МТТ-формазана (МТТ-ф), как описано в [Burmistrova и др., 2013].
Разрывы ДНК детектировали цитофлуориметрически с помощью метода TUNEL (терминального дезоксиуридинового мечения концов) Click-iT® Plus TUNEL Assay (Life Technologies, США), согласно протоколу производителя.
Экспериментальное определение концентраций лактата в образцах культуральных сред проводили спектрофотометрически с использованием тест-системы Lactate Dry-fast (Sentinel Diagnostics, Италия) согласно протоколу производителя.
Пример 2. Исследование биотрансформации лекарственных средств в системах in vitro на примере двух тестовых лекарственных средств, варфарина и дазатиниба.
Клетки линии HepaRG культивировали в полной питательной среде (ППС): William’s Е с добавлением L-глутамина (Gibco, США), 10% фетальной бычьей сыворотки (HyClone, Thermo Scientific, США), 5 мкг/мл рекомбинантного инсулина человека (Gibco, США), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1% пенициллина/стрептомицина (Gibco, США), в CO2-инкубаторе (37°C, 95% воздуха, 5% CO2, относительная влажность 98%).
По достижении клетками конфлюентного монослоя для индукции дифференцировки в ППС вносили 2% ДМСО. Через 14 дней после начала дифференцировки формировали сфероиды, состоящие из 5000 клеток HepaRG, в ППС без ДМСО.
Сфероиды формировали в 96-луночных планшетах с низкой адгезией и U-образным дном в течение 5 дней.
После 5 дней формирования сфероиды переносили в бессывороточную питательную среду и инкубировали еще сутки. В состав бессывороточной питательной среды (БПС) входят: William’s Е с добавлением L-глутамина (Gibco, США), 1x Insulin-Transferrin-Selenium (ITS-G, Thermo Scientific, США), 1 μг/мл бычьего сывороточного альбумина (BSA, Sigma, Германия), 5×10-5 М гидрокортизона гемисукцината (Sigma, США), 1х заменимых аминокислот (NEAA, Thermo Scientific, США), 1% пенициллина/стрептомицина (Gibco, США) [PromoCell (Hepatocyte Medium), Life Technologies (Hepatocyte Maintenance Supplement Pack)] [Bao J. et al. Serum-free medium and mesenchymal stromal cells enhance functionality and stabilize integrity of rat hepatocyte spheroids. // Cell Transplant. 2013. Vol. 22, №2. P. 299-308; Wang Z. et al. HepaRG culture in tethered spheroids as an in vitro three-dimensional model for drug safety screening. // J. Appl. Toxicol. 2015. Vol. 35, №8. P. 909-917].
Полученные сфероиды культивировали в условиях замкнутого цикла циркуляции питательной среды с помощью микробиореактора (МБР) «Гомункулус» [Samatov T.R. et al. Modelling the metastatic cascade by in vitro microfluidic platforms. // Prog. Histochem. Cytochem. 2015. Vol. 49, №4. P. 21-29].
| название | год | авторы | номер документа |
|---|---|---|---|
| МИКРОФЛЮИДНОЕ УСТРОЙСТВО ДЛЯ ИССЛЕДОВАНИЯ ВЛИЯНИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ НА КЛЕТКИ МЛЕКОПИТАЮЩИХ | 2016 |
|
RU2672581C2 |
| СРЕДСТВО ДЛЯ СЕЛЕКТИВНОЙ АПОПТОТИЧЕСКОЙ ЭЛИМИНАЦИИ ОПУХОЛЕВЫХ КЛЕТОК | 2014 |
|
RU2567670C2 |
| Способ оценки способности клеток рака молочной железы к дедифференцировке методом образования сфероидов | 2022 |
|
RU2805842C1 |
| КЛЕТОЧНЫЙ ПРОДУКТ ИНСУЛИН-ПРОДУЦИРУЮЩИХ КЛЕТОК МЛЕКОПИТАЮЩИХ И ЕГО ИСПОЛЬЗОВАНИЕ ДЛЯ ТЕРАПИИ САХАРНОГО ДИАБЕТА | 2017 |
|
RU2663118C1 |
| Способ ингибирования метастазирования опухолей путем подавления дедифференцировки опухолевых клеток | 2023 |
|
RU2840966C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК ДЛЯ ЗАМЕСТИТЕЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ ПАТОЛОГИЙ ПЕЧЕНИ | 2012 |
|
RU2510276C1 |
| Способ подбора лекарственных средств для реализации фармакологической индукции митохондриальной дисфункции в макрофагах для противоопухолевой терапии | 2023 |
|
RU2810558C1 |
| СПОСОБ СЕЛЕКЦИИ КАРДИОМИОЦИТОВ (ВАРИАНТЫ) | 2007 |
|
RU2426784C2 |
| ПРИМИТИВНЫЕ И ПРОКСИМАЛЬНЫЕ ПЕЧЕНОЧНЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2003 |
|
RU2327479C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХРЯЩЕПОДОБНЫХ СТРУКТУР ИЗ СТВОЛОВЫХ КЛЕТОК С ИНДУЦИРОВАННОЙ ПЛЮРИПОТЕНТНОСТЬЮ И СТРУКТУРЫ, ПОЛУЧЕННЫЕ УКАЗАННЫМ СПОСОБОМ | 2023 |
|
RU2814248C1 |
Изобретение относится к биотехнологии, в частности к получению сфероидов клеток HepaRG, экспрессирующих цитохромы Р450 3А4, 2В6, 2С19, 2С9. Способ включает культивирование клеток HepaRG в полной питательной среде William’s E с добавлением L-глутамина, 10% фетальной бычьей сыворотки, 5 мкг/мл рекомбинантного инсулина человека, 5х10-5 М гидрокортизона гемисукцината, 1% пенициллина/стрептомицина, в СО2-инкубаторе при 37°C, 95% воздуха, 5% CO2 и относительной влажности 98%, индукцию. Далее способ включает перенос в 96-луночные планшеты с низкой адгезией и U-образным дном для формирования сфероидов и последующее инкубирование сфероидов в бессывороточной питательной среде William’s E с добавлением L-глутамина, 1х Insulin-Transferrin-Selenium, 1 мкг/мл бычьего сывороточного альбумина, 5х10-5 М гидрокортизона гемисукцината, 1х заменимых аминокислот, 1% пенициллина или стрептомицина при 37°C, 95% воздуха, 5% СО2 и относительной влажности 98%. Изобретение позволяет получить сфероиды клеток HepaRG, экспрессирующие цитохромы Р450 3А4, 2В6, 2С19, 2С9, для исследования метаболизма и токсичности фармацевтических препаратов. 3 з.п. ф-лы., 2 ил., 2 пр.
1. Способ получения сфероидов клеток HepaRG, экспрессирующих цитохромы Р450 3А4, 2В6, 2С19, 2С9, включающий культивирование клеток HepaRG в полной питательной среде William’s E с добавлением L-глутамина, 10% фетальной бычьей сыворотки, 5 мкг/мл рекомбинантного инсулина человека, 5х10-5 М гидрокортизона гемисукцината, 1% пенициллина/стрептомицина в СО2-инкубаторе при 37°C, 95% воздуха, 5% CO2 и относительной влажности 98%, индукцию, перенос в 96-луночные планшеты с низкой адгезией и U-образным дном для формирования сфероидов и последующее инкубирование сфероидов в бессывороточной питательной среде William’s E с добавлением L-глутамина, 1х Insulin-Transferrin-Selenium, 1 мкг/мл бычьего сывороточного альбумина, 5х10-5 М гидрокортизона гемисукцината, 1х заменимых аминокислот, 1% пенициллина или стрептомицина при 37°C, 95% воздуха, 5% СО2 и относительной влажности 98%.
2. Способ по п.1, отличающийся тем, что по достижении клетками конфлюентного монослоя для индукции дифференцировки в ППС вносят 2% ДМСО и культивируют 14 дней.
3. Способ по п.1, отличающийся тем, что сфероиды формируют в планшетах в течение 5 дней.
4. Способ по п.1, отличающийся тем, что инкубирование в бессывороточной питательной среде осуществляют в течение 1 дня в СО2-инкубаторе.
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ХРОНИЧЕСКОГО ВИРУСНОГО ГЕПАТИТА И ЦИРРОЗА ПЕЧЕНИ | 2008 |
|
RU2383021C1 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК ДЛЯ ЗАМЕСТИТЕЛЬНОЙ КЛЕТОЧНОЙ ТЕРАПИИ ПАТОЛОГИЙ ПЕЧЕНИ | 2012 |
|
RU2510276C1 |
| Способ получения цитохрома Р-450 | 1989 |
|
SU1693043A1 |
| WO 2014159622 A1, 02.10.2014 | |||
| WO 2015185714 A1, 10.12.2015 | |||
| ГОРКУН А.А | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| канд.биол.наук, 2012 | |||
| М.: ФГБУ "Научно-исследовательский институт общей патологии и патофизиологии" | |||
| Видоизменение пишущей машины для тюркско-арабского шрифта | 1923 |
|
SU25A1 |
| ЦОЙ А.М | |||
| и др | |||
| "Микрокапсулированные мультиклеточные опухолевые сфероиды: получение и использование в качестве модели in vitro для тетирования лекарств", Биомедицинская химия, 2010; 56(6):674-685. | |||
Авторы
Даты
2018-07-11—Публикация
2016-01-21—Подача