Изобретение относится к медицине, к онкологии, а именно к способам оценки способности клеток рака молочной железы к дедифференцировке, и может быть использовано для изучения стволовой пластичности дифференцированных клеток рака молочной железы при исследовании фундаментальных механизмов канцерогенеза, для предсказания рисков развития метастазов после оперативного удаления опухоли и для оценки эффективности новых противораковых препаратов, а именно антиметастатических препаратов. Способ заключается в культивировании клеток рака молочной железы в полной питательной среде с добавлением эмбриональной телячьей сыворотки, глутамина, антибиотика в стандартных условиях в СО2-инкубаторе при 37°C, снятии клеток с поверхности пластика, дезагрегации и получении одноклеточной суспензии путем фильтрования через клеточное сито, отборе дифференцированных клеток методом иммуного сортинга, переносе клеток в 6-луночные планшеты с низкой адгезией к пластику, индукции дедифференцировки клеток за счет добавления в среду интерлейкина 6, формировании сфероидов в среде на основе Mammocult Basal Medium в СО2-инкубаторе в течение 7 дней, и обнаружении сфероидов, подсчета их количества и данных измерения диаметра сформировавшихся сфероидов с использованием микроскопа.
В связи с недавно доказанной ролью диффренцированных клеток рака в формировании микрометастазов и их способности давать начало макрометастазам в отдаленных тканях и органах [Chikina AS, Aleksandrova AIu. [The cellular mechanisms and regulation of metastasis formation]. Mol Biol (Mosk). 2014 Mar-Apr;48(2):195-213. Russian. PMID: 25850289; Chaffer CL, Marjanovic ND, Lee T, Bell G, Kleer CG, Reinhardt F, D'Alessio AC, Young RA, Weinberg RA. Poised chromatin at the ZEB1 promoter enables breast cancer cell plasticity and enhances tumorigenicity. Cell. 2013 Jul 3;154(1):61-74. doi: 10.1016/j.cell.2013.06.005. PMID: 23827675; PMCID: PMC4015106; Piyush B. Gupta, Christine M. Fillmore, Guozhi Jiang, Sagi D. Shapira, Kai Tao, Charlotte Kuperwasser, Eric S. Lander, Stochastic State Transitions Give Rise to Phenotypic Equilibrium in Populations of Cancer Cells, Cell, Volume 146, Issue 4, 2011, Pages 633-644, ISSN 0092-8674, doi.org/10.1016/j.cell.2011.07.026] появилась острая потребность в методах, позволяющих проводить оценку способности диффренцированых раковых клеток образовывать вторичные опухолевые узлы, в том числе для разарботки противоопухолевых, антиметастатических препаратов. Для решения данной задачи может быть применен метод образоания сфероидов.
Известен способ получения сфероидов, первоначально описанный Dontu et al. (In vitro propagation and transcriptional profiling of human mammary stem/progenitor cells. DOI: 10.1101/gad.1061803), в котором ткани нормальной молочной железы диссоциировали до одноклеточной суспензии, после чего инкубировали в бессывороточной ростовой среде для эпителиальных клеток молочной железы с добавлением B27, эпидермальный фактор роста (EGF), фактора роста фиброблатов (bFGF) и гепарина в плашках с неадгезивной поверхностью для образования сфероидов. Ограничением данного метода является то, что для анализа не проводится отбор популяции дифференцированных клеток, а сам метод применяют для изучения стволовых клеток.
В патенте (WO/2017/207737 Methods For Producing Cancer Stem Cell Spheroids) описан способ получения популяции раковых клеток, образующих сфероиды, включающих следующие этапы: 1. выращивание раковых клеток в суспензионной культуре в первой культуральной среде на одном или нескольких первых планшетах для тканевых культур с низкой адгезией, тем самым формируются раковые клеточные сфероиды, обогащенные раковыми стволовыми клетками; 2. дезагрегация указанных сфероидов раковых клеток с образованием суспензии одиночных клеток, обогащенных раковыми стволовыми клетками; 3. посев указанной суспензии одиночных клеток во второй культуральной среде на один или несколько вторых планшетов для тканевых культур с низкой адгезией; и 4. замораживание указанной суспензии отдельных клеток в указанных одной или нескольких вторых чашках для тканевых культур с получением таким образом популяции готовых к использованию сфероидобразующих раковых клеток. Данная методика может быть использована для производства массы раковых клеток, исследования механизмов или способов лечения различных видов рака.
Недостатком данного способа является то, что опухоль и ее клеточная суспензия не является однородной и содержит клетки разной степени зрелости, не оценивается возможность дедифференцировки зрелых клеток и их участие в образовании сфероидов.
Известен метод стимуляции клеточных линий рака молочной железы онкостатином М - цитокином из семейства интерлейкина-6, который опосредует фенотипические изменения клеток, индуцирует дедифференцировку и тем самым усиливает образование сфероидов (West N., Murray J., Watson P. Oncostatin-M promotes phenotypic changes associated with mesenchymal and stem cell-like differentiation in breast cancer. Oncogene. 2014; 33(12): 1485-94. doi: 10.1038/onc.2013.105; Junk D.J., Bryson B.L., Smigiel J.M., Parameswaran N., Bartel C.A., Jackson M.W. Oncostatin M promotes cancer cell plasticity through cooperative STAT3-SMAD3 signaling. Oncogene. 2017; 36(28): 4001-13. doi: 10.1038/onc.2017.33). Согласно этому методу клетки рака молочной железы (РМЖ) в виде одноклеточной суспензии культивируют на низкоадгезионных плашках в бессывороточной среде с добавлением 1% метилцеллюлозы, 20 нг/мл bFGF, инсулин-трансферин-селенита и онкостатином. Отличием данного метода явлется использование онкостатина в качестве индуктора дедиффренцировки и необходимость поддержания стимуляции в процессе культивирования путем периодического добавления индуктора в куьтуральную среду.
Наиболее близким к заявляемому техническому решению по технической сущности и достигаемому техническому результату является способ получения сфероидов стволовых клеток рака путем индуцирования стволовой пластичности с помощью интерлейкина-6, описанный в статье Xie G. и др. (IL-6-induced epithelial-mesenchymal transition promotes the generation of breast cancer stem-like cells analogous to mammosphere cultures. doi: 10.3892/ijo.2011.1275). В данном методе клетки РМЖ разных линий, в том числе субпопуляцию диффренцированных клеток, определяемых по отсутствию на поверхности клеток маркера CD44 (CD44-), культивировали в среде RPMI-1640 (T47D, ZR-75-1 и MDA- MB-453) или DMEM (MCF7) с добавлением 10% сыворотки и интерлейкина-6 для стимуляции дедифференцировки. Для образования сфероидов их культивировали в среде DMEM/F12 (1:1) содержащей инсулин, бычий сывороточный альбумин, B27, bFGF, EGF. После из дифференцирования клетки пересаживали в стандартные адгезионные культуральные условия в сывороточную среду.
Описанный способ принят за прототип изобретения. Недостатком прототипа является необходимость длительного культивирования клеток со стимулятором (в течение 10 дней) и отсутствие информации о длительности культивирования в разных средах, необходимости и периодичности смены среды при культивировании, дополнительного добавления индуктора в среду.
В основу настоящего изобретения положена задача оценить способность дифференцированных клеток РМЖ давать начало росту сфероидов, рассматриваемых как модель формирования вторичного опухолевого узла, для исследования фундаментальных механизмов канцерогенеза, предсказания рисков развития метастазов после оперативного удаления опухоли и для оценки эффективности новых антиметастатических препаратов.
Способ реализуется следующим образом:
Клетки РМЖ культивируют для получения достаточного для исследования количества клеток (не менее 3х пассажей). Производят снятие клеток с поверхности пластика и дезагрегацию их с помощью аккутазы, после чего пропускают через клеточное сито с размером пор 40 мкм для получения одноклеточной суспензии. Клетки в виде одноклеточной суспензии разносят в покрытые агарозой лунки 12-луночного планшета для уменьшения адгезии клеток к пластику. Для индукции дедифференцировки в экспериментальные лунки вносят интерлейкин-6. На следующие сутки клетки снимают с поверхности пластика с использованием аккутазы и окрашивают с использованием антител к CD44 антигену дифференцировки человека. Одну тысячу клеток переносят в лунки плашки с низкой адгезией и инкубируют в течение через 7 дней в СО2-инкубаторе. После завершения инкубации планшеты анализируют под микроскопом и фиксируюти наличие в культуре сфероидов. Наличие сфероидов - образований сферической или близкой к сферической формы диаметром более 30 мкм - указывает на способность клеток дедифференцироваться. Проводят подсчет количества и измерение диаметра образовавшихся сфероидов. При тестировании способности вещества или физического воздействия уменьшение количества сфероидов и/или их диаметра в культуре делают заключение о способности данного воздействия подавлять дедифференцировку клеток рака молочной железы.
Сущность заявляемого технического решения поясняется чертежами. Ниже представлено краткое описание приложенных фигур, используемых для описания осуществления изобретения.
На фиг. 1 изображено влияние разных методов снятия клеток линии T47D с поверхности пластика на содержание клеток с цитофлуориметрическими признаками раннего апоптоза (AnV+PI–), некроза (AnV–PI+) и позднего апоптоза (AnV+PI+). А - клетки с низкой конфлюентностью (40-50%). Б - клетки с высокой конфлюентностью (70-80%). Данные представлены как среднее±SD, n=3. *p < 0,05.
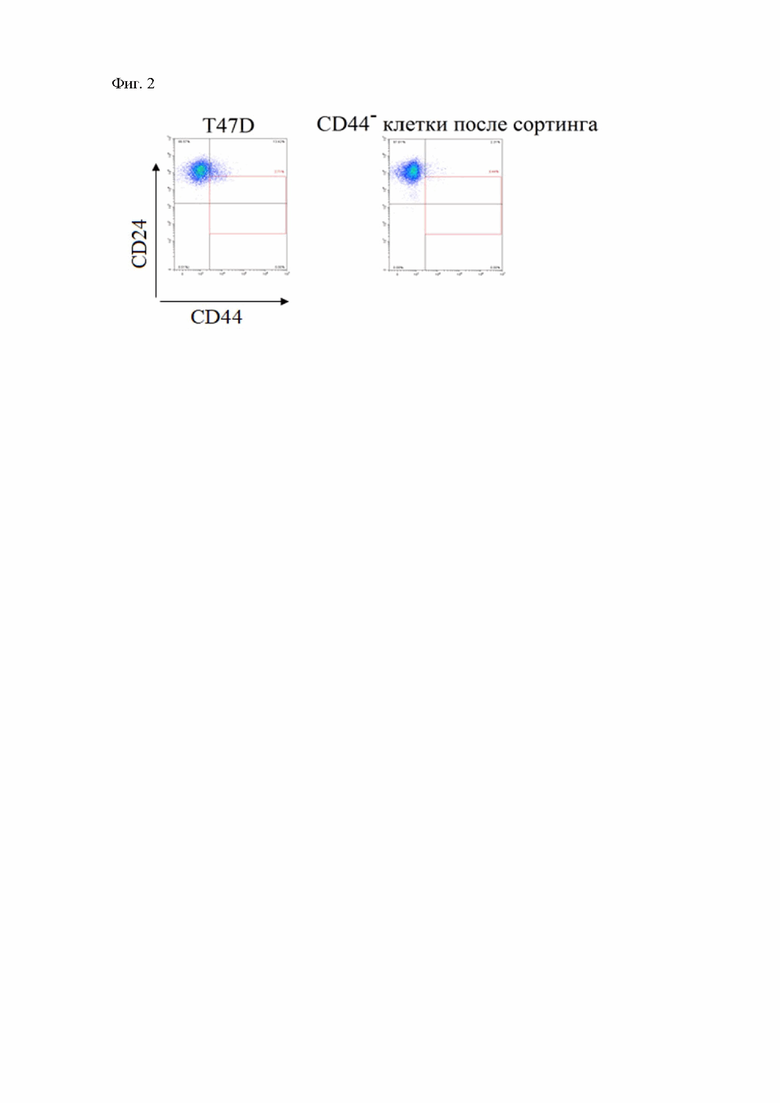
На фиг. 2 изображены гистограммы отражающие фенотипический профиль клеток линии T47D до и после сортинга.
На фиг. 3 изображено влияние продолжительности инкубации после внесения IL6 на фенотипический профиль клеток. А - количество CD24+CD44+клеток, Б - количество CD24–/lowCD44+клеток.
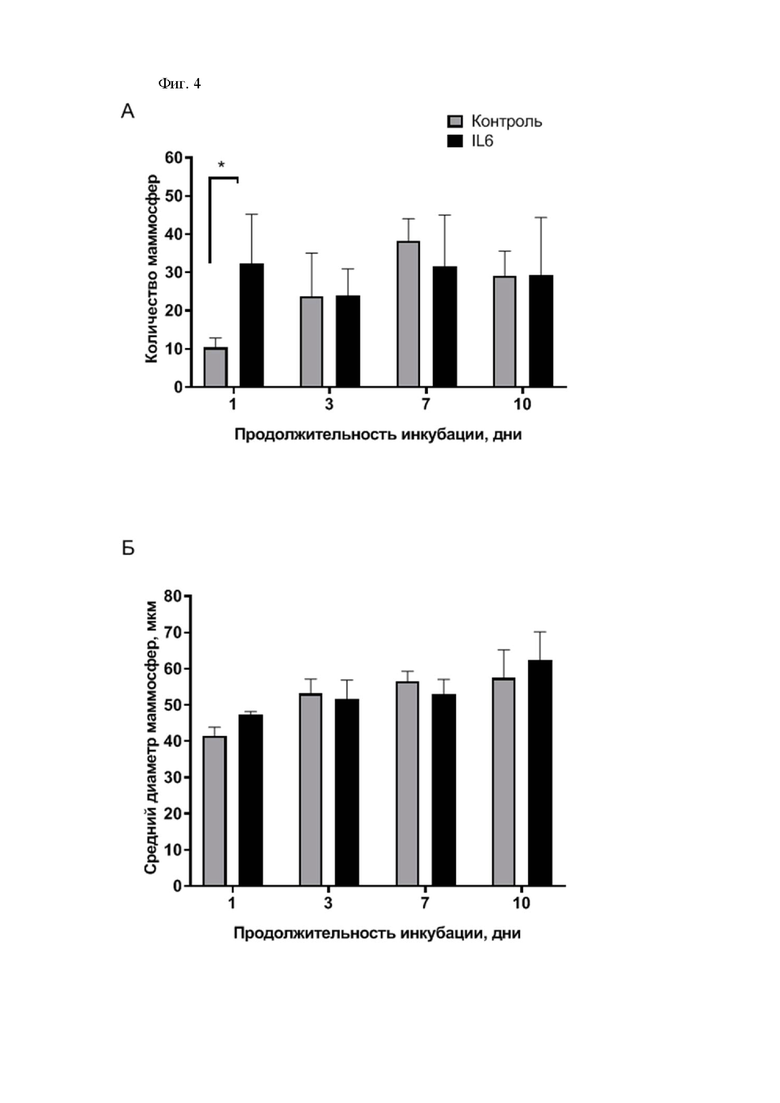
На фиг. 4 изображены гистограммы, демонстрирующие влияние продолжительности инкубации после внесения IL6 на способность CD44–CD24+клеток линии T47D к образованию сфероидов. А - количество сфероидов, Б - диаметр сфероидов. Данные представлены как среднее±SD, n=3. *p < 0,05.
На фиг. 5 изображены фотографии сфероидов, образованных дифференцированными клетками линии T47D после индукции дедифференцировки интерлейкином-6 в течение 1 суток и последующем формировании сфероидов в течение 7 суток. Длина масштабного отрезка 20 мкм.
На фиг. 6 изображены фотографии сфероидов, образованных дифференцированными клетками линии BT474 после индукции дедифференцировки интерлейкином-6 в течение 1 суток и последующем формировании сфероидов в течение 7 суток. Длина масштабного отрезка 20 мкм.
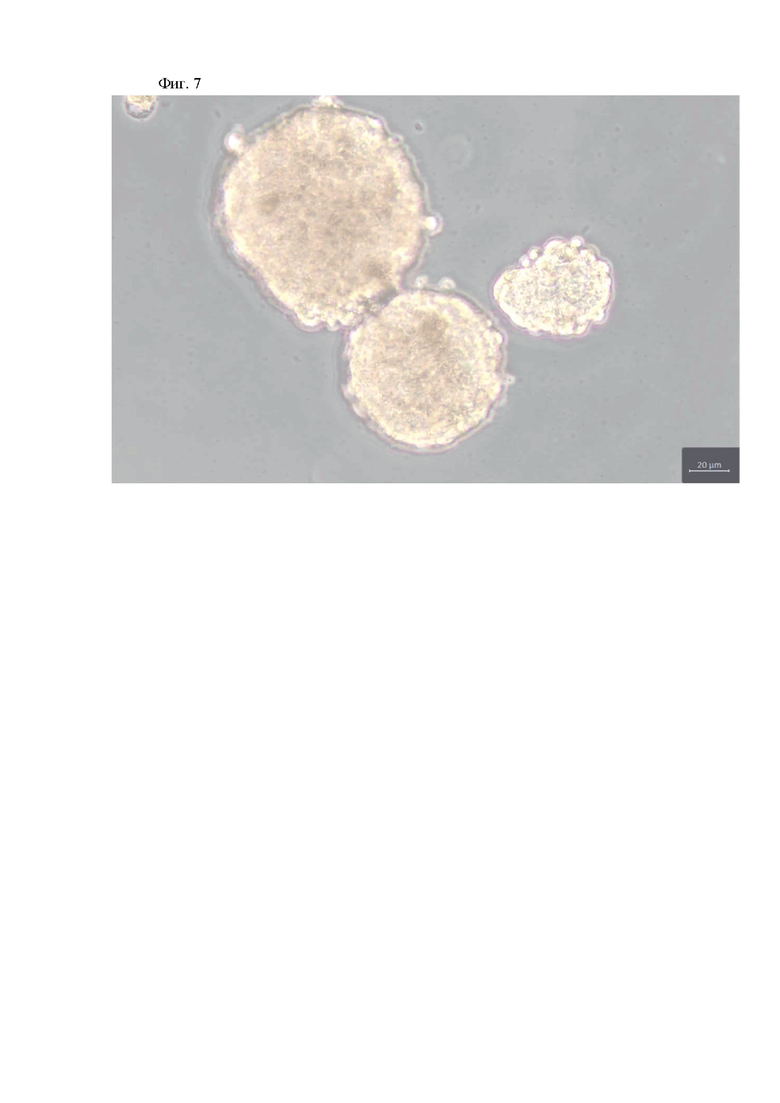
На фиг. 7 изображены фотографии сфероидов, образованных дифференцированными клетками линии MCF после индукции дедифференцировки интерлейкином-6 в течение 1 суток и последующем формировании сфероидов в течение 7 суток. Длина масштабного отрезка 20 мкм.
На фиг. 8 изображены фотографии сфероидов, образованных дифференцированными клетками линии Т47D после индукции дедифференцировки интерлейкином-6 в течение 1 суток (А) без или (Б) после воздействия ингибитора BIBR1532.
Примеры осуществления изобретения.
Пример 1.
Оценка способность дифференцированных клеток РМЖ давать начало росту сфероидов.
Клетки линии T47D (люминальный рак молочной железы типа А) культивировали в полной питательной среде RPMI-1640 (Gibco, США) с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США), глутамина (Gibco, США), гентамицина (Gibco, США), амфотерицина В (Синтез, Россия) (ППС RPMI-1640) до достижения 70-80% конфлюентности. Клетки снимали с поверхности пластика с использованием аккутазы (Stemcell Technologies, США). Определение фенотипического профиля клеток проводили с использованием антител PE anti-human CD44 (клон BJ18, Sony Biotechnology, США) и APC anti-human CD24 (клон ML5, Sony Biotechnology, США) на проточном цитолфлуориметре CytoFlex (Beckman Coulter, США), для исключения мертвых клеток из анализа их окрашивали 4', 6-диамидино-2-фенилиндолом (DAPI, Thermo Fisher Scientific, США). Жизнеспособность клеток определяют с помощью набора AnnexinV:FITC Assay kit (Bio-Rad, Австрия) (Фиг. 1). Для изучения динамики дедифференцировки клеток под влиянием интрлейкина-6 клетки линии T47D с конфлюентностью 70-80% снимали с поверхности пластика с использованием аккутазы, окрашивали флуоресцентно-меченными антителами PE- anti-human CD44 и APC- anti-human CD24 и отбирали фракцию CD44– на клеточном сортере SH800 (Sony, США) (Фиг. 2). Далее 50 тыс.клеток рассаживали в лунки 6-луночного планшета в 1 мл ППС RPMI-1640. Для индукции дедифференцировки в экспериментальные лунки добавляли 50 нг/мл интрлейкина-6 (Abcam, США). Через 1, 3, 7 и 10 дней клетки снимали с поверхности лунок, проводили цитофлуориметрическую оценку экспрессии CD44 и CD24, а также способность клеток образовывать сфероиды. Согласно полученным данным, стимуляция дифференцированных (CD44–CD24+) клеток линии T47D интрлейкином-6 уже через 24 часа приводит к появлению популяций прогениторных CD44+CD24+ и стволовых CD44+CD24–/low клеток, т.е. инкубации в течение 24 часов является достаточной для индукции дедифференцировки клеток РМЖ (Фиг. 4).
Для оценки способности к образованию сфероидов 1 тыс.клеток в 1 мл среды Mammocult Basal Medium (Stemcell Technologies, США) с добавлением 10% Mammocult proliferation supplement (Stemcell Technologies, США), 4 мкг/мл гепарина (Sigma, США), 0,48 мкг/мл гидрокортизона (Stemcell Technologies, США), антибиотика-антимикотика (Gibco, США) рассаживали в лунки 12-луночного планшета. Дно лунок планшета предварительно покрывали 1% агарозой (Хеликон, Россия) для уменьшения адгезии клеток к пластику. Для получения одноклеточной суспензии клетки предварительно пропускали через клеточное сито с размером пор 40 мкм (Corning). Планшеты инкубировали в СО2-инкубаторе в течение 7 дней, после чего получали фотографии всех лунок с использованием сканирующего микроскопа Leica DMi8 (Leica, Германия). Наличие в лунках сфероидов - образований сферической или близкой к сферической формы диаметром более 30 мкм - указывает на способность клеток к дедифференцировке (Фиг. 5). Количество и диаметр сфероидов определяли с использованием стандартных инструментов программы ImageJ (Fiji) (Vlachou, T., Aobuli, X., D' Elia, E., Santoro, A., Moroni, M.C., Pelicci, P.G. Quantification of Self-renewal in Murine Mammosphere Cultures/J. Vis. Exp.(153), e60256, doi:10.3791/60256 (2019))
Аналогично анализировали способность образовывать маммосферы клетками линий рака молочной железы человека BT474 (Фиг.6) и MCF (Фиг. 7).
Пример 2.
Оценка способности вещества подавлять дедифференцировку опухолевых клеток.
Клетки культивировали в полной питательной среде RPMI-1640 (Gibco, США) с добавлением 10% эмбриональной телячьей сыворотки (Gibco, США), 292 мг/л L-глутамина (Gibco, США), 40 мкг/мл гентамицина (Gibco, США) и 0,25 мкг/мл амфотерицина В (Синтез, Россия). Для проведения эксперимента клетки с конфлюентностью 70-80% снимали с поверхности пластика с использованием аккутазы (Stemcell Technologies, США). Клетки окрашивали флуоресцентно-меченными антителами FITC-anti-human CD44 (clone BJ18, Sony, США) и отбирали фракцию CD44– на клеточном сортере SH800 (Sony, США). Для оценки способности к образованию маммосфер 1 тыс.клеток в 1 мл среды Mammocult Basal Medium (Stemcell Technologies, США) с добавлением 10% Mammocult proliferation supplement (Stemcell Technologies, США), 4 мкг/мл гепарина (Sigma, США), 0,48 мкг/мл гидрокортизона (Stemcell Technologies, США), антибиотика-антимикотика (Gibco, США) рассаживали в лунки 12-луночного планшета. Дно лунок планшета предварительно покрывали 1% агарозой (Хеликон, Россия) для уменьшения адгезии клеток к пластику. Для получения одноклеточной суспензии клетки предварительно пропускали через клеточное сито с размером пор 40 мкм (Corning). Для индукции дедифференцировки в лунки добавляли 50 нг/мл IL6 (Abcam, США). В экспериментальные лунки добавляли ингибитор BIBR1532 (Sigma, США) в концентрации 93 нМ. В контрольных лунках клетки без IL-6 ингибитора. Планшеты инкубировали в СО2-инкубаторе в течение 7 дней, после чего получали фотографии всех лунок с использованием сканирующего микроскопа Leica DMi8 (Leica, Германия). Количество и диаметр маммосфер определяли с использованием программного обеспечения ImageJ. Отсутствие сфероидов в лунках с добавлением ингибитора указывает на его способность подавлять дедифференцировку опухолевых клеток (Фиг. 8).
Техническим результатом настоящего изобретения является способ получения сфероидов из дифференцированных клеток рака молочной железы, за счет индукции их дедифференцировки интерлейкином-6.
Изобретение позволяет изучать стволовую пластичность опухолевых клеток и процессы дедифференцировки раковых клеток для понимания фундаментальных механизмов канцерогенеза, для прогнозирования риска метастазирования после оперативного удаления опухоли молочной железы, для оценки эффективности новых и противоопухолевых, в частности антиметастатических, лекарственных препаратов. Данный способ возможно воспроизвести с применением стандартного оснащения лаборатории, для него не требуется большого количества редких или дорогостоящих реактивов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ ингибирования метастазирования опухолей путем подавления дедифференцировки опухолевых клеток | 2023 |
|
RU2840966C1 |
| СПОСОБ ИНГИБИРОВАНИЯ РАДИАЦИОННО-ИНДУЦИРОВАННОГО УВЕЛИЧЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2800366C2 |
| Рекомбинантные плазмидные ДНК lenti sgRNA(MS2)_zeo_Myc, обеспечивающие активацию экспрессии гена MYC в клетках человека, способ получения клеток человека со стабильно повышенной экспрессией гена MYC и моноклональная линия клеток рака молочной железы человека BT549_Myc со стабильно повышенной экспрессией гена MYC | 2022 |
|
RU2812975C1 |
| Способ подавления индуцирующего действия высокомолекулярной гиалуроновой кислоты на стволовые клетки рака молочной железы | 2021 |
|
RU2774031C1 |
| КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ РАКА | 2016 |
|
RU2729396C2 |
| СПОСОБ СНИЖЕНИЯ КОЛИЧЕСТВА СТВОЛОВЫХ КЛЕТОК АДЕНОКАРЦИНОМЫ МОЛОЧНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2022 |
|
RU2798550C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХРЯЩЕПОДОБНЫХ СТРУКТУР ИЗ СТВОЛОВЫХ КЛЕТОК С ИНДУЦИРОВАННОЙ ПЛЮРИПОТЕНТНОСТЬЮ И СТРУКТУРЫ, ПОЛУЧЕННЫЕ УКАЗАННЫМ СПОСОБОМ | 2023 |
|
RU2814248C1 |
| Способ прогнозирования риска опухолевой прогрессии у больных раком молочной железы | 2024 |
|
RU2838618C1 |
| ИСПОЛЬЗОВАНИЕ О-АЦЕТИЛИРОВАННОГО GD2 ГАНГЛИОЗИДА В КАЧЕСТВЕ МИШЕНИ КАК НОВЫЙ ТЕРАПЕВТИЧЕСКИЙ И ДИАГНОСТИЧЕСКИЙ ПОДХОД ПРИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЯХ, СОДЕРЖАЩИХ ОПУХОЛЕВЫЕ СТВОЛОВЫЕ КЛЕТКИ | 2014 |
|
RU2702428C2 |
| СПОСОБ ОБНАРУЖЕНИЯ ИЛИ ВЫДЕЛЕНИЯ/ПОЛУЧЕНИЯ ЦИРКУЛИРУЮЩЕЙ ОПУХОЛЕВОЙ КЛЕТКИ, ИСПОЛЬЗУЮЩИЙ МЕТОД ПРОЛИФЕРАЦИИ КЛЕТОК | 2016 |
|
RU2707083C1 |





Изобретение относится к биотехнологии, а именно к способам оценки способности клеток рака молочной железы к дедифференцировке путем культивирования клеток рака молочной железы в полной питательной среде с добавлением эмбриональной телячьей сыворотки, глутамина, антибиотика в стандартных условиях, снятия клеток, дезагрегации и получения одноклеточной суспензии, отбора дифференцированных клеток методом иммунного сортинга, переноса клеток в 6-луночные планшеты с низкой адгезией к пластику, индукции дедифференцировки клеток за счет добавления в среду интерлейкина-6. Изобретение может быть использовано для изучения стволовой пластичности дифференцированных клеток рака молочной железы при исследовании фундаментальных механизмов канцерогенеза, предсказания рисков развития метастазов после оперативного удаления опухоли и для оценки эффективности новых противораковых препаратов, а именно антиметастатических препаратов. 8 ил.
Способ оценки способности клеток рака молочной железы к дедифференцировке, включающий культивирование клеток в полной питательной среде с добавлением эмбриональной телячьей сыворотки в CO2-инкубаторе, снятие с поверхности пластика и получение одноклеточной суспензии путем фильтрования через клеточное сито, отбор дифференцированных клеток, определяемых по отсутствию на поверхности клеток маркера, перенос их в планшеты с низкой адгезией, индукцию дедифференцировки клеток добавлением интерлейкина-6, окрашивание с использованием антител к CD44 антигену дифференцировки человека, культивирование клеток до формирования сфероидов в среде на основе Mammocult Basal Medium в CO2-инкубаторе в течение 7 дней, обнаружение и подсчет сфероидов диаметром более 30 мкм с использованием микроскопа, где появление популяций прогениторных CD44+CD24+ и стволовых CD44+CD24-/low клеток и образование ими сфероидов свидетельствует о способности клеток к дедифференцировке.
| CHAFFER C., et al., Poised chromatin at the ZEB1 promoter enables breast cancer cell plasticity and enhances tumorigenicity, Cell, 2013 V.3, 154-174 | |||
| Печь-кухня, могущая работать, как самостоятельно, так и в комбинации с разного рода нагревательными приборами | 1921 |
|
SU10A1 |
| CN 0107847481 A1, 27.03.2018 | |||
| US 20190194622 A1, 27.06.2019 | |||
| WO 2019101956 A1, 31.05.2019 | |||
| WEST N., et al., Oncostatin-M promotes phenotypic changes associated with | |||
Авторы
Даты
2023-10-24—Публикация
2022-12-01—Подача