Изобретение относится к фармацевтической химии а именно - к синтезу ноотропных препаратов производных пирацетама.
1-Карбамоилметил-4-фенил-2-пирролидон (фенотропил) (1) - лекарственное средство, относящееся к группе ноотропных препаратов и являющееся фенилзамещенным пирацетамом общей формулы:
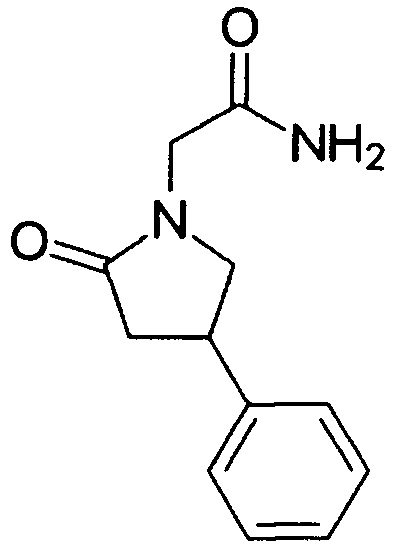
В 2010 г. Всемирной организацией здравоохранения препарату было присвоено международное непатентованное наименование «фонтурацетам». Входит наряду с пирацетамом в перечень жизненно необходимых и важнейших лекарственных препаратов РФ. Благодаря наличию в молекуле хирального центра в положении 4 фенотропил может существовать в виде двух (R)- и (S)-энантиомеров. Имеются данные о том, что (R)-изомер обладает большей активностью по сравнению с (S)-изомером. В медицинской практике фенотропил применяется в виде рацемической смеси.
Синтез фенотропила (1) был осуществлен в 1979 г. кипячением 4-фенил-2-пирролидона (2) с металлическим натрием в бензоле в течение 5 ч, взаимодействием образовавшейся натриевой соли 4-фенил-2-пирролидона (3) с избытком этилхлорацетата при 60°С, перегонкой 1-этоксикарбонил-4-фенил-2-пирролидона (4) в вакууме при 170-180°С/1 мм и переводом последнего в амид обработкой водным аммиаком, выход 50% в расчете на. пирролидон (2). [(В.В. Перекалин, Б.М. Новиков, М.М. Зобачева и др., заявка на авт. свид. 2763033 (1979); Пат. РФ 797219 (1995)].
В статье 1980 г. [О.М. Глозман, И.С. Морозов, Л.А. Жмуренко, В.А. Загоревский, Хим. - фарм. журн., 14, №11, 43 (1980)] описан синтез фенотропила (1) из 4-фенил-2-пирролидона (3) генерированием натриевой соли последнего (2) нагреванием с гидридом натрия в сухом диоксане, алкилированием этилбромацетатом при 125°С в течение 5 ч, вакуум-перегонкой этоксикарбонильного производного (4) при 198-204°С/4-5 мм и превращением последнего в амид действием аммиака в метаноле, выход 50.7% (схема 1)
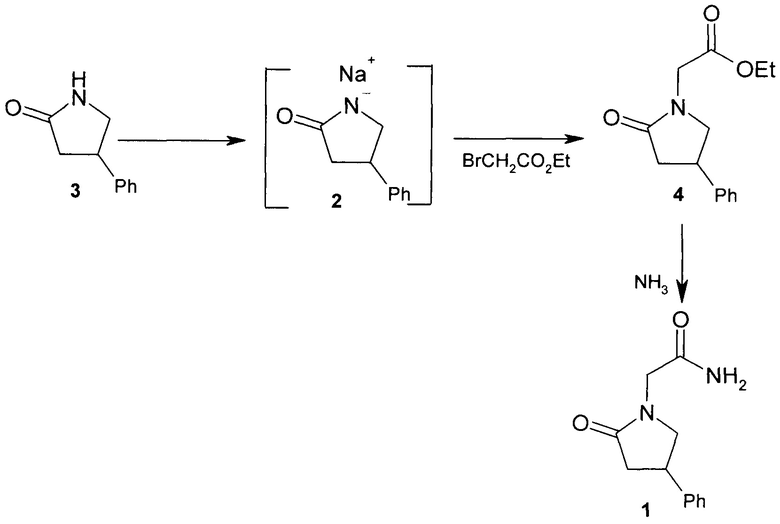
Схема 1 - Получения фенотропила известным методом.
Подобный путь синтеза алкилированием этилбромацетатом натриевой соли 4-фенил-2-пирролидона, генерированной действием гидрида натрия в диоксане, и последующим аммонолизом (см. схему 1), применяется также для получения оптически активных стереоизомеров фенотропила. Синтезу предшествует разделение 4-фенил-2-пирролидона на энантиомеры, после чего (4R)-4-фенил-2-пирролидон превращают в (R)-фенотропил по схеме 1 [G. Veinberg, М. Vorona, Lebedevs et. al. US Pat. 2010/0022784; G. Veinberg, M. Vorona, L. Zvejniece et. al. US Pat. 2015/0216846]. Для получения оптического (4R)-изомера была использована энантиоселективная реакция присоединения диэтилмалоната к β-нитростиролу, катализируемая комплексами Ni(II). Образующийся (4R)-этил-4-нитро-2-этоксикарбонил-3-фенилбутират затем превращали в (4R)-4-фенил-2-пирролидон и далее по схеме 1 - в (R)-фенотропил [А.Н. Резников, Е.В. Головин, Ю. Климочкин Ю.Н. Журн. орг. хим., 2013, 49, вып. 5, 682].
Задачей настоящего изобретения является упрощение метода получения фенотропила. Поставленная задача решается применением в качестве алкилирующего агента не эфира галогенуксусной кислоты, а ее амида, конкретно - хлорацетамида. Соль 4-фенил-2-пирролидона (3) с щелочным металлом алкилируют хлорацетамидом с образованием непосредственно кристаллического фенотропила (1) (схема 2). Этим исключаются стадии алкилирования этилбромацетатом, вакуум-перегонки образующегося 1-этоксикарбонилметил-4-фенил-2-пирролидона и его последующего аммонолиза. Кроме того, следует иметь в виду, что хлорацетамид является многотоннажным промышленным продуктом, применяемым в качестве гербицида и консерванта, коммерчески более доступным по сравнению с этилгалогенацетатами
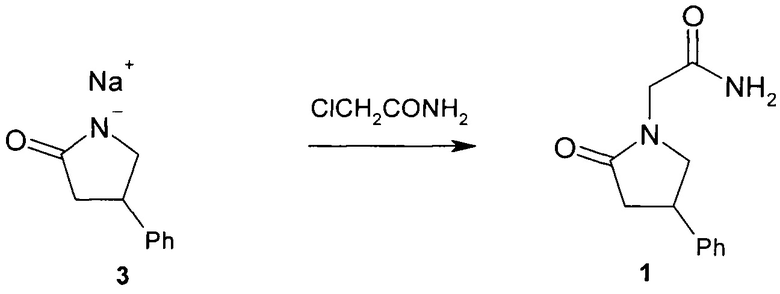
Схема 2 - Получение фенотропила предлагаемым методом.
Основные преимущества предлагаемого метода заключаются в сокращении химических стадий, а также применении более доступного сырья.
На стадии генерирования соли 4-фенил-2-пирролидона в неполярном растворителе (бензоле или толуоле) для уменьшения опасности вместо применения металлического натрия или гидрида натрия использованы твердый метоксид натрия с азеотропным удалением метанола или гидроксид калия с азеотропной отгонкой воды.
Во всех цитированных выше работах исходный 4-фенил-2-пирролидон получали из его 3-этоксикарбонильного производного гидролизом эфирной группировки и декарбоксилированием при нагревании в соляной кислоте с образованием гидрохлорида 4-амино-3-фенилбутановой кислоты (лекарственный препарат фенибут) и затем обратной циклизацией. Необходимость дополнительных стадий для элиминирования 3-этоксикарбонильной группы обусловлена применением малонового эфира на стадии синтеза нитросоединения, подвергаемого гидрированию. Эти осложнения отпадают, если при синтезе нитросоединения исходить не из малонового эфира, а из этилциннамата. В заявляемом изобретении в качестве начального этапа синтеза фенотропила использовано взаимодействие алкилциннамата с нитрометаном, которое после каталитического восстановления водородом образующегося эфира 4-нитро-3-фенилбутановой кислоты сразу приводит к 4-фенил-2-пирролидону.
Предлагаемое изобретение иллюстрируется нижеприведенными примерами.
Пример 1. Получение 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила) из 4-фенил-2-пирролидона. В раствор 16.1 г (0.01 моля) фенилпирролидона в 180 мл толуола вносят 6.0 г (0.11. моль) метоксида натрия. Смесь нагревают при перемешивании до кипения и кипятят с одновременной отгонкой летучей фракции (80 мл) до полного удаления метанола, о чем свидетельствует достижение температуры в парах 110°С. Суспензию образовавшейся натриевой соли фенилпирролидона охлаждают до 10°С и порциями вносят 15 г (0.16 моль) хлорацетамида. Размешивание продолжают 2 ч и оставляют реакционную смесь на 16 ч при 15°С, приливают 50 мл холодной воды, осадок отфильтровывают, промывают толуолом, водой и высушивают. Получают 7.90 г (36%) 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила) с содержанием основного вещества 96%. Фильтрат переносят в делительную воронку. После отстаивания нижний водный и верхний органический слои разделяют. Из водного слоя производят сначала экстракцию толуолом (трижды порциями по 30 мл) для извлечения не вступившего в реакцию фенилпирролидона, контролируя полноту экстракции методом ТСХ. Экстракт присоединяют к органическому слою. Объединенные толуольный слой и экстракт испаряют в вакууме с роторным испарителем. Получают 4.3.г (27%) 4-фенил-2-пирролидона, который для повторного использования кристаллизуют из 10 мл этанола. Получают 4.3.г (27%) 4-фенил-2-пирролидона с концентрацией 90% (ВЖХ).
Водный слой после экстракции толуолом подвергают экстракции этилацетатом (4 порции по 40 мл). Полноту извлечения 1-карбамоилметил-4-фенил-2-пирролидона контролируют методом ТСХ. Раствор в этилацетате после экстракции концентрируют путем отгонки 140 растворителя, охлаждают и оставляют на сутки при 0-5°С. Кристаллы, выпавшие в результате концентрации раствора в этилацетате, отфильтровывают, промывают 10 мл охлажденного этилацетата и сушат, получая еще 3.8 г фенотропила Общий выход фенотропила составляет 11.7 г (53% теоретического в расчете на загруженный 4-фенил-2-пирролидон). С учетом возврата 27% исходного 4-фенил-2-пирролидона выход на прореагировавший 4-фенил-2-пирролидон равен 73%.
Пример 2. Получение 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила) из 4-фенил-2-пирролидона.
В колбу с мешалкой, обратным холодильником и насадкой Дина-Старка вносят 16.1 г (0.01 моля) фенилпирролидона, 6.1 г (0.11. моль) растертого безводного гидроксида калия и 200 мл толуола. Смесь кипятят при интенсивном перемешивании до прекращения отделения азеотропа толуол-вода с достижением температуры в парах 110°С. По охлаждении при размешивании вносят 11.2 г (0.12 моль) хлорацетамида и оставляют на ночь. Реакционную смесь переносят в делительную воронку. После отстаивания прозрачные нижний водный и верхний органический слои разделяют. Из водного слоя производят сначала экстракцию толуолом (трижды порциями по 30 мл) для извлечения не вступившего в реакцию фенилпирролидона, контролируя полноту экстракции методом ТСХ. Экстракт испаряют в вакууме с роторным испарителем до обьема 50 мл, охлаждают.
Осадок отфильтровывают и промывают 5 мл толуола. Получают 4-фенил-2-пирролидон 4.0 г (25%), который возвращают в процесс. Из водного слоя экстракцией этилацетатом, как указано в примере 1, извлекают 11.0 г (51.5%) фенотропила (выход 51.5, с учетом возврата части фенилпирролидона - 68%).
Пример 3. Получение этилового эфира 4-нитро-3-фенилбутановой кислоты.
В четырехгорлую колбу вместимостью 1000 см3 загружают 206 см3 диметилсульфоксида и 20,85 г (0.49 моль) растертого безводного гидроксида калия и перемешивают 1 ч при 20°С. Затем из капельной воронки по каплям добавляют 35.3 г (0.58 моль) нитрометана при температуре не выше 20°С, после чего перемешивание продолжают еще 30 мин. Постепенно за 15-20 мин прикапывают 55,0 г (0.27 моль) этилового эфира коричной кислоты (5) при температуре не выше 20°С и перемешивают 6-7 ч при той же температуре. К реакционной смеси, охлаждаемой смесью льда с хлоридом натрия, медленно и при интенсивном перемешивании приливают 330 см3 3,7%-ного раствора соляной кислоты при температуре не выше 10°С до величины рН от 4 до 4,5. Перемешивание продолжают еще 1 ч, прекратив охлаждение, после чего дают отстояться реакционной массе до полного расслоения водного и органического слоев.
Органический слой промывают водой, затем разбавляют 140 см3 этилацетата и сушат над безводным сульфатом натрия при 20°С в течение 5-6 часов, этилацетат отгоняют на роторном испарителе в колбе вместимостью 250 см3 при пониженном давлении и при температуре в бане не выше 60°С. Получают технический этиловый эфир 4-нитро-3-фенилбутановой кислоты в виде желто-оранжевой жидкости с содержанием основного вещества 83,8%, которую перегоняют в вакууме, т. кип. 147-149°С (1 мм рт. ст.), содержание основного вещества 94,3%.
Пример 4. Получение 4-фенил-2-пирролидона.
В лабораторный автоклав вместимостью 350 см3, снабженный термометром, манометром и мешалкой, загружают 20,0 г этилового эфира 4-нитро-3-фенилбутановой кислоты, 200 см3 метанола и 7 г катализатора 5% палладия на угле. Автоклав продувают азотом и затем водородом из баллона через редуктор, включают перемешивание, подают водород до достижения давления 1,0 МПа и поддерживают это давление в ходе всей реакции. Автоклав термостатируют теплоносителем при 40°С. За счет начавшейся экзотермической реакции температура в автоклаве постепенно повышается до 65-70°С, продолжают перемешивание при этой температуре 4-5 часов. Позволяют реакционной массе самопроизвольно охладиться до 50 С, затем ее фильтруют, автоклав промывают дополнительно 100 см3 метанола и повторно фильтруют через тот же фильтр. Объединенный метанольный фильтрат переносят в одногорлую круглодонную колбу вместимостью 1000 см3 и испаряют растворитель досуха на роторном испарителе при температуре в бане не выше 80 С и остаточном давлении 15-30 кПа. Остаток обрабатывают серным эфиром, кристаллы фенилпирролидона отделяют и перекристаллизовывают из изопропанола. Получают 21.3 г 4-фенил-2-пирролидона (49% в расчете на исходный этилциннамат), содержание основного вещества 90% (ВЭЖХ).
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ФОНТУРАЦЕТАМА ИЗ ФЕНИБУТА | 2024 |
|
RU2827339C1 |
| ПРОИЗВОДНОЕ 4-ФЕНИЛПИРРОЛИДИНОНА-2, СОДЕРЖАЩАЯ ЕГО КОМПОЗИЦИЯ С НООТРОПНОЙ АКТИВНОСТЬЮ, СПОСОБ ИХ ПОЛУЧЕНИЯ И СПОСОБ ЛЕЧЕНИЯ ИЛИ ПРОФИЛАКТИКИ НАРУШЕНИЙ НЕРВНОЙ СИСТЕМЫ | 2015 |
|
RU2611623C2 |
| N-КАРБАМОИЛМЕТИЛ-4-ФЕНИЛ-2-ПИРРОЛИДОН, ОБЛАДАЮЩИЙ ГИПОТЕНЗИВНОЙ АКТИВНОСТЬЮ | 1979 |
|
SU797219A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПРОИЗВОДНЫХ 3-ФЕНИЛ-4-АМИНОБУТАНОВОЙ КИСЛОТЫ | 2000 |
|
RU2190595C2 |
| Новый состав N-карбамоилметил-4-фенил-2-пирролидона | 2017 |
|
RU2696277C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА-4-АМИНО-3-ФЕНИЛБУТАНОВОЙ КИСЛОТЫ | 1993 |
|
RU2072984C1 |
| Новые составы N-карбамоилметил-4-фенил-2-пирролидона | 2018 |
|
RU2699669C1 |
| Способ получения 4-замещенного 2-[2-оксо-1-пирролидинил] ацетамида | 2016 |
|
RU2629117C1 |
| СПОСОБ ПОЛУЧЕНИЯ ГИДРОХЛОРИДА γ-АМИНО-βФЕНИЛМАСЛЯНОЙ КИСЛОТЫ (ФЕНИБУТА) | 1998 |
|
RU2146246C1 |
| СПОСОБ ПОЛУЧЕНИЯ 5-(1-ПИПЕРАЗИНИЛ)БЕНЗОФУРАН-2-КАРБОКСАМИДА И ПРОМЕЖУТОЧНЫЕ СОЕДИНЕНИЯ | 2000 |
|
RU2266292C2 |
Изобретение относится к фармацевтической химии, а именно к способу получения 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила). Способ получения 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила) заключается в том, что щелочную соль 4-фенил-2-пирролидона алкилируют в толуоле 2-хлорацетамидом, добавляют холодную воду с выделением образующегося фенотропила, разделяют водный и органический слои, водный слой экстрагируют толуолом, объединяют полученные экстракты с толуольным слоем и извлекают непрореагировавший 4-фенил-2-пирролидон, а последующей экстракцией водного слоя этилацетатом получают дополнительное количество фенотропила. Преимущества способа заключаются в сокращении стадий способа и применении более доступного сырья.
Способ получения 1-карбамоилметил-4-фенил-2-пирролидона (фенотропила) из 4-фенил-2-пирролидона, отличающийся тем, что щелочную соль 4-фенил-2-пирролидона алкилируют в толуоле 2-хлорацетамидом, добавляют холодную воду с выделением образующегося фенотропила, разделяют водный и органический слои, водный слой экстрагируют толуолом, объединяют полученные экстракты с толуольным слоем и извлекают непрореагировавший 4-фенил-2-пирролидон, а последующей экстракцией водного слоя этилацетатом получают дополнительное количество фенотропила.
| CN 106083685 A, 09.06.2016 | |||
| Способ получения -замещенных лактамов | 1971 |
|
SU508185A3 |
| N-КАРБАМОИЛМЕТИЛ-4-ФЕНИЛ-2-ПИРРОЛИДОН, ОБЛАДАЮЩИЙ ГИПОТЕНЗИВНОЙ АКТИВНОСТЬЮ | 1979 |
|
SU797219A1 |
| US 5461157 A1, 24.10.1995. | |||
Авторы
Даты
2018-08-13—Публикация
2017-07-19—Подача