Изобретение относится к области биотехнологии, в частности к стимуляции деструкции полимерных отходов микроорганизмами - биодеструкторами.
В настоящее время потребление упаковки растет быстрыми темпами. В России такой рост составляет 5-6% в год. Все это делает актуальной проблему утилизации упаковки. И на первый план выступает утилизация именно полимерной упаковки. При этом объемы утилизации отходов в России находятся на низком уровне. Так, в 2003 году в России было утилизировано полимерных отходов - всего 0,61 млн. т (7,7%), что заметно меньше, чем в 1990 году (0,72 млн. т и 23,5%, соответственно). В целом, только 3% всех отходов перерабатывается промышленными методами, остальные вывозятся на полигоны или сжигаются. Под полигоны и свалки твердых бытовых отходов ежегодно отчуждается до 10 тыс.га земель, включая плодородные земли, изымаемые из сельскохозяйственного оборота.
Рост количества неразлагаемых в природных условиях полимерных отходов ведет к загрязнению окружающей среды, и создает глобальную экологическую проблему.
Накопление синтетических полимерных материалов, главным образом полиолефинов (полиэтиленов и полипропиленов) составляет 180 млн. т в год. И ежегодно их объем возрастает примерно на 25 млн. т.
Активно ведутся работы по развитию основных направлений для очистки окружающей среды от пластмассовых отходов и борьбы с угрожающим накоплением отходов полимерной природы. К ним относятся разные способы утилизации и захоронения. Утилизация полимерных неразлагаемых материалов включает сжигание, пиролиз, рециклизацию или переработку (RU 2587455 от 20.06.2016; RU 2617213 от 24.04.2017). Однако ни одни из этих способов абсолютно не улучшают экологическую обстановку при сжигании образуются высокотоксичные и супертоксичные (фураны, диоксины) соединения. А другие способы борьбы с накоплением отходов при современных технологиях их сбора и сортировки достаточно дороги, поскольку, прежде чем переработать полимерный материал, необходимо произвести отбор из бытового мусора пластической тары и упаковки, разделить отходы по виду пластиков, промыть, высушить, измельчить и только затем переработать в новое полимерное изделие. [Примеров О.С, Макеев П.В., Клинков А.С. Обзор методов переработки отходов полимерных материалов и анализ рынка вторичного сырья // Молодой ученый. 2013. №6. С. 121-123].
Поэтому основная часть полимерных отходов складируется на свалках, а повторной переработке в развитых странах подвергается не более 16-20%.
Одним из возможных путей сокращения гигантских отходов синтетических пластиков считают компостирование [Орлова A.M., Попова М.Н. Современные проблемы твердых бытовых отходов: Монография. - М.: МГСУ, 2010. - 216 с.]. Этот преимущественно аэробный процесс переработки отходов может рассматриваться как аналог природоподобной технологии. В ходе компостирования под воздействием почвенных и водных микроорганизмов биополимеры трансформируются до гумуса и далее до диоксида углерода и воды (конечных продуктов распада органической материи) в срок от несколько месяцев до десятков суток. Скорость разложения материалов зависит от многих факторов - вида полимера, влажности, температуры, светового воздействия, видовой структуры микробной составляющей среды и др.
Известны также способы микробного разложения полимерных отходов с участием накопительных культур микроорганизмов, выделенных из почвы. Так, выделены доминирующие формы из накопительной культуры и модельных систем на основе светло-каштановой почвы Астраханской области с внесением различных полимерных материалов. Изучены оптимальные условия для развития данных микроорганизмов и максимального действия их ферментных систем. При изучении ферментативной активности исследуемых микроорганизмов особое внимание уделяли видам, выделенным с базовой среды с гомогенизированным полиэтиленом. После обработки полученных данных установили, что максимальным спектром активностей на базовой среде с полиэтиленом обладают нейтрофильные формы Bacillus circulans 1, Pseudomonas putida; ацидофильные формы Aspergillus, flavus, A. fumigatus, B. circulans 2; алкалофильные формы Penicillium chrysogenum, B. megaterium, B. polymyxa. Комплекс определяемых ферментов может максимально эффективно воздействовать на сложные связи в разветвленной молекуле полиэтилена и воздействовать на его деструкцию [Каширская А.О., Пархоменко А.Н. Влияние условий культивирования на ферментативную активность микроорганизмов-деструкторов полимерных отходов в почвах Астраханской области. Известия Уфимского научного центра РАН, 2013, №4, С. 50-53]. Однако способность полимерных материалов разлагаться под действием бактерий и грибов зависит от физических и химических свойств. Для полимеров биологическое разложение протекает в два этапа: 1) под действием химических, биохимических и других агентов происходит разрушение кристаллической макромолекулярной структуры, которое в некоторых случаях происходит вплоть до образования мономеров; 2) происходит усвоение остатков макромолекул биологическими организмами, которые разрушают вещество до воды, углекислого газа, метана (при анаэробном брожении). Способность к биологическому разложению, прежде всего, обусловлена размером макромолекул: полимеры с большой молекулярной массой устойчивы к воздействию организмов. Скорость разложения зависит и от кристаллической структуры полимера.
Большие надежды возлагались и возлагаются на применение в народном хозяйстве биоразрушаемых пластиков [Власов С.В., Ольхов В.В. Биоразлагаемые полимерные материалы // Полимерные материалы. 2006, №7. С. 23-26]. Однако сроки, необходимые для разложения, например, таких тароупаковочных материалов в естественных условиях могут составлять многие годы и десятилетия. И, по мнению экологов, простое захоронение даже биоразлагаемых пластмассовых отходов, это «бомба замедленного действия» и перекладывание сегодняшних проблем на плечи будущих поколений.
При изготовлении биоразлагаемых полимерных материалов учитывают, что процесс деструкции (разрушения) базового полимера практически не ускоряется. Для интенсификации этого процесса в состав полимерной матрицы вводят добавки, ускоряющие ее распад под действием УФ-облучения.
Так, известен способ стимуляции активности микроорганизмов-биодеструкторов полимерных отходов путем внесения добавок в виде сополимеров на основе этилена и моносахарида углерода, винилкетоны и другие материалы (Ecoplast, Ecolyte - Канада, Bioplast, Biopol и Ecostar - Великобритания, Novon и Tone - США, Biocell - Франция и др.) [Кузьмич В.В., Почанин Ю.С. и др.. Биоразлагаемые упаковочные материалы на основе местных добавок растительного происхождения. Материалы и оборудование ресурсосберегающих технологий в машиностроении. Международная научно-техническая конференция. Минск: БНТУ-2010].
Известен также способ стимуляции активности грибов-биодеструкторов путем внесения крахмала в полимерную матрицу полиметилакрилата с целью повышения биоразлагаемости материала. Грибостойкими считались образцы, получившие оценку степени обрастания не более 2-х баллов. [Кряжев Д.В. Экологические основы диагностики процессов биодеструкции природных и синтетических полимерных материалов в условиях воздействия ряда абиотических факторов внешней среды. Дисс. на соиск. учен. степ. докт. биол. наук. Нижний Новгород, 2014, с. 128-129]. Данный источник информации рассмотрен в качестве ближайшего аналога.
Цель настоящей работы заключалась в поиске новых способов ускорения биодеградации полимерных материалов.
Технический результат заключается в расширении арсенала технических средств для стимуляции активности микроорганизмов-биодеструкторов полимерных отходов,
обеспечивающих повышенную агрессивность микроорганизмов в отношении данных отходов.
Технический результат достигается тем, что стимуляцию активности грибов-биодеструкторов полимерных отходов осуществляют путем использования добавок природного происхождения, при этом в качестве добавки используют автолизат пивных дрожжей (АПД) при следующем соотношении АПД к грибам деструкторам г : млн.спор 0,02:10 соответственно.
Автолизат пивных дрожжей представляет собой отходы пивоваренного производства, включающие остаточные пивные дрожжи. Количество этих отходов напрямую связано с количеством выпускаемого пива и составляет примерно 1,2% от объема пива. При пересчете на абсолютно сухое вещество годовые объемы отработанных пивных дрожжей в России могут составить 1,0-1,3 млн. тонн. Эти отходы, несмотря на высокую питательную ценность (ТУ 9184-001-76373465-2007), не находят широкого практического применения, хотя и многосторонне исследуются, в частности как добавки в комбикорма животным [Автолизированные пивные дрожжи в кормах свиней / М. Кирилов, А. Яхин, М. Прищеп, М. Бабурина // Комбикорма. 2007. - №7. - С. 57]. До сих пор, однако, эти отходы не нашли рационального применения в животноводстве, и, в основном вывозятся на поля в виде жидких органических удобрений.
Другое направление применение препарата АПД относится к фармакологии. АПД - продукт индуцированного автолиза пивных дрожжей, прошедший дополнительную очистку от клеточных оболочек, содержит большое количество полезных для человека компонентов. Большая часть белков расщеплена до небольших пептидных цепочек и отдельных аминокислот. АПД богат витаминами группы В1, аминокислотами и минеральными веществами. Витамины, микро- и макроэлементы дрожжей находятся в белковых комплексах.
Так, в составе препарата под коммерческим названием «Нагипол» биодобавка к пище с содержанием автолизата пивных дрожжей, обладающим фармакологическим действием, отмечается, что он содержит белковые вещества, аминокислоты (в т.ч. 8 незаменимых), витамины группы В (В1-В6, Be), Е, Н, F и др.; углеводы, нуклеотиды, липиды, полисахариды, ферменты, высшие и низшие пептиды и др. ценные компоненты; макро- и микроэлементы.
Нами средство АПД, то есть подвергнутые гидролизу остатки дрожжевых клеток Saccaromyces cerevisiae, испытано в данной работе в качестве добавок к культурам
микодеструкторов для стимуляции их активности в процессе их воздействия с полимерными материалами.
Оценка физиологической активности микодеструкторов при добавлении к ним АПД и последующем развитии их на полимерных материалах осуществлялась по эмиссии CO2.
Готовили и исследовали следующие концентрации АПД, добавляемые к микодеструкторам и полимерным отходам: 0; 0,01; 0,05; 0,10; 0,15; 0,20 (г/см3). При этом споры микодеструктора наносились в одной дозе (в виде суспензии при концентрации 2 млн. спор/см3) из расчета 0,0005 см3 на 1 см2 полимерного образца.
Обработку полимерных образцов проводили следующим образом.
Суспензию препарата АПД в стерильной дистиллированной воде готовили в рабочих концентрациях 0,01; 0,05; 0,10; 0,15; 0,20 (г/см3) непосредственно перед обработкой образцов полимерных материалов. Тщательно взбалтывали в колбе и переливали (в стерильных условиях) в стакан или другую емкость, в которую удобно погружать образцы полимерных материалов/отходов.
Предварительно проводили подготовку водной суспензии спор Aspergillus niger (а также других видов микроорганизмов по отдельности), используя для этого дистиллированную воду и культуру гриба на агаризованной среде Чапека в возрасте 14-28 суток. Концентрацию спор подсчитывали методом прямого счета в камере Горяева. Для исследования использовали суспензию спор гриба с концентрацией 2 млн. спор/см3; - в суспензию также добавляли ПАВ Твин-80 (1 капля в 10 мл суспензии).
Затем надевали медицинскую маску, резиновые перчатки и проводили обработку исследуемого полимерного материала (а) суспензией АПД, погружая в сосуд на 4-5 секунд, раскладывали на решетчатое дно эксикатора и подсушивали в течение 30-40 мин. После чего из пульверизатора аккуратно распыляли суспензию спор микодеструкторов из расчета 0,0005 мл на 1 см2 полимерного образца, не допуская слияния капель споровой суспензии Aspergillus niger или другим видом микроорганизма. Одновременно готовили контрольный образец, в котором на полимерный образец в тех же количественных концентрациях наносили суспензию спор микодеструкторов без использования добавки в виде АПД. Для работы со спорами микодеструкторов использовали металлическую кювету и эксикатор. Работы выполняли при соблюдении стерильных условий в ламинарном боксе.
Далее образцы полимерных материалов с исследуемой площадью, обработанные микодеструкторами без АПД (контрольный образец) и обработанные АПД и зараженные с поверхности суспензией спор микодеструктора (опытный образец) помещали в отдельные чашки Петри и/или на решетчатое дно эксикатора на расстоянии 1,5-2 см друг от друга и инкубировали при оптимальных для развития микроорганизмов условиях - при влажности 80-85% и температуре 24-28°С, один-два раза в неделю сдвигая в сторону крышку эксикатора или чашек Петри на 5-10 секунд. Емкости открывают и закрывают для обеспечения циркуляции воздуха. Затем по истечении 28-96 суток инкубации при свободном газообмене образцы переносили в пенициллиновые флаконы объемом 15 см3. Далее их герметично закрывали и инкубировали 24-48 часов при температуре 24-28°С. Затем производили отбор шприцом аликвоты газовой пробы из флаконов с контрольными и опытными образцами в количестве 0,5-1,0 см3. Определяли в них хроматографически концентрацию диоксида углерода, рассчитывая удельную эмиссию диоксида углерода (мкмоль/см2/час) в опытной пробе Vo и контрольной пробе Vк по формуле: Vo или Vк=(So или к*0.002124*Mr*v)/(t*s), где
S - средняя площадь пика опытной или контрольной пробы на хроматографе при умножении на коэффициент 0,002124 и Mr, показывающий концентрацию CO2 в мкмолях;
Mr - молярная масса углекислого газа (равна 44,01 г/моль); v - объем аликвоты газовой пробы из флакона (см3);
t - время экспозиции инкубации пробы в закрытом флаконе, час;
s - площадь поверхности опытного или контрольного образца, см2.
Биостимулирующую активность АПД определяют по превышению эмиссии диоксида углерода в опытном образце над контрольным.
Для этого рассчитывают отношение удельной эмиссии диоксида углерода в опытном образце к контрольному в % (об), определяя кратность превышения концентрации диоксида углерода (k) в опытном образце по формуле: k=Vo/Vк.
При значении k>2 определяют стимулирующую активность АПД.
Результаты испытаний представлены в таблице 1.

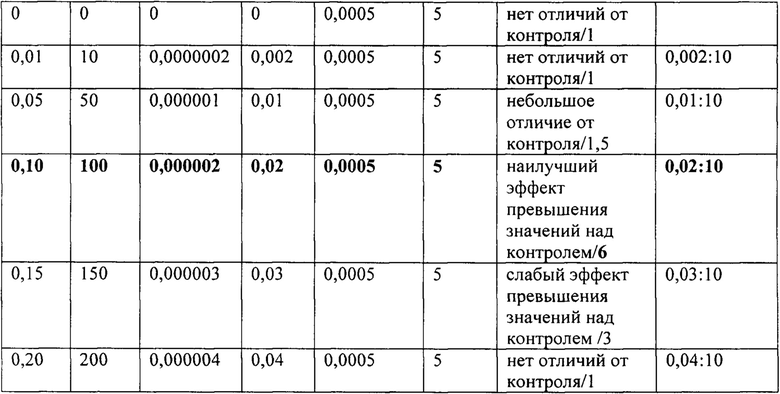
АПД наносили из расчета по 0,02 мл на см2.
Споры микодеструктора (гриба) наносили в виде суспензии (концентрация 2 млн. спор/см3) из расчета 0,0005 мл на 1 см2 образца. Наилучшим соотношением АПД к микодеструктору как видно из таблицы явилось 0,02 г АПД к 10 млн. спор микодеструктора.
Пример 1.
Для исследования использовали полимерный материал в виде высушенной пластины тонкого полиуретанового герметика Makroflex.
Образцы материала очищали от внешних загрязнений, погружая на 1 минуту в этиловый спирт, и высушивали. Расход спирта составлял от 0,05 до 0,1 дм3/м2. Предварительно осуществляли подготовку суспензии спор Aspergillus niger как описано выше. Готовили суспензию спор грибов в воде по ГОСТ 9.048. (п. 1.3). 0,0005 мл/см2. Готовили суспензию препарата АПД в рабочей концентрации 0,01; 0,02 и 0,03 г/см2. Затем погружали в АПД образцы полимерного материала на 4-5 сек.
Под ламинарным боксом при соблюдении условий стерильности готовили пластины полимерного материала в количестве 3 контрольных и 3 опытных. Контрольные образцы погружали в стерильную дистиллированную воду, а опытные образцы погружали в суспензию АПД в концентрации 0,1 г/см3. Затем выкладывали на решетчатое дно эксикатора, подсушивали в течение 30-40 мин. После чего опытные и контрольные образцы обрабатывали из пулевизатора суспензией спор Aspergillus niger, не допуская слияния капель на поверхности.
Образцы полимерных материалов с исследуемой площадью поверхности (s) равной 9 см2, зараженные без АПД (контрольный образец) и зараженные с поверхности суспензией спор Aspergillus niger с АПД (опытный образец) размещали в эксикаторах, на дно которых налита вода, и инкубировали 68 суток при температуре 29°С и влажности 80%.
Затем эти образцы полимерных материалов контрольные и опытные помещали в пенициллиновые флаконы объемом 15 см3. Герметично закрывали и инкубировали 24 часа при температуре 28°С. Из пенициллиновых флаконов с контрольным и опытным образцами отобрали шприцом аликвоты газовой пробы (v) в количестве 1,0 см3. Далее определяли в ней концентрацию диоксида углерода с помощью газового хроматографа (М 3700-4).
Было проведено три измерения, при этом площадь пика контрольной пробы на хроматографе трех параллельных измерений равнялась 352,66; 581,30; 514,46. Рассчитанная средняя площадь пика пробы на хроматографе (Sк) при этом равнялась 482,81. Молярная масса углекислого газа (Mr) составляет 44,01 г/моль. Объем аликвоты газовой пробы из флакона (v) составил 1 см3. Время экспозиции инкубации пробы в закрытом флаконе (t) составляла 24 часа. Удельная эмиссия диоксида углерода (мкмоль/см /час, в контрольной пробе) рассчитывали по формуле: Vo=(482,81*0,002124*44,01*1)/(24*9)=0,210
Также было проведено три измерения площади пика опытной пробы в грех параллелях на хроматографе, которые равнялись 3549,3; 3015,2; 3195,5. Рассчитанная средняя площадь пика пробы на хроматографе (Sк) при этом равнялась 3253,00. Молярная масса углекислого газа (Mr) составляет 44,01 г/моль. Объем аликвоты газовой пробы из флакона (v) составил 0,5 см3. Время экспозиции инкубации пробы в закрытом флаконе (t) составляла 24 часа. Удельная эмиссия диоксида углерода (мкмоль/см2/час, в контрольной пробе) рассчитывали по формуле: Vo=(3253,0*0,002124*44,01*0,5)/(24*4,4)=1,44.
Затем рассчитывали отношение удельной эмиссии диоксида углерода в опытном образце к контрольному в % (об), определяя кратность превышения концентрации диоксида углерода (k) в опытном образце по формуле: k=1,44/0,21=6,74.
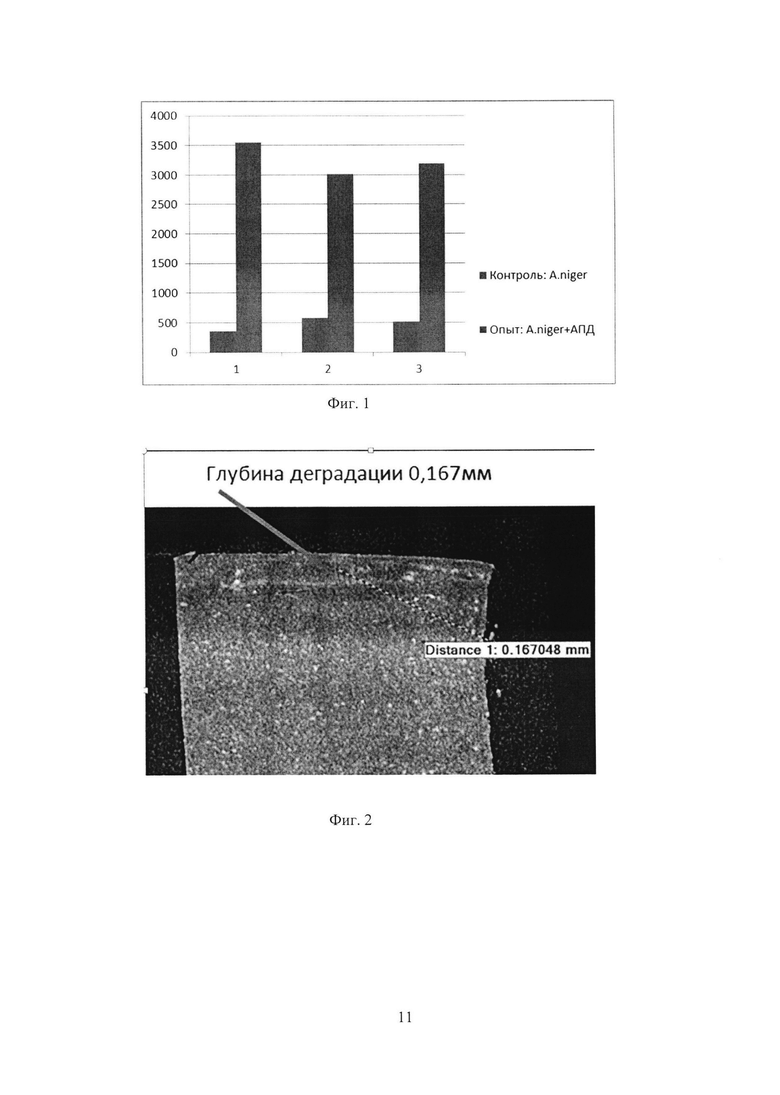
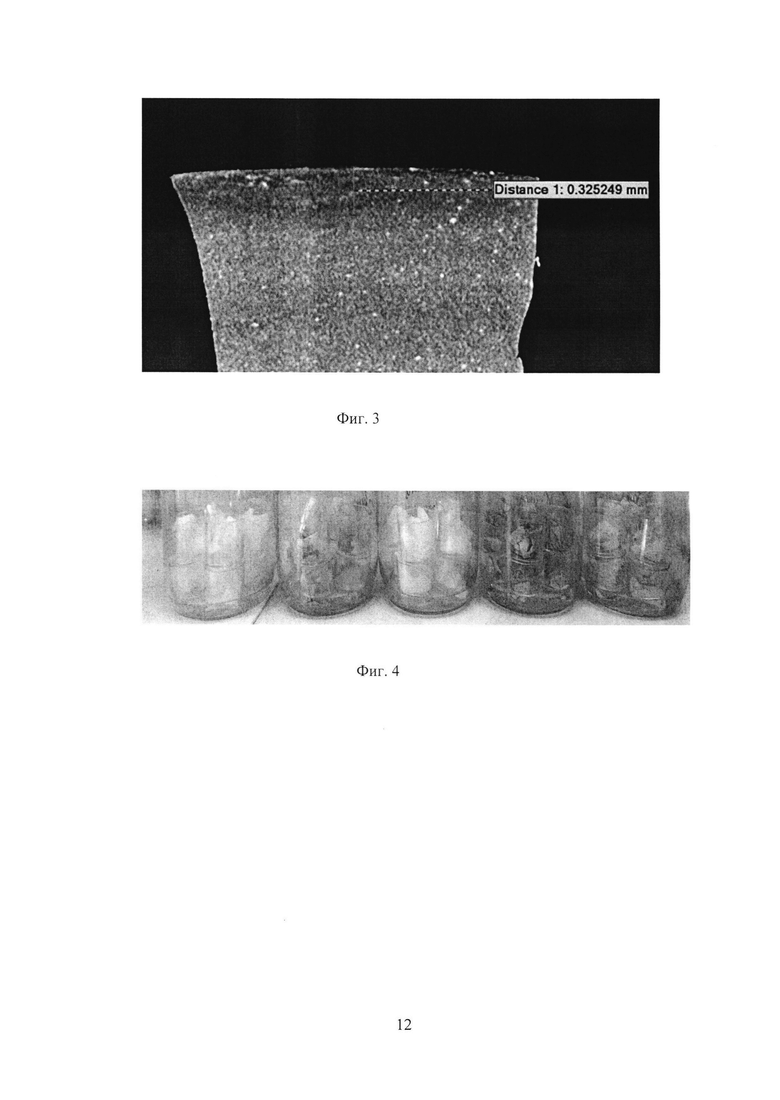
Таким образом, в опытном образце наблюдалась стимуляция физиологической активности микроорганизмов, которая отражается в увеличении эмиссии СО2. А k - кратность превышения значения содержания диоксида углерода (в объемных процентах) опытного над контрольным составила 6,74, что больше 2. Представленные на фиг. 1 иллюстрации, полученные с помощью инженерной томографии контрольного образца (0,167 мм) и опытного (0,325 мм) показывают различия в глубине деструкции полимерного материала, что подтверждает повышенную агрессивность микроорганизмов в варианте с добавкой АПД.
Было проведено исследование степени деструкции полимерного материала путем оценки обрастания мицелия в баллах по ГОСТ 9.048-89. Агрессивность биодеструкторов в опытном образце превышала таковую в контрольном, что представлено на фиг. 2, 3 и 4. На фигуре 2 представлен контрольный образец полимерного материала обработанного A. niger без АПД. Глубина деградации равна 0,167 мм. На фиг. 3 представлен опытный образец полимерного материала, обработанного A. niger с АПД. При этом АПД к микроорганизмам деструкторам г:млн. спор 0,02:10 соответственно. На фиг. 4 представлены образцы биоразлагаемой полиэтиленовой пленки, где слева направо первый образец является котролем не обработанный ничем; второй образец обработан микодеструктором - гриб A. niger; третий обработан только АПД, четвертый образец обработан A. niger + АПД в заявленных концентрациях соотношений и пятый образец также обработан спорами A. niger + прпаратом АПД в заявленных концентрациях соотношений и подвергнутый автоклавированию. В четвертом и пятом образцах соответственно имеется наилучший эффект роста гриба и его разрушительного действия на полиэтиленовую пленку.
Таким образом, биостимулирующий препарат АПД действительно оказывает положительный эффект на физиологическую активность биодеструкторов и способствует ускорению деградации полимерных материалов.
Учитывая отсутствия коммерческого интереса к подобному отходу пивоваренного производства, предлагаемая методика обработки полимерных отходов не только позволит решить некоторые современные экологические проблемы, но является экономически выгодным процессом утилизации отходов.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ определения агрессивности микроорганизмов-биодеструкторов полимерных материалов | 2018 |
|
RU2671478C1 |
| Штамм Aspergillus niger ВКПМ F-1331 - биодеструктор полиэтилена | 2017 |
|
RU2670058C2 |
| СПОСОБ ЗАЩИТЫ БАЗАЛЬТОПЛАСТИКОВОЙ АРМАТУРЫ ОТ ГРИБНОГО ПОРАЖЕНИЯ | 2020 |
|
RU2757053C1 |
| СПОСОБ КАЧЕСТВЕННОЙ ОЦЕНКИ БИОКОРРОЗИОННЫХ ПОРАЖЕНИЙ ТОНКОСТЕННЫХ ГЕРМЕТИЧНЫХ ОБОЛОЧЕК ИЗ АЛЮМИНИЕВО-МАГНИЕВЫХ СПЛАВОВ ПРИ ЭКСПЛУАТАЦИИ КОСМИЧЕСКИХ АППАРАТОВ И СУСПЕНЗИЯ СПОРОВЫХ МАТЕРИАЛОВ ДЛЯ ЕГО РЕАЛИЗАЦИИ | 2011 |
|
RU2486250C2 |
| СПОСОБ ПОЛУЧЕНИЯ СТИМУЛЯТОРА РОСТА МИКРООРГАНИЗМОВ | 2011 |
|
RU2482175C1 |
| СРЕДСТВО ДЛЯ ЗАЩИТЫ ОТ БИОПОВРЕЖДЕНИЙ ПРОМЫШЛЕННЫХ МАТЕРИАЛОВ, И СТРОИТЕЛЬНЫХ БЕТОНА, КИРПИЧА, ДРЕВЕСИНЫ, А ТАКЖЕ ШТУКАТУРНО-ОТДЕЛОЧНЫХ МАТЕРИАЛОВ | 2007 |
|
RU2383613C2 |
| ШТАММ STREPTOMYCES FLAVOGRISEUS - ПРОДУЦЕНТ АНТИБИОТИЧЕСКОГО КОМПЛЕКСА, СОДЕРЖАЩЕГО ГЕКСАЕНОВЫЙ АНТИБИОТИК ПОДГРУППЫ МЕДИОЦИДИНА И НЕПОЛИЕНОВЫЙ АНТИБИОТИК ГЕТЕРОЦИКЛИЧЕСКОЙ СТРУКТУРЫ | 2013 |
|
RU2562119C2 |
| Экологически безопасный биоцид для защитных биостойких органосиликатных покрытий | 2020 |
|
RU2741653C1 |
| ДРОЖЖИ SACCHAROMYCES CEREVISIAE ШТАММ ВГШ-2 ДЛЯ БРОДИЛЬНЫХ ПРОИЗВОДСТВ | 1998 |
|
RU2147034C1 |
| Штамм Aspergillus terreus в качестве биодеструктора полиэтилена высокого давления | 2017 |
|
RU2679078C1 |
Изобретение относится к биотехнологии. Предложен способ стимуляции активности грибов-биодеструкторов полимерных отходов. Способ предусматривает использование добавки природного происхождения - автолизата пивных дрожжей (АПД) при следующем соотношении АПД к грибам-биодеструкторам, г:млн спор, 0,02:10 соответственно. Изобретение обеспечивает повышение агрессивности грибов-биодеструкторов в отношении полимерных отходов. 4 ил., 1 табл., 1 пр.
Способ стимуляции активности грибов-биодеструкторов полимерных отходов, включающий использование добавок природного происхождения, отличающийся тем, что в качестве добавки используют автолизат пивных дрожжей (АПД) при следующем соотношении АПД к грибам деструкторам, г:млн спор, 0,02:10 соответственно.
| САКАЕВА Э.Х., МЕХОНОШИНА А.В | |||
| "Исследование биодеструкции отходов полимерных материалов".//Транспорт | |||
| Транспортные сооружения | |||
| Экология | |||
| Автомобиль-сани, движущиеся на полозьях посредством устанавливающихся по высоте колес с шинами | 1924 |
|
SU2017A1 |
| SHTILMAN M.I | |||
| "Biodegradation of polymers".// Journal of Siberian federal University | |||
| Biology, 2015, N 8, с.113-130 | |||
| ЛУГАУСКАС А.Ю | |||
| и др | |||
| "Каталог микромицетов-биодеструкторов полимерных материалов".// М., "Наука", 1987, с.27 | |||
| СПОСОБ ПОЛУЧЕНИЯ ЖИДКОГО КОДЖИ | 2006 |
|
RU2409659C2 |
| КАШИРСКАЯ А.О | |||
| "Разработка микробного биопрепарата на основе микроорганизмов-деструкторов полимерсодержащих отходов".// Естественные и математические науки в современном мире: сб.ст | |||
| по матер.ХVIII Междунар.научно-практ.конф., Новосибирск: СибАК, 2014, N 5 (17), с.160-166. | |||
Авторы
Даты
2018-09-26—Публикация
2017-12-21—Подача