Изобретение относится к области биотехнологии, в частности к средствам борьбы с загрязнениями окружающей среды, и касается использования штамма Aspergillus niger ВКПМ F-1331 - в качестве биодеструктора полимерных материалов на примере полиэтилена. Изобретение может быть использовано при утилизации таких полимерсодержащих отходов и материалов.
В настоящее время остро стоит проблема загрязнения окружающей среды отходами полимерной природы. В связи с массовым производством упаковочных материалов и их широким использованием во многих областях деятельности человека (промышленности: строительство, агросектор, автопроизводства; бытовой деятельности), происходит чрезмерное накопление синтетических полимерных материалов в окружающей среде, что вызывает необходимость в утилизации данных соединений.
Известен штамм микроскопических грибов - биодеструктор полимерных материалов, которые встречается на полимерсодержащих материалах практического назначения России и Прибалтики (см. кн. Лугаускас А.Ю. и др. Каталог микромицетов - биодеструкторов полимерных материалов, М.: Наука, 1987 г. С. 72). Представлены краткие данные о культурально-морфологических особенностях биодеструкторов. Однако штамм обладает меньшей деструкционной способностью в отношении полимерсодержащих материалов, таких как полиэтилен высокого давления.
В качестве ближайшего аналога (прототипа) принят штамм Clonostachys solani f. Nigrovirens (van Beyma) Schroers - биодеструктор термопластичных полиуретанов и латексов на основе акриловой кислоты (Патент РФ №2415914, 2011). Однако, при отнесении микроорганизмов к биодеструкторам использовался метод приманки, который менее эффективен, чем метод накопительных культур, используемый при реализации предполагаемого изобретения на протяжении 100 месяцев экспериментальных исследований.
Технической задачей заявляемого изобретения является выявление нового штамма, характеризующегося высоким уровнем биодеструкции в отношении полиэтилена, путем изменения физико-химических особенностей образцов после иммобилизации их исследуемым микромицетом, а так же интенсивности действия ферментных систем микромицета под действием факторов окружающей среды для максимизации деструктивного процесса.
Технический результат - повышение биодеструкции полиэтилена штаммом Aspergillus niger ВКПМ F-1331 в составе консорциума микроорганизмов-деструкторов, путем снижения прочности полиэтилена при растяжении (σрм) на 49,2% и относительного процентного удлинения при разрыве (ε) на 80,2% за весь период экспозиции модельных систем.
Предлагаемый штамм в составе сообщества биодеструкторов деформирует аморфную часть полимерсодержащего материала и нарушает его кристалличность. Таким образом, происходит снижение плотности укладки длинной цепи метиленовых групп, которые составляют молекулу полиэтилена, что приводит к снижению прочности и увеличению упругости материала.
Особенностью предлагаемого штамма является то, что в процессе его культивирования на протяжении 21 суток на минеральной синтетической среде с полиэтиленом при оптимальных условиях культивирования наблюдается максимальная экзооксидоредуктазная активность. Экзооксидоредуктазы способны осуществлять окисление химических группировок обширного количества органических соединений, а так же повышать устойчивость микроскопических грибов к условиям внешней среды.
Штамм Aspergillus niger выделен в лабораторных условиях методом накопительных культур из модельных экосистем на основе минеральной синтетической среды (содержание неорганических солей не более 2%) с внесением полиэтилена. Заявляемый штамм стабильно выделялся на протяжении 100 месяцев непрерывного культивирования модельного эксперимента.
Таксономическая принадлежность штамма определена при помощи нуклеотидных последовательностей генов 18S рДНК. Штамм депонирован во Всероссийской коллекции промышленных микроорганизмов при ФГУП ГосНИИгенетика и имеет коллекционный номер F-1331.
Культура заявляемого штамма имеет следующие признаки:
- Культуральные признаки: ограниченно растущие колонии, пушистые с ровным краем; на минеральном синтетическом агаре размер колонии D=2-3 см достигается за 10 суток культивирования; изначально колонии белые, на 3 сутки культивирования появляется густое темно-коричневое/черное спороношение, наблюдается поверхностно-стелющийся рост с участками глубинного роста; цвет обратной стороны колонии белый, слегка желтоватый; может образовывать желтоватый пигмент; по мере старения конидиальные головки расщепляются на 2 или более колонки; концентрических кругов и складчатости нет; возможно культивирование на агаре Чапека и других питательных средах и субстратах.
- Морфологические признаки: конидиальные головки большие и черные, сначала шаровидные, потом радиальные, при старении расщепляющиеся на две колонки, 700-800 мкм в диаметре, везикулы округлые неодинаковой величины (30-50 мкм). Конидиеносцы 1,5-3 мкм, гладкие коричневых оттенков в верхней половине. Вздутие шаровидное 55-70 мкм в диаметре. Конидии шаровидные 4-5 мкм, коричневые нерегулярношиповатые. Стеригмы радиальные, двуярусные: первого яруса - тесноскрученные разных размеров, второго яруса - однообразные почти черного цвета.
- Физиолого-биохимические признаки: штамм термотолерантный, способен расти при температуре 15-40°С (оптимальные значения 24-26°С), оптимум рН 6,0-7,0 (рост наблюдается при рН=3-10), максимально активный рост на питательных средах с содержанием минеральных солей ≤2%. Хорошо растет на стандартных питательных средах: агар Чапека, сусло-агар. Ассимилирует экзооксидоредуктазы (каталаза, пероксидаза), глюкозу. Проявляет высокую липолитическую, пектолитическую активность, наименее выражена протеолитическая, амилолитическая, целлюлозолитическая активность. Тип катаболизма - дыхание. Отношение к кислороду - аэроб. Тип питания: гетеротрофный. Необходимость в ростовых факторах и витаминах отсутствует. Штамм непатогенный, нетоксичный.
Условия культивирования: для получения препаративной формы штамма Aspergillus niger ВКПМ F-1331 в качестве питательной среды используют недорогостоящую среду - минеральный синтетический агар следующего состава (г/л) K2HPO4 - 7,0; KH2PO4 - 0,3; MgSO4⋅7H2O - 0,1; (NH4)2SO4 - 1,0; Na-цитрат⋅3H2O - 0,5; микроэлементы: MgO - 0,l; FeCl3 - 0,054; ZnSO4⋅7H2O - 0,014; MnSO4⋅4H2O - 0,011; CuSO4⋅5H2O - 0,0025; CoSO4⋅7H2O - 0,0028; H3BO3 - 0,006; NaMoO4⋅2H2O - 0,0049; дистиллированная вода - 1,0). Для получения посевного материала используют стандартную методику: культуру рассевают на скошенный синтетический агар, инкубируют в условиях термостата при 25-28°С в течение 5-7 суток. При культивировании штамм Aspergillus niger ВКПМ F-1331 не нуждается в дополнительных факторах роста.
Для хранения штамма штамма Aspergillus niger ВКПМ F-1331 используют метод периодических пересевов на поверхность скошенного синтетического агара (3-4 раза в год). После пересева штамма производится культивирование при температуре 25-28°С в течение 5-7 суток, после чего культуры хранят при температуре 4±1°С.
Заявляемый штамм, являющийся биодеструктором полимерсодержащих материалов, хранится в коллекции кафедры «Прикладная биология и микробиология» ФГБОУ ВО «Астраханский государственный технический университет» и во Всероссийской коллекции промышленных микроорганизмов ФГБУ «ГосНИИгенетика» (г. Москва).
Получение и применение заявляемого штамма поясняется нижеприведенными примерами
Пример 1 демонстрирует условия культивирования заявляемого штамма Aspergillus niger ВКПМ F-1331. В ходе экспериментальных исследований производили определение оптимальных для роста и развития заявляемого штамма значений следующих факторов среды: температура, влажность, освещенность, кислотность, соленость. По истечении определенного срока культивирования определяли ростовые параметры и ростовой коэффициент заявляемого штамма (см. монографию А.С.Бухало «Высшие съедобные базидиальные грибы в чистой культуре в чистой культуре». - Киев: изд-во «Наукова думка», 1988. - 144 с.)
Изучение температуры культивирования производилось при 3-х температурных режимах: 36±0,9°С, 25±0,5°С, 4±0,6°С. По истечении 14 суток культивирования изучали параметры развития микромицета, представленные в таблице 1.
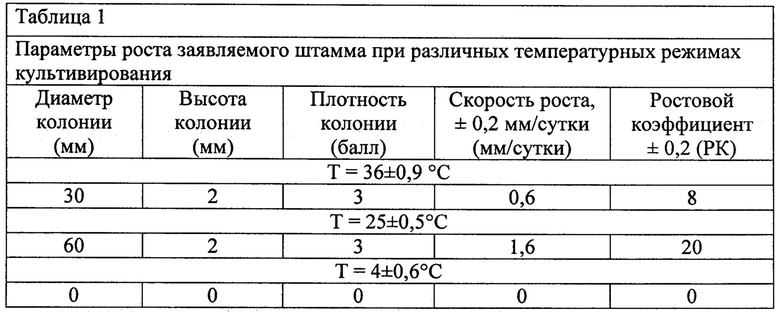
Из таблицы 1 видно, что оптимальной температурой для развития заявляемого штамма является температурный режим 25±0,5°С.
Изучение содержания влаги в среде проводилось при 2х уровнях увлажненности: на высушенном и влажном субстрате, инокулированном суспензией спор микромицета. По истечении 14 суток культивирования изучали параметры развития микромицета. В ходе эксперимента установили, что на сухом субстрате колонии не развивались, в то время как на влажном диаметр колоний был равен 20±2 мм. Заявленному штамму для роста, развития и поддержания жизненных процессов необходимо значительное содержание влаги.
Изучение влияния света на рост и развитие заявляемого штамма производили при постоянном освещении (люминесцентная лампа) и при полном его отсутствии. Исследование проводили в течении 10 суток культивирования, после которого изучали параметры развития штамма, представленные в таблице 2.
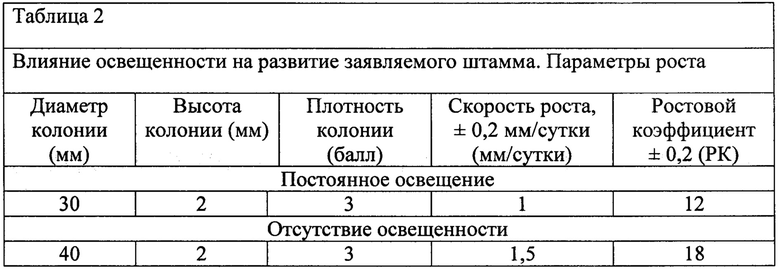
Таблица 2 демонстрирует, что отсутствие постоянного освещения более благоприятно сказывается на ростовых факторах заявляемого штамма.
Концентрацию ионов водорода в среде изучали при 3-х реакциях среды: кислая, нейтральная, щелочная. Исследование проводили в течение 14 суток культивирования, по истечении которого изучали параметры развития штамма (таблица 3).
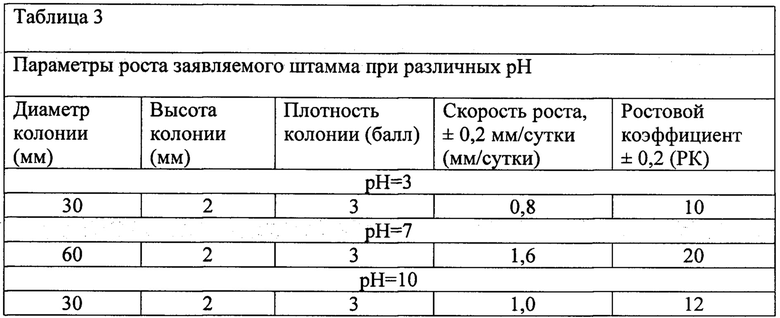
В таблице 3 показано, что нейтральная реакция среды является оптимальной для развития заявляемого штамма.
Определение солености среды для заявляемого штамма производилось при 3-х различных концентраций NaCl (3%; 5%; 10%). По истечении 20 суток культивирования изучали параметры развития объектов исследования (таблица 4).
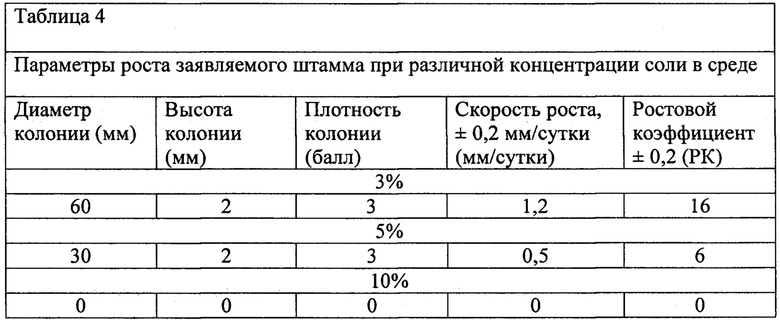
Из таблицы 4 видно, что повышение концентрации соли в питательной среде, сказывается на величине осмотического давления внутри клеток заявляемого штамма микромицета и вызывает их обезвоживание. При повышении концентрации соли более 4% рост и размножение замедляется, при концентрации более 7% - прекращается.
Пример 2 демонстрирует деструкционное влияние заявляемого штамма Aspergillus niger ВКПМ F-1331 на полиэтилен материал и его грибостойкость. Культуру штамма получали описанным способом. Грибостойкость определяли по ГОСТ 9.049-91. Инкубируемый материал - полиэтилен высокого давления (производитель ООО «Спринт-пласт») помещали в чашки Петри и инокулировали суспензией спор заявляемого штамма и выдерживали в течение 28 суток при t=25±2°С и влажности >95%. Грибостойкость определяли на основании визуального обрастания инокулируемого полимерсодержащего материала по 5-балльной шкале.
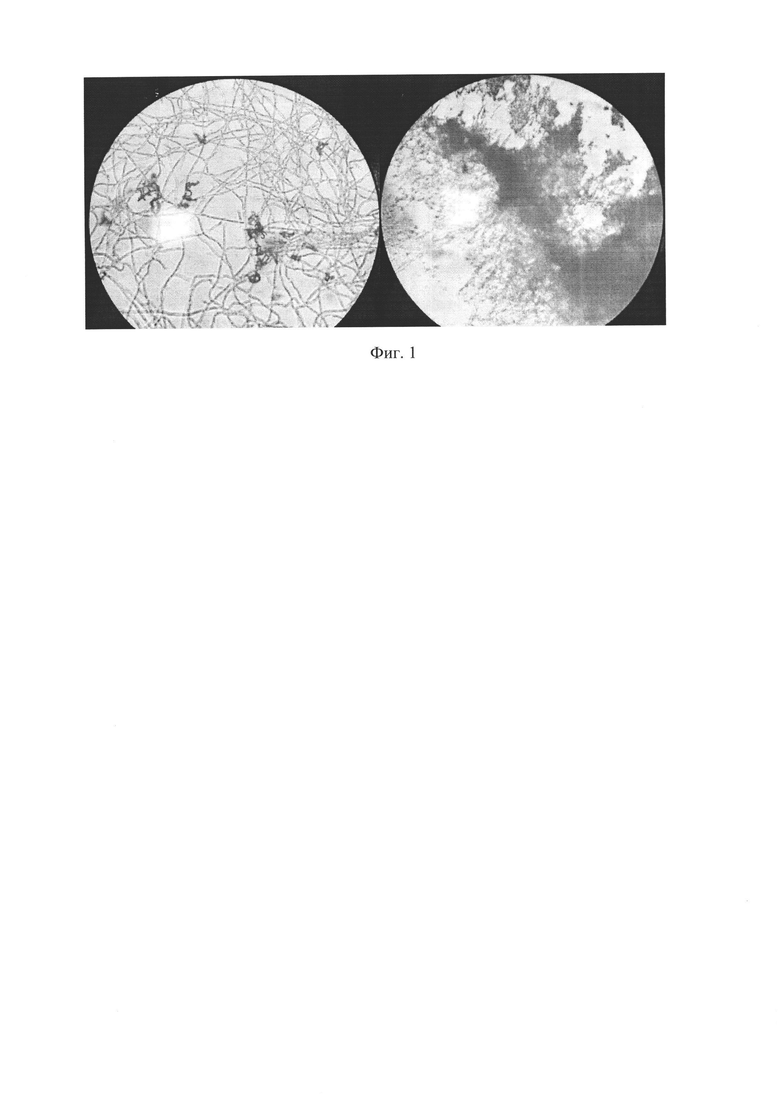
По истечении заявленного срока культивирования произвели микроскопирование нескольких образцов полимерсодержащего материала, в результате чего интенсивность роста заявленного штамма на поверхности ПСМ оценена в 4 и 5 баллов: невооруженным глазом отчетливо виден рост микромицета, покрывающего в отдельных случаях менее или более 25% поверхности соответственно. На фигуре 1 (электронное изображение) показан рост заявляемого штамма на поверхности полимерсодержащего материала по истечении 28 суток инокулирования.
Пример 3 демонстрирует проявление экзооксидоредуктазной активности заявляемого штамма Aspergillus niger ВКПМ F-1331, а так же условия среды для максимального проявления экзокаталазной и экзопероксидазной активностей.
Изучение динамики накопления экзооксидоредуктаз проводили на примере таких ферментов как каталаза и пероксидаза, так как именно они играют ключевую роль при протекании биодеструктивных процессов.
Заявленный штамм выращивался на качалке, обеспечивающей встряхивание колб со скорость 200 об/мин. В стерильные колбы Эрленмейера на 250 мл, содержащих жидкую питательную синтетическую среду, помещали при помощи бактериологической петли споры исследуемого гриба, а также измельченный полиэтиленной пакет (производитель ООО «Спринт-пласт»). Данные манипуляции проводили для подтверждения биодеструктивного потенциала заявляемого штамма. Данные сравнивали с контрольными. Контролем являлись колбы с синтетической средой без внесения полимерсодержащего материала. Затем колбы ставили на качалку при температуре +27±2°С. После окончания культивирования культуральную жидость отделяли от мицелия путем фильтрования. Для дальнейших исследований использовалась культуральная жидкость (КЖ).
Определение активности пероксидазы проводилось спектрофотометрически (СФ-2000) по модифицированому методу Aurand'a (см. Aurand et all, 1956). В качестве субстрата использовали пероксид водорода (0,03%) и парафенилендиамин (0,1 М). Измерения проводили при λmax = 535 нм.
В кювету спекрофотометра толщиной 1 см помещалось: 1,5 мл буферного раствора рН=7,2; 0,5 мл ферментативного препарата (КЖ); 0,5 мл ОДМ раствора п-фенилендиамина; 0,5 мл 0,03% H2O2. В контрольной кювете H2O2 заменяли водой. Измерения проводили в течение 1 минуты.
Определение активности каталазы проводилось спектрофотометрически (СФ-2000) по методу Patterson'а (см. Patterson et all, 1984). В качестве субстрата использовали пероксид водорода (30 мМ). Измерения проводили при λmax = 240 нм.
В кювету спекрофотометра толщиной 1 см помещалось: 1 мл буферного раствора рН=7,8; 1 мл ферментативного препарата (КЖ); 1 мл 30 мМ H2O2. В контрольной кювете H2O2 заменяли водой. Измерения проводили в течение 1 минуты.
Активность пероксидазы и каталазы рассчитывали по формуле:
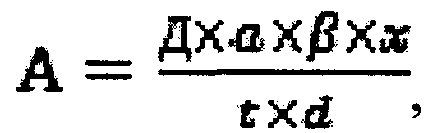
где А - активность фермента, Д - приращение оптической плотности, d - толщина слоя жидкости в кювете (1 см), t - время измерения, мин.; α×β×х - факторы разведения (равны 1).
Результаты измерений выражались в условных единицах (у.е.). За единицу активности принималось приращение оптической плотности в 1 мл реакционной смеси за 1 час, в пересчете на 1 мг вносимого белка.
Эксперименты проводили в течение 21-х суток. Контрольные показатели измеряли на 7, 14 и 21 сутки инокулирования.
Установили, что максимальное продуцирование каталазы и пероксидазы у заявляемого штамма наблюдалось на 14 сутки культивирования, причем показатели опытных колб (с субстратом) превышали контрольные (без субстрата) в 2 (0,64±0,04 у.е.) и 8 (0,079±0,009 у.е.) раз соответственно. Полученные данные представлены на фигуре 2.
Вышеприведенные денные свидетельствуют о высокой эксзооксидоредуктазной активности заявляемого штамма Aspergillus niger ВКПМ F-1331 в отношении полиэтилена высоко давления, который был использован в эксперименте в качестве субстрата.
Определили оптимальные значения рН и температуры среды для проявления экзооксидоредуктазной активности заявляемого штамма. рН-оптимум ферментов важен для дальнейшей постановки модельных экспериментов, направленных на изучение процесса биодеструкции полимерсодержащих материалов.
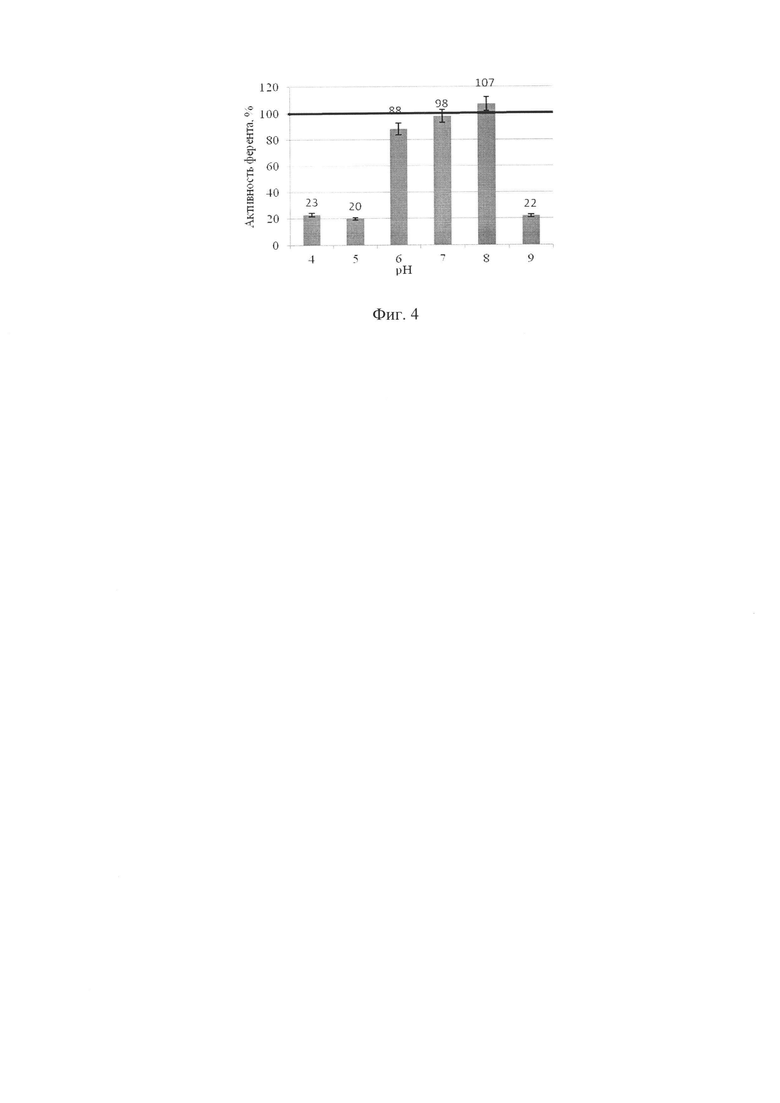
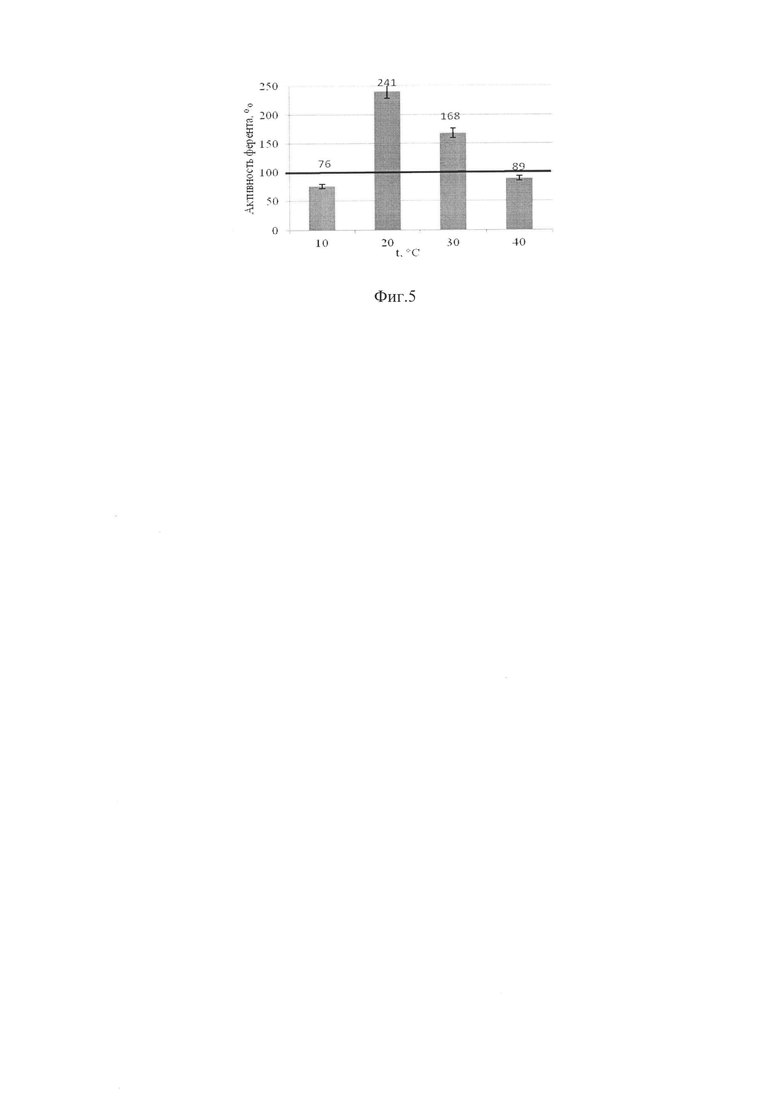
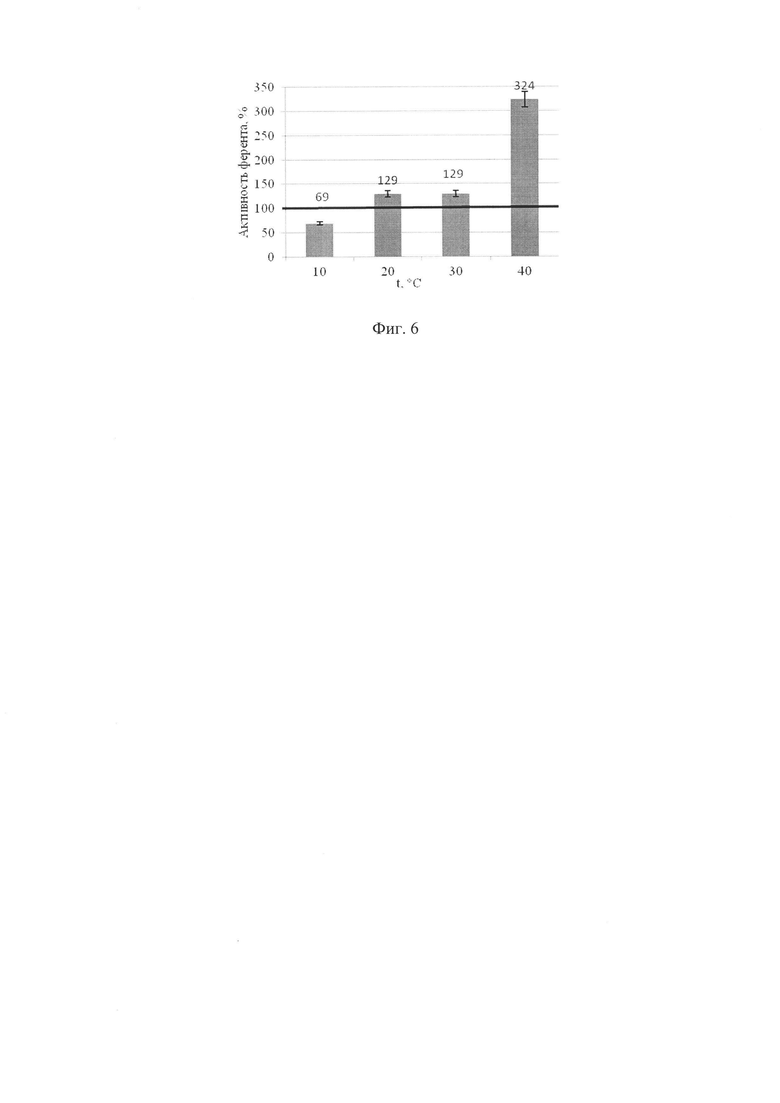
Полученные экспериментальные данные представлены в %, произведен перерасчет при помощи дисперсионного анализа, построен график. Значения сравнивали с контрольными (100%). Данные по определения рН - оптимума для проявления экзопероксидазной и экзокаталазной активностей показаны на фигурах 3, 4, данные по температурному оптимуму - на фигурах 5, 6.
Изменение уровня активности пероксидазы при культивировании заявленного штамма Aspergillus niger ВКПМ F-1331 на среде с различными значениями рН показало, что количество фермента по отношению к контролю увеличивается при рН=4 на 56%, остальные показатели ниже контроля. Оптимальное значение рН=4.
Выше представленные данные показывают изменение уровня активности экзокаталазы при культивировании заявленного штамма Aspergillus niger ВКПМ F-1331 на среде с различными значениями рН по отношению к контролю. Оптимальное значение рН находится в диапазоне значений от 7 до 8.
Экспериментальные данные показывают, что изменение пероксидазной активности при культивировании Aspergillus niger ВКПМ F-1331 на среде с различными температурами увеличивается при температуре 20°С и 30°С на 141% и 68% соответственно, остальные показатели ниже уровня контроля. Температурный оптимум в диапазоне от 20°С до 30°С.
Выше представленные данные показывают, что изменение каталазной активности при культивировании Aspergillus niger при различных температурных режимах увеличивается при 40°С на 224%, при 20°С и 30°С на 29%. Температурный оптимум проявления экзокаталазной активности в диапазоне от 20°С до 40°С.
Заявляемый штамм Aspergillus niger ВКПМ-1331 стабильно выделяется в составе сообщества микромицетов - деструкторов полиэтилена на протяжении 100 месяцев культивирования модельных экспериментов. Установлено, что для достижения максимальных ростовых параметров культуры биодеструктора необходим температурный режим в 25±0,5°С, высокое содержание влаги в среде (>60%), культивирование при постоянном освещении и нейтральная реакция среды. За 28 суток культивирования штамма на поверхности полимерсодержащего материала в вышеуказанных инкубационнных условиях происходит обрастание полиэтилена, образование микротрещин. Заявляемый штамм обладает высокой экзооксидоредуктазной активностью (каталаза, пероксидаза), за счет чего обеспечивается протекание биодеструктивных процессов, причем максимальное выделение ферментов происходит на 14 сутки экспонирования на поверхности полиэтилена.
Положительный эффект заявляемого штамма Aspergillus niger ВКПМ-1331 заключается в эффективном действии экзооксидоредуктаз микромицета, входящего в состав сообщества биодеструкторов; высокой степени обрастания полиэтилена, за счет чего происходит снижение физических параметров полимеродержащего материала.
| название | год | авторы | номер документа |
|---|---|---|---|
| Штамм Aspergillus terreus в качестве биодеструктора полиэтилена высокого давления | 2017 |
|
RU2679078C1 |
| Штамм Streptomyces hygroscopicus 18 - продуцент нафтохиноновых антибиотиков - астолидов А и В с противогрибковой и цитотоксической активностью и способ их получения | 2018 |
|
RU2681828C1 |
| ШТАММ ГРИБА ASPERGILLUS NIGER - ПРОДУЦЕНТ ЛИМОННОЙ КИСЛОТЫ | 2000 |
|
RU2192460C2 |
| ШТАММ БАКТЕРИЙ BACILLUS SP. - АНТОГОНИСТ МИКРОМИЦЕТОВ - ДЕСТРУКТОРОВ ТЕХНИЧЕСКИХ СМАЗОЧНЫХ МАСЕЛ | 1991 |
|
RU2031936C1 |
| ШТАММ Aspergillus niger - ПРОДУЦЕНТ ЛИМОННОЙ КИСЛОТЫ | 2013 |
|
RU2558228C2 |
| ПРЕПАРАТ ДЛЯ ОЧИСТКИ ПОЧВЫ И ВОДНЫХ ПОВЕРХНОСТЕЙ ОТ НЕФТИ И НЕФТЕПРОДУКТОВ | 2004 |
|
RU2280013C2 |
| ШТАММ ГРИБА ASPERGILLUS ORYZAE - ПРОДУЦЕНТ КОМПЛЕКСА ПРОТЕИНАЗ, ПЕПТИДАЗ, β-ГЛЮКАНАЗЫ, α-АМИЛАЗЫ И КСИЛАНАЗЫ | 2006 |
|
RU2315096C1 |
| ШТАММ ГРИБА ASPERGILLUS NIGER ВКПМ F - 790 - ПРОДУЦЕНТ ГЛЮКОНОВОЙ И ЛИМОННОЙ КИСЛОТ | 1999 |
|
RU2183218C2 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ФИТАЗЫ | 2012 |
|
RU2504579C2 |
| ФРАГМЕНТ ДНК РСХ-302, КОДИРУЮЩИЙ СИНТЕЗ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ PENICILLIUM CANESCENS И ШТАММ ГРИБА PENICILLIUM CANESCENS - ПРОДУЦЕНТ СЕКРЕТИРУЕМОЙ ЭНДО-(1-4)-БЕТА-КСИЛАНАЗЫ | 2001 |
|
RU2197526C1 |


Изобретение относится к области биотехнологии. Штамм Aspergillus niger Asp.1, обладающий экзооксидоредуктазной активностью, депонирован во Всероссийской коллекции промышленных микроорганизмов под регистрационным номером ВКПМ F-1331. Штамм Aspergillus niger ВКПМ F-1331 может быть использован в качестве биодеструктора полимерных материалов на основе полиэтилена высокого давления. Изобретение позволяет повысить деструкцию синтетических полимерных материалов. 6 ил., 4 табл., 3 пр.
Штамм Aspergillus niger ВКПМ F-1331 в качестве биодеструктора полиэтилена.
| ШТАММ Trichoderma harzianum Rifai-БИОДЕСТРУКТОР ТЕРМОПЛАСТИЧНОГО ПОЛИУРЕТАНА, ПОЛИВИНИЛОВОГО СПИРТА, ЛАТЕКСА НА ОСНОВЕ АКРИЛОВОЙ КИСЛОТЫ, СЕВИЛЕНА | 2009 |
|
RU2415914C1 |
| СОПРУНОВА О.Б., ЛЕОНТЬЕВА А.О | |||
| Изменение прочностных свойств полиэтилена в процессе экспонирования в составе модельных экспериментов с микроорганизмами-деструкторами | |||
| Вестник ВГУ | |||
| Серия Химия | |||
| Биология | |||
| Фармация, 2017, N2, с.93-98 | |||
| ЛЕГОНЬКОВА О.А., СЕЛИЦКАЯ О.В | |||
| Микробиологическая деструкция композитных полимерных материалов в почвах | |||
| Почвоведение, 2009, N.1, с.71-78 | |||
| ЛЕГОНЬКОВА О.А | |||
| Биотехнология утилизации органических отходов путем создания гибридных композитов | |||
| Автореф | |||
| дисс | |||
| на соискание ученой степени доктора тех | |||
| наук | |||
| М., 2009, с.5-41. | |||
Авторы
Даты
2018-10-17—Публикация
2017-04-10—Подача