ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к композициям, составам и способам для лечения жировой дистрофии печени (ЖДП), такой как неалкогольная жировая болезнь печени (НАЖБП) и неалкогольный стеатогепатит (НАСГ). а также их осложнений, путем введения фармацевтической композиции, содержащей 15-гидрокси-эйкозапентаеновую кислоту (известную как 15-ОН ЭПК или 15-ОН ЕРА), нуждающемуся в этом субъекту. В частности, настоящее изобретение относится к фармацевтической композиции с повышенной эффективностью в сравнении с композицией, содержащей ЭПК, а не 15-ОН ЭПК, в качестве значимого активного компонента, для лечения субъектов, страдающих ЖДП и/или осложнениями ЖДП, в плане уменьшения жировых отложений в печени для лечения или профилактики ЖДП и связанных с ней осложнений.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Жировая дистрофия печени, также известная как жирная печень или жировая болезнь печени (ЖБП), представляет собой состояние, при котором большие вакуоли триглицеридных жиров накапливаются в клетках печени в результате процесса стеатоза, или аномального задержания липидов внутри клетки. Несмотря на то, что у данного состояния может быть несколько причин, жирную печень считают единым заболеванием, часто встречающимся у субъектов, избыточно употребляющих алкоголь и/или страдающих ожирением (с или без влияния резистентности к инсулину). Данное состояние также связано с другими заболеваниями, влияющими на метаболизм жиров. ЖДП можно разделить на два отдельных состояния: алкогольную ЖДП и неалкогольную ЖДП. При обоих состояниях наблюдаются микровезикулярные и макровезикулярные жировые изменения на различных стадиях заболевания. Накопление жира также может сопровождаться прогрессирующим воспалением печени (гепатитом), называемым в таком случае стеатогепатитом. В данной области техники жирная печень также известна как алкогольный стеатоз и неалкогольная жировая болезнь печени (НАЖБП), а более тяжелые формы известны как алкогольный стеатогепатит (составляющая алкогольной болезни печени) и неалкогольный стеатогепатит (НАСГ). Цирроз, связанный с неалкогольной жировой болезнью печени, является наиболее тяжелой формой заболевания и характеризуется воспалением печени, которое приводит к появлению рубцов на печеночной ткани, в конечном итоге приводящих к печеночной недостаточности.
В западном мире угрожающими темпами распространяются ожирение, метаболический синдром, сахарный диабет 2 типа и атеросклероз. В последние годы жирная печень была признана независимым фактором риска для данных заболеваний. Жирная печень представляет собой накопление триглицеридов и других жиров внутри гепатоцитов. Жировая дистрофия печени может варьировать от собственно жирной печени (также известной как «стеатоз») до жирной печени, связанной с воспалением, или стеатогепатита. Неалкогольная жировая болезнь печени (НАЖБП) и неалкогольный стеатогепатит (НАСГ) являются наиболее распространенными причинами хронического заболевания печени у взрослого населения и представляют собой важнейший фактор риска прогрессирования до печеночной недостаточности, цирроза и печеночноклеточного рака. В то время как стеатозом страдает приблизительно 30% населения, 80% пациентов с ожирением страдает НАЖБП, а у 50% пациентов, подвергавшихся бариатрической хирургии, регистрируют стеатогепатит. НАЖБП также является наиболее распространенной причиной заболевания печени у детей. По оценкам, НАЖБП страдает до 20 процентов взрослых и около 5 процентов детей. По оценкам некоторых экспертов, примерно у двух третей взрослых, страдающих ожирением, и у половины детей с ожирением может быть жирная печень. За последние десть лет с учетом того, что частота случаев ожирения удвоилась у взрослых и утроилась у детей и подростков, НАЖБП и НАСГ становятся все более распространенными. НАСГ может вызвать образование рубцов и отвердение печени, приводя к циррозу печени, очень серьезному заболеванию, при котором может потребоваться пересадка печени, и, в конечном итоге, к печеночноклеточному раку.
Не существует единого установленного терапевтического лечения жирной печени. В настоящее время лечение НАЖБП ограничено следующим: 1) лечение связанных нарушений обмена веществ, таких как диабет и гиперлипидемия; 2) контроль резистентности к инсулину с акцентом на снижение массы тела и физическую нагрузку, и/или фармакологический подход; и 3) применение антиоксидантов в качестве гепатопротекторов. Несмотря на применение многих различных способов терапии, в настоящее время отсутствует четко сформулированный способ лечения НАЖБП. Поскольку с клинической точки зрения важно устранять НАЖБП и ее осложнения, существует потребность в новых подходах, нацеленных на предупреждение и обращение вспять накапливания жира в печени.
Авторы настоящего изобретения неожиданно обнаружили, что 15-ОН ЭПК, метаболит ЭПК, является более эффективным средством для лечения ЖДП по сравнению с ЭПК.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к композициям и способам для лечения жировой дистрофии печени, включая неалкогольную жировую болезнь печени (НЖБП) и неалкогольный стетогепатит (НАСГ), путем введения композиции, содержащей 15-ОН ЭПК, субъекту, нуждающемуся в этом.
В тексте настоящего документа "15-ОН ЭПК" обозначает 15-гидрокси-эйкоза-5,8,11,13,17-пентаеновую кислоту. 15-ОН ЭПК можно синтезировать из эйкозапентаеновой кислоты, ЭПК, в соответствии со способами, известными в данной области техники. В тексте настоящего документа термин "15-ОН ЭПК" обозначает 15-ОН ЭПК в форме свободной кислоты (например, 15-гидрокси-эйкоза-5,8,11,13,17-пентаеновую кислоту) и/или ее фармацевтически приемлемого эфира, конъюгата или соли, или смесей любого из вышеназванного. Взамен можно использовать производное 15-ОН ЭПК, без включения всех производных соединения, в которых отсутствует группа гидрокси 15-ОН ЭПК. Согласно некоторым вариантам реализации 15-ОН ЭПК применяют в форме свободной кислоты. В качестве альтернативы, в настоящем изобретении применяют фармацевтически приемлемые эфиры или соли 15-ОН ЭПК. Согласно некоторым вариантам реализации 15-ОН ЭПК находится в форме алкилового эфира, такого как метиловый эфир или этиловый эфир.
В тексте настоящего документа "ЭПК" обозначает эйкоза-5,8,11,14,17-пентаеновую кислоту, также известную как 20:5n-3, омега-3 жирную кислоту. ЭПК можно легко приобрести из коммерческих источников.
Соответственно, в одном из аспектов настоящего изобретения предложен способ лечения жировой дистрофии печени у субъекта, включающий введение субъекту терапевтически эффективного количества композиции, содержащей 15-ОН ЭПК.
Согласно настоящему изобретению предложена 15-ОН ЭПК или композиция, содержащая 15-ОН ЭПК, для применения для лечения жировой дистрофии печени.
Согласно настоящему изобретению предложен способ применения 15-ОН ЭПК или композиции, содержащей 15-ОН ЭПК, для получения лекарственного средства для лечения жировой дистрофии печени.
Согласно другому аспекту в настоящем изобретении предложена фармацевтическая композиция, содержащая терапевтически эффективное количество 15-ОН ЭПК. 15-ОН ЭПК может быть единственным значимым активным ингредиентом в данной композиции, а также в способах и применении, описанных в настоящем документе. 15-ОН ЭПК может являться единственным активным ингредиентом. В качестве альтернативы, 15-ОН ЭПК можно комбинировать для совместного приготовления или совместного введения с другими агентами для лечения ЖДП. В случае, если необходимо применить дополнительный активный ингредиент, 15-ОН ЭПК можно совместно с ним приготовить в виде единичной лекарственной формы, или можно приготовить две или несколько лекарственных форм для координированного, комбинированного или одновременного введения.
В настоящем изобретении также предложены составы 15-ОН ЭПК и составы, содержащие 15-ОН ЭПК, и способы применения данных составов для лечения жировой дистрофии печени, включая неалкогольную жировую болезнь печени (НАЖБП) и неалкогольный стеатогеапатит (НАСГ).
15-ОН ЭПК представляет собой хиральную молекулу и может применяться в (S)- или (R)-энантиомерной форме или в качестве рацемической смеси. В тексте настоящего документа "15-ОН ЭПК" включает все такие формы, без ограничений в отношении стереоспецифичности. Согласно другому варианту реализации 15-ОН ЭПК содержит форму (S): 15(S)-гидрокси-(5Z,8Z,11Z,13E,17Z)-эйкозапентаеновая кислота. Согласно некоторым вариантам реализации 15-ОН ЭПК можно применять в форме этилового эфира. Согласно другим вариантам реализации 15-ОН ЭПК можно применять в качестве свободной кислоты.
В настоящем изобретении дополнительно предложена фармацевтическая композиция для перорального введения, содержащая 15-ОН ЭПК. Указанная композиция может содержать фармацевтически приемлемое вспомогательное вещество. 15-ОН ЭПК может присутствовать в любой из описанных в настоящем документе форм. 15-ОН ЭПК может присутствовать в количестве от примерно 50 мг до примерно 3000 мг.
В случае, если не дано иное определение, все технические и научные термины в тексте настоящего документа употребляются в том же значении, которое обычно подразумевается специалистом в области техники, к которой относится настоящее изобретение. Подходящие способы и материалы описаны ниже, хотя способы и материалы, схожие с описанными в настоящем документе или эквивалентные им, могут быть применены на практике согласно настоящему изобретению. Все публикации, заявки на патент, патенты и другие источники, упомянутые в тексте настоящего документа, явным образом полностью включены в настоящее описание посредством ссылки. В случае конфликта настоящее описание, включая определения, будет иметь преимущественную силу. Кроме того, материалы, способы и примеры, описанные в настоящем документе, являются исключительно иллюстративными и не ограничивают настоящее изобретение.
Другие свойства и преимущества настоящего изобретения будут видны из следующего подробного описания.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
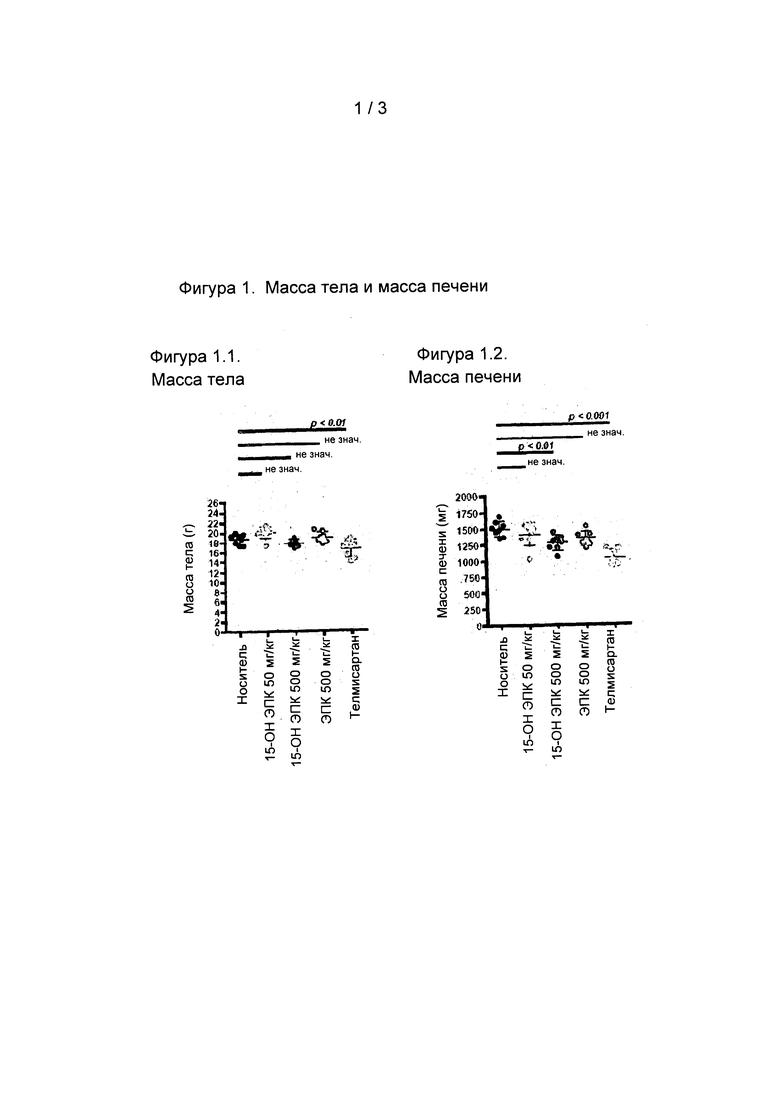
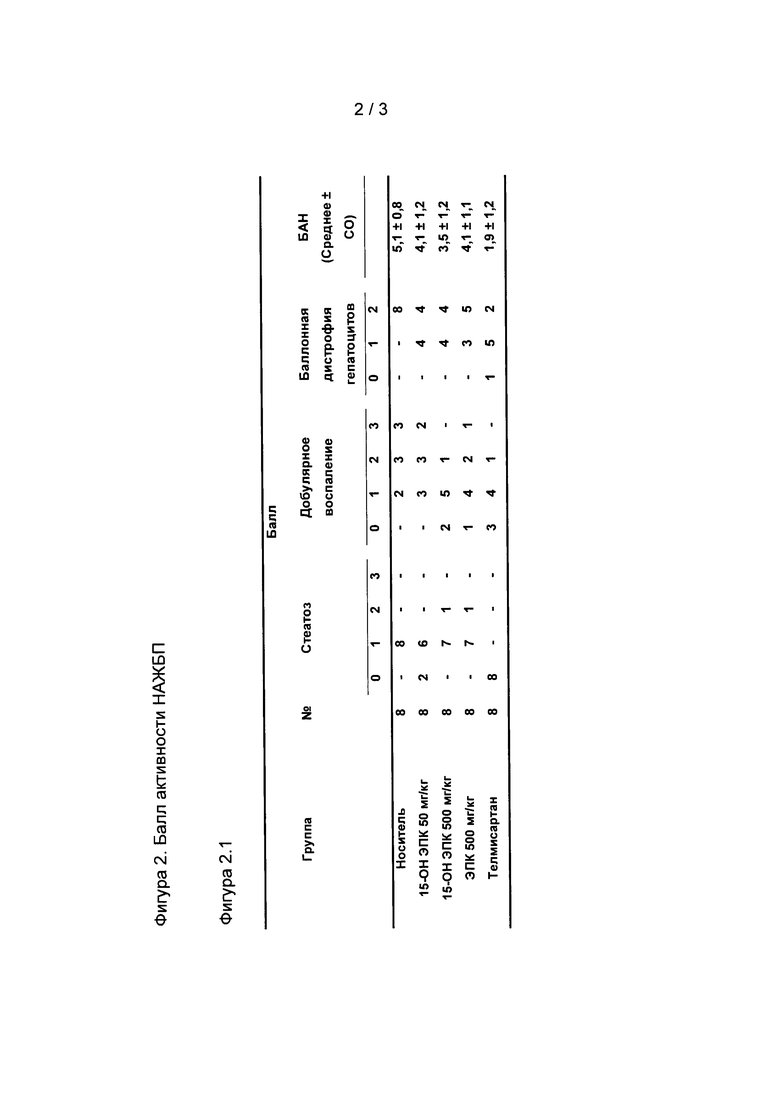
На Фиг. 1.1, 1.2, 2.1 и 2.2 представлены данные исследования эффективности in vivo 15-ОН ЭПК и ЭПК в модели STAM неалкогольного стеатогепатита, как описано в приведенных в настоящем документе примерах.
Фармацевтические композиции
В то время как настоящее изобретение может быть реализовано в различных формах, нижеприведенное описание нескольких вариантов реализации составлено с учетом того, что настоящий документ следует считать иллюстрацией изобретения, и не предполагается, что он ограничивает изобретение конкретными проиллюстрированными вариантами реализации. Названия даны исключительно для удобства и не должны трактоваться как ограничивающие настоящее изобретение тем или иным образом. Проиллюстрированные в тексте данного документа варианты реализации под любым названием могут быть скомбинированы с вариантами реализации, проиллюстрированными под любым другим названием.
Числовые значения, выражающие различные числовые величины, приведенные в тексте данного документа, если явным образом не указано иное, даны как приближенные значения, как если бы минимальному и максимальному значениям в указанных диапазонах предшествовало слово «примерно». Таким образом, могут быть использованы небольшие отклонения от указанного значения с достижением по существу тех же результатов, что и при указанном значении. Кроме того, предполагается, что описание диапазонов представляет собой непрерывный диапазон, включающий каждое значение между данными минимальным и максимальным значениями, а также любые диапазоны, которые могут быть образованы такими значениями. Также в данном документе приведены любые и все отношения (и диапазоны любых таких отношений), которые могут быть получены путем деления указанного числового значения на любое другое указанное числовое значение. Соответственно, специалист в данной области техники поймет, что многие такие отношения, диапазоны и диапазоны отношений могут быть однозначно выведены из числовых значений, представленных в данном документе, и во всех случаях такие отношения, диапазоны и диапазоны отношений представляют различные варианты реализации настоящего изобретения.
15-гидрокси-эйкозапентаеновая кислота
Согласно одному из вариантов реализации композиции согласно настоящему изобретению содержат 15-ОН ЭПК в качестве активного ингредиента. 15-ОН ЭПК является аббревиатурой для обозначения 15-гидрокси-эйкозапентаеновой кислоты, метаболита эйкозапентаеновой кислоты (ЭПК), который может быть синтезирован способами, известными специалисту в данной области техники, такими как подвергание эйкозапентаеновой кислоты воздействию фермента 15-липоксигеназы. В тексте данного документа термин "15-ОН ЭПК" относится к 15-ОН ЭПК в форме свободной кислоты (например, 15-гидрокси-эйкозапентаеновой кислоты) и/или ее фармацевтически приемлемому эфиру, конъюгату или соли, или смесям любого из вышеназванного. Взамен может быть использовано производное 15-ОН ЭПК, хотя это не касается производных соединений, в которых отсутствует гидрокси-группа 15-ОН ЭПК. Термин «фармацевтически приемлемый» в тексте данного документа означает, что определенное вещество не вызывает неприемлемой токсичности для пациента или взаимодействия с другими компонентами композиции.
Согласно одному из вариантов реализации 15-ОН ЭПК представляет собой эфир (также называемый в тексте данного документа Э-15-ОН ЭПК или этил-15-OH ЭПК). Согласно другому варианту реализации 15-ОН ЭПК содержит C1-С5 алкиловый эфир 15-ОН ЭПК. Согласно другому варианту реализации 15-ОН ЭПК содержит метиловый эфир 15-ОН ЭПК, пропиловый эфир 15-ОН ЭПК или бутиловый эфир 15-ОН ЭПК. Согласно еще одному варианту реализации 15-ОН ЭПК содержит оптически активную 15(S)-гидрокси-(5Z,8Z,11Z,13Е,17Z)-эйкозапентаеновую кислоту. Данный изомер может быть использован в любой из вышеописанных форм.
Согласно другому варианту реализации 15-ОН ЭПК включает литий-15-OH ЭПК, моно, ди- или триглицерид 15-ОН ЭПК или любой другой эфир или соль 15-ОН ЭПК или 15-ОН ЭПК в форме свободной кислоты.
Согласно различным вариантам реализации в настоящем изобретении предложены фармацевтические композиции, например композиции, доставляемые перорально, содержащие 15-ОН ЭПК. Согласно одному из вариантов реализации композиции содержат терапевтически эффективное количество 15-ОН ЭПК. Согласно одному из вариантов реализации фармацевтическая композиция содержит от примерно 0,1% до примерно 99%, от примерно 1% до примерно 95%, от примерно 5% до примерно 90% по массе 15-ОН ЭПК.
Согласно одному из вариантов реализации фармацевтическая композиция содержит по меньшей мере примерно 70%, по меньшей мере примерно 80% или по меньшей мере примерно 90% по массе 15-ОН ЭПК. Согласно одному из вариантов реализации фармацевтическая композиция содержит по меньшей мере примерно 50%, по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80% или по меньшей мере примерно 90% по массе 15-ОН ЭПК.
Согласно другому варианту реализации 15-ОН ЭПК содержится в композиции согласно настоящему изобретению в количестве от примерно 1 мг до примерно 10000 мг, от 25 мг до примерно 7500 мг, от примерно 25 мг до примерно 5000 мг, от примерно 50 мг до примерно 5000 мг, от примерно 50 мг до примерно 3000 мг, от примерно 75 мг до примерно 2500 мг, или от примерно 100 мг до примерно 1000 мг, например, примерно 25 мг, примерно 50 мг, примерно 75 мг, примерно 100 мг, примерно 125 мг, примерно 150 мг, примерно 175 мг, примерно 200 мг, примерно 225 мг, примерно 250 мг, примерно 275 мг, примерно 300 мг, примерно 325 мг, примерно 350 мг, примерно 375 мг, примерно 400 мг, примерно 425 мг, примерно 450 мг, примерно 475 мг, примерно 500 мг, примерно 525 мг, примерно 550 мг, примерно 575 мг, примерно 600 мг, примерно 625 мг, примерно 650 мг, примерно 675 мг, примерно 700 мг, примерно 725 мг, примерно 750 мг, примерно 775 мг, примерно 800 мг, примерно 825 мг, примерно 850 мг, примерно 875 мг, примерно 900 мг, примерно 925 мг, примерно 950 мг, примерно 975 мг, примерно 1000 мг, примерно 1025 мг, примерно 1050 мг, примерно 1075 мг, примерно 1100 мг, примерно 1025 мг, примерно 1050 мг, примерно 1075 мг, примерно 1200 мг, примерно 1225 мг, примерно 1250 мг, примерно 1275 мг, примерно 1300 мг, примерно 1325 мг, примерно 1350 мг, примерно 1375 мг, примерно 1400 мг, примерно 1425 мг, примерно 1450 мг, примерно 1475 мг, примерно 1500 мг, примерно 1525 мг, примерно 1550 мг, примерно 1575 мг, примерно 1600 мг, примерно 1625 мг, примерно 1650 мг, примерно 1675 мг, примерно 1700 мг, примерно 1725 мг, примерно 1750 мг, примерно 1775 мг, примерно 1800 мг, примерно 1825 мг, примерно 1850 мг, примерно 1875 мг, примерно 1900 мг, примерно 1925 мг, примерно 1950 мг, примерно 1975 мг, примерно 2000 мг, примерно 2025 мг, примерно 2050 мг, примерно 2075 мг, примерно 2100 мг, примерно 2125 мг, примерно 2150 мг, примерно 2175 мг, примерно 2200 мг, примерно 2225 мг, примерно 2250 мг, примерно 2275 мг, примерно 2300 мг, примерно 2325 мг, примерно 2350 мг, примерно 2375 мг, примерно 2400 мг, примерно 2425 мг, примерно 2450 мг, примерно 2475 мг или примерно 2500 мг.
Согласно одному из вариантов реализации 15-ОН ЭПК, входящая в состав композиции согласно настоящему изобретению, содержит по меньшей мере 90% по массе 15-ОН ЭПК (в том понимании термина "15-ОН ЭПК", которое определено и проиллюстрировано примерами в тексте данного документа). Композиции с 15-ОН ЭПК могут содержать 15-ОН ЭПК даже более высокой чистоты, например по меньшей мере 95% по массе 15-ОН ЭПК или по меньшей мере 97% по массе 15-ОН ЭПК, причем 15-ОН ЭПК находится в любой из форм 15-ОН ЭПК, описанных в данном документе. Чистота 15-ОН ЭПК (например, состав примесей) может быть дополнительно определена по любому из описаний 15-ОН ЭПК, приведенных в тексте данного документа.
Выше указаны количества 15-ОН ЭПК в фармацевтической композиции и ее чистота. Природа незаменимых жирных кислот и их синтез таковы, что композиция с 15-ОН ЭПК может включать молекулы других незаменимых жирных кислот в метаболическом каскаде незаменимых жирных кислот.
Согласно одному из вариантов реализации композиция согласно настоящему изобретению содержит не более примерно 10%, не более примерно 9%, не более примерно 8%, не более примерно 7%, не более примерно 6%, не более примерно 5%, не более примерно 4%, не более примерно 3%, не более примерно 2%, не более примерно 1% или не более примерно 0,5% по массе других омега-3 жирных кислот, включая альфа-линоленовую кислоту, стеаридоновую кислоту, докозагексаеновую кислоту (ДГК) или их производные. Согласно другим вариантам реализации такие другие омега-3 жирные кислоты отсутствуют или по существу отсутствуют.
Согласно другому варианту реализации 15-ОН ЭПК составляет по меньшей мере примерно 60%, по меньшей мере примерно 70%, по меньшей мере примерно 80%, по меньшей мере примерно 90%, по меньшей мере примерно 95%, по меньшей мере примерно 97%, по меньшей мере примерно 98%, по меньшей мере примерно 99% или 100% по массе от всех жирных кислот, содержащихся в композиции согласно настоящему изобретению.
Может присутствовать в некотором количестве эйкозапентаеновая кислота, оставшаяся от синтеза 15-ОН ЭПК. ЭПК может составлять не более примерно 10%, не более примерно 9%, не более примерно 8%, не более примерно 7%, не более примерно 6%, не более примерно 5%, не более примерно 4%, не более примерно 3%, не более примерно 2%, не более примерно 1% или не более примерно 0,5%, по массе. В качестве альтернативы, ЭПК отсутствует или по существу отсутствует в форме, не модифицированной с получением гидроксильной формы.
Дополнительные активные агенты
Согласно одному из вариантов реализации фармацевтическая композиция дополнительно содержит один или более дополнительных активных агентов. Согласно одному из вариантов реализации фармацевтическая композиция содержит дополнительный активный агент, в количестве меньшем, чем общепризнанное терапевтически эффективное количество для указанного агента. Согласно одному из вариантов реализации фармацевтическая композиция содержит дополнительный активный агент в количестве большем, чем общепризнанное терапевтически эффективное количество для указанного агента, или равном ему.
ЭПК сама по себе обладает полезными свойствами для лечения ЖДП, и согласно альтернативному варианту реализации можно комбинировать 15-ОН ЭПК с ЭПК.
Согласно одному из вариантов реализации 15-ОН ЭПК и один или более активных агентов содержатся в композиции согласно настоящему изобретению или одновременно вводятся в следующем массовом отношении к 15-ОН ЭПК: дополнительный агент от примерно 1:1000 до примерно 1000:1, от примерно 1:500 до примерно 500:1, от примерно 1:100 до примерно 100:1, от примерно 1:50 до примерно 50:1, от примерно 1:25 до примерно 25:1, от примерно 1:10 до примерно 10:1, от примерно 1:5 до примерно 5:1, от примерно 1:4 до примерно 4:1 от примерно 1:3 до примерно 3:1, от примерно 1:2 до примерно 2:1 или примерно 1:1.
Лекарственные формы
Композиция для применения согласно настоящему изобретению может быть приготовлена в виде одной или более лекарственных форм. Термин «лекарственная форма» обозначает в тексте настоящего документа порцию фармацевтической композиции, которая содержит в некотором количестве терапевтический агент для однократного применения с целью получения терапевтического эффекта. Такие лекарственные формы можно применять от одного до нескольких раз в сутки (т.е. от 1 до примерно 10, от 1 до примерно 8, от 1 до примерно 6, от 1 до примерно 4 или от 1 до примерно 2) или столько раз, сколько необходимо для того, чтобы вызвать терапевтический ответ.
Согласно некоторым вариантам реализации композиции согласно настоящему изобретению предложены в форме доставляемых перорально лекарственных форм. Неограничивающие примеры подходящих лекарственных форм включают таблетки (например, суспендируемые таблетки, раскусываемые суспендируемые таблетки, быстро диспергируемые таблетки, жевательные таблетки, и т.д.), капсуловидные таблетки, капсулы (например, капсулу из мягкого или твердого желатина или капсулу из ГПМЦ), леденцы, саше, крахмальные капсулы, пастилки, гранулы, суспензию, эликсиры, сиропы или любую другую твердую лекарственную форму, надлежащим образом адаптированную для перорального введения. Термины «пероральная доставка» и «пероральное введение» в тексте настоящего документа включают любую форму доставки, при которой агент или композицию помещают в рот пациента, получающего лечение, независимо от того, проглатывает он их или нет. Таким образом, сюда включены трансбуккальное и подъязычное введение, а также введение в пищевод.
В качестве альтернативы, композиции согласно настоящему изобретению могут также быть приготовлены в виде лекарственных форм для ректальной, местной или парентеральной (например, подкожной, внутримышечной, внутривенной и внутрикожной или инфузии) доставки.
Что касается количества 15-ОН ЭПК в композиции согласно настоящему изобретению, его можно разделять на несколько лекарственных форм. В случае перорального введения существует ограничение по размеру. В случае, если пациенту надлежит принимать от 1 до 4 г 15-ОН ЭПК в сутки, может потребоваться до 4 капсул, каждая из которых содержит 1 г 15-ОН ЭПК.
Композиции согласно настоящему изобретению могут быть в виде жидких лекарственных форм или стандартных доз для непосредственного поглощения, или они могут быть смешаны с пищей или напитком до приема. Неограничивающие примеры подходящих жидких лекарственных форм включают растворы, суспензии, эликсиры, сиропы, жидкие аэрозоли и тому подобное.
Согласно другому варианту реализации композиции согласно настоящему изобретению содержат одно или более фармацевтически приемлемых вспомогательных веществ. Термин «фармацевтически приемлемое вспомогательное вещество» в тексте данного документа обозначает любое вещество, которое само не является терапевтическим агентом, применяемое в качестве носителя или основы для доставки терапевтического агента субъекту или добавляемое в фармацевтическую композицию для улучшения ее свойств при обработке или хранении, или для обеспечения или облегчения получения стандартной дозы композиции, и которое не вызывает неприемлемой токсичности и не взаимодействует с другими компонентами в композиции. Исключительно в качестве примера, фармацевтическая композиция согласно настоящему изобретению может содержать одно или более из следующего: антиоксиданты, поверхностно-активные вещества, консерванты, ароматизаторы, сорастворители, загустители, суспендирующие агенты и липофильные фазы.
Согласно одному из вариантов реализации фармацевтическая композиция содержит один или более антиоксидантов, таких как аскорбиновая кислота, пальмитиновая кислота, аскорбил пальмитат, α-токоферол, идебенон, убихинон, феруловая кислота, кофермент Q10, ликопен, зеленый чай, катехины, эпигаллокатехин-3-галлат (ЭГКГ), полифенолы зеленого чая (ПЗЧ), силимарин, жостер калифорнийский, ресвератрол, семена винограда, экстракты граната, генистеин, пикногенол, ниацинамид, и т.п. Согласно одному из вариантов реализации фармацевтическая композиция содержит от примерно 0,01 масс. % до примерно 2 масс. % антиоксиданта, например, примерно 0,01 масс. %, примерно 0,02 масс. %, примерно 0,03 масс. %, примерно 0,04 масс. %, примерно 0,05 масс. %, примерно 0,06 масс. %, примерно 0,07 масс. %, примерно 0,08 масс. %, примерно 0,09 масс. %, примерно 0,1 масс. %, примерно 0,11 масс. %, примерно 0,12 масс. %, примерно 0,13 масс. %, примерно 0,14 масс. %, примерно 0,15 масс. %, примерно 0,16 масс. %, примерно 0,17 масс. %, примерно 0,18 масс. %, примерно 0,19 масс. %, примерно 0,2 масс. %, примерно 0,21 масс. %, примерно 0,22 масс. %, примерно 0,23 масс. %, примерно 0,24 масс. %, примерно 0,25 масс. %, примерно 0,26 масс. %, примерно 0,27 масс. %, примерно 0,28 масс. %, примерно 0,29 масс. %, примерно 0,3 масс. %, примерно 0,31 масс. %, примерно 0,32 масс. %, примерно 0,33 масс. %, примерно 0,34 масс. %, примерно 0,35 масс. %, примерно 0,36 масс. %, примерно 0,37 масс. %, примерно 0,38 масс. %, примерно 0,39 масс. %, примерно 0,4 масс. %, примерно 0,41 масс. %, примерно 0,42 масс. %, примерно 0,43 масс. %, примерно 0,44 масс. %, примерно 0,45 масс. %, примерно 0,46 масс. %, примерно 0,47 масс. %, примерно 0,48 масс. %, примерно 0,49 масс. %, примерно 0,5 масс. %, примерно 0,51 масс. %, примерно 0,52 масс. %, примерно 0,53 масс. %, примерно 0,54 масс. %, примерно 0,55 масс. %, примерно 0,56 масс. %, примерно 0,57 масс. %, примерно 0,58 масс. %, примерно 0,59 масс. %, примерно 0,6 масс. %, примерно 0,61 масс. %, примерно 0,62 масс. %, примерно 0,63 масс. %, примерно 0,64 масс. %, примерно 0,65 масс. %, примерно 0,66 масс. %, примерно 0,67 масс. %, примерно 0,68 масс. %, примерно 0,69 масс. %, примерно 0,7 масс. %, примерно 0,71 масс. %, примерно 0,72 масс. %, примерно 0,73 масс. %, примерно 0,74 масс. %, примерно 0,75 масс. %, примерно 0,76 масс. %, примерно 0,77 масс. %, примерно 0,78 масс. %, примерно 0,79 масс. %, примерно 0,8 масс. %, примерно 0,81 масс. %, примерно 0,82 масс. %, примерно 0,83 масс. %, примерно 0,84 масс. %, примерно 0,85 масс. %, примерно 0,86 масс. %, примерно 0,87 масс. %, примерно 0,88 масс. %, примерно 0,89 масс. %, примерно 0,9 масс. %, примерно 0,91 масс. %, примерно 0,92 масс. %, примерно 0,93 масс. %, примерно 0,94 масс. %, примерно 0,95 масс. %, примерно 0,96 масс. %, примерно 0,97 масс. %, примерно 0,98 масс. %, примерно 0,99 масс. %, примерно 1 масс. %, примерно 1,1 масс. %, примерно 1,2 масс. %, примерно 1,3 масс. %, примерно 1,4 масс. %, примерно 1,5 масс. %, примерно 1,6 масс. %, примерно 1,7 масс. %, примерно 1,8 масс. %, примерно 1,9 масс. % или примерно 2 масс. % одного или более антиоксидантов.
Терапевтические способы
Композиции и составы, описанные в настоящем документе, могут применяться для лечения жировой дистрофии печени. Согласно одному из вариантов реализации жировая дистрофия печени представляет собой неалкогольную жировую болезнь печени. Согласно другому варианту реализации жировая дистрофия печени представляет собой неалкогольный стеатогепатит. Согласно одному из вариантов реализации способ включает введение фармацевтической композиции, описанной в данном документе, субъекту один раз в сутки, два раза в сутки, три раза в сутки или более трех раз в сутки.
В тексте настоящего документа термин «лечение» заболевания, нарушения или состояния включает по меньшей мере частично: (1) профилактику заболевания, нарушения или состояния, т.е. недопущение развития клинических симптомов заболевания, нарушения или состояния у млекопитающего, которое подвержено или предрасположено к заболеванию, нарушению или состоянию, но которое еще не испытывает симптомов данного заболевания, нарушения или состояния, или они не проявились; (2) подавление заболевания, нарушения или состояния, т.е. остановка или уменьшение развития заболевания, нарушения или состояния или их клинических симптомов; или (3) облегчение заболевания, нарушения или состояния, т.е. вызывание ремиссии заболевания, нарушения или состояния или их клинических симптомов. Термин «профилактика» по отношению к данному заболеванию или нарушению означает: предупреждение начала развития заболевания, в случае если оно не произошло, предупреждение возникновения заболевания или нарушения у пациента, который может быть предрасположен к указанному нарушению или заболеванию, но у которого еще не было диагностировано указанное нарушение или заболевание, и/или предупреждение дальнейшего развития заболевания/нарушения, если оно уже возникло.
Термин «эффективное количество» в тексте данного документа относится к количеству активной композиции, которое требуется для оказания терапевтического воздействия на пациента. Термин «терапевтически эффективное количество» в тексте данного документа относится к достаточному количеству вводимого агента или соединения, которое облегчит в некоторой степени один или более симптомов заболевания, нарушения или состояния, которое лечат. Согласно некоторым вариантам реализации результат представляет собой ослабление и/или смягчение признаков, симптомов или причин заболевания или другое желаемое изменение биологической системы. Например, согласно некоторым вариантам реализации «эффективное количество» для применения в терапии составляет количество композиции, содержащей соединение, описанное в данном документе, требуемое для обеспечения клинически значимого ослабления симптомов заболевания без излишних нежелательных побочных эффектов. Согласно некоторым вариантам реализации подходящее «эффективное количество» в каждом отдельном случае определяют с помощью методов, таких как исследование с увеличением дозы. Термин «терапевтически эффективное количество» включает, например, эффективное с точки зрения профилактики количество. Согласно другим вариантам реализации «эффективное количество» соединения, описанного в данном документе, такого как соединение по формуле (А) или формуле (I), представляет собой количество, достаточно эффективное для достижения желаемого фармакологического эффекта или терапевтического улучшения без излишних нежелательных побочных эффектов. Согласно другим вариантам реализации подразумевается, что «эффективное количество» или «терапевтически эффективное количество» варьирует от пациента к пациенту вследствие различий в метаболизме, возрасте, массе тела, общем состоянии здоровья пациента, состоянии, от которого он получает лечение, тяжести состояния, от которого он получает лечение и мнения врача, назначившего лечение. Термин «фармацевтически приемлемый» в тексте данного документа означает, что указанное вещество не вызывает неприемлемой токсичности у пациента и не взаимодействует с другими компонентами композиции.
Не вдаваясь в дальнейшие подробности, авторы полагают, что специалист в данной области техники может, используя данное выше описание и нижеследующие иллюстративные примеры, получить и применить агенты согласно настоящему изобретению и применить на практике способы согласно настоящему изобретению. Следующие демонстрационные примеры даны для облегчения применения на практике настоящего изобретения, и их не следует интерпретировать как ограничивающие тем или иным образом остальной объем настоящего изобретения.
ПРИМЕРЫ
Цель данного исследования состояла в том, чтобы изучить эффект 15-ОН ЭПК и ЭПК в модели STAM неалкогольного стеатогепатита.
Протокол
Беспатогенных мышей линии C57BL/6 с 15-дневной беременностью получали от компании Charles River Laboratories in Japan Inc. (Канагава, Япония). У родившихся самцов мышей, которые неограниченно получали пищу с высоким содержанием жиров (компании HFD; CLEA) Япония, Япония), в возрасте 4 недель (28 день ±2) вызывали НАСГ с помощью однократной подкожной инъекции стрептозотоцина (СТ3) (компания Sigma, США). Мышей рандомизировали в 5 групп по 8 мышей в возрасте 5 недель (35 день ±2) накануне начала лечения.
В течение периода лечения ежедневно измеряли массу тела каждого животного, а также оценивали клинические признаки поведения и выживаемости.
Группы:
Группа 1 (плацебо): восемь мышей с НАСГ получали перорально носитель [оливковое масло] в объеме 10 мл/кг один раз в сутки с 5 по 9 неделю.
Группа 2 (15-ОН ЭПК 50 мг/кг): восемь мышей с НАСГ получали перорально носитель, в который была добавлена 15-ОН ЭПК, в дозе 50 мг/кг один раз в сутки с 5 по 9 неделю.
Группа 3 (15-ОН ЭПК 500 мг/кг): восемь мышей с НАСГ получали перорально носитель, в который была добавлена 15-ОН ЭПК, в дозе 500 мг/кг один раз в сутки с 5 по 9 неделю.
Группа 4 (ЭПК 500 мг/кг): восемь мышей с НАСГ получали перорально носитель, в который была добавлена ЭПК, в дозе 500 мг/кг один раз в сутки с 5 по 9 неделю.
Группа 5 (положительный контроль): восемь мышей с НАСГ получали перорально чистую воду, в которую был добавлен телмисартан, в дозе 10 мг/кг один раз в сутки с 5 по 9 неделю.
В возрасте 9 недель всех мышей умерщвляли и фиксировали следующие данные:
- Масса тела каждого животного
- Отношение массы печени к массе тела.
Гистопатологический анализ срезов печени проводили с методом гематоксилин-эозиновой окраски (для оценки балла активности для НАЖБП). Для ГЭ-окраски делали срезы с парафиновых блоков с тканью печени, зафиксированной с помощью раствора Боуина, и окрашивали гематоксилином Майера, модификация Лили (компания Muto Pure Chemicals, Япония) и раствором эозина (компания Wako Pure Chemical Industries). Балл активности для НАЖБП (БАН) рассчитывали в соответствии с критериями Клейнера (Kleiner DE. et al., Hepatology, 2005; 41:1313).
Статистические тесты проводили, применяя критерий множественных сравнений Бонферрони. Р-значения <0,05 считали статистически значимыми.
Результаты
На Фиг. 1.1 показано, что значимого изменения массы тела ни в одной из экспериментальных групп не наблюдалось.
На Фиг. 1.2 показано, что лишь в группе лечения 15-ОН ЭПК (500 мг/кг) и положительного контроля (телмисартан) наблюдалось значимое уменьшение массы печени в сравнении с носителем, используемым в качестве контроля.
На Фиг. 2.1 и 2.2 показано, что значимое облегчение симптомов НАС наступало лишь в группах 15-ОН ЭПК (500 мг/кг) и положительного контроля (телмисартан) в сравнении с носителем, используемым в качестве контроля.

Изобретение относится к медицине и предназначено для лечения жировой дистрофии печени. Используется 15-гидрокси-эйкозопентаеновая кислота в форме свободной кислоты, 15-гидрокси-эйкоза-5,8,11,13,17-пентаеновой кислоты и/или фармацевтически приемлемого эфира, конъюгата или соли или их смесей. Изобретение позволяет расширить арсенал терапевтических средств. 10 з.п. ф-лы, 4 ил., 1 пр.
1. Применение 15-гидрокси-эйкозапентаеновой кислоты (15-ОН ЭПК) для лечения жировой дистрофии печени, где 15-ОН ЭПК представлена в форме свободной кислоты, 15-гидрокси-эйкоза-5,8,11,13,17-пентаеновой кислоты и/или фармацевтически приемлемого эфира, конъюгата или соли, или их смесей.
2. Применение по п. 1, отличающееся тем, что жировая дистрофия печени выбрана из неалкогольной жировой болезни печени и неалкогольного стеатогепатита.
3. Применение по п. 1 или 2, отличающееся тем, что указанная 15-ОН ЭПК представлена в форме C1 - C5 алкилового эфира.
4. Применение по п. 1, отличающееся тем, что указанная 15-ОНЭПК находится в форме фармацевтической композиции.
5. Применение по п. 4, отличающееся тем, что указанная фармацевтическая композиция дополнительно содержит фармацевтически приемлемое вспомогательное вещество.
6. Применение по п. 4 или п.5, отличающеея тем, что указанная фармацевтическая композиция представляет собой пероральную фармацевтическую композицию.
7. Применение по п. 4, отличающееся тем, что указанная фармацевтическая композиция дополнительно содержит другие омега-3 жирные кислоты.
8. Применение по п. 7, отличающееся тем, что указанная 15-ОН ЭПК составляет по меньшей мере примерно 90% по массе от всех присутствующих жирных кислот.
9. Применение по п. 7, в которой отсутствуют какие-либо другие омега-3 жирные кислоты в значимых количествах.
10. Применение по п. 4, не содержащее каких-либо других омега-3 жирных кислот.
11. Применение по п. 4, отличающееся тем, что указанная 15-ОН ЭПК присутствует в количестве от примерно 50 мг до примерно 3000 мг.
| US2011105510 A1, 05.05.2011 | |||
| MASTERTON GS et al., Review article: omega-3 fatty acids - a promising novel therapy for non-alcoholic fatty liver disease | |||
| Aliment Pharmacol Ther | |||
| Приспособление для суммирования отрезков прямых линий | 1923 |
|
SU2010A1 |
| Мост | 1912 |
|
SU679A1 |
| PARKER HM et al., Omega-3 supplementation and non-alcoholic fatty liver disease: a systematic review and meta-analysis | |||
| J Hepatol | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Реактивная катушка | 1924 |
|
SU944A1 |
| KAJIKAWA S et al., Eicosapentaenoic acid attenuates progression of hepatic fibrosis with inhibition of reactive oxygen species production in rats fed methionine- and choline-deficient diet | |||
| Dig Dis Sci | |||
| Способ приготовления лака | 1924 |
|
SU2011A1 |
Авторы
Даты
2018-10-30—Публикация
2014-01-24—Подача