Область техники
[1] Настоящее изобретение относится к терапевтическому средству для лечения заболеваний печени, включающему в качестве активного ингредиента соединение на основе пиразола или его фармацевтически приемлемую соль.
Уровень техники
[2] Известно, что неалкогольные жировые болезни печени (НАЖБП), которые являются наиболее распространенными хроническими заболеваниями печени, тесно связаны с диабетом 2 типа, ожирением и метаболическим синдромом [Cohen JC, Horton JD, Hobbs HH. Science 2011;332:1519-23.].
[3] Неалкогольные жировые болезни печени относятся к жировым болезням печени, при которых избыток нейтрального жира откладывается в печени, и в широком смысле включают простой стеатоз, неалкогольный стеатогепатит (НАСГ) и цирроз печени [Cohen JC, Horton JD, Hobbs HH. Science 2011;332:1519-23.].
[4] Помимо ожирения, диабета и дислипидемии, неалкогольные жировые болезни печени считаются важными факторами метаболического синдрома и большинство пациентов с метаболическим синдромом страдают неалкогольными жировыми заболеваниями печени [Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, Hobbs HH, Dobbins RL. Am J Physiol Endocrinol Metab 2005; 288: E462-8.]. В общем, неалкогольные жировые заболевания печени возникают, когда синтез нейтрального жира превышает усвоение нейтрального жира в печени, например, когда увеличивается абсорбция свободной жирной кислоты в печени или повышается биосинтез нейтрального жира за счет углеводного обмена [Birkenfeld AL, Shulman GI. Hepatology 2014;59:713-23.]. Свободная жирная кислота, которая является ингредиентом для синтеза нейтрального жира, происходящего в печени, инкорпорируется в печень путем биосинтеза с пищей или in vivo и высвобождается из жировой ткани [Musso G, Gambino R, Cassader M. Prog Lipid Res 2009;48:1-26.].
[5] Хроническое воспаление в адипоцитах, возникающее вследствие длительного избыточного питания, может вызывать облегченный липолиз, увеличение содержания жирных кислот и нейтрального жира в крови и инфильтрацию макрофагов в адипоцитах, что приводит к секреции TNF-α, который является типичным воспалительным цитокином. Это приводит к увеличению включения жирных кислот в скелетные мышцы, что приводит к увеличению количества жира, накопленного в скелетных мышцах, и резистентности к инсулину в мышцах [Guilherme A, Virbasius JV, Puri V, Czech MP. Nat Rev Mol Cell Biol 2008;9:367-77.].
[6] В общем, причины неалкогольных жировых болезней печени были объяснены на основе двух популярных гипотез.
[7] Первый вариант представляет собой отложение нейтральных жиров в печени вследствие резистентности к инсулину и увеличения количества свободных жирных кислот. Второй вариант заключается в том, что окислительный стресс вызывает перекисное окисление жира и, следовательно, изменения в некротическом воспалении, которое, как установлено, вызывает гистологические изменения, известные как "неалкогольный стеатогепатит" [Day CP, James OF. Gastroenterology 1998;114:842-5.].
[8] Типичные механизмы, при которых липидные метаболиты показывают повреждение гепатоцитов и токсичность, включают стресс эндоплазматического ретикулума и окислительный стресс. Когда в эндоплазматическом ретикулуме накапливаются белки, которые не могут соответствующим образом изменить свою структуру (несвернутые белки), индуцируется отклик несвернутого белка (UPR), активируя IRE1, ATF6 и PERK. Было показано, что эти реакции активируют NF-κB, c-Jun N-терминальную киназу и пути окислительного стресса, которые способствуют переходу от простого стеатоза к стеатогепатиту [Birkenfeld AL, Shulman GI. Hepatology 2014;59:713-23.].
[9] Между тем, нет исследований, раскрывающих, что соединение на основе пиразола настоящего изобретения обладает эффектами профилактики и лечения жировых заболеваний печени.
[10] [Предшествующий уровень техники]
[11] [Патентный документ]
[12] (Патентный документ 1) патент Кореи No. 10-1280160
[13] (Патентный документ 2) патент Кореи No. 10-1633957
[14] [Непатентный документ]
[15] (Непатентный документ 1) Cohen JC, Horton JD, Hobbs HH. Science 2011;332:1519-23.
[16] (Непатентный документ 2) Szczepaniak LS, Nurenberg P, Leonard D, Browning JD, Reingold JS, Grundy S, Hobbs HH, Dobbins RL. Am J Physiol Endocrinol Metab 2005; 288: E462-8.
[17] (Непатентный документ 3) Birkenfeld AL, Shulman GI. Hepatology 2014;59:713-23.
[18] (Непатентный документ 4) Musso G, Gambino R, Cassader M. Prog Lipid Res 2009;48:1-26.
[19] (Непатентный документ 5) Guilherme A, Virbasius JV, Puri V, Czech MP. Nat Rev Mol Cell Biol 2008;9:367-77.
[20] (Непатентный документ 6) Day CP, James OF. Gastroenterology 1998;114:842-5.
[21] Раскрытие сущности изобретения
Техническая задача
[22] Принимая во внимание вышеизложенные проблемы, авторы настоящего изобретения завершили настоящее изобретение на основании того факта, что на различных животных моделях с жировой болезнью печени, ожирение печени, воспаление печени и фиброз печени, которые являются основными патологиями жировых болезней печени, могут быть эффективно излечены путем лечения соединением на основе пиразола настоящего изобретения.
[23] В ходе непрерывных исследований эффективных терапевтических средств для лечения заболеваний печени авторы настоящего изобретения обнаружили, что соединение, имеющее сердцевинную структуру 3-фенил-4-алкил-1-(пиридин-2-ил)-1Н-пиразол-5-ола ингибирует воспалительный цитокин, полученный из жирной печени, и тем самым оказывает эффект ингибирования воспаления печени и фиброза печени. Настоящее изобретение было выполнено на основании этих результатов.
[24] Следовательно, целью настоящего изобретения является создание фармацевтической композиции для предупреждения, облегчения или лечения заболеваний печени, включающей в качестве активного ингредиента соединение на основе пиразола, имеющее сердцевинную структуру 3-фенил-4-алкил-1-(пиридин-2-ил)-1Н-пиразол-5-ола или его фармацевтически приемлемую соль.
Решение задачи
[25] В соответствии с настоящим изобретением вышеуказанные и другие цели могут быть достигнуты путем предоставления фармацевтической композиции для предупреждения, облегчения или лечения заболеваний печени, включающей в качестве активного ингредиента, по меньшей мере, одно соединение, выбранное из соединения на основе пиразола, представленного следующей формулой 1, и его фармацевтически приемлемой соли:
[26] [Формула 1]
[27]

[28] где R представляет собой С1-С10 линейную или разветвленную алкильную группу.
[29] В соответствии с другим аспектом настоящего изобретения предложен способ предупреждения, облегчения или лечения заболевания печени у пациента с заболеванием печени, включающий введение эффективного количества по меньшей мере одного соединения, выбранного из соединения на основе пиразола, представленного формулой 1, и его фармацевтически приемлемой соли нуждающемуся в этом субъекту.
[30] В соответствии с другим аспектом настоящего изобретения, предложено по меньшей мере одно соединение, выбранное из соединения на основе пиразола, представленного формулой 1, и его фармацевтически приемлемой соли для профилактики, облегчения или лечения заболевания печени у пациента с заболеванием печени.
[31] В соответствии с другим аспектом настоящего изобретения предложено применение по меньшей мере одного соединения, выбранного из соединения на основе пиразола, представленного формулой 1, и его фармацевтически приемлемой соли для получения средства для предупреждения, облегчения или лечения заболевания печени у пациента с заболеванием печени.
Полезные эффекты изобретения
[32] Соединение на основе пиразола или его фармацевтически приемлемая соль по настоящему изобретению способно эффективно ингибировать ожирение печени, воспаление печени и фиброз печени и является полезным для профилактики или лечения НАЖБП, в частности, НАСГ.
[33] Термин «жировая болезнь печени», используемый в настоящем описании, в широком смысле относится к заболеваниям, при которых жир накапливается в клетках печени, вызывая гепатопатию, и включает алкогольную гепатопатию и неалкогольную жировую болезнь печени (НАЖБП или НАСГ).
Краткое описание фигур
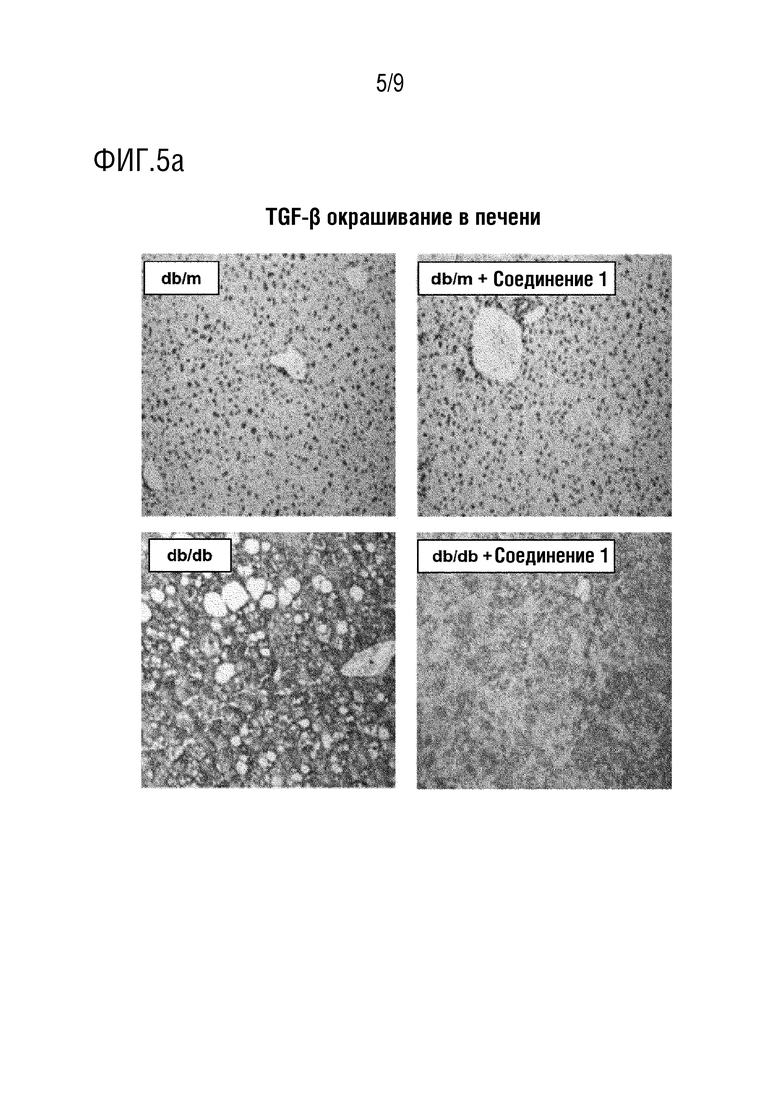
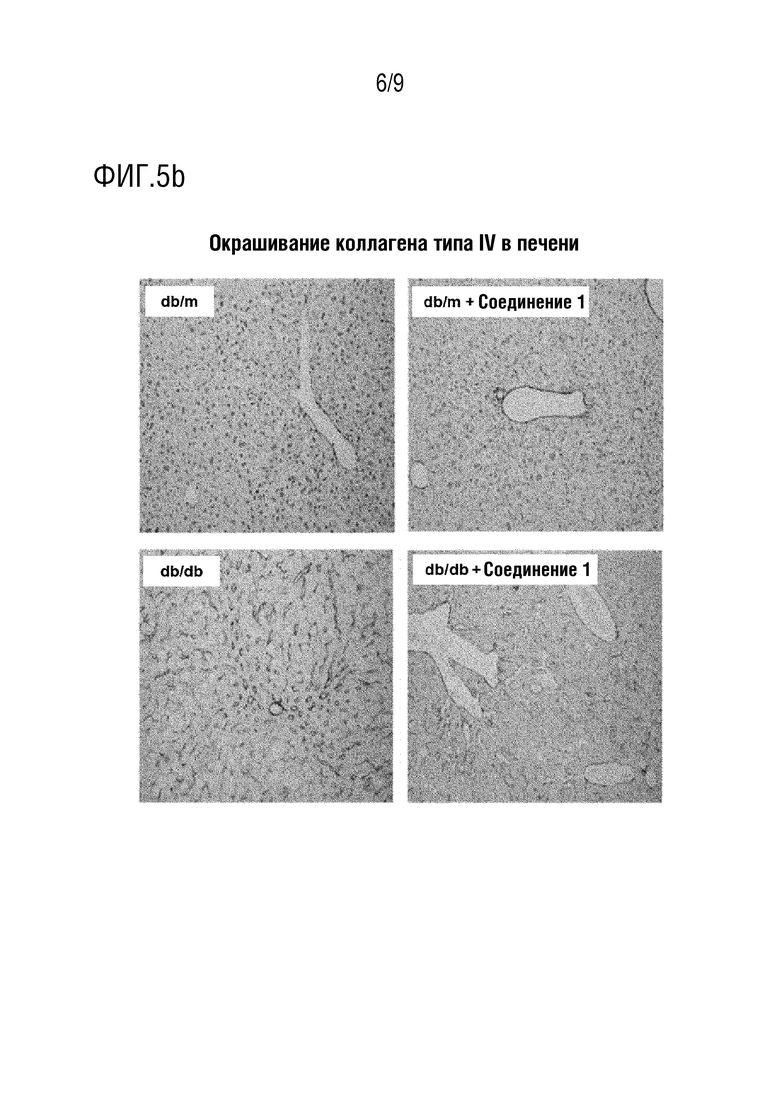
[34] Вышеуказанные и другие цели, признаки и другие преимущества настоящего изобретения будут более понятны из последующего подробного описания, взятого вместе с прилагаемыми чертежами, на которых:
[35] Фиг. 1 представляет собой график, показывающий уменьшение ALT в крови в тесте с использованием животной модели с жировым гепатозом, индуцированным диетой MCD (дефицит метионина/холина);
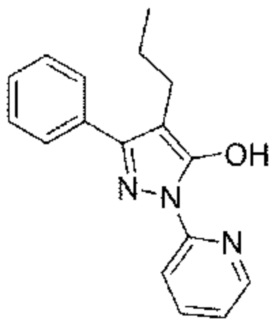
[36] Фиг. 2 представляет собой изображение, демонстрирующее эффект ингибирования воспаления в тканях печени в тесте с использованием животной модели с жировым гепатозом, индуцированным диетой MCD (дефицит метионина/холина);
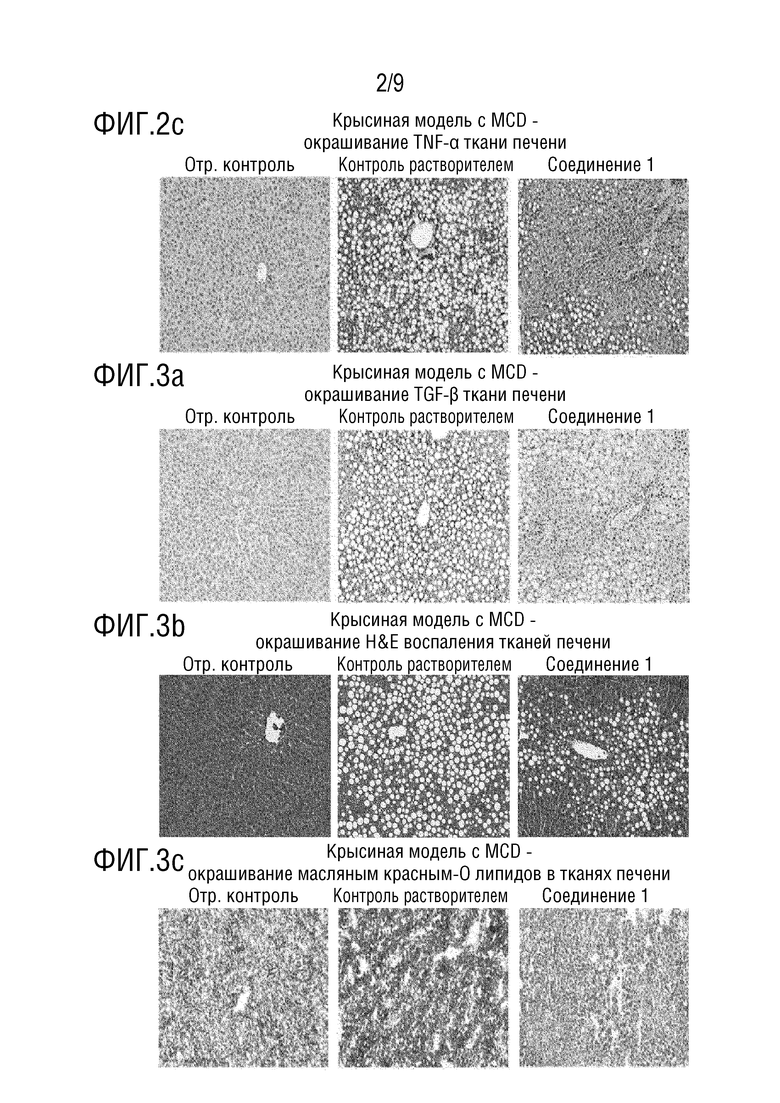
[37] Фиг. 3 представляет собой изображение, демонстрирующее эффект ингибирования фиброза в тканях печени в тесте с использованием животной модели с жировым гепатозом, индуцированным диетой MCD (дефицит метионина/холина);
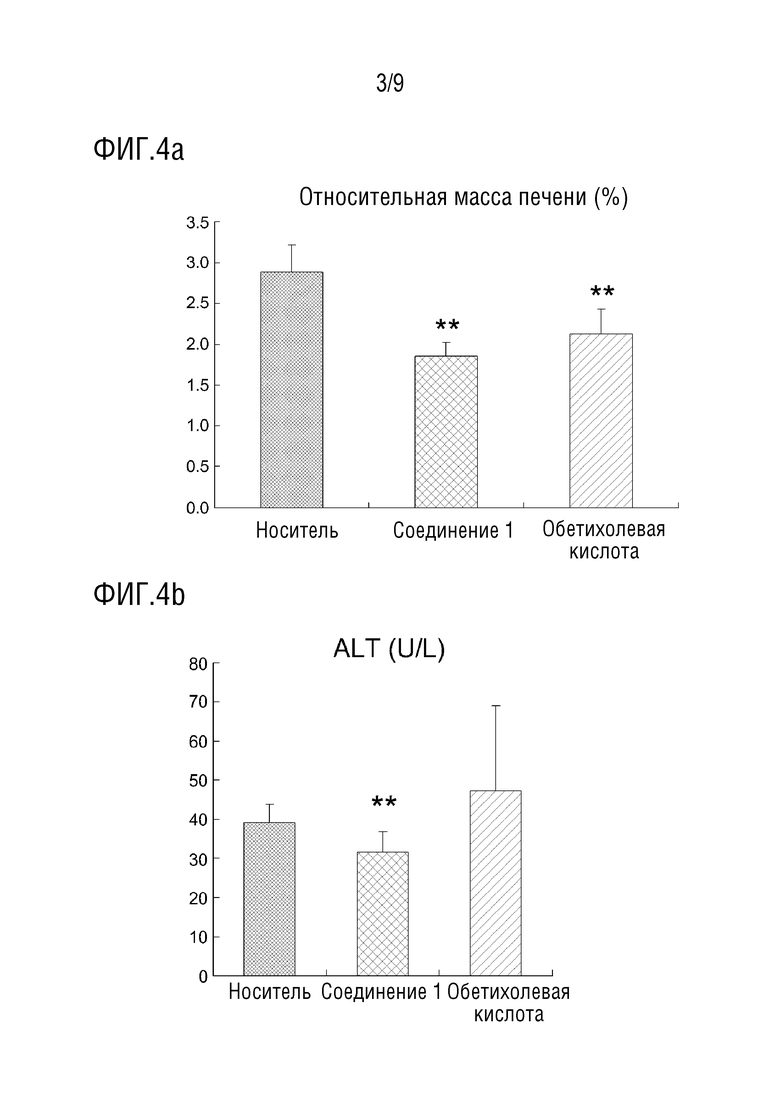
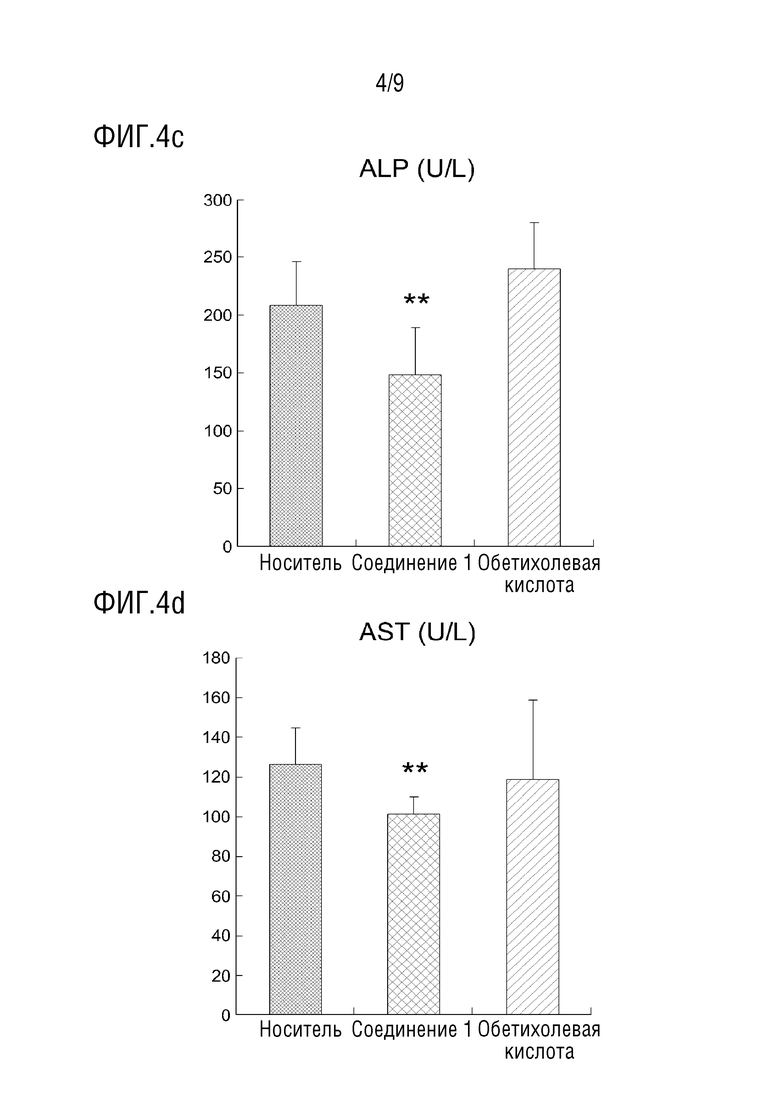
[38] На фиг.4 показаны эффекты снижения относительной массы печени и уровней ALT, ALP и AST в крови в тесте с использованием животной модели с жировым гепатозом, вызванным пищей с высоким содержанием жира;
[39] Фиг. 5 представляет собой изображение, демонстрирующее эффект ингибирования фиброза печени в тканях печени в тесте с использованием животной модели с жировым гепатозом, индуцированным у диабетических мышей db/db; и
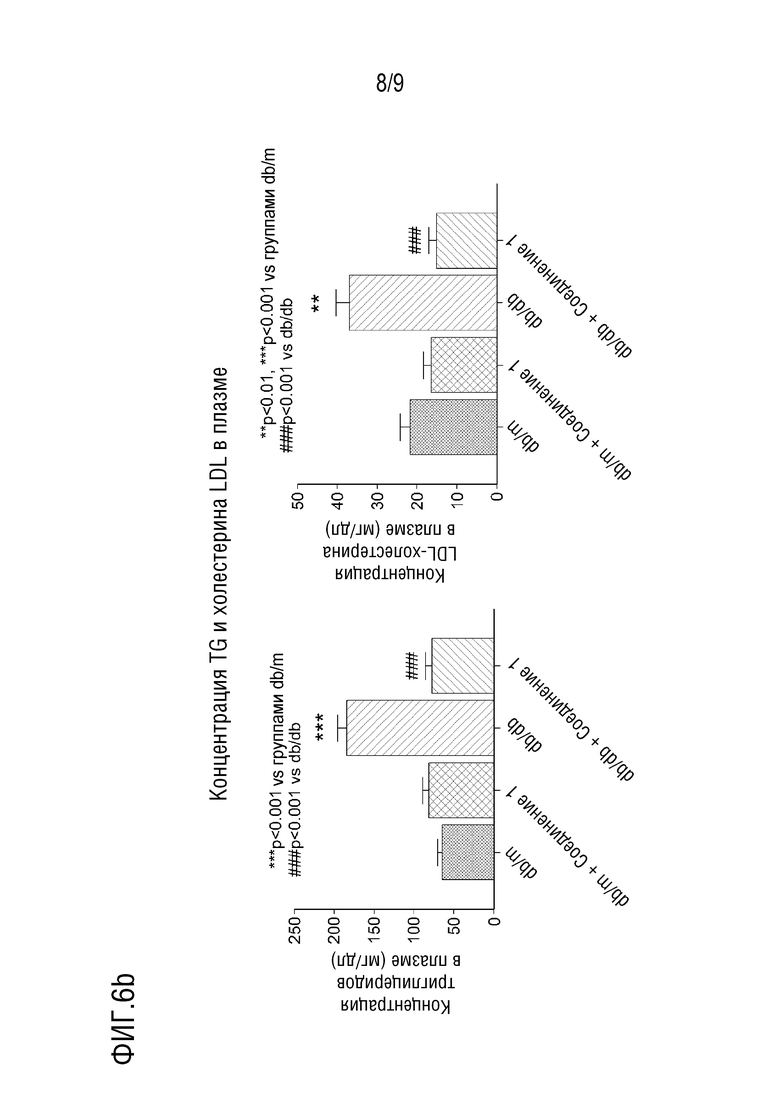
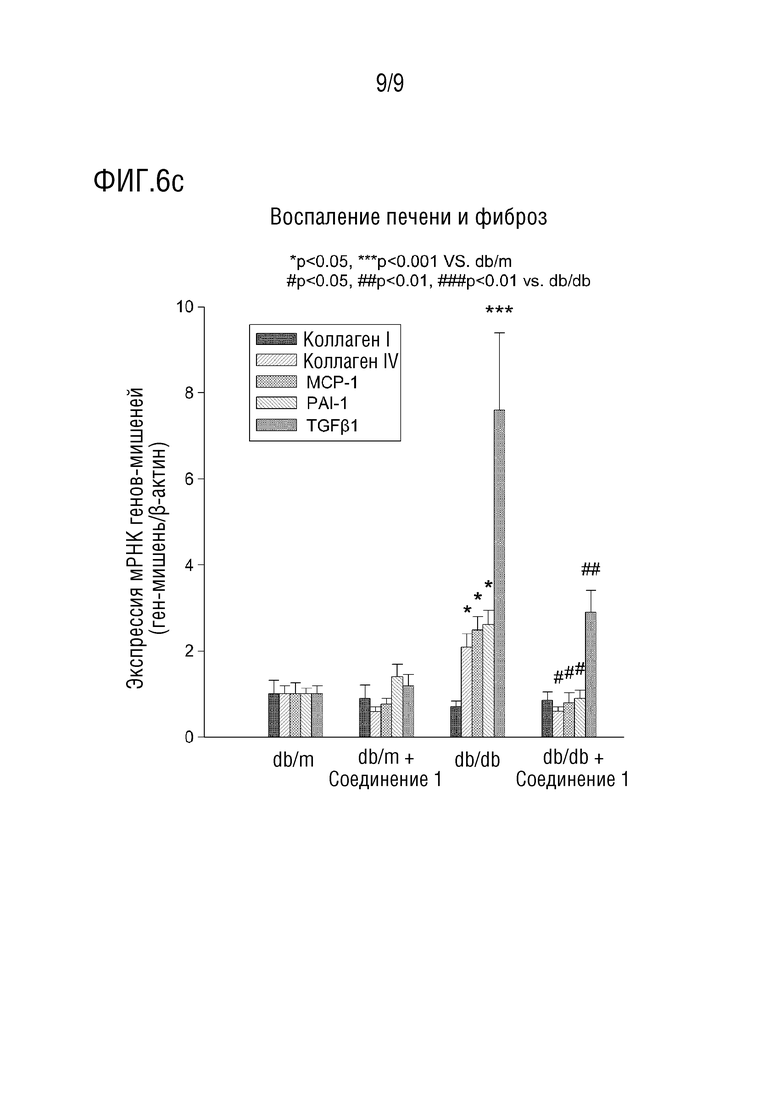
[40] На фиг.6 показаны эффекты снижения уровней TG и LDL в тканях печени, ингибирования воспаления печени и фиброза печени и снижения уровней TG и LDL в крови в тесте с использованием животной модели с жировым гепатозом, индуцированным у диабетических мышей db/db.
[41] Лучший вариант осуществления изобретения
[42] Теперь будет сделана подробная ссылка на предпочтительные варианты осуществления настоящего изобретения, примеры которых проиллюстрированы на прилагаемых чертежах. Везде, где возможно, одни и те же ссылочные позиции будут использоваться на всех чертежах для обозначения одинаковых или похожих частей.
[43] В одном варианте осуществления настоящего изобретения болезнь печени может представлять собой жировую болезнь печени, жировая болезнь печени может представлять собой неалкогольную жировую болезнь печени или простой стеатоз, и композиция в соответствии с одним вариантом осуществления настоящего изобретения обладает эффектами ингибирования накопления жира в печени, подавляя воспалительные цитокины, происходящие из жирной печени и тем самым подавляя воспаление печени и фиброз печени.
[44] Следует понимать, что в описании, когда диапазон относится к параметру, параметр охватывает все цифры, включая конечные точки, раскрытые в пределах диапазона. Например, диапазон ''5-10'' включает цифры 5, 6, 7, 8, 9 и 10, а также произвольные поддиапазоны, такие как диапазоны от 6 до 10, от 7 до 10, от 6 до 9, и от 7 до 9 и любые цифры, такие как 5,5, 6,5, 7,5, 5,5-8,5 и 6,5-9, между соответствующими целыми числами, попадающими в диапазон. Кроме того, например, диапазон «10%-30%» охватывает все целые числа, которые включают значения, такие как 10%, 11%, 12% и 13%, а также 30%, и любые поддиапазоны 10%-15%, 12%-18% или 20%-30%, а также любые цифры, такие как 10,5%, 15,5% и 25,5%, между соответствующими целыми числами, попадающими в диапазон.
[45] Далее настоящее изобретение будет описано подробно.
[46] Настоящее изобретение относится к фармацевтической композиции для предупреждения, облегчения или лечения заболеваний печени, включающей в качестве активного ингредиента, по меньшей мере, одно соединение, выбранное из соединения на основе пиразола, представленного следующей формулой 1, и его фармацевтически приемлемой соли:
[47] [Формула 1]
[48]

[49] где R представляет собой С1-С10 линейную или разветвленную алкильную группу.
[50] Термин «жировая болезнь печени», как используется в настоящем описании, в широком смысле относится к заболеванию, при котором жир накапливается в клетках печени, вызывая гепатопатию, и включает алкогольную гепатопатию и неалкогольную жировую болезнь печени (НАЖБП или НАСГ). Неалкогольный стеатогепатит (НАЖБП или НАСГ) классифицируется на четыре типа в зависимости от степени прогрессирования. Тип 1 представляет собой простой стеатоз, тип 2 представляет собой жировой гепатит, тип 3 представляет собой стеатонекроз, и тип 4 включает некроз печени, включающий фиброз. Основываясь на долгосрочном прогностическом обзоре, типы 3 и 4, которые имеют значительно более высокую прогрессию до цирроза или смертности, связанной с печенью, определяются как стадии НАСГ. [Matteoni, C.A., et al 1999, Gastroenterology, 116: 1413-1419]. На конференции Single Topic Conference 2002 of the American Association for the Study of Liver Diseases, стадии 3 и 4 НАЖБП рассматриваются как НАСГ в виду стеатоза, лобулярного воспаления и гепатоцеллюлярного баллонирования в виде состояний НАСГ [Single Topic Conference 2002, Neuschwander-Tetri, B.A., et al, 2003, Hepatology, 37: 1202-1219].
[51] Жировая болезнь печени для лечения которой применяется профилактическое или терапевтическое средство по настоящему изобретению, предпочтительно представляет собой неалкогольную жировую болезнь печени (НАЖБП), особенно предпочтительно простой стеатоз или неалкогольный стеатогепатит (НАСГ).
[52] Фармацевтически приемлемая соль соединения на основе пиразола, содержащегося в фармацевтической композиции по настоящему изобретению, означает соль, обычно используемую в фармацевтической отрасли, и ее примеры включают: соли неорганической кислоты, полученные с хлористоводородной кислотой, азотной кислотой, фосфорной кислотой, бромноватой кислотой, йодноватой кислотой, перхлорной кислотой, серной кислотой и тому подобное; соли органических кислот, полученные с уксусной кислотой, трифторуксусной кислотой, малеиновой кислотой, янтарной кислотой, щавелевой кислотой, бензойной кислотой, винной кислотой, фумаровой кислотой, миндальной кислотой, пропионовой кислотой, лимонной кислотой, молочной кислотой, гликолевой кислотой, глюконовой кислотой, галактуроновой кислотой, глутаминовой кислотой, глутаровой кислотой, глюкуроновой кислотой, аспарагиновой кислотой, аскорбиновой кислотой, угольной кислотой, ванилиновой кислотой, йодистоводородной кислотой и тому подобное; соли сульфоновой кислоты, полученные с метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, п-толуолсульфоновой кислотой, нафталинсульфоновой кислотой и тому подобное; и тому подобное, и тип соли в соответствии с настоящим изобретением не ограничивается этим. Предпочтительно, фармацевтически приемлемая соль представляет собой гидрохлорид.
[53] Конкретно, примеры соединения на основе пиразола, представленного формулой 1, содержащегося в фармацевтической композиции по настоящему изобретению, приведены ниже:
[54] 3-фенил-4-метил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[55] 3-фенил-4-этил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[56] 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[57] 3-фенил-4-изопропил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[58] 3-фенил-4-н-бутил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[59] 3-фенил-4-трет-бутил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид;
[60] 3-фенил-4-н-пентил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид; и
[61] 3-фенил-4-н-гексил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид.
[62] Более конкретно, соединение на основе пиразола, представленное формулой 1, содержащееся в фармацевтической композиции по настоящему изобретению, может представлять собой 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ол или его гидрохлорид.
[63] Композиция по настоящему изобретению может дополнительно включать фармацевтически приемлемую добавку, такую как разбавитель, связующее, разрыхлитель, смазывающее вещество, регулятор рН, антиоксидант или солюбилизирующее средство, при условии, что это не ослабляет эффекты настоящего изобретения.
[64] Разбавителем может быть сахар, крахмал, микрокристаллическая целлюлоза, лактоза (гидрат лактозы), глюкоза, ди-маннит, альгинат, соли щелочноземельных металлов, глина, полиэтиленгликоль, безводный гидрофосфат кальция, их смесь или тому подобное, и связующее вещество может быть крахмалом, микрокристаллической целлюлозой, высокодиспергируемым кремнеземом, маннитом, ди-маннитом, сахарозой, гидратом лактозы, полиэтиленгликолем, поливинилпирролидоном (повидоном), поливинилпирролидоновыми сополимерами (коповидоном), гипромеллозой, гидроксипропилцеллюлозой, природной камедью, синтетической камедью, желатином, их смесью или тому подобное.
[65] Разрыхлитель может представлять собой: крахмал или модифицированный крахмал, такой как натрий крахмал гликолят, кукурузный крахмал, картофельный крахмал или предварительно желатинизированный крахмал; глину, такую как бентонит, монтмориллонит или вигум; целлюлозу, такую как микрокристаллическая целлюлоза, гидроксипропилцеллюлоза или карбоксиметилцеллюлоза; альгинат, такой как альгинат натрия или альгиновая кислота; сшитая целлюлоза, такая как кроскармеллоза натрия; камедь, такая как гуаровая камедь или ксантановая камедь; сшитый полимер, такой как сшитый поливинилпирролидон (кросповидон); шипучий агент, такой как бикарбонат натрия или лимонная кислота; или их смесь.
[66] Смазывающим веществом может быть тальк, стеариновая кислота, стеарат магния, стеарат кальция, лаурилсульфат натрия, гидрогенизированное растительное масло, бензоат натрия, стеарилфумарат натрия, глицерилбегенат, глицерилмоноолеат, глицерилмоностеарат, глицерилпальмитостеарат, коллоидный диоксид кремния, их смесь или тому подобное.
[67] Регулятор рН может быть кислотным регулятором рН, таким как уксусная кислота, адипиновая кислота, аскорбиновая кислота, аскорбат натрия, эфират натрия, яблочная кислота, янтарная кислота, винная кислота, фумаровая кислота или лимонная кислота, или основной регулятор рН, такой как осажденный карбонат кальция, аммиачная вода, меглюмин, карбонат натрия, оксид магния, карбонат магния, цитрат натрия, трехосновный фосфат кальция или тому подобное.
[68] Антиоксидант может представлять собой дибутилгидрокситолуол, бутилированный гидроксианизол, токоферилацетат, токоферол, пропилгаллат, гидросульфит натрия, пиросульфит натрия или тому подобное. В компартементе раннего высвобождения по настоящему изобретению солюбилизирующее средство может представлять собой полиоксиэтиленовый эфир сорбита и жирной кислоты, такой как лаурилсульфат натрия или полисорбат, докузат натрия, полоксамер или тому подобное.
[69] Кроме того, для получения композиции с замедленным высвобождением могут быть включены энтеросолюбильный полимер, нерастворимый в воде полимер, гидрофобное соединение и гидрофильный полимер.
[70] Энтеросолюбильный полимер относится к полимеру, который является нерастворимым или стабильным в кислых условиях ниже pH 5, то есть полимер, который растворяется или разлагается при определенном pH 5 или более, и его примеры включают: производные энтеросолюбильной целлюлозы, такие как гипромеллоза ацетат сукцинат, гипромеллоза фталат (гидроксипропилметилцеллюлоза фталат), гидроксиметилэтилцеллюлоза фталат, целлюлозы ацетатфталат, целлюлозы ацетат сукцинат, малеат ацетата целлюлозы, целлюлозы бензоатфталат, целлюлозы пропионат фталат, метилцеллюлозы фталат, карбоксиметилэтилцеллюлозу, фталат этилгидроксиэтилцеллюлозы и метилгидроксиэтилцеллюлозу; энтеросолюбильные сополимеры на основе акриловой кислоты, такие как сополимеры стирола и акриловой кислоты, сополимеры метилакрилата и акриловой кислоты, сополимеры метилакрилата и метакриловой кислоты (например, акрил-EZE®), сополимеры бутилакрилата, стирола и акриловой кислоты и сополимеры метилакрилата, метакриловой кислоты и октилакрилата; энтеросолюбильные полиметакрилатные сополимеры, такие как сополимеры поли(метакриловой кислоты, метилметакрилата) (например, Eudragit L, Eudragit S, Evonik Industries AG, Germany), и сополимеры поли(метакриловой кислоты и этилакрилата) (например, Eudragit L100-55); энтеросолюбильные сополимеры на основе малеиновой кислоты, такие как сополимеры винилацетата и малеинового ангидрида, сополимеры стирола и малеинового ангидрида, сополимеры стирола и малеиновой кислоты, сополимеры винилметилового эфира и малеинового ангидрида, сополимеры этилена и малеинового ангидрида, сополимеры винилбутилового эфира и малеинового ангидрида, сополимеры акрилонитрила и метилакрилат малеинового ангидрида и сополимеры бутилакрилата и стирола с малеиновым ангидридом; энтеросолюбильные производные поливинила, такие как фталат поливинилового спирта, фталат поливинилацеталя, фталат поливинилбутирата и фталат поливинилацетоацеталя.
[71] Нерастворимый в воде полимер относится к фармацевтически приемлемому полимеру для контроля высвобождения лекарственных средств, который не растворяется в воде. Примеры нерастворимого в воде полимера включают поливинилацетат (например, Kollicoat SR30D), нерастворимые в воде полиметакрилатные сополимеры [например, сополимеры поли(этилакрилат-метилметакрилат) (например, Eudragit NE30D, сополимеры поли(этилакрилат-метилметакрилат-триметиламиноэтилметакрилат) (например, Eudragit RSPO) или тому подобное], этилцеллюлозу, сложный эфир целлюлозы, эфир целлюлозы, ацилат целлюлозы, диацилат целлюлозы, триацилат целлюлозы, ацетат целлюлозы, диацетат целлюлозы, триацетат целлюлозы и тому подобное.
[72] Гидрофобное соединение относится к фармацевтически приемлемому нерастворимому в воде веществу для контроля высвобождения лекарственных средств. Примеры гидрофобного соединения включают: жирные кислоты и сложные эфиры жирных кислот, такие как глицерилпальмитостеарат, глицерилстеарат, глицерилбегенат, цетилпальмитат, глицерилмоноолеат и стеариновая кислота; спирты жирных кислот, такие как цетостеариловый спирт, цетиловый спирт и стеариловый спирт; воски, такие как карнаубский воск, пчелиный воск и микрокристаллический воск; и неорганические вещества, такие как тальк, осажденный карбонат кальция, моногидрофосфат кальция, оксид цинка, оксид титана, каолин, бентонит, монтмориллонит и вигум.
[73] Гидрофильный полимер относится к фармацевтически приемлемому водорастворимому полимеру для контроля высвобождения лекарственных средств. Примеры гидрофильного полимера включают: сахара, такие как декстрин, полидекстрин, декстран, пектин и производные пектина, альгинат, полигалактуроновую кислоту, ксилан, арабиноксилан, арабиногалактан, крахмал, гидроксипропилкрахмал, амилоза и амилопектин; производные целлюлозы, такие как гипромеллоза, гидроксипропилцеллюлоза, гидроксиметилцеллюлоза, гидроксиэтилцеллюлоза, метилцеллюлоза и натрий карбоксиметилцеллюлоза; камеди, такие как гуаровая камедь, камедь рожкового дерева, трагакант, каррагинан, камедь акации, гуммиарабик, геллановая камедь и ксантановая камедь; белки, такие как желатин, казеин и зеин; производные поливинила, такие как поливиниловый спирт, поливинилпирролидон и поливинилацетальный диэтиламиноацетат; гидрофильные полиметакрилатные сополимеры, такие как сополимер поли(бутилметакрилат-(2-диметиламиноэтил)метакрилат-метилметакрилат) (например, Eudragit E100, Evonik Industries AG, Germany) и сополимеры поли(этилакрилат-метилметакрилат-триэтиламиноэтил-метакрилатхлорид) (например, Eudragit RL, RS, Evonik Industries AG, Germany); производные полиэтилена, такие как полиэтиленгликоль и полиэтиленоксид; карбомеры и тому подобное.
[74] Кроме того, состав по настоящему изобретению может быть получен с использованием множества фармацевтически приемлемых добавок, выбранных из красителей и ароматизаторов.
[75] Объем добавки не ограничивается вышеупомянутыми добавками, и получение может быть осуществлено при помощи отобранной добавки в обычном диапазоне дозы.
[76] Фармацевтическая композиция по настоящему изобретению может быть получена в форме пероральной лекарственной формы, такой как порошок, гранула, таблетка, пилюля, капсула, суспензия, эмульсия, сироп или аэрозоль или препарата для наружного применения, суппозитория или стерильного раствора для инъекций.
[77] В одном варианте осуществления настоящее изобретение относится к фармацевтической композиции для профилактики, облегчения или лечения заболеваний печени, включающей активный ингредиент в количестве от 0,01 до 90% масс., в расчете на общую массу фармацевтической композиции.
[78] Доза соединения на основе пиразола, представленного формулой 1, или его фармацевтически приемлемой соли в средстве для профилактики или лечения жировых болезней печени по настоящему изобретению может быть соответствующим образом изменена в зависимости от возраста, массы тела и симптомов пациентов, путей введения и тому подобное. Например, дневная доза для взрослых (60 кг) может составлять от около 1 мг до около 1000 мг, предпочтительно от около 10 мг до около 750 мг для перорального введения, и может составлять от около 0,3 мг до около 200 мг для инъекционного введения, и может быть введена только один раз или порционно несколько раз в день.
[79] Другой вариант осуществления настоящего изобретения обеспечивает средство для предупреждения или лечения простого стеатоза, включающее в качестве активного ингредиента, по меньшей мере, один, выбранный из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ола и его фармацевтически приемлемой соли.
[80] Другой вариант осуществления настоящего изобретения обеспечивает терапевтическое или профилактическое средство для лечения неалкогольного стеатогепатита, включающее в качестве активного ингредиента, по меньшей мере, один, выбранный из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ола и его фармацевтически приемлемой соли.
[81] Другой вариант осуществления настоящего изобретения обеспечивает терапевтическое или профилактическое средство для лечения цирроза печени, включающее в качестве активного ингредиента, по меньшей мере, один, выбранный из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола и его фармацевтически приемлемой соли.
[82] Термин «введение», используемый в настоящем описании, означает, что композицию по настоящему изобретению для предупреждения или лечения жировой болезни печени вводят пациенту любым подходящим способом. Способ введения композиции в соответствии с настоящим изобретением для профилактики или лечения жировой болезни печени может представлять собой любой общий путь, позволяющий композиции достичь ткани-мишени. Примеры пути введения включают, но не ограничиваются ими, пероральное, внутрибрюшинное, внутривенное, внутримышечное, подкожное, внутрикожное, интраназальное, внутрилегочное, ректальное, внутриполостное, внутрибрюшинное и интратекальное введения.
[83] Принцип изобретения
[84] Далее будут приведены предпочтительные примеры для лучшего понимания настоящего изобретения. Однако эти примеры приведены только для лучшего понимания настоящего изобретения и не должны рассматриваться как ограничивающие объем настоящего изобретения.
[85] [Пример синтеза]
[86] В настоящем примере синтеза будет описан репрезентативный пример способа синтеза соединения на основе пиразола, содержащегося в качестве активного ингредиента в фармацевтической композиции для лечения заболеваний печени.
[87] Пример синтеза 1. Синтез 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола
[88]
[89] Этиловый эфир 2-пропил-3-оксо-3-фенилпропионовой кислоты (2,52 г, 10,7 ммоль) и 10 мл этанола загружали в круглодонную колбу и раствор 2-гидразинопиридина (1,29 г, 1,18 ммоль), разбавленный в 3 мл этанола, затем медленно добавляли по каплям при 0°С. Полученную смесь кипятили с обратным холодильником при нагревании при 100°С в течение 3 дней. Растворитель удаляли перегонкой при пониженном давлении и полученные твердые вещества промывали гексаном и этилацетатом, и затем сушили в вакууме с получением целевого соединения с выходом 82%.
[90] 1H ЯМР (300 MГц, CDCl3) δ 12,50 (1H, с), 8,27-8,25 (1H, м), 8,01 (1H, д, J=8,5 Гц), 7,81 (1H, м), 7,69 (2H, м), 7,48-7,34 (3H, м), 7,12-7,10 (1H, м), 2,54 (2H, д, J=7,5 Гц), 1,64 (2H, м), 0,93 (3H, т, J=7,3 Гц); EIMS (70 eV) m/z (относительная интенсивность) 279(M+, 37), 250(100).
[91] Пример синтеза 2. Синтез 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорида (соединение 1)
[92]

[93] 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол (280 мг, 1,0 ммоль), полученный в примере синтеза 1, растворяли в 4 мл этилового эфира в круглодонной колбе и раствор 2 М HCl в 0,55 мл этилового эфира медленно по каплям добавляли в колбу при 0°С. Полученные твердые вещества отфильтровывали при пониженном давлении из реакционного раствора, растворитель удаляли и остаток промывали гексаном и этилацетатом и сушили в вакууме с получением целевого соединения (270 мг, 0,85 ммоль).
[94] 1H ЯМР (300 MГц, CDCl3) δ 8,44 (1H, д, J=4,2 Гц), 8,0-8,03 (2H, м), 7,66-7,64 (2H, м), 7,48-7,42 (3H, м), 7,34-7,30 (1H, м), 2,49 (2H, шир с), 2,43 (2H, т, J=7,5 Гц), 1,48 (2H, м), 0,48 (3H, т, J= 7,3 Гц).
[95] [Пример]
[96] В настоящем примере фармацевтическое действие производного на основе пиразола, содержащегося в качестве активного ингредиента в фармацевтической композиции для лечения заболеваний печени, будет подробно описано.
[97] Пример 1: Активность 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола гидрохлорида в отношении ингибирования жирового гепатоза [Тест с использованием жирового гепатоза на животной модели, индуцированного диетой MCD (дефицит метионина/холина)]
[98] В качестве животных-субъектов исследования были приобретены самцы крыс Sprague Dawley (SD) в возрасте 6 недель. Всех крыс содержали в стандартных условиях. Когда крысы достигли 12-недельного возраста после того, как их выращивали в течение приблизительно 6 недель, крысам вводили тестируемые вещества. Тестируемые группы устанавливали на основании уровня ALT в крови, собранной через 5 недель.
[99] В течение 5 недель после того, как крысы достигли 12-недельного возраста, тестируемые вещества раздельно вводили в группу введения носителя и в группу введения 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорида.
[100] Нормальную контрольную группу использовали в качестве отрицательного контроля.
[101] Кровь брали за один день до начала эксперимента (из яремной вены), и образцы крови собирали через 3 недели, 5 недель, 7 недель, 9 недель и в день вскрытия (через 24 часа после голодания, всего шесть раз). Кроме того, анализировали плазму каждого образца крови, взятого через 5 недель, 7 недель, 9 недель и в день вскрытия.
[102] После завершения теста животных анестезировали, из соответствующих животных извлекали ткани печени и брали кровь для обследования. Ткани печени взвешивали и визуализировали. Ткани печени иммобилизировали в 10% забуференном нейтральном формалине. Иммобилизованные ткани разрезали до заданной толщины, подвергали общему процессу обработки ткани, помещали в парафин и получали срезы ткани размером от 4 до 5 мкм, и срезы ткани подвергали окрашиванию гематоксилином и эозином (окрашивание H&E) в виде общего способа окрашивания и наблюдали с помощью гистопатологического исследования.
[103] В дополнение к окрашиванию H&E проводили окрашивание масляным красным O для наблюдения липидов, индуцированных образованием жировой печени, измеряли уровни продуцируемых липидов и прогнозировали влияние введения лекарственного средства на снижение липидов. Ткани печени окрашивали рабочим раствором масляным красным-O для оценки уровня продуцируемых липидов. Кровь собирали и центрифугировали при 3000 об/мин при 4°С в течение 10 мин. Брали плазму верхнего слоя и измеряли уровень аланин-трансаминазы (ALT) с использованием автоматического биохимического анализатора крови (AU480, Beckman 30-18 Coulter, USA) и результаты анализировали.
[104] Измеряли отношение массы печени к массе тела и количество триглицеридов в тканях печени, чтобы рассчитать эффекты введения лекарственного средства на снижение относительной массы печени и триглицеридов. Ткани печени измельчали с помощью гомогенизатора, добавляли хлороформ и метанол (2:1), полученную смесь центрифугировали при 3000 об/мин и при 4°С в течение 10 минут и слой органического растворителя, содержащий липиды, отделяли. Органический растворитель в отделенном липидном слое удаляли в сушилке при 50°С в течение 12 часов. Пробирки, содержащие только липиды, погружали в 100% EtOH, и затем суспендировали в пробирке, не содержащей липидов, и затем анализировали с помощью набора реагентов для измерения триглицеридов (AM157S-K, Asan, Korea).
[105] Для наблюдения иммуногистохимических изменений в тканях печени, из тканей, иммобилизованных в 10% забуференном нейтральном формалине, получали тонкие срезы, прикрепляли к предметному стеклу, депарафинировали и окрашивали, и затем подвергали взаимодействию с антителами TNF-α (фактор некроза опухоли-α ab1793, Abcam), TGF-β (трансформирующий фактор роста-β, ab66043, Abcam), α-SMA (α-актин гладких мышц, ab7817, Abcam) и IL-1β (интерлейкин-1β, ab9722, Abcam) на соответствующих предметных стеклах. Результаты анализировали.
[106] Фиг. 1, 2 и 3 представляют собой изображения, показывающие, что в тесте с использованием животной модели с жировым гепатозом, индуцированным диетой MCD (дефицит метионина/холина), группа в которой вводили 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорид в виде лекарственного средства в суточной разовой дозе 60 мг/кг, обладает эффектами снижения уровня ALT в крови, ингибирования воспаления тканей печени и ингибирования фиброза тканей печени. Как показано на фиг. 1, 2 и 3, на фиг. 1, уровень ALT в крови значительно снижается в группе, которой вводили лекарственное средство, по сравнению с группой, получавшей носитель, после введения лекарственного средства. На фиг.2 показаны результаты окрашивания α-SMA, IL-1β и TNF-α в качестве факторов воспаления в тканях печени, что указывает на то, что воспаление значительно снижается в группе, которой вводили лекарственное средство, по сравнению с группой, которой вводили носитель. На фиг. 3 показаны результаты TGF-β, окрашивания H&E и окрашивания масляным красным O тканей печени с целью выявления повреждения ткани печени и фиброза печени, которое указывает на то, что повреждение ткани печени и фиброз печени уменьшаются в группе, которой вводили лекарственное средство, по сравнению с группой, которой вводили носитель.
[107] Пример 2: Активность 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорида в отношении ингибирования жирового гепатоза [Тест с использованием жирового гепатоза на животной модели, индуцированного диетой с высоким содержанием жиров]
[108] В качестве животных-субъектов исследования были приобретены крысы в возрасте 6 недель. Всех крыс содержали в стандартных условиях. Когда крысы достигли 12-недельного возраста после того, как их выращивали в течение приблизительно 6 недель, крысам вводили тестируемые вещества. Тестируемые группы устанавливали на основании уровня ALT в крови, собранной через 5 недель. В течение 5 недель после того, как крысы достигли 12-недельного возраста, тестируемые вещества раздельно вводили группе, получавшей носитель, группе, получавшей обетихолевую кислоту в качестве группы положительного контроля, и группе, получавшей 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорид.
[109] Кровь брали за один день до начала эксперимента (из яремной вены), и образцы крови собирали через 5 недель, 8 недель и в день вскрытия (через 24 часа после голодания, всего 4 раза). Кроме того, анализировали плазму каждого образца крови, взятого на 5-й, 8-й неделе и в день вскрытия.
[110] После завершения теста животных анестезировали, из соответствующих животных извлекали ткани печени и брали кровь для обследования. Ткани печени взвешивали и визуализировали. Ткани печени иммобилизировали в 10% забуференном нейтральном формалине. Иммобилизованные ткани разрезали до заданной толщины, подвергали общему процессу обработки ткани, помещали в парафин и получали срезы ткани размером от 4 до 5 мкм, и срезы ткани подвергали окрашиванию гематоксилином и эозином (окрашивание H&E) в виде общего способа окрашивания и наблюдали с помощью гистопатологического исследования.
[111] В дополнение к окрашиванию H&E проводили окрашивание масляным красным-O для наблюдения липидов, индуцированных образованием жировой печени, измеряли уровни продуцируемых липидов и прогнозировали влияние введения лекарственного средства на снижение липидов. Ткани печени окрашивали рабочим раствором масляным красным-O для оценки уровня продуцируемых липидов.
[112] Кровь собирали и центрифугировали при 3000 об/мин при 4°С в течение 10 мин. Плазму верхнего слоя брали и измеряли уровни щелочного фосфата (ALP), аспартат-трансаминаза (AST) и аланин-трансаминазы (ALT) с использованием автоматического биохимического анализатора крови (AU480, Beckman 30-18 Coulter, USA) и результаты анализировали.
[113] Измеряли отношение массы печени к массе тела и количество триглицеридов в тканях печени, чтобы рассчитать эффекты введения лекарственного средства на снижение относительной массы печени и триглицеридов. Ткани печени измельчали с помощью гомогенизатора, добавляли хлороформ и метанол (2:1), полученную смесь центрифугировали при 3000 об/мин и при 4°С в течение 10 минут и слой органического растворителя, содержащий липиды, отделяли. Органический растворитель в отделенном липидном слое удаляли в сушилке при 50°С в течение 12 часов. Пробирки, содержащие только липиды, погружали в 100% EtOH, и затем суспендировали в пробирке, не содержащей липидов, и затем анализировали с помощью набора реагентов для измерения триглицеридов (AM157S-K, Asan, Korea).
[114] На фиг. 4 показано, что в тесте с использованием животной модели с жировым гепатозом, индуцированным диетой с высоким содержанием жира, группа, которой вводили 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ол гидрохлорид в виде лекарственного средства в суточной разовой дозе 60 мг/кг, обладает эффектами снижения относительной массы печени и уровней ALT, ALP и AST в крови. Как видно из фиг. 4А, относительная масса печени значительно снижена в группе, получавшей лекарственное средство, по сравнению с группой, получавшей носитель, и группой, получавшей обетихолевую кислоту, в качестве группы положительного контроля, после введения лекарственного средства. На фиг. 4B, 4C и 4D показано, что уровни ALT, ALP и AST в крови значительно снижаются в группе, которой вводили лекарственное средство, по сравнению с группой, в которой вводили носитель, и группой, где вводили обетихолевую кислоту, в качестве группы положительного контроля, после введения лекарственного средства.
[115] Пример 3: Активность 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H- иразол-5-ол гидрохлорида в отношении ингибирования жирового гепатоза [Тест с использованием животной модели с жировым гепатозом, индуцированным у диабетических мышей db/db]
[116] В качестве животных-субъектов исследования 6-недельных самцов диабетических мышей db/db (C57BLKS/J-leprdb/leprdb) приобретали в лаборатории Jackson Laboratory (Bar Harbor, ME, USA). Мышей содержали в стандартных условиях. Когда мыши достигали 8-недельного возраста после того, как их выращивали в течение приблизительно 2 недель, мышам вводили тестируемые вещества. В течение 12 недель после того, как мыши достигали 8-недельного возраста, тестируемые вещества вводили отдельно в группе введения носителя и группе, получавшей 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ол гидрохлорид.
[117] Нормальную контрольную группу использовали в качестве отрицательного контроля.
[118] После завершения теста животных анестезировали, из соответствующих животных извлекали ткани печени и брали кровь для обследования. Ткани печени взвешивали и визуализировали. Ткани печени иммобилизировали в 10% забуференном нейтральном формалине. Иммобилизованные ткани разрезали до заданной толщины, подвергали общему процессу обработки ткани, помещали в парафин и получали срезы ткани размером от 4 до 5 мкм, и срезы ткани подвергали окрашиванию гематоксилином и эозином (окрашивание H&E) в виде общего способа окрашивания и наблюдали с помощью гистопатологического исследования.
[119] В дополнение к окрашиванию H&E проводили окрашивание масляным красным-O для наблюдения липидов, индуцированных образованием жировой печени, измеряли уровни продуцируемых липидов и прогнозировали влияние введения лекарственного средства на снижение липидов. Ткани печени окрашивали рабочим раствором масляным красным-O для оценки уровня продуцируемых липидов.
[120] Кровь собирали и центрифугировали при 3000 об/мин при 4°С в течение 10 мин. Брали плазму верхнего слоя и измеряли уровни триглицерида (TG) и LDL-холестерина (LDL-C) с использованием автоматического биохимического анализатора крови (AU480, Beckman 30-18 Coulter, USA) и результаты анализировали.
[121] Измеряли отношение массы печени к массе тела и количество триглицеридов в тканях печени, чтобы рассчитать эффекты введения лекарственного средства на снижение относительной массы печени и триглицеридов. Ткани печени измельчали с помощью гомогенизатора, добавляли хлороформ и метанол (2:1), полученную смесь центрифугировали при 3000 об/мин и при 4°С в течение 10 минут и слой органического растворителя, содержащий липиды, отделяли. Органический растворитель в отделенном липидном слое удаляли в сушилке при 50°С в течение 12 часов. Пробирки, содержащие только липиды, погружали в 100% EtOH, и затем суспендировали в пробирке, не содержащей липидов, и затем анализировали с помощью набора реагентов для измерения триглицеридов (AM157S-K, Asan, Korea).
[122] Фиг. 5 и 6 представляют собой изображения и графики, показывающие, что в тесте с использованием животной модели с жировым гепатозом, индуцированным у диабетических мышей db/db, группа, которой вводили 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1H-пиразол-5-ол гидрохлорид в виде лекарственного средства в суточной разовой дозе 60 мг/кг, обладает эффектами подавления воспаления тканей печени, ингибирования фиброза тканей печени и снижения уровней TG и LDL в крови и тканях печени. Как видно из фиг. 5 и 6, на фиг. 5 показаны результаты окрашивания TGF-β и коллаген типа IV в тканях печени для анализа повреждения тканей печени и фиброза печени, которые указывают, что повреждение ткани печени и фиброз печени значительно уменьшены в группе, получавшей лекарственное средство, по сравнению с группой, получавшей носитель. На фиг. 6А и 6В показаны изменения TG и холестерина в тканях печени и изменения TG и холестерина в крови, которые указывают, что повреждение ткани печени и фиброз печени значительно снижаются в группе, получавшей лекарственное средство, по сравнению с группой, получавшей носитель. Фиг. 6C показывает, что экспрессия мРНК коллагена I, коллагена IV, MCP-1, PAI-1 и TGF-β, которые являются факторами воспаления и фиброза в тканях печени, значительно снижена в группе, получавшей лекарственное средство, по сравнению с группой, получавшей носитель.
[123] Хотя предпочтительные варианты осуществления настоящего изобретения были раскрыты для иллюстративных целей, специалистам в данной области техники должно быть понятно, что возможны различные модификации, дополнения и замены, не выходя за рамки объема и сущности изобретения, которые раскрыты в прилагаемой формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ФИБРОЗА ЛЕГКИХ, СОДЕРЖАЩЕЕ ПРОИЗВОДНОЕ ПИРАЗОЛА | 2021 |
|
RU2817989C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ ОСТРОГО ПОРАЖЕНИЯ ПОЧЕК, ВЫЗВАННОГО КОНТРАСТНЫМ ВЕЩЕСТВОМ | 2021 |
|
RU2817980C1 |
| КОМПОЗИЦИЯ ДЛЯ ПРЕДОТВРАЩЕНИЯ ИЛИ ЛЕЧЕНИЯ ЖИРОВЫХ БОЛЕЗНЕЙ ПЕЧЕНИ | 2015 |
|
RU2664696C2 |
| НОВОЕ КРИСТАЛЛИЧЕСКОЕ ТВЕРДОЕ СОЕДИНЕНИЕ ГИДРОХЛОРИДА 3-ФЕНИЛ-4-ПРОПИЛ-1-(ПИРИДИН-2-ИЛ)-1Н-ПИРАЗОЛ-5-ОЛА | 2018 |
|
RU2754255C2 |
| НОВОЕ ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ СОЕДИНЕНИЙ ТИЕНО[3,2-D]ПИРИМИДИН-4-ОНА | 2019 |
|
RU2768828C1 |
| Новые производные пиразола | 2022 |
|
RU2816835C1 |
| ЛЕЧЕНИЕ НЕАЛКОГОЛЬНОЙ ЖИРОВОЙ БОЛЕЗНИ ПЕЧЕНИ | 2019 |
|
RU2815647C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ПРЕДУПРЕЖДЕНИЯ ИЛИ ЛЕЧЕНИЯ НЕАЛКОГОЛЬНОГО СТЕАТОГЕПАТИТА | 2021 |
|
RU2803733C1 |
| Применение лактитола и пероральная лекарственная форма для лечения и профилактики неалкогольной жировой болезни печени | 2018 |
|
RU2692243C1 |
| ТРИЦИКЛИЧЕСКОЕ СОЕДИНЕНИЕ И ЕГО ФАРМАЦЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2833354C1 |


Раскрыта фармацевтическая композиция для предупреждения или лечения жировой болезни печени, включающая в качестве активного ингредиента соединение на основе пиразола или его фармацевтически приемлемую соль. 3-фенил-4-алкил-1-(пиридин-2-ил)-1Н-пиразол-5-ол и его фармацевтически приемлемая соль способны эффективно ингибировать жировой гепатоз, воспаление печени и фиброз печени и являются полезными для профилактики или лечения НАЖБП, в частности НАСГ. 4 н. и 6 з.п. ф-лы, 3 пр., 6 ил.
1. Применение фармацевтической композиция для предупреждения, облегчения или лечения заболевания печени, где заболевания печени выбраны из стеатоза (жировой болезни печение), неалкогольной жировой болезнь печени (НАЖБП), неалкогольного стеатогепатита (НАСГ), воспаления печени и цирроза печени, включающей в качестве активного ингредиента эффективное количество по меньшей мере одного соединения, выбранного из соединения на основе пиразола, представленного следующей формулой 1, и его фармацевтически приемлемой соли
[Формула 1]
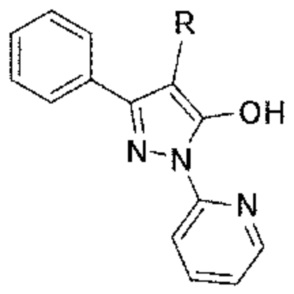 ,
,
где R представляет собой С1-С10 линейную или разветвленную алкильную группу и фармацевтически приемлемую добавку.
2. Применение по п.1, где фармацевтическая композиция включает в качестве активного ингредиента по меньшей мере одно соединение, выбранное из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола и его фармацевтически приемлемой соли.
3. Применение по п.1, где фармацевтически приемлемая соль выбрана из группы, состоящей из соли щелочного металла, соли щелочноземельного металла, соли с неорганической кислотой, соли с органической кислотой и соли с кислой аминокислотой.
4. Применение по п.1, где фармацевтически приемлемая соль представляет собой гидрохлорид.
5. Применение по п.1, где заболевание печени представляет собой неалкогольную жировую болезнь печени (НАЖБП).
6. Применение по п.5, где неалкогольная жировая болезнь печени (НАЖБП) включает по меньшей мере одно из простого стеатоза, неалкогольного стеатогепатита (НАСГ) и цирроза печени.
7. Применение по п.1, где фармацевтическая композиция получена в виде лекарственной формы, выбранной из группы, состоящей из инъекций, гранул, таблеток, пилюль, капсул, гелей, сиропов, суспензий, эмульсий, капель и жидкостей.
8. Применение терапевтического или профилактического средства для лечения или профилактики простого стеатоза, включающего в качестве активного ингредиента по меньшей мере одно соединение, выбранное из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола и его фармацевтически приемлемой соли.
9. Применение терапевтического или профилактического средства для лечения или профилактики неалкогольного стеатогепатита, включающего в качестве активного ингредиента по меньшей мере одно соединение, выбранное из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола и его фармацевтически приемлемой соли.
10. Применение терапевтического или профилактического средства для лечения или профилактики цирроза печени, включающего в качестве активного ингредиента по меньшей мере одно соединение, выбранное из 3-фенил-4-н-пропил-1-(пиридин-2-ил)-1Н-пиразол-5-ола и его фармацевтически приемлемой соли.
| US 2014128418 A1, 08.05.2014 | |||
| US 2015218125 A1, 06.08.2015 | |||
| KR 20090102145 A, 30.09.2009 | |||
| ПРОИЗВОДНЫЕ СОЕДИНЕНИЯ ПИРАЗОЛА | 2012 |
|
RU2600983C2 |
Авторы
Даты
2020-06-17—Публикация
2018-09-14—Подача