Предлагаемое изобретение относится к способу получения производных бинафтила, а именно диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, который может быть использован для получения полиимидных материалов, используемых при изготовлении мембран топливных элементов, твердополимерных электролитов, используемых в различных областях техники.
Основными требованиями, предъявляемыми к мембранам топливных элементов, а также твердополимерным электролитам являются: высокая механическая прочность в сочетании с химической и термической стабильностью и наличие ионной (протонной) проводимости.
Одними из перспективных материалов для изготовления мембран топливных элементов считаются ароматические полиимиды (ПИ) [Sedesheva, Y.S., Ivanov, V.S., Wozniak, A.I., & Yegorov, A.S. // ORIENTAL JOURNAL OF CHEMISTRY. 2016, V. 32 (5), P. 2283-2296.]. Однако выявлено, что изготавливаемые мембраны для топливных элементов на основе полиимидов демонстрируют незначительную степень деградации при включении/выключении топливного элемента, удерживают воду, имеют низкую проницаемость по отношению к метанолу, особенно при повышенных температурах [Yin Y.; Yamada О.; Tanaka K. Okamoto K.-I. // Polymer. 2006, V. 38, P. 197-219.].
К известным полиимидным материалам относятся сульфированные нафталевые полиимиды (с шестичленными имидными циклами в цепи) и сульфированные фталевые полиимиды (с пятичленными имидными циклами в цепи), применяемые в топливных элементах, однако которые, как выявлено, являются довольно недолговечными [Jang W., Lee С., Sundar S., Shul Y.G., Han H. // Polymer Degradation and Stability. 2005; 90: 431-440.].
Особое внимание в последние годы уделяется созданию полимерных электролитов для топливных элементов, которые состоят из полиимидов с чередующимися шестичленными имидными циклами в основной цепи. [Kraytsberg A., Yair Е.-Е. Review of Advanced Materials for Proton Exchange Membrane Fuel Cells // Energy Fuels. 2014, V. 28 (12), P. 7303-7330]. К таковым относятся диангидриды с нафталевым имидным циклом, представителями которых являются коммерчески доступный диангидрид 1,4,5,8-нафталинтетракарбоновой кислоты и диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты. Непосредственный интерес для предлагаемого изобретения представляют производные именно производные бинафтила, а именно: 4,4'-диаценафтен (син. 5,5'-диаценафтен) (1), 4,4'-бинафтил-1,1',8,8'-тетракарбоновая кислота (син. 1,11-бинафтил-4,4',5,5'-тетракарбоновая кислота) (2) и диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты (3), структурные формулы которых представлены ниже:
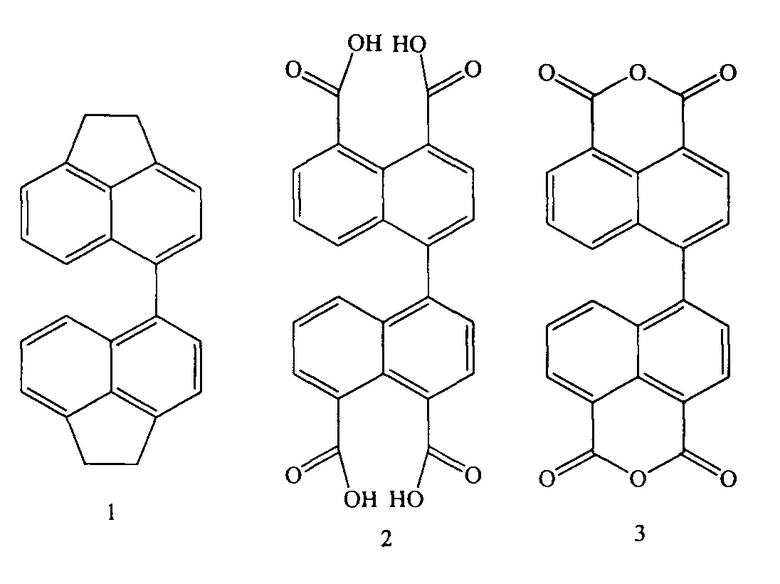
Способ синтеза диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты описан в ряде информационных источников. Впервые синтез диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты описан в 1973 году. [L.A. Jones, R. Watson // Can. J. Chem. 1973. V. 51. P. 1833-1837.] В основе этого синтеза лежит реакция конденсации коммерчески доступного 5-бромаценафтена с 5-магнийбромаценафтеном, предварительно полученным из того же 5-бромаценафтена и магниевых стружек в тетрагидрофуране, протекающая в присутствии CoCl2. с суммарным выходом (45%). Получение диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты с использованием реактива Гриньяра в данном процессе протекает по следующей схеме:
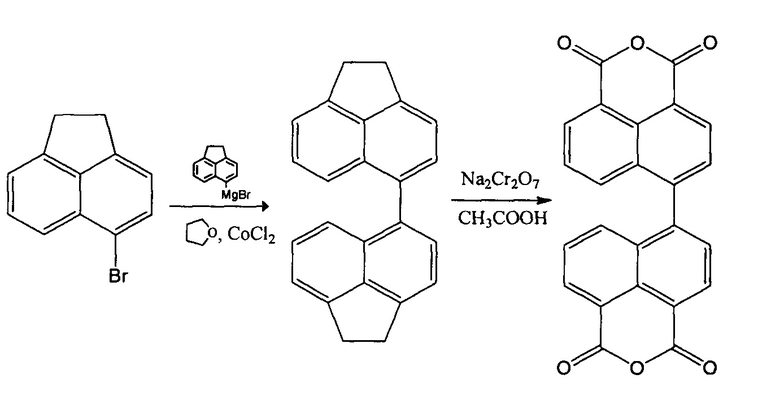
Основным недостатком этого способа является необходимость использования хроматографии для отделения 4,4'-диаценафтена от образующегося в результате отщепления брома аценафтена и исходного 5-бромаценафтена. Использование колоночной хроматографии серьезно ограничивает возможности для промышленного осуществления данного процесса. Существенным недостатком также является невысокий выход конечного продукта (43%), а также использование в процессе легко воспламеняющихся и химически агрессивных веществ.
Во всех последующих работах, касающихся синтеза производных бинафтила, ключевой стадией также является образование 4,4' - С-С связи между двумя нафталиновыми фрагментами, осуществляемой с использованием катализаторов, в качестве которых используются различные металлы и соли металлов. Так, например, в работе [Jaworek W.,  // European Journal of Inorganic Chemistry. 1991. V. 124. №. 2. P. 347-352.] описывается способ получения 4,4'-диаценафтена (1) из аценафтена в присутствии тетраацетата свинца и BF3*(C2H5)2O в ацетонитриле при комнатной температуре, осуществляемый с выходом 47%.
// European Journal of Inorganic Chemistry. 1991. V. 124. №. 2. P. 347-352.] описывается способ получения 4,4'-диаценафтена (1) из аценафтена в присутствии тетраацетата свинца и BF3*(C2H5)2O в ацетонитриле при комнатной температуре, осуществляемый с выходом 47%.
В качестве катализатора для синтеза производных бинафтила также применяется палладий, например, в способе получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, описанном в китайском патенте [CN 101397287, 2009]. Данный способ осуществляют в несколько стадий. Сначала исходный диангидрид 4-гало-1,8-нафталиндикарбоновой кислоты смешивают с 4-10 кратным молярным избытком гидроксида калия, добавляют дистиллированную воду и нагревают для полного растворения. Затем к раствору добавляют катализатор Pd/C (палладий на углероде) и восстановитель и реакционную массу при температуре 80-120°C кипятят с обратным холодильником в течение от 3-40 часов. После этого отработанный катализатор - Pd/C и примеси отфильтровывают, а затем в фильтрат добавляют хлористоводородную кислоту или азотную кислоту до установления рН 1-3. Затем осажденная желтая эмульсия промывается дистиллированной водой в течение 3-5 раз и сушится в вакуумной печи в течение 10-20 часов при температуре от 180-200°C. В результате получается твердый порошок желтого цвета, который затем перекристаллизовывают из диметилформамида, и получают 4,4',5,5'-бинафтил-тетракарбоновый диангидрид(син. диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты). Преимущество использования катализатора- палладия на углероде, не смотря на его дороговизну, заключается в том, что за счет использования восстановителя катализатор не теряет своей активности и может быть повторно использован в синтезе.
В ряде работ синтез производных бинафтила предлагается проводить с использованием в качестве катализаторов безводных солей никеля, в присутствии цинкового порошка и трифенилфосфина в диметиацетамиде.
Известен способ получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты из ангидрида 4-хлор-1,8-нафталиндикарбоновой кислоты, рассмотренный в статье [Gao J.P., Wang Z.Y. // Journal of Polymer Science Part A: Polymer Chemistry. 1995. V. 33. №. 10. P. 1627-1635]. Получение диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты из ангидрида 4-хлор-1,8-нафталиндикарбоновой кислоты в цитируемой статье осуществляют по следующей схеме:
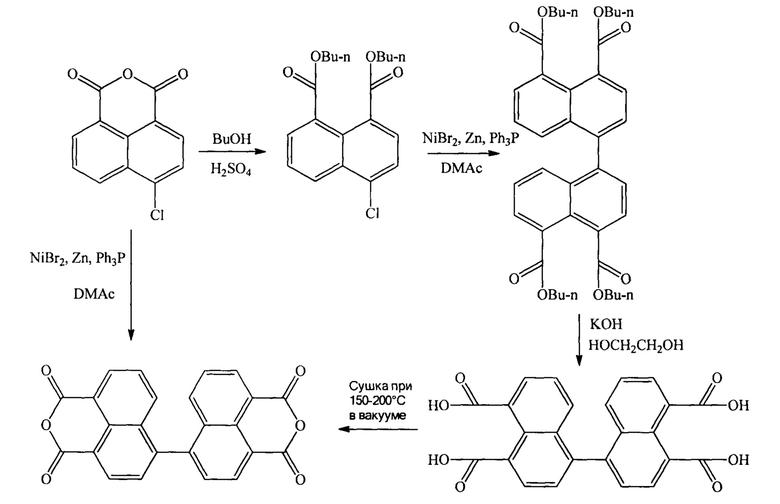
В этой работе приводятся два варианта получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты. Первый вариант-это получение непосредственно из ангидрида 4-хлор-1,8-нафталиндикарбоновой кислоты путем конденсации, осуществляемой в присутствии бромида никеля (II), цинкового порошка и трифенилфосфина в диметиацетамиде. Второй вариант включает стадию образования бутилового эфира 4-хлор-1,8-нафталиндикарбоновой кислоты, после чего осуществляется его конденсация с превращением сложного эфира в диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты. Основным недостатком первого варианта являются трудности, возникающие на стадии очистки конечного продукта, связанные с образованием неидентифицируемого красноватого побочного продукта, отделять который от целевого диангидрида удается только многократным переосаждением метанолом из щелочного раствора. Это в свою очередь сказывается на невысоком выходе конечного продукта (43,8%). Второй вариант осуществления рассматриваемого процесса, не смотря на большее количество стадий, более технологичен чем первый вариант, поскольку исключает трудоемкую очистку, а также более эффективен, так как проходит с суммарным выходом 66%.
В другой работе [Li N. et al. // Polymer. 2007. V. 48. №.25. P. 7255-7263.] диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты получают через образование эфира 4-хлор-1,8-нафталиндикарбоновой кислоты с последующей конденсацией. Для этого ангидрид 4-хлор-1,8-нафталиндикарбоновой кислоты обрабатывают смесью PCl5/POCl3, а затем метанолом и полученный диметиловый эфир конденсируют, затем гидролизуют раствором KOH в этиленгликоле и высушивают в вакууме при 200°C в течение 12 часов. Суммарный выход целевого диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты составляет 75%. Данный способ, не смотря на свою эффективность, имеет существенные недостатки, которые заключаются в использовании на первой стадии процесса в больших количествах высокотоксичных и реакционноспособных хлорангидридов фосфора. Работа с данными соединениями, как известно, требует применения особых мер безопасности и использования коррозионностойкого оборудования.
В качестве исходного соединения при синтезе диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты может быть применен 5-бромаценафтен, получение которого описано в известных публикациях [Liu L., Zhang С., Zhao J. // Dalton Transactions. 2014. V. 43. №. 35. P. 13434-13444.] или в [Constantine P.R., Deady L.W., Topsom R.D. // The Journal of Organic Chemistry. 1969. V. 34. №. 4. P. 1113-1115.]. Применение 5-бромаценафтена в качестве исходного продукта предложено в известном способе получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, выбранном в качестве прототипа предлагаемому способу, который описан в статье [Sun F. et al. // Polymer. 2010. V. 51. №. 17. P. 3887-3898] и который протекает по следующей схеме:
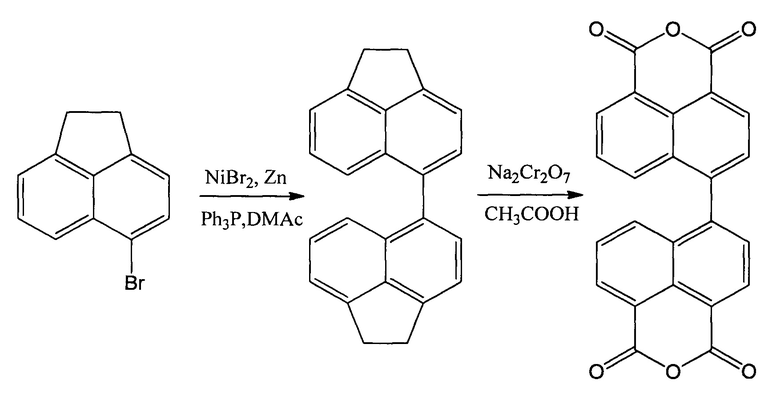
Цитированный способ проводят следующим образом. Смесь хлорида никеля (II) (3 ммоль) с цинковым порошком (180 ммоль) и трефенилфосфином (15 ммоль) в 50 мл диметилацетамида нагревают при перемешивании в токе азота до 90°C в течение 30 минут, после чего прибавляют раствор 5-бромаценафтена (45 ммоль) в диметилацетамиде. Затем реакционную смесь выдерживают при 90°C в течение 12 часов, упаривают и обрабатывают 10% соляной кислотой, а нерастворившуюся массу отделяют и растворяют в ацетоне и фильтруют снова. Органический слой высушивают над сульфатом магния, упаривают растворитель, осадок очищают колоночной хроматографией при использовании в качестве элюента гексана. Выход, 4'-диаценафтена (0,01 моль) - 49.7%.
Полученный таким образом промежуточный продукт -4,4'-диаценафтен (0,01 моль), растворяют в ледяной уксусной кислоте (450 мл) при 100°C и при перемешивании, присыпают небольшими порциями бихромат натрия (0,1 моль), затем реакционную массу кипятят 12 часов, после чего охлаждают до 100-110°C, выливают в дистиллированную воду и выдерживают в ней 10 часов, отфильтровывают выпавший осадок целевого продукта, промывают его холодной водой и перекристаллизовывают в диметилформамиде. Выход 71%
Как видно из приводимых данных, мольное соотношение 5-бромаценафтена, хлорида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,067:0,333:4), а мольное соотношение 4,4'-диаценафтена и бихромата натрия составляет 1:10.
Основной недостаток данного способа получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты заключается в необходимости применения хроматографических методов для выделения промежуточного 4,4'-диаценафтена, что ограничивает возможность его промышленной применимости и масштабируемость метода. Кроме того, данный способ осуществляется со сравнительно невысоким суммарным выходом реакции (35%).
Целью предлагаемого изобретения является разработка технологичного процесса получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, исключающего трудоемкие стадии выделения промежуточного продукта и обеспечивающего получение продукта с высоким выходом и высокого качества. Для достижения указанной цели предлагается Способ получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, осуществляемый с использованием в качестве исходного соединения 5-галогенаценафтена, выбранного из группы следующих соединений: 5-бромаценафтен, 5-иодаценафтен и 5-хлораценафтен, который подвергается реакции конденсации, проводимой в присутствии каталитической смеси, содержащей 0,2-0,4 моля галогенида никеля (II), 0,2-0,4 моля трифенилфосфина, 2-4 моля активированного цинкового порошка в расчете на 1 моль галогенаценафтена и предварительно нагретой при перемешивании в токе инертного газа до 80-100°C в течение 10-40 минут, после чего к ней добавляется раствор галоаценафтена в органическом сухом амидном растворителе, реакционная смесь выдерживается при 80-100°C в течение 6-12 часов, упаривается досуха, к ней добавляется низкокипящий хлорсодержащий органический растворитель и полученный раствор подкисляется соляной кислотой, отфильтровывается, затем органический фильтрат высушивается, упаривается хлорсодержащий растворитель, а осадок растворяется в одноатомном спирте, кипятится при перемешивании и выделенный фильтрацией 4,4'-диаценафтен сушится в вакууме 5-10 часов при 150-200°C, после чего растворяется при 100°C при перемешивании в ледяной уксусной кислоте и к нему прикапывается бихромат натрия из расчета 8-12 моль бихромата на 1 моль полученного 4,4'-диаценафтена, затем реакционная масса кипятится 8-12 часов, охлаждается до 100-110°C, выливается в дистиллированную воду, в которой выдерживается в ней 4-10 часов, выпавший осадок целевого продукта отфильтровывается, промывается холодной водой и сушится в вакууме при 100°C.
В качестве катализаторов используются галогениды никеля (II), выбранные из группы следующих соединений: хлорид никеля (II), бромид никеля (II), иодид никеля (II).
В качестве органических амидных растворителей в способе используются соединения, выбранные из группы: формамид, ацетамид, диметилформамид, диметилацетамид.
В качестве органических низкокипящих хлорсодержащих органических растворителей используются растворители, выбранные из группы: хлористый метилен, хлороформ, тетрахлорметан.
На стадии выделения промежуточного 4,4'-диаценафтена используются одноатомные спирты, выбранные из группы: метанол, этанол, 1-пропанол.
В предлагаемом способе получение диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты осуществляется конденсацией галоген-аценафтена с образованием С-С связи и осуществляется по схеме (аналогично прототипу):
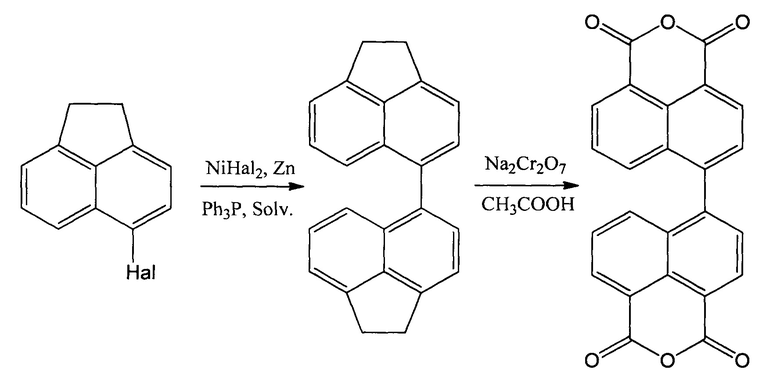
В качестве исходного продукта в предлагаемом способе, в отличие от способа-прототипа, предлагается применять не только 5-бромаценафтен, но и 5-хлораценафтен и 5-иодаценафтен, а в качестве катализатора использовать не только бромид никеля (II), но и хлорид никеля (II), иодид никеля (II), что расширяет доступность выбора исходных продуктов. Исходные галоидаценафтены в процессе подвергают реакции конденсации с образованием С-С связи до образования 4,4'-диаценафтена. Эта стадия процесса, как и в прототипе, осуществляется в сухом органическом растворителе в присутствии каталитической смеси, содержащей безводный галогенид никеля (II), цинковый порошок и трифенилфосфин. Однако для оптимизации реакции конденсации подобраны определенные количественные соотношения реагентов, позволяющие повысить выход промежуточного продукта -4,4'-диаценафтена до 40-45% (в прототипе 35%). Предлагается, исходные продукты вводить в количествах, соответствующих их мольным соотношениям, равным: 0,03-0,07 моля галогенида никеля на 1 моль 5-галоген-аценафтена, 0,2-0,4 моля трифенилфосфина на 1 моль галоген-аценафтена, 2-4 моля активированного цинкового порошка на 1 моль галоген-аценафтена. Никель выступает в роли катализатора образования С-С связи. Избыток цинка восстанавливает никель до нулевой степени окисления и поддерживает его в этом состоянии все время реакции, а за счет комплексообразования с трифенилфосфином никель остается в растворе.
Цинк предварительно активируют обработкой порошка соляной кислотой в течение непродолжительного времени для удаления пленки оксида. Для этого цинк обрабатывают по следующей схеме: к порошку цинка добавляют 5-10% водный раствора соляной кислоты, после чего перемешивают в течение 10 минут, раствор декантируют, промывают водой, отфильтровывают осадок цинка, промывают его ацетоном и высушивают в вакууме водоструйного насоса.
Для осуществления процесса на данной стадии подобраны определенные температурно-временные режимы, которые в комплексе с другими признаками процесса (весовыми соотношениями компонентов) влияют на протекание процесса и выход промежуточного продукта - 4,4'-диаценафтена.
Такими признаками являются: температура нагревания каталитической смеси до стадии ее контактирования с 5-галоген-аценафтеном (до 80-100°C в течение 10-40 мин); температура проведения основной реакции и последующего выдерживания реакционной массы (при 80-100°C в течение 6-12 часов) и температура сушки полученного 4,4'-диаценафтена (при 150-200°C). При сопоставлении температурно-временных режимов способа прототипа и предлагаемого способа видно, что в предлагаемом способе значительно расширены допустимые интервалы температурных и временных режимов на обеих стадиях процесса, что расширяет возможность его применения в разных условиях.
Существенным отличием от прототипа является отсутствие стадии выделения 4,4'-диаценафтена хроматографическими методами, что серьезно упрощает проведения реакции его получения. Очистка 4,4'-диаценафтена в предлагаемом способе позволяет получить продукт такой же чистоты.
В качестве органических амидных растворителей в способе используются соединения, выбранные из группы: формамид, ацетамид, диметилформамид, диметилацетамид.
Как выявлено на основании экспериментальных исследований, наилучшие результаты при проведении процесса конденсации с образование С-С связи достигаются при выдержке в течение 12 часов при 90°C. При таком температурно-временном режиме основная реакция протекает наиболее полно и с максимальным выходом. Наилучшие результаты достигаются при следующих условиях: безводный бромид никеля (II) (0,07 моль на 1 моль галоген-аценафтена), трифенилфосфин (0,35 моль на 1 моль галоген-аценафтена), и предварительно активированный цинковый порошок (4 моль на 1 моль галоген-аценафтена) и использовании в качестве растворителя диметиацетамида и использовании метанола в качестве одноатомного спирта.
Для исключения побочных нежелательных реакций окисления, которые могут протекать при проведении процесса в воздушной среде, предлагаемый процесс проводится в среде инертного газа, например, аргоне или азоте.
Вторая стадия процесса - это процесс образования целевого продукта-диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, осуществляемый реакцией окисления 4,4'-диаценафтена бихроматом натрия. Как и в прототипе, 4,4'-диаценафтен растворяют в ледяной уксусной кислоте. Существенными признаками заявленного процесса на второй стадии, также как и на первой, являются весовые соотношения реагентов и температурно-временные режимы. Экспериментально подобрано, что весовое соотношение бихромата натрия к 4,4'-диаценафтену должно равняться 8-12 моль бихромата на 1 моль полученного 4,4'-диаценафтена, а время кипения реакционной массы, полученной после окисления 4,4'-диаценафтена, должно составлять 8-12 часов, температура, до которой реакционная масса затем охлаждается, должна равняться 100-110°C, а температура сушки в вакууме должна составлять 150-200°C при времени сушки 5-10 часов. Оптимально использовать молярное соотношение, равное 12 молей бихромата натрия на 1 моль 4,4'-диаценафтена при времени выдержки реакционной смеси при кипении, составляющем 12 часов. В прототипе предлагается использовать 10 молей, что может быть недостаточным для полноты прохождения процесса.
Существенно на качество получаемого продукта оказывают условия проведения стадии сушки при получении промежуточного продукта (4,4'-диаценафтена), которая в предлагаемом способе проводится в вакууме при температуре не менее 150°C (150-200°C), что позволяет получать продукт, не содержащий примесей трудноудаляемых высококипящих органических растворителей и воды.
Выход и чистота получаемых продуктов подтверждена методами 1Н ЯМР и элементного CHNS-анализа, приведенными в конкретных примерах. Получаемые на основе диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты полиимидные материалы, обладают высокой механической прочностью в сочетании с химической и термической стабильностью, а также обладают ионной (протонной) проводимостью, что приводит к возможности их применения, например, при изготовлении мембран топливных элементов, а также при изготовлении электрохимических сенсоров, аккумуляторов и суперконденсаторов [Sammes N. (ed.). Fuel cell technology: reaching towards commercialization. - Springer Science & Business Media, 2006.].
Ниже изобретение иллюстрируется следующими примерами:
Пример 1:
В колбу, снабженную магнитной мешалкой, баней с силиконовым маслом, капельной воронкой, обратным холодильником и вводом/выводом инертного газа помещают безводный хлорид никеля (II) 0,206 г (0,0016 моль), трифенилфосфин 2,78 г (0,0106 моль), и предварительно активированный цинковый порошок 6,7 г (0,106 моль) и 50 мл сухого ацетамида. Смесь нагревают при перемешивании в токе аргона до 80°C выдерживают 10 мин. После этого медленно прибавляют раствор 5-хлораценафтена 10 г (0,053 моль) в 30 мл сухом ацетамиде. Смесь выдерживают при 80°C в течение 6 часов. По окончании из реакционной смеси упаривают весь объем ацетамида и добавляют 80 мл хлористого метилена. Полученный раствор осторожно, при охлаждении перемешивании приливают к 150 мл 10% водного раствора HCl. По окончании выделения газов фильтруют смесь через слой кизельгура марки Celite, отделяют органический слой и экстрагируют водный слой 50 мл хлористого метилена. Объединенные экстракты высушивают над сульфатом магния. Хлористый метилен упаривают. Осадок растворяют в 30 мл метанола. Кипятят раствор при перемешивании. Отфильтровывают нерастворившийся осадок и сушат в вакууме при 150°C. Получают 3,3 г 4,4'-диаценафтена. Выход: 40%
Мольное соотношение галоген-аценафтена, галогенида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,03:0,2:2)
1Н ЯМР (CDCl3, δ, м.д.): 7.49-7.51 (d, 2Н); 7.39-7.41 (d, 2Н); 7.27-7.32 (m, 6Н); 3.50 (s, 8Н). Элементный CHNS-анализ (ЭА): рассчитано для С24Н18: С, 94.08%; Н, 5.92%. Найдено: С, 93.95%; Н, 5.89%.
3,3 г (0,0108 моль) 4,4'-диааценафтена полностью растворяют в 250 мл ледяной уксусной кислоте при 100°C и перемешивании, затем прибавляют небольшими порциями 22,6 г (0,086 моль) бихромат натрия. Доводят смесь до кипения и кипятят 8 часов. Охлаждают до 100°C и выливают в стакан с 250 мл дистиллированной воды. Оставляют на 4 часа и затем отфильтровывают выпавший осадок, промывают несколько раз 15 мл холодной воды и сушат в вакууме при 100°C. Получают 2,3 г диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты Выход: 55%
Мольное соотношение 4,4'-диааценафтена и бихромата натрия составляет (1:8)
1Н ЯМР (DMSO d6, δ, м.д.): 8.70-8.72 (d, 2Н); 8.59-8.61 (d, 2Н); 7.98-8.00 (d, 2Н); 7.79-7.83(t, 2Н); 7.73-7.75 (d, 2Н). ЭА: Рассчитано для C24H10O6: С, 73.1%; Н, 2.56%. Найдено: С, 73.04%; Н, 2.73%.
Пример 2:
В колбу, снабженную магнитной мешалкой, баней с силиконовым маслом, капельной воронкой, обратным холодильником и вводом/выводом инертного газа помещают безводный бромид никеля (II) 0,49 г (0,00225 моль), трифенилфосфин 4,21 г (0,0161 моль), и предварительно активированный цинковый порошок 10,5 г (0,161 моль) и 75 мл сухого диметилформамида. Смесь нагревают при перемешивании в токе аргона до 85°C выдерживают 40 мин. После этого медленно прибавляют раствор 5-бромаценафтена 15 г (0,064 моль) в 45 мл сухом диметилформамиде. Смесь выдерживают при 85°C в течение 8 часов. По окончании из реакционной смеси упаривают весь объем диметилформамида и добавляют 120 мл хлороформа. Полученный раствор осторожно, при охлаждении перемешивании приливают к 225 мл 10% водного раствора HCl. По окончании выделения газов фильтруют смесь через слой кизельгура марки Celite, отделяют органический слой и экстрагируют водный слой 75 мл хлороформа. Объединенные экстракты высушивают над сульфатом магния. Хлороформ упаривают. Осадок растворяют в 50 мл этанола. Кипятят раствор при перемешивании 5 минут. Отфильтровывают нерастворившийся осадок и сушат в вакууме в 150°C. Получают 3,72 г 4,4'-диаценафтена. Выход: 38%
Мольное соотношение галоген-аценафтена, галогенида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,035:0,25:2,5)
1Н ЯМР (CDCl3, δ, м.д.): 7.49-7.51 (d, 2Н); 7.39-7.41 (d, 2Н); 7.27-7.32 (m, 6Н); 3.50 (s, 8Н). Элементный CHNS-анализ (ЭА): Рассчитано для С24Н18: С, 94.08%; Н, 5.92%. Найдено: С, 94.05%; Н, 5.95%.
3,72 г (0,0122 моль) 4,4'-диааценафтена полностью растворяют в 300 мл ледяной уксусной кислоте при 100°C и перемешивании, затем прибавляют небольшими порциями 40,36 г (0,109 моль) бихромат натрия. Доводят смесь до кипения и кипятят 8 часов. Охлаждают до 100°C и выливают в стакан с 300 мл дистиллированной воды. Оставляют на 5 часов и затем отфильтровывают выпавший осадок, промывают несколько раз 20 мл холодной воды и сушат в вакууме в 100°C. Получают 2,93 г диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты Выход: 61%
Мольное соотношение 4,4'-диааценафтена и бихромата натрия составляет (1:9)
1Н ЯМР (DMSO d6, δ, м.д.): 8.70-8.72 (d, 2Н); 8.59-8.61 (d, 2Н); 7.98-8.00 (d, 2Н); 7.79-7.83(t, 2Н); 7.73-7.75 (d, 2Н). ЭА: Рассчитано для C24H10O6: С, 73.1%; Н, 2.56%. Найдено: С, 72.96%; Н, 2.75%.
Пример 3:
В колбу, снабженную магнитной мешалкой, баней с силиконовым маслом, капельной воронкой, обратным холодильником и вводом/выводом инертного газа помещают безводный иодид никеля (II) 1,10 г (0,00357 моль), трифенилфосфин 7,01 г (0,0268 моль), и предварительно активированный цинковый порошок 17,4 г (0,268 моль) и 130 мл сухого формамида. Смесь нагревают при перемешивании в токе аргона до 100°C выдерживают 15 мин. После этого медленно прибавляют раствор 5-иодаценафтена 25 г (0,089 моль) в 75 мл сухого формамида. Смесь выдерживают при 100°C в течение 10 часов. По окончании из реакционной смеси упаривают весь объем формамида и добавляют 200 мл тетрахлорметана.
Полученный раствор осторожно, при охлаждении перемешивании приливают к 225 мл 10% водного раствора HCl. По окончании выделения газов фильтруют смесь через слой кизельгура марки Celite, отделяют органический слой и экстрагируют водный слой 130 мл тетрахлорметана. Объединенные экстракты высушивают над сульфатом магния. Тетрахлорметан упаривают. Осадок растворяют в 70 мл 1-пропанола. Кипятят раствор при перемешивании 15 минут. Отфильтровывают нерастворившийся осадок и сушат в вакууме при 200°C. Получают 4,5 г 4,4'-диаценафтена. Выход: 33%
Мольное соотношение галоген-аценафтена, галогенида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,04:0,3:3)
1Н ЯМР (CDCl3, δ, м.д.): 7.49-7.51 (d, 2Н); 7.39-7.41 (d, 2Н); 7.27-7.32 (m, 6Н); 3.50 (s, 8Н). Элементный CHNS-анализ (ЭА): Рассчитано для С24Н18: С, 94.08%; Н, 5.92%. Найдено: С, 94.05%; Н, 5.95%.
4,5 г (0,0147 моль) 4,4'-диааценафтена полностью растворяют в 300 мл ледяной уксусной кислоте при 100°C и перемешивании, затем прибавляют небольшими порциями 38,5 г (0,147 моль) бихромат натрия. Доводят смесь до кипения и кипятят 10 часов. Охлаждают до 100°C и выливают в стакан с 300 мл дистиллированной воды. Оставляют на 6 часов и затем отфильтровывают выпавший осадок, промывают несколько раз 30 мл холодной воды и сушат в вакууме при 100°C. Получают 3,7 г диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты Выход: 64%
Мольное соотношение 4,4'-диааценафтена и бихромата натрия составляет (1:10)
1Н ЯМР (DMSO d6, δ, м.д.): 8.70-8.72 (d, 2Н); 8.59-8.61 (d, 2Н); 7.98-8.00 (d, 2Н); 7.79-7.83(t, 2Н); 7.73-7.75 (d, 2Н). ЭА: Рассчитано для C24H10O6: С, 73.1%; Н, 2.56%. Найдено: С, 73.0%; Н, 2.70%.
Пример 4:
В колбу, снабженную магнитной мешалкой, баней с силиконовым маслом, капельной воронкой, обратным холодильником и вводом/выводом инертного газа помещают безводный бромид никеля (II) 3,94 г (0,018 моль), трифенилфосфин 23,6 г (0,09 моль), и предварительно активированный цинковый порошок 67 г (1,03 моль) и 300 мл сухого диметилацетамида. Смесь нагревают при перемешивании в токе аргона до 90°C выдерживают 30 мин. После этого медленно прибавляют раствор 5-бромаценафтена 60 г (0,258 моль) в 180 мл сухого диметиацетамида. Смесь выдерживают при 90°C в течение 12 часов. По окончании из реакционной смеси упаривают весь объем диметилацетамида и добавляют 500 мл хлористого метилена. Полученный раствор осторожно, при охлаждении перемешивании приливают к 800 мл 10% водного раствора HCl. По окончании выделения газов фильтруют смесь через слой кизельгура марки Celite, отделяют органический слой и экстрагируют водный слой 200 мл хлористого метилена. Объединенные экстракты высушивают над сульфатом магния. Хлористый метилен упаривают. Осадок растворяют в 70 мл метанола. Кипятят раствор при перемешивании 15 минут. Отфильтровывают нерастворившийся осадок, и сушат в вакууме при 150°C. Получают 23,7 г 4,4'-диаценафтена. Выход: 60%
Мольное соотношение галоген-аценафтена, галогенида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,07:0,35:4)
1Н ЯМР (CDCl3, δ, м.д.): 7.49-7.51 (d, 2Н); 7.39-7.41 (d, 2Н); 7.27-7.32 (m, 6Н); 3.50 (s, 8Н). Элементный CHNS-анализ (ЭА): Рассчитано для С24Н18: С, 94.08%; Н, 5.92%. Найдено: С, 94.0%; Н, 5.93%.
23,7 г (0,0775 моль) 4,4'-диааценафтена полностью растворяют в 1200 мл ледяной уксусной кислоте при 100°C и перемешивании, затем прибавляют небольшими порциями 243,5 г (0,929 моль) бихромата натрия. Доводят смесь до кипения и кипятят 12 часов. Охлаждают до 100°C и выливают в стакан с 1200 мл дистиллированной воды. Оставляют на 8 часов и затем отфильтровывают выпавший осадок, промывают несколько раз 50 мл холодной воды и сушат в вакууме при 100°C. Получают 22,9 г диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты Выход: 75%
Мольное соотношение 4,4'-диааценафтена и бихромата натрия составляет (1:12)
1Н ЯМР (DMSO d6, δ, м.д.): 8.70-8.72 (d, 2Н); 8.59-8.61 (d, 2Н); 7.98-8.00 (d, 2Н); 7.79-7.83(t, 2Н); 7.73-7.75 (d, 2Н). ЭА: Рассчитано для C24H10O6: С, 73.1%; Н, 2.56%. Найдено: С, 72.89%; Н, 2.68%.
Пример 5:
В колбу, снабженную магнитной мешалкой, баней с силиконовым маслом, капельной воронкой, обратным холодильником и вводом/выводом инертного газа помещают безводный бромид никеля (II) 3,94 г (0,018 моль), трифенилфосфин 27 г (0,103 моль), и предварительно активированный цинковый порошок 67 г (1,03 моль) и 300 мл сухого диметилацетамида. Смесь нагревают при перемешивании в токе аргона до 90°C выдерживают 30 мин. После этого медленно прибавляют раствор 5-бромаценафтена 60 г (0,258 моль) в 180 мл сухого диметиацетамида. Смесь выдерживают при 90°C в течение 12 часов. По окончании из реакционной смеси упаривают весь объем диметилацетамида и добавляют 500 мл хлористого метилена. Полученный раствор осторожно, при охлаждении перемешивании приливают к 800 мл 10% водного раствора HCl. По окончании выделения газов фильтруют смесь через слой кизельгура марки Celite, отделяют органический слой и экстрагируют водный слой 200 мл хлористого метилена. Объединенные экстракты высушивают над сульфатом магния. Хлористый метилен упаривают. Осадок растворяют в 70 мл метанола. Кипятят раствор при перемешивании 15 минут. Отфильтровывают нерастворившийся осадок и сушат в вакууме при 150°C. Получают 21,7 г 4,4'-диаценафтена. Выход: 55%
Мольное соотношение галоген-аценафтена, галогенида никеля, трифенилфосфина и цинкового порошка в способе-аналоге составляет (1:0,07:0,4:4)
1Н ЯМР (CDCl3, δ, м.д.): 7.49-7.51 (d, 2Н); 7.39-7.41 (d, 2Н); 7.27-7.32 (m, 6Н); 3.50 (s, 8Н). Элементный CHNS - анализ (ЭА): Рассчитано для С24Н18: С, 94.08%; Н, 5.92%. Найдено: С, 94.0%; Н, 5.93%.
23,7 г (0,0775 моль) 4,4'-диааценафтена полностью растворяют в 1200 мл ледяной уксусной кислоте при 100°C и перемешивании, затем прибавляют небольшими порциями 243,5 г (0,929 моль) бихромата натрия. Доводят смесь до кипения и кипятят 12 часов. Охлаждают до 110°C и выливают в стакан с 1200 мл дистиллированной воды. Оставляют на 10 часов и затем отфильтровывают выпавший осадок, промывают несколько раз 50 мл холодной воды и сушат в вакууме при 100°C. Получают 22,9 г диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты Выход: 75%
Мольное соотношение 4,4'-диааценафтена и бихромата натрия составляет (1:12)
1Н ЯМР (DMSO d6, δ, м.д.): 8.70-8.72 (d, 2Н); 8.59-8.61 (d, 2Н); 7.98-8.00 (d, 2Н); 7.79-7.83(t, 2Н); 7.73-7.75 (d, 2Н). ЭА: Рассчитано для С24Н10О6: С, 73.1%; Н, 2.56%. Найдено: С, 72.89%; Н, 2.68%.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ ДИАНГИДРИДОВ АРОМАТИЧЕСКИХ ТЕТРАКАРБОНОВЫХ КИСЛОТ | 2017 |
|
RU2682170C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИИМИДНЫХ СОПОЛИМЕРОВ, СОДЕРЖАЩИХ КРАУН-ЭФИРНЫЕ И ПОЛИСИЛОКСАНОВЫЕ ФРАГМЕНТЫ | 2016 |
|
RU2644152C1 |
| СПОСОБ ПОЛУЧЕНИЯ КУБОВЫХ КРАСИТЕЛЕЙ И ПИГМЕНТОВ, СОДЕРЖАЩИХ ПЕРИЛЕНОВЫЙ ФРАГМЕНТ | 1997 |
|
RU2128200C1 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАНГИДРИДА 3,3-БИС-(3,4-ДИКАРБОКСИФЕНИЛ)ФТАЛИДА | 2018 |
|
RU2698914C1 |
| Способ получения диангидрида 1,1-динафтил-4,4,5,5,8,8-гексакарбоновой кислоты | 1975 |
|
SU1109400A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИИМИДНОГО КОМПОЗИТНОГО ПЛЕНОЧНОГО ПОКРЫТИЯ, АРМИРОВАННОГО НАНОСТРУКТУРИРОВАННЫМ КАРБИДОМ КРЕМНИЯ (ВАРИАНТЫ) | 2015 |
|
RU2620122C2 |
| СПОСОБ ПОЛУЧЕНИЯ ГАЛОИДПРОИЗВОДПЫХ АЦЕНАФТЕНХИПОНОВ | 1973 |
|
SU406827A1 |
| Способ получения диангидрида 2,3,7,8-тетракарбокси | 1971 |
|
SU418037A1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИИМИДНОГО КОМПОЗИТНОГО ВОЛОКНА НА УГЛЕРОДНОЙ ОСНОВЕ, АРМИРОВАННОГО НАНОСТРУКТУРИРОВАННЫМ КАРБИДОМ КРЕМНИЯ | 2016 |
|
RU2644906C2 |
| БИС-(3-АМИНО-5-ФЕНОКСИ)ФЕНИЛОВЫЙ ЭФИР ГИДРОХИНОНА И ПОЛИИМИДЫ НА ЕГО ОСНОВЕ ДЛЯ ТЕРМОСТОЙКИХ МАТЕРИАЛОВ | 1994 |
|
RU2072350C1 |
Изобретение относится к способу получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, который может быть использован для получения полиимидных материалов, используемых при изготовлении мембран топливных элементов, твердополимерных электролитов. Способ получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты осуществляется с использованием в качестве исходного соединения 5-галогенаценафтена, который подвергают реакции конденсации, проводимой в органическом амидном растворителе в атмосфере инертного газа в присутствии каталитической смеси, содержащей безводный галогенид никеля (II), цинковый порошок и трифенилфосфин, после чего получаемый 4,4'-диаценафтен окисляют бихроматом натрия в ледяной уксусной кислоте и выделяют образовавшийся диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, где реакция конденсации осуществляется с использованием 5-галогенаценафтена, выбранного из группы следующих соединений: 5-бромаценафтен, 5-иодаценафтен и 5-хлораценафтен, и проводится в присутствии каталитической смеси, содержащей 0,2-0,4 моля галогенида никеля(II), 0,2-0,4 моля трифенилфосфина, 2-4 моля активированного цинкового порошка в расчете на 1 моль галогенаценафтена и предварительно нагретой при перемешивании в токе инертного газа до 80-100°С в течение 10-40 минут, после чего к ней добавляют раствор галоаценафтена в органическом сухом амидном растворителе, реакционную смесь выдерживают при 80-100°С в течение 6-12 часов, упаривают досуха, добавляют низкокипящий хлорсодержащий органический растворитель и полученный раствор подкисляют соляной кислотой, фильтруют, органический фильтрат высушивают, упаривают хлорсодержащий растворитель, осадок растворяют в одноатомном спирте, кипятят при перемешивании и выделенный фильтрацией 4,4'-диаценафтен сушат в вакууме при 150-200°С, после чего его растворяют при перемешивании в ледяной уксусной кислоте и к нему прикапывают бихромат натрия из расчета 8-12 моль бихромата на 1 моль полученного 4,4'-диаценафтена, затем реакционную массу кипятят 8-12 часов, охлаждают до 100-110°С, выливают в дистиллированную воду и выдерживают в ней 4-10 часов, отфильтровывают выпавший осадок целевого продукта, промывают его холодной водой и сушат в вакууме. Максимальный выход целевого продукта 75%. 4 з.п. ф-лы, 5 пр.
1. Способ получения диангидрида 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, осуществляемый с использованием в качестве исходного соединения 5-галогенаценафтена, который подвергают реакции конденсации, проводимой в органическом амидном растворителе в атмосфере инертного газа в присутствии каталитической смеси, содержащей безводный галогенид никеля (II), цинковый порошок и трифенилфосфин, после чего получаемый 4,4'-диаценафтен окисляют бихроматом натрия в ледяной уксусной кислоте и выделяют образовавшийся диангидрид 4,4'-бинафтил-1,1',8,8'-тетракарбоновой кислоты, отличающийся тем, что реакция конденсации осуществляется с использованием 5-галогенаценафтена, выбранного из группы следующих соединений: 5-бромаценафтен, 5-иодаценафтен и 5-хлораценафтен, и проводится в присутствии каталитической смеси, содержащей 0,2-0,4 моля галогенида никеля(II), 0,2-0,4 моля трифенилфосфина, 2-4 моля активированного цинкового порошка в расчете на 1 моль галогенаценафтена и предварительно нагретой при перемешивании в токе инертного газа до 80-100°С в течение 10-40 минут, после чего к ней добавляют раствор галоаценафтена в органическом сухом амидном растворителе, реакционную смесь выдерживают при 80-100°С в течение 6-12 часов, упаривают досуха, добавляют низкокипящий хлорсодержащий органический растворитель и полученный раствор подкисляют соляной кислотой, фильтруют, органический фильтрат высушивают, упаривают хлорсодержащий растворитель, осадок растворяют в одноатомном спирте, кипятят при перемешивании и выделенный фильтрацией 4,4'-диаценафтен сушат в вакууме при 150-200°С, после чего его растворяют при перемешивании в ледяной уксусной кислоте и к нему прикапывают бихромат натрия из расчета 8-12 моль бихромата на 1 моль полученного 4,4'-диаценафтена, затем реакционную массу кипятят 8-12 часов, охлаждают до 100-110°С, выливают в дистиллированную воду и выдерживают в ней 4-10 часов, отфильтровывают выпавший осадок целевого продукта, промывают его холодной водой и сушат в вакууме.
2. Способ по п. 1, в котором в качестве катализаторов используются галогениды никеля (II), выбранные из группы следующих соединений: хлорид никеля (II), бромид никеля (II), иодид никеля (II).
3. Способ по п. 1, отличающийся тем, что в качестве органических амидных растворителей используются соединения, выбранные из группы: формамид, ацетамид, диметилформамид, диметилацетамид.
4. Способ по п. 1, отличающийся тем, что в качестве органических низкокипящих хлорсодержащих органических растворителей используются растворители, выбранные из группы: хлористый метилен, хлороформ, тетрахлорметан.
5. Способ по п. 1, отличающийся тем, что на стадии выделения промежуточного 4,4'-диаценафтена используются одноатомные спирты, выбранные из группы: метанол, этанол, 1-пропанол.
| Sun F | |||
| et a | |||
| "Synthesis and characterization of sulfonated polyimides bearing sulfonated aromatic pendant group for DMFC applications" Polymer, 2010, 51, 17, р | |||
| ПРИСПОСОБЛЕНИЕ К СТАНКУ ДЛЯ НАНЕСЕНИЯ ДЕЛЕНИЙ НА ЛИНЕЙКАХ, ШКАЛАХ И Т. П. | 1925 |
|
SU3887A1 |
| ЖАРИНОВА МАРИНА Юрьевна "СИНТЕЗ И СВОЙСТВА НОВЫХ СУЛЬФИРОВАННЫХ ПОЛИНАФТОИЛЕНИМИДОВ И ПОЛИТРИАЗОЛОВ ДЛЯ ПРОТОНПРОВОДЯЩИХ МЕМБРАН НИЗКОТЕМПЕРАТУРНЫХ ТОПЛИВНЫХ ЭЛЕМЕНТОВ" ДИССЕРТАЦИЯ на соискание ученой степени кандидата химических наук, Москва, 2017 | |||
| Liu L | |||
| et al | |||
| "The effect of the regioisomeric naphthalimide acetylide ligands on the photophysical properties of N,N Pt(II) bisacetylide complexes" Dalton Trans., 2014, 43, р.13434-13444. | |||
Авторы
Даты
2018-11-02—Публикация
2017-12-22—Подача