РОДСТВЕННЫЕ ЗАЯВКИ И ВКЛЮЧЕНИЕ ПОСРЕДСТВОМ ССЫЛКИ
По этой заявке испрашивается приоритет по временным заявками на патенты США с серийными номерами 61/708763 и 61/792382, поданными 2 октября 2012 года и 15 марта 2013 года, соответственно, и озаглавленными «CLAY-CONTAINING COMPOSITION THAT ALLEVIATES EFFECTS OF BACTERIAL EXOTOXIN-ASSOCIATED DISEASE» и «CLAY, A YEAST PRODUCT AND GLUTAMATE BLENDED PRODUCT AND USES THEREOF» соответственно.
Вышеупомянутые заявки и все документы, цитируемые здесь или во время их рассмотрения («appln cited documents», «цитируемые документы заявки»), и все документы, цитируемые или упоминаемые в цитируемых документах заявки («цитируемые здесь документы»), и все документы, цитируемые или упоминаемые в цитируемых здесь документах, вместе с любыми инструкциями производителя, описаниями, описаниями продукта и описаниями продукта для любых продуктов, упомянутых здесь или в любом документе, включенном здесь посредством ссылки, включены в настоящее описание посредством ссылки и могут применяться в практике изобретения. Более конкретно, все упоминаемые документы включены посредством ссылки в том же объеме, как если бы включение каждого отдельного документа конкретно и отдельно показано посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Заявка относится к смеси глины, дрожжевого продукта и опционально глутамата и к их применениям, в частности для снижения эффектов кишечного заболевания.
УРОВЕНЬ ТЕХНИКИ, К КОТОРОМУ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Клостридии представляют собой вид бактерий, которые секретируют токсины, вызывающие заболевания у домашних птиц, животных и людей. Анаэробные бактериальные патогены представляют собой серьезное экономическое бремя в сельском хозяйстве. Бактерии семейства Клостридий представляют отдельное бремя, поскольку эти бактерии вызывают серьезные заболевания у домашних птиц и других экономически ценных домашних животных. Предыдущие усилия по контролю этих организмов были направлены на санитарные меры и введение антибиотиков в корм для животных.
Некротический энтерит (NE) является наиболее распространенным и финансово опустошающим бактериальным заболеванием у современного бройлерного стада. Оно представляет собой инфекционное заболевание, вызываемое Clostridium perfringens, которая является грам-положительной анаэробной бактерией, которую можно обнаружить в почве, мусоре, грязи и в низких уровнях в кишечнике здоровых птиц. Clostridium perfringens вызывает NE только, когда она превращается из непродуцирующего токсин типа в токсинпродуцирующий тип.
Существует пять типов Clostridium perfringens (А, В, С, D и Е), которые продуцируют ряд токсинов (альфа, бета, ипсилон, йота и CPE). α-токсин, фермент (фосфатолипаза С) считается ключевым в развитии NE. Тем не менее, недавнее исследование показывает, что культура, которая не продуцирует α-токсин, все еще может вызывать заболевание. В дополнение, недавно в культуре Clostridium perfringens обнаружен новый токсин, называемый NetB. Кишечник инфицированных птиц является хрупким, растянутым газом и с обширными повреждениями, вызываемыми токсинами. При острой форме NE птицы часто умирают до появления клинических симптомов. Тем не менее, в своей субклинической форме заболевание является гораздо более вредящим финансам производителя. Часто наблюдаемые симптомы заболевания варьируются в зависимости от возраста птицы.
В данной области техники сохраняется необходимость в безопасном, экономном и эффективном способе защиты интенсивно культивируемых домашних животных, включая птичьих, таких как цыплят, от инфекции, вызываемой видами Клостридий. Вызываемые Клостридиями заболевания также являются причиной страданий человека и экономических потерь в животноводстве. Эффективная по затратам манера вмешиваться в эти заболевания поможет системам управления течением заболевания.
Цитирование и идентификация любого документа в этой заявке не является признанием того, что этот документ доступен в качестве известного уровня техники настоящего изобретения.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антитоксину, иммуномодулятору, соединению, которое обеспечивает энергией клетки слизистой оболочки, или к комбинации, которые могут быть полезными в снижении эффектов заболеваний, вызываемых видами Клостридий и кокцидий, или других кишечных заболеваний, или для улучшения здоровья или функции желудочно-кишечного тракта в целом.
Заявители показывают in vitro, что конкретная глина может абсорбировать токсины Clostridium difficile и Clostridium perfringens. Заявители показывают in vivo, что конкретная глина или составы глины могут облегчать некротический энтерит у цыплят, заболевание, связанное с Clostridium perfringens. Заявители находят, что глины или составы глины могут связывать клостридиальные токсины in vitro, и что глина или составы глины могут облегчать заболевание, вызываемое Clostridium perfringens, и подобные другие вызываемые клостридиями заболевания.
Заявители также обнаруживают, что глина может абсорбировать экзотоксин, продуцируемый Clostridium difficile и Clostridium perfringens. Обнаружено, что смесь, которая представляет собой комбинацию глины, дрожжевого продукта и формы функциональной аминокислоты, помогает снизить эффекты Некротического Энтерита у бройлеров при применении модели заражения, которая включает C. perfringens и кокцидию (Eimeria maxima).
Настоящее изобретение относится к антитоксину, иммуномодулятору и компоненту, которые обеспечивает энергией клетки слизистой оболочки, или к их комбинации. Преимущественно антитоксин может представлять собой глину, иммуномодулятор может представлять собой дрожжевой продукт, и компонент, который предоставляет энергию клеткам, может представлять собой функциональную аминокислоту, такую как глутамат. В конкретном предпочтительном варианте осуществления глина может представлять собой кальциевую монтмориллонитовую глину, дрожжевой продукт может представлять собой дрожжевой продукт Pichia guilliermondii, и функциональная аминокислота может представлять собой глутамат натрия («MSG»). В другом предпочтительном варианте осуществления смесь может включать приблизительно от 50 до 90% (мас./об.) антитоксина, приблизительно от 10 до 50% (мас./об.) иммуномодулятора, который может представлять собой дрожжевой продукт, и приблизительно от 0,01 до 15% (мас./об.) глутамата.
В конкретном предпочтительном варианте осуществления композиция или смесь может содержать по меньшей мере 80% (мас./об.) глины, приблизительно 10% (мас./об.) дрожжевого продукта и приблизительно 10% (мас./об.) глутамата или 60% (мас./об.) глины, приблизительно 35% (мас./об.) дрожжевого продукта и приблизительно от 5% (мас./об.) до 10% (мас./об.) глутамата.
Настоящее изобретение также включает раскрытые здесь композиции и/или смеси, применяемые как обогащение пищи. В одном варианте осуществления добавка может составлять приблизительно от 0,05% (мас./об.) до приблизительно 0,35% (мас./об.) корма, приблизительно от 0,15% (мас./об.) до приблизительно 0,25% (мас./об.) корма или приблизительно 0,25% (мас./об.) корма.
Соответственно, целью изобретения является не включение в изобретение любого известного ранее продукта, способа получения продукта или способа применения продукта, так что Заявители сохраняют за собой право и раскрывают здесь отказ от любого известного ранее продукта, процесса или способа. Дополнительно следует отметить, что изобретение включает в объем изобретения любой продукт, способ получения продукта или способ применения продукта, которые не соответствует письменному описанию и реализации требований USPTO (35 U.S.C. §112, первый пункт) или EPO (Статья 83 EPC), так что Заявители сохраняют за собой право и раскрывают здесь отказ от любого описанного ранее продукта, процесса изготовления продукта или способа применения продукта.
Следует отметить, что в этом раскрытии и в частности в формуле изобретения и/или пунктах, такие термины, как «включает», «включал», «включающий» и им подобные имеют значение, приписываемое им Патентным правом США, например, они могут обозначать «включает», «включал», «включающий» и им подобное; и что термины, такие как «в основном состоящий из» и «состоит в основном из» имеют значение, приписываемое им Патентным правом США, например, они предусматривают элементы, не перечисленные открыто, но исключают элементы, которые обнаружены в предшествующем уровне техники или которые влияют на основные или новые характеристики изобретения.
Эти и другие варианты осуществления раскрыты или являются очевидными из и включенными в следующее подробное описание.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Следующее подробное описание, данное в форме примера, но без намерения ограничивать изобретение только конкретными описанными вариантами осуществления, можно лучшим образом понять вместе с сопровождающими чертежами.
ФИГ. 1 отображает схематический план экспериментального дизайна.
ФИГ. 2 отображает сравнение наборов веса тел цыплят-бройлеров, которых кормят брендированными продуктами Oil-Dri Corporation of American’s Amlan International («Amlan»), такими как 100% глиняный продукт, (B), глиняный продукт в смеси с органической кислотой и растительным экстрактом (Y), смесь глины и дрожжевого продукта (С), смесь глины, дрожжевого продукта и глутамата натрия (D) по сравнению с антибиотиком виргиниамицином (VM), и которых заражают Clostridium perfringens (CP) для индуцирования некротического энтерита. Вес тел определяют со дня инфицирования E. maxima до 2 дня после СР инфекции. Птиц инфицируют 10000 спорулирующих ооцист E. maxima на 14 день после вылупливания. Через 4 дня после инфицирования E. maxima птиц за исключением находящихся в Контроле лечения инокулируют 1×109 КОЕ СР.
ФИГ. 3 отображает сравнение наборов веса тел цыплят-бройлеров, которых кормят продуктами Amlan, такими как B, Y, C, D, и сравнивают с антибиотиком VM. Наборы веса тела определяют со дня инфицирования CP до 7 дня после инфицирования СР. Птиц инфицируют 10 000 спорулирующих ооцист E. maxima на 14 день после вылупливания. Через 4 дня после инфицирования E. maxima птиц инокулируют 1×109 КОЕ СР.
ФИГ. 4 отображает эффект питательных продуктов Amlan на величины повреждения кишечника.
ФИГ. 5А отображает ответ антител сыворотки на антиген α-токсин на 7 день после инфицирования Clostridium perfringens.
ФИГ. 5В отображает ответ антител сыворотки на антиген α-токсин на 14 день после инфицирования C. perfringens.
ФИГ. 6А отображает ответ антител сыворотки на антиген NetB токсин на 7 день после инфицирования C. perfringens.
ФИГ. 6B отображает ответ антител сыворотки на антиген NetB токсин на 14 день после инфицирования C. perfringens.
ФИГ. 7А отображает эффект обогащения пищи при помощи продуктов Amlan на сывороточный токсин. Сыворотки собирают на 2 день после инфицирования C. perfringens и применяют для измерения уровней α-токсина при помощи ELISA.
ФИГ. 7В отображает эффект обогащения пищи при помощи продуктов Amlan на сывороточный токсин. Сыворотки собирают на 2 день после инфицирования C. perfringens и применяют для измерения уровней NetB токсина при помощи ELISA.
ФИГ 8А отображает сравнение трансформации корма с 0 по 21 день во втором эксперименте in vivo. В этом эксперименте цыплят-бройлеров за исключением тех, которые не инфицированы (без NE), заражают для индуцирования некротического энтерита, и они не получают продукт (NE), получают смесь глины, дрожжевого продукта и глутамата натрия, как в предыдущем эксперименте (D), глину, дрожжевой продукт и глутамат натрия с различными уровнями включения (D8) и те два состава с применением различных дрожжевых продуктов (DX и D8X), и эти продукты сравнивают с антибиотиком виргиниамицином (VM). В этом эксперименте на 14 день бройлеров перорально заражают приблизительно 5000 ооцист E. maxima (штамм кокцидия), на 19, 20 и 21 день им дают бульонную культуру C. perfringens 108 КОЕ/мл, культивированную из клинического случая некротического энтерита, которая продуцирует как альфа, так и NetB B токсины (за исключением незараженного контроля лечения (без NE)). Эксперимент длится 28 дней. В целом, трансформация корма для птиц, которых кормят различными продуктами Amlan, является промежуточной между теми с NE и находящимися на лечении VM с 0 по 21 день. Тем не менее, птицы, которых кормят продуктом D8X, не следуют этой схеме, и имеют плохую трансформацию корма, статистически и количественно, как и те, которые находятся на лечении NE без какого-либо продукта в этом периоде времени.
ФИГ. 8В отображает трансформацию корма с 14 по 21 день. Трансформация корма для зараженных птиц, которые получают Лечение DX, значительно лучше, чем у птиц, получающих лечение NE (зараженные, но не получающие продукт), в период времени с 14 по 21 день, и является статистически равной питанию с добавлением VM.
ФИГ. 8С отображает трансформацию корма с 0 по 28 день. Все продукты за исключением D8X значительно лучше, чем NE без продукта. Продукты D и DX являются лучшими из тестируемых продуктов, сходными с птицами, получающими лечение VM, и не отличаются статистически от птиц, которые не участвуют в заражении NE.
ФИГ. 9А отображает набор веса с 0 по 28 день. Набор улучшается при помощи VM по сравнению с NE контролем без какого-либо продукта. D8 статистически равен и является количественно лучшим по сравнению с VM. Все другие продукты являются промежуточными между NE без продукта и VM.
ФИГ. 9В отображает набор веса с 14 по 28 день. Набор имеет сходный характер для 14-28 дней, как и для 0-28 дней за исключением того, что D8 количественно равен VM.
ФИГ. 10 отображает величины повреждения. Величины повреждения для птиц, которых кормят D8 и D8X, ниже, чем для птиц, которых кормят VM, и могут не отличаться статистически от птиц, которых не заражают NE.
ФИГ. 11 отображает смертность от NE. Все продукты за исключением D снижают Смертность по сравнению с зараженными NE птицами, которые не получают продукт, и равны смертности тех, которых кормят VM.
ФИГ. 12А отображает сравнение наборов веса тела цыплят-бройлеров в третьем исследовании in vivo, определяемом со дня инфицирования Eimeria maxima до 2 дней после инфицирования C. perfringens. Птиц инфицируют 10 000 спорулирующих ооцист E. maxima на 14 день после вылупливания. Через 4 дня после инфицирования E. maxima птиц инокулируют 1×109 КОЕ C. perfringens. В этом эксперименте присутствует незараженный контроль (Конт), группа, инфицированная для индуцирования некротического энтерита, но не получающая продукт (NE), состав продукта D с включением 0,35, 0,25, 0,15 и 0,05% (D35, D25, D15 и D05) также включает продукты, которые сочетают ингредиенты в различных соотношениях (DS, DSF, D8 D8F), и конечная группа, получающая 20 г/тонну виргиниамицина в питании (VM).
ФИГ. 12В отображает сравнение процента повышения набора веса тела относительно птиц контроля заражения некротическим энтеритом, не получающих продукт. NE представляет собой группу, инфицированную для индуцирования некротического энтерита, но не получающую никакой продукт; VM представляет собой группу, которая получает 20 г/тонну виргиниамицина в питании.
ФИГ. 13А отображает сравнение наборов веса тела цыплят-бройлеров. Наборы веса тела определяют, начиная со дня инфицирования C. perfringens и заканчивая 7 днем после инфицирования C. perfringens.
ФИГ. 13В отображает сравнение процента повышения набора веса тела относительно инфицированного контроля некротического энтерита без какого-либо продукта.
ФИГ. 14 отображает эффект Продуктов на величины повреждений кишечника, величины представляют среднее из 5 птиц в группе, исследуемых на 2 день после инфицирования C. perfringens.
ФИГ. 15А отображает ответ антител сыворотки на α-токсин антиген на 2 день после инфицирования C. perfringens.
ФИГ. 15В отображает ответ антител сыворотки на α-токсин антиген на 7 день после инфицирования C. Perfringens.
ФИГ. 16А отображает ответ антител сыворотки на NetB токсин антиген на 2 день после инфицирования C. perfringens.
ФИГ. 16B отображает ответ антител сыворотки на NetB токсин антиген на 7 день после инфицирования C. perfringens.
ФИГ. 17А отображает эффект обогащения пищи на уровни α-токсин сыворотки. Сыворотку собирают на 2 день после инфицирования C. perfringens и используют для определения уровней α-токсина при помощи иммуноферментного анализа (ELISA).
ФИГ. 17В отображает эффект обогащения пищи на уровни NetB-токсина сыворотки. Сыворотки собирают на 2 день после инфицирования C. perfringens и используют для определения уровней NetB-токсина при помощи иммуноферментного анализа (ELISA).
ФИГ. 18А-В отображают продукцию цитокинов в интраэпителиальных лимфоцитах тощей кишки на 2 день после инфицирования C. perfringens.
ФИГ. 18С-D отображают продукцию цитокинов в интраэпителиальных лимфоцитах тощей кишки птиц на 2 день после инфицирования C. perfringens.
ФИГ. 19А-C отображают продукцию цитокинов в селезенке птиц на 2 день после инфицирования C. perfringens.
ФИГ. 19D-F отображают продукцию цитокинов в селезенке птиц на 2 день после инфицирования C. perfringens.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к антитоксину, иммуномодулятору, соединению, которое обеспечивает энергией клетки слизистой оболочки, или к их комбинации, которые могут быть полезными для снижения эффектов Клостридиального заболевания.
Клостридии представляют собой вид бактерий, которые секретируют токсины, вызывающие заболевания у домашних птиц, животных и людей. Заявители исследовали два вида Клостридий, Clostridium difficile и Clostridium perfringens, и обнаружили, что глина может абсорбировать экзотоксин, производимый обоими видами. Заболевания, вызываемые C. difficile, распространены у людей и свиней, а заболевания, вызываемые C. perfringens, распространены у крупного рогатого скота и особенно выделяются у цыплят и известны как Некротический Энтерит (NE). Исследовали смесь, которая представляет собой комбинацию глины, дрожжевого продукта и формы функциональной аминокислоты и обнаружили, что она помогает снизить эффекты Некротического Энтерита у бройлеров при применении модели заражения, включающей C. perfringens и кокцидиоз (Eimeria maxima).
Ранее сообщалось, что высокие концентрации пищевых волокон или питание цельными зерновыми, питание, богатое сырым протеином, особенно с высокими концентрациями животного протеина или рыбной муки, или высокими концентрациями аминокислот глицина или метионина, повышают риск высоких уровней бактерий C. perfringens и, таким образом, повышают вероятность некротического энтерита (Williams, R.B. 2005 Intercurrent coccidiosis and necrotic enteritis of chickens: rational, integrated disease management by maintenance of gut integrity. Avian Path. 34:159-180). В исследовании Заявителей продукты, которые находятся в смеси глины, комплекса сниженного источника углерода и органической кислоты, или представляют собой органическую глину, не улучшают характеристики бройлеров по сравнению с одной глиной при заражении для индуцирования некротического энтерита.
Заявители провели несколько экспериментов in vivo, исследуя продукты для помощи в улучшении некротического энтерита. Заявители наблюдают за эффектами шести различных продуктов по сравнению с отсутствием продукта или с виргиниамицином. В одном эксперименте после инфицирования птиц Clostridium perfringens все продукты снижают уровни повреждения по сравнению с птицами, инфицированными C. perfringens и не получающими ни одного продукта. Один продукт (Y) равен виргиниамицину, и два продукта (СС, В) не отличаются от виргиниамицина значительно. При сравнении смертности птиц, зараженных C. perfringens, только виргиниамицин оказывается значительно лучше, чем отсутствие продукта, но СС продукт не отличается от виргиниамицина значительно. При наблюдении за трансформацией корма (корм:набор) с 14 по 28 день (период времени, на который в основном влияет инфицирование C. perfringens), оцениваемые два продукта (BFA, BT) количественно ухудшают трансформацию корма по сравнению с зараженными птицами без продукта, в то время как оставшиеся продукты количественно не значительно хуже, чем виргиниамицин. По набору веса с 14 по 28 день только птицы, получающие В, имеют значительно больший набор веса по сравнению с птицами, не получающими продукт. Поскольку не существует продукта, который бы был существенно лучшим по критериям ответа в этом эксперименте, продукты упорядочены по тому, как они демонстрируют основные критерии ответа (Таблица А). Это расстановка на основании расстановки в каждом из четырех критериев ответа: 1) набор веса 14-28 день; 2) трансформация корма 14-28 день; 3) величина повреждения; и 4) смертность от некротического энтерита. Не предпринимается попытка придать значение одному критерию ответа в большей степени, чем другому, или любая попытка статистического анализа в этой расстановке.
Простая расстановка лечений на основании уровня повреждений, смертности от некротического энтерита, набора веса с 14 по 28 день и соотношения трансформации корма у птиц, инфицированных Clostridium perfringens
На основании результатов этой и предыдущей работы in vitro и in vivo заявители считают, что продукты на основе глины могут помочь снизить эффекты некротического энтерита у домашних птиц, но не имеют конкретного продукта, который бы был очевидно лучше остальных. Такой вывод сделан после другого исследования in vivo. В этом исследовании продукты CA, BT и BFA больше не применяют из-за их позиции. Поскольку позиция В выше, чем у СА, смесь CC заменяют для применения В, и соотношение смеси изменяют для следующего эксперимента (новый продукт С).
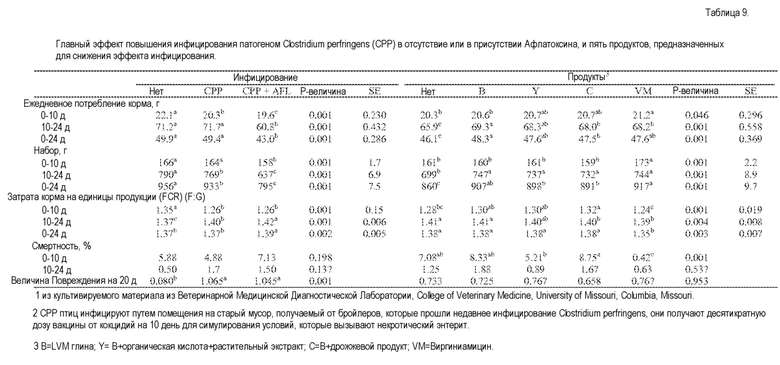
Проводят следующий эксперимент для присмотра за птицами, зараженными C. perfringens или C. perfringens + афлатоксин. Тремя тестируемыми продуктами являются B, Y или С. Три тестируемых продукта облегчают заболевание. Это в основном выражается в наборе веса во время периода заражения с 10 по 24 день у птиц, которые инфицированы C. perfringens, поскольку продукты B, Y или виргиниамицина улучшают набор по сравнению с диетой без продукта, где Y статистически равен кормлению виргиниамицином. С этим заражением отсутствуют значительные различия для корма: соотношение набора между продуктами за исключением виргиниамицина. Когда заражение некротическим энтеритом объединяют с инфицированием афлатоксином (1 м.д.), наблюдают больше эффектов от продуктов. Для набора веса в течение периода инфицирования (14-24 день) птицы, которых кормят любым продуктом, имеют более высокий набор веса, чем те, которые не получают продукт. Кормление В оказывает наибольший эффект на набор, значительно более высокий, чем у других продуктов, включая виргиниамицин. Соотношение корм:набор также лучше для птиц, которых кормят продуктом В или С, чем у тех, когда не кормят продуктом (Таблица В).
Настоящее изобретение также включает антитоксины, дрожжи, дрожжевые продукты или дрожжеподобные продукты и MSG-подобные материалы в дополнение к предпочтительным вариантам осуществления, раскрытым здесь. Другие материалы, которые считаются антитоксинами, также могут включать другие глины и материалы, дрожжи и дрожжевые продукты или дрожжевые компоненты или дрожжеподобные продукты, такие как другие источники волокон, бета-глюканы или ферменты.
Как применяют здесь, глина может относиться к любым типам глины, таким как силикаты. Силикаты могут включать филлосиликаты, незосиликаты, циклосиликаты, соросиликаты, иносиликаты и тектосиликаты. Филлосиликаты могут включать слюду, хлориты, каолиниты, смектиты (бентонитовая глина), гормиты, тальки и серпентиниты. Тектосиликаты могут включать кварц, зеолиты и полевой шпат.
В предпочтительном варианте осуществления глина представляет собой смектит (бентонитовую глину). Смектиты включают, но не ограничиваются триокстаэдрическими смектитами и диоктаэдрическими смектитами. Триоктаэдрические смектиты включают, но не ограничивают сапонитом, гекторитом, стевенситом и сауконитом. Диоктаэдрические смектиты включают, но не ограничиваются монтмориллонитом, бейделлитом и нонтронитом. Монтмориллонит включает, но не ограничивается монтмориллонитом натрия и монтмориллонитом кальция.
Как применяют здесь, дрожжи могут относиться к дрожжам (таким, как Ascomycota и Basidiomycota), фрагментам дрожжей, дрожжевым продуктам и дрожжеподобным продуктам. В частности, термин дрожжи включает не только дрожжи (такие, как Ascomycota и Basidiomycota), фрагменты дрожжей, дрожжевые продукты и дрожжеподобные продукты, но также все, что может действовать, как дрожжи. Как применяют здесь, дрожжи могут относиться также к источникам дрожжевых продуктов или продуктам дрожжевого брожения и, дрожжевой камеди или цельным дрожжам или компонентам клетки дрожжей (таким, как клеточная стенка дрожжей, но не ограничиваясь ей) или их смесям или дрожжам или компонентам дрожжей других видов дрожжей.
В предпочтительном варианте осуществления бета-глюкан может представлять собой бета-1,3-глюкан. В другом предпочтительном варианте осуществления бета-глюкан может представлять собой бактериальный бета-глюкан или бактериальный бета-1,3-глюкан.
Другие иммуномодуляторы могут также включать дрожжи или дрожжевые продукты или дрожжевые компоненты, или другие волокна, иммуноглобулины или источники иммуноглобулинов, хитины или кортикостероиды. Другие источники энергии для слизистой оболочки кишечника могут также включать функциональные протеины, глутаминовую кислоту, треонин или источники функциональных протеинов, такие как плазма, или функциональные пептиды. Как применяют здесь, пептиды могут представлять собой короткие цепочки аминокислот, такие как 2-4 молекулы глутамата, или комбинации аминокислот с глутаматом или без него.
Настоящее изобретение также включает добавление тепла для глины между 300 и 800 градусами Цельсия вплоть до одного часа.
Настоящее изобретение также включает нагревание глины, поскольку оно может повлиять на эффективность глины. Это можно выполнить как статично при помощи муфельной печи, так и динамично в ротационной сушильной печи или кольцевой сушилке.
Предпочтительный вариант осуществления этого продукта может включать приблизительно от 50 до 90% (мас./об.) антитоксина, такого как глина, приблизительно от 5 до 50% (мас./об.) иммуномодулятора, который может представлять собой дрожжевой продукт, и приблизительно от 0,01 до 15% (мас./об.) глутамата. В особенно предпочтительном варианте осуществления продукт может содержать приблизительно 80% (мас./об.) антитоксина, такого как глина, приблизительно 10% (мас./об.) иммуномодулятора, который может представлять собой дрожжевой продукт, и приблизительно 10% (мас./об.) глутамата.
Антитоксин может представлять собой глину монтмориллонита кальция, преимущественно нагреваемую до температуры между 100 и 800 градусами Цельсия, преимущественно между 400 и 800 градусами Цельсия, для снижения влажности и измельчения до тонкодисперсного размера частиц. Этот процесс нагревания между 100 и 800 градусами Цельсия и/или мелкодисперсного измельчения (со средним размером частиц приблизительно равным между 20 и 50 микрон) демонстрирует увеличение способности связывать токсин глиной на множестве токсинов. Дрожжевой продукт может представлять собой дрожжевой продукт Pichia guilliermondii или Saccharomyces cerevisiae или продукт из другого вида дрожжей. Глутамат натрия представляет собой форму аминокислоты глутамата.
В предпочтительном варианте осуществления смесь может включать приблизительно 80% (мас./об.) глины, от приблизительно 30% (мас./об.) до приблизительно 35% (мас./об.) дрожжевого продукта и от приблизительно 5% (мас./об.) до приблизительно 10% (мас./об.) глутамата.
В конкретном предпочтительном варианте осуществления глина может представлять собой монтмориллонитовую глину, предпочтительно высоко очищенную монтмориллонитовую сорбирующую глину, и более предпочтительно Calibrin®-Z. В другом конкретном предпочтительном варианте осуществления дрожжевой продукт может быть предпочтительно продуктом дрожжевой камеди. В другом конкретном варианте осуществления глутамат представляет собой глутамат натрия.
В конкретном предпочтительном варианте осуществления смесь может включать приблизительно 60% (мас./об.), приблизительно 30% (мас./об.) дрожжевого продукта и приблизительно 10% (мас./об.) глутамата или 60% (мас./об.) глины, приблизительно 35% (мас./об.) дрожжевого продукта и приблизительно от 5% (мас./об.) до приблизительно 10% (мас./об.) глутамата.
В конкретном предпочтительном варианте осуществления глина может представлять собой монтмориллонитовую глину, предпочтительно высоко очищенную монтмориллонитовую сорбирующую глину, и более предпочтительно Calibrin®-Z. В другом конкретном предпочтительном варианте осуществления дрожжевой продукт может быть продуктом дрожжевой камеди, включая продукты камеди Pichia guilliermondii или дрожжевые продукты Saccharomyces cerevisiae. В другом конкретном варианте осуществления глутамат представляет собой глутамат натрия.
Настоящее изобретение также включает раскрытые здесь смеси, применяемые для обогащения пищи. В одном варианте осуществления добавка может составлять от приблизительно 0,05% (мас./об.) до приблизительно 0,35% (мас./об.) корма, от приблизительно 0,15% (мас./об.) до приблизительно 0,25% (мас./об.) корма или приблизительно 0,25% (мас./об.) корма.
В дополнение к предпочтительному варианту осуществления другие материалы, способные связывать токсины, можно заменить на продукты Amlan, такие, как другие глины или сорбирующие материалы, диатомиты, силикаты, зеолиты, аттапульгиты, гормиты, или эти материалы или комбинации этих материалов (включая основной материал для продуктов Amlan), производимые при помощи других процессов (включая увеличение или снижение температуры высушивания или времени или конечного содержания влаги, кальцинированных материалов или материалов, измельченных до большего или меньшего размера частиц), можно применять с оговоркой, что может потребоваться больше не-Amlan продуктов и/или что не-Amlan продукт может привести к меньшей эффективности.
Глину можно нагревать до приблизительно 100°С, приблизительно 125°С, приблизительно 150°С, приблизительно 175°С, приблизительно 200°С, приблизительно 225°С, приблизительно 250°С, приблизительно 275°С, приблизительно 300°С, приблизительно 325°С, приблизительно 350°С, приблизительно 375°С, приблизительно 400°С, приблизительно 425°С, приблизительно 450°С, приблизительно 475°С, приблизительно 500°С, приблизительно 525°С, приблизительно 550°С, приблизительно 600°С, приблизительно 625°С, приблизительно 650°С, приблизительно 675°С, приблизительно 700°С, приблизительно 725°С, приблизительно 750°С, приблизительно 775°С, приблизительно 800°С, приблизительно 825°С, приблизительно 850°С, приблизительно 875°С, приблизительно 900°С, приблизительно 925°С, приблизительно 950°С, приблизительно 975°С, приблизительно 1000°С. Ее можно нагревать в течение от 1 минуты до 4 часов.
Средний размер частиц глины может быть от такого маленького, как 1 микрон, до такого большого, как 500 микрон. Средний размер частиц может быть в основном между 20 и 50 микронами.
Можно применять другие источники дрожжевых продуктов или продукты дрожжевого брожения, дрожжевая камедь или цельные дрожжи или компоненты дрожжевой клетки (такие, как клеточная стенка дрожжей, но не ограничиваясь ей) или их смеси или дрожжи или компоненты дрожжей других видов дрожжей. Также можно применять источники для олигосахаридов маннанов и/или бета-глюканов или других основных компонентов дрожжей, включая, но не ограничиваясь другими волокнами или источниками углеводов. Другие источники пребиотиков или смеси пребиотиков также можно применять для настоящего изобретения.
Другие источники глутамата, глутаминовой кислоты или любой из их солей или других энергогенерирующих аминокислот (включая, но не ограничиваясь: α-кетоглутаратом, глутамином, аспартатом или аминокислотами с разветвленной цепью, L-глутаминовой кислотой или L-глутамином), другие функциональный аминокислоты, функциональные пептиды или функциональные протеины или нуклеотиды также включены в настоящее изобретение.
Процентное включение материалов может увеличиваться или снижаться по сравнению с предпочтительным вариантом осуществления.
В то время как предпочтительный вариант осуществления демонстрирует ценность против некротического энтерита, вызываемого эзофагеальной инокуляцией кокцидиоза (Eimeria maxima) и Clostridium perfringens, он может иметь сходные эффекты в отношении заболеваний, вызываемых другими видами Клостридий или кокцидий, или других заболеваний кишечника, или путем общего улучшения здоровья и функции желудочно-кишечного тракта у видов птиц, а также других видов, таких, как собак, кошек, свиней, крупного рогатого скота, козлов, лошадей и людей, а также водных видов, таких как креветок или искусственно выращенных рыб. Другие заболевания, которым возможно помочь, могут представлять собой инфицирование Clostridia difficile человека и животных, хронические расстройства стула у человека, геморрагическое расстройство стула у коров, энтеротоксемию крупного рогатого скота, свиней и овец, шигеллез человека и животных или диарею путешественников, а также другие заболевания, вызываемые бактериальными или пищевыми или поступающими с водой эндотоксинами или экзотоксинами животных и человека.
Исследование проводят для изучения эффектов нескольких продуктов на клинические признаки некротического энтерита у цыплят-бройлеров. Продукты включают некоторые, которые ранее протестированы Заявителями, и новый комбинационный продукт, который Заявители ранее не применяли у животных. Протестированные ранее продукты представляют собой: 1) 100% глиняный продукт, (В); 2) глиняный продукт, смешанный с органической кислотой и растительным экстрактом (Y); 3) смесь глины и дрожжевого продукта (С). Не тестированные ранее продукт представляет собой смесь глины, дрожжевого продукта и глутамата натрия (D). Все эти продукты тестируют в двух концентрациях, 0,25% и 0,5% от питания Виргиниамицин (22 м.д.), антибиотик, которые широко применяют для предотвращения некротического энтерита у домашних птиц, также включен в лечение для сравнения.
У цыплят, которым вместе с кормом вводят комбинацию глины, дрожжевого продукта и глутамат натрия и которых одновременно инфицируют E. Maxima и C. perfringens для индуцирования некротического энтерита, наблюдают значительно повышенный набор веса, сниженные величины повреждения, усиление уровней антител сыворотки на α-токсин или NetB токсин и снижение уровней α-токсина в сыворотке. Это не только оказывается значительно лучше по сравнению с отсутствием продукта, но часто также хорошо сравнимо с другими тестируемыми продуктами.
В целом, добавление D 0,25% от питания показывает лучшее действие, чем D 0,5% от питания, что показывает, что есть необходимость балансировать эти ингредиенты для обеспечения оптимального ответа.
Включение смеси глины, дрожжевого продукта и опционально глутамата настоящего изобретения в корм для животного или воду можно производить путем, известным специалисту в области техники. В предпочтительном варианте осуществления смесь изобретения глины, дрожжевого продукта и опционально глутамата вводят в предварительно приготовленную смесь. Предварительно приготовленная смесь включает глину, дрожжевой продукт и опционально глутамат, смесь, физиологически приемлемый носитель и опционально пищевой продукт. Предварительно приготовленная смесь в целом находится в относительно концентрированной форме и адаптирована для разведения другим материалом, таким, как один или более другие носители, витамины и минеральные добавки и пищевой продукт для образования конечного корма для животных. Предварительно приготовленная смесь включает глину, дрожжевой продукт и опционально глутамат, смесь в концентрации в диапазоне от 0,1 до 70% по весу, предпочтительно от 0,5 до 50% по весу, более предпочтительно приблизительно 0,25% по весу. Оптимальная концентрация зависит от того, является ли лечение профилактическим, для контроля или лечебным, а также от того, является ли в смеси изобретения глина, дрожжевой продукт и опционально глутамат единственными активными ингредиентами или они применяются в сопутствующей терапии с другими материалами, а также от вида и возраста или стадии жизни реципиента.
В предпочтительном варианте осуществления концентрированная композиция смеси глины, дрожжевого продукта и опционально глутамата представляет собой форму с контролируемым высвобождением. Форма с контролируемым высвобождением включает смесь глины, дрожжевого продукта и опционально глутамата и полимерный материал для обеспечения контролируемого высвобождения смеси глины, дрожжевого продукта и опционально глутамата для системы контролируемого высвобождения, и который является в частности полезным в композициях для добавления к твердому кормовому материалу. В результате состава с контролируемым высвобождением высвобождение смеси глины, дрожжевого продукта и опционально глутамата может быть отсрочено так, что оно произойдет главным образом после двенадцатиперстной кишки. Полимер с контролируемым высвобождением также может минимизировать отторжение композиции из-за вкуса или применяться для ректальных суппозиторий.
В этом изобретении термин «система с контролируемым высвобождением» применяют в таком же контексте, как и указано, и он включает такой же диапазон примеров, как цитируют в «Controlled Drug Delivery» (Robinson and Lee, 1987). В области техники (Robinson and Lee, 1987) известно много других систем с контролируемым высвобождением, чувствительных к pH, которые можно заменить полимером акриловой кислоты или сополимером акриламида и акриловой кислоты. Например, растворимые и анионные или нерастворимые сшитые и анионные целлюлозные системы; или растворимые и анионные или нерастворимые сшитые и анионные полимеры, полученные из любого полимера акриловой кислоты-дженерика и/или его производных. Такие сшитые и нерастворимые полимеры являются предпочтительными, поскольку они набухают и также меньше склонны метаболизироваться.
Изобретение также предоставляет композицию корма для животных, включающую смесь изобретения глины, дрожжевого продукта и опционально глутамата, и пищевой продукт. Смесь глины, дрожжевого продукта и опционально глутамата предпочтительно присутствует в количестве от 0,0001 до 25% от общей композиции корма и предпочтительно от 0,0001 до 5% от общей композиции корма, более предпочтительно приблизительно 0,25% от общей композиции корма.
В другом предпочтительном варианте осуществления смесь изобретения глины, дрожжевого продукта и опционально глутамата можно приготовить для дополнения к питьевой воде для животных.
Смесь изобретения глины, дрожжевого продукта и опционально глутамата предпочтительно вводят в количествах от 0,05 до 5000 мг/кг по весу тела/день, более предпочтительно от 100 до 1000 мг/кг/день.
Примеры подходящих инертных носителей для применения в композициях для введения смеси изобретения глины, дрожжевого продукта и опционально глутамата, включают, но не ограничиваются водой, оливковым маслом, арахисовым маслом, кунжутным маслом, подсолнечным маслом, сафлоровым маслом, арахисовым маслом, кокосовым маслом, жидким парафином, этиленгликолем, пропиленгликолем, полиэтиленгликолем, этанолом, пропанолом, изопропанолом, глицерином, жирными спиртами, триглицеридами, поливиниловым спиртом, частично гидролизованным поливинилацетатом и смесью вышеперечисленных веществ.
Твердые формы для перорального или ректального введения могут содержать фармацевтически и ветеринарно приемлемые связывающие вещества, подсластители, дезинтегрирующие средства, растворители, ароматизаторы, покрывающие средства, консерванты, лубриканты и/или средства для отсрочки времени. Подходящие связывающие вещества включают аравийскую камедь, желатин, кукурузный крахмал, трагакантовую камедь, алгинат натрия, карбоксиметилцеллюлозу или полиэтиленгликоль. Подходящие подсластители включают сахарозу, лактозу, глюкозу или флавонолгликозиды, такие как неогесперидин дигидрохалкон. Подходящие дезинтегрирующие средства могут включать кукурузный крахмал, метилцеллюлозу, поливинилпирролидон, ксантановую камедь, бентонит, алгиновую кислоту или агар. Подходящие растворители включают лактозу, сорбитол, маннитол, декстрозу, каолин, целлюлозу, карбонат кальция, силикат кальция или дикальция фосфат. Подходящие ароматизаторы включают мятное масло, масло грушанки, ароматизирующие вещества вишни, апельсина или малины. Подходящие покрывающие средства включают полимеры или сополимеры акриловой кислоты и/или метакриловой кислоты и/или их эфиры и/или их амиды, воска, жирные спирты, зенит, шеллак или глютен. Подходящие консерванты включают бензоат натрия, витамин Е, альфа-токоферол, аскорбиновую кислоту, метилпарабены, пропилпарабены или бисульфат натрия. Подходящие лубриканты включают стеарат магния, стеариновую кислоту, олеат натрия, хлорид натрия или тальк. Подходящие средства для отсрочки времени включают глицерилмоностеарат или глицерилдистеарат.
Суспензии для перорального или ректального введения могут дополнительно включать диспергирующие средства и/или суспендирующие средства. Подходящие суспендирующие средства включают карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, алгинат натрия или цетиловый спирт. Подходящие диспергирующие средства включают лецитин, полиоксиэтиленовые эфиры жирных кислот, таких, как стеариновая кислота, полиоксиэтиленсорбитол моно- или ди-олеат, стеарат- или лаурат, полиоксиэтиленсорбитан моно- или диолеат, -стеарат или -лаурат и им подобные.
Композиция смеси глины, дрожжевого продукта и опционально глутамата может дополнительно включать один или более эмульгатор. Подходящие эмульгаторы включают диспергирующие средства, как описано выше, или природные камеди, такие как аравийская камедь или трагакантовая камедь.
Композиции для введения в способе изобретения можно изготовить при помощи средств, известных в области техники для приготовления композиция (таких, как в области техники ветеринарии и фармацевтических композиций), включающих смешивание, размельчение, гомегенизацию, суспендирование, растворение, эмульгирование, диспергирование и, где необходимо, смешивание активных ингредиентов с выбираемыми эксципиентами, растворителями, носителями и адъювантами.
Для перорального введения фармацевтическая или ветеринарная композиция может быть в форме таблеток, пастилок, пилюль, пастилок, капсул, эликсиров, порошков, включая лиофилизированные порошки, растворов, гранул, суспензий, эмульсий, сиропов и настоек. Также можно приготовить формы с медленным высвобождением или отсроченным высвобождением, например, в форме покрытых частиц, многослойных таблеток или микрогранул.

Хотя настоящее изобретение и его преимущества описаны подробно, следует понимать, что различные изменения, замещения и модификации могут быть сделаны здесь без отхождения от сущности и объема изобретения, как определено в прилагаемой формуле изобретения.
Настоящее изобретение дополнительно проиллюстрировано следующими Примерами, которые даны только с иллюстративной целью и не имеют намерение ограничивать изобретение каким-либо образом.
Пример 1: Сущность клостридиальных токсинов/заболевания, эффективность прототипа продукта
Несколько абсорбентов для токсинов 2 видов бактерий Clostridium тестируют in vitro и in vivo. Анализ абсорбции in vitro с альфа-токсином проводят с тремя образцами измельченной глины: бентонитом кальция (CBEN), фуллеровой землей аттапульгитового типа (AFE) и фуллеровой землей, обработанной термически (HTF). Альфа-токсин продуцируется C. perfringens в кишечнике домашних птиц во время состояний стресса, что приводит к некротическому энтериту. Пять уровней токсина (0, 5, 10, 50 и 100 мкг/мл) и три уровня каждой глины (0, 0,5% и 1,0%) тестируют вместе в 50 мкл раствора фосфатного буфера, инкубируют, центрифугируют, определяют связывание путем измерения гидролиза лецитинового агара яичного желтка, возникающего вследствие несвязанного альфа-токсина. Все продукты связывают токсин на одинаковом уровне. Таблица 1 показывает резюме результатов. Уменьшение соотношения связывающего вещества к токсину приводит к разделению эффективностей связывания глин, где CBEN имеет большую эффективность связывания, чем две другие глины (приблизительно в 2 раза более эффективен). В целом, лучшее связывание альфа-токсина in vitro проявляет CBEN, затем AFE и HTF.
Абсорбция Альфа Токсина C. perfringens
Несколько видов глин тестируют на активность в отношении 2 токсинов А и В C. difficile (AFE, обработанный кислотой аттапульгит (ATA), CBEN и термически обработанный бентонит кальция (HCBN). Как глины (в виде мелкодисперсных порошков), так и токсины (очищенные токсины разводят до конечной концентрации 2000 цитотоксических единиц на мл токсина А и 10 000 цитотоксических единиц на мл для токсина В) добавляют в различных концентрациях. Глины помещают в суспензию с токсином и инкубируют. Твердые остатки далее удаляют центрифугированием. Надосадочную жидкость (жидкий остаток, где все еще может оставаться активный токсин) добавляют к клеточной культуре (овариальные клетки Китайского Хомяка) и записывают повреждения. Большее клеточное повреждение означает меньшую активность глины. Меньшее клеточное повреждение означает большую активность против токсина.
Результаты: Ни один продукт не абсорбирует Токсин В (которые применяют в концентрации, десятикратно превышающей Токсин А). Таблица 2 дает данные примеров. AFE и ATA абсорбируют некоторое количество Токсина А. Следующая таблица предоставляет пример результатов. 100 означает, что не наблюдается измеренного уменьшения абсорбции токсина. 0 означает, что активность токсина отсутствует.
Абсорбция Токсина А и В C. difficile
=>
Последующий цикл тестирования при помощи только Токсина В, где применяют 2% глину и токсины подсчитывают по весу (не по цитотоксическим единицам) показывает, что все тестируемые продукты имеют какую-либо степень активности (Таблица 3). В этой таблице определение активности отличается от того, которое находится в Таблице 2. 100 означает, что активность токсина отсутствует. 0 означает, что наблюдается большая активность токсина (т.е., цитотоксичность).
Абсорбция Токсина В C. difficile, Университет Аризоны, 2010
токсин
В исследованиях in vivo для инфицирования используют штамм JGS4143, вирулентный внелабораторный штамм. Только что вылупившихся цыплят Cornish × Rock кормят свободным от антибиотика цыплячьим начальным питанием с 16% протеина в течение 7 дней. На 8 день питание меняют на имеющее в основе пшеницу, корм с высоким содержанием белка (28%), содержащий 60% рыбной муки и цинк на 400 м.д. Глину HCBEN, CBEN и CBEN+пребиотики добавляют в 1% или 2% к корму для индивидуальных групп. Перед инфицированием (День 14) кормление отменяют за 20 часов. Начиная на 15 день, птиц кормят (каждые 12 часов в течение 3,5 дней) соотношением корм : смесь культур 1,25:1. Выживших птиц вскрывают на 18 и 19 день). Обширные повреждения подсчитывают и оценивают, и двойные образцы собирают свежими для бактериологического культивирования и фиксируют в 10% фосфатно-буферном формалине для гистопатологии. Обработанные парафином ткани разрезают (5 мкм), окрашивают гематоксилином и эозином, исследуют при помощи световой микроскопии и определяют оценку повреждения на основании степени некроза. Для полуколичественных бактериологических результатов, у вскрытых цыплят собирают сегменты тощей кишки, вскрывают асептически на стерильной фольге и удаляют слизистую оболочку путем соскребывания при помощи стерильных предметных стекол. Соскобы из областей с обширными поражениями наносят полосками на триптозный кровяной агар. Все колонии, имеющие типичную морфологию и гемолитический вид, испещряют полосками для культивирования на кровяном агаре и подтверждают как C. perfringens (грамположительный анаэробный вид с двойной зоной гемолиза). Определение концентрации C. perfringens производят путем оценки колоний из последующих полосок (например, 4 представляет колонии на полоске 4).
Результаты: Обе глины без пребиотика демонстрируют значительное снижение величины повреждения или величины высевания. Все цыплята являются довольно больными, что, как подозревают, происходит из-за тяжелого инокулята и применяемого корма.
Результаты Некротического Энтерита in vivo
Величины повреждения и высевания в исследовании цыплят на Некротический Энтерит in vivo*
** Смертность от лечения представляет собой процент птиц, которые умерли во время лечения клостридий, не включая тех, которые умерли до лечения клостридий.
Поскольку в развитии заболевания не применяют кокцидий (некротический энтерит связан с кокцидиальной инфекцией), исследование проводят при помощи кокцидиальной модели.
Способ: Двенадцать схем лечения (TRT) с 8 повторами на 8 птиц применяют в эксперименте для оценки эффектов различных продуктов на здоровье кишечника, показатели роста и эффекты некротического энтерита (NE) у цыплят. Шесть продуктов также оценивают при инфицировании Clostridium perfringens (CP), а два этих продукта также оценивают без инфицирования Clostridium perfringens (CP). Цыплят кормят лечебным кормом с 0 по 28 день, и все птицы получают пероральное инфицирование кокцидиями на 14 дней со смешанным кокцидиальным инокулятом (~5000 ооцист E. maxima на птицу). Инфицированные птицы также получают бульонную культуру СР (108 КОЕ/мл) для индуцирования NE на 19, 20 и 21 день.
Схемы лечения записаны в Таблице 5.
Схемы лечения для Исследования Некротического Энтерита
Схемы лечения и описание
растительный экстракт
органическая кислота
растительный экстракт
Результаты: Все продукты снижают заболевание в некоторой форме в зависимости от измерений. Таблица 6 показывает расстановку по порядку действия. В то время, как виргиниамицин (лекарственное средство, применяемое для контроля некротического энтерита) Количественно является лучшим, глиняные продукты в целом не отличаются от него значительно.
Простое распределение схем лечения на основании величины повреждения, смертности от некротического энтерита и набора веса за 14-28 день, а также соотношения трансформации корма для птиц с инфицированиема- Clostridium perfringens или без него
Поскольку некоторое количество измеряемых параметров и результаты являются в некоторой степени сложными, следующие Таблицы всего лишь их перечисляют.
Величина повреждения и смертность от некротического энтерита у птиц
b Подсчет производят на основании шкалы от 0 до 3, где 0 обозначает нормальную степень, а 3 наиболее тяжелую.
c Смертность определяют как имеющую в своей причине некротический энтерит, поделенную на число птиц, которые начинают эксперимент (8/клетка).

Пример 2: Эффекты некротического энтерита и афлатоксина на показатели роста, величины повреждения и смертность молодых бройлеров, а также продукты для их уменьшения
Немного известно о возможной взаимосвязи некротического энтерита/афлатоксина. Проводят исследование для изучения возможной взаимосвязи, а также способности некоторых прототипных продуктов облегчать заболевание. Ключ продукта В=LVM глина; Y=B + органическая кислота+растительный экстракт; С=B + дрожжевой продукт. Три тестовых материала облегчают заболевание.
Цыплят Кобб 500 (2,640, мужского пола) используют для определения эффектов заболевания инфицированием и продуктов для снижения этих эффектов. Применяют три уровня инфицирования: 1) нет инфицирования; 2) инфицирование некротическим энтеритом (СРР); и 3) CPP+1 м.д. афлатоксина В1. Тестируемые продукты для снижения заболеваний инфицированием представляют собой: 1) нет продукта (НП); 2) патентованный продукт на основе глины (В); 3) (Y); 4) С); 5) виргиниамицин (VM). В 24-часовом исследовании 22 цыпленка (выравненные до 20 на 7 день) на клетку разделяют на 15 схем лечения (3×5 конфигурация точек плана факторного эксперимента) с 8 повторениями (экспериментальная единица=клетка). Значительное различие установлено при Р<0,05. Вес замеряют на 0, 10 и 24 день для подсчета потребления корма (FI), набора (G) и соотношения корм:набор (F:G). Птицы поглощают корм и воду неограниченно. Увеличение отрицательных ответов на комбинацию NE и AFL наблюдают в этом исследовании, поскольку FI (0-10 день), набор (10-24 день, 0-24 день) и F:G (10-24 день) становятся значительно хуже при применении уровня инфицирования, идущего от отсутствия инфицирования к инфицированию СР и до инфицирования CPP+AFL (Р<0,05). Другие ростовые реакции хуже, чем в отсутствие инфицирования или при CPP-инфицировании, при одновременном применении CPP+AFL (Р<0,05). Величина повреждения выше у инфицированных CPP птиц с AFL или без него (Р<0,05). Кормление VM улучшает показатель у неинфицированных птиц (Р<0,05). У птиц, инфицированных CPP, добавление В или Y улучшает FI и набор по сравнению с NP; где Y равна тем, кого кормят VM в течение периода инфицирования (Р<0,05). У птиц, получающих В, наблюдают самый высокий набор и трансформацию корма при инфицировании CPP и AFL; кормление Y, C и VM имеет большие наборы, чем при добавлении NP (Р<0,05). В заключении, увеличение уровня инфицирования снижает показатели птиц. Птицы с некротическим энтеритом, получающие Y, имеют набор, равный набору тех, которые получают VM во время периода инфицирования. Кормление продуктами на основе глины улучшает показатели во время инфицирования CPP+AFL.
Таблицы 9 и 10 - Таблицы данных, CQR.

Пример 3: Эффекты некротического энтерита и афлатоксина на показатели роста, величину повреждения и смертность у молодых бройлеров, и продукты для их снижения
Цыплят Кобб 500 (2,640, мужского пола) используют для определения эффектов заболевания инфицированием и продуктов для снижения этих эффектов. Применяют три уровня инфицирования: 1) нет инфицирования; 2) инфицирование некротическим энтеритом (СРР); и 3) CPP+1 м.д. афлатоксина В1. Тестируемые продукты для снижения заболеваний инфицированием представляют собой: 1) нет продукта (НП); 2) патентованный продукт на основе глины (В); 3) второй патентованный продукт на основе глины (Y); 4) третий патентованный продукт на основе глины С); 5) виргиниамицин (VM). В 24-часовом исследовании 22 цыпленка (выравненные до 20 на 7 день) на клетку разделяют на 15 схем лечения (3×5 конфигурация точек плана факторного эксперимента) с 8 повторениями (экспериментальная единица=клетка). Значительное различие установлено при Р<0,05. Вес замеряют на 0, 10 и 24 день для подсчета потребления корма (FI), набора (G) и соотношения корм : набор (F:G). Птицы поглощают корм и воду неограниченно. Увеличение отрицательных ответов на комбинацию NE и AFL наблюдают в этом исследовании, поскольку FI (0-10 день), набор (10-24 день, 0-24 день) и F:G (10-24 день) становятся значительно хуже при применении уровня инфицирования, идущего от отсутствия инфицирования к инфицированию СР и до инфицирования CPP+AFL (Р<0,05). Другие ростовые реакции хуже, чем в отсутствии инфицирования или при CPP-инфицировании, при одновременном применении CPP+ AFL (Р<0,05). Величина повреждения выше у инфицированных CPP птиц с AFL или без него (Р<0,05). Кормление VM улучшает показатель у неинфицированных птиц (Р<0,05). У птиц, инфицированных CPP, добавление В или Y улучшает FI и набор по сравнению с NP; где Y равна тем, кого кормят VM в течение периода инфицирования (Р<0,05). У птиц, получающих В, наблюдают самый высокий набор и трансформацию корма при инфицировании CPP и AFL; кормление Y, CL3 и VM имеет большие наборы, чем при добавлении NP (Р<0,05). В заключении, увеличение уровня инфицирования снижает показатели птиц. Птицы с некротическим энтеритом, получающие Y, имеют набор, равный набору тех, которые получают VM во время периода инфицирования. Кормление продуктами на основе глины улучшает показатели во время инфицирования CPP+AFL.
Пример 4: Эффекты некротического энтерита, афлатоксина и виргиниамицина на показатели роста, величину повреждения и смертность у молодых бройлеров
Всего 2,112 цыплят Кобб 500 мужского пола используют для определения эффектов увеличения концентрации афлатоксина (AFL; 0, 0,75, 1,5 м.д.) на бройлеров с некротическим энтеритом или без него, или виргиниамицина (VM). На 23 день исследования 22 цыпленка (выравненные до 20 на 7 день) на клетку разделяют на 12 схем лечения (3×2×2 конфигурация точек плана факторного эксперимента) с 8 повторениями в полной блочной рандомизации; клетка является экспериментальной единицей. Значительное различие установлено при Р<0,05. Вес замеряют на 0, 16 и 23 день для подсчета потребления корма (FI), набора (G) и соотношения корм:набор (F:G). Птицы поглощают корм и воду неограниченно. Афлатоксин снижает набор и потребление корма и приводит к худшим показателями корм:набор, смертности и величины повреждения (Р<0,05). Индуцирование некротического энтерита, применяя контаминированный Clostridium perfringens мусор и 10-кратную дозу вакцины против кокцидий, вводимую на 10 день, увеличивает величину повреждения и снижает потребление корма и набор (Р<0,05). Добавление VM к пище улучшает набор, потребление пищи и трансформацию корма, и снижает смертность (Р<0,05). Тем не менее, существует взаимосвязь (Р<0,05) между тем, как у инфицированных птиц во втором периоде с CPP и кормлением AFL 0,75 м.д. появляется отрицательный синергический эффект на набор, в то время как добавочный эффект не наблюдается, когда птица получает 1,5 м.д. AFL. При 1,5 м.д. AFL неинфицированные СРР птицы, получающие VM, имеют больший набор, чем те птицы, которые не получают VM, что равно набору инфицированных птиц с VM или без него. Похожая взаимосвязь (Р<0,05) наблюдается в общем периоде кормления, хотя VM помогает инфицированным СРР птицам при итоговой 0,75 м.д. Виргиниамицин улучшает трансформацию корма с наибольшим улучшением при 1,5 м.д. Афлатоксин увеличивает величины повреждения в неинфицированных, но не у инфицированных птиц. VM увеличивает величины повреждения у инфицированных, но не у неинфицированных птиц (Р<0,05). Афлатоксин и некротический энтерит снижают показатели бройлеров и взаимодействуют для снижения набора веса; VM помогает улучшить набор у инфицированных птиц при 0,75 м.д. AFL, но не при 1,5 м.д. AFL.
Пример 5: Эффекты продуктов Amlan против эффектов невротического энтерита у бройлерных птиц
Целью этого Примера является оценка эффекта продуктов Amlan на клинические признаки NE, иммунопатологию и цитокиновые ответы у цыплят-бройлеров, одновременно инфицируемых Eimeria maxima и Clostridium perfringens, в Модели Заболевания Некротического Энтерита (NE). Для этого исследования применяют модель заболевания NE (Park SS, Lillehoj HS, с соавт. Immunopathology and cytokine responses in broiler chickens coinfected with Eimeria maxima and Clostridium perfringens with use of an animal model of necrotic enteritis. Avian Diseases 2008; 52:14-22; Jang SI, Lillehoj HS, с соавт. Vaccination with Clostridium perfringens recombinant proteins in combination with Montanide™ ISA 71 VG adjuvant increase protection against experimental necrotic enteritis in commercial broiler chickens. Vaccine 2012; 30:5401-5406).
Материалы и методы. Продукты Amlan представляют собой 100% глиняный продукт (В), глиняный продукт в смеси с органической кислотой и растительным экстрактом (Y), смесь глины и дрожжевого продукта (С), смесь глины, дрожжевого продукта и глутамата натрия (D) и антибиотик виргиниамицин (VM). Возраст цыплят - один день. Бройлерные птицы (Ross/Ross) вылупливаются в Longeneckers Hatchery (Elizabethtown, PA), их транспортируют в почтовом грузовике и содержат в стартерном брудере. Птиц держат в брудерных клетках в свободном от Eimeria помещении и перевозят в крупных подвешиваемых клетках в отдельное место, где их инфицируют и содержат до окончания экспериментального периода для проведения исследования инфицирования в "прямом эфире". Все процедуры, а именно перевозка, измерение веса тела, инфицирование, забор крови и селезенки проводят в соответствии с установленными рекомендациями для экспериментов на животных.
Всех птиц кормят нелечебным имеющимся в продаже основным кормом из 17% сырого протеина в возрасте с 1 по 18 день. Корм смешивают с продуктами B, Y, C, D и VM соответственно. В возрасте 18 дней корм замещают имеющимся в продаже нелекарственным кормом, содержащим 24% сырого протеина корма-стартера.
Штаммы Eimeria сохраняют и размножают в соответствии с установленной процедурой. E. maxima (41A) очищают флотацией при помощи 5% гипохлорита натрия, промывают трижды при помощи PBS и измеряют жизнеспособность при помощи трипанового синего, используя гемоцитометр. Число ооцист основано только на спорулирующих ооцистах. На 14 день цыплят инокулируют эзофагеально 10 000 E. maxima при помощи инокуляционной иглы.
Через четыре дня после инфицирования Eimeria птиц из группы NE инокулируют эзофагеально 1×109КОЕ Clostridium perfringens, каждый раз применяя инокуляционную иглу.
Птиц взвешивают непосредственно перед инфицированием E. maxima (EM), на 0 и 2 день после инфицирования C. perfringens для подсчета набора веса.
Для определения величины поражения птиц (5 птиц/группа) умерщвляют на 2 день после инфицирования C. perfringens (СР). Получают приблизительно 20 см сегменты кишечника протяженностью 10 см до и после дивертикула и рассекают вдоль. Величины повреждения оценивают 3 независимых наблюдателя от 0 до 4 в восходящем порядке тяжести повреждения.
На каждый из 0, 2, 7 и 14 дня после инфицирования СР всего 12 птиц (5/группа) анализируют на титр антител сыворотки (собирают индивидуально). Для сывороток образцам крови, получаемым от индивидуальных птиц (3 мл/птица), позволяют сворачиваться в течение ночи при 4°С, и собирают сыворотки.
Образцы сывороток тестируют на антитела к клостридиям при помощи установленного ELISA. Кратко, микротитрационный планшет покрывают на ночь 200 нг/лунка рекомбинантного клостридиального антигена, промывают PBS - 0,05% Tween и блокируют при помощи PBS - 1% BSA. Добавляют разведения сыворотки, инкубируют с непрерывным аккуратным встряхиванием, промывают и связывают антитела, определяемые при помощи конъюгированного с пероксидазой кроличьего анти-цыплячьего IgG (Sigma) и пероксидазо-специфического субстрата. Оптическую плотность (OD) определяют на 450 нм при помощи планшета-ридера (Bio-Rad, Richmond, CA).
Образцы сывороток тестируют на антигены против α-токсина или NetB при помощи установленного ELISA. Кратко, микротитрационный планшет покрывают на ночь 0,5 мкг/лунка моноклонального антитела к α-токсину или Net B-токсину, промывают PBS - 0,05% Tween и блокируют при помощи PBS - 1% BSA. Добавляют разведения сыворотки, инкубируют с непрерывным аккуратным встряхиванием, промывают и связывают антитела, определяемые при помощи конъюгированного с пероксидазой кроличьего анти-α-токсина или Net B-токсина и пероксидазо-специфического субстрата. Оптическую плотность (OD) определяют на 450 нм при помощи планшета-ридера (Bio-Rad, Richmond, CA).
Для статистического анализа все величины выражают как среднее значение ± SEM (стандартная ошибка средней). Средние величины для набора веса тела и величины повреждения сравнивают в группах при помощи теста Множественных Диапазонов Дункана вслед за ANOVA, применяя SPSS 15,0 для Windows (SPSS Inc., Chicago, IL). Различия в средних значениях считаются значительными при р<0,05.
Экспериментальный Дизайн
Используют 220 бройлерных птиц (20/группа) и держат в брудерных клетках с 2 брудерами Petersime на единицу. Заключительная единица составляет 80 подвешиваемых единиц клеток, в которых птиц транспортируют в возрасте 18 дней.
Цыплята прибывают на 0 день и переезжают в тот же день в единицы Petersime. Цыплят переводят в большие клетки на 18 день. Птиц инфицируют 10 000 спорулирующими ооцистами E. Maxima на 14 день и инфицируют 1×109 КОЕ C. perfringens на 18 день. Кровь собирают на 14, 18, 20, 25 и 32 день. Повреждения оценивают на 20 день. Вес тела определяют на 14, 20 и 25 день (см., например, ФИГ.1).
Как показано на ФИГ. 2, цыплята, которых кормят 0,25% D и 0,5% D-обогащенным питанием и одновременно инфицируют E. maxima и C. perfringens, показывают увеличенный вес тела по сравнению с инфицированными животными, которые получают необогащенное питание.
Как показано на ФИГ. 3, цыплята, которых кормят 0,25% D-обогащенным питанием и одновременно инфицируют E. maxima и C. perfringens, показывают увеличенный вес тела по сравнению с инфицированными животными, которые получают необогащенное питание (контрольная NE группа).
Как показано на ФИГ. 4, цыплята, которых кормят группами D (0,25%) и D (0,5%) и Y (0,5%), показывают значительное снижение величины повреждения по сравнению с контрольной NE группой.
Как показано на ФИГ. 5А, уровни антител сыворотки против α-токсина (через 7 дней после инфицирования C. perfringens) значительно выше в группе D (0,25%) по сравнению с инфицированной NE контрольной группой. Тем не менее, не наблюдают значительных отличий в уровне антител между другими группами питания и инфицированной NE контрольной группой.
Как показано на ФИГ. 5В, у птиц, которых кормят D (0,25%) и D (0,5%) -обогащенным питанием, сывороточный гуморальный ответ на α-токсин (через 14 дней после инфицирования C. perfringens) демонстрирует значительное повышение по сравнению в контрольной NE группой.
Как показано на ФИГ. 6А, у птиц, которых кормят D (0,25%), антитела сыворотки против NetB-токсина (через 7 дней после инфицирования C. perfringens) демонстрируют увеличение по сравнению с контрольной NE группой.
Как показано на ФИГ. 6В, у птиц, которых кормят D (0,25%), уровень антител сыворотки против NetB-токсина (через 14 дней после инфицирования C. perfringens) демонстрирует значительное повышение по сравнению в контрольной NE группой.
Как показано на ФИГ. 7А, уровни α-токсина сыворотки значительно ниже у инфицированных групп D (0,25%) и В (0,5%) по сравнению с необогащенными и инфицированными NE контролями.
Как показано на ФИГ. 7В, уровни NetB-токсина сыворотки ниже у инфицированных групп D (0,25%, 0,5%) и В (0,25%, 0,5%) по сравнению с необогащенными и инфицированными NE контролями. Тем не менее, между группами не существует значительной разницы.
Обобщая этот Пример, цыплят, которых с вылупливания кормят нормальным питанием или питанием, обогащенным продуктами Amlan (C, Y, B, D и по сравнению с антибиотиком VM), и иммунитетом против NE, сравнивают между экспериментальной и контрольной NE группами. Цыплята, которых кормят D-обогащенным питанием и одновременно инфицируют E. maxima и C. perfringens, демонстрируют значительное увеличение набора веса тела, снижение величины повреждения, увеличение уровней сывороточных антител к α-токсину и NetB-токсину и снижением уровней α-токсина в сыворотке.
Пример 6: Сравнительная эффективность продуктов с виргиниамицином, вводимым в корм для контролирования некротического энтерита, вызываемого Clostridium perfringens у бройлерных цыплят
Ключ продукта представляет собой:
Длительность исследования составляет 28 дней и животным-мишенью является бройлерный цыпленок.
Схемы лечения
Материалы и Методы:
Экспериментальный Рацион: Изготавливают нелечебный имеющийся в продаже тип стартера для цыплят, укомплектованный пищевыми продуктами, широко применяемыми в Соединенных Штатах. Этот рацион (в виде мешанки) скармливают в неограниченном количестве цыплятам с даты их прибытия до 28 Дня исследования. Состав диеты включен в первичные данные. Экспериментальные лечебные корма изготавливают из этого основного стартера. Количества основного стартера и исследуемые препараты, применяемые для приготовления лечебных партий, документированы. Лечебные корма перемешивают для того, чтобы обеспечить равномерное распределение соответствующего исследуемого препарата. Корм распределяют по клеткам той же самой схемы лечения.
Собирают три образца: по одному в начале, середине и в конце партии лечебного питания и смешивают для создания комбинированного образца. Один комбинированный образец забирают от комбинации для каждой схемы лечения.
Животные: Цыплят-бройлеров мужского пола в возрасте 1 дня приобретают в инкубатории Cobb-Vantress, Cleveland, GA. Вид представляет собой Cobb Х Cobb. Записывают информацию о маточном стаде. В инкубатории определяют пол птиц и прививают стандартными вакцинами. В этом исследовании используют только птиц, которые выглядят здоровыми. Документируют число и нрав птиц, которых не используют для распределения.
Содержание: По прибытию цыплят растят в батарейных клетках Petersime. После размещения птиц кормят лечебными кормами. Площадь пола на животное составляет 0,63 кв. фута/птица. Кормовой фронт на птицу составляет 8 птиц/43 см × 6,8 см фидер. Термостатистически контролируемая газовая печь/кондиционер поддерживают одинаковую температуру. Предоставляется даже освещение. Документируют диаграмму клеток.
Распределение Птиц и Рандомизация Клеток: Клетки блокируют расположением в батарее с размером блока, равным схемам лечения (7 клеток на блок). Исследование начинают после размещения птиц (день вылупливания) (DOT 0), во время которого их переносят в экспериментальные клетки. Выбирают только здоровых птиц. На DOT 0 записывают вес тел группы на клетку. Птиц не замещают во время проведения исследования.
Индуцирование заболевания: Корм и вода доступны в неограниченных количествах на протяжении испытания. На DOT 14 всех птиц перорально инокулируют кокцидиальным инокулятом, содержащим приблизительно 5000 ооцист E. maxima на птицу. Процедуры инокуляции кокцидиальными ооцистами описаны в SPR SOP. Начиная с DOT 19, все птицы за исключением схемы Лечения 1 получают бульонную культуру C. perfringens 108 кое/мл. Птицам вводят свежую бульонную культуру один раз в день в течение 3 дней (на DOT 19, 20 и 21).
Взвешивания на DOT 0, 14, 21 и 28: Всех птиц взвешивают в клетках на DOT 0, 14, 21 и 28. Корм взвешивают на DOT 0, оставшийся корм взвешивают на DOT 14, 21 и 28. Испытание прекращают на DOT 28.
Определение величины повреждения некротическим энтеритом: На DOT 21 выбирают трех птиц из каждой клетки, умерщвляют, взвешивают, исследуют на степень наличия повреждения Некротического Энтерита. Подсчет производят на основании шкалы от 0 до 3, где 0 обозначает нормальную степень, а 3 наиболее тяжелую.
Организация: Оборудование тщательно проверяют для уверенности в том, что во всех клетках имеется вода и что корм доступен в каждой клетке. Диапазон температур здания поддерживают на подходящем уровне для возраста птиц. Предоставляют даже постоянное освещение при помощи флуоресцентных ламп, подвешенных вертикально вдоль стены. Корм и воду предоставляют в неограниченных количествах.
В соответствии со стандартной операционной процедурой (SOP) клетки проверяют дважды в день. Наблюдения включают доступность корма и воды, контроль температуры и любые необычные условия. Внимательно наблюдают за наличием любых ненормальных реакций у птиц.
Когда умерших птиц удаляют из клеток, записывают номер клетки, дату, вес птицы, пол и возможную причину смерти.
Анализ Данных: Подсчитывают средние значения для набора веса в клетке, потребления корма, трансформации корма, величин повреждения и смертности.
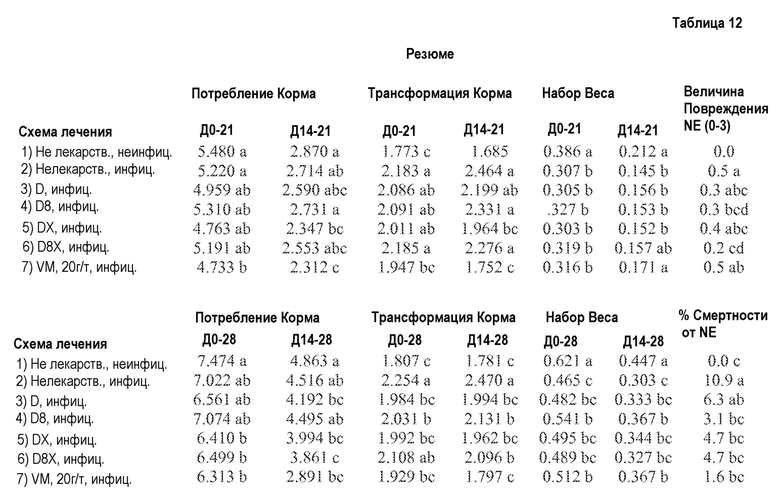
ФИГ. 8А отображает трансформацию корма с 0 по 21 День. В целом, трансформация корма для птиц, которых кормят разными схемами лечения, была промежуточной между теми со схемами лечения NE (птицы, которых инфицируют для индуцирования некротического энтерита, но которые не получают продукт) и VM (птицы, которых инфицируют для индуцирования некротическим энтеритом и кормят виргиниамицином) с 0 по 21 день. Тем не менее, птицы, которых кормят продуктом D8X, не следуют этой схеме, и имеют плохую трансформацию корма, статистически и количественно, как и те, которые находятся на лечении NE без какого-либо продукта в этом периоде времени.
ФИГ. 8В отображает трансформацию корма с 14 по 21 день. Трансформация корма для зараженных птиц, которые получают Лечение DX, значительно лучше, чем у птиц, получающих лечение NE (зараженные, но не получающие корм), в период времени с 14 по 21 день, и является статистически равной питанию с добавлением VM.
ФИГ. 8С отображает трансформацию корма с 0 по 28 день. Все продукты за исключением D8X значительно лучше, чем NE без продукта. Продукты D и DX являются лучшими из тестируемых продуктов, сходными с птицами на лечении VM и не отличаются статистически от птиц, которые не участвуют в заражении NE.
ФИГ. 9А отображает набор веса с 0 по 28 день. Набор улучшается при помощи VM по сравнению с NE контролем без какого-либо продукта. D8 статистически равен и является количественно лучшим по сравнению с VM. Все другие продукты являются промежуточными между NE без продукта и VM.
ФИГ. 9В отображает набор веса с 14 по 28 день. Набор имеет сходный характер для 14-28 дней, как и для 0-28 дней за исключением того, что D8 количественно равен VM.
ФИГ. 10 отображает величины повреждения. Величины повреждения для птиц, которых кормят D8 и D8X, ниже, чем для птиц, которых кормят VM, и могут не отличаться статистически от птиц, которых не заражают NE.
ФИГ. 11 отображает смертность от NE. Все продукты за исключением D снижают Смертность по сравнению с зараженными NE птицами, которые не получают продукт, и равны смертности тех, которых кормят VM.
Пример 7: Эффекты продуктов против эффектов некротического энтерита у бройлерных птиц
Целью этого примера является оценка различных формул и дозировок раскрытых ранее продуктов на клинические проявления Некротического Энтерита (NE), иммунопатологию и цитокиновые ответы у цыплят-бройлеров, одновременно инфицируемых Eimeria maxima и Clostridium perfringens, в Модели Заболевания Некротического Энтерита (NE). Для этого исследования применяют модель заболевания NE (Park SS, Lillehoj HS, с соавт. Immunopathology and cytokine responses in broiler chickens coinfected with Eimeria maxima and Clostridium perfringens with use of an animal model of necrotic enteritis. Avian Diseases 2008; 52:14-22; Jang SI, Lillehoj HS, с соавт. Vaccination with Clostridium perfringens recombinant proteins in combination with Montanide™ ISA 71 VG adjuvant increase protection against experimental necrotic enteritis in commercial broiler chickens. Vaccine 2012; 30:5401-5406).
Материалы и методы: Продукты представляют собой смесь глины, дрожжевого продукта и глутамата натрия в формуле, которую ранее находят эффективной (D), в текущем эксперименте ее включают в четырех различных количествах (0,35, 0,25, 0,15 и 0,05%), также включая продукты, содержащие такие же ингредиенты, как и предыдущий продукт, но с четырьмя различными составами ингредиентов в формуле Продукта (называемыми D, DSF, D8 и D8F5). Антибиотик виргиниамицин (VM) также включают в лечение. Цыплята представляют собой бройлерных птиц возрастом один день (Ross/Ross), которые вылупливаются в Longeneckers Hatchery (Elizabethtown, PA), которых транспортируют в почтовом грузовике и содержат в стартерном брудере. Птиц держат в брудерных клетках в свободном от Eimeria помещении и перевозят в крупных подвешиваемых клетках в отдельное место, где их инфицируют и содержат до окончания экспериментального периода для проведения исследования инфицирования в "прямом эфире". Все процедуры, а именно перевозка, измерение веса тела, инфицирование, забор крови и селезенки проводят в соответствии с установленными рекомендациями для экспериментов на животных.
Всех птиц кормят нелечебным имеющимся в продаже основным кормом из 17% сырого протеина в возрасте с 1 по 18 день. Корм смешивают с D в различных количествах включения (0,35, 0,25, 0,15 и 0,05%) или другими составами продукта (D, DSF, D8 и D8F5), включающими 0,25% корма. Антибиотик VM (22 м.д.) также включают в лечение. В возрасте 18 дней корм замещают имеющимся в продаже нелекарственным кормом, содержащим 24% сырого протеина корма-стартера с лечебными продуктами, как и в 17% CP рационе.
Штаммы Eimeria сохраняют и размножают в соответствии с установленной процедурой. E. maxima (41A) очищают флотацией при помощи 5% гипохлорита натрия, промывают трижды при помощи PBS и измеряют жизнеспособность при помощи трипанового синего, используя гемоцитометр. Число ооцист основано только на спорулирующих ооцистах. На 14 день цыплят инокулируют эзофагеально 10 000 E. maxima при помощи инокуляционной иглы.
Через четыре дня после инфицирования Eimeria птиц из группы NE инокулируют эзофагеально 1×109КОЕ Clostridium perfringens, каждый раз применяя инокуляционную иглу.
Птиц взвешивают непосредственно перед инфицированием E. maxima (EM), на 0 и 2 день после инфицирования C. perfringens для подсчета набора веса.
Для определения величины поражения птиц (5 птиц/группа) умерщвляют на 2 день после инфицирования C. perfringens (СР). Получают приблизительно 20 см сегменты кишечника протяженностью 10 см до и после дивертикула и рассекают вдоль. Величины повреждения оценивают 3 независимых наблюдателя от 0 до 4 в восходящем порядке тяжести повреждения.
На каждый из 0, 2, 7 и 14 дня после инфицирования СР всего 12 птиц (5/группа) анализируют на титр антител сыворотки (собирают индивидуально). Для сывороток образцам крови, получаемым от индивидуальных птиц (3 мл/птица), позволяют сворачиваться в течение ночи при 4°С, и собирают сыворотки.
Образцы сывороток тестируют на антитела к клостридиям при помощи установленного ELISA. Кратко, микротитрационный планшет покрывают на ночь 200 нг/лунка рекомбинантного клостридиального антигена, промывают PBS-0,05% Tween и блокируют при помощи PBS-1% BSA. Добавляют разведения сыворотки, инкубируют с непрерывным аккуратным встряхиванием, промывают и связывают антитела, определяемые при помощи конъюгированного с пероксидазой кроличьего анти-цыплячьего IgG (Sigma) и пероксидазо-специфического субстрата. Оптическую плотность (OD) определяют на 450 нм при помощи планшета-ридера (Bio-Rad, Richmond, CA).
Образцы сывороток тестируют на антигены против α-токсина или NetB при помощи установленного ELISA. Кратко, микротитрационный планшет покрывают на ночь 0,5 мкг/лунка моноклонального антитела к α-токсину или Net B-токсину, промывают PBS - 0,05% Tween и блокируют при помощи PBS - 1% BSA. Добавляют разведения сыворотки, инкубируют с непрерывным аккуратным встряхиванием, промывают и связывают антитела, определяемые при помощи конъюгированного с пероксидазой кроличьего анти- α-токсина или Net B-токсина и пероксидазо-специфического субстрата. Оптическую плотность (OD) определяют на 450 нм при помощи планшета-ридера (Bio-Rad, Richmond, CA).
Для статистического анализа все величины выражают как среднее значение ± SEM (стандартная ошибка средней). Средние величины для набора веса тела и величины повреждения сравнивают в группах при помощи теста Множественных Диапазонов Дункана вслед за ANOVA, применяя SPSS 15,0 для Windows (SPSS Inc., Chicago, IL). Различия в средних значениях считаются значительными при р<0,05.
Экспериментальный Дизайн
(EM+CP)*
Используют 220 бройлерных птиц (20/группа) и держат в брудерных клетках Petersime. Заключительная единица составляет 80 подвешиваемых единиц клеток, в которых птиц транспортируют в возрасте 18 дней.
Цыплята прибывают на 0 день и переезжают в тот же день в единицы Petersime. Цыплят переводят в большие клетки на 18 день. Птиц инфицируют 10 000 спорулирующих ооцист E. Maxima на 14 день и инфицируют 1×109 КОЕ C. perfringens на 18 день. Кровь собирают на 14, 18, 20, 25 и 32 день. Повреждения оценивают на 20 день. Вес тела определяют на 14, 20 и 25 день (см., например, ФИГ.1).
Как показано на ФИГ. 12А-В, цыплята, которых кормят питанием, содержащим 0,25% D или 0,25% D8, показывают увеличенный набор веса тела со дня заражения Eimeria до 2 дня после инфицирования CP, равный 25,4% или 29,3% соответственно, по сравнению с инфицированными птицами, которые получают необогащенное питание (контрольная NE группа).
Как показано на ФИГ. 13А-В, цыплята, которых кормят 0,25% D8 или D8F-обогащенным питанием, показывают 20,18% и 18,29% увеличение набора веса тела, соответственно, по сравнению с инфицированными птицами, которые получают необогащенное питание (контрольная NE группа).
Как показано на ФИГ. 14, цыплята, которых кормят D с уровнями включения 0,25%, 0,15% и 0,05%, или группами DSF, D8 и D8F, показывают значительное снижение величины повреждения по сравнению с инфицированными птицами, которые получают необогащенное питание.
Как показано на ФИГ. 15А, уровни антител сыворотки против α-токсина значительно выше в группе D при уровне включения 0,05% или 0,25% или DSF, D8 или D8F при уровне включения 0,25% или VM группе по сравнению с инфицированными птицами, которые получают необогащенное питание (контрольная NE группа) на 2 день после инфицирования C. perfringens.
Как показано на ФИГ. 15В, на 7 день после инфицирования C. perfringens птиц, получающих корм формулы D при уровне включения 0,25% или 0,05% или D8 или D8F при уровне включения 0,25% или обогащенное VM питание, оптическая плотность показывает заметное увеличение антител к α-токсину по сравнению с контрольной NE группой.
Как показано на ФИГ. 16А, уровни антител сыворотки против антигена NetB-токсина выше на 2 день после инфицирования C. perfringens , у птиц, которых кормят продуктом D при уровне включения 0,05% или 0,25%, или D8 или D8F при уровне включения 0,25% или VM, поскольку оптическая плотность увеличивается по сравнению в контрольной NE группой.
Как показано на ФИГ. 16В, птицы, которых кормят формулой D при уровне включения 0,05% или 0,25%, или DS, DSF, D8 и VM, демонстрируют повышенный уровень антител сыворотки против антигена NetB-токсина на 7 дней после инфицирования C. Perfringens.
Как показано на ФИГ. 17А, уровни α-токсина сыворотки на 2 день после инфицирования C. Perfringens значительно ниже у инфицированных птиц, которых кормят D (0,25%) по сравнению с необогащенными инфицированными NE контролями. Уровень α-токсина сыворотки показывает тяжесть клостридиальной инфекции. Этот результат может показывать снижение уровня α-токсина C. perfringens при помощи продукта через прямое или непрямое действие.
Как показано на ФИГ. 17В, уровни NetB-токсина сыворотки на 2 день после инфицирования C. Perfringens значительно ниже (хотя не значимо статистически) у инфицированных NE птиц, которых кормят D (0,25%) и D8 (0,25%) по сравнению с необогащенными и инфицированными NE контролями. Уровень NetB-токсина сыворотки показывает тяжесть клостридиальной инфекции. Этот результат может показывать снижение уровня α-токсина C. perfringens при помощи продукта через прямое или непрямое действие.
Как показано на ФИГ. 18А-В, экспрессия ИЛ8 интраэпителиальных лимфоцитов снижается в группах, обогащенных всеми продуктами D, DS, DSF, D8 или VM ,по сравнению с птицами NE контроля. Экспрессия интраэпителиальных лимфоцитов (LITAF) снижается в группе, обогащенной продуктом D при уровнях включения 0,35, 0,25 или 0,15%, или продуктами DSF, D8, D8F или антибиотиком VM. Добавление DS 0,25% в питание демонстрируем снижение уровня LITAF.
Как показано на ФИГ. 18С-D, экспрессия ИЛ-6 и iNOS (индуцибельная NO-синтетаза) в целом снижается в группах, обогащенных всеми продуктами D, DS, DSF, D8 или VM по сравнению с птицами NE контроля. В целом, эти результаты показывают благоприятные эффекты кормления молодых цыплят-бройлеров этими продуктами.
Как показано на ФИГ. 19А-С, экспрессия ИЛ8 в селезенке увеличивается в группах, обогащенных D8F. В то же время LITAF экспрессия снижается в группе, обогащенной продуктом Amlan D8 (0,25%) и D8F. Тем не менее, DSF группа показывает увеличение уровня LITAF. Экспрессия TNFSF15 снижается в группе, обогащенной продуктом Amlan D, при всех уровнях включения продуктов D8 или D8F, или антибиотика VM.
Как показано на ФИГ. 19D-F, в отношение цитокиновой экспрессии ИЛ-6 в селезенке не наблюдают существенные различия между группами. В то же время экспрессия iNOS снижается в группах, обогащенных продуктом D, при уровнях включения 0,25% или 0,05%, или продуктом D8F или антибиотиком VM. Дополнительно экспрессия ИЛ-Iβ снижается в группе, обогащенной продуктом D, при включениях 0,35 или 0,15%, или продуктом DS или D8.
Для подытоживания этого Примера, цыплят кормят с момента вылупливания нормальным питанием или питанием, которое содержит добавки продуктов D, DS, DSF, D8, D8F или VM, и иммунитет против NE сравнивают между экспериментальной и NE контрольной группами. Цыплята, которых кормят обогащенным 0,25% D или 0,25% D8 питанием и одновременно инфицируют E. maxima и C. perfringens, показывают значительно увеличенных набор веса тела, сниженные величины повреждения кишечника, усиление уровней антител сыворотки к α-токсину и NetB-токсину и сниженные уровни α-токсина сыворотки. Уровни транскриптов для ИЛ-6, ИЛ-8, iNOS и TNFSF15 в кишечнике снижены в группе, обогащенной 0,25% продукта D, DS, DSF, D8 и D8F соответственно. При добавлении 0,25% продукта D к питанию, птицы демонстрируют снижение уровня экспрессии цитокинов, таких как NRFSF15 и iNOS в селезенке. Эти результаты показывают благоприятные эффекты добавления 0,25% продукта D или 0,25% обогащения D8 на уменьшение вредных эффектов NE заболевания у цыплят-бройлеров.
ФИГ. 12А отображает сравнение наборов веса тела цыплят-бройлеров определяемом со дня инфицирования Eimeria maxima до 2 дней после инфицирования C. perfringens. Птиц инфицируют 10000 спорулирующих ооцист E. maxima на 14 день после вылупливания. Через 4 дня после инфицирования E. maxima птиц инокулируют 1×109 КОЕ C.РСР. (Конт. представляет собой незараженную контрольную группу; NE представляет собой группу, инфицированную для индуцирования некротического энтерита, но которая получает продукт; VM представляет собой группу, которая получает 20 г/т виргиниамицина в питании).
ФИГ. 12В отображает сравнение процента повышения набора веса тела относительно птиц контроля заражения некротическим энтеритом, не получающих продукт на основании 1.
ФИГ. 13А отображает сравнение наборов веса тела в цыплят-бройлеров. Наборы веса тела определяют, начиная со дня инфицирования C. perfringens и заканчивая 7 днем после инфицирования C. perfringens.
ФИГ. 13В отображает сравнение процента повышения набора веса тела относительно инфицированного контроля некротического энтерита без какого-либо продукта на основании Фиг. 3-1.
ФИГ. 14 отображает эффект Продуктов на величины повреждений кишечника, величины составляют среднее из 5 птиц на группу, исследуемых на 2 день после инфицирования C. perfringens.
ФИГ. 15А отображает ответ антител сыворотки на α-токсин антиген на 2 день после инфицирования C. perfringens .
ФИГ. 15В отображает ответ антител сыворотки на α-токсин антиген на 7 день после инфицирования C. Perfringens.
ФИГ. 16А отображает ответ антител сыворотки на NetB токсин антиген на 2 день после инфицирования C. perfringens.
ФИГ. 16B отображает ответ антител сыворотки на NetB токсин антиген на 7 день после инфицирования C. perfringens.
ФИГ. 17А отображает эффект обогащения пищи на уровни α-токсина сыворотки. Сыворотки собирают на 2 день после инфицирования C. perfringens и применяют для определения уровней α-токсина при помощи иммуноферментного анализа (ELISA).
ФИГ. 17В отображает эффект обогащения пищи на уровни NetB-токсина сыворотки. Сыворотки собирают на 2 день после инфицирования C. perfringens и применяют для определения уровней NetB-токсина при помощи иммуноферментного анализа (ELISA).
ФИГ. 18А-В отображают продукцию цитокинов в интраэпителиальных лимфоцитах тощей кишки на 2 день после инфицирования C. perfringens.
ФИГ. 18С-D отображают продукцию цитокинов в интраэпителиальных лимфоцитах тощей кишки птиц на 2 день после инфицирования C. perfringens.
ФИГ. 19А-C отображают продукцию цитокинов в селезенке птиц на 2 день после инфицирования C. perfringens.
ФИГ. 19D-F отображают продукцию цитокинов в селезенке птиц на 2 день после инфицирования C. perfringens.
Изобретение дополнительно описано следующими пронумерованными пунктами:
1. Способ лечения заболевания кишечника у животных при необходимости в таковом, включающий введение смеси, включающей глину, дрожжевой продукт и глутамат, животному, таким образом вылечивая заболевание кишечника.
2. Способ по п.1, где заболевание кишечника вызывают бактерии Clostridium или Eimeriaprotazoa.
3. Способ по п.1 или 2, где заболевание кишечника представляет собой некротический энтерит, кокцидиоз, инфекцию Clostridia difficile, хроническое или геморрагическое расстройство стула, энтеротоксемию, шигеллез, диарею или заболевание, вызываемое бактериальными или пищевыми или поступающими с водой эндотоксинами и/или экзотоксинами.
4. Способ по любому из пп.1-3, где животное представляет собой виды домашней птицы, собаку, кошку, крупный рогатый скот, овцу, козла, лошадь или человека.
5. Способ по любому из пп.1-3, где животное представляет собой водные виды животных.
6. Способ по п.5, где водные виды животных представляют собой креветок или искусственно выращенных рыб.
7. Способ по любому из пп.1-6, где смесь вводят в качестве пищевой добавки.
8. Способ по любому из пп.1-7, где смесь представляет собой приблизительно от 50 до 90% по весу (мас./об.) глины, приблизительно от 10 до 50% по весу (мас./об.) дрожжевого продукта и приблизительно от 0,01 до 15% по весу (мас./об.) глутамата.
9. Способ по любому из пп.1-8, где глина представляет собой кальциевую монтмориллонитовую глину.
10. Способ по любому из пп.1-8, где глина представляет собой сорбирующий минерал, диатомовую землю, силикат, зеолит, аттапульгит или комбинацию вышеперечисленных веществ.
11. Способ по любому из пп.1-10, где глину нагревают между приблизительно 100°С и приблизительно 800°С.
12. Способ по любому из пп.1-11, где глину измельчают до размера частиц приблизительно от 20 до 50 микрон.
13. Способ по любому из пп.1-12, где дрожжевой продукт представляет собой дрожжевой продукт Pichia guilliermondii.
14. Способ по п. 13, где дрожжевой продукт представляет собой спрессованный осадок лимонной кислоты.
15. Способ по любому из пп.1-12, где дрожжевой продукт представляет собой продукт дрожжевого брожения.
16. Способ по любому из пп.1-15, где дрожжевой продукт представляет собой дрожжевой компонент.
17. Способ по п. 16, где дрожжевой компонент представляет собой дрожжевой маннан, дрожжевую клеточную стенку, олигосахарид маннанов, бета-глюкан, волокна, источник углеводов, пребиотик или комбинацию вышеперечисленных веществ.
18. Способ по любому из пп.1-17, где дрожжевой продукт представляет собой продукт дрожжевого брожения.
19. Способ по любому из пп.1-18, где глутамат представляет собой глутамат натрия.
20. Способ по любому из пп.1-18, где глутамат представляет собой глутаминовую кислоту, α-кетоглутарат, глутамин, L-глутаминовую кислоту или L-глутамин или их производные.
Имея таким образом описанные в деталях предпочтительные варианты осуществления настоящего изобретения, следует понимать, что изобретение, определенное пунктами выше, не должно ограничиваться конкретными деталями, перечисленными в описании выше, поскольку возможны их различные очевидные вариации без отхождения от сущности и объема настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ C. PERFRINGENS, У ЖИВОТНЫХ | 2018 |
|
RU2769503C2 |
| СПОСОБ РАННЕГО ВЫЯВЛЕНИЯ ВСПЫШКИ НЕКРОТИЧЕСКОГО ЭНТЕРИТА В ПОПУЛЯЦИИ ПТИЦ | 2019 |
|
RU2771793C1 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| ВАКЦИНА ПРОТИВ НЕКРОТИЧЕСКОГО ЭНТЕРИТА У ДОМАШНЕЙ ПТИЦЫ | 2018 |
|
RU2788096C2 |
| ОКИСЛЕННЫЕ КАРОТИНОИДЫ И ИХ КОМПОНЕНТЫ ДЛЯ ПРОФИЛАКТИКИ НЕКРОТИЧЕСКОГО ЭНТЕРИТА | 2016 |
|
RU2744892C2 |
| АДЪЮВАНТЫ НА МАСЛЯНОЙ ОСНОВЕ | 2014 |
|
RU2816851C2 |
| ЖИВЫЕ АТТЕНУИРОВАННЫЕ ВАКЦИНЫ | 2010 |
|
RU2556813C2 |
| АДЪЮВАНТЫ НА МАСЛЯНОЙ ОСНОВЕ | 2014 |
|
RU2730011C2 |
| КОМПОЗИЦИЯ ДЛЯ ПЕРОРАЛЬНОГО ВВЕДЕНИЯ ПТИЦАМ ИЛИ ЖИВОТНЫМ ДЛЯ ЛЕЧЕНИЯ ИЛИ СНИЖЕНИЯ РИСКА ИНФЕКЦИИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА (ВАРИАНТЫ), ЕЕ ПРИМЕНЕНИЕ (ВАРИАНТЫ) И СПОСОБ ЛЕЧЕНИЯ ИЛИ СНИЖЕНИЯ РИСКА ИНФЕКЦИИ ПИЩЕВАРИТЕЛЬНОГО ТРАКТА (ВАРИАНТЫ) | 2000 |
|
RU2272419C2 |
| АДЪЮВАНТЫ НА МАСЛЯНОЙ ОСНОВЕ | 2014 |
|
RU2816849C2 |
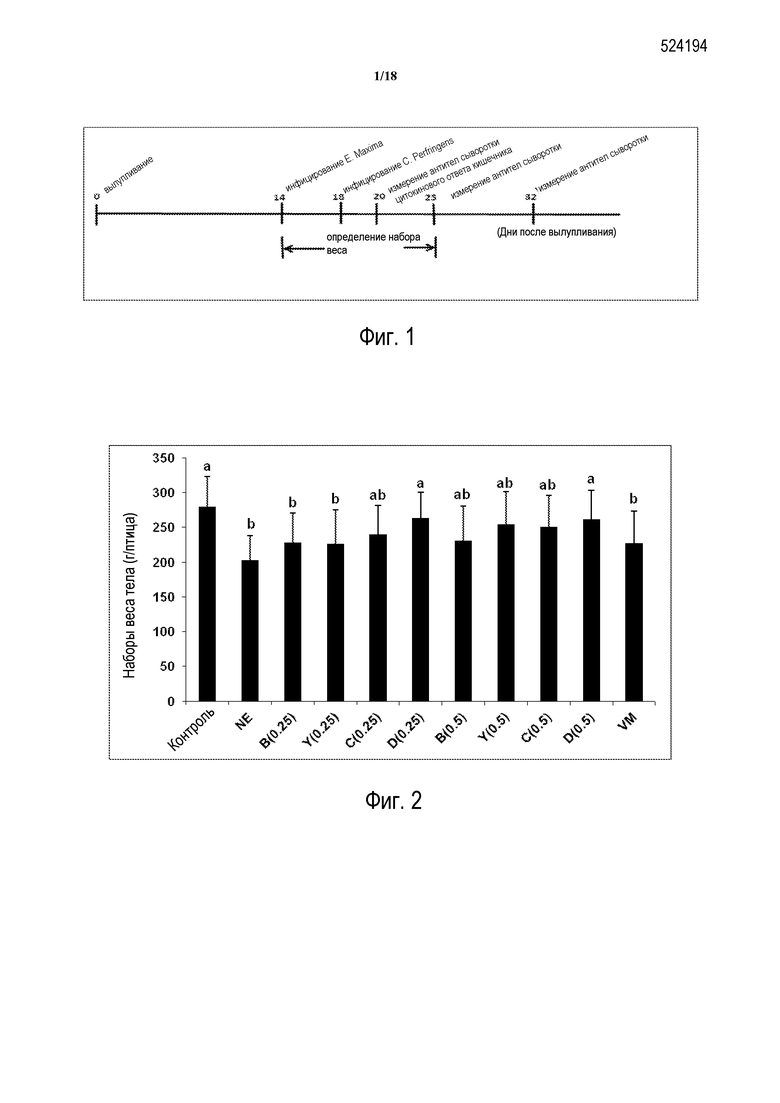


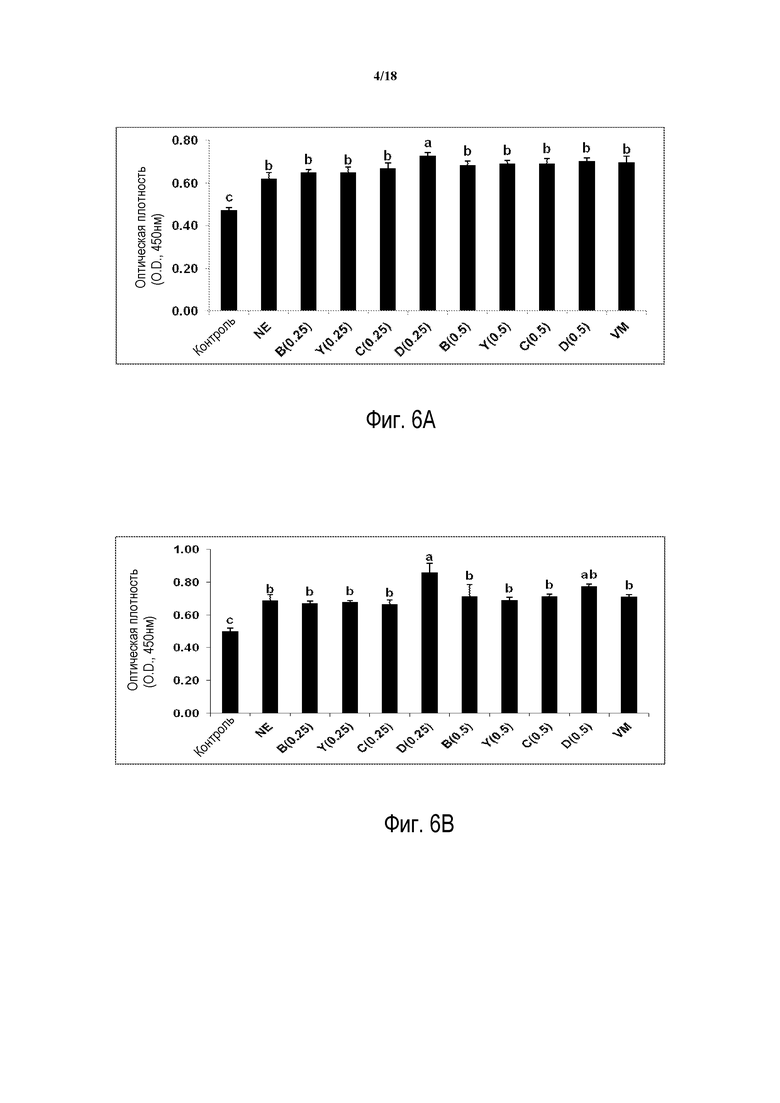

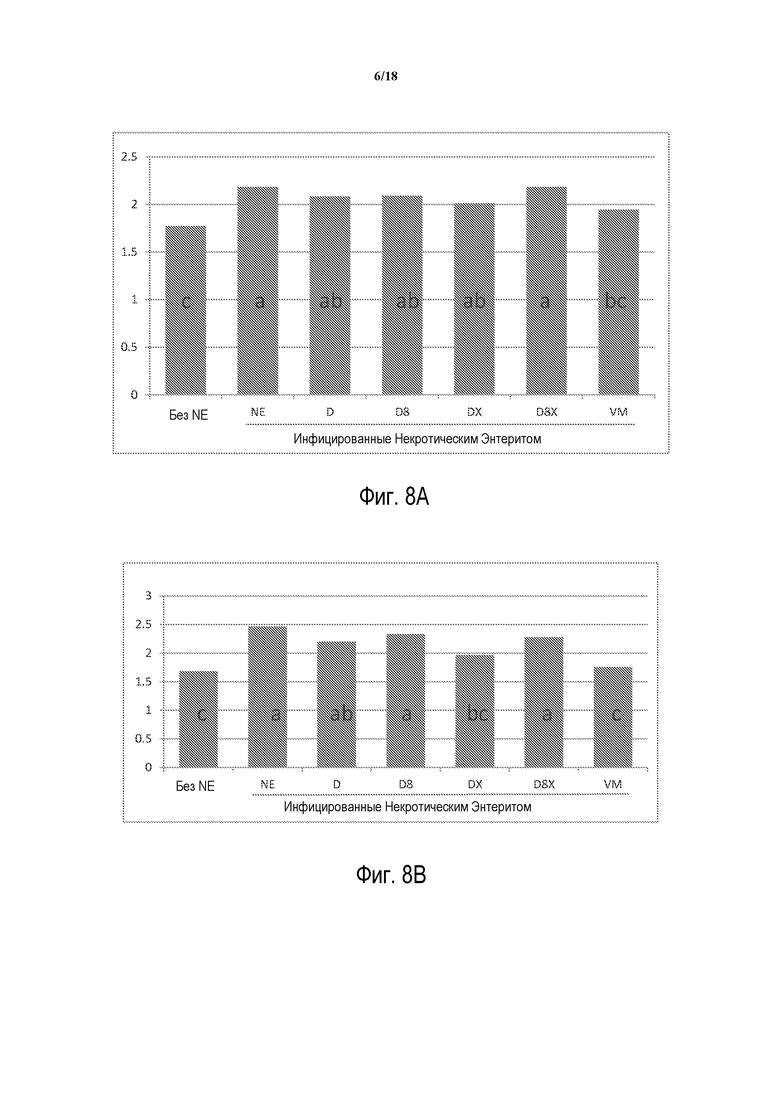
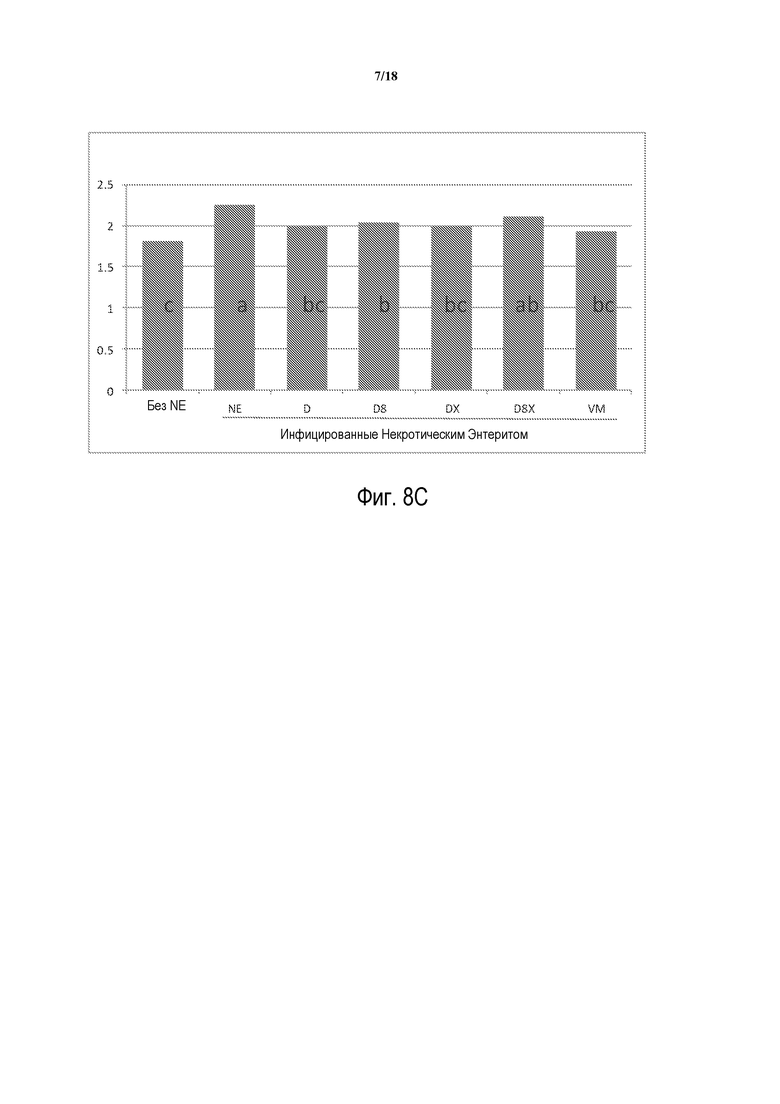

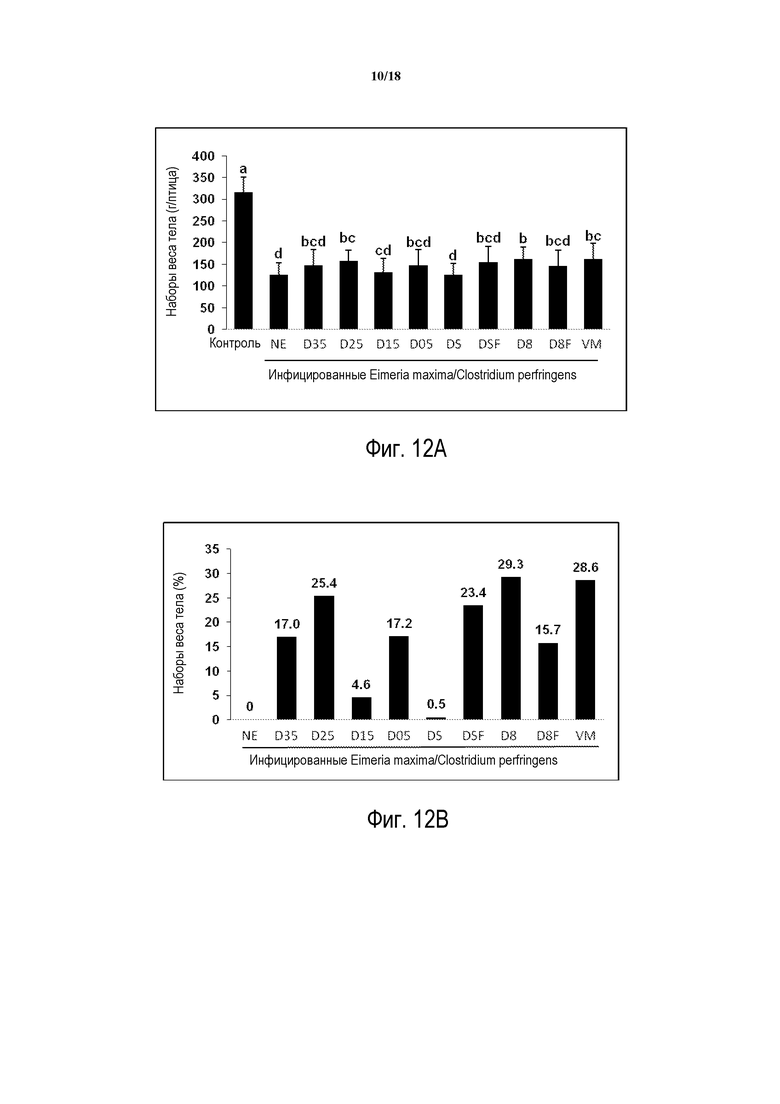
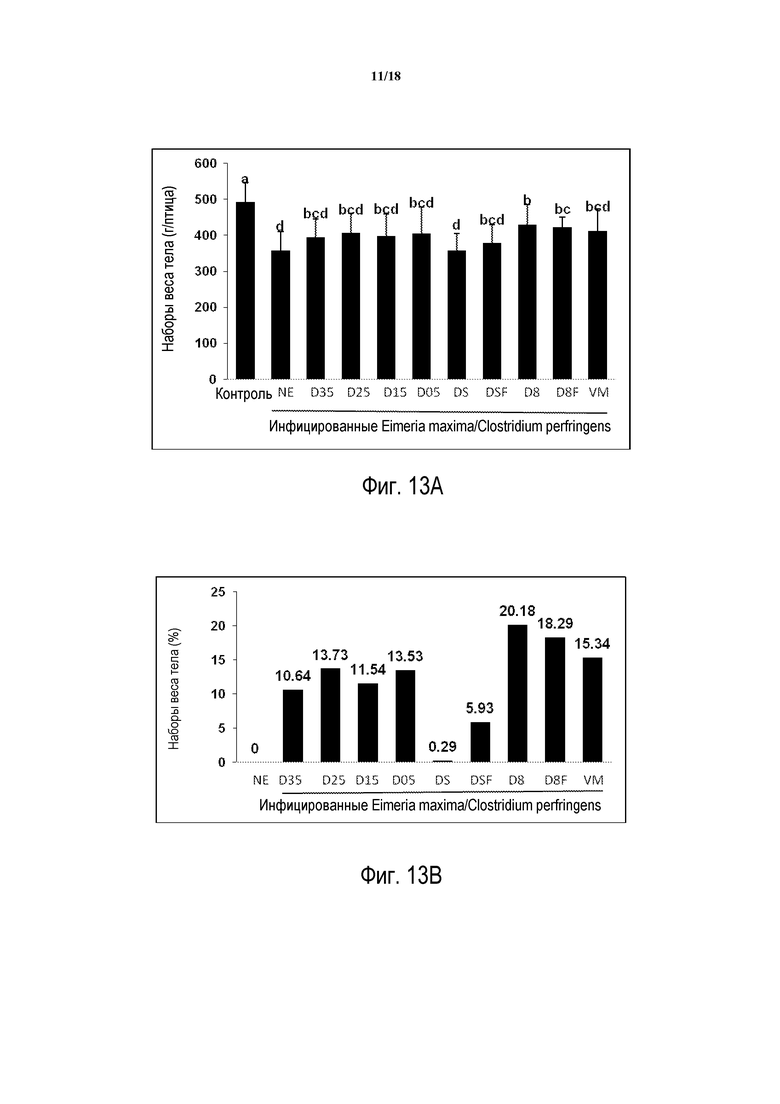
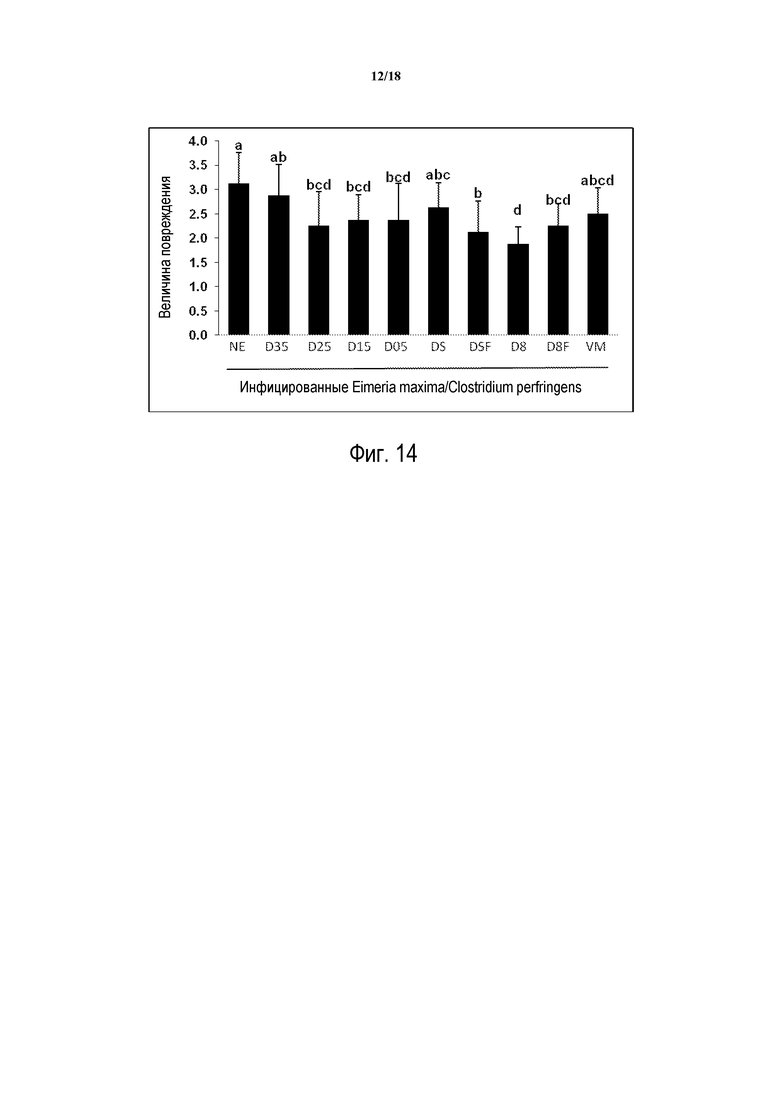
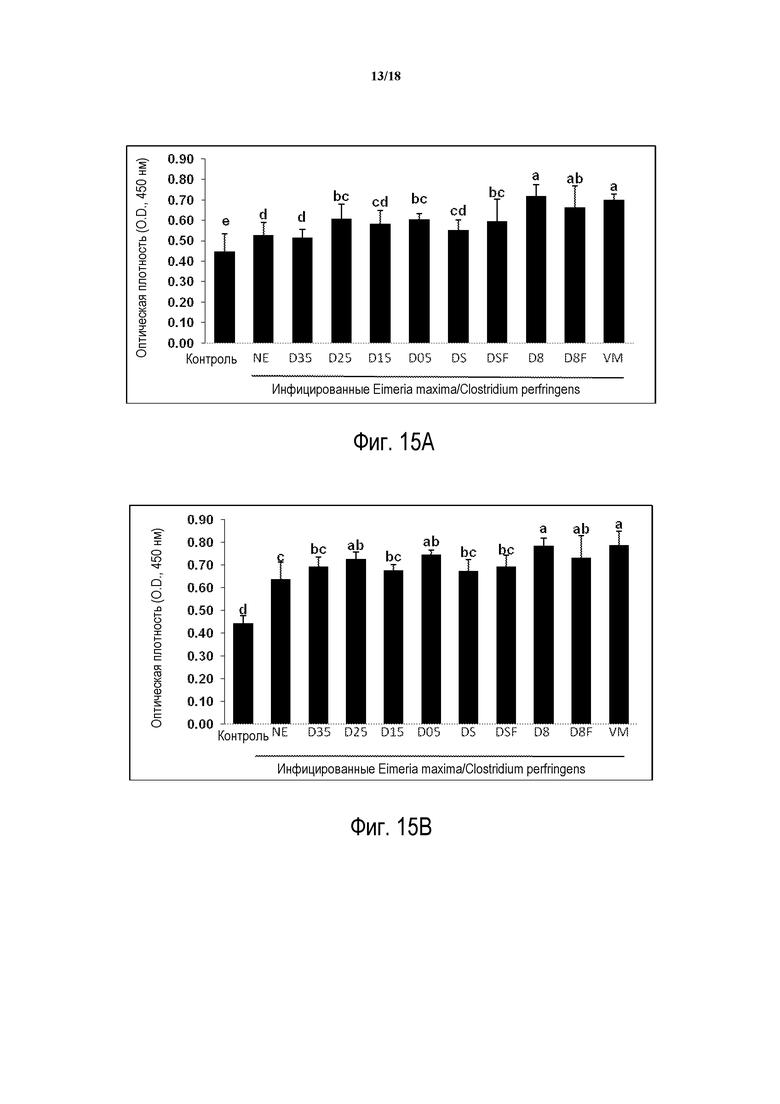
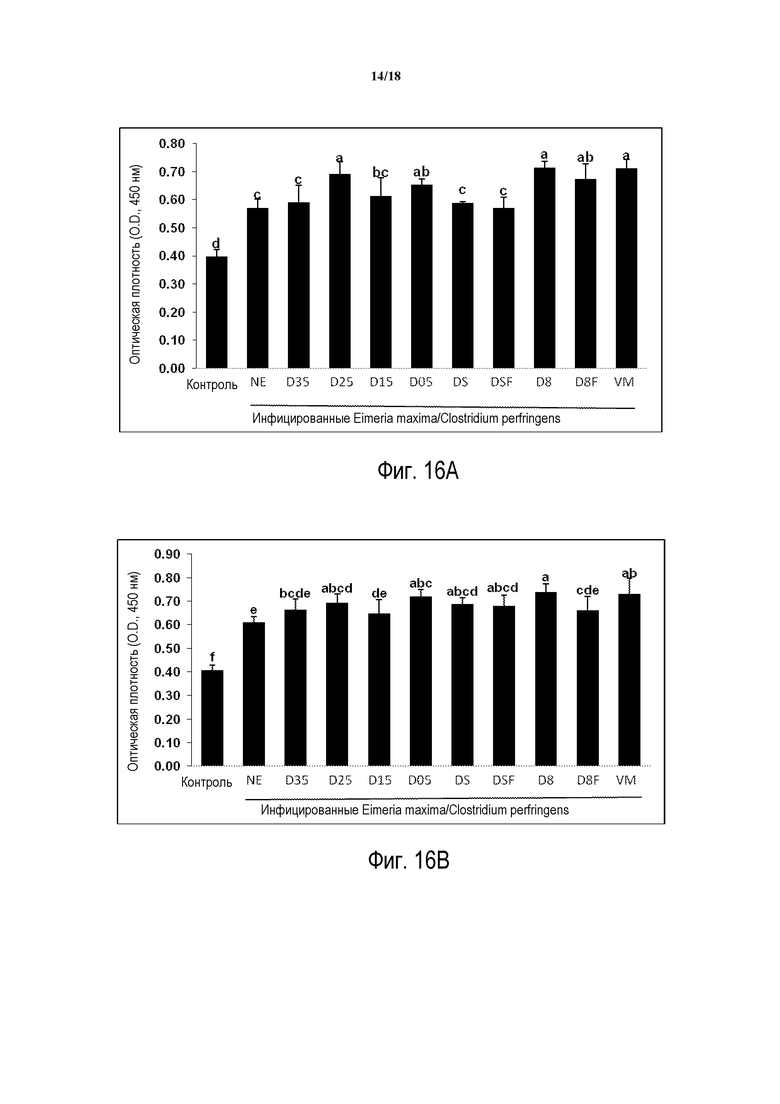
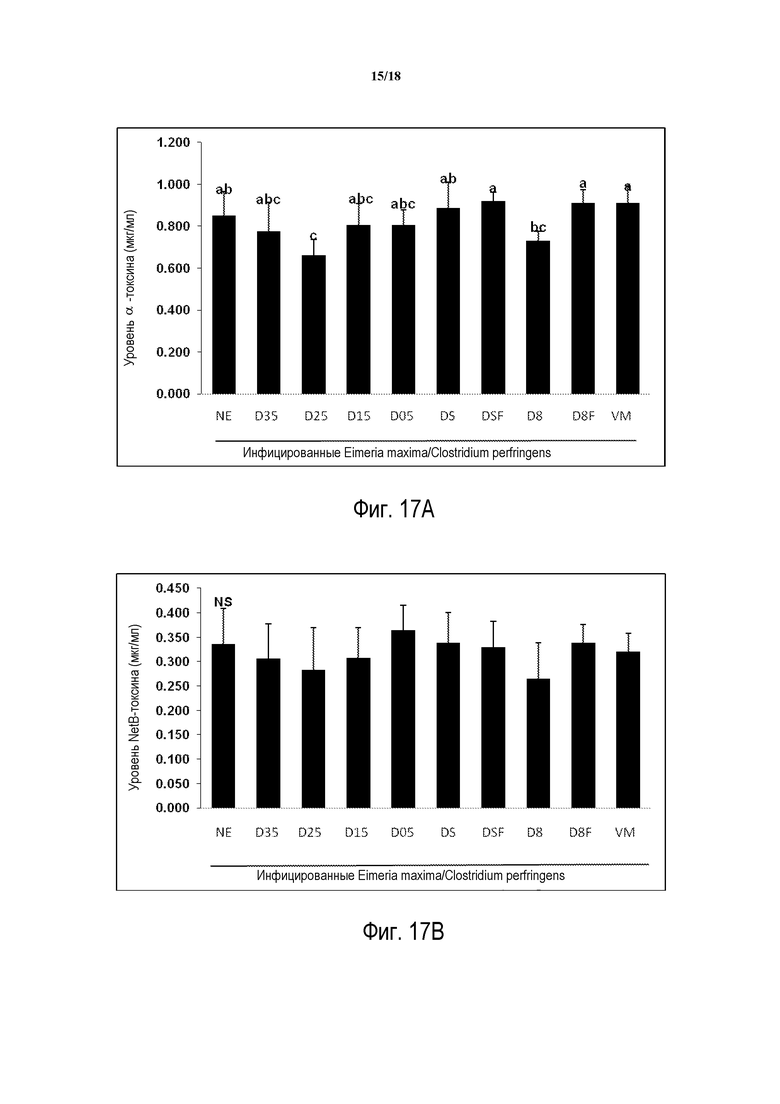

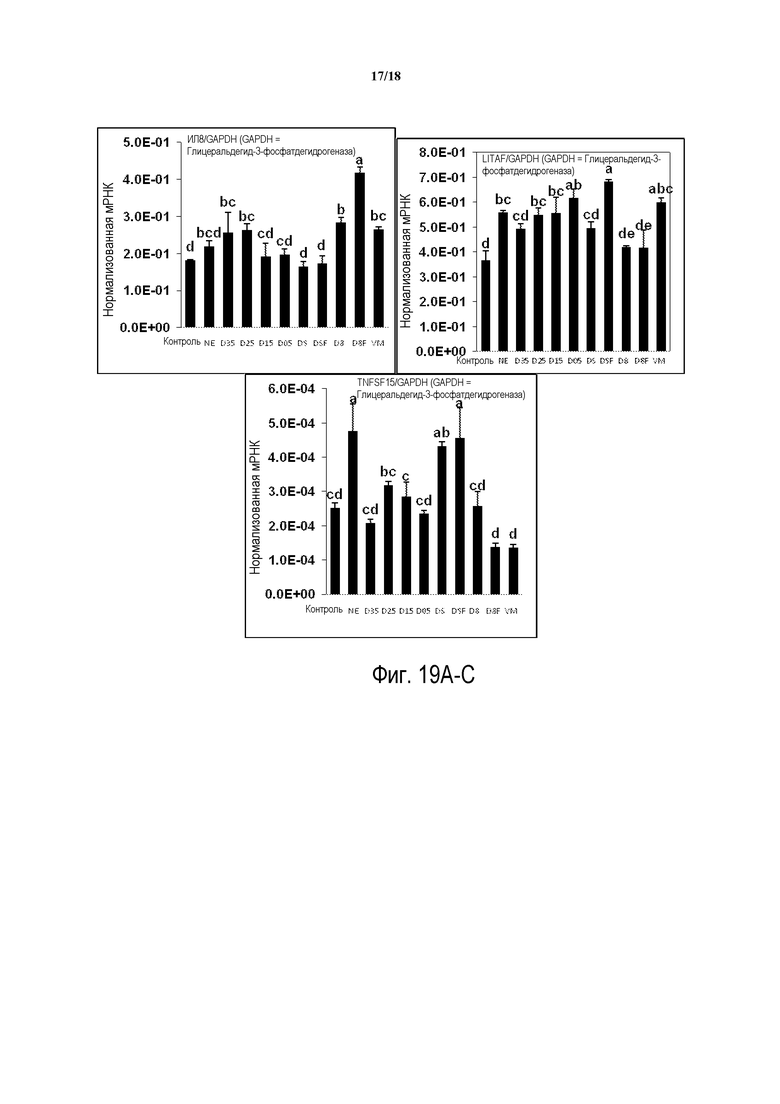

Группа изобретений относится к ветеринарии и предназначена для лечения заболеваний кишечника у птиц и свиней. Используется композиция, содержащая смектитовую глину; дрожжи, дрожжевой маннан, олигосахарид дрожжевого маннана, дрожжевой бета-глюкан или компонент дрожжевой клеточной стенки и глутамат. Композиция вводится в количестве от 100 до 1000 мг на кг веса тела в день (мг/кг/день) или она присутствует в корме в количестве, составляющем от 0,05% (мас./мас.) до 0,50% (мас./мас.) корма. Группа изобретений позволяет улучшить функции желудочно-кишечного тракта у птиц и свиней, восприимчивых к заболеванию кишечника. 2 н. и 64 з.п. ф-лы, 19 ил., 16 табл., 7 пр.
1. Применение композиции для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), или для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium, у птиц или свиней, восприимчивых к заболеванию кишечника, где указанная композиция содержит смесь от 50% (мас./мас.) до 80% (мас./мас.) абсорбирующей токсины Clostridium смектитовой глины в качестве первого ингредиента композиции, от 10% (мас./мас.) до 35% (мас./мас.) второго ингредиента композиции, состоящего по существу из целых дрожжей, дрожжевого маннана из нецелых дрожжей, олигосахарида дрожжевого маннана из нецелых дрожжей, дрожжевой бета-глюкана из нецелых дрожжей, компонента дрожжевой клеточной стенки из нецелых дрожжей, дрожжевой клеточной стенки из нецелых дрожжей или остаток прессования лимонной кислоты, и от 5% (мас./мас.) до 10% (мас./мас.) глутамата в качестве третьего ингредиента композиции, где композиция вводится в количестве от 100 до 1000 мг на кг веса тела в день (мг/кг/день) или она присутствует в корме в количестве, составляющем от 0,05% (мас./мас.) до 0,50% (мас./мас.) корма.
2. Применение по п. 1, где абсорбирующая токсины Clostridium смектитовая глина включает диоктаэдрический смектит.
3. Применение по п. 2, где диоктаэдрический смектит включает монтмориллонитовую глину.
4. Применение по п. 3, где монтмориллонитовая глина включает кальциевую монтмориллонитовую глину.
5. Применение по п. 4, где кальциевая монтмориллонитовая глина включает термически обработанную кальциевую монтмориллонитовую глину.
6. Применение по п. 5, где кальциевую монтмориллонитовую глину при термической обработке нагревают до температуры от 100 до 800°C.
7. Применение по любому из пп. 1-6, где частицы глины имеют размер частиц от 20 до 50 микрон.
8. Применение по любому из пп. 1-6, где второй ингредиент состоит по существу из остатка прессования лимонной кислоты.
9. Применение по п. 7, где второй ингредиент состоит по существу из остатка прессования лимонной кислоты.
10. Применение по любому из пп. 1-6, где второй ингредиент получен из Pichia gnilliermondii.
11. Применение по п. 7, где второй ингредиент получен из Pichia gnilliermondii.
12. Применение по п. 8, где второй ингредиент получен из Pichia gnilliermondii.
13. Применение по п. 9, где второй ингредиент получен из Pichia gnilliermondii.
14. Применение по любому из пп. 1-6, где глутамат содержит мононатрийглутамат или глутамат содержит глутаминовую кислоту, альфа-кетоглутарат, глутамин, L-глутаминовую кислоту или L-глутамин.
15. Применение по любому из пп. 1-6, где глутамат содержит мононатрийглутамат.
16. Применение по п. 7, где глутамат содержит мононатрийглутамат.
17. Применение по п. 8, где глутамат содержит мононатрийглутамат.
18. Применение по п. 9, где глутамат содержит мононатрийглутамат.
19. Применение по п. 10, где глутамат содержит мононатрийглутамат.
20. Применение по п. 11, где глутамат содержит мононатрийглутамат.
21. Применение по п. 12, где глутамат содержит мононатрийглутамат.
22. Применение по п. 13, где глутамат содержит мононатрийглутамат.
23. Применение по любому из пп. 1-6, где композиция присутствует в корме в количестве, включающем от 0,05% (мас./мас.) до 0,50% (мас./мас.) корма.
24. Применение по п. 22, где композиция присутствует в корме в количестве, включающем от 0,05% (мас./мас.) до 0,50% (мас./мас.) корма.
25. Применение по п. 24, где композиция присутствует в корме в количестве, включающем от 0,05% (мас./мас.) до 0,35% (мас./мас.) корма.
26. Применение по п. 24, где композиция присутствует в корме в количестве, включающем приблизительно 0,25% (мас./мас.) корма.
27. Применение по любому из пп. 1-6, где композиция содержит приблизительно 60% (мас./мас.) первого ингредиента, приблизительно 35% (мас./мас.) второго ингредиента и приблизительно 5% третьего ингредиента или приблизительно 80% первого ингредиента, приблизительно 10% (мас./мас.) второго ингредиента и приблизительно 10% третьего ингредиента.
28. Применение по любому из пп. 1-6, где птицей является курица, утка, гусь, индейка, перепел или голубь.
29. Применение по п. 22, где птицей является курица, утка, гусь, индейка, перепел или голубь.
30. Применение по п. 25, где птицей является курица, утка, гусь, индейка, перепел или голубь.
31. Применение по п. 26, где птицей является курица, утка, гусь, индейка, перепел или голубь.
32. Применение по п. 28, где лекарственное средство предназначено для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), у птиц или свиней, нуждающихся в этом.
33. Применение по п. 29, где лекарственное средство предназначено для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), у птиц или свиней, нуждающихся в этом.
34. Применение по п. 30, где лекарственное средство предназначено для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), у птиц или свиней, нуждающихся в этом.
35. Применение по п. 31, где лекарственное средство предназначено для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), у птиц или свиней, нуждающихся в этом.
36. Применение по п. 28, где лекарственное средство предназначено для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium.
37. Применение по п. 29, где лекарственное средство предназначено для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium.
38. Применение по п. 30, где лекарственное средство предназначено для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium.
39. Применение по п. 31, где лекарственное средство предназначено для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium.
40. Корм, содержащий композицию для лечения заболевания кишечника, включая бактериальное заболевание кишечника, включая некротический энтерит (NE), или для уменьшения эффектов воздействия бактериального заболевания кишечника, вызванного микроорганизмом, включая бактерии Clostridium, у птиц или свиней, восприимчивых к заболеванию кишечника, содержащую смесь от 50% (мас./мас.) до 80% (мас./мас.) абсорбирующей токсины Clostridium смектитовой глины в качестве первого ингредиента композиции, от 10% (мас./мас.) до 35% (мас./мас.) второго ингредиента композиции, состоящего по существу из целых дрожжей, дрожжевого маннана из нецелых дрожжей, олигосахарида дрожжевого маннана из нецелых дрожжей, дрожжевой бета-глюкана из нецелых дрожжей, компонента дрожжевой клеточной стенки из нецелых дрожжей, дрожжевой клеточной стенки из нецелых дрожжей или остаток прессования лимонной кислоты, и от 5% (мас./мас.) до 10% (мас./мас.) глутамата в качестве третьего ингредиента композиции,
где композиция присутствует в корме в количестве, составляющем от 0,05% (мас./мас.) до 0,50% (мас./мас.) корма.
41. Корм по п. 40, где абсорбирующая токсины Clostridium смектитовая глина включает диоктаэдрический смектит.
42. Корм по п. 41, где диоктаэдрический смектит включает монтмориллонитовую глину.
43. Корм по п. 42, где диоктаэдрический смектит включает монтмориллонитовую глину.
44. Корм по п. 43, где кальциевая монтмориллонитовая глина включает термически обработанную кальциевую монтмориллонитовую глину.
45. Корм по п. 44, где кальциевую монтмориллонитовую глину при термической обработке нагревают до температуры от 100 до 800°C.
46. Корм по любому из пп. 40-45, где частицы глины имеют размер частиц от 20 до 50 микрон.
47. Корм по любому из пп. 40-45, где второй ингредиент состоит по существу из остатка прессования лимонной кислоты.
48. Корм по п. 46, где второй ингредиент состоит по существу из остатка прессования лимонной кислоты.
49. Корм по любому из пп. 40-45, где второй ингредиент получен из Pichia gnilliermondii.
50. Корм по п. 46, где второй ингредиент получен из Pichia gnilliermondii.
51. Корм по п. 47, где второй ингредиент получен из Pichia gnilliermondii.
52. Корм по п. 48, где второй ингредиент получен из Pichia gnilliermondii.
53. Корм по любому из пп. 40-45, где глутамат содержит мононатрийглутамат или глутамат содержит глутаминовую кислоту, альфа-кетоглутарат, глутамин, L-глутаминовую кислоту или L-глутамин.
54. Корм по любому из пп. 40-45, где глутамат содержит мононатрийглутамат.
55. Корм по п. 46, где глутамат содержит мононатрийглутамат.
56. Корм по п. 47, где глутамат содержит мононатрийглутамат.
57. Корм по п. 48, где глутамат содержит мононатрийглутамат.
58. Корм по п. 49, где глутамат содержит мононатрийглутамат.
59. Корм по п. 50, где глутамат содержит мононатрийглутамат.
60. Корм по п. 51, где глутамат содержит мононатрийглутамат.
61. Корм по п. 52, где глутамат содержит мононатрийглутамат.
62. Корм по любому из пп. 40-45, где композиция присутствует в сырье в количестве, включающем от 0,05% (мас./мас.) до 0,35% (мас./мас.) корма.
63. Корм по п. 53, где композиция присутствует в корме в количестве, включающем от 0,05% (мас./мас.) до 0,35% (мас./мас.) корма.
64. Корм по п. 55, где композиция присутствует в корме в количестве, включающем от 0,05% (мас./мас.) до 0,35% (мас./мас.) корма.
65. Корм по п. 55, где композиция присутствует в сырье в количестве, включающем приблизительно 0,25% (мас./мас.) корма.
66. Корм по любому из пп. 40-45, где композиция содержит приблизительно 60% (мас./мас.) первого ингредиента, приблизительно 35% (мас./мас.) второго ингредиента и приблизительно 5% третьего ингредиента; или приблизительно 80% первого ингредиента, приблизительно 10% (мас./мас.) второго ингредиента и приблизительно 10% третьего ингредиента.
| US 7939066 B2, 10.05.2011 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ВЕЛИЧИНЫ И НАПРАВЛЕНИЯ ДЕФОРМАЦИЙ ПОВРЕЖДЕННОГО КУЗОВА ТРАНСПОРТНОГО СРЕДСТВА ПРИ ПРАВКЕ | 2005 |
|
RU2314172C2 |
| БОБРОВНИЧИЙ В.И | |||
| и др | |||
| Дисбактериозы кишечника у детей: причины, диагностика, лечение | |||
| Учебно-методическое пособие, Минск, 2007, 143 с | |||
| SONG M | |||
| et al., Dietary clays alleviate diarrhea of weaned pigs | |||
| J Anim Sci | |||
| Изложница с суживающимся книзу сечением и с вертикально перемещающимся днищем | 1924 |
|
SU2012A1 |
| Способ изготовления струн | 1924 |
|
SU345A1 |
| PMID:21908641. | |||
Авторы
Даты
2018-11-23—Публикация
2013-10-02—Подача