Область техники, к которой относится изобретение
Настоящее изобретение относится к осуществляемому in vitro способу раннего выявления вспышки некротического энтерита в популяции птиц. Более конкретно, в настоящем изобретении представлен способ отслеживания количественного соотношения двух генов, кодирующих токсины (netB/cpa и cpa/netB соответственно), с течением времени в материале образца фекалий, что обеспечивает выявление раннего признака вспышки некротического энтерита.
Предпосылки изобретения
Clostridium perfringens представляет собой распространенный патоген, использующий комплекс токсинов, чтобы вызывать гистотоксические и кишечные инфекции у животных, а также у людей. C. perfringens является грамположительным, палочковидным, спорообразующим, толерантным к кислороду анаэробом. Не все штаммы C. perfringens вирулентны. Вирулентные штаммы C. perfringens традиционно классифицируют на пять связанных с токсинами типов (A, B, C, D и E) на основании выработки четырех предполагаемых основных токсинов (альфа, бета, эпсилон и йота). В зависимости от вырабатываемых токсинов (основных и дополнительных токсинов, таких как NetB, Cpb2 и другие) у различных организмов-хозяев могут вызываться синдромы/заболевания, специфичные для подвидов C. perfringens [Rood, J. I. (1998) «Virulence genes of Clostridium perfringens»; Annual Review of Microbiology 52: 333-360]. Токсины кодируются полинуклеотидными последовательностями, расположенными на хромосоме и/или на плазмидах с генами токсинов [Popoff, M. R. and P. Bouvet (2013). Genetic characteristics of toxigenic Clostridia and toxin gene evolution» Toxicon 75: 63-89].
Как патоген животных C. perfringens является ответственным за несколько серьезных заболеваний, в том числе некротический энтерит птиц, на борьбу с которым в системе мирового сельского хозяйства расходуется примерно 6 миллиардов долларов США в год [Wade, B., Keyburn, A.L. (2015), «The true cost of necrotic enteritis» World Poultry 31, 16–17].
Некротический энтерит (NE) представляет собой заболевание кишечника домашней птицы, которое было впервые описано в 1961 году. NE у кур проявляется в виде острой или хронической энтеротоксемии. Острая форма заболевания приводит к значительному уровню смертности, обусловленному развитием некротических очагов в стенке кишки, в то время как хроническая форма заболевания приводит к значительной потере продуктивности и здоровья. В ранних исследованиях NE предполагалось, что главным фактором вирулентности, связанным с заболеванием, являлся альфа-токсин (известный как Cpa или Plc), обладающий активностью фосфолипазы C и сфингомиелиназы [Keyburn, A. L. et al. (2006) «Alpha-toxin of Clostridium perfringens is not an essential virulence factor in necrotic enteritis in chickens», Infection and Immunity 74(11): 6496-6500]. Все штаммы C. perfringens несут ген, кодирующий альфа-токсин [Rood, J. I. (1998) «Virulence genes of Clostridium perfringens», Annual Review of Microbiology 52: 333-360; Titball, R. W., et al. (1999) «The Clostridium perfringens α-toxin.» Anaerobe 5(2): 51-64]. Однако недавние исследования показали, что альфа-токсин, по-видимому, не является важным фактором вирулентности, поскольку штаммы, мутантные по альфа-токсину, были способны вызывать NE, что ставит под сомнение роль альфа-токсина в заболевании в целом. В более поздних исследованиях было высказано предположение, что новый порообразующий токсин NetB играет основную ключевую роль в развитии данного заболевания [Keyburn, A. L. et al. (2008) «NetB, a new toxin that is associated with avian necrotic enteritis caused by Clostridium perfringens» PLoS Pathogens 4(2)].
Известно, что NE поражает бройлеров, кур-несушек, индеек и перепелов. Клиническая форма наиболее часто наблюдается у бройлеров в возрасте от двух до пяти недель. Как правило, это также происходит близко ко времени перевода рациона со стартерного корма на ростовой корм и близко к периоду перехода от материнской иммунной системы к адаптивной иммунной системе соответственно, поэтому условно-патогенный C. perfringens может воспользоваться преимуществом данного переходного периода в кишечной среде и пролиферировать [Timbermont, L. et al. (2011) «Necrotic enteritis in broilers: An updated review on the pathogenesis» Avian Pathology 40(4): 341-347].
Поскольку не все штаммы Clostridium perfringens способны вызывать NE, требуются дифференциальные анализы для того, чтобы дополнительно отличить штаммы, вызывающие NE. Молекулярные способы, такие как ПЦР, AFLP (полиморфизм длины амплифицированных фрагментов) и/или PFGE (гель-электрофорез в импульсном поле) доступны для идентификации штаммов Clostridium perfringens. Такие способы, однако, все еще имеют ограниченную количественную мощность в отношении распознавания штаммов Clostridium perfringens, вызывающих NE.
Более того, способ раннего выявления вспышки NE в популяции птиц представляет особый интерес, так как подобное раннее выявление позволило бы осуществлять раннее вмешательство и обеспечило бы фермерам преимущество в несколько дней по сравнению с традиционными способами выявления NE в популяции птиц. Таким образом, острой необходимостью являлось обеспечение быстрого и надежного неинвазивного осуществляемого ante mortem способа раннего выявления вспышки некротического энтерита в популяции птиц.
Краткое описание изобретения
Соответственно, одной целью настоящего изобретения является обеспечение осуществляемого in vitro способа раннего выявления вспышки некротического энтерита в популяции птиц, при этом способ включает:
a) сбор материала образца фекалий, полученного от популяции птиц, в последовательные моменты времени и
b) определение количественного соотношения маркерных генов netB и cpa, содержащихся в материале образца, полученном на стадии a);
где реверсия количественного соотношения netB и cpa с течением времени («переход») является ранним признаком вспышки некротического энтерита.
Дополнительной целью настоящего изобретения является обеспечение осуществляемого in vitro способа контроля статуса по некротическому энтериту в популяции птиц, при этом способ включает отслеживание количественного соотношения маркерных генов netB и cpa, содержащихся в образцах фекалий, собранных в последовательные моменты времени, где
a) реверсия количественного соотношения netB и cpa с течением времени («переход») указывает на необходимость кормового или терапевтического вмешательства, и/или
b) обратная реверсия количественного соотношения netB и cpa с течением времени («обратный переход») после введения кормовых или терапевтических средств указывает на эффективность кормового или терапевтического вмешательства.
Дополнительно, настоящее изобретение предусматривает набор для мультиплексной qPCR, подходящий для применения в вышеописанном способе, при этом набор содержит пару праймеров, специфичную для netB , и пару праймеров, специфичную для cpa.
Ключевые аспекты настоящего изобретения подробно описаны далее.
Подробное описание изобретения
Авторы настоящего изобретения обнаружили, что реверсия количественного соотношения маркерных генов netB и cpa (т.е. соотношения netB/cpa и cpa/netB соответственно) систематически наблюдается перед установлением морфологического диагноза некротического энтерита в популяции птиц. Таким образом, указанная реверсия количественного соотношения маркерных генов netB и cpa может быть использована в качестве диагностического маркера для прогнозирования начала и/или вспышки некротического энтерита в поголовье птиц.
Соответственно, настоящее изобретение направлено на осуществляемый in vitro способ раннего выявления вспышки некротического энтерита в популяции птиц, при этом способ включает:
a) сбор материала образца фекалий, полученного от популяции птиц, в последовательные моменты времени и
b) определение количественного соотношения маркерных генов netB и cpa, содержащихся в материале образца, полученном на стадии a);
где реверсия количественного соотношения netB и cpa с течением времени («переход») является ранним признаком вспышки некротического энтерита.
В контексте настоящего изобретения термин «маркерный ген» включает в себя функциональные фрагменты соответствующего маркерного гена; т.е. функциональные фрагменты netB и cpa.
Термин «некротический энтерит»/NE относится как к клиническому, так и к субклиническому/латентному состоянию. Соответственно, термин «вспышка» следует понимать как внезапное или спонтанное возникновение заболевания (некротического энтерита) в нормальной популяции птиц, а также его индуцирование посредством введения Clostridium perfringens отдельно или в совокупности с созданием предрасполагающих условий [Shojadoost, B., Vince, A.R., Prescott, J.F., 2012. The successful experimental induction of necrotic enteritis in chickens by Clostridium perfringens: a critical review. Vet. Res. 43, 74; Fernandes da Costa, S.P., Mot, D., Bokori-Brown, M., Savva, C.G., Basak, A.K., Van Immerseel, F., Titball, R.W., 2013. Protection against avian necrotic enteritis after immunisation with NetB genetic or formaldehyde toxoids. Vaccine 31, 4003–4008; Williams, R.B., Marshall, R.N., La Ragione, R.M., Catchpole, J., 2003. A new method for the experimental production of necrotic enteritis and its use for studies on the relationships between necrotic enteritis, coccidiosis and anticoccidial vaccination of chickens. Parasitol. Res. 90, 19–26; Wu, S.B., Rodgers, N., Choct, M., 2010. Optimized necrotic enteritis model producing clinical and subclinical infection of Clostridium perfringens in broiler chickens. Avian Dis. 54, 1058–1065; Wu S-B, Stanley D, Rodgers N, Swick RA, Moore RJ. Two necrotic enteritis predisposing factors, dietary fishmeal and eimeria infection, induce large changes in the caecal microbiota of broiler chickens. Vet Microbiol 2014;169:188e97].
Авторы настоящего изобретения обнаружили, что промежуток времени между моментом реверсии количественного соотношения маркерных генов netB и cpa и установлением морфологического диагноза некротического энтерита с помощью традиционных методик находится в диапазоне от одного дня до пяти дней.
Пример такой реверсии или перехода: соотношение netB/cpa может составлять < 1 (что соответствует соотношению cpa/netB > 1) в один день, а на следующий день соотношение netB/cpa может составлять > 1 (что соответствует соотношению cpa/netB < 1).
В соответствии с этими наблюдениями вышеуказанный способ может дополнительно включать
c) определение момента времени, в который происходит реверсия количественного соотношения маркерных генов netB и cpa («точки перехода»).
Указанная точка перехода, например, может быть определена путем графического анализа. Следовательно, необходимо построить два графика. На первом графике представлено количество netB в зависимости от момента времени сбора образца; при этом на втором графике представлено количество cpa в зависимости от момента времени сбора образца. Исходя из точки пересечения этих двух графиков, можно зарегистрировать точку перехода.
Полинуклеотидные последовательности netB и cpa известны из уровня техники. Тем не менее для целей ясности и полноты информации консенсусная последовательность netB представлена под SEQ ID NO: 1 и консенсусная последовательность cpa представлена под SEQ ID NO: 2. Ген cpa расположен в хромосоме у всех штаммов C. perfringens (патогенных и непатогенных); в то время как ген netB расположен в плазмиде, несущей гены токсинoв, патогенных (индуцирующих NE) штаммов C. perfringens.
Материал образца фекалий из стадии a) может представлять собой смешанный образец фекалий, состоящий из отдельных образцов, отобранных случайным образом.
В контексте настоящего изобретения термин «фекалии» следует понимать как продукт от субъектов-птиц, полученный в результате дефекации через клоаку. Таким образом, материал образца фекалий получают неинвазивным способом и собирают в соответствии с методиками отбора образцов, описанными ниже.
Образцы фекалий, которые требуется собрать в конкретной популяции птиц, предпочтительно собирают из определенного количества мест в пределах помещения для содержания животных с целью получения объединенного образца, репрезентативного для популяции животных в целом.
Размер выборки (т.е. количество образцов фекалий, которые необходимо собрать; при этом каждый образец собирают в определенном месте в пределах помещения для содержания животных) следует определять с учетом фактической плотности размещения животных, т.е. с учетом фактического количества животных, принадлежащих к тестируемой популяции птиц.
Размер выборки можно рассчитать с помощью следующей формулы
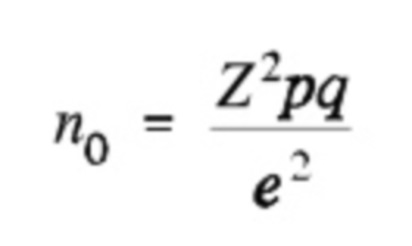 ,
,
где
n0 представляет собой рекомендованный размер выборки,
Z равняется 1,96 при доверительном уровне, составляющем 95%,
p представляет собой расчетную долю популяции, характеризующуюся наличием рассматриваемого атрибута, q равняется 1-p, и
e представляет собой доверительный интервал, выраженный в виде десятичной дроби.
Как правило, для большинства популяций сельскохозяйственных птиц достаточно как минимум от 80 до 100 отдельных образцов фекалий. Например, для поголовья бройлеров из 20000 животных требуется 96 отдельных образцов при доверительном уровне 95%.
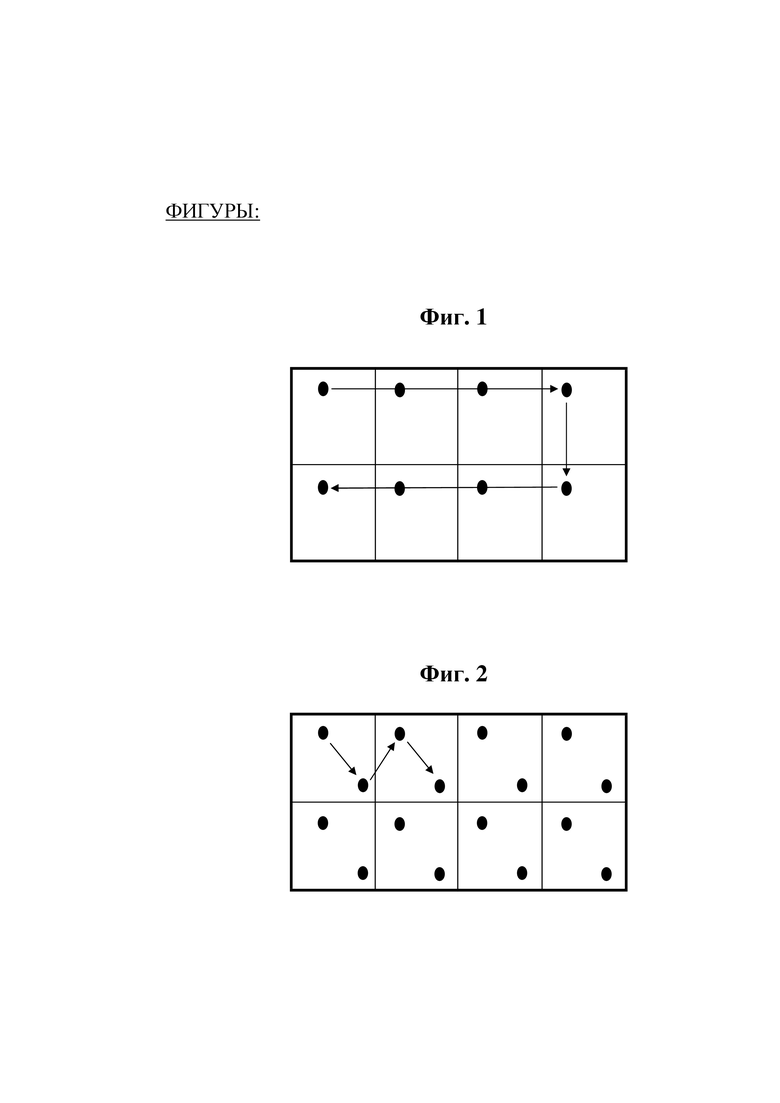
Для получения материала объединенного образца фекалий в соответствии с требованиями для стадии a) могут применяться несколько способов отбора образцов. В одном варианте осуществления объединенный образец фекалий получают с помощью систематического отбора образцов по сетке (систематического случайного отбора образцов). Для осуществления этого способа помещение для содержания животных или территорию, на которой содержится популяция птиц, делят на однородные по размеру ячейки или подобласти, образующие сетку, исходя из необходимого количества отдельных образцов фекалий (т.е. размера выборки). Затем в пределах первой ячейки сетки определяют выбранный случайным образом участок сбора образцов, и в указанном участке собирают первый образец. Наконец, дополнительные образцы получают последовательно из соседних ячеек, например, змеевидным, угловым или зигзагообразным образом, с использованием такого же относительного местоположения в пределах каждой ячейки. Выбранная случайным образом исходная точка может быть получена с помощью игральных костей или генератора случайных чисел.
Вышеуказанная процедура может необязательно повторяться для получения повторных выборок. Т.е. устанавливается новое выбранное случайным образом положение для одной точки сбора, которое должно повторяться во всех ячейках. С помощью анализа повторных выборок можно определить вариабельность оценки среднего значения, полученной с помощью исходных выборок.
Соответственно, вышеупомянутые способы могут дополнительно предусматривать следующие подстадии:
(a1) разделение помещения для содержания животных или территории, на которой содержится популяция животных, на равное количество однородных по размеру ячеек, образующих сетку;
(a2) определение по меньшей мере одного выбранного случайным образом участка сбора образцов в пределах первой ячейки и сбор одного первого образца из указанного выбранного случайным образом участка сбора образцов; и
(a3) проведение последовательного сбора отдельных образцов фекалий из остальных ячеек с использованием участков сбора образцов с таким же относительным местоположением в пределах каждой ячейки; и необязательно (a4) повторение стадий (a2) и (a3) для получения по меньшей мере одной повторной выборки.
Размер выборки соответствует количеству ячеек, образующих сетку, в случае сбора одного образца на ячейку. В целом, в случае, если для каждой ячейки необходимо собрать x образцов, размер выборки представляет собой количество ячеек, деленное на x.
Способ систематического отбора образцов по сетке можно легко реализовать в полевых условиях. Таким образом, можно избежать чрезмерной или недостаточной представленности подобластей. Паттерны систематического отбора образцов по сетке в соответствии с настоящим изобретением представлены в качестве примера на фиг. 1 и фиг. 2.
Другой способ отбора образцов представляет собой стратифицированный случайный отбор образцов (т.е. случайный отбор образцов в сетке). В данном случае образцы получают последовательно из соседних ячеек сетки, однако местоположение участка отбора образца в пределах каждой ячейки является случайным.
В качестве альтернативы образцы могут быть собраны посредством простого случайного отбора образцов, в случае чего образцы собирают из случайных местоположений (без привязки к сетке) по всему пространству, в котором содержатся животные. Для этого способа необходимо использовать формальный подход для определения случайных местоположений отбора образцов, например, на основе генератора случайных чисел.
Образцы можно собирать вручную с помощью шпателя или аналогичного инструмента и сразу же переносить в сосуд или пробирку для сбора образцов.
В альтернативном варианте осуществления объединенный образец фекалий может быть получен с использованием способа «галоши», осуществляемого посредством обхода помещения с использованием маршрута, который обеспечит получение репрезентативных образцов для всех частей помещения или соответствующего сектора. Такой маршрут, например, может характеризоваться однородной формой змеевидных или извилистых линий, угловых линий или зигзагообразных линий. Бахилы для сбора образцов с пола, обладающие достаточными поглощающими свойствами для впитывания влаги, являются особенно подходящими. Однако, трубчатые марлевые чулки также являются приемлемыми.
Подходящие массы отдельных образцов при сборе составляют, например, от 0,1 до 20 г, в частности, от 0,2 до 10 г, предпочтительно от 0,5 до 5 г. Образцы можно собирать вручную с помощью шпателя, захвата для помета или аналогичного устройства.
После завершения сбора образцов материал образца подлежит гомогенизации. Специалисту в данной области известны подходящие широко применяемые способы гомогенизации. Полученный таким образом объединенный образец может быть разбавлен и/или стабилизирован. Стабилизация образца в данном контексте означает защиту материала нуклеиновой кислоты, содержащегося в образце, от воздействия нуклеаз в растворе, например, с помощью применения буферного раствора, содержащего ингибиторы нуклеаз.
Материал образца требуется собирать в последовательные моменты времени. Материал образца фекалий можно собирать и анализировать еженедельно, ежедневно или ежечасно. Например, тестируемые образцы фекалий можно собирать и анализировать ежедневно в период от рождения до убоя.
Популяция птиц предпочтительно представляет собой поголовье птиц. Поголовье птиц в соответствии с настоящим изобретением предпочтительно представляет собой домашнюю птицу. Предпочтительной домашней птицей в соответствии с настоящим изобретением являются куры, индейки, утки и гуси. Домашняя птица может иметь характеристики, оптимальные для получения поголовья молодняка. Данный тип домашней птицы также называется родительскими и прародительскими животными. Предпочтительными родительскими и прародительскими особями соответственно являются (пра)родительские бройлеры, (пра)родительские утки, (пра)родительские индейки и (пра)родительские гуси.
Домашняя птица в соответствии с настоящим изобретением также может быть выбрана из декоративной птицы и пернатой дичи. Предпочтительной декоративной птицей или пернатой дичью являются павлины, фазаны, куропатки, цесарки, перепела, глухари, гуси, голуби и лебеди. Кроме того, предпочтительной домашней птицей в соответствии с настоящим изобретением являются страусы и попугаи. Наиболее предпочтительной домашней птицей в соответствии с настоящим изобретением являются бройлеры.
В случае поголовий бройлеров образцы фекалий можно собирать и анализировать ежедневно в ходе фазы начального роста (стартерная фаза, от дня 5 до дня 10) и/или в ходе фазы усиленного роста (от дня 11 до дня 18), а также необязательно на более поздней стадии.
В одном варианте осуществления материал образца фекалий, в частности материал образца фекалий от поголовья бройлеров, собирают и анализируют ежедневно, начиная с дня 10.
Маркерные гены netB и cpa могут быть выделены из образцов фекалий перед количественным определением. Выделение полинуклеотидов, например, может проводиться посредством экстракции с помощью способа с применением бромида цетилтриметиламмония (CTAB) или с помощью различных коммерческих наборов для экстракции нуклеиновых кислот, в случае которых лизис клеток достигается посредством химического лизиса и/или механического разрушения клеток, и нуклеиновая кислота захватывается кремнеземными матрицами или магнитными гранулами, покрытыми кремнеземом. Коммерческие наборы для экстракции, предназначенные специально для фекального материала или грубого материала, являются особенно подходящими.
Маркерные гены можно выявлять и/или определять количественно посредством общеизвестных способов, таких как секвенирование, гибридизация или различные методики ПЦР, известные из уровня техники.
В альтернативном варианте осуществления маркерные гены, содержащиеся в образце от животного, могут быть количественно определены непосредственно, например, с помощью методик ПЦР, qPCR, секвенирования или гибридизации.
В одном конкретном варианте осуществления количественное соотношение маркерных генов netB и cpa или гомологов или функциональных фрагментов этих маркерных генов, содержащихся в материале образца, полученном на стадии a), определяют с помощью qPCR.
В вышеуказанных способах по настоящему изобретению один или более олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
могут применяться в качестве праймера для ПЦР и/или в качестве зонда для ПЦР.
При этом полинуклеотид, представленный под SEQ ID NO: 3, представляет собой праймер для ПЦР (прямой) для выявления netB. Полинуклеотид, представленный под SEQ ID NO: 4, представляет собой праймер для ПЦР (обратный) для выявления netB. Полинуклеотид, представленный под SEQ ID NO: 5, представляет собой зонд для ПЦР для выявления netB.
Кроме того, полинуклеотид, представленный под SEQ ID NO: 6, представляет собой праймер для ПЦР (прямой) для выявления cpa. Полинуклеотид, представленный под SEQ ID NO: 7, представляет собой праймер для ПЦР (обратный) для выявления cpa. Полинуклеотид, представленный под SEQ ID NO: 8, представляет собой зонд для ПЦР для выявления cpa.
В соответствии с вышеизложенным, настоящее изобретение дополнительно направлено на применение олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
для раннего выявления вспышки некротического энтерита в популяции птиц.
Настоящее изобретение предусматривает вышеописанные неинвазивные способы раннего выявления вспышки NE, которые могут быть осуществлены ante mortem. Это позволяет фермеру принимать меры, направленные против вспышки некротического энтерита, на ранней стадии.
Соответственно, настоящее изобретение также относится к применению любого из вышеупомянутых способов для определения необходимости кормовых или терапевтических вмешательств.
Такие вмешательства или меры включают кормление или введение веществ с лечебно-профилактическими свойствами, таких как зоотехнические кормовые добавки, или терапевтических средств. Термин «введение» или связанные с ним термины включает пероральное введение. Пероральное введение может осуществляться с помощью питьевой воды, зонда для перорального введения, распыляемого аэрозоля или корма для животных. Термин «зоотехническая кормовая добавка» относится к любой добавке, используемой для положительного воздействия на продуктивность здоровых животных или используемой для положительного воздействия на окружающую среду. Примерами зоотехнических кормовых добавок являются усилители перевариваемости, т.е. вещества, которые при скармливании животным повышают перевариваемость рациона за счет воздействия на целевые кормовые материалы; стабилизаторы кишечной микрофлоры; микроорганизмы или другие вещества с химически установленным составом, которые при скармливании животным проявляют положительный эффект в отношении микрофлоры кишечника; или вещества, которые положительно воздействуют на окружающую среду. Предпочтительно, вещества с лечебно-профилактическими свойствами выбраны из группы, состоящей из пробиотических средств, пребиотических средств, лекарственных составов на основе растительного сырья, органических/жирных кислот, бактериофагов и бактериолитических ферментов или любых их комбинаций.
Кроме того, авторы настоящего изобретения обнаружили, что обратная реверсия («обратный переход») количественного соотношения netB и cpa с течением времени указывает на регрессию или исчезновение некротического энтерита в популяции птиц. Указанная регрессия или исчезновение могут происходить естественным путем (в виде спонтанного выздоровления) или могут быть обусловлены терапевтическим или кормовым вмешательством.
Соответственно, настоящее изобретение предусматривает осуществляемый in vitro способ контроля статуса по некротическому энтериту в популяции птиц, при этом способ включает отслеживание количественного соотношения маркерных генов netB и cpa, содержащихся в образцах фекалий, собранных в последовательные моменты времени, где
a) реверсия количественного соотношения netB и cpa с течением времени («переход») указывает на необходимость кормового или терапевтического вмешательства, и
b) обратная реверсия количественного соотношения netB и cpa с течением времени («обратный переход») после введения кормовых или терапевтических средств указывает на эффективность кормового или терапевтического вмешательства.
Момент времени, в который происходит обратная реверсия («точка обратного перехода») может быть определен графически, подобно тому, как описано выше для точки перехода.
Термин «контроль статуса по некротическому энтериту» следует понимать как оценку наличия или отсутствия какого-либо признака вспышки некротического энтерита или регрессии/исчезновения некротического энтерита соответственно.
Подходящие материалы образцов и способы сбора образцов для данного способа соответствуют описанным выше.
Кормовое или терапевтическое вмешательство может включать введение веществ, выбранных из группы, состоящей из пробиотических средств, пребиотических средств, лекарственных составов на основе растительного сырья, органических/жирных кислот, бактериофагов и бактериолитических ферментов или любых их комбинаций. Особенно предпочтительными являются пробиотики.
Соответственно, настоящее изобретение дополнительно относится к пробиотическим средствам для применения при лечении некротического энтерита, при этом вспышку некротического энтерита выявляют посредством любого из вышеупомянутых способов.
В качестве примера вышеописанных способов контроля статуса по некротическому энтериту в популяции птиц, некротический энтерит диагностируют на основании реверсии количественного соотношения netB и cpa с течением времени; например, наблюдается переход соотношения netB/cpa от значения < 1 к значению > 1. Непосредственно после постановки диагноза фермер совершает вмешательство, например, посредством введения пробиотических средств. Количественное соотношение netB и cpa, содержащихся в образцах фекалий, собранных в последовательные моменты времени, продолжают дополнительно отслеживать. В случае, если вмешательство является эффективным, соотношение netB и cpa снова меняется, например, наблюдается переход соотношения netB/cpa от значения > 1 к значению < 1.
В одном варианте осуществления вышеописанных способов контроля статуса по некротическому энтериту в популяции птиц один или более олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
применяют в качестве праймера для ПЦР и/или в качестве зонда для ПЦР.
В соответствии с вышеизложенным, настоящее изобретение дополнительно относится к применению олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
для определения эффективности кормовых или терапевтических вмешательств.
Настоящее изобретение дополнительно предусматривает диагностический набор для мультиплексной qPCR для определения количественного соотношения netB и cpa и для отслеживания количественного соотношения netB и cpa с течением времени соответственно.
Указанный набор содержит пару праймеров для выявления netB и пару праймеров для выявления cpa, где пара праймеров для netB предусматривает
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO:3, и
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
и пара праймеров для cpa предусматривает
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6, и
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7.
Необязательно набор для мультиплексной qPCR в соответствии с настоящим изобретением может дополнительно содержать один или более зондов для выявления netB и/или один или более зондов для выявления cpa.
В одном варианте осуществления набор для мультиплексной qPCR содержит, в дополнение к вышеупомянутой паре праймеров для netB и cpa, зонд для выявления netB и зонд для выявления cpa,
где зонд для выявления netB предусматривает
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
и зонд для выявления cpa предусматривает
олигонуклеотиды, характеризующиеся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 8.
Набор может дополнительно содержать буферные растворы, такие как буфер для ПЦР; соли магния; дезоксинуклеотидтрифосфаты (dNTP). Набор может также содержать такие элементы, как пробирки для сбора образцов, реагенты для выделения нуклеиновых кислот и/или инструкции по их применению.
Варианты применения способов в соответствии с настоящим изобретением представляют собой, например, (i) содействие диагностированию и/или прогнозированию некротического энтерита птиц, (ii) отслеживание прогрессирования или повторного появления некротического энтерита птиц, (iii) содействие оценке эффективности лечения для популяции животных, которые подвергаются лечению или для которых предполагается лечение, или (iv) контроль эффективности (терапевтической) вакцинации против некротического энтерита птиц, вызываемого C. perfringens.
Варианты применения способов в соответствии с настоящим изобретением, в частности, помогают избежать снижения таких показателей продуктивности животных, как, например, прирост массы тела и конверсия корма.
Далее настоящее изобретение проиллюстрировано неограничивающими примерами и иллюстративными вариантами осуществления.
Примеры
Приблизительно 20000 бройлеров случайным образом распределяли по бройлерным птичникам в рамках обычных проводимых компанией процедур по размещению кур в соответствии с сертифицированной программой Американской ассоциации гуманности, которая ограничивает плотность размещения до 6,2 фунта/квадратный фут при убое, включая выполнение основных требований к содержанию и контролю. Все поголовья содержали в соответствии со стандартными протоколами компании, которые соответствуют рекомендациям заводчиков по освещению, температуре и вентиляции. Корма состояли из основного рациона (кукуруза и соя), скорректированного с учетом потребностей птиц для стартерных, ростовых и финишных кормов. Ежедневно контролировали общие условия содержания поголовья: доступность корма и воды, температурный контроль и любые нестандартные условия. Мертвых птиц извлекали и вскрывали с определением причины смерти, а истощенных птиц умерщвляли, чтобы избавить их от дальнейших страданий.
Сбор образцов
Образцы фекалий и данные о продуктивности поголовья для нескольких стандартных производственных процессов бройлеров в живом виде собирали ежедневно от дня 10/11 до дня 24/25 в течение периода времени, составляющего 2 года. На протяжении этого периода времени три поголовья (примеры 1, 2 и 3) были диагностированы как положительные в отношении некротического энтерита (поголовья со вспышкой) на основании резкого скачка смертности во время окна заболевания для NE и наблюдения типичных для NE очагов поражения кишечника у мертвых птиц, вскрытых ветеринаром. Все образцы фекалий, собранные от таких поголовий со вспышкой NE, обрабатывали по отдельности в соответствии с инструкциями для технологии проведения обработки образцов и qPCR, запатентованной компанией Evonik.
В каждый момент времени или событие сбора собирали 24 отдельных образца из каждого квадранта помещения с помощью пластмассовых щипцов, проходя через каждый квадрант по зигзагообразному маршруту. Чтобы избежать перекрестной контаминации образцов, для каждого помещения использовали новые стерильные щипцы, а также соблюдали предписанные меры биобезопасности. Кроме того, мусор, такой как деревянная стружка, помет и т.д., удаляли из образцов до того, как все образцы из 4 квадрантов смешивали для получения одного объединенного образца (состоящего из 96 отдельных образцов фекалий) в стерильном пакете для сбора образцов. Образцы помещали на лед и переносили в лабораторию для хранения при -80°C.
Экстракция ДНК
Каждому пакету с объединенными 96 образцами давали медленно оттаять при комнатной температуре; затем фекалии переносили в стерильный контейнер и тщательно перемешивали стерильным шпателем для отдавливания языка. Пять (5) граммов гомогенизированного образца переносили в запатентованную пробирку для сбора образцов, содержащую 20 мл стабилизирующего буфера и стеклянные гранулы. Образцы фекалий в пробирках для сбора образцов сохраняют стабильность в течение периода не более 7 дней при температуре от +15°C до +30°C.
Пробирку, содержащую образец фекалий, инкубировали при 70°C в течение 20 минут на водяной бане. Затем пробирку переносили в мельницу Poly Mix (взбиватель с гранулами) для гомогенизации при 20 Гц в течение 15 минут. По окончании гомогенизации образец центрифугировали при 2000g в течение 5 минут и 500 мкл супернатанта использовали для экстракции ДНК. Экстракцию ДНК осуществляли с помощью системы King Fisher Flex (Thermo Fisher, США) в соответствии с протоколом запатентованного набора для экстракции фекалий, доступного от Evonik.
Устройство King Fisher подготавливали путем загрузки предварительно заданной программы («Cper_Extraction_01»), определяющей различные стадии процедуры экстракции; наконечники для отбора образцов, планшет для элюирования ДНК, планшеты для промывки и планшет для образцов подготавливали, как описано ниже.
Гребенку с 96 наконечниками вставляли в пустой планшет с глубокими лунками и помещали в устройство. После этого в планшет для элюирования вносили 100 мкл буфера для элюирования и этот планшет также помещали в устройство. Кроме того, 500 мкл промывочных буферов 3, 2 и 1 помещали в каждую лунку 3 разных промывочных планшетов соответственно, и эти планшеты помещали в устройство в том же порядке. Наконец, в каждую лунку планшета для образцов добавляли по 300 мкл буфера для лизиса, 25 мкл магнитных гранул, 20 мкл усиливающего средства, 10 мкл внутреннего контроля и 500 мкл супернатанта из образца фекалий. После размещения планшета для образцов в устройство экстракцию начинали нажатием кнопки запуска.
Количественное определение ДНК
Для количественного определения маркеров в ДНК 20 мкл мастер-микса, состоящего из 5 мкл компонента A мастер-микса, 15 мкл компонента B мастер-микса и 1 мкл IC (внутреннего контроля), получали в соответствии с инструкцией к запатентованному набору для ПЦР-анализа в реальном времени от Evonik Nutrition & Care GmbH для каждой реакции. Получали достаточное количество мастер-микса для обеспечения анализа всех образцов, контролей без матрицы (NTC) и 4 стандартов (от S1 до S4) в двух повторностях. 20 мкл мастер-микса вносили в отдельные лунки 96-луночного планшета. Затем в каждую лунку переносили по 10 мкл образца экстрагированной ДНК. В каждую стандартную лунку переносили по 10 мкл соответствующего стандарта и 1 мкл IC, соответственно. Для получения NTC в каждую лунку для NTC переносили по 10 мкл стерильной воды, не содержащей нуклеаз, и 1 мкл IC. Содержимое планшета тщательно перемешивали с помощью многоканальной пипетки и планшет запечатывали фольгированной пленкой Clear Weld Seal Mark II. Планшет центрифугировали в течение 30 секунд при 1000 g (~3000 об/мин). Наконец, планшет подвергали анализу в устройстве для ПЦР в реальном времени CFX96 (Bio Rad, Германия) со следующими условиями ПЦР: 45 циклов денатурации при 95°C в течение 15 секунд, отжиг при 58°C в течение 45 секунд и достройка при 72°C в течение 15 секунд. Данные получали во время фазы амплификации цикла qPCR. В конце цикла данные, полученные с помощью CFX96 от BioRad, предварительно обрабатывали с помощью CFX Manager 3.1 от Bio-Rad и экспортировали в Excel 2013 для дальнейшего анализа. Количественное определение маркеров в образцах проводили с помощью стандартной кривой, построенной с использованием стандартных растворов (от S1 до S4), содержащих равные концентрации обеих мишеней. Концентрации netB и cpa в S1, S2, S3 и S4 составляли 104 копий/мкл,103 копий/мкл, 102 копий/мкл и 101 копий/мкл, соответственно. Логарифмические показатели для стандартов откладывали на оси x, тогда как Ct (значения порогового цикла) откладывали на оси y. Полученную линию линейной регрессии [y = mx + b или Ct = m (log количества) + b] использовали для определения концентраций мишеней в тестируемом образце.
Перечень праймеров и зондов, используемых в ходе qPCR для количественного определения уровней экспрессии мишеней:
Мишень Праймеры и зонды (где применимо) Репортер для зонда
netB Прямой: 5'-TATACTTCTAGTGATACCGC-3'
(SEQ ID NO: 3)
Обратный: 5'-ATCAGAATGAGGATCTTCAA-3'
(SEQ ID NO: 4)
Зонд: 5'-TCACATAAAGGTTGGAAGGCAAC-3' FAM
(SEQ ID NO: 5)
cpa Прямой: 5'-TACATATCAACTAGTGGTGA-3'
(SEQ ID NO: 6)
Обратный: 5'-ATTCTTGAGTTTTTCCATCC-3'
(SEQ ID NO: 7)
Зонд: 5'-TGGAACAGATGACTACATGTATTTTGG-3' Cy5
(SEQ ID NO: 8)
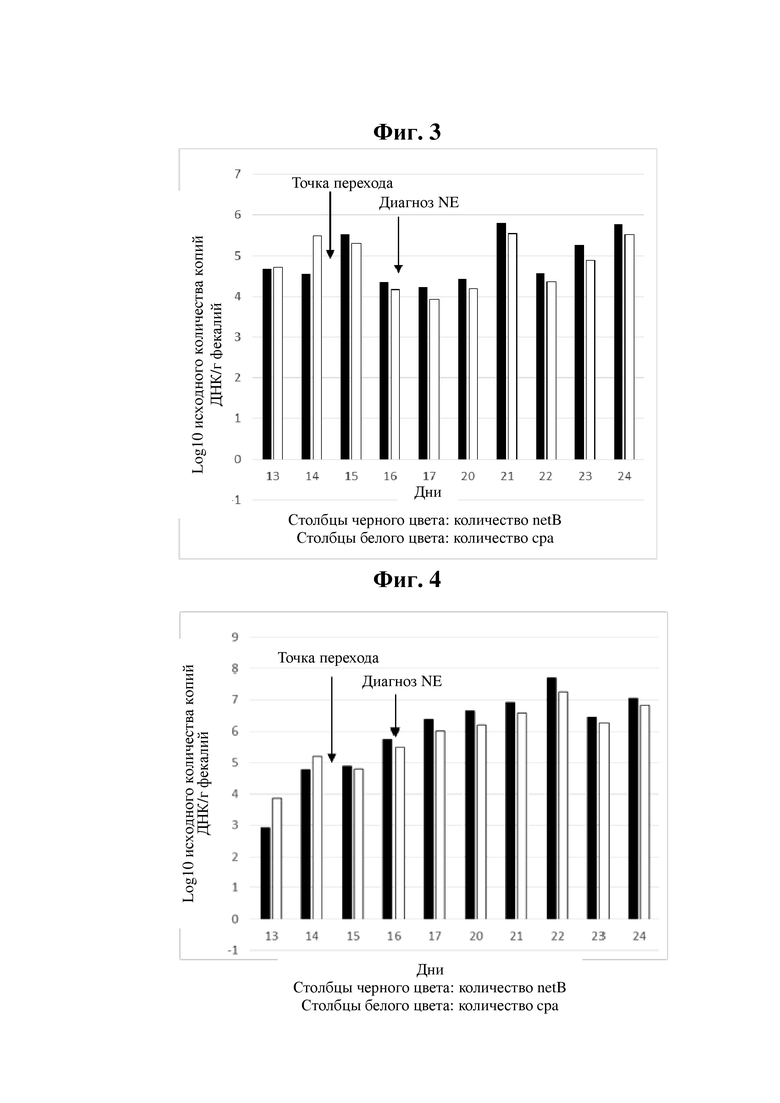
Пример 1
(для значений log 10)
В данном примере реверсия количественного соотношения netB и cpa (точка перехода) происходила в период от дня 14 до дня 15. Наличие вспышки некротического энтерита было установлено на основании диагноза ветеринарного врача (при вскрытии) в день 16.
Графическое представление данных из примера 1 можно найти на фиг. 3.
Пример 2
(для значений log 10)
В данном примере реверсия количественного соотношения netB и cpa (точка перехода) происходила в период от дня 14 до дня 15. Наличие вспышки некротического энтерита было установлено на основании диагноза ветеринарного врача (при вскрытии) в день 16.
Графическое представление данных из примера 1 можно найти на фиг. 4.
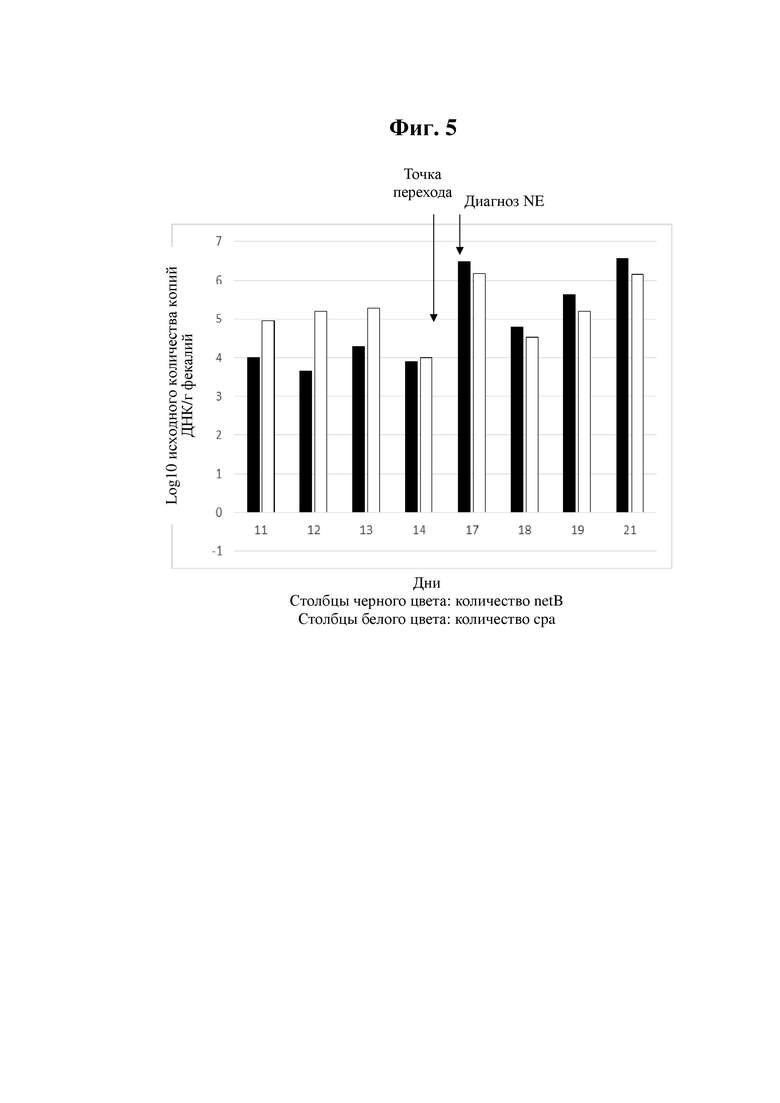
Пример 3
(для значений log 10)
В данном примере реверсия количественного соотношения netB и cpa (точка перехода) происходила в период от дня 14 до дня 17. Наличие вспышки некротического энтерита было установлено на основании диагноза ветеринарного врача (при вскрытии) в день 17.
Графическое представление данных из примера 1 можно найти на фиг. 5.
Обобщенные результаты
Вышеописанные эксперименты демонстрируют, что реверсия относительного количества маркерных генов netB и cpa систематически наблюдается перед установлением морфологического диагноза некротического энтерита в популяции птиц. Таким образом, указанная реверсия количественного соотношения маркерных генов netB и cpa является пригодной в качестве диагностического маркера для прогнозирования скорой вспышки некротического энтерита в поголовье птиц.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Эвоник Дегусса ГМБХ
<120> СПОСОБ РАННЕГО ВЫЯВЛЕНИЯ ВСПЫШКИ НЕКРОТИЧЕСКОГО ЭНТЕРИТА В
ПОПУЛЯЦИИ ПТИЦ
<130> 201800116
<160> 8
<170> PatentIn версия 3.5
<210> 1
<211> 969
<212> ДНК
<213> Clostridium perfringens
<220>
<221> прочий_признак
<222> (10)..(10)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (391)..(396)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (418)..(420)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (443)..(443)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (497)..(497)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (502)..(502)
<223> n представляет собой a, c, g или t
<400> 1
ttgaaaagan taaaaattat ttcaattaca ctagttctta caagtgtaat tagtacaagc 60
cttttttcaa ctcaaactca agtttttgca agtgaattaa atgacataaa caaaattgag 120
ttgaaaaatc taagtggaga aataataaaa gaaaatggaa aggaagctat taaatatact 180
tctagtgata ccgcttcaca taaaggttgg aaggcaactt taagtggaac atttattgaa 240
gatcctcatt ctgataagaa aactgcttta ttaaatttag aaggatttat accttctgat 300
aaacagattt ttggttctaa atattacgga aaaatgaaat ggcctgaaac ttatagaatt 360
aatgtaaaaa gtgctgatgt aaataataat nnnnnnatag caaattctat tcctaaannn 420
actatagata aaaaagatgt atntaattca attggttatt ctataggcgg taatatatct 480
gttgaaggaa aaactgntgg tnctggaata aatgcttcat ataatgtcca aaatactata 540
agctatgaac aacctgattt tagaacaatt caaagaaaag atgatgcaaa tttagcatca 600
tgggatataa aatttgttga gactaaggac ggttataata tagattctta tcatgctatt 660
tatggaaatc aattattcat gaaatcaaga ttgtataata atggtgataa aaatttcaca 720
gatgatagag atttatcaac attaatttct ggtggatttt cacccaatat ggctttagca 780
ttaacagcac ctaaaaatgc taaagaatct gtaataatag ttgaatatca aagatttgat 840
aatgactata ttttaaattg ggaaactact caatggcgag gaacaaacaa actttcgtca 900
acaagtgaat ataacgaatt tatgtttaaa ataaattggc aagatcataa aatagaatat 960
tatctgtaa 969
<210> 2
<211> 1197
<212> ДНК
<213> Clostridium perfringens
<220>
<221> прочий_признак
<222> (21)..(21)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (23)..(24)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (28)..(28)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (36)..(37)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (40)..(40)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (44)..(44)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (64)..(65)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (78)..(78)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (81)..(81)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (96)..(96)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (102)..(102)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (128)..(128)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (138)..(139)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (147)..(147)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (160)..(160)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (165)..(165)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (167)..(167)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (170)..(170)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (213)..(213)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (225)..(225)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (264)..(264)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (267)..(267)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (274)..(274)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (288)..(288)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (307)..(307)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (318)..(318)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (360)..(360)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (393)..(393)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (420)..(420)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (423)..(423)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (429)..(429)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (453)..(453)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (510)..(510)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (540)..(540)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (552)..(552)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (558)..(558)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (567)..(567)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (584)..(584)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (600)..(600)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (604)..(605)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (613)..(613)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (621)..(621)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (633)..(633)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (680)..(680)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (684)..(684)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (738)..(738)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (741)..(742)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (757)..(757)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (759)..(759)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (783)..(783)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (807)..(807)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (825)..(826)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (840)..(840)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (843)..(843)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (885)..(885)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (963)..(963)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (978)..(978)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (985)..(985)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (993)..(993)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (999)..(999)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1014)..(1014)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1020)..(1020)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1087)..(1087)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1094)..(1094)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1117)..(1117)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1124)..(1124)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1143)..(1143)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1149)..(1149)
<223> n представляет собой a, c, g или t
<220>
<221> прочий_признак
<222> (1158)..(1158)
<223> n представляет собой a, c, g или t
<400> 2
atgaaaagaa agatttgtaa ngnncttntt tgtgcnncgn tagnaactag cctatgggct 60
gggnnatcaa ctaaagtnta ngcttgggat ggaaanattg anggaacagg aactcatgct 120
atgattgnaa ctcaaggnnt ttcaatntta gaaaatgatn tgtcnanaan tgaaccagaa 180
agtgtaagaa aaaacttaga gattttaaaa ganaacatgc atgancttca attaggttct 240
acttatccag attatgataa gaangcntat gatntatatc aagatcantt ctgggatcct 300
gatacanata ataatttntc aaaggataat agttggtatt tagcttattc tatacctgan 360
acaggggaat cacaaataag aaaattttca gcnttagcta gatatgaatg gcaaagaggn 420
aantataanc aagctacatt ctatcttgga gangctatgc actattttgg agatatagat 480
actccatatc atcctgctaa tgttactgcn gttgatagcg caggacatgt taagtttgan 540
acttttgcag angaaagnaa agaacantat aaaataaaca cagnaggttg caaaactaan 600
gagnnttttt atnctgatat nttaaaaaac aangatttta atgcatggtc aaaagaatat 660
gcaagaggtt ttgctaaaan aggnaaatca atatactata gtcatgctag catgagtcat 720
agttgggatg attggganta nncagcaaag gtaactntng ctaactctca aaaaggaaca 780
gcnggatata tttatagatt cttacangat gtatcagagg gtaannatcc atcagttggn 840
aanaatgtaa aagaactagt agcttacata tcaactagtg gtganaaaga tgctggaaca 900
gatgactaca tgtattttgg aatcaaaaca aaggatggaa aaactcaaga atgggaaatg 960
ganaacccag gaaatgantt tatgnctgga agnaaagana cttatacttt caanttaaan 1020
gatgaaaatc taaaaattga tgatatacaa aatatgtgga ttagaaaaag aaaatataca 1080
gcattcncag atgnttataa gccagaaaac ataaagntaa tagnaaatgg aaaagttgta 1140
gtngacaang atataaanga gtggatttca ggaaattcaa cttataatat aaaataa 1197
<210> 3
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 3
tatacttcta gtgataccgc 20
<210> 4
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 4
atcagaatga ggatcttcaa 20
<210> 5
<211> 23
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд
<400> 5
tcacataaag gttggaaggc aac 23
<210> 6
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 6
tacatatcaa ctagtggtga 20
<210> 7
<211> 20
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Праймер
<400> 7
attcttgagt ttttccatcc 20
<210> 8
<211> 27
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Зонд
<400> 8
tggaacagat gactacatgt attttgg 27
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ВЫЯВЛЕНИЯ ЗАБОЛЕВАНИЙ, ВЫЗЫВАЕМЫХ C. PERFRINGENS, У ЖИВОТНЫХ | 2018 |
|
RU2769503C2 |
| СПОСОБ ОБНАРУЖЕНИЯ НЕКРОТИЧЕСКОГО ЭНТЕРИТА ПТИЦ | 2016 |
|
RU2712505C2 |
| КЛОСТРИДИАЛЬНЫЙ ТОКСИН NetB | 2008 |
|
RU2474587C2 |
| СЕКВЕНИРОВАНИЕ ПОЛИНУКЛЕОТИДНЫХ БИБЛИОТЕК С ВЫСОКОЙ ПРОПУСКНОЙ СПОСОБНОСТЬЮ И АНАЛИЗ ТРАНСКРИПТОМОВ | 2018 |
|
RU2790291C2 |
| УЛУЧШЕННЫЙ СПОСОБ СКРИНИНГА, ДИАГНОСТИКИ И/ИЛИ МОНИТОРИНГА КОЛОРЕКТАЛЬНОЙ НЕОПЛАЗИИ НА ПОЗДНЕЙ СТАДИИ, АДЕНОМЫ НА ПОЗДНЕЙ СТАДИИ И/ИЛИ КОЛОРЕКТАЛЬНОГО РАКА | 2020 |
|
RU2834789C2 |
| ВАКЦИНА ПРОТИВ НЕКРОТИЧЕСКОГО ЭНТЕРИТА У ДОМАШНЕЙ ПТИЦЫ | 2018 |
|
RU2788096C2 |
| ОСУЩЕСТВЛЯЕМЫЙ IN VITRO СПОСОБ МОНИТОРИНГА ПАТОГЕННОЙ НАГРУЗКИ В ПОПУЛЯЦИИ ЖИВОТНЫХ | 2019 |
|
RU2773349C2 |
| СПОСОБ ПОЛУЧЕНИЯ ХИМИЧЕСКИХ ПРОДУКТОВ ТОНКОГО СИНТЕЗА С ПОМОЩЬЮ CORYNEBACTERIUM, СЕКРЕТИРУЮЩЕЙ МОДИФИЦИРОВАННЫЕ α-1,6-ГЛЮКОЗИДАЗЫ | 2018 |
|
RU2763317C2 |
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2776121C2 |
| НОВЫЕ АНТИ-PD-L1 АНТИТЕЛА | 2017 |
|
RU2744959C2 |
Настоящее изобретение относится к осуществляемому in vitro способу раннего выявления вспышки некротического энтерита в популяции птиц, при этом способ включает a) сбор материала образца фекалий, полученного от популяции птиц, в последовательные моменты времени и b) определение количественного соотношения маркерных генов netB и cpa, содержащихся в материале образца, полученном на стадии a); где реверсия количественного соотношения netB и cpa с течением времени является ранним признаком вспышки некротического энтерита. 3 н. и 8 з.п. ф-лы, 5 ил., 3 пр.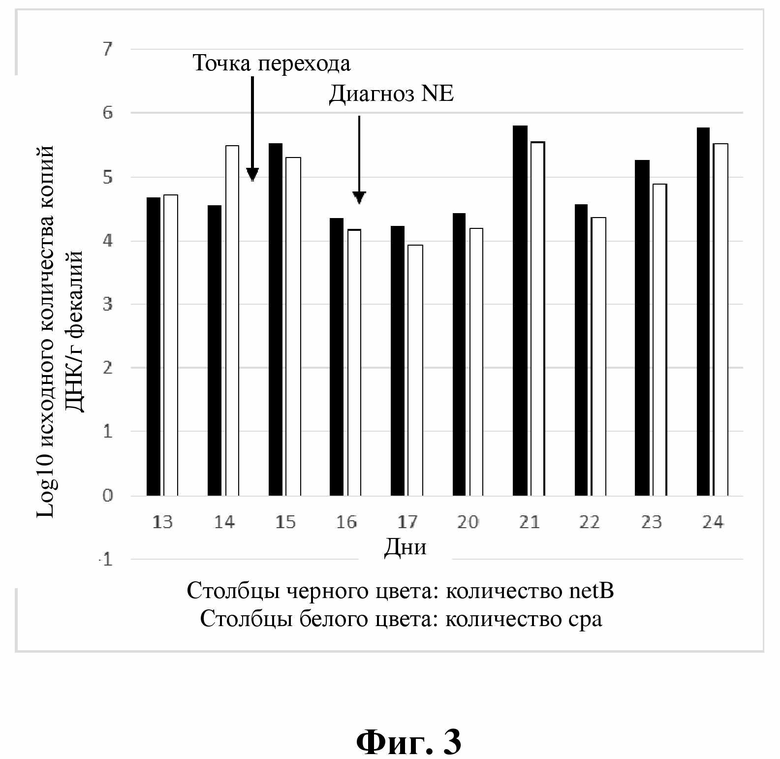
1. Осуществляемый in vitro способ раннего выявления вспышки некротического энтерита в популяции птиц, где популяция птиц представляет собой поголовье бройлеров, при этом способ включает:
a) сбор материала образца фекалий, полученного от популяции птиц, в последовательные моменты времени; и
b) определение количественного соотношения маркерных генов netB и cpa, содержащихся в материале образца, полученном на стадии a);
где реверсия количественного соотношения netB и cpa с течением времени является ранним признаком вспышки некротического энтерита.
2. Способ по п. 1, где материал образца фекалий из стадии a) представляет собой смешанный образец фекалий, состоящий из отдельных образцов, отобранных случайным образом.
3. Способ по п. 2, где количество образцов, которые необходимо собрать, определяют с помощью следующей формулы
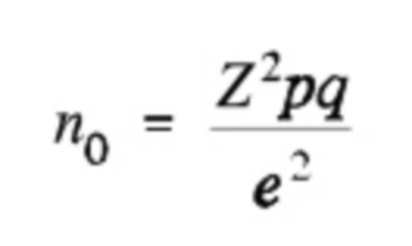 ,
,
где
n0 представляет собой рекомендованный размер выборки,
Z равняется 1,96 при доверительном уровне, составляющем 95%,
p представляет собой расчетную долю популяции, характеризующуюся наличием рассматриваемого атрибута, q равняется 1-p, и
e представляет собой доверительный интервал, выраженный в виде десятичной дроби.
4. Способ по любому из пп. 2 или 3, где смешанный образец фекалий получают путем
(a1) разделения помещения для содержания животных или территории, на которой содержится популяция животных, на равное количество однородных по размеру ячеек, образующих сетку;
(a2) определения по меньшей мере одного выбранного случайным образом участка сбора образцов в пределах первой ячейки и сбора одного первого образца из указанного выбранного случайным образом участка сбора образцов; и
(a3) проведения последовательного сбора отдельных образцов фекалий из остальных ячеек с использованием участков сбора образцов с таким же относительным местоположением в пределах каждой ячейки;
и необязательно
(a4) повторения стадий (a2) и (a3) для получения по меньшей мере одной повторной выборки.
5. Способ по п. 1, где материал образца фекалий от поголовья бройлеров собирают и анализируют ежедневно, начиная с дня 10.
6. Способ по любому из предыдущих пунктов, где количественное соотношение маркерных генов netB и cpa, содержащихся в материале образца, полученном на стадии a), определяют с помощью qPCR.
7. Способ по любому из предыдущих пунктов, где один или более олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
применяют в качестве праймера для ПЦР и/или в качестве зонда для ПЦР.
8. Применение способа по любому из пп. 1-7 для раннего выявления вспышки некротического энтерита.
9. Осуществляемый in vitro способ контроля статуса по некротическому энтериту в популяции птиц, при этом способ включает отслеживание количественного соотношения маркерных генов netB и cpa, содержащихся в образцах фекалий, собранных в последовательные моменты времени, где
a) реверсия количественного соотношения netB и cpa с течением времени указывает на необходимость кормового или терапевтического вмешательства, и
b) обратная реверсия количественного соотношения netB и cpa с течением времени после введения кормовых или терапевтических средств указывает на эффективность кормового или терапевтического вмешательства.
10. Способ по п. 9, где кормовое или терапевтическое вмешательство включает введение веществ, выбранных из группы, состоящей из пробиотических средств, пребиотических средств, лекарственных составов на основе растительного сырья, органических/жирных кислот, бактериофагов и бактериолитических ферментов или любых их комбинаций.
11. Способ по любому из пп. 9 и 10, где один или более олигонуклеотидов, выбранных из группы, состоящей из
a) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 3;
b) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 4;
c) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 5;
d) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 6;
e) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 7;
f) олигонуклеотидов, характеризующихся по меньшей мере 80%, предпочтительно по меньшей мере 85%, 90% или 95%, наиболее предпочтительно 100% идентичностью последовательности с полинуклеотидом, представленным под SEQ ID NO: 8;
g) олигонуклеотидов, комплементарных олигонуклеотидам в соответствии с (a) - (f);
h) олигонуклеотидов, содержащих любой из олигонуклеотидов в соответствии с (a) - (g) и удлиненных на не более чем 5 пар оснований по сравнению с олигонуклеотидами в соответствии с (a) - (g);
применяют в качестве праймера для ПЦР и/или в качестве зонда для ПЦР.
| WO 2016142146 A2, 15.09.2016 | |||
| J I YOUNG PARK, Characterization of Clostridium perfringens isolates obtained from2010 to 2012 from chickens with necrotic enteritis in Korea, Poultry Science, 2015, 94:1158-1164, http://dx.doi.org/10.3382/ps/pev037 | |||
| WO 2018206690 A1, 15.11.2018 | |||
| НОВИКОВА О., Анаэробная энтеротоксемия птицы, Животноводство России, |
Авторы
Даты
2022-05-12—Публикация
2019-06-07—Подача