ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННУЮ ЗАЯВКУ
[001] Настоящая заявка является не предварительной подачей заявки на патент США US 61/778814, поданной 13 марта 2013 г., которая включена в данный документ в полном объеме посредством ссылки для всех целей.
ССЫЛКА НА ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ, ПРЕДСТАВЛЕННЫЙ В МАШИНОЧИТАЕМОМ ВИДЕ
[002] Настоящая заявка включает последовательности в текстовом файле 439616SEQLIST.txt, созданном 21 февраля 2014 г., имеющем размер 1 килобайт, который включен в данный документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
[003] Генетически модифицированные животные, не относящиеся к человеку, которые имеют мутантный аллель гена Acvr1; конструкции нуклеиновых кислот, которые содержат условные мутанты гена Acvr1; животные, не относящиеся к человеку, демонстрирующие фенотипическую особенность прогрессирующей оссифицирующей фибродисплазии (ПОФ). Генетически модифицированные мыши, демонстрирующие гетеротопическую оссификацию. Животные, не относящиеся к человеку, содержащие условные мутантные аллели ACRV1, экспрессируемые ex utero, но не in utero.
УРОВЕНЬ ТЕХНИКИ
[004] Acrv1 представляет собой рецептор I типа для костных морфогенетических белков (КМБ). Некоторые мутации в гене Acvr1 человека, в том числе мутации, которые приводят к аминокислотной модификации мутации R206H, тесно связаны с таким заболеванием, как прогрессирующая оссифицирующая фибродисплазия (ПОФ) (см., например, публикацию заявки на патент США №2009/0253132; см. также публикацию Pignolo, R.J. (2011) Fibrodysplasia Ossificans Progressiva: Clinical and Genetic Aspects, Orphanet Journal of Rare Diseases, 6:80, 1-6). Как полагают, мутация R206H, среди прочего, повышает чувствительность рецептора к активации и делает его более устойчивым к сайлесингу. У химерных мышей, которые несут мутацию R206H в гене Acvr1, развивается ПОФ-подобный фенотип (см., например,, Chakkalakal et al. (2012) An Acvr1 R206H knock-in mouse has fibrodysplasia ossificans progressiva, J. Bone and Mineral Res. 27:1746-1756).
[005] Некоторые мутации в гене Acvr1, например те, что приводят к мутации белка R206H Acvr1, являются летальными для мышей в перинатальном периоде. Если мутация является перинатально-летальной, то невозможно передать нокин гена, содержащего мутацию, через зародышевую линию животного, не относящегося к человеку. Например, в вышеупомянутых исследованиях необходимо работать с химерными мышами, которые имеют в некоторых клетках данную мутацию, но не могут передать эту мутацию зародышевой линии; таким образом, не была создана стабильная и пригодная для использования мышиная линия, содержащая мутацию R206H в зародышевой линии. Остается потребность в животных, не относящихся к человеку, которые могут передавать зародышевой линии перинатально- или эмбрионально-летальную мутацию ACRV1, чтобы произвести потомство, применимое, например, для создания животных, не относящихся к человеку, имеющих фенотип, связанный с мутацией ACRV1, например фенотип ФОП, особенности ФОП, или особенности связанного расстройства, или связанное расстройство.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[006] Предлагаются генетически модифицированные животные, не относящиеся к человеку, содержащие в своей зародышевой линии последовательность нуклеиновых кислот, содержащую модификацию гена Acvr1.
[007] Предлагаются генетически модифицированные животные, не относящиеся к человеку, содержащие в своей зародышевой линии последовательность нуклеиновых кислот, содержащую условную генетическую модификацию гена Acvr1, причем указанная генетическая модификация делает животное, не относящееся к человеку, восприимчивым к гетеротопической оссификации.
[008] Предлагаются генетически модифицированные животные, не относящиеся к человеку, содержащие в своей зародышевой линии последовательность нуклеиновых кислот, содержащую условную генетическую модификацию, которая содержит условный мутантный экзон Acvr1, причем индукция экспрессии условного мутантного экзона Acvr1 придает животному, не относящемуся к человеку, восприимчивость к гетеротопической оссификации. В одном варианте реализации изобретения мутантный экзон Acvr1 представляет собой экзон 5. В конкретном варианте реализации изобретения мутация экспрессирует Acvr1-кодируемый белок, имеющий экзон 5 с мутацией R2026H.
[009] Предлагаются животные, не относящиеся к человеку, которые условно экспрессируют мутантный аллель Acvr1 В различных аспектах мутантный аллель Acvr1 представляет собой аллель, который дает патологический фенотип животному, не относящемуся к человеку, экспрессирующему этот аллель. В различных аспектах животные, не относящиеся к человеку, содержат мутантный экзон аллеля Acvr1, фланкированный выше и ниже сайтами распознавания сайт-специфической рекомбиназы (SRRS), и при этом животное, не относящееся к человеку, содержит рекомбиназу, распознающую SRRS, причем рекомбиназа является индуцируемой.
[0010] Предлагаются животные, не относящиеся к человеку, содержащие модификацию аллеля Acvr1, которая служит причиной возникновения (в одном варианте реализации изобретения в гетерозиготе; в одном варианте реализации изобретения в гомозиготе), стимулирует или производит животное, не относящееся к человеку, восприимчивое к гетеротопической оссификации.
[0011] Предлагаются животные, не относящиеся к человеку, содержащие условную мутацию аллеля Acvr1, причем мутантный аллель Acvr1 не экспрессируется внутриутробно и не экспрессируется в перинатальный период, и при этом животные, не относящиеся к человеку, экспрессируют мутантный аллель Acvr1 условным образом, причем условную экспрессию индуцируют путем введения соединения, представляющего интерес, животному, не относящемуся к человеку.
[0012] Предлагаются локусы Acvr1, содержащие модификацию, которая содержит условный мутантный экзон, причем условный мутантный экзон экспрессируется при экспериментально-индуцированной индукции.
[0013] В одном аспекте предлагается генетически модифицированный локус Acvr1, содержащий мутантный экзон в антисмысловой ориентации, фланкированный выше и ниже SRRS. В одном варианте реализации изобретения локус присутствует у животного, не относящегося к человеку, которое дополнительно содержит индуцируемый ген рекомбиназы, распознающей SRRS, фланкирующие мутантный экзон.
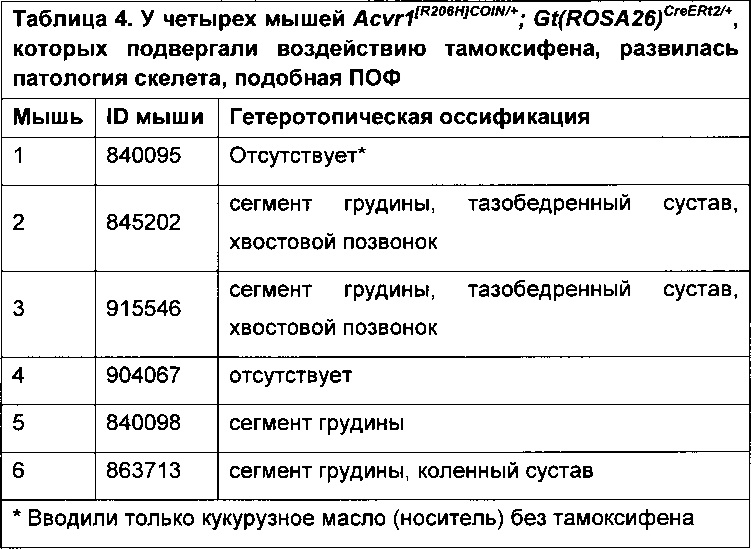
[0014] В одном аспекте предлагается животное, не относящееся к человеку, содержащее модифицированный локус Acvr1, содержащий мутантный экзон в антисмысловой ориентации, причем указанный мутантный экзон фланкирован выше и ниже RSSR, ориентированными для направления инверсии при действии рекомбиназы, распознающей RSSR. В одном варианте реализации изобретения мутантный экзон при инверсии замещает соответствующий экзон локуса Acvr1 дикого типа. В одном варианте реализации изобретения животное, не относящееся к человеку, дополнительно содержит индуцируемый ген рекомбиназы, причем рекомбиназа индуцируемого гена рекомбиназы распознает RSSR. В конкретном варианте реализации изобретения RSSR представляют собой lox-сайты или их варианты, рекомбиназа представляет собой Cre, и рекомбиназа индуцируется тамоксифеном. В конкретном варианте реализации изобретения рекомбиназа представляет собой Cre-ERT2. В одном варианте реализации изобретения животное, не относящееся к человеку, является грызуном, например, мышью или крысой. В конкретном варианте реализации изобретения грызун представляет собой крысу, а мутантный экзон Acvr1 представляет собой экзон 5.
[0015] В одном аспекте предлагается генетически модифицированная мышь, которая содержит конструкцию нуклеиновой кислоты, содержащей мутантный экзон 5 (е5), кодирующий мутацию R206H, причем мутантный е5 присутствует в антисмысловой ориентации и фланкируется выше и ниже RSSR, ориентированными для направления инверсии мутантного е5; и указанная мышь содержит индуцируемый ген рекомбиназы, кодирующий рекомбиназу, способную инвертировать антисмысловой мутантный экзон е5 в смысловую ориентацию.
[0016] В одном аспекте предлагается генетически модифицированная мышь, которая содержит конструкцию нуклеиновой кислоты в локусе Acvr1 в зародышевой линии мыши, причем указанная конструкция нуклеиновой кислоты содержит, по отношению к направлению транскрипции гена Acvr1, конструкцию, содержащую ген е5 дикого типа в смысловой ориентации и мутантный аллель е5 в антисмысловой ориентации, при этом выше от аллеля е5 дикого типа находится первый RSSR (RSSR1), который совместим со вторым RSSR (RSSR2), расположенным непосредственно ниже антисмыслового мутантного е5 (по отношению к направлению транскрипции гена Acvr1), причем RSSR1 и RSSR2 ориентированы для направления инверсии. Эта конструкция дополнительно содержит третий RSSR (RSSR3), размещенный между е5 дикого типа и мутантным антисмысловым е5, и конструкция дополнительно содержит четвертый RSSR (RSSR4), который совместим с RSSR3 и расположен ниже RSSR2 (по отношению к направлению ориентации гена Acvr1), причем RSSR3 и RSSR4 ориентированы для направления инверсии. Каждый из RSSR (1-4) распознается той же индуцируемой рекомбиназой.
[0017] В одном варианте реализации изобретения индуцируемая рекомбиназа находится в зародышевой линии мыши.
[0018] В одном варианте реализации изобретения сайты RSSR распознаются Cre рекомбиназой.
[0019] В одном варианте реализации изобретения RSSR1 и RSSR2 представляют собой сайты lox2372; RSSR3 и RSSR4 представляют собой сайты loxP, а индуцируемая рекомбиназа представляет собой CreERT2 (см., например, ФИГ. 1).
[0020] В одном варианте реализации изобретения RSSR1 и RSSR2 представляют собой сайты loxP; RSSR3 и RSSR4 представляют собой сайты lox2372, а индуцируемая рекомбиназа представляет собой CreERT2 (см., например, ФИГ. 1).
[0021] В одном варианте реализации изобретения CreERT2 находится в локусе ROSA26 (например, Gt(ROSA26)SorCreERT2/+.
[0022] В одном аспекте предлагается генетически модифицированная мышь, имеющая генотип Acvr1[R206H]COIN/+; Gt(ROSA26)SorCreERt2/+.
[0023] В одном аспекте предлагается генетически модифицированный грызун, экспрессирующий нормальный экзон 5 Acvr1 in utero и перинатально, причем при обработке генетически модифицированных грызунов рекомбиназой мышь экспрессирует Acvr1-кодируемый белок, содержащий мутацию, закодированную экзоном 5. В одном варианте реализации изобретения мутация представляет собой мутацию экзона 5, которая кодирует мутацию R206H.
[0024] В одном аспекте предлагается взрослый грызун, который экспрессирует продукт мутантного гена Acvr1, характеризующийся модификацией R206H, причем по меньшей мере 99% клеток мыши содержат мутантный ген Acvr1, кодирующий модификацию R206H.
[0025] В одном аспекте предлагается генетически модифицированный грызун, который содержит продукт мутантного гена Acvr1, характеризующийся модификацией R206H, причем мутантный ген Acvr1 присутствует по меньшей мере в 90%, 95%, 96%, 97%, 98% или 99% или более клеток генетически модифицированного грызуна.
[0026] В одном аспекте предлагается генетически модифицированный грызун, причем указанный грызун содержит в своей зародышевой линии локус Acvr1, который под действием рекомбиназы экспрессирует белок, кодируемый локусом Acvr1, содержащим модификацию R206H.
[0027] В одном аспекте предлагается грызун, экспрессирующий мутантный белок, содержащий мутацию R206H, причем мышь не является химерной. В одном варианте реализации изобретения степень химеризма грызуна не превышает 1%.
[0028] В одном аспекте предлагается мышь, экспрессирующая мутантный белок из модифицированного локуса Acvr1 зародышевой линии мыши, причем все клетки мыши, экспрессирующие Acvr1, содержат модифицированный ген Acvr1, кодирующий белок Acvr1, содержащий модификацию R206H. В одном варианте реализации изобретения все зародышевые клетки мыши содержат модифицированный локус Acvr1, содержащий условную генетическую модификацию, кодирующую белок Acvr1 с модификацией R206H.
[0029] В одном аспекте предлагается генетически модифицированная мышь, содержащая сконструированный аллель Acvr1[R206H]COIN, причем первый кодон экзона 5 ACVR1 человека (изоформа 003) модифицирован для кодирования Е, при этом на уровне белка гуманизированный экзон идентичен мышиному экзону 5 Acvr1 дикого типа (изоформа 001).
[0030] В одном аспекте предлагается мышь, содержащая условную генетическую модификацию гена Acvr1, причем модификация изменяет аминокислоту в ACVR1 α-спирали, содержащей аминокислоты 198-206 ACVR1, и приводит к конститутивной активации белка, кодируемого локусом Acvr1.
[0031] В одном варианте реализации изобретения условная генетическая модификация находится в аминокислоте, выбранной из аминокислоты 198, 199, 200, 201, 202, 203, 204, 205, 206 и их комбинации. В конкретном варианте реализации изобретения аминокислота представляет собой аминокислоту 206, а модификация представляет собой нуклеотидное изменение, которое образует кодон для гистидина.
[0032] В одном варианте реализации изобретения мышь является гетерозиготной по условной генетической модификации. В одном варианте реализации изобретения мышь является гомозиготной по условной генетической модификации.
[0033] В различных аспектах животное, не относящееся к человеку, является млекопитающим. В одном варианте реализации изобретения млекопитающее является грызуном. В одном варианте реализации изобретения грызун выбран из группы, состоящей из мыши, крысы и хомяка. В конкретном варианте реализации изобретения грызун представляет собой мышь.
[0034] В различных аспектах генетически модифицированное животное, не относящееся к человеку, содержит матрицу из RSSR, расположенных с возможностью направлять делецию экзона 5 Acvr1 дикого типа и помещать мутантный экзон 5 из антисмысловой ориентации в смысловую ориентацию.
[0035] В различных аспектах генетически модифицированное животное, не относящееся к человеку, дополнительно содержит индуцируемую рекомбиназу, которая действует при нахождении конструкции нуклеиновой кислоты в локусе Acvr1 для удаления экзона дикого типа и замещения его мутантным экзоном. В одном варианте реализации изобретения индуцируемая рекомбиназа представляет собой CreERT2.
[0036] В различных аспектах генетически модифицированные животные, не относящиеся к человеку, при экспрессии мутантного аллеля Acvr1 способны экспрессировать альтернативный (дикого типа) аллель.
[0037] В различных аспектах генетически модифицированное животное, не относящееся к человеку, которое экспрессирует мутантный аллель Acvr1, является моделью расстройства, характеризующегося гетеротопической оссификацией. В одном варианте реализации изобретения расстройство, характеризующееся гетеротопической оссификацией, представляет собой прогрессирующую оссифицирующую фибродисплазию (ПОФ).
[0038] В различных аспектах предлагаются генетически модифицированные животные, не относящиеся к человеку, которые условно экспрессируют мутантный аллель Acvr1, содержащий мутантный экзон 5 (например, экспрессируют белок, содержащий мутацию R206H), при воздействии тамоксифена, причем животные, не относящиеся к человеку, содержат тамоксифен-индуцируемую рекомбиназу, которая преобразует экзон 5 дикого типа в мутантный экзон 5 в гене Acvr1.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
[0039] На ФИГ. 1 проиллюстрирована схема условного аллеля на локусе Acvr1, который преобразует, например, мышиный экзон 5 Acvr1 в экзон R206H человека при помощи сайтов loxp и lox2372.
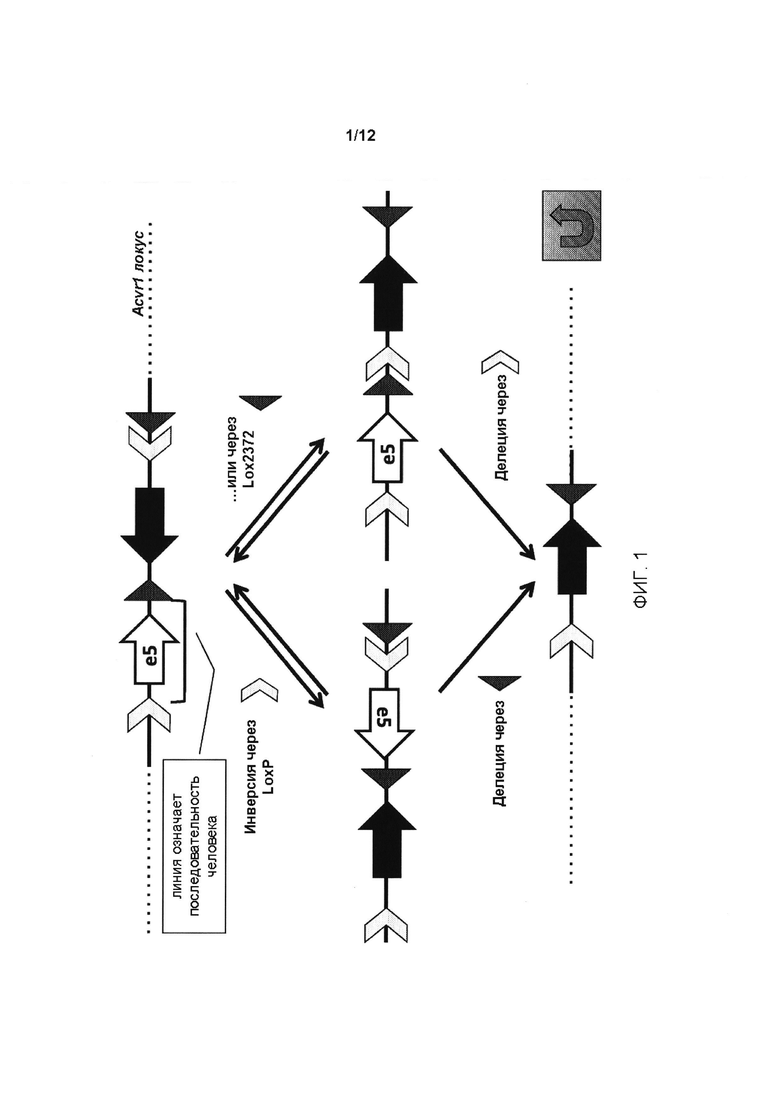
[0040] На ФИГ. 2 проиллюстрирована схема условного аллеля Acvr1 R206H гена классического мутантного рецептора ПОФ. Мышиный экзон 5 (е5 в изоформе 001) замещен экзоном 5 человека (в изоформе 003 ACVR1 человека); мышиный мутантный экзон одновременно введен в антисмысловую цепь вместе с модифицированной FRT кассетой отбора (hUB-Neo); е5 человека фланкирован lοxΡ и lox2372 pointing East, и другие сайты lοxΡ и Lox2372 размещены ниже мышиного e5(R206H) и делеции е5 человека при воздействии Cre, как схематически показано на ФИГ. 1.
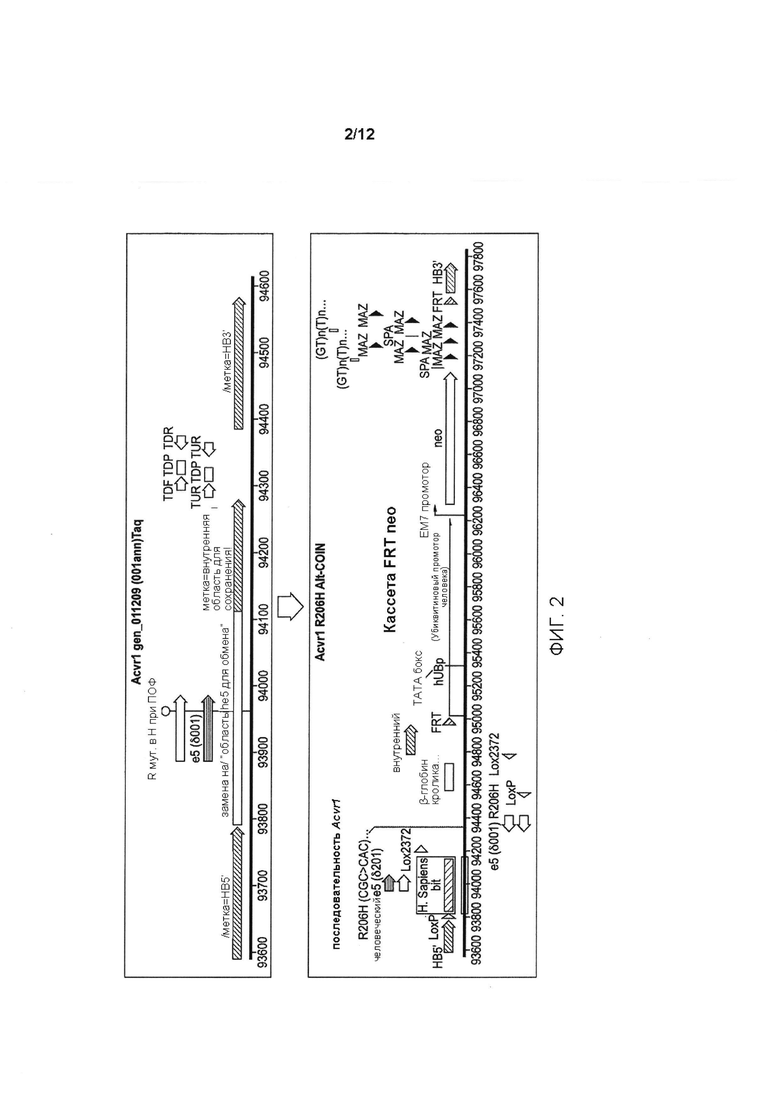
[0041] На ФИГ. 3 показана активация аллеля Acvr1[R206H]COIN, приводящая к ПОФ-подобному фенотипу у мышей, генетически модифицированных условным аллелем.
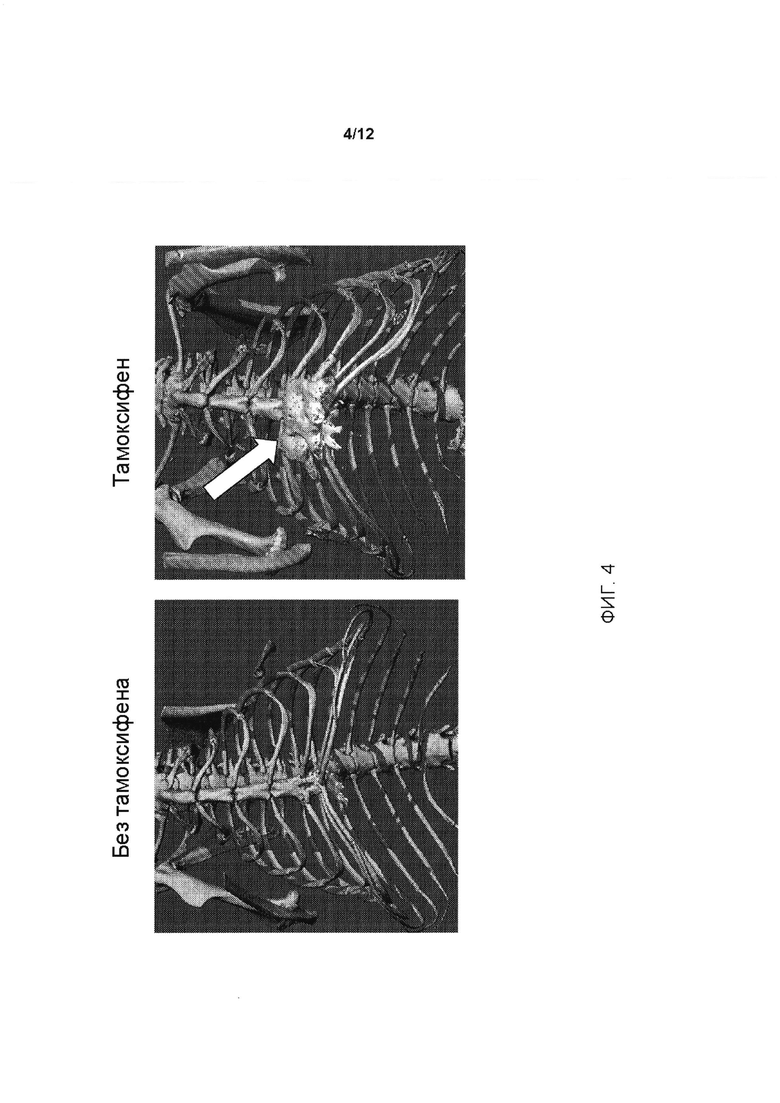
[0042] На ФИГ. 4 проиллюстрирована гетеротопическая оссификация у генетически модифицированных мышей, содержащих условный аллель, индуцированный у мышей, которым вводили тамоксифен; пример гетеротопической оссификации на грудине показан на правой панели белыми стрелками. При отсутствии введения тамоксифена (левая панель) гетеротопическая оссификация не обнаруживается.
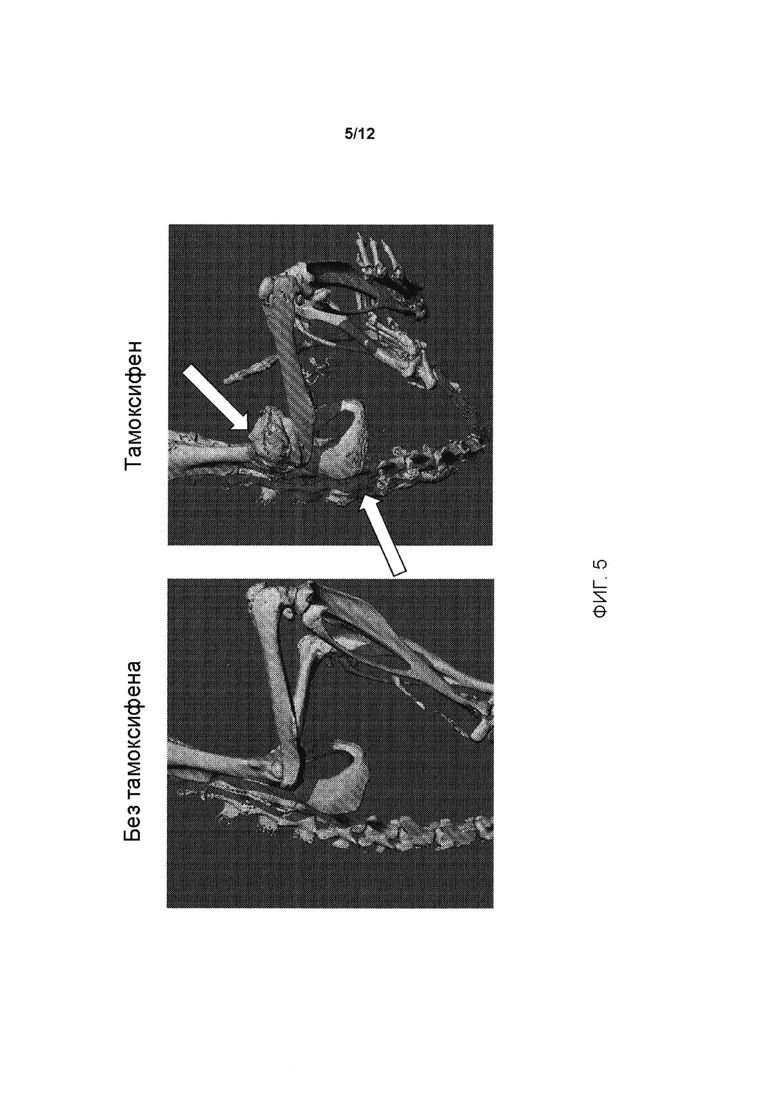
[0043] На ФИГ. 5 представлена другая иллюстрация гетеротопической оссификации у генетически модифицированных мышей, содержащих условный аллель, индуцированный у мышей, которым вводили тамоксифен; пример гетеротопической оссификации на грудине показан на правой панели белыми стрелками. При отсутствии введения тамоксифена (левая панель) гетеротопическая оссификация не обнаруживается.
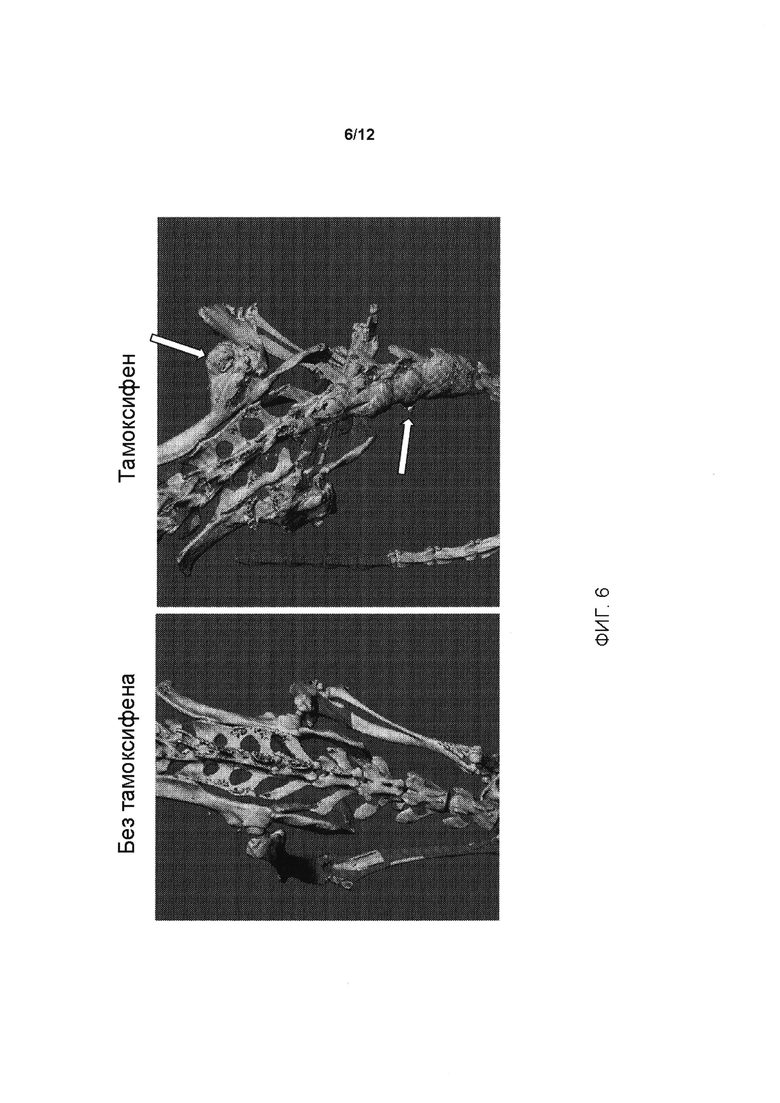
[0044] На ФИГ. 6 представлена еще одна иллюстрация гетеротопической оссификации у генетически модифицированных мышей, содержащих условный аллель, индуцированный у мышей, которым вводили тамоксифен; пример гетеротопической оссификации на грудине показан на правой панели белыми стрелками. При отсутствии введения тамоксифена (левая панель) гетеротопическая оссификация не обнаруживается.
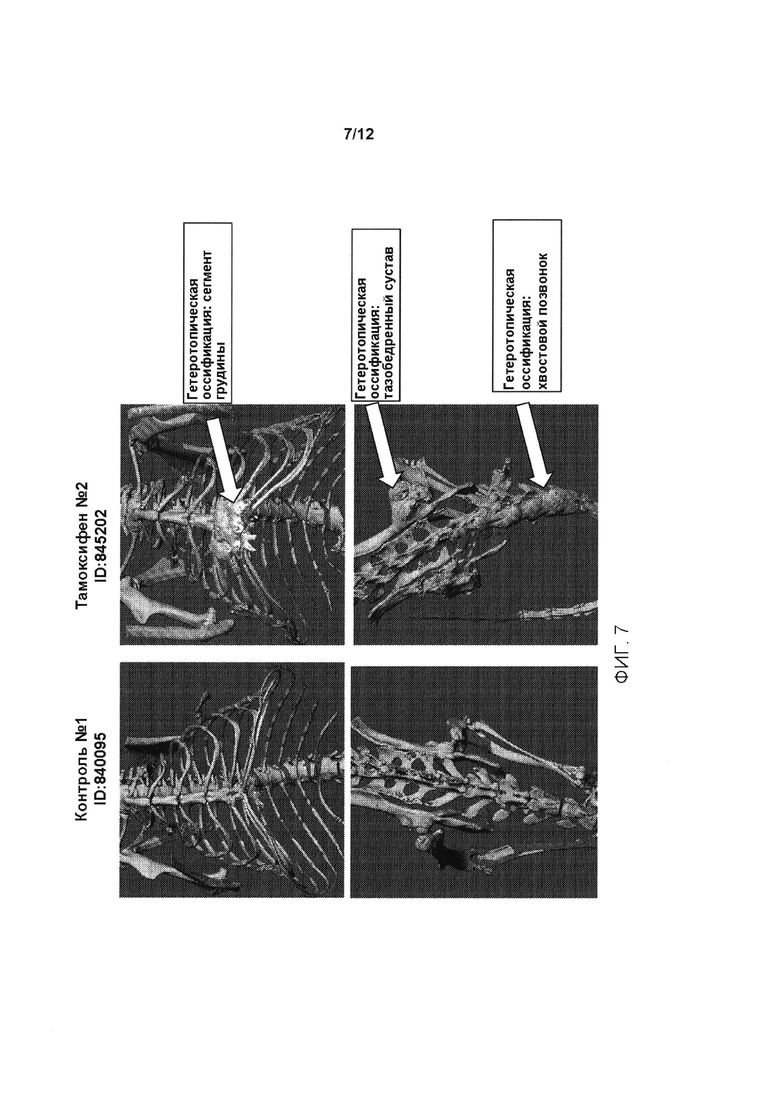
[0045] На ФИГ. 7 проиллюстрированы мыши из контрольной группы (левая панель, ID 840095); и гетеротопическая оссификация у генетически модифицированных мышей, содержащих условный аллель, индуцированный у мышей, которым вводили тамоксифен (Тамоксифен №2, ID:845202); на верхней правой панели показана гетеротопическая оссификация в сегменте грудины; на нижней правой панели показана гетеротопическая оссификация в тазобедренном суставе и хвостовых позвонках.
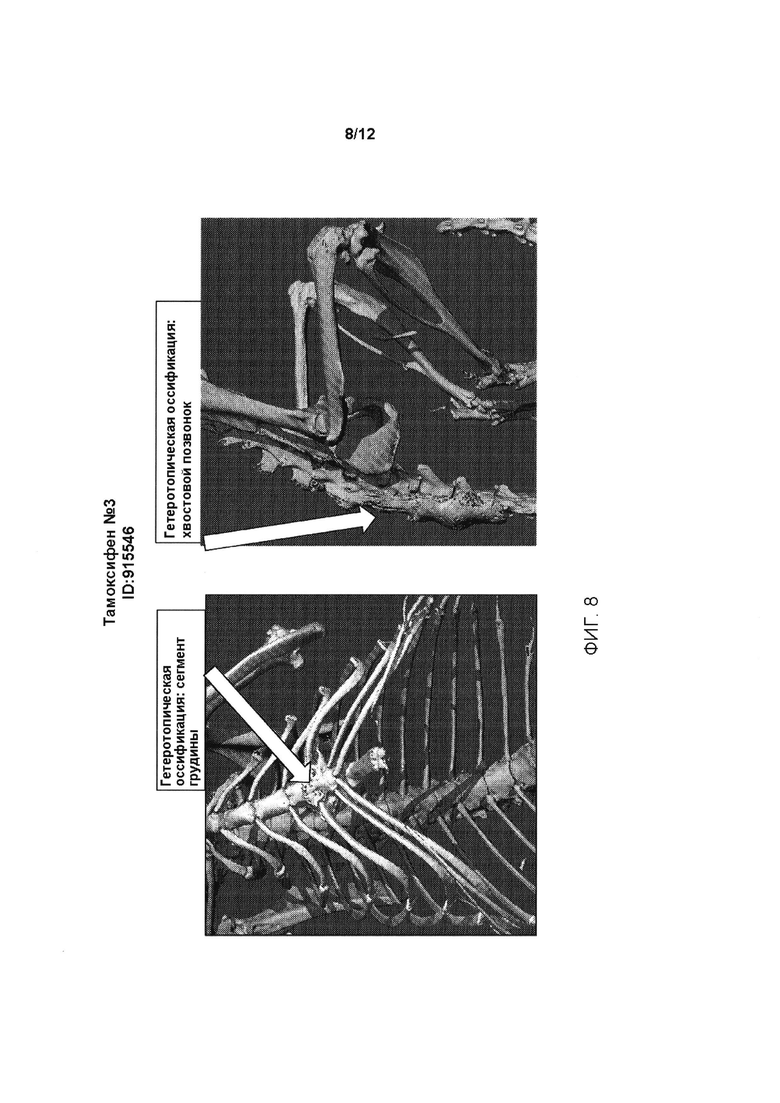
[0046] На ФИГ. 8 проиллюстрирована гетеротопическая оссификация в сегменте грудины (левая панель) и хвостовых позвонках (правая панель) генетически модифицированных мышей, содержащих условный аллель, индуцированный у мышей, которым вводили тамоксифен (Тамоксифен №3, ID:915546).
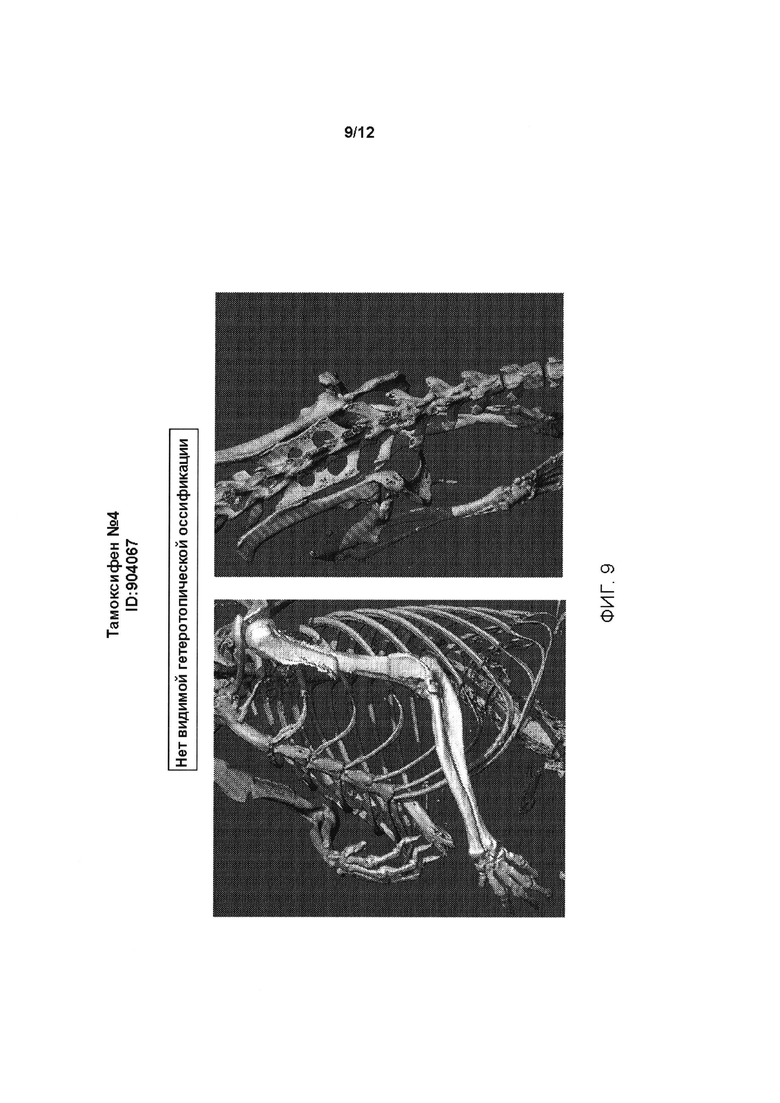
[0047] На ФИГ. 9 проиллюстрировано отсутствие гетеротопической оссификации у генетически модифицированной мыши, содержащей условный аллель, индуцированный тамоксифеном (Тамоксифен №4, ID:904067).
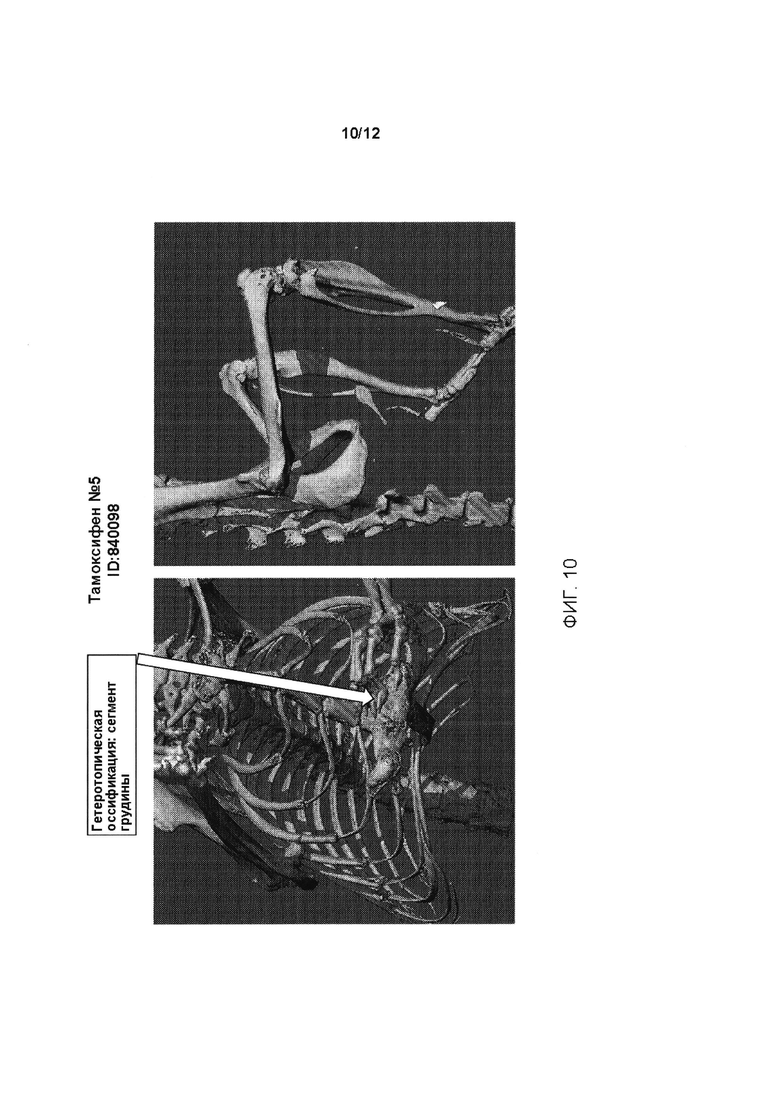
[0048] На ФИГ. 10 проиллюстрирована гетеротопическая оссификация в сегменте грудины (левая панель) у генетически модифицированных мышей, содержащих условный аллель, индуцированный введением тамоксифена (Тамоксифен №5, ID:840098).
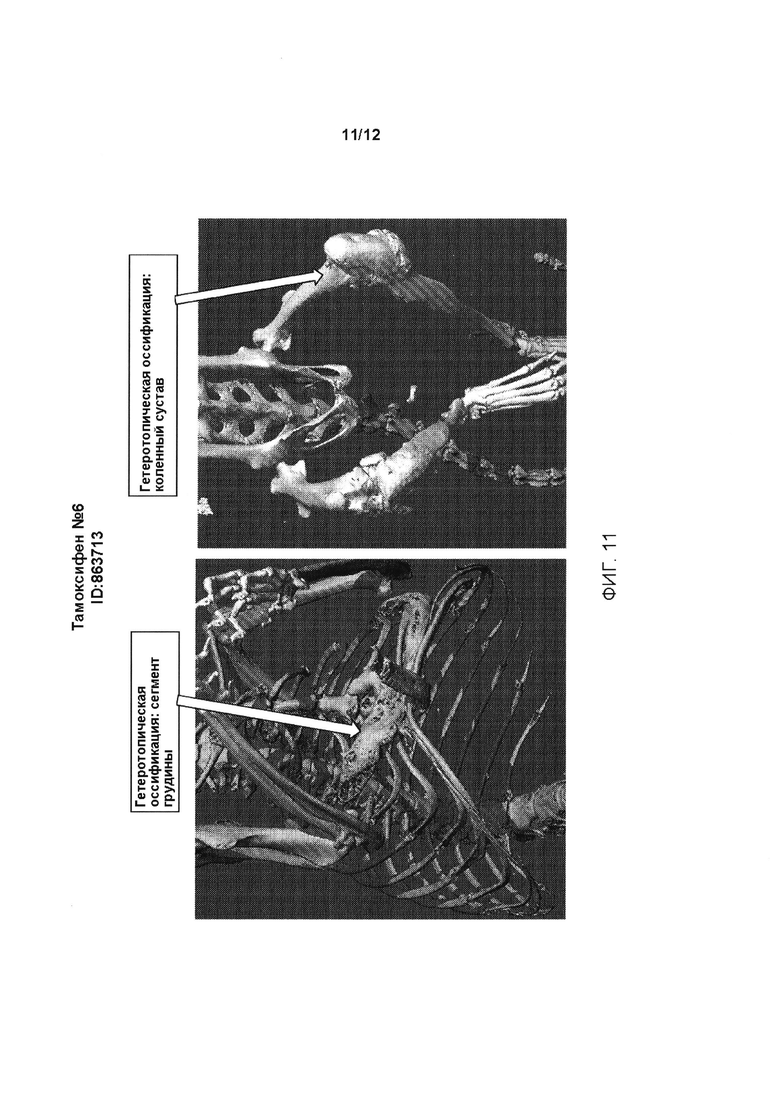
[0049] На ФИГ. 11 проиллюстрирована гетеротопическая оссификация в сегменте грудины (левая панель) и коленном суставе (правая панель) у генетически модифицированных мышей, содержащих условный аллель, индуцированный введением тамоксифена (Тамоксифен №6, ID:863713).
[0050] На ФИГ. 12 проиллюстрированы праймеры и зонды, используемые в анализе утраты аллеля для генотипирования генетически модифицированных мышей, содержащих условную мутацию в гене Acvr1, SEQ ID NO представляют собой сверху вниз: для прямого праймера сверху вниз SEQ ID NO: 1, SEQ ID NO: 2; для обратного праймера сверху вниз SEQ ID NO: 3, SEQ ID NO: 4; для зонда SEQ ID NO: 5, SEQ ID NO: 6.
ПОДРОБНОЕ ОПИСАНИЕ СУЩНОСТИ ИЗОБРЕТЕНИЯ
[0051] Прогрессирующая оссифицирующая фибродисплазия (ПОФ) представляет собой аутосомно-доминантное расстройство, характеризующееся гетеротопической оссификацией. Анализы групп сцепления в пораженных семьях показали, что ген ПОФ находится в хромосоме 2q23-24, где мутация 617G>A (R206>H) в домене активации гена рецептора активина А I типа (Acvr1) была обнаружена у всех пораженных лиц, обследованных в рамках исследования (Shore et al., (2006) A recurrent mutation in the BMP type I receptor Acvr1 causes inherited and sporadic fibrodysplasia ossificans progressiva, Nat. Genet. 38:525-527), что согласуется с ПОФ, вызванной конститутивной активацией Acvr1 (Id.).
[0052] Предлагаются генетически модифицированные мыши, экспрессирующие белок Acvr1, содержащий модификацию, которая приводит к расстройству, характеризующемуся гетеротопической оссификацией, например ПОФ. Мыши, экспрессирующие модифицированный белок Acvr1, включают мышей, которые не являются химерными, например, мышей, геном которых несет (условную) модификацию белка Acvr1, что приводит к гетеротопической оссификации у мыши, экспрессирующей модифицированный белок Acvr1.
[0053] Некоторые мутации в белке Acvr1, например R206H мутацию, связанную с ПОФ, создать в зародышевой линии мышей трудно, если не невозможно, из-за эмбриональной или перинатальной летальности, связанной с этой мутацией. Предлагаются генетически модифицированные мыши, содержащие условную-посредством-инверсии (COIN, от англ. COnditional-by-INversion) конструкцию, обеспечивающую условную инверсию и удаление экзона дикого типа и замену экзона дикого типа мутантным экзоном. Конструкция COIN обеспечивает формирование условного аллеля посредством размещения последовательности нуклеиновой кислоты, кодирующей инвертированный мутантный экзон, которая должна быть помещена рядом с экзоном дикого типа, подлежащим делеции. Посредством селекции сайтов распознавания рекомбиназы (RRS) инвертированный мутантный экзон разворачивают, чтобы поместить его в рамку считывания, тогда как экзон дикого типа удаляют. Подход COIN опирается на размещение несовместимых RSS (например, lox2372 и loxp), окружающих экзоны дикого типа и мутантные экзоны. Указанный подход COIN не позволяет экспрессию (перинатальной/эмбриональной) летальной мутации, если аллель COIN действует после отбора рекомбиназой (-ами). Еще одно преимущество указанного подхода COIN состоит в постоянном удалении экзона дикого типа при воздействии на выбранную рекомбиназу, и, таким образом, после инверсии в геноме не остается инвертированного повтора. Это является преимуществом, потому что исключает возможность повторной инверсии, поскольку оставшиеся сайты рекомбиназы несовместимы (например, lox2372 и lοxΡ). В этом случае гуманизация мышиного экзона дикого типа также сводит к минимуму последовательность инвертированного повтора, таким образом способствуя стадиям клонирования и облегчая проблемы реаранжировок во время и после таргетинга.
[0054] Если мышь, несущую аллель COIN, скрещивают с мышью с рекомбиназой, (перинатальная/эмбриональная) летальная мутация будет экспрессироваться у потомства in utero, таким образом, цель получения для исследования животного, экспрессирующего этот аллель, не будет достигнута. Поэтому мышь, несущую аллель COIN, не скрещивают с мышью, содержащей нерегулируемую рекомбиназу. Вместо этого мышь скрещивают с мышью, содержащей белок Cre-ER, модифицированный мутациями Т2 (мышь Cre-ERT2) или модифицированный для содержания аллеля Cre-ERT2. Белок Cre-ERT2 представляет собой белок Cre, модифицированный последовательностью эстрогенового рецептора, содержащей мутации Т2, делающие белок Cre неактивным (см., Indra, A. et al. (1999) Temporally-controlled site-specific mutagenesis in the basal layer of the epidermis: comparison of the recombinase activity of the tamoxifen-inducible Cre-ERT and Cre-ERT2 recombinases, Nucleic Acids Res. 27(22):4324-4327; Feil, R. et al. (1997) Regulation of Cre Recombinase Activity by Mutated Estrogen Receptor Ligand-Binding Domains, Biochem. Biophys. Res. Commun. 237:752-757; Патент США №7112715). Мышь, содержащая условный аллель, сконструированный с Cre-чувствительными RSS, как описано в данном документе, и содержащая аллель Cre-ERT2, будет, таким образом, экспрессировать аллель дикого типа если и до тех пор, пока мышь не подвергалась действию тамоксифена для индукции активности Cre. Таким образом, получены мыши, содержащие в своей зародышевой линии мутантный аллель Acvr1, но которые не экспрессируют мутантный белок Acvr1 до тех пор, пока эти мыши не подвергаются действию тамоксифена. После воздействия тамоксифена гибридный белок Cre-ERT2 активируется и условный аллель превращается в мутантный аллель, и, в различных вариантах реализации изобретения, превращение в мутантный аллель является необратимым, с делецией аллеля дикого типа. Таким образом, линия мышей, содержащая в ином случае летальную мутацию Acvr1, может поддерживаться по существу бесконечно, производить желаемое генетическое нарушение и сопровождающий фенотип всегда, когда это необходимо. В различных вариантах реализации настоящего изобретения генетически модифицированную мышь, содержащую аллель COIN Acvr1, получают путем модификации мышиной ЭС клетки для содержания в ней аллеля COIN и модификации той же ЭС клетки для содержания в ней гена, кодирующего индуцируемый тамоксифеном Cre-ERT или Cre-ERT2, и, используя ЭС клетку в качестве донорской клетки, чтобы получить мышь, содержащую аллель COIN и модифицированный ген Cre. Все ссылки, цитируемые в этой заявке, включены в данный документ посредством ссылок.
Конструирование условного аллеля ACVR1, передающегося по зародышевой линии
[0055] С целью конструирования мышиной модели прогрессирующей оссифицирующей фибродисплазии (ПОФ) была сконструирована "классическая ПОФ" мутация R206H Acvr1 человека (Shore et al. (2006)) в соответствующем мышином гене Acvr1. Эта мутация уже была смоделирована у мышей не условно, но полученные химерные мыши (возникающие в результате микроинъекции целевых ЭС клеток в бластоцисту) были не способны передавать мутацию через зародышевую линию, предположительно из-за эмбриональной или перинатальной летальности (Chakkalakal, S.A. et al. (2012) An Acvr1 R206H knock-in mouse had fibrodysplasia ossificans progressiva, J. Bone and Mineral Res. 27:1746-1756). До открытия этого фенотипа, и на основе фенотипа Acvr1 гомозиготных-нулевых мышей, которые демонстрируют важную роль Acvr1 в процессе развития (Mishina et al. (1999) Multiple roles for activin-like kinase-2 signaling during mouse embryogenesis, Dev. Biol. 212:314-326), было решено сконструировать мутацию Acvr1[R206H] у мышей в виде условной, используя способы изменения FlEx (Schnutgen, F. et al. (2003) A directional strategy for monitoring Cre-mediated recombination at the cellular level in the mouse, Nat. Biotech. 21:562-565) и COIN (Патент CUJA №7205148).
[0056] Для FlEx используется пара мутантных сайтов Lox - называются матрицей FlEx, которые распознаются одной рекомбиназой Cre, но которые не реагируют друг с другом и выложены в конфигурации А-В/[А-В], причем [А-В] находится в противоположной цепи по отношению к А-В для того, чтобы обеспечить возможность инверсии ДНК-последовательности, фланкированной этими матрицами. В опубликованном варианте реализации настоящего изобретения для FlEx используются сайты LoxP и Lox511. Менее известно, однако, что в присутствии Cre между LoxP и Lox511 имеет место низкий уровень рекомбинации. Таким образом, были протестированы различные комбинации вариантов Lox-сайтов, и комбинация LoxP-Lox2372 была отобрана для условного аллеля, описанного в данном документе, потому что эти два сайта не демонстрируют никакой перекрестной реактивности. Дополнительной особенностью FlEx является то, что последовательность, которая содержится в каждой матрице, т.е. между сайтами LoxP и Lox2372 каждой матрицы, при действии Cre будет удалена. При конструировании аллеля по изобретению (аллель Acvr1[R206H]COIN) учитываются оба эти свойства FlEx. Один вариант реализации условного аллеля проиллюстрирован на ФИГ. 2.
[0057] Мышиный Acvr1 отображает различные сплайс-варианты (например, 201, 202, 001, 003, 004). Экзон 5, мутированный при ПОФ, является общим для всех сплайс-вариантов Acvr1, кодирующих белок. В одном варианте реализации изобретения генетически модифицированная мышь содержит модификацию экзона 5 изоформы, выбранной из группы, состоящей из 201, 202, 001, 003 и 004.
[0058] Аллель Acvr1[R206H]COIN был сконструирован посредством размещения мутантной версии R206-кодирующего экзона мышиного Acvr1 (ENSMUSE00001021301) в антисмысловой цепи таким образом, что он не встроен в транскрипт Acvr1. Поскольку для функционирования Acvr1 необходима последовательность, кодируемая экзоном 5, это требует введения в конструкцию экзона, кодирующего последовательность экзона 5' дикого типа (экзон 5 разделяют все кодирующие белок сплайс-варианты Acvr1). Кроме того, поскольку экзоны не распознаются как таковые без вспомогательных интронных последовательностей, то необходимо включать участки выше и ниже экзона как в мутантный экзон, так и в экзон дикого типа, кодирующий R206. Однако это будет создавать большой инвертированный повтор, и такие структуры ДНК по своей природе склонны к рекомбинации как во время стадий генной инженерии, необходимых для построения нацеленного вектора, так и после таргетинга in vivo (Holkers, M. et al. (2012) Nonspaced inverted DNA repeats are potential targets for homology-directed gene repair in mammalian cells, Nucleic Acids Res. 40:1984-1999). Кроме того, если мышиная последовательность экзона дикого типа, кодирующего R206, и связанная с ней расположенная выше и ниже интронная последовательность были сохранены интактными и предшествуют мутантному экзону, то этот участок дикого типа может выступать в качестве группы гомологий и использоваться во время таргетинга в мышиных ЭС клетках, тем самым приводя к исключению мутированного экзона из целевого аллеля. Поэтому для решения данной задачи, аллель Acvr1[R206H]COIN был сконструирован таким образом, что:
[0059] (а) Большого инвертированного повтора удалось избежать. Чтобы достичь этого, экзон, кодирующий R206 (ENSMUSE00001021301), а также связанные с ними расположенные выше и ниже интронные последовательности были заменены соответствующей областью ACVR1 человека.
[0060] (b) Мышиная последовательность экзона дикого типа, кодирующего R206 (ENSMUSE00001021301), сохраняется на уровне белка. Учитывая то, что последовательность белка мыши и человека, соответственно, кодируются экзонами ENSMUSE00001021301 и ENSE00001009618, отличающимися одной аминокислотой, последовательность экзона ENSE00001009618 человека была изменена таким образом, чтобы соответствовать последовательности мышиного белка экзона ENSMUSE00001021301.
[0061] (с) Введенная последовательность человека полностью удаляется под действием Cre. Таким образом, при "условно-включенном" состоянии, при котором мутантный ген Acvr1[R206H] транскрибируется, не остается последовательностей человека, и, следовательно, любой возникающий фенотип не может быть связан с наличием посторонней последовательности.
[0062] Более конкретно, область, ограниченную нуклеотидами 58474046-58474368 в mmuAcvr1 (т.е. нуклеотиды от 58474046 до 58474368 хромосомы 2 мыши), заменяют нуклеотидами 15863048-158630803 hsaACVR1 (т.е. нуклеотидами от 15863048 до 158630803 хромосомы 2 человека) таким образом, что введенная последовательность, которая включает экзон ENSE00001009618 hsaACVR1, транскрибируется как часть полученного в результате модифицированного локуса Acvr1[R206H]COIN. Кроме того, кодирующую последовательность первой аминокислоты человеческого экзона ENSE00001009618 заменяют с аспарагиновой кислоты (D) на глутаминовую кислоту (Е), чтобы соответствовать на уровне белка точно такой же последовательности белка, которая кодируется мышиным экзоном ENSMUSE00001021301. (Эта введенная человеческая последовательность далее в этом описании называется hsa_e5+). Таким образом, до инверсии элемента COIN (мутированный экзон ENSMUSE00001021301 и связанные расположенные выше и ниже интронные последовательности - см. ниже), полученный локус Acvr1[R206H]COIN должен функционировать как локус дикого типа.
[0063] Мутация R206H была смоделирована путем мутации экзона ENSMUSE00001021301 в соответствующем положении посредством изменения кодона, определенного нуклеотидами от 5847419 до 58474200 с CGC (кодирование аргинина) на САС (кодирование гистидина). Полученный в результате мутантный экзон, вместе с фланкирующими интронными последовательностями, расположенными выше и ниже, были размещены 3' относительно hsa_e5+ и в антисмысловой цепи mmuAcvr1, замещая нуклеотиды mmuAcvr1 от 58473775 до 58473879 для того, чтобы создать небольшую делецию и разместить зонды LOA (Gomez-Rodriguez, J. et al. (2008) Advantages of q-PCR as a method of screening for gene targeting in mammalian cells using conventional and whole BAC-based constructs, Nucleic Acids Res. 36:e117; Valenzuela, D. et al. (2003) High-throughput engineering of the mouse genome coupled with high-resolution expression analysis, Nat. Biotech. 21:652-659). (Эта введенная мышиная последовательность далее в этом описании называется mmu_e5R206H+).
[0064] Для того чтобы сделать возможной Cre-зависимую инверсию mmu_e5R206H+ и одновременную делецию hsa_e5+, комбинацию FlEx-подобных Lox-матриц использовали таким образом, что:
[0065] (а) сайт LoxP предшествует hsa_e5+, а сайт Lox2372 следует за ним. В этом отношении hsa_e5+ содержится с 5' LoxP-Lox2372 FlEx-подобной матрицей.
[0066] (b) за mmu_e5R206H+ следует 3' LoxP-Lox2372 FlEx-подобная матрица, но эту матрицу создают таким образом, что она находится в конфигурации зеркального отображения относительно 5' LoxP-Lox2372 FlEx-подобной матрицы. Это позволяет постоянную инверсию mmu_e5R206H+ в смысловой цепи посредством Cre.
[0067] Когда полученный в результате аллель Acvr1[R206H]COIN подвергнется действию Cre, hsa_e5+ будет удален, и mmu_e5R206H+ будет инвертирован в смысловой цепи. В результате Acvr1[R206H] будет экспрессироваться вместо Acvr1.
[0068] Генетически модифицированную мышь подвергали генотипированию с использованием анализа утраты аллеля (см., например, Valenzuela et al., (2003), выше). Праймеры и зонды были такими, как показано на ФИГ. 12 (Таблица 5).
Фенотип мыши Acvr1R206HCOIN/+е
[0069] Мыши Acvr1R206HCOIN/+ являются фенотипически нормальными, но у них развивается ФОП после активации условной мутации R206H.
[0070] На основе опубликованных результатов для не-условных, простых Acvr1R206H химерных мышей с нокином гена (Chakkalakal et al., 2012), а также того факта, что ПОФ является аутосомно-доминантным заболеванием (для обзора см. (Pignolo et al., 2011)), было высказано предположение, что:
[0071] (а) В отличие от не-условного аллеля Acvr1R206H (Chakkalakal et al., 2012), целевые в отношении Acvr1[R206H]COIN ЭС клетки будут производить VELOCIMICE®, т.е. мышей F0, которые полностью получены из целевых ЭС клеток (Poueymirou et al. (2007) F0 generation mice fully derived from gene-targeted embryonic stem cells allowing immediate phenotypic analyses, Nat. Biotech. 25: 91-99).
[0072] (b) В отличие от не-условных химерных мышей Acvr1R206H/+ (Chakkalakal et al., 2012), мыши F0 Acvr1[R206H]COIN/+ будут фенотипически нормальными и будут передавать аллель Acvr1[R206H]COIN следующему поколению.
[0073] (с) После инверсии мутантного экзона, несущего мутацию R206H в смысловой цепи (действие, опосредованное Cre-рекомбиназой) клетки, преобразованные в генотип Acvr1[R206H]INV/+ будут экспрессировать мутантный аллель Acvr1[R206H], а также аллель дикого типа, отражая ситуацию пациентов с ПОФ. В тех же линиях у полученных мышей Acvr1[R206H]INV/+ со временем должны развиваться ПОФ-подобные симптомы.
[0074] Все эти гипотезы подтвердились. Например, клон ЭС клеток 1649С-А2 дал начало 16 VELOCIMICE® из 19 мышей, созданных с использованием этого клона (Таблица 1).
[0075]
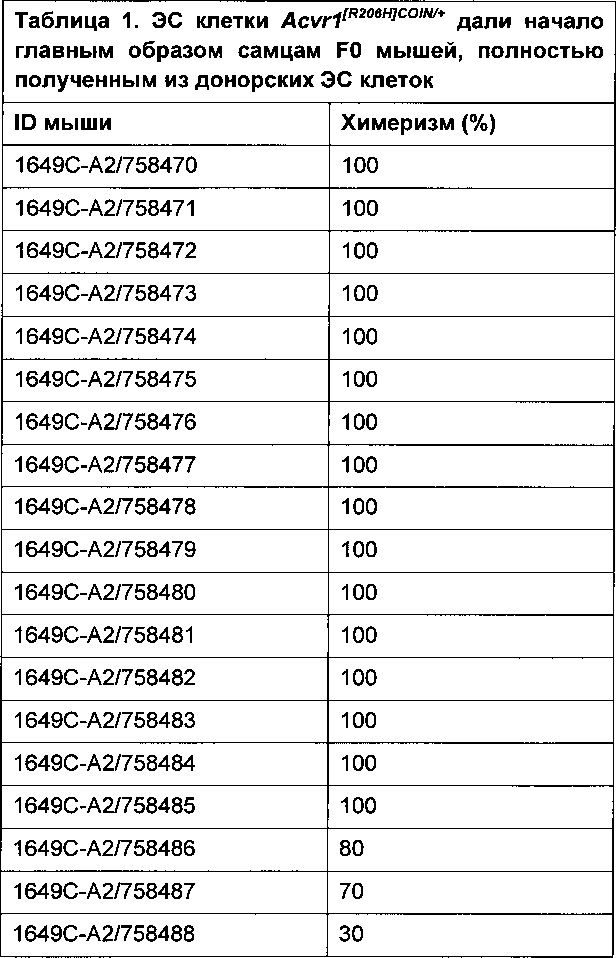
[0076] Кроме того, эти мыши не имели фенотипических различий и были способны к репродукции и стали отцами мышей поколения F1 Acvr1[R206H]COIN/+ (Таблица 2).
[0077]
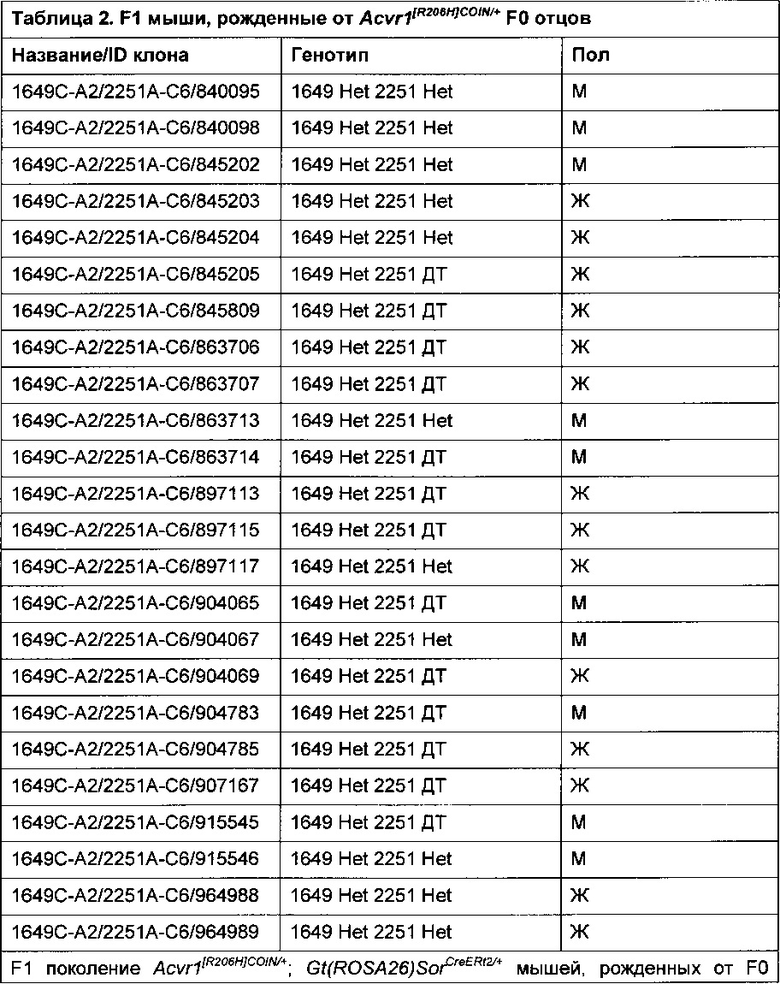
[0078] С фенотипической точки зрения мыши Acvr1[R206H]COIN/+ выглядели нормальными, без фенотипических различий. То же относится к мышам Acvr1[R206H]COIN/+; Gt(ROSA26)SorCreERt2/+, которые в дополнение к аллелю Acvr1[R206H]COIN также несут трансген CreERT2 с нокином в локусе Gt(ROSA26)Sor. Это позволяет повсеместную экспрессию неактивной версии Cre, активация которой зависит от тамоксифена (Feil et al. (1997) Regulation of Cre recombinase activity by mutated estrogen receptor ligand-binding domains, Biochem. Biophys. Res. Commun. 237:752-757). Это позволяет активацию Cre в определенный момент времени и, следовательно, не только позволяет обойти эмбриональную летальность, наблюдаемую с обычным нокином Acvr1[R206H], но также дает возможность исследователю выбирать время активации экспрессии Acvr1[R206H] у соответствующей мыши.
[0079] Для исследования того, развивается ли у мышей Acvr1[R206H]COIN/+ Gt(ROSA26)SorCreERt2/+ ПОФ после воздействия тамоксифена, авторы настоящего изобретения создали небольшую когорту и вводили ей тамоксифен, начиная приблизительно с возраста одного года (Таблица 3); следует отметить, что к этому возрасту мыши завершают свое развитие и, следовательно, у них отсутствуют значимые механизмы, связанные с моделированием или развитием, следовательно, они не могут вносить свой вклад в патологический процесс. Доставка тамоксифена осуществлялась путем инъекции в брюшину с использованием раствора в кукурузном масле с концентрацией 10 мг/мл. Инъекции проводились ежедневно в течение 8 дней. У трех мышей (мыши 1, 2 и 3 из Таблицы 3) выполняли резекцию небольшого кусочка мышцы, чтобы стимулировать повреждение.
[0080]

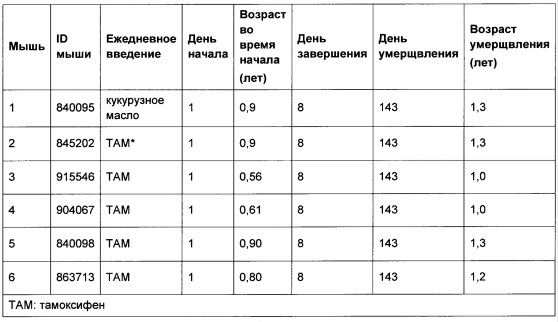
[0081] У всех мышей, которым вводили тамоксифен, кроме одной, развилась гетеротопическая оссификация, отражая то, что наблюдалось при ПОФ (Таблица 4). Хотя в этом эксперименте конкретный тип (-ы) клеток, которые могут вносить свой вклад в процесс заболевания, не был определен из-за того, что экспрессия CreERt2 является повсеместной (свойство, придаваемое тем фактом, что ее экспрессирует локус Gt(ROSΑ26)Sor), одним из важных аспектов этой работы является то, что она снимает аспекты развития ПОФ (те, которые не являются наиболее важной патологией ПОФ, поскольку они не способствуют разрушительной потере качества жизни пациентов с ПОФ), и показывает, что гетеротопическая оссификация, которая является основным постнатальным признаком патологии ПОФ, не зависит от процессов развития.
[0082]
[0083] Гетеротопическая оссификация показана на снимках генетически модифицированных мышей, описанных в данном документе, которые подверглись действию тамоксифена (отображают гетеротопическую оссификацию). Мыши, являющиеся генетически модифицированными, как описано в данном документе, но которые не подверглись действию тамоксифена, не демонстрируют гетеротопической оссификации. См., например, ФИГ. 3, ФИГ. 4, ФИГ. 5, ФИГ. 6, ФИГ. 7, ФИГ. 8, ФИГ. 10 и ФИГ. 11. Гетеротопическая оссификация продемонстрирована в различных областях тела. Как показано на ФИГ. 9, одна мышь не продемонстрировала очевидной гетеротопической оссификации.
| название | год | авторы | номер документа |
|---|---|---|---|
| МОДЕЛЬ ПРОГРЕССИРУЮЩЕЙ ОССИФИЦИРУЮЩЕЙ ФИБРОДИСПЛАЗИИ НА ГРЫЗУНАХ | 2019 |
|
RU2795136C2 |
| НЕ ЯВЛЯЮЩИЕСЯ ЧЕЛОВЕКОМ ЖИВОТНЫЕ С ДЕФИЦИТОМ ДПНРНК | 2014 |
|
RU2721855C2 |
| ОПОСРЕДОВАННОЕ НУКЛЕАЗОЙ НАЦЕЛИВАНИЕ С БОЛЬШИМИ НАЦЕЛИВАЮЩИМИ ВЕКТОРАМИ | 2013 |
|
RU2645475C2 |
| НАПРАВЛЕННАЯ МОДИФИКАЦИЯ ГЕНОМА КРЫСЫ | 2014 |
|
RU2676708C2 |
| ТРАНСГЕННЫЕ ЖИВОТНЫЕ И СПОСОБЫ ПРИМЕНЕНИЯ | 2011 |
|
RU2580017C2 |
| ЖИВОТНЫЕ, УСТОЙЧИВЫЕ К ВИРУСУ РЕПРОДУКТИВНО-РЕСПИРАТОРНОГО СИНДРОМА СВИНЕЙ | 2012 |
|
RU2644673C2 |
| Способ получения генно-модифицированных кроликов с нокаутом гена LEPR с помощью системы CRISPR/Cas9 | 2023 |
|
RU2836438C1 |
| СПОСОБ ПОЛУЧЕНИЯ ОТЛИЧНОГО ОТ ЧЕЛОВЕКА ЖИВОТНОГО С МУТИРОВАННЫМ НОКИН-ГЕНОМ, СПОСОБ ТЕСТИРОВАНИЯ ВЕЩЕСТВА НА ПРИМЕНИМОСТЬ ДЛЯ ЛЕЧЕНИЯ БОЛЕЗНИ АЛЬЦГЕЙМЕРА (ВАРИАНТЫ), ПЛАЗМИДА (ВАРИАНТЫ), СПОСОБ ПОЛУЧЕНИЯ ПЕРВИЧНОЙ КУЛЬТУРЫ КЛЕТОК ИЛИ СУБКУЛЬТИВИРУЕМОЙ КЛЕТКИ | 1999 |
|
RU2266002C2 |
| САМОИНАКТИВИРУЮЩИЕСЯ АДЕНОВИРУСЫ-ПОМОЩНИКИ ДЛЯ ПОЛУЧЕНИЯ РЕКОМБИНАНТНЫХ АДЕНОВИРУСОВ С ВЫСОКОЙ ЕМКОСТЬЮ | 2009 |
|
RU2520809C2 |
| Способ получения мышиной модели для изучения миодистрофии Дюшенна и вариантов ее терапии | 2023 |
|
RU2815936C1 |



Изобретение относится к области биохимии, в частности к генетически модифицированному грызуну, способному демонстрировать фенотип гетеротопической оссификации. При этом вышеуказанный грызун содержит внутри аллеля Acvr1 конструкцию, причем указанная конструкция содержит мутантный экзон 5 Acvr1 в антисмысловой ориентации, фланкированный парой сайтов распознавания сайт-специфической рекомбиназы (SRRS), а также дополнительно содержит вторую пару SRRS, направляющих удаление экзона 5 Acvr1 дикого типа при действии индуцируемой сайт-специфической рекомбиназы, и ген, кодирующий индуцируемую сайт-специфическую рекомбиназу. Также раскрыта мышиная эмбриональная стволовая (ЭС) клетка вышеуказанного грызуна и ее применение в качестве донорской клетки для получения мыши, содержащей генетически модифицированный аллель Acvr1 и ген тамоксифен-индуцируемой Cre-ERT или Cre-ERT2. Изобретение также относится к способу получения генетически модифицированной мыши, содержащей генетически модифицированный аллель Acvr1 и тамоксифен-индуцируемую Cre-ERT или Cre-ERT2. Изобретение позволяет эффективно получать генетически модифицированного грызуна, демонстрирующего фенотип гетеротопической оссификации. 5 н. и 3 з.п. ф-лы, 12 ил., 4 табл.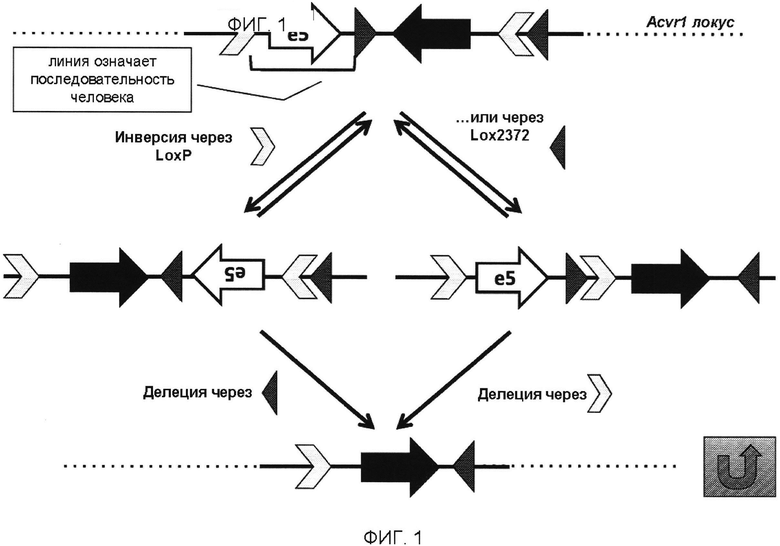
1. Генетически модифицированный грызун, способный демонстрировать фенотип гетеротопической оссификации, содержащий внутри аллеля Acvr1 конструкцию, причем указанная конструкция содержит мутантный экзон 5 Acvr1 в антисмысловой ориентации, причем мутантный экзон 5 Acvr1, содержит мутацию, кодирующую R206H, и фланкируется выше и ниже первой парой сайтов распознавания сайт-специфической рекомбиназы (SRRS), направляющих инверсию мутантного экзона 5 Acvr1 при действии индуцируемой сайт-специфической рекомбиназы, при этом грызун дополнительно содержит вторую пару SRRS, направляющих удаление экзона 5 Acvr1 дикого типа при действии индуцируемой сайт-специфической рекомбиназы, и ген, кодирующий индуцируемую сайт-специфическую рекомбиназу, причем первая пара SRRS и вторая пара SRRS являются несовместимыми, и где грызун представляет собой мышь или крысу.
2. Генетически модифицированная мышь по п. 1, при этом после вставки и удаления полученная в результате мышь демонстрирует фенотип гетеротопической оссификации.
3. Генетически модифицированная мышь по п. 2, причем экзон 5 Acvr1 дикого типа представляет собой экзон 5 Acvr1 человека и причем кодирующая последовательность первой аминокислоты экзона 5 Acvr1 человека заменена для кодирования глутаминовой кислоты; причем мутантный экзон 5 Acvr1 представляет собой мышиный экзон 5 Acvr1, содержащий мутацию, кодирующую R206H; и причем пары несовместимых SRRS представляют собой LoxP и Lox2372.
4. Генетически модифицированная мышь, которая демонстрирует фенотип гетеротопической оссификации, содержащая мутантный экзон 5 Acvr внутри смысловой цепи аллеля Acvr1, причем мутантный экзон 5 Acvr1 представляет собой мышиный экзон 5 Acvr1, содержащий мутацию, кодирующую R206H, и был инвертирован в смысловой цепи посредством индуцируемой Cre-рекомбиназы, оказывающей действие на конструкцию в антисмысловой ориентации внутри аллеля Acvr1, при этом конструкция содержит мутантный экзон 5, фланкированный выше и ниже сайтами сайт-специфической рекомбинации LoxP и Lox2372, причем экзон 5 Acvr1 дикого типа был удален посредством индуцируемой Cre-рекомбиназы и причем экзон 5 Acvr1 дикого типа представляет собой экзон 5 Acvr1 человека, причем кодирующая последовательность первой аминокислоты экзона 5 Acvr1 человека заменена для кодирования глутаминовой кислоты.
5. Мышиная эмбриональная стволовая (ЭС) клетка для получения мыши, способной демонстрировать фенотип гетеротопической оссификации, содержащая генетически модифицированный аллель Acvr1, который обеспечивает условное удаление экзона 5 Acvr1 дикого типа и замену экзона 5 Acvr1 дикого типа мутантным экзоном 5 Acvr1, содержащим мутацию, кодирующую R206H, причем мутантный экзон находится в антисмысловой ориентации и фланкируется выше и ниже первой парой сайтов распознавания сайт-специфической рекомбиназы (SRRS), направляющих инверсию мутантного экзона 5 Acvr1 при действии индуцируемой сайт-специфической рекомбиназы, и причем модифицированный аллель Acvr1 содержит вторую пару SRRS, направляющих удаление экзона 5 Acvr1 дикого типа при действии индуцируемой сайт-специфической рекомбиназы, и причем первая пара SRRS и вторая пара SRRS являются несовместимыми.
6. Мышиная ЭС клетка по п. 5, дополнительно содержащая ген, кодирующий тамоксифен-индуцируемую Cre-ERT или Cre-ERT2.
7. Применение мышиной ЭС клетки по п. 5 в качестве донорской клетки для получения мыши, содержащей (i) генетически модифицированный аллель Acvr1 и (ii) ген тамоксифен-индуцируемой Cre-ERT или Cre-ERT2.
8. Способ получения генетически модифицированной мыши, содержащей генетически модифицированный аллель Acvr1 и тамоксифен-индуцируемую Cre-ERT или Cre-ERT2, причем способ предусматривает стадии:
(a) модификации мышиной ЭС клетки для содержания в ней генетически модифицированного аллеля Acvr1, включающей мутантный экзон 5 Acvr1, содержащий мутацию, кодирующую R206H, причем мутантный экзон находится в антисмысловой ориентации и фланкируется выше и ниже первой парой сайтов распознавания сайт-специфической рекомбиназы (SRRS), направляющих инверсию мутантного экзона 5 Acvr1 при действии индуцируемой сайт-специфической рекомбиназы, при этом модифицированный аллель Acvr1 содержит вторую пару SRRS, направляющих удаление экзона 5 Acvr1 дикого типа при действии индуцируемой сайт-специфической рекомбиназы, и причем первая пара SRRS и вторая пара SRRS являются несовместимыми;
(b) модификации модифицированной ЭС клетки, полученной на стадии (а), для содержания в ней гена, кодирующего тамоксифен-индуцируемую Cre-ERT или Cre-ERT2; и
(c) использования модифицированной ЭС клетки, полученной на стадии (b), в качестве донорской клетки, чтобы получить мышь, содержащую генетически модифицированный аллель Acvr1 и тамоксифен-индуцируемую Cre-ERT или Cre-ERT2.
| WO 2007123896 A2, 01.11.2007 | |||
| KAN LIXIN et al | |||
| Animal models of typical heterotopic ossification, Journal of Biomedicine and Biotechnology, 2011, Article ID 309287, 8 pages, doi:10.1155/2011/309287 | |||
| KAPLAN FREDERICK S | |||
| et al | |||
| Fibrodysplasia ossificans progressiva: mechanisms and models of skeletal metamorphosis, Disease Models & Mechanisms 2012, 5, 756-762 | |||
| CHAKKALAKAL SALIN A | |||
| et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| РЫБЧИН В.Н | |||
| Основы генетической инженерии, Учебник для ВУЗов, Санкт-Петербург, Издательство СПбГТУ, 2002, 522 с., с.410-417. | |||
Авторы
Даты
2019-01-11—Публикация
2014-03-13—Подача