Область техники
Изобретение относится к ветеринарии, а именно, ветеринарной вирусологии, в частности к тест-системе для обнаружения РНК особо опасного возбудителя болезни Гамборо у птиц. Изобретение может быть использовано при диагностике болезни Гамборо в научно-исследовательских учреждениях, ветеринарных лабораториях и на предприятиях биологической промышленности.
Уровень техники
Болезнь Гамборо (также известная как инфекционный бурсит кур, или инфекционная бурсальная болезнь), является крайне заразной болезнью молодых цыплят, вызванной вирусом инфекционной бурсальной болезни (IBDV). Болезнь характеризуется поражением фабрициевой сумки, нефрозом, внутримышечными кровоизлияниями, иммуносупрессией и диареей. Заболеваемость и смертность нарастают быстро и достигают максимума на 3-4-й день болезни. В последние годы в Европе, Латинской Америке, Юго-Восточной Азии, Африке и на Ближнем Востоке появились очень вирулентные штаммы IBDV, вызывающие повышенную смертность у птиц. Своевременное обнаружение болезни кране важно для экономики птицеводства, в том числе из-за высокой контагиозности вируса, повышенной восприимчивости зараженных птиц к другим заболеваниям и негативного эффекта для вакцинации.
В основе всех противоэпизоотических мероприятий лежит идентификация возбудителя. Постановка полимеразной цепной реакции (ПЦР) необходима для уточнения этиологии инфекционного заболевания. Метод ПЦР в реальном времени позволяет идентифицировать генетический материал возбудителя в биологической пробе менее чем за 3 часа и включает в себя следующие этапы: выделение нуклеиновых кислот – ДНК и / или РНК, амплификацию и анализ результатов. В основе реакции ПЦР лежит многократное увеличение искомого участка ДНК при помощи специального фермента – термостабильной ДНК-полимеразы. В случае исследования РНК-содержащего материала, этому этапу предшествует реакция обратной транскрипции, направленная на получение кДНК из РНК, и проходящая в присутствии фермента обратной транскриптазы.
В настоящий день существуют несколько способов постановки ПЦР. Классические методы занимают до двух дней и включают до 14 этапов отмывок для приготовления чистой пробы нуклеиновой кислоты и до 6 этапов для проведения амплификации.
Известна тест–система для обнаружения штамма возбудителя болезни Гамборо методом ПЦР (Tomás G, et al., Development of an RT-qPCR assay for the specific detection of a distinct genetic lineage of the infectious bursal disease virus. Avian Pathol., 2017 Apr;46(2):150-156). Недостатком данной тест-системы является олигонуклеотидный состав, не позволяющий отжигать ампликоны небольшого размера (менее 200 пМ) для повышения специфичности тест-системы. Кроме того, длина и пространственная конфигурация олигонуклеотидных конструкций недостаточно оптимизирована для постановки двухэтапной ПЦР без элонгации, что увеличивает время проведения ПЦР.
Также известны другие способы идентификации болезни Гамборо, например, WO 2010126351 A1, US 2005214316 A1, US 2006188871 A1, Peters M, et al., Journal of Virological Methods, vol. 127, no. 1,pages 87-95, July 2005.
Недостатками данных способов являются недостаточная эргономичность, усложненный формат проведения реакции ПЦР, и не всегда хорошая эффективность обнаружения вируса.
Несмотря на известность ряда способов диагностики болезни Гамборо у птиц, на сегодняшний день на рынке сохраняется потребность в удобном, быстром и эффективном методе обнаружения вируса инфекционной бурсальной болезни. Данное изобретение обладает рядом свойств, необходимых для решения этой задачи.
Сущность изобретения
Задачей настоящего изобретения является создание набора для выявления нуклеиновой кислоты инфекционного агента, вызывающего болезнь Гамборо у птиц, в различных материалах при помощи ПЦР-анализа в режиме реального времени.
Существенными признаками, отличающими настоящее изобретение, являются: (а) оптимизированный олигонуклеотидный состав синтетических праймеров и зондов; (б) удобный формат амплификационной смеси для выявления нуклеиновой кислоты в один шаг.
Указанная задача решается путем создания набора для обнаружения РНК вируса болезни Гамборо, где указанный набор включает олигонуклеотиды, имеющие следующие последовательности: SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, при этом олигонуклеотид с последовательностью SEQ ID NO:3 содержит флуоресцентный краситель HEX, прикрепленный на его 5’-конце или 3'-конце при помощи ковалентной связи, и содержит гаситель флуоресценции BHQ1, прикрепленный на противоположном от указанного красителя конце указанного олигонуклеотида при помощи ковалентной связи.
В некоторых вариантах изобретения данный набор характеризуется тем, что дополнительно включает ферменты ДНК-полимеразу и обратную транскриптазу, а также смесь четырех различных дезоксирибонуклеотидов. Дезоксирибонуклеотиды должны быть пригодны для встраивания в растущую цепь ДНК в реакции ПЦР, и включают в себя дезоксиаденозинтрифосфат, дезоксигуанозинтрифосфат, дезоксицитидинтрифосфат и дезокситимидинтрифосфат. В предпочтительных вариантах изобретения ДНК-полимеразой является ДНК-полимераза Taq, в других вариантах может быть использована другая термостабильная полимераза, пригодная для осуществления реакции ПЦР.
Указанная задача также решается путем создания способа диагностики вируса болезни Гамборо у птиц, включающего по меньшей мере следующие стадии: (а) берут образец биологического материала у птицы, предположительно инфицированной вирусом; (б) выделяют РНК из указанного образца; (в) проводят реакцию ПЦР с использованием вышеуказанного набора олигонуклеотидов; (г) при обнаружении сигнала в указанной реакции ПЦР констатируют присутствие вируса болезни Гамборо в организме указанной птицы. В предпочтительных вариантах изобретения биологическим материалом является лимфоидная ткань, такая как, например, лимфоузлы, бурсальная ткань, селезенка.
Техническим результатом настоящего изобретения является повышение степени специфичности и чувствительности диагностической тест-системы, а также сокращение времени проведения диагностики при снижении вероятности технологических ошибок во время лабораторных манипуляций за счет удобного формата предложенной тест-системы.
Краткое описание рисунков
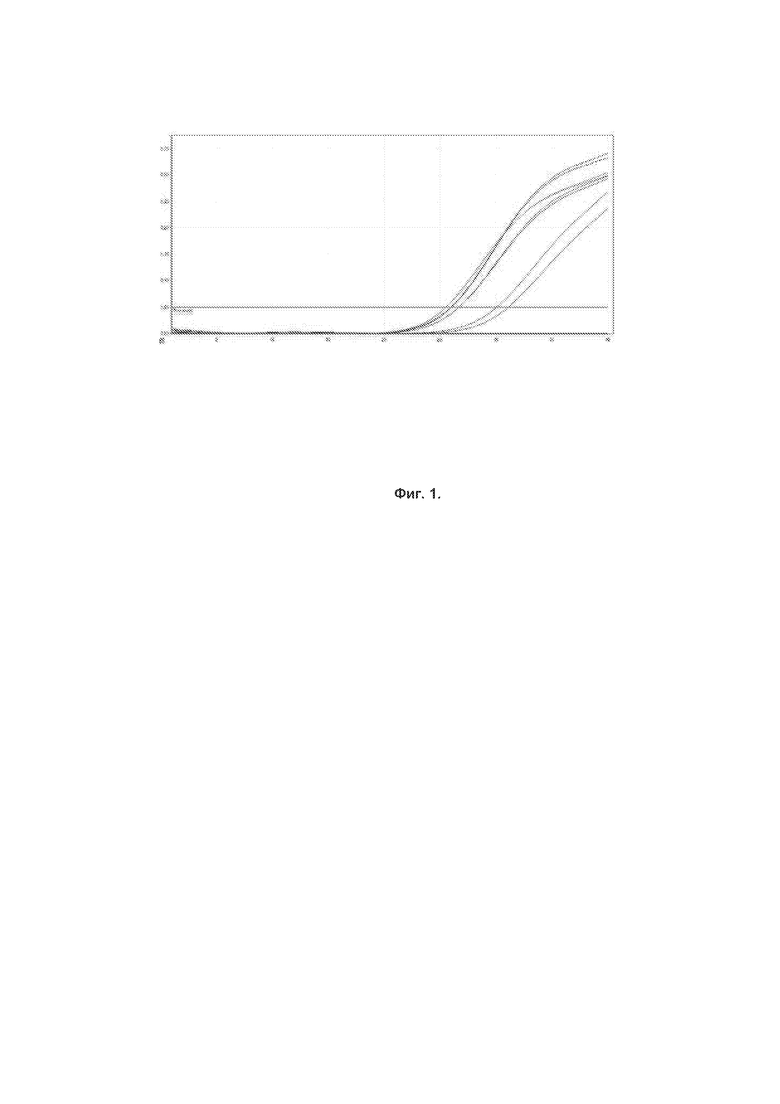
Фиг. 1. График накопления сигнала флуоресценции при амплификации специфического фрагмента нуклеиновой кислоты возбудителя, канал HEX. По оси абсцисс указано количество циклов в реакции, по оси ординат – нормализованная интенсивность флюоресценции.
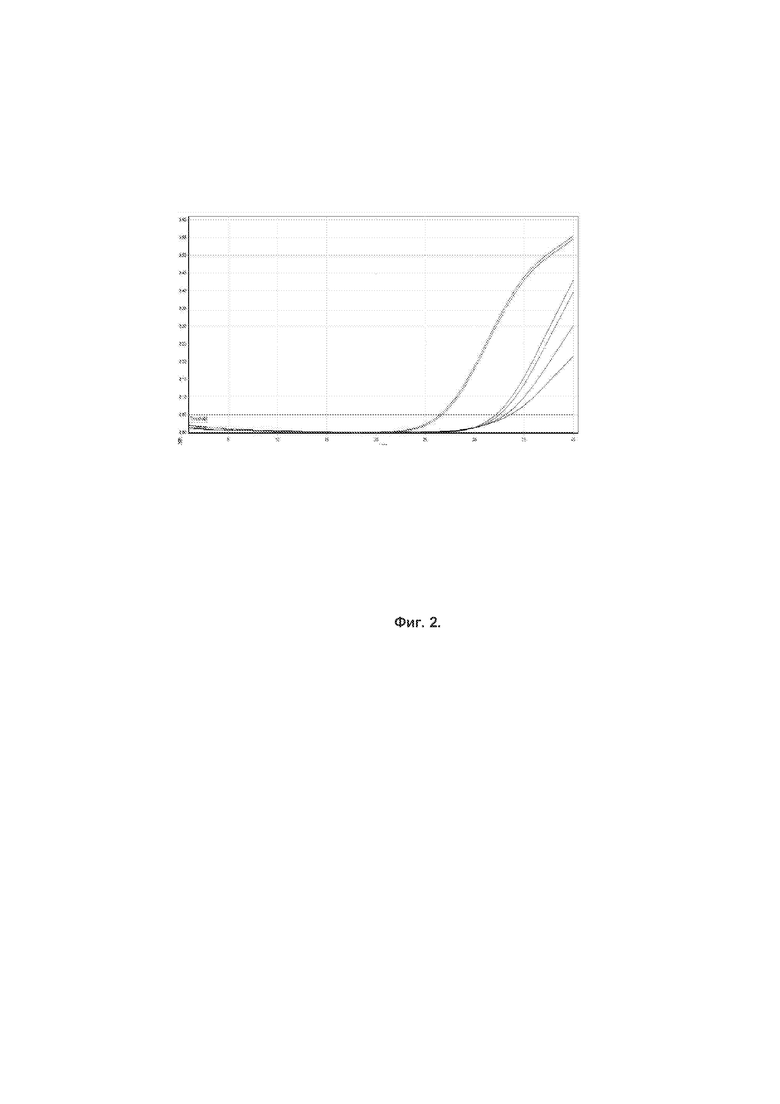
Фиг. 2. График накопления сигнала флуоресценции, канал FAM, амплификация кДНК ВКО. По оси абсцисс указано количество циклов в реакции, по оси ординат – нормализованная интенсивность флюоресценции.
Подробное раскрытие изобретения
В описании данного изобретения термины «включает» и «включающий» интерпретируются как означающие «включает, помимо всего прочего». Указанные термины не предназначены для того, чтобы их истолковывали как «состоит только из». Если не определено отдельно, технические и научные термины в данной заявке имеют стандартные значения, общепринятые в научной и технической литературе.
Одной из задач настоящего изобретения является упрощение способа проведения ПЦР-анализа для установления наличия возбудителей инфекционных заболеваний птиц. Существенным отличием заявляемого изобретения является использование системы реагентов, содержащей, в предпочтительном варианте, синтетические олигонуклеотидные конструкции, генетически-модифицированные ферменты полимеразу и обратную транскриптазу, дезоксинуклеозидтрифосфаты, буферные компоненты. В одном из вариантов изобретения олигонуклеотидные конструкции имеют следующий состав:
SEQ ID NO:1 - ACCGGCATCGACAATCTTATG (прямой праймер)
SEQ ID NO:2 - TCCAACCAATGAGATAACCCAGCCA (обратный праймер)
SEQ ID NO:3 - 5'-HEX- CGTTGTTACAACTATCGTTAGCGG-BHQ1-3' –
(олигонуклеотид - флуоресцирующий зонд, где BHQ1 обозначает присоединенный к 3'-концевому нуклеотиду G темновой гаситель флуоресценции, a HEX обозначает флуоресцентный краситель HEX, присоединенный к 5'-концевому нуклеотиду С). В другом варианте изобретения краситель может быть присоединен к 3'-концевому нуклеотиду при помощи ковалентной связи, а гаситель – к 5'-концевому нуклеотиду. Набор для обнаружения РНК вируса болезни Гамборо при помощи ПЦР-анализа также может включать положительный контрольный образец, представляющий собой смесь плазмид, одна из которых содержит участок, комплементарный синтетическим олигонуклеотидным конструкциям; также набор может включать отрицательный контрольный образец.
Необходимый технический результат достигается при приготовлении компонентов реагентов для выявления нуклеиновой кислоты возбудителя болезни Гамборо. В предпочтительных вариантах изобретения используют следующие компоненты: минимум три олигонуклеотидные конструкции, комплементарно подобранные к консервативной области генома указанного возбудителя в районе гена VP2, включающие праймеры по 0,75 пмоль/мл каждый, а также олигонуклеотидный флуоресцирующий зонд, полученный присоединением флуоресцентного красителя и гасителя флуоресценции к противоположным концам олигонуклеотида; генетически-модифицированные ферменты ДНК-полимеразу и обратную транскриптазу по 5 ед/мкл каждого; дезоксинуклеозидтрифосфаты четырех типов по 2,5 мМ каждого; и буферные компоненты. При использовании указанных компонентов предлагаемый диагностический набор способен амплифицировать специфический участок нуклеиновой кислоты возбудителя болезни Гамборо в реакции ПЦР с выходом флуоресцентного сигнала в пределах 25 – 30 циклов ПЦР. Это позволяет определять наличие возбудителей в образцах биологического материала в течение 2х часов.
Использовать изобретение можно с модификациями. Для проведения ПЦР в присутствии внутреннего контрольного образца (ВКО), в комплект реагентов можно добавить синтетическую плазмиду или фаговый вирус, а в комплект реагентов для амплификации - комплементарные ВКО олигонуклеотидные конструкции, одна из которых аналогичным образом модифицирована флуоресцентной меткой. При этом сигнал флуоресценции для специфического фрагмента нуклеиновой кислоты и для фрагмента нуклеиновой кислоты ВКО должны регистрироваться по разным каналам флуоресценции, например, FAM и HEX.
Нижеследующие примеры осуществления способа приведены в целях раскрытия характеристик настоящего изобретения и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения.
Пример 1. Предварительная обработка биологического материала.
Образцы органов и тканей птицы гомогенизируют, затем готовят 10% суспензию на стерильном физиологическом растворе (для приготовления суспензии используют объем образца, соответствующий 100 мкл в микроцентрифужной пробирке и затем доводят его до 1 мл стерильным физраствором). Центрифугируют 1 минуту при 1 000 об\мин. Надосадочную жидкость используют для выделения РНК.
Пример 2. Процедура выделения РНК из образца биологического материала.
1.В промаркированные пробирки на 1,5 мл внести по 450 мкл 1-ого раствора для выделения РНК, содержащего лизирующие клетки компоненты.
2.Пробирки закрыть и тщательно перемешать на микроцентрифуге-вортексе в течение 10 сек.
3.Осадить капли с крышек пробирок центрифугированием в течение 3-5 сек на микроцентрифуге-вортексе.
4.Пробирки инкубировать при 60 ˚С в течение 5 мин. Если в пробирках находятся взвешенные частицы (от исследуемого биологического материала), необходимо отцентрифугировать их при 13 тыс. об/мин в течение 1 мин и перенести надосадочную часть в другую пробирку.
5.Внести в каждую пробирку по 13 мкл внутреннего контрольного образца, пробирки закрыть и тщательно перемешать на вортексе, сбросить капли центрифугированием и инкубировать при 60 ˚С в течение 5 мин.
6.Тщательно ресуспендировать сорбент, в качестве которого можно использовать диатомовую землю, на вортексе и добавить в каждую пробирку отдельным наконечником по 25 мкл ресуспендированного сорбента. Содержимое пробирок перемешать и инкубировать при комнатной температуре в течение 5 мин, периодически перемешивая.
7.Отцентрифугировать пробирки для осаждения сорбента при 10 тыс. об/мин в течение 30 сек на микроцентрифуге и удалить надосадочную жидкость из каждой пробирки отдельным наконечником, используя аспиратор с колбой-ловушкой.
8.Добавить в пробирки по 400 мкл 2-ого раствора для выделения РНК, содержащего лизирующие компаненты в меньшей концентрации. Перемешать на вортексе до полного ресуспендирования сорбента, отцентрифугировать пробирки на микроцентрифуге при 10 тыс. об/мин в течение 30 сек и удалить надосадочную жидкость из каждой пробирки отдельным наконечником, используя аспиратор с колбой-ловушкой.
9.Добавить в пробирки по 500 мкл 3-его раствора для выделения РНК на основе солей и спирта. Перемешать на вортексе до полного ресуспендирования сорбента, отцентрифугировать пробирки на микроцентрифуге при 10 тыс. об/мин в течение 30 сек и удалить надосадочную жидкость из каждой пробирки отдельным наконечником, используя аспиратор с колбой-ловушкой.
10.Повторить п.9.
12.Добавить в пробирки по 400 мкл 4-ого раствора для выделения РНК, содержащего ацетон. Перемешать на вортексе до полного ресуспендирования сорбента, отцентрифугировать пробирки на микроцентрифуге при 10 тыс. об/мин в течение 30 сек и удалить надосадочную жидкость из каждой пробирки отдельным наконечником, используя аспиратор с колбой-ловушкой.
11.Оставить пробирки с открытыми крышками при комнатной температуре на 10 мин. до полного высыхания сорбента.
13. Ресуспендировать сорбент в 200 мкл раствора для элюции с помощью вортекса. Прогреть в термостате при температуре 60°C 5 мин, перемешать на вортексе и осадить сорбент на центрифуге при максимальных оборотах микроцентрифуги (12-14,5 тыс. об/мин) в течение 2 мин. Надосадочная жидкость содержит очищенную РНК.
При постановке реакции амплификации следует не допускать попадания сорбента в реакционную смесь.
Пример 3. Процедура проведения амплификации РНК вируса набором реагентов.
Комплектация набора для амплификации из расчета на 72 реакции для амплификаторов роторного типа
Реакционная смесь, раскапанная по 25 мкл в 72 пробирки на 0,2 мл типа эппендорф.
Отрицательный контрольный образец - ОКО –1 мл.
Положительный контрольный образце - ПКО 200 мкл.
Смесь ферментов – 36 мкл.
Приготовить необходимое число пробирок с реакционной смесью из комплекта и расставить в соответствии с заранее подготовленным протоколом.
Полностью разморозить содержимое пробирок.
При необходимости, если часть раствора находится на внутренней стороне крышки пробирки, отцентрифугировать пробирки 3-5 сек на микроцентрифуге-вортексе.
Добавить во все пробирки наконечником с аэрозольным фильтром по 0,5 мкл раствора ферментов.
Добавить во все пробирки индивидуальными наконечниками с аэрозольными фильтрами по 10 мкл:
в пробирку отрицательного контрольного образца – ОКО;
в пробирки исследуемых образцов – исследуемые образцы РНК;
в пробирку положительного контрольного образца – ПКО.
Для снижения риска контаминации образцы следует добавлять в указанном порядке. Пробирку, в которую был внесен образец, следует по возможности немедленно закрывать крышкой.
Пробирки плотно закрыть и центрифугировать в течение 15 сек на плашечной центрифуге или микроцентрифуге-вортексе.
Перенести пробирки в прибор и провести амплификацию и детекцию согласно инструкции.
Пробирки плотно закрыть и центрифугировать в течение 15 сек на плашечной центрифуге или микроцентрифуге-вортексе.
Создать протокол расположения образцов.
Для работы с комплектом реагентов предлагается используются каналы:
HEX (специфический сигнал)
FAM (сигнал внутреннего контроля)
Детекция продуктов амплификации осуществляется прибором автоматически в каждом цикле амплификации. На основании этих данных управляющая программа строит кривые накопления флуоресцентного сигнала по каждому из заданных для образцов каналов.
Прибор программировали следующим образом:
1 цикл обратной транскрипции при 60 °C в течение 15 минут;
1 цикл инкубирования при 96 °С в течение 2 минут;
40 циклов амплификации: денатурация при 95 °С в течение 15 секунд;
отжиг при 60 °C в течение 25 секунд.
Пример 4. Интерпретация результатов детекции.
Если значение Ct на канале HEX/Yellow менее 35, то специфическая нуклеиновая кислота возбудителя в образце обнаружена.
Если значение Ct на канале HEX/Yellow отсутствует, то специфическая нуклеиновая кислота возбудителя не обнаружена.
Если значение Ct на канале HEX/Yellow более 35, а на канале FAM/Grean значение Ct менее 37, то полученный результат является сомнительным.
Если значение Ct на канале HEX/Yellow более 35 или отсутствует, а на канале FAM/Grean значение Ct более 37 или отсутствует, то полученный результат является невалидным.
Требуется повтор постановки если получен сомнительный результат:
в пробе ПКО по каналам FAM/Green, HEX/Yellow нет значений Ct или Ct больше 30 цикла (недостоверный результат анализа);
в пробе ОКО по каналам FAM/Green, HEX/Yellow, есть значение Ct (недостоверный результат анализа);
для невалидного результата (требуется повтор анализа данного образца с этапа выделения, в случае если использовалось экспресс-выделение, то рекомендуется заменить его на сорбентное).
Получение значений Ct для ОКО и сомнительных результатов исследования может свидетельствовать о наличии внутрилабораторной контаминации. Рекомендуется провести деконтаминационные мероприятия перед проведением повторного ПЦР-исследования образца.
Несмотря на то, что изобретение описано со ссылкой на раскрываемые варианты воплощения, для специалистов в данной области должно быть очевидно, что конкретные подробно описанные случаи приведены лишь в целях иллюстрирования настоящего изобретения, и их не следует рассматривать как каким-либо образом ограничивающие объем изобретения. Должно быть, понятно, что возможно осуществление различных модификаций без отступления от сути настоящего изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| Тест-система для обнаружения ДНК вируса африканской чумы свиней с помощью полимеразной цепной реакции в режиме реального времени | 2017 |
|
RU2645263C1 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации РНК коронавируса человека 2019-nCoV методом ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2020 |
|
RU2734300C1 |
| Способ выявления ДНК хламидий у сельскохозяйственных животных и птиц | 2018 |
|
RU2700381C1 |
| Набор олигонуклеотидных праймеров и зондов для идентификации РНК вируса лихорадки Рифт-Валли методом изотермической ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2023 |
|
RU2813519C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ УРОВНЯ ЭКСПРЕССИИ ХИМЕРНОГО ГЕНА Trim5a | 2015 |
|
RU2592675C1 |
| Набор олигодезоксирибонуклеотидных праймеров и флуоресцентно-меченого зонда для идентификации РНК JMTV методом ПЦР с гибридизационно-флуоресцентной детекцией | 2023 |
|
RU2818960C1 |
| Способ выявления РНК вируса Bandavirus dabieense (SFTSV) методом ОТ-ПЦР в реальном времени | 2024 |
|
RU2831410C1 |
| Способ выявления вируса Nipah методом ОТ-ПЦР в реальном времени | 2022 |
|
RU2816270C2 |
| Набор олигодезоксирибонуклетидных праймеров и флуоресцентно-меченого зонда для идентификации РНК коронавирусов человека SARS и 2019-nCoV методом ОТ-ПЦР с гибридизационно-флуоресцентной детекцией в режиме реального времени | 2020 |
|
RU2733665C1 |
| Набор олигонуклеотидных праймеров для выявления РНК вируса желтой лихорадки методом изотермической амплификации в режиме реального времени | 2024 |
|
RU2824209C1 |
Изобретение относится к биотехнологии. Предложен набор для обнаружения РНК вируса болезни Гамборо, где указанный набор включает олигонуклеотиды, имеющие следующие последовательности: SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3. Изобретение может быть использовано при диагностике болезни Гамборо в научно-исследовательских учреждениях, ветеринарных лабораториях и на предприятиях биологической промышленности. Техническим результатом настоящего изобретения является повышение степени специфичности и чувствительности, а также сокращение времени проведения диагностики при снижении вероятности технологических ошибок во время лабораторных манипуляций за счет удобного формата предложенной тест-системы. 2 н. и 3 з.п. ф-лы, 2 ил., 4 пр.
1. Набор для обнаружения РНК вируса болезни Гамборо, где указанный набор включает олигонуклеотиды, имеющие следующие последовательности: SEQ ID NO:1, SEQ ID NO:2 и SEQ ID NO:3, при этом олигонуклеотид с последовательностью SEQ ID NO:3 содержит флуоресцентный краситель HEX, прикрепленный на его 5’-конце или 3'-конце при помощи ковалентной связи, и содержит гаситель флуоресценции BHQ1, прикрепленный на противоположном от указанного красителя конце указанного олигонуклеотида при помощи ковалентной связи.
2. Набор по п. 1, дополнительно включающий ферменты - ДНК-полимеразу и обратную транскриптазу, а также смесь четырех различных дезоксирибонуклеотидов.
3. Набор по п. 1, в котором ДНК-полимеразой является ДНК-полимераза Taq.
4. Способ диагностики вируса болезни Гамборо у птиц, включающий по меньшей мере следующие стадии:
(а) берут образец биологического материала у птицы, предположительно инфицированной вирусом;
(б) выделяют РНК из указанного образца;
(в) проводят реакцию ПЦР с использованием набора по любому из пп.1-3;
(г) при обнаружении сигнала в указанной реакции ПЦР констатируют присутствие вируса болезни Гамборо в организме указанной птицы.
5. Способ по п. 4, характеризующийся тем, что биологическим материалом является лимфоидная ткань.
| WO 2005071069 A1, 04.08.2005 | |||
| WO 2005049794 A2, 02.06.2005 | |||
| СПОСОБ ПРОФИЛАКТИКИ ИНФЕКЦИОННОЙ БУРСАЛЬНОЙ БОЛЕЗНИ КУР | 2004 |
|
RU2276995C2 |
Авторы
Даты
2019-02-04—Публикация
2018-04-02—Подача