ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к новому семейству ингибиторов протеинкиназ. В частности, настоящее изобретение относится к ингибиторам представителей семейств протеинкиназ Tec и Src, более конкретно к Btk.
УРОВЕНЬ ТЕХНИКИ
Протеинкиназы представляют собой большую группу внутриклеточных и трансмембранных белков, передающих сигналы, в эукариотических клетках. Эти ферменты отвечают за перенос концевого (гамма) фосфата с АТФ на специфические аминокислотные остатки белков-мишеней. Фосфорилирование специфических тирозиновых, сериновых или треониновых аминокислотных остатков в белках-мишенях может модулировать их активность, что приводит к кардинальным изменениям в передаче сигналов в клетках и метаболизме. Протеинкиназы можно обнаружить в клеточных мембранах, цитозоле и органеллах, таких как ядро, и они отвечают за опосредование различных клеточных функций, включая метаболизм, рост и деление клеток, клеточную передачу сигналов, модуляцию иммунного ответа и апоптоз. Рецепторные тирозинкиназы представляют собой большое семейство рецепторов на поверхности клеток с протеин-тирозинкиназной активностью, которые отвечают на внеклеточные сигналы и активируют внутриклеточные каскады передачи сигналов (Plowman et al. (1994) DN&P, 7(6): 334-339).
Аберрантная активация или чрезмерная экспрессия различных протеинкиназ вовлечены в механизмы различных заболеваний и нарушений, которые характеризуются доброкачественной и злокачественной пролиферацией, избыточным ангиогенезом, а также заболеваний, которые развиваются вследствие ненадлежащей активации иммунной системы. Таким образом, полагают, что ингибиторы селективных киназ или семейств киназ являются пригодными для лечения рака, аутоиммунных заболеваний и воспалительных состояний, включая, но не ограничиваясь только ими: солидные опухоли, гематологические злокачественные опухоли, артрит, реакцию «трансплантат против хозяина», красную волчанку, псориаз, колит, илеит, рассеянный склероз, увеит, васкулопатию коронарной артерии, системный склероз, атеросклероз, астму, отторжение трансплантата, аллергию, дерматомиозит, пузырчатку и другие.
Примеры киназ, которые могут быть нацелены на модулирование заболеваний, включают рецепторные тирозинкиназы, такие как представители семейства рецептора фактора роста тромбоцитов (PDGFR), семейства рецептора сосудистого эндотелиального роста (VEGFR) и внеклеточные белки, такие как представители семейств Syk, SRC, и Тес киназ.
Tec-киназы представляют собой главным образом нерецепторные тирозинкиназы, но не исключительно, экспрессируемые на клетках гемопоэтического происхождения (Bradshaw JM. Cell Signal. 2010, 22: 1175-84). Tec-семейство включает Тес, тирозинкиназу Bruton (Btk), индуцируемую киназу T-клеток (Itk), киназу покоящихся лимфоцитов (Rlk/Txk), и киназу, экспрессируемую костным мозгом (Bmx/Etk). Btk представляет собой киназу семейства Tec, которая является важной для передачи сигналов рецептором B-клеток. Btk активируется киназами семейства Src и фосфорилирует PLC гамма, что оказывает влияние на функционирование и выживание B-клеток. Дополнительно, Btk является важной для передачи сигналов в ответ на распознавание иммунного комплекса макрофагами, тучными клетками и нейтрофилами. Ингибирование Btk также важно для выживания лимфомных клеток (Herman, SEM. Blood 2011, 117: 6287-6289), свидетельствуя о том, что ингибирование Btk может быть пригодным для лечения лимфом. Таким образом, ингибиторы Btk и связанных с ней киназ представляют большой интерес в качестве противовоспалительных, а также противораковых агентов.
cSRC является прототипичным представителем семейства SRC тирозинкиназ, который включает Lyn, Fyn, Lck, Hck, Fgr, Blk, Syk, Yrk, и Yes. cSRC критически вовлечена в пути передачи сигналов, вовлеченных в злокачественное новообразование, и часто сверхэкспрессируется при злокачественных опухолях у людей (Kim LC, Song L, Haura EB. Nat Rev Clin Oncol. 2009 6(10): 587-9). Роль cSRC при клеточной адгезии, миграции и ремоделировании костного мозга существенно вовлекает эту киназу в развитие и прогрессирование метастаз в костном мозге. cSRC также задействована в передаче нижерасположенных сигналов тирозинкиназам рецепторов факторов роста и регулирует прохождение клеточного цикла, свидетельствуя о том, что ингибирование cSRC будет оказывать влияние на пролиферацию злокачественных клеток. Дополнительно, ингибирование представителей семейства SRC может быть пригодным для лечений, связанных с модулированием иммунных функций. Представители SRC семейства, включая Lck, регулируют передачу сигналов рецепторам Т-клеток, что приводит к регуляции генов, обуславливающих высвобождение цитокинов, выживание и пролиферацию. Таким образом, ингибиторы Lck очень востребованы в качестве иммунодепрессивных агентов с потенциальным применением при отторжении трансплантатов и аутоиммунном заболевании, опосредованном Т-клетками (Martin et al. Expert Opin Ther Pat. 2010, 20: 1573-93).
Ингибирование киназ с использованием низкомолекулярных ингибиторов эффективно приводит к некоторым улучшениям терапевтических средств, используемых для лечения состояний у людей. В настоящей заявке нами было раскрыто новое семейство ингибиторов киназ. Кроме того, нами было продемонстрировано, что модификации в замещении соединения могут оказывать влияния на селективность киназ и, следовательно, на биологическую функцию агента.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новому семейству ингибиторов киназ. Было обнаружено, что соединения этого класса обладают ингибирующей активностью по отношению к представителям семейств Tec- и Src-протеинкиназ, в частности к Btk.
Один аспект настоящего изобретения относится к соединению формулы 1:
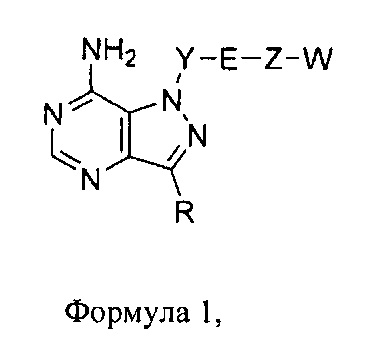
где
R выбирают из группы, состоящей из:
1) водорода,
2) алкила,
3) гетероалкила,
4) карбоциклила,
5) гетероциклила;
где алкил, гетероалкил, карбоциклил и гетероциклил могут быть дополнительно замещены.
Y представляет собой:
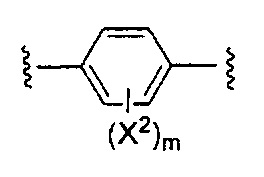 ,
,
E выбирают из кислорода,
Z выбирают из:
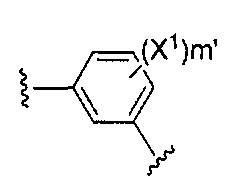 ,
,
где Y-E-Z-W представляет собой:
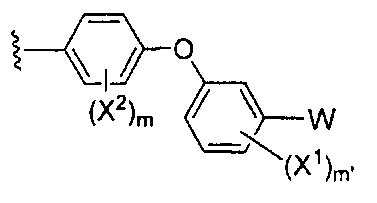
X1 и X2 независимо выбирают из водорода и галогена;
n представляет собой целое число от 0 до 2;
m представляет собой целое число от 0 до 2;
m' представляет собой целое число от 0 до 2;
W независимо выбирают из:
1) алкила,
2) аралкила,
3) гетероаралкила,
4) -OR3,
5) -OC(O)R4,
6) -OC(O)NR5R6,
7) -CH2O-R4,
8) -NR5R6,
9) -NR2C(O)R4,
10) -NR2S(O)nR4,
11) -NR2C(O)NR5R6;
где алкил, аралкил и гетероаралкил могут быть дополнительно замещены;
R2 выбирают из водорода или алкила;
R3 выбирают из замещенного или незамещенного алкила, алкенила, алкинила, гетероалкила, карбоциклила, гетероциклила, арила, гетероарила, аралкила или гетероаралкила;
R4 выбирают из замещенного или незамещенного алкила, алкенила, алкинила, гетероалкила, карбоциклила, гетероциклила, арила или гетероарила; и
R5 и R6 независимо выбирают из водорода, алкила, алкенила, алкинила, гетероалкила, карбоциклила, гетероциклила, арила, гетероарила или R5 и R6 могут быть конденсированы, образуя 3- - 8-членную гетероциклильную кольцевую систему.
Предпочтительные варианты реализации включают соединения формулы 1, в которых W выбирают из -OR3, и R3 выбирают из замещенного или незамещенного аралкила или замещенного или незамещенного гетероаралкила.
Более предпочтительные варианты реализации включают соединения формулы 1, в которых W выбирают из группы, состоящей из:
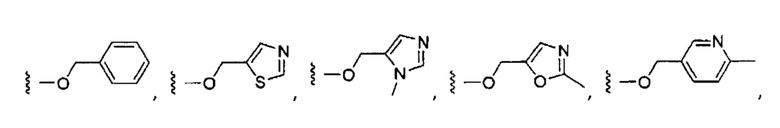
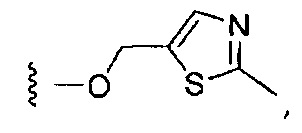 или
или 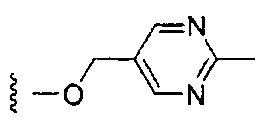 .
.
Еще более предпочтительные варианты реализации включают соединения формулы 1, в которых Y выбирают из группы, состоящей из:
 , или
, или 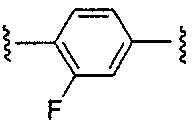 .
.
Предпочтительные варианты реализации включают соединения формулы 1, в которых Z выбирают из группы, состоящей из:
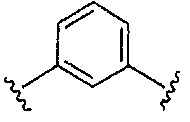 , или
, или 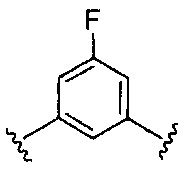 .
.
Предпочтительный вариант реализации включает соединения формулы 1, в которых R выбирают из группы, состоящей из:
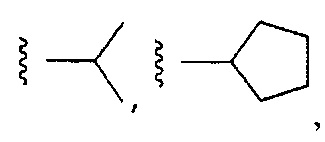 или
или 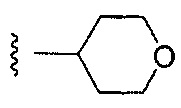 .
.
Более предпочтительные варианты реализации включают соединения формулы 1, в которых W выбирают из группы, состоящей из:
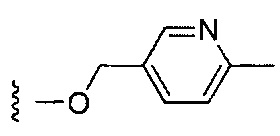 ,
, 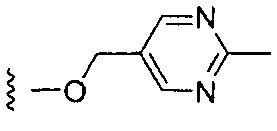 или
или 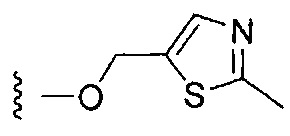 .
.
Более предпочтительные варианты реализации включают соединения формулы 1, где Z выбирают из группы, состоящей из:
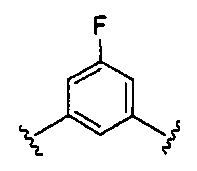 .
.
В другом аспекте настоящего изобретения представлена фармацевтическая композиция, которая содержит эффективное количество соединения формулы 1 и фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество.
В другом аспекте настоящего изобретения представлено применение соединения формулы 1 в качестве ингибитора протеинкиназы, в частности, в качестве ингибитора Btk.
В другом аспекте настоящего изобретения представлен способ модулирования функции киназы, который включает контактирование клетки с соединением по настоящему изобретению в количестве, достаточном для модулирования ферментативной активности данной киназы или киназ, такой как Btk, модулируя, таким образом, функцию киназы.
В другом аспекте настоящего изобретения представлен способ модулирования функции целевой киназы, который включает a) контактирование клетки с соединением по настоящему изобретению в количестве, достаточном для модулирования функции целевой киназы, таким образом b) модулирование активности целевой киназы и передачи сигналов.
Другой аспект настоящего изобретения обеспечивает зонд, содержащий соединение формулы 1, меченное обнаруживаемой меткой или аффинным маркером. Другими словами, зонд содержит остаток соединения формулы 1, ковалентно конъюгированный с обнаруживаемой меткой. Такие обнаруживаемые метки включают, но не ограничиваются ими, флуоресцентный компонент, хемилюминесцентный компонент, парамагнитный контрастный агент, хелатный комплекс металла, компонент, содержащий радиоактивный изотоп, или биотин.
ПОДРОБНОЕ ОПИСАНИЕ ПРЕДПОЧТИТЕЛЬНЫХ ВАРИАНТОВ РЕАЛИЗАЦИИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к новым ингибиторам киназы. Было обнаружено, что эти соединения обладают активностью ингибиторов протеинкиназ: включая представителей семейств тирозинкиназ Aurora, киназ SRC (более конкретно Lck) и Tec (более конкретно Btk).
Соединения согласно настоящему изобретению могут быть приготовлены в виде фармацевтической композиции, которая содержит эффективное количество соединения формулы 1 с фармацевтически приемлемым разбавителем или носителем. Например, фармацевтические композиции могут быть представлены в общепринятой фармацевтической форме, подходящей для перорального введения (например, таблетки, капсулы, гранулы, порошки и сиропы), парентерального введения (например, инъекции (внутривенные, внутримышечные или подкожные)), препаратов для капельного вливания, ингаляций, глазных примочек, местного введения (например, мазь) или суппозиториев. Независимо от выбранного пути введения, соединения могут быть приготовлены в виде фармацевтически приемлемых лекарственных форм с помощью общепринятых способов, хорошо известных специалисту в данной области техники.
Определение «фармацевтически приемлемый» применяется в настоящей заявке для обозначения тех лигандов, материалов, композиций, и/или лекарственных форм, которые, с медицинской точки зрения, приемлемы для применения при контактировании с тканями человека и животных без чрезмерной токсичности, раздражения, аллергических реакций или других проблем или осложнений, соразмерных с обоснованным соотношением польза/риск.
Определение «фармацевтически приемлемый носитель», в контексте настоящей заявки, обозначает фармацевтически приемлемый материал, композицию, или основу, такую как жидкий или твердый наполнитель, разбавитель, вспомогательное вещество, растворитель или инкапсулирующий материал. Каждый носитель должен быть приемлемым в смысле совместимости с другими компонентами препарата, включая активный компонент, и не наносить вред или не быть опасным для пациента. Некоторые примеры материалов, которые могут служить в качестве фармацевтически приемлемых носителей, включают: (1) сахара, такие как лактоза, глюкоза и сахароза; (2) крахмалы, такие как кукурузный крахмал, картофельный крахмал и замещенный или незамещенный β-циклодекстрин; (3) целлюлозу и ее производные, такие как натрий карбоксиметилцеллюлоза, этилцеллюлоза и ацетилцеллюлоза; (4) порошкообразный трагакант; (5) солод; (6) желатин; (7) тальк; (8) вспомогательные вещества, такие как масло какао и воски суппозиториев; (9) масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; (10) гликоли, такие как пропиленгликоль; (11) многоатомные спирты, такие как глицерин, сорбит, маннит и полиэтиленгликоль; (12) сложные эфиры, такие как этилолеат и этиллаурат; (13) агар; (14) буферные вещества, такие как гидроксид магния и гидроксид алюминия; (15) альгиновую кислоту; (16) апирогенную воду; (17) изотонический солевой раствор; (18) раствор Рингера; (19) этиловый спирт; (20) фосфатные буферные растворы; и (21) другие нетоксичные совместимые вещества, применяемые в лекарственных препаратах.
Термин «фармацевтически приемлемая соль» относится к относительно нетоксичным солям присоединения неорганической и органической кислоты соединения(-ий). Эти соли могут быть приготовлены in situ в процессе конечного выделения и очистки соединения(-ий) или путем раздельного взаимодействия очищенного(-ых) соединения(-ий) в форме его свободного основания с подходящей органической или неорганической кислотой, и выделения таким образом образованной соли. Типичные соли включают такие соли, как гидробромид, гидрохлорид, сульфат, бисульфат, фосфат, нитрат, ацетат, валерат, олеат, пальмитат, стеарат, лаурат, бензоат, лактат, фосфат, тозилат, цитрат, малеат, фумарат, сукцинат, тартрат, нафтилат, мезилат, глюкогептонат, лактобионат, лаурилсульфонат и соли аминокислот, и другие (См., например, Berge и др. (1977) "Pharmaceutical Salts", J. Pharm. Sci. 66: 1-19).
В других случаях соединения согласно настоящему изобретению могут содержать одну или несколько кислотных функциональных групп и, следовательно, способны образовывать фармацевтически приемлемые соли с фармацевтически приемлемыми основаниями. Термин «фармацевтически приемлемые соли» в этих случаях относится к относительно нетоксичным солям присоединения неорганических и органических оснований соединения(-ий). Эти соли также могут быть приготовлены in situ в процессе конечного выделения и очистки соединения(-ий) или путем раздельного взаимодействия очищенного соединения(-ий) в его свободной форме с подходящим основанием, таким как гидроксид, карбонат или бикарбонат фармацевтически приемлемого катиона металла, с аммиаком или с фармацевтически приемлемым органическим первичным, вторичным, или третичным амином. Типичные щелочные или щелочноземельные соли включают соли лития, натрия, калия, кальция, магния и алюминия, и другие. Типичные органические амины, пригодные для образования солей присоединения оснований, включают этиламин, диэтиламин, этилендиамин, этаноламин, диэтаноламин, пиперазин и другие (см., например, Berge et al., выше).
В контексте данной заявки термин «аффинный маркер» обозначает лиганд или группу, связанную либо с соединением согласно настоящему изобретению, либо с доменом протеинкиназы, который предоставляет возможность экстрагировать конъюгат из раствора.
Термин «алкил» относится к замещенным или незамещенным насыщенным углеводородным группам, включая неразветвленные алкильные и разветвленные алкильные группы, включая галоалкильные группы, такие как трифторметил и 2,2,2-трифторэтил, и др. Характерные алкильные группы включают метил, этил, н-пропил, изопропил, н-бутил, трет-бутил, изобутил, втор-бутил, (циклогексил)метил, циклопропилметил, н-пентил, н-гексил, н-гептил, н-октил и другие. Термины «алкенил» и «алкинил» относятся к замещенным или незамещенным ненасыщенным алифатическим группам, аналогичным по длине и возможному замещению алкилам, описанным выше, но которые содержат по меньшей мере одну двойную или тройную связь соответственно. Характерные алкенильные группы включают винил, пропен-2-ил, кротил, изопентен-2-ил, 1,3-бутадиен-2-ил, 2,4-пентадиенил и 1,4-пентадиен-3-ил. Характерные алкинильные группы включают этинил, 1- и 3-пропинил и 3-бутинил. В определенных предпочтительных вариантах реализации алкильные заместители представляют собой низшие алкильные группы, например те, которые имеют от 1 до 6 атомов углерода. Аналогичным образом, алкенил и алкинил предпочтительно относятся к низшим алкенильным и алкинильным группам, например тем, которые имеют от 2 до 6 атомов углерода. В контексте настоящей заявки, термин «алкилен» относится к алкильной группе с двумя открытыми валентностями (а не одной валентностью), такой как -(CH2))1-10- и ее замещенным вариантам.
Термин «алкокси» относится к алкильной группе, которая имеет присоединенный к ней кислород. Характерные алкокси группы включают метокси, этокси, пропокси, трет-бутокси и другие. «Простой эфир» представляет собой два углеводорода, ковалентно связанные кислородом. Соответственно, заместитель алкила, который превращает этот алкил в простой эфир, представляет собой или имеет сходство с алкокси.
Термин «алкоксиалкил» относится к алкильной группе, замещенной с помощью алкокси группы, с образованием таким образом простого эфира.
Термины «амид» и «амидо» относятся к известному в данной области амино-замещенному карбонилу и включают компонент, который может быть представлен общей формулой:
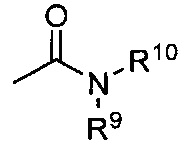 ,
,
где R9, R10 имеют значения, как указано выше. Предпочтительные варианты реализации амида не будут включать имиды, которые могут быть нестабильными.
Термины «амин» и «амино» известны в данной области и относятся как к незамещенным, так и к замещенным аминам и их солям, например, компоненту, который может быть представлен общими формулами:
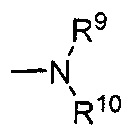 или
или 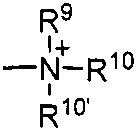 ,
,
где R9, R10 и R10' каждый независимо представляет собой водород, алкил, алкенил, -(CH2)p-R8 или R9 и R10 вместе с атомом N, к которому они присоединены, образуют гетероцикл, который имеет от 4 до 8 атомов в кольцевой структуре; R8 представляет собой арил, циклоалкил, циклоалкенил, гетероциклил или полициклил; и p представляет собой ноль или целое число от 1 до 8. В предпочтительных вариантах реализации только один из R9 или R10 может представлять собой карбонил, например, R9, R10, и азот вместе не образуют имид. В еще более предпочтительных вариантах реализации R9 и R10 (и необязательно R10') каждый независимо представляет собой водород, алкил, алкенил или -(CH2)p-R8. В определенных вариантах реализации аминогруппа является щелочной, обозначая протонированную форму, которая имеет pKa≥7,00.
Термин «аралкил», в контексте настоящей заявки, относится к алкильной группе, замещенной арильной группой, например, -(CH2)p-Ar.
Термин «гетероаралкил», в контексте настоящей заявки, относится к алкильной группе, замещенной гетероарильной группой, например, -(CH2)p-Het.
Термин «арил», в контексте настоящей заявки, включает 5-, 6-, и 7-членные замещенные или незамещенные однокольцевые ароматические группы, в которых каждый атом в кольце представляет собой углерод. Термин «арил» также включает полициклические кольцевые системы, которые имеют два или более циклических колец, в которых два или более углеродов являются общими для двух смежных колец, где по меньшей мере одно из колец является ароматическим, например, другие циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Арильные группы включают бензол, нафталин, фенантрен, фенол, анилин, антрацен, и фенантрен.
Термины «карбоцикл» и «карбоциклил», в контексте настоящей заявки, относятся к неароматическому замещенному или незамещенному кольцу, в котором каждый атом кольца представляет собой углерод. Термины «карбоцикл» и «карбоциклил» также включают полициклические кольцевые системы, имеющие два или более циклических колец, в которых два или более углеродов являются общими для двух смежных колец по меньшей мере одно из которых является карбоциклическим, например, другие циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Характерные карбоциклические группы включают циклопентил, циклогексил, 1-циклогексенил и 3-циклогексен-1-ил, циклогептил.
Термин «карбонил» известен в данной области и включает такие компоненты, которые могут быть представлены общей формулой:
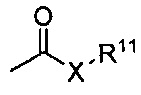 ,
,
где X представляет собой связь или представляет собой кислород, или серу, и R11 представляет собой водород, алкил, алкенил, -(CH2)p-R8 или фармацевтически приемлемую соль. Где X представляет собой кислород и R11 не представляет собой водород, формула представляет собой «сложный эфир». Где X представляет собой кислород, и R11 представляет собой водород, формула представляет собой «карбоновую кислоту».
Термин «гетероарил» включает замещенные или незамещенные ароматические 5-7-членные кольцевые структуры, более предпочтительно 5-6-членные кольца, кольцевые структуры которых включают один-четыре гетероатома. Термин «гетероарил» также включает полициклические кольцевые системы, имеющие два или более циклических колец в которых два или более углеродов являются общими для двух смежных колец по меньшей мере одно из которых является гетероароматическим, например, другие циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Гетероарильные группы включают, например, пиррол, фуран, тиофен, имидазол, изоксазол, оксазол, тиазол, триазол, пиразол, пиридин, пиразин, пиридазин и пиримидин и другие.
Термин «гетероатом», в контексте настоящей заявки, обозначает атом любого элемента, отличающегося от углерода или водорода. Предпочтительными гетероатомами являются азот, кислород и сера.
Термины «гетероциклил» или «гетероциклическая группа» относятся к замещенным или незамещенным неароматическим 3-10-членным кольцевым структурам, более предпочтительно 3-х-7-ми-членным кольцам, кольцевые структуры которых включают от одного до четырех гетероатомов. Термины «гетероциклил» или «гетероциклическая группа» также включают полициклические кольцевые системы, имеющие два или более циклических колец, в которых два или более углеродов являются общими для двух смежных колец, где по меньшей мере одно из колец является гетероциклическим, например, другие циклические кольца могут представлять собой циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы. Гетероциклильные группы включают, например, тетрагидрофуран, тетрагидропиран, пиперидин, пиперазин, пирролидин, морфолин, лактоны и лактамы.
Термин «углеводород», в контексте настоящей заявки, относится к группе, которая связана с помощью атома углерода, которая не имеет =O или =S заместителя и типично имеет по меньшей мере одну углерод-водородную связь и главным образом углеродный каркас, но необязательно может включать гетероатомы. Таким образом, группы, такие как метил, этоксиэтил, 2-пиридил и трифторметил, рассматриваются как гидрокарбил для целей настоящей заявки, но заместители, такие как ацетил (который имеет =O заместитель на связывающем углероде) и этокси (который связан с помощью кислорода, а не углерода) не рассматриваются как такие. Гидрокарбильные группы включают, но не ограничиваются только ими, арил, гетероарил, карбоцикл, гетероцикл, алкил, алкенил, алкинил и их комбинации.
Термины «полициклил» или «полициклический» относятся к двум или более кольцам (например, циклоалкилы, циклоалкенилы, циклоалкинилы, арилы, гетероарилы и/или гетероциклилы), в которых два или более углеродов являются общими для двух смежных колец, например, кольца представляют собой «сопряженные кольца». Каждое из колец полицикла может быть замещено или незамещено.
В контексте настоящей заявки, термин «зонд» обозначает соединение согласно изобретению, которое мечено либо с помощью обнаруживаемой метки, либо аффинного маркера, и которое способно связываться ковалентно или нековалентно с доменом протеинкиназы. Если, например, зонд нековалентно связан, то он может быть вытеснен тестируемым соединением. Если, например, зонд ковалентно связан, то его можно использовать для образования перекрестно-связанных аддуктов, которые можно количественно определять и ингибировать с помощью тестируемого соединения.
Термин «замещенный» относится к компонентам, которые имеют заместители, заменяющие водород на одном или более углеродах каркаса. Подразумевается, что «замещение» или «замещенный с помощью» включает условие, что такое замещение находится в соответствии с допустимой валентностью замещенного атома и заместителя, и что такое замещение приводит к стабильному соединению, например, которое не подвергается спонтанной трансформации, такой как перегруппировка, циклизация, элиминация и др. В контексте настоящей заявки, термин «замещенный» охватывает все допустимые заместители органических соединений. В широком смысле, допустимые заместители включают ациклические и циклические, разветвленные и неразветвленные, карбоциклические и гетероциклические, ароматические и неароматические заместители органических соединений. Допустимых заместителей может быть несколько или один, и они могут быть одинаковыми или разными для соответствующих органических соединений. Для целей настоящего изобретения, гетероатомы, такие как азот, могут иметь водородные заместители и/или любые допустимые заместители органических соединений, описанные в настоящей заявке, которые удовлетворяют валентностям гетероатомов. Заместители могут включать, например, галоген, гидроксил, карбонил (такой как карбоксил, алкоксикарбонил, формил или ацил), тиокарбонил (такой как сложный тиоэфир, тиоацетат или тиоформиат), алкоксил, фосфорил, фосфат, фосфонат, фосфинат, амино, амидо, амидин, имин, циано, нитро, азидо, сульфгидрил, алкилтио, сульфат, сульфонат, сульфамоил, сульфонамидо, сульфонил, гетероциклил, аралкил или ароматический или гетероароматический компонент. Для квалифицированного специалиста в данной области техники будет понятным, что компоненты, замещенные на углеводородной цепи, сами могут быть замещены, если это допустимо.
Соединения согласно изобретению также включают все изотопы атомов, присутствующих в промежуточных и/или конечных соединениях. Изотопы включают те атомы, которые имеют идентичное атомное число, но различные массовые числа. Например, изотопы водорода включают дейтерий и тритий.
Общие способы синтеза
В следующем разделе описаны общие способ(ы) синтеза, которые могут быть пригодны в получении соединений согласно настоящему изобретению.
Общий способ синтеза A:
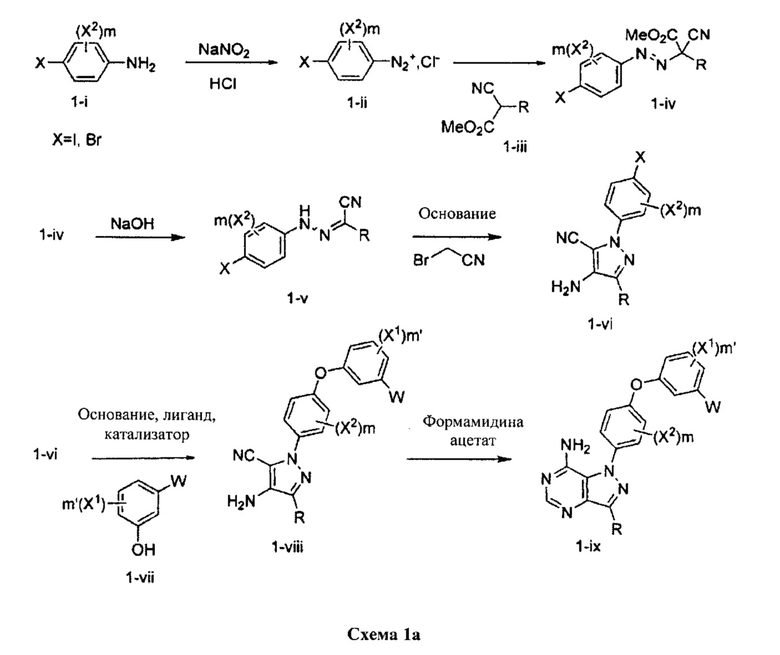
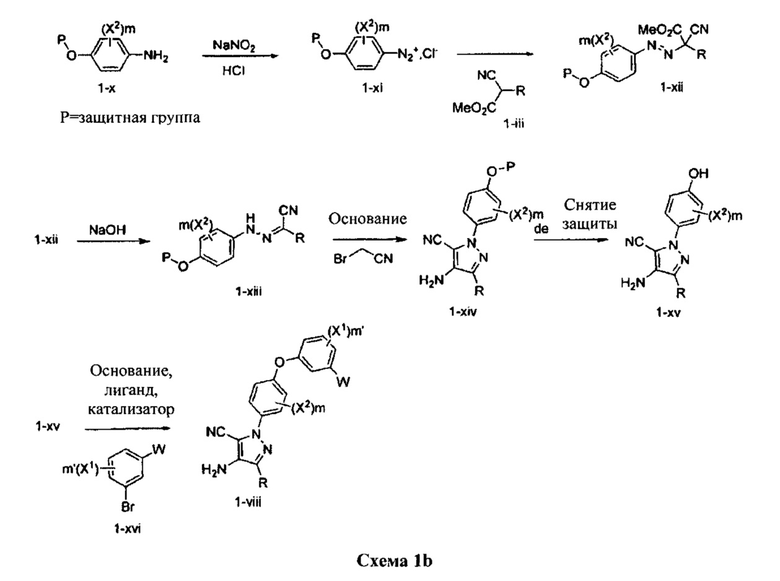
Общий способ синтеза B:
Примеры
Последующие способы синтеза предназначены для представления химии, используемой для приготовления соединений формулы 1, и не являются ограничивающими.
Синтез промежуточного соединения 2-c:
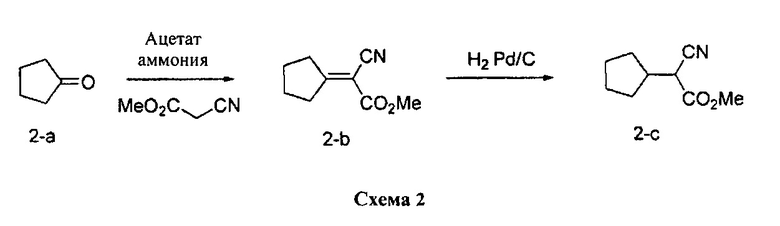
Стадия 1: Промежуточное соединение 2-b
К раствору циклопентанона (12,73 г, 151,0 ммоль) в безводном бензоле (15,2 мл) добавляли метил-2-цианоацетат (15,0 г, 151,0 ммоль), ацетат аммония (1,52 г, 19,68 ммоль) и уксусную кислоту (3,04 мл). Реакционную смесь нагревали в аппарате Дина-Старка с обратным холодильником в течение 12 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли в вакууме. К остатку добавляли воду и этилацетат, органический слой отделяли, промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 2-b в виде коричневого масла.
Стадия 2: Промежуточное соединение 2-c
К раствору промежуточного соединения 2-b (25,0 г, 151,0 ммоль) в метаноле при перемешивании в атмосфере азота добавляли 10% Pd/C (3,22 г, 1,51 ммоль). Реакционную смесь продували H2, перемешивали в течение ночи при давлении 1 атм водорода и фильтровали через целит. Фильтрат концентрировали в вакууме с получением промежуточного соединения 2-c в виде желтого масла.
Синтез промежуточного соединения 3-d:
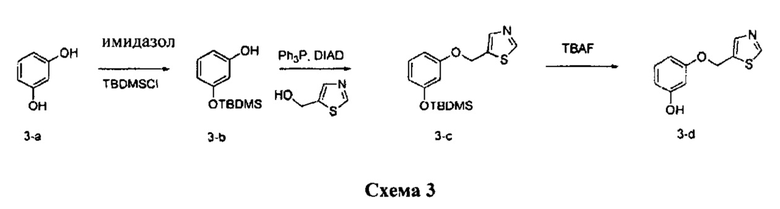
Стадия 1: Промежуточное соединение 3-b
К раствору резорцина (11,83 г, 107 ммоль) в ДМФА (50 мл), охлажденному до 0°C, добавляли имидазол (15,36 г, 226 ммоль) и трет-бутилхлордиметилсилан (17,0 г, 113 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат; органический слой отделяли, промывали 3 раза насыщенным водным раствором хлорида аммония и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает соединение промежуточное 3-b в виде бесцветного масла.
Стадия 2: Промежуточное соединение 3-е
К раствору промежуточного соединения 3-b (1,94 г, 8,68 ммоль) и тиазол-5-илметанола (1,0 г, 8,68 ммоль) в ТГФ (20 мл) последовательно добавляли трифенилфосфин (3,42 г, 13,0 ммоль) и DIAD (2,52 мл, 13,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 3-c в виде желтого масла.
Стадия 3: Промежуточное соединение 3-d
К раствору промежуточного соединения 3-c (1,6 г, 4,98 ммоль) в ТГФ (20 мл) добавляли 1,0 М раствор TBAF в ТГФ (5,47 мл, 5,47 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. К остатку добавляли диэтиловый эфир; образовавшийся осадок собирали путем фильтрации с получением промежуточного соединения 3-d в виде твердого вещества белого цвета.
Синтез промежуточного соединения 4-d:
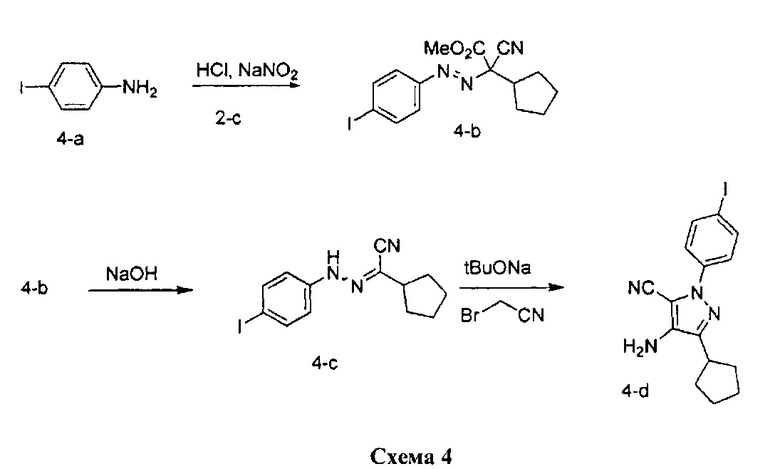
Стадия 1: Промежуточное соединение 4-b
К раствору 4-иоданилина (13,14 г, 60,0 ммоль) в 1 н. HCl (150 мл) добавляли по каплям 1,0 М водный раствор нитрита натрия (60,0 мл, 60,0 ммоль) при комнатной температуре, смесь перемешивали в течение 1 часа и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 2-c (5,0 г, 29,9 ммоль) в этаноле (41,7 мл) и воде (556 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата натрия. Смесь перемешивали при 0°C в течение 3 часов и затем при комнатной температуре до готовности. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 4-b в виде бежевого масла.
Стадия 2: Промежуточное соединение 4-c
К раствору промежуточного соединения 4-b (7,0 г, 17,6 ммоль) в ТГФ (176 мл), охлажденному до 0°C, добавляли 10 н. водный раствор NaOH (44,1 мл, 441,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали 10% лимонной кислотой, насыщенным водным раствором NaHCO3 и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 4-c в виде твердого вещества желтого цвета.
Стадия 3: Промежуточное соединение 4-d
К раствору промежуточного соединения 4-c (2,1 г, 6,19 ммоль) и бромацетонитрила (474 мкл, 6,81 ммоль) в трет-бутаноле (31,0 мл) добавляли 1,0 М раствор трет-бутилата натрия в трет-бутаноле (6,19 мл, 6,19 ммоль). Реакционную смесь затем перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 4-d в виде твердого вещества желтого цвета.
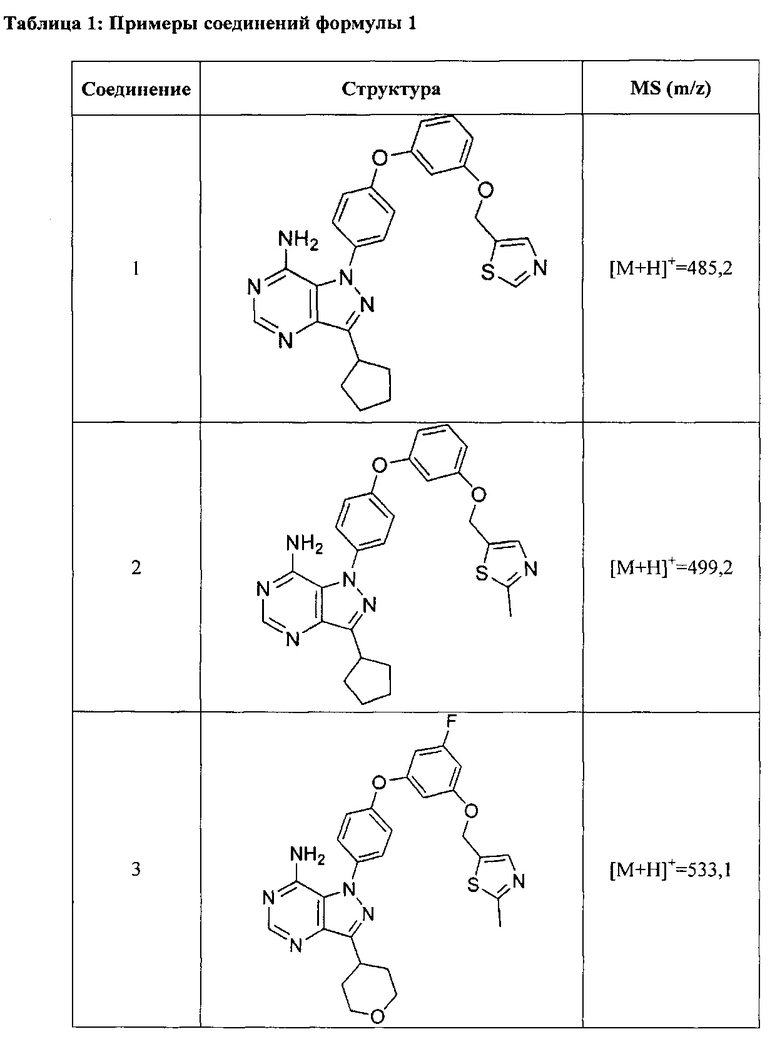
Синтез соединения 1:
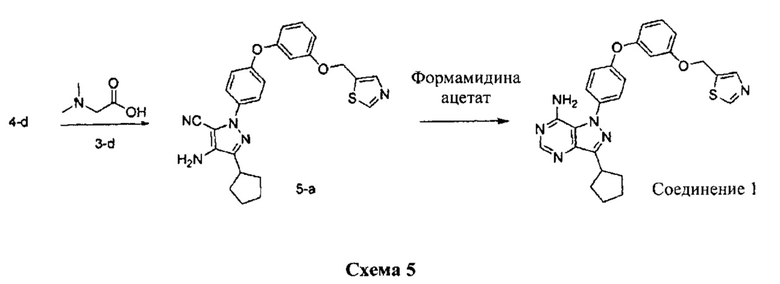
Стадия 1: Промежуточное соединение 2-I
К раствору промежуточного соединения 3-d (125 мг, 0,60 ммоль) и промежуточного соединения 4-d (200 мг, 0,60 ммоль) в 1,4-диоксане последовательно добавляли N,N-диметилглицин (37 мг, 0,36 ммоль), карбонат цезия (393 мг, 1,20 ммоль) и йодид меди (I) (23 мг, 0,12 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Добавляли воду и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 5-а в виде твердого вещества коричневого цвета.
Стадия 11: Соединение 1
К раствору промежуточного соединения 5-а (150 мг, 0,32 ммоль) в EtOH (3,0 мл) добавляли формамидина ацетат (265 мг, 2,54 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов, затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 1⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=485,2.
Синтез промежуточного соединения 6-c:
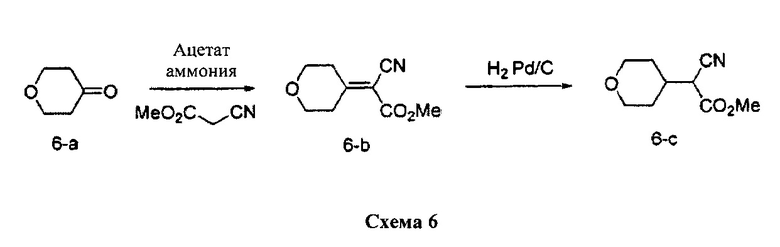
Стадия 1: Промежуточное соединение 6-b
К раствору промежуточного соединения 6-а (5,05 г, 50,5 ммоль) в безводном бензоле (5,0 мл) добавляли метил-2-цианоацетат (5,0 г, 50,5 ммоль), ацетат аммония (506 мг, 6,56 ммоль) и уксусную кислоту (1,0 мл). Реакционную смесь нагревали в аппарате Дина-Старка с обратным холодильником в течение 12 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли в вакууме. К остатку добавляли воду и этилацетат, органический слой отделяли, промывали водой, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 6-b в виде коричневого масла.
Стадия 2: Промежуточное соединение 6-с
К раствору промежуточного соединения 6-b (9,0 г, 49,7 ммоль) в метаноле в атмосфере азота добавляли 10% Pd/C (1,06 г, 0,49 ммоль). Реакционную смесь продували H2 и перемешивали в течение ночи при давлении 1 атм водорода. Затем реакционную смесь фильтровали через целит и фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 6-с в виде желтого масла.
Синтез промежуточного соединения 7-d:
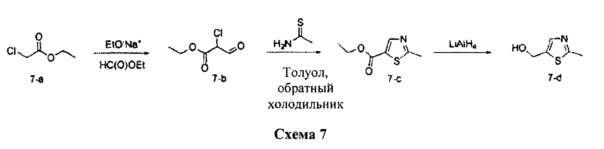
Стадия 1: Промежуточное соединение 7-b
Этилхлорацетат (50,0 г, 0,41 моль) и этилформиат (30,2 г, 0,41 моль) растворяли в безводном толуоле (500 мл) и охлаждали до 0°C. Порциями добавляли этилат натрия (35,1 г, 0,49 моль). Реакционную смесь перемешивали при 0°C в течение 5 часов и затем при комнатной температуре в течение ночи. Реакционную смесь гасили водой (250 мл) и промывали дважды простым диэтиловым эфиром. Водный слой охлаждали до 0°C и подкисляли до pH 4-5, используя 1 н. водный раствор HCl. Водный слой экстрагировали дважды простым диэтиловым эфиром; и объединенные органические слои высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 7-b в виде бежевого масла.
Стадия 2: Промежуточное соединение 7-с
К раствору этил-2-хлор-3-оксопропаноата, 7-b (34,7 г, 230 ммоль) в толуоле (250 мл) добавляли тиоацетамид (26,0 г, 346,0 ммоль). Реакционную смесь перемешивали при 90°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли водой (300 мл) и затем нейтрализовали до pH 7 с помощью насыщенного водного раствора NaHCO3. Добавляли этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 7-с в виде бежевого масла.
Стадия 3: Промежуточное соединение 7-d
К раствору промежуточного соединения 7-с (22,2 г, 130,0 ммоль) в ТГФ (430 мл), охлажденному до 0°C, добавляли 1,0 М раствор LiAlH4 в ТГФ (91,0 мл, 91,0 ммоль). Раствор медленно нагревали до комнатной температуры и перемешивали в течение 2 часов. Медленно добавляли воду (3,5 мл), после этого 3,5 мл 15% NaOH (3,5 мл) и воду (10,5 мл), и смесь перемешивали в течение 1 часа. Реакционную смесь фильтровали через целит и собирали фильтрат. Летучие компоненты удаляли в вакууме с получением промежуточного соединения 7-d в виде желтого масла.
Синтез промежуточного соединения 8-e:
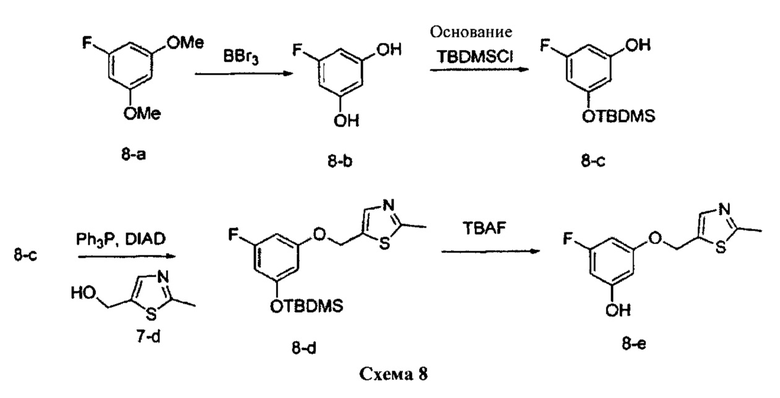
Стадия 1: Промежуточное соединение 8-b
К раствору 1-фтор-3,5-диметоксибензола (12,5 г, 80 ммоль) в дихлорметане (80 мл), охлажденному до 0°C, добавляли по каплям 1,0 М раствор трибромида бора BBr3 в дихлорметане (200 мл, 200 ммоль) в течение 30 минут. Реакционную смесь перемешивали в течение 1 часа при 0°C и затем медленно нагревали до комнатной температуры и перемешивали в течение 18 часов. Реакцию охлаждали до 0°C и гасили путем медленного добавления МеОН и воды. После перемешивания при комнатной температуре в течение 1 часа смесь фильтровали и летучие компоненты удаляли в вакууме. Твердое вещество дважды промывали этилацетатом; фильтрат концентрировали в вакууме с получением промежуточного соединения 8-b в виде твердого вещества оранжевого цвета.
Стадия 2: Промежуточное соединение 8-с
К раствору промежуточного соединения 8-b (10,25 г, 80,0 ммоль) в ДМФА (50 мл), охлажденному до 0°C, добавляли имидазол (5,99 г, 88,0 ммоль) и трет-бутилхлордиметилсилан (13,27 г, 88,0 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали 3 раза насыщенным водным раствором хлорида аммония и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 8-с в виде желтого масла.
Стадия 3: Промежуточное соединение 8-d
К раствору промежуточного соединения 8-с (1,0 г, 105,0 ммоль) и промежуточного соединения 7-d (352 г, 2,73 ммоль) в ТГФ (20 мл) последовательно добавляли трифенилфосфин (1,07 г, 4,1 ммоль) и DIAD (796 мкл, 4,1 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 8-d в виде желтого масла.
Стадия 4: Промежуточное соединение 8-е
К раствору промежуточного соединения 8-d (750 мг, 1,57 ммоль) в ТГФ (20 мл) добавляли 1,0 М раствор TBAF в ТГФ (1,72 мл, 1,72 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. К остатку добавляли простой диэтиловый эфир; образовавшийся осадок собирали путем фильтрации с получением промежуточного соединения 8-е в виде твердого вещества белого цвета.
Синтез промежуточного соединения 9-d
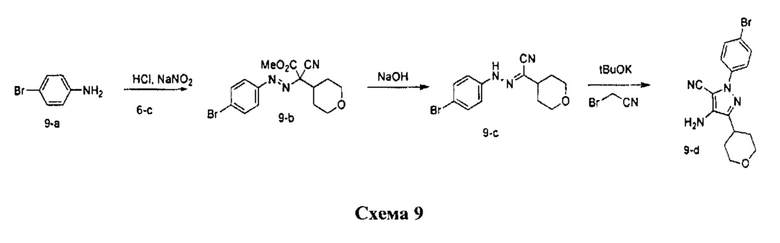
Стадия 1: Промежуточное соединение 9-b
К раствору 4-броманилина (8,43 г, 49,0 ммоль) в 1 н. водном растворе HCl (123 мл) по каплям добавляли 1,0 М водный раствор нитрита натрия (49,0 мл, 49,0 ммоль) при комнатной температуре. Смесь перемешивали в течение 1 часа и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 6-с (4,5 г, 24,56 ммоль) в этаноле (34,30 мл) и воде (457 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата натрия. Смесь перемешивали при 0°C в течение 3 часов и затем при комнатной температуре до готовности. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 9-b в виде бежевого масла.
Стадия 2: Промежуточное соединение 9-с
К раствору промежуточного соединения 9-b (10,0 г, 27,3 ммоль) в ТГФ (273 мл), охлажденному до 0°C, добавляли 10 н. водный раствор NaOH (68,3 мл, 683,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали 10% раствором лимонной кислоты, насыщенным водным раствором Na2CO3, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 9-с в виде твердого вещества желтого цвета.
Стадия 3: Промежуточное соединение 9-d
К раствору промежуточного соединения 9-с (4,0 г, 12,98 ммоль) и бромацетонитрила (995 мкл, 14,28 ммоль) в трет-бутаноле (64,9 мл), охлажденному до 0°C, добавляли 1,0 М раствор трет-бутилата калия в трет-бутаноле (27,3 мл, 27,3 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 9-d в виде твердого вещества бежевого цвета.
Синтез соединения 3:
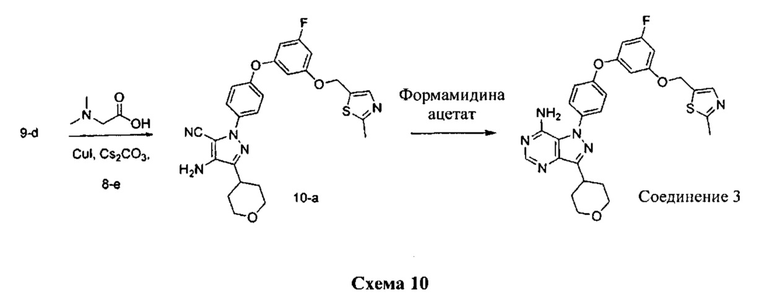
Стадия 1: Промежуточное соединение 10-а
К раствору промежуточного соединения 8-е (138 мг, 0,57 ммоль) и промежуточного соединения 9-d (200 мг, 0,57 ммоль) в 1,4-диоксане последовательно добавляли N,N-диметилглицин (36 мг, 0,35 ммоль), карбонат цезия (375 мг, 1,15 ммоль) и йодид меди (I) (22 мг, 0,11 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Добавляли воду и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 10-а в виде твердого вещества коричневого цвета.
Стадия 13: Соединение 3
К раствору промежуточного соединения 10-а (291 мг, 0,57 ммоль) в EtOH (6,0 мл) добавляли формамидина ацетат (479 мг, 4,60 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 3⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=533,1.
Синтез промежуточного соединения 11-d:
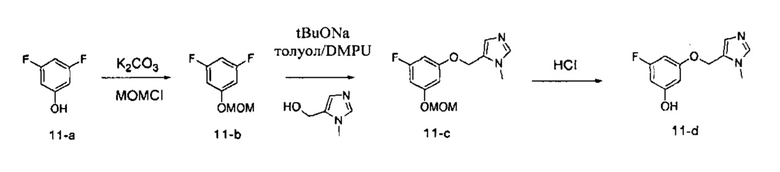
Стадия 1: Промежуточное соединение 11-b
К раствору 3,5-дифторфенола (15,0 г, 115 ммоль) в ацетоне (200 мл) добавляли K2CO3 (23,90 г, 173 ммоль) и хлорметилметиловый эфир (15,85 г, 127 ммоль). Затем реакционную смесь перемешивали при комнатной температуре в течение ночи и фильтровали. Фильтрат концентрировали при пониженном давлении с получением промежуточного соединения 11-b в виде бесцветного масла.
Стадия 2: Промежуточное соединение 11-с
К раствору (1-метил-1H-имидазол-5-ил) метанола (3,1 г, 27,6 ммоль) и промежуточного соединения 11-b (4,01 г, 23,04 ммоль) в толуоле (25,0 мл) и DMPU (25,0 мл) добавляли 2-метилпропан-2-олат натрия (4,43 г, 46,1 ммоль). Реакционную смесь перемешивали в течение ночи при 80°C и затем охлаждали до комнатной температуры. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали дважды насыщенным водным раствором хлорида аммония и солевым раствором, высушивали над MgSO4, фильтровали и концентрировали в вакууме. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 11-c в виде бежевого масла.
Стадия 3: Промежуточное соединение 11-d
К раствору промежуточного соединения 11-c (3,2 г, 12,02 ммоль) в МеОН (25,0 мл) добавляли 4 н. HCl в 1,4-диоксане (10,95 мл, 361,0 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Летучие компоненты удаляли в вакууме. К остатку добавляли простой диэтиловый эфир; образовавшийся осадок собирали путем фильтрации с получением промежуточного соединения 11-d⋅HCl в виде твердого вещества белого цвета.
Синтез промежуточного соединения 4
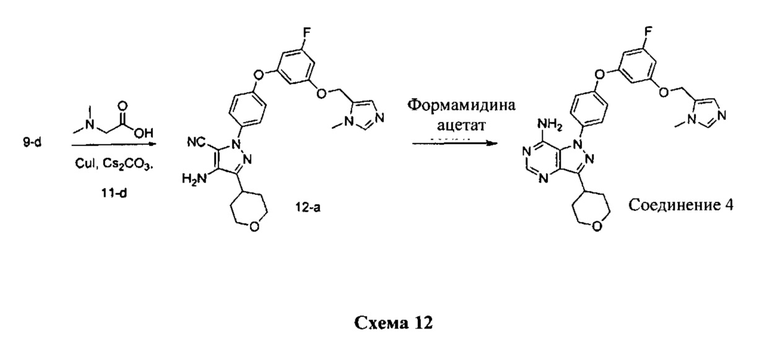
Стадия 1: Промежуточное соединение 12-а
К раствору промежуточного соединения 11-d (120 мг, 0,54 ммоль) и промежуточного соединения 9-d (187 мг, 0,54 ммоль) в 1,4-диоксане последовательно добавляли N,N-диметилглицин (167 мг, 1,62 ммоль), карбонат цезия (528 мг, 1,62 ммоль) и йодид меди (I) (103 мг, 0,54 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Добавляли этилацетат, реакционную смесь фильтровали через целит. К фильтрату добавляли воду, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 12-а в виде твердого вещества коричневого цвета.
Стадия 2: Соединение 4
К раствору промежуточного соединения 12-а (250 мг, 0,51 ммоль) в EtOH (6,0 мл) добавляли формамидина ацетат (426 мг, 4,09 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 4⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=516,2.
Синтез промежуточного соединения 13-с:
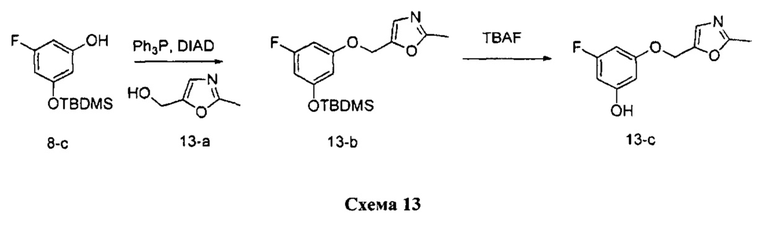
Стадия 1: Промежуточное соединение 13-b
К раствору промежуточного соединения 8-с (1,43 г, 5,89 ммоль) и (2-метилоксазол-5-ил)метанола (1,0 г, 8,84 ммоль) в ТГФ (20 мл) последовательно добавляли трифенилфосфин (2,32 г, 8,84 ммоль) и DIAD (1,72 мл, 8,84 ммоль) при комнатной температуре. Реакционную смесь затем перемешивали при комнатной температуре в течение 1 часа. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 13-b в виде желтого масла.
Стадия 2: Промежуточное соединение 13-с
К раствору промежуточного соединения 13-b (1,10 г, 3,26 ммоль) в ТГФ (32 мл) добавляли 1,0 М раствор TBAF в ТГФ (3,59 мл, 3,59 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 13-с в виде твердого вещества белого цвета.
Синтез соединения 5:
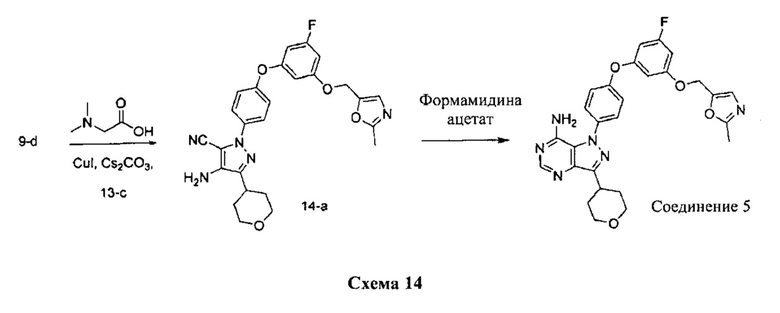
Стадия 1: Промежуточное соединение 14-а
К раствору промежуточного соединения 13-c (129 мг, 0,57 ммоль) и промежуточного соединения 9-d (200 мг, 0,57 ммоль) в 1,4-диоксане последовательно добавляли N,N-диметилглицин (36 мг, 0,34 ммоль), карбонат цезия (375 мг, 1,15 ммоль) и йодид меди (I) (22 мг, 0,11 ммоль). Реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Добавляли этилацетат, реакционную смесь фильтровали через целит. К фильтрату добавляли воду, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 14-а в виде твердого вещества коричневого цвета.
Стадия 2: Соединение 5
К раствору промежуточного соединения 14-а (384 мг, 0,78 ммоль) в EtOH (7,8 мл) добавляли формамидина ацетат (653 мг, 6,28 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 5⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=517,2.
Синтез промежуточного соединения 15-b:
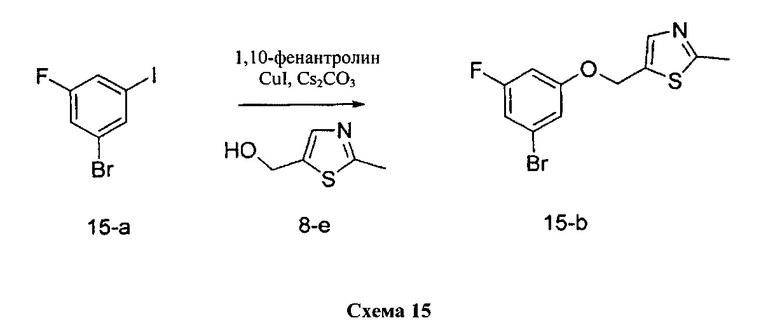
К раствору 1-бром-3-фтор-5-йодбензола 15-а (7,52 г, 25,0 ммоль) в 1,4-диоксане (12,50 мл) добавляли (2-метилтиазол-5-ил)метанол 8-е (3,55 г, 27,5 ммоль), 1,10-фенантролин (901 мг, 5,0 ммоль), йодид меди (I) (476 мг, 2,50 ммоль) и карбонат цезия (11,40 г, 35,0 ммоль). Реакционную смесь перемешивали при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. К фильтрату добавляли насыщенный водный раствор хлорида аммония, органический слой отделяли, и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 15-b в виде бежевого масла.
Синтез промежуточного соединения 16-b:
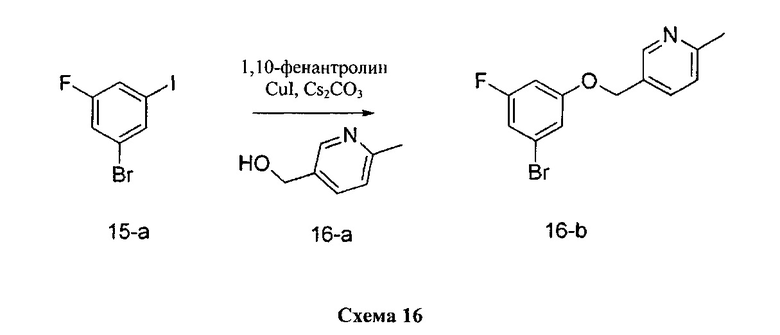
К раствору 1-бром-3-фтор-5-йодбензола 15-а (5,0 г, 16,62 ммоль) в толуоле (8,3 мл) добавляли (6-метилпиридин-3-ил)метанол 16-а (2,25 г, 18,28 ммоль), 1,10-фенантролин (599 мг, 3,32 ммоль), йодид меди (I) (316 мг, 1,66 ммоль) и карбонат цезия (7,58 г, 23,26 ммоль). Реакционную смесь перемешивали при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. К фильтрату добавляли насыщенный водный раствор хлорида аммония, органический слой отделяли, и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 16-b в виде твердого вещества бежевого цвета.
Синтез промежуточного соединения 17-b:
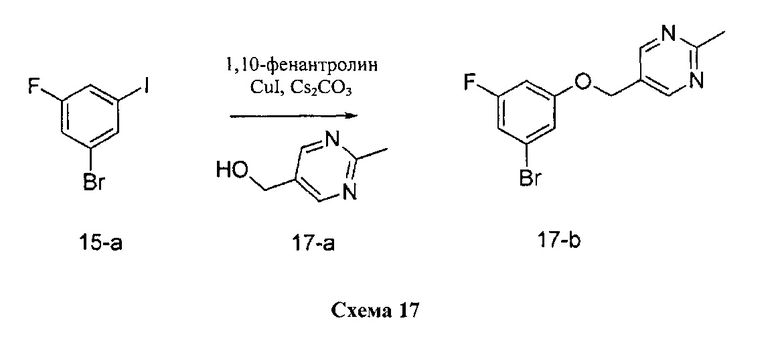
К раствору 1-бром-3-фтор-5-йодбензола 15-а (5,0 г, 16,62 ммоль) в толуоле (8,3 мл) добавляли (2-метилпиримидин-5-ил)метанол (2,26 г, 18,28 ммоль), 1,10-фенантролин (599 мг, 3,32 ммоль), йодид меди (I) (316 мг, 1,66 ммоль) и карбонат цезия (7,58 г, 23,26 ммоль). Реакционную смесь перемешивали при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. К фильтрату добавляли насыщенный водный раствор хлорида аммония, органический слой отделяли, и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 17-b в виде твердого вещества бежевого цвета.
Синтез промежуточного соединения 18-b:
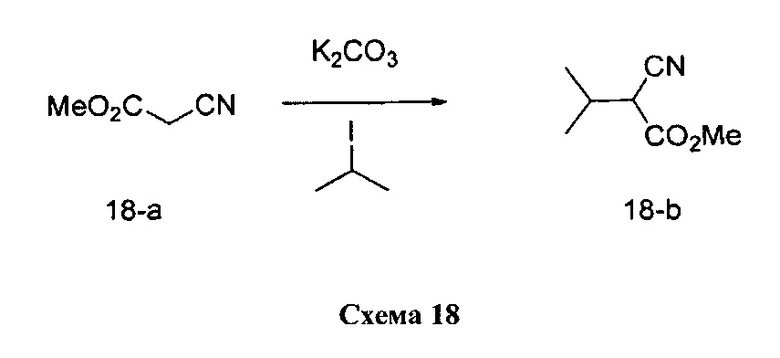
К раствору этил-2-цианоацетата 18-а (11,42 г, 101,0 ммоль) в ацетоне (153,0 мл) добавляли карбонат калия (20,94 г, 152,0 ммоль) и 2-йодпропан (29,2 г, 172,0 ммоль). Реакционную смесь нагревали с обратным холодильником в течение 2 дней, охлаждали до комнатной температуры и разбавляли в соотношении 1:1 смесью этилацетата/гексана. Добавляли воду, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 18-b в виде бесцветного масла.
Синтез промежуточного соединения 19-е:
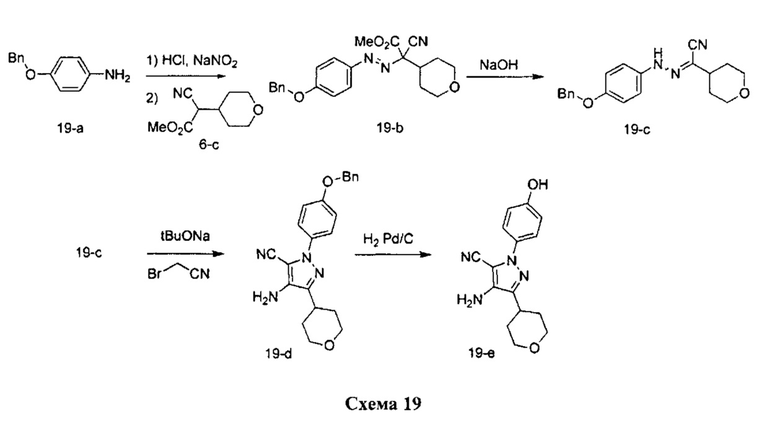
Стадия 1: Промежуточное соединение 19-b
К раствору 4-(бензилокси)анилина гидрохлорида 19-а (14,3 г, 60,8 ммоль) в 1 н. HCl (51,4 мл) добавляли по каплям 1,0 М раствор нитрита натрия в воде (76,0 мл, 76,0 ммоль) при комнатной температуре, смесь перемешивали в течение 1 часа, фильтровали и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 6-с (10,0 г, 50,7 ммоль) в этаноле (13,7 мл) и воде (188,0 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата калия. Смесь перемешивали при 0°C в течение 3 часов и при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 19-b в виде бежевого масла.
Стадия 2: Промежуточное соединение 19-с
К раствору промежуточного соединения 19-b (20,3 г, 49,8 ммоль) в 1:1 смеси 1,4-диоксан/вода (249,0 мл), охлажденному до 0°C, добавляли 10 н. NaOH (100,0 мл, 996,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 19-с в виде твердого вещества желтого цвета.
Стадия 3: Промежуточное соединение 19-d
К раствору промежуточного соединения 19-с (6,5 г, 19,4 ммоль) в трет-бутаноле (97,0 мл) добавляли 1,0 М раствор трет-бутилата калия в трет-бутаноле (40,7 мл, 40,7 ммоль). После перемешивания в течение 15 минут добавляли бромацетонитрил (3,37 мл, 48,4 ммоль) и реакционную смесь перемешивали в течение 3 часов при комнатной температуре. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, водную фазу экстрагировали этилацетатом, объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 19-d в виде пены бежевого цвета.
Стадия 4: Промежуточное соединение 19-е
К раствору промежуточного соединения 19-d (6,5 г, 17,36 ммоль) в этилацетате и при перемешивании в атмосфере азота добавляли 10% Pd/C (3,69 г, 1,73 ммоль). Реакционную смесь продували H2 и перемешивали в течение 1 часа при давлении 1 атм водорода. Затем реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме. Летучие компоненты удаляли при пониженном давлении с получением промежуточного соединения 19-е в виде твердого вещества желтого цвета.
Синтез промежуточного соединения 20-d:
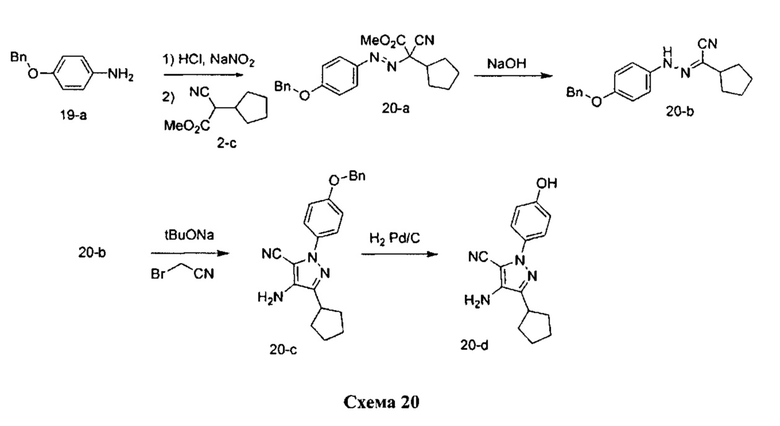
Стадия 1: Промежуточное соединение 20-а
К раствору 4-(бензилокси)анилина гидрохлорида 19-а (10,0 г, 42,4 ммоль) в 1 н. HCl (60,6 мл) добавляли по каплям 1,0 М раствор нитрита натрия (41,9 мл, 41,9 ммоль) в воде при комнатной температуре, смесь перемешивали в течение 1 часа, фильтровали и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 2-c (5,0 г, 29,9 ммоль) в этаноле (16,2 мл) и воде (222,0 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата калия. Смесь перемешивали при 0°C в течение 3 часов и при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 20-a в виде бежевого масла.
Стадия 2: Промежуточное соединение 20-b
К раствору промежуточного соединения 20-а (10,0 г, 26,5 ммоль) в 1:1 смеси 1,4-диоксан/вода (265,0 мл), охлажденному до 0°C, добавляли 10 н. NaOH (53,0 мл, 530,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 20-b в виде твердого вещества желтого цвета.
Стадия 3: Промежуточное соединение 20-с
К раствору промежуточного соединения 20-b (8,3 г, 28,8 ммоль) и бромацетонитрила (4,33 мл, 62,1 ммоль) в трет-бутаноле (141,0 мл) добавляли 1,0 М раствор трет-бутилата натрия в трет-бутаноле (56,4 мл, 56,4 ммоль). Реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 20-с в виде пены бежевого цвета.
Стадия 4: Промежуточное соединение 20-d
К раствору промежуточного соединения 20-с (3,72 г, 10,38 ммоль) в этилацетате и при перемешивании в атмосфере азота добавляли 10% Pd/C (2,20 г, 1,03 ммоль). Реакционную смесь продували H2 и перемешивали в течение 1 часа при давлении 1 атм водорода. Затем реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме. Летучие компоненты удаляли при пониженном давлении с получением промежуточного соединения 20-d в виде твердого вещества желтого цвета.
Синтез промежуточного соединения 21-d:
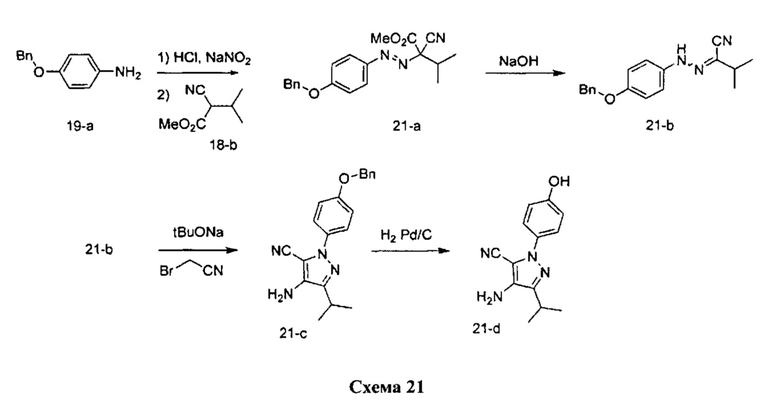
Стадия 1: Промежуточное соединение 21-а
К раствору 4-(бензилокси)анилина гидрохлорида 19-а (20,0 г, 85,0 ммоль) в 1 н. HCl (71,8 мл) добавляли по каплям 1,0 М раствор нитрита натрия (99,0 мл, 99,0 ммоль) в воде при комнатной температуре, смесь перемешивали в течение 1 часа, фильтровали и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 18-b (10,0 г, 70,8 ммоль) в этаноле (19,1 мл) и воде (263,0 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата натрия. Смесь перемешивали при 0°C в течение 3 часов и при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 21-а в виде бежевого масла.
Стадия 2: Промежуточное соединение 21-b
К раствору промежуточного соединения 21-а (24,0 г, 68,3 ммоль) в 1:1 смеси 1,4-диоксан/вода (341,0 мл), охлажденному до 0°C, добавляли 10 н. NaOH (137,0 мл, 1366,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 21-b в виде твердого вещества желтого цвета.
Стадия 3: Промежуточное соединение 21-с
К охлажденному на льду раствору промежуточного соединения 21-b (8,28 г, 28,2 ммоль) в трет-бутаноле (141,0 мл) добавляли 1,0 М раствор трет-бутилата натрия в трет-бутаноле (56,4 мл, 56,4 ммоль). После перемешивания в течение 15 минут добавляли бромацетонитрил (4,33 мл, 62,1 ммоль); реакционную смесь медленно нагревали до комнатной температуры и перемешивали в течение 2 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 21-с в виде твердого вещества желтого цвета.
Стадия 4: Промежуточное соединение 21-d
К раствору промежуточного соединения 21-с (5,84 г, 17,57 ммоль) в этилацетате и при перемешивании в атмосфере азота добавляли 10% Pd/C (1,87 г, 0,87 ммоль). Реакционную смесь продували H2 и перемешивали в течение 1 часа при давлении 1 атм водорода. Затем реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме. Очистка путем хроматографии на силикагеле обеспечивает соединение 21-d в виде твердого вещества желтого цвета.
Синтез соединения 14:
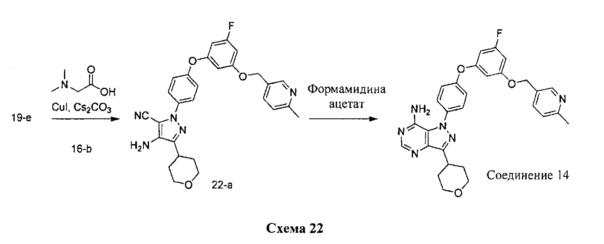
Стадия 1: Промежуточное соединение 22-а
К раствору промежуточного соединения 19-е (375,0 мг, 1,32 ммоль) в 1,4-диоксане (1,7 мл) добавляли промежуточное соединение 16-b (391 мг, 1,32 ммоль), N,N-диметилглицин (272 мг, 2,64 ммоль), йодид меди (I) (166 мг, 0,87 ммоль) и карбонат цезия (1,72 г, 5,28 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 22-а в виде пены бежевого цвета.
Стадия 2: Соединение 14
К раствору промежуточного соединения 22-а (275 мг, 0,55 ммоль) в метаноле (5,5 мл) добавляли формамидина ацетат (401 мг, 3,85 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 14⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=527,2.
Синтез соединения 15:
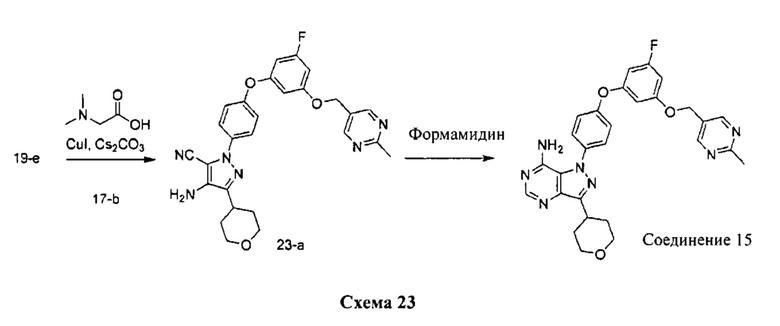
Стадия 1: Промежуточное соединение 23-а
К раствору промежуточного соединения 19-е (375 мг, 1,32 ммоль) в 1,4-диоксане (1,7 мл) добавляли промежуточное соединение 17-b (392 мг, 1,32 ммоль), N,N-диметилглицин (272 мг, 2,64 ммоль), йодид меди (I) (166 мг, 0,87 ммоль) и карбонат цезия (1,72 г, 5,28 ммоль). Реакционную смесь нагревали в герметичной пробирке при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 23-а в виде пены бежевого цвета.
Стадия 2: Соединение 15
К раствору промежуточного соединения 23-а (260 мг, 0,52 ммоль) в метаноле (5,2 мл) добавляли формамидина ацетат (541 мг, 5,19 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 15-2⋅HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=528,1.
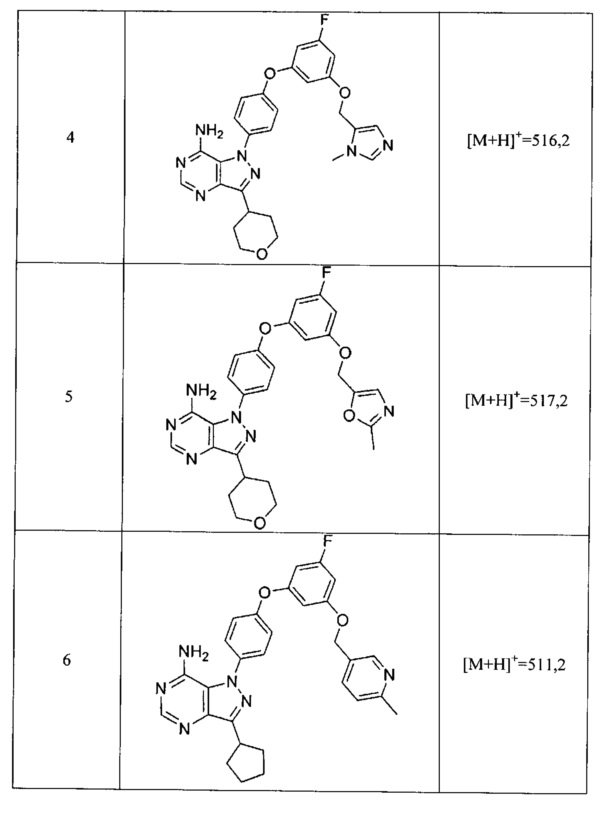
Синтез соединения 7:
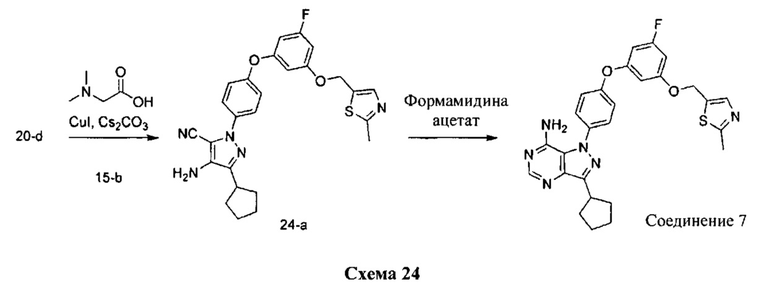
Стадия 2: Промежуточное соединение 24-а
К раствору промежуточного соединения 20-d (533,0 мг, 1,98 ммоль) в 1,4-диоксане (1,0 мл) добавляли промежуточное соединение 15-b (600 мг, 1,98 ммоль), N,N-диметилглицин (410 мг, 3,97 ммоль), йодид меди (I) (250 мг, 1,31 ммоль) и карбонат цезия (2,59 г, 7,94 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 24-а в виде бежевого масла.
Стадия 2: Соединение 7
К раствору промежуточного соединения 24-а (470,0 мг, 0,96 ммоль) в этаноле (9,60 мл) добавляли формамидина ацетат (800 мг, 7,68 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 7⋅2HCl в виде твердого вещества желтого цвета. MS (m/z) М+Н=517,1.
Синтез соединения 6:
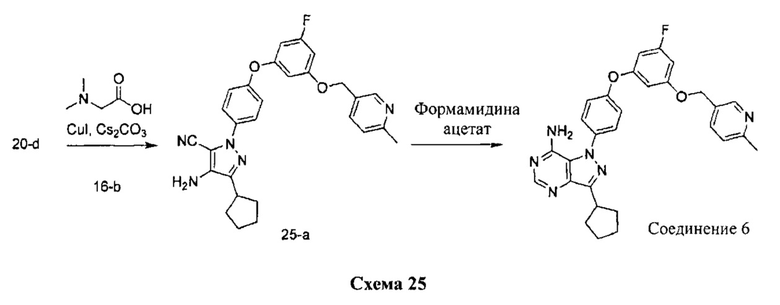
Стадия 1: Промежуточное соединение 25-а
К раствору промежуточного соединения 20-d (200 мг, 0,74 ммоль) в 1,4-диоксане (1,0 мл) добавляли промежуточное соединение 16-b (221 мг, 0,74 ммоль), N,N-диметилглицин (231 мг, 3,23 ммоль), йодид меди (I) (142 мг, 0,74 ммоль) и карбонат цезия (971 мг, 2,98 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 25-а в виде пены бежевого цвета.
Стадия 2: Соединение 6
К раствору промежуточного соединения 25-а (360 мг, 0,74 ммоль) в этаноле (7,45 мл) добавляли формамидина ацетат (620 мг, 5,96 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 6⋅2HCl в виде твердого вещества желтого цвета. MS (m/z) М+Н=511,2.
Синтез соединения 8:
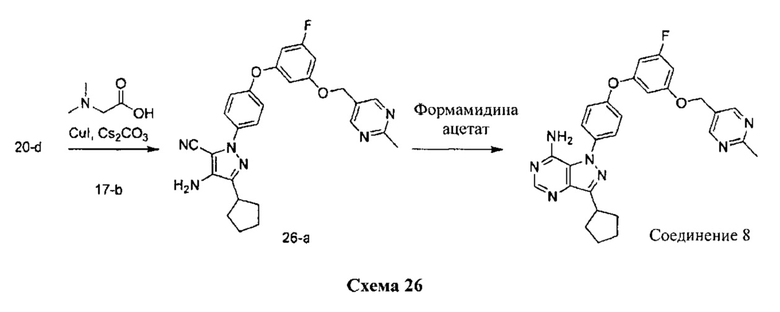
Стадия 1: Промежуточное соединение 26-а
К раствору промежуточного соединения 20-d (542 мг, 2,02 ммоль) в 1,4-диоксане (2,70 мл) добавляли промежуточное соединение 17-b (600 мг, 2,02 ммоль), N,N-диметилглицин (416 мг, 4,04 ммоль), йодид меди (I) (254 мг, 1,33 ммоль) и карбонат цезия (1,97 г, 6,06 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает соединение 26-а в виде пены бежевого цвета.
Стадия 2: Соединение 8
К раствору промежуточного соединения 26-а (420 мг, 0,86 ммоль) в этаноле (8,6 мл) добавляли формамидина ацетат (722 мг, 6,93 ммоль) и реакционную смесь перемешивали при 80°C в течение 3 часов и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 8⋅2HCl в виде твердого вещества желтого цвета. MS (m/z) М+Н=512,1,
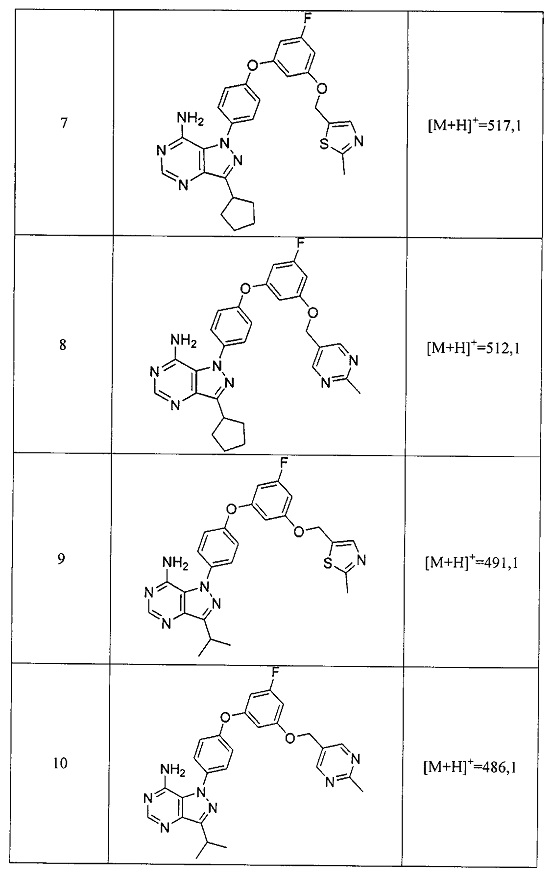
Синтез соединения 9:
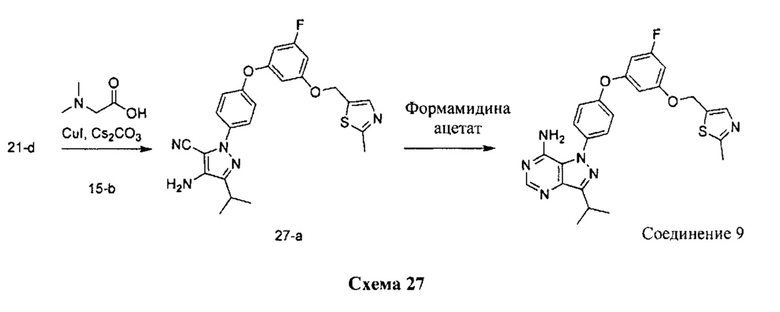
Стадия 1: Промежуточное соединение 27-а
К раствору промежуточного соединения 21-d (2,30 г, 9,49 ммоль) в 1,4-диоксане (12,7 мл) добавляли промежуточное соединение 15-b (2,87 г, 9,49 ммоль), N,N-диметилглицин (1,95 г, 19,0 ммоль), йодид меди (I) (1,19 г, 6,27 ммоль) и карбонат цезия (12,37 г, 38,0 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает соединение 27-а в виде бежевого масла.
Стадия 2: Соединение 9
К раствору промежуточного соединения 27-а (1,65 г, 3,56 ммоль) в этаноле (7,2 мл) добавляли формамидина ацетат (741 мг, 6,93 ммоль) и реакционную смесь перемешивали при 80°C в течение ночи и затем охлаждали до комнатной температуры. Добавляли воду и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает соединение 9 в виде твердого вещества белого цвета. Соединение 9 растворяли в метаноле, раствор подкисляли 1 н. HCl в МеОН, образовавшийся осадок собирали путем фильтрации с получением соединения 9⋅2HCl в виде твердого вещества белого цвета. MS (m/z) M+H=491,1.
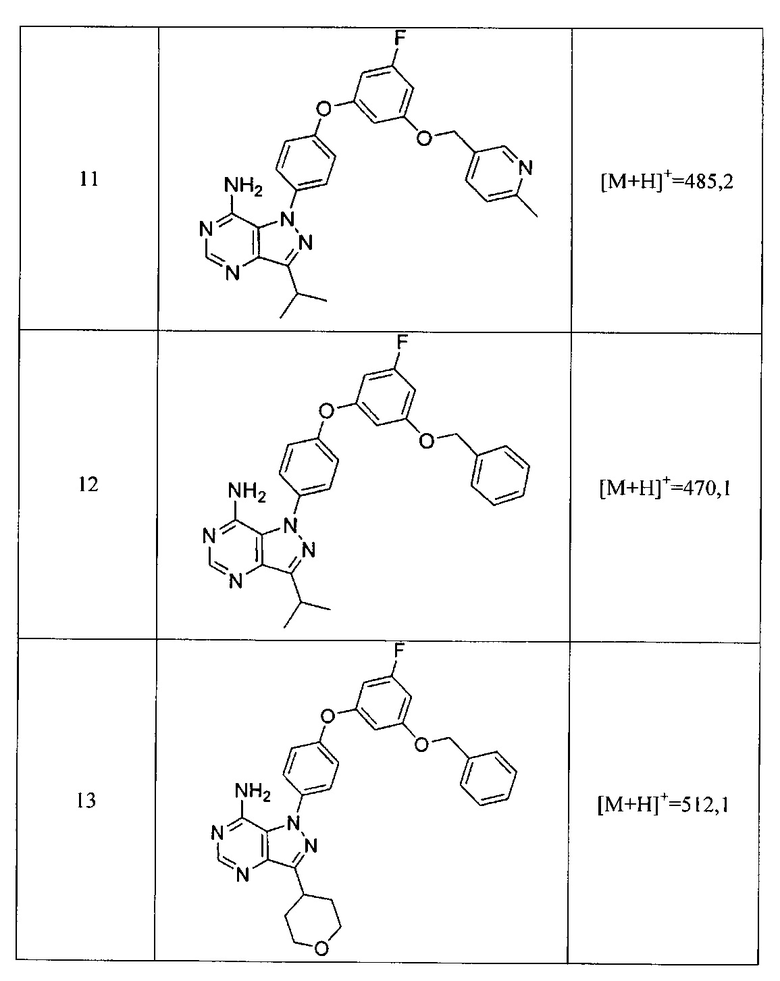
Синтез соединения 11:
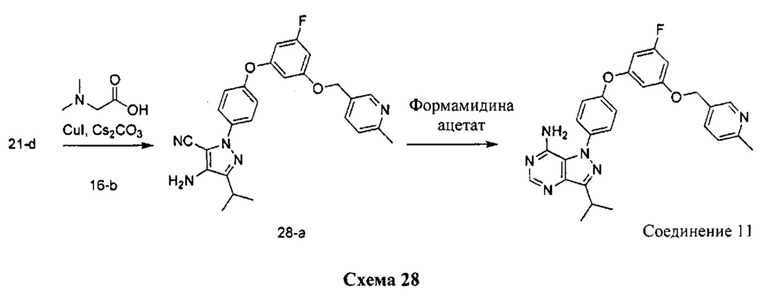
Стадия 1: Промежуточное соединение 28-а
К раствору промежуточного соединения 21-d (491 мг, 2,03 ммоль) в 1,4-диоксане (2,7 мл) добавляли промежуточное соединение 16-b (600 мг, 2,03 ммоль), N,N-диметилглицин (418 мг, 4,05 ммоль), йодид меди (I) (255 мг, 1,33 ммоль) и карбонат цезия (2,64 г, 8,10 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 28-а в виде пены бежевого цвета.
Стадия 2: Соединение 11
К раствору промежуточного соединения 28-а (510 мг, 1,11 ммоль) в метаноле (11,1 мл) добавляли формамидина ацетат (1,16 г, 11,15 ммоль), реакционную смесь перемешивали при reflux в течение ночи и летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 11⋅2HCl в виде твердого вещества белого цвета. MS (m/z) М+Н=485,2.
Синтез соединения 10:
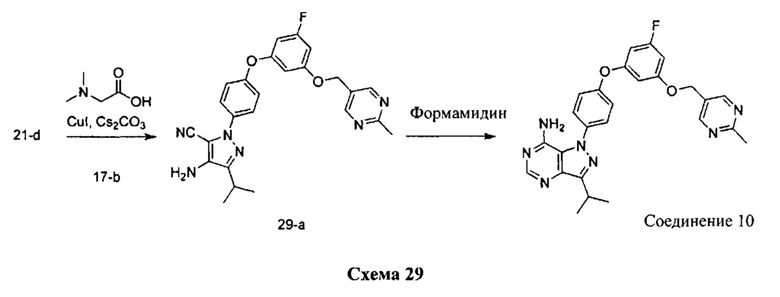
Стадия 1: Промежуточное соединение 29-а
К раствору промежуточного соединения 21-d (2,0 г, 8,26 ммоль) в 1,4-диоксане (11,0 мл) добавляли промежуточное соединение 17-b (2,45 г, 8,26 ммоль), N,N-диметилглицин (1,7 г, 16,5 ммоль), йодид меди (I) (1,0 г, 5,45 ммоль) и карбонат цезия (10,76 г, 33,0 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 29-а в виде пены бежевого цвета.
Стадия 2: Соединение 10
К раствору промежуточного соединения 29-а (1,5 г, 3,27 ммоль) в метаноле (32,7 мл) добавляли формамидина ацетат (3,41 г, 32,7 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Добавляли воду и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Летучие компоненты удаляли при пониженном давлении. К остатку добавляли метанол; образовавшийся осадок собирали путем фильтрации с получением соединения 10 в виде твердого вещества белого цвета. MS (m/z) M+H=486,2.
Синтез промежуточного соединения 30-а:
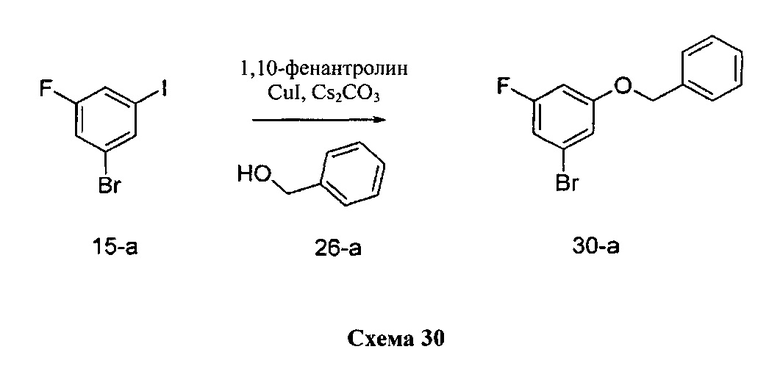
К раствору 1-бром-3-фтор-5-йодбензола 15-а (5,0 г, 16,62 ммоль) в 1,4-диоксане (8,3 мл) добавляли бензиловый спирт 30-а (1,79 г, 16,62 ммоль), 1,10-фенантролин (599 мг, 3,32 ммоль), йодид меди (I) (316 мг, 1,66 ммоль) и карбонат цезия (7,58 г, 23,26 ммоль). Реакционную смесь перемешивали при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. К фильтрату добавляли насыщенный водный раствор хлорида аммония, органический слой отделяли, и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 30-а в виде бежевого масла.
Синтез соединения 12:
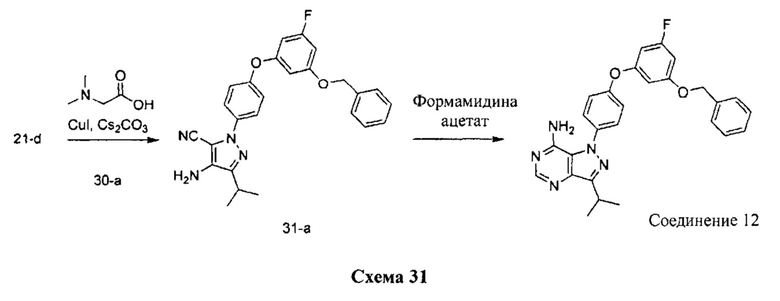
Стадия 1: Промежуточное соединение 31-а
К раствору промежуточного соединения 21-d (370 мг, 1,52 ммоль) в 1,4-диоксане (11,0 мл) добавляли промежуточное соединение 30-а (429 мг, 1,52 ммоль), N,N-диметилглицин (315 мг, 3,05 ммоль), йодид меди (I) (192 мг, 1,0 ммоль) и карбонат цезия (1,99 г, 6,11 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение ночи и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 31-а в виде пены бежевого цвета.
Стадия 2: Соединение 12
К раствору промежуточного соединения 31-а (130 мг, 0,29 ммоль) в метаноле (0,5 мл) добавляли формамидина ацетат (306 мг, 2,94 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 12⋅HCl в виде твердого вещества желтого цвета. MS (m/z)M+H=470,l.
Синтез промежуточного соединения 32-e:
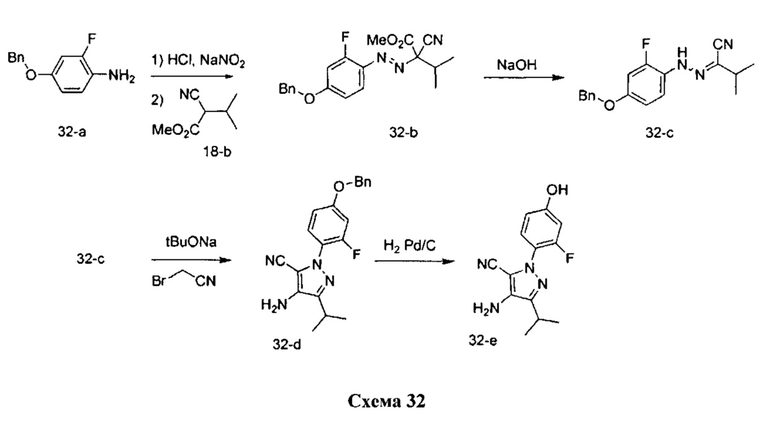
Стадия 1: Промежуточное соединение 32-b
К раствору 4-(бензилокси)-2-фторанилина 32-а (12,0 г, 47,3 ммоль) в 1 н. HCl (39,9 мл) добавляли по каплям 1,0 М раствор нитрита натрия (55,2 мл, 55,2 ммоль) в воде при комнатной температуре, смесь перемешивали в течение 1 часа, фильтровали и затем по каплям добавляли к охлажденному на льду раствору промежуточного соединения 18-b (5,56 г, 39,4 ммоль) в этаноле (10,6 мл) и воде (146,0 мл). Поддерживали pH на уровне 7 путем добавления порциями ацетата натрия. Смесь перемешивали при 0°C в течение 3 часов и при комнатной температуре в течение ночи. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 32-b в виде бежевого масла.
Стадия 2: Промежуточное соединение 32-с
К раствору промежуточного соединения 32-b (15,0 г, 40,6 ммоль) в 1:1 смеси 1,4-диоксан/вода (203,0 мл), охлажденному до 0°C, добавляли 10 н. NaOH (81,0 мл, 812,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли, промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении с получением промежуточного соединения 32-с в виде бежевого масла.
Стадия 3: Промежуточное соединение 32-d
К раствору промежуточного соединения 32-с (5,5 г, 17,6 ммоль) в tBuOH (80 мл) при комнатной температуре добавляли 1,0 М раствор tBuOK в tBuOH (37,1 мл, 37,1 ммоль). Реакционную смесь перемешивали в течение 15 минут при комнатной температуре и добавляли по каплям бромацетонитрил (3,08 мл, 44,2 ммоль). После того как добавление было завершено, реакционную смесь перемешивали в течение дополнительных 3 часов. Добавляли насыщенный водный раствор хлорида аммония и этилацетат, органический слой отделяли и органическую фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали солевым раствором, высушивали над MgSO4, фильтровали и концентрировали при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 32-d в виде бежевого масла.
Стадия 4: Промежуточное соединение 32-е
К раствору промежуточного соединения 32-d (1,0 г, 14,3 ммоль) в этилацетате и при перемешивании в атмосфере азота добавляли 10% Pd/C (607 мг, 0,3 ммоль). Реакционную смесь продували H2 и перемешивали в течение 3 часов при давлении 1 атм водорода. Затем реакционную смесь фильтровали через целит и фильтрат концентрировали в вакууме. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 32-c в виде твердого вещества желтого цвета.
Синтез соединения 16:
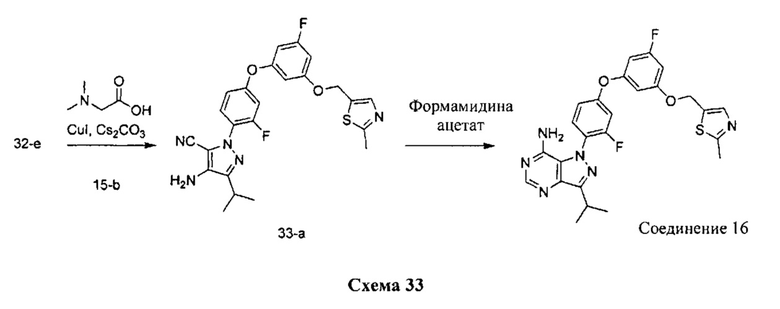
Стадия 1: Промежуточное соединение 33-а
К раствору промежуточного соединения 32-c (200 мг, 0,7 ммоль) в 1,4-диоксане (1,0 мл) добавляли промежуточное соединение 15-b (255 мг, 0,8 ммоль), N,N-диметилглицин (158 мг, 1,5 ммоль), йодид меди (I) (97 мг, 0,5 ммоль) и карбонат цезия (1,0 г, 3,1 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 33-а в виде пены бежевого цвета.
Стадия 2: Соединение 16
К раствору промежуточного соединения 33-а (70 мг, 0,1 ммоль) в изопропаноле (10,0 мл) добавляли формамидина ацетат (151 мг, 1,4 ммоль) и реакционную смесь перемешивали при 100°C в течение ночи и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 16⋅2HCl в виде твердого вещества желтого цвета. MS (m/z) М+Н=509,1.
Синтез соединения 17:
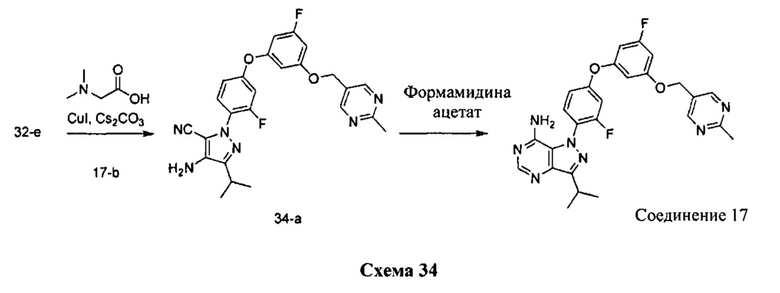
Стадия 1: Промежуточное соединение 34-а
К раствору промежуточного соединения 32-c (200 мг, 0,7 ммоль) в 1,4-диоксане (1,0 мл) добавляли промежуточное соединение 17-b (251 мг, 0,8 ммоль), N,N-диметилглицин (158 мг, 1,5 ммоль), йодид меди (I) (97 мг, 0,5 ммоль) и карбонат цезия (1,0 г, 3,1 ммоль). Реакционную смесь нагревали в герметичном сосуде при 110°C в течение 2 дней и затем охлаждали до комнатной температуры, разбавляли этилацетатом и фильтровали через целит. Летучие компоненты удаляли при пониженном давлении. Очистка путем хроматографии на силикагеле обеспечивает промежуточное соединение 34-а в виде пены бежевого цвета.
Стадия 2: Соединение 17
К раствору промежуточного соединения 34-а (35 мг, 0,07 ммоль) в изопропаноле (10,0 мл) добавляли формамидина ацетат (76 мг, 0,7 ммоль) и реакционную смесь перемешивали с обратным холодильником в течение ночи и затем охлаждали до комнатной температуры. Летучие компоненты удаляли при пониженном давлении. Очистка при помощи обращенно-фазовой хроматографии при градиентном элюировании 0,1% водным раствором HCl/метанола обеспечивает соединение 17⋅2HCl в виде твердого вещества желтого цвета. MS (m/z) M+H=504,1.
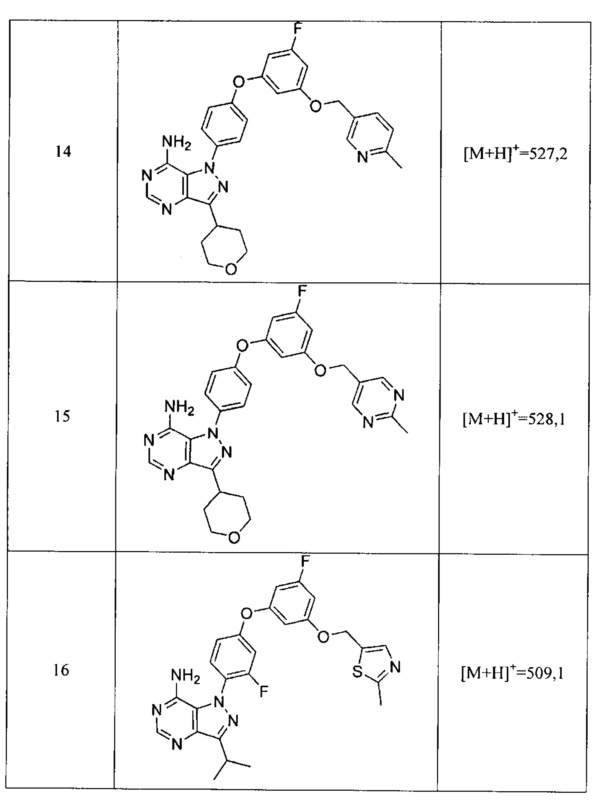
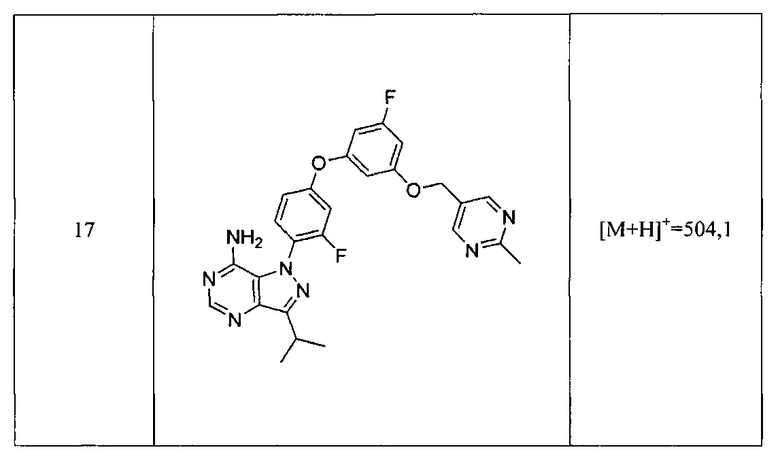
Связывание киназы
Анализ ингибирования Btk киназы
Анализы киназы на основе флуоресцентной поляризации осуществляли в формате планшета на 384 лунки, используя меченную гистидином рекомбинантную полноразмерную тирозинкиназу агаммаглобулинемии Брутона (Btk) человека и модифицированный протокол KinEASE™ FP Fluorescein Green Assay, поставляемый Millipore. Киназную реакцию осуществляли при комнатной температуре в течение 60 минут в присутствии 250 мкМ субстрата, 10 мкМ АТФ и различных концентраций тестируемых соединений. Реакцию останавливали с помощью реагентов обнаружения EDTA/киназа и поляризацию измеряли на приборе Tecan 500. На основе полученной кривой зависимости доза-эффект, рассчитывали IC50, используя Graph Pad Prisms®, применяя нелинейную аппроксимацию кривой. Экспериментально определяли Km для АТФ для каждого фермента и рассчитывали значения Ki, используя уравнение Cheng-Prusoff (см.: Cheng Y, Prusoff WH. (1973) Relationship between the inhibition constant (K1) and the concentration of inhibitor which causes 50 per cent inhibition (I50) of an enzymatic reaction". Biochem Pharmacol 22 (23): 3099-108).
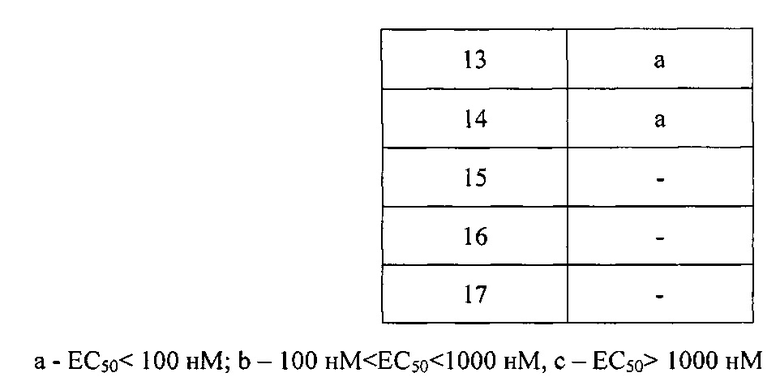
Значения ki представлены в Таблице 2.
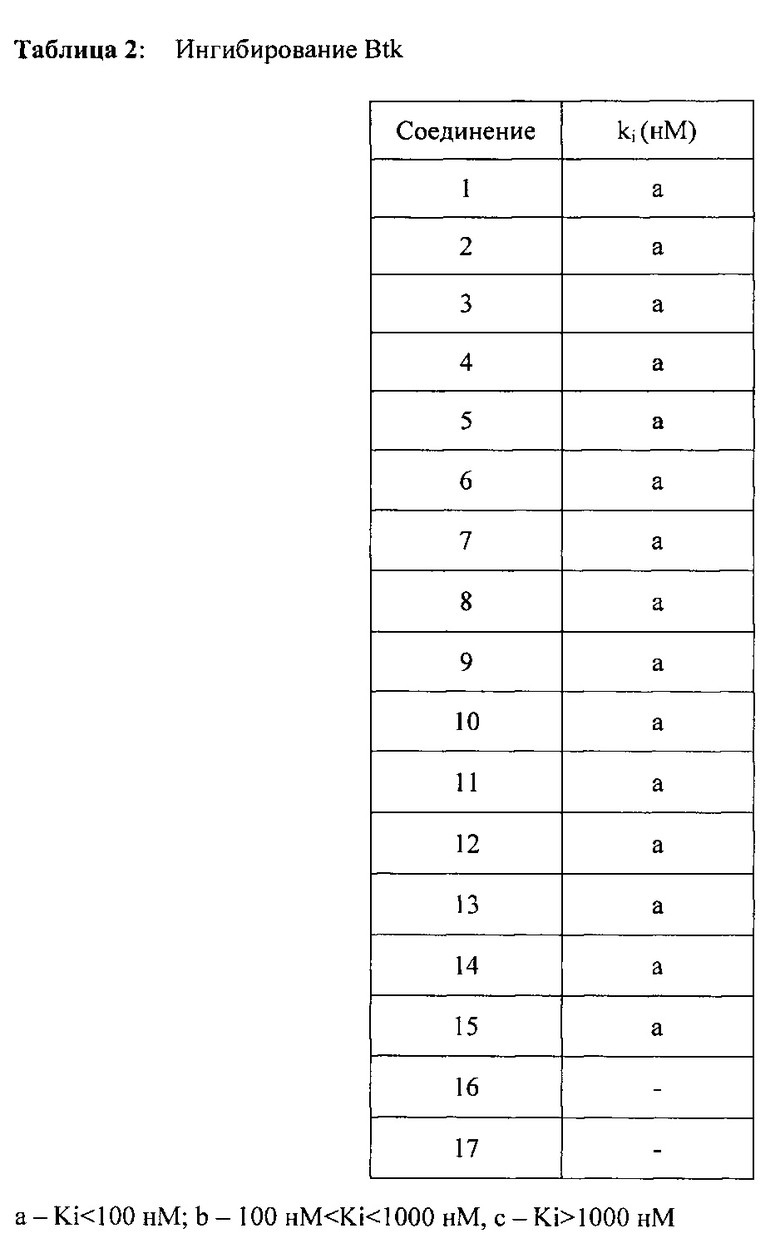
Анализ пролиферации клеток селезенки
Спленоциты получали от 6-недельных самцов мышей CD1 (Charles River Laboratories Inc.). Селезенки мышей вручную разрушали в PBS и фильтровали, используя фильтр клеток 70 мкм, после этого эритроциты лизировали с помощью хлорида аммония. Клетки промывали, ресуспендировали в Splenocyte Medium (HyClone RPMI, дополненная 10% инактивированной нагреванием FBS, 0,5Х заменимыми аминокислотами, 10 мМ HEPES, 50 мкМ бета меркаптоэтанола) и инкубировали при 37°C, 5% CO2 в течение 2 ч для удаления прилипающих клеток. Клеточную суспензию высевали в планшеты на 96 лунок при плотности 50 тыс клеток на лунку и инкубировали при 37°C, 5% CO2 в течение 1 ч. Спленоциты повторно обрабатывали в трех повторах с помощью 10000 нМ кривых соединений формулы 1 в течение 1 ч, после этого стимулировали пролиферацию B клеток с помощью 2,5 мкг/мл анти-IgM F(ab')2 (Jackson ImmunoResearch) в течение 72 ч. Пролиферацию клеток определяли с помощью Cell Titer-Glo Luminescent Assay (Promega). Рассчитывали значения EC50 (50% пролиферация в присутствии соединений по сравнению с контролями, обработанными носителем) на основании кривых зависимости доза-эффект для соединений, используя GraphPad Prism Software.
Значения EC50 представлены в Таблице 3.
Способы: Артрит у мышей
Исследования артрита у мышей осуществляли, как описано в Braselmann S, Taylor V, Zhao Н, Wang S, Sylvain C, Baluom M, Qu K, Herlaar E, Lau A, Young C, Wong BR, Lovell S, Sun T, Park G, Argade A, Jurcevic S, Pine P, Singh R, Grossbard EB, Payan DG, Masuda ES: R406 an orally available spleen tyrosine kinase inhibitor blocks fc receptor signaling and reduces immune-complex mediated inflammation. J Pharmacol Exp Ther, 2006, 319: 998-1008.
В целом, самок мышей Balb/c (в возрасте 6-7 недель при прибытии) выдерживали в виварии по меньшей мере в течение 4 дней. В день эксперимента животных предварительно обрабатывали (t = минус 1 ч) с помощью соединения или только носителя путем кормления через зонд (ПО). Во время t=0 животным инъецировали внутривенно (в/в; 0,1 мл/мышь) физиологический раствор, содержащий овальбумин и краситель синий Эванса (10 мг/мл на каждое). Через десять минут (t = 10 мин) животных анестезировали с помощью изофлурана, сбривали дорсальную поверхность и затем подкожно инъецировали антитела кролика к овальбумину в один участок на правой стороне животного (25 мкг в 30 мкл). Аналогичное количество изотипного контрольного антитела после этого инъецировали в левую сторону.
После этого животных возвращали в их клетки и с каждого участка инъекции собирали пункцию кожи (8 мм) через четыре часа. Образцы помещали в 1 мл формамида на ночь при 80°C (1 биопсия кожи на 1 мл формамида в стеклянной пробирке). После этого определяли количество красителя синего Эванса в растворе формамида с помощью спектрофотомерии (630 нм) в качестве критерия транссудации сыворотки в кожу.
Соединения 9 и 10 проявляют эффективность при пероральном введении в дозе 30 мг/кг.
| название | год | авторы | номер документа |
|---|---|---|---|
| ИНГИБИТОРЫ ПРОТЕИНКИНАЗ | 2013 |
|
RU2678767C2 |
| BIR ДОМЕН IAP СВЯЗЫВАЮЩИЕ СОЕДИНЕНИЯ | 2011 |
|
RU2567544C2 |
| ИНГИБИТОРЫ ТИРОЗИНКИНАЗЫ БРУТОНА | 2013 |
|
RU2619465C2 |
| ПЕРВИЧНЫЕ КАРБОКСАМИДЫ В КАЧЕСТВЕ ИНГИБИТОРОВ BТK | 2014 |
|
RU2708395C2 |
| ПРОИЗВОДНЫЕ 2,3-ДИГИДРО-ИЗОИНДОЛ-1-ОНА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ ТИРОЗИНКИНАЗЫ БРУТОНА | 2013 |
|
RU2671847C2 |
| АМИДНЫЕ ПРОИЗВОДНЫЕ В КАЧЕСТВЕ АГОНИСТОВ GRP119 | 2014 |
|
RU2642429C2 |
| БИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ ПИПЕРАЗИНА | 2012 |
|
RU2628616C2 |
| СОЕДИНЕНИЯ, ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, СПОСОБЫ ПРИГОТОВЛЕНИЯ СОЕДИНЕНИЙ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗЫ ATR | 2019 |
|
RU2806857C2 |
| ИНГИБИТОРЫ КАНАЛОВ С ТРАНЗИТОРНЫМ ПОТЕНЦИАЛОМ НА ОСНОВЕ ОКСАДИАЗОЛОВ | 2019 |
|
RU2818244C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2010 |
|
RU2636584C2 |
Изобретение относится к новому соединению формулы 1 или его фармацевтически приемлемой соли, обладающим свойствами ингибиторов протеинкиназы Брутона (Btk), ингибиторов киназ Tec-Btk, активируемых киназой Src. Соединения могут найти применение для получения лекарственного средства для модуляции функции киназы Btk и для лечения или предотвращения пролиферативных заболеваний, в частности клеточной пролиферации, воспалительных и аутоиммунных заболеваний, связанных с активностью киназы, например артрита, иммунной гиперчувствительности и воспаления. В формуле 1
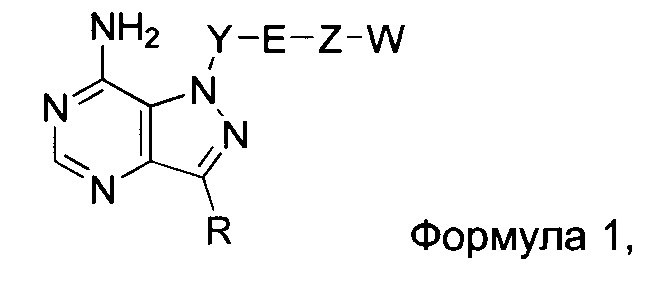
R выбран из группы, состоящей из 1) водорода, 2) C1-С6 алкила, 3) С4-С6 карбоциклила, 4) 3-7-членного гетероциклила, содержащего от одного до четырех гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы; Y представляет собой 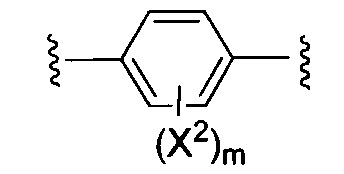 ,
,
Е выбран из кислорода, Z представляет собой 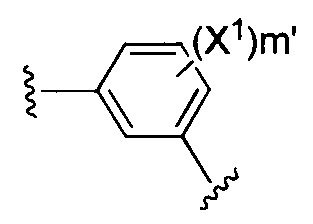 , где Y-E-Z-W выбран из:
, где Y-E-Z-W выбран из:
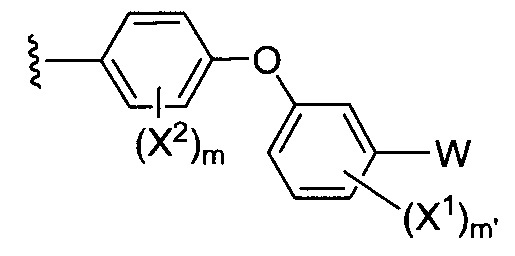 , X1 и X2 независимо выбраны из водорода и галогена;
, X1 и X2 независимо выбраны из водорода и галогена;
m представляет собой целое число от 0 до 2, и m' представляет собой целое число от 0 до 2;
W представляет собой -OR3, где R3 выбран из замещенного или незамещенного фенил(С1-С6 алкила) или замещенного или незамещенного гетероарил(С1-С6 алкила), где гетероарил включает 5-6-членные кольцевые структуры, которые включают 1 или 2 гетероатома, выбранных из О, N и S; фенил(С1-С6 алкил) может быть дополнительно замещен C1-С3 алкилом и гетероарил(С1-С6 алкил) может быть дополнительно замещен C1-С3 алкилом. Изобретение также относится к вариантам способа получения соединений формулы 1, как указано в формуле изобретения, и к фармацевтической композиции с использованием соединений формулы 1. 12 н. и 5 з.п. ф-лы, 3 табл., 17 пр.
1. Соединение формулы 1
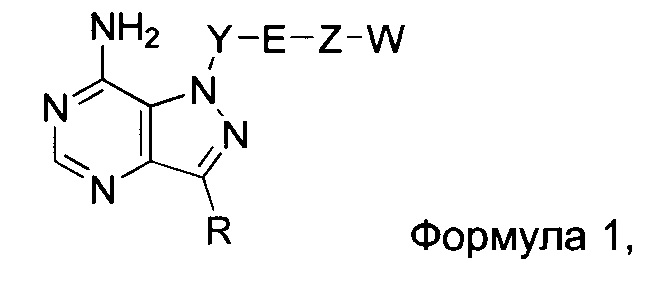
где
R выбран из группы, состоящей из:
1) водорода,
2) C1-С6 алкила,
3) С4-С6 карбоциклила,
4) 3-7-членного гетероциклила, содержащего от одного до четырех гетероатомов, выбранных из группы, состоящей из азота, кислорода и серы;
Y представляет собой
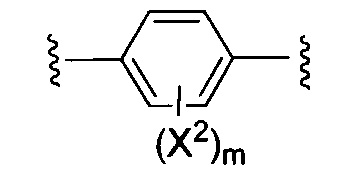
Е выбран из кислорода,
Z представляет собой
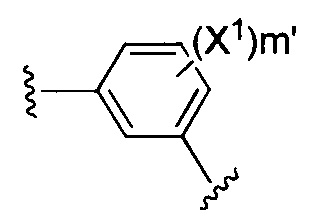
где Y-E-Z-W выбран из:
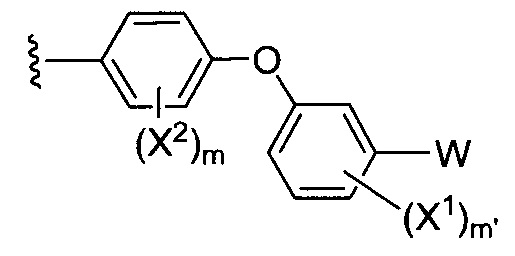
X1 и X2 независимо выбраны из водорода и галогена;
m представляет собой целое число от 0 до 2, и
m' представляет собой целое число от 0 до 2;
W представляет собой -OR3, где R3 выбран из замещенного или незамещенного фенил(С1-С6 алкила) или замещенного или незамещенного гетероарил(С1-С6 алкила), где
гетероарил включает 5-6-членные кольцевые структуры, которые включают 1 или 2 гетероатома, выбранных из О, N и S;
фенил(С1-С6 алкил) может быть дополнительно замещен C1-С3 алкилом и гетероарил(С1-С6 алкил) может быть дополнительно замещен C1-С3 алкилом;
или его фармацевтически приемлемая соль.
2. Соединение по п. 1, в котором R выбран из группы, состоящей из
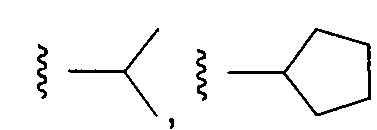 и
и 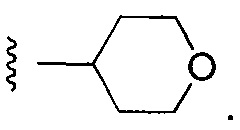
3. Соединение по п. 1, в котором Z выбран из группы, состоящей из
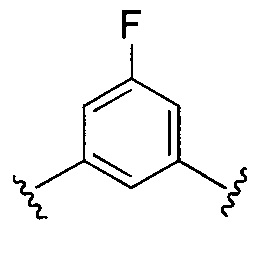 и
и 
4. Соединение по п. 1, в котором W выбран из группы, состоящей из
 и
и 
5. Соединение, выбранное из группы, состоящей из
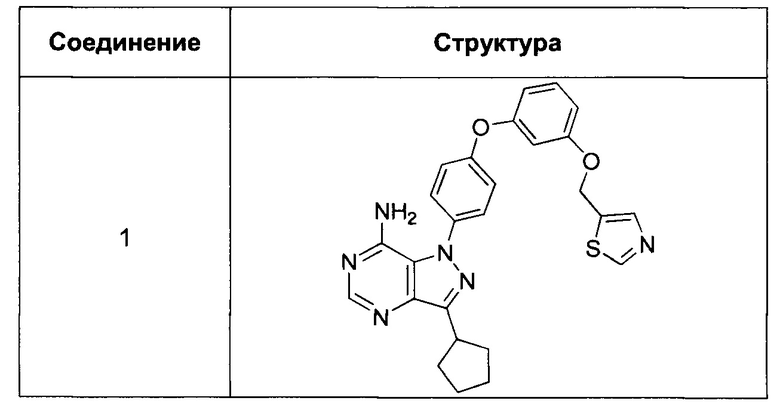
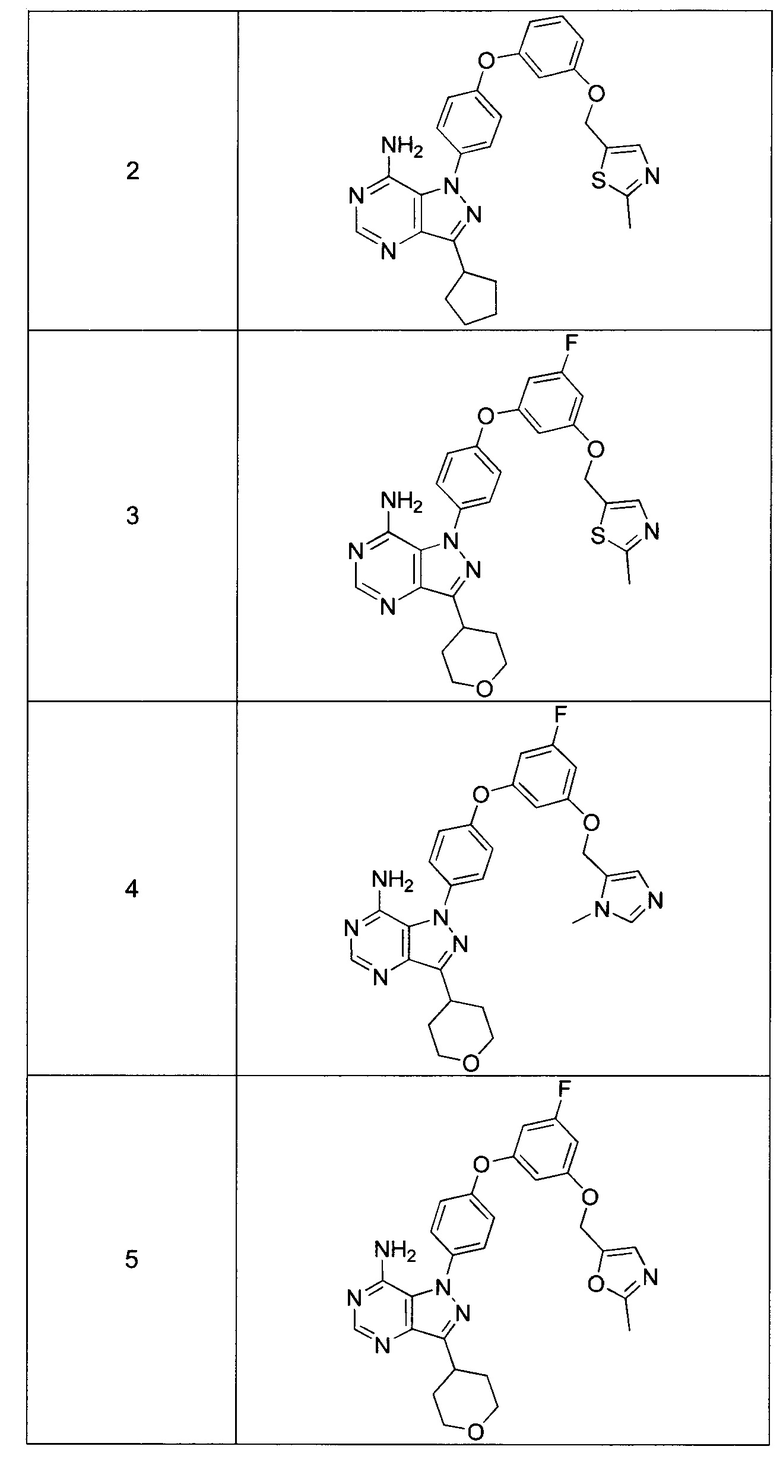
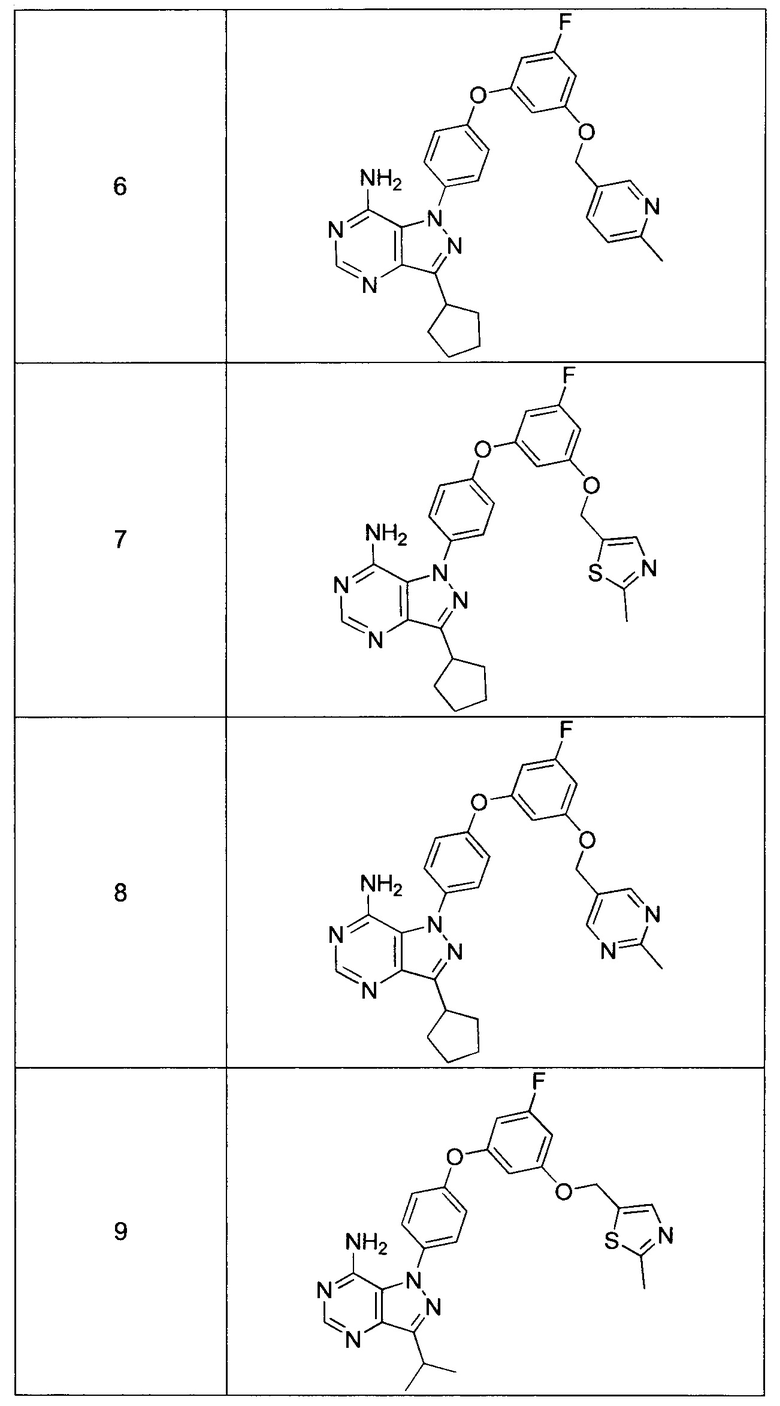
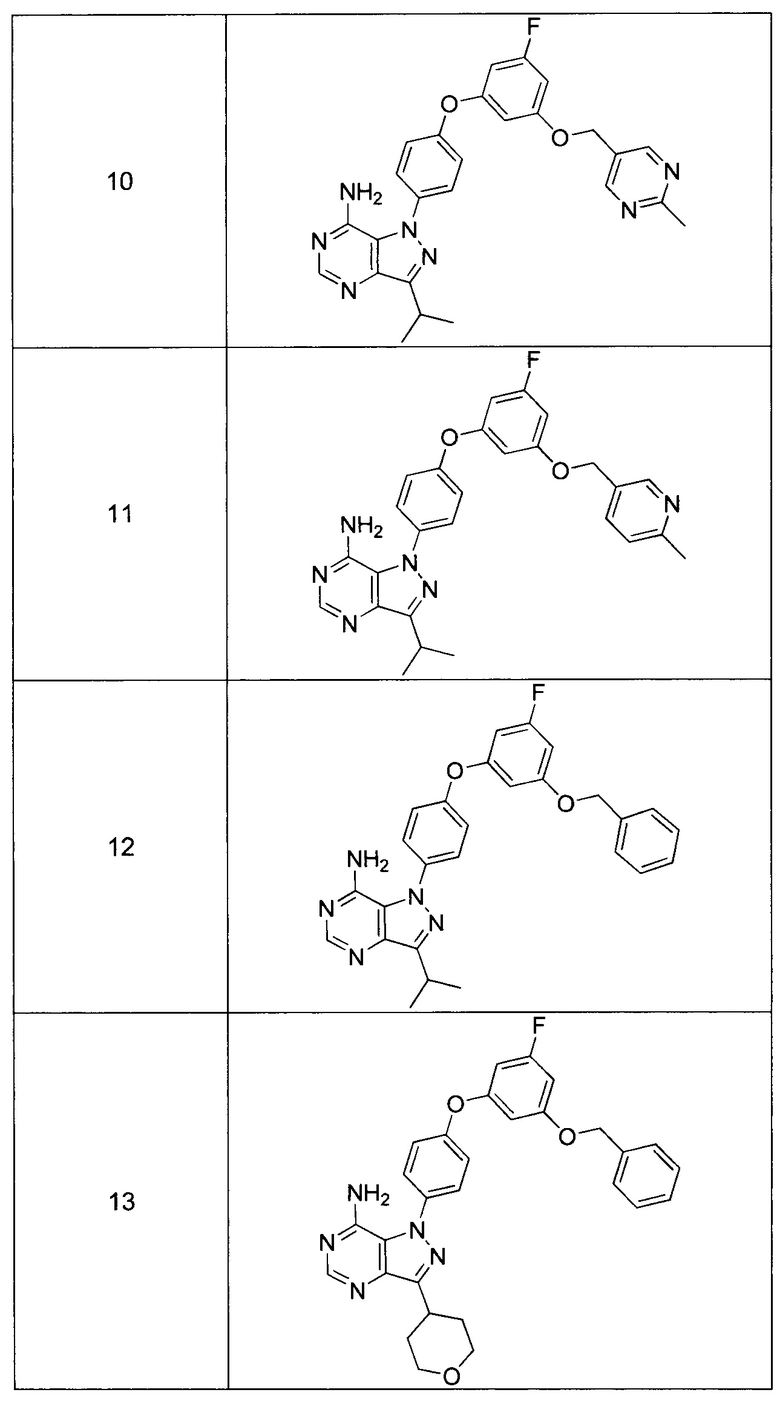
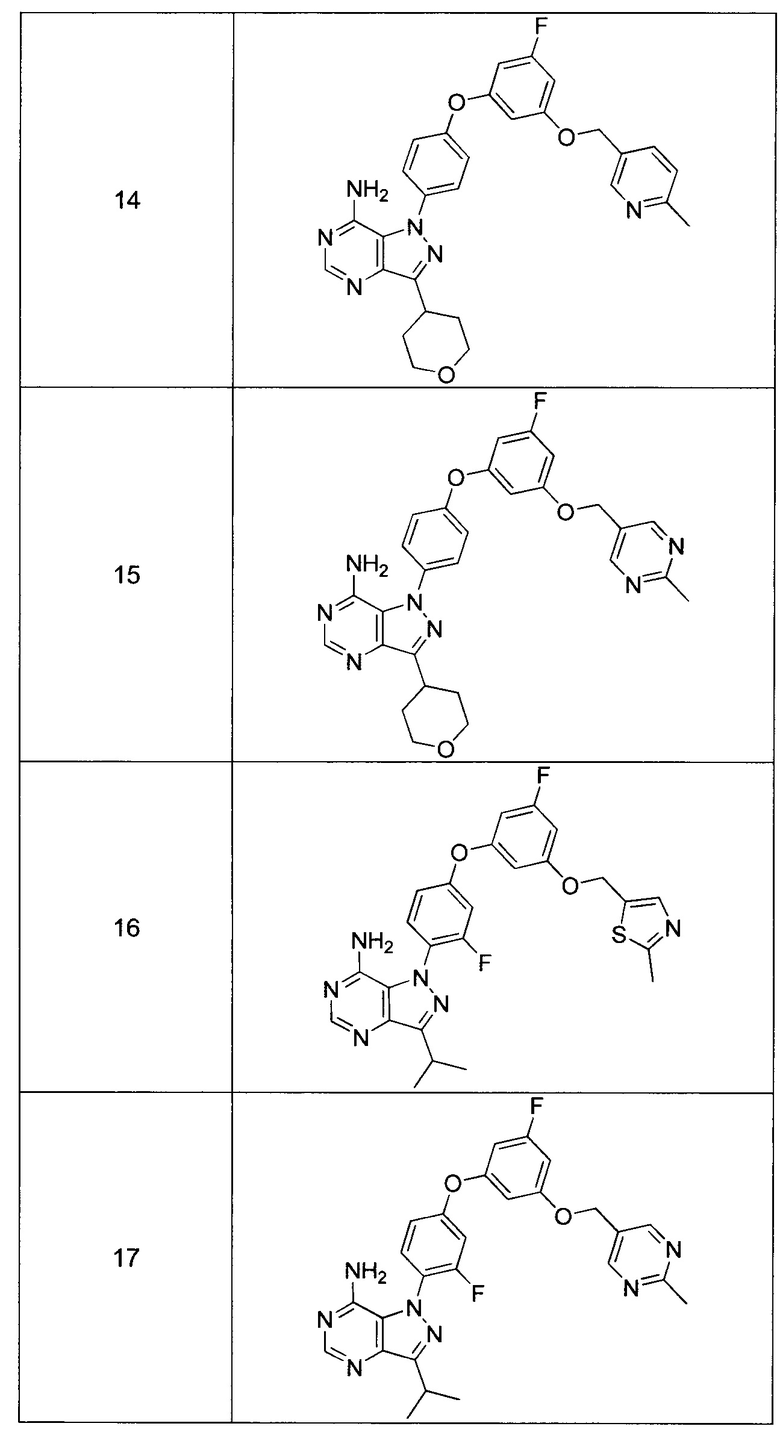
или его фармацевтически приемлемая соль.
6. Способ получения соединения формулы 1 по п. 1, где указанный способ включает следующие стадии: a) превращение промежуточного соединения 1-i в промежуточное соединение 1-ii и затем в промежуточное соединение 1-iv;
b) получение промежуточного соединения 1-v из промежуточного соединения 1-iv под действием водного раствора NaOH и приведение указанного промежуточного соединения 1-v во взаимодействие с бромацетонитрилом в трет-бутаноле с образованием промежуточного соединения 1-vi;
c) взаимодействие промежуточного соединения 1-vi с промежуточным соединением 1-vii с получением промежуточного соединения 1-viii, а затем получение соединения 1 в соответствии со следующей схемой
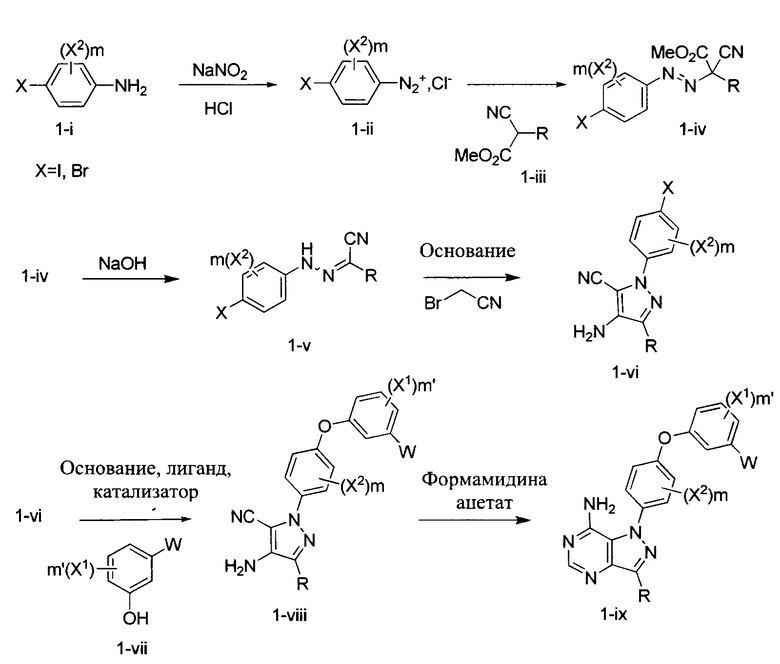
где R, W, X1, X2, m и m’ имеют значения, указанные в п. 1.
7. Способ получения соединения формулы 1 по п. 1, где указанный способ включает следующие стадии
а) превращение промежуточного соединения 1-х в промежуточное соединение 1-xi и затем в промежуточное соединение 1-xii;
b) получение промежуточного соединения 1-xiii из промежуточного соединения 1-xii под действием водного раствора NaOH и превращение его в промежуточное соединение 1-xiv под действием бромацетонитрила в трет-бутаноле, и последующее проведение стадии снятия защиты, ограниченной применением Н2 Pd/C, с образованием промежуточного соединения 1-xv;
c) взаимодействие промежуточного соединения 1-xv с промежуточным соединением 1-xvi с получением промежуточного соединения 1-viii, а затем получение соединения 1 в соответствии со следующей схемой
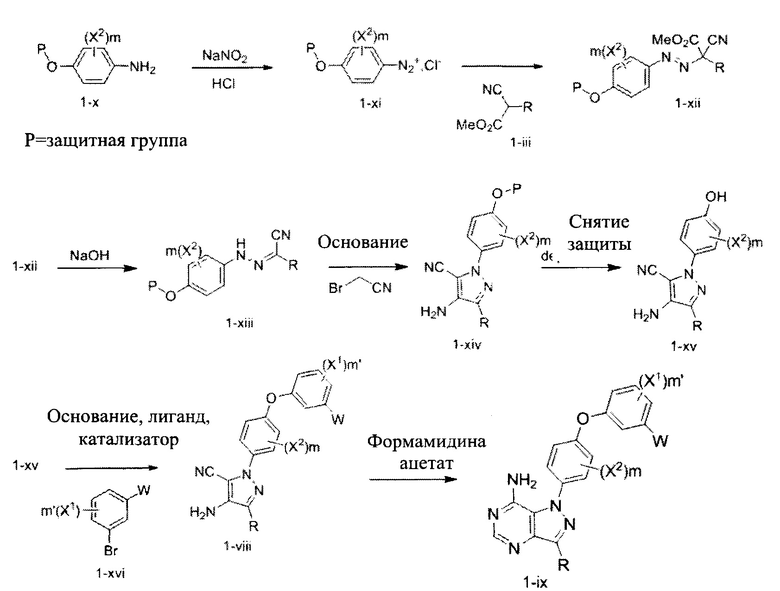
где R, W, X1, X2, m и m’ имеют значения, указанные в п. 1.
8. Фармацевтически приемлемая соль соединения по любому из пп. 1-5.
9. Фармацевтическая композиция для лечения заболевания, нарушения или состояния, связанного с киназой Btk (тирозинкиназа Брутона), содержащая терапевтически эффективное количество соединения или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 и по меньшей мере одно фармацевтически приемлемое вспомогательное вещество.
10. Применение соединения или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения фармацевтической композиции для лечения субъекта, страдающего от заболевания или состояния, связанного с киназой Btk.
11. Применение соединения по п. 10, где фармацевтическая композиция пригодна для лечения пролиферативных, воспалительных и аутоиммунных заболеваний, связанных с активностью киназы Btk.
12. Способ лечения субъекта, страдающего от заболевания или состояния, опосредованного протеинкиназой, включающий введение субъекту терапевтически эффективного количества соединения формулы 1 или его фармацевтически приемлемой соли по любому из пп. 1-5 или п. 8, где заболевание, нарушение или состояние связано с представителем семейства киназ Tec-Btk, активируемого представителями семейства киназ Src.
13. Применение соединения формулы 1 или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения лекарственного средства для лечения или предотвращения артрита или иммунной гиперчувствительности, связанных с активностью киназы Btk.
14. Применение соединения или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения лекарственного средства для лечения или предотвращения аутоиммунного заболевания, связанного с активностью киназы Btk.
15. Применение соединения или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения лекарственного средства для лечения воспаления, связанного с активностью киназы Btk.
16. Применение соединения или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения лекарственного средства для лечения или предотвращения рака, нарушения или болезненного состояния, характеризующегося воспалением или пролиферацией клеток, связанных с активностью киназы Btk.
17. Применение соединения формулы 1 или фармацевтически приемлемой соли соединения по любому из пп. 1-5 или п. 8 для получения лекарственного средства для модуляции функции киназы Btk.
| НОЖ КУТТЕРА | 2005 |
|
RU2385769C2 |
| WO 2008121742 A2 & EA 017865 B1, 29.03.2013 | |||
| RU 2015120616 А, 20.12.2016 & WO 2014071109. | |||
Авторы
Даты
2019-02-06—Публикация
2013-07-03—Подача