Перекрестная ссылка на родственные заявки
[0001] Настоящая заявка испрашивает приоритет на основании заявки на патент США №12/648,693, поданной 29 декабря 2009 года, которая является частичным продолжением заявки на патент США №12/492,180, поданной 26 июня 2009 года, которая испрашивает приоритет на основании предварительной заявки на патент США №61/076,450, поданной 27 июня 2008 года, предварительной заявки на патент США №61/148,388, поданной 29 января 2009 года, и предварительной заявки на патент США №61/170,874, поданной 20 апреля 2009 года, содержание каждой из которых полностью включено в настоящую заявку посредством ссылки.
Область техники
[0002] Настоящее изобретение относится к соединениям, подходящим для применения в качестве ингибиторов протеинкиназ. Настоящее изобретение также обеспечивает фармацевтически приемлемые композиции, содержащие соединения согласно настоящему изобретению и способы применения указанных композиций в лечении различных заболеваний.
Уровень техники
[0003] Поиску новых терапевтических агентов в последние годы в значительной степени способствовало лучшее понимание структуры ферментов и других биомолекул, связанных с заболеваниями. Одним из важных классов ферментов, который интенсивно исследовался, являются протеинкиназы.
[0004] Протеинкиназы составляют обширное семейство структурно близких ферментов, ответственных за регуляцию разнообразных процессов передачи сигнала в клетке. Считается, что протеинкиназы произошли от общего гена-прародителя, поскольку они обладают общностью структуры и каталитической функции. Почти все киназы содержат каталитический домен размером 250-300 аминокислот. Киназы можно разделить на семейства в зависимости от фосфорилируемых ими субстратов (например, протеин-тирозин, протеин-серин/треонин, липидкиназы, и т.д.).
[0005] В целом, протеинкиназы опосредуют внутриклеточную передачу сигнала путем осуществления переноса фосфатной группы с нуклеозид-трифосфата на белок-акцептор, участвующий в передаче сигнала. Указанные события фосфорилирования действуют как молекулярные переключатели типа вкл./выкл., которые могут модулировать или регулировать биологическую функцию белка-мишени. В конечном счете, данные события фосфорилирования запускаются в ответ на внеклеточные и другие стимулы. Примеры таких стимулов включают сигналы из внешней среды и стрессовые сигналы (например, осмотический шок, тепловой шок, ультрафиолетовое излучение, бактериальный эндотоксин и H2O2), цитокины (например, интерлейкин-1 (IL-1) и фактор некроза опухолей α (TNF-α) и факторы роста (например, гранулоцитарный колониестимулирующий фактор гранулоцитов-макрофагов GM-CSF) и фактор роста фибробластов (FGF)). Внеклеточные стимулы могут влиять на один или более клеточных ответов, связанных с ростом, миграцией, дифференцировкой клеток, секрецией гормонов, активацией факторов транскрипции, сокращением мышц, метаболизмом глюкозы, контролем синтеза белка и регуляцией клеточного цикла.
[0006] Многие заболевания связаны с аномальными клеточными ответами, запускаемыми событиями, опосредуемыми протеинкиназами, как описано выше. Указанные заболевания включают, но не ограничиваются перечисленными: аутоиммунные заболевания, воспалительные заболевания, заболевания костей, заболевания, связанные с нарушением метаболизма, неврологические и нейродегенеративные заболевания, рак, сердечнососудистые заболевания, аллергии и астму, болезнь Альцгеймера и заболевания, связанные с гормонами. Соответственно, сохраняется потребность в поиске ингибиторов протеинкиназ, которые можно применять в качестве терапевтических агентов.
Краткое описание изобретения
[0007] Было обнаружено, что соединения согласно настоящему изобретению и фармацевтически приемлемые композиции, содержащие указанные соединения, могут действовать как ингибиторы одной или более протеинкиназ. Такие соединения имеют общую формулу I-a и I-b:
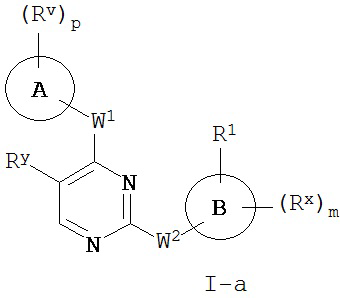
или представляют собой фармацевтически приемлемую соль соединения с такой формулой, при этом Кольцо A, Кольцо B, m, p, Rx, Ry, Rv, W1, W2 и R1 определены в настоящем тексте.
[0008] Соединения согласно настоящему изобретению и фармацевтически приемлемые композиции, содержащие указанные соединения, могут применяться для лечения различных заболеваний, расстройств или состояний, связанных с аномальными клеточными ответами, запускаемыми событиями, опосредуемыми протеинкиназами. Такие заболевания, расстройства или состояния включают заболевания, нарушения или состояния, описанные в настоящем тексте.
[0009] Соединения согласно настоящему изобретению также можно применять для исследования киназ в биологических и патологических явлениях, в исследовании путей внутриклеточной передачи сигнала, опосредуемых такими киназами, и в сравнительной оценке новых ингибиторов киназ.
Краткое описание графических материалов
На Фигуре 1 показана зависимость доза - ответ для ингибирования фосфо-фосфолипазы гамма 2 (p-plc γ 2) соединением I-2 в клетках Ramos; и результаты, полученные для соединения I-2 в эксперименте с промывкой.
На Фигуре 2 показана зависимость доза - ответ для ингибирования p-plc γ 2 соединением I-4 в клетках Ramos; и результаты, полученные для соединения I-4 в эксперименте с промывкой.
На Фигуре 3 показана зависимость доза - ответ для ингибирования p-plc γ 2 соединением I-7 в клетках Ramos; и результаты, полученные для соединения I-7 в эксперименте с промывкой.
На Фигуре 4 показана зависимость доза - ответ для ингибирования p-plc γ 2 соединением I-35 в клетках Ramos.
На Фигуре 5 показана зависимость доза - ответ для ингибирования p-plc γ 2 соединением I-38 в клетках Ramos.
На Фигуре 6 показаны результаты MC анализа, подтверждающие ковалентную модификацию киназы TEC в положении Cys449 под действием соединения I-2.
На Фигуре 7 показаны результаты MC анализа, подтверждающие ковалентную модификацию киназы TEC в положении Cys449 под действием соединения I-4.
На Фигуре 8 показаны результаты MC анализа, подтверждающие ковалентную модификацию киназы TEC в положении Cys449 под действием соединения I-7.
На Фигуре 9 показаны результаты для соединения I-2 в эксперименте с промывкой в сравнении с результатами для соединения I-4 и соединения I-7 в том же эксперименте с промывкой в клетках HCC827, содержащих мутантный EGFR с делецией.
На Фигуре 10 показаны результаты для соединения I-7 в эксперименте с промывкой в сравнении с результатами для контроля с EGF в клетках A431, содержащих EGFR дикого типа.
На Фигуре 11 показаны результаты МС анализа, подтверждающие ковалентную модификацию киназы JAK-3 в положении Cys909 под действием соединения I-7.
На Фигуре 12 показана зависимость доза - ответ для ингибирования P-Stat5 соединением I-2 в клетках CTLL-2, стимулированных IL-2; и зависимость доза - ответ для ингибирования P-JAK-3 соединением I-2 в клетках CTLL-2, стимулированных IL-2.
На Фигуре 13 показана зависимость доза - ответ для ингибирования P-Stat5 соединением I-4 в клетках CTLL-2, стимулированных IL-2; и зависимость доза - ответ для ингибирования P-JAK-3 соединением I-4 в клетках CTLL-2, стимулированных IL-2.
На Фигуре 14 показана зависимость доза - ответ для ингибирования P-Stat5 соединением I-7 в клетках CTLL-2, стимулированных IL-2.
На Фигуре 15 показаны результаты МС анализа, подтверждающие ковалентную модификацию ВТК под действием соединения I-7.
На Фигуре 16 показан Вестерн-блоттинг, демонстрирующий белок ВТК, доступный для соединения-зонда I-215 после обработки различными количествами соединения I-7.
На Фигуре 17 показан количественный анализ результатов Вестерн-блоттинга, показанного на Фигуре 16.
На Фигуре 18 показан Вестерн-блот эксперимента с промывкой с соединением I-7 и соединением-зондом I-215.
На Фигуре 19 показан количественный анализ результатов Вестерн-блоттинга, показанного на Фигуре 18.
На Фигуре 20 показана аминокислотная последовательность для ВТК (SEQ ID 1).
На Фигуре 21 показана аминокислотная последовательность для TEC (SEQ ID 2).
На Фигуре 22 показана аминокислотная последовательность для ITK (SEQ ID 3).
На Фигуре 23 показана аминокислотная последовательность для ВМХ (SEQ ID 4).
На Фигуре 24 показана аминокислотная последовательность для ТХК (SEQ ID 5).
На Фигуре 25 показана аминокислотная последовательность для JAK3 (SEQ ID 6).
Подробное описание некоторых вариантов осуществления
1. Общее описание соединений согласно настоящему изобретению
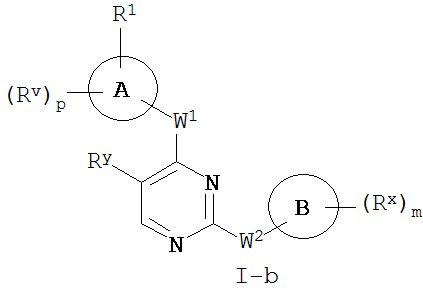
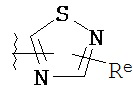
[0010] В некоторых вариантах осуществления настоящее изобретение обеспечивает соединение формулы I-a или I-b:


или его фармацевтически приемлемую соль, где:
Кольцо A представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы;
Кольцо В представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы;
R1 представляет собой высокореакционноспособную группу;
Ry представляет собой водород, галоген, -CN, -CF3, C1-4 алифатическую группу. С1-4 галогеналифатическую группу, -OR, -C(O)R или -C(O)N(R)2;
каждая группа R независимо представляет собой водород или возможно замещенную группу, выбранную из следующих: C1-6 алифатическая группа, фенил, 4-7-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, или 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы;
W1 и W2 каждый независимо представляет собой ковалентную связь или бивалентную C1-3 алкиленовую группу, причем одно метиленовое звено в W1 или W2 возможно заменено на -NR2-, -N(R2)C(O)-, -C(O)N(R2)-, -N(R2)SO2-, -SO2N(R2)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO- или -SO2-;
R2 представляет собой водород, возможно замещенную C1-6 алифатическую группу или -C(O)R или:
R2 и заместитель в Кольце A, взятые вместе с разделяющими их атомами, образуют 4-6-членное насыщенное, частично ненасыщенное или ароматическое конденсированное кольцо, или:
R2 и Ry, взятые вместе с разделяющими их атомами, образуют 4-7-членное частично ненасыщенное или ароматическое конденсированное кольцо;
m и p независимо равны 0-4; и
Rx и Rv независимо выбраны из -R, галогена, -OR, -O(CH2)qOR, -CN, -NO2, -SO2R, -SO2N(R)2, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2, где q равно 1-4; или:
Rx и R1, если они одновременно присутствуют в Кольце B, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, -CN, или C1-6 алифатической группы; или
Rv и R1, если они одновременно присутствуют в Кольце A, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, -CN или C1-6 алифатической группы.
2. Соединения и определения
[0011] Соединения, составляющие суть этого изобретения, включают кратко описанные выше, и подробно описанные ниже с делением на классы, подклассы и виды. Данные ниже определения будут применяться во всех случаях, когда не указано иное. Для целей настоящего изобретения химические элементы указаны в соответствии с Периодической таблицей элементов, CAS-номенклатурой, «Справочником по химии и физике» (75-я ред.). Кроме того, общие принципы органической химии описаны в следующих изданиях: "Organic Chemistry", Thomas Sorrell, University Science Books, Sausalito: 1999; «March’s Advanced Organic Chemistry», 5th Ed., Ed.: Smith, M.B. & March, J., John Wiley & Sons, New York: 2001, вследствие чего оба издания полностью включены в настоящее описание посредством ссылки.
[0012] Термин "алифатический" или "алифатическая группа", используемый здесь, подразумевает углеводороды с линейной (т.е. неразветвленной) или разветвленной структурой, замещенные или незамещенные углеводородные цепи, полностью насыщенные или содержащие одно или несколько ненасыщенных звеньев; моноциклические или бициклические углеводороды, полностью насыщенные или содержащие одно или несколько ненасыщенных звеньев, но не являющиеся ароматическими (также называемыми здесь "карбоциклами" "циклоалифатическими" или "циклоалкилами") с одной точкой крепления к остальной части молекулы. Если не указано иное, алифатические группы содержат 1-6 алифатических атомов углерода. В некоторых вариантах осуществления алифатические группы содержат 1-5 алифатических атомов углерода. В других вариантах осуществления алифатические группы содержат 1-4 алифатических атома углерода. В других вариантах осуществления - 1-3 алифатических атома углерода; а также - 1-2 алифатических атома углерода. В некоторых вариантах осуществления термин "циклоалифатический" (или "карбоцикл" или "циклоалкил") подразумевает моноциклический C3-C6 углеводород, полностью насыщенный или содержащий одно или несколько ненасыщенных звеньев, но неароматический, имеющий одну точку крепления к остальной части молекулы. Подходящие алифатические группы включают (но не ограничиваются) линейные или разветвленные, замещенные или незамещенные алкильные, алкенильные, алкинильные группы и их смешанные варианты, такие как (циклоалкил)алкильные, (циклоалкенил)алкильные или (циклоалкил)алкенильные.
[0013] Термин "низший алкил" относится к прямой или разветвленной C1-4-алкильной группе. Примерами низших алкильных групп являются метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил.
[0014] Термин "низший галоидалкил" относится к прямой или разветвленной C1-4-алкильной группе, замещенной одним или несколькими атомами галогена.
[0015] Термин "гетероатом" означает одну или несколько атомов кислорода, серы, азота, фосфора или кремния (в том числе любые окисленные формы азота, серы, фосфора или кремния; кватернизованную форму любого азотистого основания; или заменяемую азотную группу гетероциклического кольца, например, N (как в 3,4-дигидро-2H-пирролиле), NH (как в пирролидиниле) или NR+ (как в N-замещенном пирролидиниле)).
[0016] Термин "ненасыщенный", используемый в данном описании, означает, что группа содержит одно или несколько ненасыщенных звеньев.
[0017] В настоящем описании термин "бивалентная C1-8 (или C1-6) насыщенная или ненасыщенная, линейная или разветвленная углеводородная цепь" относится к бивалентным алкиленовым, алкениленовым и алкиниленовым цепям, прямым или разветвленным согласно данному здесь определению.
[0018] Термин "алкилен" относится к бивалентной алкильной группе. "Алкиленовая цепь" представляет собой полиметиленовую группу, т.е., -(CH2)n-, где n - натуральное число, предпочтительно от 1 до 6, от 1 до 4, от 1 до 3, от 1 до 2, или от 2 до 3. Замещенная алкиленовая цепь представляет собой полиметиленовую группу, в которой один или несколько атомов водорода метиленовой группы замещены. Подходящие заместители включают заместители алифатических групп, описанные ниже.
[0019] Термин "алкенилен" относится к бивалентной алкениловой группе. Замещенная алкениленовая цепь представляет собой полиметиленовую группу, содержащая по крайней мере одну двойную связь, в которой один или несколько атомов водорода замещены. Подходящие заместители включают заместители алифатических групп, описанные ниже.
[0020] В настоящем описании термин "циклопропиленил" подразумевает бивалентную циклопропильную группу следующей структуры: 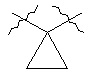 .
.
[0021] Термин "галоген" означает F, Cl, Br, или I.
[0022] Термин "арил", используемый самостоятельно или при описании фрагментов молекул, таких как "аралкил", "аралкокси" или "арилоксиалкил", относится к моноциклическим и бициклическим кольцевым системам, имеющим 5-14-членные кольца, в которых по крайней мере одно кольцо в системе является ароматическим, и каждое кольцо в системе состоит из 3-7 атомов. Термин "арил" может использоваться наравне с термином "арильное кольцо". В некоторых вариантах согласно настоящему изобретению понятие "арил" относится к ароматическим кольцевым системам, включающим (но не ограниченным ими) фенил, дифенил, нафтил, антрацил и т.п., и которые могут иметь один или несколько заместителей. Также понятие "арил", как оно понимается в настоящем документе, включает группу, в которой ароматическое кольцо сопряжено с одним или несколькими неароматическими, такими как инданил, фталимидил, нафтимидил, фенантридинил или тетрагидронафтидил и т.п.
[0023] Термины "гетероарил" и "гетероар-" используемые самостоятельно или при описании фрагментов молекул, например, "гетероаралкил", или "гетероаралкокси", - относятся к группам с 5-10 атомами в кольце, преимущественно с 5, 6 или 9 атомами в кольце, имеющих π-электронную систему из 6, 10, или 14 обобществленных электронов, и от одного до пяти гетероатомов помимо атомов углерода. Термин "гетероатом" подразумевает азот, кислород или серу, и включает любые окисленные формы азота или серы, и любые кватернизованные формы азотистых оснований. Гетероарильные группы включают, помимо прочего, тиенил, фуранил, пирролил, имидазолил, пиразолил, триазолил, тетразолил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пиридил, пиридазинил, пиримидинил, пиразинил, индолизинил, пуринил, нафтиридинил и птеридинил. Используемые в настоящем описании понятия "гетероарил" и "гетероар-" также включают группы, в которых гетероароматическое кольцо сопряжено с одним или несколькими арильными, циклоалифатическими или гетероциклическими кольцами, где радикал или точка крепления расположены в гетероароматическом кольце. Неограничивающие примеры включают индолил, изоиндолил, бензотиенил, бензофуранил, дибензофуранил, индазолил, бензимидазолил, бензотиазолил, хинолил, изохинолил, циннолинил, фталазинил, хиназолинил, хиноксалинил, 4H-хинолизинил, карбазолил, акридинил, феназинил, фенотиазинил, феноксазинил, тетрагидрохинолинил, тетрагидроизохинолинил и пиридо-[2,3-b]-1,4-оксазин-3(4H)-он. Гетероарильная группа может быть моно- или бициклической. Термин "гетероарил" может использоваться наравне с терминами "гетероарильное кольцо", "гетероарильная группа", или "гетероароматический", все эти термины включают кольца, которые возможно замещены. Термин "гетероаралкил" относится к алкильной группе, замещенной гетероарилом, при этом алкильный и гетероарильный фрагменты независимо и возможно замещены.
[0024] В настоящем описании термины "гетероцикл", "гетероциклил", "гетероциклический радикал" и "гетероциклическое кольцо" взаимозаменяемы и относятся к стабильным 5-7-членным моноциклическим или 7-10-членным бициклическим гетероциклическим фрагментам, насыщенным или частично ненасыщенным, и включающим помимо атомов углерода один или несколько и, предпочтительно, 1-4 гетероатома, как определено выше. Термин "азот" при использовании в отношении атома, входящего в состав кольца гетероцикла, включает замещенный азот. Например, в насыщенном или частично ненасыщенном кольце, включающем 0-3 гетероатома, выбранных из кислорода, серы или азота, азот может быть в форме N (как в 3,4-дигидро-2H-пирролиле) или -NH (как в пирролидиниле) или +NR (как в N-замещенных пирролидинилах).
[0025] Гетероциклическое кольцо может присоединяться к боковой группе любого гетероатома или атома углерода, что приводит к формированию стабильной структуры; и любой атом кольца может быть возможно замещен. Примеры таких насыщенных или частично ненасыщенных гетероциклических радикалов включают, но не ограничиваются ими, тетрагидрофуранил, тетрагидротиофенил пирролидинил, пиперидинил, пирролинил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, оксазолидинил, пиперазинил, диоксанил, диоксоланил, диазепинил, оксазепинил, тиазепинил, морфолинил и хинуклидинил. Термины "гетероцикл", "гетероциклил", "гетероциклильное кольцо", "гетероциклическая группа", "гетероциклический фрагмент" и "гетероциклический радикал" являются взаимозаменяемыми в настоящем описании, и включают также группы, в которых гетероциклильное кольцо соединено с одним или несколькими арильными, гетероарильными или циклоалифатическими кольцами, такими как индолинильной, 3H-индолильной, хроманильное, фенантридинильное или тетрагидрохинолинильное, при этом радикал или точка крепления расположены в гетероциклильном кольце. Гетероциклильные группы могут быть моно- или бициклическими. Термин "гетероциклилалкил" относится к алкильной группе, замещенной гетероциклилом, в которой алкильный и гетероциклильный фрагменты независимо и возможно замещены.
[0026] В настоящем описании термин "частично ненасыщенный" относится к кольцевым фрагментам, которые содержат по крайней мере одну двойную или тройную связь. Термин "частично ненасыщенный" охватывает кольцевые структуры, имеющие несколько ненасыщенных участков, но не включает арильные или гетероарильные фрагменты в том смысле, в котором они определены здесь.
[0027] В настоящем описании соединения согласно настоящему изобретению могут содержать «возможно замещенные» фрагменты. В целом, термин «замещенный», предварен он термином «возможно» или нет, означает, что один или несколько атомов водорода указанного фрагмента замещены подходящим заместителем. Если не указано иное, «возможно замещенная» группа может быть многократно замещена подходящими группами в каждой из возможных для замещения позиций; при этом, если замещение возможно более чем в одной позиции, и существует несколько подходящих заместителей, выбранных из определенной группы, то эти заместители могут быть как одинаковыми, так и разными. Настоящим изобретением предусмотрены комбинации заместителей, предпочтительно приводящие к формированию стабильных или химически реализуемых соединений. Термин «стабильный», используемый в настоящем описании, относится к соединениям, которые не претерпевают существенных изменений в условиях, необходимых для их производства, определения и, в некоторых вариантах осуществления, их восстановления, очистки и использования с одной или несколькими описанными здесь целями.
[0028] Подходящие моновалентные заместители у атома углерода "возможно замещенной" группы независимо представляют собой галоген, -(CH2)0-4R○; -(CH2)0-4OR○; -O(CH2)0-4R○, -O-(CH2)0-4C(O)OR○; -(CH2)0-4CH(OR○)2; -(CH2)0-4SR○; -(CH2)0-4Ph, который может быть замещен R°; -(CH2)0-4O(CH2)0-1Ph, который может быть замещен R°; -CH=CHPh, который может быть замещен R○; -(CH2)0-4O(CH2)0-1-пиридил, который может быть замещен R○; -NO2; -CN; -N3; -(CH2)0-4N(R○)2; -(CH2)0-4N(R○)C(O)R○; -N(R○)C(S)R○; -(CH2)0-4N(R○)C(O)NR○2; -N(R○)C(S)NR○2; -(CH2)0-4N(R○)C(O)OR○; -N(R○)N(R○)C(O)R○; -N(R○)N(R○)C(O)NR○2; -N(R○)N(R○)C(O)OR○; -(CH2)0-4C(O)R○; -C(S)R○; -(CH2)0-4C(O)OR○; -(CH2)0-4C(O)SR○; -(CH2)0-4C(O)OSiR○3; -(CH2)0-4OC(O)R○; -OC(O)(CH2)0-4SR○, SC(S)SR○; -(CH2)0-4SC(O)R○; -(CH2)0-4C(O)NR○2; -C(S)NR○2; -C(S)SR○; -SC(S)SR○, -(CH2)0-4OC(O)NR○2; -C(O)N(OR○)R○; -C(O)C(O)R○; -C(O)CH2C(O)R○; -C(NOR○)R○; -(CH2)0-4SSR○; -(CH2)0-4S(O)2R○; -(CH2)0-4S(O)2OR○; -(CH2)0-4OS(O)2R○; -S(O)2NR○2; -(CH2)0-4S(O)R○; -N(R○)S(O)2NR○2; -N(R○)S(O)2R○; -N(OR○)R○; -C(NH)NR○2; -P(O)2R○; -P(O)R○2; -OP(O)R○2; -OP(O)(OR○)2; SiR○3; -(C1-4 линейный или разветвленный алкилен) O-N(R○)2; или -(C1-4 линейный или разветвленный алкилен) C(O)O-N(R○)2, где каждый R° может быть замещен, как описано ниже, и независимо представляет собой водород, C1-6 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph, -CH2-(5-6-членное гетероарильное кольцо) или 5-6-членным насыщенное, частично ненасыщенное, или арильное кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы; или, несмотря на определение, данное выше, два независимых R○ вместе с промежуточным(и) атомом(ами) образуют 3-12-членное насыщенное, частично ненасыщенное или арильное моно- или бициклическое кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы, которые могут быть замещены, как описано ниже.
[0029] Подходящие моновалентные заместители R○ (либо кольца, образованного двумя независимыми R○ вместе с промежуточными атомами), независимо представляют собой галоген, -(CH2)0-2R•, -(галоR•), -(CH2)0-2OH, -(CH2)0-2OR•, -(CH2)0-2CH)(OR•)2; -O(галоR•), -CN, -N3, -(CH2)0-2C(O)R•, -(CH2)0-2C(O)OH, -(CH2)0-2C(O)OR•, -(CH2)0-2SR•, -(CH2)0-2SH, -(CH2)0-2NH2, -(CH2)0-2NHR•, -(CH2)0-2NR•2, -NO2, -SiR•3, -OSiR•3, -C(O)SR•, -(C1-4 линейный или разветвленный алкилен)C(O)R• или -SSR•, где каждый R• не замещен либо в случае уточнения приставкой "гало-" замещен одним или несколькими атомами галогена и независимо выбран из C1-4 алифатической группы, -CH2Ph, -O(CH2)0-1Ph или 5-6-членного насыщенного, частичного ненасыщенного или арильного кольца с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы. Подходящие бивалентные заместители R○ у насыщенного углерода включают =O и =S.
[0030] Подходящие бивалентные заместители у насыщенного атома углерода «возможно замещенной» группы включают следующие: =O, =S, =NNR*2, =NNHC(O)R*, =NNHC(O)OR*, =NNHS(O)2R*, =NR*, =NOR*, -O(C(R*2))2-3O- или -S(C(R*2))2-3S-, где R* в каждом случае независимо выбран из водорода, C1-6 алифатической группы, которая может быть замещена, как описано ниже, или незамещенным 5-6-членным насыщенным, частично ненасыщенным или арильным кольцом с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы. Подходящие бивалентные заместители, способные связываться с соседними заменяемыми атомами углерода «возможно замещенной» группывключают -O(CR*2)2-3O-, где R* в каждом случае независимо выбран из водорода, C1-6 алифатической группы, которая может быть замещена, как описано ниже, или незамещенного 5-6-членного насыщенного, частично ненасыщенного или арильного кольца с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы.
[0031] Подходящие заместители алифатической группы R* включают галогены, -R•. -(галоR•), -OH, -OR•, -O(галоR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• является незамещенной группой либо в случае уточнения приставкой «гало-» замещен только одним или несколькими атомами галогена, и независимо представляет собой C1-4 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы.
[0032] Подходящие заместители у заменяемого азота в "возможно замещенной" группе включают -R†, -NR†2, -C(O)R†, -C(O)OR†, -C(O)C(O)R†, -C(O)CH2C(O)R†, -S(O)2R†, -S(O2)NR†2, -C(S)NR†2, -C(NH)NR†2, или -N(R†)S(O)2R†, где каждый R† независимо представляет собой водород, C1-6 алифатическую группу, которая может быть замещена, как описано ниже; незамещенный -OPh или незамещенное 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы; либо, несмотря на данное выше определение, два независимых R† вместе с промежуточным(и) атомом(ами) образуют незамещенное 3-12-членное насыщенное, частично ненасыщенное или арильное моно-или бициклическое кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы.
[0033] Подходящие заместители алифатической группы R† независимо представляют собой галоген, -R•, -(галоR•), -OH, -OR•, -O(галоR•), -CN, -C(O)OH, -C(O)OR•, -NH2, -NHR•, -NR•2 или -NO2, где каждый R• является незамещенным или в случае уточнения приставкой "гало" замещен только одним или несколькими атомами галогена и независимо представляет собой C1-4 алифатическую группу, -CH2Ph, -O(CH2)0-1Ph или 5-6-членное насыщенное, частично ненасыщенное или арильное кольцо с 0-4 гетероатомами, независимо выбранными из азота, кислорода или серы.
[0034] В настоящем описании термин "фармацевтически приемлемая соль" относится к тем солям, которые по результатам тщательного медицинского исследования могут быть использованы в контакте с тканями человека и животных, не проявляя неспецифическую токсичность, не вызывая раздражение, аллергические реакции и т.п., риск от использования которых соизмерим с ожидаемой пользой. Фармацевтически приемлемые соли хорошо известны в данной области. Например, фармацевтически приемлемые соли подробно описаны в работе S.M. Berge et al. J. Pharmaceutical Sciences, 1977, 66, 1-19, включенный в настоящее описание посредством ссылки. Фармацевтически приемлемые соли соединений согласно настоящему изобретению включают соли, полученные из соответствующих неорганических и органических кислот и оснований. Примерами фармацевтически приемлемых, нетоксичных кислотно-аддитивных солей являются соли аминов и неорганических кислот, таких как соляная, бромистоводородная, фосфорная, серная и хлорная кислоты; или органических кислот, таких как уксусная, щавелевая, малеиновая, винная, лимонная, янтарная или малоновая кислоты; или соли, полученные с помощью других методов, используемых в данной области, например, ионного обмена. Другие фармацевтически приемлемые соли включают адипинат, альгинат, аскорбат, аспартат, бензолсульфонат, бензоат, бисульфат, борат, бутират, камфорат, камфорсульфонат, цитрат, циклопентанпропионат, диглюконат, додецилсульфат, этансульфонат, формиат, фумарат, глюкогептонат, глицерофосфат, глюконат, гемисульфат, гептаноат, гексаноат, гидроиодид, 2-гидрокси-этансульфонат, лактобионат, лактат, лаурат, лаурилсульфат, малат, малеат, малонат, метансульфонат, 2-нафталинсульфонат, никотинат, нитрат, олеат, оксалат, пальмитат, памоат, пектинат, персульфат, 3-фенилпропионат, фосфат, пивалат, пропионат, стеарат, сукцинат, сульфат, тартрат, тиоцианат, p-толуолсульфонат, ундеканоат, валерат и т.п.
[0035] Соли, полученные из соответствующих оснований, включают соли щелочных металлов, щелочноземельных металлов, аммонийные соли и N+(C1-4алкил)4-соли. Типичные соли щелочных или щелочноземельных металлов включают натриевые, литиевые, калиевые, кальциевые, магниевые соли и т.п. Также фармацевтически приемлемые соли включают, когда это целесообразно, нетоксичные аммонийные соли, четвертичные соли аммония и соли аминовых катионов, получаемые с использованием таких противоионов, как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, сульфонат низшего алкила и арилсульфонат.
[0036] Если не указано иное, описанные в настоящем документе структуры включают также все изомерные формы данных структур (такие как энантиомеры, диастереомеры и геометрические (конформационные) изомеры); например, R и S конфигурации для каждого асимметрический центр, Z и E изомеры положения двойной связи, Z и E конформационные изомеры. Таким образом, настоящее изобретение включает как простые стереоизомеры, так и энантиомеры, диастереомеры и геометрические (конформационные) изомеры соединений согласно настоящему изобретению в различных сочетаниях. Если не указано иное, настоящее изобретение также включает все таутомеры указанных соединений. Кроме того, если не указано иное, к структурам, приведенным в натсоящем описании, также относятся соединения, различающиеся только наличием одного или нескольких изотопно-обогащенных атомов. Например, соединения, имеющие описанную структуру и содержащие вмсето атома водорода дейтерий или тритий либо обогащенные 13C- или 14C-углеродом, также включены в настоящее изобретение. Такие соединения можно применять, например, в качестве аналитических инструментов, в качестве образцов для биологических исследований или в качестве терапевтических агентов в соответствии с настоящим изобретением. В некоторых вариантах осуществления группа R1 в формулах Ia и Ib включает один или несколько атомов дейтерия.
[0037] В настоящем описании термин "необратимый" или "необратимый ингибитор" относится к ингибитору (т.е. соединению), способному ковалентно связываться с целевой протеинкиназой по существу необратимо. Это означает, что в то время как обратимый ингибитор способен связываться (но, как правило, не способен к образованию ковалентной связи) с целевой протеинкиназой, и, следовательно, может в дальнейшем отделиться от целевой протеинкиназы, необратимый ингибитор после образования ковалентной связи с целевой протеинкиназой по существу остается по существу связанным с целевой протеинкиназой. Необратимые ингибиторы обычно демонстрируют временную зависимость, в соответствии с которой степень ингибирования возрастает при увеличении времени контакта ингибитора с ферментом. Методы выявления необратимых ингибиторов хорошо известны специалистам. Такие методы включают, но не ограничиваются ими, анализ ферментативной кинетики профиля ингибирования мишени протеинкиназы в присутствии соединения-ингибитора, масс-спектрометрическое исследование белка-мишени лекарственного средства, модифицированного в присутствии соединения-ингибитора, дискретная экспозиция, также известная как эксперименты с "промывкой", использование меченых соединений, таких как меченных радиоактивными изотопами ингибиторов, что позволяет детектировать ковалентную модификацию фермента, а также другие методы, известные специалистам в данной области.
[0038] Среднему специалисту будет очевидно, что определенные реакционноспособные функциональные группы могут выступать в качестве высокореакционноспособных групп. В настоящем описании термин «высокореакционноспособный» или «высокореакционноспособная группа» относится к функциональной группе, присутствующей в соединении согласно настоящему изобретению и способной ковалентно связываться с аминокислотным остатком (например, с остатками цистеина, лизина, гистидина или другими, способными к ковалентной модификации), присутствующими в связывающем кармане целевого белка, и способной тем самым необратимо ингибировать белок. Следует иметь в виду, что группа -L-Y, в том смысле, в каком она определена и описана в настоящем документе, включает такие «высокореакционноспособные группы» для ковалентного и необратимого ингибирования белка.
[0039] В настоящем описании термин "ингибитор" определяется как соединение, которое связывается с и/или ингибирует целевую протеинкиназу с достаточным сродством. В некоторых вариантах осуществления ингибитор имеет IC50 и/или константу связывания менее примерно 50 мкМ, менее примерно 1 мкМ, менее примерно 500 нМ, менее примерно 100 нМ, или менее примерно 10 нм.
[0040] Термины "достаточное сродство" и "значительно ингибирует", используемые в настоящем описании, означают регистрируемые изменения активности по крайней мере для одной из следующих киназ: ErbB1, ErbB1, ErbB3, ErbB4, TEC-киназы и/или янус-киназы JAK3 при сравнении образца, содержащего соединение согласно настоящему изобретению или его композицию и по крайней мере одну из перечисленных киназ: ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназу и/или янус-киназу JAK3, и эквивалентный образец, содержащий по крайней мере одну из перечисленных киназ: ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназу и/или янус-киназу JAK3 в отсутствии указанного соединения или его композиции.
3. Описание примеров соединений
[0041] Согласно одному аспекту настоящее изобретение обеспечивает соединение формулы I-a или I-b,


или его фармацевтически приемлемую соль, где:
Кольцо A представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы;
Кольцо B представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы;
R1 представляет собой -L-Y, где:
L представляет собой ковалентную связь или бивалентную C1-8 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно, два или три метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -NR-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2-, -SO2N(R)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO-, -SO2-, -C(=S)-, -C(=NR)-, -N=N- или -C(=N2)-;
Y представляет собой водород, C1-6 алифатическую группу, возможно замещенной оксогруппой, галогеном или CN, или 3-10-членное моноциклическое или бициклическое насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, и при этом указанное кольцо содержит в качестве заместителей 1-4 группы, независимо выбранных из -Q-Z, оксогруппы, NO2, галогена, CN или C1-6 алифатической группы, где:
Q представляет собой ковалентную связь или бивалентную C1-6 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -NR-, -S-, -O-, -С(O)-, -SO-, или -SO2-; и
Z представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном или CN;
Ry представляет собой водород, галоген, -CN, -CF3, C1-4 алифатическую группу, С1-4 галогеналифатическую группу, -OR, -C(O)R или -C(O)N(R)2;
каждая группа R независимо представляет собой водород или возможно замещенную группу, выбранную из следующих: C1-6 алифатическая группа, фенил, 4-7-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, и 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы;
W1 и W2 каждый независимо представляет собой ковалентную связь или бивалентную C1-3 алкиленовую цепь, причем одно метиленовое звего в W1 или W2 возможно заменено на -NR2-, -N(R2)C(O)-, -C(O)N(R2)-, -N(R2)SO2-, -SO2N(R2)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO- или -SO2-;
R2 представляет собой водород, возможно замещенную C1-6 алифатическую группу или -C(O)R, или:
R2 и заместитель в Кольце A, взятые вместе с разделяющими их атомами, образуют 4-6-членное частично ненасыщенное или ароматическое конденсированное кольцо;
или
R2 и Ry взятые вместе с разделяющими их атомами, образуют 4-6-членное насыщенное, частично ненасыщенное или ароматическое конденсированное кольцо;
m и p независимо равны 0-4; и
Rx и Rv независимо выбраны из –R, галогена, -OR, -O(CH2)qOR, -CN, -NO2, -SO2R, -SO2N(R)2, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)N(R)2, -NRSO2R или -N(R)2, или:
Rx и R1, если они одновременно присутствуют в Кольце В, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, -CN или C1-6 алифатической группы; или
Rv и R1 если они одновременно присутствуют в Кольце A, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, -CN или C1-6 алифатической группы.
[0042] Как определено в общем виде выше. Кольцо A представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы. В некоторых вариантах осуществления Кольцо A представляет собой возможно замещенную фенильную группу. В некоторых вариантах осуществления Кольцо A представляет собой возможно замещенное нафтильное кольцо или бициклическое 8-10 членное гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В некоторых других вариантах осуществления Кольцо A представляет собой возможно замещенное 3-7-членное карбоциклическое кольцо. В других вариантах осуществления Кольцо A представляет собой возможно замещенное 4-7-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы.
[0043] В некоторых вариантах осуществления Кольцо A замещено, как описано в настоящем тексте. В некоторых вариантах осуществления Кольцо A содержит в качестве заместителей одну, две или три группы, независимо выбранных из галогена, R○ или -(CH2)0-4OR○ или -O(CH2)0-4R○, где каждый R○ является таким, как определено в настоящем описании. Примеры заместителей в Кольце A включают Br, I, Cl, метил, -CF3, -C≡CH, -OCH2фенил, -OCH2(фторфенил) или -OCH2пиридил.
[0044] Примеры групп, представляющих собой Кольцо A, приведены в Таблице 1.
Таблица 1 (см. в конце описания)
[0045] В некоторых вариантах осуществления Кольцо А выбрано из i, ii, iv, v, vi, vii, ix, xiv, xvi, lii, lxiii, lxxi, lxxiv, lxxvi, lxxviii и lxxxi.
[0046] Как определено в общем виде выше, Кольцо В представляет собой возможно замещенную группу, выбранную из следующих: фенил, 3-7-членное насыщенное или частично ненасыщенное карбоциклическое кольцо, 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, 5-6-членное моноциклическое гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы, 4-7-членное насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, 7-10-членное бициклическое насыщенное или частично ненасыщенное гетероциклическое кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы, или 8-10 членное бициклическое гетероарильное кольцо, содержащее 1-5 гетероатомов, независимо выбранных из азота, кислорода или серы. В некоторых вариантах осуществления Кольцо В представляет собой возможно замещенную фенильную группу. В некоторых вариантах осуществления Кольцо В представляет собой возможно замещенное нафтильное кольцо или бициклическое 8-10-членное гетероарильное кольцо, содержащее 1-4 гетероатома, независимо выбранных из азота, кислорода или серы. В некоторых других вариантах осуществления Кольцо В представляет собой возможно замещенное 3-7-членное карбоциклическое кольцо. В других вариантах осуществления Кольцо B представляет собой возможно замещенное 4-7-членное гетероциклическое кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы.
[0047] В некоторых вариантах осуществления Кольцо B представляет собой фенил. В некоторых вариантах осуществления Кольцо В представляет собой 6-членное гетероарильное кольцо, содержащее 1-3 атома азота. В некоторых вариантах осуществления Кольцо В представляет собой 5-членное гетероарильное кольцо, содержащее 1 или 2 или 3 гетероатома, независимо выбранных из азота, кислорода или серы.
[0048] В некоторых вариантах осуществления Кольцо B представляет собой 5-6-членное насыщенное гетероциклическое кольцо, содержащее 1 атом азота. В некоторых вариантах осуществления Кольцо В представляет собой 9-10-членное бициклическое частично насыщенное гетероарильное кольцо, содержащее 1-3 атома азота. В некоторых вариантах осуществления Кольцо В представляет собой 9-10-членное бициклическое частично насыщенное гетероарильное кольцо, содержащее 1 атом азота. В некоторых вариантах осуществления Кольцо B представляет собой 9-10-членное бициклическое частично насыщенное гетероарильное кольцо, содержащее 1 атом азота 1 атом кислорода.
[0049] В некоторых вариантах осуществления Кольцо B представляет собой возможно замещенную группу, выбранную из следующих: фенил, пиридид, пиразинил, пиримидинил, имидазолил, пирролидинил, пиперидинил, индолинил, индазолил и изоиндолинил.
[0050] Примеры групп, представляющих собой Кольцо В, приведены в Таблице 2.
Таблица 2 (см. в конце описания)
[0051] В некоторых вариантах осуществления Кольцо В выбрано из i, ii. iii, iv, v, ix, x, xi, xiii, xvi, xvii, xix, xx, xxv, xxvi, xxxii, xxxiv, xxxv, xxxviii, xlii, xlvi, xlviii, l, lviii, lxiv, lxxviii, lxxxiii, lxxxvi, xciv, c, ci, cii, ciii, civ и cv.
[0052] В некоторых вариантах осуществления m в формуле I равно 1, 2, 3 или 4. В некоторых вариантах осуществления m равно 1. В других вариантах осуществления m равно 0.
[0053] В некоторых вариантах осуществления p в формуле I равно 1, 2, 3 или 4. В некоторых вариантах осуществления p равно 1. В других вариантах осуществления p равно 0.
[0054] Как определено в общем виде выше каждая группа Rx в формуле I независимо выбрана из -R, галогена, -OR, -O(CH2)qOR, -CN, -NO2, -SO2R, -SO2N(R)2, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)NR2, -NRSO2R или -N(R)2, причем q равно 1-4, или Rx и R1, если они одновременно присутствуют в Кольце B, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, CN или C1-6 алифатической группы.
[0055] В некоторых вариантах осуществления каждый Rx независимо выбран из -R, -OR, -O(CH2)qOR или галогена. В некоторых вариантах осуществления Rx представляет собой низший алкил, низший алкокси, низший алкоксиалкокси или галоген. Примеры групп Rx включают метил, метокси, метоксиэтокси и фтор. В некоторых вариантах осуществления Rx представляет собой водород.
[0056] Как определено в общем виде выше, каждая группа Rv в формуле I независимо выбрана из -R, галогена, -OR, -O(CH2)qOR, -CN, -NO2, -SO2R, -SO2N(R)2, -SOR, -C(O)R, -CO2R, -C(O)N(R)2, -NRC(O)R, -NRC(O)NR2, -NRSO2R или -N(R)2, причем q равно 1-4, или Rv и R1, если они одновременно присутствуют в Кольце A, взятые вместе с разделяющими их атомами, образуют 5-7-членное насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем указанное кольцо содержит в качестве заместителей высокореакционноспособную группу и 0-3 группы, независимо выбранных из оксогруппы, галогена, CN или C1-6 алифатической группы.
[0057] В некоторых вариантах осуществления Rv в каждом случае независимо выбран из -R, -OR, -O(CH2)qOR или галогена. В некоторых вариантах осуществления Rv представляет собой низший алкил, низший алкокси, низший алкоксиалкокси или галоген. Примеры групп Rv включают метил, метокси, трифторметил, метоксиэтокси и хлор. В некоторых вариантах осуществления Rv представляет собой водород.
[0058] В некоторых вариантах осуществления q равно 1, 2, 3 или 4. В некоторых вариантах осуществления q равно 1. В некоторых других вариантах осуществления q равно 2.
[0059] Как определено в общем виде выше, Ry представляет собой водород, галоген, -CN, -CF3, C1-4 алифатическую группу, C1-4 галогеналифатическую группу, -OR, -C(O)R или -C(O)N(R)2, причем R имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Ry представляет собой водород, галоген, -CN, -CF3, низший алкил или низший галоалкил, -C≡CR и циклопропил. В других вариантах осуществления Ry представляет собой -OR, -C(O)R или -C(O)N(R)2. В некоторых вариантах осуществления Ry представляет собой -OCH3. В некоторых других вариантах осуществления Ry представляет собой -C(O)CH3. В других вариантах осуществления Ry представляет собой -C(O)NHR. В некоторых вариантах осуществления Ry представляет собой водород. В некоторых вариантах осуществления Ry представляет собой фтор. В некоторых других вариантах осуществления Ry представляет собой метил.
[0060] Как определено в общем виде выше, W1 и W2 каждый независимо представляет собой ковалентную связь или бивалентную C1-3 алкиленовую цепь, причем одно метиленовое звено в W1 или W2 возможно заменено на -NR2-, -N(R2)C(O)-, -C(O)N(R2)-, -N(R2)SO2-, -SO2N(R2)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO- или -SO2-. В некоторых вариантах осуществления W1 и W2 одинаковы. В некоторых вариантах осуществления W1 и W2 различны.
[0061] В некоторых вариантах осуществления W1 представляет собой ковалентную связь. В некоторых вариантах осуществления W1 представляет собой бивалентную C1-3 алкиленовую цепь, причем одно метиленовое звено в W1 возможно заменено на -NR2-, -N(R2)C(O)-, -C(O)N(R2)-, -N(R2)SO2-, -SO2N(R2)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO- или -SO2-. В некоторых вариантах осуществления W1 представляет собой -C(=O), -NR2-, -S- или -O-. В некоторых вариантах осуществления W1 представляет собой -NR2-. В других вариантах осуществления W1 представляет собой -O-. В некоторых вариантах осуществления W1 представляет собой -NH-, -S- или -O-. В некоторых вариантах осуществления W1 представляет собой -CH2O-, -CH2S- или -CH2NH-. В некоторых аспектах W1 представляет собой -OCH2-, -SCH2-, -NHCH2- или -CH2CH2-.
[0062] В некоторых вариантах осуществления W2 представляет собой ковалентную связь. В некоторых вариантах осуществления W2 представляет собой бивалентную C1-3 алкиленовую цепь, причем одно метиленовое звено в W2 возможно заменено на -NR2-, -N(R2)C(O)-, -C(O)N(R2)-, -N(R2)SO2-, -SO2N(R2)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO- или -SO2-. В некоторых вариантах осуществления W2 представляет собой -C(=O), -NR2-, -S- или -O-. В некоторых вариантах осуществления W2 представляет собой -NR2-. В других вариантах осуществления W2 представляет собой -O-. В некоторых вариантах осуществления W2 представляет собой -NH-, -S- или -O-. В некоторых вариантах осуществления W2 представляет собой -CH2O-, -CH2S- или -CH2NH-. В некоторых аспектах W2 представляет собой -OCH2-, -SCH2-, -NHCH2- или -CH2CH2-.
[0063] В некоторых вариантах осуществления Кольцо B представляет собой фенил, и таким образом образует соединение формулы II-a или II-b:
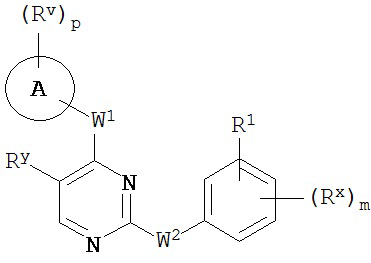
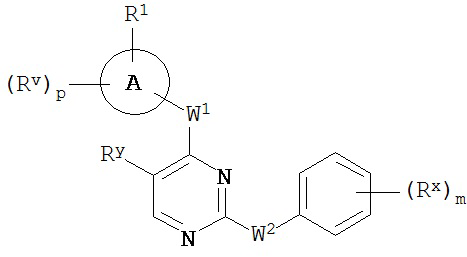
или его фармацевтически приемлемую соль, где каждое из Кольца A, m, p, Rx, Ry, Rv, W1, W2 и R1 имеют значения, определенные выше и описанные в классах и подклассах здесь и выше.
[0064] В некоторых вариантах осуществления Кольцо A представляет собой фенил, и таким образом образует соединение формулы III-a или III-b:
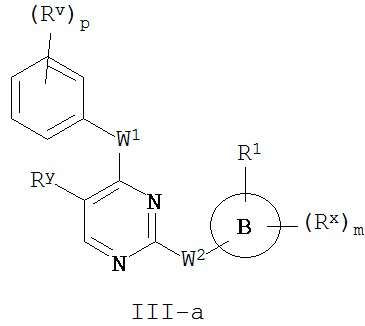
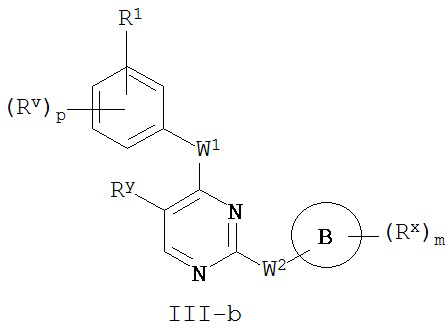
или его фармацевтически приемлемую соль, где каждый из Кольца B, m, p, Rx, Ry, Rv, W1, W2, и R1 имеют значения, определенные выше и описанные в классах и подклассах здесь и выше.
[0065] В некоторых вариантах осуществления Кольцо A представляет собой фенил, и Кольцо B представляет собой фенил, и таким образом образуют соединение формулы IV-a или IV-b:
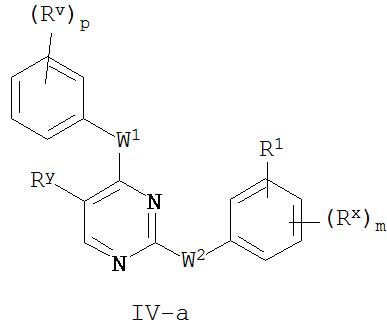
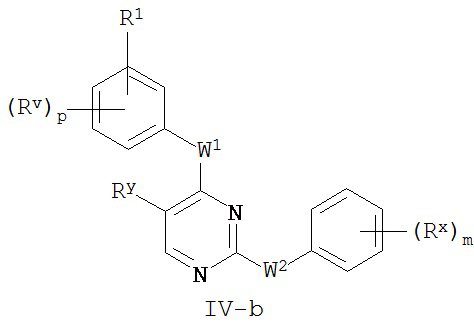
или его фармацевтически приемлемую соль, где каждый из m, p, Rx, Ry, Rv, W1, W2 и R1 имеют значения, определенные выше и описанные в классах и подклассах здесь и выше.
[0066] Как определено в общем виде выше, каждый R2 независимо представляет собой водород, возможно замещенную C1-6 алифатическую группу или -C(O)R, или R2 и заместитель в Кольце A, взятые вместе с разделяющими из атомами, образуют 4-6-членное частично ненасыщенное или ароматическое конденсированное кольцо, или R2 и Ry, взятые вместе с разделяющими их атомами, образуют 4-6-членное насыщенное, частично ненасыщенное или ароматическое конденсированное кольцо. Согласно одному аспекту R2 представляет собой водород. Согласно другому аспекту R2 представляет собой -C(O)R, причем R представляет собой возможно замещенную C1-6 алифатическую группу.
[0067] Согласно некоторым аспектам R2 и заместитель в Кольце A, взятые вместе с разделяющими их атомами, образуют 4-7-членное насыщенное или частично ненасыщенное кольцо, и таким образом образуют соединение формулы I-a-i или I-b-i:
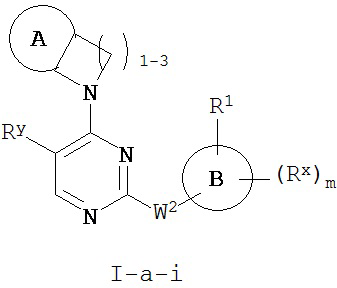
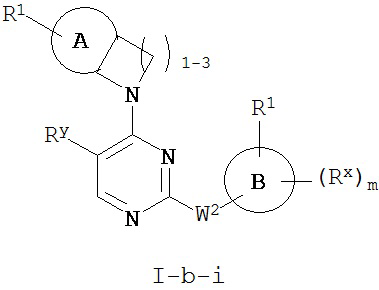
или его фармацевтически приемлемую соль, где каждый из A, R1, Rx и m имеют значения, определенные выше и описанные в классах и подклассах здесь и выше.
[0068] По аналогии с образованием соединений формул I-a-i и I-b-i, указанных выше, для специалиста в данной области будет очевидно, что соединения формул II-a, II-b, III-а, III-b, IV-a и IV-b образуют соответствующие соединения II-a-i, II-b-i, III-a-i, III-b-i, IV-a-i и IV-b-i, когда R2 и заместитель в Кольце A, взятые вместе с разделяющими их атомами, образуют 4-7-членное насыщенное или частично ненасыщенное кольцо.
[0069] Согласно некоторым аспектам R2 и Ry, взятые вместе с разделяющими их атомами, образуют 4-7-членное частично ненасыщенное кольцо, и таким образом образуют соединение формулы I-a-ii или I-b-ii:
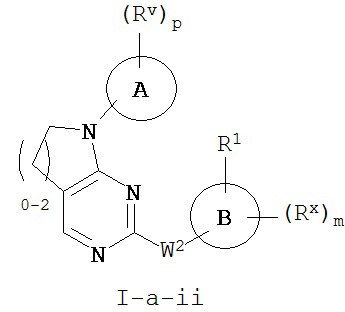
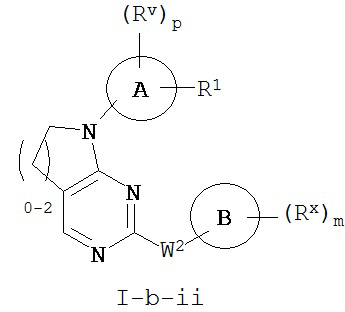
или его фармацевтически приемлемую соль, где каждый из Кольца A, R1, Rx и m имеют значения, определенные выше и описанные в классах и подклассах здесь и выше.
[0070] По аналогии с образованием соединений формул I-a-ii и I-b-ii, описанных выше, для специалиста в данной области будет очевидно, что соединения формул II-a, II-b, III-a, III-b, IV-a и IV-b образуют соответствующие соединения формул II-a-ii, II-b-ii, III-a-ii, III-b-ii, IV-a-ii и IV-b-ii в случаях, когда R2 и Ry, взятые вместе с разделяющими их атомами, образуют 4-7-членное частично ненасыщенное кольцо.
[0071] Как определено в общем виде выше, группа R1 в формулах I и II представляет собой -L-Y, где:
L представляет собой ковалентную связь или бивалентную C1-8 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно, два или три метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -NR-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2-, -SO2N(R)-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -S-, -SO-, -SO2-, -C(=S)-, -C(=NR)-, -N=N- или -C(=N2)-;
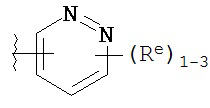
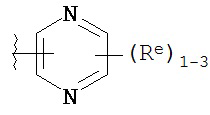
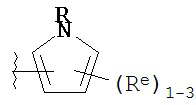
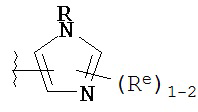
Y представляет собой водород, C1-6 алифатическую группу, замещенную оксогруппой, галогеном, NO2 или CN, или 3-10-членное моноциклическое или бициклическое, насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, и при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re; и
каждая группа Re независимо выбрана из -Q-Z, оксогруппы, NO2, галогена, CN, подходящей уходящей группы или C1-6 алифатической группы, возможно замещенной оксогруппой, галогеном, NO2 или CN, где:
Q представляет собой ковалентную связь или бивалентную C1-6 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -N(R)-, -S-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -SO- или -SO2-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2- или -SO2N(R)-; и
Z представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN.
[0072] В некоторых вариантах осуществления L представляет собой ковалентную связь.
[0073] В некоторых вариантах осуществления L представляет собой бивалентную C1-8 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь. В некоторых вариантах осуществления L представляет собой -CH2-.
[0074] В некоторых вариантах осуществления L представляет собой ковалентную связь, -СН2-, -NH-, -CH2NH-, -NHCH2-, -NHC(O)-, -NHC(O)CH2OC(O)-, -CH2NHC(O)-, -NHSO2-, -NHSO2CH2-, -NHC(O)CH2OC(O) или -SO2NH-.
[0075] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и один или два дополнительных метиленовых звена L возможно и независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, -C(O)O-, циклопропиленовую группу, -O-, -N(R)- или -C(O)-.
[0076] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -C(O)O-, и один или два дополнительных метиленовых звена L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-.
[0077] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-.
[0078] Как описано выше, в некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь. Среднему специалисту будет очевидно, что такая двойная связь может существовать в углеводородном каркасе или может быть "экзо" по отношению к каркасной цепи, что приводит к образованию алкилиденовой группы. Например, такая группа L, содержащая разветвленную алкилиденовую цепь, включает -CH2C(=CH2)CH2-. Соответственно, в некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь в составе алкилиденила. Примеры групп L включают -NHC(O)C(=CH2)CH2-.
[0079] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-. В некоторых вариантах осуществления L представляет собой -C(O)CH=CH(CH3)-, -C(O)CH=CHCH2NH(CH3)-, -C(O)CH=CH(CH3)-, -C(O)CH=CH-, -CH2C(O)CH=CH-, -CH2C(O)CH=CH(CH3)-, -CH2CH2C(O)CH=CH-, -CH2CH2C(O)CH=CHCH2-, CH2CH2C(O)CH=CHCH2NH(CH3)- или -CH2CH2C(O)CH=CH(CH3)- или CH(CH3)OC(O)CH=CH-.
[0080] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -OC(O)-.
[0081] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O), или -C(O)O-, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-. В некоторых вариантах осуществления L представляет собой -CH2OC(O)CH=CHCH2-, -CH2-OC(O)CH=CH- или -CH(CH=CH2)OC(O)CH=CH-.
[0082] В некоторых вариантах осуществления L представляет собой -NRC(O)CH=CH-, -NRC(O)CH=CHCH2N(CH3)-, -NRC(O)CH=CHCH2O-, -CH2NRC(O)CH=CH-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)(C=N2)C(O)-, -NRC(O)CH=CHCH2N(CH3)-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)CH=CHCH2O-, -NRC(O)C(=CH2)CH2-, -CH2NRC(O)-, -CH2NRC(O)CH=CH-, -CH2CH2NRC(O)- или -CH2NRC(O)циклопропилен-, причем каждый R независимо представляет собой водород или возможно замещенную C1-6 алифатическую группу.
[0083] В некоторых вариантах осуществления L представляет собой -NHC(O)CH=CH-, -NHC(O)CH=CHCH2N(CH3)-, -NHC(O)CH=CHCH2O-, -CH2NHC(O)CH=CH-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)(C=N2)C(O)-, -NHC(O)CH=CHCH2N(CH3)-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)CH=CHCH2O-, -NHC(O)C(=CH2)CH2-, -CH2NHC(O)-, -CH2NHC(O)CH=CH-, -CH2CH2NHC(O)- или -CH2NHC(O)циклопропилен-.
[0084] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну тройную связь. В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну тройную связь, и одно или два дополнительных метиленовых звена в L возможно и независимо замещены на -NRC(O)-, -C(O)NR-, -S-, -S(O)-, -SO2-, -C(=S)-, -C(=NR)-, -O-, -N(R)- или -C(O)-. В некоторых вариантах осуществления L содержит по меньшей мере одну тройную связь, и по меньшей мере одно метиленовое звено в L заменено на -N(R)-, -N(R)C(O)-, -C(O)-, -C(O)O- или -OC(O)- или -O-.
[0085] Примеры групп L включают -C≡С-, -C≡CCH2(изопропил)-, -NHC(O)C≡CCH2CH2-, -СН2-C≡C-CH2-, -C≡CCH2O-, -CH2C(O)C≡C-, -C(O)C≡C- или -CH2OC(=O)C≡C-.
[0086] В некоторых вариантах осуществления L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем одно метиленовое звено в L заменено циклопропиленовой группой, и одно или два дополнительных метиленовых звена в L независимо замещены на -C(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2- или -SO2N(R)-. Примеры групп L включают -NHC(O)-циклопропилен -SO2- и -NHC(O)-циклопропилен-.
[0087] Как определено в общем виде выше, Y представляет собой водород, C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN, или 3-10-членное моноциклическое или бициклическое насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, и при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re независимо выбрана из -Q-Z, оксогруппы, NO2, галогена, CN, подходящей уходящей группы или C1-6 алифатической группы, причем Q представляет собой ковалентную связь или бивалентную C1-6 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -N(R)-, -S-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -SO- или -SO2-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2- или -SO2N(R)-; и Z представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN.
[0088] В некоторых вариантах осуществления Y представляет собой водород.
[0089] В некоторых вариантах осуществления Y представляет собой C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN. В некоторых вариантах осуществления Y представляет собой C2-6 алкенил, возможно замещенный оксогруппой, галогеном, NO2 или CN. В других вариантах осуществления Y представляет собой C2-6 алкинил, возможно замещенный оксогруппой, галогеном, NO2 или CN. В некоторых вариантах осуществления Y представляет собой C2-6 алкенил. В других вариантах осуществления Y представляет собой C2-4 алкинил.
[0090] В других вариантах осуществления Y представляет собой C1-6 алкил, замещенный оксогруппой, галогеном, NO2 или CN. Такие группы Y включают -CH2F, -CH2Cl, -CH2CN и -CH2NO2.
[0091] В некоторых вариантах осуществления Y представляет собой насыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, причем Y содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте.
[0092] В некоторых вариантах осуществления Y представляет собой насыщенное 3-4-членное гетероциклическое кольцо, содержащее 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. Примерами таких колец являются эпоксидное и оксетановое кольца, где каждое кольцо замещено 1-2 группами Re, причем каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте.
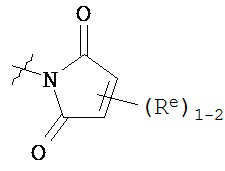
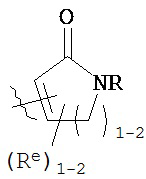
[0093] В других вариантах осуществления Y представляет собой насыщенное 5-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. Такие кольца включают пиперидин и пирролидин, где каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой  ,
,  или
или  , причем каждый из R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте.
, причем каждый из R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте.
[0094] В некоторых вариантах осуществления Y представляет собой насыщенное 3-6-членное карбоциклическое кольцо, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой циклопропил, циклобутил, циклопентил или циклогексил, где каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой 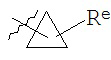 , где Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой циклопропил, возможно замещенный галогеном, CN или NO2.
, где Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой циклопропил, возможно замещенный галогеном, CN или NO2.
[0095] В некоторых вариантах осуществления Y представляет собой частично ненасыщенное 3-6-членное моноциклическое кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте.
[0096] В некоторых вариантах осуществления Y представляет собой частично ненасыщенное 3-6-членное карбоциклическое кольцо, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой циклопропенил, циклобутенил, циклопентенил или циклогексенил, причем каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой 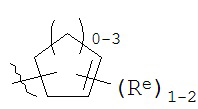 , причем каждый Re имеет значение, определенное выше и описанное в настоящем тексте.
, причем каждый Re имеет значение, определенное выше и описанное в настоящем тексте.
[0097] В некоторых вариантах осуществления Y представляет собой частично ненасыщенное 4-6-членное гетероциклическое кольцо, содержащее 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y выбран из:

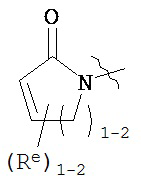
причем каждый Re и Re имеют значения, определенные выше и описанные в настоящем тексте.
[0098] В некоторых вариантах осуществления Y представляет собой 6-членное ароматическое кольцо, содержащее 0-2 атома азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой фенил, пиридил или пиримидинил, причем каждое кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте.
[0099] В некоторых вариантах осуществления Y выбран из:
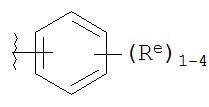
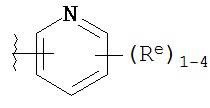
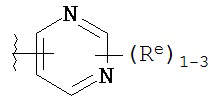
 ,
,
где каждый Re имеет значение, определенное выше и описанное в настоящем тексте.
[00100] В других вариантах осуществления Y представляет собой 5-членное гетероарильное кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y представляет собой 5-членное частично ненасыщенное или арильное кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода и серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы R®, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. Примерами таких колец являются изоксазолил, оксазолил, тиазолил, имидазолил, пиразолил, пирролил, фуранил, тиенил, тиазол, тиадиазол и оксадиазол, причем каждое кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. В некоторых вариантах осуществления Y выбран из:
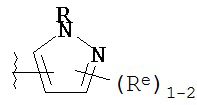
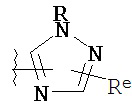
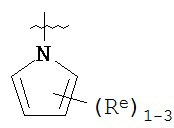
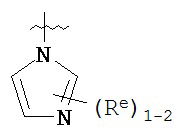
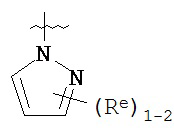
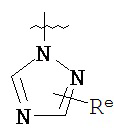
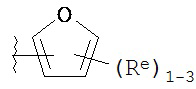
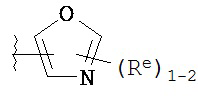
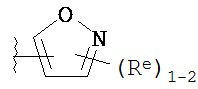
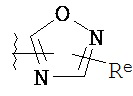
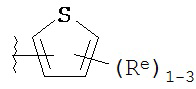
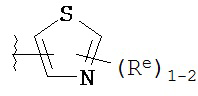
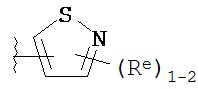
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте.
[00101] В некоторых вариантах осуществления Y представляет собой 8-10-членное бициклическое насыщенное, частично ненасыщенное или арильное кольцо, содержащее 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где Re имеет значение, определенное выше и описанное в настоящем тексте. Согласно другому аспекту Y представляет собой 9-10-членное бициклическое, частично ненасыщенное или арильное кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, причем каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте. Примеры таких бициклических колец включают 2,3-дигидробензо[d]изотиазол, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, причем Re имеет значение, определенное выше и описанное в настоящем тексте.
[00102] Как определено в общем виде выше, каждая группа Re независимо выбрана из -Q-Z, оксогруппы, NO2, галогена, CN, подходящей уходящей группы или C1-6 алифатической группы, возможно замещенной оксогруппой, галогеном, NO2 или CN, где Q представляет собой ковалентную связь или бивалентную C1-6 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -N(R)-, -S-, -O-, -C(O)-, -OC(O)-, -C(O)O-, -SO- или -SO2-, -N(R)C(O)-, -C(O)N(R)-, -N(R)SO2- или -SO2N(R)-; и Z представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN.
[00103] В некоторых вариантах осуществления Re представляет собой C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN. В других вариантах осуществления Re представляет собой оксогруппу, NO2, галоген или CN.
[00104] В некоторых вариантах осуществления Re представляет собой -Q-Z, где Q представляет собой ковалентную связь, и Z представляет собой водород (т.е., Re представляет собой водород). В других вариантах осуществления Re представляет собой -Q-Z, где Q представляет собой бивалентную C1-6 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -NR-, -NRC(O)-, -C(O)NR-, -S-, -O-, -C(O)-, -SO- или -SO2-. В других вариантах осуществления Q представляет собой бивалентную C2-6 линейную или разветвленную углеводородную цепь, содержащую по меньшей мере одну двойную связь, причем одно или два метиленовых звена в Q возможно и независимо замещены на -NR-, -NRC(O)-, -C(O)NR-, -S-, -O-, -C(O)-, -SO- или -SO2-. В некоторых вариантах осуществления группа Z группы Re представляет собой водород. В некоторых вариантах осуществления -Q-Z представляет собой -NHC(O)CH=CH2 или -C(O)CH=CH2.
[00105] В некоторых вариантах осуществления каждый Re независимо выбран из оксогруппы, NO2, CN, фтора, хлора, -NHC(O)CH=CH2, -C(O)CH=CH2, -CH2CH=CH2, -C≡CH, -C(O)OCH2Cl, -C(O)OCH2F, -C(O)OCH2CN, -C(O)CH2Cl, -C(O)CH2F, -C(O)CH2CN или -CH2C(O)CH3.
[00106] В некоторых вариантах осуществления Re представляет собой подходящую уходящую группу, т.е. группу, способную к нуклеофильному замещению. "Подходящая уходящая" группа представляет собой химическую группу, легко замещаемую желаемой входящей химической группой, такой как тиоловая группа представляющего интерес цистеина. Подходящие уходящие группы хорошо известны в данной области техники, см., например, "Advanced Organic Chemistry," Jerry March, 5th Ed., pp.351-357, John Wiley и Sons, N.Y. Такие уходящие группы включают, но не ограничиваются перечисленными, галоген, алкокси, сульфонилокси, возможно замещенный алкилсульфонилокси, возможно замещенный алкенилсульфонилокси, возможно замещенный арилсульфонилокси, ацил и диазониевую группы. Примеры подходящих уходящих групп включают хлор, иод, бром, фтор, ацетокси, метансульфонилокси (мезилокси), тозилокси, трифлилокси, нитро-фенилсульфонилокси (нозилокси) и бром-фенилсульфонилокси (брозилокси).
[00107] В некоторых вариантах осуществления реализуются следующие варианты осуществления и комбинации -L-Y:
(a) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-, -C(O)O-, циклопропиленовую группу, -O-, -N(R)- или -C(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(b) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -C(O)O-, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(c) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(d) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(e) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь, и по меньшей мере одно метиленовое звено в L заменено на -OC(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(f) L представляет собой -NRC(O)CH=CH-, -NRC(O)CH=CHCH2N(CH3)-, -NRC(O)CH=CHCH2O-, -CH2NRC(O)CH=CH-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)(C=N2)-, -NRC(O)(C=N2)C(O)-, -NRC(O)CH=CHCH2N(CH3)-, -NRSO2CH=CH-, -NRSO2CH=CHCH2-, -NRC(O)CH=CHCH2O-, -NRC(O)C(=CH2)CH2-, -CH2NRC(O)-, -CH2NRC(O)CH=CH-, -CH2CH2NRC(O)- или -CH2NRC(O)циклопропилен-, где R представляет собой H или возможно замещенную C1-6 алифатическую группу; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(g) L представляет собой -NHC(O)CH=CH-, -NHC(O)CH=CHCH2N(CH3)-, -NHC(O)CH=CHCH2O-, -CH2NHC(O)CH=CH-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)(C=N2)-, -NHC(O)(C=N2)C(O)-, -NHC(O)CH=CHCH2N(CH3)-, -NHSO2CH=CH-, -NHSO2CH=CHCH2-, -NHC(O)CH=CHCH2O-, -NHC(O)C(=CH2)CH2-, -CH2NHC(O)-, -CH2NHC(O)CH=CH-, -CH2CH2NHC(O)- или -CH2NHC(O)циклопропилен-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(h) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну двойную связь в составе алкилиденила, и по меньшей мере одно метиленовое звено в L заменено на -C(O)-, -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -C(O)O-, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на циклопропиленовую группу, -O-, -N(R)- или -C(O)-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(i) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем L содержит по меньшей мере одну тройную связь, и один или два дополнительных метиленовых звена в L возможно и независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)-или -C(O)O-, и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(j) L представляет собой C≡С-, -C≡CCH2(изопропил)-, -NHC(O)C≡CCH2CH2-. -СН2-C≡C-CH2-, -C≡CCH2O-, -CH2C(O)C≡C-, -C(O)C≡C- или -CH2OC(=O)C≡C-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(k) L представляет собой бивалентную C2-8 линейную или разветвленную углеводородную цепь, причем одно метиленовое звено в L заменено циклопропиленовой группой, и одно или два дополнительных метиленовых звена в L независимо замещены на -NRC(O)-, -C(O)NR-, -N(R)SO2-, -SO2N(R)-, -S-, -S(O)-, -SO2-, -OC(O)- или -C(O)O-; и Y представляет собой водород или C1-6 алифатическую группу, возможно замещенную оксогруппой, галогеном, NO2 или CN; или
(l) L представляет собой ковалентную связь, и Y выбран из:
(i) C1-6 алкила, замещенного оксогруппой, галогеном, NO2 или CN;
(ii) C2-6 алкенила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iii) C2-6 алкинила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(v) насыщенного 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vi)  ,
,  или
или  , где каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
, где каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(vii) насыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(viii) частично ненасыщенного 3-6-членного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(ix) частично ненасыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(x)  , где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xi) частично ненасыщенного 4-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xii) 

 или
или 
причем каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, причем указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xiv) 



 ,
,
где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xv) 5-членное гетероарильное кольцо, содержащее 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xvi) 









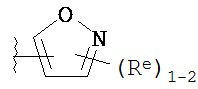

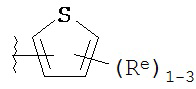
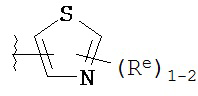
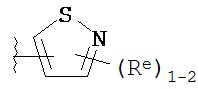
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xvii) 8-10-членного бициклического насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re причем Re имеет значение, определенное выше и описанное в настоящем тексте;
(m) L представляет собой -C(O)-, и Y выбран из:
(i) C1-6 алкила, замещенного оксогруппой, галогеном, NO2 или CN; или
(ii) C2-6 алкенила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iii) C2-6 алкинила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(v) насыщенного 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vi) 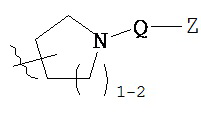 ,
,  , или
, или  , причем каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
, причем каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(vii) насыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(viii) частично ненасыщенного 3-6-членного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(ix) частично ненасыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(x)  , где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xi) частично ненасыщенного 4-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xii)  ,
,  ,
,  или
или  ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xiv) 



 ,
,
где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xv) 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xvi) 









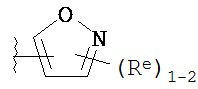

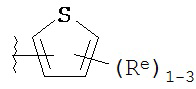
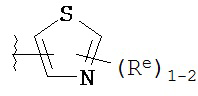
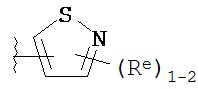
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xvii) 8-10-членного бициклического насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где Re имеет значение, определенное выше и описанное в настоящем тексте;
(n) L представляет собой -N(R)C(O)-, и Y выбран из:
(i) C1-6 алкила, замещенного оксогруппой, галогеном, NO2, или CN; или
(ii) C2-6 алкенила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iii) C2-6 алкинила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(v) насыщенного 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vi)  ,
,  , или
, или  , причем каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
, причем каждый R, Q, Z и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(vii) насыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(viii) частично ненасыщенного 3-6-членного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(ix) частично ненасыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(x)  , где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xi) частично ненасыщенного 4-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xii) ,
,  ,
,  или
или  ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xiv) 



 ,
,
причем каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xv) 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xvi) 









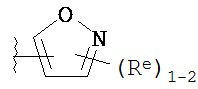

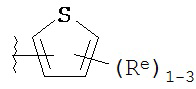
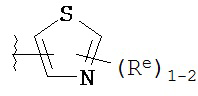
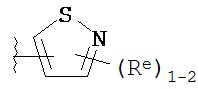
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xvii) 8-10-членного бициклического насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, причем каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте;
(o) L представляет собой бивалентную C1-8 насыщенную или ненасыщенную, линейную или разветвленную углеводородную цепь; и Y выбран из:
(i) C1-6 алкила, замещенного оксогруппой, галогеном, NO2 или CN;
(ii) C2-6 алкенила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iii) C2-6 алкинила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(v) насыщенного 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vi)  ,
,  , или
, или  , где каждый R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vii) насыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(viii) частично ненасыщенного 3-6-членного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(ix) частично ненасыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(x)  , где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xi) частично ненасыщенного 4-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xii) ,
,  ,
,  или
или  ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xiv) 



 ,
,
причем каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xv) 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xvi) 









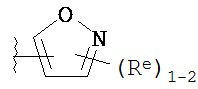

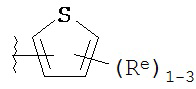
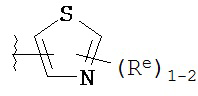
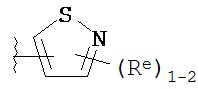
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xvii) 8-10-членного бициклического насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где Re имеет значение, определенное выше и описанное в настоящем тексте;
(p) L представляет собой ковалентную связь, -CH2-, -NH-, -C(O)-, -CH2NH-, -NHCH2-, -NHC(O)-, -NHC(O)CH2OC(O)-, -CH2NHC(O)-, -NHSO2-, -NHSO2CH2-, -NHC(O)CH2OC(O)- или -SO2NH-; и Y выбран из:
(i) C1-6 алкила, замещенного оксогруппой, галогеном, NO2 или CN; или
(ii) С2-6 алкенила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(ii) С2-6 алкинила, возможно замещенного оксогруппой, галогеном, NO2 или CN; или
(iv) насыщенного 3-4-членного гетероциклического кольца, содержащего 1 гетероатом, выбранный из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-2 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(v) насыщенного 5-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, выбранных из кислорода или азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vi) 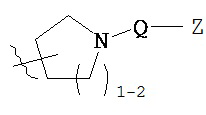 ,
,  , или
, или  , где каждый R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый R, Q, Z и Re имеет значение, определенное выше и описанное в настоящем тексте; или
(vii) насыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(viii) частично ненасыщенного 3-6-членного моноциклического кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(ix) частично ненасыщенного 3-6-членного карбоциклического кольца, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(x)  , где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
, где каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xi) частично ненасыщенного 4-6-членного гетероциклического кольца, содержащего 1-2 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xii)  ,
,  ,
,  или
или  ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xiii) 6-членного ароматического кольца, содержащего 0-2 атома азота, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xiv) 



 ,
,
причем каждый Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xv) 5-членного гетероарильного кольца, содержащего 1-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-3 группы Re, где каждая группа Re имеет значение, определенное выше и описанное в настоящем тексте; или
(xvi) 









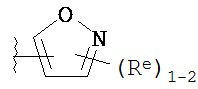

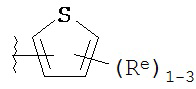
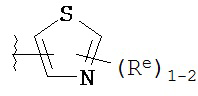
 ,
,
где каждый R и Re имеют значения, определенные выше и описанные в настоящем тексте; или
(xvii) 8-10-членного бициклического насыщенного, частично ненасыщенного или арильного кольца, содержащего 0-3 гетероатома, независимо выбранных из азота, кислорода или серы, при этом указанное кольцо содержит в качестве заместителей 1-4 группы Re, где Re имеет значение, определенное выше и описанное в настоящем тексте.
[00108] В некоторых вариантах осуществления группа Y в формуле Ia или Ib выбрана из групп, приведенных ниже в Таблице 3, при этом каждая волнистая линия указывает точку присоединения группы к остальной части молекулы.
Таблица 3 (см. в конце описания)
[00109] В некоторых вариантах осуществления R1 представляет собой -C≡CH, -C≡CCH2NH(изопропил), -NHC(O)C≡CCH2CH3, -CH2-C≡C-CH3, -C≡CCH2OH, CH2C(O)C≡CH, -C(O)C≡CH или -CH2OC(=O)C≡CH. В некоторых вариантах осуществления R1 выбран из -NHC(O)CH=CH2, -NHC(O)CH=CHCH2N(CH3)2 или -CH2NHC(O)CH=CH2.
[00110] В некоторых вариантах осуществления R1 выбран из групп, приведенных ниже в Таблице 4, при этом каждая волнистая линия указывает точку присоединения группы к остальной части молекулы.
Таблица 4 (см. в конце описания)
[00111] Как определено в общем виде выше, R1 представляет собой высокореакционноспособную группу, или, если R1 и Rx образуют кольцо, то -Q-Z представляет собой высокореакционноспособную группу. Без какого-либо конкретного теоретического обоснования считается, что такие группы R1, т.е. высокореакционноспособные группы, особенно подходят для ковалентного связывания с ключевым остатком цистеина в связывающем домене некоторых протеинкиназ. Протеинкиназы, содержащие остаток цистеина в связывающем домене, известны специалистам в данной области и включают ErbB1, ErbB2 и ErbB4 или их мутанты. В некоторых вариантах осуществления соединения согласно настоящему изобретению включают высокореакционноспособные группы, характеризующиеся тем, что соединения согласно настоящему изобретению направленно взаимодействуют с одним или несколькими из следующих остатков цистеина:
[00112] Таким образом, в некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связываться с остатком цистеина, что приводит к необратимому ингибированию фермента. В некоторых вариантах осуществления остаток цистеина представляет собой Cys797 в составе ErbBI, Cys805 в составе ErbB2 и Cys803 в составе ErbB4 или мутанта указанных киназ. Нумерация остатков дана в соответствии с Uniprot (код PO0533 для ErbB1, код Р04626 для ErbB2 и Q15303 для ErbB4). Очевидно, что Cys в составе ErbB1 (EGFR) может называться 773 или 797 в зависимости от того, содержит ли исходная последовательность сигнальный пептид или нет. Таким образом, согласно настоящему изобретению соответствующие остатки цистеина ErbB1 могут быть обозначены как Cys773 или Cys797 и употребляться взаимозаменяемо в данном контексте.
[00113] Среднему специалисту в данной области очевидно, что для такого ковалентного связывания пригодны разнообразные высокореакционноспособные группы, приведенные в настоящем описании. Такие группы R1 включают, но не ограничиваются ими, группы, описанные в настоящем тексте и изображенные ниже в Таблице 4.
[00114] Как показано выше в формулах I-a и I-b, высокореакционноспособная группа R1 может находиться в орто-, мета- или пара-положении. В некоторых вариантах осуществления высокореакционноспособная группа R1 находится в мета-положении фенильного кольца относительно остальной части молекулы.
[00115] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина тирозин Протеинкиназы TEC, что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys449.
[00116] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина ВТК (Брутоновская тирозинкиназа), что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys481.
[00117] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина ITK (киназа Т-клеток, индуцируемая интерлейкином IL-2), что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys442.
[00118] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина цитоплазматической (нерецепторной) тирозин протеинкиназы BMX, что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys 496.
[00119] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина янус-киназы JAK3, что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys909.
[00120] В некоторых вариантах осуществления R1 характеризуется тем, что группа -L-Y способна ковалентно связывать остаток цистеина тирозин протеникиназы TXK, что приводит к необратимому ингибированию этого фермента. В некоторых вариантах осуществления указанный остаток цистеина представляет собой Cys 350.
[00121] Среднему специалисту в данной области очевидно, что для такого ковалентного связывания пригодны различные высокореакционноспособные группы, приведенные в настоящем описании. Такие группы R1 включают, но не ограничиваются ими, группы, описанные в настоящем тексте и изображенные ниже в Таблице 3.
[00122] Примеры соединений согласно настоящему изобретению приведены ниже в Таблице 5.
Таблица 5 (см. в конце описания)
[00123] В некоторых вариантах осуществления настоящее изобретение обеспечивает любое соединение, представленное выше в Таблице 5, или его фармацевтически приемлемую соль.
[00124] В некоторых вариантах осуществления настоящее изобретение обеспечивает соединения, выбранные из:
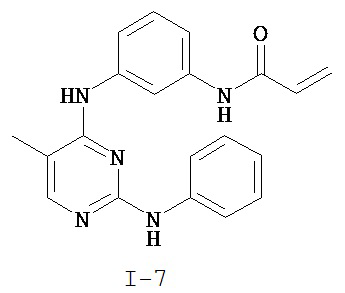
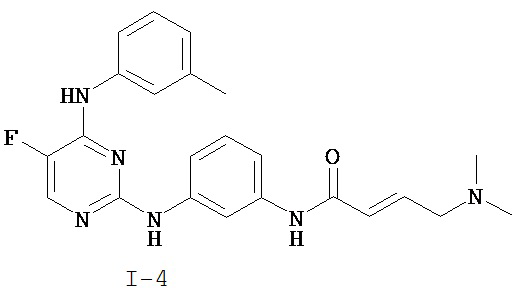
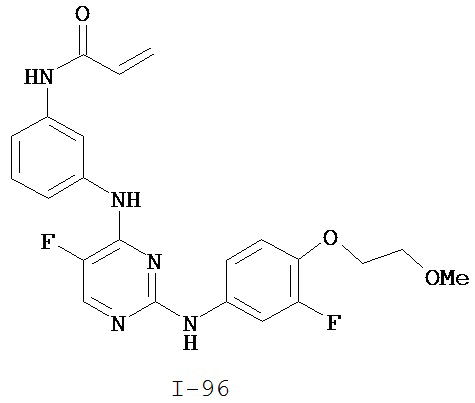
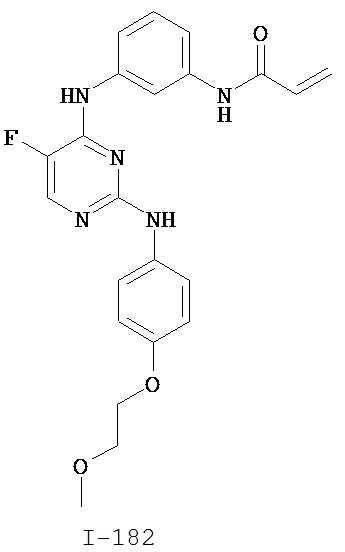
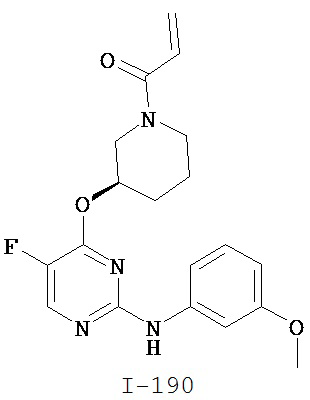
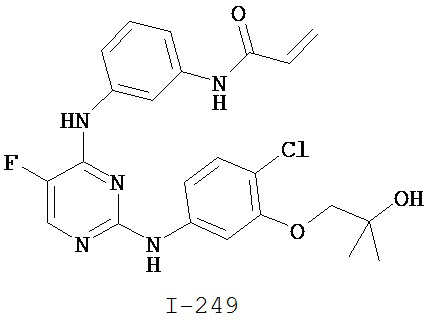 и
и 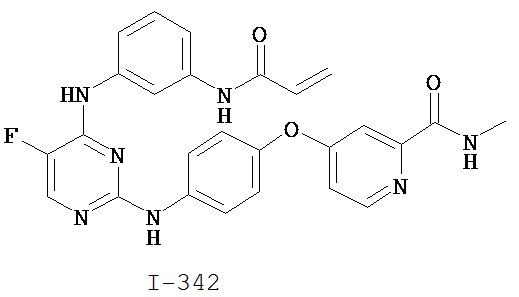
или их фармацевтически приемлемые соли.
[00125] Как описано в настоящем тексте, соединения согласно настоящему изобретению представляют собой необратимые ингибиторы по меньшей мере одной киназы из ErbB1, ErbB2, ErbB3 и ErbB4 или мутанта указанной киназы. В некоторых вариантах осуществления соединения согласно настоящему изобретению представляют собой необратимые ингибиторы киназы ТЕС (например, ВТК) и JAK3. Среднему специалисту в данной области понятно, что соединения согласно настоящему изобретению представляют собой обратимые ингибиторы. В некоторых вариантах осуществления такие соединения можно применять в качестве соединений сравнения при проведении количественного определения. В других вариантах осуществления такие соединения, обладающие обратимым действием, можно применять в качестве ингибиторов ErbB1, ErbB2, ErbB3 и ErbB4, TEC-киназы и/или JAK3, или их мутантов, и, соответственно, для лечения одного или более заболеваний, указанных в настоящем описании. Примеры соединений согласно настоящему изобретению, обладающих обратимым действием, имеют следующую структуру:
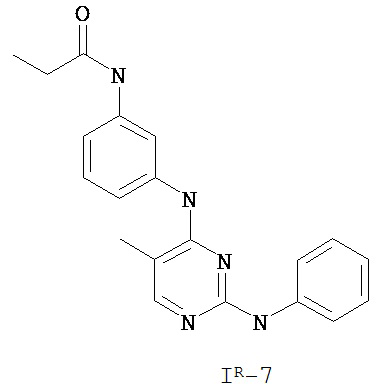
или его фармацевтически приемлемая соль.
4. Применения, лекарственные формы и способы введения
Фармацевтически приемлемые композиции
[00126] В соответствии с другим вариантом осуществления, настоящее изобретение обеспечивает композицию, включающую соединение согласно настоящему изобретению или его фармацевтически приемлемое производное, и фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель. Количество соединения в композиции согласно настоящему изобретению является таким, которого достаточно для того, чтобы значительно ингибировать протеинкиназу, в частности одну из киназ: ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназу и/или JAK3, или их мутанты, в биологическом образце или в организме пациента. В некоторых вариантах осуществления количество соединения в композиции согласно настоящему изобретению является таким, которого достаточно для того, чтобы значительно ингибировать по крайней мере одну из киназ: ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназу и/или JAK3, или их мутанты, в биологическом образце или в организме пациента. В некоторых вариантах осуществления композиция согласно настоящему изобретению готовится для введения пациенту, нуждающемуся в такой композиции. В некоторых вариантах осуществления композиция согласно настоящему изобретению готовится для перорального введения пациенту.
[00127] Термин "пациент", используемый в настоящем описании, означает животное, предпочтительно млекопитающее, и наиболее предпочтительно человека.
[00128] Термин "фармацевтически приемлемый носитель, вспомогательное вещество или разбавитель" относится к нетоксичному носителю, вспомогательному веществу или разбавителю, который не разрушает фармакологическую активность соединения, вместе с которым он используется при изготовлении лекарственной формы. Фармацевтически приемлемые носители, вспомогательные вещества или разбавители, которые могут быть использованы в композиции согласно настоящему изобретению, включают, но не ограничивается ими, ионообменные вещества, окись алюминия, стеарат алюминия, лецитин, белки сыворотки крови, такие как человеческий сывороточный альбумин, буферные вещества, такие как фосфаты, глицин, сорбиновая кислота, сорбат калия, смеси неполных глицеридов насыщенных растительных жирных кислот, воду, соли или электролиты, такие как сульфат протамина, двузамещенный фосфат натрия, двузамещенный фосфат калия, хлорид натрия, соли цинка, коллоидный диоксид кремния, трисиликат магния, поливинилпирролидон, вещества на основе целлюлозы, полиэтиленгликоль, натриевая соль карбоксиметилцеллюлозы, полиакрилаты, воски, полиэтилен-полиоксипропилен блок-сополимеры, полиэтиленгликоль и ланолин.
[00129] Фармацевтически приемлемое производное" означает любую нетоксичную соль, сложный эфир, соль сложного эфира или другое производное соединения согласно настоящему изобретению, которое при введении реципиенту способно либо прямо, либо косвенно обеспечить соединение согласно настоящему изобретению или метаболит с ингибирующей активностью или его остаток.
[00130] В настоящем описании термин "метаболит с ингибирующей активностью или его остаток" означает, что метаболит или его остаток также является ингибитором по крайней мере одной из киназ: ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов.
[00131] Композиции согласно настоящему изобретению можно вводить перорально, парентерально, в виде спрея для ингаляции, местно, ректально, назально, буккально, вагинально или с использованием имплантированногоого резервуара. Термин "парентерально", используемый в настоящем описании, включает подкожный, внутривенный, внутримышечный, внутрисуставный, внутрисиновиальный, интрастернальный (внутригрудинный), внутрипеченочный, внутриочаговый и интракраниальный (внутричерепной) способы введения инъекционным или инфузионным методом. Предпочтительно, указанные композиции вводят перорально, внутрибрюшинно или внутривенно. Стерильные инъекционные формы композиций согласно настоящему изобретению могут быть водными или масляными суспензиями. Такие суспензии могут изготавливаться в соответствии с методиками, известными в уровне техники, с использованием подходящих диспергирующих или смачивающих веществ и суспендирующих агентов. Стерильный инъекционный препарат также может представлять собой стерильный раствор или суспензию для инъекций в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, например, раствор в 1,3-бутандиоле. Такие приемлемые разбавители и растворители, пригодные для использования, включают воду, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или среды для приготовления суспензии традиционно применяют стерильные жирные масла.
[00132] Для этой цели может применяться любое нейтральное жирное масло, включая синтетические моно- или диглицериды. Жирные кислоты, такие как олеиновая кислота и ее глицеридные производные, наряду с природными фармацевтически приемлемыми маслами, такими как оливковое или касторовое масло, особенно полиоксиэтилированными, используются для приготовления инъекционных препаратов,. Такие масляные растворы или суспензии также могут содержать разбавители или диспергирующие вещества на основе длинноцепочечных спиртов, такие как карбоксиметилцеллюлоза или подобные диспергирующие вещества, которые обычно используют при изготовлении фармацевтически приемлемых дозированных форм, включая эмульсии и суспензии. Также при приготовлении лекарственных форм можно использовать другие традиционные поверхностно-активные вещества, такие как Tween, Span и другие эмульгирующие вещества или вещества, усиливающие биодоступность, которые обычно используют в производстве фармацевтически приемлемых твердых, жидких или других дозированных форм,.
[00133] Фармацевтически приемлемые композиции согласно настоящему изобретению можно вводить перорально в любой приемлемой для перорального введения дозированной форме, включая, но не ограничиваясь ими, капсулы, таблетки, водные суспензии или растворы. В случае таблеток для перорального применения, обычно используемые носители включают лактозу и кукурузный крахмал. Также обычно добавляют лубриканты, такие как стеарат магния. Для перорального введения в форме капсул используют разбавители, например, лактозу и сухой кукурузный крахмал. При необходимости перорального введения в виде водной суспензии активный ингредиент комбинируют с эмульгирующими и суспендирующими агентами. При необходимости также могут быть добавлены определенные подсластители, ароматизаторы или красители.
[00134] С другой стороны, фармацевтически приемлемые композиции согласно настоящему изобретению могут вводиться в форме суппозиториев для ректального введения. Они могут быть изготовлены смешением указанного агента с подходящим нераздражающим наполнителем, который находится в твердой форме при комнатной температуре, но в жидкой форме при ректальной температуре, и, следовательно, будет расплавляться в прямой кишке с высвобождением указанного лекарственного средства. Такие вещества включают кокосовое масло, пчелиный воск и полиэтиленгликоли.
[00135] Фармацевтически приемлемые композиции согласно настоящему изобретению также могут применяться местно, особенно когда объект лечения представляет собой область или орган, легкодоступный для местного применения препарата, включая заболевания глаз, кожи или нижнего отдела кишечного тракта. Подходящие лекарственные формы для местного применения легко изготавливаются для каждой из этих областей или органов.
[00136] Лекарственные формы для местного применения для нижнего отдела кишечного тракта могут быть выполнены в виде ректальных суппозиториев (см. выше) или подходящей лекарственной формы в виде клизмы. Также могут быть использованы трансдермальные пластыри местного назначения.
[00137] На основе фармацевтически приемлемых композиций для местного применения согласно настоящему изобретению могут быть приготовлены лекарственные формы в виде подходящей мази, содержащей активный компонент, суспендированный или растворенный в одном или нескольких носителях. Носители для лекарственных форм для местного применения соединений согласно настоящему изобретению включают, но не ограничиваются ими, минеральное масло, вазелиновое масло, белый вазелин, пропиленгликоль, полиоксиэтилен, полиоксипропилен, эмульгирующий воск и воду. С другой стороны, фармацевтически приемлемые композиции согласно настоящему изобретению могут быть использованы для приготовления лекарственных форм в виде подходящего лосьона или крема, содержащего активные компоненты, суспендированные или растворенные в одном или нескольких фармацевтически приемлемых носителях. Подходящие носители включают, но не ограничиваются ими, минеральное масло, сорбитмоностеарат, полисорбат 60, воска на основе цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и воду.
[00138] Фармацевтически приемлемые композиции согласно настоящему изобретению могут использоваться для приготовления лекарственных форм для офтальмологического применения в виде тонкодисперсных суспензий в изотоническом стерильном физиологическом растворе с доведенным pH, или, предпочтительно, в виде раствора в изотоническом стерильном физиологическом растворе с доведенным pH с консервантом, таким как бензалкония хлорид, либо без него. С другой стороны, фармацевтически приемлемые композиции для офтальмологического применения могут использоваться для приготовления лекарственной формы на основе мази, такой как вазелин.
[00139] Фармацевтически приемлемые композиции согласно настоящему изобретению также можно вводить в виде назального аэрозоля или ингаляции. Такие композиции изготавливают в соответствии с методами, хорошо известными в уровне техники для фармацевтических лекарственных форм, и могут быть изготовлены в виде раствора в физиологическом растворе с применением бензилового спирта или других подходящих консервантов, стимуляторов абсорбции для увеличения биодоступности, фторированных углеводородов и/или других традиционно используемых солюбилизирующих или диспергирующих веществ.
[00140] Наиболее предпочтительно, фармацевтически приемлемые композиции согласно настоящему изобретению используют для приготовления лекарственных форм для перорального введения.
[00141] Количество соединений согласно настоящему изобретению, которое может быть смешано с веществом-носителем для получения композиции в виде дозированной формы для однократного введения, варьируется в зависимости от организма, подвергающегося лечению, от определенного метода введения. Предпочтительно, композиции согласно настоящему изобретению могут быть приготовлены таким образом, что доза ингибитора, вводимая пациенту в составе указанных композиций, составляет от 0,01 до 100 мг на кг веса в день.
[00142] Также должно быть очевидно, что конкретная дозировка и режим лечения для любого конкретного пациента будет зависеть от множества факторов, включающих активность конкретного используемого соединения, возраст, массу тела, общее состояние здоровья, пол, режим питания пациента, время введения, скорость выведения соединения, комбинирование с другими лекарственными средствами, заключение лечащего врача и тяжесть конкретного заболевания, подвергающееся лечению. Количество соединения согласно настоящему изобретению в указанной композиции также будет зависеть от конкретного соединения в указанной композиции.
Использование соединений и фармацевтически приемлемых композиций
[00143] Соединения и композиции согласно настоящему описанию в целом пригодны для ингибирования протеинкиназной активности одного или нескольких ферментов.
[00144] Устойчивость к лекарственным средствам представляет значительные трудности при проведении таргетной терапии. Например, устойчивость к лекарственным средствам описана для Gleevec® и Iressa®, а также для нескольких других ингибиторов киназ, находящихся на стадии разработки. Кроме того, устойчивость к лекарственным средствам описана для рецепторов cKit и PDGFR. Сообщалось, что необратимые ингибиторы могут быть эффективными против форм протеинкиназ, устойчивых к лекарственных средствам (Kwak, E.L., R. Sordella, et al. (2005) "Irreversible inhibitors of the EGF receptor may circumvent acquired resistance to gefitinib." PNAS, 102 (21): 7665-7670). Без ограничения какой-либо конкретной теорией считается, что соединения согласно настоящему изобретению могут являться эффективными ингибиторами форм протеинкиназ, устойчивых к лекарственных средствам.
[00145] В настоящем описании термин "клиническая устойчивость к лекарственным средствам" означает потерю восприимчивости мишени лекарственного средства к действию этого лекарственного средства вследствие мутаций в указанной мишени лекарственного средства.
[00146] В настоящем описании термин "устойчивость" относится к изменениям в последовательности нуклеиновой кислоты дикого типа, кодирующей целевой белок и/или последовательности целевого белка, при этом такие изменения снижают или сводят на нет ингибирующий эффект ингибитора в отношении указанного целевого белка.
[00147] Примеры киназ, подверженных ингибированию соединениями и композициями согласно настоящему изобретению и против которых применимы способы, описанные в настоящем тексте, включают ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназу (в том числе BTK, ITK, TEC, BMX и рецептор-подобную киназу RLK) и/или JAK3, или их мутанты.
[00148] Активность соединения, используемого в настоящем изобретении в качестве ингибитора ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов, может быть определена in vitro, in vivo или в клеточных линиях. Анализ in vitro включает эксперименты, в которых определяется ингибирование либо фосфорилирующей активности и/или функциональных последствий, являющихся результатом проявления указанной актвиности, или АТФ-азной активности активированных ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов. В альтернативных экспериментах in vitro проводится количественное определение способности ингибитора связываться с ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназой и/или JAK3. Способность ингибитора к связыванию может быть измерена методом, заключающимся в введении радиоактивной метки в молекулу ингибитора перед связыванием, выделении комплексов ингибитор/ErbB1, ингибитор/ErbB2, ингибитор/ErbB3, ингибитор/ErbB4, ингибитор/TEC-киназа (например, TEC, BTK, ITK, RLK и BMX) или ингибитор/JAK3 и определении количества радиоактивных атомов, участвующих в образовании комплексов. Также способность ингибитора к связыванию можно оценить с помощью метода конкурентных реакций, когда новые ингибиторы инкубируют с ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназой и/или JAK3, связанными с известными лигандами, меченными радиоактивными изотопами. Подробные условия количественного определения соединения, используемого в настоящем изобретении в качестве ингибитора ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов, изложены в Примерах, приведенных ниже.
[00149] Протеин-тирозинкиназы представляют собой класс ферментов, катализирующих перенос фосфатной группы с АТФ или ГТФ на остаток тирозина, расположенный в белковом субстрате. Рецепторные тирозинкиназы передают сигналы снаружи внутрь клетки путем активации передающих сигналы вторичных эффекторов в ходе события фосфорилирования. Множество клеточных процессов активизируются этими сигналами, включая пролиферацию, утилизацию углеводов, синтез белков, ангиогенез, клеточный рост и выживаемость клеток.
(а) Семейство ErbB
[00150] Рецепторы ErbB, основное семейство рецепторных тирозинкиназ, состоят из внеклеточного лигандсвязывающего домена, одного трансмембранного домена, и внутриклеточного домена, обладающего тирозинкиназной активностью. В семейство ErbB входят ErbB1 (общеизвестный как EGFR), ErbB2 (общеизвестный как HER2 или пей), ErbB3 (общеизвестный как HER3) и ErbB4 (общеизвестный как HER4). Идентифицировано более 10 лигандов (включая EGF, TGFα, AR, BTC, EPR, HB-EGF, NRG-1, NRG-2, NRG-3, NRG-4) для различных членов семейства рецепторов. При связывании лиганда конформация внутриклеточного домена изменяется, что приводит к образованию гомодимеров или гетеродимеров с другими членами семейства ErbB. Димеризация индуцирует тирозин-фосфорилирование определенных остатков внутриклеточного домена, служащих местом связывания для белков-адаптеров и нижележащих эффекторов. В некоторых случаях происходит активация путей фосфатидилинозитол-3-киназы (PI3K) и митоген-активируемой протеинкиназы, что приводит к пролиферации и выживаемости клеток (Lin, N.U.; Winer, E.P., Breast Cancer Res., 6: 204-210, 2004).
[00151] Взаимодействие между членами семейства влечет за собой дефицит ErbB2, для которой лиганд не известен, и ErbB3, которая не обладает киназной активностью. EGFR, ErbB3 и ErbB4 связываются с лигандом, что приводит к индукции гомодимеризации или гетеродимеризации рецептора ErbB, тогда как ErbB2 выступает в качестве предпочтительного партнера для димеризации. Состав парных комбинаций является важным для диверсификации сигналов, так как тождественность димеров определяет, какой из нижележащих путей активируется. Типичные продукты нижележащих генов в пути передачи сигналов ErbB включают She, Grb2, SOS1, Ras, Rafl, Mek, ERK1, ERK2, ERα, Akt, mTOR, FKHR, p27, Cyclin Dl, FasL, GSK-3, Bad и STAT3.
[00152] Существуют твердые доказательства того, что EGFR и другие члены семейства ErbB связаны у человека с наличием опухолей, поскольку в более чем 60% всех твердых опухолей наблюдается повышенная экспрессия по крайней мере одного из этих белков или их лигандов. Сообщалось, что конститутивно активный онкогенный EGFR vIII, мутант, содержащий укороченный внеклеточный домен, присутствует в почти 78% случаев рака молочной железы, а также он был обнаружен в глиобластомах. Повышенная экспрессия EGFR обычно наблюдается в опухолях молочной железы, легких, головы и шеи, мочевого пузыря, в то время как экспрессия ErbB2 часто повышена в опухолях человека эпителиального происхождения. Активирующие мутации в домене тирозинкиназы были идентифицированы у пациентов с немелкоклеточным раком легкого (Lin, N.U.; Winer, E.P., Breast Cancer Res 6: 204-210, 2004). Амплификация ErbBI и/или ErbB2 также происходит при плоскоклеточном раке, раке слюнной железы, яичников и раках поджелудочной железы (Cooper, G.C. Oncogenes. 2nd ed. Sudbury: Jones and Barlett, 1995; Zhang, Y., et al., Cancer Res 66: 1025-32, 2006). Повышенная экспрессия ErbB2 обладает сильной трансформирующей активностью, вероятно, ввиду его способности к взаимодействию с другими рецепторами ErbB (Sherman, L., et al., Oncogene 18: 6692-99, 1999). В действительности, некоторые опухоли человека, в которых наблюдается повышенная экспрессия как EGFR, так и ErbB2, характеризуются худшим прогнозом, чем опухоли, в которых наблюдается повышенная экспрессия какого-либо одного из этих рецепторов.
[00153] Система передачи сигналов ErbB часто является ключевым компонентом в патогенезе рака молочной железы. Амплификация ErbB2 ассоциирована с агрессивным фенотипом опухоли, который характеризуется относительно быстрым ростом опухоли, распространением метастаз во внутренних органах и устойчивостью к лекарственным средствам. Было показано, что ErbB2 амплифицирован в 20% случаев рака молочной железы без поражения подмышечных лимфоузлов (axillary node-negative, ANN), и было установлено, что такая амплификация является независимыми прогностический фактор риска рецидива данного типа рака молочной железы ANN (Andrulis, I.L., et al., J Clin Oncol 16: 1340-9, 1998).
[00154] Было показано, что целевая блокада передачи сигналов ErbB трастузумабом (trastuzumab, Herceptin), моноклональным антителом против ErbB2, улучшает выживаемость женщин больных ErbB2-положительным раком молочной железы в прогрессирующей стадии. К другим моноклональным антителам против рецепторов ErbB относятся цетуксимаб (cetuximab, Erbitux) и панитумумаб (panitumumab, Vectibix).
[00155] Было обнаружено, что некоторые небольшие молекулы ингибиторов тирозинкиназы (TKI) действуют селективно на рецепторы семейства ErbB. К известным примерам относятся гефитиниб (gefitinib, Iressa) и эрлотиниб (eriotinib, Tarceva), оба нацеленные на EGFR. Эти небольшие молекулы конкурируют с АТФ за связывание с киназным доменом рецептора. По сравнению с моноклональными антителами TKI имеют некоторые достоинства: они биодоступны при пероральном введении, хорошо переносятся организмом и, по-видимому, обладают активностью против укороченных форм рецепторов ErbB2 и EGFR (например, EGFR vIII) in vitro. Кроме того, небольшие размеры молекул TKI позволяет им проникнуть в труднодоступные для лекарственных средств участки организма, такие как центральная нервная система. Наконец, гомология между киназными доменами рецепторов ErbB позволяет разрабатывать TKI, нацеленные не на один, а несколько рецепторов семейства ErbB одновременно, преимущества чего описаны в настоящей заявке.
[00156] Хотя появление некоторых злокачественных опухолей связано с повышенной экспрессией отдельных рецепторов, эффективная передача сигналов основана на совместной экспрессии рецепторов семейства ErbB. Такая кооперация рецепторов семейства ErbB в передаче сигналов и злокачественной трансформации может ограничить успешность применения агентов, нацеленных на отдельные рецепторы, в лечении рака; возможный механизм устойчивости к агентам, нацеленным на отдельный рецептор ErbB, заключается в повышенной экспрессии других рецепторов указанного семейства (Britten, С.D., Mol Cancer Ther 3: 1335-42, 2004).
[00157] Агенты, нацеленные на два или более рецепторов ErbB, называют регуляторами пан-ErbB-рецепторов. ERRP является общим негативным регулятором ErbB, экспрессирующимся в большинстве доброкачественных клеток эпителия протоков и островков поджелудочной железы. Было обнаружено, что в опухолях происходит прогрессирующее снижение экспрессии ERRP. Тот факт, что Эрбитукс (Erbitux) и Герцептин (Herceptin) показывают положительные результаты при лечении ограниченного числа пациентов (опухоли, характеризующиеся повышенной экспрессией EGFR или ErbB2), может быть частично связан с совместной экспрессией многих рецепторов семейства ErbB.
[00158] В моделях как in vitro, так и in vivo средства на основе агентов с двойственной природой по отношению к ErbB, по-видимому, обладают большей противоопухолевой активностью, чем агенты, нацеленные на отдельный рецептор ErbB. Таким образом, агенты, нацеленные на множество рецепторов семейства ErbB, с большей вероятностью окажут благоприятный терапевтический эффект у более широкой популяции пациентов (Zhang, Y., et al., Cancer Res 66: 1025-32, 2006). В определенных вариантах осуществления предложенные соединения ингибируют один или несколько рецепторов ErbB1, ErbB2, ErbB3 и ErbB4. В некоторых вариантах осуществления предложенные соединения ингибируют два или более рецепторов ErbB1, ErbB2, ErbB3 и ErbB4, или их мутантов, и поэтому являются ингибиторами пан-ErbB-рецепторов.
[00159] Несомненно, появляется все больше доказательств, подтверждающих одновременное ингибирование двух или более рецепторов ErbB (то есть, пан-ErbB-рецепторов) в противораковой терапии. Вероятные приемы, основанные на использовании небольших молекул, действующих на пан-ErbB-рецепторы, включают использование комбинаций агентов, нацеленных на отдельные рецепторы ErbB, использование единичных агентов, нацеленных на множество рецепторов ErbB, или использование агентов, препятствующих взаимодействию рецепторов ErbB (например, димеризации). Дополнительные приемы включают терапию с использованием небольших молекул в комбинации с антителами или хемопревентивную терапию (Lin, N.U.; Winer, E.P., Breast Cancer Res 6: 204-210, 2004).
[00160] Примером небольшой молекулы общего ингибитора пан-ErbB-рецепторов является CI-1033, необратимый ингибитор пан-ErbB-рецепторов, ковалентно связывающийся с сайтом связывания АТФ внутриклеточного киназного домена. Другим необратимым ингибитором пан-ErbB-рецепторов тирозинкиназы является HKI-272, ингибирующий рост клеток опухоли, которые экспрессируют ErbB-1 (EGFR) и ErbB-2 (HER-2) при культивировании клеток и ксенотрансплантатах, и обладающий противоопухолевой активностью в отношении HER-2-положительного рака молочной железы (Andrulis, I.E., et al., J Clin Oncol 16: 1340-9, 1998). Необратимые ингибиторы продемонстрировали очень высокую противоопухолевую активность по сравнению с обратимыми ингибиторами.
[00161] Нейрофиброматоз I типа (NF1) в основном является наследственным заболеванием, которым страдает один из 2500-3500 человек. Поражаются несколько систем органов, включая кости, кожные покровы, радужную оболочку глаз и центральную нервную систему, проявлением чего являются неспособность к обучению и глиомы. Признаком NF1 является развитие доброкачественных опухолей периферической нервной системы (нейрофибром), количество и размер которых сильно различаются среди пациентов. Нейрофибромы являются гетерогенными опухолями, состоящими из клеток Шванна, нейронов, фибробластов и других клеток, среди которых клетки Шванна являются основным типом клеток (60-80%).
[00162] Аберрантная экспрессия EGFR связана с развитием опухоли при NF1 и в моделях NF1 на животных, что предполагает некую роль в патогенезе и представляет новую потенциальную терапевтическую мишень. Экспрессия EGFR вызывает рост опухолевых клеточных линий, полученных от пациентов с NF1, в условиях, когда EGF не является первичным фактором, вызывающим рост клеток. Эти данные наводят на мысль, что EGFR может играть важную роль в онкогенезе NF1 и трансформации клеток Шванна (DeClue, J.E., et al., J Clin Invest 105: 1233-41, 2000).
[00163] У пациентов с NF1 развивается агрессивная неоплазма клеток Шванна, известная как злокачественная опухоль оболочек периферических нервов (MPNST). Клетки Шванна являются главной популяцией вспомогательных клеток в периферической нервной системе. Неопластические клетки Шванна в этих неоплазмах с разным уровнем экспрессируют тирозинкиназы ErbB, что вызывает ответ NRG-1 (ErbB2, ErbB3, ErbB4). Белки нейрегулина-1 (NRG-1) вызывают дифференциацию, выживаемость и/или пролиферацию множества типов клеток в развивающейся нервной системе, а повышенная экспрессия NRG-1 в клетках Шванна, образующих миелиновый слой, индуцирует формирование злокачественных опухолей оболочек периферических нервов (MPNST) (Fallen, K.В., et al., J Neuro Oncol 66: 273-84, 2004).
[00164] Бесконтрольный рост клеток Шванна является первичным дефектом, приводящим к развитию как доброкачественных нейрофибром, так и опухолей MPNST у пациентов с нейрофиброматозом I типа (NF1). Рост опухолей MPNST и трансформированных клеток Шванна у мыши in vitro сильно зависит от EGF и может быть блокирован ингибиторами EGFR в условиях, когда EGF является первичным фактором роста. Было обнаружено, что некоторые линии клеток опухоли MPNST человека демонстрируют конститутивном фосфорилировании ErbB. Хотя обработка ингибиторами ErbB останавливает процесс фосфорилирования ErbB и снижает синтез ДНК в этих линиях, эффективные химиотерапевтические режимы для лечения опухолей MPNST остаются труднодоступныыми (Stonecypher, M.S., et al., Oncogene 24: 5589-5605, 2005).
[00165] Невриномы являются опухолями периферических нервов, почти полностью состоящими из клеток, подобных клеткам Шванна, и обычно содержащими мутации в гене-супрессоре опухоли нейрофиброматоза II типа (NF2). У девяноста процентов пациентов с NF2 развиваются двусторонние невриномы слухового нерва и/или невриномы спинного мозга. Увеличивающиеся невриномы могут сдавливать прилежащие структуры, что приводит к глухоте и другим неврологическим проблемам. Хирургическое удаление этих опухолей затруднительно и часто приводит к усилению клинических проявлений заболевания у пациентов.
[00166] Как нормальные клетки Шванна человека, так и клетки неврином экспрессируют рецепторы нейрегулина (то есть рецепторы ErbB), а клетки неврином пролиферируют в ответ на нейрегулин. Возможно, что аберрантная выработка нейрегулина или ответ способствуют аберрантной пролиферации клеток невриномы (Pelton, P.D., et al., Oncogene 17: 2195-2209, 1998).
[00167] Супрессор опухоли NF2, Мерлин, является белком, ассоциированным с мембраной/цитоскелетом, вовлеченным в процесс регуляции активности тирозинкиназы. Генетические взаимодействия между мутациями в белке Мерлин и мутациями в пути EGFR были установлены для Drosophila (LaJeunesse, D.R., et al., Genetics 158: 667-79, 2001). Другой факт свидетельствует о том, что Мерлин может ингибировать интернализацию EGFR и передачу сигнала посредством контакта «клетка-клетка» за счет удерживания EGFR в мембранном компартменте, из которого EGFR не может ни передать сигнал, ни интернализоваться (McClatchey, A.I., et al., Genes and Development 19: 2265-77, 2005; Curto, M.С., et al., J Cell Biol 177: 893-903, 2007).
[00168] Используемые в настоящем описании термины "лечение", "лечить" и "проведение лечения" относятся к реверсии, облегчению, замедлению проявления или подавление развития заболевания или нарушения, или одного или нескольких его симптомов, как описано в настоящем тексте. В некоторых вариантах реализации лечение может быть назначено после того, как появились один или несколько симптомов. В других вариантах реализации лечение может быть назначено в отсутствие симптомов. Например, лечение может быть назначено восприимчивому индивидууму до проявления симптомов (например, в свете истории симптомов и/или в свете генетических факторов или других факторов восприимчивости). Лечение также может быть продолжено после того, как исчезли симптомы болезни, например, чтобы предотвратить или отложить ее повторение.
[00169] Предложенные соединения являются ингибиторами одного или нескольких рецепторов ErbB1, ErbB2, ErbB3 и ErbB4, и поэтому пригодны для лечения одного или нескольких нарушений, ассоциированных с активностью одного или нескольких рецепторов ErbB1, ErbB2, ErbB3 и ErbB4. Таким образом, в определенных вариантах реализации настоящее изобретение обеспечивает способ лечения расстройства, опосредованного ErbB1, ErbB2, ErbB3 и/или ErbB4, включающий стадию введения соединения согласно настоящему изобретению или его фармацевтически приемлемой композиции пациенту, нуждающемуся в указанном способе.
[00170] Используемые в данном описании термины расстройства или состояния, «опосредованные ErbB1», «опосредованные ErbB2», «опосредованные ErbB3» и/или «опосредованные ErbB4», означают любое заболевание или другое патологическое состояние, известное тем, что в его возникновении играют роль один или несколько рецепторов ErbB1, ErbB2, ErbB3 и/или ErbB4, или их мутанты. Соответственно, другой вариант осуществления настоящего изобретения относится к проведению лечения или снижению тяжести одного или нескольких заболеваний, известных тем, что в их возникновении играют роль один или несколько рецепторов ErbB1, ErbB2, ErbB3 и/или ErbB4 или их мутанты. В частности, настоящее изобретение относится к способу лечения или снижения тяжести заболевания или состояния, выбранного из пролиферативного заболевания, причем указанный способ включает введение соединения или композиции согласно настоящему изобретению пациенту, нуждающемуся в указанном способе.
[00171] В некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний, представляющих собой рак. В некоторых вариантах реализации указанный рак ассоциирован с твердой опухолью. В определенных вариантах реализации указанный рак представляет собой рак молочной железы, глиобластому, рак легких, рак головы и шеи, колоректальный рак, рак мочевого пузыря или немелкоклеточный рак легких. В некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний, выбранных из карциномы сквамозных клеток, карциномы слюнных желез, карциномы яичников или рака поджелудочной железы.
[00172] В некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения или снижения тяжести нейрофиброматоза I типа (NF1), нейрофиброматоза II типа (NF2), неоплазмы клеток Шванна (например, MPNST) или неврином.
(b) Семейство TEC
[00173] Семейство нерецепторных тирозинкиназ TEC, обозначенное в данном описании как "TEC-киназы", играет основную роль в передаче сигналов через антигенные рецепторы, такие как рецепторы TCR, BCR и Fc (обзор Miller A., et al. Current Opinion in Immunology 14; 331-340 (2002)). TEC-киназы необходимы для активации Т-клеток. Две киназы из указанного семейства, Itk, Rlk, активируются ниже места контакта антигена с рецептором в Т-клетках и передают сигналы нижележащим эффекторам, включая PLC-γ. Совместная делеция Itk и Rlk в мышах приводит к значительному ингибированию ответов TCR, включая пролиферацию, продукцию цитокинов и иммунные ответы на внутриклеточных паразитов (Toxoplasma gondii) (Schaeffer et al., Science 284; 638-641 (1999)). Внутриклеточная передача сигналов после контакта рецептора TCR наблюдается в дефицитных по ITK/RLK Т-клетках; при этом снижаются продукция инозитолтрифосфата, мобилизация кальция и активация MAP-киназы. TEC-киназы также необходимы для развития и активации В-клеток.
[00174] К TEC-киназам относятся пять членов семейства, которые экспрессируются главным образом в гемопоэтических клетках: TEC, BTK, ITK (также известный как TSK и ЕМТ), RLK (также известный как TXK) и ВМХ (также известный как ETK). Другие родственные TEC-киназы были обнаружены в Drosophila melanogaster, в полосатом данио (Danio rerió), в скате (Raja eglanteria) и морском еже (Anthocidaris crassispina).
[00175] Соединения согласно настоящему изобретению являются ингибиторами одной или нескольких TEC-киназ и поэтому пригодны для лечения одного или нескольких заболеваний, ассоциированных с активностью одной или нескольких TEC-киназ. Таким образом, в определенных вариантах осуществления настоящее изобретение обеспечивает способ лечения заболевания, опосредованного TEC-киназой, включающий стадию введения соединения согласно настоящему изобретению или его фармацевтически приемлемой композиции пациенту, нуждающемуся в указанном способе.
[00176] Термин «состояние, опосредованное ТЕС-киназой», используемый в настоящем описании, означает любое заболевание или другое патологическое состояние, известное тем, что в его возникновении играют роль TEC-киназы. Такие состояния включают состояния, описанные в настоящей тексте, а также у Melcher, M. et al., "The Role of TEC Family Kinases in Inflammatory Processes", Anti-Inflammatory & Anti-Allergy Agents in Medicinal Chemistry, Vol.6, No.1, pp.61-69 (Feb. 2007). Соответственно, другой вариант осуществления настоящего изобретения относится к лечению или снижению тяжести одного или нескольких заболеваний, известных тем, что в их возникновении играют роль TEC-киназы. В частности, настоящее изобретение относится к способу лечения или снижения тяжести заболевания или состояния, выбранного из аутоиммунного, воспалительного, пролиферативного и гиперпролиферативного заболеваний и иммуно-опосредованных заболеваний, включая отторжение трансплантированных органов или тканей и синдром приобретенного иммунодефицита (СПИД) (также известного как ВИЧ), при этом указанный способ включает введение композиции согласно настоящему изобретению пациенту, нуждающемуся в указанном способе.
[00177] В некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включающих заболевания дыхательных путей, включая, но не ограничиваясь ими, заболевания при которых происходит обратимое закупоривание дыхательных путей, включающие астму, такую как бронхиальная, аллергическая, врожденная, приобретенная и пылевая астма, в частности, хроническая или застарелая астма (например, поздняя стадия астматической гиперчувствительности дыхательных путей) и бронхит. В некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включая состояния, характеризующиеся воспалением носовой слизистой мембраны, включая острый ринит, аллергический, атрофический ринит и хронический ринит, в том числе хронический ринит с образованием казеозных масс, гипертрофический ринит, гнойный ринит, сухой ринит и медикаментозный ринит; мембранный ринит, включая крупозный, фибринозный и превдомембранный ринит и скрофулезный ринит, сезонный ринит, включая нейроринит (сенная лихорадка) и вазомоторный ринит, саркоидоз, "легкие фермера" (экзогенный аллергический альвеолит) и связанные с ним заболевания, пневмофиброз и идиопатическая интерстициальная пневмония.
[00178] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включая заболевания костей и суставов, включая, но не ограничиваясь ими, ревматоидный артрит, серонегативную спондилоартропатию (включая анкилозирующий спондилит, псориатический артрит и синдром Рейтера), болезнь Бехчета, синдром Шегрена, системный склероз, остеопороз, рак костей и метастазы в костях.
[00179] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включая заболевания и болезни кожи, включая, но не ограничиваясь ими, псориаз, системный склероз, атипичный дерматит, контактный дерматит и другие экзематозные дерматиты, себорейный дерматит, красный плоский лишай, пемфигус, буллезный пемфигус, буллезный эпидермолиз, крапивница, ангиодермит, васкулиты, эритемы, кожную эозинофилию, увеит, алопецию, круговой и весенний конъюнктивит.
[00180] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включая заболевания и расстройства желудочно-кишечного тракта, включая, но не ограничиваясь ими, глютеновую болезнь, проктит, эозинофильный гастроэнтерит, мастоцитоз, панкреатит, болезнь Крона, язвенный колит, пищевые аллергии, проявляющиеся вдали от пищеварительного тракта, например, в виде мигрени, ринита и экземы.
[00181] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включая заболевания и расстройства других тканей и системные заболевания, включая, но не ограничиваясь ими, рассеянный склероз, артеросклероз, красную волчанку, системную красную волчанку, тиреоидит Хашимото, тяжелую миастению, диабет, нефротический синдром, эозинофильный фасцит, гипер-IgE-синдром, лепроматозная лепра, синдром Сезари и идиопатическая тромбоцитопеническая пурпура, рестеноз после ангиопластики, опухоли (например, лейкемия, лимфома и рак простаты) и артеросклероз. В конкретных вариантах осуществления диабет представляет собой диабет I типа.
[00182] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с TEC-киназами, включающих отторжение аллотрансплантата, включая, но не ограничиваясь ими, острое или хроническое отторжение аллотрансплантата после, например, пересадки почки, сердца, печени, легкого, костного мозга, кожи и роговой оболочки глаза; и хроническую реакцию "трансплантат против хозяина".
[00183] В некоторых вариантах осуществления настоящее изобретение относится к способу лечения или снижения тяжести одного или нескольких заболеваний или состояний, ассоциированных с TEC-киназами, описанных выше, причем указанный способ включает введение соединения или композиции согласно настоящему изобретению пациенту, нуждающемуся в указанном способе.
(c) Брутоновская тиуозинкиназа (BTK)
[00184] Брутоновская тирозинкиназа (BTK), член семейства TEC-киназ, является основным сигнальным ферментом, экспрессирующимся во всех гемопоэтических типах клеток, за исключением Т-лимфоцитов и природных клеток-киллеров. BTK играет важную роль в пути передачи сигналов в В-клетках, связывая стимуляцию рецептора на поверхности В-клетки (BCR) с последующими ответами внутри клетки.
[00185] BTK является главным регулятором развития, активации, передачи сигналов и выживаемости В-клеток (Kurosaki, Curr Op Imm, 2000, 276-281; Schaeffer and Schwartzberg, Curr Op Imm 2000, 282-288). Кроме того, BTK играет роль в нескольких других сигнальных путях гемопоэтических клеток, например, в продукции Toll-подобного рецептора (TLR) и опосредованной рецептором цитокина продукции TNF-a в макрофагах, в передаче сигналов рецептором IgE (Fc_epsilon_RI) в мастоцитах, ингибирование апоптотической передачи сигналов Fas/APO-1 в лимфоидных клетках В-линии, и стимулированной коллагеном агрегации тромбоцитов. См., например, С.A. Jeffries, et al., (2003), Journal of Biological Chemistry 278:26258-26264; N.J. Horwood, et al., (2003), The Journal of Experimental Medicine 197: 1603-1611; Iwaki et al. (2005), Journal of Biological Chemistry 280 (48): 40261-40270; Vassilev et al. (1999), Journal of Biological Chemistry 274(3); 1646-1656 и Quek et al. (1998), Current Biology 8(20): 1137-1140.
[00186] У пациентов с мутациями в ВТК наблюдается значительный блок в развитии В-клеток, что приводит к практически полному отсутствию зрелых В-лимфоцитов и клеток плазмы, сильному понижению уровня иммуноглобулинов и сильному ингибированию гуморального ответа на антигены тканей донора (обзор в Vihinen et al. Frontiers in Bioscience 5: d917-928). У мышей, дефицитных по BTK, также снижено количество периферических В-клеток и существенно снижены уровни IgM и IgG3 в сыворотке крови. Делеция ВТК у мышей оказывает сильное воздействие на пролиферацию В-клеток, индуцированную анти-IgM, и ингибирует иммунные ответы на тимус-независимые антигены II типа (Ellmeier et al, J Exp Med 192: 1611-1623 (2000)). ВТК также играет важную роль в активации мастоцитов через высокоаффинный рецептор IgE (Fc_epsilon_RI). Мастоциты мыши, дефицитные по BTK, характеризуются пониженной дегрануляцией и пониженной продукцией провоспалительных цитокинов вследствие поперечномго сшивания Fc_epsilon_RI (Kawakami et al. Journal of Leukocyte Biology 65: 286-290).
[00187] BTK связывают с диабетом. Дефицит ВТК у не страдающих ожирением диабетических мышей значительно защищает от диабета и улучшает связанную с В-клетками устойчивость, о чем свидетельствует неспособность генерировать аутоантитела к инсулину (Kendall, et al. J. Immunol. 183: 6403-6412 (2009)). Поэтому модуляцию ВТК и улучшение связанной с В-клетками устойчивости можно использовать при лечении диабета, в частности опосредованного Т-клетками аутоиммунного диабета, например, диабета I типа.
[00188] BTK также связывают с различными типами рака. Например, в раковых клетках поджелудочной железы уровень ВТК выше по сравнению с нормальными клетками поджелудочной железы, а также уровень ВТК в клетках поджелудочной железы повышен при хроническом панкреатите, который иногда является предшественником рака поджелудочной железы (Cmogorac-Jurcevic, et al. Gastroenterology 129: 1454-1463 (2005)). В связи с тем, что ВТК играет ключевую роль в регуляции развития, активации, передачи сигналов и выживаемости В-клеток, ВТК принимает участие во многих раковых заболеваниях, связанных с В-клетками.
[00189] Предложенные соединения являются ингибиторами BTK и поэтому являются полезными при лечении одного или нескольких заболеваний, ассоциированных с активностью BTK. Таким образом, в некоторых вариантах реализации настоящее изобретение обеспечивает способ лечения заболевания, ассоциированного с BTK, включающий введение соединения согласно настоящему изобретению или его фармацевтически приемлемой композиции пациенту, нуждающемуся в указанном способе.
[00190] Используемый в настоящем описании термин заболевание или состояние, «ассоциированное с BTK», означает любое заболевание или другое патологическое состояние, известное тем, что в его возникновении играет роль BTK или ее мутант. Соответственно, другой вариант осуществления настоящего изобретения относится к лечению или снижению тяжести одного или нескольких заболеваний, известных тем, что в его возникновении играет роль ВТК или ее мутант. В частности, настоящее изобретение относится к способу лечения или снижения тяжести заболевания или состояния, выбранного из пролиферативного заболевания или аутоиммунного расстройства, причем указанный способ включает введение соединения или его композиции согласно настоящему изобретению пациенту, нуждающемуся в указанном способе.
[00191] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с BTK. В некоторых вариантах осуществления настоящего изобретения таким заболеванием или состоянием является аутоиммунное заболевание, например, воспалительное заболевание кишечника, артрит, системная красная волчанка (SLE), васкулит, идиопатическая тромбоцитопеническая пурпура (ITP), ревматоидный артрит, псориатический артрит, остеоартрит, болезнь Стилла, подростковый артрит, диабеты, тяжелая миастения, тиреоидит Хашимото, тиреоидит Орда, базедова болезнь, аутоиммунный тиреоидит, синдром Шергена, рассеянный склероз, системный склероз, нейроборрелиоз Лайма, синдром Гийена-Барре, острый рассеянный энцефаломиелит, болезнь Аддисона, синдром танцущих глаз, анкилозирующий спондилоартрит, антифосфолипидный синдром, апластическая анемия, аутоиммунный гепатит, аутоиммунный гастрит, пернициозная анемия, глютеновая болезнь, синдром Гудпасчера, идиопатическая тромбоцитопеническая пурпура, неврит глазного нерва, склеродерма, первичный биллиарный цирроз, синдром Рейтера, артрит Такаясу, височный артериит, аутоиммунная гемолитическая анемия тепловых антител, гранулематоз Вегенера, псориаз, общая алопеция, синдром Бехчета, хроническая усталость, вегетативная дистония, мембранозная гломерулопатия, эндометриоз, интерстициальный цистит, обыкновенная пузырчатка, буллезный пемфигоид, нейромиотония, склеродерма или вульводиния. В некоторых вариантах осуществления таким заболеванием или состоянием является гиперпролиферативное заболевание или иммуно-опосредованное заболевание, включая отторжение трансплантированных органов или тканей и синдром приобретенного иммунодефицита (СПИД, также известный как ВИЧ). В конкретных вариантах осуществления диабет представляет собой диабет I типа.
[00192] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с BTK, причем указанное заболевание или состояние выбрано из гетероиммунных состояний или заболеваний, которые включают, но не ограничиваются ими, реакцию "трансплантат против хозяина", трансплантацию, трансфузию, анафилаксию, аллергию (например, аллергию на пыльцу растений, латекс, лекарственные препараты, пищевые продукты, яды насекомых, шерсть животных, перхоть животных, пылевых клещей или стенкам яиц таракана), гиперчувствительность I типа, аллергический конъюнктивит, аллергический ринит и атонический дерматит.
[00193] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ВТК, причем указанное заболевание или состояние выбрано из воспалительного заболевания, например, астмы, аппендицита, атопического дерматита, астмы, аллергии, блефарита, бронхиолита, бронхита, бурсита, цервицита, холангита, холецистита, хронического отторжения трансплантата, колита, конъюнктивита, болезни Крона, цистита, дакриоаденита, дерматита, дерматомиозита, энцефалита, эндокардита, эндометрита, энтерита, энтероколита, эпикондилита, эпидидимита, фасцита, фиброзита, гастрита, гастроэнтерита, болезни Шенлейна-Геноха, гепатита, гнойного гидраденита, IgA-нефропатии, интерстициального заболевания легких, ларингита, мастита, менингита, миелита, миокардита, миозита, нефрита, оофорита, орхита, остита, отита, панкреатита, эпидемического паротита, перикардита, перитонита, фарингита, плеврита, флебита, пневмонита, пневмонии, полимиозита, проктита, простатита, пиелонефрита, ринита, сальпингита, синусита, стоматита, синовита, тендинита, тонзиллита, язвенного колита, увеита, вагинита, васкулита или вульвита.
[00194] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ВТК, причем указанное заболевание или состояние выбрано из рака. В одном варианте осуществления к раку относится заболевание, вызванное пролиферацией В-клеток, например, диффузная В-крупноклеточная лимфома, фолликулярная лимфома, хроническая лимфоцитарная лимфома, хронический лимфоцитарный лейкоз, острый лимфоцитарный лейкоз, В-клеточный пролимфоцитарный лейкоз, лимоплазмицитарная лимфома/макроглобулинемия Вальденстрома, лимфома маргинальной зоны селезенки, множественная миелома (также известная как плазмоклеточная миелома), неходжкинская лимфома, ходжскинская лимфома, плазмоцитома, экстранодальная В-клеточная лимфома маргинальной зоны, нодальная В-клеточная лимфома маргинальной зоны, лимфома клеток коры головного мозга, медиастенальная (тимусная) В-крупноклеточная лимфома, внутрисосудистая В-крупноклеточная лимфома, первичная эффузионная лимфома, лимфома/лейкоз Буркитта или лимфоматоидный грануломатоз. В некоторых вариантах осуществления рак представляет собой рак молочной железы, рак простаты или рак мастоцитов (например, мастоцитома, тучноклеточный лейкоз, тучноклеточная саркома, системный мастоцитоз). В одном варианте осуществления настоящего изобретения указанный рак представляет собой рак костей. В другом варианте осуществления указанный рак представляет собой рак другого первичного происхождения, метастазирующий в костях. В конкретных вариантах осуществления рак представляет собой колоректальный рак или рак поджелудочной железы.
[00195] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний или состояний, ассоциированных с ВТК, включающих заболевания костей и суставов, включая, но не ограничиваясь ими, ревматоидный артрит, серонегативную спондилоартропатию (включающую анкилозирующий спондилит, псориатический артрит и синдром Рейтера), болезнь Бехчета, синдром Шегрена, системный склероз, остеопороз, рак костей и метастазы в костях.
[00196] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ВТК, где указанное заболевание или состояние выбрано из тромбоэмболических осложнений, например, инфаркт миокарда, стенокардия, реокклюзия после ангиопластики, рестеноз после ангиопластики, реокклюзия после аортокоронарного шунтирования, рестеноз после аортокоронарного шунтирования, инсульт, транзиторная ишемическая атака, окклюзионные заболевания периферических артерий, эмболия легких или глубокий венозный тромбоз.
[00197] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с BTK, включающих инфекционные и неинфекционные воспалительные явления, а также аутоиммунные и другие воспалительные заболевания. Такие аутоиммунные и воспалительные заболевания, расстройства и синдромы включают воспалительные заболевания органов таза, уретрит, солнечный ожог кожи, синусит, пневмонит, энцефалит, менингит, миокардит, нефрит, остиомиелит, миозит, гепатит, гастрит, энтерит, дерматит, гингивит, аппендицит, панкреатит, холецистит, агаммаглобулинемию, псориаз, аллергию, болезнь Крона, синдром раздраженного кишечника, язвенный колит, болезнь Шегрена, отторжение тканевого трансплантата, сверхострое отторжение трансплантированных органов, астму, аллергический ринит, хроническое обструктивное заболевание легких (COPD), аутоиммунное полигландулярное заболевание (также известное как аутоиммунный полигранулярный синдром), аутоиммунная алопеция, пернициозная анемия, гломерулонефрит, дерматомиозит, рассеянный склероз, склеродерму, васкулит, аутоиммунные гемолитические и тромбоцитопенические состояния, синдром Гудпасчера, атеросклероз, болезнь Аддисона, болезнь Паркинсона, болезнь Альцгеймера, диабет, септический шок, системную красную волчанку (SLE), ревматоидный артрит, псориатический артрит, подростковый артрит, остеоартрит, хроническая идиопатическая тромбоцитопеническая пурпура, макроглобулинемия Вальденстрома, тяжелая миастения, тиреоидит Хашимото, атопический дерматит, дегенеративное поражение суставов, витилиго, аутоиммунный гипопитуитаризм, синдром Гийена-Барре, болезнь Бехчета, склеродерма, фунгоидный микоз, острые воспалительные реакции (такие как синдром острой дыхательной недостаточности и ишемия/реперфузионное повреждение), болезнь Грейвса. В конкретных вариантах осуществления диабет представляет собой диабет I типа.
[00198] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ВТК, выбранных из ревматоидного артрита, рассеянного склероза, В-клеточного хронического лимфоцитарного лейкоза, острого лимфоцитарного лейкоза, лейкоза ворсистых клеток, неходжкинской лимфомы, ходжкинской лимфомы, множественной миеломы, рака костей, метастаз в костях, остеопороза, диабета (например, диабет I типа), синдрома раздраженного кишечника, болезни Крона, волчанки и ренального трансплантата.
(d) ITK
[00199] Индуцируемая интерлейкином-2 Т-клеточная киназа (ITK) экспрессируется в Т-клетках, мастоцитах и природных клетках-киллерах. Она активируется в Т-клетках при стимулировании рецептора Т-клеток (TCR) и в мастоцитах при активации высокоаффинного рецептора IgE. После стимуляции рецептора в Т-клетках, лимфоцит-специфическая тирозинкиназа Lck, фермента Src-семейства тирозинкиназ, фосфорилирует Y511 в активационной петле киназного домена ITK (S. D. Heyeck et al., 1997, J. Biol. Chem, 272, 25401-25408). Активированная ITK вместе с Zap-70 необходима для фосфорилирования и активации PLC-гамма (S.С. Bunnell et al., 2000, J. Biol. Chem., 275, 2219-2230). PLC-гамма катализирует образование инозитол-1,4,5-трифосфата и диацилглицерина, что приводит к мобилизации кальция и активации PKC, соответственно. Эти события активируют множество последующих путей и приводят в конечном итоге к дегрануляции (мастоциты) и экспрессии генов цитокинов (Т-клетки) (Y. Kawakami et al., 1999, J. Leukocyte BioL, 65, 286-290).
[00200] Роль ITK в активации Т-клеток подтверждена в опытах на мышах, нокаутированных по ITK. CD4+ Т-клетки из мышей, нокаутированных по ITK, демонстрировали низкий пролиферативный ответ в реакции смешанных лимфоцитов или при стимуляции Con А или анти-CD3. (X.С. Liao and D.R. Littman, 1995, Immunity, 3, 757-769). Также, Т-клетки из мышей, нокаутированных по ITK, производили мало IL-2 при стимуляции TCR, что приводило к пониженной пролиферации этих клеток. В другом исследовании CD4+ Т-клетки, дефицитные по ITK, производили пониженный уровень цитокинов, включая IL-4, IL-5 и IL-13 при стимуляции TCR, даже после примирования в индуцирующих условиях (D.J. Fowell, 1999, Immunity, 11, 399-409).
[00201] Роль ITK в активации PLC-гамма и мобилизации кальция также была подтверждена в Т-клетках этих нокаутированных мышей, у которых были значительно снижены образование IP3 и не происходил внеклеточный транспорт кальция при стимуляции TCR (K. Liu et al., 1998, J. Exp. Med. 187, 1721-1727). Подобные исследования подтверждают ключевую роль 1ТК в активации Т-клеток и мастоцитов. Таким образом, ингибитор ITK будет обладать благоприятным терапевтическим эффектом при заболеваниях, опосредованных несоответствующей активацией этих клеток.
[00202] Является широко признанным тот факт, что Т-клетки играют важную роль в регулировании иммунного ответа (Powrie and Coffman, 1993, Immunology Today, 14, 270-274). Действительно, активация Т-клеток часто является инициирующим событием в иммунологических заболеваниях. Следом за активацией TCR происходит транспорт кальция, который требуется для активации Т-клеток. При активации Т-клетки производят цитокины, включая IL-2, 4, 5, 9, 10 и 13, что приводит к пролиферации, дифференцировке и осуществлению эффекторной функции Т-клеток. Клинические исследования с использованием ингибиторов IL-2 продемонстрировали, что их вмешательство в процессы активации и пролиферации Т-клеток эффективно подавляет иммунный ответ in vivo (Waldmann, 1993, Immunology Today, 14, 264-270). Соответственно, агенты, которые ингибируют активацию Т-лимфоцитов и последующую продукцию цитокинов, являются терапевтически пригодными для селективного подавления иммунного ответа у пациентов, нуждающихся в такой иммуносупрессии.
[00203] Мастоциты играют серьезную роль в развитии астмы и аллергических заболеваний за счет высвобождаения медиаторы провоспаления и цитокины. Антиген-опосредованная аггрегация FεRI, высокоаффинных рецепторов иммуноглобулина IgE, приводит к активации мастоцитов (D.B.Corry et al., 1999, Nature, 402, В 18-23). Данный процесс запускает серию сигнальных событий, что приводит к высвобождению медиаторов, в том числе гистамина, протеаз, лейкотриенов и цитокинов (J.R. Gordon et al., 1990, Immunology Today, 11, 458-464). Эти медиаторы приводит к повышению проницаемости сосудов, продуцированию слизи, бронхоспазму, деградации тканей и воспалению, играя, таким образом, ключевую роль в этиологии и симптоматике астмы и аллергических заболеваний.
[00204] Опубликованные данные, полученные в результате экспериментов на нокаутированных по ITK- мышах, позволяют предположить, что в отсутствие активной ITK происходит увеличение числа Т-клеток памяти (A.T. Miller et al., 2002 The Journal of Immunology, 168, 2163-2172). Одним из путей повышения эффективности вакцинации является стимуляция образования большего количества Т-клеток памяти (S.M. Kaech et al., Nature Reviews Immunology, 2, 251-262). Кроме того, делеция ITK у мышей приводит к снижению уровней обусловленной рецепторами Т-клеток (ТСК)-индуцированной пролиферации и секреции цитокинов IL-2, IL-4, IL-5, IL-10 и IFN-y (Schaeffer et al, Science 284; 638-641 (1999)), Fowell et al. Immunity 11, 399-409 (1999), Schaeffer et al. Nature Immunology 2 (12): 1183-1188 (2001))). Иммунологические признаки аллергической астмы у ITK-делетированных (1ТК(-))-мышей выражены в меньшей степени. Воспаление легких, эозинофильная инфильтрация и производство слизи в ответ на введение аллергена овальбумина (OVA) у ITK(-)-мышей резко снижены (Mueller et al. Journal of Immunology 170: 5056-5063 (2003)). ITK также вовлечена в возникновение атопического дерматита. Было показано, что ген ITK интенсивнее экспрессируется в Т-клетках периферической крови у пациентов с умеренной и/или тяжелой формой атопического дерматита, чем в контрольной группе или в группе пациентов с легкой формой атопического дерматита (Matsumoto et al. International Archives of Allergy and Immunology 129: 327-340 (2002)).
[00205] Спленоциты RLK-делетированных мышей секретируют в два раза меньшее количество IL-2 по сравнению с клетками животных дикого типа в ответ на связывание TCR ((Schaeffer et al. Science 284: 638-641 (1999)); а одновременная делеция ITK и RLK у мышей приводит к выраженному ингибированию TCR-индуцированных ответов, включая пролиферацию и синтез цитокинов IL-2, IL-4, IL-5 и интерферона-гамма IFN-y (Schaeffer et al. Nature Immunology 2 (12): 1183-1188 (2001), Schaeffer et al. Science 284: 638-641 (1999)). В ITK/RLK-дефицитных Т-клетках после связывания TCR происходит внутриклеточная передача сигнала,; уровень продукции инозитолтрифосфата снижен, подавлены мобилизация кальция, активация MAP-киназы и факторов транскрипции NFAT и АР-1 (Schaeffer et al. Science 284: 638-641 (1999), Schaeffer et al. Nature Immunology 2 (12): 1183-1188(2001)).
[00206] Соединения согласно настоящему изобретению являются ингибиторами ITK и поэтому могут применяться для лечения одного или нескольких заболеваний, ассоциированных с активностью ITK-киназы. Таким образом, в некоторых вариантах осуществления настоящее изобретение включает способ лечения ITK-опосредованных заболеваний, включающий стадию введения пациенту, нуждающемуся в указанном лечении,, соединения согласно настоящему изобретению или его фармацевтически приемлемых композиций.
[00207] В настоящем описании термин "ITK-опосредованные" заболевания или состояния означает любое заболевание или другое патологическое состояния, известное тем, что в его возникновении играет роль ITK-киназа или ее мутант. Соответственно, в другом варианте осуществления настоящее изобретение относится к способу лечения или снижения тяжести одного или нескольких заболеваний, известных тем, что в их возникновении играет роль ITK-киназа или ее мутант. В частности, настоящее изобретение относится к способу лечения или снижения тяжести заболевания или состояния, выбранного из состояния, опосредованного мастоцитами, базофилами, иммунного или аллергического заболевания, при этом указанный способ включает введение пациенту, нуждающемуся в указанном лечении, соединения или композиции согласно настоящему изобретению.
[00208] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ITK-киназой, при этом указанное заболевание или состояние представялет собой иммунное расстройство, включая воспалительные заболевания, аутоиммунные заболевания, отторжения трансплантированных органов и костного мозга и других расстройств, связанных с иммунным ответом, опосредованным Т-клетками или мастоцитами.
[00209] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ITK, при этом указанное заболевание или состояние представляет собой острое или хроническое воспаление, аллергию, контактный дерматит, псориаз, ревматоидный артрит, рассеянный склероз, диабет (например, диабет I типа), синдром раздраженного кишечника, синдром Гийена-Барре, болезнь Крона, язвенный колит, рак, реакцию «трансплантат против хозяина» (и другие формы отторжения трансплантированных органов или костного мозга) или красную волчанку.
[00210] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ лечения или снижения тяжести одного или нескольких заболеваний и состояний, ассоциированных с ITK, при этом указанное заболевание или состояние представляет собой состояния, вызванных с мастоцитами, расстройство, опосредованное базофилами, обратимое закупоривание дыхательных путей, астму, ринит, хроническое обструктивное заболевнаие легких (COPD), периферическую Т-клеточную лимфому или ВИЧ [также известный как синдром приобретенного иммунодефицита (СПИД)]. Такие состояния включают описанные в публикации Readinger, et al., PNAS 105: 6684-6689 (2008).
(e) Семейство JAK-киназ
[00211] Янус-киназы (JAK) - семейство тирозинкиназ, состоящее из JAK1, JAK2, JAK3 и TYK2. JAK-киназы играют важную роль в цитокиновой сигнализации. Нижерасположенные субстраты киназ JAK-семейства включают белковые сигнальный трансдуктор и активатор транскрипции (STAT). JAK/STAT сигнализация задействована в возникновении различных аномальных иммунных ответов, таких как аллергии, астма, аутоиммунные заболевания, такие как отторжение трансплантата, ревматоидный артрит, боковой амиотрофический склероз и рассеянный склероз, а также твердые и гематологические злокачественныеопухоли, такие как лейкоз и лимфома. Фармацевтическое вмешательство в JAK/STAT сигнальный путь представлено в виде обзора [Frank, Mol. Med. 5: 432-456 (1999) и Seidel, et al, Oncogene 19: 2645-2656 (2000)].
[00212] JAK1, JAK2 и TYK2 экспрессируются во всех клетках, в то время как JAK3 преимущественно экспрессируется в гемопоэтических клетках. JAK3 избирательно связывается с общей гамма цепью цитокинового рецептора (γC) и активируется интерлейкинами IL-2, IL-4, IL-7, IL-9 и IL-15.
[00213] Было показано, что пролиферация и выживаемость мастоцитов мышей, индуцированных IL-4 и IL-9, действительно зависят от JAK3 и γC-сигнализации [Suzuki et al. Blood 96: 2172-2180 (2000)].
[00214] Перекрестное связывание высокоаффинных иммуноглобулиновых IgE рецепторов в сенсибилизированных мастоцитах приводит к высвобождению провоспалительных медиаторов, в том числе ряда вазоактивных цитокинов, в результате чего формируется острая аллергическая реакция или реакция гиперчувствительности немедленного типа (типа I) [Gordon et al. Nature 346: 274-276 (1990) и Galli, N. Engl. J. Med., 328: 257-265 (1993)]. Была установлена важная роль JAK3 в опосредованных IgE рецепторами ответах мастоцитах in vitro и in vivo [Malaviya, et al, Biochem. Biophys. Res. Commun. 257: 807-813 (1999)]. Кроме того, было описано предотвращение реакций гиперчувствительности I типа, в том числе анафилактического шока, опосредованного активацией мастоцитов, за счет ингибирования JAK3 [Malaviya et al, J. Biol. Chem. 274: 27028-27038 (1999)]. Направленное воздействие ингибиторов JAK3 на мастоциты регулирует дегрануляцию мастоцитов in vitro и предотвращает IgE рецептор/антиген-опосредованн$1 анафилактические реакции in vivo.
[00215] Недавние исследования подтвердили успешное использование механизма направленного воздействия JAK3 для подавлении иммунитета и приживлении аллотрансплантатов. В данных исследованиях было продемонстрировано дозозависимое приживление аллотрансплантата сердца буйвола у крыс линии Вистар (Wistar Furth) при введении ингибиторов JAK3, что указывает на возможность регулирования нежелательных иммунных реакций «трансплантат против хозяина» [Kirken, Transpl. Proc. 33:3268-3270(2001)].
[00216] IL-4-опосредованное STAT-фосфорилированиеявляется механизмом, участвующим в формировании ранних и поздних стадий ревматоидного артрита (РА). Повышенная экспрессия провоспалительных цитокинов в синовиальной оболочке и синовиальной жидкости при РА является характерным для данного заболевания. Показано, что IL-4-опосредованная активация пути IL-4/STAT опосредована янус-киназами (JAK1 и 3), и что IL-4-ассоциированные JAK-киназы экспрессируются в синовиальной оболочке при PA [Muller-Ladner, et al, J. Immunol. 164: 3894-3901 (2000)].
[00217] Семейный боковой амиотрофический склероз (FALS) является смертельным нейродегенеративным расстройством, поражающим около 10% от пациентов, страдающих боковым амиотрофическим склерозом. Выживаемость мышей с синдромом FALS увеличилась при лечении специфическим ингибитором JAK3-киназы. Это подтвердило, что JAK3 участвует в формировании FALS [Trieu и др., Biochem. Biophys. Res. Commun. 267: 22-25 (2000)].
[00218] Белковые трансдуктор сигнала и активатор транскрипции (STAT) активируются, в частности, киназами семейства JAK. Результаты недавнего исследования указывают на возможность вмешательства в сигнальный путь JAK/STAT путем направленного воздействия на киназ семейства JAK специфическими ингибиторами при лечении лейкоза [Sudbeck, et al., Clin. Cancer Res. 5: 1569-1582 (1999)]. Было показано, что JAK3-специфные соединения препятствуют клональному росту JAK3-экспрессирующих клеточных линий DAUDI, RAMOS, LC1; 19, NALM-6, MOLT-3 и HL-60. Ингибирование JAK3 и TYK 2 блокирует тирозин-фосфорилирование STAT3 и останавливает рост клеток фунгоидного микоза (формы кожной Т-клеточной лимфомы).
[00219] JAK3 также связывают с диабетом. Ингибитор JAK3 показал высокую иммуномодулирующую активность и задержал дебют диабета на модели аутоиммунного диабета I типа NOD мышей (Cetkovic-Cvrlje, et al. Clin. Immunol. 106: 213-225 (2003)).
[00220] В другом варианте осуществления изобретение обеспечивает способ лечения или снижения тяжести JAK3-опосредованных заболеваний или состояний у пациента, включающий стадию введения указанному пациенту композиции согласно настоящему изобретению.
[00221] Термин "JAK3-опосредованное заболевание", используемый в настоящем описании, означает любое заболевание или другое патологическое состояние, известное тем, что в его возникновении играет роль JAK3-киназа. Соответственно, в одном варианте осуществления настоящее изобретение относится к лечению или снижению тяжести одного или нескольких заболеваний, известных тем, что в их возникновении играет роль JAK3-киназа. В частности, настоящее изобретение относится к способу лечения или снижения тяжести заболевания или состояния, выбранного иммунных реакций, таких как аллергические реакции или реакции гиперчувствительности I типа, астма, аутоиммунные заболевания, такие как отторжение трансплантата, реакции «трансплантат против хозяина», ревматоидный артрит, диабет (например, диабет I типа), боковой амиотрофический склероз и рассеянный склероз; нейродегенеративные расстройства, такие как семейный боковой амиотрофический склероз (FALS), а также твердые и гематологические злокачественные опухоли, такие как лейкозы и лимфомы, при этом указанный способ включает введение пациенту, нуждающемуся в указанном способе, композиции согласно настоящему изобретению.
[00222] Соединения и композиции согласно настоящему изобретению могут быть введены в любом количестве и любыми способами введения, эффективными для лечения или снижения тяжести рака, аутоиммунных расстройств, нейродегенеративных или неврологических расстройств, шизофрении, заболеваний костей, болезней печени или сердца. Точное необходимое количество будет изменяться от субъекта к субъекту в зависимости от вида, возраста и общего состояния субъекта, тяжести инфекции, конкретного типа лекарственного агента, способа его введения и т.п. Соединения согласно настоящему изобретению предпочтительно должны быть представлены в единичных дозированных формах, удобных для приема и обеспечивающих однородность единиц дозирования. Термин "единичная дозированная форма", используемый в настоящем описании, относится к физически дискретной единице лекарственного агента, подходящего пациенту, подвергающегося лечению. Однако необходимо понимать, что совокупное количество соединений и композиций согласно настоящему изобретению, назначаемое пациенту ежедневно, должно определяться лечащим врачом по результатам тщательного медицинского обследования. Конкретная эффективная доза для каждого конкретного пациента или организма будет зависеть от многих факторов, включая характер заболевания, подвергаемого лечению, и степень его тяжести, активность конкретного используемого соединения; конкретную используемую композицию, возраст, массу тела, общее состояние здоровья, пол и рацион питания пациента; время введения, способ введения и скорость выведения из организма конкретного используемого соединения; длительность лечения; лекарства, используемые в комбинации или параллельно с конкретным используемым соединением и другие факторы, известные специалистам в медицине. Термин "пациент", используемый в настоящем описании, означает животное, предпочтительно млекопитающее, и более предпочтительно, человека.
[00223] Фармацевтически приемлемые композиции согласно настоящему изобретению, могут быть введены людям и животным перорально, ректально, парентерально, интрацистернально, интравагинально, внутрибрюшинно, местно (в виде порошков, мазей или капель), буккально, распылением в носовую или ротовую полость (в виде спрея) и т.п., в зависимости от тяжести инфекции, подвергаемой лечению. В некоторых вариантах осуществления соединения согласно настоящему изобретению могут быть введены перорально или парентерально в дозировке от примерно 0,01 мг/кг до примерно 50 мг/кг, и предпочтительно от примерно 1 мг/ кг до примерно 25 мг/кг массы тела в день, один или несколько раз в день, для получения желаемого терапевтического эффекта.
[00224] Жидкие лекарственные формы для перорального введения включают, но не ограничиваются ими, фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. Помимо активных компонентов жидкие лекарственные формы могут содержать инертные разбавители, обычно используемые в данной области, такие как, например, воду или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное, масло зародышей пшеницы, оливковое, касторовое, кунжутное), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры жирных кислот и сорбита, и их смеси. Кроме инертных разбавителей композиции для перорального введения могут включать вспомогательные вещества, такие как увлажняющие агенты, эмульгаторы и суспендирующие агенты, подсластители, вкусовые и ароматизирующие добавки.
[00225] Препараты для инъекций, например, стерильные инъекционные водные или масляные суспензии, могут быть приготовлены в соответствии с общеизвестными методиками с использованием подходящих диспергирующих или увлажняющих агентов и суспендирующих агентов. Стерильный инъекционный препарат может быть также представлен стерильным инъекционным раствором, суспензией или эмульсией в нетоксичном парентерально приемлемом разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Примерами приемлемых разбавителей или растворителей, пригодные для использования, являются вода, раствор Рингера, U.S.Р. и изотонический раствор хлорида натрия. Кроме того, обычно в качестве растворителей или суспендирующей среды применяют стерильные жирные масла. С этой целью может быть использовано любое нейтральное жирное масло, в том числе синтетические моно- или диглицериды. Кроме того, для приготовления инъекционных препаратов используются жирные кислоты, например, олеиновая кислота.
[00226] Составы для инъекций могут быть стерилизованы, например, путем фильтрации через удерживающий бактерии фильтр или путем включения стерилизующих агентов в виде твердых стерильных композиций, которые перед использованием могут быть растворены или диспергированы в стерильной воде или другой стерильной среде для инъекций.
[00227] Для пролонгации эффекта соединения согласно настоящему изобретению часто желательно замедлить абсорбцию указанного соединения, введенного инъекционно подкожно или внутримышечно. Это может быть достигнуто путем использования жидкой суспензии кристаллического или аморфного вещества, плохо растворимого в воде. Скорость абсорбции соединения в этом случае будет зависеть от скорости его растворения, что, в свою очередь, может зависеть от размера кристаллов и кристаллической формы. Кроме того, при парентеральном введении соединения замедлить абсорбцию можно путем растворения или суспендирования соединения в масляном разбавителе. Инъекционные препараты замедленного всасывания изготавливаются путем образования микрокапсул, содержащих соединение, в биоразлагаемых полимерах, таких как полилактид-полигликолид. Скорость высвобождения соединения можно регулировать, так как она зависит от соотношения соединение-полимер и природы конкретного используемого полимера. Примеры других биоразлагаемых полимеров включают поли(ортоэфиры) и поли(ангидриды). Инъекционные препараты замедленного всасывания также могут быть изготовлены путем заключения соединения в липосомы или микроэмульсии, совместимые с тканями организма.
[00228] Составы для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые могут быть получены путем смешивания соединений согласно настоящему изобретению с подходящими нераздражающими наполнителями или носителями, такими как какао-масло, полиэтиленгликоль или воск для суппозиториев, твердыми при комнатной температуре, но жидкими при температуре тела, и поэтому растворяющимися в прямой кишки или вагинальномй полости, высвобождая активное вещество.
[00229] Твердые лекарственные формы для перорального введения включают капсулы, таблетки, пилюли, порошки и гранулы. В таких твердых лекарственных формах активное соединение смешивают по меньшей мере с одним инертным фармацевтически приемлемым наполнителем или носителем, например, с цитратом натрия или дикальцийфосфатом и/или а) наполнителями или добавками, такими, как крахмал, лактоза, сахароза, глюкоза, маннит и кремниевая кислота; б) связующими веществами, такими как, например, карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидинон, сахароза и гуммиарабик; в) влагоудерживаюшие вещества, такие как глицерин; г) вещества, улучшающие распадаемость таблеток, например, агар-агар, карбонат кальция, картофельный или тапиоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; д) замедлители растворения, такие как парафин; е) ускорители абсорбции, например, четвертичные соединения аммония; ж) увлажняющие агенты, такие как, например, цетиловый спирт и моностеарат глицерина; з) абсорбенты, например, каолин и бентонитовая глина; и) лубриканты, такие как тальк, стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси. В случае капсул, таблеток и пилюль лекарственная форма может также содержать буферные вещества.
[00230] Подобные твердые композиции могут быть также использованы при изготовлении желатиновых капсул с мягким или твердым содержимым в качестве наполнителей, в этом случае могут быть использованы такие наполнители, каклактоза (молочный сахар), высокомолекулярные полиэтиленгликоли и т.п. Твердые лекарственные формы - таблетки, драже, капсулы, пилюли, гранулы - могут производиться с покрытиями и оболочками, например, кишечнорастворимой оболочкой и др. оболочками, хорошо известными в области готовых лекарственных форм. Они могут необязательно содержать замутняющие агенты, а также могут иметь состав, обеспечивающий высвобождение только активного(ых) ингредиента(ов) или, предпочтительно, в определенной части кишечного тракта, необязательно отложенное во времени. Примеры капсулирующих композиций, пригодных для использования, включают полимерные вещества и воски. Твердые композиции подобного типа могут быть также использованы в качестве наполнителей в желатиновых капсулах с мягким или твердым содержимым, включая такие наполнители как лактоза (молочный сахар), высокомолекулярные полиэтиленгликоли и т.п.
[00231] Активные соединения могут также быть представлены микроинкапсулированными формами, в состав которых входит один или несколько наполнителей из описанных выше. Твердые лекарственные формы - таблетки, драже, капсулы, пилюли и гранулы - могут производиться с покрытиями и оболочками, например, кишечнорастворимым покрытием, покрытием, контролирующим высвобождение действующего вещества, и другими покрытиями, хорошо известными в области готовых лекарственных форм. В таких твердых лекарственных формах активное вещество может быть смешано по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Обычной практикой является также добавление в такие лекарственные формы помимо инертных разбавителей дополнительных веществ, например, лубрикантов для таблеток и других вспомогательных таблетирующих агентов, таких, как стеарат магния и микрокристаллическая целлюлоза. При производстве капсул, таблеток и пилюль лекарственные формы могут также содержать буферные агенты. Они могут необязательно содержать замутняющие агенты, а также могут иметь состав, обеспечивающий высвобождение только активного(ых) ингредиента(ов) или, предпочтительно, в определенной части кишечного тракта, необязательно отложенное во времени. Примеры капсулирующих композиций, пригодных для использования, включают полимерные вещества и воски.
[00232] Лекарственные формы для местного применения или чрескожного введения соединения согласно настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингаляции или пластыри. Активные компоненты смешивают в стерильных условиях с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферными веществами. Офтальмологические препараты, ушные капли и глазные капли предусмотрены настоящим изобретением. Кроме того, настоящее изобретение предусматривает использование трансдермальных пластырей, которые имеют дополнительное преимущество, обеспечивая контролируемое поступление действующего вещества в организм. Такие лекарственные формы могут быть изготовлены путем растворения или разведения соединения в подходящей среде. Для увеличения эффективности проникновения через кожу могут быть использованы усилители абсорбции. Скорость выделения можно регулировать либо при помощи мембраны, контролирующей скорость выделения действующего вещества, либо путем диспергирования соединения в полимерной матрице или геле.
[00233] В одном варианте осуществления изобретение относится к способу ингибирования активности протеинкиназы в биологическом образце, включающему стадию осуществления контакта биологической образца с соединением согласно настоящему изобретению, или композиции, содержащей указанное соединение.
[00234] В другом варианте осуществления изобретение относится к способу ингибирования активности ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов в биологическом образце, включающему стадию осуществления контакта указанного биологического образца с соединением согласно настоящему изобретению или композиции, содержащей указанное соединение. В некоторых вариантах осуществления изобретение относится к способу необратимого ингибирования активности ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3 или их мутантов, в биологическом образце, включающему стадию осуществления контакта указанного биологического образца с соединением согласно настоящему изобретению или композиции, содержащей указанное соединение.
[00235] В настоящем описании термин "биологический образец" включает, но не ограничивается ими, клеточные культуры или их экстракты, материалы биопсии, полученные из тканей млекопитающих, или их экстракты, а также кровь, слюну, мочу, кал, сперму, слезную жидкость или другие жидкости организма или их экстракты.
[00236] Ингибирование протеинкиназной активности или активности протеинкиназ, выбранных из ErbB1, ErbB2, ErbB3, ErbB4, ТЕС-киназы и/или JAK3 или их мутантов, в биологических образцах может быть использовано с различными целями, очевидными для специалистов в данной области. Примеры таких целей включают, но не ограничиваются ими, переливание крови, трансплантацию органов, хранение биологических образцов и биологических проб.
[00237] В другом варианте осуществления настоящее изобретение относится к способу ингибирования активности протеинкиназы у пациента, включающему стадию введения указанному пациенту соединения согласно настоящему изобретению или композиции, содержащей указанное соединение.
[00238] В другом варианте осуществления настоящее изобретение относится к способу ингибирования активности одной или нескольких киназ из ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов, у пациента, включающему стадию введения указанному пациенту соединения согласно настоящему изобретению или композиции, содержащей указанное соединение. В некоторых вариантах осуществления изобретение относится к методу необратимого ингибирования активности одной или нескольких киназ из ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов, у пациента, включающему стадию введения указанному пациенту соединения согласно настоящему изобретению или композиции, содержащей указанное соединение. В других вариантах осуществления настоящее изобретение обеспечивает способ лечения заболеваний, опосредованных одной или несколькими киназами из ErbB1, ErbB2, ErbB3, ErbB4, TEC-киназы и/или JAK3, или их мутантов, у пациента, нуждающегося в у, включающему стадию введения указанному пациенту соединения согласно настоящему изобретению или его фармацевтически приемлемой композиции. Такие заболевания подробно описаны в настоящем тексте.
[00239] В зависимости от конкретного состояния или заболевания, подвергаемого лечению, в композиции согласно настоящему изобретению могут присутствовать дополнительные лекарственные агенты, обычно назначаемые при терапии данного состояния. В настоящем описании такие дополнительные лекарственные агенты, обычно назначаемые для лечения конкретного заболевания или состояния, упоминаются как "подходящие для лечения заболевания или состояния, подвергаемого лечению".
[00240] Например, соединения согласно настоящему изобретению или их фармацевтически приемлемые композиции вводят в сочетании с химиотерапевтическими агентами для лечения пролиферативных заболеваний и рака. Примеры известных химиотерапевтических агентов включают, но не ограничиваются ими, адриамицин, дексаметазон, винкристин, циклофосфамид, фторурацил, топотекан, таксол, интерфероны, производные платины, таксан (например, паклитаксел), алкалоиды барвинка (например, винбластин), антрациклины (например, доксорубицин), эпиподофиллотоксины (например, этопозид), цисплатин, ингибиторы mTOR (например, рапамицин), метотрексат, актиномицин D, доластатин 10, колхицин, эметин, триметрексат, метоприн, циклоспорин, даунорубицин, тенипозид, амфотерицин, алкилирующие агенты (например, хлорамбуцил), 5-фторурацил, камптотецин, цисплатин, метронидазол, «Гливек»™ и др. В других вариантах осуществления соединения согласно настоящему изобретению вводят в сочетании с биологическим агентом, таким как «Авастин» или VECTIBIX.
[00241] В некоторых вариантах осуществления соединения согласно настоящему изобретению или их фармацевтически приемлемые композиции вводят в сочетании с одним или несколькими антипролиферативными или химиотерапевтическими агентами, выбранными из одного или нескольких следующих: абареликс, альдеслейкин, алемтузумаб, алитретиноин, аллопуринол, альтретамин, амифостин, анастрозол, триоксид мышьяка, аспарагиназа, азацитидин, живая БЦЖ, бевацизумаб, фторурацил, бексаротен, блеомицин, бортезомиб, бусульфан, калустерон, капецитабин, камптотецин, карбоплатин, кармустин, целекоксиб, цетуксимаб, хлорамбуцил, кладрибин, клофарабин, циклофосфамид, цитарабин, дактиномицин, дарбепоэтин альфа, даунорубицин, денилейкин, дексразоксан, доцетаксел, доксорубицин (нейтральный), доксорубицина гидрохлорид, дромостанолон пропионат, эпирубицин, эпоэтин альфа, эрлотиниб, эстрамустин, этопозида фосфат, этопозид, экземестан, филграстим, флоксуридин, флударабин, фулвестрант, гефитиниб, гемцитабин, гемтузумаб, госерелина ацетат, гистрелина ацетат, гидроксимочевина, ибритумомаб, идарубицин, ифосфамид, иматиниба мезилат, интерферон альфа-2a, интерферон альфа-2b, иринотекан, леналидомид, летрозол, лейковорин, лейпролида ацетат, левамизол, ломустин, мегестрола ацетат, мелфалан, меркаптопурин, 6-меркаптопурин (6-MP), месна, метотрексат, метоксален, митомицин C, митотан, митоксантрон, нандролон, неларабин, нофетумомаб, опрелвекин, оксалиплатин, паклитаксел, палифермин, памидронат, пегадемаза, пегаспаргаза, пэгфилграстим, пеметрексед динатрия, пентостатин, пипоброман, пликамицин, порфимер натрия, прокарбазин, хинакрин, расбуриказа, ритуксимаб, сарграмостим, сорафениб, стрептозоцин, сунитиниба малеат, тальк, тамоксифен, темозоломид, тенипозид, VM-26, тестолактон, тиогуанин, 6-тиогуанин (6-TG), тиотепа, топотекан, торемифен, тоситумомаб, трастузумаб, третиноин, ATRA, урамустин, вальрубицин, винбластин, винкристин, винорельбин, золедронат или золедроновая кислота.
[00242] Примеры других агентов, с которыми могут быть скомбинированы ингибиторы, являющиеся предметом данного изобретения, включают, но не ограничиваются ими, препараты для лечения болезни Альцгеймера, такие как донепезила гидрохлорид (Арисепт®) и ривастигмин (Экселон®); препараты для лечения болезни Паркинсона, такие как леводопа (L-DOPA)/карбидопа, энтакапон, ропинирол, прамипексол, бромокриптин, перголид, тригексифенидил и амантадин; средства для лечения рассеянного склероза, такие как бета-интерферон (например, Авонекс® и Ребиф®), глатирамера ацетат (Копаксон®) и митоксантрон; препараты для лечения астмы, такие, как альбутерол и монтелукаст (Сингуляр®); препараты для лечения шизофрении, такие, как зипрекса, риспердал, сероквель и галоперидол; противовоспалительные средства, такие как кортикостероиды, блокаторы ФНО (фактора некроза опухолей) (TNF), IL-1 РА (блокаторы интелейкина-1), азатиоприн, циклофосфамид и сульфасалазин; иммуномодулирующие и иммуносупрессивные препараты, такие, как циклоспорин, такролимус, рапамицин, микофенолата мофетил, интерфероны, кортикостероиды, циклофосфамид, азатиоприн и сульфасалазин; и нейротрофические факторы, такие как ингибиторы ацетилхолинэстеразы, ингибиторы моноаминоксидазы (МАО), интерфероны, противосудорожные препараты, блокаторы ионных каналов, рилузол и препараты для лечения болезни Паркинсона; препараты для лечения сердечно-сосудистых заболеваний, такие как бета-блокаторы, ингибиторы АПФ (ангиотензинпревращающего фермента) (АСЕ), диуретики, нитраты, блокаторы кальциевых каналов и статины; препараты для лечения заболеваний печени, такие как кортикостероиды, холестирамин, интерфероны; противовирусные препараты; препараты для лечения заболеваний крови, такие как кортикостероиды, антилейкемические препараты, факторы роста, а также препараты для лечения иммунодефицитных состояний, такие как гамма-глобулин.
[00243] В некоторых вариантах осуществления соединения согласно настоящему изобретению или их фармацевтически приемлемые композиции вводят в комбинации с моноклональным антителом или препаратами малой интерферирующей РНК (siRNA).
[00244] Эти дополнительные агенты можно вводить отдельно от композиций, содержащих соединения согласно настоящему изобретению, в составе комплексной схемы лечения. Также эти средства могут быть частью одной дозированной формы в смеси с соединением согласно настоящему изобретению. При назначении в составе комплексной схемы, два активных вещества могут приниматься одновременно, последовательно или с временным интервалом, обычно равным пяти часам.
[00245] Используемые в настоящем описании термины «комбинация», "комбинированный" и связанные с ними термины относятся к одновременному или последовательному введению лекарственных агентов согласно настоящему изобретению. Например, соединения согласно настоящему изобретению могут быть введены одновременно или последовательно с другим лекарственным агентом в виде отдельных дозированных форм или в составе одной дозированной формы. Таким образом, настоящее изобретение обеспечивает единичную дозированную форму, содержащую предложенное соединение, дополнительные лекарственный агент и фармацевтически приемлемые - носитель, вспомогательное вещество или разбавитель.
[00246] Количество обоих веществ - соединения согласно настоящему изобретению и дополнительного лекарственного агента (в тех композициях, которые содержат дополнительный лекарственный агент, описанный выше), которое может быть скомбинировано с веществами-носителями для производства единичной дозированной формы, будет меняться в зависимости от подвергаемого лечению объекта и способа введения. Предпочтительно, композиции согласно настоящему изобретению должны быть приготовлены таким образом, чтобы обеспечивать возможность введения соединения согласно настоящему изобретению в дозировке 0,01-100 мг/кг массы тела в день.
[00247] В композициях, содержащих дополнительный лекарственный агент, указанный дополнительный лекарственный агент и соединение согласно настоящему изобретению могут действовать синергически. Таким образом, количество дополнительного лекарственного агента в таких композициях будет меньше, чем требуется при монотерапии с использованием только указанного лекарственного агента. В таких композициях дополнительный лекарственный агент может быть введен в дозировке 0,01-1000 мкг/кг массы тела в день.
[00248] Количество дополнительного лекарственного агента, присутствующего в композициях согласно настоящему изобретению, не будет превышать количество, обычно вводимое в составе тех композиций, где указанный лекарственный агент является единственным активным веществом. Предпочтительно, количество дополнительного лекарственного агента в композициях согласно настоящему изобретению будет варьироваться от 50% до 100% от количества, обычно присутствующего в композициях, где указанный лекарственный агент является единственным терапевтически активным веществом.
[00249] Соединения согласно настоящему изобретению или их фармацевтические композиции, также могут быть включены в композиции для покрытия имплантируемых медицинских устройств, таких как протезы, искусственные клапаны, сосудистые импланты, стенты и катетеры. Сосудистые стенты, например, используются для подавления рестеноза (повторного сужения просвета сосуда после повреждения). Однако при использовании стентов или других имплантируемых устройств у пациентов существует риск образования тромбов или активации тромбоцитов. Эти нежелательные эффекты могут быть предотвращены или уменьшены путем предварительного покрытия имплантируемого устройства фармацевтически приемлемой композицией, содержащей ингибитор киназы. Имплантируемые устройства, покрытые соединением согласно настоящему изобретению, являются другим вариантом осуществления настоящего изобретения.
5. Соединения-зонды
[00250] В некоторых аспектах соединение согласно настоящему изобретению может быть связано с детектируемой группой с образованием соединения-зонда. В одном аспекте соединение-зонд согласно настоящему изобретению включает необратимый ингибитор протеинкиназы формулы I-a или I-b, как описано выше, детектируемую группу и связывающую группу, которая присоединяет ингибитор к детектируемой группе.
[00251] В некоторых вариантах осуществления такие соединения-зонды согласно настоящему изобретению включают предложенное соединение формулы I-a или I-b, связанное с детектируемой группой, Rt, бивалентной связывающей группой, -T-. Связывающая группа может быть присоединены к соединению формулы I-a или I-b через Кольцо A, Кольцо B или R1. Среднему специалисту в данной области будет очевидно, что если связывающая группа связана с R1, R1 представляет собой бивалентную высокореакционную группу, обозначенную R1’. В некоторых вариантах осуществления предложенное соединение-зонд выбрано из соединений любой из формул V-a, V-b, VI-a, VI-b, VII-a или VII-b:
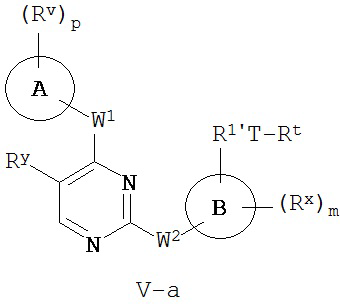
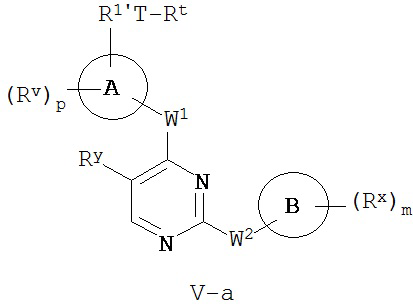
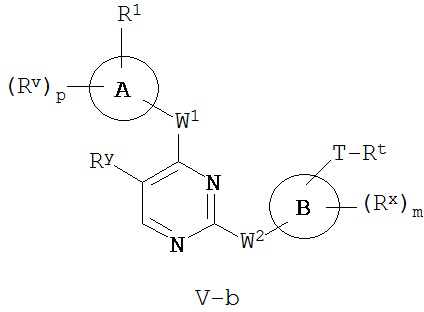
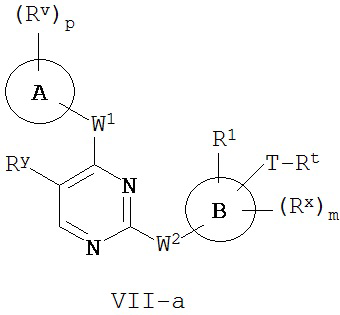
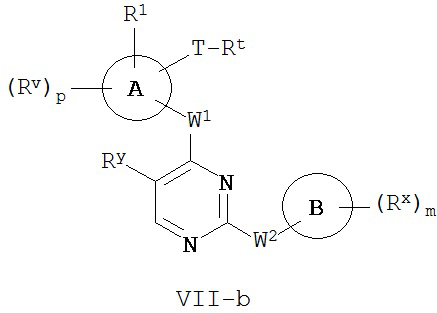
где каждый из Кольца A, Кольца B, R1, m, p, Rx, Ry, Rv, W1 и W2 имеет значение, приведенное выше для формул I-a и I-b и описанные в классах и подклассах в настоящем тексте. R1’ представляет собой бивалентную высокореакционноспособную группу, T представляет собой бивалентную связывающую группу, и Rt представляет собой детектируемую группу.
[00252] В некоторых вариантах осуществления Rt представляет собой детектируемую группу, выбранную из первичной метки или вторичной метки. В некоторых вариантах осуществления Rt представляет собой бивалентную детектируемую группу, выбранную из флуоресцентной метки (например, флуоресцентного красителя или флуорофора), масс-спектрометрической метки, хемилюминесцентной группы, хромофора, электронно-плотной группы или агента, переносящего энергию.
[00253] В настоящем тексте термин "детектируемая группа" используется взаимозаменяемо с терминами "метка" и "репортерная группа" и относится к любой группе, которую можно детектировать, например, к первичным метками и вторичным меткам. Присутствие детектируемой группы можно определить с использованием методов количественного анализа (в абсолютных, приблизительных или относительных единицах) детектируемой группы в исследуемой системе. В некоторых вариантах осуществления такие методы хорошо известны средним специалистам в данной области и включают любые методы количественного анализа репортерной группы (например, метки, красителя, фото-кросслинкера, цитотоксического соединения, лекарственного средства, аффинной метки, фотоаффинной метки, реакционноспособного соединения, антитела или фрагмента антитела, биоматериала, наночастицы, спиновой метки, флуорофора, металлсодержащей группы, радиоактивной группы, квантовой точки (точек), новой функциональной группы, группы, которая ковалентно или нековалентно взаимодействует с другими молекулами, фотосвязываемой группы, группы, возбуждаемой актиничным излучением, лиганда, фотоизомеризуемой группы, биотина, аналога биотина (например, биотин сульфоксида), группы, содержащей тяжелый атом, химически расщепляемой группы, фоторасщепляемой группы, редокс-активного агента, группы, меченной изотопом, биофизического зонда, фосфоресцентной группы, хемилюминесцентной группы, электронно-плотной группы, магнитной группы, интеркалирующей группы, хромофора, агента, переносящего энергию, биологически активного вещества, детектируемой метки и любой комбинации вышеперечисленного).
[00254] Первичные метки, такие как радиоактивные изотопы (например, тритий, 32P, 33P, 35S, 14C, 123I, 124I, 125I или 131I), масс-спектрометрические метки, включая, без ограничения, стабильные изотопы (например, 13C, 2H, 17O, 18O, 15N, 19F и 127I), позитрон-испускающие изотопы (например, 11C, 18F, 13N, 124I и 15O) и флуоресцентные метки, представляют собой репортерные группы, генерирующие сигнал, которые можно детектировать без дополнительных модификаций. Детектируемые группы можно анализировать способами, включающими, но не ограничивающимися перечисленными: флюоресценция, позитронно-эмиссионная томография, медицинская визуализация SPECT, хемилюминесценция, электронный спиновый резонанс, спектроскопия поглощения в УФ- и видимой областях, масс-спектрометрия, ядерный магнитный резонанс, магнитный резонанс, проточная цитометрия, авторадиография, регистрация сцинтилляций и электрохимические методы.
[00255] Термин «вторичная метка» в настоящем описании относится к группам, таким как биотин и антигены различных белков, которые генерируют детектируемый сигнал только в присутствии второго промежуточного соединения. Для биотина вторичным промежуточным соединением могут быть конъюгаты стрептавидин-фермент. Для меток, являющихся антигенами, вторичные промежуточные соединения могут включать конъюгаты антитело-фермент. Некоторые флуоресцентные группы действуют как вторичные метки, поскольку они переносят энергию на другую группу в процессе безызлучательного резонансного переноса энергии (FRET), и указанная вторая группа генерирует детектируемый сигнал.
[00256] Термины «флуоресцентная метка», «флуоресцентный краситель» и "флуорофор" в настоящем описании относятся к группам, которые поглощают энергию света на определенной длине волны возбуждения и испускают световую энергию на другой длине волны. Примеры флуоресцентных меток включают, но не ограничиваются перечисленными: красители Alexa Fluor (Alexa Fluor 350, Alexa Fluor 488, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 660 и Alexa Fluor 680), AMCA, AMCA-S, красители BODIPY (BODIPY FL, BODIPY R6G, BODIPY TMR, BODIPY TR, BODIPY 493/503, BODIPY 530/550, BODIPY 558/568, BODIPY 564/570, BODIPY 576/589, BODIPY 581/591, BODIPY 630/650, BODIPY 650/665), карбоксиродамин 6G, карбокси-X-родамин ROX), Cascade Blue, Cascade Yellow, кумарин 343, цианиновые красители (Cy3, CY5, Cy3.5, Cy5.5), данзил, дапоксил (Dapoxyl), диалкиламинокумарин, 4’,5’-дихлор-2’,7’-диметокси-флуоресцеин, DM-NERF, эозин, эритрозин, флуоресцеин, FAM, Гидроксикумарин, IRDyes (IRD40, IRD 700, IRD 800), JOE, Lissamine rhodamine В, Marina Blue, метоксикумарин, нафтофлуоресцеин, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, PyMPO, пирен, родамин В, родамин 6G, родаминовый зеленый, родаминовый красный, Rhodol Green, 2’,4’,5’,7’-тетра-бромсульфон-флуоресцеин, тетраметил-родамин (TMR), карбокситетраметилродамин (TAMRA), техасский красный, техасский красный X, 5(6)-карбоксифлуоресцеин, 2,7-дихлорфлуоресцеин, N,N-Bis(2,4,6-trimethylphenyl)-3,4:9,10-perylenebis(dicarboximide, HPTS, Ethyl Eosin, DY-490XL MegaStokes, DY-485XL MegaStokes, Adirondack Green 520, ATTO 465, ATTO 488, ATTO 495, YOYO-1.5-FAM, BCECF, дихлорфлуоресцеин, родамин 110, родамин 123, YO-PRO-1, SYTOX Green, Sodium Green, SYBR Green I, Alexa Fluor 500, FITC, Fluo-3, Fluo-4, fluoro-emerald, YoYo-1 ssDNA, YoYo-1 dsDNA, YoYo-1, SYTO RNASelect, Diversa Green-FP, Dragon Green, EvaGreen, Surf Green EX, Spectrum Green, NeuroTrace 500525, NBD-X, MitoTracker Green FM, LysoTracker Green DND-26, CBQCA, PA-GFP (пост-активационный), WEGFP (пост-активационный), FlASH-CCXXCC, Azami Green мономерный, Azami Green, зеленый флуоресцентный белок (GFP), EGFP (Campbell Tsien 2003), EGFP (Patterson 2001), Kaede Green, 7-бензиламино-4-нитробенз-2-окса-1,3-диазол, Bexl, доксорубицин, Lumio Green и SuperGlo GFP.
[00257] Термин «масс-спектрометрическая метка» в настоящем тексте относится к любой группе, которую возмоно однозначно детектировать по ее массе посредством масс-спектрометрических (MS) методов. Примеры масс-спектрометрических меток включают метки, высвобождающие электрофоры, такие как N-[3-[4’-[(p-метокситетрафторбензил)окси]фенил]-3-метилглицеронил]изонипекотиновая кислота, 4’-[2,3,5,6-тетрафтор-4-(пентафторфеноксил)]метил ацетофенон и их производные. Синтез и использование этих масс-спектрометрических меток описаны в патентах США US 4,650,750, US 4,709,016, US 5,360,8191, US 5,516,931, US 5,602,273, US 5,604,104, US 5,610,020 и US 5,650,270. Другие примеры масс-спектрометрических меток включают, но не ограничиваются ими, нуклеотиды, дидезоксинуклеотиды, олигонуклеотиды различной длины и различного по основаниям состава, олигопептиды, олигосахариды и другие синтетические полимер, имеющие различную длину и состав мономеров. Разнообразные органические молекулы, как нейтральные, так и заряженные (биомолекулы и синтетические соединения), масса которых лежит в подходящем диапазоне (100-2000 Дальтон), также моно использовать в качестве масс-спектрометрических меток. Также в качестве масс-спектрометрических меток можно использовать стабильные изотопы (например, 13C, 2H, 17O, 18O и 15N).
[00258] Термин «хемилюминесцентная группа» в настоящем описании относится к группе, которая испускает свет в результате химической реакции без выделения тепла. К примеру, люминол (5-амино-2,3-дигидро-1,4-фталазиндион) реагирует с окислителями, такими как перекись водорода (H2O2) в присутствии основания и металлического катализатора с образованием продукта в возбужденном состоянии (3-аминофталата, 3-APA).
[00259] Термин «хромофор» в настоящем описании относится к молекуле, которая поглощает свет видимых длин волн, УФ-длин волн или ИК-длин волн.
[00260] Термин «краситель» в настоящем описании относится к растворимому красящему веществу, которое содержит хромофор.
[00261] Термин «электронно-плотная группа» в настоящем описании относится к группе, которая при облучении пучком электронов рассеивает электроны. Такие группы включают, но не ограничиваются ими, молибдат аммония, основной азотнокислый висмут, иодид кадмия, карбазид, гексагидрат хлорида железа (III), гексаметилентетрамин, безводный трихлорид индия, нитрат лантана, тригидрат ацетата свинца, тригидрат цитрата свинца, нитрат свинца, периодная кислота, фосфорномолибденовая кислота, фосфорновольфрамовая кислота, ферроцианид калия, рутений красный, нитрат серебра, протеинат серебра (количественное содержание Ag: 8,0-8,5%) "Strong", тетрафенилпорфин серебра (S-TPPS), хлораурат натрия, вольфрамат натрия, нитрат таллия, тиосемикарбазид (TSC), уранилацетат, уранилнитрат и ванадилсульфат.
[00262] Термин «агент, переносящий энергию» в настоящем описании относится к молекуле, которая либо отдает, либо принимает энергию от другой молекулы. Исключительно в качестве примера: флуоресцентный резонансный перенос энергии (FRET) представляет собой процесс диполь-дипольного взаимодействия, в результате которого энергия возбужденного состояния флуоресцентной молекулы-донора переносится безызлучательно на невозбужденную молекулу-акцептор, которая затем испускает полученную энергию на больших длинах волн (флюоресцирует).
[00263] Термин «группа, содержащая тяжелый атом» в настоящем описании относится к группе, которая включает ион атома, который обычно тяжелее углерода. В некоторых вариантах осуществления такие ионы или атомы включают, но не ограничены ими, кремний, вольфрам, золото, свинец и уран.
[00264] Термин «фотоаффинная метка» в настоящем описании относится к метке группой, которая под воздействием света образует связь с молекулой, к которой эта метка обладает аффинностью.
[00265] Термин «фотосвязываемая группа» в настоящем описании относится к группе, которая после освещения светом на определенных длин волн ковалентно или нековалентно связывается с другими ионами или молекулами.
[00266] Термин «фотоизомеризуемая группа» в настоящем описании относится к группе, которая после освещения светом переходит из одной изоформы в другую.
[00267] Термин «радиоактивная группа» в настоящем описании относится к группе, ядра которой самопроизвольно испускают радиоактивное излучение, такое как альфа-, бета- или гамма-частицы; при этом альфа-частицы - это ядра атомов гелия, бета-частицы - это электроны, а гамма-частицы - это фотоны с высокой энергией.
[00268] Термин «спиновая метка» в настоящем описании относится к молекулам, которые содержат атом или группу атомов, имеющих неспаренный электронный спин (т.е. стабильную парамагнитную группу), которую в некоторых вариантах осуществления детектируют путем электронно-спиновой резонансной спектроскопии, а в других вариантах осуществления присоединяют к другой молекуле. Такие молекулы со спиновыми метками включают, но не ограничиваются ими, нитрильные радикалы и нитроксиды и в некоторых вариантах осуществления представляют собой отдельные спиновые метки или двойные спиновые метки.
[00269] Термин «квантовые точки» в настоящем описании относится к коллоидным полупроводниковым нанокристаллам, которые в некоторых вариантах осуществления детектируют в ближней инфракрасной области и которые обладают исключительно высокими квантовыми выходами (т.е., очень ярко светятся после умеренного освещения).
[00270] Среднему специалисту в данной области очевидно, что детектируемая группа может быть присоединена к предложенному соединению через подходящий заместитель. В настоящем описании термин «подходящий заместитель» относится к группе, которая способна к ковалентному присоединению к детектируемой группе. Такие группы хорошо известны среднему специалисту в данной области и включают группы, содержащие, например, карбоксилатнную группу, аминогруппу, тиольную группу или гидроксильную группу и др.. Очевидно, что такие группа могут быть присоединены к предложенному соединению непосредственно или через связывающую группу, такую как бивалентная насыщенная или ненасыщенная углеводородная цепь.
[00271] В некоторых вариантах осуществления детектируемые группы присоединены к предложенному соединению посредством приемов клик-химии. В некоторых вариантах осуществления такие группы присоединены через 1,3-циклоприсоединение азида с алкином, необязательно в присутствии медного катализатора. Методы использования клик-химии известны и включают методы, описанные в следующих публикациях: Rostovtsev et al., Angew. Chem. Int. Ed. 2002, 41, 2596-99 и Sun et al., Bioconjugate Chem., 2006, 17, 52-57. В некоторых вариантах осуществления обеспечивают клик-доступную группу ингибитора и осуществляют ее реакцию с клик-доступной группой-T-Rt. В настоящем описании «клик-доступный» относится к группе, содержащей азид или алкин для использования в реакции клик-химии. В некоторых вариантах осуществления клик-доступная группа ингибитора включает азид. В некоторых вариантах осуществления клик-доступная группа -T-Rt содержит напряженный циклооктин для использования в реакции клик-химии без использования меди (например, с использованием методов, описанных в публикации Baskin et al., Proc. Natl. Acad. Sci. USA 2007, 104. 16793-16797).
[00272] В некоторых вариантах осуществления клик-доступная группа ингибитора представляет собой структуру одну из следующих формул:
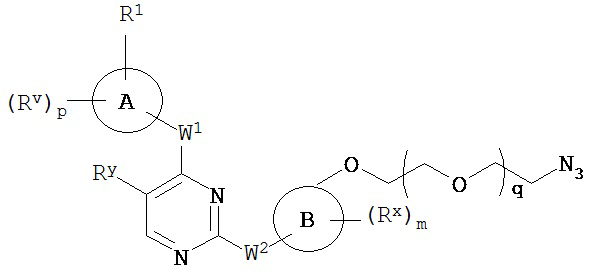
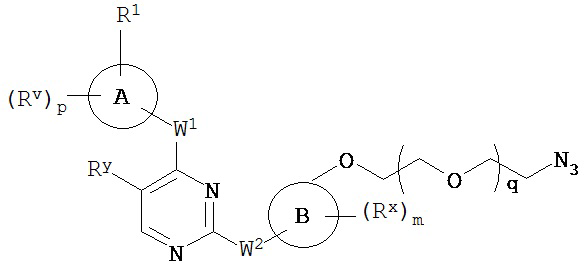
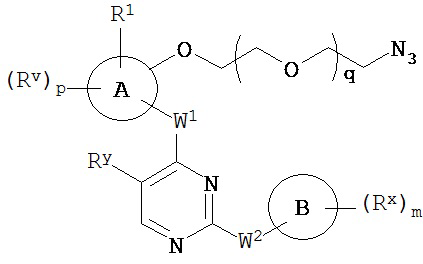
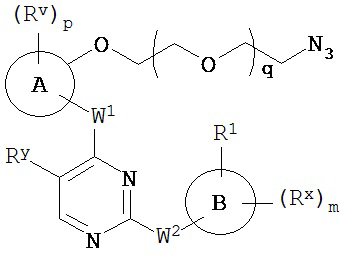
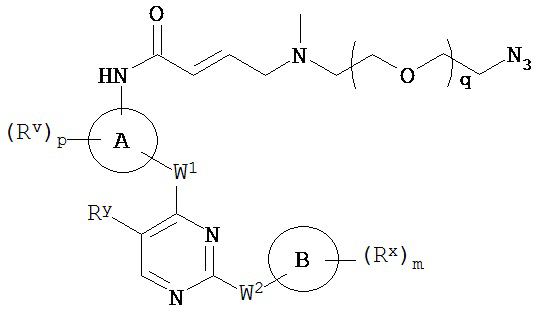 или
или 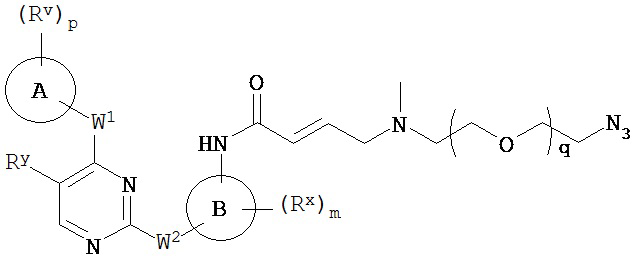 ,
,
где Кольцо A, Кольцо B, W1, W2, Ry, Rv, p, Rx и m имеют значения, определенные выше для Формулы I и приведенные в настоящем описании, a q равно 1, 2 или 3.
[00273] Примеры клик-доступных ингибиторов включают:
 ,
,  , и
, и  .
.
[00274] В некоторых вариантах осуществления клик-доступная группа -T-Rt имеет структуру формулы:
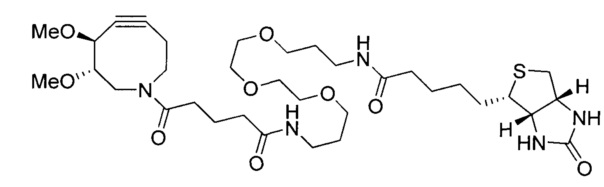 .
.
[00275] Примером реакции, в которой клик-доступная группа ингибитора и клик-доступная группа -T-R1 присоединяются друг к другу путем [2+3]-циклоприсоединения, является следующая реакция:
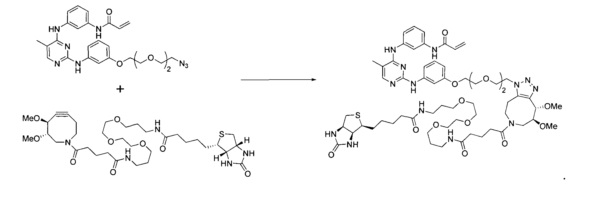
[00276] В некоторых вариантах осуществления детектируемая группа, Rt, выбрана из метки, красителя, фото-кросслинкера, цитотоксического соединения, лекарственного средства, аффинной метки, фотоаффинной метки, реакционноспособного соединения, антитела или фрагмента антитела, биоматериала, наночастицы, спиновой метки, флуорофора, металлсодержащей группы, радиоактивной группы, квантовой точки (точек), новой функциональной группы, группы, которая ковалентно или нековалентно взаимодействует с другими молекулами, фотосвязываемой группы, группы, возбуждаемой актиничным излучением, лиганда, фотоизомеризуемого соединения, биотина, аналога биотина (например, биотин сульфоксида), группы, содержащей тяжелый атом, химически расщепляемой группы, фоторасщепляемой группы, редокс-активного агента, группы, меченной изотопом, биофизического зонда, фосфоресцентной группы, хемилюминесцентной группы, электронно-плотной группы, магнитной группы, интеркалирующей группы, хромофора, агента, переносящего энергию, биологически активного вещества, детектируемой метки или их комбинации.
[00277] В некоторых вариантах осуществления Rt представляет собой биотин или его аналог. В некоторых вариантах осуществления Rt представляет собой биотин. В некоторых других вариантах осуществления Rt представляет собой биотин сульфоксид.
[00278] В другом варианте осуществления Rt представляет собой флуорофор. В дальнейшем варианте осуществления флюорофор выбран из красителей Alexa Fluor (Alexa Fluor 350, Alexa Fluor 488, Alexa Fluor 532, Alexa Fluor 546, Alexa Fluor 568, Alexa Fluor 594, Alexa Fluor 633, Alexa Fluor 660 и Alexa Fluor 680), AMCA, AMCA-S, красителей BODIPY (BODIPY FL, BODIPY R6G, BODIPY TMR, BODIPY TR, BODIPY 493/503, BODIPY 530/550, BODIPY 558/568, BODIPY 564/570, BODIPY 576/589, BODIPY 581/591, BODIPY 630/650, BODIPY 650/665), карбоксиродамина 60, карбокси-Х-родамина (ROX), Cascade Blue, Cascade Yellow, кумарина 343, цианиновых красителей (Cy3, Cy5, Cy3.5, Cy5.5), данзила, дапоксила (Dapoxyl), диалкиламинокумарина, 4’,5’-дихлор-2’,7’-диметокси-флуоресцеина, DM-NERF, эозина, эритрозина, флуоресцеина, FAM, гидроксикумарина, красителей IRDyes (IRD 40, IRD 700, IRD 800), JOE, Lissamine rhodamine В, Marina Blue, метоксикумарина, нафтофлуоресцеина, Oregon Green 488, Oregon Green 500, Oregon Green 514, Pacific Blue, PyMPO, пирена, родамина В, родамина 6G, родаминового зеленого, родаминового красного, Rhodol Green, 2’,4’,5’,7’-тетра-бромсульфон-флуоресцеина, тетраметил-родамина (TMR), карбокситетраметилродамина С (TAMRA), техасского красного, техасского красного X, 5(6)-карбоксифлуоресцеина, 2,7-дихлорфлуоресцеина, N,N-бис(2,4,6-триметилфенил)-3,4:9,10-периленбис(дикарбоксимида, HPTS, Ethyl Eosin, DY-490XL MegaStokes, DY-485XL MegaStokes, Adirondack Green 520, ATTO 465, ATTO 488, ATTO 495, YOYO-1,5-FAM, BCECF, дихлорфлуоресцеина, родамина 110, родамина 123, YO-PRO-1, SYTOX Green, Sodium Green, SYBR Green I, Alexa Fluor 500, FITC, Fluo-3, Fluo-4, fluoro-emerald, YoYo-1 ssDNA, YoYo-1 dsDNA, YoYo-1, SYTO RNASelect, Diversa Green-FP, Dragon Green, EvaGreen, Surf Green EX, Spectrum Green, NeuroTrace 500525, NBD-X, MitoTracker Green FM, LysoTracker Green DND-26, CBQCA, PA-GFP (пост-активационного), WEGFP (пост-активационного), F1ASH-CCXXCC, Azami Green мономерного, Azami Green, зеленого флуоресцентного белка (GFP), EGFP (Campbell Tsien 2003), EGFP (Patterson 2001), Kaede Green, 7-бензиламино-4-нитробелнз-2-окса-1,3-диазола, Bexl, Doxorubicin, Lumio Green, или SuperGlo GFP.
[00279] Как в общих чертах описано выше, предложенные соединения-зонды включают связывающую группу, -T- группу, которая присоединяет необратимый ингибитор к детектируемой группе. В настоящем описании термин «связующая нить» или «связывающая группа» относится к любому бивалентному химическому спейсеру, включая, но не ограничиваясь перечисленными: ковалентная связь, полимер, водорастворимый полимер, возможно замещенный алкил, возможно замещенный гетероалкил, возможно замещенный гетероциклоалкил, возможно замещенный циклоалкил, возможно замещенный гетероциклил, возможно замещенный гетероциклоалкилалкил, возможно замещенная гетероциклоалкилалкенил, возможно замещенная арил, возможно замещенный гетероарил, возможно замещенный гетероциклоалкилалкенилалкил, возможно замещенная амидная группа, эфирная группа, кетонная группа, сложноэфирная группа, возможно замещенная карбаматная группа, возможно замещенная гидразонная группа, возможно замещенная гидразинная группа, возможно замещенная оксимная группа, дисульфидная группа, возможно замещенная иминная группа, возможно замещенная сульфонамидная группа, сульфогруппа, сульфоксидная группа, тиоэфирная группа или любая их комбинацияо.
[00280] В некоторых вариантах осуществления связывающая группа -T- выбрана из ковалентной связи, полимера, водорастворимого полимера, возможно замещенного алкила, возможно замещенного гетероалкила, возможно замещенного гетероциклоалкила, возможно замещенного циклоалкила, возможно замещенного гетероциклоалкилалкила, возможно замещенного гетероциклоалкилалкенила, возможно замещенного арила, возможно замещенного гетероарила, и возможно замещенного гетероциклоалкилалкенилалкила. В некоторых вариантах осуществления связывающая группа представляет собой возможно замещенный гетероцикл. В других вариантах осуществления гетероцикл выбран из азиридина, оксирана, эписульфида, азетидина, оксетана, пирролина, тетрагидрофурана, тетрагидротиофена, пирролидина, пиразола, пиррола, имидазола, триазола, тетразола, оксазола, изоксазола, оксирена, тиазола, изотиазола, дитиолана, фурана, тиофена, пиперидина, тетрагидропирана, тиана, пиридина, пирана, тиапирана, пиридазина, пиримидина, пиразина, пиперазина, оксазина, тиазина, дитиана и диоксана. В дальнейших вариантах осуществления гетероцикл представляет собой пиперазин. В дальнейших вариантах осуществления связывающая группа возможно замещена галогеном, -CN, -ОН, -NO2, алкилом, S(O) и S(O)2. В других вариантах осуществления водорастворимый полимер представляет собой ПЭГ группу.
[00281] В других вариантах осуществления связывающая группа обеспечивает достаточной пространственное разделение детектируемой группы и группы ингибитора протеинкиназы. В других вариантах осуществления связывающая группа стабильна. В еще одном варианте осуществления связывающая группа не оказывает существенного влияния на отклик детектируемой группы. В других вариантах осуществления связывающая группа обеспечивает химическую стабильность соединения-зонда. В дальнейших вариантах осуществления связывающая группа обеспечивает достаточную растворимость соединения-зонда.
[00282] В некоторых вариантах осуществления связывающая группа -T-, такая как водорастворимый полимер, одним концом присоединена к необратимому ингибитору согласно настоящему изобретению, а другим концом - к детектируемой группе Rt. В других вариантах осуществления водорастворимый полимер присоединен через функциональную группу или заместитель необратимого ингибитора согласно настоящему изобретению. В дальнейших вариантах осуществления водорастворимый полимер присоединен через функциональную группу или заместитель репортерной группы.
[00283] В некоторых вариантах осуществления примеры гидрофильных полимеров для использования в связывающей группе -T- включают, но не ограничиваются перечисленными: полиалкиловые эфиры и их кэпированные по карбокси-концу аналоги (например, полиоксиэтиленгликоль, полиоксиэтилен/пропиленгликоль, а также их метокси- или этокси-кэпированные аналоги, полиоксиэтиленгликоль, также известный как полиэтиленгликоль или ПЭГ); поливинлипирролидоны; поливинилалкиловые эфиры; полиоксазолины, полиалкилоксазолины и полигидроксиалкил оксазолины, полиакриламиды, полиалкилакриламиды и полигидроксиалкил акриламиды (например, полигидроксипропилметакриламид и их производные); полигидроксиалкилакрилаты, полисиаловые кислоты и их аналоги, гидрофильные пептидные последовательности, полисахариды и их производные, включая декстран и производные декстрана, например, карбоксиметилдекстран, декстрансульфаты, аминодекстран; целлюлозу и ее производные, например, карбоксиметилцеллюлозу, гидроксиалкилцеллюлозы; хитин и его производные, хитозан, сукцинил хитозан, карбоксиметилхитин, карбоксиметилхитозан; гиалуроновую кислоту и ее производные; крахмалы; альгинаты; хондроитин сульфат; альбумин; пуллулан и карбоксиметилпуллулан; полиаминокислоты и их производные, например, полиглутаминовые кислоты, полилизины, полиаспартовые кислоты, полиаспартамиды; сополимеры малеинового ангидрида, такие как: сополимер малеинового ангидрида и стирола, сополимер дивинилэтилового эвира и малеинового ангидрида; поливиниловые спирты; их сополимеры, их терполимеры, их смеси и производные вышеперечисленных соединений. В других вариантах осуществления водорастворимый полимер имеет структурную форму, включающую, но не ограничивающуюся перечисленными: линейную, раздвоенную или разветвленную. В других вариантах осуществления многофункциональные производные полимера включают, но не ограничиваются перечисленными: линейные полимеры, имеющие два конца, каждый из которых связан с функциональной группой, причем группы могут быть одинаковыми или различными.
[00284] В некоторых вариантах осуществления водорастворимый полимер включает фрагмент поли(этиленгликоля). В дальнейших вариантах осуществления молекулярная масса полимера лежит в широком диапазоне, включая, без ограничения, от примерно 100 Да до примерно 100000 Да или более. В еще других вариантах осуществления молекулярная масса полимера составляет в диапазоне от примерно 100 Да до примерно 100000 Да, включая, без ограничения, примерно 100000 Да, примерно 95000 Да, примерно 90000 Да, примерно 85000 Да, примерно 80000 Да, примерно 75000 Да, примерно 70000 Да, примерно 65000 Да, примерно 60000 Да, примерно 55000 Да, примерно 50000 Да, примерно 45000 Да, примерно 40000 Да, примерно 35,000 Да, 30000 Да, примерно 25000 Да, примерно 20000 Да, примерно 15000 Да, примерно 10000 Да, примерно 9000 Да, примерно 8000 Да, примерно 7000 Да, примерно 6000 Да, примерно 5000 Да, примерно 4000 Да, примерно 3000 Да, примерно 2000 Да, примерно 1000 Да, примерно 900 Да, примерно 800 Да, примерно 700 Да, примерно 600 Да, примерно 500 Да, примерно 400 Да, примерно 300 Да, примерно 200 Да и примерно 100 Да. В некоторых вариантах осуществления молекулярная масса полимера составляет от примерно 100 Да до 50000 Да. В некоторых вариантах осуществления молекулярная масса полимера составляет от примерно 100 Да до примерно 40000 Да. В некоторых вариантах осуществления молекулярная масса полимера составляет примерно от 1000 Да до 40000 Да. В некоторых вариантах осуществления молекулярная масса полимера составляет примерно от 5000 Да до 40000 Да. В некоторых вариантах осуществления молекулярная масса полимера составляет примерно от 10000 Да до 40000 Да. В некоторых вариантах осуществления молекула полиэтиленгликоля представляет собой разветвленный полимер. В дальнейших вариантах осуществления молекулярная масса разветвленной цепи ПЭГ составляет от примерно 1000 Да до примерно 100000 Да, включая, без ограничения, примерно 100000 Да, примерно 95000 Да, примерно 90000 Да, примерно 85000 Да, примерно 80000 Да, примерно 75000 Да, примерно 70000 Да, примерно 65000 Да, примерно 60000 Да, примерно 55000 Да, примерно 50000 Да, примерно 45000 Да, примерно 40000 Да, примерно 35000 Да, примерно 30000 Да, примерно 25000 Да, примерно 20000 Да, примерно 15000 Да, примерно 10000 Да, примерно 9000 Да, примерно 8000 Да, примерно 7000 Да, примерно 6000 Да, примерно 5000 Да, примерно 4000 Да, примерно 3000 Да, примерно 2000 Да, и примерно 1000 Да. В некоторых вариантах осуществления молекулярная масса разветвленной цепи ПЭГ составляет от примерно 1000 Да до примерно 50000 Да. В некоторых вариантах осуществления молекулярная масса разветвленной цепи ПЭГ составляет от примерно 1000 Да до примерно 40000 Да. В некоторых вариантах осуществления молекулярная масса разветвленной цепи ПЭГ составляет от примерно 5000 Да до примерно 40000 Да. В некоторых вариантах осуществления молекулярная масса разветвленной цепи ПЭГ составляет от примерно 5000 Да до примерно 20000 Да. Ниже приведен список по существу каркасов водорастворимых полимеров, который не является исчерпывающим, а приведен лишь в качестве наглядного примера, и в некоторых вариантах осуществления для использования в способах и композициях согласно настоящему изобретению подходят полимерные материалы, обладающие описанными выше свойствами.
[00285] Среднему специалисту в данной области очевидно, что если -T-Rt присоединена к соединению формулы I-a или I-b через высокореакционноспособную группу R1, получаемая в результате связывающая группа содержит указанную высокореакционноспособную группу R1. В настоящем описании фраза "содержит высокореакционноспособную группу" означает, что связывающая группа, образованная -R1’-Т- формулы V-a или V-b либо содержит высокореакционноспособную группу в качестве заместителя, либо высокореакционноспособная группа входит в состав связывающей группы. Например, связывающая группа, образованная -R1’-T-, может содержать в качестве заместителя высокореакционноспособную группу -L-Y, причем каждая группа определена в настоящем описании. В альтернативном варианте связывающая группа, образованная -R1’-T-, обладает необходимыми свойствами высокореакционноспособной группы, включенной в эту связывающую группу. Например, связывающая группа, образованная -R1’-T-, может включать один или несколько ненасыщенных фрагментов и необязательных заместителей и/или гетероатомов, которые, в комбинации, образуют группу, способную к ковалентной модификации протеинкиназы согласно настоящему изобретению. Такая связывающая группа -R1-T- представлена ниже. [00286] В некоторых вариантах осуществления метиленовое звено связывающей группы -R1’-T- замещено бивалентной группой -L-Y’- с образованием соединения формулы V-a-iii или V-b-iii:
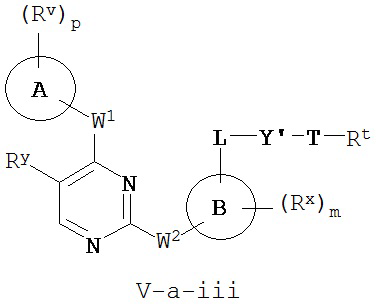
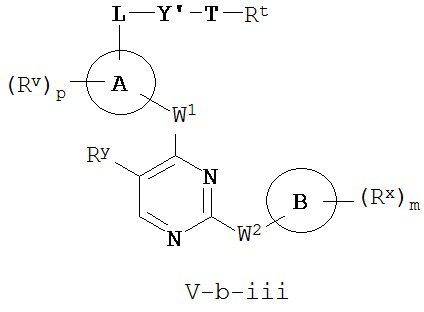 ,
,
где каждый из Кольца A, Кольца B, m, p, Rx, Ry, Rv, W1, W2, T, L, Y’ и Rt имеет значение, определенное выше и приведенное в классах и подклассах в настоящем описании, и Y’ представляет собой бивалентный вариант группы Y, приведенной в классах и подклассах в настоящем описании.
[00287] В некоторых вариантах осуществления метиленовое звено связывающей группы -R1’-Т- замещено группой -L(Y)- с получением соединения формулы V-a-iv или V-b-iv:
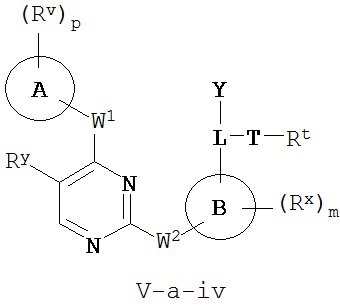
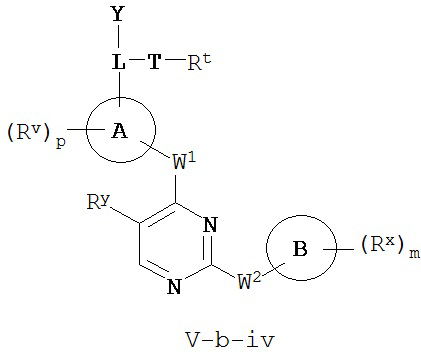 ,
,
где каждый из Кольца A, Кольца B, m, p, Rx, Ry, Rv, W1, W2, T, L, Y’ и Rt имеет значение, определенное выше и приведенное в классах и подклассах в настоящем описании.
[00288] В некоторых вариантах осуществления связывающая группа содержит в качестве заместителя группу L-Y, в результате чего образуется соединение формулы V-a-v или V-b-v:
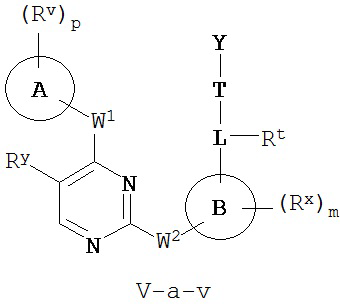
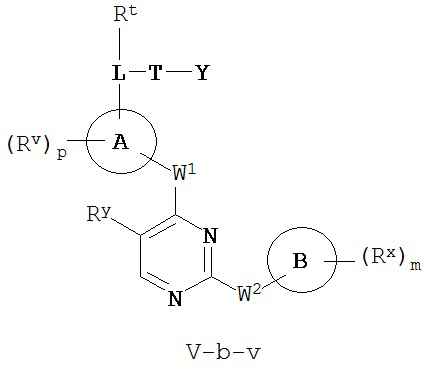 ,
,
где каждый из Кольца А, Кольца В, m, p, Rx, Ry, Rv, W1, W2, T, L, Y’ и Rt имеет значение, определенное выше и приведенное в классах и подклассах в настоящем описании.
[00289] В некоторых вариантах осуществления связывающая группа -T- имеет одну из следующих структур:
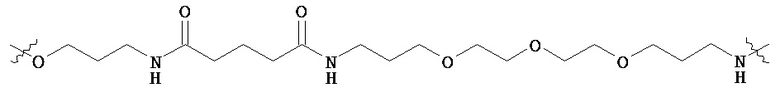 .
.
[00290] В некоторых вариантах осуществления связывающая группа -T- имеет следующую структуру:
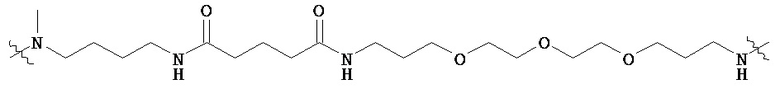 .
.
[00291] В других вариантах осуществления связывающая группа -Т- имеет следующую структуру:
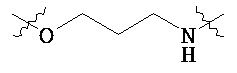 .
.
[00292] В конкретных других вариантах осуществления связывающая группа -T- имеет следующую структуру:
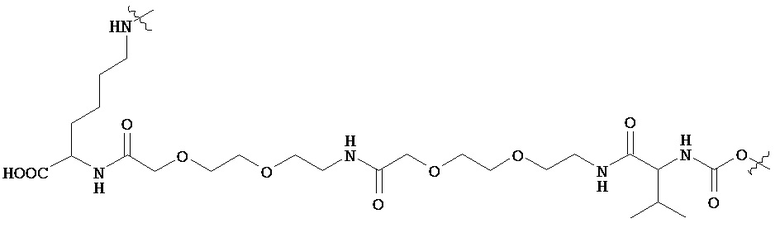 .
.
[00293] В еще других вариантах осуществления связывающая группа -Т- имеет следующую структуру:
 .
.
[00294] В некоторых вариантах осуществления связывающая группа -T- имеет следующую структуру:
 .
.
[00295] В некоторых вариантах осуществления -T-R’ имеет следующую структуру:
 .
.
[00296] В других вариантах осуществления -T-R1 имеет следующую структуру:
 .
.
[00297] В конкретных вариантах осуществления -T-Rt имеет следующую структуру:
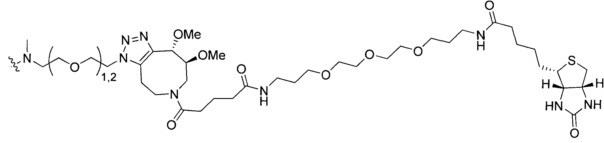 .
.
[00298] В некоторых вариантах осуществления соединение-зонд формулы V-a, V-b, VI-а, VI-b, VII-a или VII-b является производным одного из соединений, приведенных в Таблице 5.
[00299] В конкретных вариантах осуществления соединение-зонд имеет одну из следующих структур:
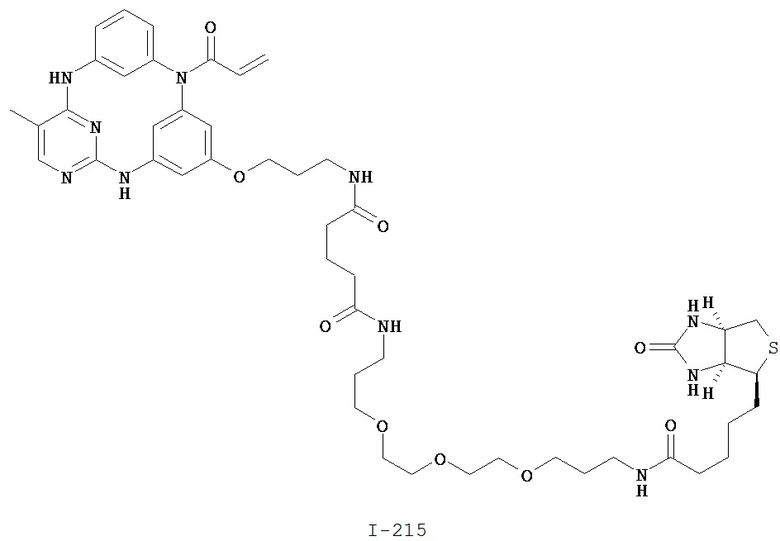
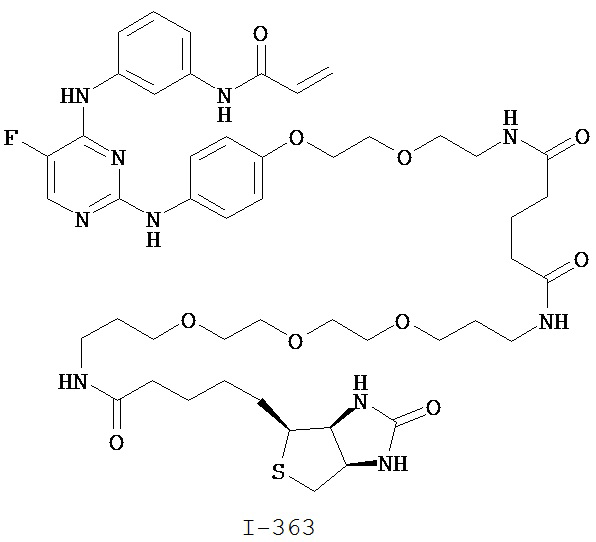
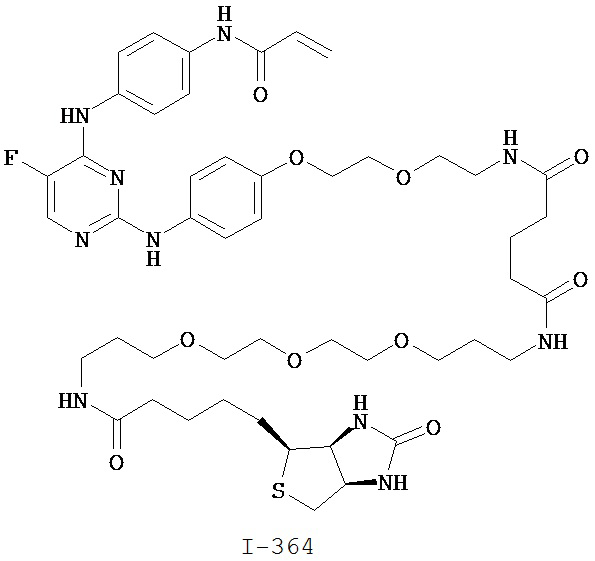
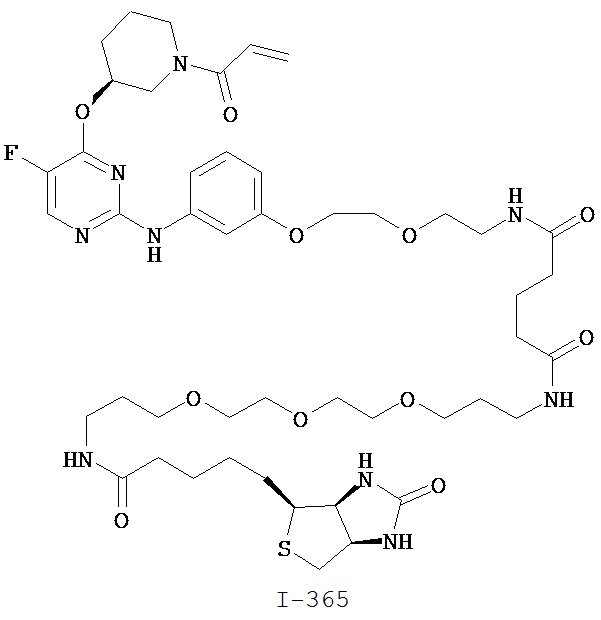
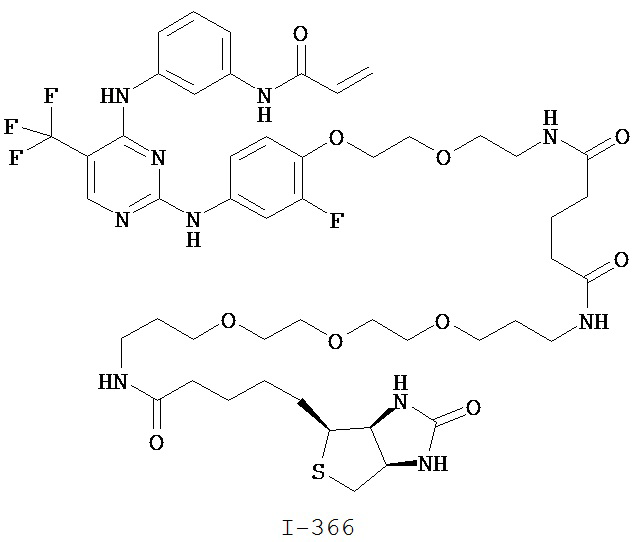
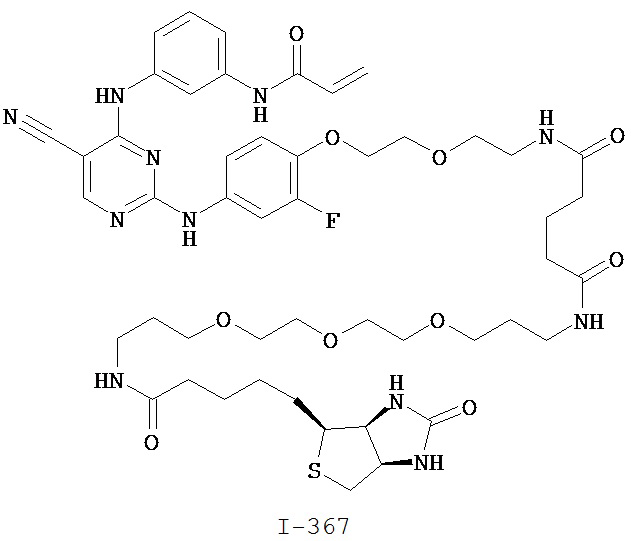
[00300] Очевидно, что многие реагенты-T-Rt коммерчески доступны. Например, множество биотинилирующих реагентов с различной длиной цепи связывающей группы можно приобрести, например, в Thermo Scientific. Такие реагенты включают NHS-PEG4-Biotin и NHS-PEG12-Biotin.
[00301] В некоторых вариантах осуществления структуры зондов, аналогичные приведенным в качестве примеров выше, получают с использованием клик-доступных групп ингибиторов -T-Rt, как описано в настоящем тексте.
[00302] В некоторых вариантах осуществления предложенные соединения-зонды ковалентно модифицируют фосфорилированную конформацию протеинкиназы. В одном аспекте фосфорилированная конформация протеинкиназы представляет собой либо активную, либо неактивную форму протеинкиназы. В конкретных вариантах осуществления фосфорилированная конформация протеинкиназы представляет собой активную форму указанной киназы. В конкретных вариантах осуществления соединение-зонд может проникать в клетки.
[00303] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ определения степени связывания протеинкиназы необратимым ингибитором согласно настоящему изобретению (т.е., соединением формулы I-a или I-b) у пациента, включающий обеспечение осуществления контакта одной или нескольких тканей, типов клеток или их лизатов, полученных у пациента, которому ввели по меньшей мере одну дозу соединения, представляющего собой указанный необратимый ингибитор, с соединением-зондом (т.е., соединением формулы V-a, V-b, VI-a, VI-b, VII-a или VII-b), что приводит к ковалентной модификации по меньшей мере одной протеинкиназы, присутствующей в указанном лизате, и измерение количества указанной протеинкиназы, ковалентно модифицированной указанным соединением-зондом, что позволяет определить степень связывания указанной протеинкиназы указанным соединением формулы I-a или I-b относительно степени связывания указанной протеинкиназы указанным соединением-зондом. В конкретных вариантах осуществления способ дополнительно включает стадию подбора дозы соединения формулы I-a или I-b для повышения степени связывания протеинкиназы. В конкретных других вариантах осуществления указанный способ дополнительно включает стадию подбора дозы соединения формулы I-a или I-b для снижения степени связывания протеинкиназы
[00304] В настоящем описании термины "степень связывания" или "связывать" относятся к степени, до которой протеинкиназа модифицируется предложенным соединением, представялющим собой ковалентный ингибитор. Среднему специалисту очевидно, что желательно вводить самую низкую дозу, обеспечивающую желаемый эффективную степень связывания протеинкиназы.
[00305] В некоторых вариантах осуществления модифицируемая протеинкиназа представляет собой BTK. В других вариантах осуществления модифицируемая протеинкиназа представляет собой EGFR. В конкретных вариантах осуществления протеинкиназа представляет собой JAK. В конкретных других вариантах осуществления протеинкиназа представляет собой одну или несколько из ErbB1, ErbB2 или ErbB4. В еще других вариантах осуществления протеинкиназа представляет собой TEC, ITK или BMX.
[00306] В некоторых вариантах осуществления соединение-зонд включает необратимый ингибитор, для которого определяют степень связывания.
[00307] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ оценки эффективности необратимого ингибитора согласно настоящему изобретению у млекопитающих, включающий введение необратимого ингибитора согласно настоящему изобретению млекопитающему, введение соединения-зонда согласно настоящему изобретению в ткани или клетки, выделенные из указанного млекопитающего, или их лизат, измерение активности детектируемой группы соединения-зонда и сравнение активности детектируемой группы со стандартом.
[00308] В других вариантах осуществления настоящее изобретение обеспечивает способ оценки фармако динамики необратимого ингибитора согласно настоящему изобретению в организме млекопитающего, включающий введение необратимого ингибитора согласно настоящему изобретению млекопитающему, введение соединения-зонда, описанного в настоящем тексте, в один или несколько типов клеток или их лизатов, выделенных из организма млекопитающего, и измерение активности детектируемой группы соединения-зонда в разные моменты времени после введения ингибитора.
[00309] В еще других вариантах осуществления настоящее изобретение обеспечивает способ для in vitro введения меток в протеинкиназу, включающий осуществление контакта указанной протеинкиназы с описанным в настоящем тексте соединением-зондом. В одном варианте осуществления стадия осуществления контакта включает инкубирование протеинкиназы с соединением-зондом, описанным в настоящем тексте.
[00310] В конкретных вариантах осуществления настоящее изобретение обеспечивает способ для in vitro введения меток в протеинкиназу, включающий осуществление контакта одной или нескольких клеток или тканей, экспрессирующих протеинкиназу, или их лизатов, с описанным в настоящем тексте соединением-зондом.
[00311] В конкретных других вариантах осуществления настоящее изобретение обеспечивает способ детектирования меченой протеинкиназы, включающий разделение белков, содержащих протеинкиназу, меченную соединением-зондом, описанным в настоящем тексте, методом электрофореза и детектирование соединения-зонда по флуоресценции.
[00312] В некоторых вариантах осуществления настоящее изобретение обеспечивает способ оценки фармакодинамики in vitro необратимого ингибитора согласно настоящему изобретению, включающий инкубацию необратимого ингибитора согласно настоящему изобретению с целевой протеинкиназой, добавление описанного в настоящем тексте соединения-зонда к целевой протеинкиназе и определение количества мишени-протеинкиназы, модифицированной соединением-зондом.
[00313] В конкретных вариантах осуществления соединение-зонд детектируют за счет связывания с авидином, стрептавидином, нейтравидином или каптавидином.
[00314] В некоторых вариантах осуществления зонд детектируют методом Вестерн-блоттинга. В других вариантах осуществления зонд детектируют методом твердофазного ИФА (ELISA). В конкретных вариантах осуществления зонд детектируют методом проточной цитометрии.
[00315] В других вариантах осуществления настоящее изобретение обеспечивает способ зондирования кинома (полного комплемента киназ) необратимыми ингибитороми, включающий инкубирование одного или нескольких типов клеток или их лизатов с биотинилированным соединением-зондом с получением белков, модифицированных фрагментом биотина, расщепление белков, связывание авидином или его аналогом и проведение многомерного анализа ЖХ-МС-МС для идентификации протеинкиназ, модифицированных соединением-зондом, и сайтов присоединения указанных киназ.
[00316] В конкретных вариантах осуществления настоящее изобретение обеспечивает способ измерения синтеза белка в клетке, включающий инкубирование клеток с необратимым ингибитором белка-мишени, получение лизатов указанных клеток в определенные моменты времени и инкубацию указанных лизатов клеток с соединениями-зондами согласно настоящему изобретению, что позволяет измерить появление свободного белка на протяжении продолжительного периода времени.
[00317] В других вариантах осуществления настоящее изобретение обеспечивает способ определения режима дозирования у млекопитающего для максимизации степени связывания целевой протеинкиназы, включающий количественный анализ одного или нескольких типов клеток или их лизатов, выделенных из организма млекопитающего (полученные, например, из спленоцитов, периферических В-клеток, цельной крови, лимфатических узлов, интестициальной ткани или других тканей), полученных от млекопитающего, которому ввели необратимый ингибитор формулы I-a или I-b согласно настоящему изобретению, причем указанная стадия количественного анализа включает осуществление контакта указанной одной или нескольких тканей, типов клеток или их лизатов с соединением-зондом согласно настоящему изобретению и измерение количества протеинкиназы, ковалентно модифицированной соединением-зондом.
ПРИМЕРЫ
[00318] Как описано ниже в разделе Примеры, в примерах некоторых вариантов осуществления соединение получают в соответствии с приведенными ниже общими процедурами. Очевидно, что хотя общие способы описывают синтез отдельных соединений, описанные ниже способы и другие методы, известные специалисту в данной области, могут быть применены ко всем соединениям, подклассам и видам каждого из этих соединений, как описано в настоящем тексте.
[00319] Номера соединений, используемые ниже в разделе Примеры, соответствуют номерам соединений, приведенным выше в Таблице 5.
ПРИМЕР 1
[00320] Получение N-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)фенил)акрил-амида I-7
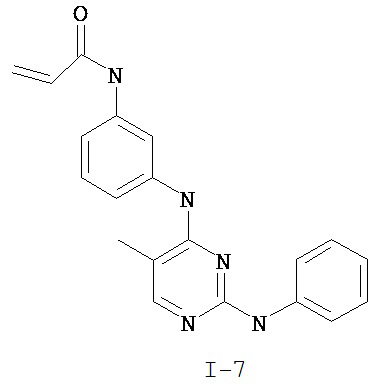
[00321] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
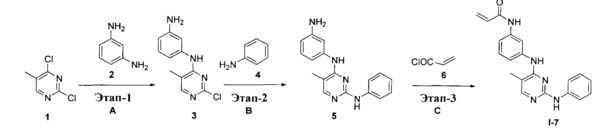
A) DIPEA, н-BuOH, 120°C, 30 минут, СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) NMP, 0°C - 30 минут, комн. темп. - 30 минут.
[00322] Этап
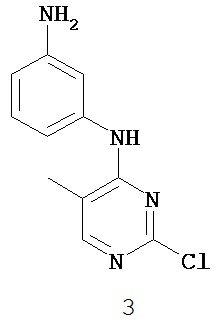
[00323] Раствор соединения 1 (2,0 г, 0,012 моль), 1,3-фениленедиамина (2,0 г, 0,018 ммоль), диизопропилэтиламина (DIPEA) (2,33 г, 0,018 моль) в н-бутаноле (н-BuOH) (20 мл) облучали в микроволновой печи при 120°C в течение 30 минут. Реакционную смесь гасили водой (100 мл), экстрагировали этилацетатом EtOAc (3×100 мл). Объединенный этилацетатный экстракт промывали водой (100 мл), солевым раствором (100 мл), сушили над сульфатом натрия Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, EtOAc/CHCl3: 15/85) с получением соединения 3 (1,3 г, 45%) в виде темно-коричневого твердого продукта.
[00324]
Этап 2
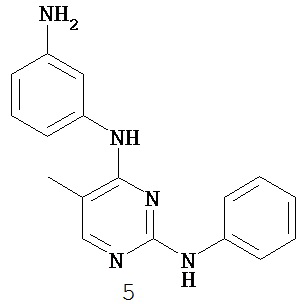
[00325] Раствор соединения 3 (1,0 г, 4,27 ммоль), соединения 4 (1,5 г, 16,12 ммоль) в N-метилпирролидоне (NMP) (10,0 мл) облучали в микроволновой печи (200°C, 10 минут). Реакционную смесь охлаждали, разбавляли водой (100 мл) и экстрагировали EtOAc (3×100 мл). Объединенный этилацетатный экстракт промывали водой (100 мл), солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением сухого остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 98/2) с получением соединения 5 (0,5 г, 40,3%) в виде светло-коричневого твердого продукта.
[00326] Этап 3
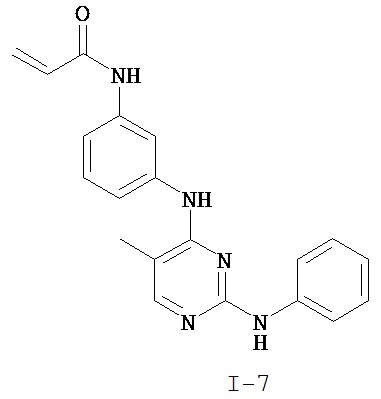
[00327] К раствору соединения 5 (200 мг, 0,68 ммоль) в NMP (2,0 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (248 мг, 2,74 ммоль), и перемешивали реакционную смесь при температуре 0°C в течение 60 минут. Реакционную смесь затем перемешивали с гексаном в течение 30 мин, и затем гексан удаляли из реакционной смеси декантацией, а остаток гасили водой (10 мл). Водный раствор переводили в основание насыщенным раствором бикарбоната натрия NaHCO3 и затем экстрагировали EtOAc (3×10 мл). Объединенный этилацетатный экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 230-400 меш, MeOH/CHCl3: 10/90) с получением соединения 1-7 (110 мг, 46,4%) в виде твердого коричневого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,10 (s, 3H), 5,73 (dd, 1,88 и 10,42 Гц, 1H), 6,24 (dd, J=1,88 и 17 Гц, 1H), 6,44 (dd, J=10,08 и 16,92 Гц, 1H), 6,78 (t, J=7,36 Гц, 1H), 7,06-7,11 (m, 2H), 7,26 (t, J=8,08 Гц, 1H), 7,38-7,40 (bm, 2H), 7,65 (d, J=8,52 Гц, 2H), 7,88 (s, 1H), 7,92 (s, 1H), 8,37 (s, 1H), 8,91 (s, 1H), 10,09 (s, 1H); ЖХ/МС: m/e 346,8 (M+1).
ПРИМЕР 2
[00328] Получение N-(3-(4-(м-толиламино)пиримидин-2-иламино)-фенил)акриламида I-1
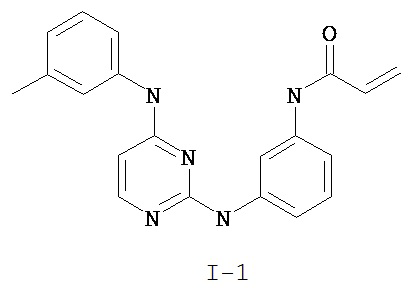
[00329] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
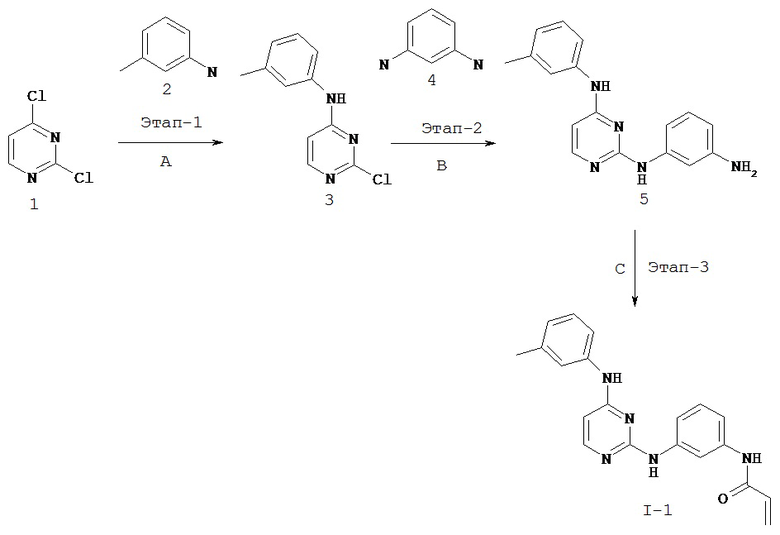
A) DIPEA, н-BuOH, 110°C, 30 минут. СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) акрилоилхлорид, NMP, 0°C - 30 минут, комн. темп. - 30 минут.
[00330] Этап 1
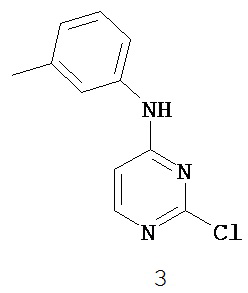
[00331] Раствор соединения 1 (0,5 г, 3,35 ммоль), м-толуидина (0,36 г, 3,35 ммоль), DIPEA (0,65 г, 5,0 ммоль) в н-BuOH (2,0 мл) облучали в микроволновой печи при 110°C в течение 30 мин. Реакционную смесь затем концентрировали при пониженном давлении, гасили водой (5 мл) и экстрагировали EtOAc (3×20 мл). Объединенный EtOAc экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 99/1) с получением соединения 3 (0,4 г, 54,2%) в виде желтого твердого продукта.
[00332] Этап 2
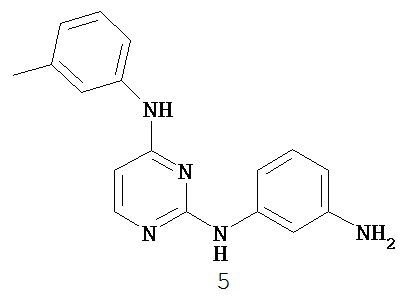
[00333] Раствор соединения 3 (0,2 г, 0,91 ммоль), соединения 4 (0,2 г, 1,8 ммоль) в NMP (2,0 мл) облучали в микроволновой печи (200 С, 10 минут). Реакционную смесь охлаждали, разбавляли водой (10 мл) и экстрагировали дихлорметаном CH2Cl2 (ДХМ) (3×15 мл). Объединенный CH2Cl2 экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением сухого остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 98/2) с получением соединения 5 (0,14 г, 53%) в виде светло-желтого твердого продукта.
[00334] Этап 3
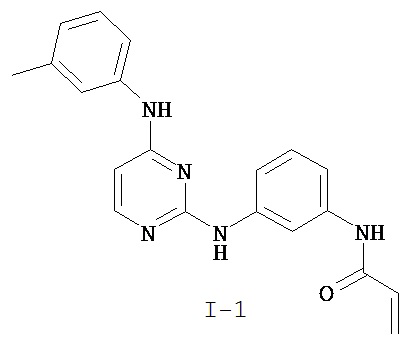
[00335] К раствору соединения 5 (0,075 г, 0,25 ммоль) в NMP (1,0 мл) при перемешивании при температуре 0°С добавляли акрилоилхлорид (0,19 г, 2,0 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 30 минут, после чего перемешивали при комнатной температуре в течение 30 минут. Необработанную реакционную смесь затем очищали методом колоночной хроматографии (нейтральный Al2O3, CHCl3/MeOH: 98/2) с получением соединения I-1 (0,04 г, 45%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,56 (s, 3H), 5,71 (dd, J=2,0 и 10,08 Гц, 1H), 6,20-6,25 (m, 2H), 6,45 (dd, J=10,12 и 17,00 Гц, 1H), 6,78 (d, J=7,52 Гц, 1H), 7,12-7,19 (m, 2H), 7,31 (d, J=8,44 Гц, 1H), 7,46-7,53 (m, 3H), 7,87 (s, 1H), 7,99 (d, J=5,76 Гц, 1H), 9,15 (s, 1H), 9,24 (s, 1H), 10,03 (s, 1H); ЖХ/МС: m/e 346,4 (M+1).
ПРИМЕР 3
[00336] Получение N-(3-(5-метил-4-(м-толиламино)пиримидин-2-иламино)фенил)акриламида I-2
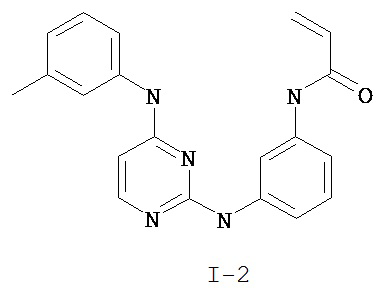
[00337] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
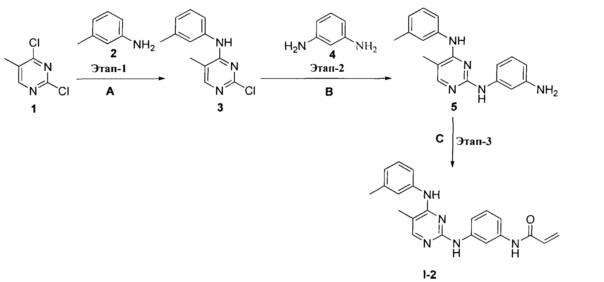
A) DIPEA, н-BuOH, 110°C, 30 минут, СВЧ; B) NMP, 200°C, 15 минут, СВЧ; C) акрилоилхлорид, NMP, 0°C - 30 минут, комн. темп. - 30 минут.
[00338] Этап 1
[00339] Раствор соединения 1 (0,1 г, 0,613 ммоль), соединения 2 (0,066 г, 0,613 ммоль), DIPEA (0,118 г, 0,919 ммоль) в н-BuOH (2,0 мл) облучали в микроволновой печи при 110°C в течение 90 минут. Реакционную смесь охлаждали, концентрировали при пониженном давлении, и полученный остаток затем очищали методом колоночной хроматографии (SiO2, смесь CHCl3/MeOH) с получением соединения 3 (0,05 г, 34%) в виде беловатого твердого продукта.
[00340] Этап 2
[00341] Раствор соединения 3 (0,05 г, 0,213 ммоль), соединения 4 (0,046 г, 0,427 ммоль) в NMP (2,0 мл) облучали в микроволновой печи (200°C, 15 минут). Реакционную смесь охлаждали, разбавляли водой (15 мл) и экстрагировали EtOAc (3×15 мл). Объединенный EtOAc экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением сухого остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 98/2) с получением соединения 5 (0,03 г, 46%) в виде серого твердого продукта.
[00342] Этап 3
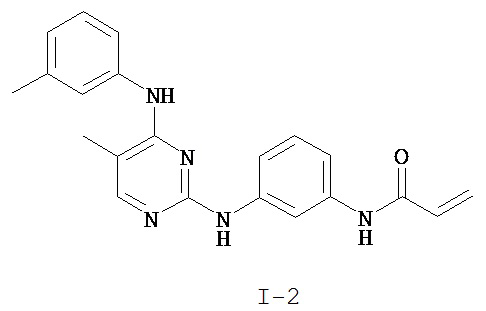
[00343] К раствору соединения 5 (0,025 г, 0,082 ммоль) в NMP (0,5 мл) при перемешивании при температуре 0°C добавляли акрилоилхлорид (0,073 г, 0,821 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 30 минут, после чего перемешивали при комнатной температуре в течение 30 минут. Сырую реакционную смесь затем очищали методом колоночной хроматографии на оксиде алюминия (нейтральный Al2O3, смес CHCl3/MeOH) с получением соединения 1-2 (0,012 г, 41%) в виде светло-коричневого твердого продукта: 1H-ЯМР (ДМСО-d6) δ ppm: 2,10 (s, 3H), 2,27 (s, 3H), 5,72 (dd, J=2 и 10,04 Гц, 1H), 6,22 (dd, J=1,96 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 6,83 (d, J=7,36 Гц, 1H), 7,09 (t, J=8,06 Гц, 1H), 7,17 (t, J=7,78 Гц, 1H), 7,26 (d, J=7,80 Гц, 1H), 7,47 (d, J=1,08 Гц, 1H), 7,53 (s, 1H), 7,58 (d, J=8,60 Гц, 1H), 7,78 (s, 1H), 7,88 (s, 1H), 8,15 (s, 1H), 9,01 (s, 1H), 9,99 (s, 1H); ЖХ/МС: m/e 360,1 (M+1).
ПРИМЕР 4
[00344] Получение N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)фенил)акриламида I-3
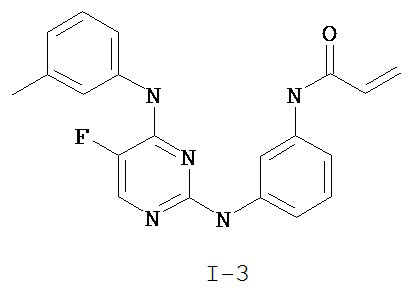
[00345] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
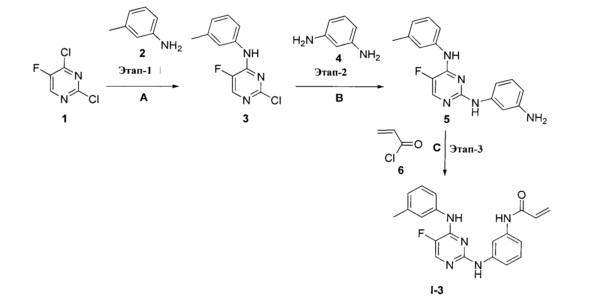
A) н-BuOH, DIPEA, 110°C, 45 минут, СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) NMP, DMAP, 0°C, 30 минут.
[00346] Этап 1
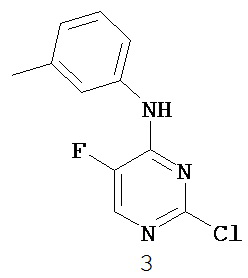
[00347] К раствору соединения 1 (0,5 г, 3 ммоль) в н-BuOH (5,0 мл) добавляли соединение 2 (0,64 г, 0,6 ммоль), DIPEA (0,116 г, 0,8 ммоль) и облучали реакционную смесь в микроволновой печи при температуре 110°C в течение 45 минут. Реакционную смесь охлаждали, гасили водой (50 мл) и экстрагировали EtOAc (2×25 мл). Объединенный EtOAc экстракт промывали водой (25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (0,45 г, 63%), который использовали на следующем этапе без дополнительной очистки.
[00348] Этап 2
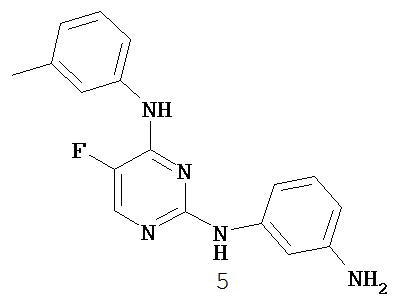
[00349] Раствор соединения 3 (0,45 г, 1,8 ммоль) и соединения 4 (0,41 г, 3,7 ммоль) в NMP (4,5 мл) облучали в микроволновой печи при 200°C в течение 10 минут. Затем реакционную смесь охлаждали, разбавляли водой (25 мл) и экстрагировали EtOAc (3×25 мл). Объединенный EtOAc экстракт промывали водой (2×25 мл), солевым раствором (25 мл), сушили над NO2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/EtOAc: 90/10) с получением соединения 5 (0,23 г, 41%) в виде светло-желтого твердого продукта.
[00350] Этап 3
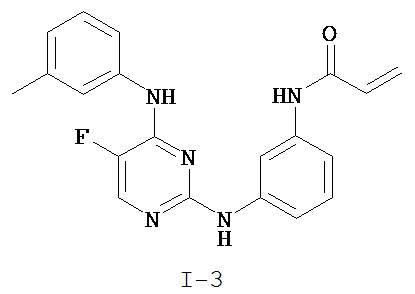
[00351] К раствору соединения 5 (0,075 г, 0,24 ммоль) в NMP (1,5 мл) при перемешивании при 0°C в атмосфере N2 добавляли 4-диметиламинопиридин (DMAP) (0,059 г, 0,48 ммоль) и акрилоилхлорид (0,064 г, 0,725 ммоль) и реакционную смесь выдержали при этой температуре в течение 30 минут. Затем ее гасили водой (7,5 мл) и экстрагировали EtOAc (3×25 мл). Объединенный EtOAc экстракт промывали 5% раствором лимонной кислоты (10 мл), водой (2×10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой остаток далее очищали методом колоночной хроматографии (Al2O3, CHCl3/MeOH): 98/2) с получением соединения I-3 (0,01 г, 11,3%) в виде беловатого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,27 (s, 3H), 5,72 (d, J=9,84 Гц, 1H), 6,22 (d, J=16,92 Гц, 1H), 6,44 (dd, J=10,2 и 17,02 Гц, 1H), 6,85 (d, J=7,12 Гц, 1H), 7,12-7,19 (m, 2H), 7,29 (d, J=7,68 Гц, 1H), 7,43 (d, J=7,92 Гц, 1H), 7,61-7,63 (m, 2H), 7,82 (s, 1H), 8,08 (s, 1H), 9,23 (bs, 2H), 10,03 (s, 1H); ЖХ/МС: m/e 364,2 (M+1).
ПРИМЕР 5
[00352] Получение (E)-4-(диметиламино)-N-(3-(5-фтор-4-(м-толил-амино)пиримидин-2-иламино)фенил)бут-2-енамида I-4
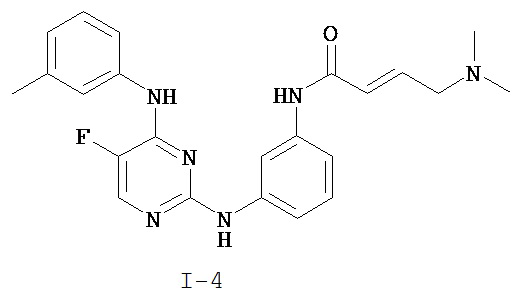
[00353] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
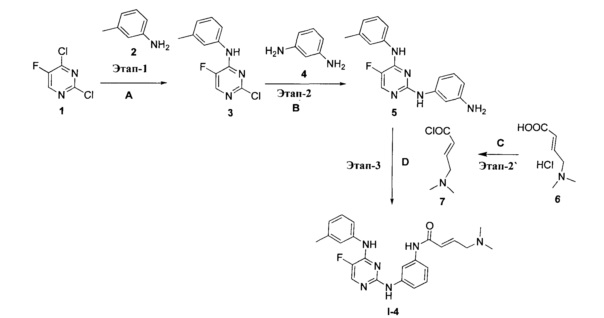
A) н-BuOH, DIPEA, 110°C, 45 минут, СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) оксалилхлорид, CH3CN, 30 мин при 0°C, 2 часа при 25°C, 5 минут при 45°C; D) NMP, 0°C-10°C, 30 минут.
[00354] Этап 1

[00355] Раствор соединения 1 (0,5 г, 3,0 ммоль), соединения 2 (0,32 г, 3,0 ммоль) в н-BuOH (5,0 мл) облучали в микроволновой печи (110°С, 45 минут). Реакционную смесь охлаждали, гасили водой (50 мл) и экстрагировали EtOAc (2×25 мл). Объединенный EtOAc экстракт промывали водой (25 мл), солевым раствором (25 мл), сушили над Na2S04 и концентрировали при пониженном давлении с получением соединения 3 (0,45 г, 63%), который использовали на следующем этапе без дополнительной очистки.
[00356] Этап 2

[00357] Раствор соединения 3 (0,45 г, 1,8 ммоль), соединения 4 (0,41 г, 3,7 ммоль) в NMP (4,5 мл) облучали в микроволновой печи (200°C, 10 минут). Реакционную смесь охлаждали, разбавляли водой (25 мл) и экстрагировали EtOAc (3×25 мл). Объединенный EtOAc экстракт промывали водой (2×25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток далее очищали методом колоночной хроматографии (SiO2, CHCl3/EtOAc: 90/10) с получением соединения 5 (0,23 г, 41%) в виде светло-желтого твердого продукта.
[00358] Этап 3a
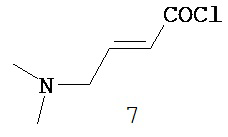
[00359] К раствору соединения 6 (0,13 г, 0,80 ммоль) в ацетонитриле CH3CN (1,0 мл) при перемешивании добавляли оксалилхлорид (0,122 г, 0,96 ммоль) при 0°C. Реакционную смесь оставляли при перемешивании при 0°C в течение 30 мин, затем при комнатной температуре в течение 2 часов. После реакционную смесь грели при 45°C в течение 5 минут, охлаждали и использовали на следующем этапе без дальнейшей очистки.
[00360] Этап 3

[00361] К раствору соединения 5 (0,05 г, 0,16 ммоль) в NMP (1,0 мл) при перемешивании добавляли соединение 7 при 0°C. Реакционную смесь перемешивали при 0°C в течение 30 минут и при 10°C в течение 30 минут. Реакционную смесь гасили насыщенным раствором натрия бикарбоната (5 мл) и экстрагировали CH2Cl2 (3×5 мл). Объединенный органический экстракт промывали водой (1 мл), солевым раствором (1 мл) и сушили над Na2SO4. Концентрировали при пониженном давлении, после чего очищали методом колоночной хроматографии (SiO2, 230-400 меш, CHCl3/MeOH: 95/5) с получением соединения 1-4 (0,02 г, 29.4%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,21 (s, 6H), 2,28 (s, 3H), 3,08 (bd, J=5,6 Гц, 2H), 6,29 (d, J=15,60 Гц, 1H), 6,67-6,74 (m, 1H), 6,86 (d, J=7,20 Гц, 1H), 7,12-7,20 (m, 2H), 7,27 (d, J=8,00 Гц, 1H), 7,43 (d, J=8,00 Гц, 1H), 7,62-7,64 (m, 2H), 7,82 (s, 1H), 8,08 (d, J=3,6 Гц, 1H), 9,23 (s, 1H), 9,24 (s, 1H), 9,96 (s, 1H); ЖХ/МС: m/e 421,2 (M+1).
ПРИМЕР 6
[00362] Получение N-(3-(5-метил-4-(фениламино)пиримидин-2-иламино)фенил)акриламида I-5
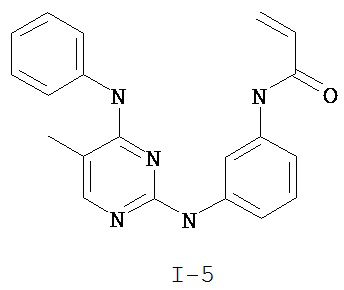
[00363] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
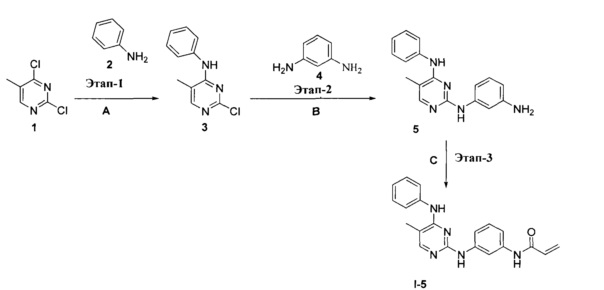
A) DIPEA, н-BuOH, 110°C, 30 минут, СВЧ; В) NMP, 200°C, 15 минут, СВЧ; C) акрилоилхлорид, NMP, 0°C - 30 минут, комн. темп. - 30 минут.
[00364] Этап 1
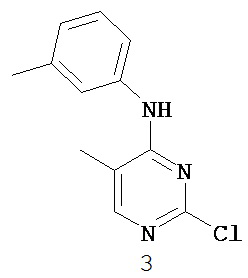
[00365] Раствор соединения 1 (0,1 г, 0,613 ммоль), соединения 2 (0,114 г, 1,226 ммоль), DIPEA (0,118 г, 0,919 ммоль) в н-BuOH (2,0 мл) облучали в микроволновой печи при 110°C в течение 90 минут. Реакционную смесь охлаждали, концентрировали при пониженном давлении, и полученный остаток затем очищали методом колоночной хроматографии (SiO2, MeOH/CHCl3: 1/9) с получением соединения 3 (0,08 г, 59%) в виде белого твердого продукта.
[00366] Этап 2
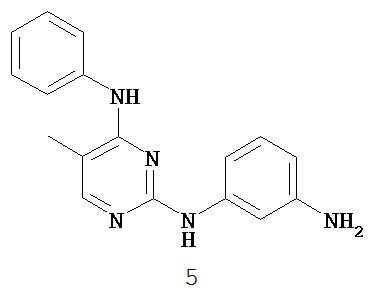
[00367] Раствор соединения 3 (0,08 г, 0,364 ммоль), соединения 4 (0,059 г, 0,546 ммоль) в NMP (2,0 мл) облучали в микроволновой печи (200°C, 15 минут). Реакционную смесь охлаждали, разбавляли водой (15 мл) и экстрагировали EtOAc (3×15 мл). Объединенный EtOAc экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением сухого остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 98/2) с получением соединения 5 (0,06 г, 60%) в виде светло-серого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,09 (s, 3H), 4,74 (s, 2H), 6.09-6,11 (m, 1H), 6,77-6,85 (m, 2H), 6,91 (t, J=1,72 Гц, 1H), 7,02 (t, J=7,36 Гц, 1H), 7,31 (t, J=7,52 Гц, 2H), 7,75 (d, J=7,68 Гц, 2H), 7,84 (s, 1H), 8,18 (s, 1H), 8,65 (s. 1H); ЖХ/МС: m/e 293,2 (M+1).
[00368] Этап 3
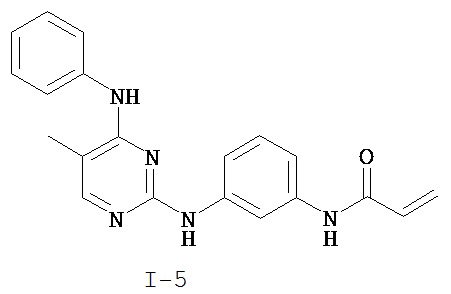
[00369] К раствору соединения 5 (60 мг, 0,205 ммоль) в NMP (2,0 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,148 г, 1,64 ммоль) и перемешивали реакционную смесь при 0°C в течение 30 минут. Необработанную реакционную смесь пропускали через колонку с оксидом алюминия (нейтральный Al2O3, CHCl3/MeOH: 99/1) с получением соединения 1-5 (0,013 г, 18,5%) в виде беловатого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,11 (s, 3H), 5,72 (dd, J=1,92 и 10,04 Гц, 1H), 6,22 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=9,32 и 16,92 Гц, 1H), 7,00 (t, J=7,28 Гц, 1H), 7,09 (t, J=8,04 Гц, 1H), 7,23-7,30 (m, 3H), 7,43 (d, J=8,04 Гц, 1H), 7,75-7,77 (m, 2H), 7,83 (s, 1H), 7,88 (s, 1H), 8,22 (s, 1H), 9,00 (s, 1H), 9,99 (s, 1H); ЖХ/МС: m/e 346 (M+1).
ПРИМЕР 7
[00370] Получение N-(4-метил-3-(5-метил-4-(м-толиламино)-пиримидин-2-иламино)фенил)акриламида I-8
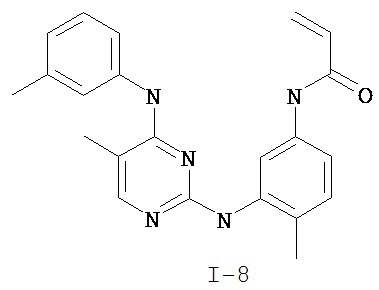
[00371] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
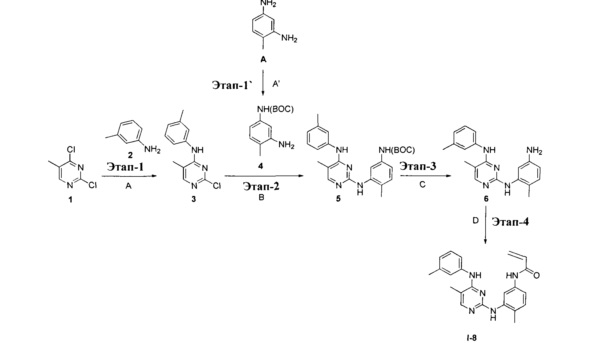
A) DIPEA, н-BuOH, 120°C, 60 минут., СВЧ; A’) (Boc)2O, MeOH, -10°C, 4 часа; B) Pd(OAc)2, BINAP, CS2CO3, толуол, 110°C, 12 часов; C) TFA, CH2Cl2, 0°C - 30 минут, комн. темп. - 2 часа; D) акрилоилхлорид, NMP, 0°C - 30 минут, комн. темп. - 30 минут.
[00372] Этап 1’
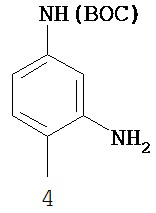
[00373] К раствору соединения А (5 г, 0,04 ммоль) в MeOH (75 мл) при перемешивании медленно добавляли (Boc)2O (11,59 г, 0,050 ммоль) при температуре -10°C. Реакционную смесь перемешивали при этой температуре в течение 4 часов, после чего концентрировали при пониженном давлении. Полученный остаток обрабатывали EtOAc (300 мл). Экстракт промывали водой (25 мл), солевым раствором (25 мл) и сушили над Na2SO4. Отфильтровывали, после чего концентрировали при пониженном давлении с получением соединения 4 (2,5 г, 27%) в виде беловатого твердого продукта.
[00374] Этап 1
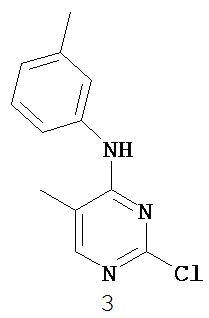
[00375] Раствор соединения 1 (0,5 г, 3,06 ммоль), соединения 2 (0,39 г, 3,06 ммоль), DIPEA (0,59 г, 4,5 ммоль) в н-BuOH (5 мл) облучали в микроволновой печи (120°C, 30 минут). Реакционную смесь охлаждали, удаляли растворители при пониженном давлении, и полученный осадок гасили водой (5 мл). Его экстрагировали EtOAc (3×20 мл) и объединенный EtOAc слой промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Отфильтровывали, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 9/1) с получением соединения 3 (0,35 г, 49%) в виде беловатого твердого продукта.
[00376] Этап 2
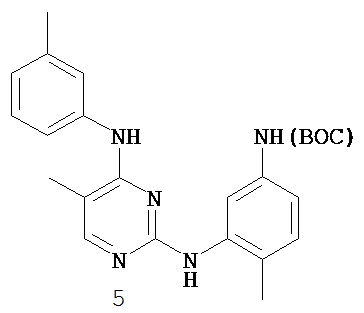
[00377] Раствор соединения 3 (0,1 г, 0,43 ммоль), соединения 4 (0,14 г, 0,64 ммоль), ацетата палладия (II) Pd(OAc)2 (10 мг, 0,043 ммоль), 2,2’-бис(дифенилфосфино)-1,1’-бинафтил (BINAP) (0,013 г, 0,021 ммоль) и карбонат цезия CS2CO3 (0,2 г, 1,06 ммоль) в дегазированном толуоле (толуол продували N2 в течение 15 минут) нагревали с обратным холодильником в течение 12 часов в атмосфере N2. Реакционную смесь охлаждали и пропускали через небольшой слой целита®. Фильтрат разбавляли EtOAc (25 мл), промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Отфильтровывали, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 9/1) с получением соединения 5 (40 мг, 22%) в виде беловатого твердого продукта.
[00378] Этап 3
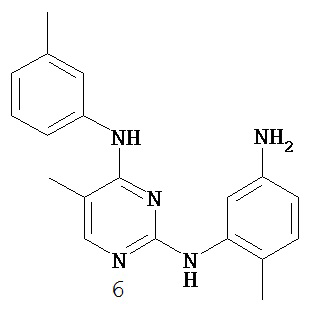
[00379] К раствору соединения 5 (0,04 г, 0,095 ммоль) в сухом дихлорметане CH2Cl2 (2 мл) при 0°C при перемешивании добавляли трифторуксусную кислоту (TFA) (0,.2 мл, 5 объемов), затем реакционную смесь выдерживали при этой температуре в течение 30 минут.Доводили температуру реакционной смеси до комнатной и перемешивали при этой температуре в течение 2 часов. Затем реакционную смесь гасили ледяной водой (2 мл), подщелачивали раствором натрия бикарбоната и экстрагировали EtOAc (2×10 мл). Объединенный EtOAc экстракт промывали водой (2 мл), солевым раствором (2 мл) и сушили над Na2SO4. Отфильтровывали, после чего концентрировали при пониженном давлении с получением соединения 6 (22 мг, 73%) в виде светло-коричневого твердого продукта.
[00380] Этап 4
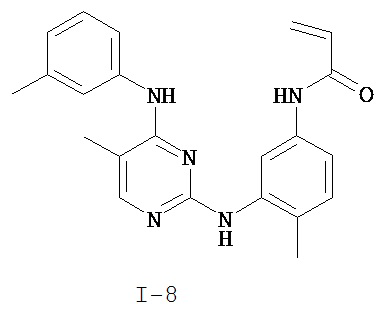
[00381] К раствору соединения 6 (0,2 г, 0,63 ммоль) в NMP (4 мл) при перемешивании добавляли акрилоилхлорид (0,12 г, 1,25 ммоль) при 0°C. Реакционную смесь выдерживали при этой температуре в течение 30 минут, а затем при комнатной температуре в течение 30 минут. Затем реакционную смесь гасили ледяной водой (2 мл) и экстрагировали EtOAc (2×10 мл). Объединенный EtOAc экстракт промывали водой (2 мл), солевым раствором (2 мл) и сушили над Na2SO4. Отфильтровывали, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 230-400 меш, CHCl3/MeOH: 9/1) с получением соединения 1-8(10 мг, 4%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,07 (s, 3H), 2,13 (s, 6H), 5,70 (dd, J=1,92 и 10,08 Гц, 1H), 6,20 (dd, J=1,96 и 16,88 Гц, 1H), 6,41 (dd, J=10,16 и 16,96 Гц, 1H), 6,69 (d, J=7,36 Гц, 1H), 6,98 (t, J=7,76 Гц, 1H), 7,11 (d, J=8,24 Гц, 1H), 7,41 (q, J=9,92 Гц, 1H), 7,49-7,51 (m, 2H), 7,73 (s, 1H), 7,80 (s, 1H), 7,97 (s, 1H), 8,16 (s, 1H), 10,00 (s, 1H); ЖХ/МС: m/e 374 (M+1).
ПРИМЕР 8
[00382] Получение N-(3-(4-(3-бромфениламино)-5-метилпиримидин-2-иламино)-фенил)акриламида I-9
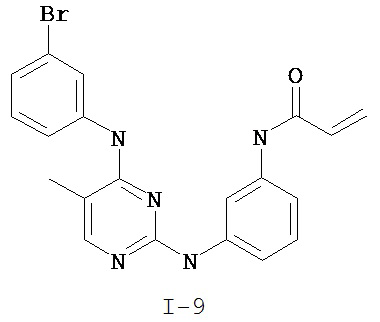
[00383] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.

A) DIPEA, н-BuOH, 110°C, 1 час, СВЧ; B) 1,5 N HCl, EtOH, 90°C, 30 минут, СВЧ; C) акрилоилхлорид, NMP, 0°C, 30 минут.
[00384] Этап 1
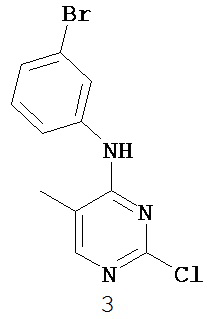
[00385] Раствор соединения 1 (0,5 г, 3,06 ммоль), соединения 2 (0,53 г, 3,06 ммоль), и DIPEA (0,80 мл, 4,06 ммоль) в н-BuOH (5 мл) облучали в микроволновой печи (110°C, 1 час). Реакционную смесь охлаждали и концентрировали при пониженном давлении с получением сухого остатка. Остаток обрабатывали EtOAc (5 мл) и промывали раствором NaHCO3 (2 мл), водой (2 мл) и солевым раствором (2 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением сырого соединения 3, которое затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl2/MeOH: 9/1) с получением соединения 3 (0,125 г, 13%) в виде коричневого твердого продукта.
[00386] Этап 2
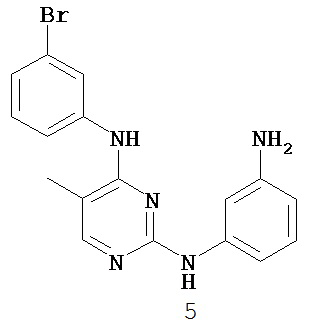
[00387] К раствору соединения 3 (0,15 г, 0,5 ммоль) в этаноле EtOH (3 мл) добавляли соединение 4 (0,081 г, 0,75 ммоль), а затем 1,5 N раствор HCl (0,055 г, 1,5 ммоль). Реакционную смесь облучали в микроволновой печи (90°C, 30 минут), охлаждали и концентрировали при пониженном давлении. Полученный остаток обрабатывали EtOAc (5 мл) и промывали раствором NaHCO3 (2 мл), водой (2 мл) и солевым раствором (2 мл). Сушили над Na2SO4, отфильтровывали, после чего концентрировали при пониженном давлении с получением сырого соединения 5, которое затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 9/1) с получением соединения 5 (0,06 г, 32%) в виде светло-коричневого твердого продукта.
[00388] Этап 3
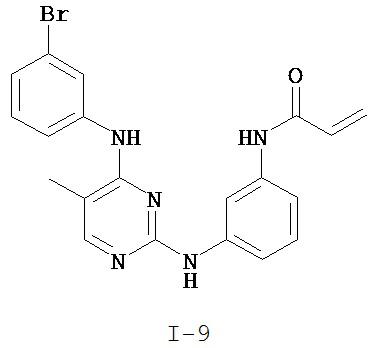
[00389] К раствору соединения 5 (0,06 г, 0,16 ммоль) в NMP (1 мл) при перемешивании добавляли акрилоилхлорид (0,117 г, 1,29 ммоль) при 0°C. Реакционную смесь оставляли при перемешивании при этой температуре в течение 30 минут, после чего ее обрабатывали CH2Cl2 (2 мл). Промывали экстракт раствором NaHCO3 (1 мл), водой (1 мл) и солевым раствором (1 мл). Затем его сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток затем очищали колоночной хроматографией (SiO2, 60-120 меш, CHCl3/MeOH: 9/1) с получением соединения 1-9 (0,016 г, 23%) в виде светло-коричневого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,16 (s, 3H), 5,75 (dd, J=1,72 и 10 Гц, 1H), 6,23 (dd, J=1,76 и 16,88 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 7,22-7,34 (m, 4H), 7,38 (d, J=8,00 Гц, 1H), 7,63 (d, J=8,08 Гц, 1H), 7,77 (s, 1H), 7,82 (s, 1H), 7,93 (s, 1H), 9,68 (s, 1H), 10,26 (s, 1H), 10,34 (s, 1H); ЖХ/МС: m/e 426 (M+1).
ПРИМЕР 9
[00390] Получение 3-(4-(2-(циклопропилсульфонил)-1,2,3,4-тетрагидроизохинолин-6-иламино)-5-метилпиримидин-2-иламино)бензолсульфонамида I-10
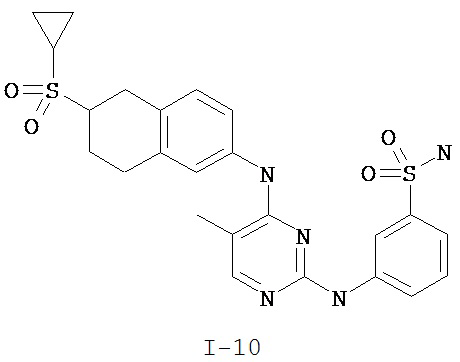
[00391] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
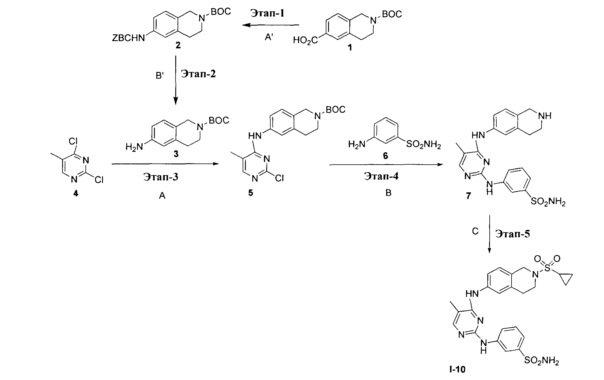
A’) DPPA, бензиловый спирт, Et3H толуол, 110°C, 12 часов; B’) Pd(OH)2, аммония формиат, EtOH, кипячение с обратным холодильником, 6 часов; A) DIPEA, н-BuOH, 120°C, 1 час, СВЧ; B) 1,5 N HCl, EtOH, кипячение с обратным холодильником, 12 часов.; C) циклопропилсульфонилхлорид, DIPEA, ТТФ, комн. темп., 12 часов.
[00392] Этапы 1-4 Процедура синтеза структуры 7 описана в экспериментальной части для синтеза соединения I-11 в настоящем описании.
[00393] Этап 5
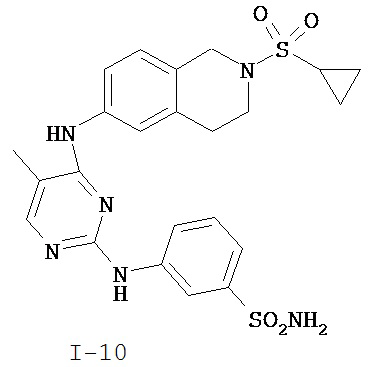
[00394] К раствору соединения 7 (0,05 г, 0,0121 ммоль) в тетрагидрофуране ТГФ (4 мл) при температуре 0°C при перемешивании добавляли DIPEA (0,023 г, 0,182 ммоль), а затем циклопропилсульфонилхлорид (0,031 г, 0,182 ммоль) в атмосфере N2. Реакционную смесь оставляли до достижения комнатной температуры, и выдерживали при этой температуре 12 часов. Затем ее обрабатывали EtOAc (10 мл), промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Отфильтровывали, и затем концентрировали при пониженном давлении с получением сухого остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 6/4) с получением соединения 1-10 (0,035 г, 56%) в виде желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 0,97-1,00 (m, 4H), 2,12 (s, 3H), 2,60-2,66 (m, 1H), 2,90 (t, J=5,2 Гц, 2H), 3,52 (t, J=6 Гц, 2H), 4,42 (s, 2H), 7,16 (d, J=8,4 Гц, 1Н), 7,27 (s, 2H), 7,31-7,35 (m, 2H), 7,53 (s, 1H), 7,59 (d, J=8,4 Гц, 1H), 7,92 (s, 1H), 8,03-8,04 (m, 2H), 8,45 (s, 1H), 9,40 (s, 1H); ЖХ/МС: m/e 515 (M+1).
ПРИМЕР 10
[00395] Получение 3-(4-(2-(2-хлорацетил)-1,2,3,4-тетрагидроизохинолин-6-иламино)-5-метилпиримидин-2-иламино)бензолсульфонамида I-11
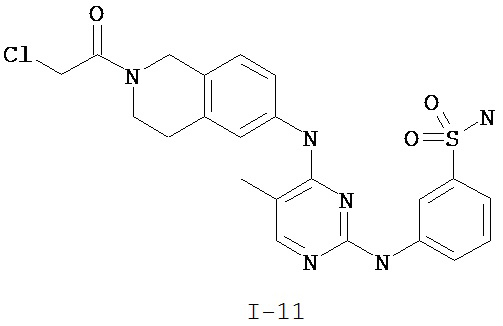
[00396] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.

A’) DPPA, бензиловый спирт, Et3N, толуол, 110°C, 12 часов; B’) Pd(OH)2, аммония формиат, EtOH, кипячение с обратным холодильником, 6 часов; A) DIPEA, н-BuOH, 120°C, 1 час, СВЧ; B) 1,5 N HCl, EtOH, кипячение с обратным холодильником 12 часов.; C) Cl-CH2-COCl, Et3N, ТГФ, комн. темп., 12 часов.
[00397] Этап 1
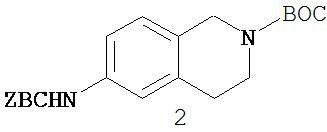
[00398] К раствору соединения 1 (1,5 г, 5,4 ммоль) в толуоле (15 мл) добавляли при перемешивании дифенилфосфорилазид (DPPA) (2,17 г, 8,11 ммоль), триэтиламин Et3N (1,05 мл, 8,11 ммоль) и бензиловый спирт (0,876 г, 8,11 ммоль) а атмосфере N2. Реакционную смесь кипятили с обратным холодильником в течение 12 часов, охлаждали и экстрагировали этилацетатом (100 мл). Экстракт промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Затем отфильтровывали и концентрировали при пониженном давлении, и остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 2 (2,0 г, 97%) в виде белого твердого продукта.
[00399] Этап 2

[00400] К раствору соединения 2 (2,2 г, 5,75 ммоль) в EtOH (25 мл) при перемешивании добавляли формиат аммония (3,68 г, 57,5 ммоль) и кипятили реакционную смесь с обратным холодильником в течение 6 часов. Затем охлаждали, отфильтровывали через слой целита® и концентрировали фильтрат при пониженном давлении с получением соединения 3 (1,3 г, 91%) в виде темно-коричневого масла, которое использовали далее без очистки.
[00401] Этап 3
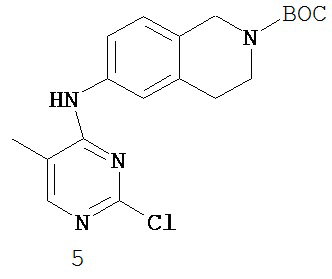
[00402] Раствор соединения 3 (1,4 г, 5,56 ммоль), соединения 4 (0,912 г, 5,56 ммоль) и DIPEA (1,077 г, 8,3 ммоль) в н-BuOH (15 мл) облучали в микроволновой печи при 120°C в течение 45 минут. Реакционную смесь охлаждали и концентрировали при пониженном давлении. Остаток обрабатывали этилацетатом (20 мл), промывали водой (5 мл) и солевым раствором (5 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 5 (1,1 г, 52%) в виде твердого продукта кремового цвета.
[00403] Этап 4
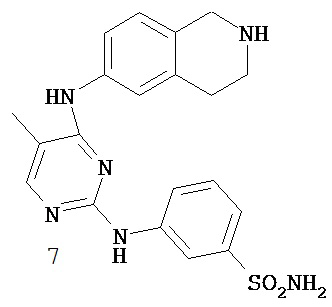
[00404] К раствору соединения 5 (0,25 г, 0,66 ммоль) в этаноле (5 мл) при перемешивании добавляли соединение 6 (0,126 г, 0,73 ммоль) и каталитическое количество водного раствора HCl, после чего реакционную смесь кипятили с обратным холодильником в течение 12 часов при 100°C. Реакционную смесь охлаждали, выпавший осадок отфильтровывали, промывали диэтиловым эфиром и сушили в высоком вакууме с получением соединения 7 (0,24 г, 82%) в виде светло-желтого продукта.
[00405] Этап 5
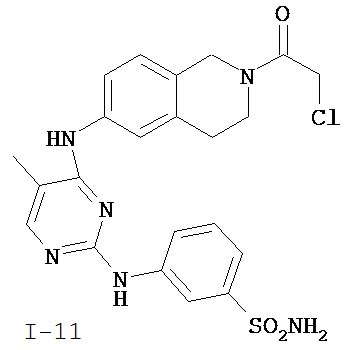
[00406] К раствору соединения 7 (0,2 г, 0,487 ммоль) в NMP (5 мл) при перемешивании добавляли Et3N (0,094 г, 0,731 ммоль). Раствор охлаждали до 0°C, после чего добавляли хлорацетилхлорид (0,082 г, 0,731 ммоль). Реакционную смесь оставляли до достижения комнатной температуры и перемешивали при комнатной температуре в течение 12 часов. Затем ее гасили ледяной водой (2 мл) и экстрагировали этилацетатом (3×5 мл). Объединенный этилацетатный экстракт промывали солевым раствором (2 мл), сушили над безводным Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Полученный остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения I-11 (0,038 г, 16%) в виде светло-желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,11 (s, 3H), 2,77-2,89 (m, 2H), 3,70-3,72 (m, 2H), 4,49 (d, J=2,92 Гц, 2H), 4,63 (d, J=23,56 Гц, 2H), 7,15-7,17 (m, 1H), 7,24 (s, 2H), 7,30-7,32 (m, 2H), 7,50-7,65 (m, 2H), 7,91 (s, 1H), 8,04-8,05 (m, 2H), 8,27 (s, 1H), 9,31 (s, 1H), ЖХ/МС: m/e 486,8 (MH+).
ПРИМЕР 11
[00407] Получение N-(3-(5-метил-4-(4-феноксифениламино)пиримидин-2-иламино)фенил)акриламида 1-23
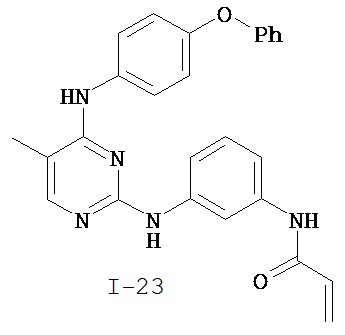
[00408] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
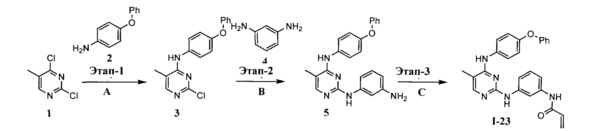
A) DIPEA, н-бутанол, 100°C, 1 час, СВЧ; B) конц. HCl, н-BuOH, 160°C, 20 минут, СВЧ; C) акрилоилхлорид 0°C, комн. темп., 1 час.
[00409] Этап 1
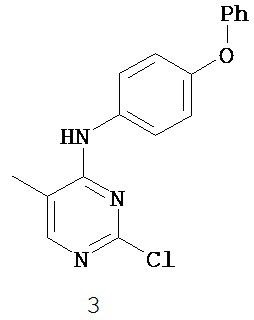
[00410] Раствор соединения 1 (0,2 г, 1,2 ммоль), соединения 2 (0,12 г, 0,95 ммоль) и DIPEA (0,23 г, 1,78 ммоль) в н-BuOH (2 мл) облучали в микроволновой печи (100°C в течение 1 часа). Затем реакционную смесь охлаждали, концентрировали при пониженном давлении, и остаток экстрагировали EtOAc (5 мл). Экстракт промывали раствором NaHCO3 (2 мл), водой (2 мл) и солевым раствором (2 мл), после чего сушили над безводным Na2SO4. Концентрировали при повышенном давлении, затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 3 (0,11 г, 28,9%) в виде светло-коричневого твердого продукта.
[00411] Этап 2
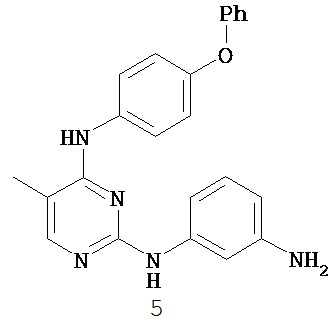
[00412] К раствору соединения 3 (0,11 г, 0,3 ммоль), соединения 4 (0,114 г, 1,05 ммоль) в н-бутаноле (1 мл) добавляли концентрированную HCl (1 каплю), и облучали смесь облучению в микроволновой печи (165°С в течение 10 минут). Реакционную смесь охлаждали, концентрировали при пониженном давлении, и остаток экстрагировали EtOAc (5 мл). Экстракт промывали раствором NaHCO3 (2 мл), водой (2 мл) и солевым раствором (2 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 5 (0,08 г, 65%) в виде твердого продукта коричневого цвета.
[00413] Этап 3

[00414] К раствору соединения 5 (0,015 г, 0,03 ммоль) в NMP (1 мл) при перемешивании добавляли акрилоилхлорид (0.005 г, 0,05 ммоль) при температуре 0°C. Реакционную смесь оставляли до достижения комнатной температуры и выдерживают при этой температуре в течение 1 часа. Затем реакционную смесь разбавляли дихлорметаном (2 мл) и промывали раствором NaHCO3 (1 мл), водой (1 мл) и солевым раствором (1 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 1-23 (0,004 г, 23%) в виде твердого продукта коричневого цвета. 400 МГц, MeOD: δ 2,14 (s, 3H), 5,71 (d, J=11,20 Гц, 1H), 6,30-6,44 (m, 2H), 6,94-6,99 (m, 4H), 7,07-7,15 (m, 2H), 7,22 (d, J=7,2 Гц, 1H), 7,34-7,36 (m, 3H), 7,63 (d, J=8,8 Гц, 2H), 7,79 (s, 2H); ЖХ/МС: m/e 437 (M+1).
ПРИМЕР 12
[00415] Получение N-(3-(5-метил-2-(3-сульфамоилфениламино)пиримидин-4-иламино)фенил)акриламида 1-33

[00416] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
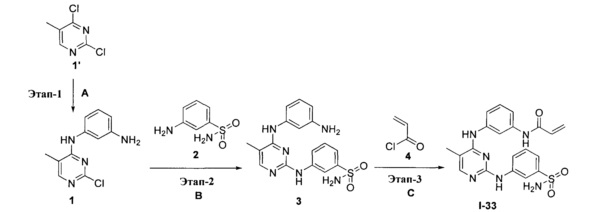
A) DIPEA, н-BuOH, 120°C, 30 минут, СВЧ; B) 1,5 N HCl, этанол, 100°C, 12 часов; C) NMP, 0°C до комн. темп., 1 час.
[00417] Этап 1
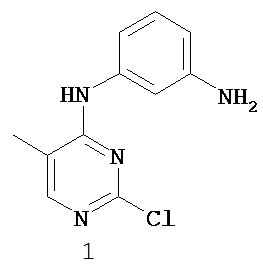
[00418] Раствор соединения 1’ (0,5 г, 3,06 ммоль), 1 (0,49 г, 4,59 ммоль), DIPEA (0,59 г, 4,59 ммоль) в н-бутаноле (8 мл) облучали в микроволновой печи (120°C, 30 минут). Охлаждали, гасили водой (5 мл) и экстрагировали этилацетатом (3×20 мл). Объединенный этилацетатный слой промывали солевым раствором (5 мл), сушили над Na2SO4, отфильтровывали и концентрировали при пониженном давлении. Остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/этилацетат, 9/1) с получением соединения 1 (0,25 г, 34,77%) в виде светло-коричневого твердого продукта.
[00419] Этап 2
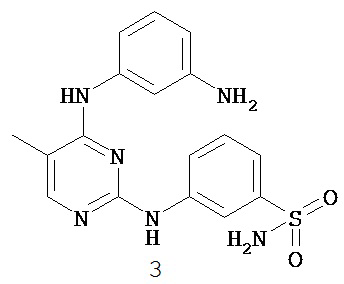
[00420] К раствору соединения 3 (0,1 г, 0,48 ммоль), в этаноле (2 мл) при перемешивании добавляли соединение 4 (0,070 г, 0,42 ммоль) и каталитическое количество 1,5 N раствора HCl (3 капли), затем нагревали до 100°C в течение 12 часов. 15 Затем реакционную смесь охлаждали, твердую фазу отделяли, фильтровали и промывали эфиром с получением соединения 5 (0,1 г, неочищенного), после чего использовали на следующем этапе без дополнительной очистки.
[00421] Этап 3
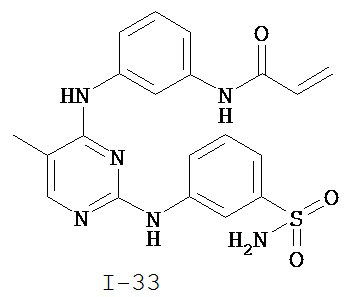
[00422] К раствору соединения 5 (0,1 г, 0,27 ммоль) в NMP (2 мл) при перемешивании добавляли акрилоилхлорид (0,037 г, 0,425 ммоль) при температуре 0°C, после чего перемешивали при комнатной температуре в течение 1 часа, затем реакционную смесь гасили водойй (4 мл) и подщелачивали NaHCO3, после чего экстрагировали этилацетатом (5 мл), объединенный органический слой промывали солевым раствором (1 мл), сушили над безводным Na2SO4, отфильтровывали и концентрировали, затем очищали сырой продукт методом препаративной ВЭЖХ с получением соединения 1-33 (0,07 г, 6%) в виде беловатого твердого продукта. 1H-ЯМР (MeOD) δ ppm: 2,17 (s, 3H), 5,78 (dd, J=2,36 и 9,52 Гц, 1H), 6,34-6,48 (m, 2H), 7,26-7,43 (m, 5H), 7,87 (s, 1H), 7,96-8,03 (m, 3H); ЖХ/МС: m/e 425 (M+1).
ПРИМЕР 13
[00423] Получение N-(3-(метил-(5-метил-2-(фениламино)пиримидин-4-ил)амино) фенил)акриламида I-34
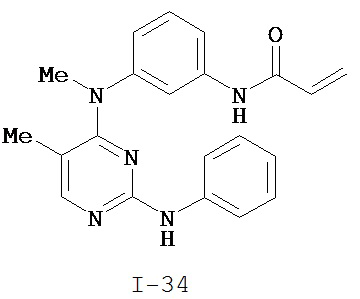
[00424] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
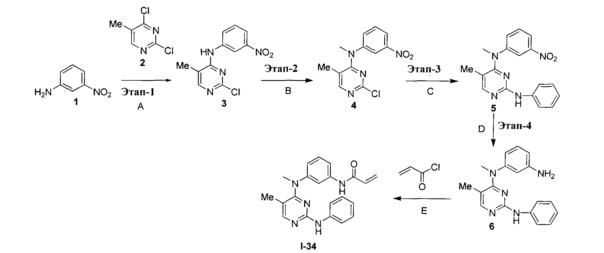
A) Pd(OAc)2, BINAP, CS2CO3, толуол, 100°C, 16 часов; B) NaH, CH3I, ТГФ, 0°C - 30 минут, комн. темп. - 16 часов; С) анилин, конц. HCl, этанол, 90°C, 60 мин; D) H2, Pd/C, этанол, 16 часов; Е) акрилоилхлорид, NMP, 0°С, 1 час.
[00425] Этап 1
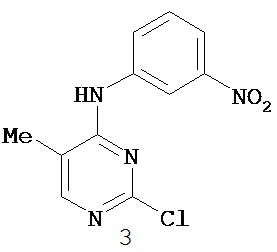
[00426] К раствору соединения 2 (1,0 г, 6,0 ммоль) в толуоле (30,0 мл) при перемешивании добавляли соединение 1 (0,84 г, 6,0 ммоль), BINAP (0,186 г, 0,3 ммоль), Cs2CO3 (4,87 г, 15,0 ммоль). Реакционную смесь дегазировали, продувая N2 в течение 15 минут. Затем к реакционной смеси добавляли Pd(OAc)2 (0,134 г, 0,6 ммоль), и нагревали реакционную смесь при 100°С в течение 16 часов в атмосфере N2. Затем реакционную смесь охлаждали, разбавляли этилацетатом (30 мл) и фильтровали через целит®. Фильтрат промывали водой (2×25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, этилацетат/гексан: 10/90) с получением твердого продукта, который промывали эфиром с получением соединения 3 (0,6 г, 37%) в виде светло-желтого твердого продукта.
[00427] Этап 2
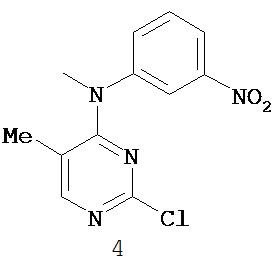
[00428] К смеси NaH (0,1 г, 2,5 ммоль, 60% дисперсия в парафиновом масле) в сухом ТГФ (10,0 мл) при перемешивании добавляли соединение 3 (0,5 г, 1,89 ммоль) при температуре 0°C и перемешивали реакционную смесь при этой температуре в течение 30 минут. Добавляли йодистый метил CH3I (0,305 г, 2,15 ммоль), после чего реакционную смесь оставляли до достижения комнатной температуры, затем перемешивали при этой температуре в течение 16 часов. Реакционную смесь разбавляли водой (25 мл) и экстрагировали EtOAc (3×25 мл). Объединенный EtOAc экстракт промывали водой (25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением сухого остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 99/1) с получением соединения 4 (0,12 г, 22,7%) в виде светло-желтого твердого продукта.
[00429] Этап 3
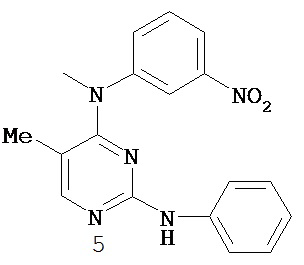
[00430] К раствору соединения 4 (120 мг, 0,431 ммоль) в EtOH (2 мл) добавляли концентрированную HCl (0,044 г, 1,2 ммоль) и анилин (0,16 г, 1,72 ммоль) и грели реакционную смесь в колбе под давлением при 90°C в течение 1 часа. Реакционную смесь охлаждали, растворители удаляли методом концентрирования при пониженном давлении и полученный остаток разбавляли 10% раствором NaHCO3 (10,0 мл). Реакционную смесь экстрагировали EtOAc (3×15 мл) и объединенный EtOAc экстракт промывали водой (15 мл), солевым раствором (15 мл) и сушили над Na2SO4. Концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 99/1) с получением соединения 5 (0,11 г, 76%) в виде светло-желтого твердого продукта.
[00431] Этап 4
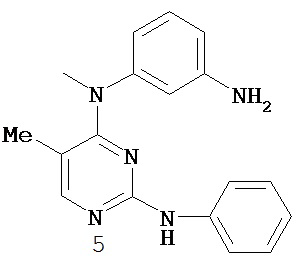
[00432] К раствору соединения 5 (0,110 г, 0,328 ммоль) в этаноле (50 мл) добавляли 10% палладий на угле Pd/C (0,022 г) и перемешивали реакционную смесь в атмосфере H2 (1,5 кг) при комнатной температуре в течение 16 часов. Фильтровали через целит® и концентрировали при пониженном давлении с получением остатка. Остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, метанол/хлороформ: 1/99) с получением соединения 6 (0,07 г, 69,9%) в виде бесцветной вязкой жидкости.
[00433] Этап 5
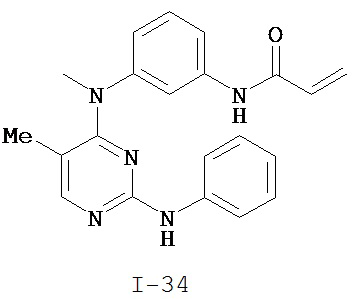
[00434] К раствору соединения 6 (0,070 г, 0,23 ммоль) в NMP (1,5 мл) при перемешивании при 0°C добавляли акрилоилхлорид (0,083 г, 0,916 ммоль) и реакционную смесь перемешивали при 0°C в течение 1 часа. Затем ее гасили 10% раствором натрия бикарбоната (15 мл), после чего отфильтровывали выпавший осадок, промывали осадок холодной водой (5 мл), гексаном (5 мл). Осадок сушили в течение 2 часов при пониженном давлении с получением соединения 1-34 (0,033 г, 40%) в виде светло-желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: δ 1,47 (s, 3H), 3,45 (s, 3H), 5,74 (dd, J=Гц, 1H), 6,22 (dd, J=2,0 и 16,98 Гц, 1H), 6,38 (dd, J=10 и 16,94 Гц, 1H), 6,85-6,91 (m, 2H), 7,21-7,25 (m, 2H), 7,32 (t, J=8,02 Гц, 1H), 7,43-7,47 (m, 2H), 7,77-7,79 (m, 2H), 7,90 (s, 1H), 9,22 (s, 1H), 10,18 (s, 1H); ЖХ/МС: m/e 360,8 (M+1).
ПРИМЕР 14
[00435] Получение N-(3-(5-метил-2-(3-(проп-2-инилокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-35
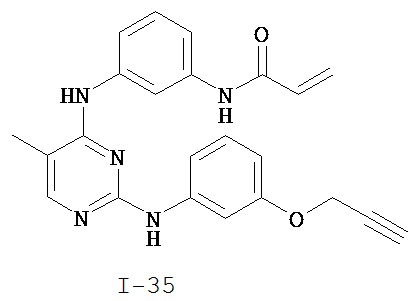
[00436] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
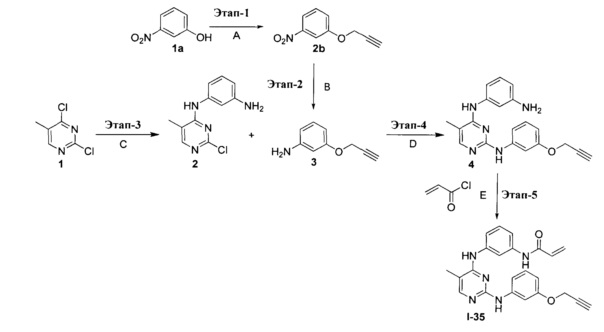
A) K2CO3, CH3CN 65°C, 8 часов; B) Fe порошок, NH4Cl, MeOH, H2O, 80°C, 4 часа; C) 1,3-фенилендиамин, DIPEA, н-BuOH, 120°C, 30 минут, СВЧ; D) конц. HCl, абсолютный этанол, 110°C, 2 часа; Е) NMP, 0°C, 1 час.
[00437] Этап 1
[00438] К раствору соединения 1a (4 г, 0,0287 моль) и K2CO3 (5,6 г, 0,0574 моль) в CH3CN (15 мл) при перемешивании добавляли пропаргилбромид (4,1 г, 0,0345 моль) и полученную смесь кипятили с обратным холодильником в течение 8 часов. Реакционную смесь затем охлаждали, гасили водой и экстрагировали EtOAc (3×50 мл). Объединенный EtOAc экстракт промывали водой (20 мл), солевым раствором (20 мл) и сушили над Na2SO4. Отфильтровывали и концентрировали при пониженном давлении с получением соединения 2b в виде твердого продукта коричневатого цвета, которое использовали далее без очистки.
[00439] Этап 2
[00440] К раствору соединения 2b в смеси метанола (30 мл) и воды (30 мл) при перемешивании последовательно добавляли NH4Cl (10,3 г, 0,194 моль) и железный порошок (6,8 г, 0,121 моль). Полученную смесь кипятили с обратным холодильником при 80°C в течение 4 часов. Реакционную смесь охлаждали, разбавляли метанолом и фильтровали через слой целита®. Фильтрат концентрировали при пониженном давлении и остаток обрабатывали EtOAc. Затем промывали водой, солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, колоночная хроматография с гравитационным элюированием, и целевой продукт элюировали CHCl3/MeOH: 96/4) с получением соединения 3 (3,2 г, 91%) в виде коричневатого твердого продукта.
[00441] Этап 3
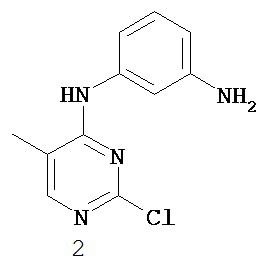
[00442] Раствор 2,4-дихлор-5-метилпиримидина 1 (0,3 г, 0,0018 моль), 1,3-фенилендиамина (0,24 г, 0,022 моль), DIPEA (0,35 г, 0,0027 моль) в н-BuOH (3 мл) подвергали облучению в микроволновой печи (120°C, 30 минут). Реакционную смесь охлаждали, гасили водой (15 мл) и экстрагировали EtOAc (3×15 мл). Объединенный EtOAc экстракт промывали водой (20 мл), солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный осадок далее очищали методом колоночной хроматографии (SiO2, 60-120 меш) с получением соединения 2 (0,15 г, 35%) в виде коричневатого твердого продукта.
[00443] Этап 4
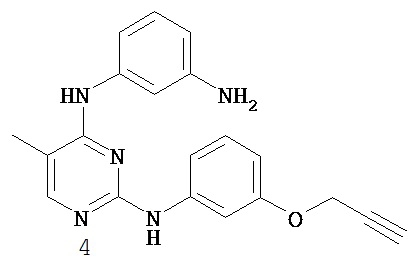
Соединения 2 (0,15 г, 0,006 моль) и 3 (0,37 г, 0,0025 моль) помещали в реактор высокого давления и добавляли в него абс. EtOH (3 мл), а затем конц. HCl (0,04 г, 0,0012 моль). Пробирку плотно закручивали и грели при 120°C в течение 2 часов. Затем реакционную смесь охлаждали, отгоняли растворители при пониженном давлении, и полученный остаток обрабатывали EtOAc (10 мл). Промывали водой (4 мл), раствором NaHCO3 (4 мл) и солевым раствором (5 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, колоночная хроматография с гравитационным элюированием, элюировали целевой продукт смесью CHCl3/MeOH: 94/6) с получением соединения 4 (125 мг, 56%) в виде светло-коричневого твердого продукта.
[00444] Этап 5
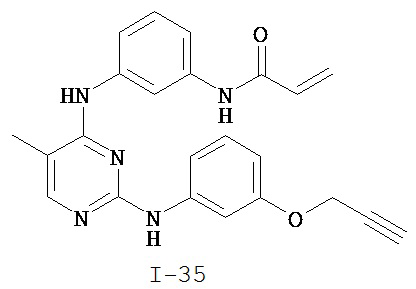
[00445] К раствору соединения 4 (0,1 г, 0,002 ммоль) в NMP (8 мл) при перемешивании добавляли акрилоилхлорид (0,1 г, 0,001 моль) по каплям при температуре 0°C. Реакционную смесь выдерживали при этой температуре в течение 10 минут, после чего оставляли реакционную смесь до достижения комнатной температуры и перемешивали при этой температуре в течение 1,5 часов. Затем реакционную смесь гасили 10% раствором натрия бикарбоната (8 mL) и экстрагировали EtOAc (2×15 мл). Объединенный EtOAc экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный осадок затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, колоночная хроматография с гравитационным элюированием, целевой продукт элюировали смесью CHCl3/МеОН: 90/10) с получением соединения I -35 (20 мг, 18%) в виде беловатого твердого продукта. 1H-ЯМР (ДМСО-d6) 5 ppm: 2,11 (s, 3H), 3,51 (s, 1H), 4,61 (s, 2H), 5,74 (d, J=9,08 Гц, 1Н), 6,25 (d, J=15,84 Гц, 1H), 6,45 (s, 2H), 7,02 (s, 1H), 7,27-7,45 (m, 5H), 7,91 (d, J=8,84 Гц, 2H), 8,36 (s, 1H), 8,93 (s, 1H), 10,09 (s, 1H), ЖХ/МС: m/e 400 (M+1).
ПРИМЕР 15
[00446] Получение (E)-4-(диметиламино)-N-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)фенил)бут-2-енамида I-38
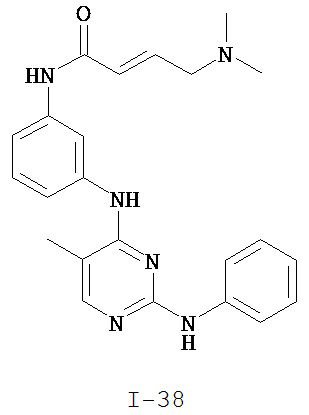
[00447] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
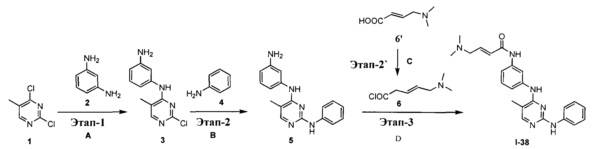
A) DIPEA, н-BuOH, 120°C, 30 минут, СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) оксалилхлорид, CH3CN, 30 минут при температуре 0°C, 2 часа при температуре 25°C, 5 минут при температуре 45°C, D) NMP, 0°C, 1 час.
[00448] Этап 1
[00449] Раствор соединения 1 (2,0 г, 12 ммоль), соединения 2 (2,0 г, 18 ммоль), DIPEA (2,33 г, 18 ммоль) в н-BuOH (20,0 мл) облучали в микроволновой печи при 120°C в течение 30 мин. Реакционную смесь затем гасили водой (100 мл) и экстрагировали EtOAc (3×20 мл). Объединенный EtOAc экстракт промывали водой (100 мл), солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/этил ацетат, 15/85) с получением соединения 3 (1,3 г, 45%) в виде темно-коричневого твердого продукта.
[00450] Этап 2
[00451] Раствор соединения 3 (1,0 г, 4,27 ммоль), соединения 4 (1,5 г, 16,12 ммоль) в NMP (10 мл) облучали в микроволновой печи (200°C, 10 минут). Затем реакционную смесь охлаждали, разбавляли водой (100 мл) и экстрагировали EtOAc (3×100 мл). Объединенный EtOAc экстракт промывали водой (100 мл), солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 98/2) с получением соединения 5 (0,5 г, 40,3%) в виде светло-коричневого твердого продукта.
[00452] Этап 2’
[00453] К раствору соединения 6’ (70 мг, 0,42 ммоль) в CH3CN (1,0 мл) при перемешивании добавляли оксалилхлорид (80 мг, 0,62 ммоль) при температуре 0°C. Реакционную смесь перемешивали при температуре 0°C в течение 30 мин, а затем при комнатной температуре в течение 2 часов. Затем реакционную смесь грели при 45°C в течение 5 минут, охлаждали и использовали на следующем этапе без очистки.
[00454] Этап 3
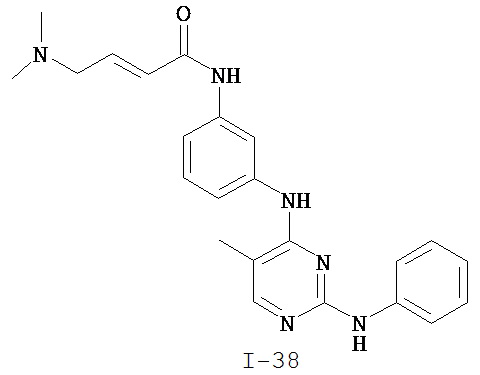
[00455] К раствору соединения 5 (75 мг, 0,12 ммоль) в NMP (1 мл) при перемешивании добавляли соединение 6 при температуре 0°C. Реакционную смесь перемешивали при 0°C в течение 1 часа, гасили холодной водой (5 мл), подщелачивали Et3N и экстрагировали CH2Cl2 (3×10 мл). Объединенный органический экстракт промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Концентрировали при пониженном давлении, затем очищали на силикагеле (60-120 меш), элюируя 5% раствором метанола в хлороформе с получением сырого соединения (20 мг) в виде коричневого смолистого твердого продукта, которое затем снова обрабатывали дихлорметаном и перемешивали с 10% раствором бикарбоната в течение 30 минут, отделяли слой дихлорметана, сушили над Na2SO4 и концентрировали с получением соединения 1-38 (8 мг, 17%) в виде коричневого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,15 (s, 3H), 2,32 (s, 6H), 3,21 (d, J=5,76 Гц, 2H), 6,27 (d, J=15,36 Гц, 1H), 6,84-6,93 (m, 2H), 7,14 (t, J=7,52 Гц, 2H), 7,27-7,33 (m, 2H), 7,44 (dd, J=2,04 Гц и 5,08 Гц, 1H), 7,53 (d, J=7,72 Гц, 2H), 7,80 (s, 1H), 8,00 (s, 1H); ЖХ/МС: m/e 402,8 (M+1).
ПРИМЕР 16
[00456] Получение N-(4-(5-метил-2-(фениламино)пиримидин-4-иламино)фенил)акрил-амида I-39
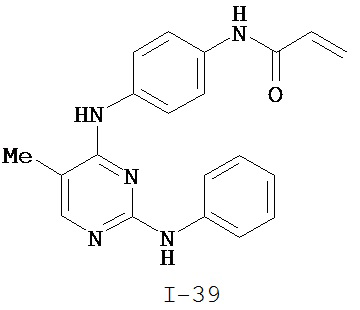
[00457] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
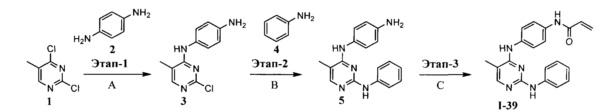
A) DIPEA, н-BuOH, 110°C, 45 минут, СВЧ; B) конц. HCl, н-BuOH, 150°C, 10 минут, СВЧ; C) акрилоил хлорид, NMP, 0°C - 30 минут, комн. темп. - 2 часа.
[00458] Этап 1
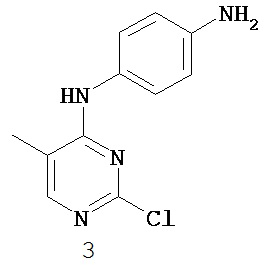
[00459] Раствор соединения 1 (0,4 г, 2,4 ммоль), соединения 2 (0,3 г, 2,6 ммоль), DIPEA (0,46 г, 3,6 ммоль) в н-BuOH (10 мл) облучали в микроволновой печи (110°C, 45 минут) Реакционную смесь охлаждали, разбавляли водой (20 мл) и экстрагировали EtOAc (3×15 мл). Объединенный EtOAc экстракт промывали водой (20 мл), солевым раствором (2(мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 99/1) с получением соединения 3 (350 мг, 62%) в виде беловатого твердого продукта.
[00460] Этап 2
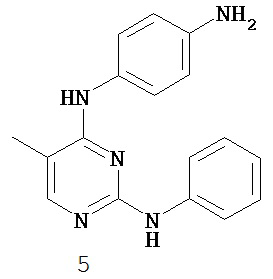
[00461] Раствор соединения 3 (0,2 г, 0,8 ммоль), соединения 4 (0,63 г, 6,8 ммоль), и конц. HCl (0,03 г, 0,8 ммоль) в н-BuOH (10 мл) облучали в микроволновой печи (150°C, 10 минут). Реакционную смесь охлаждали, разбавляли водой (10 мл), подщелачивали 10% раствором натрия бикарбоната и экстрагировали EtOAc (3×15 мл). Объединенный EtOAc экстракт промывали водой (15 мл), солевым раствором (15 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 97/3) с получением соединения 5 (110 мг, 47%) в виде коричневого смолистого твердого вещества.
[00462] Этап 3
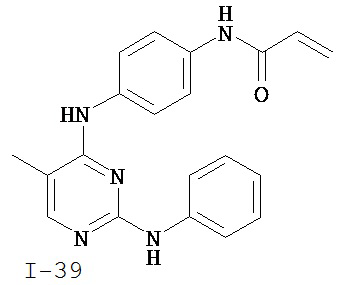
[00463] К раствору соединения 5 (0,06 г, 0,2 ммоль) в NMP (2 мл) при перемешивании добавляли акрилоилхлорид (0,03 г, 0,3 ммоль) при температуре 0°C. Перемешивали при этой температуре в течение 20 минут, а затем при комнатной температуре в течение 2 часов. Реакционную смесь гасили водой, подщелачивали 10% раствором натрия бикарбоната и экстрагировали EtOAc (3×10 мл). Объединенный EtOAc слой промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш) и финальную очистку проводили методом препаративной ВЭЖХ с получением соединения 1-39 (10 мг, 16%) в виде беловатого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,10 (s, 3H), 5,71-5,76 (m, 1H), 6,25 (dd, J 2,04 и 16,96 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 6,84 (t, J=7,30 Гц, 1H), 7,14-7,18 (m, 2H), 7,62-7,68 (m, 6H), 7,86 (s, 1H), 8,26 (s, 1H), 8,94 (s, 1H), 10,11 (s, 1H), ЖХ/МС: m/e 346 (M+1).
ПРИМЕР 17
[00464] Получение N-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)фенил)пропионамида IR-7
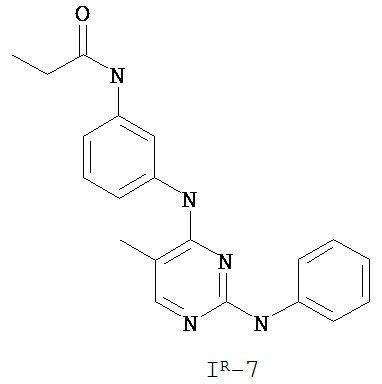
[00465] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
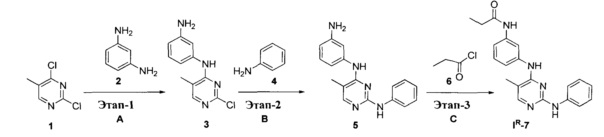
A) DIPEA, н-BuOH, 120°C, 30 минут, СВЧ; B) NMP, 200°C, 10 минут, СВЧ; C) 6, NMP, 0°C, 60 минут.
[00466] Этап 1
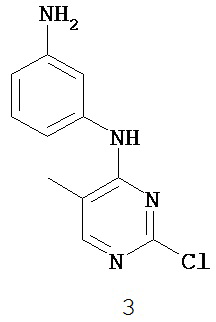
[00467] Раствор соединения 1 (2,0 г, 12 ммоль), соединения 2 (2,0 г, 18 ммоль), DIPEA (2,33 г, 18 ммоль) в н-BuOH (20,0 мл) облучали в микроволновой печи при 120°C в течение 30 мин. Реакционную смесь затем гасили водой (100 мл) и экстрагировали EtOAc (3×20 мл). Объединенный EtOAc экстракт промывали водой (100 мл), солевым растворол (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш EtOAc/CHCl3: 15/85) с получением соединения 3 (1,3 г, 45%) в виде темно-коричневогс твердого продукта.
[00468] Этап 2
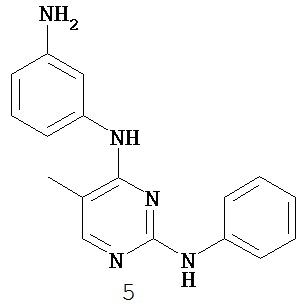
[00469] Раствор соединения 3 (1,0 г, 4,27 ммоль), соединения 4 (1,5 г, 16,12 ммоль) в NMP (10 мл) облучали в микроволновой печи (200°C, 10 минут). Реакционную смесь затем охлаждали, разбавляли водой (100 мл) и экстрагировали EtOAc (3×100 мл). Объединенный EtOAc экстракт промывали водой (100 мл), солевым раствором (100 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, CHCl3/MeOH: 98/2) с получением соединения 5 (0,5 г, 40,3%) в виде светло-коричневого твердого продукта.
[00470] Этап 3
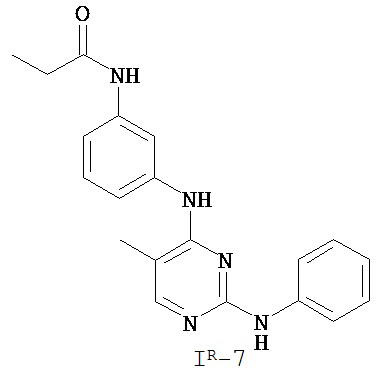
[00471] К раствору соединения 5 (75 мг, 0,25 ммоль) в NMP (1,0 мл) при перемешивании при температуре 0°C добавляли пропаноилхлорид (6) (72 мг, 0,75 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 60 минут. Затем реакционную смесь гасили водой (5 мл), подщелачивали Et3N и экстрагировали EtOAc (3×10 мл). Объединенный EtOAc экстракт промывали водой (10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 230-400 меш, метанол/хлороформ: 2/98) с получением соединения IR-7 (0,025 г, 28,73%) в виде беловатого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,08 (t, J=7,6 Гц, 3H), 2,11 (s, 3H),2,31 (q, J=7,6 Гц, 2H), 6,81 (t,J=7,2 Гц, 1H), 7,11 (t, J=8 Гц, 2H), 7,21-7,25 (m, 1H), 7,31 (d, J=8,40 Гц, 1H), 7,36 (d, J=8,00 Гц, 1H), 7,66 (d, J=8,40 Гц, 2H), 7,86 (s, 1H), 7,89 (s, 1H), 8,35 (s, 1H), 8,93 (s, 1H), 9,81 (s, 1H); ЖХ/МС: m/e 348,3 (M+1).
ПРИМЕР 18
[00472] Получение N-(4-метил-3-(4-(пиридин-3-ил)пиримидин-2-иламино)фенил)акриламида I-56
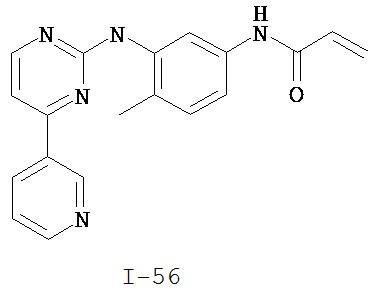
[00473] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
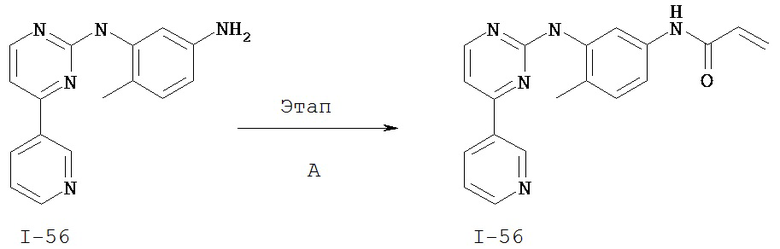
А) акрилоилхлорид, Et3N, ДМФА, комн. темп., 12 часов.
[00474] Этап 1

[00475] К раствору соединения 1 (0,15 г, 0,54 ммоль) и Et3N (0,11 г, 1,08 ммоль) в диметилформамиде ДМФА (1 мл) при перемешивании при температуре 0°C добавляли акрилоилхлорид (0,09 г, 1,08 ммоль) по каплям в атмосфере N2. Реакционную смесь оставляли до достижения комнатной температуры и перемешивали 12 часов. Затем ее гасили ледяной водой (2 мл) и экстрагировали EtOAc (2×15 мл). Объединенный EtOAc экстракт промывали солевым раствором (2 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с выпадением сырого остатка. Остаток далее очищали методом препаративной ВЭЖХ с выходом соединения 1-56 (0,060 г, 33%) в виде бледно-желтого твердого продукта. 1H-ЯМР (ДМСО-d3) δ ppm: 2,19 (s, 3H), 5,72 (dd, J=2 и 10,08 Гц, 1H), 6,22 (dd, J=2 и 16,92 Гц, 1H), 6,45 (dd, J=10 и 17 Гц, 1H), 7,16 (d, J=8,36 Гц, 1H), 7,32 (dd, J=1,92 и 8,16 Гц, 1H), 7,42 (d, J=5,12 Гц, 1H), 7,50-7,53 (m, 1H), 7,95 (d, J=1,68 Гц, 1H), 8,45 (dd, J=6,16 и 8,16 Гц, 1H), 8,49 (d, J=5,16 Гц, 1H), 8,68 (dd, J=1,56 и 4,76 Гц, 1H), 8,95 (s, 1H), 9,25 (d, J=1,56 Гц, 1H), 10,08 (s, 1H); ЖХ/МС: m/e 332,4 (M+1).
ПРИМЕР 19
[00476] Общая схема получения соединений, содержащих высокореакционноспособную группу с еноновым фрагментом, например, 3-метил-1-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)фенил)бут-2-ен-1-она I-47
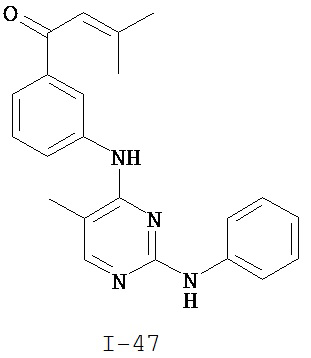
[00477] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже. Специалистам в данной области техники очевидно, что соединение I-47 является примером соединения, содержащего высокореакционноспособные группы с еноновым фрагментом, и что другие соединения, содержащие высокореакционноспособные группы с еноновым фрагментом, могут быть синтезированы по существу тем же способом с использованием схем, этапов и промежуточных соединений, описанных ниже.
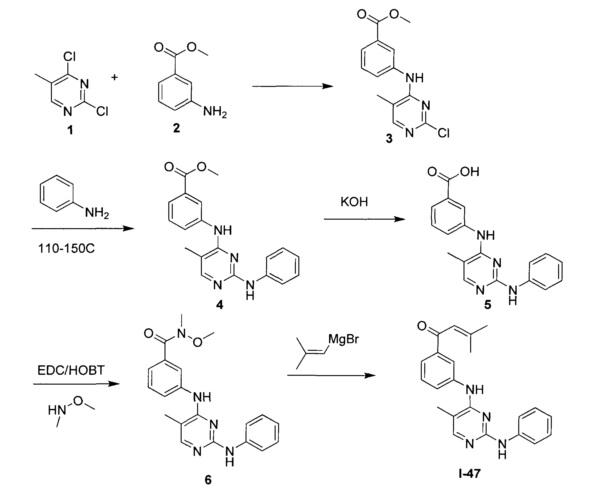
[00478] Проводят реакцию между соединениями 1 и 2 в присутствии триэтиламина с получением соединения 3. Соединение 3 обрабатывают анилином при повышенной температуре с получением соединения 4. Омыление соединения 4 гидроксидом калия дает кислое соединение 5, которое взаимодействует с N-O-диметилгидроксиламином в присутствии EDC с получением соединения 6. Обработка соединения 6 при низкой температуре дает соединение 1-47, приведенного в качестве примера.
ПРИМЕР 20
[00479] Получение N-(3-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)пиримидин-4-ил-амино)фенил)акриламида I-182
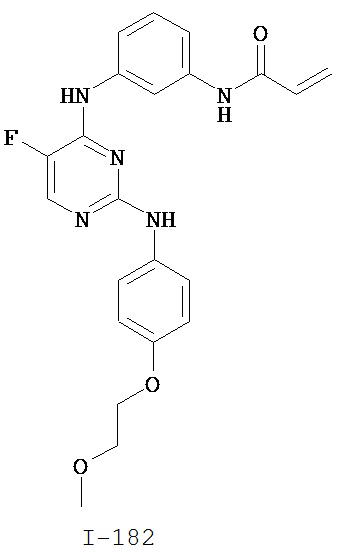
[00480] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
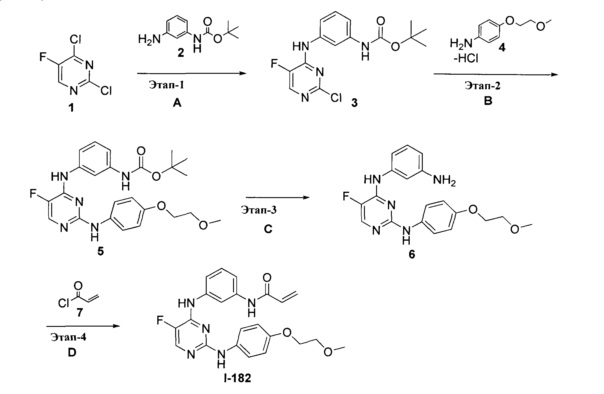
A) соединение 2, DIPEA, ТГФ, кипячение с обратным холодильником; В) соединение 4, трет-амплоъыи спирт, HOAc, кипячение с обратным холодильником; C) TFA, ДХМ; D) соединение 7, DIPEA, ТГФ, -10°C.
[00481] Этап 1
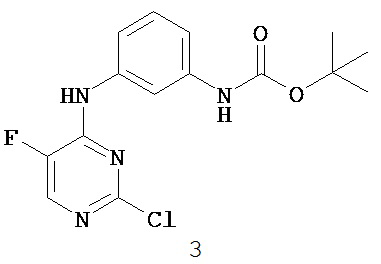
[00482] Соединение 1 (800 мг, 4,8 ммоль), соединение 2 (996 мг, 4,8 ммоль) и основание Хунига (948 мкл, 5,75 ммоль) растворяли в ТГФ (20 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения промывали водой/солевым раствором (10 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе. После фильтрации промывали EtOAc и гептаном с получением белого твердого продукта, 1 г. ЖХ/МС (RT=2,03/(M+1)) 339,1.
[00483] Этап 2
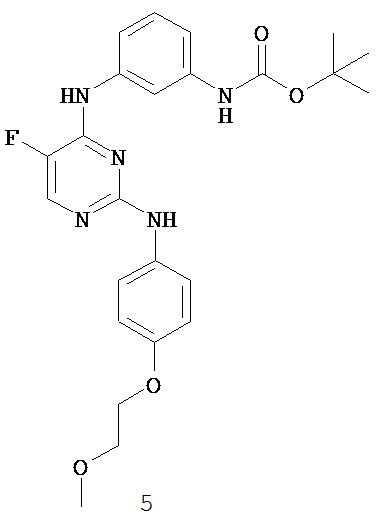
[00484] Соединение 3 (800 мг, 2,37 ммоль) и соединение 4 (576 мг, 2,84 ммоль) суспендировали в трет-амиловом спирте (14 мл) и уксусной кислоте (5 капли). Кипятили с обратным холодильником в течение 4 часов. Охлаждали, удаляли растворители на роторном испарителе. Темное масло промывали водой/солевым раствором и ТГФ (по 10 мл каждого), встряхивали и разделяли слои, после чего органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением фиолетового твердого продукта, 0,55 г. ЖХ/МС (RT=2,997/(M+1)) 470,2. Дополнительные 150 мг продукта без защитной группы (Boc) кристаллизовали из водного слоя.
[00485] Этап 3
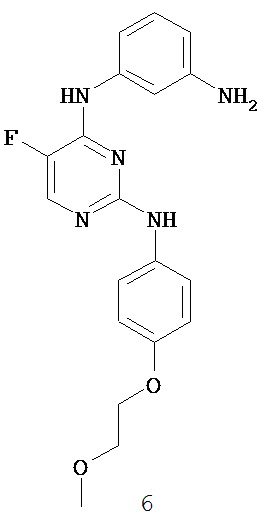
[00486] К раствору соединения 6 (550 мг, 1,17 ммоль) в ДХМ (20 мл) добавляли TFA (2 мл). Перемешивали при комнатной температуре в течение 4 часов, удаляли растворитель на роторном испарителе и промывали масло холодным (0°C) насыщенным раствором натрия бикарбоната (10 мл) и EtOAc (10 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе с получением темного масла. Очищали методом флэш-хроматографии в градиенте 20%-100% гептан/EtOAc при помощи системы комбифлэш с получением 309 мг светло-розового твердого продукта. ЖХ/МС (RT=2,78/(M+1)) 370,2.
[00487] Этап 4

[00488] Раствор соединения 6 (309 мг, 0,84 ммоль) в ТГФ (10 мл) охлаждали в бане вода/лед-МеОН (-10°C). К раствору добавляли соединения 7 (71 мкл, 0,88 ммоль), перемешивали в течение 10 минут, затем добавляли основание Хунига (145 мкл, 0,88 ммоль), и перемешивали в течение 10 минут.Промывали водой/солевым раствором (10 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия. Удаляли растворители на роторном испарителе и после фильтрования промывали осадок диэтиловым эфиром с получением 285 мг (80%) в виде беловатого твердого продукта. ЖХ/МС (RT=2,79/(M+H)) 424,2.
ПРИМЕР 21
[00489] Получение N-(3-(2-(3-хлор-4-(пиридин-2-илметокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-86
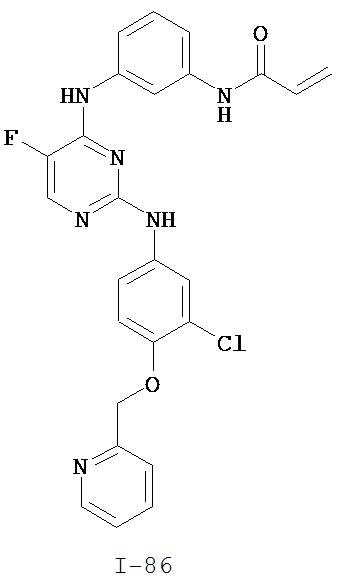
[00490] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-хлор-4-(пиридин-2-илметокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,87/(M+H)) 491,1.
ПРИМЕР 22
[00491] Получение N-(3-(5-фтор-2-(4-(2-(2-оксипирролидин-1-ил)этокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-92
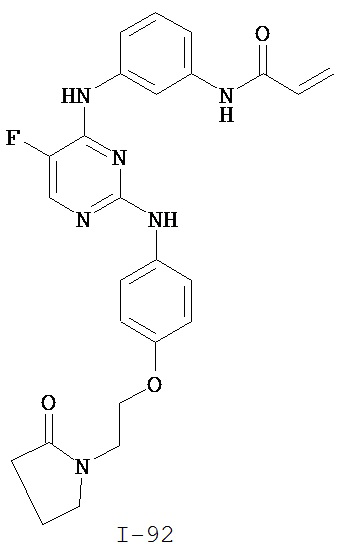
[00492] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 1-(2-(4-аминофенокси)этил)пирролидин-2-она вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,718/(M+H)) 477,1.
ПРИМЕР 23
[00493] Получение N-(3-(5-фтор-2-(4-(1-гидрокси-2-метилпропан-2-илокси)фенил-амино)пиримидин-4-иламино)фенил)акриламида I-93
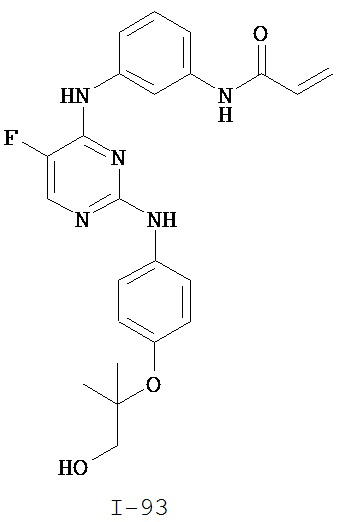
[00494] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 2-(4-аминофенокси)-2-метилпропан-1-ола вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,724/(M+H))438,1.
ПРИМЕР 24
[00495] Получение N-(3-(5-фтор-2-(6-изопропоксипиридин-3-иламино)пиримидин-4-ил-амино)фенил)акриламида I-172
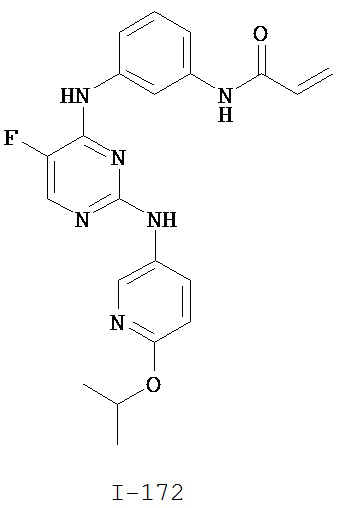
[00496] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-изопропоксипиридин-3 -амина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,878/(M+H)) 409,2.
ПРИМЕР 25
[00497] Получение N-(3-(5-фтор-2-(2-оксоиндолин-5-иламино)пиримидин-4-иламино)-фенил)акриламида I-181
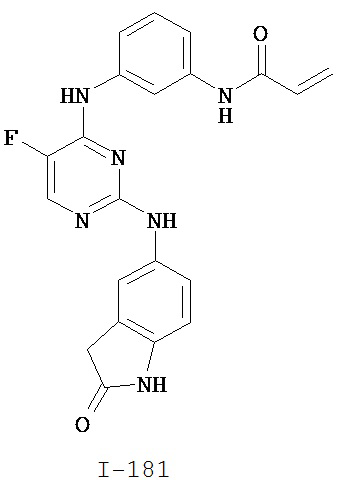
[00498] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 5-аминоиндолин-2-она вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,617/(M+H)) 405,1.
ПРИМЕР 26
[00499] Получение N-(2-хлор-5-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-108
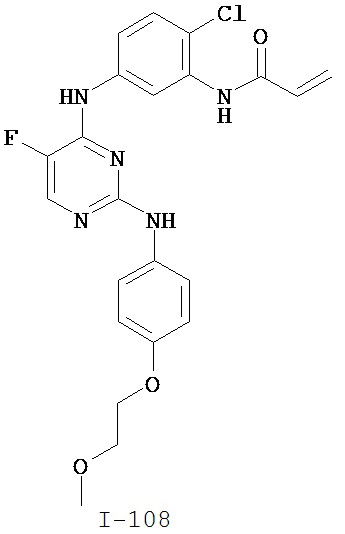
[00500] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием трет-бутил-5-амино-2-хлорфенилкарбамата вместо соединения 4 на Этапе 1. ЖХ/МС (RT=2,852/(M+H))458,1.
ПРИМЕР 27
[00501] Получение N-(2-хлор-5-(5-фтор-2-(6-изопропоксипиридин-3-иламино)-пиримидин-4-иламино)фенил)акриламида I-107
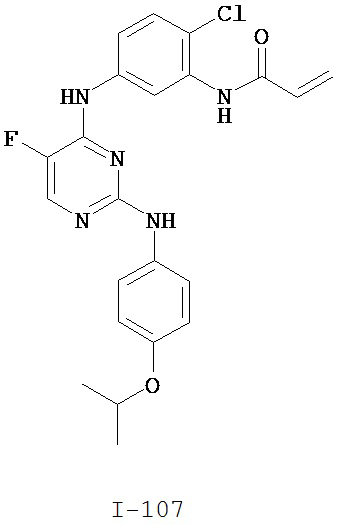
[00502] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием трет-бутил-5-амино-2-фторфенилкарбамата вместо соединения 2 на Этапе 1 и 6-изопропоксипиридин-3-амина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,938/(M+H)) 443,1.
ПРИМЕР 28
[00503] Получение N-(2-фтор-5-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-87
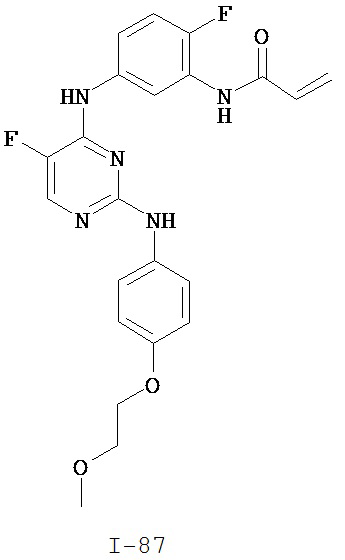
[00504] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием трет-бутил-5-амино-2-фторфенилкарбамата вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,797/(M+H)) 442,0.
ПРИМЕР 29
[00505] Получение N-(3-(5-фтор-2-(4-((1-метилпиперидин-4-ил)метокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-90
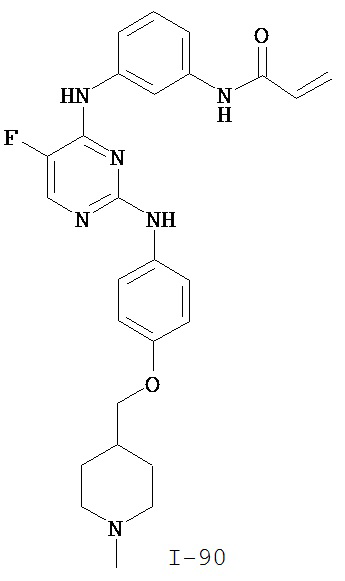
[00506] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
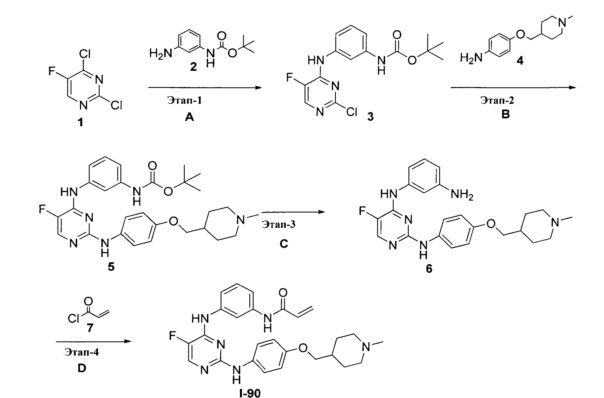
A) соединение 2, DIPEA, ТГФ, кипячение с обратным холодильником; В) соединение 4, Pd(OAc)2, X-Phos, CsCO3, диоксан, кипячение с обратным холодильником, 12 часов; C) TFA, ДХМ; D) соединение 7, DIPEA, ТГФ, -10°C.
[00507] Этап 1
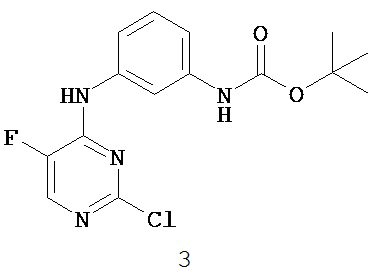
[00508] Соединение 1 (800 мг, 4,8 ммоль), соединение 2 (996 мг, 4,8 ммоль) и основание Хунига (948 мкл, 5,75 ммоль) растворяли в ТГФ (20 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения, промывали водой/солевым раствором (10 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе. Промывали EtOAc и гептаном с получением после фильтрации белого твердого продукта, 1 г. ЖХ/МС (RT=2,03/(M+1)) 339,1.
[00509] Этап 2
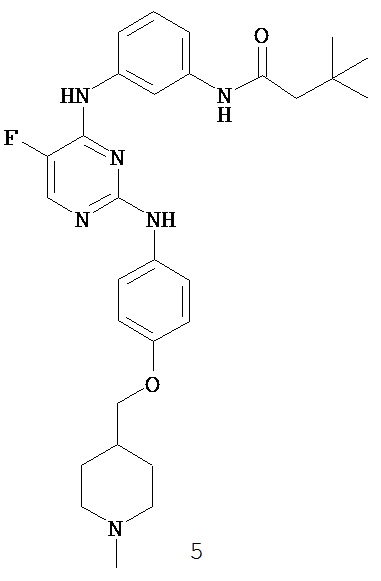
[00510] Соединение 3 (205 мг, 0,61 ммоль) и соединение 4 (150 мг, 0,73 ммоль) растворяли в диоксане (4 мл). Дегазировали раствор в течение 1 минуты. Добавляли палладия ацетат (20 мг, 5 мольн. %), лиганд 2-дициклогексилфосфино-2’,4’,6’-триизопропилбифенил (X-Phos) (35 мг, 10 мольн. %) и CsCO3 (325 мг, 1,2 ммоль) в указанном порядке. Дегазировали суспензию в течение 1 минуты и кипятили с обратным холодильником в атмосфере аргона в течение 12 часов. После охлаждения удаляли растворитель на роторном испарителе. Темное масло проывали водой/солевым раствором и EtOAc (по 5 мл каждого), встряхивали, отфильтровывали осадок и разделяли слои фильтрата. Органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением темного масла. Очищали методом флэш-хроматографии с использованием градиента 0-30% гептан/EtOAc с получением светло-желтого масла. ЖХ/МС (RT=3,043/(M+1)) 523,2.
[00511] Этап 3
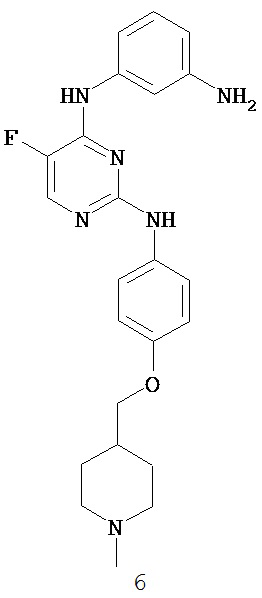
[00512] К раствору соединения 5 (144 мг, 0,27 ммоль) в ДХМ (10 мл) добавляли TFA (1 мл). Перемешивали при комнатной температуре в течение 12 часов, удаляли растворитель на роторном испаритле и промывали масло холодным (0°C) насыщенным раствором натрия бикарбоната (5 мл) и EtOAc (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испаритле с получением светло-желтой пены. ЖХ/МС (RT=2,723/(М+1)) 423,1.
[00513] Этап 4
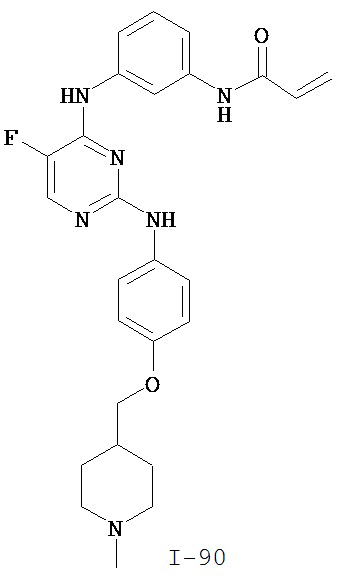
[00514] Раствор соединения 6 (105 мг, 0,25 ммоль) в ТГФ (3 мл) охлаждали в бане вода/лед-MeOH (-10°C). К раствору добавляли соединение 7 (21 мкл, 0,26 ммоль), перемешивали в течение 10 минут, затем добавляли основание Хунига (51 мкл, 0,26 ммоль) и перемешивали в течение 10 минут. Промывали водой/солевым раствором (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением светло-желтой пены. ЖХ/МС (RT=2,726/(М+Н)) 477,1.
ПРИМЕР 30
[00515] Получение N-(3-(5-фтор-2-(6-((2-метоксиэтил)(метил)амино)пиридин-3-ил-амино)пиримидин-4-иламино)фенил)акриламида I-77
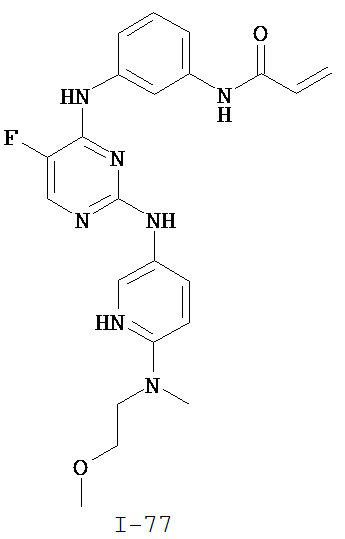
[00516] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 29, с использованием N2-(2-метоксиэтил)-N2-метилпиридин-2,5-диамин вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,739/(M+H)) 438,1.
ПРИМЕР 31
[00517] Получение 1-(6-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)-2H-бензо[b][1,4]оксазин-4(3H)-ил)проп-2-ен-1-она I-194
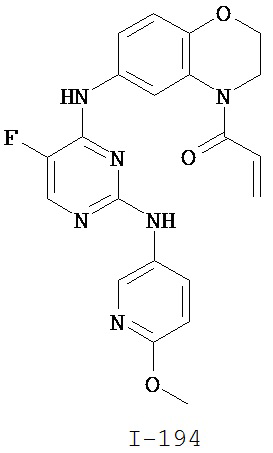
[00518] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.

A) соединение 2, DIPEA, ТГФ, кипячение с обратным холодильником; В) соединение 4, HOAc, трет-амиловъш спирт, кипячение с обратным холодильником, 12 часов; C) TFA, ДХМ; D) соединение 7, DIPEA, ДХМ, NMP, -10°C.
[00519] Этап 1
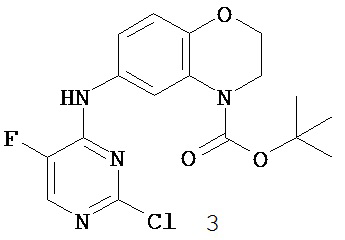
[00520] Соединение 1 (186 мг, 1,1 ммоль), соединение 2 (280 мг, 1,1 ммоль) и основание Хунига (220 мкл, 1,3 ммоль) растворяли в ТГФ (6 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения промывали водой/солевым раствором (6 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе с получением желто-коричневого твердого продукта. ЖХ/МС (RT=3,008/(M+1)) 381,1.
[00521] Этап 2
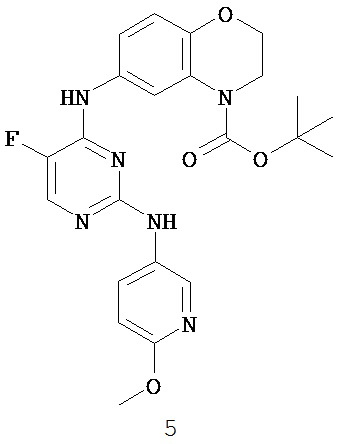
[00522] Соединение 3 (215 мг, 0,56 ммоль) и соединение 4 (83 мг, 0,66 ммоль) суспендировали в трет-амиловом спирте (6 мл) и уксусной кислоте (3 капли). Кипятили с обратным холодильником в течение 12 часов. Охлаждали и удаляли растворитель на роторном испарителе. Темное масло промывали водой, солевым раствором и EtOAc (по 5 мл каждого), встряхивали и разделяли слои, после чего органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением масла. Очищали методом флэш-хроматографии с использованием градиента 30-70% гептан/этилацетат при помощи системы комбифлэш с получением желто-коричневого твердого продукта. ЖХ/МС (RT=2,011/(M+1)) 469,2.
[00523] Этап 3
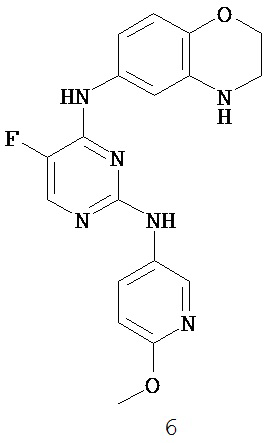
[00524] К раствору соединения 5 (200 мг, 0,43 ммоль) в ДХМ (10 мл) добавляли TFA (1 мл). Перемешивали при комнатной температуре в течение 12 часов, удаляли растворитель на роторном испарителе и промывали масло холодным (0°C) насыщенным раствором натрия бикарбоната (5 мл) и EtOAc (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе с получением розового твердого продукта. ЖХ/МС (RT=2,782/(M+1)) 369,1.
[00525] Этап 4
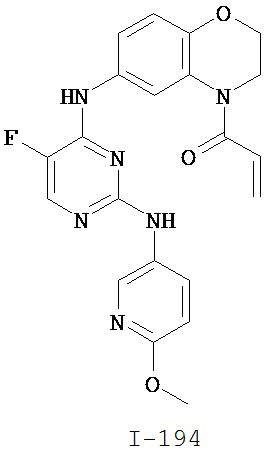
[00526] Раствор соединения 6 (150 мг, 0,41 ммоль) в ДХМ (2 мл) и NMP (0,5 мл) охлаждали в бане вода/лед-MeOH (-10°C). К раствору добавляли соединение 7 (34 мкл, 0,43 ммоль), перемешивали в течение 10 минут, затем добавляли основание Хунига (70 мкл, 0,43 ммоль) и перемешивали в течение 10 минут. Промывали водой/солевым раствором (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия. После чего сразу очищали методом флэш-хроматографии с использованием градиента 20-80% гептан/этилацетат с получением розового твердого продукта. ЖХ/МС (RT=2,8/(M+H)) 423,1.
ПРИМЕР 32
[00527] Получение 1-(6-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)пиримидин-4-иламино)-2H-бензо[b][1,4]оксазин-4(3H)-ил)проп-2-ен-1-она I-141
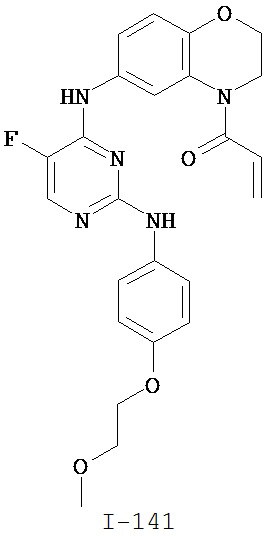
[00528] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 31, с использованием 4-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,845/(M+H)) 466,2.
ПРИМЕР 33
[00529] Получение 1-(6-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-иламино)индолин-1-ил)проп-2-ен-1-она I-166
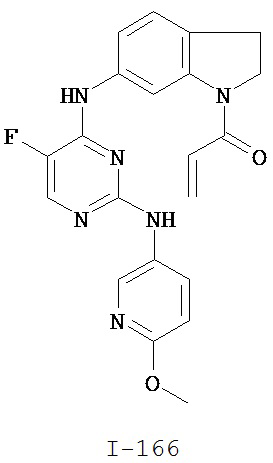
[00530] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 31, с использованием трет-бутил-6-аминоиндолин-1-карбоксилата вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,825/(M+H)) 407,1.
ПРИМЕР 34
[00531] Получение 1-(5-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-иламино)изоиндолин-2-ил)проп-2-ен-1-она I-165
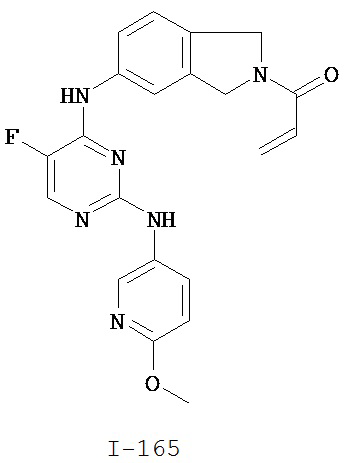
[00532] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 31, с использованием трет-бутил-5-аминоизоиндолин-1-карбоксилата вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,751/(M+H)) 407,1.
ПРИМЕР 35
[00533] Получение 1-(6-(4-(3-хлорфениламино)-5-фторпиримидин-2-иламино)-2H-бензо[b][1,4]оксазин-4(3H)-ил)проп-2-ен-1-она I-149

[00534] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
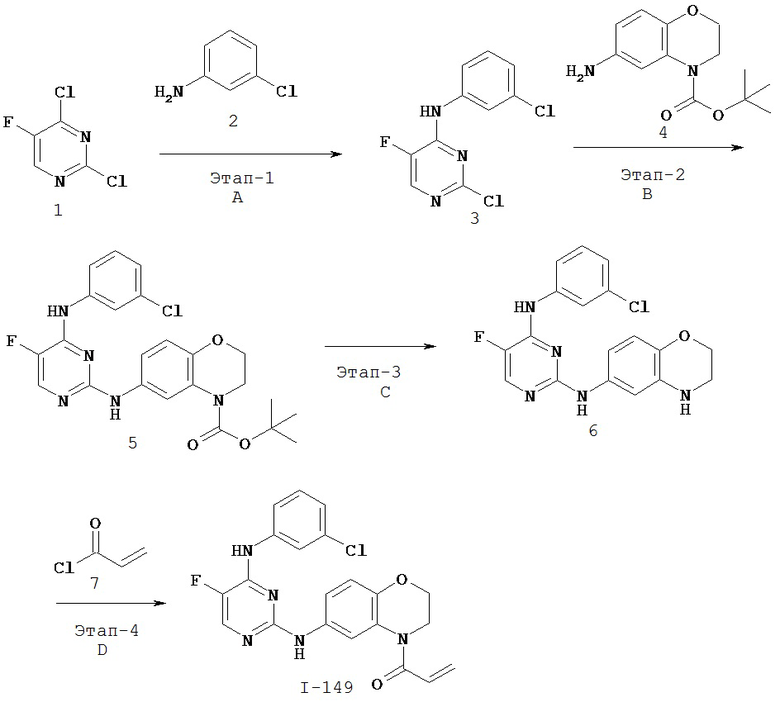
A) соединение 2, DIPEA, ТГФ, кипячение с обратным холодильником; В) соединение 4, НОАс, трет-амиловый спирт, кипячение с обратным холодильником, 12 часов; C) TFA, ДХМ; D) соединение 7, DIPEA, ТГФ, -10°C.
[00535] Этап 1
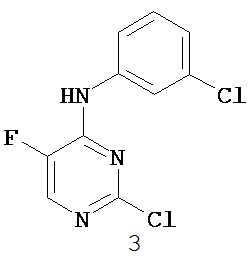
[00536] Соединение 1 (484 мг, 2,9 ммоль), соединение 2 (305 мг, 2,9 ммоль) и основание Хунига (526 мкл, 3,5 ммоль) растворяли в ТГФ (10 мл). Реакционную смесь кипятили с обратным холодильником в течение ночи. После охлаждения, промывали водой/солевым раствором (10 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе. Очищали методом флэш-хроматографии с использованием градиента 0-30% гептан/этилацетат при помощи системы комбифлэш с получением белого твердого продукта. ЖХ/МС (RT=2,03/(M+1)) 339,1.
[00537] Этап 2
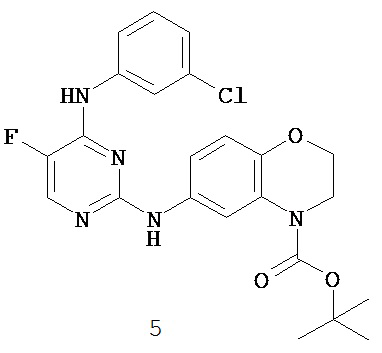
[00538] Соединение 3 (150 мг, 0,58 ммоль) и соединение 4 (175 мг, 0,7 ммоль) суспендировали в трет-амиловом спирте (8 мл) и уксусной кислоте (3 капли). Кипятили с обратным холодильником в течение 12 часов. Охлаждали, удаляли растворители на роторном испарителе. Темное масло промывали водой/солевым раствором и EtOAc (по 5 мл каждого), встряхивали и разделяли слои, после чего органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением темного масла. Очищали методом флэш-хроматографии с использованием градиента 0-25% гептан/этилацетат при помощи системы комбифлэш с получением белого твердого продукта. ЖХ/МС (RT=2,997/(M+1)) 470,2.
[00539] Этап 3
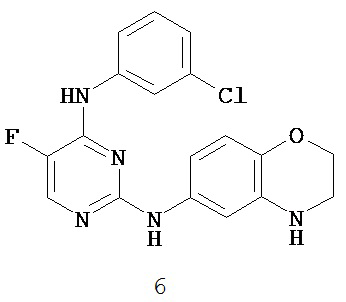
[00540] К раствору соединения 5 (180 мг, 0,38 ммоль) в ДХМ (10 мл) добавляли TFA (1 мл). Перемешивали при комнатной температуре в течение 4 часов, удаляли растворитель на роторном испарителе и промывали масло холодным (0°C) насыщенным раствором натрия бикарбоната (5 мл) и EtOAc (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия и удаляли растворитель на роторном испарителе с получением светло-желтого твердого продукта. ЖХ/МС (RT=2,723/(M+1)) 423,1.
[00541] Этап 4
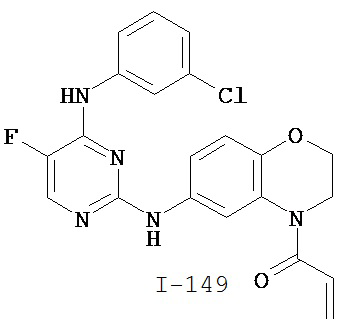
[00542] Раствор соединения 6 (150 мг, 0,4 ммоль) в ТГФ (3 мл) охлаждали в бане вода/лед-MeOH (-10°C). К раствору добавляли соединение 7 (34 мкл, 0,42 ммоль), перемешивали в течение 10 минут, затем добавляли основание Хунига (70 мкл, 0,42 ммоль) и перемешивали в течение 10 минут. Промывали водой/солевым раствором (5 мл), встряхивали и разделяли слои. Органическую фазу сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением светло-желтого твердого продукта. Очищали методом флэш-хроматографии с использованием градиента 10-50% гептан/этилацетат при помощи системы комбифлэш с получением белого твердого продукта. ЖХ/МС (RT=2,945/(M+H)) 426.
ПРИМЕР 36
[00543] Получение 5-(2-(4-акрилоил-3,4-дигидро-2H-бензо[b][1,4]оксазин-6-иламино)-5-фторпиримидин-4-иламино)индолин-2-она I-130
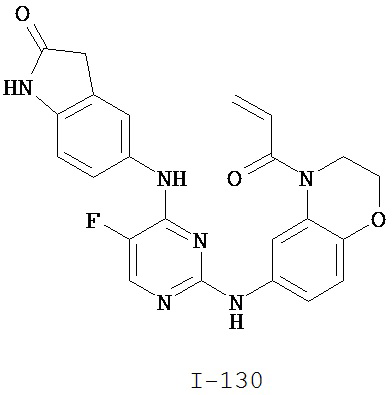
[00544] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 35, с использованием 5-аминоиндолин-2-она вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,673/(M+H)) 447,1.
ПРИМЕР 37
[00545] Получение 4-(3-акриламидофениламино)-2-(фениламино)пиримидин-5-карбоксамида I-230
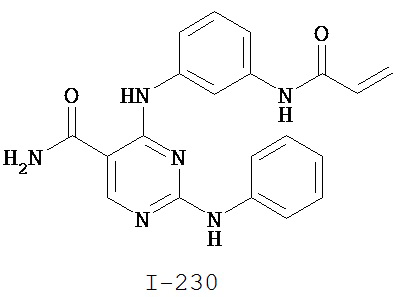
[00546] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
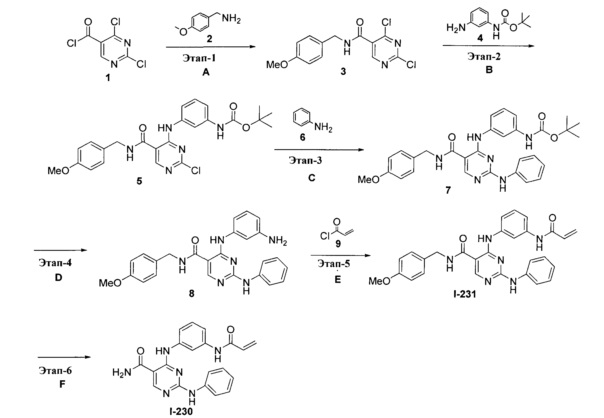
A) соединение 2, Et3N, ДХМ, 0°C до комн. темп.; B) соединение 4, DIPEA, ТГФ, комн. темп., 12 часов; C) соединение 6, DIPEA, трет-амиловыи спирт, кипячение с обратным холодильником, 4 часа; D) TFA, ДХМ, комн. темп.; Е) соединение 7, Et3N, ТГФ, 0°C; F) TFA, TfOH, ДХМ, комн. темп.
[00547] Этап 1
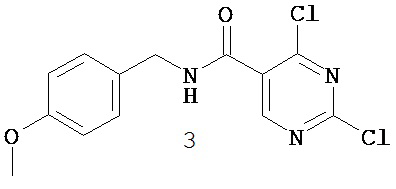
[00548] Соединение 1 (500 мг, 2,4 ммоль, полученный из 2,4-дигидроксипиримидин-5-карбоновой кислоты согласно J. Med. Chem. 50: 591 (2007) и US 2007/0072851) растворяли в ДХМ (10 мл) и охлаждали в бане вода/лед (0°C). Добавляли соединение 2 (309 мкл, 2,4 ммоль) и перемешивали смесь в течение 10 минут. Добавляли триэтиламин (365 мкл, 2,6 ммоль), после чего смесь оставляли до достижения комнатной температуры и перемешивали при этой температуре в течение 30 минут. На роторном испарителе отгоняли растворитель и сразу очищали методом флэш-хроматографии с использованием градиента 0-30% гептан/этилацетат при помощи системы комбифлэш с получением белого твердого продукта. ЖХ/МС (RT=2,789/(M+1)) 312.
[00549] Этап 2
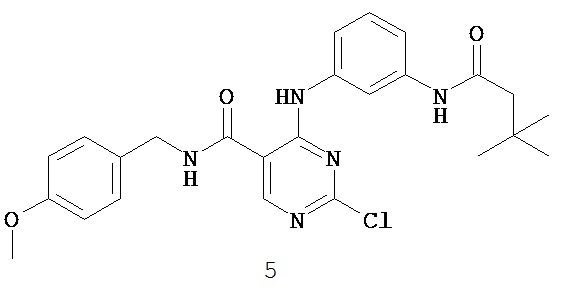
[00550] Соединение 3 (170 мг, 0,55 ммоль), соединение 4 (113 мг, 0,55 ммоль) и основание Хунига (108 мкл, 0,65 ммоль) растворяли в ТГФ (6 мл). Перемешивали при комнатной температуре в течение 12 часов. Промывали водой/солевым раствором, встряхивали и разделяли слои, после чего органическую фазу сушили над сульфатом натрия. Удаляли растворитель на роторном испарителе с получением после промывки EtOAc белого твердого продукта. ЖХ/МС (RT=3,123/(M+1)) 484.
[00551] Этап 3
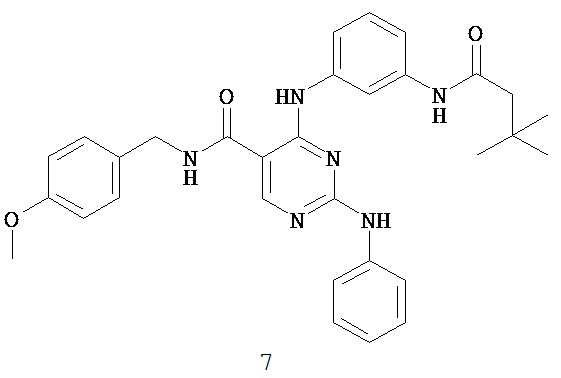
[00552] Соединение 5 (230 мг, 0,48 ммоль), соединение 6 (126 мкл, 1,4 ммоль) и основание Хунига (94 мкл, 0,57 ммоль) растворяли в трет-амиловом спирте (6 мл). Кипятили с обратным холодильником в течение 4 часов, охлаждали и добавляли к твердому остатку воду. Встряхивали, отфильтровывали и сушили с получением белого твердого продукта. ЖХ/МС (RT=3,182/(M+1)) 541,2.
[00553] Этап 4
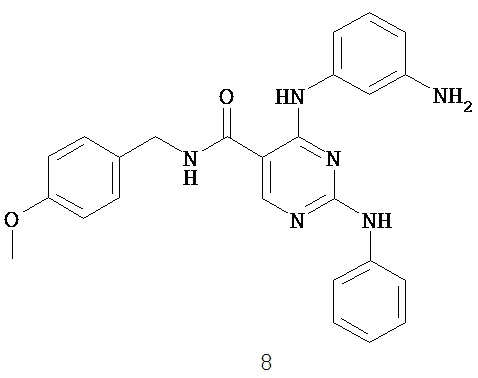
[00554] Соединение 7 (180 мг, 0,33 ммоль) суспендировали в ДХМ (10 мл) и обрабатывали TFA (1 мл). Перемешивали в течение ночи при комнатной температуре. Разбавляли ДХМ (40 мл) и промывали NaOH (IN, 25 мл). Встряхивали, выпавший осадок отфильтровывали и сушили с получением белого твердого продукта. ЖХ/МС (RT=2,934/(M+1))441,1.
[00555] Этап 5
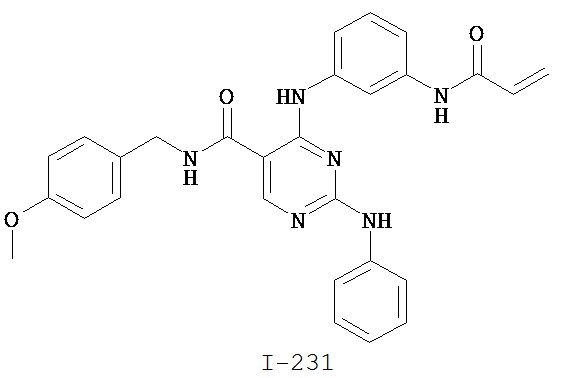
[00556] Суспензию соединения 8 (130 мг, 0,29 ммоль) в ТГФ (6 мл) охлаждали в бане вода/лед-MeOH (0°C). К суспензии добавляли соединение 9 (25 мкл (плюс дополнительные 5 мкл), 0,38 ммоль (всего)), затем добавляли триэтиламин (43 мкл (плюс дополнительные 11 мкл), 0,38 ммоль (всего)) и перемешивали, суммарное время помешивания составило 1 час. Добавляли воду, встряхивали, отфильтровывали и выбрасывали осадок. Фильтрат сушили над сульфатом натрия. Растворитель удаляли на роторном испарителе с получением желтого твердого продукта. Очищали методом флэш-хроматографии с использованием градиента 0-25% гептан/этилацетат при помощи системы комбифлэш с получением белого твердого продукта. ЖХ/МС (RT=2,964/(M+H)) 495,1.
[00557] Этап 6
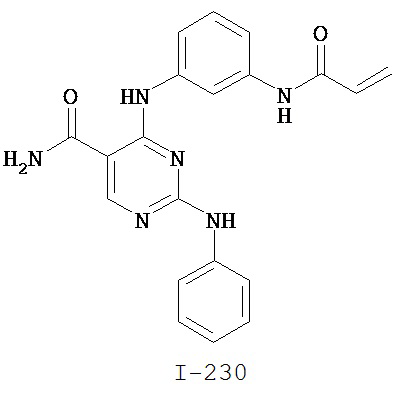
[00558] К суспензии соединения 1-231 (30 мг, 0,061 ммоль) в ДХМ (4 мл) добавляли TFA (200 мкл) и трифторметансульфокислоту (TfOH) (68 мкл, 0,61 ммоль). Перемешивали при комнатной температуре в течение 1 часа. Удаляли растворитель на роторном испарителе при пониженном давлении и промывали холодным (0°C) насыщенным раствором натрия бикарбоната (10 мл) и EtOAc (10 мл), встряхивали и разделяли слои. Сушили органический слой над сульфатом натрия и удаляли растворитель на роторном испарителе, промывали диэтиловым эфиром с получением белого твердого продукта. ЖХ/МС (RT=2,715/(M+H)) 375,1.
ПРИМЕР 38
[00559] Получение 4-(3-акриламидофениламино)-N-фенил-2-(фениламино)пиримидин-5-карбоксамида I-222
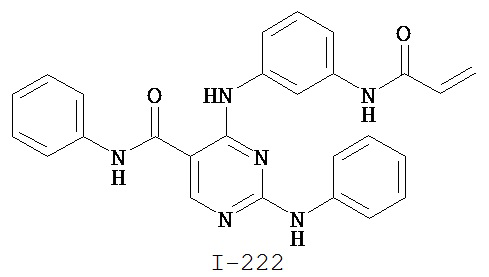
[00560] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 37, с использованием анилина вместо соединения 2 на Этапе 1, и пропуская этап 6. ЖХ/МС (RT=2,991/(M+H)) 451,2.
ПРИМЕР 39
[00561] Получение 4-(3-акриламидофениламино)-N-циклопропил-2-(фениламино)-пиримидин-5-карбоксамида I-221
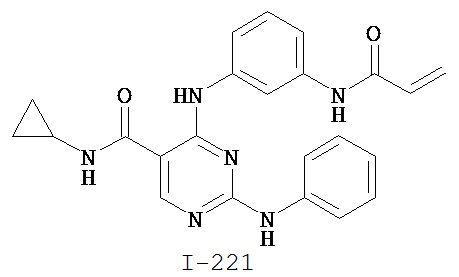
[00562] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 37, с использованием циклопропиламина вместо соединения 2 на Этапе 1, и пропуская этап 6. ЖХ/МС (RT=2,838/(M+H))415,2.
ПРИМЕР 40
[00563] Получение 4-(3-акриламидофениламино)-2-(3-метоксифениламино)пиримидин-5-карбоксамида I-210
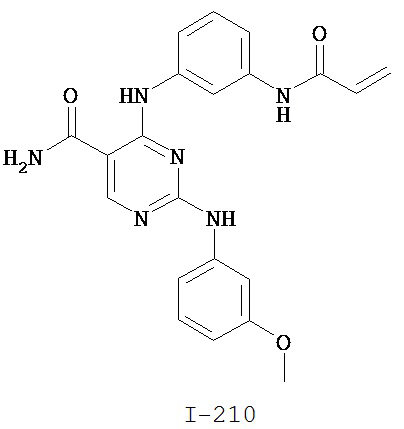
[00564] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 37, с использованием 3-метоксианилина вместо соединения 6 на Этапе 3. ЖХ/МС (RT=2,743/(M+H)) 405,1.
ПРИМЕР 41
[00565] Получение 4-(3-акриламидофениламино)-2-(6-метоксипиридин-3-иламино)-пиримидин-5-карбоксамида I-209
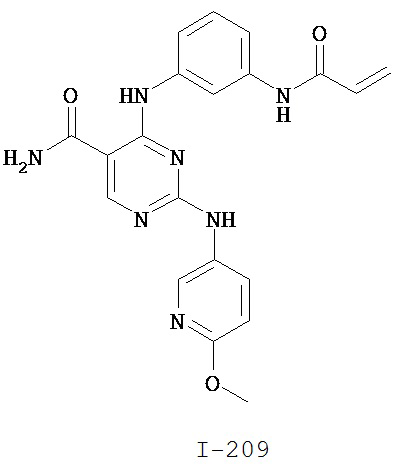
[00566] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 37, с использованием 6-метоксипиридин-3-амина вместо соединения 6 на Этапе 3. ЖХ/МС (RT=2,657/(M+H)) 406,2.
ПРИМЕР 42
[00567] Получение 1-{6-[5-ацетил-2-(6-метокси-пиридин-3-иламино)-пиримидин-4-иламино]-2,3-дигидро-бензо[1,4]оксазин-4-ил}-пропенона I-170
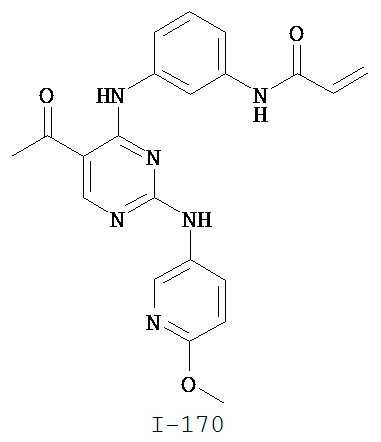
[00568] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
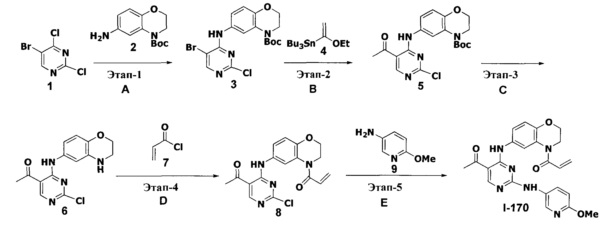
A) соединение 2, DIPEA, ТГФ, 70°C, 16 часов; B) (а) соединение 4, PdCl2(PPh3)2, ДМФ, 70°C; (б) IN HCl, ацетон, 60°C, 15 минут; C) HCl/диоксан, ДХМ; D) соединение 7, DIPEA, NMP, ДХМ, -20°C до комн. темп.; E) соединение 9, n-TsOH, диоксан, 100°C, 15 минут.
[00569] Этап 1
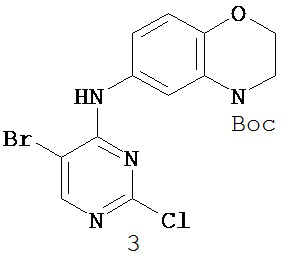
[00570] Смесь 499 мг соединения 1 (2,19 ммоль), 547 мг соединения 2 (2,19 ммоль) и 500 мкл DIPEA в 20 мл безводного ТГФ грели при температуре 70°C в течение ночи. После охлаждения реакционную смесь концентрировали и обрабатывали последовательно 50 мл EtOAc, раствором натрия бикарбоната 20 мл, солевым раствором и сушили над безводным сульфатом натрия. После фильтрования и концентрирования остаток пропускали через небольшой картридж с оксидом кремния, в качестве элюента брали гептан/EtOAc (3/1 об./об.), с получением 815 мг слегка желтоватого твердого продукта (84%). ЖХ/МС: m/z 441,0 (ES+), 439,0 (ES-).
[00571] Этап 2
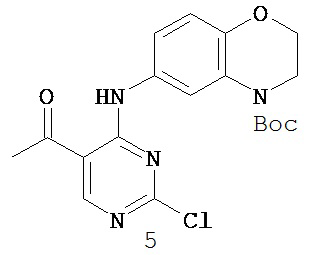
[00572] Раствор промежуточного соединения 3 (815 мг, 1,85 ммоль), соединения 4 (740 мг, 1,1 экв.), 27 мг дихлорбис(трифенилфосфин)палладия (II) (PdCl2(PPh3)2) (2 мольн. %) в 6 мл безводного ДМФ продували азотом в течение 30 минут. Реакционную смесь грели при температуре 70°C в течение ночи. Анализ методом ЖХ/МС показал 70% конверсию. После охлаждения добавляли 30 мл этилацетата и 760 мг калия фторида в 5 мл воды и перемешивали реакционную смесь при комнатной температуре по меньшей мере в течение 2 часов. Выпавший белый осадок отфильтровывали, отделяли органический слой, промывали его водой, солевым раствором и сушили над безводным сульфатом натрия.
[00573] Фильтровали и концентрировали, затем остаток растворяли в 20 мл ацетона, после чего добавляли 3 мл 1,0 N водного раствора HCl. Реакционную смесь грели при температуре 60°C в течение 15 минут и концентрировали при пониженном давлении. Обрабатывали 50 мл EtOAc, 10 мл насыщенного раствора натрия бикарбоната, солевым раствором, безводным сульфатом натрия. Концентрировали, очищали остаток методом колоночной флэш-хроматографии на силикагеле с получением 405 мг желтого твердого продукта (70% от исходного реагента), а также промежуточного соединения 3(183 мг). ЖХ/МС: m/z 405,1 (ES+), 403,1 (ES-).
[00574] Этап 3
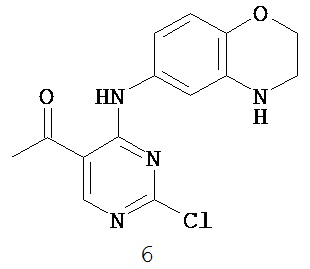
[00575] К смеси 1,28 г промежуточного соединения 1-2 в 10 мл ДХМ добавляли 10 мл 4,0 N HCl в диоксане. Перемешивали при комнатной температуре в течение ночи, удаляли растворитель и сушили остаток под вакуумом. ЖХ/МС: m/z 305,1 (ES+), 303,1 (ES-).
[00576] Этап 4
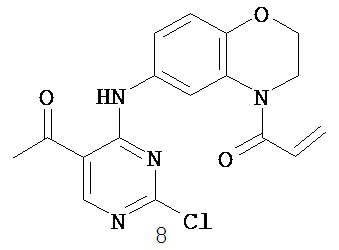
[00577] В атмосфере азота к смеси промежуточного соединения 6, полученного как описано выше, 1 мл DIPEA в 10 мл NMP и 10 мл ДХМ при температуре -20°C, добавляли 275 мкл соединения 7 (1,1 экв.). Реакция проводили 5 минут, после чего ее гасили 1 мл изопропилового спирта. Реакционную смесь подогревали до комнатной температуры и экстрагировали 100 мл EtOAc, промывали водой (10 млх2), солевым раствором, сушили над сульфатом натрия. Фильтровали и концентрировали, после чего остаток очишали методом колоночной флэш-хроматографии с подвижной фазой гептан/EtOAc (2/3 об./об.) с получением желтого твердого продукта I-3 (450 мг) (40%). ЖХ/МС: m/z 359,1 (ES+), 357,1 (ES-).
[00578] Этап 5
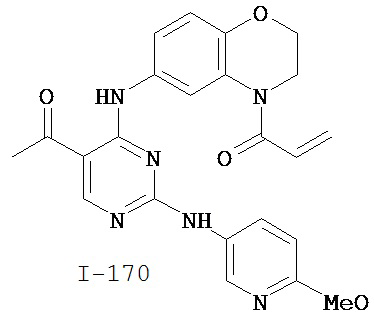
[00579] Смесь 30 мг промежуточного продукта 8 (84 мкМоль) и 13 мг соединения 9 (1,2 экв.) в 1 мл 0,08 М раствора n-толуолсульфокислоты n-TsOH в диоксане грели при температуре 100°C в течение 15 минут. Охлаждали, после чего реакционную смесь обрабатывали 50 мл EtOAc, водным натрия бикарбонатом, солевым раствором и сушили над безводным сульфатом натрия. Концентрировали и остаток очищали методом колоночной хроматографии на силикагеле с элюентом гептан/EtOAc (1/4 об./об.) с получением 22,8 мг белогатого твердого продукта (61%). ЖХ/МС: m/z=447,1 (ES+), 445,2 (ES-).
ПРИМЕР 43
[00580] Получение 1-{6-[5-ацетил-2-(4-морфолин-4-ил-фениламино)-пиримидин-4-иламино]-2,3-дигидро-бензо[1,4]оксазин-4-ил}-пропенона I-169
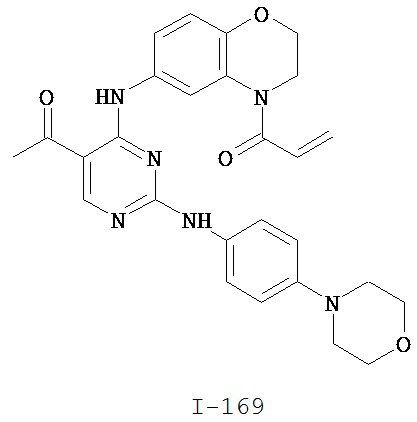
[00581] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 4-морфолин-4-ил-фениламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 501,1 (ES+), 499,2 (ES-).
ПРИМЕР 44
[00582] Получение 1-{6-[5-ацетил-2-(6-морфолин-4-ил-пиридин-3-иламино)-пиримидин-4-иламино]-2,3-дигидро-бензо[1,4]оксазин-4-ил}-пропенона I-168
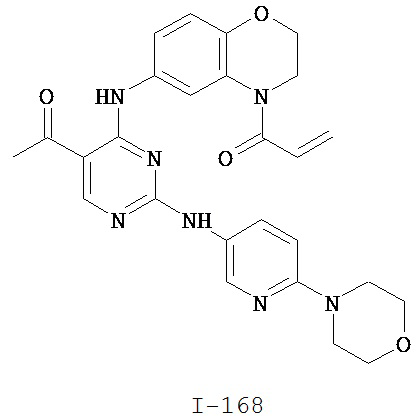
[00583] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 3-амино-[6-морфолин-4-ил]-пиридина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 502,2 (ES+), 500,3 (ES-).
ПРИМЕР 45
[00584] Получение 1-{6-[5-ацетил-2-(1-метил-1H-индазол-6-иламино)-пиримидин-4-иламино]-2,3-дигидро-бензо[1,4]оксазин-4-ил}-пропенона I-154
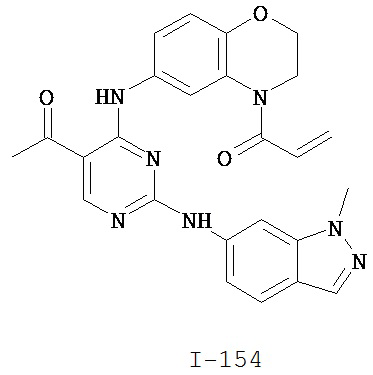
[00585] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 1-метил-1H-индазол-6-иламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 470,1 (ES+), 468,1 (ES-).
ПРИМЕР 46
[00586] Получение 1-{6-[5-ацетил-2-(1H-индазол-6-иламино)-пиримидин-4-иламино]-2,3-дигидро-бензо[1,4]оксазин-4-ил}-пропенона I-153
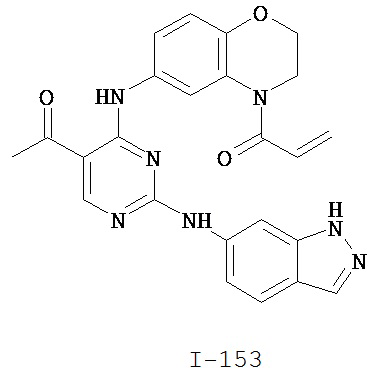
[00587] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 1H-индазол-6-иламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 456,1 (ES+), 454,2 (ES-).
ПРИМЕР 47
[00588] Получение 1-{4-[5-ацетил-4-(4-акрилоил-3,4-дигидро-2H-бензо[1,4]оксазин-6-иламино)-пиримидин-2-иламино]-фенил}-пирролидин-2-она I-152
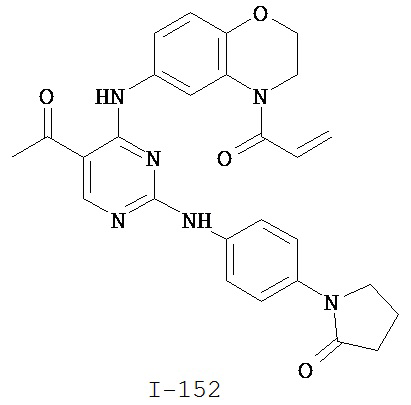
[00589] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 1-(4-амино-фенил)-пирролидин-2-она вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 456,1 (ES+), 454,2 (ES-).
ПРИМЕР 48
[00590] Получение 1-(6-{5-ацетил-2-[4-(2-метокси-этокси)-фениламино]-пиримидин-4-иламино}-2,3-дигидро-бензо[1,4]оксазин-4-ил)-пропенона I-150
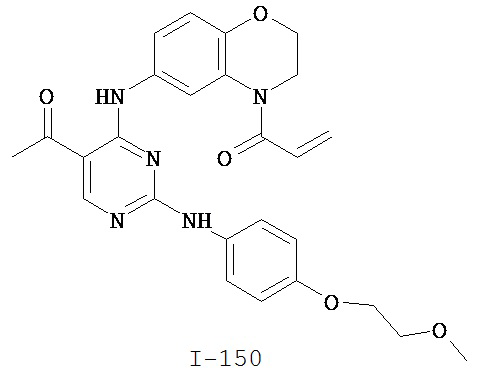
[00591] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 4-(2-метокси-этокси)-фениламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 490,2 (ES+), 488,3 (ES-).
ПРИМЕР 49
[00592] Получение 5-[5-ацетил-4-(4-акрилоил-3,4-дигидро-2H-бензо[1,4]оксазин-6-иламино)-пиримидин-2-иламино]-1,3-дигидро-индол-2-она I-129
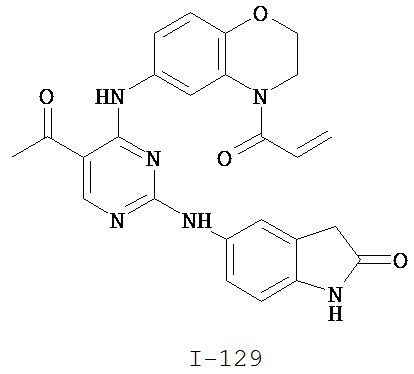
[00593] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 5-амино-1,3-дигидро-индол-2-она вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 471,1 (ES+), 469,2 (ES-).
ПРИМЕР 50
[00594] Получение 1-(6-{5-ацетил-2-[6-(2-гидрокси-этокси)-пиридин-3-иламино]-пиримидин-4-иламино}-2,3-дигидро-бензо[1,4]оксазин-4-ил)-пропенона I-128
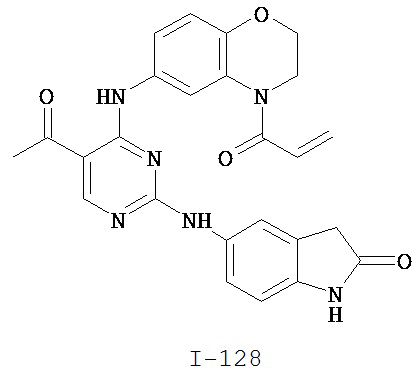
[00595] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 2-(5-амино-пиридин-2-илокси)-этанола вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 477,1 (ES+), 475,2 (ES-).
ПРИМЕР 51
[00596] Получение N-{3-[5-ацетил-2-(6-метокси-пиридин-3-иламино)-пиримидин-4-иламино]-фенил}-акриламида I-189
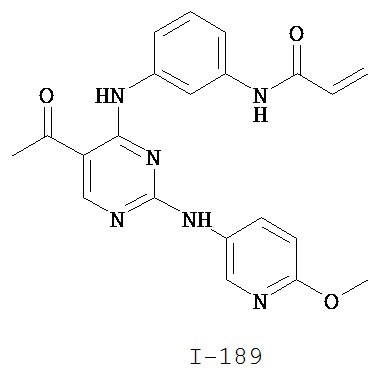
[00597] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием трет-бутил-3-аминофенилкарбамата вместо соединения 2 на Этапе 1 и 5-амино-2-метоксипиридина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 405,1 (ES+), 403,2 (ES-).
ПРИМЕР 52
[00598] Получение N-{3-[5-ацетил-2-(6-метокси-пиридин-3-иламино)-пиримидин-4-илокси]-фенил}-акриламида I-188
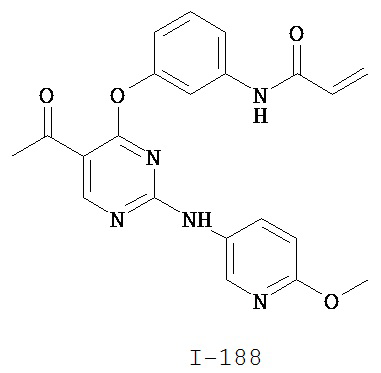
[00599] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием трет-бутил-3-гидроксифенилкарбамата вместо соединения 2 на Этапе 1 и 5-амино-2-метоксипиридина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 406,2 (ES+), 404,1 (ES-).
ПРИМЕР 53
[00600] Получение 1-{3-[5-ацетил-2-(6-метокси-пиридин-3-иламино)-пиримидин-4-иламино]-азетидин-1-ил}-пропенона I-187
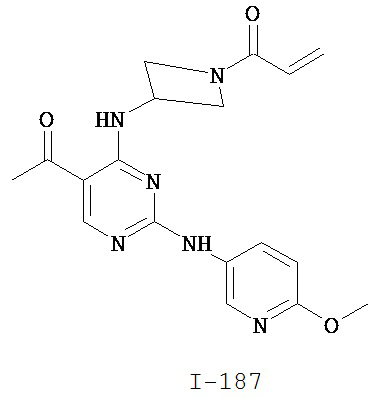
[00601] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 3-амино-N-Boc-азетидина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 369,1 (ES+), 367,2 (ES-).
ПРИМЕР 54
[00602] Получение N-(3-{5-ацетил-2-[4-(2-метокси-этокси)-фениламино]-пиримидин-4-иламино}-фенил)-акриламида I-124
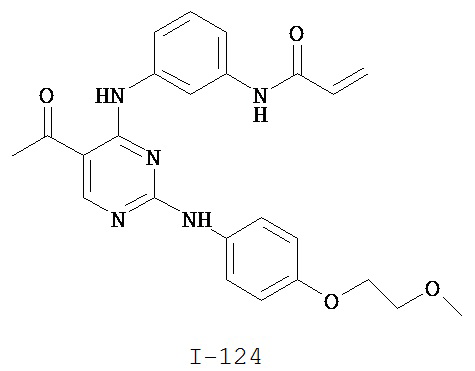
[00603] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием трет-бутил-3-аминофенилкарбамата вместо соединения 2 на Этапе 1 и 4-(2-метокси-этокси)-фениламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 448,2 (ES+), 446,3 (ES-).
ПРИМЕР 55
[00604] Получение N-(3-{5-ацетил-2-[6-(2-метокси-этокси)-пиридин-3-иламино]-пиримидин-4-иламино}-фенил)-акриламида I-122
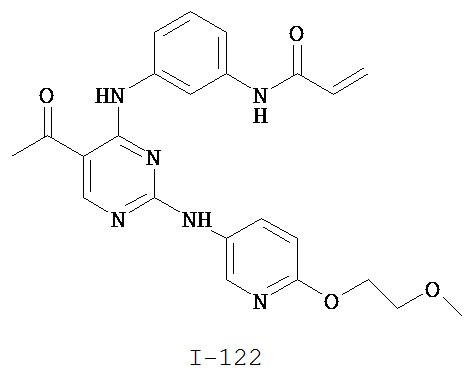
[00605] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием трет-бутил-3-аминофенилкарбамата вместо соединения 2 на Этапе 1 и 6-(2-метокси-этокси)-пиридин-3-иламина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 449,2 (ES+), 447,1 (ES-).
ПРИМЕР 56
[00606] Получение N-(3-{5-ацетил-2-[6-(2-гидрокси-этокси)-пиридин-3-иламино]-пиримидин-4-иламино}-фенил)-акриламида I-121
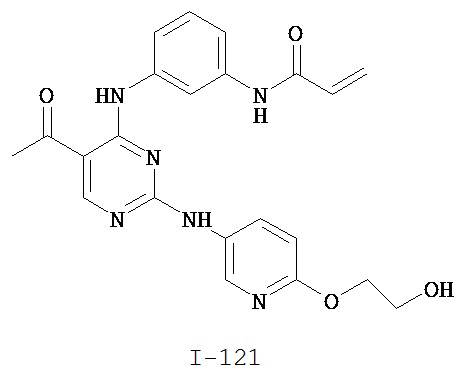
[00607] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием трет-бутил-3-аминофенилкарбамата вместо соединения 2 на Этапе 1 и 2-(5-амино-пиридин-2-илокси)-этанола вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 435,1 (ES+), 433,2 (ES-).
ПРИМЕР 57
[00608] Получение фениламида 4-(3-акриламидофенокси)-2-(3-метоксифениламино)-пиримидин-5-карбоновой кислоты I-200
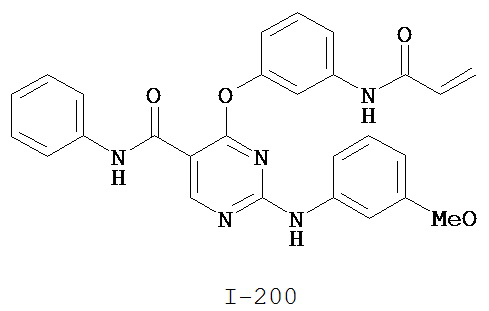
[00609] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
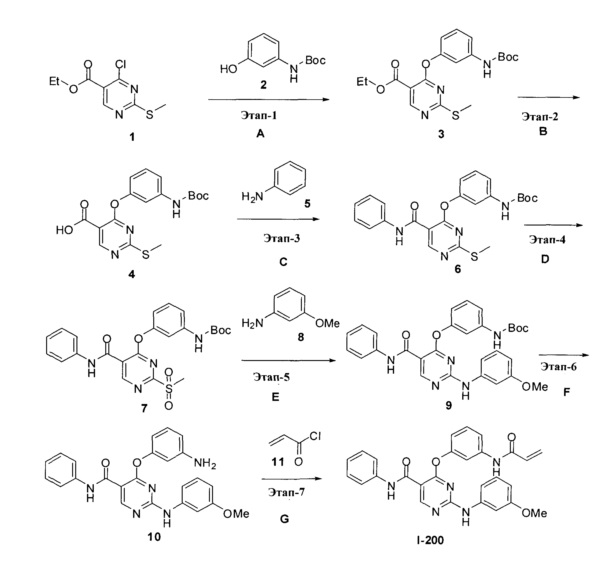
A) соединение 2, NaH, ТГФ, 0°C; B) NaOH, ТГФ, MeOH; C) соединение 5, TBTU, DIPEA, CH3CN, 0°C; D) м-CPBA, ДХМ, 0°C; E) соединение 8, 50°C, 3 часа; F) TFA, ДХМ; G) соединение 11, DIPEA, ДХМ
[00610] Этап 1
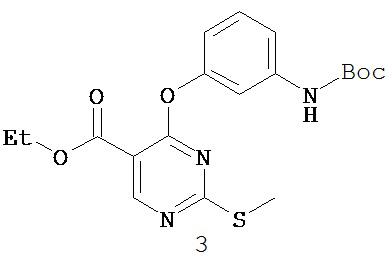
[00611] К раствору трет-бутилового эфира (3-гидроксифенил)карбаминовой кислоты 2 (1,79 г, 8,59 ммоль) при температуре 0°C при перемешивании добавляли суспензию натрия гидрида NaH (60% дисперсия в минеральном масле) (0,34 г, 8,9 ммоль) в безводном ТГФ (30 мл). Смесь перемешивали при температуре 0°C в течение 20 минут. Затем к раствору этилового эфира 4-хлор-(2-метилсульфанил)пиримидин-5-карбоновой кислоты 1 (2 г, 8,59 ммоль) в ТГФ (20 мл) по каплям добавляли раствор феноксида при температуре 0°C. Реакционную смесь перемешивали при температуре 0°C в течение 2 часов. Реакционную смесь экстрагировали этилацетатом (150 мл) и промывали водой (50 мл) и солевым раствором (50 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Сырой продукт промывали смесью CH2Cl2:гексан (1:9) с получением указанного в названии соединения 3 в виде белого твердого продукта (2,43 г, 70%).
[00612] Этап 2
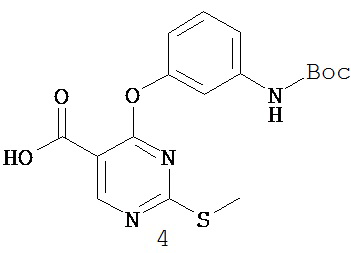
[00613] К раствору этилового эфира 4-(3-трте-бутоксикарбониламинофенокси)-2-(метилсульфанил-пиримидин)-5-карбоновой кислоты 3 (2 г, 4,93 ммоль) в ТГФ (60 мл) при перемешивании добавляли метанол (60 мл) при температуре -10°C, а затем - водный раствор натрия гидроксида (0,3 г, 30 мл воды, 7,5 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали при этой температуре в течение 1 часа. Реакционную смесь разбавляли водой (50 мл), подкисляли лимонной кислотой и выпавший осадок отфильтровывали и промывали ледяной водой (50 мл) с получением соединения 4 в виде белого твердого продукта. (1,52 г, 82%).
[00614] Этап 3
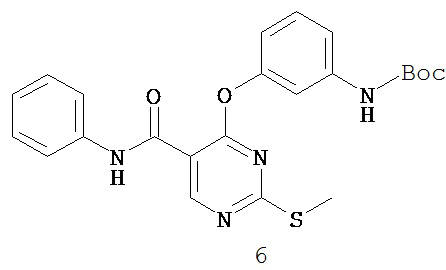
[00615] К раствору 4-(3-трет-бутоксикарбониламинофенокси)-2-(метилсульфанил)пиримидин-5-карбоновой кислоты 4 (2,0 г, 5,29 ммоль) и N,N,N’,N’-тетраметил-O-(бензотриазол-1-ил)урониум-тетрафторборат (TBTU) (2,55 г, 7,94 ммоль) в ацетонитриле (30 мл) при температуре 0°C при перемешивании добавляли DIPEA (1,36 г, 10,6 ммоль), а затем анилин 5 (0,60 г, 6,35 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. После завершения реакции реакционную смесь выливали в ледяную воду (100 мл) и полученный белый осадок отфильтровывали, промывали ледяной водой (20 мл), сушили в вакууме с получением указанного в названии соединения 6 (1,79 г, 75%).
[00616] Этап 4
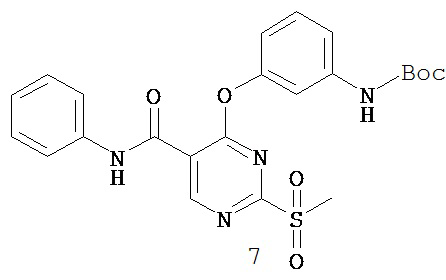
[00617] К раствору трет-бутилового эфира [3-(2-метилсульфанил-5-фенилкарбамоилпиримидин-4-илокси)-фенил]-карбаминовой кислоты 6 (1,5 г, 3,31 ммоль) в CH2Cl2 при температуре 0°C при перемешивании добавляли раствор 3-хлорпероксибензойной кислоты (м-CPBA) (70%, 1,62 г, 2 экв.) в CH2Cl2 (10 мл). Реакционную смесь оставляли до достижения комнатной температуры, затем перемешивали в течение 12 часов. Реакционную смесь гасили насыщенным водным раствором NaHCO3 и полученный раствор экстрагировали EtOAc. Органический слой промывали солевым раствором, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Сырой продукт промывали смесью CH2Cl2:гексан (1:9) с получением указанного в названии соединения 7 в виде белого твердого продукта (1,16 г, 73%).
[00618] Этап 5
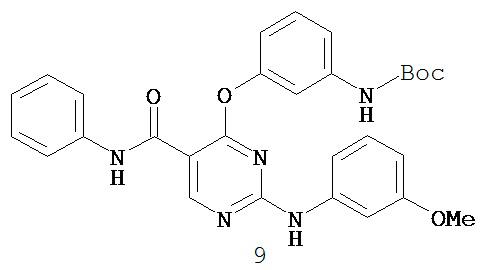
[00619] Избыток 3-метоксианилина (8) (2 мл) добавляли к твердому трет-бугиловому эфиру [3-(2-метансульфонил-5-фенилкарбамоил-пиримидин-4-илокси)-фенил]-карбаминовой кислоты 7 (0,5 г, 1,03 ммоль) и полученную смесь грели при температуре 50°C в атмосфере аргона в течение 3 часов. Реакционную смесь остужали до комнатной температуры и разбавляли смесью этилацетат/гексаном (1:1, 20 мл), после чего выпавший осадок отфильтровывали и промывали смесью этилацетат/гексан (1:1, 10 мл) с получением целевого соединения 9 в виде белого твердого продукта (0,40 г, выход 75%).
[00620] Этап 6
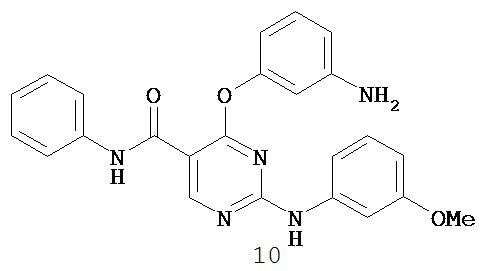
[00621] К раствору трет-бутилового эфира {3-[2-(3-метокси-фениламино)-5-фенилкарбамоил-пиримидин-4-илокси]-фенил }-карбаминовой кислоты 9 (0,3 г, 0,56 ммоль) в CH2Cl2 (10 мл) добавляли трифторуксусную кислоту (2 мл) и полученную смесь перемешивали при комнатной температуре в течение 1 часа. Удаляли растворители при пониженном давлении и растворяли остаток в CH2Cl2, промывали 10% водным раствором NaHCO3, сушили (Na3SO4), фильтровали и упаривали при пониженном давлении с получением свободного амина 10 в виде белого твердого продукта.
[00622] Этап 7
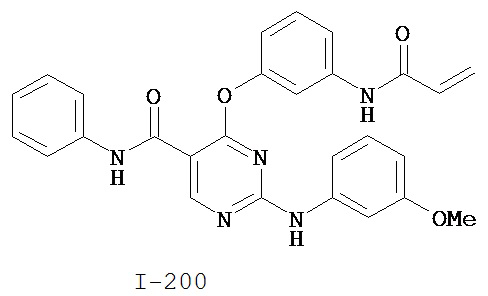
[00623] К раствору амина 10 (0,24 г, 0,56 ммоль) в дихлорметане (20 мл), охлажденному до -70°C, в атмосфере аргона при перемешивании добавляли DIPEA (0,072 г, 0,56 ммоль), после чего по каплям добавляли акрилоилхлорид (0,050 г, 0,56 ммоль).
Полученную смесь перемешивали при температуре -70°C в течение 5 минут, и разбавляли реакционную смесь CH2Cl2 (50 мл), после чего промывали насыщенным водным раствором NaCl (10 мл). Органический слой сушили (Na2SO4), фильтровали и упаривали при пониженном давлении. Остаток очищали методом флэш-хроматографии на силикагеле с использованием смеси MeOH-CHCl3 5:95 в качестве элюента с получением целевого соединения 11 (0,094 г, 35%) в виде белого твердого продукта: 1H-ЯМР (200 МГц, ДМФ-d6) δ 8,9 (s, 1H), 8,10-7,70 (m, 6H), 7,60-7,10 (m, 6H), 6,60 (m, 2H), 6,40 (dd, 1H, J=8,0, 2,0 Гц), 5,80 (m, 2H), 3,70 (s, 3H).
ПРИМЕР 58
[00624] Получение фениламида 4-(3-акриламидофенокси)-2-(6-метоксипиридин-3-ил-амино)-пиримидин-5-карбоновой кислоты I-159
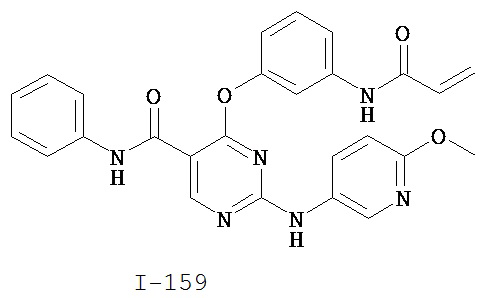
[00625] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 57, с использованием 6-метокси-3-аминопиридина вместо соединения 8 на Этапе 5. 1H-ЯМР (200 МГц, ДМСО-d6) δ 8,90 (s, 1H), 8,20 (brs, 1H), 7,90-7,60 (m, 4H), 7,45(m, 4H), 7,10 (m, 2H), 6,50 (m, 1H), 6,20 (m, 2H), 5,90 (dd, J=8,0, 2,0 Гц, 1H), 3,90 (s, 3H).
ПРИМЕР 59
[00626] Получение циклопропиламида 4-(3-акриламидофенокси)-2-(3-метоксифенил-амино)-пиримидин-5-карбоновой кислоты I-177
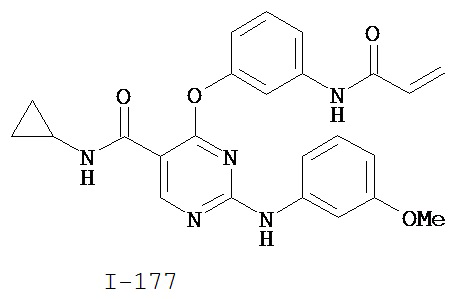
[00627] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 57, с использованием циклопропиламина вместо соединения 5 на Этапе 3. 1H-ЯМР (200 МГц, CD3OD) δ 9,0 (s, 1H), 7,90 (brs, 1H), 7,50 (m, 3H), 7,0 (m, 4H), 6,50 (m, 1H), 6,40 (d, J=8,0 Гц, 2H), 5,80 (dd, J=8,2, 3,0 Гц, 1H), 3,60 (s, 3H), 0,90 (m, 2H), 0,62 (m, 2H).
ПРИМЕР 60
[00628] Получение циклопропиламида 4-(3-акриламидофенокси)-2-(6-метоксипиридин-3-иламино)-пиримидин-5-карбоновой кислоты I-176
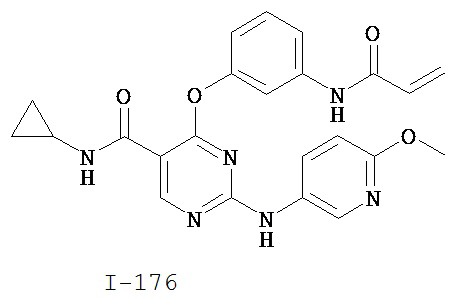
[00629] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 57, с использованием циклопропиламина вместо соединения 5 на Этапе 3 и 6-метокси-3-аминопиридина вместо соединения 8 на Этапе 5. 1H-ЯМР (200 МГц, CD3OD) δ 8,90 (s, 1H), 7,95 (brs, 1H), 7,90-7,82 (m, 3H), 7,40 (m, 3H), 6,98 (d, J=6,0 Гц, 1H), 6,42 (m, 2H), 5,90 (dd, J=8,0, 2,0 Гц, 1H), 3,90 (s, 3H), 0,95 (m, 2H), 0,83 (m, 2F).
ПРИМЕР 61
[00630] Получение амида 4-(3-акриламидофенокси)-2-(3-метоксифениламино)-пиримидин-5-карбоновой кислоты I-178
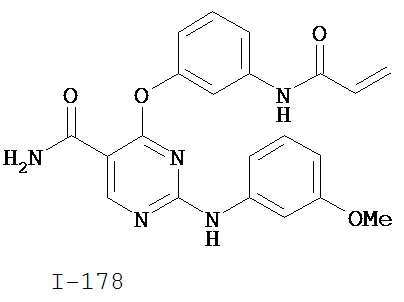
[00631] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
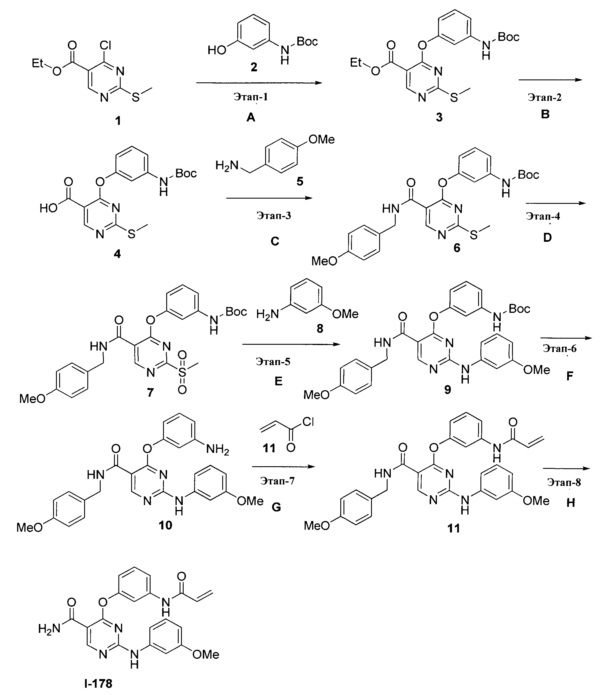
A) соединение 2, NaH, ТГФ, 0°C; В) LiOH, ТГФ, H2O; C) соединение 5, TBTU, DIPEA, CH3CN; D) м-СРВА, CHCl3, 0°C; E) соединение 8, DMA, 90°C, 24 часа; F) 4N HCl, диоксан; G) соединение 11, CH2Cl2; H) трифторметансульфокислота, TFA, CH2Cl2
[00632] Этап 1

[00633] Этап 1 осуществляли также, как Этап 1 в Примере 57.
[00634] Этап 2

[00635] Омыляли соединение 3 (4,58 г, 11,3 ммоль) LiOH (500 мг, 20 ммоль) в 80 мл ТГФ/H2O (1:1) и после стандартной обработки 1 N раствором HCl получали свободную кислоту 4.
[00636] Этап 3
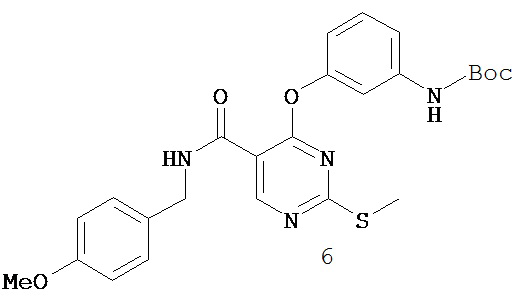
[00637] Полученную кислоту 4 без очистки смешивали с 4-метоксибензиламином (1,55 г, 11,3 ммоль), TBTU (5,4 г, 16,8 ммоль) и DIPEA (2,4 мл, 13,4 ммоль) в 100 мл MeCN при комнатной температуре. Реакционную смесь оставляли на ночь, после чего очищали методом флэш-хроматографии (EtOAc-гексан) с получением соединения 6 в виде белого твердого продукта (4,2 г, 8,5 ммоль).
[00638] Этап 4
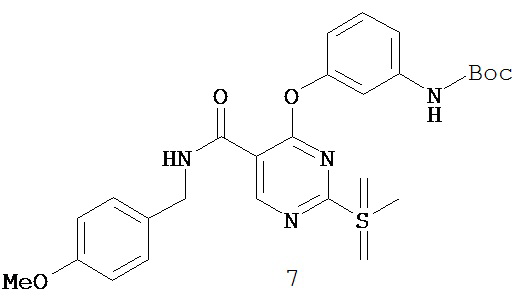
[00639] Этап 4 осуществляли также, как и Этап 4 в Примере 57, но применяя CHCl3 вместо CH2Cl2 в качестве растворителя.
239 [00640] Этап 5
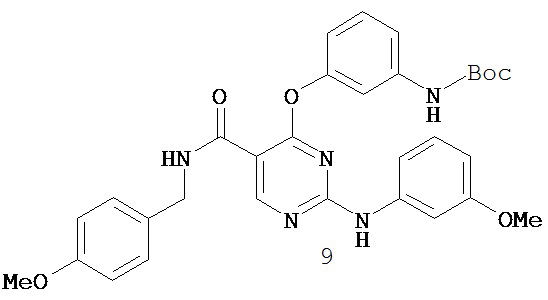
[00641] 2-метилсульфон соединения 7 (1,0 г, 1,9 ммоль) смешивали с 3-метоксианилином (420 мг, 3,4 ммоль) в диметилацетамиде (DMA) и полученную смесь грели при температуре 90°C в течение 24 часов. Обработку проводили также, как и на Этапе 5 в Примере 57 с получением соединения 9 (300 мг, 0,52 ммоль).
[00642] Этапы 6, 7 и 8
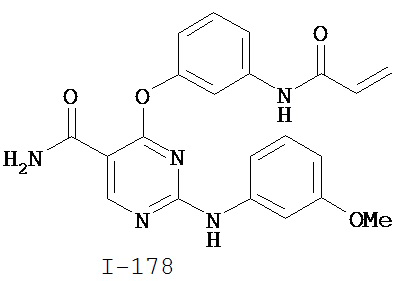
[00643] Группу Boc удаляли из соединения 9 обработкой 4 N раствором HCl в диоксане. Продукт (300 мг, 0,52 ммоль) сразу же обрабатывали акрилоилхлоридом (43 мкл, 0,52 ммоль) в 15 мл ДХМ при температуре -40°C. Это промежуточное соединение очищали методом флэш-хроматографии (MeOH-ДХМ) и проводили его реакцию с трифторметансульфокислотой и TFA в ДХМ с получением сырого бензиламина 11 (120 мг, 0,228 ммоль). Это промежуточное соединение (120 мг, 0,228 ммоль) превращали в I-178, используя трифторметансульфокислоту (305 мкл, 3,44 ммоль) в TFA/ДХМ (5 мл, 1:1) при комнатной температуре, очищали методом колоночной хроматографии и получали примерно 35 мг целевого соединения 1-178 в виде серого порошка (выход 16% после 3 этапов). MS: m/z=405.
ПРИМЕР 62
[00644] Получение трет-бутил-3-(3-(4-(3-акриламидофениламино)-5-метил-пиримидин-2-иламино)фенокси)пропилкарбамата I-45
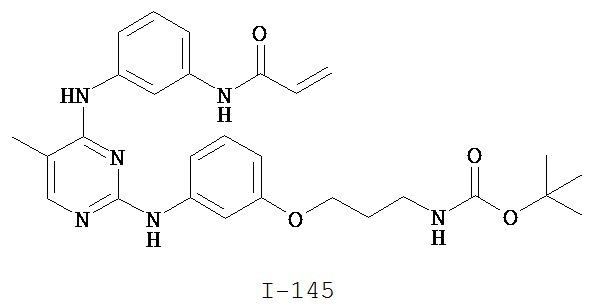
[00645] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
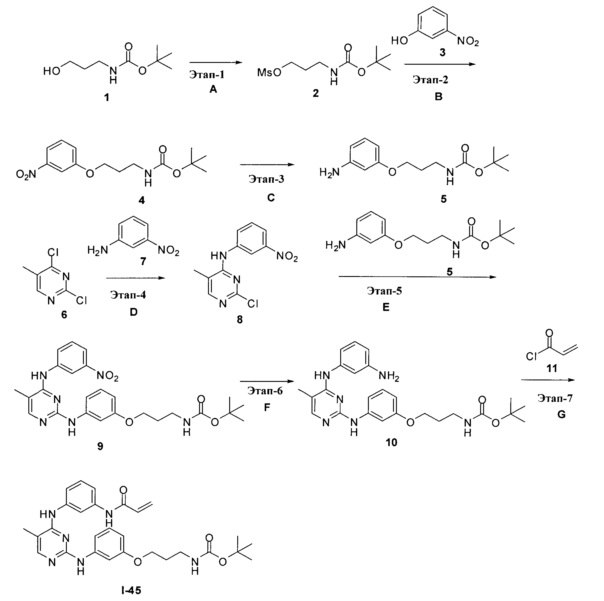
A) соединение 1, метансульфонилхлорид, CH2Cl2, Et3N, комн. темп., 1 час; B) соединение 3, K2CO3, ДМФА, 60°C; C) H2, Pd/C, EtOH, комн. темп., 16 часов; D) соединения 6, 7, Pd(OAc)2, BINAP, Cs2CO3, толуол, 100°C, 16 часов; E) соединение 5, АсОН, EtOH, 90°C, 16 часов; F) H2, Pd/C, EtOH, комн. темп., 16 часов; G) соединение 11, NMP, 0°C, 15 минут.
[00646] Этап 1
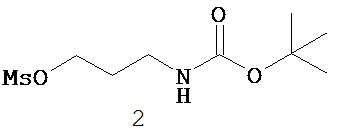
[00647] К раствору соединения 1 (1,0 г, 5,7 ммоль) в дихлорметане (20,0 мл) при перемешивании добавляли Et3N (1,15 г, 11,41 ммоль) и метансульфонилхлорид (0,98 г, 8,56 ммоль). Реакционную смесь перемешивали в атмосфере азота при комнатной температуре в течение 60 минут. Затем гасили водой (20 мл) и экстрагировали EtOAc (2×50 мл). Объединенный EtOAc экстракт промывали 10% раствором NaHCO3 (25 мл), водой (25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 2 (1,36 г, 94%) в виде бесцветной вязкой жидкости. Ее использовали на следующем этапе без дополнительной очистки.
[00648] Этап 2
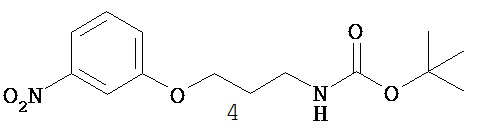
[00649] К раствору соединения 2 (0,749 г, 5,39 ммоль) и K2CO3 (0,99 г, 7,19 ммоль) в сухом ДМФА (20 мл) при перемешивании добавляли соединение 3 (1,36 г, 5,39 ммоль) и реакционную смесь нагревали при температуре 60°C в течение 16 часов в атмосфере азота. Реакционную смесь охлаждали, концентрировали при пониженном давлении и остаток обрабатывали этилацетатом (25 мл). Этилацетатный раствор промывали водой (2×10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 4 (1,2 г, 75%) в виде желтоватой вязкой жидкости. Ее использовали на следующем этапе без дополнительной очистки.
[00650] Этап 3
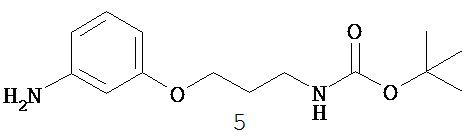
[00651] К раствору соединения 4 (1,20 г, 4,05 ммоль) в этаноле (25 мл) добавляли Pd/C (0,12 г, 10% (вес.)) после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 5 (0,95 г, 88%) в виде коричневатого вязкого масла. Его использовали на следующем этапе без дополнительной очистки.
[00652] Этап 4
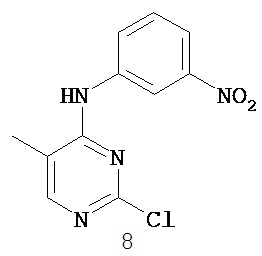
[00653] К раствору соединения 6 (1,69 г, 12,26 ммоль), в толуоле (50,0 мл) добавляли соединение 7 (2,0 г, 12,26 ммоль), BINAP (0,3 г, 0,49 ммоль), карбонат цезия (7,9 г, 24,5 ммоль). Раствор дегазировали (продувая N2 в течение 15 минут) и добавляли к нему Pd(OAc)2 (0,054 г, 0,25 ммоль). Реакционную смесь перемешивали при температуре 100°C в течение 16 часов в атмосфере азота. Затем ее охлаждали, разбавляли этилацетатом (100 мл) и фильтровали через целит. Фильтрат промывали водой (2×25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, этилацетат/гексан: 15/85). Твердое остаток, полученный после упаривания растворителя, промывали диэтиловым эфиром и сушили в высоком вакууме с получением соединения 8 (1,2 г, 37%) в виде желтого твердого продукта.
[00654] Этап 5
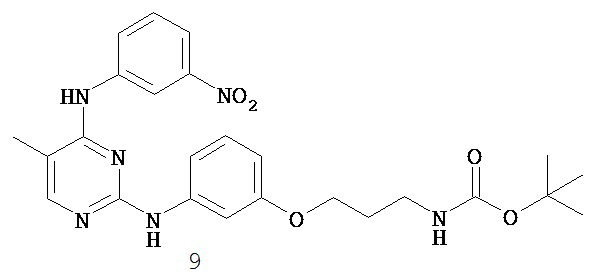
[00655] К раствору соединения 8 (0,5 г, 1,89 ммоль) и соединения 5 (0,805 г, 3,0 ммоль) в этаноле (10,0 мл) добавляли ледяную уксусную кислоту (0,056 г, 0,95 ммоль) и перемешивали реакционную смесь в закрытой пробирке в течение 16 часов при температуре 90°C. Реакционную смесь остужали, концентрировали при пониженном давлении. Осадок гасили 10% раствором натрия бикарбоната (10,0 мл) и экстрагировали этилацетатом (3×15 мл). Объединенный этилацетатный экстракт промывали водой (15 мл), солевым раствором (15 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Сырой остаток затем очищали методом колоночной хроматографии (SiO2, EtOAc/гексан: 50/50) с получением соединения 9 (0,57 г, 61%) в виде светло-желтого твердого продукта.
[00656] Этап 6
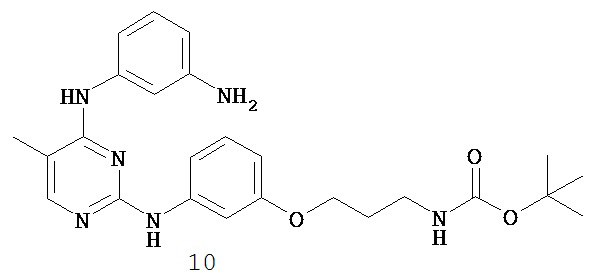
[00657] К раствору соединения 9 (0,56 г, 1,13 ммоль) в этаноле (25 мл) добавляли 10% Pd/C (0,068 г), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода - 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 10 (0,45 г, 85%) в виде коричневатого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00658] Этап 7
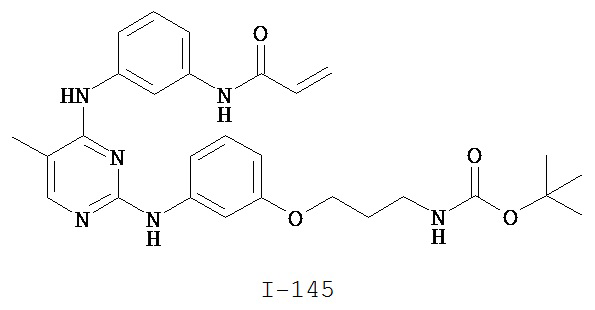
[00659] К раствору соединения 10 (0,25 г, 0,5382 ммоль) в NMP (2,5 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,073 г, 0,807 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 15 минут. Реакционную смесь при перемешивании добавляли по каплям в холодный 10% раствор NaHCO3. После полного добавления раствор полученный перемешивали еще в течение 30 минут при температуре 0°C, после чего для отделения осадка фильтровали на воронке Бюхнера. Осадок промывали холодной водой и гексаном. Затем его растворяли в смеси метанол:дихлорметан (50:50, 10 мл) и концентрировали при пониженном давлении. Полученный осадок суспендировали в холодной воде (50 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×100 мл). Объединенный этилацетатный экстракт промывали водой (50 мл), солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 1-45 (0,100 г, 35,8%) в виде беловатого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,37 (s, 9H), 1,70-1,80 (m, 2H), 2,10 (s, 3H), 3,00-3,06 (m, 2H), 3,79 (t, J=6,24 Гц, 2H), 5,74 (d, J=11,92 Гц, 1H), 6,24 (dd, J=1,84 и 15,16 Гц, 1H), 6,35-6,47 (m, 2H), 6,80-6,90 (bs, 1H), 6,97 (t, J=8,28 Гц, 1H), 7,23-7.27 (m, 2H), 7,31 (s, 1H), 7,37 (d, J=8,2 Гц, 1H), 7,46 (d, J=7,48 Гц, 1H), 7,90-7,91 (m, 2H), 8,36 (s, 1H), 8,87 (s, 1H), 10,07 (s, 1H); ЖХ/МС: m/e 519 (M+1).
ПРИМЕР 63
[00660] Получение трет-бутил-3-(3-(4-(3-акриламидофениламино)-5-фтор-пиримидин-2-иламино)фенокси)пропилкарбамата I-183
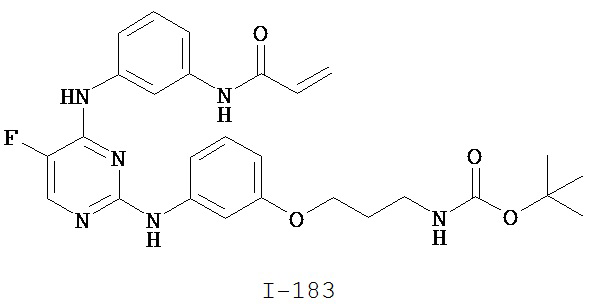
[00661] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
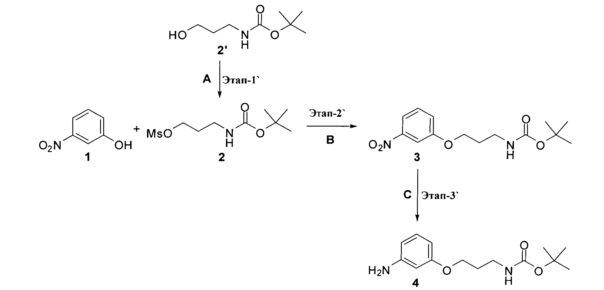
A) метансульфонилхлорид, CH2Cl2, Et3N, комн. темп., 1 час; B) K2CO3, ДМФА, 60°C, 16 часов; C) Pd/C, H2, этанол, комн. темп., 16 часов.
[00662] Этап 1’
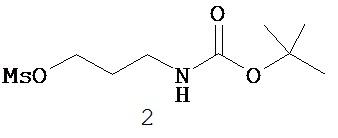
[00663] К раствору соединения 2’ (4,0 г, 22,8 ммоль) в дихлорметане (80,0 мл) при перемешивании добавляли Et3N (4,6 г, 45,5 ммоль) и метансульфонилхлорид (3,92 г, 34,2 ммоль) и перемешивали реакционную смесь в атмосфере азота при комнатной температуре в течение 60 минут. Реакционную смесь гасили водой (50 мл) и экстрагировали EtOAc (2×100 мл). Объединенный экстракт промывали 10% раствором NaHCO3 (50 мл), водой (50 мл) и солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 2 (5,5 г, 95,2%) в виде светло-желтой вязкой жидкости. Соединение 2 использовали на следующем этапе без дополнительной очистки.
[00664] Этап 2’
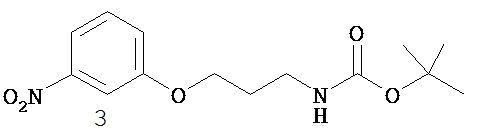
[00665] К раствору соединения 1 (2,3 г, 16,5 ммоль) и K2CO3 (4,6 г, 33,3 ммоль) в сухом ДМФА (100 мл) при перемешивании добавляли соединение 2 (5,5 г, 21,7 ммоль) и реакционную смесь грели при температуре 60°C в течение 16 часов в атмосфере азота. Реакционную смесь охлаждали, гасили водой (250 мл) и экстрагировали EtOAc (2×100 мл). Объединенный экстракт промывали 10% раствором NaHCO3 (100 мл), водой (3×100 мл) и солевым раствором (100 мл), сушили над Na2SO2 и концентрировали при пониженном давлении с получением соединения 3 (4,0 г, 81,6%) в виде светло-желтой вязкой жидкости. Соединение 3 использовали на следующем этапе без дополнительной очистки.
[00666] Этап 3’
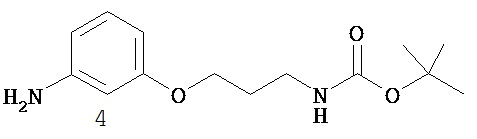
[00667] К раствору соединения 3 (4,0 г, 13,4 ммоль) в этаноле (50 мл) добавляли Pd/C (0,8 г, 10% (вес.)), после чего реакционную смесь перемешивали в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (3,3 г, 91,9%) в виде коричневатого вязкого масла. Соединение 4 использовали на следующем этапе без дополнительной очистки.
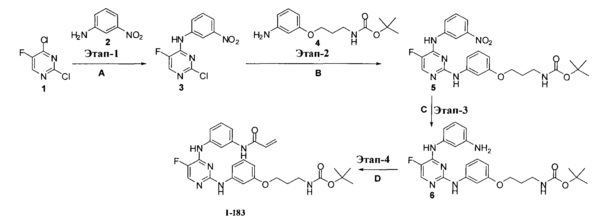
[00668] Этап 1
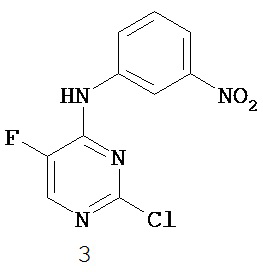
[00669] В реактор высокого давления помещали соединения 2 (10,0 г, 0,072 моль), 1 (24,1 г, 0,145 моль), н-BuOH (100 мл) и DIPEA (13,9 г, 0,108 моль) и перемешивали содержимое при температуре 120°C в течение 2 часов. Реакционную смесь охлаждали и отделяли выпавший осадок фильтрованием на воронке Бюхнера, осадок промывали холодным гексаном и сушили с получением соединения 3 (12,5 г, 64%) в виде желтого твердого продукта. Соединение 3 использовали на следующем этапе без дополнительной очистки.
[00670] Этап 2
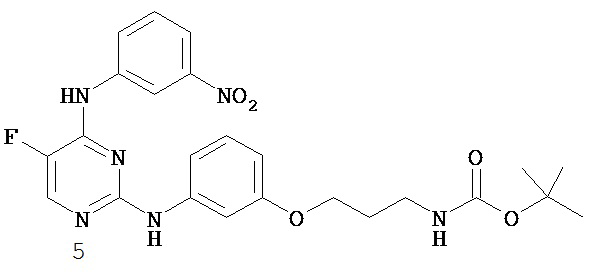
[00671] К раствору соединения 3 (1,5 г, 5,58 ммоль) и соединения 4 (1,48 г, 5,58 ммоль) в этаноле (30,0 мл) добавляли ледяную уксусную кислоту (0,167 г, 2,79 ммоль) и перемешивали реакционную смесь в реакторе высокого давления при температуре 90°C в течение 48 часов. Реакционную смесь охлаждали и концентрировали при пониженном давлении; осадок гасили 10% раствором натрия бикарбоната (20,0 мл) и экстрагировали этилацетатом (2×50 мл). Объединенный экстракт промывали водой (25 мл) и солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 5. Сырой остаток очищали методом колоночной хроматографии (нейтральный Al2O3. MeOH/хлороформ: 0,5/99,5) с получением соединения 5 (1,4 г, 50,3%) в виде коричневого твердого продукта.
[00672] Этап 3
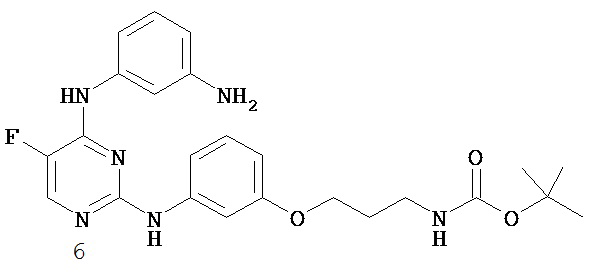
[00673] К раствору соединения 5 (1,4 г, 2,8 ммоль) в этаноле (50 мл) добавляли 10% Pd/C (0,28 г, 10% (вес.)), после чего реакционную смесь перемешивали в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением остатка. Сырой остаток далее очищали методом колоночной хроматографии (Al2O3, MeOH/хлороформ): 0,5/99,5) с получением твердого продукта, который промывали смесью дихлорметан/гексан с получением соединения 6 (0,7 г, 53,4%) в виде светло-коричневого твердого продукта.
[00674] Этап 4
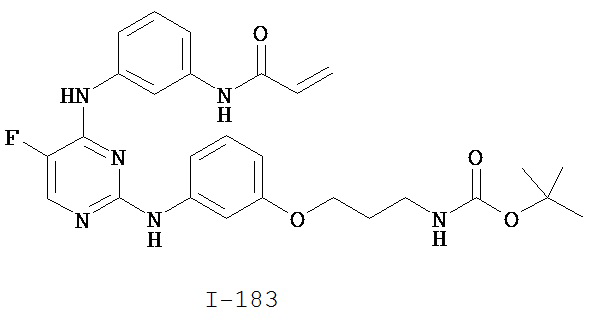
[00675] трет-бутил-3-(3-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)фенокси)пропилкарбамат.К раствору соединения 6 (0,25 г, 0,533 ммоль) и калия карбоната (0,138 г, 1,02 ммоль) в NMP (2,5 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,060 г, 0,665 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 30 минут. Реакционную смесь добавляли по каплям при перемешивании к 10% раствору NaHCO3 и полученную реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Выпавший белый осадок отделяли фильтрованием на воронке Бюхнера. Затем осадок промывали холодной водой и гексаном и растворяли в смеси метанол/дихлорметан (50:50, 10 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (25 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×50 мл). Объединенный этилацетатный экстракт промывали водой (50 мл), солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 1-183 (0,255 г, 91,4%) в виде светло-желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,36 (s, 9H), 1,78 (quin, J=6,4 Гц, 2H), 3,01-3,06 (m, 2H), 3,83 (t, J=6,12 Гц, 2H), 5,74 (dd, J=1,4 и 10,04 Гц, 1H), 6,24 (d, J=16,84 Гц, 1H), 6,41-6,48 (m, 2H), 6,88 (s, 1H), 7,03 (t, J=8.24 Гц, 1H), 7,23-7,31 (m, 3H), 7,41 (d, J=8,28 Гц, 1H), 7,56 (d, J=7,96 Гц, 1Н), 7,90 (s, 1H), 8,11 (d, J=3,56 Гц, 1H), 9,11 (s, 1H), 9,43 (s, 1Н), 10,10 (s, 1H); ЖХ/МС: m/e 523,1 (M+1).
ПРИМЕР 64
[00676] Получение трет-бутил-3-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)фенокси)пропилкарбамата I-198
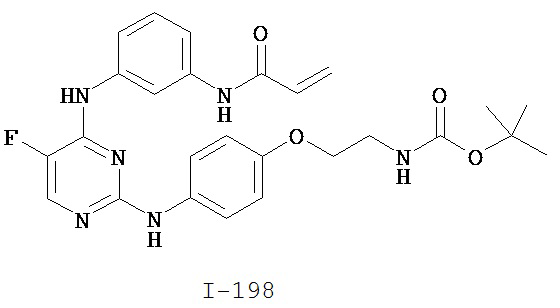
[00677] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 63, с использованием трет-бутил-3-(4-аминофенокси)пропилкарбамата вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,37 (s, 9H), 1,78 (quin, J=6,36 Гц, 2H), 3,05 (q, J=6,24 Гц, 2H), 3,86 (t, J=6,2 Гц, 2H), 5,75 (dd, J=1,92 и 10,04 Гц, 1H), 6,24 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 6,72 (d, J=9 Гц, 2H), 6,89 (t, J=5,4 Гц, 1H), 7,26 (t, J=8,08 Гц, 1H), 7,40 (d, J=8,12 Гц, 1H), 7,48-7,52 (m, 3H), 7,92 (s, 1H), 8,05 (d, J=3,72 Гц, 1Н), 8,95 (s, 1H), 9,36 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 523,2 (M+1).
[00678] Промежуточное соединение трет-бутил-3-(4-аминофенокси)пропилкарбамат получали с использованием схемы, описанной ниже.
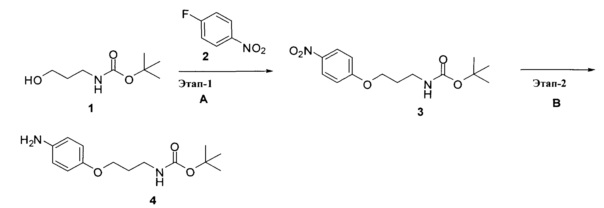
A) NaH, ТГФ, комн. темп., 16 часов; B) H2, Pd/C, EtOH, комн. темп., 16 часов
[00679] Этап 1
[00680] К раствору соединения 1 (1,7 г, 9,7 ммоль) в сухом ТГФ (40 мл) при перемешивании добавляли NaH (0,72 г, 18,0 ммоль, 60% дисперсия в парафиновом масле) при температуре 0°C и перемешивали полученную реакционную смесь при комнатной температуре в течение 15 минут в атмосфере азота. К реакционной смеси добавляли соединение 2 (2,0 г, 13,87 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 16 часов. Гасили холодной водой (20 мл) и экстрагировали этилацетатом (25 мл). Этилацетатный экстракт промывали водой (2×10 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением маслянистой жидкости, которую растирали в гексане с получением соединения 3 (2,0 g, 69,5%) в виде желтого кристаллического твердого продукта.
[00681] Этап 2
[00682] К раствору соединения 3 (2,0 г, 6,749 ммоль) в этаноле (30 мл) добавляли 10% Pd/C (0,4 г, 20% (вес.)), после чего реакционную смесь перемешивали в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (1,6 г, 89,3%) в виде розоватого вязкого масла. Его использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 65
[00683] Получение 4-(3-акриламидофениламино)-5-фтор-2-(3,4-диметоксифенил-амино)-пиримидина I-134
[00684] Указанное в названии соединение получали с использованием схем, этапов и промежуточных продуктов, описанных в Примере 20, с использованием 3,4-диметоксианилина вместо соединения 4 на Этап-2. 1H-ЯМР (200 МГц, CD3OD) δ 8,50 (s, 1H), 7,80 (d, J=6,5 Гц, 1H), 7,70-7,66 (m, 2H), 7,20 (m, 1H), 7,0 (m, 2H), 6,41 (m, 2H), 5,92 (dd, J=8,0, 2,0 Гц, 1H), 3,89 (s, 6H).
ПРИМЕР 66
[00685] Получение 4-(3-акриламидофениламино)-5-фтор-2-(3,4,5-триметоксифенил-амино)-пиримидина I-133
[00686] Указанное в названии соединение получали с использованием схем, этапов и промежуточных продуктов, описанных в Примере 20, с использованием 3,4,5-триметоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CD3OD) 5 8,10 (s, 1H), 8,0 (d, J=6,0 Гц, 1H), 7,50 (m, 2H), 7,30 (m, 1H), 7,0 (m, 2H), 6,45 (m, 2H), 5,90 (dd, J=8,0, 2,0 Гц, 1H), 3,90 (s, 3H), 3,89 (s, 9H).
ПРИМЕР 67
[00687] Получение 4-(3-акриламидофениламино)-5-фтор-2-(3-(гидроксиметил)фенил-амино)-пиримидина I-145
[00688] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-гидроксиметиланилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 4,38 (d, J=5,6 Гц, 2H), 5,07 (t, J=5,68 Гц, 1H), 5,75 (d, J=10,84 Гц, 1H), 6,24 (dd, J=16,96 Гц, 1H), 6,44 (dt, J=10,04 и 17,0 Гц, 1H), 6,83 (d, J=7,4 Гц, 1H), 7,10 (t, J=7,72 Гц, 1H), 7,28 (t, J=8,16 Гц, 1H), 7,40 (d, J=8,08 Гц, 1H), 7,55-7,59 (m, 3H), 7,92 (s, 1H), 8,09 (d, J=3,6 Гц, 1H), 9,11 (s, 1H), 9,40 (s, 1H), 10,1 (s, 1H); ЖХ/МС: m/e 378,0 (M+1).
ПРИМЕР 68
[00689] Получение 4-(3-акриламидофениламино)-5-фтор-2-(3-(3-(2-оксопирролидин-1-ил)пропокси)фениламино)-пиримидина I-144

[00690] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(2-оксопирролидин-1-ил)пропоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,8-1,94 (m, 4H), 2,18 (q, J=8,08 Гц, 2H), 3,26-3,40 (m, 4H), 3,80 (t, J=6 Гц, 2H), 5,74 (d, J=10,72 Гц, 1H), 6,24 (d, J=15,64 Гц, 1H), 6,41-6,80 (m, 2H), 7,04 (t, J=8,16 Гц, 1H), 7,22-7,29 (m, 2H), 7,33 (s, 1H), 7,42 (d, J=8,08 Гц, 1H), 7,55 (d, J=7,52 Гц, 1H), 7,91 (s, 1H), 8,11 (d, J=3,48 Гц, 1H), 9,13 (s, 1H), 9,43 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 491 (M+1).
ПРИМЕР 69
[00691] Получение 4-(3-акриламидофениламино)-5-фтор-2-(3-(3-(метилсульфонил)-пропокси)фениламино)-пиримидина I-138
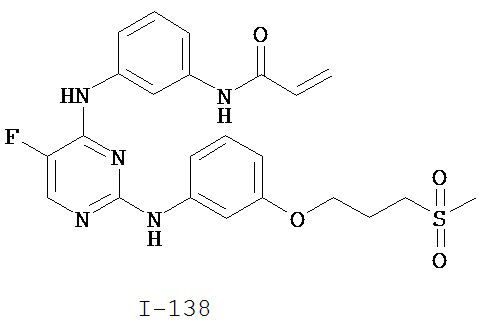
[00692] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(3-(метилсульфонил)пропоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,05-2,15 (m, 2H), 3,0 (s, 3H), 3,22 (t, J=7,76 Гц, 2H), 3,93 (t, J=6,08 Гц, 2H), 5,74 (dd, J=1,88 и 10 Гц, 1H), 6,25 (dd, J=1,8 и 16,88 Гц, 1H), 6,44 (dd, J=10,16 и 16,84 Гц, 2H), 7,05 (t, J=8,16 Гц, 1H), 7,24-7,30 (m, 2H), 7,35 (s, 1H), 7,42 (d, J=8,2 Гц, 1H), 7,55 (d, J=8 Гц, 1H), 7,90 (s, 1H), 8,11 (d, J=3,6 Гц, 1H), 9,14 (s, 1H), 9,43 (s, 1H), 10,10 (s, 1H); ЖХ/МС: m/e 484 (M+1).
[00693] Промежуточное соединение 3-(3-(метилсульфонил)пропоксианилин получали с использованием схемы, описанной ниже.
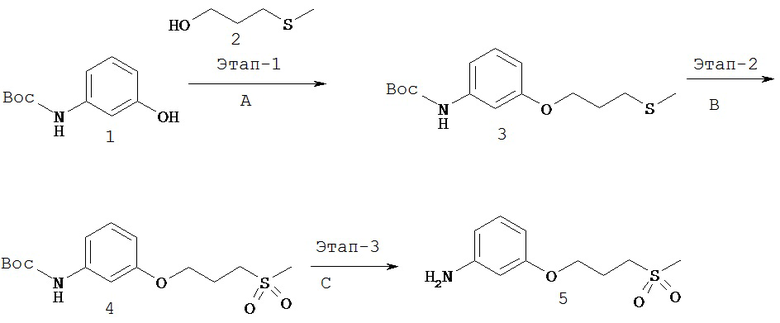
A) DEAD, Ph3P, Et3N, ТГФ, комн. темп., 1 час; B) м-CPBA, CH2Cl2, комн. темп., 30 минут; C) TFA, CH2Cl2, комн. темп., 1 час
[00694] Этап 1

[00695] К раствору соединения 2 (1,1 г, 10,3 ммоль) в ТГФ (20 мл) добавляли при перемешивании соединение 1 (2,18 г, 10,3 ммоль), трифенилфосфин PPh3 (2,98 г, 11,3 ммоль) и Et3N (1,68 г, 15 ммоль) в атмосфере N2. Реакционную смесь охлаждали до 0°C и добавляли к ней диэтилазодикарбоксилат (DEAD) (1,98 г, 11,3 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали 1 час. Затем гасили водой, экстрагировали этилацетатом (3×25 мл) и промывали объединенный EtOAc экстракт водой и солевым раствором (по 5 мл каждого). Полученный экстракт концентрировали при пониженном давлении и очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 8/2) с получением соединения 3 (2 г, 60,6%) в виде белого твердого продукта.
[00696] Этап 2
[00697] К раствору соединения 3 (2 г, 6,7 ммоль) в CH2Cl2 (25 мл) при перемешивании добавляли м-CPBA (4,13 г, 26,7 ммоль) при температуре -10°C. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали в течение 30 минут. Затем гасили раствором Na2CO3 (10 мл), экстрагировали CH2Cl2 (10 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 4 (1,05 г, 68,8%) в виде желтого масла
[00698] Этап 3
[00699] К раствору соединения 4 (0,75 г, 2,2 ммоль) в CH2Cl2 (7,5 мл) при перемешивании добавляли TFA (3 об.) при температуре 0°C. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали 1 час. Затем концентрировали при пониженном давлении, подщелачивали раствором NaHCO3 (5 мл) и экстрагировали CH2Cl2 (3×10 мл). Объединенный органический экстракт промывали водой (2 мл) и солевым раствором (2 мл). Сушили над Na2SO4, затем фильтровали и концентрировали при пониженном давлении с получением соединения 5 (500 мг, 96%) в виде коричневого твердого продукта.
ПРИМЕР 70
[00700] Получение N-(3-(5-фтор-2-(3-(2-гидроксиэтокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-105
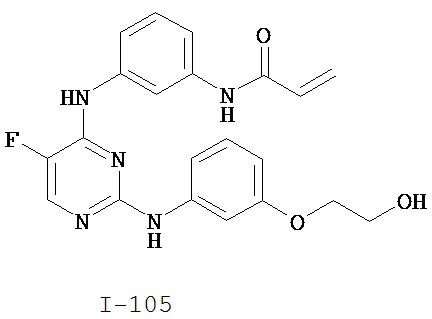
[00701] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(2-гидрокси)этоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,67 (dd, J=4,5 и 10 Гц, 2H), 3,85-3,87 (m, 2H), 4,83 (t, J=5,6 Гц, 1H), 5,75 (bd, J=10 Гц, 1H), 6,25 (d, J=15,6 Гц, 1H), 6,42-6,46 (m, 2H), 7,05 (t, J=8,4 Гц, 1H), 7,26 (d, J=8 Гц, 1H), 7,30 (d, J=8 Гц, 1H), 7,33 (s, 1H), 7,41 (d, J=8 Гц, 1H), 7,57 (d, J=8 Гц, 1H), 7,92 (s, 1H), 8,11 (d, J=3,6 Гц, 1H), 9,11 (s, 1H), 9,42 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 409,9 (M+1).
[00702] Промежуточное соединение 3-(2-гидрокси)этоксианилин получали с использованием схемы, описанной ниже.
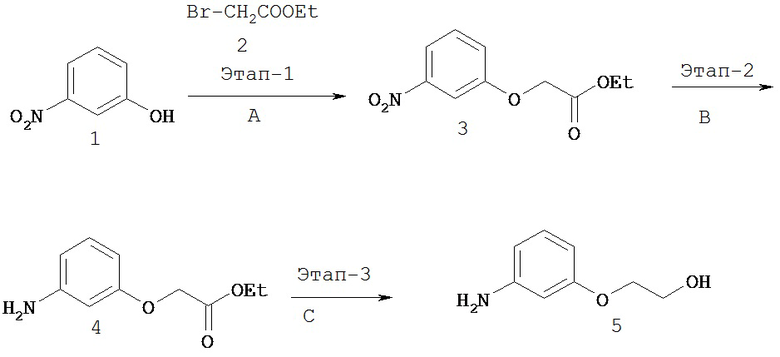
A) K2CO3, ДМФА, 70°C, 12 часов; B) Pd/C, H2, этанол, комн. темп., 10 часов; C) 1 М раствор LAH, ТГФ, -15°C, 45 минут.
[00703] Этап 1
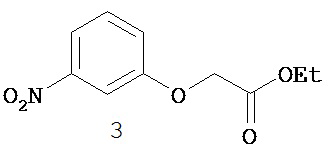
[00704] К раствору соединения 1 (2,0 г, 14,37 ммоль) и K2CO3 (3,95 г, 28,6 ммоль) в сухом ДМФА (15 мл) при перемешивании добавляли соединение 2 (2,88 г, 17,25 ммоль) и реакционную смесь агрели при температуре 70°C в течение 12 часов в атмосфере азота. Реакционную смесь охлаждали, концентрировали при пониженном давлении и осадок обрабатывали этилацетатом (50 мл). Полученную смесь промывали водой (2×10 мл), солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (2,5 г, 78%) в виде светло-коричневой жидкости. Его использовали на следующем этапе без дополнительной очистки.
[00705] Этап 2
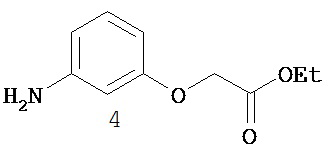
[00706] К раствору соединения 3 (2,0 г, 8,88 ммоль) в этаноле (20 мл) добавляли Pd/C (0,2 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,0 кг) при комнатной температуре в течение 10 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (1,6 г, 94%) в виде светло-коричневой жидкости. Его использовали на следующем этапе без дополнительной очистки.
[00707] Этап 3
[00708] К раствору соединения 4 (1,2 г, 6,14 ммоль) в сухом ТГФ (12 мл) при перемешивании добавляли литийалюминий гидрид (LAH) (9,2 мл, 9,20 ммоль, 1,0 М раствор в ТГФ) при температуре -15°C, в атмосфере N2. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали в течение 45 минут. Реакционную смесь гасили насыщенным раствором аммония хлорида и фильтровали через слой целита® и экстрагировали EtOAc (2×20 мл). Объединенный органический слой промывали солевым раствором (10 мл) и концентрировали при пониженном давлении с получением соединения 5 (0,9 г, 95%) в виде темно-коричневой жидкости. Его использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 71
[00709] Получение N-(3-(5-фтор-2-(3-(2-гидрокси-2-метилпропокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-118
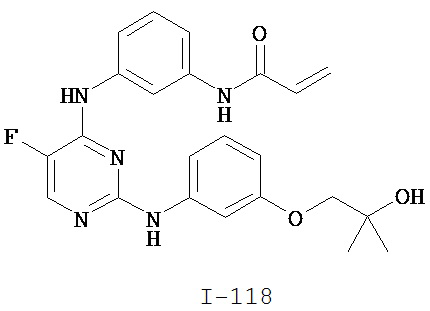
[00710] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
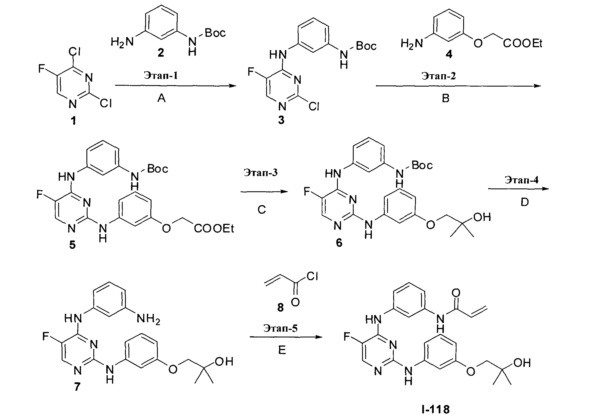
A) DIPEA, н-BuOH, 110°C, 16 часов; B) Pd(OAc)2, BINAP, Cs2CO3, толуол, 100°C, 16 часов; С) MeMgBr (3 М раствор в эфире), ТГФ, -78°C, 3 часа; D) TFA, CH2Cl2, комн. темп., 3 часа;
E) K2CO3, NMP, комн. темп., 45 минут.
[00711] Этап 1
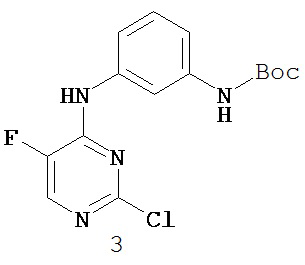
[00712] Соединение 3 получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20.
[00713] Этап 2
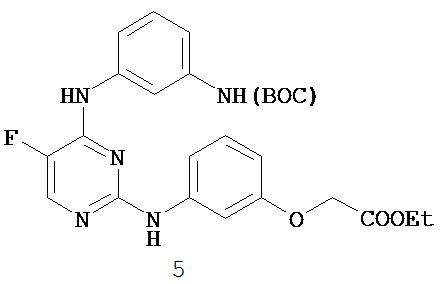
[00714] Раствор соединения 4 (0,7 г, 3,5 ммоль), соединения 3 (1,45 g, 4,3 ммоль), Pd(OAc)2 (0,03 г, 0,14 ммоль), BINAP (0,13 г, 0,21 ммоль) и Cs2CO3 (2,8 г, 8,7 ммоль) в дегазированном толуоле (30 мл) (толуол продували N2 в течение 30 минут) кипятили с обратным холодильником в течение 16 часов при температуре 100°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (15 мл) и промывали водой (10 мл), солевым раствором (10 мл) и сушили над Na2SO4. Фильтровали, и затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 6/4) с получением соединения 5 (700 мг, 40%) в виде белого твердого продукта.
[00715] Этап 3
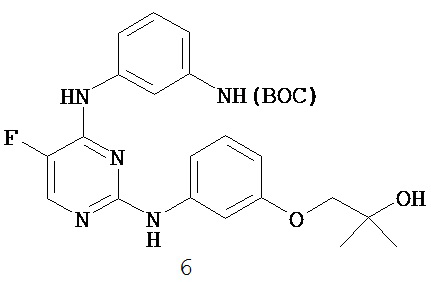
[00716] К раствору соединения 5 (0,4 г, 0,8 ммоль) в ТГФ (10 мл) при перемешивании добавляли метилмагнийбромид (MeMgBr) (3 М раствор в эфире, 1,6 мл, 4,8 ммоль) при температуре -78°C. Реакционную смесь оставляли нагреваться до -30°C в течение 3 часов, после чего снова охлаждали до -78°C и гасили насыщенным раствором аммония хлорида (5 мл). Реакционную смесь фильтровали через целит® и концентрировали фильтрат при пониженном давлении с получением соединения 6 в виде светло-желтого твердого продукта (300 мг, 78%), который использовали на следующем этапе без дополнительной очистки.
[00717] Этап 4
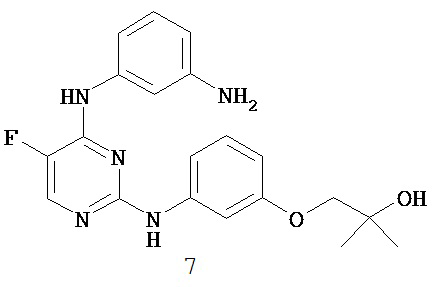
[00718] К раствору соединения 6 (0,2 г, 0,4 ммоль) в CH2Cl2 (7,5 мл) при перемешивании добавляли ТФА (3 об.) при температуре 0°C. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали 3 часа. Затем концентрировали при пониженном давлении, подщелачивали раствором NaHCO3 (5 мл) и экстрагировали CH2Cl2 (3×10 мл). Объединенный органический экстракт промывали водой (2 мл) и солевым раствором (2 мл). Сушили над Na2SO4, фильтровали и затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 6/4) с получением соединения 7 (130 мг, 86%) в виде белого твердого продукта.
[00719] Этап 5

[00720] К раствору соединения 7 (0,08 г, 0,2 ммоль) и калия карбоната (0,11 г, 0,8 ммоль) в NMP (1 мл) при температуре 0°C при перемешивании добавляли соединение 8 (0,023 г, 0,22 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 45 минут. Реакционную смесь по каплям при перемешивании добавляли в холодный 10% раствор NaHCO3 и перемешивали при температуре 0°C в течение 30 минут. Выпавший осадок отделяли фильтрованием на воронке Бюхнера. Затем осадок промывали холодной водой и гексаном, затем растворяли его в смеси метанол/дихлорметан (50:50, 5 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (10 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×5 мл). Объединенный этилацетатный экстракт промывали водой (2 мл), солевым раствором (2 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 5/5) с получением соединения I-118 (35 мг, 38%) в виде белого твердого продукта. 1H-ЯМР (CD3OD) δ ppm: 1,27 (s, 6H), 3,67 (s, 2H), 5,76 (dd, J=2,4 и 9,6 Гц, 1H), 6,34 (dd, J=2 и 16.8 Гц, 1H), 6,42 (dd, J=9,6 и 16,8 Гц, 1H), 6,54 (td, J=2 и 7,2 Гц, 1H), 7,07-7,12 (m, 2H), 7,27-7,31 (m, 2H), 7,40 (d, J=8 Гц, 1H), 7,45 (d, J=8 Гц, 1H), 7,92 (d, J=4 Гц, 1H), 8,07 (d, J=2 Гц, 1H); ЖХ/МС: m/e 436,2 (M-1).
ПРИМЕР 72
[00721] Получение N-(3-(5-фтор-2-(3-(2-морфолино-2-охоэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-110
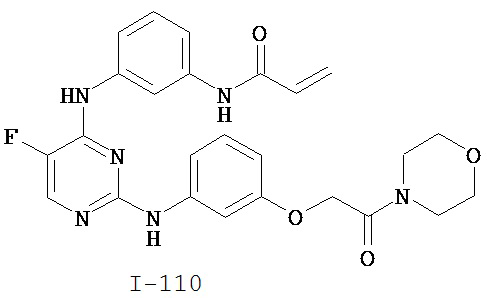
[00722] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-[(3-аминофенокси)ацетил]-морфолина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,4-3,5 (bm, 4H), 3,5-3,6 (bm, 4H), 4,69 (s, 2H), 5,75 (dd, J=1 и 10 Гц, 1H), 6,25 (dd, J=2 и 17,2 Гц, 1H), 6,42-6,49 (m, 2H), 7,05 (t, J=8 Гц, 1H), 7,29 (t, J=8 Гц, 3H), 7,41 (d, J=8 Гц, 1H), 7,57 (d, J=8,8 Гц, 1H), 7,91 (s, 1H), 8,12 (d, J=3,6 Гц, 1H), 9,15 (s, 1H), 9,45 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 491,0 (M-2).
[00723] Промежуточное соединение 4-[(3-аминофенокси)ацетил]-морфолин получали с использованием схемы, описанной ниже.
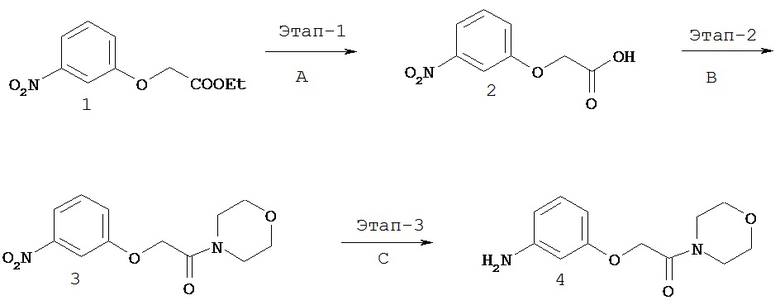
A) LiOH, ТГФ, MeOH, H2O, комн. темп., 4 часа; B) SOCl2, 85°C, морфолин, 0°C, 30 минут; C) Pd/C, H2, этилацетат, комн. темп., 2 часа.
[00724] Этап 1
[00725] К раствору соединения 1 (1,0 г, 4,44 ммоль) в смеси метанол/ТГФ/вода: 5 мл / 5 мл / 5 мл при перемешивании добавляли LiOH моногидрат (0,75 г, 17,76 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 4 часов. Концентрировали при пониженном давлении, остаток обрабатывали водой (10 мл), подкисляли 1,0 N раствором HCl (pH ~5-6) и экстрагировали эфиром (2×20 мл). Объединенный эфирный экстракт промывали водой (20 мл), солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 2 (0,8 г, 91,43%) в виде беловатого твердого продукта.
[00726] Этап 2
[00727] Тионил хлорид (2,0 ml, 27,56 ммоль) добавляли к соединению 2 (0,2 г, 1,014 ммоль) в атмосфере азота. К полученной смеси добавляли каплю ДМФА и перемешивали раствор при температуре 85°C в течение 2 часов. После охлаждения до комнатной температуры тионил хлорид удаляли концентрированием при пониженном давлении. Остаток охлаждали до 0°C, добавляли небольшими порциями морфолин (0,5 г, 5,74 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 30 минут. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре в течение 30 минут, охлаждали и гасили водой (10 мл). Реакционную смесь экстрагировали эфиром (2×10 мл) и промывали объединенный эфирный экстракт водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (0,180 г, 66,67%) в виде желтого твердого продукта.
[00728] Этап 3
[00729] К раствору соединения 3 (0,180 г, 0,676 ммоль) в этилацетате (10 мл) добавляли Pd/C (0,036 г, 20% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,0 кг) при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (0,14 г, 87,67%) в виде беловатого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 73
[00730] Получение N-(3-(5-фтор-2-(3-(1-гидрокси-2-метилпропан-2-илокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-91
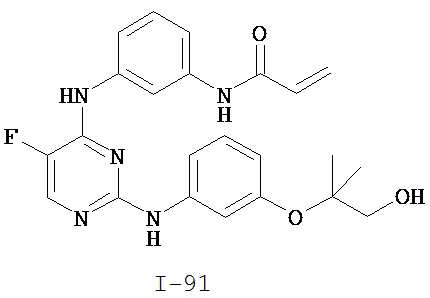
[00731] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(1-гидрокси-2-метилпропан-2-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,16 (s, 6H), 3,32-3,35 (m, 2H), 4,81 (t, J=5,74 Гц, 1H), 5,74 (dd, J=1,84 и 10,04 Гц, 1H), 6,24 (dd, J=1,88 и 16,96 Гц, 1H), 6,44 (dd,J=10,12 и 16,96 Гц, 1H), 6,50 (dd, J=2,12 и 7,96 Гц, 1H), 7,02 (t, J=8,12 Гц, 1H), 7,26-7,30 (m, 2H), 7,41 (d, J=8,16 Гц, 1H), 7,48 (d, J=8,24 Гц, 1H), 7,57 (d, J=8,12 Гц, 1H), 7,92 (s, 1H), 8,09 (d, J=3,6 Гц, 1H), 9,07 (s, 1H), 9,41 (s, 1H), 10,09 (s, 1H); ЖХ/МС: m/e 438,0 (M+1).
[00732] Промежуточное соединение 3-(1-гидрокси-2-метилпропан-2-илокси)анилин получали с использованием схемы, описанной ниже.
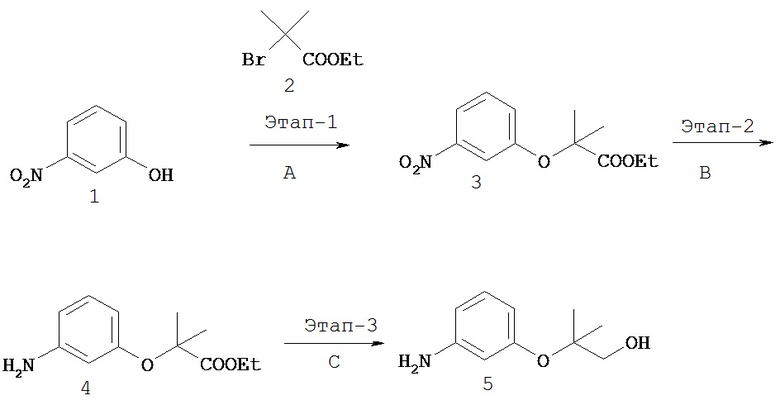
A) K2CO3, ДМФА, 16 часов, комн. темп.; B) Pd/C, этанол, 5 часов, комн. темп.; C) LAH (1 М раствор в ТГФ), 0°C до комн. темп., 2 часа.
[00733] Этап 1
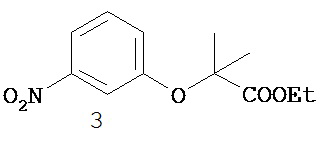
[00734] К раствору соединения 1 (0,5 г, 3,59 ммоль) и соединения 2 (0,84 г, 4,316 ммоль) в ДМФА добавляли K2CO3 (0,99 г, 7,194 ммоль). Помешивали при комнатной температуре в течение 16 часов, затем реакционную смесь концентрировали при пониженном давлении. Остаток обрабатывали этилацетатом (10 мл) и промывали 10% раствором NaOH (5 мл), водой (5 мл) и солевым раствором (5 мл). Сушили над Na2SO4, после чего концентрировали при пониженном давлении с получением соединения 3 в виде красно-коричневой жидкости (0,5 г, 52%).
[00735] Этап 2
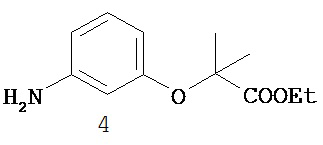
[00736] К раствору соединения 3 (0,45 г, 1,77 ммоль) в этаноле (5 мл) при перемешивании добавляли Pd/C (45 мг), после чего реакционную смесь гидрогенезировали (давление в реакторе ~1,5 кг) в течение 5 часов. Реакционную смесь пропускали через слой целита® и концентрировали в вакууме с получением соединения 4 (0,35 г, 88%) в виде бесцветной жидкости.
[00737] Этап 3
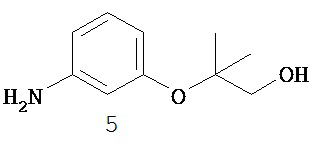
[00738] К раствору соединения 4 (0,25 г, 1,15 ммоль) в ТГФ (5 мл) в атмосфере N2 при перемешивании добавляли LAH (3,45 мл, 3,35 ммоль, 1 М раствор в ТГФ) при температуре 0°C. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали при этой температуре в течение 2 часов. Затем ее осторожно гасили насыщенным раствором Na2SO4 (2 мл), фильтровали и концентрировали. Полученный остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 6/4) с получением соединения 5 (0,15 g 71%) в виде светло-коричневого твердого продукта.
ПРИМЕР 74
[00739] Получение N-(3-(5-фтор-2-(3-(2-(2-оксопирролидин-1-ил)этокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-164
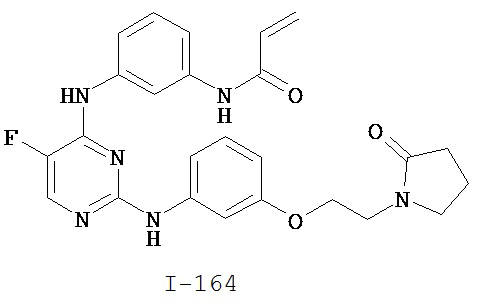
[00740] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(2-(2-оксопирролидин-1-ил)этокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,89 (quin, J=7,6 Гц, 2H), 2,21 (t, J=8 Гц, 2H), 3,40 (t, J=6,8 Гц, 2H), 3,50 (t, J=5,6 Гц, 2H), 3,93 (t, J=5,2 Гц, 2H), 5,75 (dd, J=2 и 10 Гц, 1H), 6,25 (dd, J=2 и 16,84 Гц, 1H), 6,42-6,49 (m, 2H), 7,05 (t, J=8,4 Гц, 1H), 7,28 (t, J=8 Гц, 2H), 7,33 (s, 1H), 7,43 (d, J=8 Гц, 1H), 7,57 (d, J=8 Гц, 1H), 7,92 (s, 1H), 8,12 (d, J=3,6 Гц, 1H), 9,15 (s, 1H), 9,45 (s, 1H), 10,13 (s, 1H); ЖХ/МС: m/e 475 (M-2).
ПРИМЕР 75
[00741] Получение N-(3-(5-фтор-2-(6-(3-(метилсульфонил)пропокси)пиридин-3-ил-амино)пиримидин-4-иламино)фенил)акриламида I-80
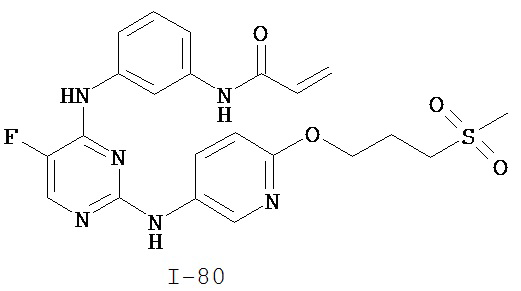
[00742] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(3-(метилсульфонил)пропокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,05-2,20 (m, 2H), 3,00 (s, 3H), 3,24 (t, J=7,46 Гц, 2H), 4,27 (t, J=6,32 Гц, 2H), 5.75 (dd, J=1,76 и 10 Гц, 1H), 6,25 (dd, J=1,8 и 16,96 Гц, 1H), 6,45 (dd, J=10,04 и 16,92 Гц, 1H), 6,65 (d, J=8,88 Гц, 1H), 7,27 (t, J=8,08 Гц, 1H), 7,39 (d, J=8,08 Гц, 1H), 7,49 (d, J=8 Гц, 1H), 7,92 (s, 1H), 7,99 (dd,J=2,6 и 8,76 Гц, 1H), 8,07 (d, J=3,64 Гц, 1H),8,31 (d, J=2,28 Гц, 1H), 9,10 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 486,9 (M+1).
ПРИМЕР 76
[00743] Получение N-(3-(2-(6-циклобутоксипиридин-3-иламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-79
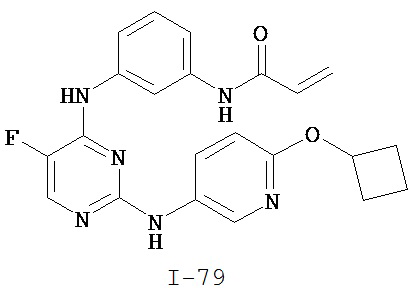
[00744] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-циклобутоксипиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,57-1,66 (m, 1H), 1,71-1,78 (m, 1H), 1,94-2,04 (m, 2H), 2,32-2,38 (m, 2H), 4,95-5,05 (m, 1H), 5,73-5,76 (m, 1H), 6,25 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 6,58 (d, J=8,84 Гц, 1H), 7,25 (t, J=8,04 Гц, 1H), 7,39 (d, J=7,84 Гц, 1H), 7,45-7,55 (m, 1H), 7,90 (s, 1H), 7,94 (dd, J=2,72 и 8,88 Гц, 1H), 8,06 (d, J=3,68 Гц, 1H), 8,27 (d, J=2,6 Гц, 1H), 9,04 (s, 1H), 9,41 (s, 1H), 10,1 (s, 1H); ЖХ/МС: m/e 421,2 (M+1).
ПРИМЕР 77
[00745] Получение N-(3-(5-фтор-2-(6-((1-метилпиперидин-4-ил)метокси)пиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-78
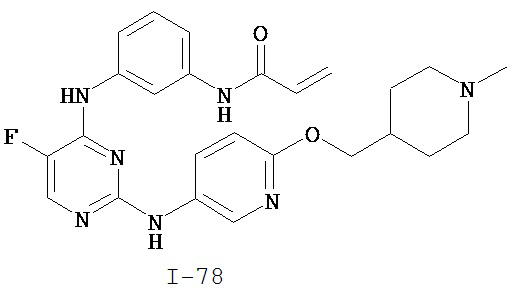
[00746] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(1-метилпиперидин-4-ил)метоксипиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,23-1,27 (m, 3H), 1,65-1,69 (m, 2H), 1,83 (t, J=11,72 Гц, 2H), 2,14 (s, 3H), 2,75 (d, J=11,24 Гц, 2H), 4,0 (d, J=6,2 Гц, 2H), 5,74 (dd, J=2 и 10,04 Гц, 1H), 6,24 (dd, J=1,96 и 16,92 Гц. 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 6,62 (d, J=8,88 Гц, 1H), 7,27 (t, J=8,08 Гц, 1H), 7,40 (d, J=8,88 Гц, 1H), 7,47 (d, J=7,6 Гц, 1H), 7,92 (s, 1H), 7,97 (dd, J=2,76 и 8,92 Гц, 1H), 8,07 (d, J=3,72 Гц, 1H), 8,28 (d, J=2,64 Гц, 1H), 9,07 (s, 1H), 9,41 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 478,0 (M+1).
ПРИМЕР 77
[00747] Получение N-(3-(5-фтор-2-(4-хлоро-3-метоксифениламино)пиримидин-4-ил-амино)фенил)акриламида I-74
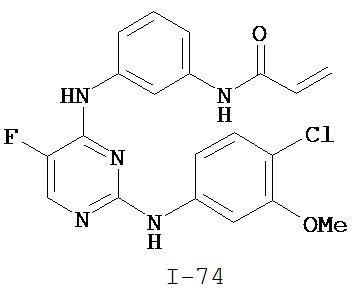
[00748] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,64 (s, 3H), 5,74 (dd, J=2,12 и 9,96 Гц, 1H), 6,24 (dd, J=1,84 и 17 Гц, 1H), 6,44 (dd, J=10 и 16,84 Гц, 1H), 7,13 (s, 1H), 7,28 (t, J=8,08 Гц, 1H), 7,36 (dd, J=2,12 и 8,68 Гц, 1H), 7,40 (d, J=7,64 Гц, 1H), 7,45 (d, J=2,04 Гц, 1H), 7,50 (d, J=8,12 Гц, 1H), 7,91 (s, 1H), 8,13 (d, J=3,52 Гц, 1H), 9,28 (s, 1H), 9,48 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 414,0 (M+1).
ПРИМЕР 78
[00749] Получение N-(3-(5-фтор-2-(4-(2-гидрокси-2-метилпропокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-73
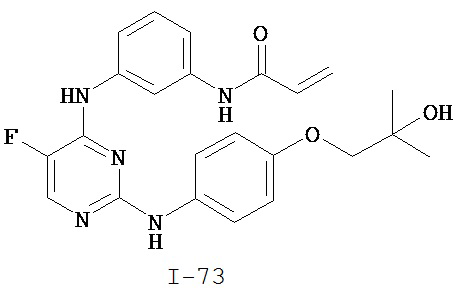
[00750] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(2-гидрокси-2-метилпропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (MeOD) δ ppm: 1,33 (s, 6H), 3,75 (s, 2H), 5,80 (dd, J=3,28 и 10,64 Гц, 1H), 6,39 (dd, J=2,24 и 16,96 Гц, 1H), 6,47 (dd, J=9,6 и 16,96 Гц, 1H), 6,84 (td, J=3,48 и 9,0 Гц, 2H), 7,30 (t, J=7,72 Гц, 1H), 7,41-7,50 (m, 4H), 7,89 (d, J=3,88 Гц, 1H), 8,09 (s, 1H); ЖХ/МС: m/e 438 (M+1).
ПРИМЕР 79
[00751] Получение N-(3-(5-фтор-2-(6-(1,1-диоксидотиоморфолин-4-ил)-пиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-72
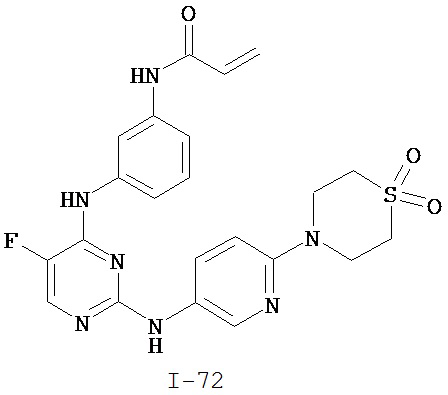
[00752] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(1,1-диоксидотиоморфолин -4-ил)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,00-3,15 (bm, 4H), 3,90-4,10 (bm, 4H), 5,76 (dd, J=1,64 и 10,04 Гц, 1H), 6,26 (dd, J=1,72 и 16,92 Гц, 1H), 6,46 (dd, J=10,04 и 16,88 Гц, 1H), 6,87 (d, J=9,04 Гц, 1H), 7,20 (t, J=8,04 Гц, 1H), 7,39 (d, J=8,24 Гц, 1H), 7,50 (d, J=7,68 Гц, 1H), 7,90-7,93 (m, 2H), 8,06 (d, J=3,6 Гц, 1H), 8,35 (d, J=2,4 Гц, 1H), 9,0 (s, 1H), 9,40 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 484 (M+1).
ПРИМЕР 80
[00753] Получение N-(3-(5-фтор-2-(6-(2-(2-оксопирролидин-1-ил)этокси)пиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-70
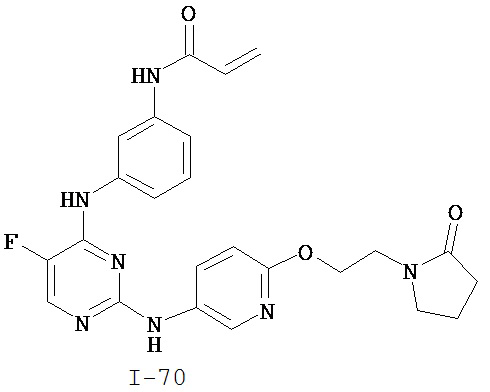
[00754] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(2-(2-оксопирролидин-1-ил)этокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,90 (quintet, J=7,6 Гц, 2H), 2,19 (t, J=8,04 Гц, 2H), 3,41 (t, J=6,88 Гц, 2H), 3,50 (t, J=5,36 Гц, 2H), 4,27 (t. J=5,48 Гц, 2H), 5,75 (d, J=10,92 Гц, 1H), 6,25 (d, J=17,04 Гц, 1H), 6,45 (dd, J=10,12 и 16,84 Гц, 1H), 6,63 (d, J=8,96 Гц, 1H), 7,27 (t, J=8,04 Гц, 1H), 7,39 (d, J=7,56 Гц, 1H), 7,47 (d, J=7,32 Гц, 1H), 7,92 (s, 1H), 7,98 (dd, J=2,36 и 8,84 Гц, 1H), 8,08 (d, J=3,3 Гц, 1H), 8,31 (d, J=2,24 Гц, 1H), 9,10 (s, 1H), 9,44 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 478,0 (M+1).
ПРИМЕР 81
[00755] Получение (R)-N-(3-(5-фтор-2-(6-(тетрагидрофуран-3-илокси)пиридин-3-ил-амино)пиримидин-4-иламино)фенил)акриламида I-69
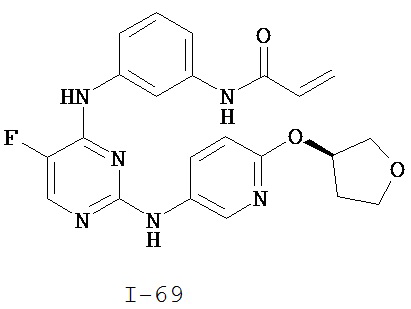
[00756] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-3-амино-6-(тетрагидрофуран-3-илокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,91-1,99 (m, 1H), 2,14-2,23 (m, 1H), 3,70-3,77 (m, 2H), 3,81 (dd, J=7,90 и 15,48 Гц, 1H), 3,88 (dd, J=4,76 и 10,16 Гц, 1H), 5,38 (t, J=4,68 Гц, 1H), 5,75 (dd,J=1,72 и 10,08 Гц, 1H), 6,24 (d, J=16,92 Гц, 1H), 6,45 (dd, J=10,16 и 16,88 Гц, 1H), 6,63 (d, J=8,84 Гц, 1H), 7,26 (d, J=7,64 Гц, 1H), 7,39 (d, J=7,92 Гц, 1H), 7,46 (d, J=7,64 Гц, 1H), 7,92 (s, 1H), 7,97 (dd, J=2,6 и 8,83 Гц, 1H), 8,07 (d, J=3,6 Гц, 1H), 8,32 (d, J=2,48 Гц, 1H), 9,08 (s, 1H), 9,42 (s, 1H), 10,10 (s, 1H); ЖХ/МС: m/e 437,2 (M+1).
ПРИМЕР 82
[00757] Получение N-(3-(2-(4-хлор-3-(3-(метилсульфонил)пропокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-55
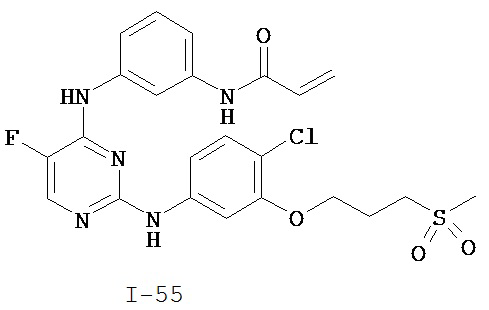
[00758] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-(3-(метилсульфонил)пропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,07-2,14 (m, 2H), 3,0 (s, 3H), 3,22 (t, J=7,72 Гц, 2H), 3,90 (t, J=6,08 Гц, 2H), 5,75 (dd, J=1,88 и 10,08 Гц, 1H), 6,24 (dd, J=1,84 и 16,92 Гц, 1H), 6,44 (dd, J=10,12 и 16,96 Гц, 1H), 7,15 (d, J=8,72 Гц, 1H), 7,30 (t, J=8,08 Гц, 1H), 7,35 (dd, J=2,2 и 8,8 Гц, 1H), 7,43 (d, J=8 Гц, 1H), 7,45-7,55 (m, 2H), 7,91 (s, 1H), 8,14 (d, J=3,56 Гц, 1H), 9,31 (s, 1H), 9,49 (s, 1H), 10,14 (s, 1H); ЖХ/МС: m/e 520,0 (M+1).
ПРИМЕР 83
[00759] Получение N-(3-(2-(3-фтор-4-(2-метоксиэтокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-96
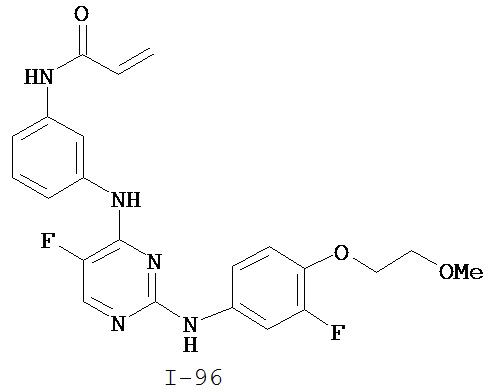
[00760] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО, 400 МГц) δ 10,13 (s, 1H), 9,43 (s, 1H), 9,18 (s, 1H), 8,09 (d, 1H, J=3,68 Гц), 7,92 (s, 1H), 7,65 (dd, 1H, J=2,3, 14,2 Гц), 7,47 (d, 1H, J=8,24 Гц), 7,41 (d, 1H, J=8,28 Гц), 7,27 (t, 2H, J=8,0 Гц), 6,94 (t, 1H, J=9,4 Гц), 6,44 (dd, 1H, J=16,96, 10,1 Гц), 6,23 (dd, 1H, J=1,84, 16,96 Гц), 5,73 (dd, 1H, J=l,4, 10,1 Гц), 4,04 (m, 2H), 3,61 (m, 2H), 3,29 (s, 3H), MS m/z: 442,0 (M+H+).
ПРИМЕР 84
[00761] Получение N-(3-(2-(4-трет-бутоксикарбонил-2,3-дигидробензо[1,4]оксазин-6-ил)амино-5-фторпиримидин-4-иламино)фенил)акриламида I-175
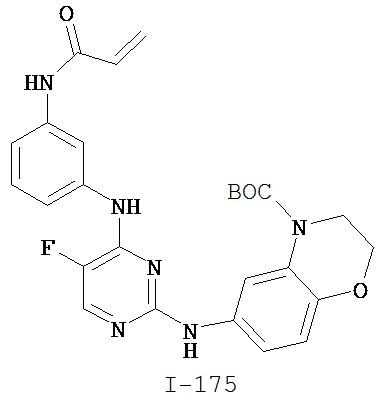
[00762] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-амино-4-трет-бутоксикарбонил-2,3-дигидробензо[1,4]оксазина вместо соединения 4 на Этапе 2. 507,1 (M+H+).
ПРИМЕР 85
[00763] Получение N-(3-(2-(4-трет-бутоксикарбонил-2,3-дигидробензо[1,4]оксазин-6-ил)амино-5-фторпиримидин-4-иламино)фенил)акриламида I-174
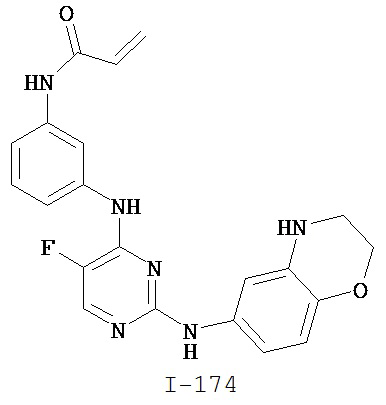
[00764] Указанное в названии соединение получали обработкой продукта из Примера 83 4 N раствором HCl в диоксане при комнатной температуре в течение 1 часа, после чего удаляли растворители в вакууме. MS m/z: 407,1 (M+H+).
ПРИМЕР 86
[00765] Получение N-(3-(2-(4-трифторацетил-2,3-дигидробензо[1,4]оксазин-6-ил)-амино-5-фторпиримидин-4-иламино)фенил)акриламида I-143
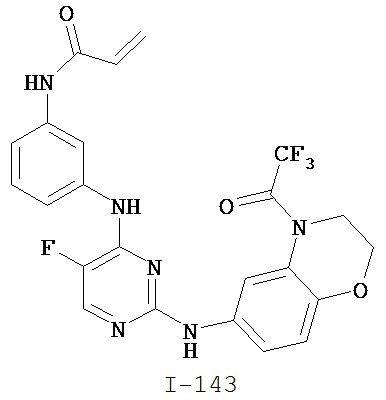
[00766] Указанное в названии соединение получали обработкой продукта из Примера 85 трифторуксусным ангидридом при комнатной температуре в течение 1 часа, после чего удаляли растворители в вакууме. MS m/z: 503,1 (M+H+).
ПРИМЕР 87
[00767] Получение N-(3-(2-(4-метилсульфонил-2,3-дигидробензо[1,4]оксазин-6-ил)-амино-5-фторпиримидин-4-иламино)фенил)акриламида I-140
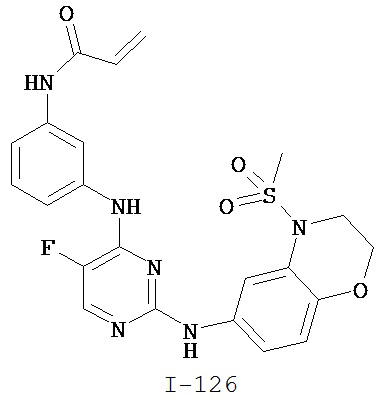
[00768] Указанное в названии соединение получали обработкой продукта из Примера 85 метилсульфонилхлоридом и Et3N в CH2Cl2 при температуре 0°C в течение 30 минут, после чего промывали водным NaHCO3, сушили над Na2SO4 и удаляли растворители в вакууме. MS m/z: 485,1 (M+H+).
ПРИМЕР 88
[00769] Получение N-[-(3-(2-(4-метил-2,3-дигидробензо[1,4]оксазин-6-ил)амино-5-фтор-пиримидин-4-иламино)фенил)акриламида I-126
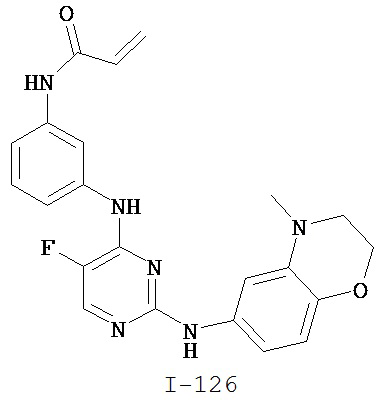
[00770] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-амино-4-метил-2,3-дигидробензо[1,4]оксазина вместо соединения 4 на Этапе 2 MS m/z: 421,1 (M+H+).
ПРИМЕР 89
[00771] Получение N-(3-(2-(4-ацетил-2,3-дигидробензо[1,4]оксазин-6-ил)амино-5-фторпиримидин-4-иламино)фенил)акриламида I-112
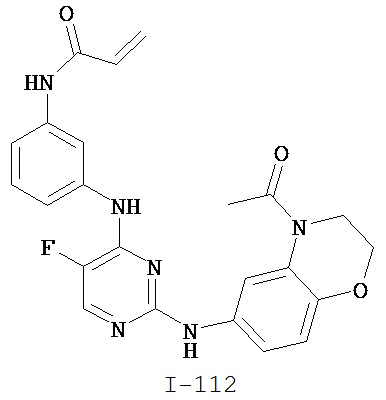
[00772] Указанное в названии соединение получали обработкой продукта из Примера 85 уксусным ангидридом и пиридином в CH2Cl2 при комнатной температуре в течение 1 часа, после чего промывали 1 N раствором HCl, после чего водным NaHCO3, сушили над Na2SO4 и удаляли растворители в вакууме. MS m/z: 449,1 (M+H+).
ПРИМЕР 90
[00773] Получение N-(3-(2-(1-трет-бутоксикарбонил-1H-индазол-5-ил)амино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-151
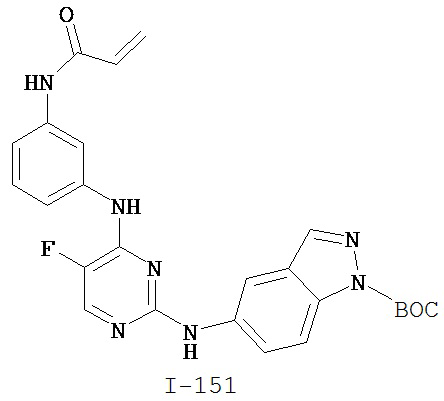
[00774] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 5-амино-N-(трет-бутоксикарбонил)-1H-индазола вместо соединения 4 на Этапе 2 MS m/z: 490,2 (M+H+).
ПРИМЕР 91
[00775] Получение N-(3-(2-(1H-индазол-5-ил)амино)-5-фторпиримидин-4-иламино)-фенил)акриламида I-156
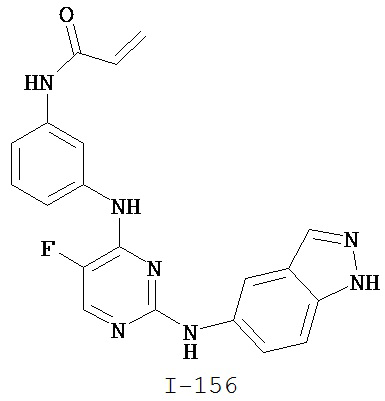
[00776] Указанное в названии соединение получали обработкой продукта из Примера 90 4N раствором HCl в диоксане при комнатной температуре в течение 1 часа, после чего удаляли растворители в вакууме. MS m/z: 390,1 (M+H+).
ПРИМЕР 92
[00777] Получение N-(3-(2-(1-метил-1H-индазол-5-ил)амино)-5-фторпиримидин-4-ил-амино)фенил)акриламида I-155
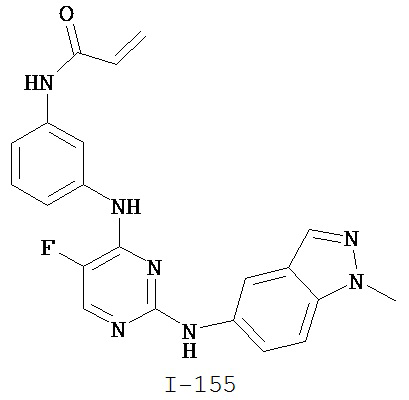
[00778] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 5-амино-1-метил-1H-индазола вместо соединения 4 на Этапе 2 MS m/z: 404,2 (M+H+).
ПРИМЕР 93
[00779] Получение N-(3-(5-фтор-2-(3-сульфамоилфениламино)пиримидин-4-иламино)-фенил)акриламида I-160
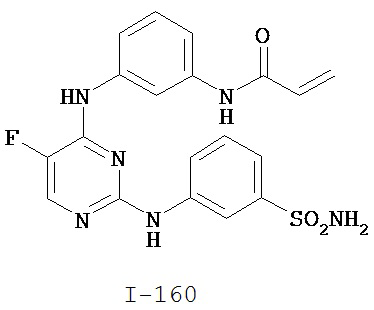
[00780] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
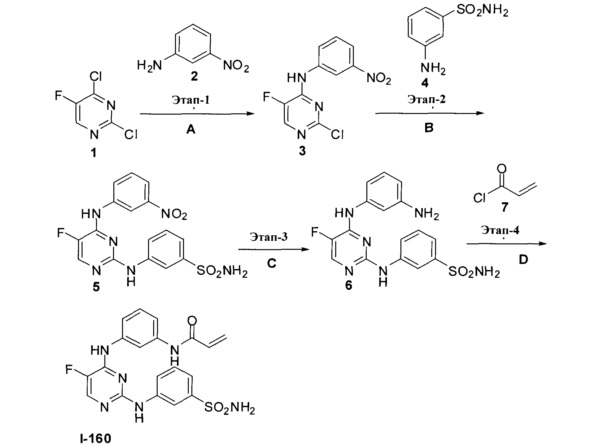
A) DIPEA, н-бутанол, 120°C, 2 часа, реактор высокого давления; B) АсОН, этанол, 90°C, 16 часов; C) Pd/C, N2, этанол, комн. темп., 3 часа; D) акрилоилхлорид, K2CO3, NMP, 0°C, 60 минут.
[00781] Этап 1
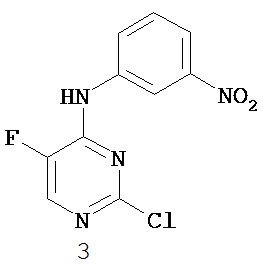
[00782] В реактор высокого давления помещали соединения 2 (10,0 г, 0,072 моль), 1 (24,1 г, 0,145 моль), н-BuOH (100 мл) и DIPEA (13,9 г, 0,108 моль) и перемешивали содержимое при температуре 120°C в течение 2 часов. Реакционную смесь охлаждали, выпавший осадок отфильтровывали на воронке Бюхнера, промывали осадок холодным гексаном и сушили с получением соединения 3 (12,5 г, 64%) в виде желтого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00783] Этап 2
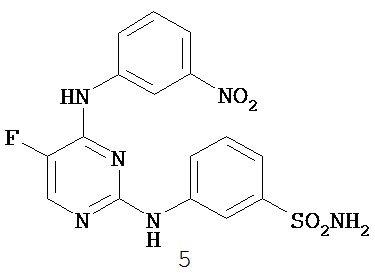
[00784] К раствору соединения 3 (0,25 г, 0,93 ммоль) и соединения 4 (0,16 г, 0,93 ммоль) в этаноле (2,5 мл) добавляли ледяную уксусную кислоту (0,083 г, 1,39 ммоль) и перемешивали реакционную смесь в реакторе высокого давления в течение 16 часов при температуре 90°C.Реакционную смесь охлаждали, выпппавший осадок отфильтровывали на воронке Бюхнера, промывали осадок холодным эфиром и сушили с получением соединения 5 (0,245 г, 65%) в виде коричневого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00785] Этап 3
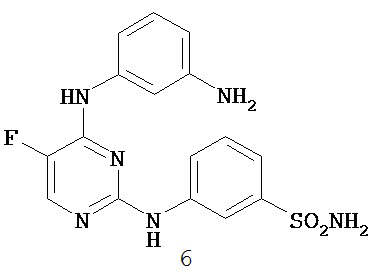
[00786] К раствору соединения 5 (0,1 г, 0,24 ммоль) в метаноле (4 мл) добавляли 10% Pd/C (0,2 г, 20% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 3 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 6 (0,076 г, 82%) в виде коричневой жидкости. Его использовали на следующем этапе без дополнительной очистки.
[00787] Этап 4
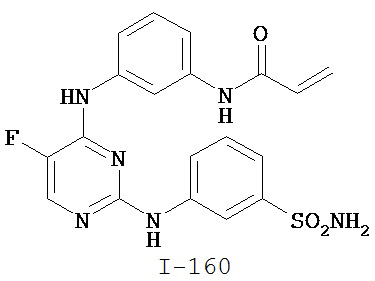
[00788] К раствору соединения 6 (0,07 г, 0,18 ммоль) и калия карбоната (0,051 г, 0,37 ммоль) в NMP (0,7 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,021 г, 0,23 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 60 минут. Реакционную смесь по каплям при перемешивании добавляли к холодному 10% раствору NaHCO3 и выдерживали при температуре 0°C в течение 30 минут. Выпавший осадок отфильтровывали на воронке Бюхнера. Затем осадок промывали холодной водой и гексаном и растворяли его в смеси метанол/дихлорметан (50:50, 5 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (10 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×10 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Сырой остаток далее очищали методом колоночной хроматографии (Al2O3, MeOH/хлороформ): 3/97) с получением соединения I-160 (0,028 г, 35%) в виде светло-коричневого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 5,75 (dd, J=1,68 и 10,24 Гц, 1H), 6,25 (dd, J=1,8 и 17 Гц, 1H), 6,43 (dd, J=10 и 16,92 Гц, 1H), 7,27-7,35 (т, 5Н), 7,40 (d, J=8 Гц, 1H), 7,60 (d, J=8,16 Гц, 1H), 7,92 (s, 1H), 7,95-8,05 (т, 1H), 8,07 (s, 1H), 8,14 (d, J=3,52 Гц, 1H), 9,50 (s, 2H), 10,12 (s, 1H); ЖХ/МС: m/e 428,9 (M+1).
ПРИМЕР 94
[00789] Получение N-(3-(5-циано-2-(4-(2-метоксиэтокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-109
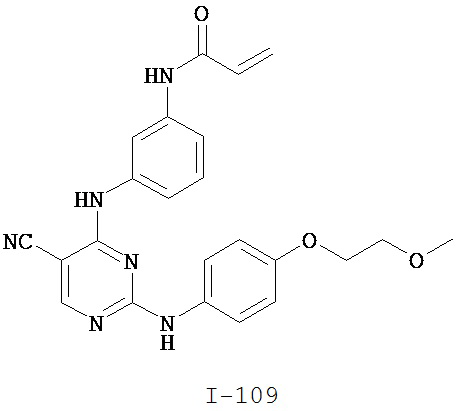
[00790] Указанное в названии соединение получали с использованием этапов и промежуточных соединений, описанных ниже.
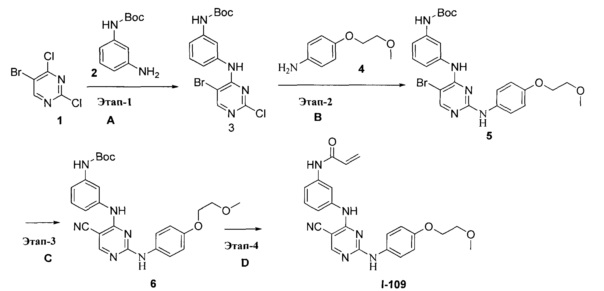
A) DMA, K2CO3, комн. темп., 10 часов, реактор высокого давления; B) n-TsOH, диоксан, 100°C, 2 часа; C) Zn(CN)2, Ph3P, ДМФА, 120°C, 12 часов; D) 4N раствор HCl, диоксан, комн. темп., 1 час; затем - акрилоилхлорид, Et3N, ДХМ, -10°C, 10 минут.
[00791] Этап 1
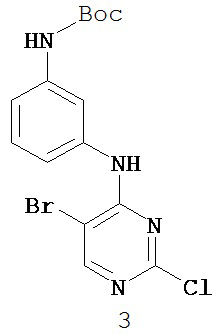
[00792] К раствору 5-бром-2,4-дихлорпиримидина (0,45 г, 2,0 ммоль) и трет-бутил-3-аминофенилкарбамата (0,44 г, 2,1 ммоль) в DMA (3 мл) добавляли K2CO3 (0,55 г, 4,0 ммоль). Суспензию перемешивали в течение 10 часов. Добавляли воду (10 мл) и выпавший осадок отфильтровывали. Осадок промывали эфиром и сушили с получением 0,8 г соединения 3. MS: m/e 399,1, 401,2 (M+1).
[00793] Этап 2
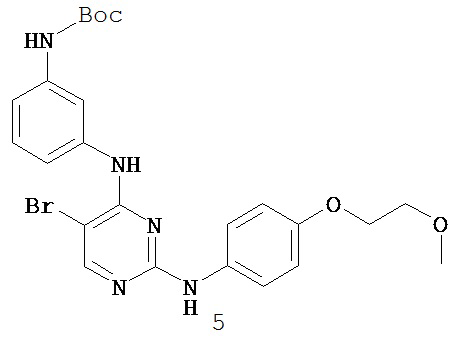
[00794] К раствору соединения 3 (400 мг, 1,0 ммоль) и 4-(2-метоксиэтокси)анилина (0,2 г, 1,2 ммоль) в 8 мл диоксана добавляли моногидрат n-TsOH (0,15 г, 0,8 ммоль). Смесь перемешивали при температуре 100°C в течение 2 часов. Растворитель отгоняли. Остаток растворяли в 30 мл этилацетата и промывали водным раствором NaHCO3, водой и солевым раствором. Органический слой отделяли и сушили над Na2SO4. После удаления растворителя сырой продукт очищали методом хроматографии на силикагеле (гексан:EtOAc=1:1) с получением 0,40 г указанного в названии соединения: MS m/z: 530,1,532,1 (M+H)+.
[00795] Этап 3
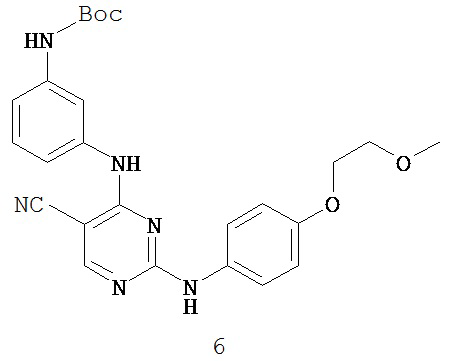
[00796] К суспензии Zn(CN)2 (0,24 г, 2,0 ммоль), Pd(PPh3)4 (60 мг, 0,05 ммоль) в 3 мл ДМФА добавляли к соединению 5 (0,25 г, 0,5 ммоль). Реакционную смесь дегазировали и плотно закрывали в атмосфере аргона, после чего нагревали до 120°C в течение 12 часов. Добавляли воду (10 мл) и выпавший осадок отфильтровывали. Осадок промывали эфиром и сушили с получением 0,2 г соединения 6. MS: m/e 477,1 (M+1).
[00797] Этап 4
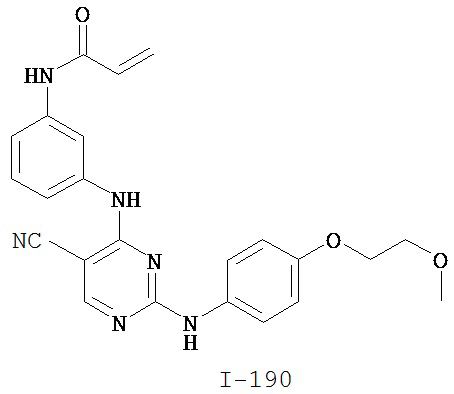
[00798] Соединение 6 (0,10 г, 0,21 ммоль) растворяли в 4 N растворе HCl (2 мл) в диоксане. Смесь перемешивали при комнатной температуре в течение 1 часа. После удаления растворителей приливали 5 мл ДХМ, после чего упаривали до сухого остатка. Процедуру добавления ДХМ и упаривания повторяли три раза с получением твердого остатка, который сразу же использовали на следующем этапе: MS m/z: 377,0 (M+H+).
[00799] К раствору полученного ранее промежуточного соединения добавляли триэтиламин (0,1 ml, 0,8 ммоль) в 2 мл дихлорметана, затем добавляли акрилоилхлорид (19 мг, 0,21 ммоль) при температуре -10°C. Реакционную смесь перемешивали в течение 10 минут при температуре -10°C и гасили водным раствором NaHCO3. Добавляли этилацетат (10 мл) и промывали водным раствором NaHCO3, водой и солевым раствором.: Органический слой отделяли и сушили над Na2SO4. После удаления растворителя сырой продукт очищали методом хроматографии на силикагеле (гексан:EtOAc=1:2) с получением 30 мг указанного в названии соединения. MS m/z: 431,1 (M+H+).
ПРИМЕР 95
[00800] Получение N-(3-(5-циано-2-(6-метоксипиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-173
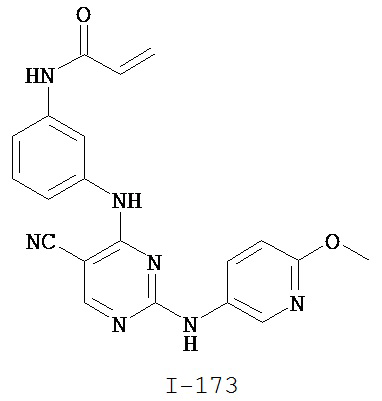
[00801] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 94, с использованием 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS m/z: 388,2 (M+H+).
ПРИМЕР 96
[00802] Получение N-(3-(5-циклопропил-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-139
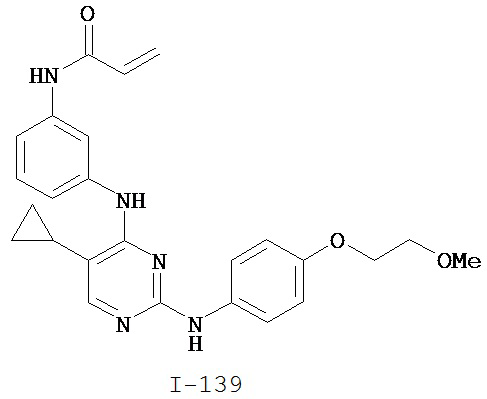
[00803] Указанное в названии соединение получали с использованием этапов и промежуточных соединений, описанных ниже.
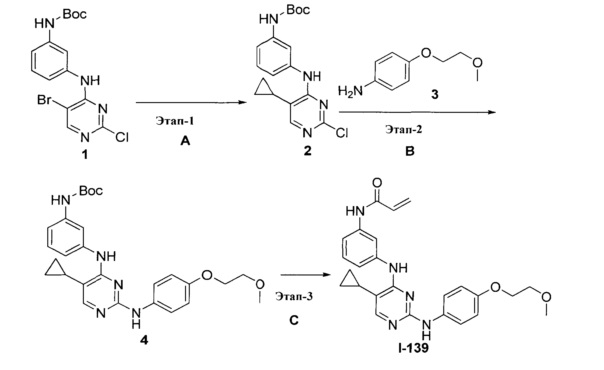
A) калия циклопропилтрифторборат, Pd(OAc)2, Xantphos, Cs2(CO3), толуол, 100°C, 12 часов; B) n-TsOH, диоксан, 100°C, 2 часа; C) Zn(CN)2, Ph3P, ДМФА, 120°C, 12 часов; D) 4N HCl, диоксан, комн. темп., 1 час; затем - акрилоилхлорид, Et3N ДХМ, -10°C, 10 минут.
[00804] Этап 1
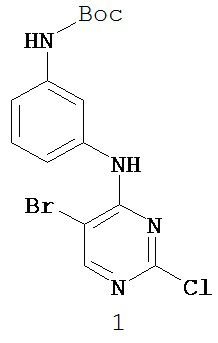
[00805] Калия циклопропилтрифторборат (0,4 г, 3,0 ммоль), соединение 1 (1,0 г, 2,5 ммоль), палладия ацетат (34 мг, 0,15 ммоль), 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos) (0,17 г, 0,3 ммоль) и Cs2CO3 (2,4 г, 7,5 ммоль) суспендировали в 25 мл толуола и 5 мл воды. Реакционную смесь дегазировали и плотно закрывали в атмосфере аргона, после чего нагревали до 100°C в течение 12 часов. Добавляли 50 мл этилацетата и промывали водным раствором NaHCO3, водой и солевым раствором. Органический слой отделяли и сушили над Na2SO4. После удаления растворителя сырой продукт очищали методом хроматографии на силикагеле (гексан:EtOAc=3:2) с получением 0,54 г указанного в названии соединения 2: MS m/z: 361,2 (M+H+).
[00806] Этап 2
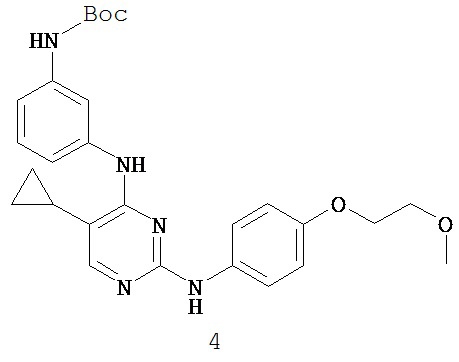
[00807] Соединение 4 получали из соединений 2 и 3 согласно процедуре, описанной в Этапе 2 Примера 94. MS m/z: 492,2 (M+H+).
[00808] Этап 3
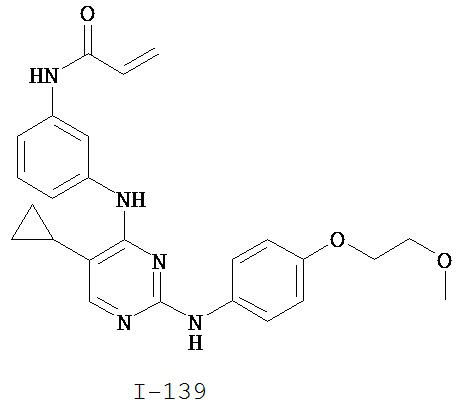
[00809] Указанное в названии соединение I-139 получали из соединения 4 соглансо процедуре, описанной в Этапе 4 Примера 94. MS m/z: 446,1 (M+H+).
ПРИМЕР 97
[00810] Получение N-(3-(5-циклопропил-2-(6-метоксипиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-167
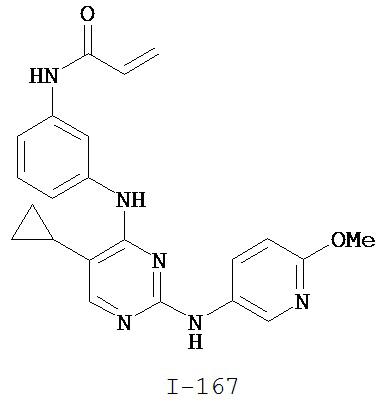
[00811] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 96, с использованием 3-амино-6-метоксипиридина вместо соединения 3 на Этапе 2 MS m/z: 403,2 (M+H+).
ПРИМЕР 98
[00812] Получение N-(3-(5-фтор-2-(3-(3-(2-оксопирролидин-1-ил)пропокси)фениламино)пиримидин-4-илокси)фенил)акриламида I-162
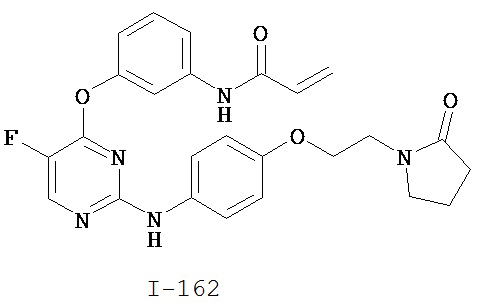
[00813] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
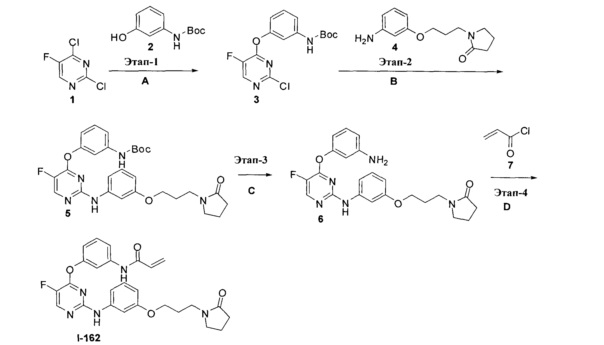
A) DIPEA, н-BuOH, 110°C, 16 часов; B) Pd(OAc)2, BINAP, Cs2CO3, толуол, 100°C, 16 часов; C) TFA, CH2Cl2, комн. темп., 2 часа; D) K2CO3, NMP, комн. темп., 45 минут.
[00814] Этап 1
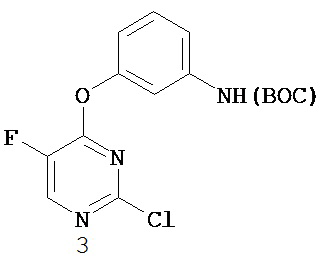
[00815] В реактор высокого давления помещали соединение 2 (2,0 г, 9,61 ммоль), соединение 1 (3,21 г, 19,23 ммоль), н-BuOH (30 мл) и DIPEA (1,86 г, 14,42 ммоль), после чего содержимое перемешивали при температуре 110°C в течение 16 часов. Реакционную смесь охлаждали, концентрировали при пониженном давлении, гасили водой (30 мл), экстрагировали этилацетатом (2×30 мл). Объединенный этилацетатный экстракт промывали водой (20 мл), солевым раствором (20 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением остатка. Затем растирали с гексаном с получением соединения 3 (2,5 г, 96%) в виде желтого твердого продукта.
[00816] Этап 2
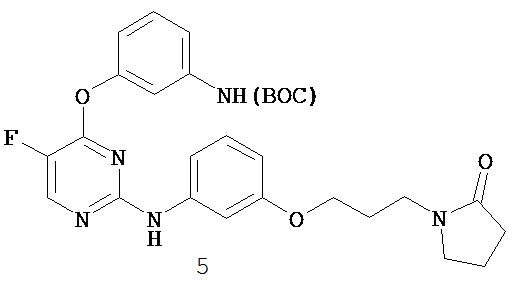
[00817] К раствору соединения 3 (0,36 г, 1,1 ммоль) в толуоле (15 мл) добавляли 3-(3-(2-оксопирролидин-1-ил)пропоксианилин 4 (0,25 г, 1,1 ммоль), а затем BINAP (0,031 г, 0,05 ммоль), палладия ацетат (0,0022 г, 0,01 ммоль) и Cs2CO3 (0,82 г, 2,5 ммоль). Реакционную смесь перемешивали и пропускали через нее N2 в течение 15 минут. Грели реакционную смесь при температуре 100°C в течение 8 часов в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом (30 мл), промывали водой (15 мл), солевым раствором (15 мл) и сушили над Na2SO4. Концентрировали при пониженном давлении с получением остатка, который очищали методом колоночной хроматографии (SiO2, 60-120 меш, используя в качестве элюента 3% раствор метанол/хлороформ: 3/97) с получением соединения 5 (0,3 г, 60%) в виде желтого твердого продукта.
[00818] Этап 3
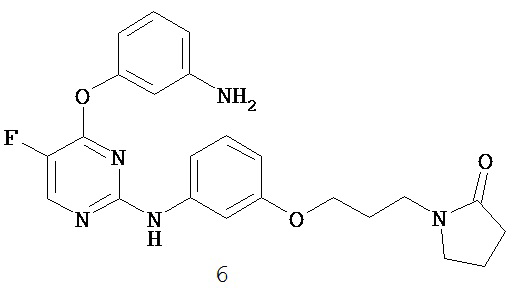
[00819] К раствору соединения 5 (0,25 г, 0,46 ммоль) в CH2Cl2 (10 мл) при перемешивании добавляли TFA (1,0 мл) при температуре 0°C в атмосфере азота. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре в течение 2 часов. Сырую реакционную смесь выливали в ледяную воду (10 мл), подщелачивали раствором натрия бикарбоната и экстрагировали этилацетатом (3×15 мл). Объединенный этилацетатный экстракт промывали водой (15 мл), солевым раствором (10 мл), сушили над NO2SO4 и концентрировали при пониженном давлении с получением соединения 6 (0,130 г, 65%) в виде желтого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00820] Этап 4
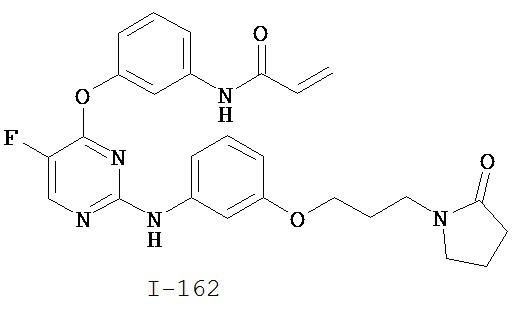
[00821] К раствору соединения 6 (0,08 г, 0,18 ммоль) и калия карбоната (0,124 г, 0,9 ммоль) в NMP (1,2 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,020 г, 0,22 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 45 минут. Реакционную смесь по каплям при перемешивании добавляли к холодному 10% раствору NaHCO3 и перемешивали при температуре 0°C в течение 30 минут. Выпавший осадок отфильтровывали на воронке Бюхнера. Затем осадок промывали холодной водой, гексаном и растворяли в смеси метанол/дихлорметан (50:50, 5 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (10 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×10 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 1-162 (0,050 мг, 56%). 1H-ЯМР (ДМСО-d6) δ ppm: 1,81-1,91 (m, 4H), 2,19 (t, J=7,84 Гц, 2H), 3,26-3,35 (m, 4H), 3,73 (t, J=6,04 Гц, 2H), 5,76 (dd, J=1,92 и 10,04 Гц, 1H), 6,25 (dd, J=1,88 и 16,9 Гц, 1H), 6,38-6,45 (m, 2H), 6,93 (t, J=8,12 Гц, 1H), 7,02-7,04 (m, 2H), 7,11 (s, 1H), 7,43 (t, J=8,16 Гц, 1H), 7,55 (d, J=8,24 Гц, 1H), 7,68 (d, J=1,8 Гц, 1H), 8,56 (d, J=2,88 Гц, 1H), 9,56 (s, 1H), 10,34 (s, 1H); ЖХ/МС: m/e 490,0 (M-2).
[00822] Промежуточное соединение 3-(3-(2-оксопирролидин-1-ил)пропоксианилин 4 получали с использованием схемы, описанной ниже.
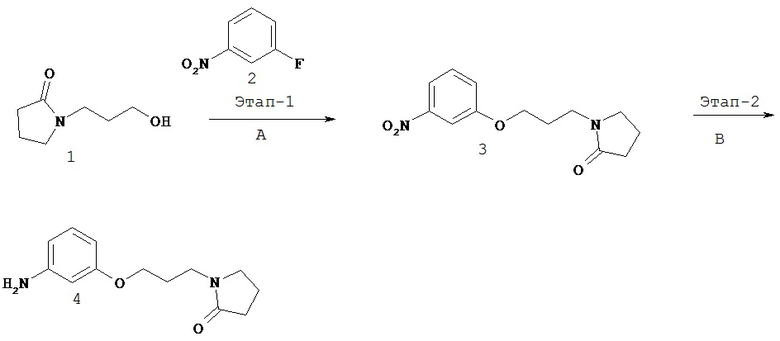
A) NaH, ДМФА, комн. темп., 16 часов; B) SnCl2 конц. HCl, 50°C, 2 часа.
[00823] Этап 1
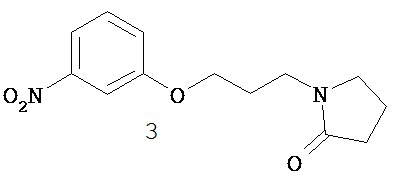
[00824] К раствору NaH (1,0 г, 20,94 ммоль) в ДМФА (10 мл) при перемешивание добавляли соединение 1 (2,0 г, 13,96 ммоль) при температуре 0°C. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре в течение 30 минут. К реакционной смеси медленно добавляли соединение 1 (1,96 г, 13,96 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Реакционную смесь концентрировали при пониженном давлении и обрабатывали этилацетатом (20 мл). Экстракт промывали водой (2×5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Фильтровали, концентрировали при пониженном давлении с получением сырого соединения 3 (2 г, 55,5%) который использовали на следующем этапе без дополнительной очистки.
[00825] Этап 2
[00826] К раствору соединения 3 (2 г, 7,57 ммоль) в конц. HCl (20 мл) при перемешивании небольшими порциями добавляли SnCl2 (7,5 г, 34,06 ммоль). Реакционную смесь перемешивали при температуре 50°C в течение 2 часов, охлаждали и подщелачивали NaHCO3. Экстрагировали этилацетатом (3×25 мл), промывали водой (5 мл), солевым раствором (5 мл) и сушили над безводным Na2SO4. Фильтровали, затем концентрировали при пониженном давлении с получением соединения 4 (1,65 г, 93%) в виде темно-коричневого твердого продукта, который использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 99
[00827] Получение N-(4-(5-фтор-2-(3-(2-(2-оксопирролидин-1-ил)этокси)фениламино)-пиримидин-4-илокси)бензил)-N-метилакриламида I-146
[00828] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием трет-бутилового эфира (4-гидроксибензил)(метил)карбаминовой кислоты вместо соединения 2 на Этапе 1 и 3-(2-(2-оксопирролидин-1-ил)этоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3) δ ppm: 2,03 (quin, J=7,4 Гц, 2H), 2,39 (t, J=8 Гц, 2H), 3,07 и 3,06 (s, together 3H), 3,57 (t, J=6,96 Гц, 2H), 3,66 (t, J=5,08 Гц, 2H), 4,03-4,04 (bd, J=4,96 Гц, 2H), 4,67 и 4,72 (s, together 2H), 5,70-5,85 (m, 1H), 6,43 (d, J=16,72 Гц, 1H), 6,50 (d, J=5,72 Гц, 1H), 6,60-6,75 (m, 1H), 6,89-6,96 (m, 2H), 7,06-7,08 (m, 2H), 7,18-7,30 (m, 2H), 7,37 (d, J=8,44 Гц, 1H), 8,21 (d, J=2,36 Гц, 1H); ЖХ/МС: m/e 506,2 (M+1).
ПРИМЕР 100
[00829] Получение N-(4-(5-фтор-2-(3-(3-(метилсульфонил)пропокси)фениламино)-пиримидин-4-илокси)бензил)-N-метилакриламида I-136
[00830] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием трет-бутилового эфира (4-гидроксибензил)(метил)карбаминовой кислоты вместо соединения 2 на Этапе 1 и 3-(3-(3-метилсульфонил)пропоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3) δ ppm: 2,25-2,40 (m, 2H), 2,97 (s, 3H), 3,07 (s, 3H), 3,20-3,30 (m, 2H), 3,98-4,05 (m, 2H), 4,67 (s, 1H), 4,72 (s, 1H), 5,7-5,82 (m, 1H), 6,43 (dd, J=1,96 и 16,96 Гц, 1H), 6,49-6,53 (m, 1H), 6,6-6,75 (m, 1H), 6,85-7,00 (m, 2H), 7,05-7,15 (m, 2H), 7,18-7,25 (m, 2H), 7,36 (d, J=8,36 Гц, 1H), 8,21 (bd, J=2,52 Гц, 1H); ЖХ/МС: т/е 515,0 (M+1).
ПРИМЕР 101
[00831] Получение N-(4-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-окси)бензил)-N-метилакриламида I-117
[00832] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием трет-бутилового эфира (4-гидроксибензил)(метил)карбаминовой кислоты вместо соединения 2 на Этапе 1 и 6-метокси-3-аминопиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,92 и 3,07 (s, 3H), 3,76 (s, 3H), 4,62 и 4,74 (s, 2H), 5,69 и 5,75 (dd, J=1,6 и 10,4 Гц, 1H), 6,20 (dd, J=1,2 и 16,4 Гц, 1H), 6,56 (d, J=8,8 Гц, 1H), 6,82-6,90 (m, 1H), 7,28-7,35 (m, 4H), 7,71 (bd, J=7,6 Гц, 1H), 8,14 (s, 1H), 8,44 (bd, J=2,8 Гц, 1H), 9,48 (s, 1H); ЖХ/МС: m/е 410 (M+1).
ПРИМЕР 102
[00833] Получение N-(4-(5-фтор-2-(3-(3-(2-оксопирролидин-1-ил)пропокси)фенил-амино)пиримидин-4-илокси)бензил)-N-метилакриламида I-111
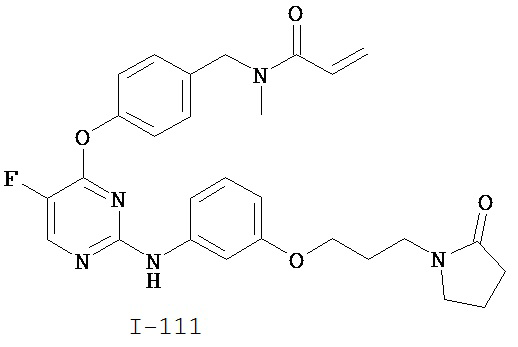
[00834] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием трет-бутилового эфира (4-гидроксибензил)(метил)карбаминовой кислоты вместо совместно 2 на Этапе 1 и 3-(3-(2-оксопирролидин-1-ил)пропокси)анилина вместо совместно 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,80-2,6 (m, 4H), 2,20 (t, J=7,6 Гц, 2H), 2,92 и 3,06 (s, together 3H), 3,20-3,40 (m, 4H), 3,75-3,90 (m, 2H), 4,62 и 4,73 (s, together 2H), 5,65-5,77 (m, 1H), 6,20 (dd, J=2,4 и 16,8 Гц, 1H), 6,24 (bd, J=8 Гц, 1H), 6,86 (dd, J=10,4 и 16,8 Гц, 1H), 6,93 (t, J=8 Гц, 1H), 7,08 (t, J=8 Гц, 2H), 7,28-7,36 (m, 4H), 8,48 (d, J=2,8 Гц, 1H), 9,51 (s, 1H); ЖХ/МС: m/e 520,2 (M+1).
ПРИМЕР 103
[00835] Получение N-(3-(5-фтор-2-(3-(2-(2-оксопирролидин-1-ил)этокси)фениламино)-пиримидин-4-илокси)фенил)акриламида I-184
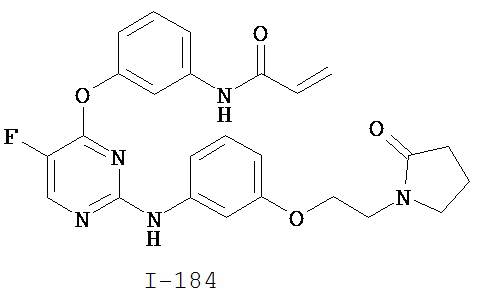
[00836] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
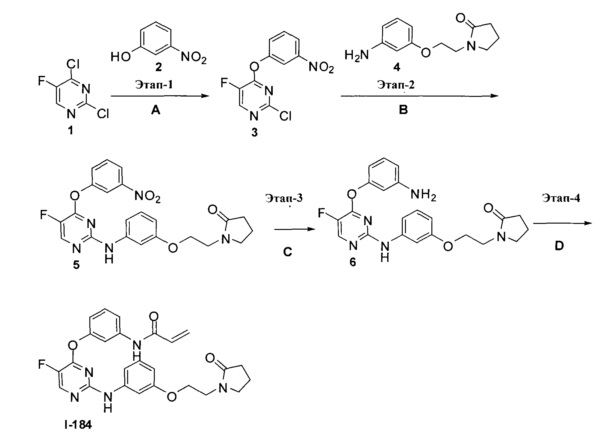
A) K2CO3, ДМФА, комн. темп., 16 часов; B) Pd(OAc)2, BINAP, Cs2CO3, толуол, 100°C, 8 часов; C) Pd/C, H2, метанол, комн. темп., 16 часов; D) акрилоилхлорид, K2CO3, NMP, 0°C, 30 минут.
[00837] Этап 1
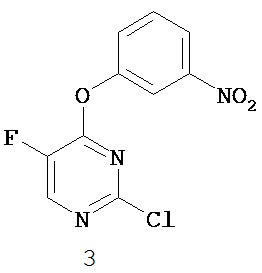
[00838] К раствору соединения 1 (24 г, 143,7 ммоль) и K2CO3 (20 г, 143,6 ммоль) в сухом ДМФА (300 мл) при перемешивании добавляли соединение 2 (10 г, 71,8 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 часов в атмосфере азота. Охлаждали и гасили водой (600 мл). Выпавший белый осадок отфильтровывали на воронке Бюхнера и сушили в вакууме с получением соединения 3 (13 г, 68%) в виде белого твердого продукта.
[00839] Этап 2
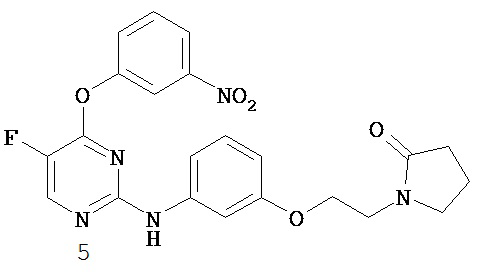
[00840] К раствору соединения 3 (0,9 г, 3,3 ммоль) в толуоле (30 мл) добавляли соединение 4 (950 мг, 4,3 ммоль), а затем BINAP (0,12 г, 0,19 ммоль), палладия ацетат (0,02 г, 0,09 ммоль) и Cs2CO3 (2,7 г, 8,2 ммоль). Реакционную смесь перемешивали и пропускали через нее N2 в течение 15 минут. Затем грели при температуре 100°C в течение 8 часов в атмосфере N2. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом (60 мл), промывали водой (35 мл), солевым раствором (35 мл) и сушили над NO2SO4. Концентрировали при пониженном давлении с получением остатка, который очищали методом колоночной хроматографии (SiO2, 60-120 меш, используя в качестве элюента смесь метанол/хлороформ: 8/92) с получением соединения 5 (0,50 г, 33%) в виде белого твердого продукта.
[00841] Этап 3
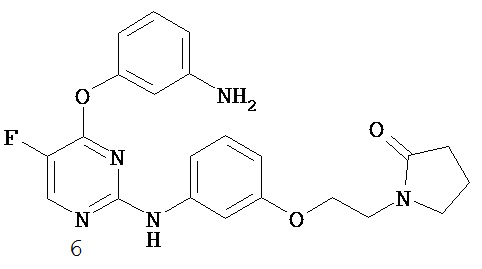
[00842] К раствору соединения 5 (0,5 г, 1,1 ммоль) в метаноле (50 мл) добавляли 10% Pd/C (0,05 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 6 (0,3 г, 65%) в виде бесцветной вязкой жидкости.
[00843] Этап 4

[00844] К раствору соединения 6 (0,21 г, 0,5 ммоль) и калия карбоната (0,27 г, 2,0 ммоль) в NMP (2,5 мл) при температуре 0°C при перемешивании добавляли акрилоилхлорид (0,053 г, 0,6 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 30 минут. Реакционную смесь по каплям при перемешивании добавляли к холодному 10% раствору NaHCO3 и перемешивали при температуре 0°C в течение 30 минут. Выпавший белый осадок отфильтровывали на воронке Бюхнера. Затем твердый осадок промывали холодной водой и гексаном, растворяли его в смеси метанол/дихлорметан (50:50, 10 мл) и концентрировали при пониженном давлении. Полученный осадок суспендировали в холодной воде (25 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×50 мл). Объединенный этилацетатный экстракт промывали водой (50 мл), солевым раствором (50 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 1-184 (0, 150 г, 65%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,89 (quin, J=7,2 Гц, 2H), 2,21 (t, J=7,6 Гц, 2H), 3,39 (t, J=7,2 Гц, 2H), 3,49 (t, J=5,2 Гц, 2H), 3,87 (t, J=5,6 Гц, 2H), 5,77 (dd, J=1,6 и 10,4 Гц, 1H), 6,26 (dd, J=1,6 и 17,2 Гц, 1H), 6,39-6,46 (m, 2H), 6,95 (t, J=8,4 Гц, 1H), 7,03-7,12 (m, 3H), 7,44 (t, J=8,4 Гц, 1H), 7,56 (d, J=8,4 Гц, 1H), 7,70 (s, 1H), 8,51 (d, J=2,8 Гц, 1H), 9,56 (s, 1H), 10,35 (s, 1H); ЖХ/МС: m/e 478 (M+1).
[00845] Промежуточное соединение 3-(2-(2-оксопирролидин-1-ил)этоксианилин 4 получали с использованием схемы, описанной ниже.
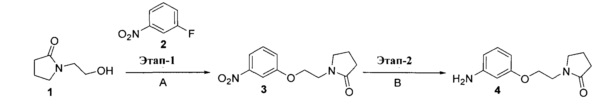
A) NaH, ТГФ, комн. темп., 16 часов; B) Pd/C, H2, метанол, комн. темп., 16 часов.
[00846] Этап 1
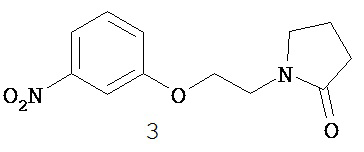
[00847] К раствору NaH (3,4 г, 141,6 ммоль, 60% дисперсия в парафиновом масле) в сухом ТГФ (50 мл) при перемешивании добавляли соединение 1 (6 г, 46,0 ммоль) при температуре 0°C, после чего реакционную смесь перемешивали при комнатной температуре в течение 15 минут в атмосфере азота. К реакционной смеси добавляли раствор соединения 2 (5,0 г, 35,4 ммоль) в ТГФ (10 мл), после чего реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Затем ее гасили холодной водой (40 мл) и экстрагировали этилацетатом (35 мл). Этилацетатный экстракт промывали водой (2×25 мл), солевым раствором (25 мл), сушили над Na2SO4 и концентрировали при пониженном давлениис получением остатка, который очищали методом колоночной хроматографии (SiO2, 60-120 меш, в качестве элюента использовали метанол/хлороформ: 10/90) с получением соединения 3 (2,5 г, 30%) в виде коричневатой жидкости.
[00848] Этап 2
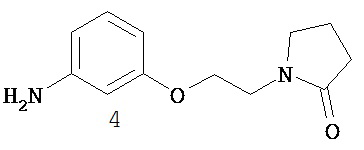
[00849] К раствору соединения 3 (2,2 г, 8,8 ммоль) в метаноле (50 мл) добавляли 10% Pd/C (0,22 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере Hz (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (1,7 г, 89%) в виде желтоватой жидкости. Его использовали на следующем этапе без дальнейшей очистки.
ПРИМЕР 104
[00850] Получение N-(3-(2-(6-метоксипиридин-3-иламино)-5-метилпиримидин-4-ил-окси)фенил)акриламида I-186
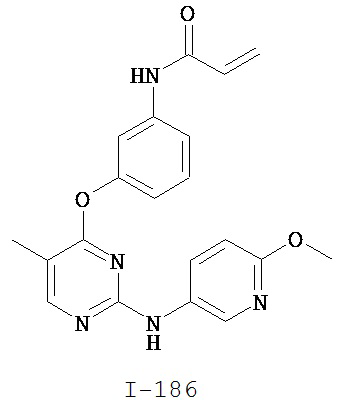
[00851] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 103, с использованием 2,4-дихлор-5-метилпиримидина вместо соединения 1 на Этапе 1 и 6-метокси-3-аминопиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,16 (s, 3H), 3,73 (s, 3H), 5,76 (dd, J=1,92 и 10,04 Гц, 1H), 6,24 (dd, J=1,92 и 16,92 Гц, 1H), 6,39-6,49 (m, 2H), 6,92 (dd, J=1,48 и 8 Гц, 1H), 7,40 (t, J=8,08 Гц, 1H), 7,49 (d, J=8,16 Гц, 1H), 7,64 (d, J=1,84 Гц, 1H), 7,77-7,79 (m, 1H), 8,17 (bs, 1H), 8,20 (s, 1H), 9,27 (s, 1H), 10,29 (s, 1H); ЖХ/МС: m/e 378 (M+1).
ПРИМЕР 105
[00852] Получение N-(3-(5-метил-2-(фениламино)пиримидин-4-илокси)фенил)-акриламида I-248
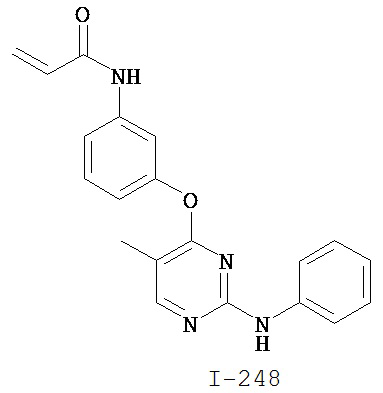
[00853] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
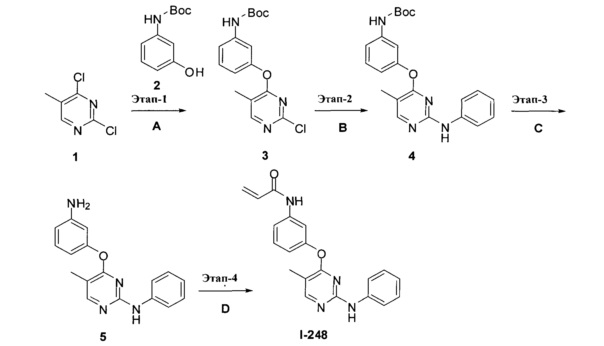
A) K2CO3, ДМФА, комн. темп., 24 часа; A’) (Boc)2O, ТГФ, 60°C, 2 часа; В) анилин, конц. HCl, EtOH, 80°C, 1 час; C) TFA, CH2Cl2, 0°C до комн. темп., 30 мин; D) акрилоилхлорид, NMP, 0°C, 10 минут.
[00854] Этап 1
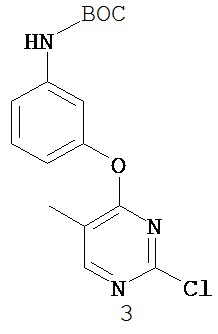
[00855] К раствору соединения 2 (100 мг, 0,48 ммоль) и K2CO3 (99,2 мг, 0,717 ммоль) в сухом ДМФА (5 мл) при перемешивании добавляли соединение 1 (78 мг, 0,478 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 24 часов в атмосфере азота. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли этилацетатом (10 мл). Промывали водой (2×5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (120 мг, 75%) в виде белого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00856] Этап 2
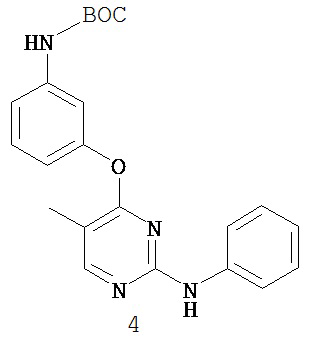
[00857] В реактор высокого давления помещали соединение 3 (75 мг, 0,224 ммоль), конц. HCl (40 мг, 0,4 ммоль), анилин (83 мг, 0,89 ммоль) и этанол (2,0 мл). Плотно закрывали реактор и перемешивали реакционную массу при 80°C в течение 60 минут. Реакционную смесь охлаждали, концентрировали при пониженном давлении и осадок обрабатывали водой (5,0 мл). Подщелачивали 10% раствором NaHCO3 и экстрагировали этилацетатом (3×10 мл). Объединенный EtOAc слой промывали водой (2×5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, этилацетат/гексан: 50/50) с получением соединения 4 (0,04 г, 45,9%) в виде беловатого твердого продукта.
[00858] Этап 3

[00859] К раствору соединения 4 (160 мг, 0,40 ммоль) в дихлорметане (4,0 мл) при перемешивании при температуре 0°C добавляли трифторуксусную кислоту (0,8 мл). Продолжали помешивать при той же температуре в течение 30 минут, затем реакционную смесь концентрировали при пониженном давлении и растворяли осадок в воде (5,0 мл), подщелачивали 10% раствором NaHCO3 и экстрагировали дихлорметаном (2×5 мл). Дихлорметановый экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 5 (110 мг, 93,2%) в виде беловатого твердого продукта. Его использовали на следующем этапе без дополнительной очистки.
[00860] Этап 4

[00861] К раствору соединения 5 (75 мг, 0,256 ммоль) в NMP (0,8 мл) при перемешивании при температуре 0°C добавляли акрилоилхлорид (34,8 мг, 0,38 ммоль) и перемешивали реакционную смесь при температуре 0°C в течение 10 минут. Затем реакционную смесь гасили водой (4,0 мл), подщелачивали 10% раствором NaHCO3 и экстрагировали дихлорметаном (2×5 мл). Дихлорметановый экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, 60-120 меш, CHCl3/MeOH: 99/1) с получением соединения 1-248 (0,035 г, 39,6%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 2,15 (s, 3H), 5,75 (dd, J=1,92 и 10,04 Гц, 1H), 6,24 (dd, J=1,96 и 16,96 Гц, 1H), 6,41 (dd, J=10,6 и 17 Гц, 1H), 6,78-6,8 (m, 1H), 6,94 (dd, J=1,44 и 8,04 Гц, 1H), 7,00 (t, J=7,52 Гц, 2H), 7,40-7,44 (m, 3H), 7,53 (d, J=8,24 Гц, 1H), 7,6 (t, J=2 Гц, 1H), 8,23 (d, J=1,04 Гц, 1H), 9,36 (s, 1H), 10,30 (s, 1H); ЖХ/МС: m/e 346,8 (M+1).
ПРИМЕР 106
[00862] Получение 1-(4-(5-фтор-2-(фениламино)пиримидин-4-иламино)пиперидин-1-ил)проп-2-ен-1-она I-229
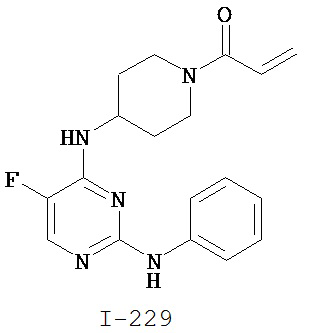
[00863] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 1-трет-бутилоксикарбонил-4-аминопиперидина вместо соединения 2 на Этапе 1 и анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,35-1,50 (m, 2H), 1,90-2,05 (m, 2H), 2,7-2,85 (m, 1H), 3,10-3,20 (m, 1H), 4,11-4,15 (m, 2H), 4,46 (bd, J=13,72 Гц, 1H), 5,67 (dd, J=2,44 и 10,4 Гц, 1H), 6,10 (dd, J=2,44 и 16,6 Гц, 1H), 6,82-6,88 (m, 2H), 7,22 (t, J=7,44 Гц, 2H), 7,35 (d, J=7,56 Гц, 1H), 7,70 (d, J=7,72 Гц, 2H), 7,87 (d, i=3,76 Гц, 1H), 9,07 (s, 1H); ЖХ/МС: m/e 341 (M+1).
ПРИМЕР 107
[00864] Получение 2-((3-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)пиримидин-4-ил-амино)фенил)(гидрокси)метил)акрилонитрил I-71
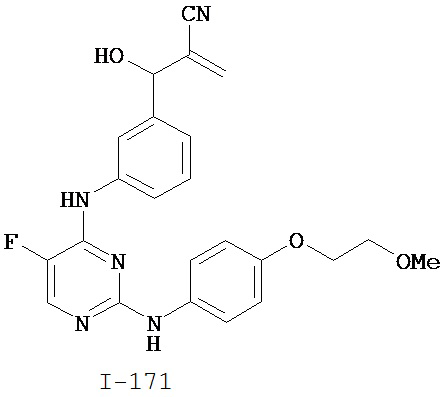
[00865] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
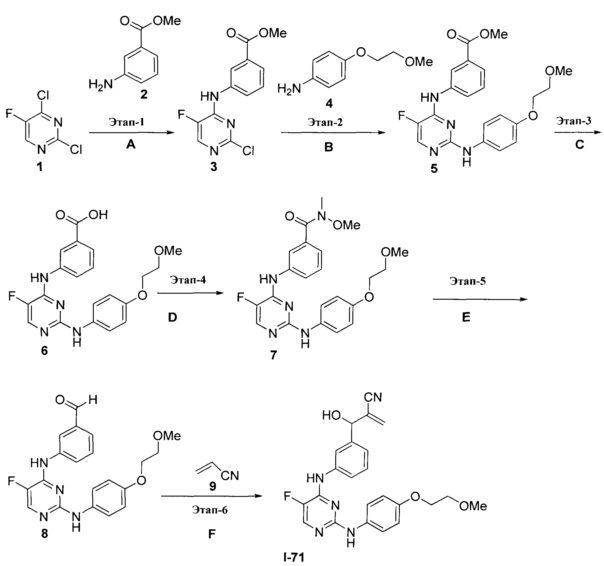
A) соединение 2, DIPEA, н-BuOH, 120°C, 12 часов; В) конц. HCl, этанол, 100°C, 5 часов; C) LiOH, MeOH/ТГФ/H2O, комн. темп., 6 часов; D) Me-NH-OMe.HCl, EDCLHCl, НОВТ, DIPEA, ДМФА, комн. темп., 8 часов; E) LAH (1,0 М раствор в ТГФ), -78°C, 30 минут; F) DABCO, 1,4-диоксан/вода, комн. темп., 48 часов.
[00866] Этап 1
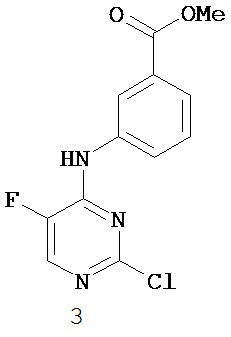
[00867] Раствор соединения 1 (0,50 г, 2,99 ммоль), соединения 2 (0,45 г, 2,99 ммоль) и DIPEA (0,57 г, 4,48 ммоль) в н-бутаноле (5,0 мл) нагревали в реакторе высокого давления (120°C, 16 часов). Охлаждали, гасили водой (5 мл) и экстрагировали EtOAc (2×5 мл). Объединенный EtOAc экстракт промывали водой (2 мл), солевым раствором (2 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (0,70 г, 83,3%) в виде беловатого твердого продукта.
[00868] Этап 2
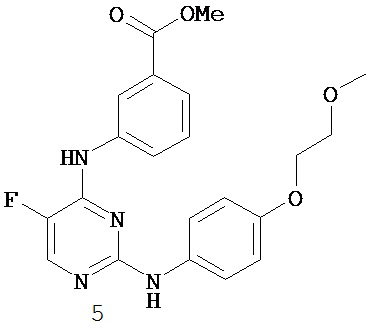
[00869] Раствор соединения 3 (0,5 г, 1,77 ммоль) и соединения 4 (0,29 г, 1,77 ммоль) в этаноле (2,5 мл) помещали в реактор высокого давления и добавляли уксусную кислоту (0,1 мл). Плотно закрывали реактор и перемешивали содержимое при 100°C в течение 5 минут. Реакционную смесь охлаждали, концентрировали при пониженном давлении и обрабатывали осадок этилацетатом (50 мл). Промывали раствором NaHCO3 (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Выпавший осадок отфильтровывали. Осадок сушили в вакууме с получением соединения 5 (0,6 г, 80%).
[00870] Этап 3
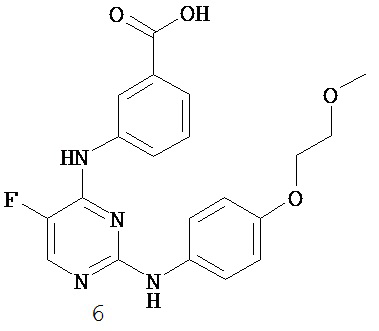
[00871] К раствору соединения 5 (0,6 г, 1,4 ммоль) в смеси метанол/ТГФ/вода: 6 мл / 6 мл / 3 мл добавляли LiOH (0,298 г, 7 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Реакционную смесь концентрировали при пониженном давлении; остаток разбавляли водой (2 мл) и экстрагировали диэтиловым эфиром (5 мл). Водный слой отделяли и подкисляли 1,5 N растором HCl (до pH ~4-5), концентрировали и сушили в вакуумеом с получением соединения 6 (0,4 г, 70%) в виде белого твердого продукта, который использовалось на следующем этапе без дополнительной очистки.
[00872] Этап 4
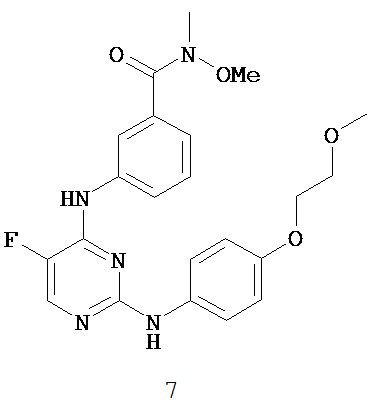
[00873] К раствору соединения 6 (0,4 г, 1 ммоль) в ДМФ (3 мл) при перемешивании добавляли метоксиметиламин гидрохлорид (MeNH-OMe.HCl) (0,102 г, 0,1 ммоль), N-(3-диметиламинопропил)-этилкарбодиимид гидрохлорид (EDCI.HCl) (0,003 г, 1,5 ммоль), гидроксибензотриазол (HOBT) (71 мг, 0,5 ммоль) и DIPEA (0,204 г, 1,5 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 8 часов, гасили водой и экстрагировали EtOAc (2×5 мл). Объединенный органический слой промывали солевым раствором и сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением соединения 7 (0,4 г, 90,9%) в виде белого твердого продукта.
[00874] Этап 5
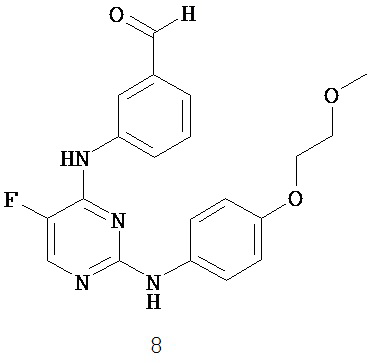
[00875] К раствору соединения 7 (0,4 г, 0,9 ммоль) в ТГФ (10 мл) при перемешивании добавляли LAH (1,8 мл, 1,8 ммоль) при температуре -78°C. Реакционную смесь перемешивали при этой температуре 30 минут, после чего ее гасили раствором Na2SO4 (2 мл) и экстрагировали этилацетатом (10 мл). Этилацетатный слой отделяли и промывали водой (2 мл), солевым раствором (2 мл) и сушили над безводным Na2SO4. Фильтровали и затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 7/3) с получением соединения 8 (200 мг, 58%) в виде желтого твердого продукта.
[00876] Этап 6

[00877] К раствору соединения 8 (200 мг, 0,523 ммоль) и соединения 9 (69 мг, 1,3 ммоль) в смеси 1,4-диоксан/H2O (1,4 мл/0,6 мл) при перемешивании добавляли 1,4-диазабицикло[2.2.2]октан (DABCO) (50 мг, 0,2523 ммоль) при комнатной температуре. Продолжали перемешивать при комнатной температуре в течение 48 часов, после чего реакционную смесь концентрировали при пониженном давлении. Полученный остаток далее очищали методом колоночной хроматографии (SiO2, петролейный эфир/этилацетат, 6/4) с получением соединения 1-71 в виде зеленоватого смолистого продукта (0,05 г, 22,7%).1H-ЯМР (ДМСО-d6) δ ppm: 3,48 (s, 3H), 3,77 (t, J=4,4 Гц, 2H), 4,11-4,16 (т, 2H), 5,11 (s, 1H), 5,99 (s, 1H), 6,06 (s, 1H), 6,85 (s, 1H), 6,91 (d, J=8,84 Гц, 2H), 7,15 (d, J=7,44 Гц, 1H), 7,30-7,40; ЖХ/МС: m/e (M+1).
ПРИМЕР 108
[00878] Получение 2-((4-(5-фтор-2-(фениламино)пиримидин-4-иламино)фенил)-(гидрокси)метил)акрилонитрила I-161
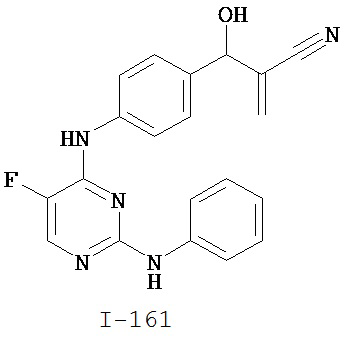
[00879] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 107, с использованием анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3) δ ppm: 5,32 (s, 1H), 6,07 (d, J=0,8 Гц, 1H), 6,15 (d, J=1,6 Гц, 1H), 6,84 (d, J=2,8 Гц, 1H), 7,03-7,06 (m, 2H), 7,29 (t, J=1,6 Гц, 2H), 7,38 (d, J=8,44 Гц, 2H), 7,52 (d, J=8,8 Гц, 2H), 7,67 (dd, J=1,6 и 6,4 Гц, 2H), 7,96 (d, J=3,2 Гц, 1H); ЖХ/МС: m/e 361,8 (M+1).
ПРИМЕР 109
[00880] Получение 2-((4-(5-фтор-2-(3-трифторметоксифениламино)пиримидин-4-ил-амино)фенил)(гидрокси)метил)акрилонитрила I-163
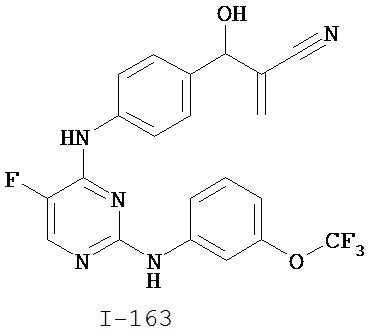
[00881] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 107, с использованием 3-трифторметоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 5,29 (d, J=3,8 Гц, 1H), 6,13 (s, 1H), 6,19 (s, 1H), 6,31 (dd, J=3,8 Гц, 1H), 6,83 (d, J=7,76 Гц, 1H), 7,11 (d, J=7,8 Гц, 1H), 7,30-7,37 (m, 2H), 7,61-7,63 (m, 2H), 7.81 (s, 1H), 7,90 (d, J=7,4 Гц, 1H), 8,16 (dd, J=1,44 и 3,56 Гц, 1H), 9,45 (s, 1H), 9,53 (s, 1H); ЖХ/МС: m/e 446 (M+1).
ПРИМЕР 110
[00882] Получение N-(3-(5-фтор-2-(3-(3-(метилсульфонил)пропокси)фениламино)-пиримидин-4-илокси)фенил)акриламида I-116
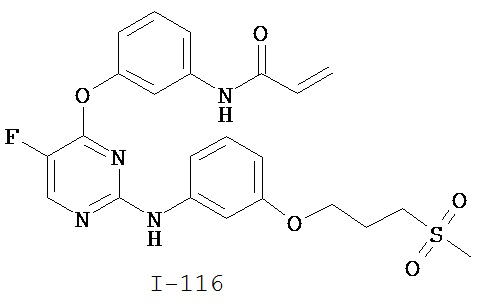
[00883] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием 3-(3-(метилсульфонил)пропоксианилина вместо соединения 4 на Этапе 4. 1H-ЯМР (ДМСО-d6) δ ppm: 2,02-2,15 (m, 2H), 3,01 (s, 3H), 3,22 (t, J=7,56 Гц, 2H), 3,88 (t, J=6,12 Гц, 2H), 5,77 (dd, J=1,84 и 10,12 Гц, 1H), 6,25 (dd, J=1,72 и 16,88 Гц, 1H), 6,43 (d, J=9,96 и 16,76 Гц, 2H), 6,95 (t, J=8,12 Гц, 1H), 7,06 (t, J=7,48 Гц, 2H), 7,13 (s, 1H), 7,44 (t, J=8,12 Гц, 1H), 7,56 (d, J=8,44 Гц, 1H), 7,68 (s, 1H), 8,50 (d, J=2,84 Гц, 1H), 9,57 (s, 1H), 10,34 (s, 1H); ЖХ/МС: m/e 487,0 (M+2).
ПРИМЕР 111
[00884] Получение N-(3-(5-циклопропил-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-илокси)фенил)акриламида I-131
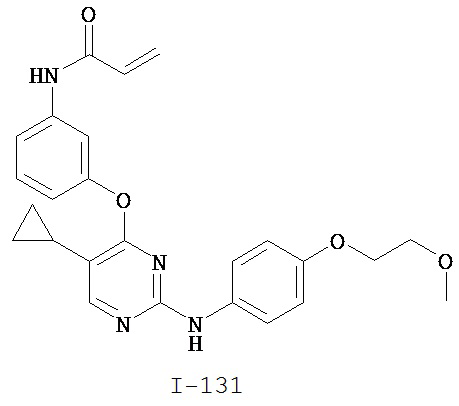
[00885] Указанное в названии соединение получали с использованием этапов и промежуточных соединений, описанных ниже.
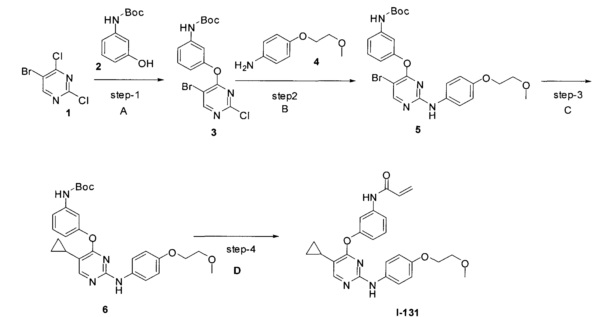
A) K2CO3, DMA, комн. темп., 5 часов; B) n-TsOH, диоксан, 100°C, 2 часа; C) калия циклопропилтрифторборат, Pd(OAc)2, Xantphos, Cs2CO3, толуол, 100°C, 12 часов; D) 4N HCl, диоксан, комн. темп., 1 час; затем - акрилоил хлорид, Et3N, ДХМ, -10°C, 10 минут.
[00886] Этап 1
[00887] К раствору 5-бром-2,4-дихлорпиримидина (0,68 г, 3,0 ммоль) и трет-бутил-3-гидроксифенилкарбамата (0,65 г, 3,1 ммоль) в DMA (4 мл) добавляли K2CO3 (0,83 г, 6,0 ммоль). Суспензию перемешивали в течение 5 часов. Добавляли воду (15 мл) и выпавший осадок отделяли фильтрованием. Осадок промывали эфиром и сушили с получением 1,2 г соединения 3. MS: m/e 400,2, 402,2 (M+1).
[00888] Этап 2
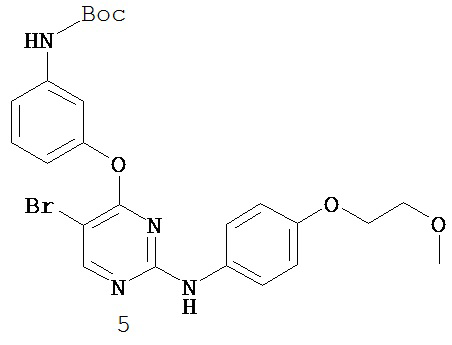
[00889] К раствору соединения 3 (200 мг, 0,5 ммоль) и 4-(2-метоксиэтокси)анилина (0,1 г, 0,6 ммоль) в 8 мл диоксана добавляли 4-метилбензолсульфокислоты моногидрат (0,08 г, 0,4 ммоль). Смесь перемешивали при температуре 100°C в течение 2 часов. Растворитель отгоняли. Остаток растворяли в 20 мл этилацетата и промывали водным раствором NaHCO3, водой и солевым раствором. Органический слой отделяли и сушили над Na2SO4. После удаления растворителя сырой продукт очищали методом хроматографии на силикагеле (гексан:EtOAc=1:1). Получали 0,10 g соединения 5: MS m/z: 531,1, 531,0 (M+H+).
[00890] Этап 3
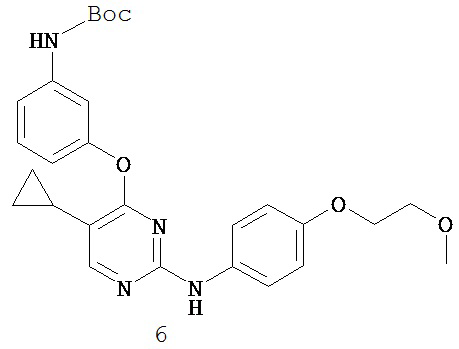
[00891] Калия циклопропилтрифторборат (36 мг, 0,25 ммоль), соединение 5 (0,10 г, 0,19 ммоль), палладия ацетат (3,4 мг, 0,015 ммоль), Xantphos (17,5 мг, 0,03 ммоль) и Cs2CO3 (186 мг, 0,57 ммоль) суспендировали в 5 мл толуола и 1 мл воды. Реакционную смесь дегазировали и плотно закрывали в атмосфере аргона, после чего нагревали до 100°C в течение 12 часов. Добавляли этилацетат (20 мл) и промывали водным раствором NaHCO3, водой и солевым раствором. Органический слой отделяли и сушили над Na2SO4. После удаления растворителя сырой продукт очищали методом хроматографии на силикагеле (гексан:EtOAc=1:1). Получали 50 мг соединения 6: MS m/z: 493,2 (M+H+).
[00892] Этап 4

[00893] Указанное в названии соединение получали из соединения 6 согласно процедуре, описанной в Примере 96. MS m/z: 447,1 (M+H+).
ПРИМЕР 112
[00894] Получение 1-(4-(5-фтор-2-(3-(2-диметиламиноэтокси)фениламино)пиримидин-4-иламино)фенил)-2-метилпроп-2-ен-1-она I-207
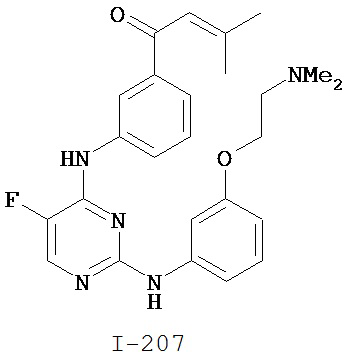
[00895] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.

A) соединение 2, DIPEA, н-BuOH, 90°C, 12 часов; B) соединение 4, Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 16 часов; C) LiOH, МеОН/ТГФ/H2O, комн. темп., 6 часов; D) MeNH-OMe.HCl, EDCI.HCl, HOBT, DIPEA, ДМФА, комн. темп., 3 часа; Е) соединение 8, ТГФ, 0°C до комн. темп., 2 часа.
[00896] Этап 1
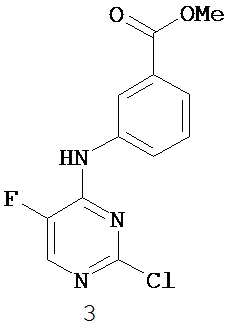
[00897] Раствор соединения 1 (4 г, 23,9 ммоль), соединения 2 (3,6 г, 23,7 ммоль) и DIPEA (4,6 г, 35,58 ммоль) в н-бутаноле (40 мл) нагревали в реакторе высокого давления (90°C, 12 часов). Охлаждали, гасили водой (5 мл) и экстрагировали EtOAc (2×5 мл). Объединенный EtOAc экстракт промывали водой (60 мл), солевым раствором (40 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (5,5 г, 82%) в виде беловатого твердого продукта.
[00898] Этап 2
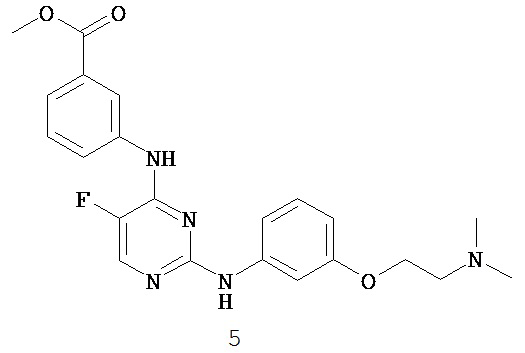
[00899] Раствор соединения 3 (0,319 г, 1,76 ммоль), соединения 4 (0,5 г, 1,76 ммоль), Pd(OAc)2 (0,039 г, 0,17 ммоль), BINAP (0,055 г, 0,08 ммоль) и Cs2CO3 (1,44 г, 4,42 ммоль) в дегазированном толуоле (толуол продували N2 в течение 30 минут) нагревали в течение 16 часов при температуре 100°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (25 мл), промывали водой (5 мл), солевым раствором (2 мл) и сушили над Na2SO4. Фильтровали, затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, хлороформ/метанол, 9/1) с получением соединения 4 (0,63 г, 84%) в виде желтого твердого продукта.
[00900] Этап 3
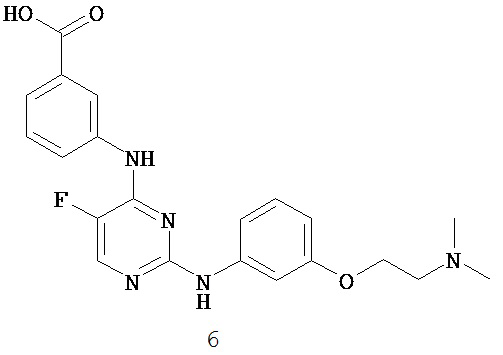
[00901] К раствору соединения 5 (0,3 г, 0,70 ммоль) в смеси метанол/ТГФ/вода: 1 мл / 1 мл / 0,5 мл добавляли LiOH (0,147 г, 3,52 ммоль), после чего реакционную смесь перемешивали при комнатной температуре в течение 6 часов. Концентрировали при пониженном давлении; остаток разбавляли водой (2 мл) и экстрагировали диэтиловым эфиром (5 мл). Водный слой отделяли и подкисляли 1,5 N раствором HCl (до pH ~4-5), концентрировали и сушили в вакууме с получением соединения 6 (0,31 г, неочищенного) в виде желтого смолистого твердого продукта, которое использовалось на следующем этапе без дополнительной очистки.
[00902] Этап 4
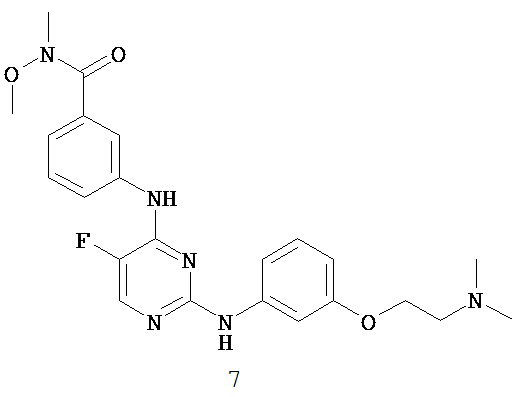
[00903] К раствору соединения 6 (0,29 г, 0,70 ммоль) в ДМФ (3 мл) при перемешивании добавляли MeNH-OMe.HCl (0,068 г, 0,70 ммоль), EDCI.HCl (0,202 г, 1,05 ммоль), НОВТ (0,047 г, 0,35 ммоль) и DIPEA (0,136 г, 1,05 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 3 часов, гасили водой и экстрагировали EtOAc (2×5 мл). Объединенный органический слой промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, метанол/хлороформ: 20/80) с получением соединения 7 (0,061 г, 19%) в виде желтого смолистого твердого продукта.
[00904] Этап 5
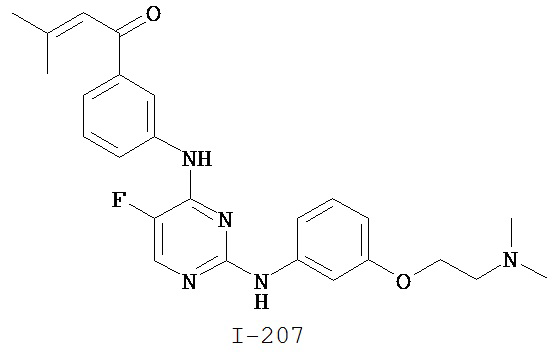
[00905] К раствору соединения 7 (100 мг, 0,22 ммоль) в ТГФ (1 мл) при перемешивании при температуре 0°C добавляли соединение 8 (17,6 мл, 8,80 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 2 часов. Затем ее гасили насыщенным раствором NH4Cl (0,5 мл) и экстрагировали EtOAc (2×3 мл). Объединенный органический слой промывали солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением белого твердого продукта. Затем его очищали методом колоночной хроматографии (SiO2, 60-120 меш, использовали в качестве элюента 20% раствор метанол/хлороформ) с получением соединения 1-207 (9 мг, 9%) в виде желтого смолистого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,90 (s, 3H), 2,01 (s, 3H), 2,19 (s, 6H), 2,57 (t, J=5,64 Гц, 2H), 3,87 (t, J=5,84 Гц, 2H), 6,45 (dd, J=1,64 и 8,08 Гц, 1H), 6,82 (s, 1H), 7,04 (t, J=8,16 Гц, 1H), 7,18 (d, J=8,16 Гц, 1H), 7,33 (s, 1H), 7,47 (t, J=7,88 Гц, 1H), 7,62 (d, J=7,72 Гц, 1H), 8,13-8,16 (m, 3H), 9,24 (s, 1H), 9,56 (s, 1H); ЖХ/МС: m/e 450,1 (M+1).
ПРИМЕР 113
[00906] Получение 1-(4-(5-фтор-2-(фениламино)пиримидин-4-иламино)фенил)-3-метил-бут-2-ен-1-она I-206
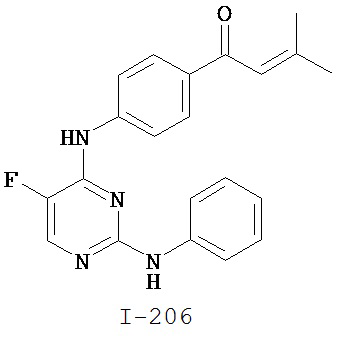
[00907] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием метил-4-аминобензоата вместо соединения 4 на Этапе 1 и анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,98 (s, 3H), 2,12 (s, 3H), 6,90-7,00 (m, 2H), 7,20-7,30 (m, 2H), 7,65 (d, J=8,16 Гц, 2H), 7,90 (d, J=8,56 Гц, 2H), 7,98 (d, J=8,68 Гц, 2H), 8,18 (bs, 1H), 9,31 (s, 1H), 9,68 (s, 1H); ЖХ/МС: m/e 363,0 (M+1).
ПРИМЕР 114
[00908] Получение 1-(3-(5-фтор-2-(3-(проп-2-инилокси)фениламино)пиримидин-4-ил-амино)фенил)-3-метилбут-2-ен-1-она I-211
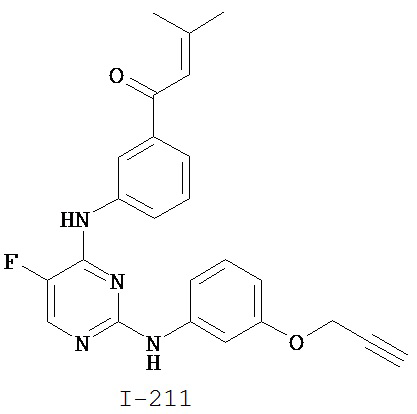
[00909] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 3-проп-2-инилоксианилина вместо соединения 4 на Этапе 4. 1H-ЯМР (CD3OD) δ ppm: 2,0 (d, J=1 Гц, 3H), 2,21 (d, J=1,04 Гц, 3H), 2,94-2,96 (d, J=2,44 Гц, 1H), 4,59 (d, J=2,36 Гц, 2H), 6,79-6,81 (m, 2H), 7,03 (dd, J=3,12 и 8,04 Гц, 1H), 7,14 (t, J=2,2 Гц, 1H), 7,23 (t, J=8,12 Гц, 1H), 7,54 (t, J=7,92 Гц, 1H), 7,83 (d, J=7,96 Гц, 1H), 7,86 (dd, J=2,08 и 8,08 Гц, 1H), 8,03 (d, J=4,96 Гц, 1H), 8,21 (t, J=1,88 Гц, 1H); ЖХ/МС: m/e 417,0 (M+1).
ПРИМЕР 115
[00910] Получение 1-(3-(5-фтор-2-(3-(трифторметокси)фениламино)пиримидин-4-ил-амино)фенил)-3-метилбут-2-ен-1-она I-223
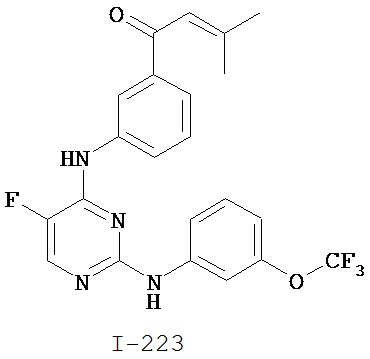
[00911] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 3-трифторметоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3) δ ppm: 2,0 (d, J=1,08 Гц, 3H), 2,24 (d, J=1,04 Гц, 3H), 6,74 (t, J=1,24 Гц, 1 Н), 6,85 (dd, J=1,08 и 7,0 Гц, 1H), 6,90 (s, 1H), 7,08 (s, 1H), 7,24-7,28 (m, 1H), 7,35 (td, J=1,2 и 7,44 Гц, 1H), 7,49 (t, J=7,88 Гц, 1H), 7,63 (s, 1H), 7,72 (td, J=1,04 и 7,76 Гц, 1H),7,90-7,92 (m, 1H), 8,00-8,05 (m, 2H); ЖХ/МС: m/e 447 (M+1).
ПРИМЕР 116
[00912] Получение 1-(3-(5-фтор-2-(3-(трифторметокси)фениламино)пиримидин-4-ил-амино)фенил)-2-метилпроп-2-ен-1-она I-199
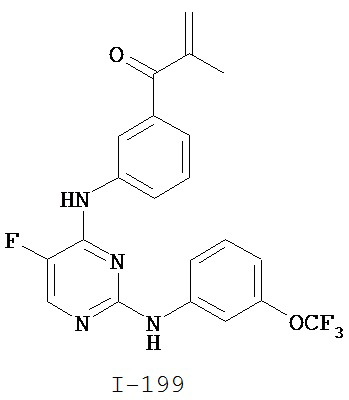
[00913] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 3-трифторметоксианилина вместо соединения 4 на Этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 1,97 (s, 3H), 5,6 (s, 1H), 6,0 (d, J=0,96 Гц, 1H), 6,82 (d, J=8,08 Гц, 1H), 7,27 (t, J=8,2 Гц, 1H), 7,41 (dd, J=1,12 и 7,56 Гц, 1H), 7,48 (t, J=7,76 Гц, 1H), 7,60 (dd, J=1,28 и 7,88 Гц, 1H), 7,78 (s, 1H), 7,90 (d, J=1,64 Гц, 1H), 8,15 (d, J=8 Гц, 1H), 8,19 (d, J=3,64 Гц, 1H), 9,55 (s, 1H), 9,65 (s, 1H); ЖХ/МС: m/e 433 (M+1).
ПРИМЕР 117
[00914] Получение 1-(4-(5-фтор-2-(фениламино)пиримидин-4-иламино)фенил)-2-метил-проп-2-ен-1-она I-185
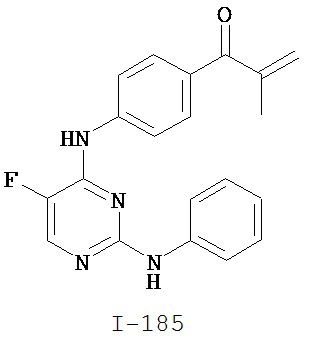
[00915] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием метил-4-аминобензоата вместо соединения 2 на Этапе 1, анилина вместо соединения 4 на Этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 1,99 (s, 3H), 5,54 (s, 1H), 1,01 (s, 1H), 6,93 (t, J=7,36 Гц, 1H), 7,24 (t, J=7,52 Гц, 2H), 7,66-7,72 (m, 4H), 8,01 (d, J=8,72 Гц, 2H), 8,19 (d, J=3,6 Гц, 1H), 9,32 (s, 1H), 9,72 (s, 1H); ЖХ/МС: m/e 348,8 (M+1).
ПРИМЕР 118
[00916] Получение N-(3-(2-(3-(2-(диметиламино)этокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-233
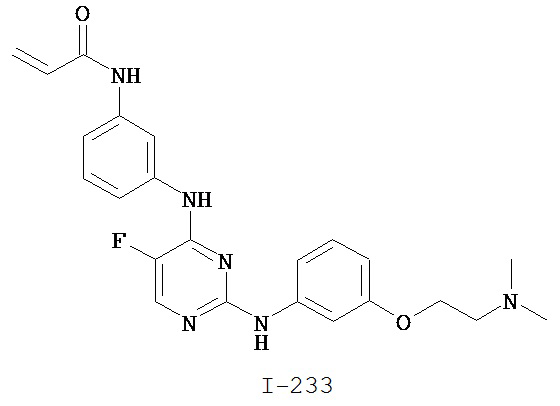
[00917] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(2-диметиламиноэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CD3OD) δ ppm: 2,31 (s, 6H), 2,76 (t, J=5,6 Гц, 2H), 3,97 (t, J=5,2 Гц, 2H), 5,78 (dd, J=2 и 9,2 Гц, 1H), 6,38-6,42 (m, 2H), 6,52-6,55 (m, 1H), 7,1-7,11 (m 2H), 7,30 (t, J=8,0 Гц, 1H), 7,36 (s, 1H), 7,42-7,48 (m, 2H), 7,94 (d, J=3,6 Гц, 1H), 8,05 (s, 1H); ЖХ/МС: m/e 437 (M+1).
ПРИМЕР 119
[00918] Получение N-(3-(5-фтор-4-(4-феноксифенокси)пиримидин-2-иламино)фенил)-акриламида I-130
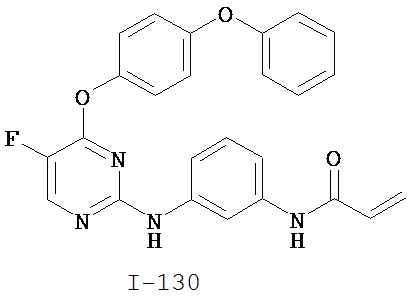
[00919] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 11, с использованием 5-фтор-2,4-дихлорпиримидина вместо соединения 1 на Этапе 1. 1H-ЯМР (ДМСО-d6) δ ppm: 5,71 (dd, J=1,6 и 10 Гц, 1H), 6,22 (dd, J=1,6 и 16,8 Гц, 1H), 6,44 (dd, J=10,4 и 17,2 Гц, 1H), 6,98-7,05 (m, 3H), 7,1-7,12 (m, 2H), 7,17 (t, J=7,2 Гц, 1H), 7,24 (t, J=7,6 Гц, 2H), 7,35-7,37 (m, 2H), 7,42 (t, J=8,4 Гц, 2H), 7,71 (s, 1H), 8,5 (s, 1H), 9,6 (s, 1H). 10,05 (s, 1H); ЖХ/МС: m/e 443,0 (M+1).
ПРИМЕР 120
[00920] Получение (S)-N-(3-(5-фтор-2-(4-(тетрагидрофуран-3-илокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-43
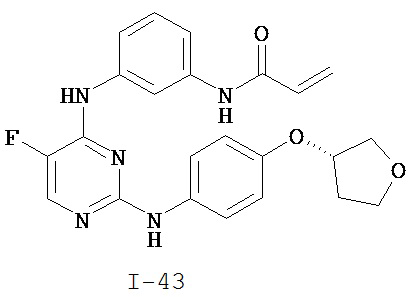
[00921] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-4-тетрагидрофуран-3-илоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 500 МГц) δ ppm: δ 10,10 (s, 1H), 9,35 (s, 1H), 8,95 (s, 1H), 8,05 (d, J=4,0 Гц, 1H), 7,92 (s, 1H), 7,52 (d, J=9,0 Гц, 2H), 7,47 (d, J=7,5 Гц, 1H), 7,41 (d, J=8,5 Гц, 1H), 7,27 (t, J=8,0 Гц, 1H), 6,72 (d, J=9,0 Гц, 2H), 6,45 (dd, J=1,5, 17,0 Гц, 1H), 6,25 (dd, J=1,1, 16,5 Гц, 1H), 5,75 (dd, J=1,1, 10,0 Гц, 1H), 4,93-4,84 (m, 1H), 3,88-3,72 (m, 4H), 2,20-2,10 (m, 1H), 1,97-1,90 (m, 1H), MS m/e 436 [M++1].
ПРИМЕР 121
[00922] Получение (R)-N-(3-(5-фтор-2-(4-(тетрагидрофуран-3-илокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-46
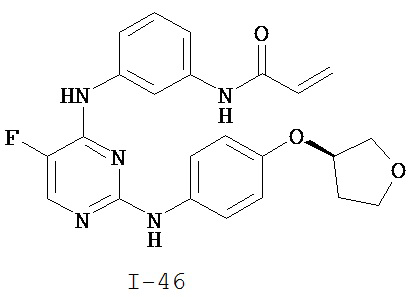
[00923] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-4-тетрагидрофуран-3-илоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 500 МГц) δ ppm: δ 10,10 (s, 1H), 9,35 (s, 1H), 8,95 (s, 1H), 8,05 (d, J=4,0 Гц, 1H), 7,92 (s, 1H), 7,52 (d, J=9,0 Гц, 2H), 7,47 (d, J=7,5 Гц, 1H), 7,41 (d, J=8,5 Гц, 1H), 7,27 (t, J=8,0 Гц, 1H), 6,72 (d, J=9,0 Гц, 2H), 6,45 (dd, J=1,5, 17,0 Гц, 1H), 6,25 (dd, J=1,1, 16,5 Гц, 1H), 5,75 (dd, J=1,1, 10,0 Гц, 1H), 4,93-4,84 (m, 1H), 3,88-3,72 (m, 4H), 2,22-2,14 (m, 1H), 1,97-1,90 (m, 1H), MS: m/e 436 [M++1]
ПРИМЕР 122
[00924] Получение N-(3-(5-фтор-2-(3-((1-метилпиперидин-3-ил)метокси)фениламино)-пиримидин-4-иламино)фенил)-акриламида I-76
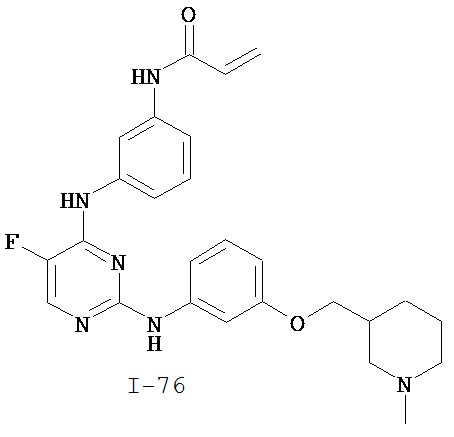
[00925] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(1-метилпиперидин-3-ил)метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 500 МГц) δ ppm: δ 10,08 (s, 1H), 9,41 (s, 1H), 9,09 (s, 1H), 8,11 (d, J=3,5 Гц, 1H), 7,90 (s, 1H), 7,57 (d, J=8,0 Гц, 1H), 7,41 (d, J=8,0 Гц, 1H), 7,32 (s, 1H), 7,30-7,20 (m, 2H), 7,03 (t, J=8,0 Гц, 1H), 6,50-6,40 (m, 2H), 6,24 (dd, J=1,5, 17,0 Гц, 1H), 5,74 (dd, J=2,0, 10,5 Гц, 1H), 3,75-3,65 (m, 2H), 2,73 (d, J=10 Гц, 1H), 2,60 (d, J=10,5 Гц, 1H), 2,13 (s, 3H), 1,98-1,83 (m, 2H), 1,75-1,58 (m, 3H), 1,55-1,45 (m, 1H), 1,05-0,95 (m, 1H), MS: m/e 477 (M++1).
ПРИМЕР 123
[00926] Получение N-(3-(5-фтор-2-(3-((1-метилпиперидин-4-ил)метокси)фениламино)-пиримидин-4-иламино)фенил)-акриламида I-82
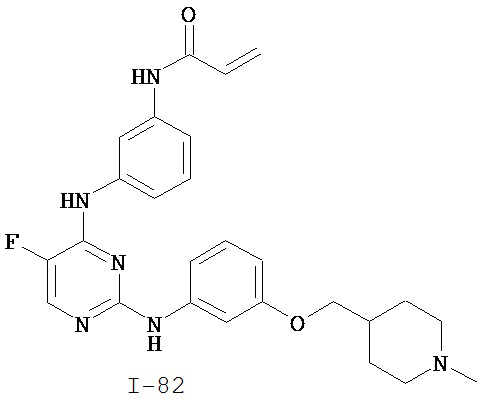
[00927] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(1-метилпиперидин-4-ил)метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3+ДМСО-d6, 500 МГц): δ 9,04 (bs, 1H), 8,30 (s, 1H), 7,96 (s, 1H), 7,75 (s, 1H), 7,63 (s, 1H), 7,59 (d, J=7,0 Гц, 1H), 7,38-7,33 (m, 2H), 7,27 (t, J=8,5 Гц, 1H), 7,16 (t, J=8 Гц, 1H), 7,09 (d, J=8,5 Гц, 1H), 6,52 (d, J=7,0 Гц, 1H), 6,51-6,38 (m, 2H), 5,73 (dd, J=2,0, 9,0 Гц, 1H), 3,77 (d, J=6,0 Гц, 2H), 2,90-2,84 (m, 2H), 2,28 (s, 3H), 1,95 (t, J=10,0 Гц, 1H), 1,85-1,74 (m, 2H), 1,45-1,32 (m, 2H), 1,28-1,25 (m, 2H), MS: m/e 477 (M++1).
ПРИМЕР 124
[00928] Получение N-(3-(2-(3-(4-(2-гидроксиэтил)пиперазин-1-ил)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-83
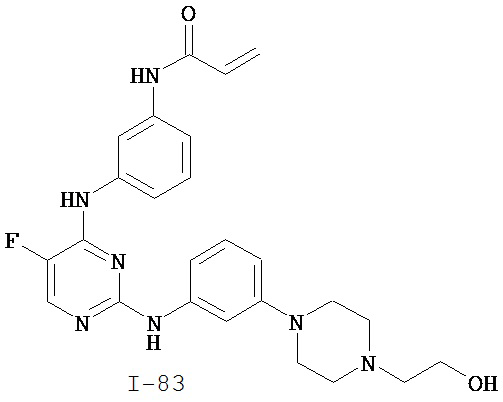
[00929] Указанное в названии соединение получали используя этапы, схемы и промежуточные соединения, описанные в Примере 20, с использованием 3-(4-(2-трет-бутилдиметилсилилоксиэтил)пиперазин-1-иланилина вместо соединения 4 на Этапе 2 и снятие защиты эфирной TBS группой с помощью TFA в ДХМ представляло собой Этап 5. 1H-ЯМР (ДМСО-d6, 500 МГц): δ 8,99 (s, 1H), 8,85 (s, 1H), 8,04 (d, J=4,0 Гц, 1H), 7,28-7,19 (m, 2H), 7,08-7,00 (m, 2H), 6,94 (t, J=3,5 Гц, 2H), 6,48 (dd, J=2,0, 8,0 Гц, 1H), 6,35-6,31 (m, 1H), 4,94 (s, 2H), 3,71 (t, J=6,0 Гц, 2H), 3,02 (t, J=4,5 Гц, 4H), 2,57-2,50 (m, 4H), 2,46 (t, J=6,0 Гц, 2H), 0,87 (s, 9H), 0,05 (s, 6H), MS: m/e 538 (M++1).
ПРИМЕР 125
[00930] Получение N-(4-(5-фтор-2-(3-метоксифениламино)пиримидин-4-иламино)-бензил)-N-метилакриламида I-113
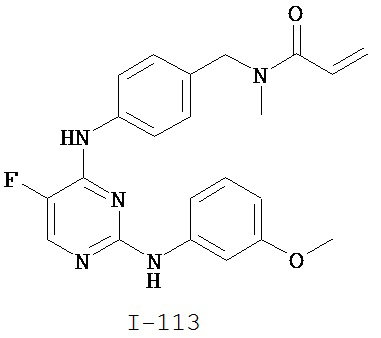
[00931] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(N-метил-N-трет-бутилоксикарбониламино)метиланилина вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 200 МГц): δ 9,36 (bs, 1H), 9,16 (bs, 1H), 8,10 (d, J=3,4 Гц, 1H), 7,83-7,70 (m, 2H), 7,34 (bs, 1H), 7,26-7,01 (m, 4H), 6,86-6,73 (m, 1H), 6,48 (d, J=8,0 Гц, 1H), 6,21 (dd, J=16,4, 2,2 Гц, 1H), 5,76- 5,64 (m, 1H), 4,64-4,53 (2s, 2H), 3,65 (s, 3H), 3,00-2,88 (2s, 3H). MS: m/e 408,2 [M++1].
ПРИМЕР 126
[00932] Получение N-(4-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)бензил)-N-метилакриламида I-114
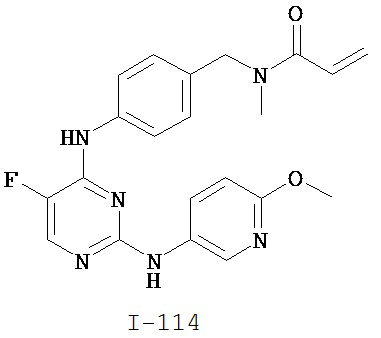
[00933] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(N-метил-N-трет-бутилоксикарбониламино)метиланилина вместо соединения 2 на Этапе 1 и 6-метокси-3-аминопиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 200 МГц): δ 9,36 (bs, 1H), 9,09 (bs, 1H), 8,32 (bs, 1H), 8,06 (dd, J=3,8 Гц, 1H), 7,97-7,92 (m, 1H), 7,76-7,68 (m, 2H), 7,20-7,08 (m, 2H), 6,87-6,75 (m, 1H), 6,72 (d, J=8,4 Гц, 1H), 6,22 (dd, J=19,4, 2,6 Гц, 1H), 5,74-5,65 (m, 1H), 4,64-4,53 (два s, 2H), 3,78 (s, 3H), 3,00-2,88 (два s, 3H). MS: m/e 409 (M++1).
ПРИМЕР 127
[00934] Получение N-(3-(5-фтор-2-(3-метиоксифениламино)пиримидин-4-иламино)-бензил)-N-метилакриламида I-115
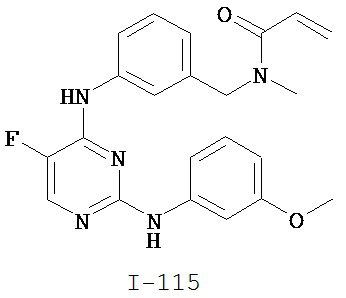
[00935] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(N-метил-N-трет-бутилоксикарбониламино)метиланилина вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 200 МГц): δ 9,50-9,30 (m, 1H), 9,15-8,96 (m, 1H), 8,15 (bs, 1H), 7,82-7,59 (m, 2H), 7,45-7,00 (m, 4H), 6,97-6,65 (m, 2H), 6,55-6,45 (m, 1H), 6,26-6,12 (m, 1H), 5,78-5,60 (m, 1H), 4,68 (s, 1H), 4,55 и 3,75 (2 s, 3H), 2,90 и 3,00 (2 s, 3H). MS: m/e 408,2 [M++1].
ПРИМЕР 128
[00936] Получение N-(3-(5-фтор-2-(3-(4-(2-гидроксиэтил)пиперазин-1-ил)фениламино)-пиримидин-4-илокси)фенил)акриламида I-84
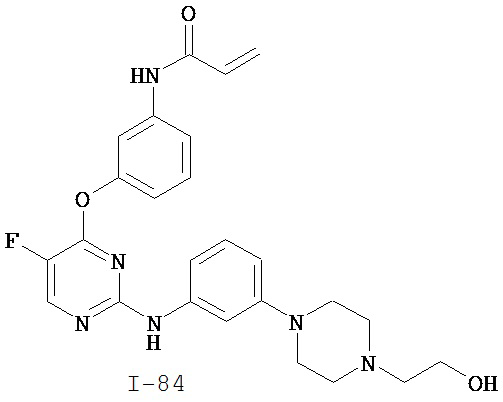
[00937] Указанное в названии соединение получали используя этапы, схемы и промежуточные соединения, описанные в Примере 98, с использованием 3-(4-(2-трет-бутилдиметилсилилоксиэтил)пиперазин-1-иланилина вместо соединения 4 на Этапе 2 и снятие защиты эфирной TBS группой с помощью TFA в ДХМ представляло собой эЭтап 5. 1H-ЯМР (ДМСО-d6, 500 МГц): δ 8,19 (s, 1H), 7,75-7,70 (m, 2H), 7,42-7,35 (m, 2H), 7,12-7,05 (m, 2H), 6,97 (dd, J=2,0, 10,5 Гц, 1H), 6,93 (s, 1H), 6,72 (d, J=6,5 Гц, 1H), 6,57-6,54 (m, 1H), 6,44 (d, J=17,0 Гц, 1H), 6,29-6, 20 (m, 1H), 5,78 (d, J=10,0 Гц, 1H), 3,68 (t, J=5,5 Гц, 2H), 3,00-2,94 (m, 4H), 2,63-2,56 (m, 6H). MS: m/e 479 (M++1).
ПРИМЕР 129
[00938] Получение N-(3-(5-фтор-2-(3-((1-метилпиперидин-3-ил)метокси)фениламино)-пиримидин-4-илокси)фенил)акриламида I-81
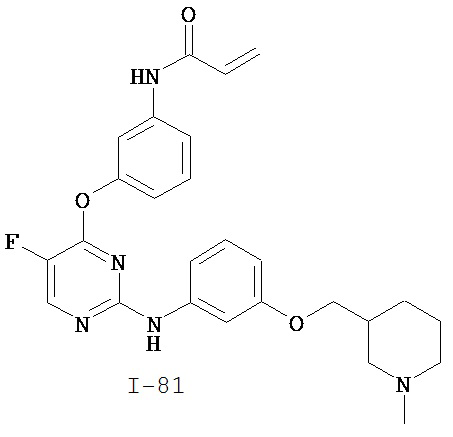
[00939] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием 3-(1-метилпиперидин-3-ил)метоксианилина вместо соединения 4 на Этапе 2. 1Н-ЯМР (CDCl3, 500 МГц): δ 8,19 (d, J=2,5 Гц, 1H), 7,82-7,75 (m, 2H), 7,42-7,36 (m, 2H), 7,08-7,02 (m, 3H), 6,99 (d, J=7,0 Гц, 1H), 6,91 (s, 1H), 6,79 (d, J=7,5 Гц, 1H), 6,48-6,44 (m, 1H), 6,42 (s, 1H), 6,29-6,23 (m, 1H), 5,77 (d, J=10 Гц, 1H), 3,67-3,62 (m, 2H), 2,95-2,91 (m, 1H), 2,82 2,76 (m, 1H), 2,28 (s, 3H), 2,11-2,05 (m, 1H), 1,98-1,92 (m, 1H), 1,79-1,70 (m, 3H), 1,11-1,04 (m, 1H). MS: m/e 478 (M++1).
ПРИМЕР 130
[00940] Получение N-(3-(5-фтор-2-(3-((1-метилпиперидин-4-ил)метокси)фениламино)-пиримидин-4-илокси)фенил)-акриламида I-75
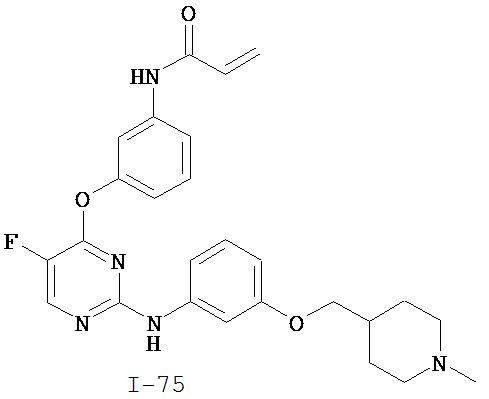
[00941] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием 3-(1-метилпиперидин-4-ил)метоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6, 500 МГц): δ 10,31 (s, 1H), 9,50 (s, 1H), 8,50 (s, 1H), 7,67 (s, 1H), 7,55 (d, J=8,0 Гц, 1H), 7,42 (t, J=8,0 Гц, 1H), 7,10 (s, 1H), 7,04 (d, J=7,0 Гц, 2H), 6,94 (t, J=8,0 Гц, 1H), 6,45-6,39 (m, 2H), 6,27 (d, J=15,0 Гц, 1H), 5,78 (dd, J=2,0, 10,5 Гц, 1H), 3,64 (d, J=6,0 Гц, 2H), 2,75 (d,J=6,5 Гц, 2H), 2,14 (s, 3H), 1,83 (t,J=10,5 Гц, 2H), 1,66-1,64 (m, 3H), 1,25-1,23 (m, 2H). MS: m/e 478 (M++1).
ПРИМЕР 131
[00942] Получение N-(3-(5-циано-2-(фениламино)пиримидин-4-иламино)фенил)-акриламида I-157
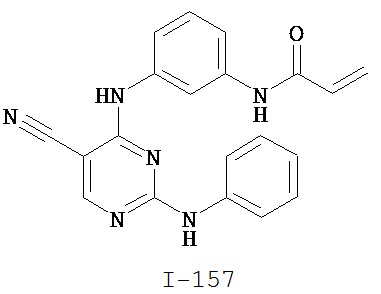
[00943] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 94, с использованием 2,4-дихлор-5-цианопиримидина вместо соединения 4 на Этапе 2. MS 379,1 (M+Na).
ПРИМЕР 132
[00944] Получение N-(3-(5-фтор-2-(3-(трифторметокси)фениламино)пиримидин-4-ил-амино)фенил)акриламида I-244
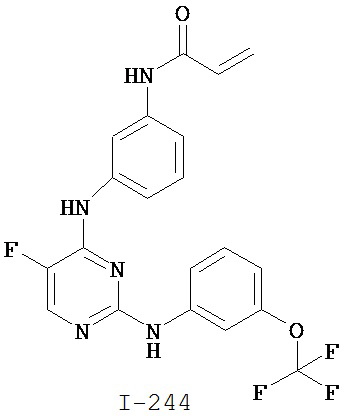
[00945] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(трифторметокси)анилина вместо соединения 4 на Этапе 2. MS 434,1 (M++1).
ПРИМЕР 133
[00946] Получение N-(3-(5-фтор-2-(пиридин-3-иламино)пиримидин-4-иламино)фенил)-акриламида I-234
[00947] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-аминопиридина вместо соединения 4 на Этапе 2. MS 351,1 (M+1).
ПРИМЕР 134
[00948] Получение N-(3-(5-фтор-2-(4-фторфениламино)пиримидин-4-иламино)фенил)-акриламида I-247
[00949] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-фторанилина вместо соединения 4 на Этапе 2. MS 368,1 (M+1).
ПРИМЕР 135
[00950] Получение N-(3-(5-фтор-2-(3-(3-морфолинопропокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-208
[00951] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(3-морфолинопропокси)анилина вместо соединения 4 на Этапе 2. MS 515,3 (M+Na).
ПРИМЕР 136
[00952] Получение N-(3-(2-(3-(3-(1H-имидазол-1-ил)пропокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-204
[00953] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(3-(1H-имидазол-1-ил)пропокси)анилина вместо соединения 4 на Этапе 2. MS 474,3 (M+Na).
ПРИМЕР 137
[00954] Получение N-(3-(2-(1-ацетилпиперидин-3-иламино)-5-фторпиримидин-4-ил-амино)фенил)акриламида I-238

[00955] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 1-(3-аминопиперидин-1-ил)этанона вместо соединения 4 на Этапе 2. MS 421,1 (M+Na).
ПРИМЕР 138
[00956] Получение N-(3-(5-фтор-2-(фениламино)пиримидин-4-илокси)фенил)акрил-амида I-228
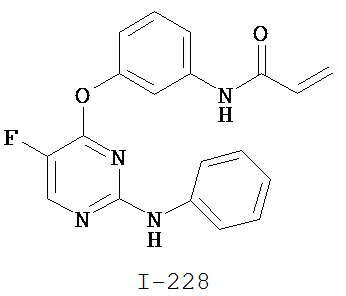
[00957] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием анилина вместо соединения 4 на Этапе 2. MS 351,3 (M+1).
ПРИМЕР 139
[00958] Получение N-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)фенил)акриламида I-243
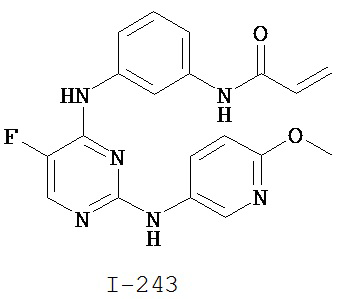
[00959] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-метоксипиридин-3-амина вместо соединения 4 на Этапе 2. MS 381,1 (M+1).
ПРИМЕР 140 [00960] Получение N-(3-(5-метокси-2-(3-метоксифениламино)пиримидин-4-иламино)-фенил)акриламида I-158
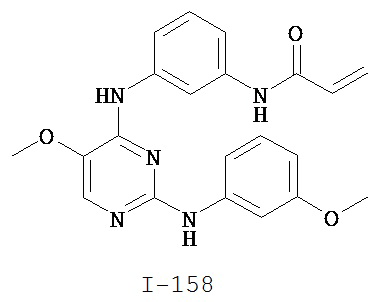
[00961] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 1, с использованием 5-метокси-2,4-дихлорпиримидина вместо соединения 1 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 392,3 (M+1).
ПРИМЕР 141
[00962] Получение N-(3-(5-метокси-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)фенил)акриламида I-192
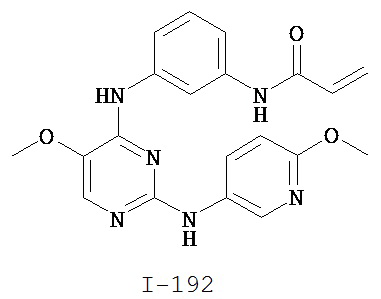
[00963] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 1, с использованием 5-метокси-2,4-дихлорпиримидина вместо соединения 1 на Этапе 1 и 5-амино-2-метоксипиридина вместо соединения 4 на Этапе 2. MS 393,3 (M+1).
ПРИМЕР 142
[00964] Получение N-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-окси)фенил)акриламида I-222
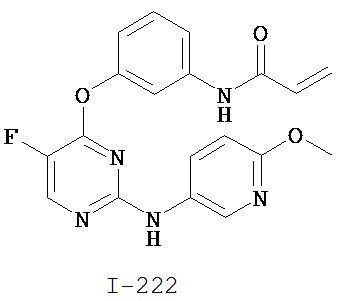
[00965] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 382,3 (M+1).
ПРИМЕР 143
[00966] Получение 4-(3-акриламидофениламино)-N-трет-бутил-2-(6-метоксипиридин-3-иламино)пиримидин-5-карбоксамида I-216
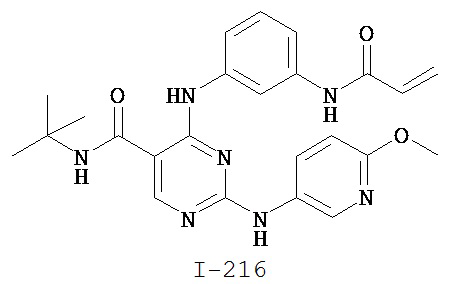
[00967] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 37, с использованием трет-бутиламина вместо соединения 2 на Этапе 1, и пропуская Этап 6. MS 484,3 (M+Na).
ПРИМЕР 144
[00968] Получение (R)-1-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)пиперидин-1-ил)проп-2-ен-1-она I-202
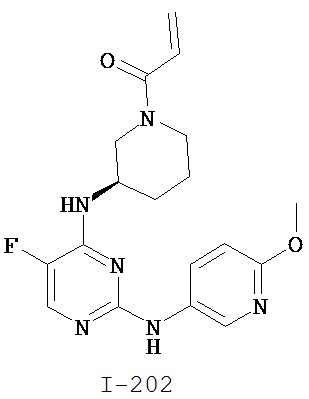
[00969] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 395,3 (M+Na).
ПРИМЕР 145
[00970] Получение (R)-1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-иламино)-пиперидин-1-ил)проп-2-ен-1-она I-195
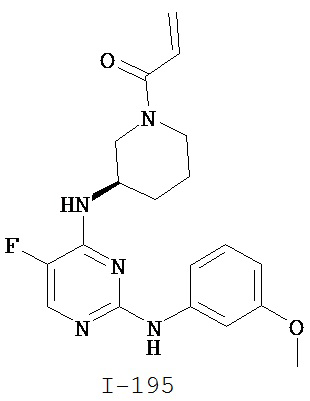
[00971] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 394,3 (M+Na).
ПРИМЕР 146
[00972] Получение (S)-1-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)пиперидин-1-ил)проп-2-ен-1-она I-197
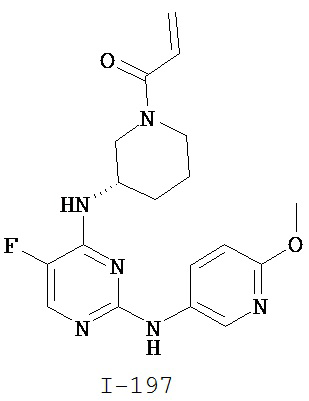
[00973] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 373,3 (M+1).
ПРИМЕР 147
[00974] Получение (S)-1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-иламино)-пиперидин-1-ил)проп-2-ен-1-она I-196
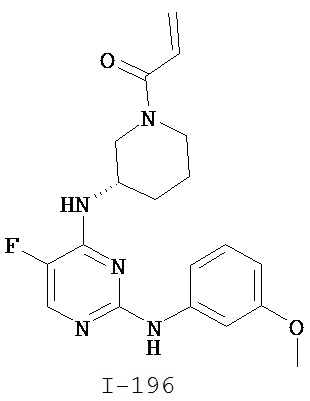
[00975] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-6утил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 372,3 (M+1).
ПРИМЕР 148
[00976] Получение (R)-1-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-окси)пиперидин-1-ил)проп-2-ен-1-она I-180
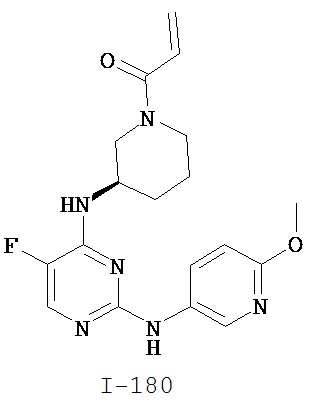
[00977] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием (R)-трет-бутил-3-гидроксипиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 374,3 (M+l).
ПРИМЕР 149
[00978] Получение (R)-1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-илокси)-пиперидин-1-ил)проп-2-ен-1-она I-190
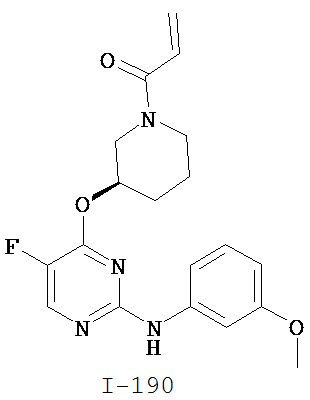
[00979] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием (R)-трет-бутил-3-гидроксипиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 395,3 (M+Na).
ПРИМЕР 150
[00980] Получение (S)-1-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-окси)пиперидин-1-ил)проп-2-ен-1-она I-193
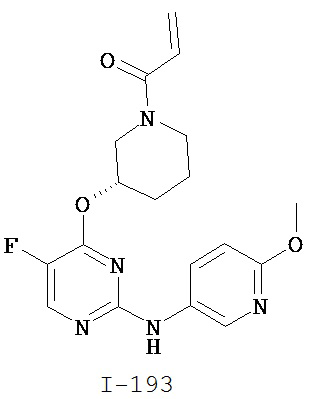
[00981] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием (S)-трет-6утил-3-гидроксипиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 396,3 (M+Na).
ПРИМЕР 151
[00982] Получение (S)-1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-илокси)-пиперидин-1-ил)проп-2-ен-1-она I-179
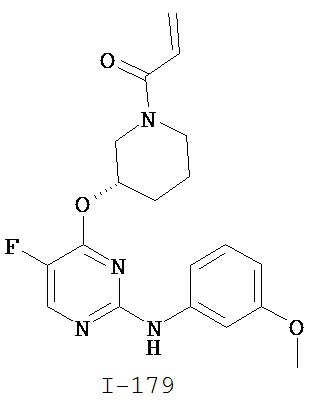
1-179
[00983] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием (S)-трет-5утил-3-гидроксипиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 395,3 (M+Na).
ПРИМЕР 152
[00984] Получение 1-(3-(5-фтор-2-(6-метоксипиридин-3-иламино)пиримидин-4-ил-амино)пирролидин-1-ил)проп-2-ен-1-она I-203

[00985] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-амино-6-метоксипиридина вместо соединения 4 на Этапе 2. MS 381,3 (M+Na).
ПРИМЕР 153
[00986] Получение 1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-иламино)-пирролидин-1-ил)проп-2-ен-1-она I-201
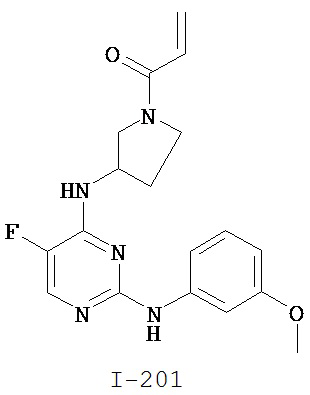
[00987] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-аминопирролидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 358,3 (M+1).
ПРИМЕР 154
[00988] Получение (R)-1-(3-(5-фтор-2-(3-метоксифениламино)пиримидин-4-илтио)-пиперидин-1-ил)проп-2-ен-1-она I-137
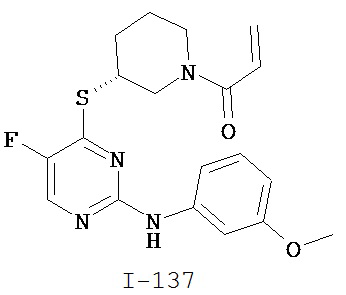
[00989] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-меркаптопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-метоксианилина вместо соединения 4 на Этапе 2. MS 411,1 (M+Na).
ПРИМЕР 155
[00990] Получение (R)-1-(3-(2-(3-хлорфениламино)-5-фторпиримидин-4-иламино)-пиперидин-1-ил)проп-2-ен-1-она I-147
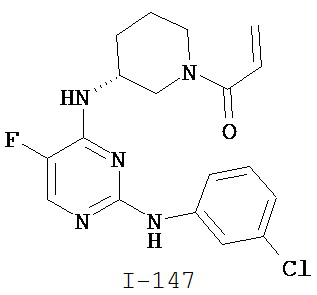
[00991] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-хлоранилина вместо соединения 4 на Этапе 2. MS 376,1 (M+1).
ПРИМЕР 156
[00992] Получение (R)-1-(3-(5-фтор-2-(3-(2-морфолиноэтокси)фениламино)пиримидин-4-иламино)пиперидин-1-ил)проп-2-ен-1-она I-135
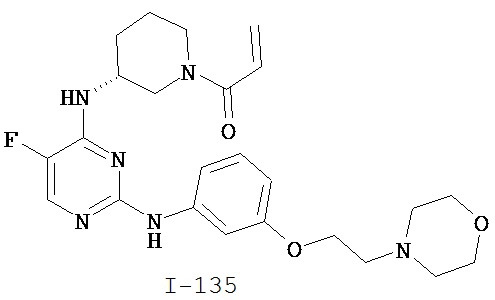
[00993] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-трет-бутил-3-аминопиперидин-1-карбоксилата вместо соединения 2 на Этапе 1 и 3-(2-морфолиноэтокси)анилина вместо соединения 4 на Этапе 2. MS 471,3 (M+1).
ПРИМЕР 157
[00994] Получение (E)-4-(диметиламино)-N-(3-(5-фтор-2-(6-метоксипиридин-3-ил-амино)пиримидин-4-иламино)фенил)бут-2-енамида I-125

[00995] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 139, с использованием (E)-4-(диметиламино)бут-2-еноилхлорида вместо соединения 7 на Этапе 4. MS 460,1 (M+Na).
ПРИМЕР 158
[00996] Получение 2-((1H-пиразол-1-ил)метил)-N-(3-(5-фтор-4-(м-толиламино)-пиримидин-2-иламино)фенил)акриламида I-98

[00997] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием 2-((1H-пиразол-1-ил)метил)акрилоилхлорида вместо соединения 6 на Этапе 3. MS 466,1 (M+Na).
ПРИМЕР 159
[00998] Получение (E)-4-(азетидин-1-ил)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)фенил)бут-2-енамида I-123
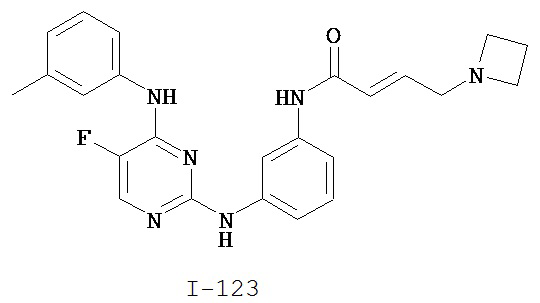
[00999] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (E)-4-(азетидин-1-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 455,1 (M+Na).
ПРИМЕР 160
[001000] Получение (E)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)-фенил)-4-морфолинобут-2-енамида I-102
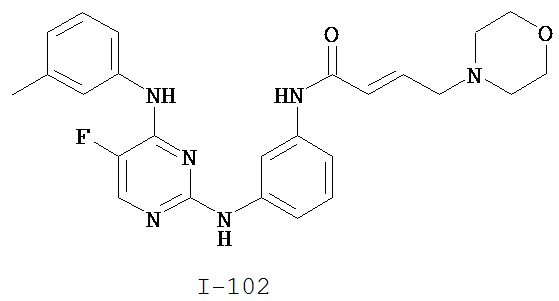
[001001] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (Е)-4-(морфолин-4-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 485,3 (M+Na).
ПРИМЕР 161
[001002] Получение (E)-4-((1S,4S)-2,5-диазабицикло[2.2.1]гептан-2-ил)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)фенил)бут-2-енамида I-101
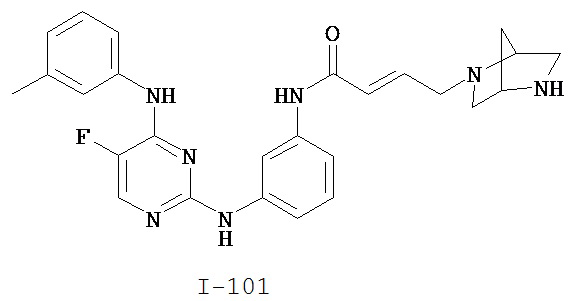
[001003] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (E)-4-((1S,4S)-2,5-диазабицикло[2.2.1]гептан-2-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 496,1 (M+Na).
ПРИМЕР 162
[001004] Получение (E)-N-[-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)-фенил)-4-((2-метоксиэтил)(метил)амино)бут-2-енамида I-120
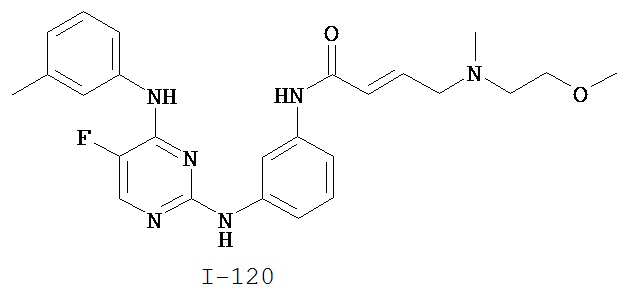
[001005] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (E)-4-((2-метоксиэтил)(метил)амино)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 487,3 (M+Na).
ПРИМЕР 163
[001006] Получение (S,E)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)-фенил)-4-(3-гидроксипирролидин-1-ил)бут-2-енамида I-99
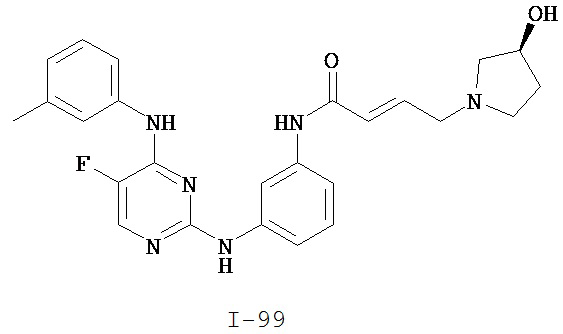
[001007] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (S,E)-4-(3-гидроксипирролидин-1-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 485,3 (M+Na).
ПРИМЕР 164
[001008] Получение (R,E)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)-фенил)-4-(3-гидроксипирролидин-1-ил)бут-2-енамида I-104
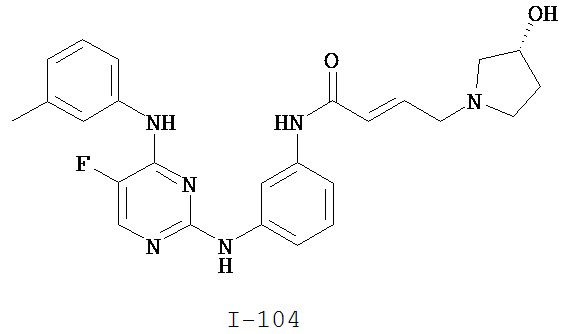
[001009] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (R,E)-4-(3-гидроксипирролидин-1-ил)бут-2-еноила вместо соединения 6 на Этапе 3. MS 485,3 (M+Na).
ПРИМЕР 165
[001010] Получение (E)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)-фенил)-4-(1H-пиразол-1-ил)бут-2-енамида I-100
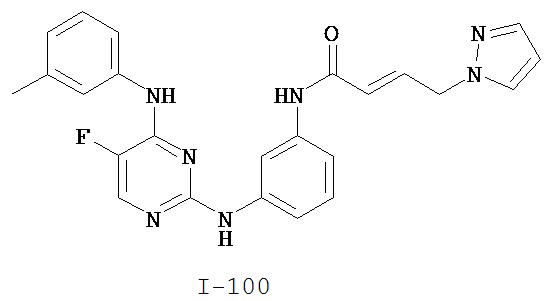
[001011] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (E)-4-(1H-имидазол-1-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 466,1 (M+Na).
ПРИМЕР 166
[001012] Получение (R,E)-N-(3-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-4-(3-гидроксипирролидин-1-ил)бут-2-енамида I-89
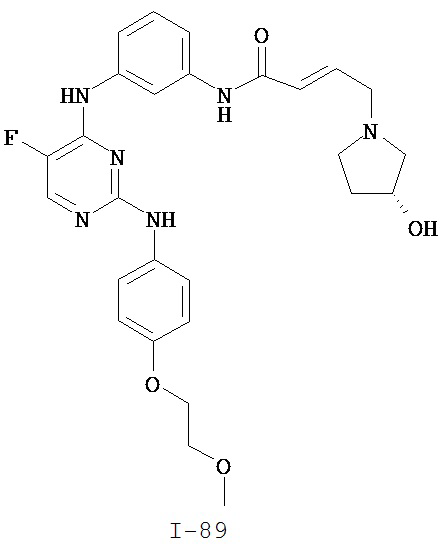
[001013] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R,E)-4-(3-гидроксипирролидин-1-ил)бут-2-еноилхлорида вместо соединения 7 на Этапе 4. MS 545,3 (M+Na).
ПРИМЕР 167
[001014] Получение (S,E)-N-(3-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-4-(3-гидроксипирролидин-1-ил)бут-2-енамида I-88
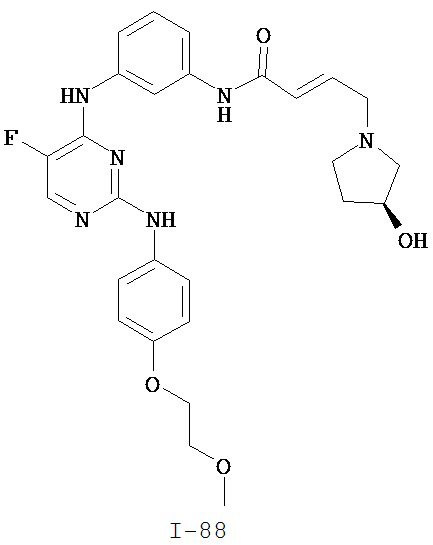
[001015] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S,E)-4-(3-гидроксипирролидин-1-ил)бут-2-еноилхлорида вместо соединения 7 на Этапе 4. MS 545,3 (M+Na).
ПРИМЕР 168
[001016] Получение 2-((1H-пиразол-1-ил)метил)-N-(3-(5-фтор-2-(4-(2-метокси-этокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-85
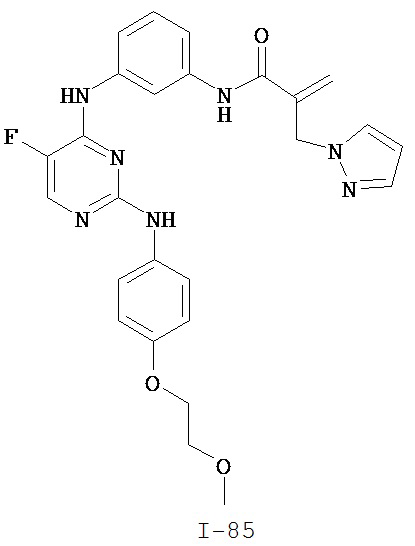
[001017] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 2-((1H-пиразол-1-ил)метил)акрилоилхлорида вместо соединения 7 на этапе 4. MS 526,1 (M+Na).
ПРИМЕР 169
[001018] Получение N-(3-(5-фтор-2-(фениламино)пиримидин-4-иламино)фенил)-акриламида I-28
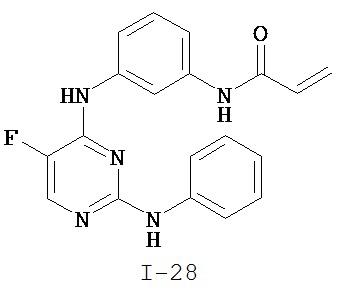
[001019] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием анилина вместо соединения 4 на Этапе 2. MS 372,1 (M+Na).
ПРИМЕР 170
[001020] Получение (E)-4-((3R,5S)-3,5-диметилпиперазин-1-ил)-N-(3-(5-фтор-4-(м-толиламино)пиримидин-2-иламино)фенил)бут-2-енамида I-119
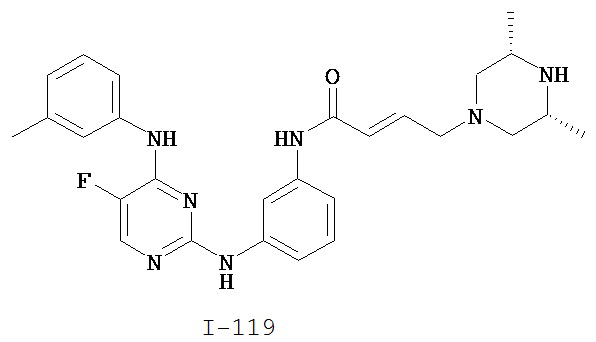
[001021] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (E)-4-((3R,5S)-3,5-диметилпиперазин-1-ил)бут-2-еноилхлорида вместо соединения 6 на Этапе 3. MS 512,3 (M+Na).
ПРИМЕР 171
[001022] Получение 1-(3-(5-метил-2-(3-аминосульфонилфениламино)пиримидин-4-ил-амино)фенил)-3-метилбут-2-ен-1-она I-224
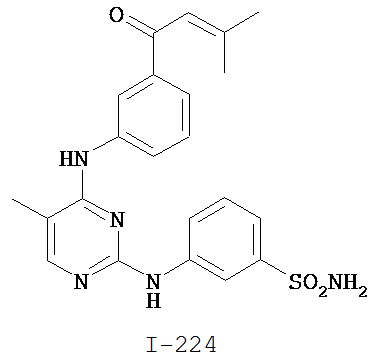
[001023] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 112, с использованием 2,4-дихлор-5-метилпиримидина вместо соединения 1 на Этапе 1 и 3-аминобензолсульфонамида вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,97 (s, 3H), 2,14 (s, 6H), 6,88 (s, 1H), 7,25-7,30 (m, 4H), 7,47 (t, J=7,92 Гц, 1H), 7,62 (d, J=7,72 Гц, 1H), 7,96 (s, 1H), 8,0-8,07 (m, 3H), 8,20 (t, J=7,36 Гц, 1H), 8,55 (s, 1H), 9,37 (s, 1H); ЖХ/МС: m/e 438 (M+1).
ПРИМЕР 172
[001024] Получение N-(3-акриламидофенил)-N-(5-циано-2-(6-метоксипиридин-3-ил-амино)пиримидин-4-ил)акриламида I-171
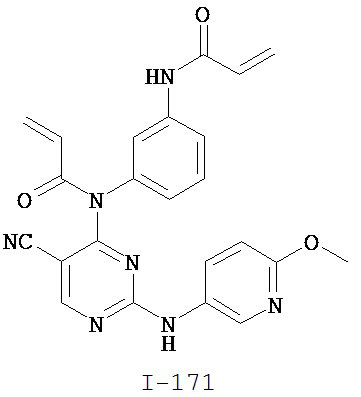
[001025] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 95, с использованием избытка акрилоилхлорида на Этапе 4. MS m/z. 442,1 (M+H+).
ПРИМЕР 173
[001026] Получение N-3-(N-метил-N-(5-фтор-2-(4-метил-3,4-дигидро-2H-бензо-[b][1,4]оксазин-6-иламино)пиримидин-4-ил)аминофенилакриламида I-127
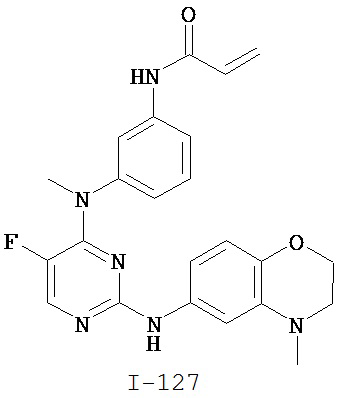
[001027] Указанное в названии соединение получали обработкой продукта, полученного по Примеру 88, избытком формальдегида и NaBH3CN (2 экв.) в ацетонитриле и уксусной кислоте (4:1). MS m/z: 435,1 (M+H+).
ПРИМЕР 174
[001028] Получение N-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)бензил)-акриламида I-205

[001029] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 2,4-дихлор-5-метилпиримидина вместо соединения 1 и 3-(трет-бутоксикарбониламино)метиланилина вместо соединения 2 на Этапе 1 и анилина вместо соединения 4 на Этапе 2. 1H-NMR (CDCl3, 500 МГц): δ 7,91 (s, 1H), 7,77 (s, 1H), 7,57 (d, J=9,0 Гц, 2H), 7,41 (d, J=8,0 Гц, 1H), 7,36-7,26 (m, 2H), 7,13-6,96 (m, 4H), 6,36-6,25 (m, 2H), 5,97 (dd, J=10,5, 17,0 Гц, 1H), 5,78 (bs, 1H), 5,63 (d, J=10,5 Гц, 1H), 4,51 (d, J=6,0 Гц, 2H), 2,12 (s, 3H). MS: m/e 360 (M++1).
ПРИМЕР 175
[001030] Получение (E)-3-(5-метил-2-(фениламино)пиримидин-4-иламино)бензил-бут-2-еноата I-246
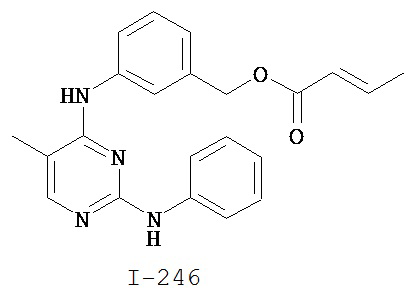
[001031] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
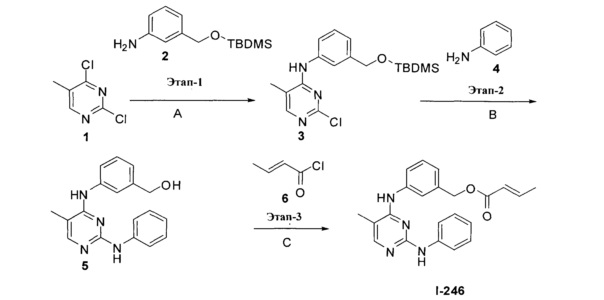
A) соединение 2, Xanthphos, Pd2(dba)3, Cs2CO3, CH3CN, 90°C, 12 часов; B) соединение 4, трет-BuOH, 90°C, 4 часа; C) соединение 6, ТЭА, ДХМ, -30°C, 5 минут
[001032] Этап 1
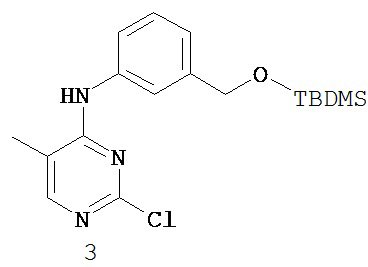
[001033] К раствору соединения 1 (0,34 г, 2,08 ммоль) в ацетонитриле (5 мл) добавляли при перемешивании Cs2CO3 (1,09 г, 3,35 ммоль), Xanthphos (0,024 г, 0,041 ммоль) и трис(дибензилиденацетон)-дипалладий (0) (Pd2(dba)3) (38 мг, 0,04 ммоль) и соединение 2 (0,5 г, 2,1 ммоль) при комнатной температуре в атмосфере N2. Продували в реакционную смесь аргон в течение 1 часа и перемешивали при температуре 90°C в течение 12 часов. Степень протекания реакции определяли методом ТСХ. Реакционную смесь фильтровали через слой целита, после чего фильтрат концентрировали при пониженном давлении. Сырой продукт очищали методом колоночной хроматографии на силикагеле с получением соединения 3 (0,56 г, 29,16%) в виде светло-желтого жидкости. 1H-NMR (CDCl3, 500 МГц): δ 8,0 (s, 1H), 7,55 (s, 1H), 7,51 (d, J=8,0 Гц, 1H), (t, J=7,5 Гц, 1H), (d, J=7,5 Гц, 1H), 6,48 (s, 1H), 4,76 (s, 2H), 2,18 (s, 3H), 0,95 (s, 9H), 0,10 (s, 6H). MS: m/e 364 [M++1].
[001034] Этап 2
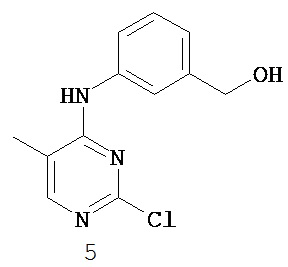
[001035] К раствору соединения 3 (0,07 г, 0,19 ммоль) в трет-BuOH (1,5 мл) при перемешивании при комнатной температуре добавляли соединение 4 (0,018 г, 0,19 ммоль). Реакционную смесь нагревали до 90°C и перемешивали в течение 4 часов при этой температуре. Степень протекания реакции определяли методом ТСХ. После исчезновения исходных реагентов летучие растворители отгоняли при пониженном давлении с получением соединения 5 (0,033 г, 55,9%) в виде светло-желтого твердого продукта. 1H-NMR (ДМСО-d6, 500 МГц): δ 10,45 (s, 1H), 9,82 (s, 1H), 7,91 (s, 1H), 7,58-7.01 (m, 9H), 4,50 (s, 2H), 2,16 (s, 3H). MS: m/e 307 [M++1].
[001036] Этап 3
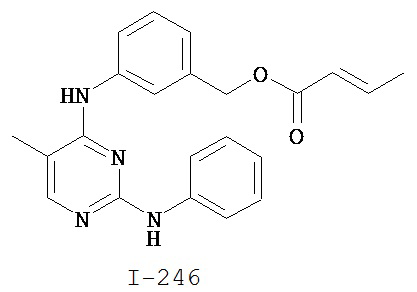
[001037] К раствору соединения 5 (0,5 г, 1,63 ммоль) в ДХМ (5 мл) при перемешивании при температуре -30°C в атмосфере N2 добавляли соединение 6 (0,18 г, 1,72 ммоль), а затем триэтиламин (ТЭА) (0,66 мл, 4,78 ммоль). Реакционную смесь перемешивали в течение 5 минут при температуре -30°C, а степень протекания реакции определяли методом TCX. После завершения реакции гасили реакционную массу водой и экстрагировали ДХМ (2×50 мл). Органический слой отделяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Сырой продукт очищали методом колоночной хроматографии на силикагеле с получением 50 мг смеси изомеров указанного в названии соединения. Смесь в ДХМ (2 мл) обрабатывали диазабициклоундецен (DBU) (0,02 г, 0,127 ммоль) при комнатной температуре. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, гасили водой и экстрагировали ДХМ (2×10 мл). Органический слой отделяли, сушили над безводным Na2SO4 и концентрировали при пониженном давлении с получением 1-246 (0,05 г, 10%) в виде светло-желтого продукта. 1H-NMR (CDCl3, 500 МГц): δ 7,87 (s, 1H), 7,65 (s, 1H), 7,58-7,51 (m, 3H), 7,34 (t, J=7,5 Гц, 1H), 7,30-7,23 (m, 3H), 7,13 (d, J=7,5 Гц, 1H), 7,08-6,96 (m, 2H), 6,40 (s, 1H), 5,87 (dd, J=1,5, 15,5 Гц, 1H), 5,16 (s, 2H), 2,13 (s, ЗН), 1,87 (dd, J=2,0, 7,0 Гц, 3H), 13C-NMR (CDCl3, 125 МГц): δ 166,3, 159,1, 158,4, 155,4, 145,3, 139,9, 138,9, 137,0, 128,9, 128,7, 123,2, 122,4, 121,9, 121,2, 121,0, 119,3, 105,2,65,7, 17,9, 13,2. MS: m/e 375 [M++1].
ПРИМЕР 176
[001038] Получение (Е)-4-(5-метил-2-(фениламино)пиримидин-4-иламино)бензил-бут-2-еноата I-60
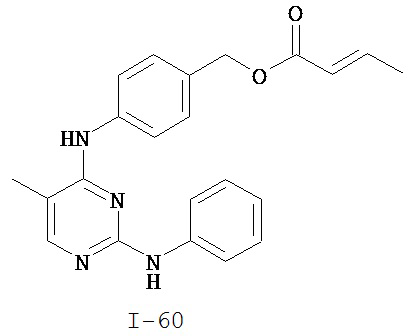
[001039] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 175, с использованием 4-((трет-бутилдиметилсилилокси)метил)анилина вместо соединения 2 на Этапе 1. 1H-ЯМР (CDCl3, 500 МГц): δ 8,19 (bs, 1H), 7,81 (s, 1H), 7,56 (d, J=8,5 Гц, 2H), 7,53 (d, J=7,5 Гц, 2H), 7,42-7,36 (m, 3H), 7,28-7,22 (m, 1H), 7,08-6,98 (m, 2H), 6,54 (s, 1H), 5,89 (dd, J=12,5, 14,0 Гц, 1H), 5,17 (s, 2H), 2,15 (s, 3H), 1,89 (dd, J=1,5, 7,0 Гц, 3H). MS: m/e 375 [M++1].
ПРИМЕР 177
[001040] Получение N-метил-N-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)-бензил)акриламида I-220
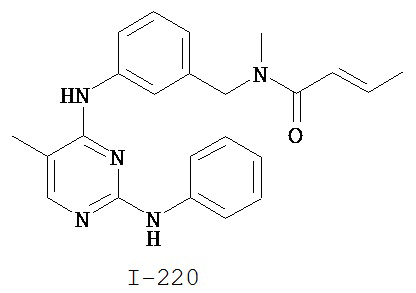
[001041] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
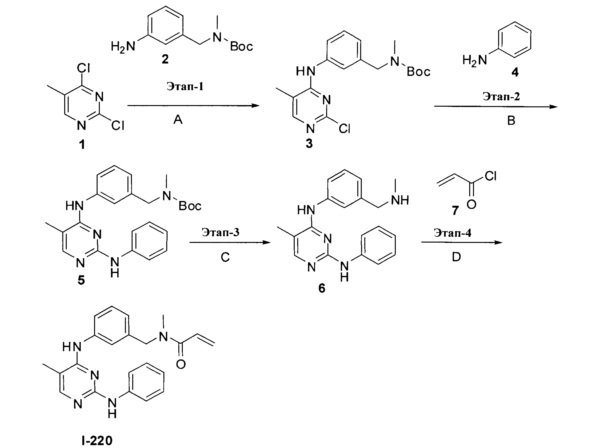
А) соединение 2, Xanthphos, Pd2(dba)3, Cs2CO3, CH3CN, 100°C, 12 часов; B) соединение 4, трет-BuOH, 90°C, 4 часа; C) 10 N HCl, ДХМ, комн. темп., 30 минут: D) соединение 7, ТЭА, ДХМ, -10°C, 10 минут.
[001042] Этап 1
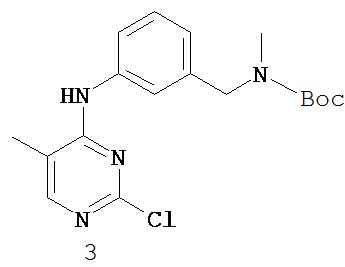
[001043] К раствору соединения 1 (2,6 г, 15,7 ммоль) в ацетонитриле (26,7 мл) добавляли при перемешивании соединение 2 (2,67 г, 11,3 ммоль), Pd2(dba)3 (0,31 г, 0,33 ммоль), Xanthophos (0,52 г, 0,89 ммоль) и Cs2CO3 (6,6 г, 20,0 ммоль). Реакционную смесь дегазировали, продувая через нее аргон в течение 1 часа, затем грели при 100°C в течение 12 часов. После завершения реакции (согласно ТСХ) реакционную смесь фильтровали через слой целита и концентрировали фильтрат при пониженном давлении. Полученный сырой продукт очищали методом колоночной хроматографии (силикагель 60-120 меш; 20% смесь этилацетат/гексан) с получением соединения 3 (2,32 г, 56,71%) в виде светло-коричневого твердого продукта. 1H-NMR (CDCl3, 500 МГц): δ 8,01 (s, 1H), 7,56 (d, J=7,5 Гц, 1H), 7,43 (s, 1H), 7,35 (t, J=7,0 Гц, 1H), 7,05 (s, 1H), 6,80 (bs, 1H), 4,45 (s, 2H), 2,87 (s, 3H), 2,30 (s, 3H), 1,48 (s, 9H).
[001044] Этап 2
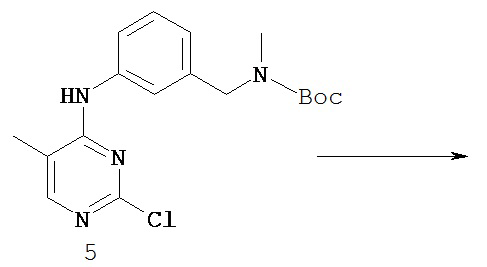
[001045] К раствору соединения 3 (2,32 г, 6,0 ммоль) в трет-BuOH (11,6 мл) при перемешивании при комнатной температуре добавляли соединение 4 (0,65 г, 6,9 ммоль), после чего реакционную смесь кипятили с обратным холодильником в течение 48 часов. Степень протекания реакции отслеживали методом TCX. После завершения реакции, трет-BuOH концентрировали при пониженном давлении с получением соединения 5 (2,3 г, 85,82%) в виде светло-желтого твердого продукта. 1H-NMR (ДМСО-d6, 500 МГц): δ 10,32 (s, 1H), 9,78 (s, 1H), 7,91 (s, 1H), 7,50 (d, J=8,0 Гц, 1H), 7,45-7,30 (m, 4H), 7,24 (t, J=7,0 Гц, 2H), 7,15-7,06 (m, 2H), 4,36 (s, 2H), 2,72 (s, 3H), 2,17 (s, 3H), 1,41, 1,34 (два s, 9H). MS: m/e 420 (M++1).
[001046] Этап 3
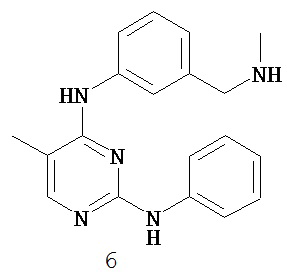
[001047] К раствору соединения 5 (0,05 мг, 0,11 ммоль) в ДХМ (5 мл) при перемешивании добавляли 37% CHl (1,0 мл) и перемешивали при комнатной температуре в течение 30 минут. После завершения реакции (согласно ТСХ) летучие растворители отгоняли при пониженном давлении. Водный слой охлаждали до 0°C, подщелачивали до pH ~8-9 10% раствором NaOH и экстрагировали ДХМ (50 мл). Органический слой отделяли, промывали водой, солевым раствором, сушили над безводным Na2SO4 и упаривали при пониженном давлении с получением соединения 6 (0,015 г, 48,36%) в виде светло-желтого продукта. 1H-NMR (CDCl3, 500 МГц): δ 7,95-7,85 (m, 2H), 7,68-7,60 (m, 3H), 7,42 (d, J=8,0 Гц, 1H), 7,32-7,20 (m, 4H), 7,05 (d, J=7,5 Гц, 1H), 7,00-6,95 (m, 1H), 6,40 (s, 1H), 3,84 (s, 2H), 2,48 (s, 3H), 2,06 (s, 3H). MS: m/e 320 (M++1).
[001048] Этап 4

[001049] К раствору соединения 6 (0,3 г, 0,94 ммоль) в ДХМ (12 мл) при перемешивании добавляли ТЭА (0,10 г, 0,99 ммоль) и соединение 7 (0,08 г, 0,88 ммоль) по каплям в течение 5 минут при температуре -10°C в атмосфере инертного газа. Реакционную смесь перемешивали при температуре -10°C в течение 5-10 минут. После завершения реакции (согласно ТСХ) реакционную смесь гасили холодной водой (5 мл) и экстрагировали ДХМ (2×50 мл). Слой ДХМ промывали водой, солевым раствором, сушили над безводным Na2SO4 и концентрировали при пониженном давлении. Полученный сырой продукт очищали методом колоночной хроматографии (силикагель 60-120 меш; 30% смесь этилацетат/гексан) с получением соединения 1-220 (0,15 г, 42,85%) в виде беловатого твердого продукта. 1H-NMR (ДМСО-d6, 500 МГц, при 80°C): δ 8,48 (bs, 1H), 8,07 (s, 1H), 7,88 (s, 1H), 7,69-7,58 (m, 4H), 7,28 (t, J=8,0 Гц, 1H), 7,16 (t, J=8,0 Гц, 2H), 6,91-6,85 (m, 2H), 6,75 (dd, J=2,5, 15,3 Гц, 1H), 6,13 (d,.7=15,0 Гц, 1H), 5,66 (d, J=7,5 Гц, 1H), 4,60 (s, 2H), 2,95 (s, 3H), 2,12 (s, 3H). MS: m/e 374 (M++1).
ПРИМЕР 178
[001050] Получение N-метил-N-(4-(5-метил-2-(фениламино)пиримидин-4-иламино)-бензил)акриламида I-219
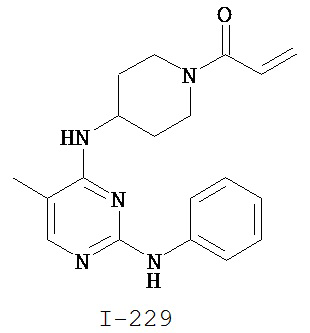
[001051] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 177, с использованием трет-бутил-4-аминобензил(метил)-карбамата вместо соединения 2 на Этапе 1. 1H-ЯМР (ДМСО-d6, 500 МГц при 80°C): δ 8,55 (s, 1H), 8,03 (s, 1H), 7,86 (s, 1H), 7,65 (d, J=8,0 Гц, 2H), 7,62 (d, J=8,0 Гц, 2H), 7,20-7,13 (m, 4H), 6,86-6,75 (m, 2H), 6,14 (dd, J=2,5, 17,0 Гц, 1H), 5,67 (d, J=15,0 Гц, 1H), 4,58 (s, 2H), 2,96 (s, 3H), 2,10 (s, 3H). MS: m/e 374 (M++1).
ПРИМЕР 179
[001052] Получение N-(5-(5-ацетил-4-(4-акрилоил-3,4-дигидро-2H-бензо[b][1,4]-оксазин-6-иламино)пиримидин-2-иламино)пиридин-2-ил)-2,2,2-трифтор-N-метилацетамида I-142
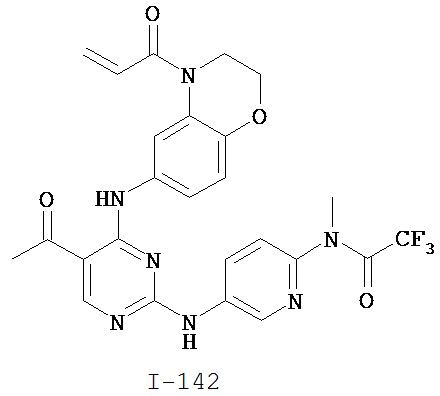
[001053] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 42, с использованием 5-амино-2-(2,2,2-трифторацетамидо)пиридина вместо соединения 9 на Этапе 5. ЖХ/МС: m/z 542,2 (ES+), 540,2 (ES-).
ПРИМЕР 180
[001054] Получение 1-(6-(5-фтор-2-(4-(2-метоксиэтокси)фениламино)пиримидин-4-иламино)индолин-1-ил)проп-2-ен-1-она I-94
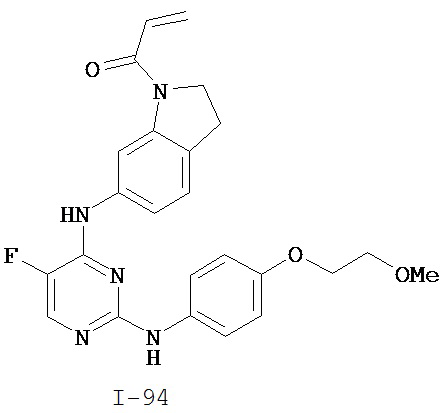
[001055] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием N-Boc-6-аминоиндолина вместо соединения 2 на Этапе 1. ЖХ/МС: m/z 450,1 (ES+), 448,1 (ES-).
ПРИМЕР 181
[001056] Получение N-(3-(5-фтор-2-(6-(2-метоксиэтокси)пиридин-3-иламино)-пиримидин-4-иламино)фенил)акриламида I-103
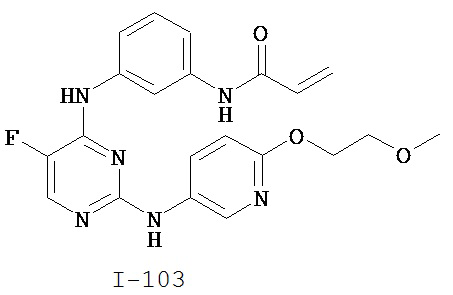
[001057] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(2-метоксиэтокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3 + следовое количество ДМСО-d6) δ ppm: 3,44 (s, 3H), 3,75 (t, J=4,4 Гц, 2H), 4,43 (t, J=4,4 Гц, 2H), 5,81 (dd, J=1,8 и 9,6 Гц, 1H), 6,45 (m, 1H), 6,80 (m, 3H), 7,17 (m, 1H), 7,29 (m, 1H), 7,43 (m, 1H), 7,49 (m, 1H), 7,60 (m, 1H), 7,80 (dd, J=2,8 и 9,2 Гц, 1H), 7,94 (d, J=3,1 Гц, 1H), 8,14 (s, 1H), 8,32 (d, J=2,9 Гц, 1H); ЖХ/МС: m/e 425,1 (M+1).
ПРИМЕР 182
[001058] Получение N-(3-(5-фтор-2-(4-(3-метилсульфонилпропокси)фенил)амино-пиримидин-4-иламино)фенил)акриламида I-97
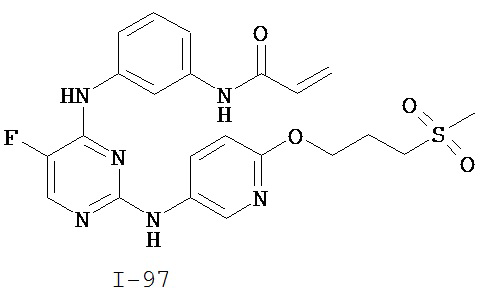
[001059] Указанное в названии соединение получали в виде трифторацетата с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(3-метилсульфонилпропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3 + следовое количество ДМСО-d6) δ ppm: 1,95 (m, 2H), 2,67 (s, 3H), 2,98 (m, 5H), 3,74 (t, J=6,0 Гц, 2H), 5,45 (dd, J=4,1 и 7,3 Гц, 1H), 6,07 (m, 2H), 6,48 (d, J=8,2 Гц, 1H), 6.77 (m, 4H), 7,09 (d, J=7,4 Гц, 1H), 7.51 (d, J=4,1 Гц, 1H), 7,70 (br, 1H): ЖХ/МС: m/e 486,1 (M+1).
ПРИМЕР 183
[001060] Получение N-(3-(5-фтор-2(6-тридейтерометокси)пиридин-3-иламино)-пиримидин-4-иламино)фенил)акриламида I-95
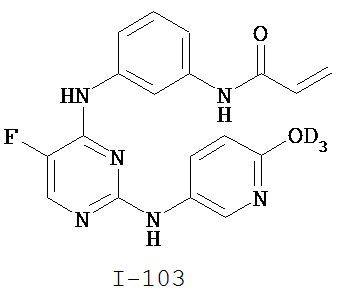
[001061] Указанное в названии соединение получали в виде трифторацетата с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-(тридейтерометокси)пиридин-3-амина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCIs+следовое количество ДМСО-d6) δ ppm: 5,78 (dd, J=3,7 и 7,8 Гц, 1H), 6,40 (m, 2H), 6,71 (d, J=8,7 Гц, 1H), 7,3 (m, 3H), 7,75 (dd, J=2,7 и 8,7 Гц, 1H), 7,82 (d, J=4,6 Гц, 1H), 7,95 (s, 1H), 8,33 (d, J=2,3 Гц, 1H); ЖХ/МС: m/е 384,1 (M+1). [001062] Промежуточное соединение 6-(тридейтерометокси)пиридин-3-амин получали с использованием схемы, описанной ниже.

A) NaH, CD3OD, комн. темп.; BH3⋅NMe3, Pd(OH)2
[001063] Этап 1
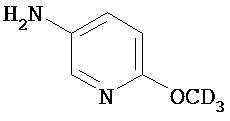
[001064] К NaH (60%, 0,30 г) в 5 мл дейтерированного метанола CD3OD при температуре 0°C добавляли 2-хлор-5-нитропиридин (1,0 г). Смесь перемешивали при комнатной температуре в течение ночи. К этой смеси добавляли триметиламин-боран (BH3⋅NMe3) (550 мг) и Pd(OH)2 (100 мг). Полученную смесь кипятили с обратным холодильником в течение 2 часов. Охлаждали, после чего концентрировали и очищали методом хроматографии на силикагеле с получением целевого 6-(тридейтеррметокси)пиридин-3-амина (130 мг). 1H-ЯМР (CDCl3) δ ppm: 3,30 (br, 2H), 6,60 (d,.7=8,7 Гц, 1 Н), 7,03 (dd,.7=3,2 и 8,7 Гц, 1H), 7,66 (d,J=3,2 Гц, 1H).
ПРИМЕР 184
[001065] Получение N-(3-(5-фтор-2-(3,4,5-триметоксифениламино)пиримидин-4-ил-окси)фенил)акриламида I-148
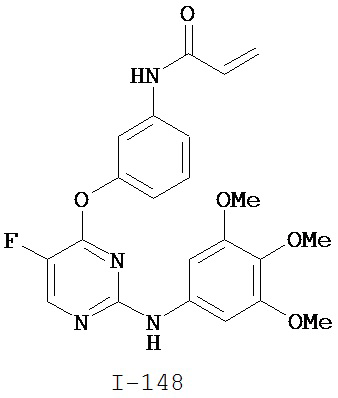
[001066] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 98, с использованием 3,4,5-триметоксианилина вместо соединения 4 на Этапе 2. MS: m/e 441 [M+1].
ПРИМЕР 185
[001067] Получение 3-метил-1-(3-(5-метил-2-(фениламино)пиримидин-4-иламино)-фенил)бут-2-ен-1-она I-232
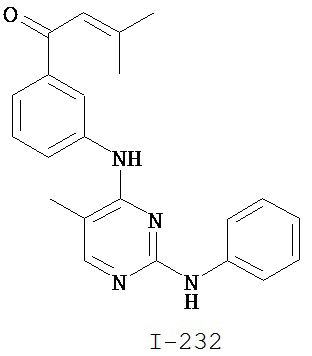
[001068] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 2,4-дихлор-5-метилпиримидина вместо соединения 1 на Этапе 1 и анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (CDCl3) δ ppm: 1,97 (s, 3H), 2,15 (s, 3H), 2,22 (s, 3H), 6,47 (s, 1H), 6,71 (s, 1H), 6,97 (t, J=9,8 Гц, 1H), 7,17 (s, 1H), 7,24 (t, J=10,36 Гц, 1H), 7,27 (s, 1H), 7,44 (t, J=10,64 Гц, 1H), 7,53 (d, J=10,48 Гц, 2H), 7,68 (d, J=10,28 Гц, 1H), 7,94 (d, J=10 Гц, 1H), 7,98 (s, 1H); ЖХ/МС: m/e 359 (M+1).
ПРИМЕР 186 [001069] Получение 1-(3-(5-метил-2-фениламино)пиримидин-4-иламино(пиперидин-1-ил)проп-2-ен-она I-27
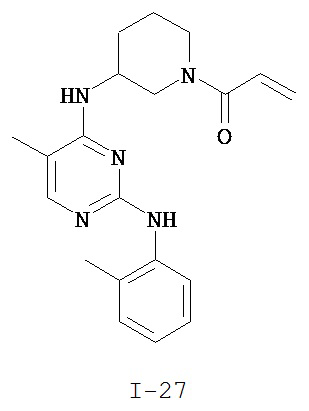
[001070] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 1, с использованием 1-трет-бутоксикарбонил-3-аминопиперидина вместо соединения 1 на Этапе 1. 1Н-ЯМР (ДМСО-d6) δ ppm: 1,30-1,50 (m, 1H), 1,55-1,75 (m, 1H), 1,75-1,90 (m, 1H), 1,92 (s, 3H), 1,95-2,05 (m, 1H), 2,75-3,31 (m, 2H), 3,99-4,09 (m, 2H), 4,10-4,15 и 4,40-4,47 (m, 1H), 5,49 и 5,70 (d, J=10,8 Гц и d, J=9,2 Гц, 1H), 6,02 и 6,13 (d, J=17,6 Гц и d, J=16,8 Гц, 1H), 6,25-6,40 (m, 1H), 6,63 и 6,80-6,90 (dd, J=10,8, 16,8 Гц и m, 1H), 6,75-6,85 (m, 1H), 7,15 (t, J=8 Гц, 2H), 7,69 (bs, 3H), 8,81 (s, 1H); ЖХ/МС: m/e 337,8 (M+1).
ПРИМЕР 187
[001071] Получение 3-(4-(2-акрилоил-1,2,3,4-тетрагидроизохинолин-6-иламино)-5-метилпиримидин-2-иламино)бензолсульфонамида I-40
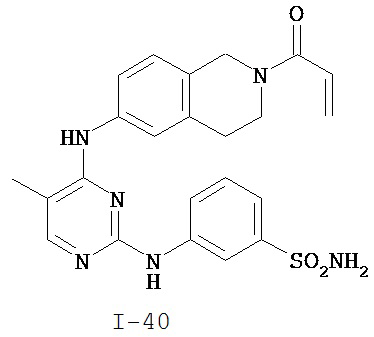
[001072] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 1, с использованием 6-амино-2-трет-бутоксикарбонил-1,2,3,4-тетрагидроизохинолина вместо соединения 1 на Этапе 1. 1H-ЯМР (ДМСО-d6) δ ppm: 2,10 (s, 3H), 2,80-2,83 (m, 2H), 3,75-3,90 (m, 2H), 4,66 (s, 1H), 4,76 (s, 1H), 5,71-5,74 (m, 1H), 6,16 (dd, J=2,32 и 16,76 Гц, 1H), 6,87-6,91 (m, 1H), 7,13-7,18 (m, 1H), 7,25-7,31 (m, 4H), 7,53-7,57 (m, 2H), 7,90 (s, 1H), 8,05 (s, 2H), 8,28 (s, 1H), 9,31 (s, 1H); ЖХ/МС: m/e 464,8 (M+1).
ПРИМЕР 188
[001073] Получение (S)-N-(3-(5-фтор-2-(тетрагидрофуран-3-илокси)пиридин-3-иламино)пиримидин-4-иламино)фенил)акриламида I-54
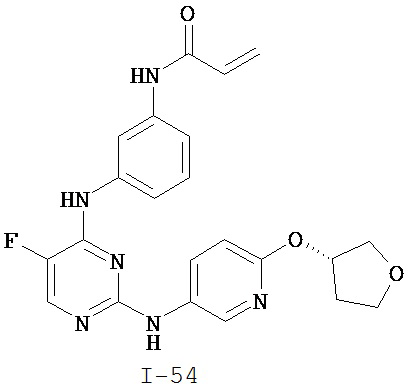
[001074] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-3-амино-6-(тетрагидрофуран-3-илокси)пиридина вместо соединения 4 на Этапе 2. MS: m/e 437 [M+1].
ПРИМЕР 189
[001075] Получение N-(3-(5-трифторметил-2-(фениламино)пиримидин-4-иламино)-фенил)акриламида I-245
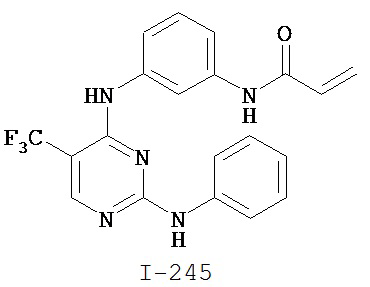
[001076] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
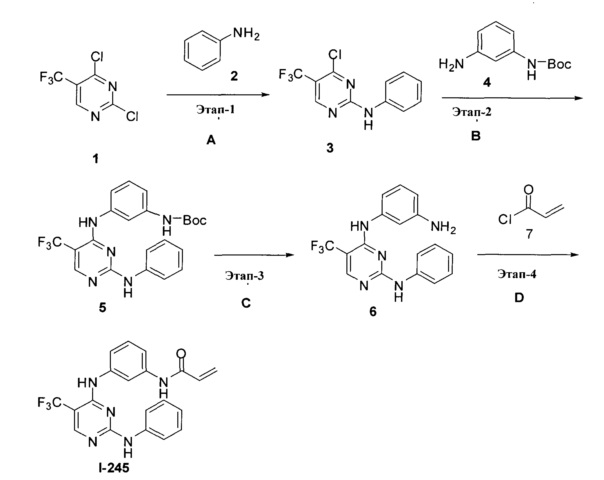
A) соединение 2, ZnCl2, ДХЭ, трет-BuOH (1:1), 0°C, 30 минут; B) соединение 4, ДМФА, DIEPA, 70°C, 16 часов; C) TFA, ДХМ, комн. темп., 1 час; D) соединение 7, ТЭА, ДХМ.
[001077] Этап 1
[001078] К холодному (0°C) раствору соединения 1 (2 г, 9,2 ммоль) в 80 мл смеси 1:1 трет-BuOH/дихлорэтан (ДХЭ) добавляли цинка хлорид (11 мл 1 М раствора в эфире, 1,2 экв.). Через час добавляли соединение 2 (0,858 г, 9,2 ммоль), а затем по каплям добавляли триэтиламин (1,03 г; 1,1 экв.) в 10 мл ДХЭ/трет-BuOH. Перемешивали в течение 30 минут, отгоняли растворители при пониженном давлении и растворяли остаток в этилацетате (50 мл), после чего промывали солевым раствором (10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Целевой продукт 3 получали в виде белого твердого продукта после екристаллизации из смеси EtOAc/гексан (1:9) (2 г, 80%).
[001079] Этап 2
[001080] К раствору соединения 3 (0,5 г, 1,82 ммоль) и соединения 4 (0,38 г, 1,83 ммоль) в ДМФ (10 мл) добавляли DIPEA (0,283 г, 2,192 ммоль) и смесь грели при 60°C в атмосфере аргона в течение 16 часов. Растворитель отгоняли, после чего остаток растворяли в этилацетате (50 мл) и промывали солевым раствором (10 мл). Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме. Сырую смесь очищали методом колоночной флэш-хроматографии (элюент EtOAc/гексан 1:1) с получением соединения 5 в виде белого твердого продукта (0,48 г, 60%).
[001081] Этап 3
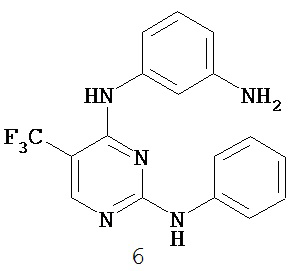
[001082] К раствору соединения 6 (0,25 г, 0,63 ммоль) в CH2Cl2 (10 мл) добавляли трифторуксусную кислоту (2 мл), после чего смесь перемешивали при комнатной температуре в течение 1 часа. Отгоняли растворители при пониженном давлении и растворяли остаток в CH2Cl2, промывали 10% водным раствором NaHCO3, сушили (Na2SO4), фильтровали и упаривали при пониженном давлении с получением свободного амина в виде белого твердого продукта.
[001083] Этап 4

[001084] К раствору соединения 6 (0,2 г) в ДХМ (20 мл) в атмосфере аргона, охлажденного до -40°C, при перемешивании добавляли триэтиламин, после чего по каплям добавляли соединение 7 (0,069 г, 0,686 ммоль). Полученную смесь перемешивали при -40°C в течение 10 минут. Реакционную смесm разбавляли ДХМ (50 мл) и промывали солевым раствором (10 мл). Органический слой сушили над сульфатом натрия, фильтровали и упаривали при пониженном давлении. Остаток очищали методом колоночной флэш-хроматографии на силикагеле (элюент - MeOH: EtOAc 5:95), с получением целевого соединения 1-245. 1H-ЯМР (200 МГц, CD3OD) δ 8,25 (s, 1H), 7,80 (s, 1H), 7,60-7,05 (m, 7H), 6,90 (m, 1H), 6,35 (m, 2H), 5,75 (dd, J=8,0, 2,0 Гц, 1H).
ПРИМЕР 190
[001085] Получение N-(3-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-иламино)фенил)акриламида I-242
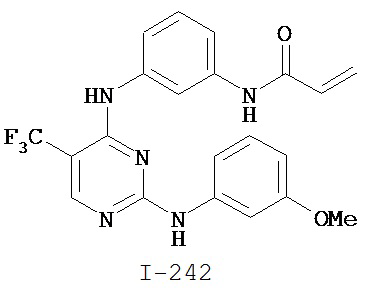
[001086] Указанное в названии соединение получали с использованием схем, этапов и промежуточных продуктов, описанных в Примере 189, с использованием 3-диметоксианилина вместо соединения 2 на Этапе 1. 1H-ЯМР (200 МГц, CD3OD) δ 8,31 (s, 1H), 7,84 (s, 1H), 7,59 (m, 1H), 7,37-7,09 (m, 5H) 6,53 (m, 1H), 6,41 (m, 2H), 5,79 (dd, J=8,0, 2,0, Гц, 1H), 3,66 (s, 3H).
ПРИМЕР 191
[001087] Получение N-(4-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-иламино)фенил)акриламида I-236
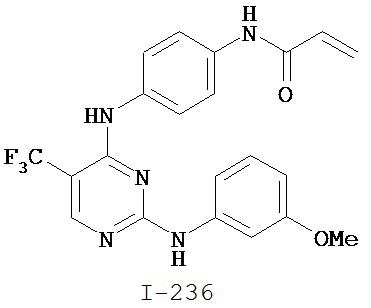
[001088] Указанное в названии соединение получали с использованием схем, этапов и промежуточных продуктов, описанных в Примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и 4-амино-N-трет-бутоксикарбониланилина вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CD3OD) SS,27 (s, 1H), 7,70 (d, J=6,0 Hz) 1H), 7,46 (d, J=6,0 Hz, 1H), 7,09 (brs, 1H), 7,07 (m, 2H) 6,51 (m, 1H), 6,44 (m, 2H), 5,80 (dd, J=8,0, 2,0 Гц, 1H), 3,56 (s, 3H).
ПРИМЕР 192
[001089] Получение N-(4-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-иламино)фенил)метилакриламида I-235
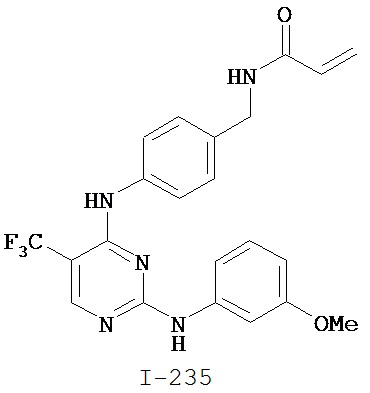
[001090] Указанное в названии соединение получали с использованием схем, этапов и промежуточных продуктов, описанных в Примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и 4-аминофенилметил-N-трет-бутоксикарбониламина вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CD3OD) 08,30 (s, 1H), 7,49 (d, J=8,0 Гц, 1H), 7.37 (d, J=8,0 Гц, 1H), 7,10 (m, 3H), 6,60 (m, 1H) 6,34 (m, 2H), 5,75 (dd, J=8,0, 2.0 Гц, 1H), 4,51 (s, 2H), 3,68 (s, 3H).
ПРИМЕР 193
[001091] Получение N-(4-хлор-3-(5-трифторметил-2-(3-метоксифениламино)-пиримидин-4-иламино)фенил)акриламида I-227
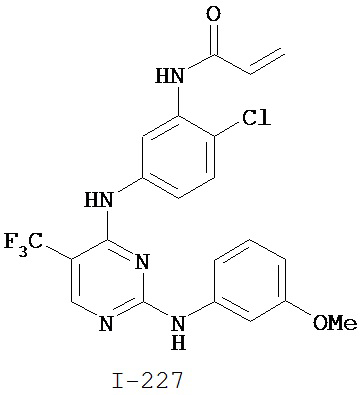
[001092] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и N-трет-бутоксикарбонил-3-амино-6-хлоранилина вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CD3OD) (8,33 (s, 1H), 6 8,08 (s, 1H), 7,45 (m, 2H), 7,21-7,07 (m, 3H), 6,60-6,36 (m, 3H), 5,84 (dd, J=8,0, 2,0 Гц, 1H), 3,71 (s, 3H).
ПРИМЕР 194
[001093] Получение N-(3-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-иламино)фенил)метилакриламида I-226
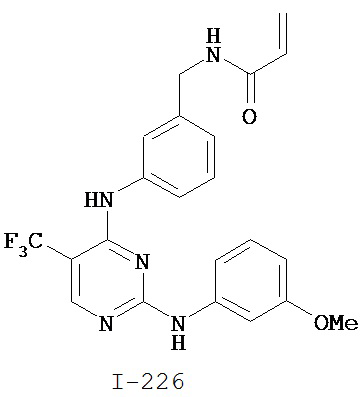
[001094] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и 3-аминофенилметил-N-трет-бутоксикарбониламина вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CD3OD) (8,31 (s, 1H), 7,71-7,33 (m, 3H), 7,21-7,08 (m, 4H), 6,57 (m, 1H), 6,26 (d, J=4Hz, 2H), 5,69 (dd, J=8,0, 2,0 Гц, 1H), 4,47 (s, 2H), 3,67 (s, 3H).
ПРИМЕР 195
[001095] Получение N-(4-(5-трифторметил-2-(6-метоксипиридин-3-иламино)-пиримидин-4-иламино)фенил)акриламида I-218
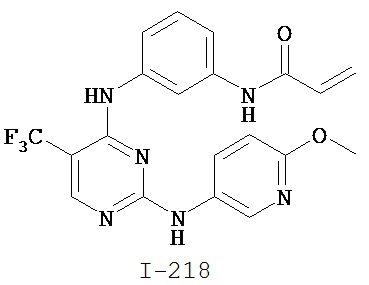
[001096] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 189, с использованием 3-амино-6-метоксипиридина вместо соединения 2 на Этапе 1. 1H-ЯМР (200 МГц, CD3OD) (8,21 (s, 1Н), 7,90-7,78 (m, 3H), 7,48 (m, 2H), 7,30 (m, 2H), 6,40 (m, 2H), 5,75 (dd, J=8,0, 2,0 Гц, 1H), 3,81 (s, 3H).
ПРИМЕР 196
[001097] Получение N-(4-(5-трифторметил-2-(5-метоксипиридин-3-иламино)-пиримидин-4-иламино)фенил)акриламида I-214
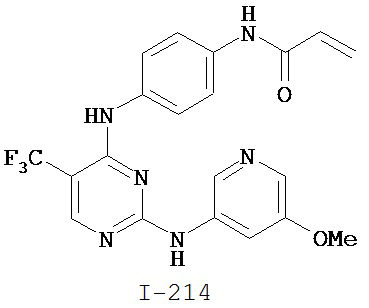
[001098] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 189, с использованием 3-амино-5-метоксипиридина вместо соединения 2 на Этапе 1 и 4-амино-N-трет-бутоксикарбониланилина вместо соединения 4 на Этапе 2. MS: m/e 431 [M+1].
ПРИМЕР 197
[001099] Получение 1-(3-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-ил-амино)фенил)-3-метил-бут-2-ен-1-она I-225
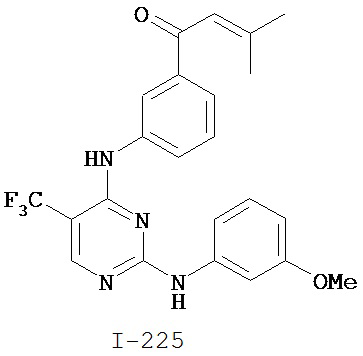
[001100] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и 1-(3-аминофенил)-3-метилбут-2-ен-1-она вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CDCl3) δ 8,33 (s, 1H), δ 8,38 (s, 1H), 7,99-7,77 (m, 4H), 7,50 (m, 2H), 7,20-7,01 (m, 4H), 6,68-6,60 (m, 2H), 3,68 (s, 3H), 2,25 (s, 3H), 1,99 (s, 3H).
[001101] 1-(3-аминофенил)-3-метилбут-2-ен-1-он получали с использованием схем, этапов, промежуточных соединений, описанных ниже.
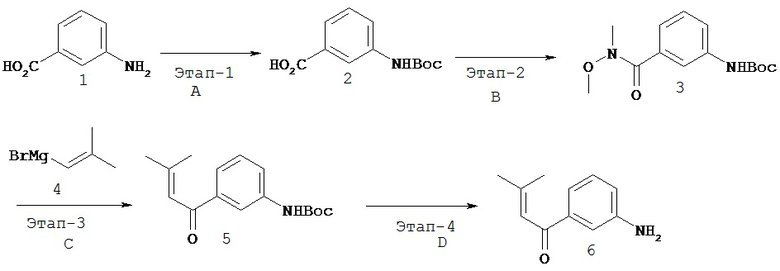
A) Boc2O, Et3N, DMAP, ДХМ; В) NHMe-OMe.HCl, TBTU, ДХМ, 0°C до комн. темп.; C) соединение 4, ТГФ, 0°C до комн. темп.; D) TFA, ДХМ.
[001102] Этап 1
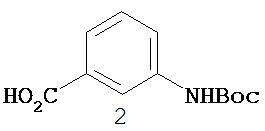
[001103] Ди-трет-бутилдикарбонат (6,54 г, 30 ммоль, 1,5 экв.) добавляли к раствору соединения 1 (2,70 г, 20 ммоль) в CH2Cl2 (100 мл), содержащему Et3N (3,4 мл, 24 ммоль, 1,2 экв.) и DMAP (122 мг, 1,0 ммоль, 5 мольн. %). Раствор перемешивали в течение ночи с хлоркальциевой трубкой. Растворители отгоняли и остаток промывали эфиром (50 мл) и водой (50 мл). Водную фазу экстрагировали эфиром и подкисляли до pH 3 IN раствором HCl, после чего экстрагировали EtOAc (2×50 мл). Объединенный органический слой промывали водой и солевым раствором и сушили над NaSO4. Концентрировали с получением сырого продукта, который кристаллизовали из смеси EtOAc/гексан с получением соединения 2 (2,92 г, 62%).
[001104] Этап 2
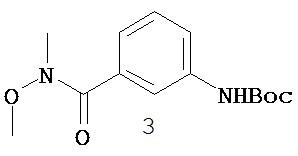
[001105] К смеси соединения 2 (1,5 г, 6,33 ммоль), N-метокси-N-метиламина гидрохлорида (NHMe-OMe.HCl) (614 мг, 6,33 ммоль) и TBTU (2,05 г, 6,33 ммоль) в ДХМ (30 мл) при температуре 0°C добавляли Et3N (2,7 мл, 19 ммоль, 3 экв.). Смесь перемешивали в течение 30 минут при температуре 0°C, а затем при комнатной температуре в течение 2 часов до завершения реакции (согласно ВЭЖХ). Реакционную смесь выливали в 150 мл холодной воды, после чего выпавший белый осадок отделяли и промывали водой. Продукт сушили в вакуумном шкафу в течение ночи с получением соединения 3 (1,34 г, 75%) в виде белого твердого продукта.
[001106] Этап 3
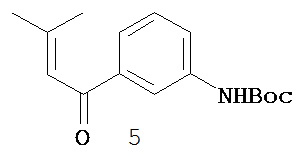
[001107] К раствору соединения 3 (546 мг, 1,95 ммоль) в ТГФ (3 мл) при температуре 0°C в атмосфере аргона по каплям добавляли соединение 4 (0,5 М раствор в ТГФ, 9,75 мл, 4,9 ммоль, 2,5 экв.). Реакционную смесь перемешивали при температуре 0°C в течение 30 минут, затем охлаждающую баню убирали и перемешивали реакционную смесь при комнатной температуре в течение 2 часов. Реакционную смесь охлаждали до температуры 0°C и гасили 5% раствором лимонной кислоты. Разбавляли водой (10 мл) и экстрагировали водную фазу эфиром (2×15 мл), затем объединенный органический слой промывали водой и солевым раствором и сушили над NaSO4. Концентрировали с получением соединения 5 (82%) в виде желтого твердого продукта, который был достаточно чистым, чтобы непосредственно использовать на следующем этапе.
[001108] Этап 4
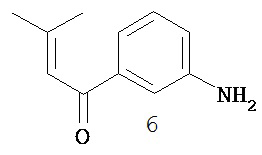
[001109] Навеску соединения 5 массой 400 мг обрабатывали 5 мл смесью CH2Cl2:трифторуксусная кислота 1:3 и полученный раствор перемешивали при комнатной температуре в течение 15 минут. Растворители отгоняли в вакууме и перерастворяли остаток в CH2Cl2 и отгоняли растворитель, после чего повторяли эту процедуру еще три раза. Остаток снова растворяли в CH2Cl2 и промывали раствор насыщенным раствором бикарбоната натрия. CH2Cl2 слой сушили над сульфатом натрия, фильтровали и упаривали с получением соединения 6 в виде белого твердого продукта, который непосредственно использовали в следующих реакциях.
ПРИМЕР 198
[001110] Получение 1-(3-(2-(3-метокси-фениламино)-5-трифторметил-пиримидин-4-иламино)-циклогексил)-3-метил-бут-2-ен-1-она I-213
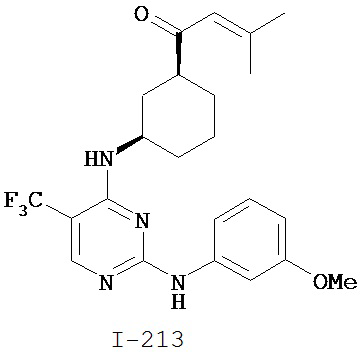
[001111] Указанное в названии соединения получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и (d,l)-цис-1-(3-амино-циклогексил)-3-метил-бут-2-ен-1-она вместо соединения 4 на Этапе 2. 1H-ЯМР (200 МГц, CDCl3) δ 8,07 (s, 1Н), 7,33 (s, 1H), 7,19-7,0 (m, 3H), 6,54 (d, J=2,7 Гц, 1H), 6,02 (s, 1H), 4,04 (m, 1H), 3,75 (s, 3H), 2,50 (m, 1H), 2,10 (m, 1H), 1,89-1,15 (m, 14H).
[001112] (D,L)-цис-1-(3-амино-циклогексил)-3-метил-бут-2-ен-1-он получали с использованием схем, этапов, промежуточных соединений, описанных ниже.
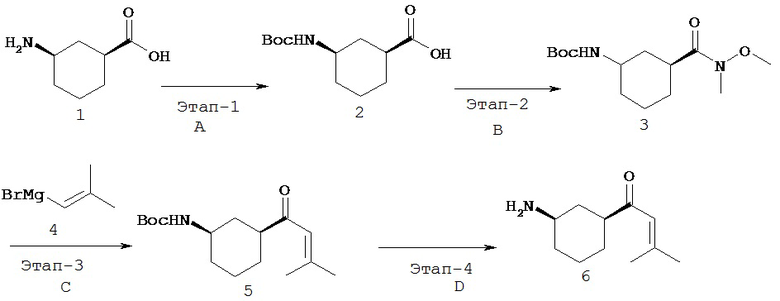
A) Boc3O, Na2CO., ацетон, H2O; B) NHMe-OMe.HCl, TBTU, ДХМ, 0°C до комн. темп.; C) соединение 4, ТГФ, 0°C до комн. темп.; D) TFA, ДХМ.
[001113] Этап 1
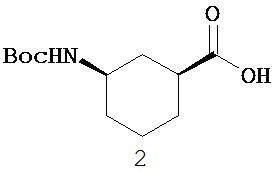
[001114] К раствору соединения (±)-1 (4,05 г, 28,2 ммоль) в воде (150 мл), содержащему Na2CO3 (3,0 г, 28,2 ммоль) и ацетон (100 мл), при перемешивании добавляли ди-трет-бутилдикарбонат Boc2O (7,4 г, 33,8 ммоль, 1,2 экв.) и перемешивали реакционную смесь при температуре 25°C в течение ночи. Ацетон удаляли и водный слой экстрагировали эфиром (2 раза). Водный слой подкисляли до pH 3, отделяли осадок и промывали его водой. Продукт сушили в вакуумном шкафу в течение ночи с получением соединения 2 (5,90 г, 85%) в виде белого твердого продукта.
[001115] Этап 2
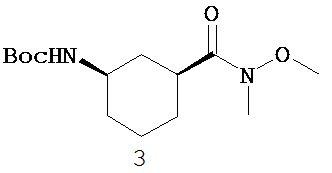
[001116] К раствору соединения 2 (2,45 г, 10,1 ммоль), TBTU (3,44 г, 10,6 ммоль, 1,05 экв.) и N-метил-N-метоксиамина гидрохлорида (1,03 г, 10,6 ммоль, 1,05 экв.) в CH2Cl2 (40 мл) при температуре 0°C при перемешивании добавляли триэтиламин (4,25 мл, 30,3 ммоль, 3 экв.). Смесь перемешивали при температуре 0°C в течение 20 минут и удаляли баню, после чего продолжали перемешивать в течение 3 часов при температуре 25°C. Затем гасили водой, CH2Cl2 удаляли и остаток промывали эфиром и водой. Водную фазу экстрагировали эфиром и промывали объединенный органический слой водой и солевым раствором, после чего сушили над MgSO4. Отгоняли растворители с получением соединения 3 (2,37 г, 82%) в виде белого твердого продукта.
[001117] Этап 3
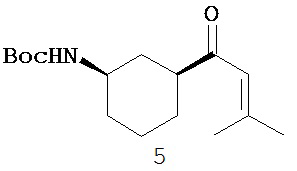
[001118] К раствору соединения 3 (1,23 г, 4,32 ммоль) в ТГФ (20 мл) при температуре 0°C в атмосфере аргона по каплям добавляли соединение 4 (27 мл, 0,5 М раствор в ТГФ, 10,8 ммоль, 2,5 экв.). Полученную смесь перемешивали при температуре 0°C в течение 30 минут, а затем при комнатной температуре в течение 1 часа. Реакицонную смесь охлаждали до 0°C, затем гасили 5% раствором лимонной кислоты (5 мл). Разбавляли водой и экстрагировали смесь эфиром (2 раза), затем объединенный органический слой промывали водой и солевым раствором и сушили над NaSO4. После упаривания оставался оранжевый остаток, который очищали методом хроматографии на силикагеле, элюируя 20% раствором EtOAc в гексане, с получением соединения 5 (600 мг, 56%) в виде светло-желтого твердого продукта.
[001119] Этап-4
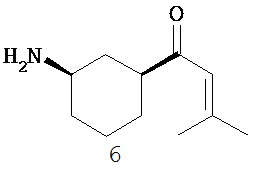
[001120] Навеску соединения 5 массой 500 мг обрабатывали 6 мл смеси CH2Cl2:трифторуксусная кислота 1:3 и полученный раствор перемешивали при комнатной температуре в течение 15 минут. Растворители отгоняли в вакууме и растворяли осадок в CH2Cl2, упаривали, после чего повторяли эту процедуру еще три раза. Осадок снова растворяли в CH2Cl2 и промывали раствор насыщенным раствором бикарбоната натрия. CH2Cl2 слой сушили над сульфатом натрия, фильтровали и упаривали с получением соединения 6 в виде белого твердого продукта, которое использовали без очистки.
ПРИМЕР 199
[001121] Получение 1-(5-(5-трифторметил-2-(3-метоксифениламино)пиримидин-4-ил)амино-1,3-дигидроизоиндол-2-ил)-2-пропен-1-она I-132
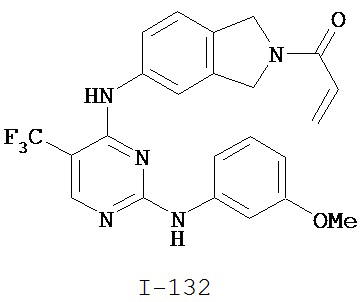
[001122] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в примере 189, с использованием 3-метоксианилина вместо соединения 2 на Этапе 1 и 2-(N-трет-бутоксикарбонил)-5-аминоизоиндолина вместо соединения 4 на Этапе 2. MS m/e 456 [M+1].
ПРИМЕР 200
[001123] Получение 3-(2-(2-акрилоилизоиндолин-5-иламино)-5-фторпиримидин-4-иламино)бензонитрила I-106
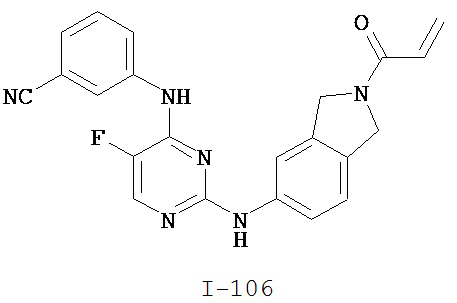
[001124] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 2, с использованием 5-фтор-2,4-дихлорпиримидина вместо соединения 1 и 3-аминобензонитрила вместо соединения 2 на Этапе 1 и 2-(трет-бутоксикарбонил-5-аминоизоиндолина вместо вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,82/(M+H)) 401,1
ПРИМЕР 201
[001125] Получение N-(3-(5-фтор-4-((6-(трифторметил)пиридин-3-ил)метиламино)-пиримидин-2-иламино)фенил)акриламида I-53
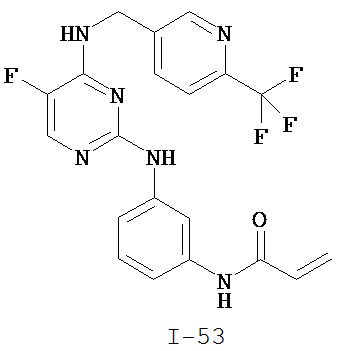
[001126] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 2, с использованием 5-фтор-2,4-дихлорпиримидина вместо 1 и 3-аминометил-6-трифторметилпиридина вместо 2 на этапе-1. ЖХ/МС (RT=2,805/(M+H)) 433,0
ПРИМЕР 202
[001127] Получение N-(3-(4-((2,3-дигидробензофуран-5-ил)метиламино)-5-фтор-пиримидин-2-иламино)фенил)акриламида I-6

[001128] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 2, с использованием 5-фтор-2,4-дихлорпиримидина вместо соединения 1 и 3-аминометил-2,3-дигидробензофурана вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,815/(M+H)) 406,2
ПРИМЕР 203
[001129] Получение N-(3-(5-фтор-2-(4-метоксибензиламино)пиримидин-4-иламино)-фенил)акриламида I-241
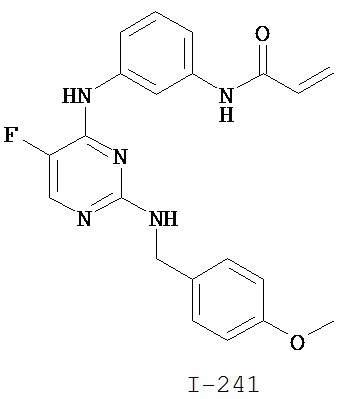
[001130] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-метоксибензиламина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,801/(M+H)) 394,2
ПРИМЕР 204
[001131] Получение N1-(3-(3-(4-(3-акриламидофениламино)-5-метилпиримидин-2-ил-амино)фенокси)пропил)-N5-(15-оксо-19-((3aR,4R,6aS)-2-оксогексагидро-1H-тиено[3,4-d]имидазол-4-ил)-4,7,10-триокса-14-азанонадецил)глутарамида I-215
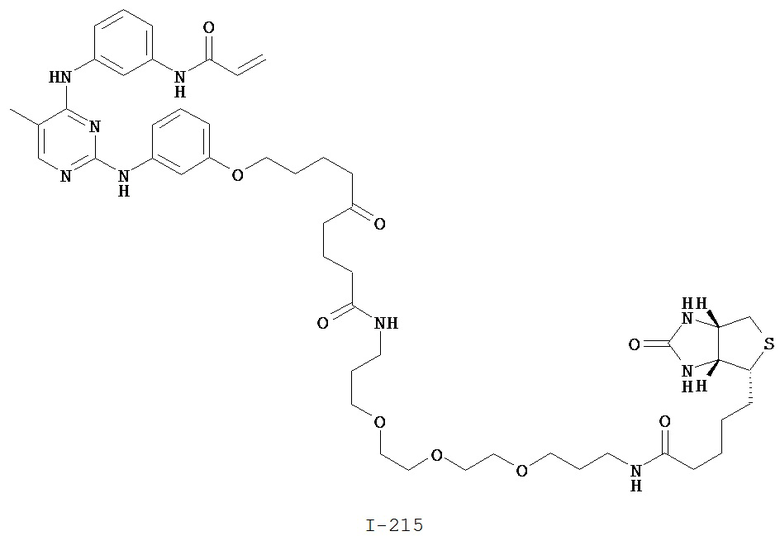
[001132] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
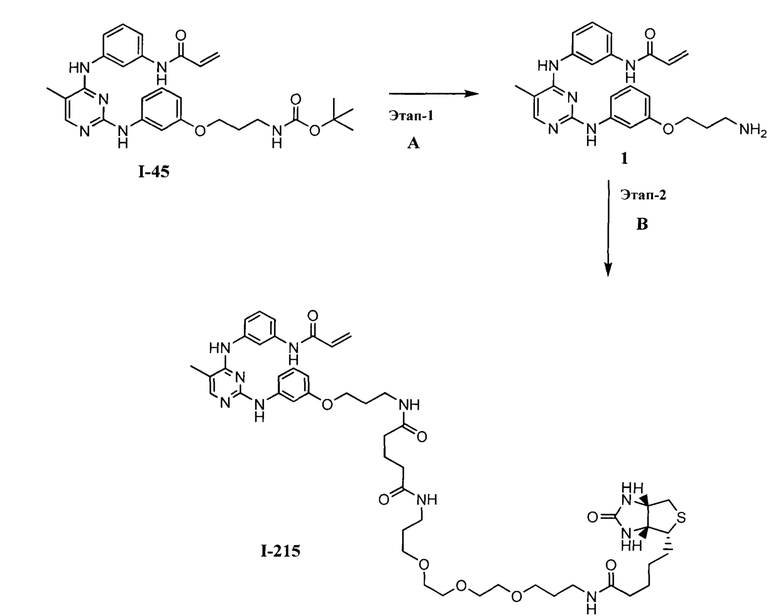
A) TFA, ДХМ; B) N-биотилин-NH-(PEG)2-COOH-DIPEA, HOBt, EDC, NMM, ДМФА.
[001133] Этап-1
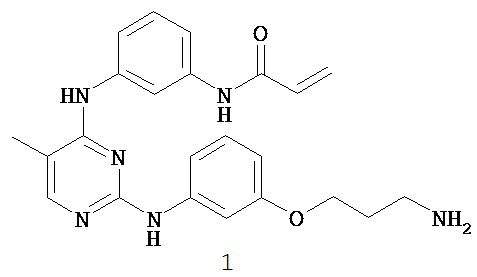
[001134] Соединение 1-45 (97 мг, 0,19 ммоль; синтез соединения I-45 приведен в Примере 62) растворяли в ДХМ (10 мл). Добавляли трифторуксусную кислоту (200 мкл), после чего смесь перемешивали при комнатной температуре в течение 24 часов. Растворитель удаляли на роторном испарителе с получением желто-коричневой пены (130 мг), которую использовали в следующей реакции без очистки. ЖХ/МС (RT=2,63/(МН+) 419,2)
[001135] Этап-2
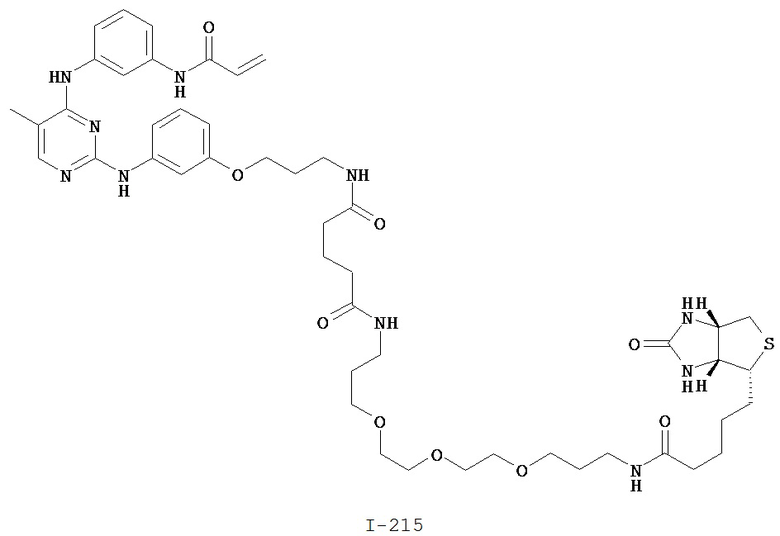
Соединение 1 (80 мг, 0,15 ммоль) растворяли в ДМФА (2 мл). К смеси добавляли N-биотинил-NH-(PEG)2-COOH-DIPEA (114 мг, 0,16 ммоль) и HOBt (25 мг, 0,16 ммоль (89%)), после чего реакционную смесь охлаждали в бане с ледяной водой. Добавляли N-(3-диметиламинопропил)-этилкарбодиимид (EDC) (32 мг, 0,16 ммоль), а затем N-метилморфолин (NMM) (50 мкл, 0,45 ммоль). Реакцонную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 30 минут. Реакцонную смесь без обработки очищали методом флэш-хроматографии с использованием 10% градиента МеОН в ДХМ с получением 40 мг соединения 1-215 в виде желтой пленки. ЖХ/МС (RT=2,654/(МН+) 961,3).
ПРИМЕР 205
[001136] Получение N-(3-(3-(4-(3-акриламидофениламино)-5-метилпиримидин-2-ил-амино)фенокси)пропил)-5-((3aS,4S,6aR)-2-оксогексагидро-1H-тиено[3,4-d]имидазол-4-ил)пентанамида I-237
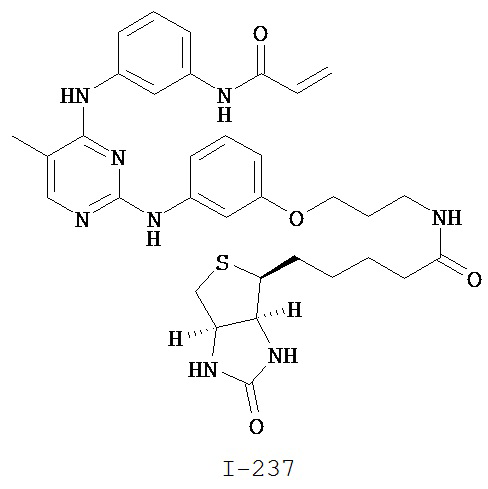
[001137] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 204, с использованием В-(+)-биотина вместо N-биотинил-NH-(PEG)2-COOH-DIPEA на Этапе 2. ЖХ/МС (RT=2,686/(M+H)) 645,2
ПРИМЕР 206
[001138] Получение (R)-N-(3-(5-фтор-2-(3-фтор-4-(тетрагидрофуран-3-илокси)фенил-амино)пиримидин-4-иламино)фенил)акриламида I-316
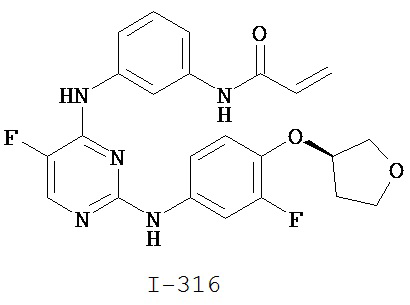
[001139] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-3-фтор-4-(тетрагидрофуран-3-илоксианилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,85-2,00 (m, 1H), 2,20 (m, 1H), 3,70-3,90 (m, 4H), 4,90 (s, 1H), 5,73 (dd, J=1,56 и 10,04 Гц, 1H), 6,23 (dd, J=1,76 и 17,00 Гц, 1H), 6,44 (dd, J=10,08 и 16,88 Гц, 1H), 7,28 (t, J=8,04 Гц, 1H), 7,40-7,47 (m, 2H), 7,67-7,71 (m, 2H), 7,68 (dd, J=1,96 и 14,08 Гц, 1H), 7,92 (s, 1H), 8,1 (d, J=3,64 Гц, 1H), 9,21 (s, 1H), 9,44 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 452,0 (M-1).
ПРИМЕР 207
[001140] Получение 1-(4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-3-метилбут-2-ен-1-она I-325
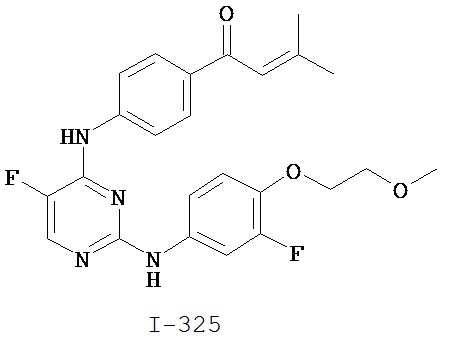
[001141] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием метил4-аминобензоата вместо соединения 2 на Этапе 1 и 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1Н-ЯМР (ДМСО-d6) δ ppm: 2,01 (s, 3H), 2,15 (d, J=0,72 Гц, 3H), 3,31 (s, 3H), 3,66 (dd, J=3,64 и 4,56 Гц, 2H), 4,11 (dd, J=4,44 и 6,12 Гц, 2H), 6,93 (s, 1H), 7,08 (t, J=9,44 Гц, 1H), 7,27 (d, J=8,88 Гц, 1H), 7,74 (dd, J=2,44 и 14,24 Гц, 1Н), 7,93 (d, J=8,96 Гц, 2Н), 7,98 (d, J=8,92 Гц, 2Н), 8,20 (d, J=3,64 Гц, 1H), 9,35 (s, 1H), 9,73 (s, 1H); ЖХ/МС: m/e 455 (M+1).
ПРИМЕР 208
[001142] Получение 1-(3-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-3-метилбут-2-ен-1-она I-323
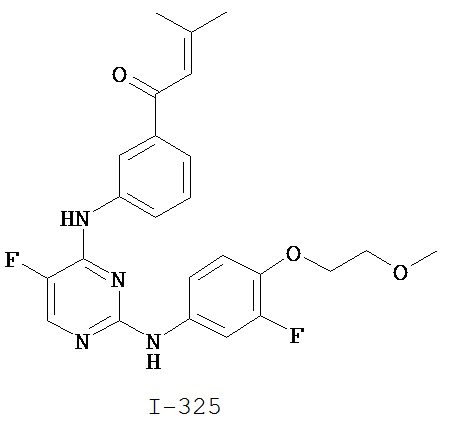
[001143] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 2-(3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,95 (s, 3H), 2,14 (s, 3H), 3,31 (s, 3H), 3,63 (t, J=4,64 Гц, 2H), 4,06 (t, J=4,36 Гц, 2H), 6,85 (bs, 1H), 6,97 (t, J=9,52 Гц, 1H), 7,26 (bd, J=8,32 Гц, 1H), 7,48 (t, J=7,92 Гц, 1H), 7,62-7,67 (m, 2H), 8,08 (bd, J=7,04 Гц, 1H), 8,15-8,16 (m, 2H), 9,29 (s, 1H), 9,58 (s, 1H); ЖХ/МС: m/e 455 (M+1).
ПРИМЕР 209
[001144] Получение 1-(4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-2-метилпроп-2-ен-1-она I-324
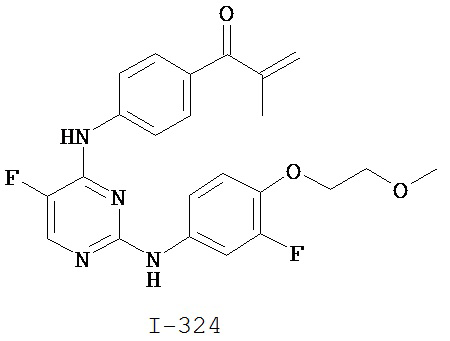
[001145] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием метил 4-аминобензоата вместо соединения 2 на Этапе 1, 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 2,0 (s, 3H), 3,32 (s, 3H), 3,66 (t, J=4,36 Гц, 2H), 4,11 (t, J=4,44 Гц, 2H), 5,55 (s, 1H), 5,94 (s, 1H), 7,07 (t, J=9,32 Гц, 1H), 7,26 (t, J=9,4 Гц, 1H), 7,72-7,76 (m, 3H), 7,99 (d, J=8,44 Гц, 2H), 8,21 (d, J=3,56 Гц, 1H), 9,38 (s, 1H), 9,75 (s, 1H); ЖХ/МС: m/e 441,2 (M+1).
ПРИМЕР 210
[001146] Получение 1-(4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-3-метилбут-3-ен-2-она I-329
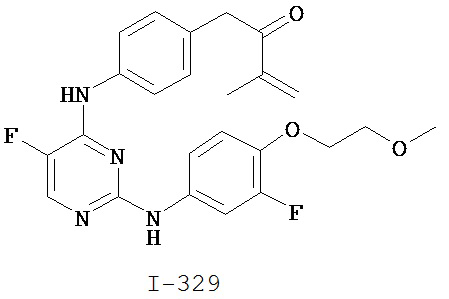
[001147] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием этил-4-аминофенилацетата вместо соединения 2 на Этапе 1, 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 1,79 (s, 3H), 3,30 (s, 3H), 3,62-3,65 (m, 2H), 4,06 (s, 2H), 4,08-4,10 (m, 2H), 5,95 (d, J=1 Гц, 1H), 6,27 (s, 1H), 7,01 (t, J=9,44 Гц, 1H), 7,15 (d, J=8,52 Гц, 2Н), 7,28 (d, J=8,88 Гц, 1H), 7,64-7,70 (m, 3H), 8,08 (d, J=3,72 Гц, 1Н), 9,19 (s. 1H), 9,33 (s, 1H); ЖХ/МС: m/e 455,3 (M+1).
ПРИМЕР 211
[001148] Получение 1-(4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-4-метилпент-3-ен-2-она I-331
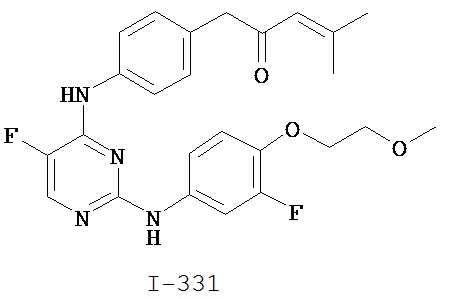
[001149] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием этил-4-аминофенилацетата вместо соединения 2 на Этапе 1, 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,84 (d, J=1 Гц, 3H), 2,05 (d, J=0,92 Гц, 3H), 3,30 (s, 3H), 3,62-3,64 (m, 2H), 3,68 (s, 2H), 4,07-4,09 (m, 2H), 6,21 (t, J=1,2 Гц, 1H), 7,01 (t, J=8,68 Гц, 1H), 7,16 (d,J=8,48 Гц, 2H), 7,26 (d, J=8,96 Гц, 1H), 7,65-7,72 (m, 3H), 8,08 (d, J=3,72 Гц, 1H), 9,20 (s, 1H), 9,34 (s, 1H); ЖХ/МС: m/e 469,3 (M+1).
ПРИМЕР 212
[001150] Получение 1-(3-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-2-метилпроп-2-ен-1-она I-322
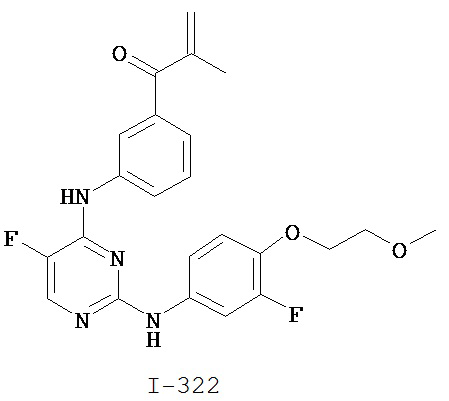
[001151] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием 1,3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 1,96 (s, 3H), 3,30 (s, 3H), 3,63 (t, J=4,6 Гц, 2H), 4,07 (t, J=4,36 Гц, 2H), 5,62 (s, 1H), 6,00 (s, 1H), 6,99 (t, J=9,24 Гц, 1H), 7,26 (d, J=8,92 Гц, 1H), 7,39 (d, J=7,56 Гц, 1H), 7,46 (t, J=7,72 Гц, 1H), 7,62 (bd, J=14,4 Гц, 1H), 7,93 (s, 1H), 8,12-8,14 (m, 2H), 9,25 (s, 1H), 9,58 (s, 1H); ЖХ/МС: m/e 441,2 (M+1).
ПРИМЕР 213
[001152] Получение 1-(3-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-3-метилбут-3-ен-2-она I-328
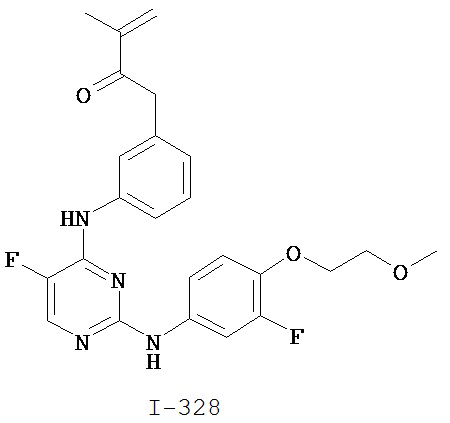
[001153] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием этил-3-аминофенилацетата вместо соединения 2 на Этапе 1, 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на этапе 2 и изопропенилмагнийбромида вместо соединения 8 на Этапе 5. 1H-ЯМР (ДМСО-d6) δ ppm: 1,8 (s, 3H), 3,31 (s, 3H), 3,64 (t, J=4,56 Гц, 2H), 4,06 (s, 2H), 4,09 (t, J=4,37 Гц, 2H), 5,95 (s, 1H), 6,23 (s, 1H), 6,92 (d, J=7,52 Гц, 1H), 7,02 (t, J=9,4 Гц, 1H), 7,27 (t, J=7,8 Гц, 2H), 7,50 (s, 1H), 7,66-7,72 (m, 2H), 8,10 (d, J=3,56 Гц, 1H), 9,21 (s, 1H), 9,36 (s, 1H); ЖХ/МС: m/e 455,1 (M+1).
ПРИМЕР 214
[001154] Получение 2-((3-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)(гидрокси)метил)акрилонитрила I-326
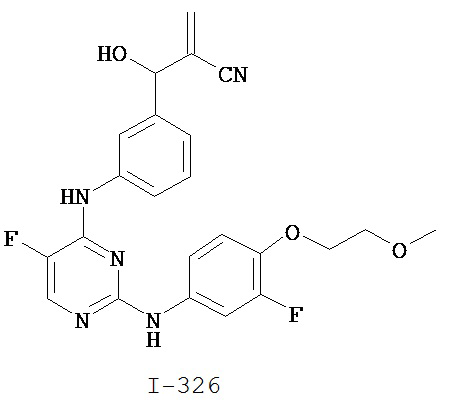
[001155] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 107, с использованием 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,30 (s, 3H), 3,62-3,65 (m, 2H), 4,09 (t, J=4,6 Гц, 2H), δ 5,29 (d, J=3,84 Гц, 1H), 6,13 (s, 1H), 6,19 (s, 1H),6,31 (d, J=4,04 Гц, 1H), 7,03 (t,J=9,24 Гц, 1H), 7,10 (d, J=7,44 Гц, 1H), 7,28 (d, J=8,72 Гц, 1H), 7,36 (t, J=7,8 Гц, 1H), 7,62 (s, 1H), 7,66 (dd, J=2,32 и 14,44 Гц, 1H), 7,89 (d, J=8,2 Гц, 1H), 8,10 (d, J=3,68 Гц, 1H), 9,14 (s, 1H), 9,45 (s, 1H); ЖХ/МС: т/е 454 (M+1).
ПРИМЕР 215
[001156] Получение 2-((4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)(гидрокси)метил)акрилонитрила I-327
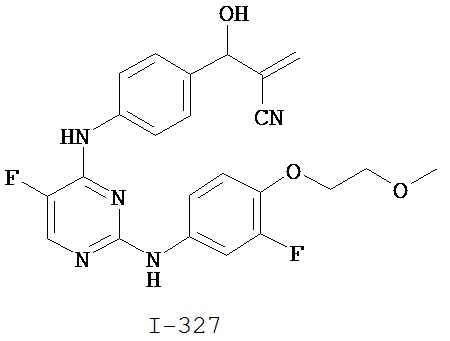
[001157] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 107, с использованием метил-4-аминобензоата вместо соединения 2 на Этапе 1 и 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,30 (s, 3H), 3,64 (dd, J=2,96 и 4,56 Гц, 2H), 4,08 (t, J=4,48 Гц, 2H), 5,29 (d, J=3,8 Гц, 1H), 6,11 (s, 1H), 6,21 (s, 1H), 6,24 (d, J=4,12 Гц, 1H), 7,01 (t, J=9,4 Гц, 1H), 7,29-7,34 (m, 3H), 7,68 (dd, J=2,2 и 14,16 Гц, 1H), 7,77 (d, J=8,52 Гц, 2H), 8,11 (d, J=3,68 Гц, 1H), 9,23 (s, 1H), 9,42 (s, 1H); ЖХ/МС: m/e 454,0 (M+1).
ПРИМЕР 216
[001158] Получение N-(3-(2-(4-хлор-3-(2-гидрокси-2-метилпрокси)феламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-249
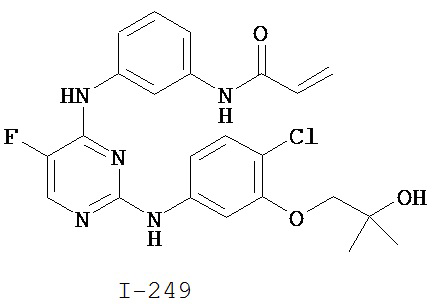
[001159] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-(2-гидрокси-2-метилпропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,20 (s, 6H), 3,61 (s, 2H), 4,61 (s, 1H), 5,75 (d, J=11,4 Гц, 1H), 6,24 (d, J=18,36 Гц, 1H), 6,44 (dd, J=10,32 и 17,08 Гц, 1H), 7,13 (d,J=8,64 Гц, 1H), 7,28 (t,J=8 Гц, 1H), 7,37-7,44 (m, 3H), 7,55 (d, J=7,08 Гц, 1H), 7,93 (s, 1H), 8,12 (d, J=3,44 Гц, 1H), 9,23 (s, 1H), 9,47 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 472,0 (M+1).
ПРИМЕР 217
[001160] Получение N-(3-(5-фтор-2-(3-фтор-4-(2-гидрокси-2-метилпропокси)-фенил-амино)пиримидин-4-иламино)фенил)акриламида I-315
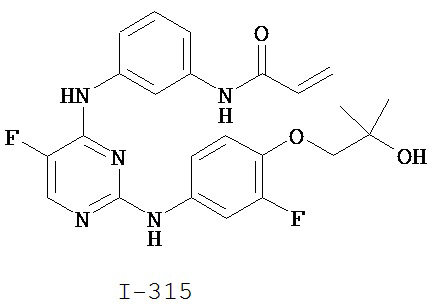
[001161] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-фтор-4-(2-гидрокси-2-метилпропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,19 (s, 6H), 3,67 (s, 2H), 4,62 (s, 1H), 5,75 (d, J=10,4 Гц, 1H), 6,25 (d, J=17,2 Гц, 1H), 6,45 (dd, J=10 и 16,8 Гц, 1H), 6,94 (t, J=9,2 Гц, 1H), 7,29 (t, J=8 Гц, 2H), 7,43 (d, J=8,4 Гц, 1H), 7,49 (d, J=7,6 Гц, 1H), 7,67 (d, J=13,6 Гц, 1H), 7,94 (s, 1H), 8,11 (d, J=3,6 Гц, 1H), 9,19 (s, 1H), 9,45 (s, 1H), 10,14 (s, 1H); ЖХ/МС: m/e 456 (M-1).
ПРИМЕР 218
[001162] Получение N-(3-(5-фтор-2-(3-фтор-4-(1-гидроксипропан-2-илокси)фенил-амино)пиримидин-4-иламино)фенил)акриламида I-333
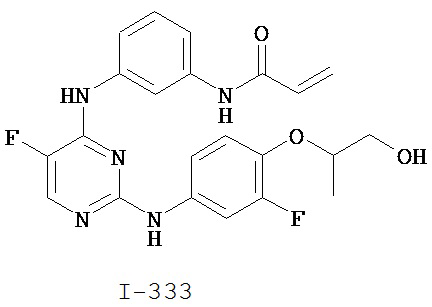
[001163] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-фтор-4-(2-гидрокси-1-метилэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,16 (d, J=6,12 Гц, 3H), 3,40-3,46 (m, 1H), 3,50-3,56 (m, 1H), 4,22 (sextet, J=5,6 Гц, 1H), 4,84 (t, J=5,68 Гц, 1H), 5,75 (dd, J=1,96 и 10,08 Гц, 1H), 6,25 (dd, J=1,92 и 16,92 Гц, 1H), 6,46 (dd, J=10,08 и 16,92 Гц, 1H), 6,98 (t, J=9,32 Гц, 1H), 7,26-7,31 (m, 2H), 7,43 (d, J=8,76 Гц, 1H), 7,49 (d, J=8 Гц, 1H), 7,68 (dd, J=2,44 и 14,28 Гц, 1H), 7,95 (s, 1H), 8,11 (d, J=3,68 Гц, 1H), 9,23 (s, 1H), 9,46 (s, 1H), 10,17 (s, 1H); ЖХ/МС: m/e 442,2 (M+1).
ПРИМЕР 219
[001164] Получение N-(3-(2-(4-(2,3-дигидроксипропокси)-3-фторфениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-334
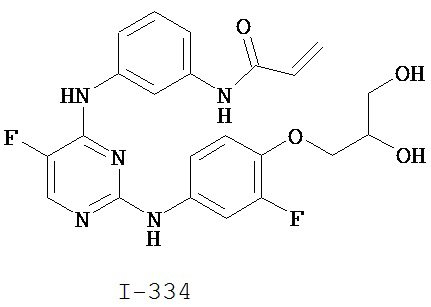
[001165] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(2,3-дигидроксипропокси)-3-фторанилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,42 (t, J=5,6 Гц, 2H), 3,7-3,8 (m, 1H), 3,8-3,9 (m, 1H), 3,94 (dd, J=4,36 и 9,92 Гц, 1H), 4,65 (t, J=5,64 Гц, 1H), 4,93(d, J=5,08 Гц, 1Н), 5,7-5,8 (m, 1H), 6,24 (dd, J=1,64 и 16,84 Гц, 1H), 6,44 (dd, J=10 и 16,96 Гц, 1H), 6,94 (t, J=9,32 Гц, 1H), 7,28 (t, J=7,96 Гц, 2H), 7,40 (d. J=8,28 Гц, 1H), 7,49 (d, J=7,44 Гц, 1Н), 7,66 (d, J=14,24 Гц, 1H), 7,92 (s, 1H), 8,09 (d, J=3,6 Гц, 1H), 9,17 (s, 1H), 9,45 (s, 1H), 10,15 (s, 1Н); ЖХ/МС: m/e 456 (M-1).
ПРИМЕР 220
[001166] Получение N-(3-(2-(4-xnop-3-(1-гидрокси-2-метилпропан-2-илокси)фенил-амино)-5-фторпиримидин-4-иламино)фенил)акриламида I-336
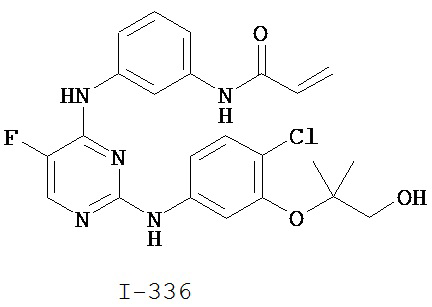
[001167] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-(1-гидрокси-2-метилпропан-2-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,22 (s, 6Н), 3,47 (d, J=5,88 Гц, 2H), 4,88 (t, J=5,84 Гц, 1H), 5,75 (dd, J=3,24 и 10 Гц, 1H), 6,25 (dd, J=2 и 16,92 Гц, 1H), 6,46 (dd, J=10,12 и 17,08 Гц, 1H), 7,15 (d, J=8,8 Гц, 1H), 7,31 (t, J=8,2 Гц, 1H), 7,40-7,45 (m, 1H), 7,51-7,60 (m, 3H), 7,93 (s, 1H), 8,13 (d, J=3,56 Гц, 1H), 9,24 (s, 1H), 9,47 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 472,2 (M+1).
ПРИМЕР 221
[001168] Получение N-(3-(2-(4-хлор-3-(1-гидроксипропан-2-илокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-337
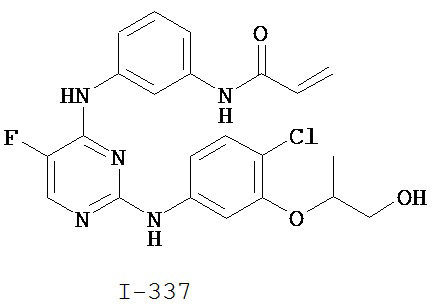
[001169] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-(1-гидроксипропан-2-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,18 (d, J=6,12 Гц, 3H), 3,40-3,47 (m, 1H), 3,50-3,56 (m, 1H), 4,20-4,30 (m, 1H), 4,82 (t, J=5,6 Гц, 1H), 5,75 (dd, J=1,88 и 10,08 Гц, 1H), 6,25 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 7,12 (d, J=8,76 Гц, 1H), 7,29 (t, J=8,08 Гц, 1H), 7,40-7,44 (m, 3H), 7,52 (d, J=8,44 Гц, 1H), 7,91 (s, 1H), 8,12 (d, J=3,64 Гц, 1H), 9,21 (s, 1H), 9,45 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 458,0 (M+1).
ПРИМЕР 222
[001170] Получение N-(3-(2-(4-(2,3-дигидроксипропокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-335
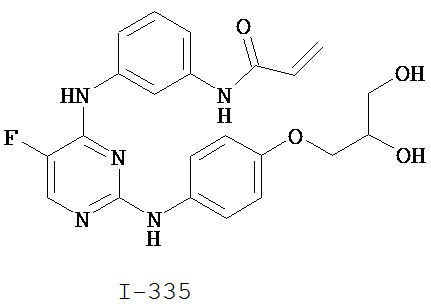
[001171] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(1-гидроксипропан-2-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,43 (dd, J=0,64 и 6,84 Гц, 2H), 3,70-3,80 (m, 2H), 3,85-3,95 (m, 1H), 4,62 (t, J=5,6 Гц, 1H), 4,88 (d, J=4,76 Гц, 1H), 5,75 (dd, J=1,76 и 10,08 Гц, 1H), 6,25 (dd, J=1,72 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,88 Гц, 1H), 6,74 (d, J=9 Гц, 2H), 7,27 (t, J=8,08 Гц, 1H), 7,39 (d, J=8,04 Гц, 1H), 7,38-7,53 (m, 3H), 7,93 (s, 1H), 8,05 (d, J=3,68 Гц, 1H), 8,93 (s, 1H), 9,35 (s, 1H), 10,11 (s, 1H); ЖХ/МС: m/e 440,3 (M+1).
ПРИМЕР 223
[001172] Получение (R)-N-(3-(2-(4-хлор-3-(тетрагидрофуран-3-илокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-341
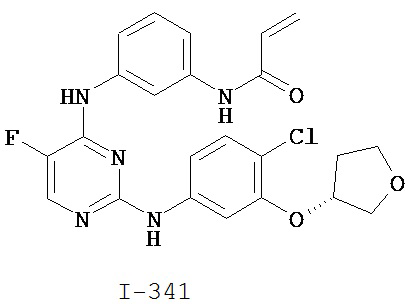
[001173] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-4-хлор-3-(тетрагидрофуран-3-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,85-1,95 (m, 1H), 2,0-2,15 (m, 1H), 3,60-3,70 (m, 1H), 3,73-3,83 (m, 3H), 4,68 (s, 1H), 5,74 (dt, J=1,92 и 10,0 Гц, 1H), 6,23 (dd, J=1,88 и 16,92 Гц, 1H), 6,43 (dd, J=10,12 и 16,96 Гц, 1H), 7,14 (d, J=8,72 Гц, 1H), 7,29 (t, J=8,08 Гц, 1H), 7,33 (dd, J=4,16 и 8,76 Гц, 1H), 7,41-7,47 (m, 3H), 7,90 (s, 1H), 8,13 (d, J=3,56 Гц, 1H), 9,28 (s, 1H), 9,47 (s, 1H), 10,13 (s, 1H); ЖХ/МС: m/e 469,8 (M+1).
ПРИМЕР 224
[001174] Получение N-(3-(5-фтор-2-(3-фтор-4-(1-гидрокси-2-метилпропан-2-илокси)-фениламино)пиримидин-4-иламино)фенил)акриламида I-332
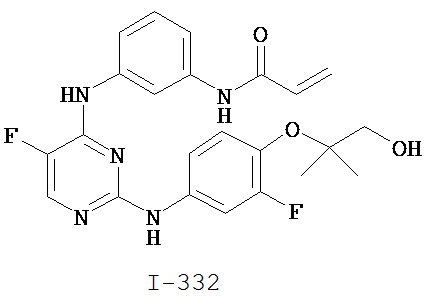
[001175] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-фтор-4-(1-гидрокси-2-метилпропан-2-илокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,13 (s, 6H), 3,36 (d, J=5,84 Гц, 2H), 4,86 (t, J=5,84 Гц, 1H), 5,73 (dd, J=1,96 и 10,04 Гц, 1H), 6,24 (dd, J=1,96 и 16,96 Гц, 1H), 6,44 (dd, J=10,08 и 16,92 Гц, 1H), 6,95 (t, J=9,16 Гц, 1H), 7,23 (dd, J=1,64 и 8,96 Гц, 1H), 7,28 (t, J=8,12 Гц, 1H), 7,43 (d, J=8,8 Гц, 1H), 7,48 (d, J=7,92 Гц, 1H), 7,70 (dd, J=2,48 и 13,84 Гц, 1H), 7,92 (s, 1H), 8,11 (d, J=3,68 Гц, 1H), 9,25 (s, 1H), 9,45 (s, 1H), 10,10 (s, 1Н); ЖХ/МС: m/e 456,2 (М+1).
ПРИМЕР 225
[001176] Получение N-(3-(2-(3-(2,3-дигидроксипропокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-339
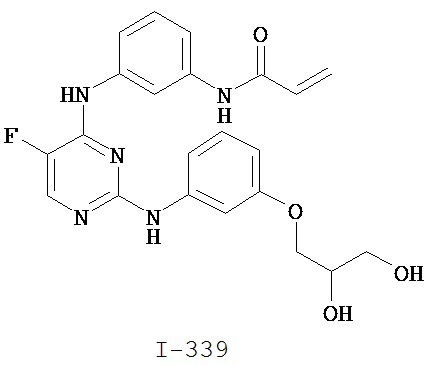
[001177] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-(2,3-дигидроксипропокси)анилина вместо соединения 4 на Этапе 2. 1Н-ЯМР (MeOD) δ ppm: 3,59-3,69 (m, 2H), 3,88-3,98 (m, 3H), 5,78 (dd, J=2,16 и 9,6 Гц, 1H), 6,36 (dd, J=2,24 и 17,04 Гц, 1H), 6,44 (dd, J=9,56 и 16,96 Гц, 1Н), 6,54-6,57 (m, 1Н), 7,08-7,12 (m, 2H), 7,32 (t, J=7,92 Гц, 2H), 7,44 (dd, J=7,88 и 13,4 Гц, 2H), 7,94 (d, J=3,8 Гц, 1H), 8,09 (s, 1H); ЖХ/МС: m/e 440,1 (М+1).
ПРИМЕР 226
[001178] Получение N-(4-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-351
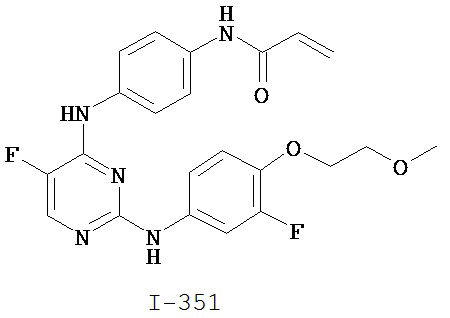
[001179] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием метил-трет-бутоксикарбониламино-4-аминоанилина вместо соединения 2 на Этапе 1 и 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1Н-ЯМР (ДМСО-d6) δ ppm: 3,30 (s, 3H), 3,63 (t, J=4,6 Гц, 2H), 4,08 (t, J=4,48 Гц, 2H), 5,74 (dd, J=2 и 10,08 Гц, 1H), 6,25 (dd, J=1,96 и 16,92 Гц, 1H), 6,44 (dd, J=10,04 и 16,96 Гц, 1H), 7,02 (t, J=9,48 Гц, 1H), 7,23 (bd, J=7,44 Гц, 1H), 7,64 (d, J=9 Гц, 2H), 7,70-7,74 (m, 3H), 8,07 (d, J=3,72 Гц, 1H), 9,19 (s, 1H), 9,34 (s, 1H), 10,13 (s, 1H); ЖХ/МС: m/e 442,0 (M+1).
ПРИМЕР 227
[001180] Получение 2-((3-(5-фтор-2-(6-(2-гидрокси-2-метилпропокси)пиридин-3-ил-амино)пиримидин-4-иламино)фенил)(гидрокси)метил)акрилонитрила I-312
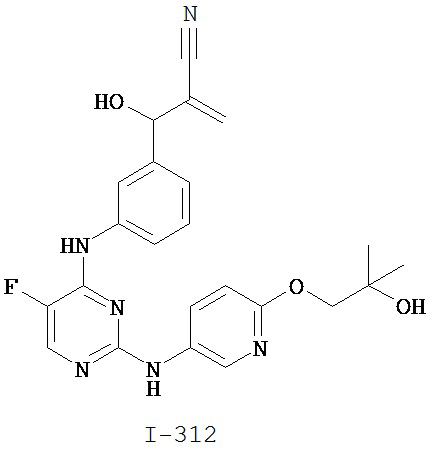
[001181] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 107, с использованием 3-амино-6-(2-гидрокси-2-метилпропокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,18 (s, 6H), 3,98 (s, 2H), 4,61 (s, 1H), 5,31 (d, J=3,88 Гц, 1H), 6,13 (s, 1H), 6,19 (s, 1H), 6,32 (d, J=4 Гц, 1H), 6,75 (d, J=8,88 Гц, 1H), 7,10 (d, J=7,72 Гц, 1H), 7,33 (t, J=7,84 Гц, 1H), 7,68 (s, 1H), 7,84 (d, J=7,52 Гц, 1H), 7,96 (dd, J=2,72 и 8,88 Гц, 1H), 8,08 (d, J=3,64 Гц, 1H), 8,33 (d, J=1,76 Гц, 1H), 9,06 (s, 1H), 9,44 (s, 1H); ЖХ/МС: m/e 451 (M+1).
ПРИМЕР 228
[001182] Получение 4-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-ил-амино)фенокси)-N-метилпиколинамида I-342
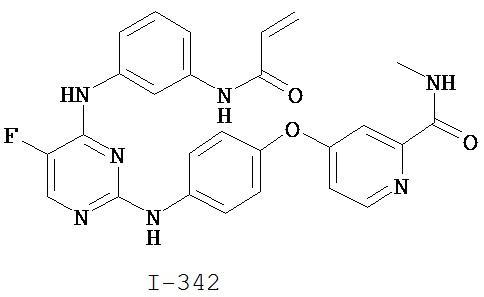
[001183] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(4-аминофенокси)-N-метилпиколинамида вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 500,2.
ПРИМЕР 229
[001184] Получение (R)-1-(3-(3-фтор-4-(2-метоксиэтокси)фениламино)пиримидин-4-иламино)пиперидин-1-ил)проп-2-ен-1-она I-344
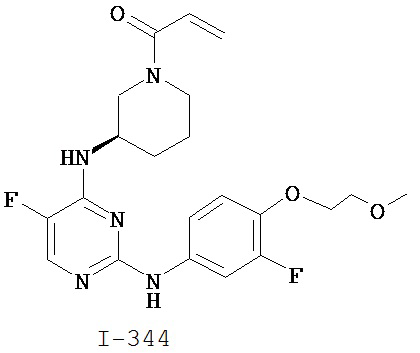
[001185] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-1-трет-бутоксикарбонил-3-аминопиперидина вместо соединения 2 на Этапе 1 и 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (М+Н) 434,1.
ПРИМЕР 230
[001186] Получение (R)-1-(3-(4-(2-метоксиэтокси)фениламино)пиримидин-4-ил-амино)пиперидин-1-ил)проп-2-ен-1-она I-345
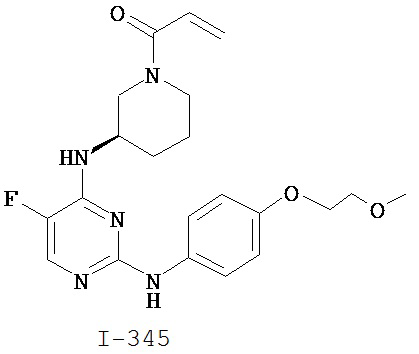
[001187] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-1-трет-бутоксикарбонил-3-аминопиперидина вместо соединения 2 на Этапе 1 и 4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 416,2.
ПРИМЕР 231
[001188] Получение 4-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-ил-амино)фенокси)пиридина I-346
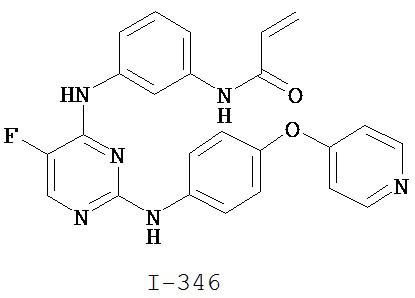
[001189] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-(4-аминофенокси)пиридина вместо соединения 4 на Этапе 2. ЖХ/МС (RT=2,802/(M+H)) 500,2
ПРИМЕР 232
[001190] Получение 1-((R)-3-(5-фтор-2-(4-((S)-тетрагидрофуран-3-илокси)фенил-амино)пиримидин-4-иламино)пиперидин-1-ил)проп-2-ен-1-она I-347
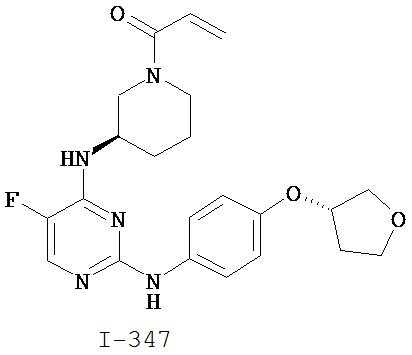
[001191] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-1-трет-бутоксикарбонил-3-аминопиперидина вместо соединения 2 на Этапе 1 и 4-(S)-(тетрагидрофуран-3-илокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 428,3.
ПРИМЕР 233
[001192] Получение 1-((R)-3-(5-фтор-2-(4-((R)-тетрагидрофуран-3-илокси)фенил-амино)пиримидин-4-иламино)пиперидин-1-ил)проп-2-ен-1-она I-348
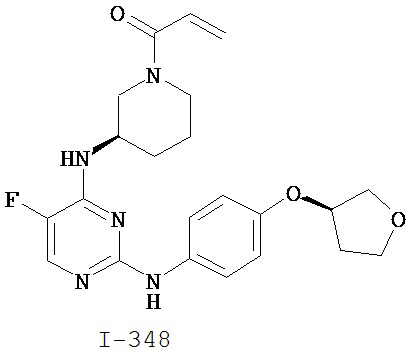
[001193] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-1-трет-бутоксикарбонил-3-аминопиперидина вместо соединения 2 на Этапе 1 и 4-(R)-(тетрагидрофуран-3-илокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 428,3.
ПРИМЕР 234
[001194] Получение N-(3-(2-(2,3-дигидробензо[b][1,4]диоксин-6-иламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-349
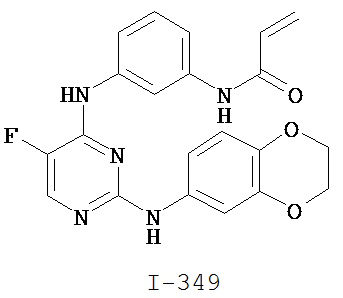
[001195] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 6-амино-2,3-дигидробензо[6][1,4]диоксана вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 408
ПРИМЕР 235
[001196] Получение 1-(6-(4-(3-хлор-4-(пиридин-2-илметокси)фениламино)-5-фтор-пиримидин-2-иламино)-2H-бензо[b][1,4]оксазин-4(3H)-ил)проп-2-ен-1-она I-343
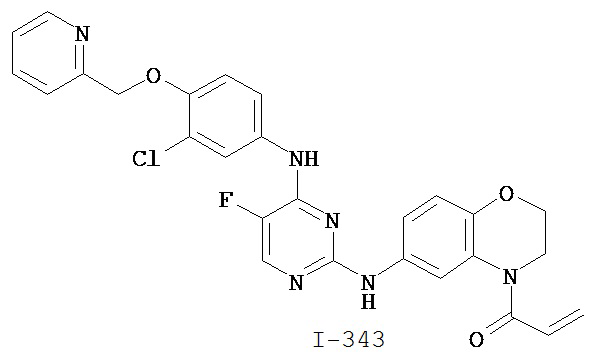
[001197] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 35, с использованием 3-хлор-4-(пиридин-2-илметокси)анилина вместо соединения 2 на Этапе 1. ЖХ/МС (M+H) 533,1
ПРИМЕР 236
[001198] Получение N-(3-(5-циано-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)акриламида I-350
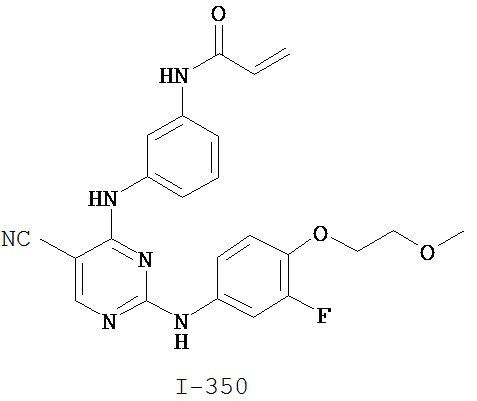
[001199] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 94, с использованием 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС (M+H) 449,1
ПРИМЕР 237
[001200] Получение N-(3-(5-трифторметил-2-(3-фтор-4-(2-метоксиэтокси)фенил-амино)пиримидин-4-иламино)фенил)акриламида I-352
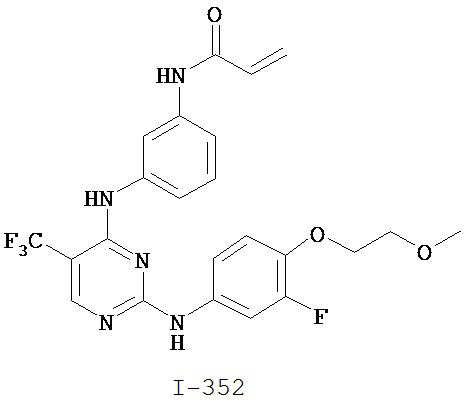
[001201] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 189, с использованием 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 2 на Этапе 1. ЖХ/МС (M+H) 492,1
ПРИМЕР 238
[001202] Получение N-(3-(2-(4-хлор-3-(2-метоксиэтокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-321
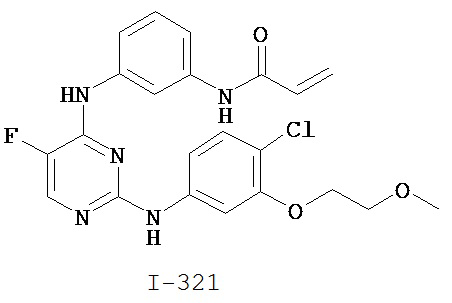
[001203] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 4-хлор-3-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 3,30 (s, 3H), 3,60 (t, J=4,56 Гц, 2H), 3,88 (t, J=3,48 Гц, 2H), 5,74 (dd, J=4,36 и 10,0 Гц, 1H), 6,24 (dd, J=1,8 и 16,88 Гц, 1H), 6,44 (dd, J=4,36 и 10,0 Гц, 1H), 7,13 (d, J=8,72 Гц, 1H), 7,28 (t, J=8,04 Гц, 1H), 7,33 (dd, J=2,16 и 8,8 Гц, 1H), 7,41 (d, J=7,96 Гц, 1H), 7,47-7,49 (m, 2H), 7,84 (s, 1H), 8,13 (d, J=3,6 Гц, 1H), 9,27 (s, 1H), 9,47 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 458,0 (M+1).
ПРИМЕР 239
[001204] Получение N-(3-(5-фтор-2-(6-(2-гидрокси-2-метилпропокси)пиридин-3-ил-амино)пиримидин-4-иламино)фенил)акриламида I-313
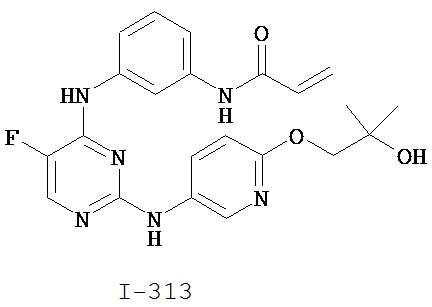
[001205] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-амино-6-(2-гидрокси-2-метилпропокси)пиридина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,16 (s, 6H), 3,93 (s, 2H), 4,57 (s, 1H), 5,74 (dd, J=1,68 и 10,04 Гц, 1H), 6,24 (dd, J=1,84 и 16,92 Гц, 1H), 6,45 (dd, J=10,04 и 16,88 Гц, 1H), 6,65 (d, J=8,88 Гц, 1H), 7,26 (t, J=8,04 Гц, 1H), 7,39 (d, J=8 Гц, 1H), 7,48 (d, J=7,8 Гц, 1H), 7,91 (s, 1H), 7,99 (dd, J=2,72 и 8,92 Гц, 1H), 8,07 (d, J=3,68 Гц, 1H), 8,27 (d, J=2,52 Гц, 1H), 9,06 (s, 1H), 9,41 (s, 1H), 10,1 (s, 1H); ЖХ/МС: m/e 439,0 (M+1).
ПРИМЕР 240
[001206] Получение N-(3-(5-фтор-2-(3-фтор-4-(3-(метилсульфонил)пропокси)фенил-амино)пиримидин-4-иламино)фенил)акриламида I-318
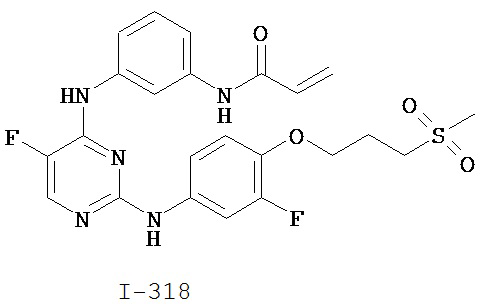
[001207] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием 3-фтор-4-(3-(метилсульфонил)пропокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 2,05-2,15 (m, 2H), 3,01 (s, 3H), 3,24 (t, J=7,56 Гц, 2H), 4,05 (t, J=6,12 Гц, 2H), 5,74 (dd, J=1,84 и 9,72 Гц, 1H), 6,24 (dd, J=1,72 и 16,96 Гц, 1H), 6,44 (dd, J=10 и 16,84 Гц, 1H), 6,96 (t, J=9,36 Гц, 1H), 7,28 (t, J=8,04 Гц, 2H), 7,40 (d, J=7,8 Гц, 1H), 7,48 (d, J=8,32 Гц, 1H), 7,69 (dd, J=2,2 и 14,4 Гц, 1H), 7,91 (s, 1H), 8,10 (d, J=3,64 Гц, 1H), 9,20 (s, 1H), 9,44 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 504,2 (M+1).
ПРИМЕР 241
[001208] Получение 1-(3-(5-фтор-2-(3-фтор-4-(2-метоксиэтокси)фениламино)-пиримидин-4-иламино)фенил)-4-метилпент-3-ен-2-она I-330
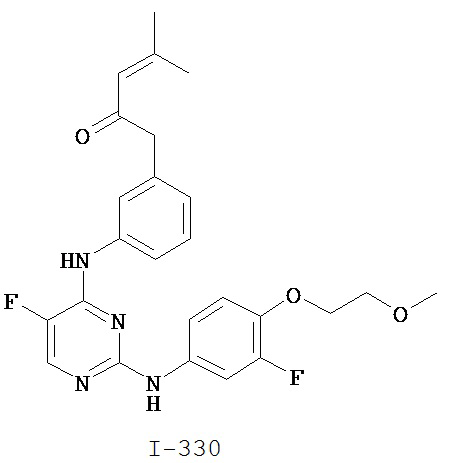
[001209] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 112, с использованием этил-4-аминометилбензоата вместо соединения 2 на Этапе 1 и 3-фтор-4-(2-метоксиэтокси)анилина вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ ppm: 1,83 (s, 3H), 2,05 (s, 3H), 3,31 (s, 3H), 3,64 (t, J=4,56 Гц, 2H), 3,69 (s, 2H), 4,08 (t, J=4,4 Гц, 2H), 6,18 (s, 1H), 6,92 (d, J=7,44 Гц, 1H), 7,01 (t, J=9,36 Гц, 1H), 7,27 (t, J=7,84 Гц, 2H), 7,51 (s, 1H), 7,64-7,71 (m, 2H), 8,09 (d, J=3,64 Гц, 1H), 9,19 (s, 1H), 9,34 (s, 1H); ЖХ/МС: m/e 469,1 (M+1).
ПРИМЕР 242
[001210] Получение N-(3-(2-(4-хлор-3-(2,3-дигидроксипропокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-353
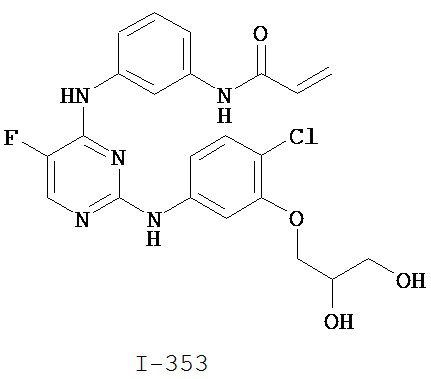
[001211] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
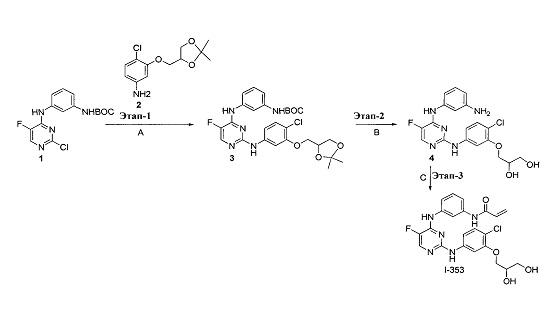
A) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 16 часов; B) TFA, CH2Cl2 комн. темп., 2 часа; C) акрилоилхлорид, K2CO3, NMP, комн. темп., 45 минут.
[001212] Этап 1
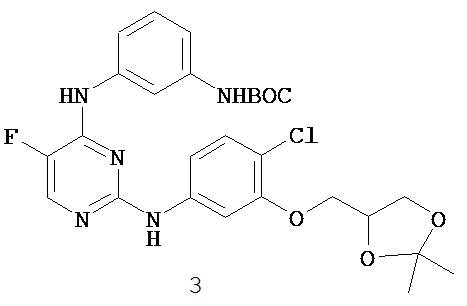
[001213] Раствор соединения 2 (200 мг, 0,77 ммоль), соединения 1 (262 мг, 0,77 ммоль), Pd(OAc)2 (17,3 мг, 0,07 ммоль), BINAP (24 мг, 0,038 ммоль) и Cs2CO3 (630 мг, 1,9 ммоль) в дегазированном толуоле (через толуол пропускали N2 в течение 30 минут) грели в течение 16 часов при 100°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (15 мл) и фильтровали через целит®. Фильтрат промывали водой (5 мл) и солевым раствором (3 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 3 (0,3 г, 69%) в виде желтого твердого продукта.
[001214] Этап 2
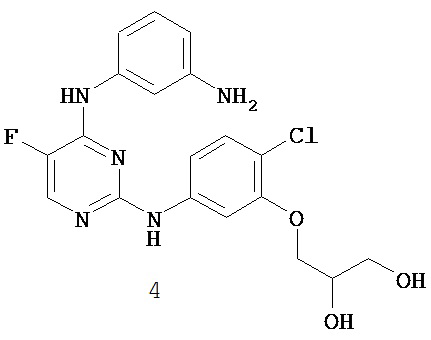
[001215] К раствору соединения 3 (300 мг, 0,5 ммоль) в сухом CH2Cl2 (6 мл) при температуре 0°C добавляли TFA (3 мл) и выдерживали реакционную смесь при этой температуре в течение 30 минут. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре в течение 3 часов. Реакционную смесь концентрировали при пониженном давлении, и остаток гасили водой (5 мл), подщелачивали раствором NaCO3 и экстрагировали этилацетатом (2×10 мл). Объединенный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 4 (200 мг, 88%) в виде желтого твердого продукта.
[001216] Этап 3
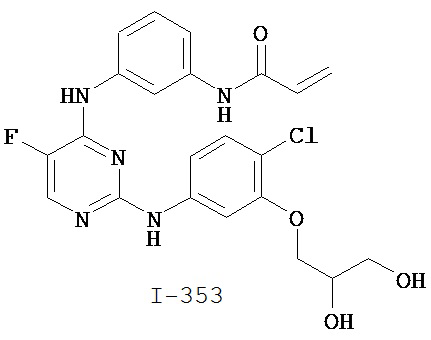
[001217] К раствору соединения 4 (240 мг, 0,5 ммоль) и NMP (1,5 мл) при температуре 0°C при перемешивании добавляли калия карбонат (780 мг, 5,7 ммоль) и акрилоилхлорид (57 мг, 0,5 ммоль), и перемешивали реакционную смесь при температуре 0°C в течение 3 часов. Далее реакционную смесь перемешивали при комнатной температуре в течение 30 минут и гасили реакционную смесь, добавляя ее по капле в холодный 10% раствор NaHCO3 при перемешивании, после чего перемешивали полученный раствор при температуре 0°C еще 30 минут. Выпавший осадок отфильтровывали на воронке Бюхнера. Твердый осадок промывали холодной водой, растворяли в EtOAc (20 мл) и подщелачивали триэтиламином, после чего промывали реакционную смесь водой (2 мл), солевым раствором (1 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток очищали методом препаративной ВЭЖХ с получением указанного в названии соединения (45 мг, 15,5%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 3,43-3,50 (m, 2H), 3,78-3,85 (m, 2H), 3,89-3,92 (m, 1H), 4,65 (t, J=5,6 Гц, 1H), 4,93 (d, J=4,8 Гц, 1H), 5,76 (dd, J=1,92 и 10,04 Гц, 1H), 6,26 (dd, J=1,92 и 16,92 Гц, 1H), 6,46 (dd, J=10,08 и 16,92 Гц, 1H), 7,14 (d, J=8,72 Гц, 1H), 7,30 (t, J=8,08 Гц, 1H), 7,39-7,43 (m, 2H), 7,46 (dd, J=2,2 и 8,72 Гц, 1H), 7,56 (d, J=8,04 Гц, 1H), 7,94 (s, 1H), 8,14 (d, J=3,6 Гц, 1H), 9,24 (s, 1H), 9,48 (s, 1H), 10,13 (s, 1H); ЖХ/МС: m/e 473,8 (M+).
[001218] Получение промежуточного соединения 2
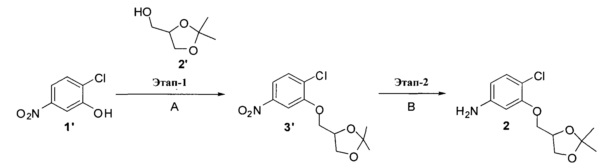
A) DIAD, PPh3, Et2N, сухой ТГФ, комн. темп., 1 час; B) H2, Ra Ni, метанол, 2 часа.
[001219] Этап 1
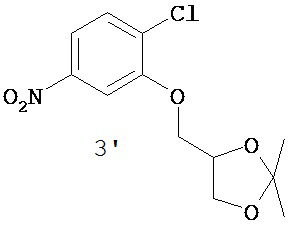
[001220] К раствору соединения 2’ (0,640 г, 3,7 ммоль) в ТГФ (20 мл) добавляли при перемешивании соединение Г (0,5 г, 3,7 ммоль), PPh3 (1,09 г, 4,1 ммоль) и Et3N (0,73 г, 5,6 ммоль) в атмосфере N2. Реакционную смесь охлаждали до 0°C и добавляли диизопропилазодикарбоксилат (DIAD) (0,84 г, 4,1 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали 1 час. Затем реакционную смесь гасили водой, экстрагировали этилацетатом (3×10 мл) и промывали объединенный экстракт водой и солевым раствором (по 5 мл каждого). Остаток концентрировали при пониженном давлении, после чего очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 9/1) с получением соединения 3’ (0,6 г, 60%) в виде белого твердого продукта.
[001221] Этап-2
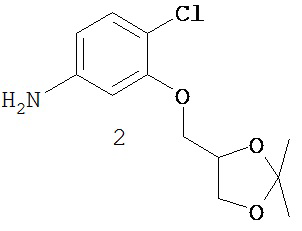
[001222] К раствору соединения 3’ (0,3 г, 1,04 ммоль) в метаноле добавляли Никель Ренея Ra Ni (60 мг, 20% (вес.)) в атмосфере N2 и выдерживали реакционную смесь в атмосфере H2 (под давлением) в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали фильтрат при пониженном давлении. Остаток разбавляли 1,5 N раствором HCl (2 мл) и промывали этилацетатом (5 мл) для удаления органических примесей. Водный слой подщелачивали раствором NaHCO3 (5 мл), экстрагировали этилацетатом, промывали водой (2 мл) и солевым раствором (2 мл) и сушили над безводным Na2SO4. Фильтровали, после чего концентрировали при пониженном давлении с получением соединения 2 (0,2 г, 76,9%) в виде коричневой жидкости.
ПРИМЕР 243
[001223] Получение (S)-N-(3-(2-(4-хлор-3-(тетрагидрофуран-3-илокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-354
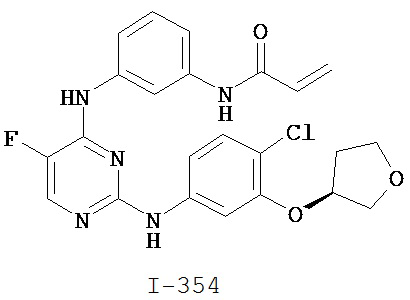
[001224] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-4-хлор-3-(тетрагидрофуран-3-илокси)анилина вместо соединения 4 на Этапе 2. ЖХ/МС: m/e 469,8 (M+1).
ПРИМЕР 244
[001225] Получение (N-(3-(5-фтор-2-(3-фтор-4-(((2S,4R)-4-гидроксипирролидин-2-ил)метокси)фениламино)пиримидин-4-иламино)фенил)акриламида I-355
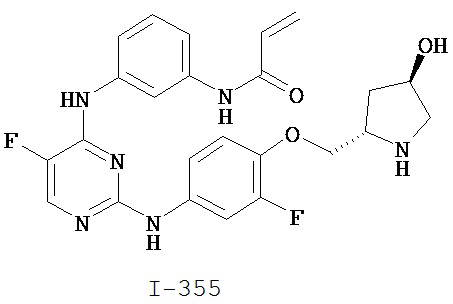
[001226] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
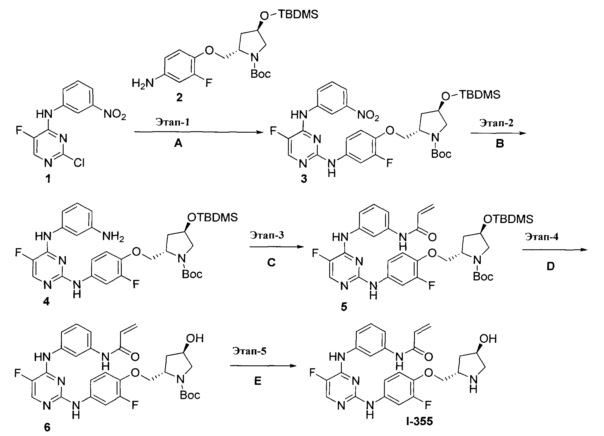
A) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 6 часов; B) TFA, CH2Cl2, комн. темп., 1 час; C) (Boc)2O, 30 минут, затем - акрилоилхлорид, K2CO3, NMP, 0°C, 90 минут; D) HF (49% водный раствор), CH3CN, комн. темп., 2 часа; E) TFA, ДХМ, комн. темп., 2 часа.
[001227] Этап 1
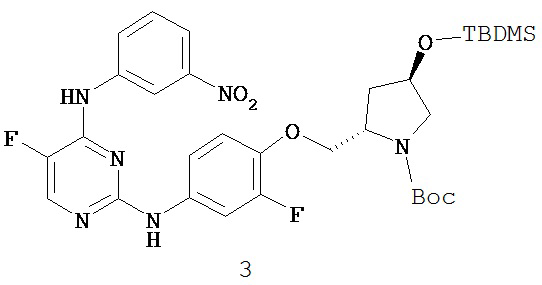
[001228] Раствор соединения 2 (0,50 г, 1,13 ммоль), соединения 1 (0,30 г, 1,13 ммоль), Pd(OAc)2 (0,0025 г, 0,1 ммоль), BINAP (0,0035 г, 0,05 ммоль) и Cs2CO3 (0,92 г, 2,8 ммоль) в дегазированном толуоле (толуол продували N2 в течение 30 минут) грели в течение 16 часов при температуре 110°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл), промывали водой (10 мл), солевым раствором (10 мл) и сушили над Na2SO4. Фильтровали, после чего концентрировали при пониженном давлении с получением остатка, который промывали гексаном с получением соединения 3 (0,3 г, 42,8%) в виде желтого твердого продукта.
[001229] Этап 2
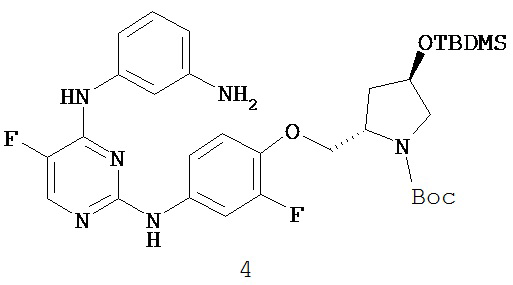
[001230] К раствору соединения 3 (0,3 г, 0,44 ммоль) в этаноле (5 мл) добавляли Pd/C (0,030 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (из баллона) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (0,19 г, 67,6%) в виде желтого твердого продукта.
[001231] Этап 3
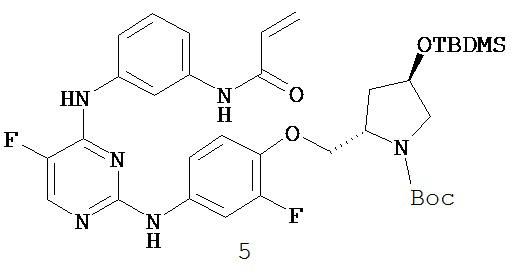
[001232] К раствору соединения 4 (0,1 г, 0,15 ммоль) в NMP (1,0 мл) при комнатной температуре при перемешивании Boc-ангидрид (0,046 г, 0,212 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 60 минут. Затем его охлаждали до 0°C и добавляли K2CO3 (0,107 г, 0,77 ммоль), акрилоилхлорид (0,016 г, 0,18 ммоль), после чего реакционную смесь перемешивали при температуре 0°C в течение 90 минут. Реакционную смесь при перемешивании по каплям добавляли к холодному 10% раствору NaHCO3. После этого раствор перемешивали в течение еще 30 минут при температуре 0°C, и отделяли выпавший осадок фильтрованием на воронке Бюхнера. Полученный осадок промывали холодной водой, гексаном и растворяли в смеси метанол:дихлорметан (50:50, 10 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (5 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×10 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Остаток далее очищали методом колоночной хроматографии (SiO2, метанол/хлороформ: 4/96) с получением соединения 5 (0,075 г, 71,4%) в виде желтого твердого продукта.
[001233] Этап 4
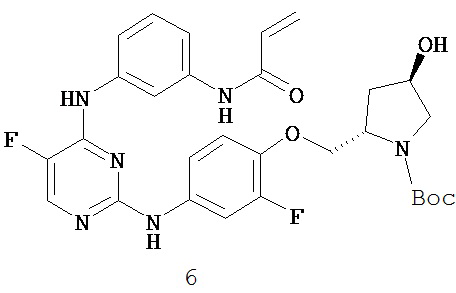
[001234] К раствору соединения 5 (15 мг, 0,02 ммоль) в ацетонитриле добавляли HF (49% водный раствор, 0,0048 мл, 0,024 ммоль) при температуре 0°C. Реакционную смесь перемешивали при комнатной температуре в течение 2 часов, экстрагировали этилацетатом (2 мл), промывали водой (1 мл), сушили над Na2SO4 и фильтровали. Фильтрат концентрировали при пониженном давлении. Чистота остатка по данным ЖХ/МС составила60%, и остаток использовали на следующем этапе без дальнейшей очистки.
[001235] Этап 5
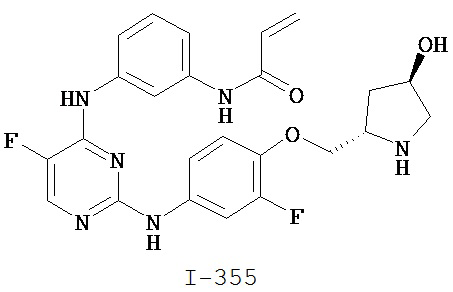
[001236] К раствору соединения 6 (0,008 г, 0,013 ммоль) в CH2Cl2 (0,024 мл) при температуре 0°C при перемешивании добавляли TFA (0,016 мл). Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали в течение еще 2 часов. Затем реакционную смесь концентрировали и перемешивали с холодным 10% NaHCO3 (1,0 мл). Экстрагировали EtOAc (2×2 мл) и объединенный экстракт EtOAc промывали солевым раствором (1 мл), сушили над Na2SO4 и концентрировали при пониженном давлении. Сырой остаток далее очищали методом колоночной хроматографии (SiO2, метанол/хлороформ: 2/98) и затем очищали методом препаративной ТСХ с получением указанного в названии соединения (2 мг, чистота 81% согласно ВЭЖХ и чистота 79% согласно ЖХ/МС) в виде белого твердого продукта. ЖХ/МС: m/e 483 (M+).
[001237] Соединение 2 получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
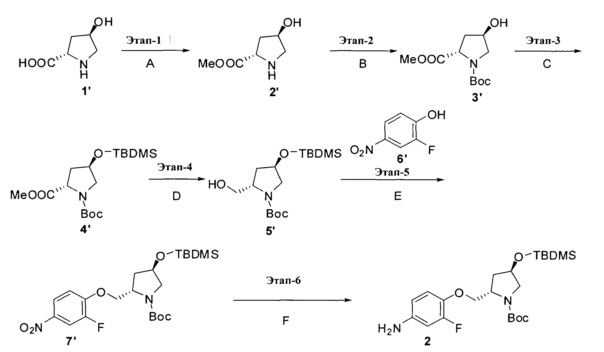
A) MeOH, SOCl2, кипячение с обратным холодильником, 5 часов; B) (Boc)2O, Et3N, CH2Cl2, комн. темп., 5 часов; C) TBDMS-Cl, имидазол, ДМФА, комн. темп., 16 часов; D) раствор LAH (1М в ТГФ), -20°C, 20 минут; E) DIAD, PPh3, Et3N, ТГФ, 16 часов; F) N2, Pd/C, метанол, комн. темп., 16 часов.
[001238] Этап 1
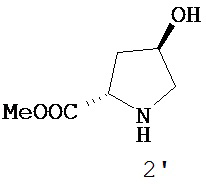
[001239] К раствору соединения 1’ (2 г, 15,26 ммоль) при перемешивании добавляли раствор, приготовленный добавлением тионилхлорида (2 мл) к метанолу (20 мл). Реакционную смесь кипятили с обратным холодильником в течение 5 часов. После завершение реакции при пониженном давлении удаляли метанол с получением соединения 2’ в виде бесцветной соли (3,0 г), которую без дополнительной очистки использовали на следующем этапе.
[001240] Этап 2

[001241] К раствору соединения 2’ (3,0 г, 12,24 ммоль) в ДХМ (30 мл) при перемешивании добавляли Et3N (1,85 г, 18,31 ммоль) и Boc-ангидрид (2,92 г, 13,46 ммоль). Перемешивали реакционную смесь при комнатной температуре в течение 5 часов, после чего гасили ее водой. Органический слой отделяли, сушили и концентрировали при пониженном давлении. Остаток очищали методом колоночной хроматографии (SiO2, 60-120 меш, 100% этилацетат) с получением соединения 3’ (3,2 г, 64%) в виде белого твердого продукта.
[001242] Этап 3
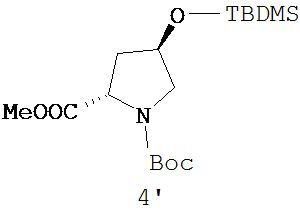
[001243] К раствору соединения 3’ (3 г, 12,24 ммоль) в ДМФА (30 мл) при перемешивании добавляли имидазол (1,2 г, 18,36 ммоль), а затем трет-бутилдиметилсилилхлорид (TBDMS-Cl) (1,84 г, 12,24 г). Перемешивали реакционную смесь в течение 16 часов. Реакционную смесь разбавляли этилацетатом (50 мл), после чего отделяли этилацетатный слой. Его промывали водой (5 мл), солевым раствором (5 мл) и сушили над Na2SO4. Фильтровали, после чего концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 6/4) с получением соединения 4’ (3,2 г, 80%) в виде бесцветной жидкости.
[001244] Этап 4

[001245] К раствору соединения 4’ (0,5 г, 1,39 ммоль) в ТГФ (5 мл) при перемешивании добавляли LAH (1,39 мл, 1М раствор, 1,39 ммоль) при температуре -20°C. Реакция проводили при этой температуре в течение 15 минут, после чего ее гасили раствором Na2SO4. Реакционную массу фильтровали через целит® и концентрировали фильтрат при пониженном давлении. Остаток разбавляли этилацетатом (10 мл), сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением соединения 5’ (0,3 г, 65%) в виде бесцветной жидкости.
[001246] Этап 5
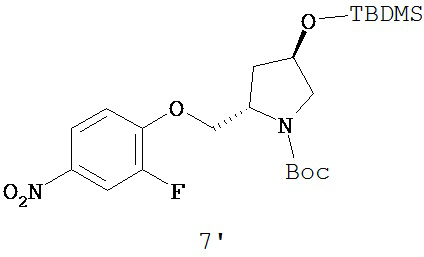
[001247] К раствору соединения 5’ (0,1 г, 0,3 ммоль) в ТГФ (6 мл) добавляли при перемешивании соединение 6’ (0,047 г, 0,3 ммоль), PPh3 (0,16 г, 0,64 ммоль) и Et3N (0,048 г, 0,48 ммоль) в атмосфере N2. Реакционную смесь охлаждали до 0°C и после этого добавляли к ней DIAD (0,094 г, 0,48 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали ее при этой температуре 1 час. Затем гасили реакционную смесь водой, экстрагировали этилацетатом (2×5 мл) и промывали объединенный этилацетатный экстракт водой и солевым раствором (по 5 мл каждого). Полученный остаток концентрировали при пониженном давлении и очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 9/1) с получением соединения 7’ (0,120 г 85%) в виде желтого твердого продукта.
[001248] Этап 6
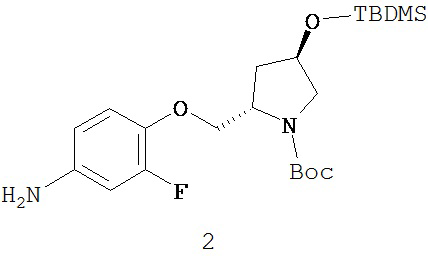
[001249] К раствору соединения 7’ (0,1 г, 0,21 ммоль) в метаноле (5 мл) добавляли Pd/C (0,010 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (под давлением) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® пластину и концентрировали при пониженном давлении с получением соединения 2 (0,085 г, 91%) в виде коричневатого вязкого масла. Его использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 245
[001250] Получение трет-бутил-2-(2-(4-(4-(3-акриламидофениламино)-5-фтор-пиримидин-2-иламино)-2-фторфенокси)этокси)этилкарбамата I-356
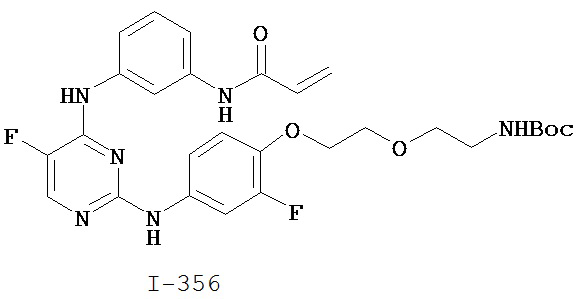
[001251] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
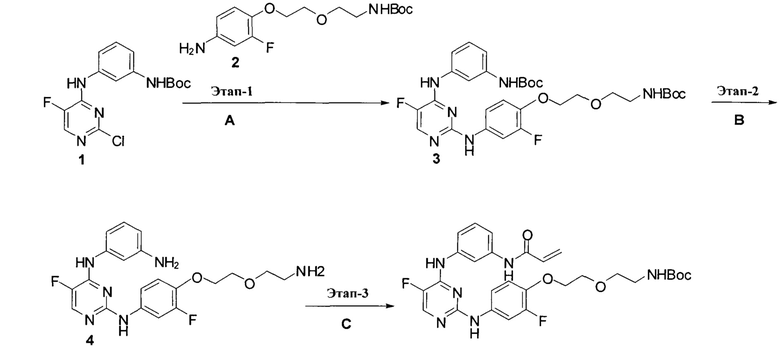
A) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 6 часов; B) TFA, CH2Cl2, комн. темп., 1 час; C) (Boc)2O, 30 минут, затем - акрилоилхлорид, K2CO3, NMP, 0°C, 90 минут.
[001252] Этап 1
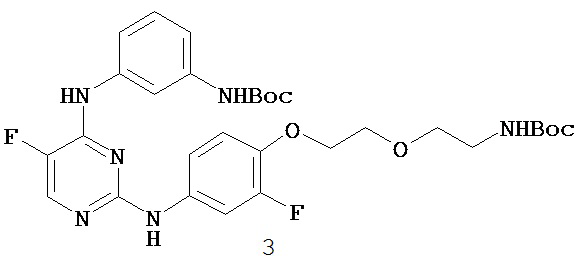
[001253] Раствор соединения 2 (0,050 г, 0,159 ммоль), соединения 1 (0,053 г, 0,159 ммоль), Pd(OAc)2 (0,0035 г, 0,01590 ммоль), BINAP (0,0049 г, 0,0079 ммоль) и Cs2CO3 (0,129 г, 0,3975 ммоль) в дегазированном толуоле (толуол продували N2 в течение 30 минут) грели в течение 16 часов при температуре 110°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл), промывали водой (10 мл), солевым раствором (10 мл) и сушили над Na2SO4. Фильтровали и концентрировали при пониженном давлении с получением остатка, который промывали гексаном с получением соединения 3 (0,049 г, 50%) в виде коричневого твердого продукта.
[001254] Этап 2
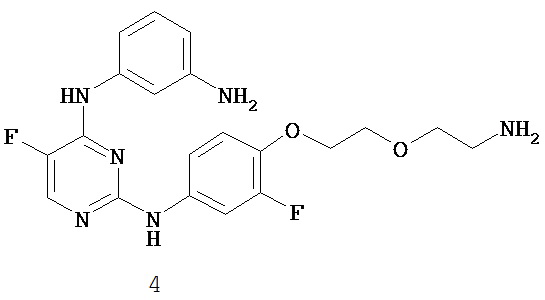
[001255] К раствору соединения 3 (0,047 г, 0,0762 ммоль) в сухом CH2Cl2 (3 мл) при температуре 0°C при перемешивании добавляли TFA (1,0 мл) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь оставляли до достижения комнатной температуры, после чего ее перемешивали при этой температуре в течение 1 часа. Затем концентрировали при пониженном давлении и гасили остаток раствором NaHCO3 (3 мл). Полученный ратствор экстрагировали этилацетатом (3×10 мл) и объединенный EtOAc экстракт промывали водой (10 мл), а затем 10% раствором лимонной кислоты (3×10 мл). Объединенный экстракт лимонной кислоты подщелачивали 10% раствором NaOH и экстрагировали EtOAc (3×25 мл). EtOAc экстракт промывали водой (20 мл), солевым раствором (10 мл) и сушили над Na2SO4 с получением соединения 4 (0,028 г, 88%) в виде светло-желтого твердого продукта.
[001256] Этап 3

[001257] К раствору соединения 4 (0,028 г, 0,06731 ммоль) в NMP (1,0 мл) при комнатной температуре при перемешивании добавляли (Boc)2O (0,016 г, 0, 07404 ммоль) и перемешивали реакционную смесь при комнатной температуре в течение 30 минут. Охлаждали реакционную смесь до температуры 0°C и добавляли к ней K2CO3 (0,051 г, 0,372 ммоль) и акрилоилхлорид (0,0067 г, 0,07404 ммоль) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь при перемешивании по каплям добавляли к холодному 10% раствору NaHCO3. После добавления раствор перемешивали в течение еще 30 минут при температуре 0°C, и отделяли выпавший осадок фильтрованием на воронке Бюхнера. Осадок промывали холодной водой, гексаном и растворяли в смеси метанол: дихлорметан (50:50, 5 мл) и концентрировали при пониженном давлении. Полученный осадок суспендировали в холодной воде (3 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом (2×5 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в названии соединения (0,016 г, 42%) в виде серого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,37 (s, 9H), 3,09 (d, J=5,5 Гц, 2H), 3,43 (d, J=5,84 Гц, 2H), 3,69 (s, 2H), 4,05 (s, 2H), 5,75 (d, J=11,12 Гц, 1H), 6,25 (d, J=16,76 Гц, 1H), 6,46 (dd, J=10,12 и 16,84 Гц, 1H), 6,81 (s, 1H), 6,96 (t, J=9,12 Гц, 1H), 7,24-7,31 (m, 2H), 7,43 (d, J=7,96 Гц, 1H), 7,49 (d, J=7,56 Гц, 1H), 7,68 (d, J=14 Гц, 1H), 7,94 (s, 1H), 8,11 (d, J=3,24 Гц, 1H), 9,21 (s, 1H), 9,46 (s, 1H), 10,15 (s, 1H); ЖХ/МС: m/e 571,1 (M+1).
[001258] Промежуточное соединение 2 получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
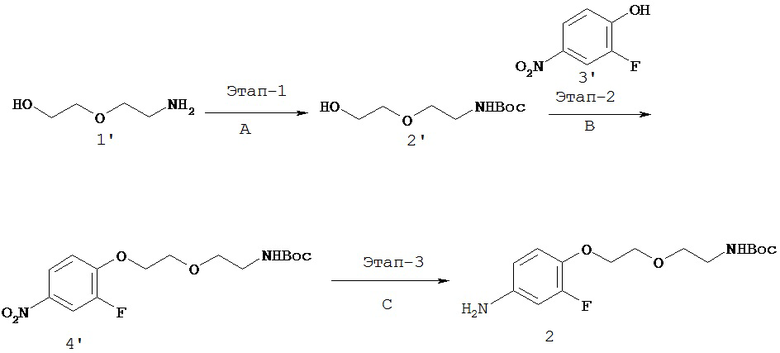
A) (Boc)2O, водн. NaOH, комн. темп., 16 часов; B) DIAD, PPh3, Et3H сухой ТГФ, комн. темп., 1 час; C) H2, Pd/C, этанол, комн. темп., 16 часов.
[001259] Этап 1
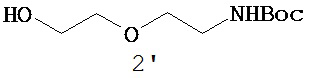
[001260] К раствору NaOH (0,76 г, 0,019 ммоль) в воде (9,6 мл) при комнатной температуре добавляли соединение Г (2,0 г, 19,022 ммоль) и полученную реакционную смесь перемешивали в течение 30 минут. Затем к ней по каплям в течение 5 минут добавляли раствор Boc-ангидрида (4,561 г, 20,92 ммоль) в ТГФ (12,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Концентрировали при пониженном давлении, разбавляли водой (20 мл) и экстрагировали EtOAc (4×50 мл). Объединенный EtOAc экстракт промывали водой (50 мл), солевым раствором (50 мл) и сушили над Na2SO4 с получением соединения 2’ (3,2 г, 82%) в виде вязкого масла.
[001261] Этап 2

[001262] К раствору соединения 2’ (0,38 г, 1,851 ммоль) в ТГФ (6 мл) добавляли при перемешивании соединение 3’ (0,29 г, 1,851 ммоль), PPh3 (0,534 г, 2,0361 ммоль) и Et3N (0,280 г, 2,776 ммоль) в атмосфере N2. Реакционную смесь охлаждали до 0°C и добавляли к ней DIAD (0,411 г, 2,0361 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре 1 час. Затем гасили ее водой, экстрагировали этилацетатом (3×5 мл) и промывали объединенный этилацетатный экстракт водой и солевым раствором (по 5 мл каждого). Остаток, полученный концентрированием при пониженном давлении, очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 9/1) с получением соединения 4’ (0,360 г, неочищенного) в виде желтого твердого продукта.
[001263] Этап 3
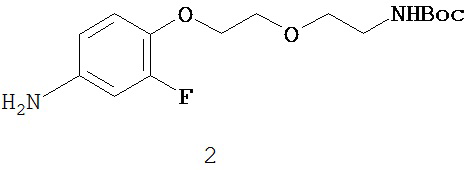
[001264] К раствору соединения 4’ (0,360 г, 1,0456 ммоль) в этаноле (10 мл) добавляли Pd/C (0,072 г, 20% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (давление водорода 1,5 кг) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 2 (0,28 г, 85%) в виде коричневатого вязкого масла. Его использовали на следующем этапе без дополнительной очистки.
ПРИМЕР 246
[001265] Получение N1-(2-(2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)-2-фторфенокси)этокси)этил)N5-(15-оксо-18-((3aR,4R,6aS)-оксогексагидро-1H-тиено[3,4-d]имидазол-4-ил)-4,7,10-триокса-14-азаоктадецил)глутарамид I-362
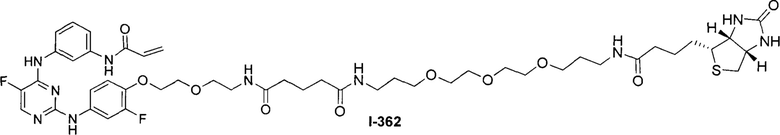
[001266] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 204, с использованием трет-бутил-2-(2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)-2-фторфенокси)-этокси)этилкарбамата (I-356, описано в Примере 245) вместо соединения 1-45 на Этапе 1. 1H-ЯМР (ДМСО-d6) δ ppm: 10,1 (s, 1H), 9,87 (s, 1H), 9,52 (s, 1H), 8,09 (d, J=4,1 Гц, 1H), 7,86 (s, 1H), 7,78 (t, J=5,5 Гц, 1H), 7,66 (m, 3H), 7,48 (dd, J=2,3 и 13,8 Гц, 1H), 7,33 (m, 2H), 7,21 (t, J=7,8 Гц, 1H), 7,11 (d, J=9,2 Гц, 1H), 6,90 (t, J=9,2 Гц, 1H), 6,34 (m, 2H), 6,14 (dd, J=2,3 и 17,0 Гц, 1H), 5,66 (dd, J=2,3 и 17,0 Гц, 1H), 4,20 (dd, J=5,0 и 7,3 Гц, 1H), 3,99 (m, 3H), 3,61 (m, 2H), 3,12 (q, J=6,0 Гц, 2H), 2,97 (m, 9H), 2,72 (m, 2H), 2,46 (m, 2H), 1,95 (m, 9H), 1,1-1,6 (m, 18H); ЖХ/МС: m/e 1013, (M+1).
ПРИМЕР 247
[001267] Получение N-(3-(5-фтор-2-(3-фтор-4-(2-(2-метоксиэтокси)этокси)-фенил-амино)пиримидин-4-иламино)фенил)акриламида I-359
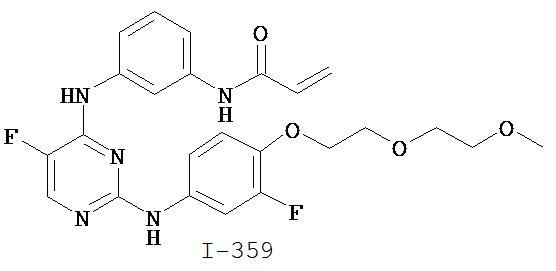
[001268] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
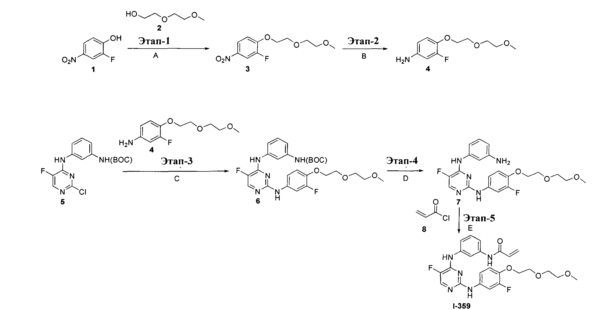
A) DIAD, PPh3, Et3N, сухой ТГФ, комн. темп., 1 час; B) H2, Pd/C, метанол, комн. темп., 16 часов; C) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 6 часов; D) TFA, ОДСЪ комн. темп., 1 час; E) (Boc)2O, 30 минут, затем - K2CO3, NMP, 0°C, 15 минут.
[001269] Этап 1
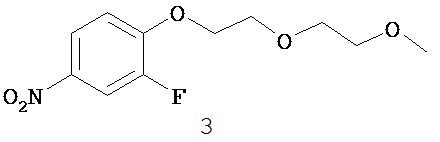
[001270] К раствору соединения 1 (0,5 г, 3,18 ммоль) в ТГФ (10 мл) добавляли при перемешивании соединение 2 (0,38 г, 3,18 ммоль), PPh3 (0,91 г, 3,498 ммоль) и Et3N (0,48 г, 4,776 ммоль) в атмосфере Nz. Реакционную смесь охлаждали до 0°C и добавляли к ней DIAD (0,707 г, 3,5 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре 1 час. Затем гасили ее водой, экстрагировали этилацетатом (3×5 мл) и промывали объединенный этилацетатный экстракт водой и солевым раствором (по 5 мл каждого). Остаток, полученный концентрированием при пониженном давлении, очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат, 7/3) с получением соединения 3 (0,61 г, 65%) в виде белого твердого продукта.
[001271] Этап 2
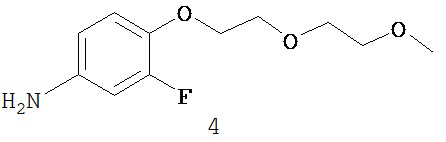
[001272] К раствору соединения 3 (0,6 г, 2,31 ммоль) в этаноле (20 мл) добавляли Pd/C (0,060 г, 10% (вес.)), после чего реакционную смесь оставляли при перемешивании в атмосфере H2 (под давлением) при комнатной температуре в течение 16 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении с получением соединения 4 (0,375 г, 70,7%) в виде коричневатого вязкого масла.
[001273] Этап 3
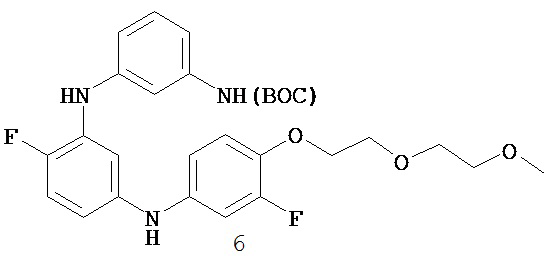
[001274] Раствор соединения 4 (0,275 г, 1,19 ммоль), соединения 5 (0,403 г, 1,19 ммоль), полученный согласно Примеру 20, Pd(OAc)2 (0,0026 г, 0,11 ммоль), BINAP (0,0037 г, 0,059 ммоль) и Cs2CO3 (0,969 г, 2,95 ммоль) в дегазированном толуоле (толуол продували N2 в течение 30 минут) грели в течение 16 часов при температуре 110°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл), промывали водой (10 мл), солевым раствором (10 мл) и сушили над Na2SO4. Фильтровали и затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 5/5) с получением соединения 6 (0,350 г, 55%) в виде желтого твердого продукта.
[001275] Этап 4
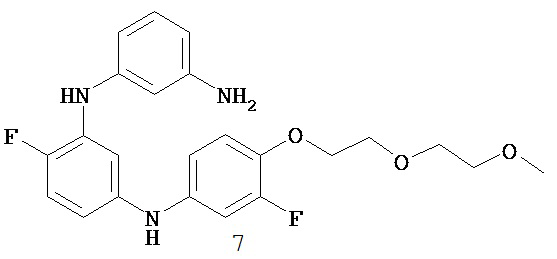
[001276] К раствору соединения 6 (0,3 г, 0,56 ммоль) в сухом CH2Cl2 (3 мл) при температуре 0°C при перемешивании добавляли TFA (1,0 мл) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре 1 час. Затем концентрировали при пониженном давлении, остаток гасили раствором NaHCO3 (3 мл) и экстрагировали EtOAc (3×25 мл). EtOAc экстракт промывали водой (20 мл), солевым раствором (10 мл) и сушили над Na2SO4 с получением соединения 7 (0,15 г, 62,5%) в виде коричневатой вязкой жидкости.
[001277] Этап 5
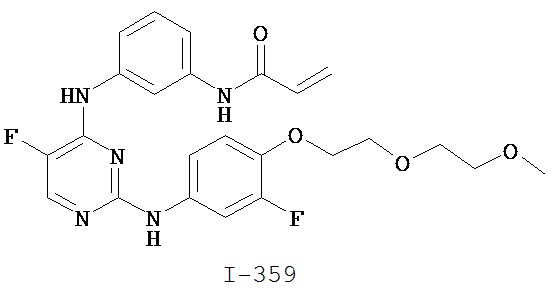
[001278] К охлажденному раствору соединения 7 (0,1 г, 0,23 ммоль) в NMP (1,0 мл) при температуре примерно 0°C добавляли K2CO3 (0,15 г, 1,1 ммоль), акрилоилхлорид (0,0022 г, 0,25 ммоль) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь при перемешивании по каплям добавляли к холодному 10% раствору NaHCO3. После добавления раствор перемешивали в течение еще 30 минут при температуре 0°C и отделяли выпавший осадок фильтрованием на воронке Бюхнера. Осадок промывали холодной водой, гексаном и растворяли в смеси метанол: дихлорметан (50:50, 25 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (3 мл), добавляли к нему Et3N и экстрагировали этилацетатом (2×5 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в названии соединения (0,055 г, 50%) в виде желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 3,24 (s, 3H), 3,44 (t, J=4,88 Гц, 2H), 3,57 (t, J=4,04 Гц, 2H), 3,69 (t, J=4,24 Гц, 2H), 4,04 (t, J=4,04 Гц, 2H), 5,73 (d, J=10,12 Гц, 1H), 6,23 (d, J=16,8 Гц, 1H), 6,45 (dd, J=10,12 и 16,92 Гц, 1H), 6,95 (t, J=9,4 Гц, 1H), 7,28-7,30 (m, 2H), 7,42 (d, J=8,04 Гц, 1H), 7,48 (d, J=7,48 Гц, 1H), 7,67 (d, J=14,36 Гц, 1Н), 7,93 (s, 1H), 8,10 (d, J=3,44 Гц, 1H), 9,20 (s, 1H), 9,44 (s, 1H), 10.14 (s, 1H); ЖХ/МС: m/e 486,1 (M+1).
ПРИМЕР 248
[001279] Получение (S)-N-(3-(2-(4-хлор-3-(1-гидроксипропан-2-илокси)фенил-амино)-5-фторпиримидин-4-иламино)фенил)акриламида I-357
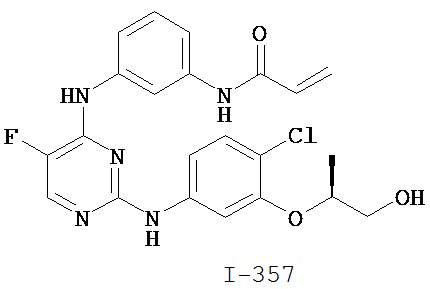
[001280] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
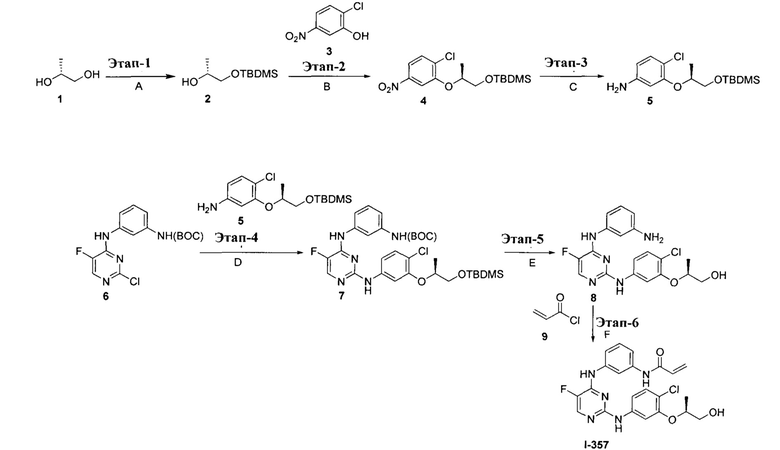
A) TBDMS-Cl, имидазол, CH2Cl2 0°C, 2 часа; В) DIAD, PPh3, Et3N сухой ТГФ, комн. темп., 1 час; C) H2, никель Ренея, МеОН, 2 часа; D) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 6 часов; E) TFA, CH2Cl2 комн. темп., 1 час; F) (Boc)2O, 30 минут, затем - K2CO3, NMP, 0°C, 15 минут.
[001281] Этап 1
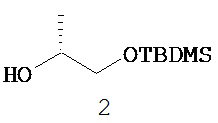
[001282] К раствору соединения 1 (1 г, 13,1 ммоль) в ДХМ при перемешивании при температуре 0°C добавляли имидазол (0,875 г, 13,1 ммоль) и трет-бутилдиметилсилилхлорид (TBDMS-Cl) (1,98 г, 13,1 ммоль). Выдерживали реакционную смесь при этой температуре в течение 2 часов, после чего реакционную смесь фильтровали и концентрировали. Остаток очищали методом колоночной хроматографии (нейтральный оксид алюминия, петролейный эфир/этилацетат: 7/3) с получением соединения 2 (1,4 г, 56%) в виде бесцветной жидкости.
[001283] Этап 2
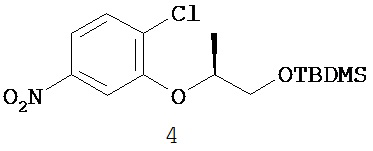
[001284] К раствору соединения 2 (1,5 г, 7,89 ммоль) в ТГФ (15 мл) добавляли при перемешивании соединение 3 (1,36 г, 7,89 ммоль), PPh3 (2,27 г, 8,6 ммоль) и Et3N (1,19 г, 11,1 ммоль) в атмосфере N2. Реакционную смесь охлаждали до 0°C и добавляли к ней DIAD (1,75 г, 8,6 ммоль). Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре 1 час. Затем гасили водой, экстрагировали этилацетатом (3×5 мл) и промывали объединенный этилацетатный экстракт водой и солевым раствором (по 5 мл каждого). Остаток, полученный после концентрирования при пониженном давлении, очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 7/3) с получением соединения 4 (2,1 g 76,9%) в виде желтого масла.
[001285] Этап 3
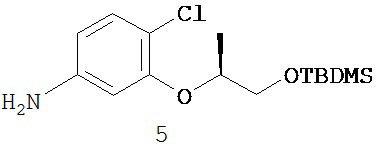
[001286] К раствору соединения 4 (2 г, 5,7 ммоль) в метаноле (20 мл) добавляли Никель Ренея (3 г). Реакционную смесь оставляли при перемешивании в атмосфере H2 (под давлением) при комнатной температуре в течение 2 часов. Реакционную смесь фильтровали через слой целита® и концентрировали при пониженном давлении, после чего остаток очищали методом колоночной хроматографии (нейтральный оксид алюминия, петролейный эфир/этилацетат: 8/2) с получением соединения 5 (1,4 г, 77%) в виде коричневатого вязкого масла.
[001287] Этап 4
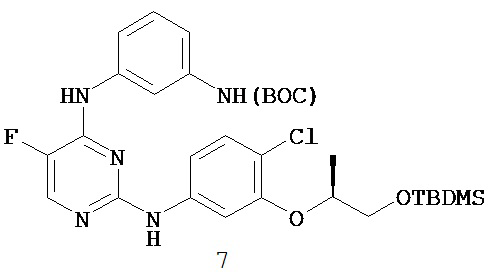
[001288] Раствор соединения 6 (0,2 г, 0,63 ммоль), полученный согласно Этапу 1 Примера 20, соединения 1 (0,213 г, 0,63 ммоль), Pd(OAc)2 (0,014 г, 0,063 ммоль), BINAP (0,0019 г, 0,031 ммоль) и Cs2CO3 (0,511 г, 1,5 ммоль) в дегазированном толуоле (толуол продували N2 в течение 30 минут) грели в течение 16 часов при температуре 110°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc (20 мл), промывали водой (10 мл), солевым раствором (10 мл) и сушили над Na2SO4. Фильтровали, и затем концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, 60-120 меш, петролейный эфир/этилацетат: 7/3) с получением соединения 7 (0,15 г, 38,4%) в виде желтого твердого продукта.
[001289] Этап 5
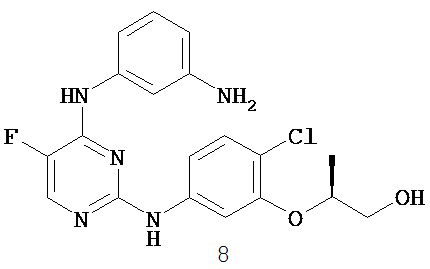
[001290] К раствору соединения 7 (0,15 г, 0,24 ммоль) в сухом CH2Cl2 (5 мл) при температуре 0°C при перемешивании добавляли TFA (1,5 мл) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь оставляли до достижения комнатной температуры, после чего перемешивали при этой температуре 1 час. Затем концентрировали при пониженном давлении, остаток гасили раствором NaHCO3 (3 мл) и экстрагировали EtOAc (3×25 мл). Объединенный EtOAc экстракт промывали водой (20 мл), солевым раствором (10 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 8 (0,085 г, 86,7%) в виде белого твердого продукта.
[001291] Этап 6
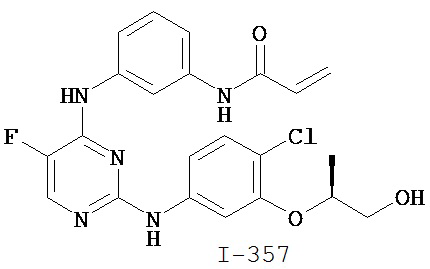
[001292] Раствор соединения 8 (0,085 г, 0,21 ммоль) в NMP (2,0 мл) охлаждали до температуры 0°C и добавляли к нему K2CO3 (0,29 г, 2,1 ммоль) и акрилоилхлорид (1 М раствор в ТГФ, 0,21 мл) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Реакционную смесь при перемешивании по каплям добавляли к холодному 10% раствору NaHCO3. После добавления раствор перемешивали при температуре 0°C в течение еще 30 минут и отделяли выпавший осадок фильтрованием на воронке Бюхнера. Осадок промывали холодной водой, гексаном и растворяли в смеси метанол:дихлорметан (50:50, 25 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (3 мл), добавляли к нему Et3N и экстрагировали этилацетатом (2×5 мл). Объединенный этилацетатный экстракт промывали водой (5 мл), солевым раствором (5 мл), сушили над Na2SO4 и концентрировали при пониженном давлении с получением указанного в названии соединения (65 мг, 67%) в виде желтого твердого продукта. 1H-ЯМР (ДМСО-d6) δ ppm: 1,18 (d, J=6,12 Гц, 3H), 3,40-3,47 (m, 1H), 3,50-3,56 (m, 1H), 4,20-4,30 (m, 1H), 4,82 (t, J=5,6 Гц, 1H), 5,75 (dd, J=1,88 и 10,08 Гц, 1H), 6,25 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 7,12 (d, J=8,76 Гц, 1H), 7,29 (t, J=8,08 Гц, 1H), 7,40-7,44 (m, 3H), 7,52 (d, J=8,44 Гц, 1H), 7,91 (s, 1H), 8,12 (d, J=3,64 Гц, 1H), 9,21 (s, 1H), 9.45 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 458,0 (M+1).
ПРИМЕР 249
[001293] Получение (R)-N-(3-(2-(4-хлор-3-(1-гидроксипропан-2-илокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-358
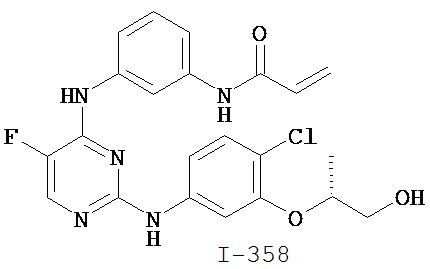
[001294] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 248, с использованием (R)-пропан-1,2-диола вместо соединения 1 на Этапе 1. 1H-ЯМР (ДМСО-d6) δ ppm: 1,18 (d, J=6,12 Гц, 3H), 3,40-3,47 (m, 1H), 3,50-3,56 (m, 1H), 4,20-4,30 (m, 1H), 4,82 (t, J=5,6 Гц, 1H), 5,75 (dd, J=1,88 и 10,08 Гц, 1H), 6,25 (dd, J=1,92 и 16,92 Гц, 1H), 6,45 (dd, J=10,08 и 16,92 Гц, 1H), 7,12 (d, J=8,76 Гц, 1H), 7,29 (t, J=8,08 Гц, 1H), 7,40-7,44 (m, 3H), 7,52 (d, J=8,44 Гц, 1H), 7,91 (s, 1H), 8,12 (d, J=3,64 Гц, 1H), 9,21 (s, 1H), 9,45 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 458,0 (M+1).
ПРИМЕР 250
[001295] Получение (E)-4-(диметиламино)-N-(3-(5-метил-4-(м-толиламино)-пиримидин-2-иламино)фенил)бут-2-енамида I-360
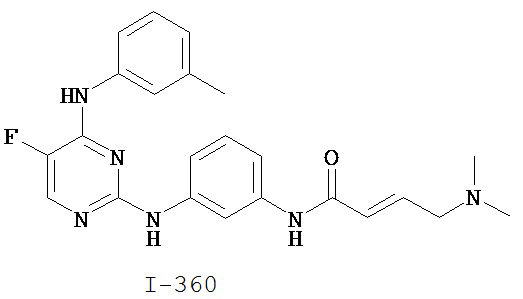
[001296] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 3, с использованием (E)-4-(диметиламино)бут-2-еноилхлорида вместо акрилоилхлорида на Этапе 3. 1H-ЯМР (ДМСО-d6) δ ppm: 7,91 (s, 1H), 7,85 (s, 1H), 7,52 (d, J=6,4 Гц, 1H), 7,45 (d, J=7,8 Гц, 1H), 7,34 (s, 1H), 7,31-7,26 (m, 1H), 7,21 (dd, J=8,2, 8,0 Гц, 1H), 7,01-6,92 (m, 4H); 6,27 (s, 1H), 6,06 (d, J=15,1 Гц, 1H), 3,14 (d, J=5,5 Гц, 2H), 2,37 (s, 3H), 2,31 (s, 6H), 2,13 (s, 3H); ЖХ/МС: m/z 417 (M+1).
ПРИМЕР 251
[001297] Получение N-(3-(2-(3,4-бис(2-метоксиэтокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-277
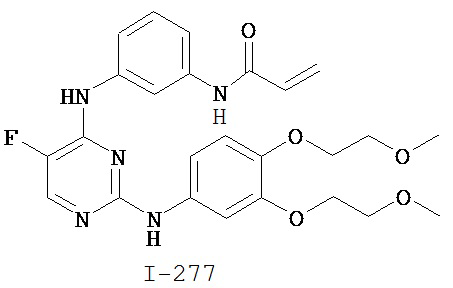
[001298] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
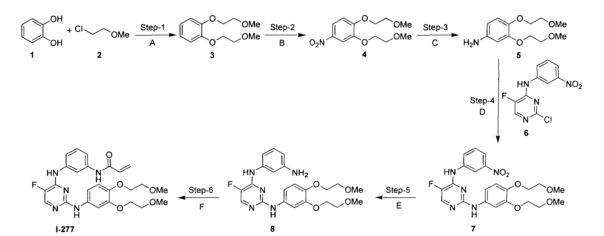
A) K2CO3, Cs2CO3, ДМФА, 90°C, 16 часов; В) HNO3, уксусная кислота, комн. темп., 1 час; C) Pd/C, метанол, комн. темп., 3 часа; D) уксусная кислота, этанол, 80°C, 16 часов; E) Pd/C, метанол, комн. темп., 16 часов; F) акрилоилхлорид, K2CO3, NMP, комн. темп., 30 минут.
[001299] Этап 1
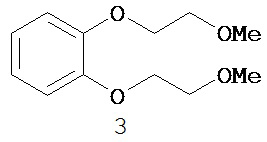
[001300] К раствору соединения 1 (5 г, 45,4 ммоль) в ДМФА (100 мл) при перемешивании добавляли K2CO3 (15,6 г, 112,9 ммоль), Cs2CO3 (36,6 г, 112,3 ммоль), затем соединение 2 (12,4 мл, 135,8 ммоль) и реакционную смесь грели в течение 16 часов при температуре 90°C. Затем реакционную смесь охлаждали, фильтровали и фильтрат концентрировали при пониженном давлении. Остаток разбавляли этилацетатом, промывали водой и солевым раствором и сушили над безводным Na2SO4, фильтровали и концентрировали с получением соединения 3 (9,9 г, 96%) в виде жидкости коричневого цвета.
[001301] Этап 2
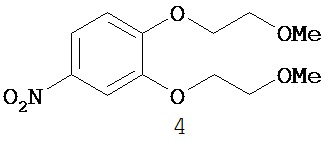
[001302] К раствору соединения 3 (2,5 г, 11 ммоль) в уксусной кислоте (50 мл) при перемешивании при температуре 0°C по каплям добавляли дымящую азотную кислоту (0,83 г, 13,2 ммоль) и перемешивали в течение 1 часа при комнатной температуре. Реакционную смесь выливали на измельченный лед, и выпавший осадок отфильтровывали и сушили в вакууме с получением соединения 4 (2,23 г, 74%) в виде желтого твердого продукта.
[001303] Этап 3
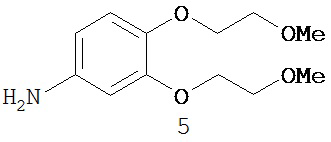
[001304] К раствору соединения 4 (1 г, 3,68 ммоль) в метаноле (20 мл) добавляли Pd/C (0,2 г, 20% (вес.)) в атмосфере N2. После чего реакционную смесь перемешивали в атмосфере H2 (под давлением) в течение 3 часов. Реакционную смесь фильтровали через слой целита и концентрировали фильтрат с получением соединения 5 (0,87 г, 98%) в виде коричневого масла.
[001305] Этап 4
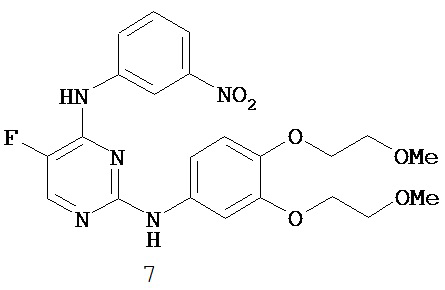
[001306] К раствору соединения 6 (0,45 г, 1,675 ммоль) в этаноле (4 мл) добавляли соединение 5 (0,4 г, 1,658 ммоль) и уксусную кислоту (0,2 мл) и грели реакционную смесь при 80°C в течение 16 часов. После чего концентрировали при пониженном давлении и очищали остаток методом колоночной хроматографии (SiO2, петролейный эфир/этилацетат: 6/4) с получением соединения 7 (0,13 г, 17%) в виде желтого твердого продукта.
[001307] Этап 5
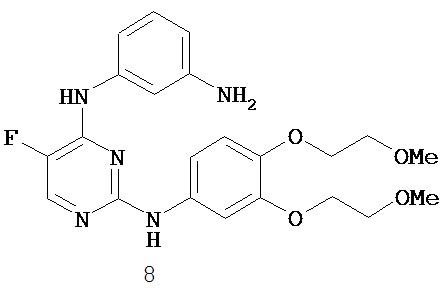
[001308] К раствору соединения 7 (0,13 г, 0,275 ммоль) в метаноле (3 мл) добавляли Pd/C (26 мг, 20% (вес.)) в атмосфере N3. После чего реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (под давлением) в течение 16 часов. Реакционную смесь фильтровали через слой целита и концентрировали фильтрат с получением соединения 8 (0,10 г, 82%) в виде зеленого твердого продукта.
[001309] Этап 6
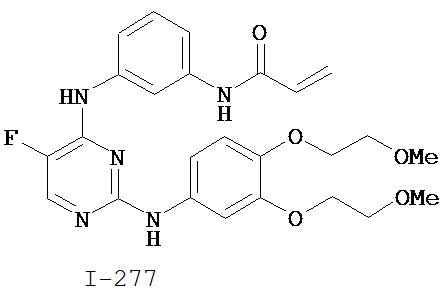
[001310] К охлажденному раствору соединения 8 (0,1 г, 0,225 ммоль) в NMP (1,0 мл) добавляли K2CO3 (0,15 г, 1,1 ммоль), акрилоилхлорид (0,002 г, 0,25 ммоль) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут. Затем реакционную смесь при перемешивании добавляли по каплям вкхолодному 10% раствору NaHCO3 (~5 мл) и перемешивали при температуре 0°C в течение 30 минут. Выпавший осадок отделяли фильтрованием на воронке Бюхнера. Осадок растворяли в смеси метанол: дихлорметан (1:1, 25 мл) и концентрировали при пониженном давлении. Полученный остаток суспендировали в холодной воде (3 мл), добавляли к нему Et3N и затем экстрагировали этилацетатом. Объединенный этилацетатный экстракт промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении с получением соединения 1-277 (0,049 г, 44%) в виде желтого твердого продукта. 1Н-ЯМР (ДМСО-d6) δ=: 3,28 (s, 3H), 3,29 (s, 3H), 3,56-3,60 (m, 4H), 3,88 (t, J=4,8 Гц, 2H), 3,98 (t, J=4,9 Гц, 2H), 5,74 (d, J=12,1 Гц, 1H), 6,24 (d, J=14 Гц, 1H), 6,45 (dd, J=16, 10 Гц, 1H), 6,75 (d, J=8,7 Гц, 1H), 7,21-7,27 (m, 3H), 7,41 (d, J=8 Гц, 1H), 7,52 (d, J=8 Гц, 1H), 7,89 (s, 1H), 8,07 (d, J=3,7 Гц, 1H), 8,95 (s, 1H), 9,38 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 498,2 (M+1).
ПРИМЕР 252
[001311] Получение трет-бутил-2-(2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)фенокси)этокси)этилкарбамата I-370
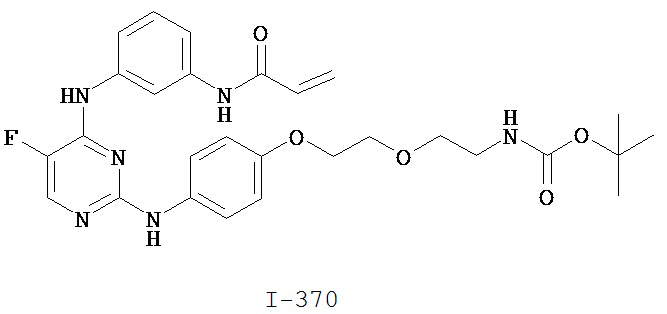
[001312] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 245, с использованием трет-бутил-2-(2-(4-аминофенокси)этокси)этилкарбамата вместо соединения 2 на Этапе 1. 1Н-ЯМР (ДМСО-d6) δ=: 1,37 (s, 9H), 3,09 (m, 2H), 3,43 (t, J=6,0 Гц, 2H), 3,68 (d, J=4,3 Гц, 2H), 3,98 (t, J=4,3 Гц, 2H), 5,75 (d, J=11,4 Гц, 1H), 6,25 (d, J=15,6 Гц, 1H), 6,45 (dd, J=16,9, 10 Гц, 1H), 6,73-6,81 (m, 3H), 7,27 (t, J=8,1 Гц, 1H), 7,40 (d, J=7,9 Гц, 1H), 7,47-7,53 (m, 3H), 7,92 (s, 1H), 8,06 (d, J=3,6 Гц, 1H), 8,96 (s, 1H), 9,36 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 553,2 (M+1).
ПРИМЕР 253
[001313] Получение N1-(2-(2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)фенокси)этокси)этил)-N5-(15-оксо-19-((3aS,4S,6aR)-2-оксогексагидро-1H-тиено[3,4-d]имидазол-4-ил)-4,7,10-триокса-14-азанонадецил)глутарамида I-363
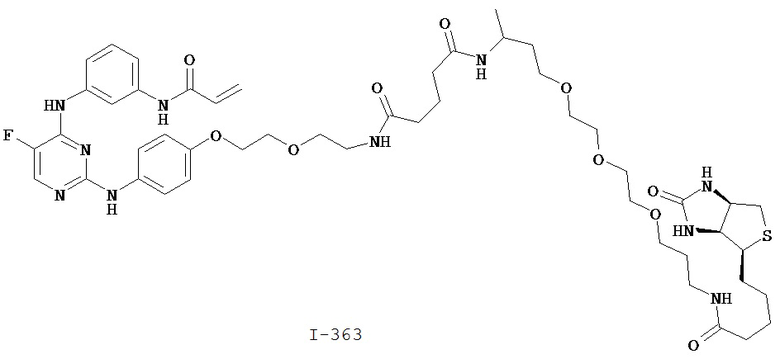
[001314] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 204, с использованием трет-бутил-2-(2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)фенокси)этокси)этил-карбамата (I-370, описанное в Примере 252) вместо соединения I-45 на Этапе 1. ЖХ/МС (RT=2,045/(M+H)) 995,4.
ПРИМЕР 254
[001315] Получение (R)-N-(3-(5-фтор-2-(3-фтор-4-(1-гидроксипропан-2-илокси)-фениламино)пиримидин-4-иламино)фенил)акриламида I-372
[001316] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (R)-2-(4-амино-2-фторфенокси)пропан-1-ола вместо соединения 4 на Этапе 2. 1H-ЯМР (ДМСО-d6) δ=:1,17 (в, J=6,2 Гц, 3H), 3,40-3,46 (m, 1H), 3,50-3,56 (m, 1H), 4,22 (q, J=5,9 Гц, 1H), 4,83 (t, J=5,8 Гц, 1H), 5,75 (dd, J=10,1, 1,9 Гц, 1H), 6,25 (dd, J=16,9, 1,9 Гц, 1H), 6,46 (dd, J=16,9, 10,1 Гц, 1H), 6,98 (t, J=9,4 Гц, 1H), 7,24-7,31 (m, 2H), 7,42 (d, J=8,2 Hz, 1H), 7,49 (d, J=7,9 Hz, 1H), 7,68 (dd, J=14,3, 2,4 Hz, 1H), 7,93 (s, 1H), 8,11 (d, J=3,7 Hz, 1H), 9,20 (s, 1H), 9,45 (s, 1H), 10,14 (s, 1H); ЖХ/МС: m/e 442,2 (M+1).
ПРИМЕР 255
[001317] Получение (S)-N-(3-(5-фтор-2-(3-фтор-4-(1-гидроксипропан-2-илокси)-фениламино)пиримидин-4-иламино)фенил)акриламида I-373
[001318] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 20, с использованием (S)-2-(4-амино-2-фторфенокси)пропан-1-ола вместо соединения 4 на Этапе 2. ЖХ/МС (RT=3,316/(M+H)) 442,0.
ПРИМЕР 256
[001319] Получение (S)-((R)-2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)-2-фторфенокси)пропил)-2-амино-3-метилбутаноата I-374
[001320] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
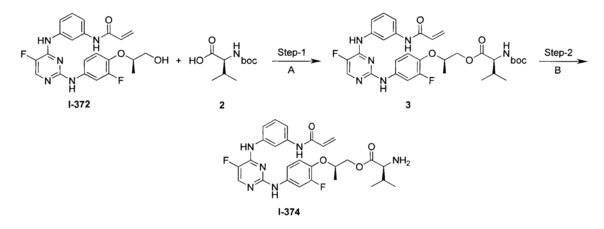
A) EDC.HCl, HOBT, DMAP, NMM, ДМФА, комн. темп., 16 ч; B) HCl (1 М раствор в диэтиловом эфире), 0°C, 1 ч.
[001321] Этап 1
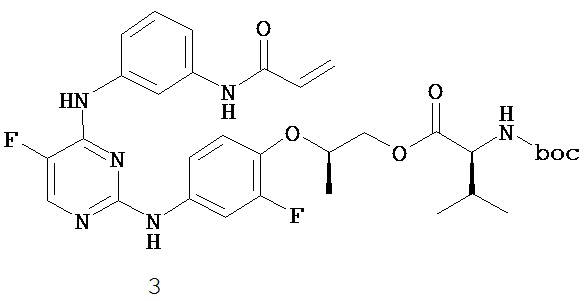
[001322] К раствору соединения I-372 (0,08 г, 0,18 ммоль) в ДМФА (0,8 мл) добавляли при перемешивании соединение 2 (0,057 г, 0,26 ммоль), EDC.HCl (0,086 г, 0,45 ммоль), HOBT (0,06 г, 0,44 ммоль), 4-DMAP (0,008) и NMM (0,036 г, 0,45 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 16 часов. Затем реакционную смесь гасили водой и экстрагировали этилацетатом. Этилацетатный слой промывали водой и солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Полученный остаток очищали методом колоночной хроматографии (SiO2, хлороформ/метанол: 9/1) с получением соединения 3 (0,06 г, 51,7%) в виде беловатого твердого продукта.
[001323] Этап 2
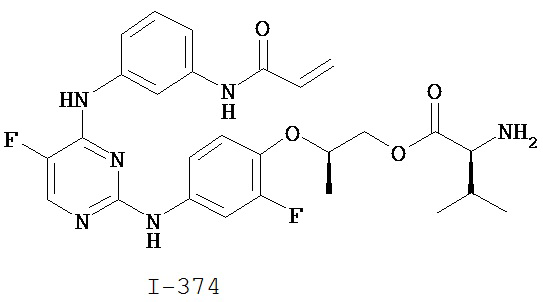
[001324] Охлажденный раствор HCl в диэтиловом эфире (1 М, 6 мл) добавляли к соединению 3 (60 мг, 0,09 ммоль) и реакционную смесь перемешивали при 0°C в течение 45 минут. После этого реакционную смесь концентрировали и полученный твердый остаток промывали диэтиловым эфиром и сушили с получением соединения 1-374 (в виде его HCl-соли) в виде желтого твердого продукта (20 мг). 1H-ЯМР (ДМСО-d6) δ=:0,77 (d, J=6,8 Hz, 3H), 0,83 (d, J=6,8 Hz, 3H), 1,23 (d, J=6,3 Hz, 3H), 1,75-1,83 (m, 1H), 3,10 (d, J=5,2 Hz, 1H), 4,05-4,11 (m, 1H), 4,22 (dd, J=11,7, 3,3 Hz, 1H), 4,40-4,50 (m, 1H), 5,73 (d, J=10,2 Hz, 1H), 6,23 (d, J=17,1 Hz, 1H), 6,44 (dd, J=17, 10,2 Hz, 1H), 6,98 (t, J=9,2 Hz, 1H), 7,24-7,29 (m, 2H), 7,41 (d, J=7,8 Hz, 1H), 7,48 (d, J=7,8 Hz, 1H), 7,68 (d, J=14,3 Hz, 1H), 7,91 (s, 1H), 8,10 (d, J=3,5 Hz, 1H), 9,23 (s, 1H), 9,44 (s, 1H), 10,13 (s, 1H); ЖХ/МС: m/e 541,2 (M+1).
ПРИМЕР 257
[001325] Получение (S)-((5)-2-(4-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)-2-фторфенокси)пропил)-2-амино-3-метилбутаноата I-377
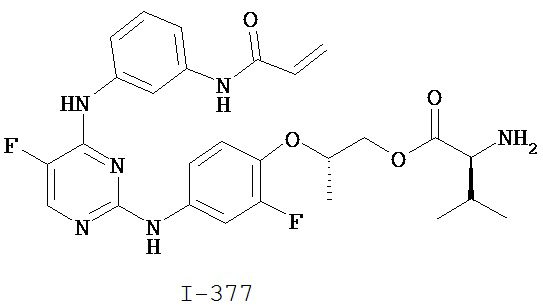
[001326] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 256, с использованием (S)-N-(3-(5-фтор-2-(3-фтор-4-(1-гидроксипропан-2-илокси)фениламино)пиримидин-4-иламино)-фенил)акриламида (I-373, описанное в Примере 255) вместо соединения I-372 на Этапе 1. ЖХ/МС (RT=3,227/(M+H)) 542,2.
ПРИМЕР 258
[001327] Получение (S)-((S)-2-(5-(4-(3-акриламидофениламино)-5-фторпиримидин-2-иламино)-2-хлорфенокси)пропил)-2-амино-3-метилбутаноата I-369
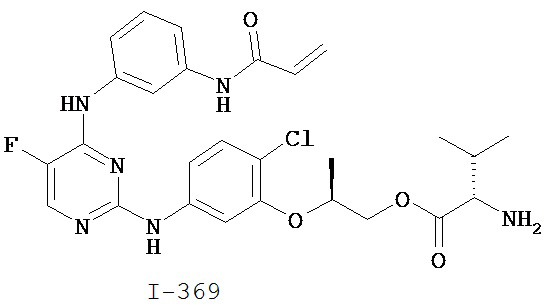
[001328] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 256, с использованием (S)-N-(3-(2-(4-хлор-3-(1-гидроксипропан-2-илокси)фениламино)-5-фторпиримидин-4-иламино)-фенил)акриламида (1-357, описанное в Примере 248) вместо соединения 1-372 на Этапе 1. ЖХ/МС (RT=3,54/(M+H)) 557,2.
ПРИМЕР 259
[001329] Получение N-(3-(2-(4-(2-(2-азидоэтокси)этокси)фениламино)-5-фтор-пиримидин-4-иламино)фенил)акриламида I-371
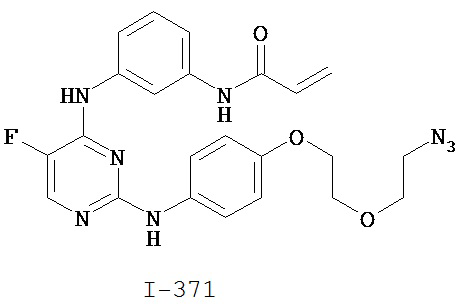
[001330] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных ниже.
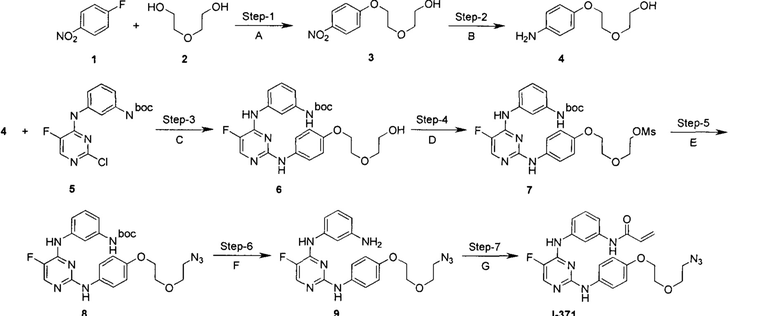
A) K2CO3, ДМСО, комн. темп., 16 ч; B) Pd/C, этанол, 16 ч; C) Pd(OAc)2, BINAP, Cs2CO3, толуол, 110°C, 16 ч; D) мезилхлорид, Et3N, CH2Cl2, комн. темп., 1 ч; Е) азид натрия, ДМФА, 70°C, 4 ч; F) TFA, CH2Cl2, 0°C - комн. темп., 1,5 ч; G) акрилоилхлорид, NMP, K2CO3, 30 мин.
[001331] Этап 1
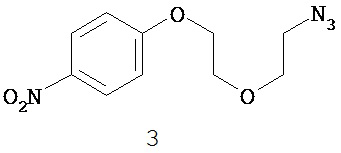
[001332] К раствору соединения 1 (1 г, 7,09 ммоль) в диметилсульфоксиде (ДМСО) (20 мл) добавляли при перемешивании K2CO3 (0,96 г, 6,95 ммоль) и перемешивали при комнатной температуре в течение 15 минут. Затем добавляли соединение 2 (3,7 г, 34,86 ммоль) и продолжали перемешивать при комнатной температуре в течение 16 часов. Реакционную смесь выливали в ледяную воду и экстрагировали этилацетатом. Органический слой промывали водой и солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали с получением соединения 3 в виде желтого твердого продукта (1,0 г, 62%).
[001333] Этап 2
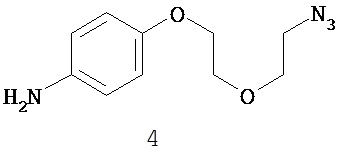
[001334] К раствору соединения 3 (1,0 г, 4,4 ммоль) в этаноле добавляли Pd/C (0,1 г, 10% (вес.)) в атмосфере N2 и затем реакционную смесь перемешивали в атмосфере H2 (под давлением) в течение 16 часов. После этого реакционную смесь фильтровали и концентрировали фильтрат с получением соединения 4 в виде коричневой вязкой жидкости (0,8 г, 92,2%).
[001335] Этап 3
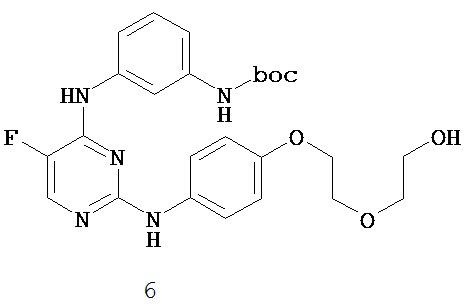
[001336] Смесь соединения 4 (0,3 г, 1,52 ммоль), соединения 5 (0,61 г, 1,8 ммоль), Pd(OAc)2 (0,017 г, 0,076 ммоль), BINAP (0,066 г, 0,106 ммоль) и Cs2CO3 (1,23 г, 3,78 ммоль) в дегазированном толуоле (20 мл) (толуол продували N2 в течение 30 минут) грели в течение 16 часов при температуре 110°C в атмосфере N2. Реакционную смесь охлаждали, разбавляли EtOAc, промывали водой и солевым раствором и сушили над Na2SO4. Фильтровали и концентрировали при пониженном давлении с получением остатка, который затем очищали методом колоночной хроматографии (SiO2, петролейный эфир/этилацетат: 6/4) с получением соединения 6 (0,3 г, 39,5%) в виде коричневого твердого продукта.
[001337] Этап 4
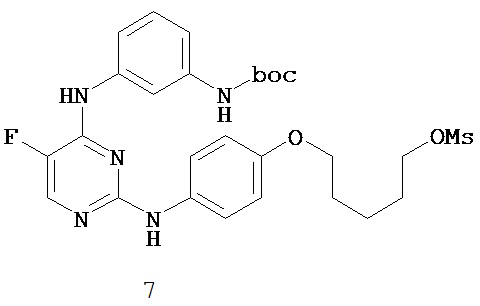
[001338] К раствору соединения 6 (0,35 г, 0,7 ммоль) и триэтиламина (0,2 мл, 1,4 ммоль) в дихлорметане (10 мл) при 0°C при перемешивании добавляли мезилхлорид (0,12 г, 1,05 ммоль) и после этого реакционную смесь перемешивали при комнатной температуре в течение 1 часа. Реакцию гасили водой, органический слой отделяли, сушили над безводным Na2SO4 и концентрировали с получением 7 в виде бесцветного масла (0,4 г, неочищенный).
[001339] Этап 5
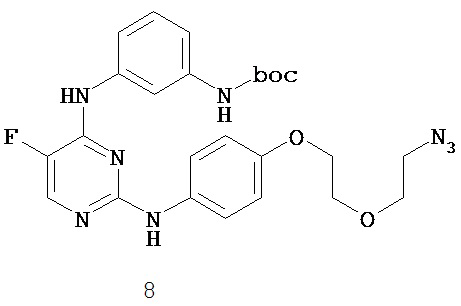
[001340] К раствору соединения 7 (0,4 г, 0,69 ммоль) в ДМФА (5 мл) добавляли при перемешивании азид натрия (0,054 г, 0,83 ммоль) и реакционную смесь грели при 70°C в течение 4 часов. Затем смесь обрабатывали ледяной водой и экстрагировали этилацетатом. Этилацетатный слой промывали водой и солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали с получением соединения 8 в виде вязкого масла (0,3 г, 82,6%).
[001341] Этап 6
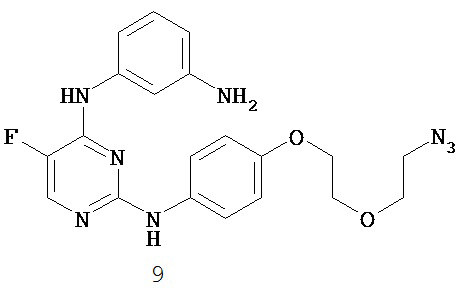
[001342] К раствору соединения 3 (0,3 г, 0,57 ммоль) в сухом CH2Cl2 (10 мл) при температуре 10°C при перемешивании добавляли TFA (1,0 мл) и реакционную смесь перемешивали при температуре 0°C в течение 30 минут и затем при комнатной температуре в течение 1 часа. Смесь концентрировали при пониженном давлении и полученный остаток обрабатывали раствором NaHCO3 и экстрагировали этилацетатом. Объединенный EtOAc экстракт промывали водой. Затем экстрагировали 10% раствором лимонной кислоты. Объединенный экстракт лимонной кислоты подщелачивали 10% раствором NaOH и экстрагировали EtOAc. EtOAc экстракт промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали с получением соединения 9 (0,17 г, 70%) в виде коричневого твердого продукта.
[001343] Этап 7

[001344] К раствору соединения 9 (0,075 г, 0,177 ммоль) в NMP (1,5 мл) при перемешивании при 0°C добавляли K2CO3 (0,05 г, 0,36 ммоль), а затем акрилоилхлорид (0,017 г, 0,188 ммоль) и реакционную смесь перемешивали при 0°C в течение 30 минут. Затем реакционную смесь при перемешивании по каплям добавляли к охлажденному 10% раствору МаНСОз. После окончания добавления раствор перемешивали в течение еще 30 минут при 0°C, и выпавший осадок отделяли фильтрованием на воронке Бюхнера. Осадок промывали холодной водой, гексаном и растворяли в смеси метанол:дихлорметан (1:1, 5 мл) и затем концентрировали при пониженном давлении. Полученный осадок суспендировали в холодной воде (3 мл) и Et3N (~1 мл), перемешивали и затем экстрагировали этилацетатом. Объединенный этилацетатный экстракт промывали водой и солевым раствором, сушили над Na2SO4 и концентрировали при пониженном давлении. Полученный остаток дважды очищали методом колоночной хроматографии (SiO2, петролейный эфир/этилацетат: 1/1) с получением соединения 1-371 (0,04 г, 47,3%) в виде белого твердого продукта. 1H-ЯМР (ДМСО-d6) δ=3,42 (t, J=4,9 Hz, 1H), 3,66 (t, J=4,9 Hz, 1H), 3,72-3,77 (m, 4H), 4,00 (t, J=4,6 Hz, 2H), 5,75 (dd, J=10,1, 1,8 Hz, 1H), 6,25 (dd, J=17, 1,9 Hz, 1H), 6,45 (dd, J=16,9, 10,1 Hz, 1H), 6,75 (d, J=9 Hz, 2H), 7,27 (t, J=8,1 Hz, 1H), 7,40 (d, J=8 Hz, 1H), 7,47-7,53 (m, 3H), 7,92 (s, 1H), 8,06 (d,.7=3,7 Hz, 1H), 8,97 (s, 1H), 9,37 (s, 1H), 10,12 (s, 1H); ЖХ/МС: m/e 479,2 (M+1).
ПРИМЕР 260
[001345] Получение N-(3-(2-(4-(2-азидоэтокси)фениламино)-5-фторпиримидин-4-ил-амино)фенил)акриламида I-376
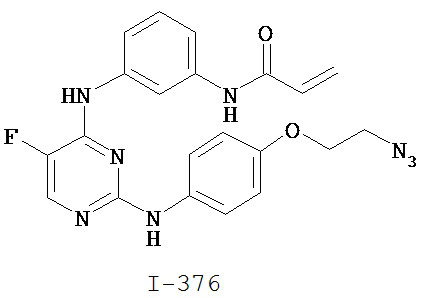
[001346] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 259, с использованием 2-(4-аминофенокси)этанола вместо соединения 4 на Этапе 3. ЖХ/МС (RT=3,447/(M+H)) 435,2.
ПРИМЕР 261
[001347] Получение N-(3-(2-(4-(2-(2-(2-азидоэтокси)этокси)этокси)фениламино)-5-фторпиримидин-4-иламино)фенил)акриламида I-379.
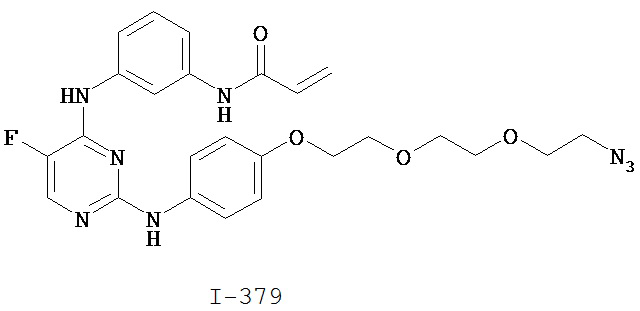
[001348] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 259, с использованием 2,2’-(этан-1,2-диилбис(окси))диэтанола вместо соединения 2 на Этапе 1. ЖХ/МС (RT=4,454/(M+H)) 475,6.
ПРИМЕР 262
[001349] Получение (E)-N-(3-(2-(4-хлор-3-(2-метоксиэтокси)фениламино)-5-фторпиримидин-4-иламино)фенил)бут-2-енамида I-375

[001350] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 238, с использованием (E)-бут-2-еноилхлорида вместо соединения 7 на Этапе 4. ЖХ/МС (RT=4,026/(M+H)) 473,2.
ПРИМЕР 263
[001351] Получение N-(3-(5-фтор-4-(4-(2-метоксиэтокси)фениламино)пиримидин-2-иламино)фенил)акриламида I-381
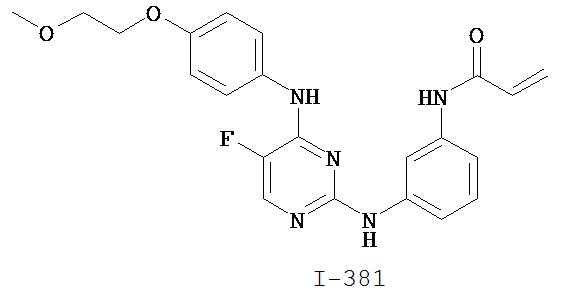
[001352] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием 4-(2-метоксиэтокси)анилина вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,275/(M+H)) 424,1.
ПРИМЕР 264
[001353] Получение N-(3-(5-фтор-4-(3-(2-морфолиноэтокси)фениламино)пиримидин-2-иламино)фенил)акриламида I-382
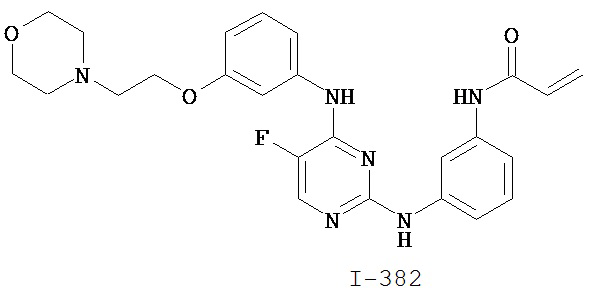
[001354] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием 3-(2-морфолиноэтокси)анилина вместо соединения 2 на Этапе 1. ЖХ/МС (RT=2,108/(M+H)) 479,2.
ПРИМЕР 265
[001355] Получение (S)-N-(3-(5-фтор-4-(4-тетрагидрофуран-3-илокси)фениламино)-пиримидин-2-иламино)фенил)акриламида I-338
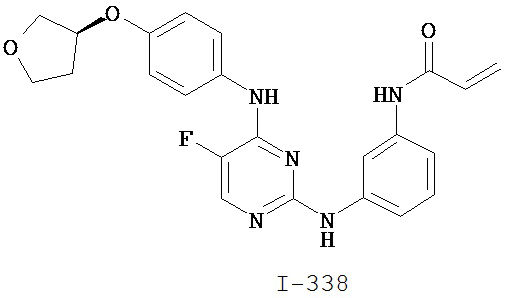
[001356] Указанное в названии соединение получали с использованием схем, этапов и промежуточных соединений, описанных в Примере 4, с использованием (S)-4-(тетрагидрофуран-3-илокси)анилина вместо соединения 2 на Этапе 1. ЖХ/МС (RT=1,71/(M+H))458,1.
Примеры биологических исследований
[001357] Ниже описаны тесты, использованные для измерения биологической активности предложенных соединений в качестве ингибиторов BTK, TEC, ITK, BMX, ErbB1 (EGFR), ErbB2, ErbB4 и JAK3.
ПРИМЕР 266
Общая методика анализа активности в отношении ВТК
[001358] Ниже приведена методика анализа с использованием EGFR-WT и EGFR-T790M/L858R, а далее - в условиях с оптимизацией реагентов для ВТК. [001359] Принцип действия основ метода анализа лучше всего описан на веб-сайте производителя (Invitrogen, Карлсбад, Калифорния, США): URL: http://www.invitrogen.com/content.cfin?pageid=11338 или http://www.invitrogen.com/site/us/en/home/Products-and-Services/Applications/Drug-Discovery/Target-and-Lead-Identification-and-Validation/KinaseBiology/KB-Misc/Biochemical-Assays/Omnia-Kinase-Assays.html.
[001360] Краткое изложение методики: готовили 10Х исходные растворы из EGFR-WT (PV3872) (Invitrogen) и EGFR-T790M/L858R (40350) (BPS Bioscience, Сан-Диего, Калифорния), 1.13X ATP (AS001A), и растворы соответствующих пептидных субстратов, конъюгированных с Tyr-Sox (KCZ1001), готовили в IX буфере для реакций с киназами, состоящем из 20 мМ Tris, pH 7,5, 5 мМ MgCl2, 1 мМ этиленгликольтетрауксусной кислоты (EGTA), 5 мМ β-глицерофосфата, 5% глицерина (10X исходный раствор, KB002A) и 0,2 мМ дитиотреитола (DTT) (DS001A). 5 мкл каждого фермента инкубировали в 384-луночном белом микротитровальном планшете с несвязывающей поверхностью Coming (#3574) (Coming, NY) в течение 30 мин. при 27°C с 0,5 мкл 50% ДМСО и последовательными разбавлениями соединений в 50% ДМСО. Реакции с киназами инициировали путем добавления 45 мкл смеси АТФ/Tyr-Sox-пептидного субстрата и каждые 30-90 секунд в течение 60 минут измеряли флуоресценцию при λex360/λem485 в планшетном ридере Synergy4 производства BioTek (Винуски, Вермонт, США). После каждого теста по кривым, полученным для каждой лунки, изучали линейную кинетику реакции и проводили статистическую обработку данных (R, 95% доверительный интервал, абсолютная сумма квадратов). Начальную скорость (от 0 минут до ~30 минут) для каждой реакционной смеси определяли по углу наклона графика относительных единиц флуоресценции от времени (минуты) и затем строили график зависимости начальной скорости от концентрации ингибитора, по которому оценивали IC50 из зависимости log [Ингибитора] от отклика флуоресценции, модель Variable Slope (переменный угол наклона) в программе GraphPad Prism от GraphPad Software (Сан-Диего, Калифорния, США).
[001361] Условия с оптимизацией реагентов для модифицированной ВТК приведены ниже:
[BTK]=5 нМ, [АТФ]=40 мМ, [Y5-Sox]=10 мМ (АТФ KMapp ~ 36 мМ).
ПРИМЕР 267
[001362] В Таблице 6 показана активность некоторых соединений согласно настоящему изобретению в тесте на ингибирование ВТК. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50≤10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50≤10000 нМ.
Таблица 6 (см. в конце описания)
ПРИМЕР 268
Тест ВТК с клетками Ramos
[001363] Соединения I-2, I-4 и I-7 тестировали на человеческих клетках лимфомы Беркитта Ramos. Клетки Ramos выращивали в суспензии во флаконах Т225, центрифугировали, ресуспендировали в 50 мл бессывороточной среды и инкубировали в течение 1 часа. Соединения добавляли к клеткам Ramos в бессывороточной среде до конечной концентрации 1, 0,1, 0,01, или 0,001 мкМ. Клетки Ramos инкубировали с соединением в течение 1 часа, промывали еще раз и ресуспендировали в 100 мкл бессывороточной среды. Затем клетки стимулировали 1 мкг F(ab’)2 козы к IgM человека и инкубировали на льду в течение 10 минут, чтобы активировать рецепторные сигнальные пути В-клеток. Через 10 минут клетки однократно промывали фосфатно-солевым буфером (PBS) и затем лизировали на льду буфером для экстракции клеток (Cell Extraction buffer) производства Invitrogen. 16 мкг общего белка из лизатов загружали на гель и полученные блоты тестировали на фосфорилирование субстрата BTK - PLCy2. Дозозависимое ингибирование передачи сигнала BTK в клетках Ramos представлено на Фигурах 1, 2, 3, 4 и 5.
[001364] В Таблице 7 показана активность примеров соединений согласно настоящему изобретению в тесте на ингибирование ВТК в клетках Ramos. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50 5:10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50 rt 10000 нМ.
Таблица 7 (см. в конце описания)
ПРИМЕР 269
Эксперимент с промывкой на клетках Ramos
[001365] Клетки Ramos выдерживали без сыворотки в течение одного часа в среде RPMI + 1% глутамина при 37°C. После этого клетки Ramos обрабатывали 100 нМ раствором соединения, разбавленного в бессывороточной среде RPMI, в течение 1 часа. После обработки соединением среду удаляли и клетки промывали средой, не содержащей указанное соединение. Затем клетки Ramos промывали каждые 2 часа и ресуспендировали в свежей среде, не содержащей указанное соединение. Клетки отбирали в определенные моменты времени с использованием 1 мкг антител к IgM человека (Southern Biotech кат. №2022-01) в течение 10 минут на льду, чтобы стимулировать передачу сигнала с участием BCR, а затем промывали PBS. Затем клетки Ramos лизировали в буфере Cell Extraction Buffer (Invitrogen FNN0011) с добавкой полного ингибитора протеаз (в таблетках) (Roche 11697498001) и ингибитора фосфатаз (Roche 04 906 837 001), и загружали по 18 мкг общего белкового лизата на каждую дорожку. Ингибирование активности киназы ВТК определяли путем измерения фосфорилирования ее субстрата (PLCy2) методом вестерн-блоттинга с использованием фосфо-специфичных антител производства Cell Signaling Technologies (кат. - Nb 3871). Результаты этого эксперимента с соединениями I-2,I-4 и I-7 представлены на Фигурах 1, 2 и 3.
[001366] В Таблице 8 приведены результаты теста с промывкой на клетках Ramos для отобранных соединений.
ПРИМЕР 270
Масс-спектрометрическое исследование для ВТК
[001367] Интактную ВТК инкубировали в течение 1 часа при 10-кратном избытке соединения I-7 по отношению к белку. Аликвоты (2 мкл) образцов разбавляли 10 мкл 0,1% раствора TFA, а затем наносили при помощи наконечников micro C4 ZipTip непосредственно на мишень MALDI с использованием синапиновой кислоты в качестве десорбирующей матрицы (10 мг/мл в 0,1% смеси ТРА:ацетонитрил 20:80). См. Фиг.15. На верхнем рисунке показан масс-спектр интактного белка ВТК (m/z 81,032 Да). На нижнем рисунке показан масс-спектр в случае, когда ВТК инкубировали с соединением I-7 (Mw=345,4). Центр масс (m/z=81,403 Да) демонстрирует положительный сдвиг около 371,1 Да, что указывает на полную модификацию ВТК под действием соединения I-7. Другие соединения, которые полностью модифицируют BTK, включают I-96, I-71, I-149, I-161, I-163, I-182, I-195, I-207, I-219 и I-244.
ПРИМЕР 271
Тест на пролиферацию первичных B-клеток человека
[001368] Наивные В-клетки человека выделяли из 100 мл цельной крови с использованием набора для очистки MACS, предназначенного для выделения CD19+, IgD+ клеток путем отрицательного отбора. Очищенные наивные B-клетки ресуспендировали в полной среде RPMI и стимулировали 5 мкг/мл α-IgM в течение 72 часов. 3H-Тимидин добавляли в культуральную среду в течение последних 16 часов, клетки собирали и измеряли включение 3H. Ингибирование пролиферации В-клеток коррелирует с ингибированием фосфорилирования субстрата BTK после стимуляции α-IgM. Необходимо отметить, что молекула с такой же структурой, что и I-7, но не обладающая биохимической активностью в отношении BTK, IR-7, не активна в тесте на пролиферацию наивных В-лимфоцитов.
ПРИМЕР 272
Тест на пролиферацию В-клеточной лимфомы
[001369] Предложенные соединения ингибируют пролиферацию различных линий клеток В-клеточной лимфомы, как показано в Таблице 10. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали EC50<0,1 мкМ; соединения, активность которых обозначена "B", продемонстрировали EC50 0,1-1 мкМ; соединения, активность которых обозначена "С", продемонстрировали ЕС50 I-10 мкМ; и соединения, активность которых обозначена "D", продемонстрировали EC50>10 мкМ
Таблица 10 (см. в конце описания)
ПРИМЕР 273
Тимус-независимая активация B-клеток in vivo (TI-2)
[001370] Мышам С57/В6 ежедневно вводили 100 мг/кг соответствующего соединения в дни с 0 по 5. Мышей иммунизировали однократно 25 мкг TNP-Ficoll в день 1, сыворотку отбирали в день 6 и исследовали на продукцию циркулирующих антител α-TNP IgM (разбавление сыворотки 1:1600) и IgG3 (разбавление сыворотки 1:200) методом твердофазного иммуноферментного анализа. Результаты представлены в виде среднего по 10 мышам из каждой группы и приведены в таблице 11 в виде % ингибирования TI-2-независимой активации B-клеток.
ПРИМЕР 274
Модель артрита, индуцированного антителом к коллагену
[001371] В день 0 проводили фоновые измерения подушечек лап и делили животных на экспериментальные группы таким образом, чтобы получить группы, которые не имели существенных отличий друг от друга. Затем каждому животному внутривенно вводили 2 мг коктейля моноклональных антител Arthritomab. В этот момент начинали обработку исследуемыми агентами. В день 6 каждому животному внутрибрюшинно вводили 50 мкг липополисахарида (LPS) в 200 мкл стерильного PBS. Исследования подушечек стоп и клиническую оценку проводили в дни 6, 7, 8, 9, 10, 11, 12, 14, 18 и 21. Результаты показаны в Таблице 12.
ПРИМЕР 275 Модель артрита PG-PS
[001372] В день 0 самкам крыс Lewis делали внутрибрюшинные болюсные инъекции (IP) пептидогликан-полисахарида (PG-PS) в количестве 15 мкг/г массы тела крысы. Крысам, представляющим контрольную группу, делали внутрибрюшинную болюсную инъекцию PBS. Группе, получавшей среду, и группе лечения вводили соединения путем орального гаважа непосредственно перед введением PG-PS. Ежедневное введение среды и соединения продолжали до дня 22. На протяжении исследования осуществляли измерение максимальной толщины лодыжки на обеих задних конечностях с помощью штангенциркуля. В день 23 исследование завершали, рассчитывали конечное изменение опухания лодыжки, и сравнивали с контролем (крысы, получавшие среду). В Таблице 13 показаны результаты для двух соединений (n = число экспериментов).
ПРИМЕР 276
Масс-спектрометрическое исследование для ТЕС киназы (соединение I-2)
[001373] Киназу ТЕС (45 пмоль; Invitrogen) инкубировали с соединением I-2 (450 пмоль) в течение 3 часов при 10Х избытке, после чего осуществляли расщепление трипсином. После инкубации с соединением использовали иодацетамид в качестве алкилирующего агента. Также готовили контрольный образец (45 пмоль), в который не добавляли I-2. Аликвоты фрагментов для расщепления трипсином объемом 5 мкл (7,5 пмоль) разбавляли 15 мкл 0,1% TFA, а затем наносили наконечником micro С 18 Zip Tip непосредственно на мишень MALDI с использованием альфа-циано-4-гидрокси-коричной кислоты в качестве матрицы (5 мкг/мл в 0,1% смеси ТРА:ацетонитрил 50:50).
[001374] Как показано на Фигуре 6, пептид, который, как ожидалось, будет модифицирован (GCLLNFLR), обнаруживали сразу после реакции с соединением I-2 (масса молекулярного иона MI 359,17 Да) при МН+1294,72. Также было четко установлено, что этот пептид был модифицирован иодацетамидом в контрольном образце (МН+992,56). Интересным фактом является то, что модифицированный иодацетамидом пептид не обнаруживался в гидролизате после реакции с соединением I-2, что указывает завершение реакции. Следов присутствия других модифицированных пептидов обнаружено не было.
[001375] Присутствие соединения I-2 подтверждалось MH+360,17 в диапазоне низких масс спектра. В спектре фрагментации пика 360,17 наблюдались диагностические фрагменты, которые были видны в спектре распада после источника (PSD) модифицированного пептида на 1294,72 (См. Фиг.6).
[001376] Чтобы дополнительно убедиться в присутствии модифицированных пептидов, пептиды, меченые иодацетамидом (992,56) и меченые I-2 (1294,72), подвергали анализу методом PSD (MC/MC). Поиск в базе данных NCBI Homo sapien с использованием программы для поиска ионов MC/MC Ion Search показал, что в обоих случаях высокое совпадение было для ожидаемых пептидов. Аппаратура:
[001377] Для расщепления трипсином использовали режим Reflectron с настройкой пульсовой экстракции 2200. Калибровку проводили с использованием стандартов Laser Biolabs Pep Mix (1046,54, 1296,69, 1672,92, 2093,09, 2465,20). Для анализа методом CID/PSD (CID - индуцированная столкновениями диссоциация) пептид выбирали с помощью курсора для того, чтобы задавать интервалы пропускания ионов и фрагментацию, которые имеют место при энергии лазера выше 20%, в качестве газа для соударений для CID использовали гелий. Калибровку для фрагментов осуществляли с использованием калибровки для фрагментов P14R для режима Curved field Reflectron.
ПРИМЕР 277
Масс-спектрометрическое исследование для TEC киназы (соединение I-4)
[001378] Киназу TEC (45 пмоль; Invitrogen) инкубировали с соединением I-4 (450 пмоль) в течение 3 часов при 10Х избытке, после чего осуществляли расщепление трипсином. После инкубации с соединением использовали иодацетамид в качестве алкилирующего агента. Также готовили контрольный образец (45 пмоль), в который не добавляли I-4. Аликвотыфрагментов, полученных в результате расщепления трипсином объемом 5 мкл (7,5 пмоль) разбавляли 15 мкл 0,1% TFA, а затем наносили micro наконечником С 18 Zip Tip непосредственно на мишень MALDI с использованием альфа-циано-4-гидрокси-коричной кислоты в качестве матрицы (5 мкг/мл в 0,1% смеси ТРА: ацетонитрил 50:50).
[001379] Как показано на Фигуре 7, пептид, который, как ожидалось, будет модифицирован (GCLLNFLR), наблюдали при MH+ 1355,72. Эта масса соответствует тому, что соединение I-4 с прибавленной массой 420,21 добавляют к пептиду массой 935,51. Также этот пептид, модифицированный иодацетамидом, был выявлен в контрольном образце на MH+ 992,56. Интересным является то, что модифицированный иодацетамидом пептид не обнаруживался в гидролизате после реакции с соединением I-4, что указывает о завершении реакции. Следов присутствия других модифицированных пептидов обнаружено не было.
[001380] Присутствие соединения I-4 наблюдали при MH+421,35 в диапазоне низких масс спектра. В спектре фрагментации пика при 421,35 наблюдались два значительных пика, которые были видны в PSD-спектре модифицированного пептида при 1355,72 (См. Фиг.7).
[001381] Чтобы дополнительно убедиться в присутствии модифицированного соединением I-4 пептида, пептиды с МН+1355,72 подвергали PSD-анализу (МС/МС). Из-за низкой интенсивности пиков фрагментов корреляция с базой данных невозможна. Однако, диагностические фрагменты самой молекулы I-4 обеспечили достоверную идентификацию. Диагностические фрагменты при MH+ 376,38 и 421,83 - фрагменты I-4.
Аппаратура:
[001382] Для расщепления трипсином аппарат устанавливали в режим Reflectron с настройкой пульсовой экстракции 2200. Калибровку проводили с использованием стандартов Laser Biolabs Pep Mix (1046,54, 1296,69, 1672,92, 2093,09, 2465,20). Для анализа CID/PSD пептид выбирали с помощью курсора для того, чтобы задавать интервалы пропускания ионов и фрагментацию, которые имеют место при энергии лазера выше 20%, в качестве газа для соударений для CID использовали гелий. Калибровку для фрагментов осуществляли с использованием калибровки для фрагментов P14R для режима Curved field Reflectron.
ПРИМЕР 278
Масс-спектрометрическое исследование для ТЕС киназы (соединение I-7)
[001383] ТЕС-киназу (45 пмоль; Invitrogen) инкубировали с соединением I-7 (450 пмоль) в течение 3 часов при 10Х избытке, после чего осуществляли расщепление трипсином. После инкубации с соединением использовали иодацетамид в качестве алкилирующего агента. Также готовили контрольный образец (45 пмоль), в который не добавляли I-7. Аликвоты фрагментов, полученных в результате расщепления трипсином объемом 5 мкл (7,5 пмоль) разбавляли 15 мкл 0,1% TFA, а затем наносили с использованием наконечника micro С 18 Zip Tip непосредственно на мишень MALDI с использованием альфа-циано-4-гидрокси-коричной кислоты в качестве матрицы (5 мкг/мл в 0,1% смеси ТРА: ацетонитрил 50:50).
[001384] Как показано на Фигуре 8, пептид, который, как ожидалось, будет модифицирован (GCLLNFLR), обнаруживали при МН+1280,73. Эта масса соответствует тому, что соединение I-7 с прибавленной массой 345,16, добавляют к пептиду массой 935,51. Также этот пептид, модифицированный иодацетамидом, был выявлен в контрольном образце при MH+ 992,56. Интересным является тот факт, что модифицированный иодацетамидом пептид не обнаруживался в гидролизате после реакции с соединением I-7, что указывает на завершение реакции. Следов присутствия других модифицированных пептидов при MH+ 1985,93 обнаружено не было (TIDELVECEETFGR).
[001385] Присутствие соединения I-7 наблюдали при MH+ 346,32 в диапазоне низких масс спектра. В спектре фрагментации пика 346,32 наблюдалось много диагностических фрагментов, которые были видны в спектре PSD двух модифицированных пептидов (см. Фиг.8).
[001386] Чтобы дополнительно убедиться в присутствии пептидов, модифицированных соединением I-7, пептиды с MH+ 1280,73 и 1985,93 подвергали PSD-анализу (МС/МС). Сопоставление полученных данных с базой данных по белкам человека выявил ожидаемые пептиды, модифицированные I-7.
Аппаратура:
[001387] Для расщепления трипсином аппарат устанавливали в режим Reflectron с настройкой пульсовой экстракции 2200. Калибровку проводили с использованием стандартов Laser Biolabs Pep Mix (1046,54, 1296,69, 1672,92, 2093,09, 2465,20). Для анализа методом CID/PSD пептид выбирали, используя курсор для того, чтобы задавать интервалы пропускания ионов и фрагментацию, которые имеют место при энергии лазера выше 20%, в качестве газа для соударений для CID использовали гелий. Калибровку для фрагментов осуществляли с использованием калибровки P14R для режима Curved field Reflectron.
ПРИМЕР 279
Общая методика анализа активности в отношении активных форм киназы ITK
[001388] В этом примере описаны испытания киназ с непрерывным считыванием данных для измерения активности соединений в отношении активных форм ферментов ITK, осуществляемые согласно описанному выше Примеру 251, за исключением того, что использовались следующие условия с оптимизацией реагентов по ITK:
[ITK]=10 нМ, [АТФ]=25 мкМ, [Y6-Sox]=10 мкМ (АТФ KMapp=33 мкМ).
ПРИМЕР 280
[001389] В Таблице 14 показана активность некоторых соединений согласно настоящему изобретению в тесте на ингибирование ITK. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50≤10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50≥10000 нМ.
Таблица 14 (см. в конце описания)
ПРИМЕР 281
Общая методика анализа активности в отношении активных форм киназы ВМХ
[001390] В этом примере описаны испытания киназ с непрерывным считыванием данных для измерения активности соединений в отношении активных форм ферментов ВМХ, осуществляемых согласно описанному выше Примеру 251, за исключением того, что использовались следующие условия с оптимизацией реагентов по ВМХ:
[BMX]=2,5 нМ, [АТФ]=100 мкМ, [Y5-Sox]=7,5 мкМ (АТФ KMapp=107 мкМ).
ПРИМЕР 282
[001391] В Таблице 15 показана активность некоторых соединений согласно настоящему изобретению в тесте на ингибирование ВМХ. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50≤10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50≥10000 нМ.
ПРИМЕР 283
Клонирование, экспрессия и очистка мутантных EGFR-WT и EGFR C797S с использованием бакуловируса и клеток насекомого
(i) Субклонирование EGFR-WT и мутантных киназных доменов
[001392] Аминокислоты с 696 по 1022 киназного домена EGFR-WT (NM_005228, NP_005219.2) субклонировали в сайты Ncol и HindIII вектора pFastHTa (Invitrogen, Карлсбад, Калифорния, США). Для получения мутантного белка EGFR цистеин в положении 797 заменяли на серин, используя набор Stratagene QuikChange kit (Stratagene, Cedar Creek, TX) в соответствии с инструкцией производителя.
(ii) Экспрессия
[001393] Исходные растворы бакуловируса Р1 нарабатывали в клетках SF9 в соответствии с методикой трансфекции в суспензии Blue Sky Biotech (Вустер, Массачусетс, США). Анализ экспрессии осуществляли в 125 мл культуры клеток насекомого SF21 ((выращенной в SF900I SFM (Invitrogen, кат. №10902-088) с добавкой 10 мг/л гентамицина (Invitrogen, Карлсбад, Калифорния, кат.№15710-064)) при вирусной нагрузке 0,1 мл вируса на 100 мл суспензии клеток. Экспрессию оптимизировали, используя систему мониторинга кинетики инфекции Blue Sky Biotech’s Infection Kinetics Monitoring system (Вустер, Массачусетс, США).
(iii) Очистка
[001394] Инфицированные клетки насекомого осаждали центрифугированием. Клеточные осадки ресуспендировали в буфере для лизиса Blue Sky Biotech’s lysis buffer (Вустер, Массачусетс, США, IX WX; солюбилизирующий буфер, содержащий коктейль ингибиторов протеаз из лейпептина, пепстатина, PMSF (фенилметансульфонилфторид), апротинин и ЭДТА) в соотношении 10 мл на грамм влажной массы клеток. Клетки лизировали обработкой ультразвуком и лизат осветляли путем центрифугирования при 9000 об/мин в течение 30 минут в роторе GSA. Слой смолы NiNTA (Qiagen, Валенсия, Калифорния, США) объемом 500 мкл добавляли к супернатантам и связывание проводили в течение двух часов при постоянном встряхивании. Материал переносили под действием силы тяжести в пустую колонку объемом 2 мл. Колонку промывали 2 мл промывного буфера (Blue Sky Biotech, Вустер, Массачусетс, США, 1X WX, 25 мМ имидазола). Белок элюировали смесью 1X WX/имидазол разной концентрации: элюат 1:75 мМ имидазола (2 фракции, 1 объем колонки); элюат 2:150 мМ имидазола (2 фракции, 1 объем колонки); Элюат 3:300 мМ имидазола (2 фракции, 1 объем колонки). Все фракции анализировали методом электрофореза в полиакриламидном геле с додецилсульфатом натрия (SDS PAGE) с последующим окрашиванием Кумасси и Вестерн-блоттингом с использованием антител к пента-гистидину (Qiagen, Валенсия, Калифорния, США). Из некоторых очищенных белков удаляли карбокси-концевую метку из шести гистидинов с использованием набора AcTEV Protease kit (Invitrogen, Карлсбад, Калифорния, кат. №12575-015) в соответствии с инструкцией производителя. Все образцы (до и после расщепления Tev) анализировали методом SDS PAGE с последующим окрашиванием Кумасси и Вестерн-блоттингом, как описано выше.
ПРИМЕР 284
Масс-спектрометрическое исследование для EGFR
[001395] EGFR дикого типа и EGFR (мутант C797S) инкубировали с 10-кратным избытком исследуемого соединения в течение 1 часа и 3 часов. Аликвоты образцов объемом 1 мкл (общий объем 5-8 мкл) разбавляли 10 мкл 0,1% TFA перед нанесением наконечником micro C4 ZipTip непосредственно на мишень MALDI с синапиновой кислотой в качестве матрицы десорбции (10 мг/мл в 0,1% смеси ТРА: ацетонитрил 50:50). Измерение интактной массы показало, что номинальная масса для дикого типа составляет около 37557, а у мутанта - несколько ниже, около 37500. Реакционную способность наблюдали только для EGFR дикого типа, при этом появлялся новый пик массы, соответствующей ковалентной модификации в единственном сайте под действием исследуемого соединения, имеющего массу 410 Да.
ПРИМЕР 285
Общая методика анализа активности в отношении активных ферментов EGFR (WT) и EGFR (T790M/L858R)
[001396] Общую методику анализа активности в отношении EGFR воспроизводят согласно описанному выше Примеру 251 за тем исключением, что использовали следующие условия с оптимизацией реагентов для EGFR-WT и EGFR T790M/L858R-модиф.:
[001397] [EGFR-WT]=5 нМ, [АТФ]=15 мМ, [Y12-Sox]=5 мМ (АТФ KMappp ~ 12 мМ); и [EGFR-T790M/L858R]=3 нМ, [АТФ]=50 мМ, [Y12-Sox]=5 мМ (АТФ KMapp ~ 45 мМ).
ПРИМЕР 286
[001398] В Таблицах 16 и 17 показана активность некоторых соединений согласно настоящему изобретению в тесте на ингибирование EGFR. В Таблице 16 показаны данные для EGFR дикого типа; в Таблице 17 показаны данные для двух мутантных EGFR. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50≤10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50≥10000 нМ.
Таблицы 16 и 17 (см. в конце описания)
ПРИМЕР 287
Тесты на активность EGFR с использованием клеток
[001399] Соединения исследовали на клетках А431 эпидермоидной карциномы человека методом, по существу аналогичным методу, описанному у Fry, et al., Proc. Natl. Acad. Sci. USA, vol.95, pp.12022-12027, 1998. В частности, клетки эпидермоидной карциномы человека А431 выращивали в 6-луночных планшетах до непрерывности слоя 90% и затем инкубировали в бессывороточной среде в течение 18 часов. Наборы клеток в двух повторностях обрабатывали 1 мкМ раствором обозначенного соединения в течение 2, 5, 10, 30 или 60 мин. Клетки отмывали от соединения подогретой бессывороточной средой, инкубировали в течение 2 ч, промывали еще раз, инкубировали еще 2 ч, промывали еще раз и затем инкубировали еще 2 ч, снова промывали и инкубировали дополнительно в течение 2 ч, после чего стимулировали обработкой 100 нг/мл раствором EGF в течение 5 мин. Экстракты готовили, как описано у Fry et al..
[001400] Соединения тестировали на клетках эпидермоидной карциномы человека A431 методом, по существу аналогичным методу, описанному у Fry, et al.. В частности, клетки эпидермоидной карциномы человека A431 выращивали в 6-луночных планшетах до непрерывности слоя 90% и затем инкубировали в бессывороточной среде в течение 18 часов. Затем клетки обрабатывали 10, 1, 0,1, 0,01 или 0,001 мкМ раствором тестируемого соединения в течение 1 ч. Затем клетки стимулировали обработкой 100 нг/мл раствором EGF в течение 5 мин и готовили экстракты, как описано у Fry et al.. 20 мкг общего белка из лизатов загружали на гель и полученные блоты исследовали либо на фосфорилирование EGFR, либо на фосфорилирование р42/р44 Erk.
ПРИМЕР 288
Эксперименты с промывкой на исследование активности EGFR
[001401] Клетки эпидермоидной карциномы человека А431 выращивали в 6-луночных планшетах до непрерывности слоя 90% и затем инкубировали в бессывороточной среде в течение 18 часов. Наборы клеток в двух повторностях обрабатывали 1 мкМ раствором обозначенного соединения в течение 1 часа. Затем один набор клеток стимулировали 100 нг/мл раствором EGF в течение 5 минут и готовили экстракты, как указано. Другой набор клеток отмывали от соединения I-7 подогретой бессывороточной средой, инкубировали в течение 2 чаов, промывали еще раз, инкубировали еще 2 ч, снова промывали инкубировали еще 2 часа, после чего снова промывали и инкубировали дополнительно в течение 2 часов и затем стимулировали обработкой EGF. Результаты этого эксперимента с соединением I-7 изображены на Фигуре 10.
ПРИМЕР 289
Эксперименты с промывкой на клетках НСС827. содержащих мутант EGFR HCC827 с делецией
[001402] Клетки (ATCC, Манассас, Вирджиния, США) высевали в планшет в среде Growth Media (RPM 1640) с добавкой 10% FBS (фетальной бычьей сыворотки), 10 мкМ HEPES, 2 мМ 1-глутамина, 1 мМ NA-пирувата и пенстрепа (pen/strep) (Invitrogen, Карлсбад, Калифорния) при плотности 2,5×10 клеток на лунку в 6-луночных культуральных планшетах. Спустя двадцать четыре часа дважды промывали PBS, а затем выдерживали без сыворотки в течение ночи в основной среде Basal Media (среда для выращивания без FBS).
[001403] На следующее утро среду удаляли и в лунки (в двух повторностях) добавляли 2 мл свежей основной среды Basal Media, содержащей 1 мкМ соединения в 0,1% ДМСО. Через 1 час одну лунку с клетками обрабатывали 100 нг/мл EGF в течение 5 минут, промывали PBS, после чего осуществляли лизирование путем разрушения в 75 мкл в буфере Cell Extraction Buffer (Invitrogen, Карлсбад, Калифорния, США) с добавкой ингибитора фосфатаз PhosSTOP и полного ингибитора протеаз Complete Protease Inhibitor (Roche, Индианаполис, США) в момент времени 0 ч. Соединение удаляли из второго набора лунок и промывали эти лунки дважды основной средой. Клетки промывали основной средой каждые 2 часа в течение 8 часов, после чего их обрабатывали EGF и лизировали как в момент времени 0 ч.
[001404] Концентрации белка в лизатах определяли биуретовым методом ВСА Assay (Pierce, Рокфорд, Иллинойс, США), 10 мкг каждого лизата отделяли с использованием 4-12% градиента в SDS-PAGE (Invitrogen), переносили на мембрану Immobilon-FL (Millipore) и обрабатывали антителами кролика к фосфо-EGFR (Tyrl068) (Zymed, Invitrogen) и антителами мыши к EGFR (Cell Signaling Technologies, Дэнверс, Массачусетс, США). Сигналы фосфо-белка измеряли с использованием системы инфракрасной визуализации Odyssey (Li-Cor Biosciences, Линкольн, Небраска, США). Результаты этих экспериментов представлены на Фигуре 9, на которой показано сравнение результатов для соединения I-2 с результатами для соединения I-4 и соединения I-7 в одном и том же эксперименте с промывкой.
ПРИМЕР 290
Масс-спектрометрическое исследование для ErbB4
[001405] Киназный домен Erbb4 (Upstate) инкубировали с соединением в течение 60 минут при 10-кратном избытке соединений I-4 и I-11 относительно белка. Аликвоты образцов объемом 1 мкл (общий объем 4,24 мкл) разбавляли 10 мкл 0,1% TFA, а затем наносили при помощи наконечника micro C4 ZipTip непосредственно на мишень MALDI с синапиновой кислотой в качестве матрицы десорбции (10 мг/мл в 0,1% TFA: ацетонитрил 50:50). Для измерения массы интактного белка прибор устанавливали в линейный режим с использованием настройки импульсной экстракции 16,952 для стандарта миоглобина, используемого для калибровки прибора (Shimadzu Axima TOF2).
[001406] Интактный белок ErbB4 имеет сигнал при МН+ 35850, соответствующие продукты присоединения синопиновой кислоты (матрицы) имеют сигналы примерно на 200 Да выше. В результате стехиометрического включения исследуемого соединения (I-4 и I-11) (Mw=410 Да) наблюдался новый пик массы примерно на 410 Да больше (MH+36260). Это соответствует ковалентной модификации ErbB4 соединениями I-4 и I-11.
ПРИМЕР 291
Ингибирование киназ ErbB1, ErbB2 и/или ErbB4
[001407] Соединения согласно настоящему изобретению исследовали в качестве ингибиторов одной или более киназ ErbBI, ErbB2 и/или ErbB4 по существу аналогично методу, описанного у Invitrogen Corp (Invitrogen Corporation, 1600 Faraday Avenue, Карлсбад, Калифорния; http://www.invitrogen.com/downloads/Z-LYTE_Brochure_1205.pdf), с использованием процедуры биохимического анализа Z’-LYTE™ или аналогичного биохимического анализа. Биохимический анализ Z’-LYTE™ представляет собой флуоресцентный метод со связыванием фермента и основан на различной чувствительности к протеолитическому расщеплению фосфорилированного и нефосфорилированного пептидов. При помощи этого анализа было обнаружено, что соединение I-56 ингибирует ErbBI с IC50=2,233 нМ. При помощи этого анализа также было обнаружено, что соединение I-56 ингибирует ErbB4 (HER4) с IC50=2,165 нМ.
ПРИМЕР 292
Масс-спектрометрическое исследование для янус-3 киназы (Janus-3) (JAK3)
[001408] Киназу JAK3 (33 пмоль; Invitrogen) инкубировали с I-7 (327 пмоль) в течение 3 часов при 10X избытке, после чего осуществляли расщепление трипсином. После инкубации с соединением использовали иодацетамид в качестве алкилирующего агента. Аликвоты продуктов расщепления трипсином объемом 5 мкл (5,5 пмоль) разбавляли 15 мкл 0,1% TFA, а затем наносили наконечником micro С 18 Zip Tip непосредственно на мишень MALDI с альфа-циано-4-гидрокси-коричной кислотой в качестве матрицы (5 мг/мл в 0,1% смеси TFA: ацетонитрил 50:50).
[001409] Как показано на Фигуре 11, пептид (LVMEYLPSGCLR), который, как ожидалось, будет подвергаться модификации, сразу наблюдали как самый большой пик при MH+ 1725,88. Эта масса соответствует ожидаемой для случая, когда соединение I-7 с добавленной массой 345,16, добавляют к пептида с массой 1380,70. Интересным является тот факт, что пик пептид, модифицированный иодацетамидом, не наблюдали при MH+ 1437,73 в спектре гидролизата после реакции с соединением I-7, что указывает на неполное протекание реакции. Также наблюдали присутствие других модифицированных пептидов, однако их сигналы были низкими.
[001410] Доказательством присутствия соединения I-7 является пик, наблюдаемый при MH+ 346,12 в диапазоне низких масс спектра. В спектре фрагментации пика при 346,12 не наблюдали диагностические фрагменты, которые были видны в PSD-спектре модифицированных пептидов (См. Фиг.11).
[001411] Чтобы дополнительно подтвердить присутствие пептидов, модифицированных соединением I-7, пептиды с MH+ 1725,88 и 1118,55 подвергали PSD-анализу (МС/МС). Сопоставление полученных данных с базой данных пептидов человека позволил идентифицировать соответствующие пептиды как модифицированные соединением I-7. Соединение I-11 также тестировали этим же методом и наблюдали измеряемую модификацию пептида.
Аппаратура:
[001412] Для расщепления трипсином аппарат устанавливали в режим Reflectron с настройкой пульсовой экстракции 2200. Калибровку проводили с использованием стандартов Laser Biolabs Pep Mix (1046,54, 1296,69, 1672,92, 2093,09, 2465,20). Для анализа CID/PSD пептид выбирали курсором для того, чтобы задавать интервалы пропускания ионов и фрагментацию, которые имеют место при энергии лазера выше 20%, в качестве газа для соударений для CID использовали гелий. Калибровку для фрагментов осуществляли с использованием калибровки для фрагментации P14R для режима Curved field Reflectron.
ПРИМЕР 293
Общая методика анализа активности в отношении активных форм JAK3:
[001413] Общую методику анализа активности в отношении JAK3 воспроизводили по существу аналогично методу, описанному выше в Примере 251, за тем исключением, что использовали следующие условия реакции, оптимизированные для JAK3:
[JAK3]=5 нМ, [АТФ]=5 мкМ, [Y12-Sox]=5 мкМ (АТФ KMapp ~ 5 мкМ).
ПРИМЕР 294
[001414] В Таблице 18 показана активность некоторых соединений согласно настоящему изобретению в тесте на ингибирование JAK3. Номера соединений соответствуют номерам соединений в Таблице 5. Соединения, активность которых обозначена "A", продемонстрировали IC50≤10 нМ; соединения, активность которых обозначена "B", продемонстрировали IC50 10-100 нМ; соединения, активность которых обозначена "C", продемонстрировали IC50 100-1000 нМ; соединения, активность которых обозначена "D", продемонстрировали IC50 1000-10000 нМ; и соединения, активность которых обозначена "E", продемонстрировали IC50≥10000 нМ.
ПРИМЕР 295
Методика анализа JAK3 с использованием клеток CTLL2
[001415] Соединения I-2, I-4 и I-7 исследовались в соответствии со следующей методикой.
CTLL2: линия клеток лимфомы мыши АТСС: TIB-214. 5×106 клеток/образец выдерживали без IL-2 в среде RPMI-1640 в течение 2 часов. Образцы затем обрабатывали соединением в течение 90 минут. Затем образцы за исключением контроля с ДМСО стимулировали 100 нМ IL-2 в течение 10 минут. Образцы лизировали и подвергали анализу методом вестерн-блоттинга. Результаты представлены на Фигуре 12, Фигуре 13 и Фигуре 14.
ПРИМЕР 296
Связывание ВТК в клетках Ramos соединениями I-7 и I-215 с использованием гранул со стрептавидином
[001416] Клетки Ramos инкубировали с соединением I-7 при концентрациях 0,1, 0,05, 0,01 или 0,001 мкМ в бессывороточной среде в течение 1 часа при 37°C. Клетки осаждали путем центрифугирования и лизировали в буфере для экстракции клеток Cell Extraction buffer (Invitrogen) в течение 10 минут на льду, центрифугировали (10 минут при 14000 об/мин) и собирали супернатанты. Лизаты клеток инкубировали с соединением I-215 при концентрации 1 мкМ в течение 1 часа при комнатной температуре, а затем инкубировали с агарозными гранулами, связанными со стрептавидином (ThermoFisher) в течение ночи при 4°С. Гранулы трижды промывали лизирующим буфером и выпаривали связавшийся белок с гранул при 95°С в течение 5 минут в буфере для образцов, содержащим литий додецилсульфат (LDS) 4X LDS. Количество BTK, связанной с соединением-зондом I-215, определяли методом вестерн-блоттинга с BTK. Все значения нормировали по образцу, обработанному ДМСО, этот образец принимали за 100%. На Фигуре 16 показан вестерн-блоттинг; на Фигуре 17 показан результат количественного анализа данных, представленных на Фигуре 16, демонстрирующие, что несвязанный белок ВТК доступен для зонда I-215 при обработке клеток раствором соединения I-7 низких концентраций (10 нМ, 1 нМ), но при более высоких концентрациях I-7 белок ВТК полностью связан и не может взаимодействовать I-215.
ПРИМЕР 297
Эксперименты с промывкой с соединением I-7 и соединением-зондом I-215
[001417] Клетки Ramos инкубировали с соединением I-7 при его концентрации 0,1 мкМ или контрольного соединения - обратимого ингибитора ВТК в бессывороточной среде в течение 1 часа при 37°C. Затем клетки промывали в среде, не содержащей соединение, и лизировали через 0, 4, 6 или 8 часов после удаления соединения. Лизаты клеток инкубировали с соединением I-215 при его концентрации 1 мкМ в течение 1 часа при комнатной температуре, а затем в течение ночи при 4°C с агарозными гранулами, связанными со стрептавидином. Белки выпаривали с гранул и оценивали степень связывания BTK методом вестерн-блоттинга. На Фигуре 18 показан Вестерн-блоттинг; на Фигуре 19 показан результат количественного анализа данных, представленных на Фигуре 18, эта фигура демонстрирует, что весь белок ВТК остается связанным с соединением I-7 в течение более 8 часов. Это указывает на то, что время повторного синтеза детектируемого белка BTK в клетках Ramos превышает 8 часов. В контроле с обратимым ингибитором, напротив, 45% белка BTK не связано и доступно для зонда в момент времени 0 ч, а к 4 часам уже 100% белка ВТК не связано и доступно для связывания с зондом. Все образцы нормировали по клеткам, обработанным ДМСО, которые собирали в 0 часов.
ПРИМЕР 298
Определение степени связывания ВТК в in vitro образцах методом твердофазного ИФА (ELISA)
[001418] Для того чтобы определить количество свободной ВТК в лизатах клеток или тканей, применяли метод ELISA с использованием биотинилированного соединения-зонда, который связывается только со свободной, несвязанной ВТК. Конъюгированный биотин иммобилизуют на покрытом стрептавидином планшете для ELISA и детектируют антителом мыши к ВТК (Becton Dickinson, Franklin Lakes, Нью-Джерси, США) и вторичным антителом козы к мышиному HRP (пероксидазе хрена) (Zymed, South San Francisco, Калифорния, США).
[001419] Все образцы готовили в буфере для лизиса Biorad одинаковой концентрации (Hercules, Калифорния, США) с 0,5% бычьего сывороточного альбумина (БСА) в PBS с 0,05% Tween-20 с конечной концентрацией 1 мкМ соединения I-215. Образцы инкубировали в планшете для смешивания в течение 1 часа при комнатной температуре при встряхивании, чтобы обеспечить связывание соединения I-215 со свободной ВТК. После инкубации с соединением I-215 образцы помещали в промытый планшет для ELISA, покрытый стрептавидином (Pierce, Рокфорд, Иллинойс, США) и инкубировали в течение 1 часа при комнатной температуре при встряхивании. Затем планшеты промывали PBS, содержащим 0,05% Tween-20 с использованием автоматического промывателя для планшетов. Антитело к ВТК готовили разбавлением 1: 1000 в 0,5% БСА в PBS (0,05% Tween-20) и добавляли в планшет для ELISA. Планшет инкубировали в течение 1 часа при комнатной температуре со встряхиванием. Планшет промывали, как описано выше, и готовили вторичное HRP-антитело разбавлением 1: 5000 в 0,5% БСА в PBS (0,05% Tween-20). Планшет инкубировали и промывали, как описано выше. В планшет добавляли тетраметилбензидин (ТМВ) и проводили мониторинг оптической плотности при 650 нм OD650 до достижения OD650, равной 1 единице оптической плотности (ОП). Затем реакцию останавливали добавлением H2SO4. Планшет анализировали с использованием программы Gen 5 и логистической кривой с 4 параметрами для количественного анализа образцов. Для построения стандартной кривой использовали рекомбинантную ВТК (Invitrogen, Карлсбад, Калифорния, США).
[001420] В Таблице 19 показаны результаты, полученные с использованием клеток Ramos, представленные в виде концентрации, при которой связано >50% или >90% BTK. Концентрация, обозначенная "A", больше 1 нМ; концентрация, обозначенная "B", - больше 10 нМ; и концентрация, обозначенная "C", - больше 50 нМ.
ПРИМЕР 299
Ковалентное связывание зонда в первичных B-клетках человека in vitro
[001421] Первичные В-клетки человека выделяли, как описано в Примере 256, а затем ресуспендировали в среде RPMI (10% сыворотки). К среде добавляли раствор анализируемого соединения, разбавленный 1:1000. Клетки инкубировали с соединением в инкубаторе для культур клеток в течение 1 ч при 37°С. После инкубации клетки осаждали центрифугированием, промывали IX PBS и лизировали на льду в течение 45 мин, периодически встряхивая. Образцы центрифугировали в микроцентрифуге с охлаждением в течение 30 мин при 14000 об/мин и отделяли супернатант. Супернатант анализировали, как описано в Примере 283, с использование соединения I-215. Соединения I-96 и I-182 связывали по меньшей мере 50% BTK при концентрациях более 10 нМ.
ПРИМЕР 300
Ковалентное связывание зонда в первичных B-клетках собаки in vitro
[001422] Цельную кровь собаки (30 мл) разбавляли до объема 50 мл IX PBS и наслаивали на Histopaque-1077 (Sigma Aldrich). Цельную кровь на Histopaque центрифугировали при 400g в течение 30 мин в центрифуге Beckman без перерыва. Мононуклеары периферической крови (РВМС) собирали и осаждали центрифугированием при 400 g в течение 15 мин. Эритроциты (RBC) лизировали с использованием 2,5 мл буфера для лизирования эритроцитов RBC lysis buffer (Boston Bioproducts) и оставшиеся PBMC трижды промывали IX PBS при 250 g. PBMC обрабатывали соединением, разбавленным 1:1000 в течение одного часа при 37°C, промывали PBS и лизировали на льду в течение 45 минут. Лизат центрифугировали в течение 30 минут при 14000g и собирали супернатант. Супернатант анализировали, как описано в Примере 283, с использованием соединения I-215. Соединение I-96 связывало по меньшей мере 50% BTK при концентрации более 10 нМ.
ПРИМЕР 301
Определение степени связывания BTK в образцах in vivo методом ELISA
[001423] Крысам перорально вводили соединение в дозе 30 мг/кг и отбирали часть селезенки через 2 или 24 часа после введения соединения. Селезенки крыс разрушали между двумя стеклами для микроскопа, покрытыми матовым стеклом, чтобы получить суспензии отдельных клеток. Эритроциты лизировали инкубированием с буфером для лизиса эритроцитов RBC lysis buffer (Boston Bioproducts) в течение 2 минут при комнатной температуре, затем клетки ресуспендировали в полной среде RPMI и осаждали путем центрифугирования. В-клетки крыс выделяли путем положительного отбора с использованием конъюгатов антител к B220+ с - магнитными гранулами, очищали на колонке MACS и лизировали в буфере для лизиса Bio-Rad при концентрации 10 миллионов клеток в 100 мкл. Лизаты анализировали с использованием биотинилированного соединения - зонда I-215 методом ELISA, подробно описанном в Примере 278. Результаты приведены в Таблице 20.
ПРИМЕР 302
Анализ с использованием методов протеомики
[001424] Белки, которые ковалентно связываются с I-215 в лизате клеток, идентифицируют методом масс-спектрометрии. Лизаты клеток инкубирует с соединением I-215в концентрации 1 мкМ в течение 1 часа при комнатной температуре с последующим добавлением агарозных гранул, связанных со стрептавидином. Белки, отличные от ВТК, идентифицируют масс-спектрометрически. Они являются участниками потенциальных «нецелевых» взаимодействий.
[001425] Хотя в настоящем тексте описан рад вариантов осуществления настоящего изобретения, очевидно, что приведенные базовые примеры могут быть изменены, в результате чего будут реализованы другие варианты осуществления с использованием способов и соединений согласно настоящему изобретению. Соответственно, очевидно, что объем притязаний настоящего изобретения определяется прилагаемой формулой изобретения, а не конкретными вариантами его осуществления, которые были приведены в качестве примеров.
| название | год | авторы | номер документа |
|---|---|---|---|
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2734822C2 |
| ПРОИЗВОДНЫЕ АЗАИНДАЗОЛА ИЛИ ДИАЗАИНДАЗОЛА В КАЧЕСТВЕ МЕДИКАМЕНТА | 2012 |
|
RU2600976C2 |
| ГЕТЕРОАРИЛЬНЫЕ СОЕДИНЕНИЯ И ИХ ПРИМЕНЕНИЕ | 2009 |
|
RU2536584C2 |
| СОЕДИНЕНИЯ ТИЕНОПИРИМИДИНА | 2013 |
|
RU2637925C2 |
| ЗАМЕЩЕННЫЕ 4-(АРИЛАМИНО) СЕЛЕНОФЕНОПИРИМИДИНОВЫЕ СОЕДИНЕНИЯ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2011 |
|
RU2566293C2 |
| ПИРРОЛОПИРИМИДИНОВОЕ СОЕДИНЕНИЕ | 2015 |
|
RU2701206C2 |
| КОНДЕНСИРОВАННЫЕ ГЕТЕРОАРИЛЫ И ИХ ПРИМЕНЕНИЕ | 2011 |
|
RU2552114C2 |
| ЗАМЕЩЕННЫЕ ДИАМИНОКАРБОКСАМИДНЫЕ И ДИАМИНОКАРБОНИТРИЛЬНЫЕ ПРОИЗВОДНЫЕ ПИРИМИДИНОВ, ИХ КОМПОЗИЦИИ И СПОСОБЫ ЛЕЧЕНИЯ С ИХ ПОМОЩЬЮ | 2012 |
|
RU2697712C2 |
| БЕНЗОКСЕПИНОВЫЕ ИНГИБИТОРЫ PI3 И СПОСОБЫ ПРИМЕНЕНИЯ | 2010 |
|
RU2557658C2 |
| ТРИЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ЯНУС-КИНАЗЫ 1, ИХ КОМПОЗИЦИИ, СПОСОБЫ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2019 |
|
RU2824349C2 |
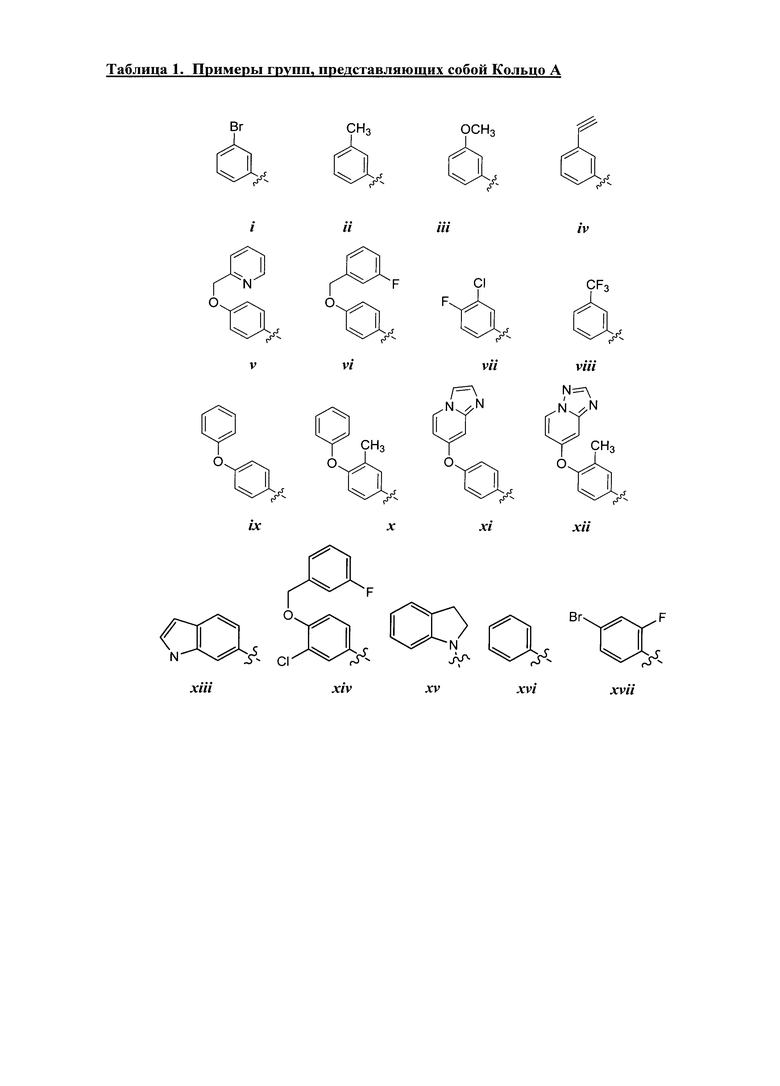

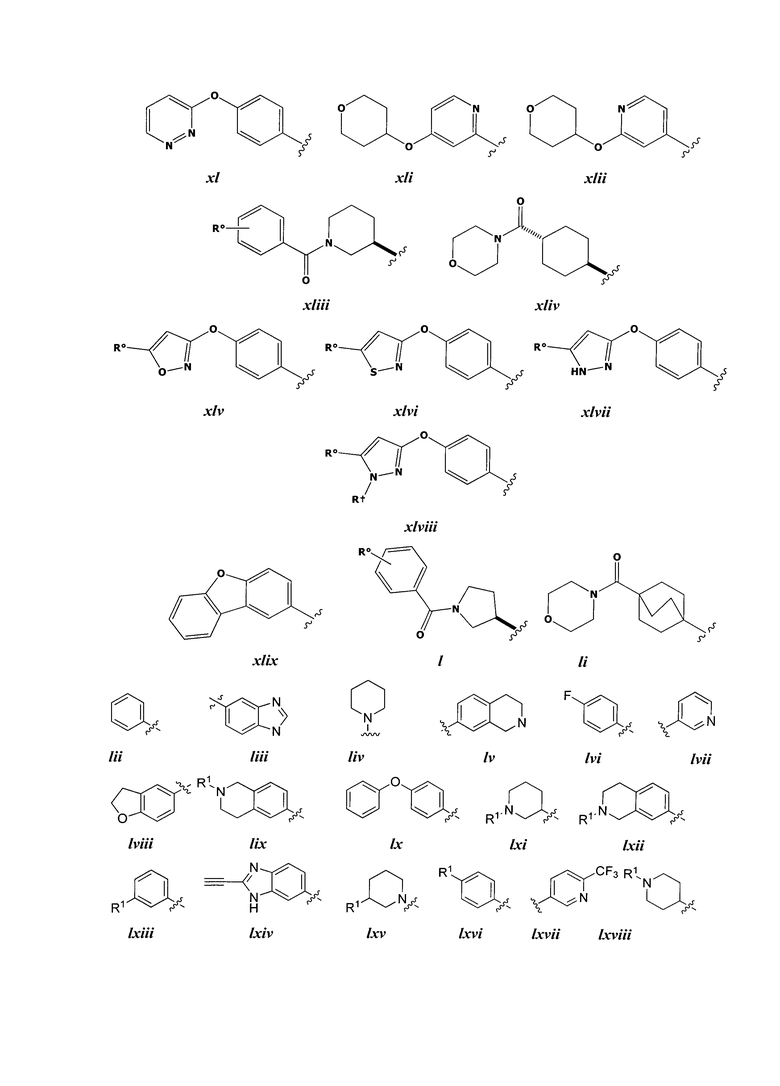
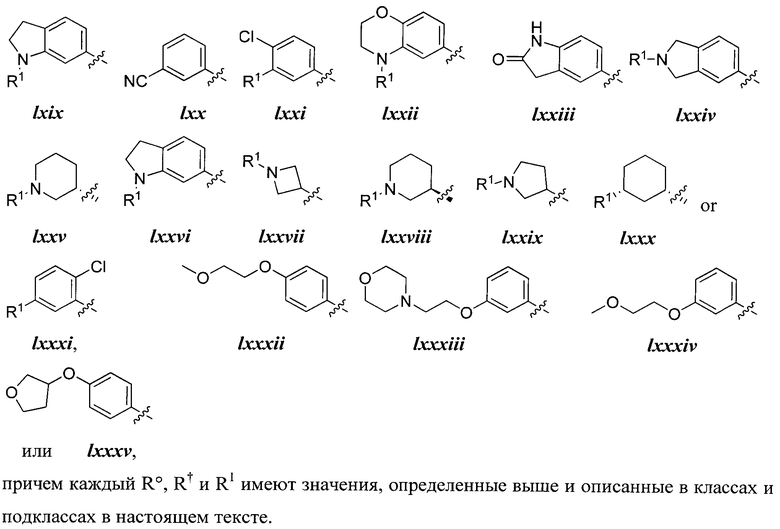
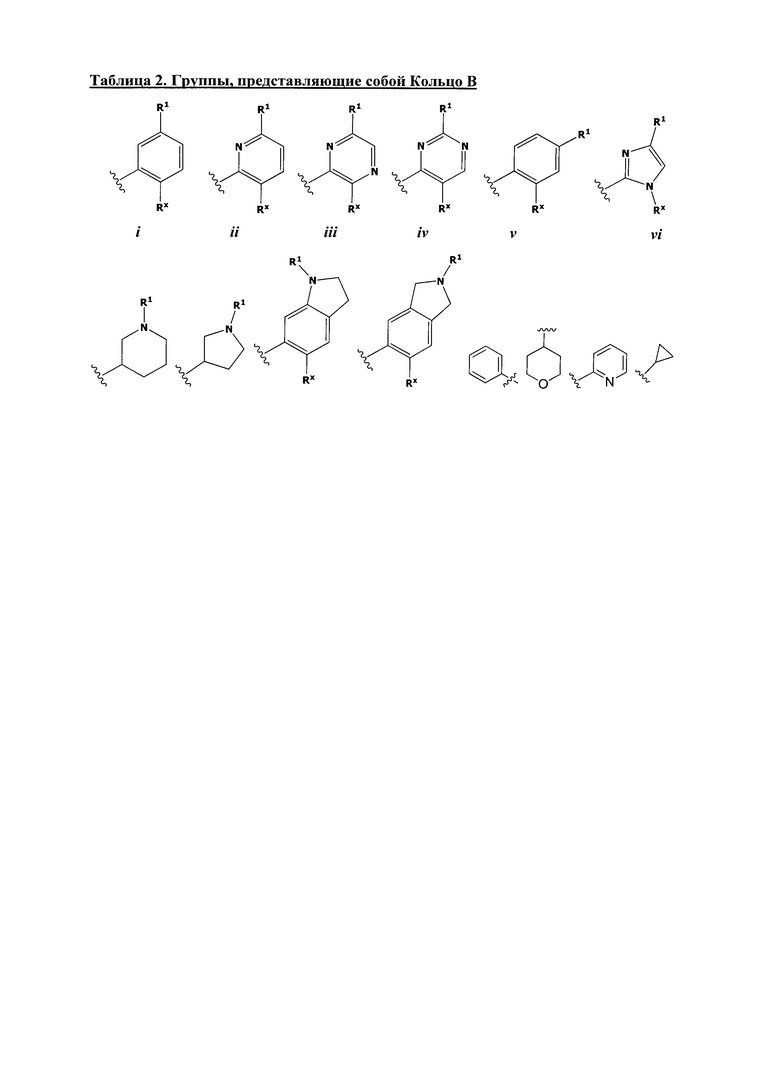
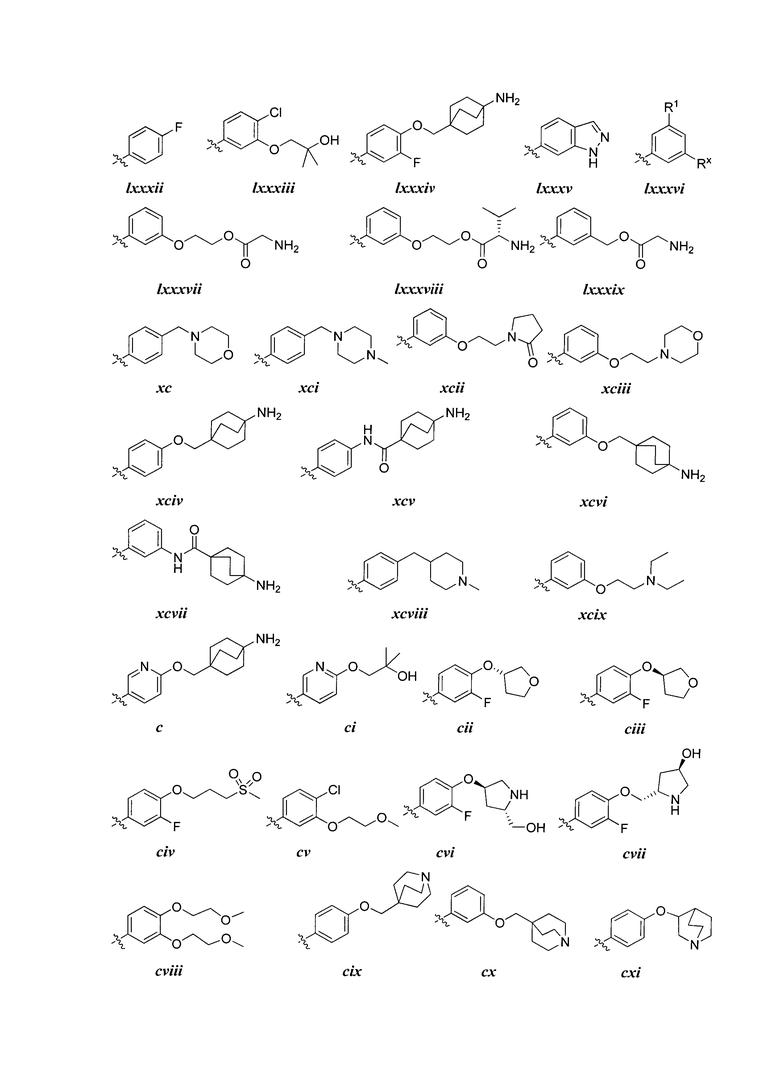
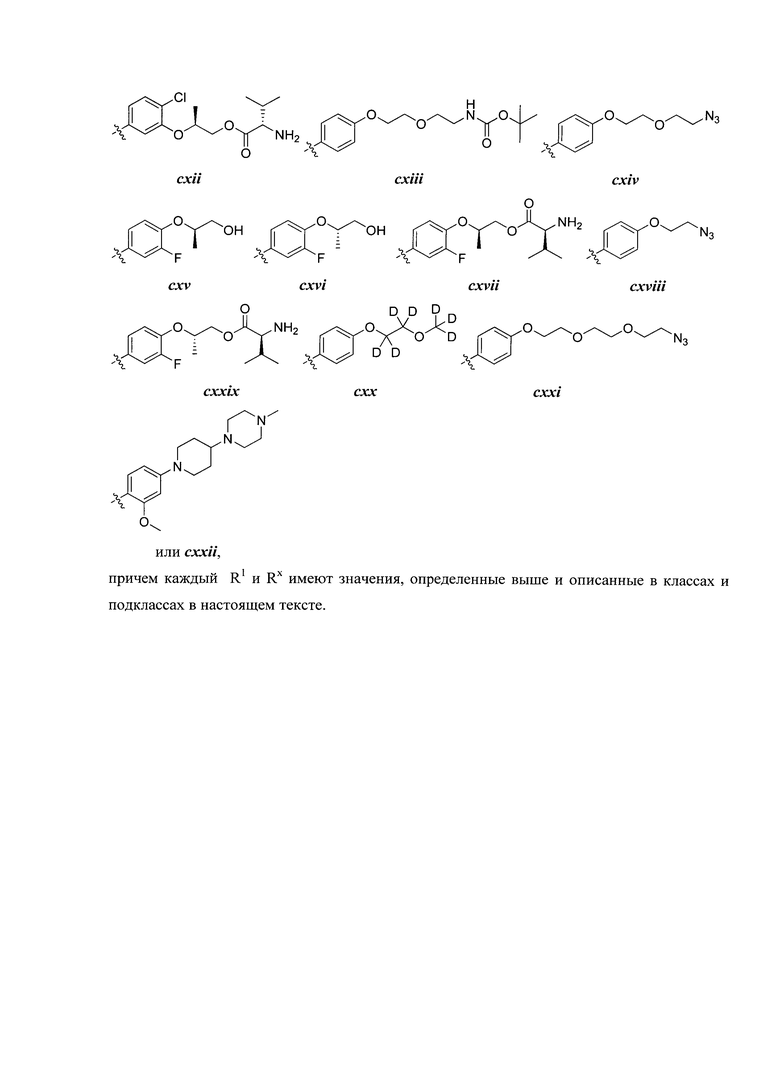
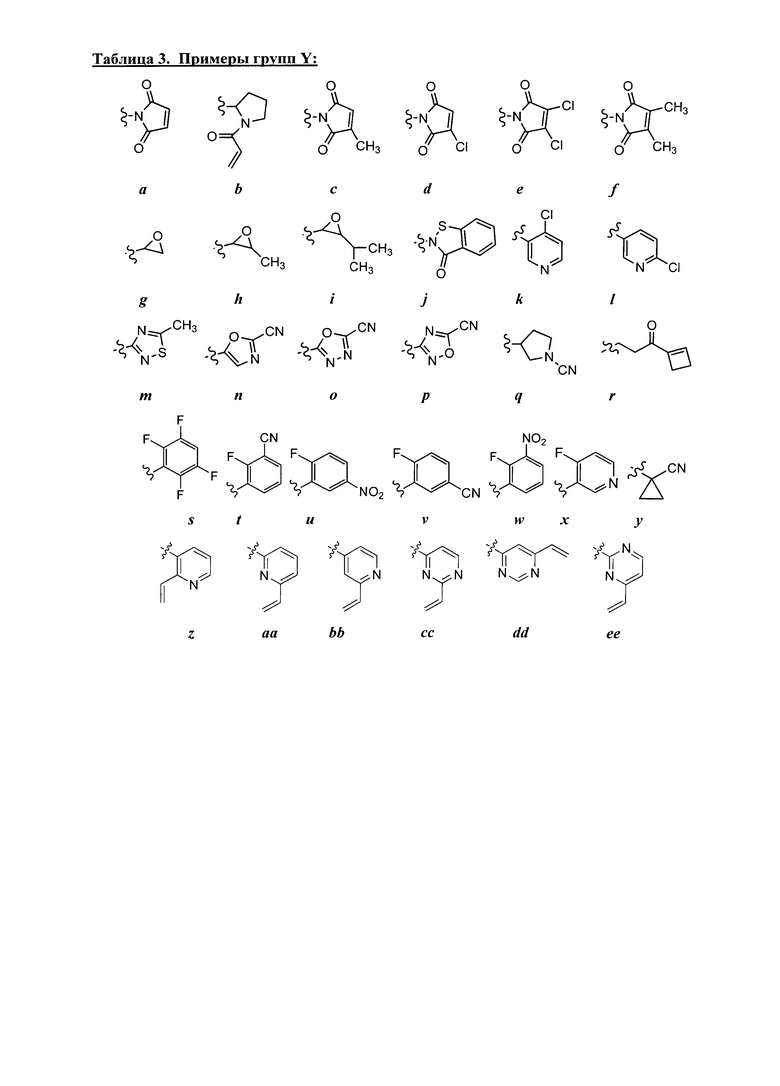

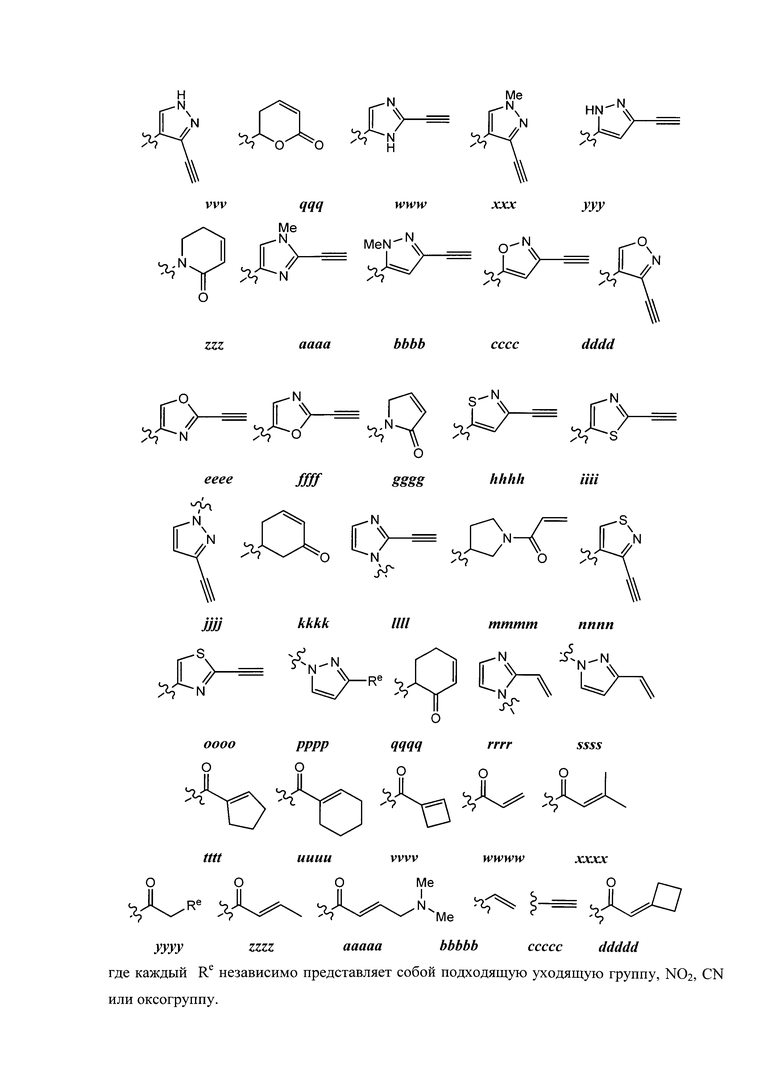
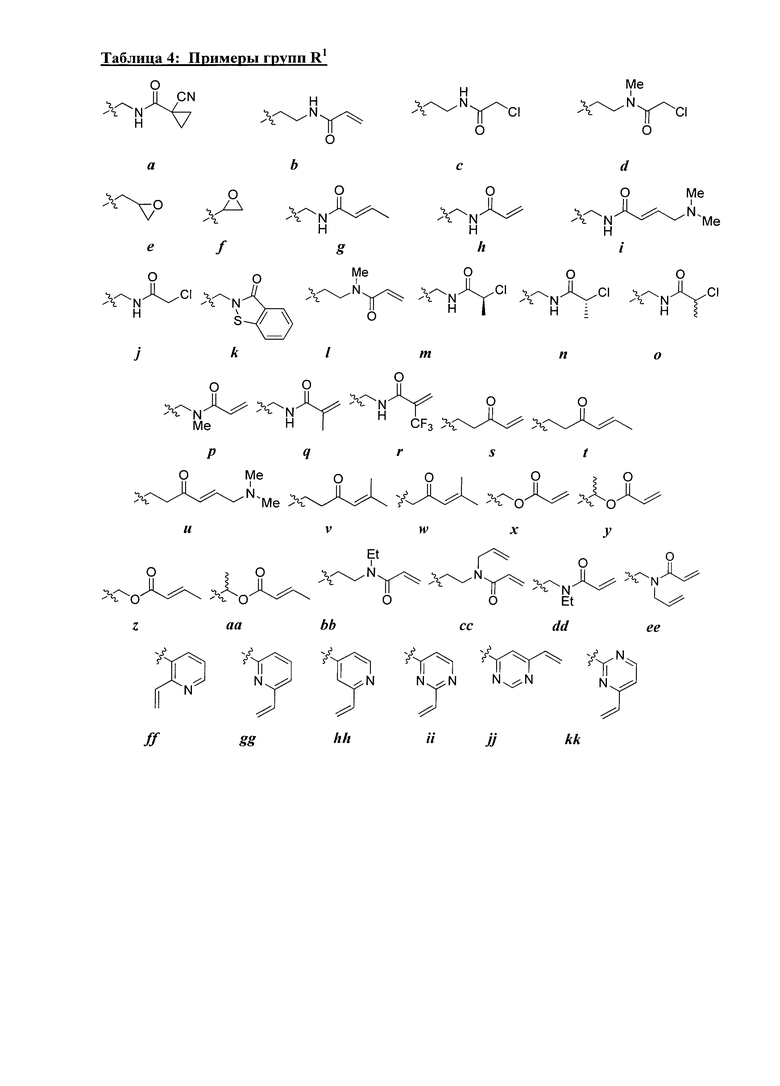
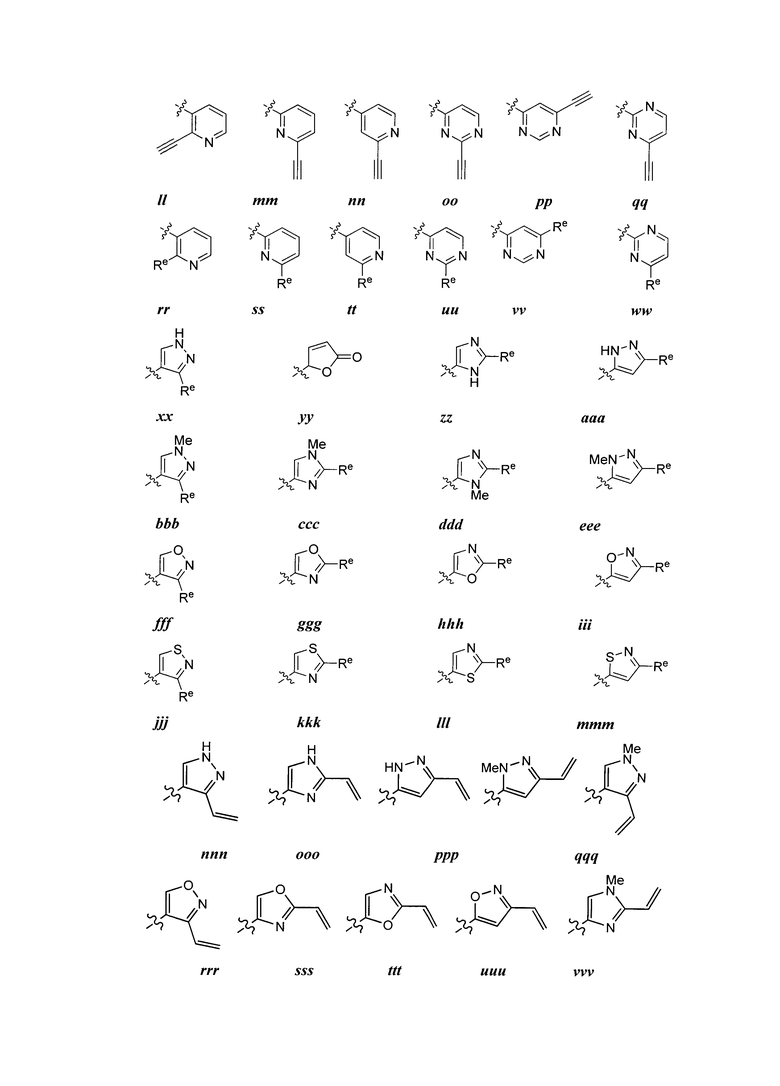
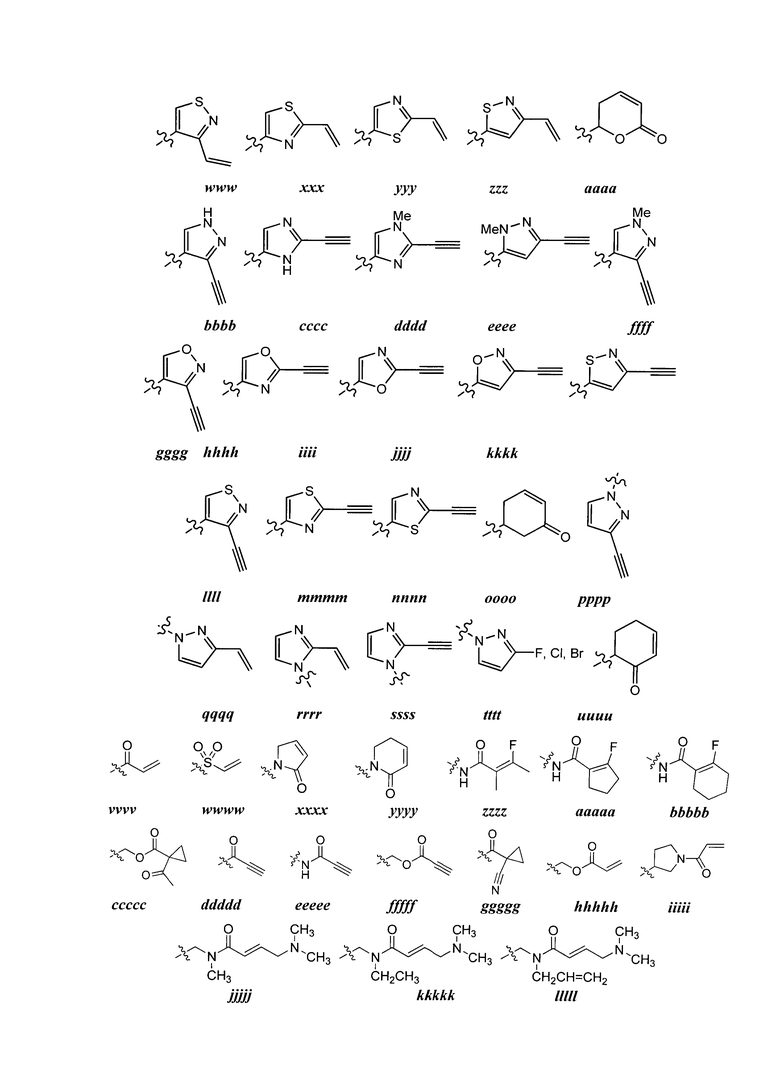
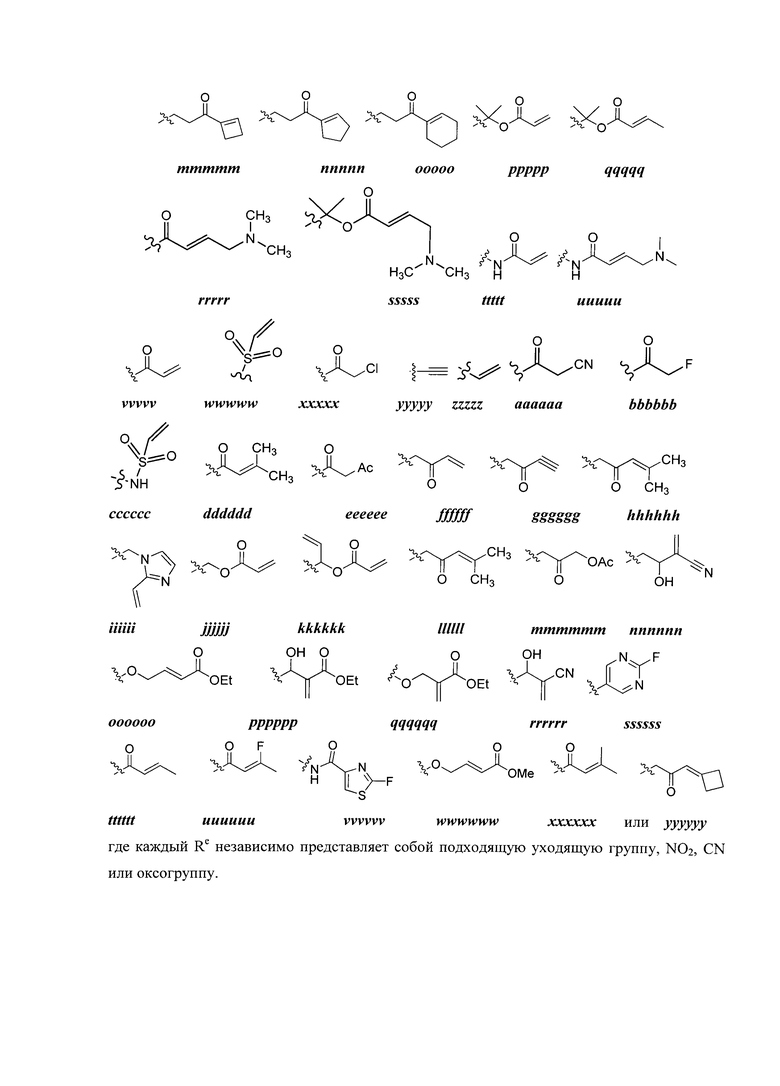
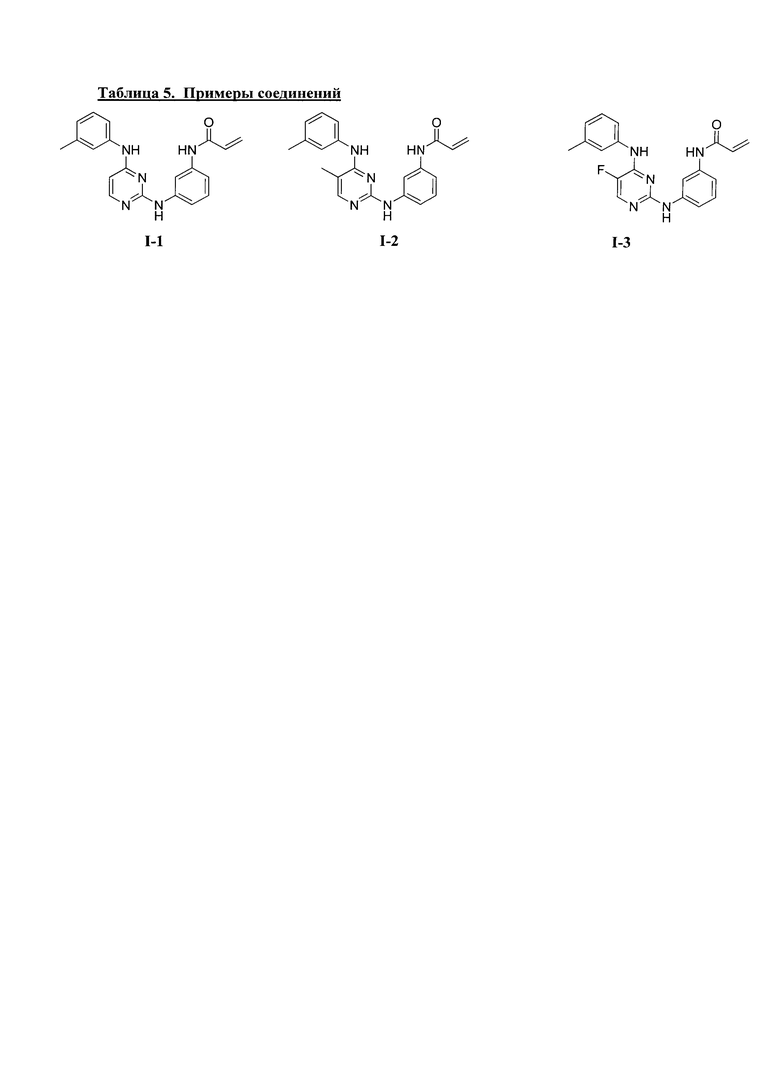
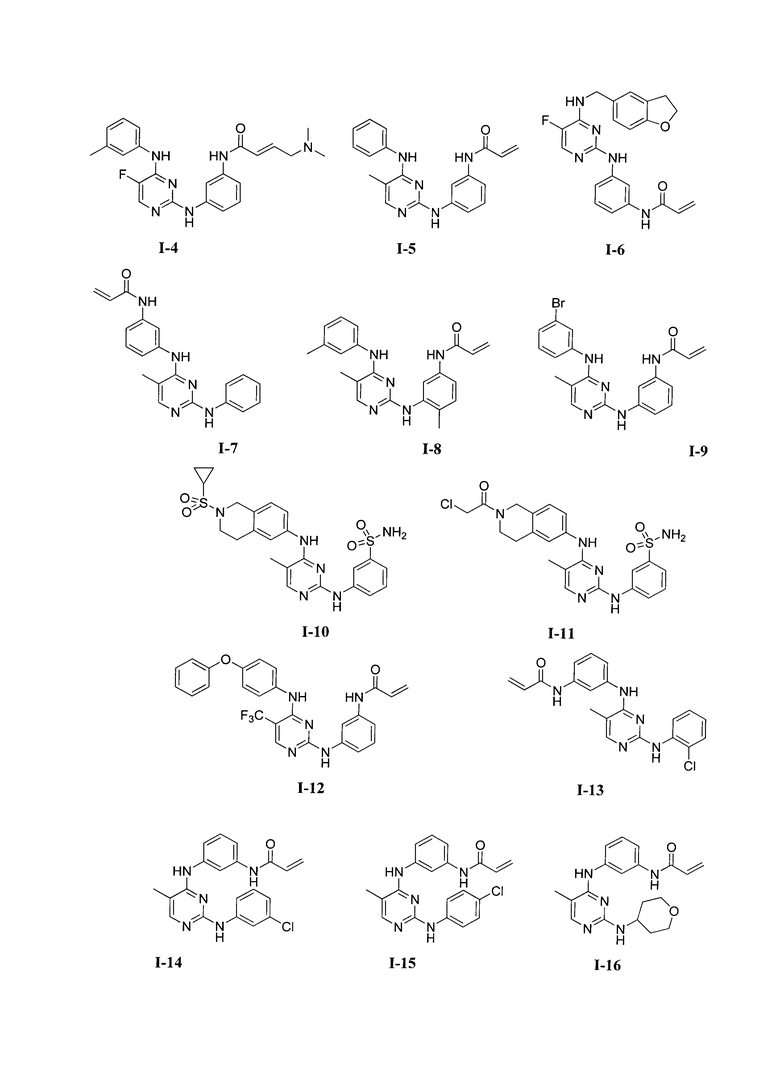
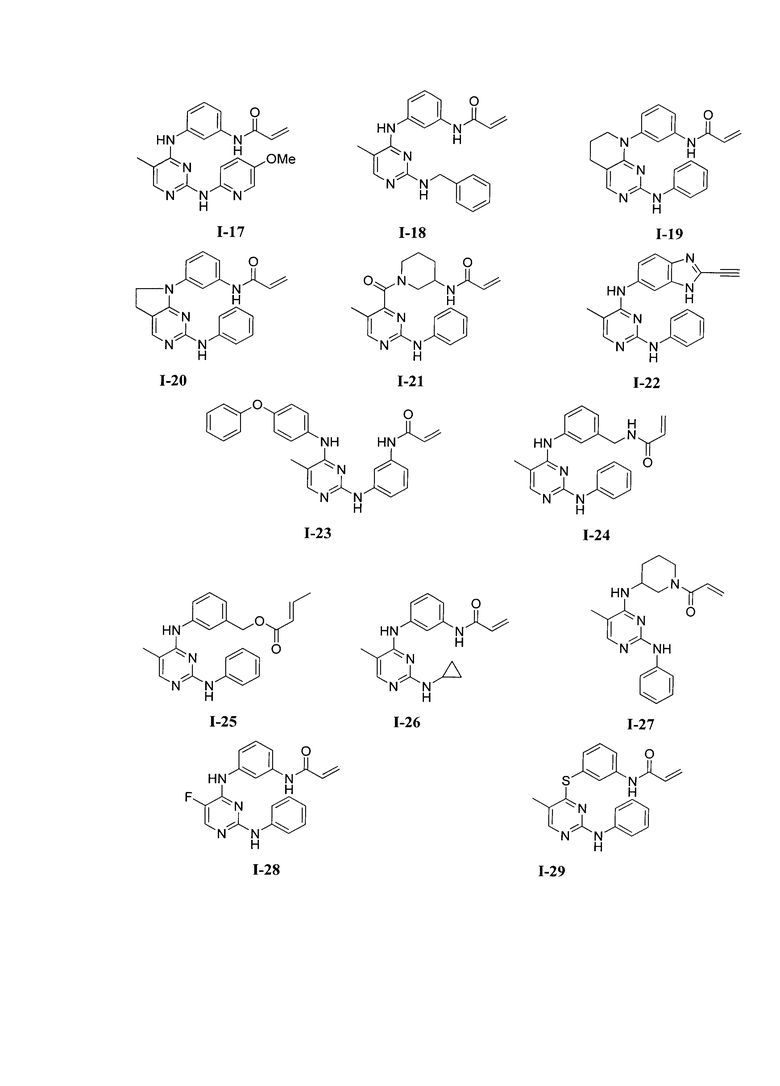
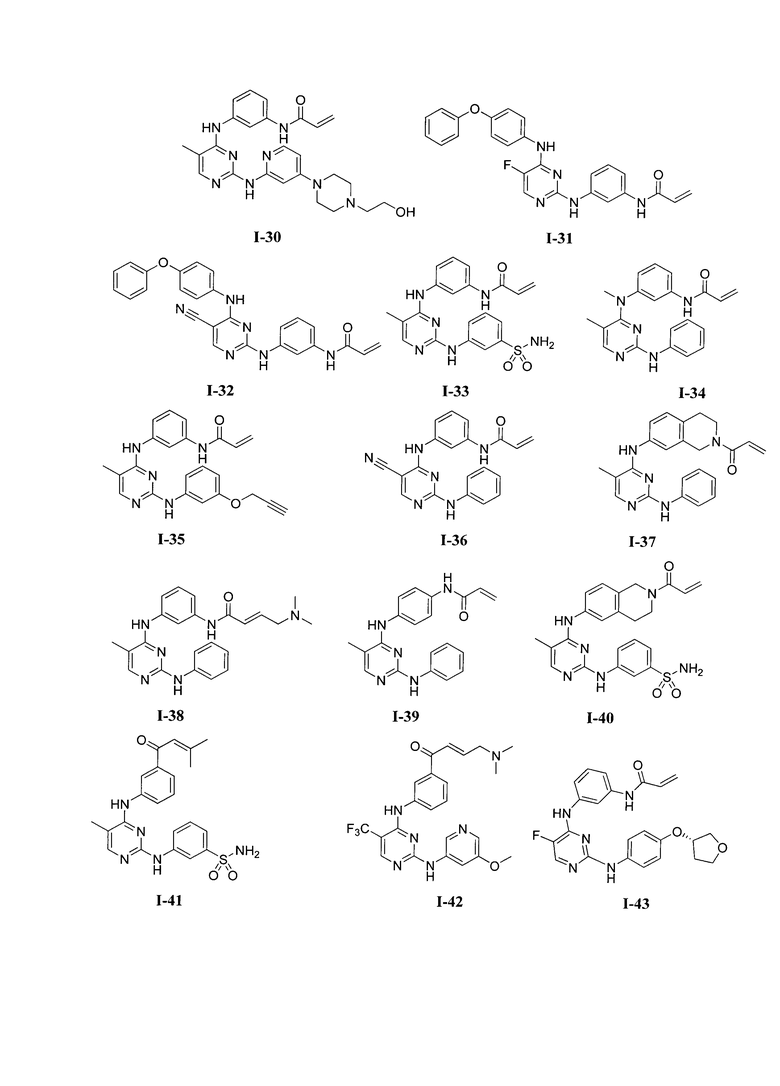
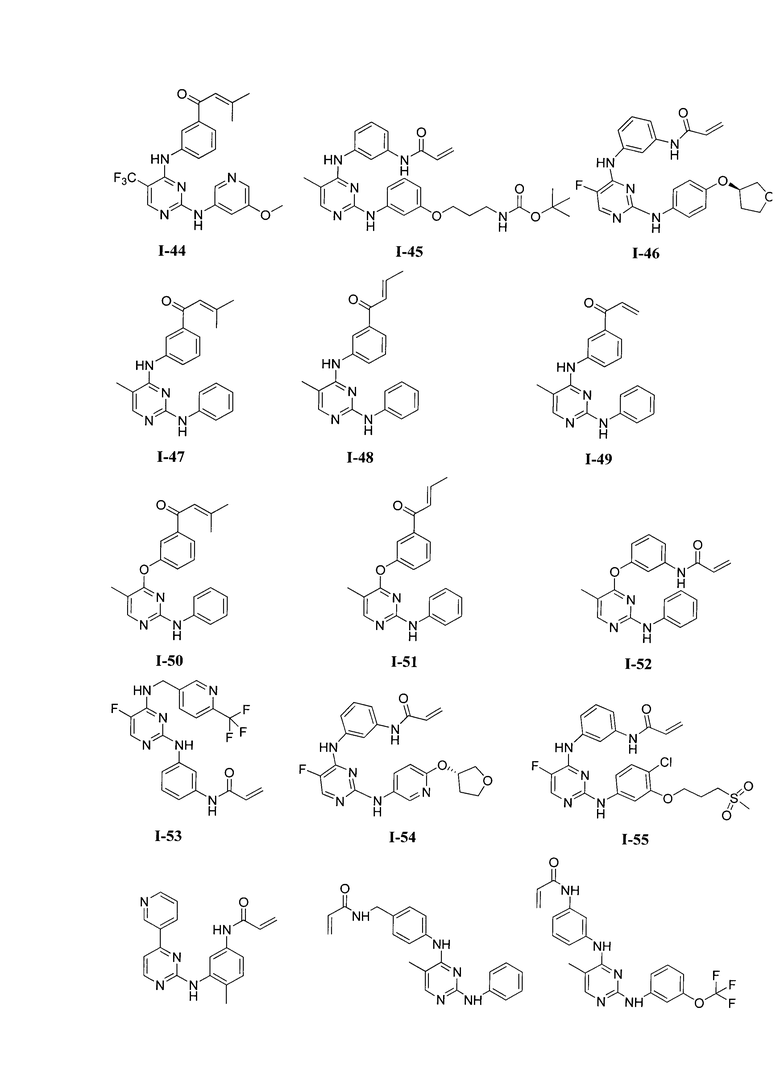
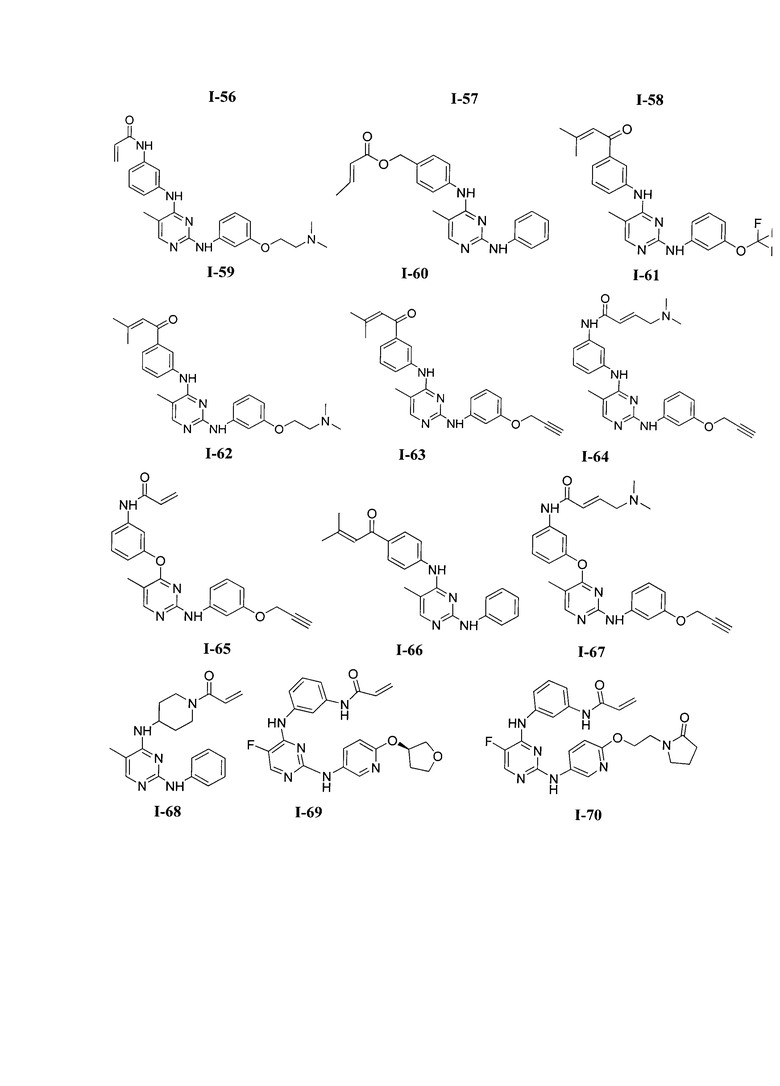
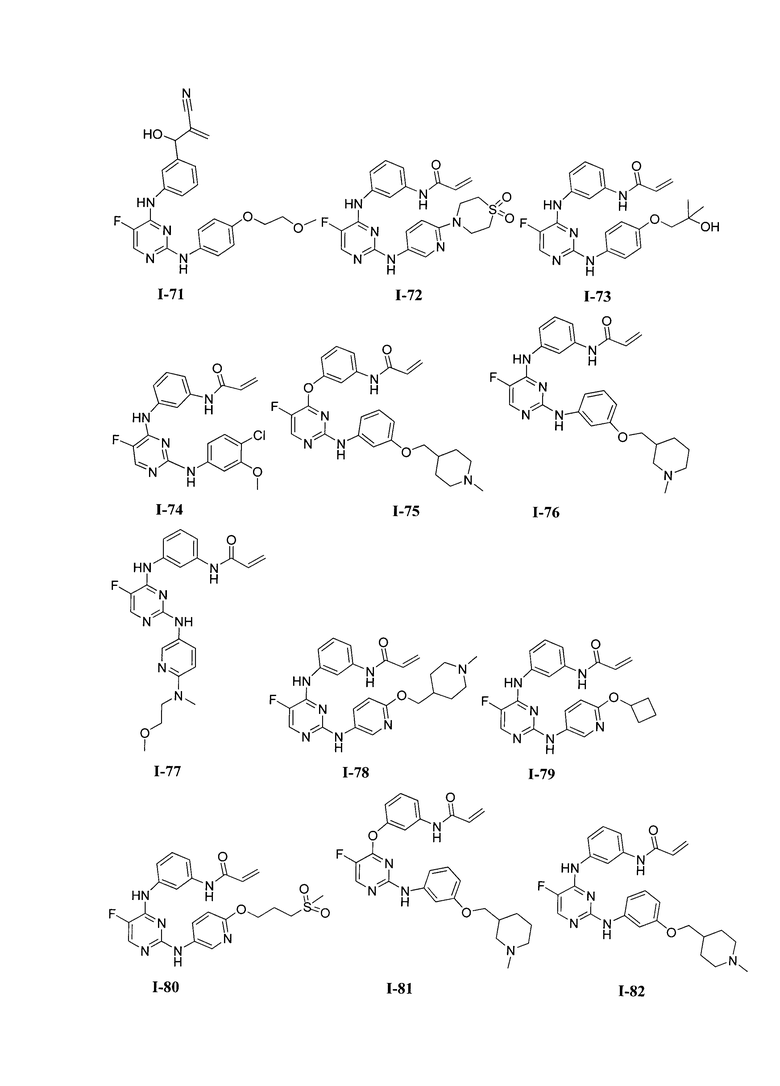
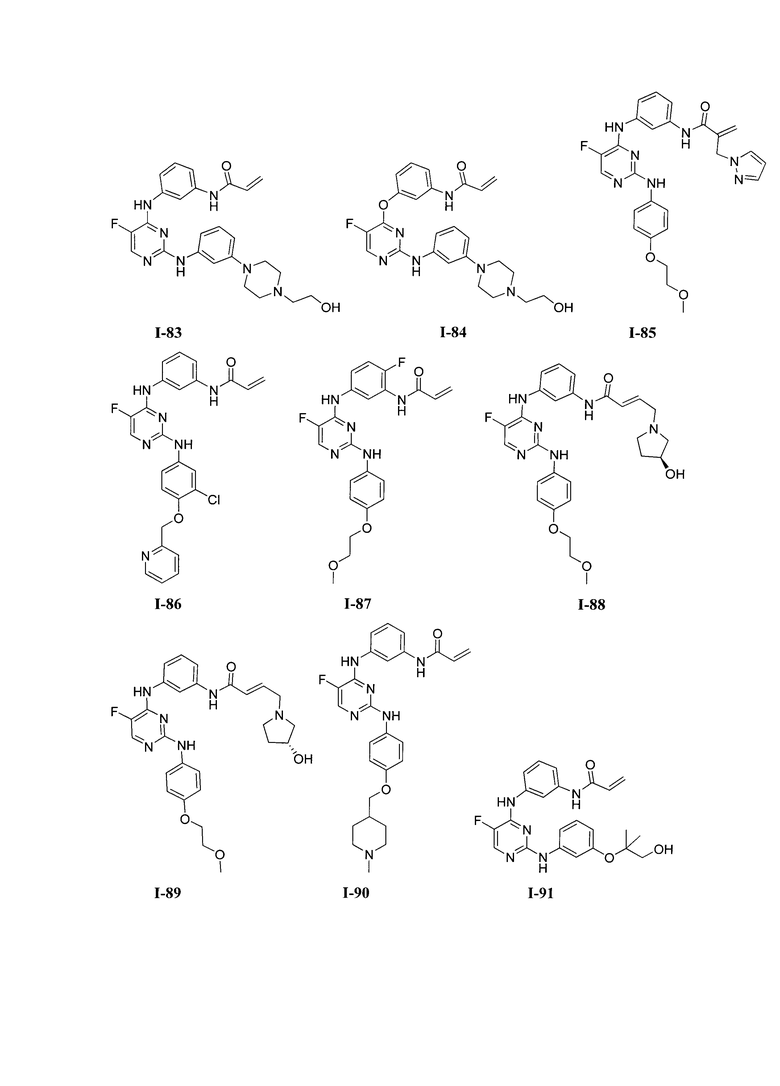
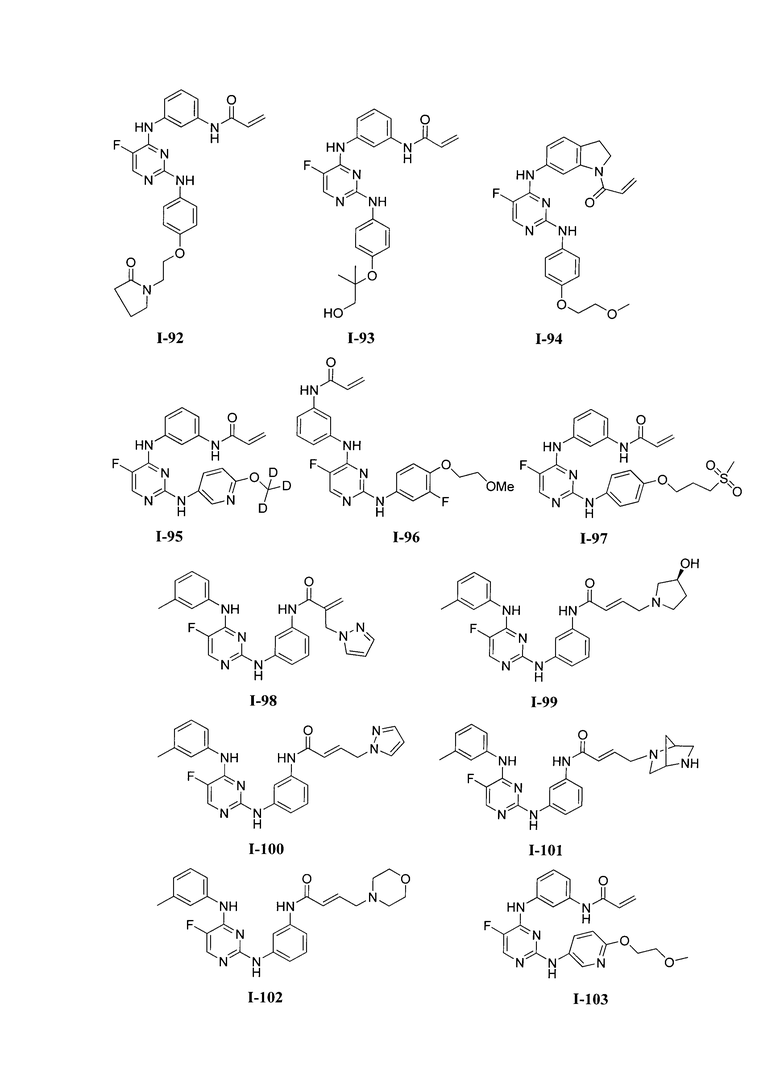
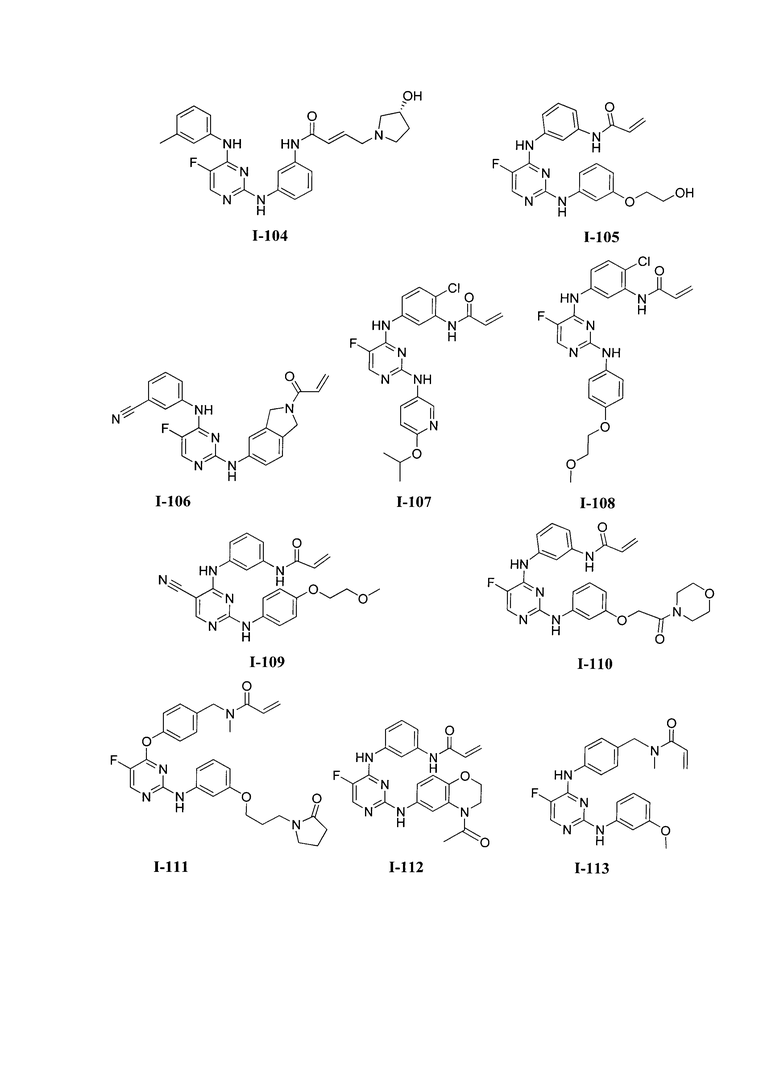
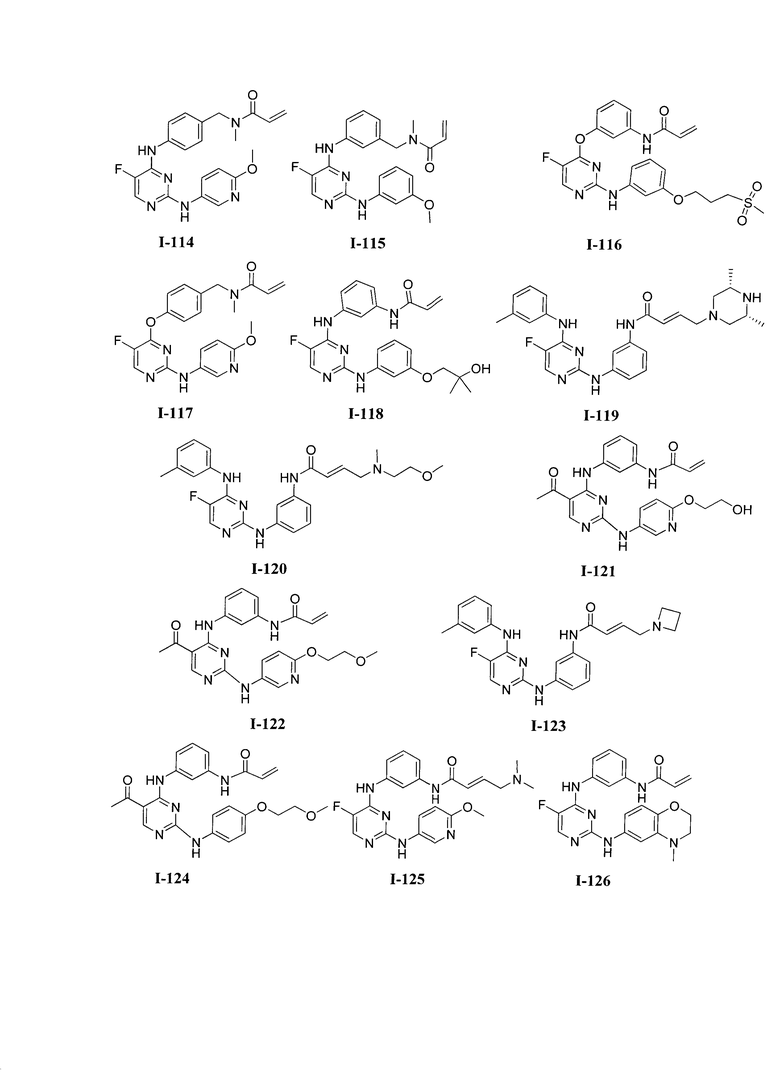
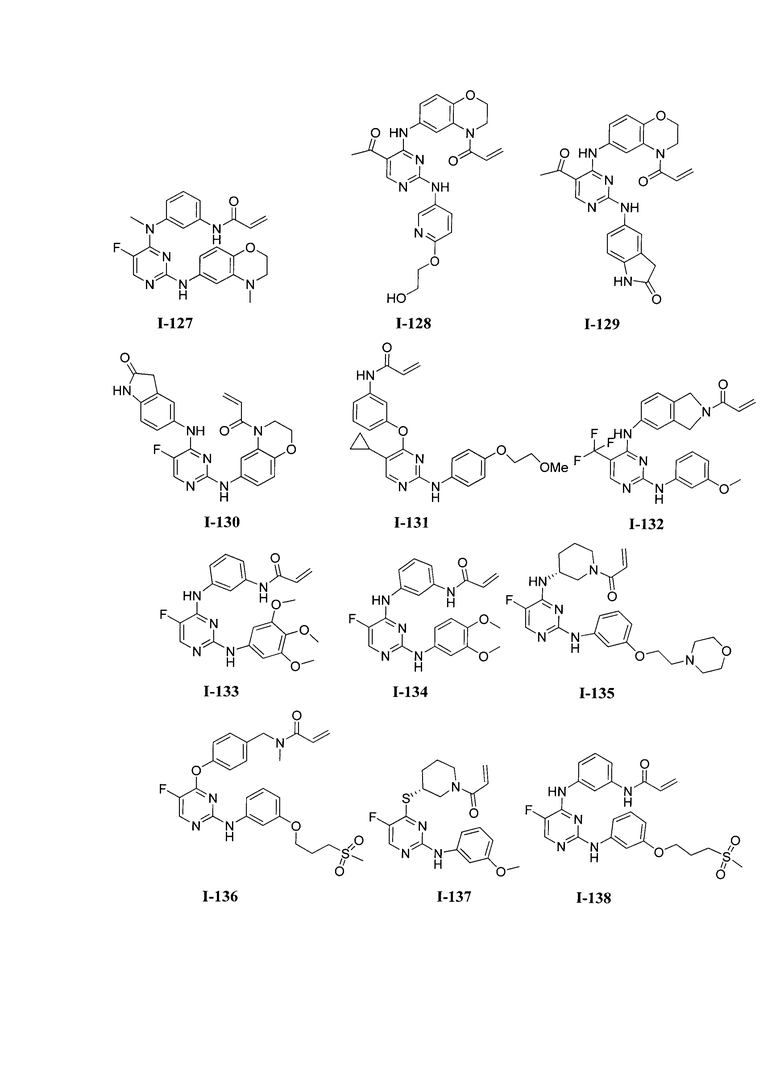
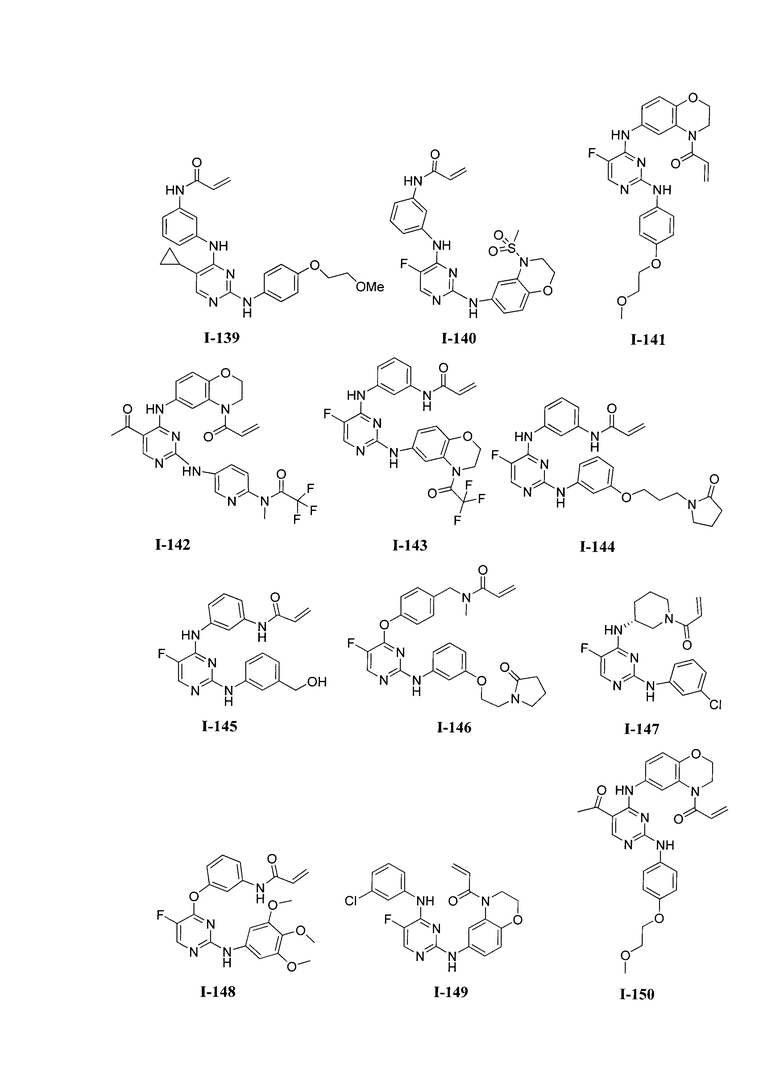
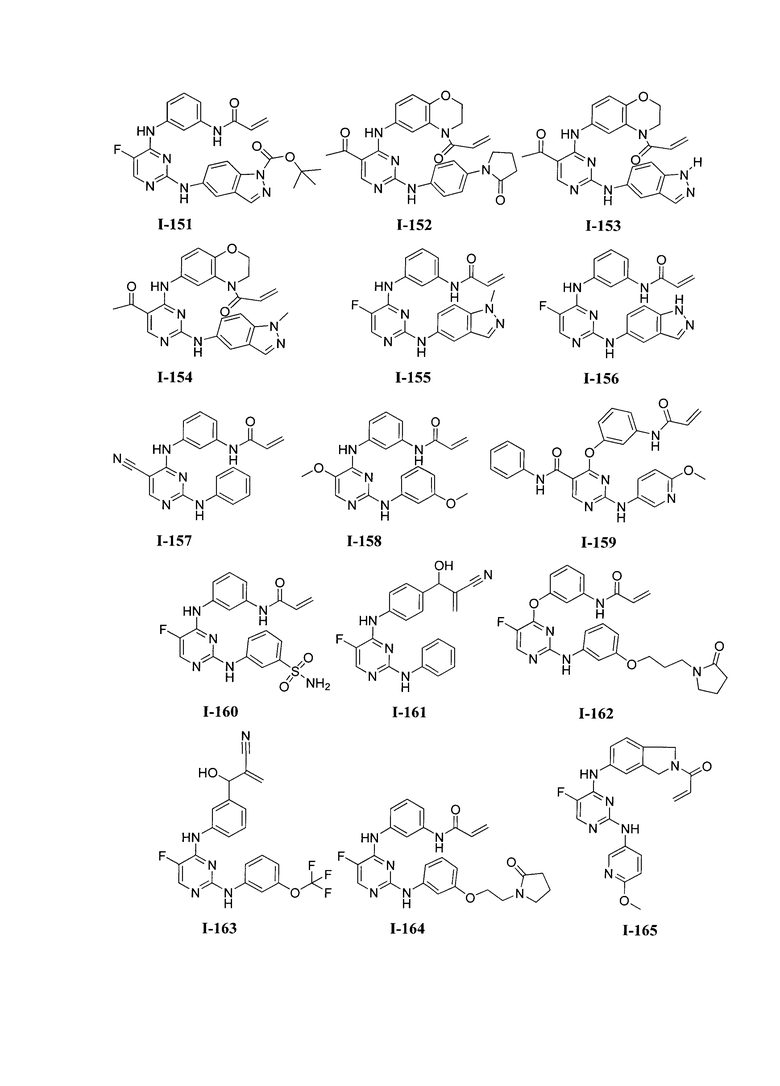

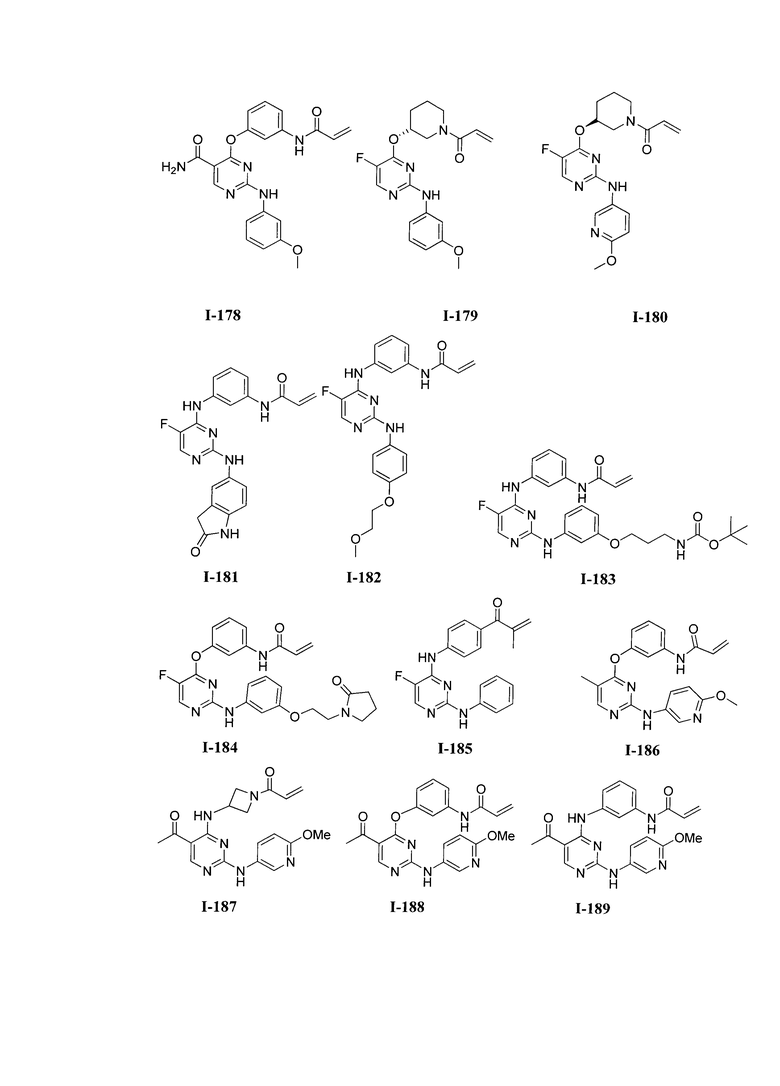
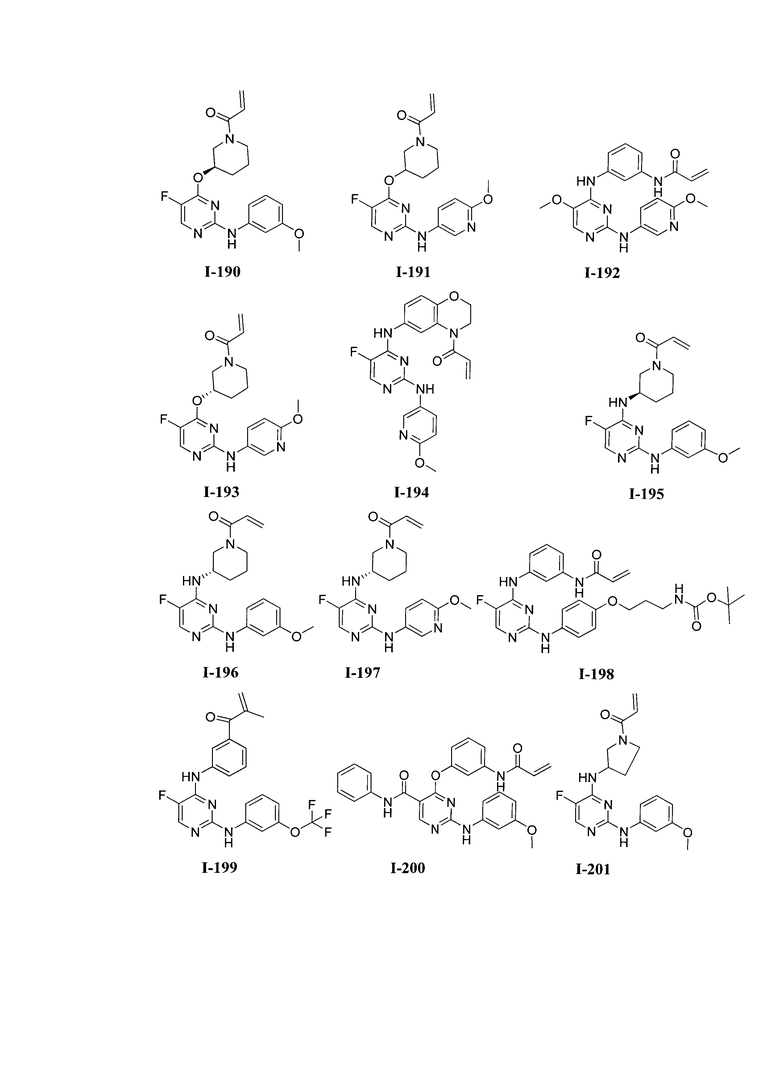
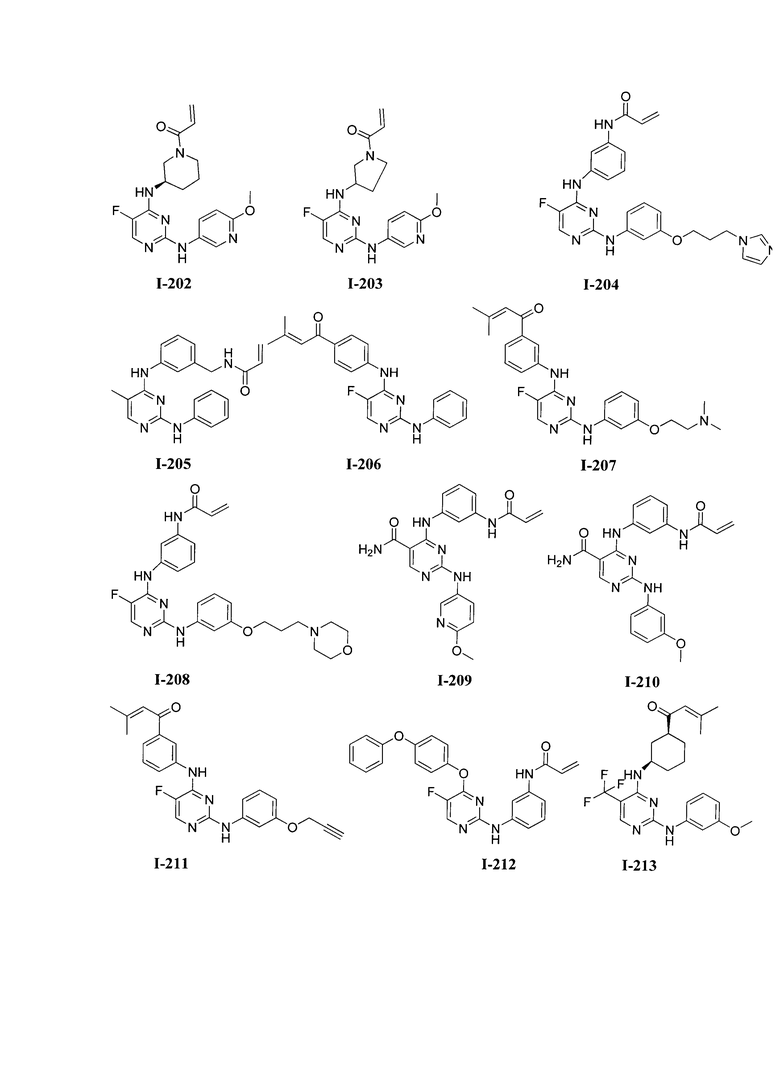
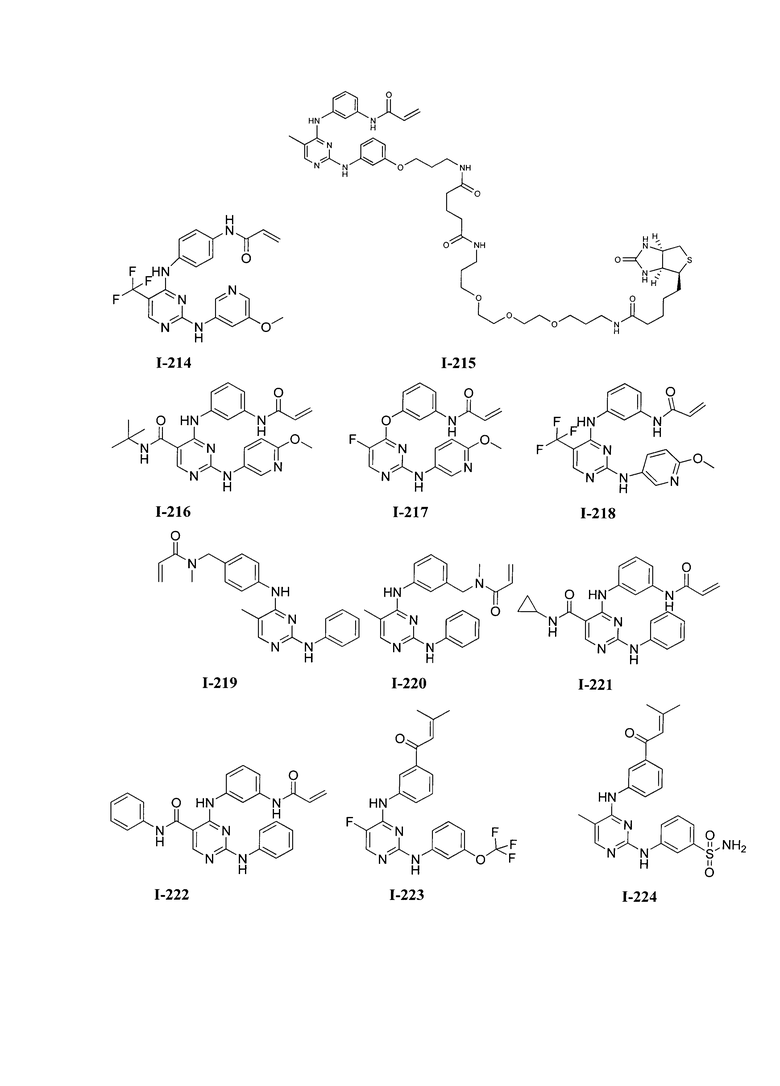
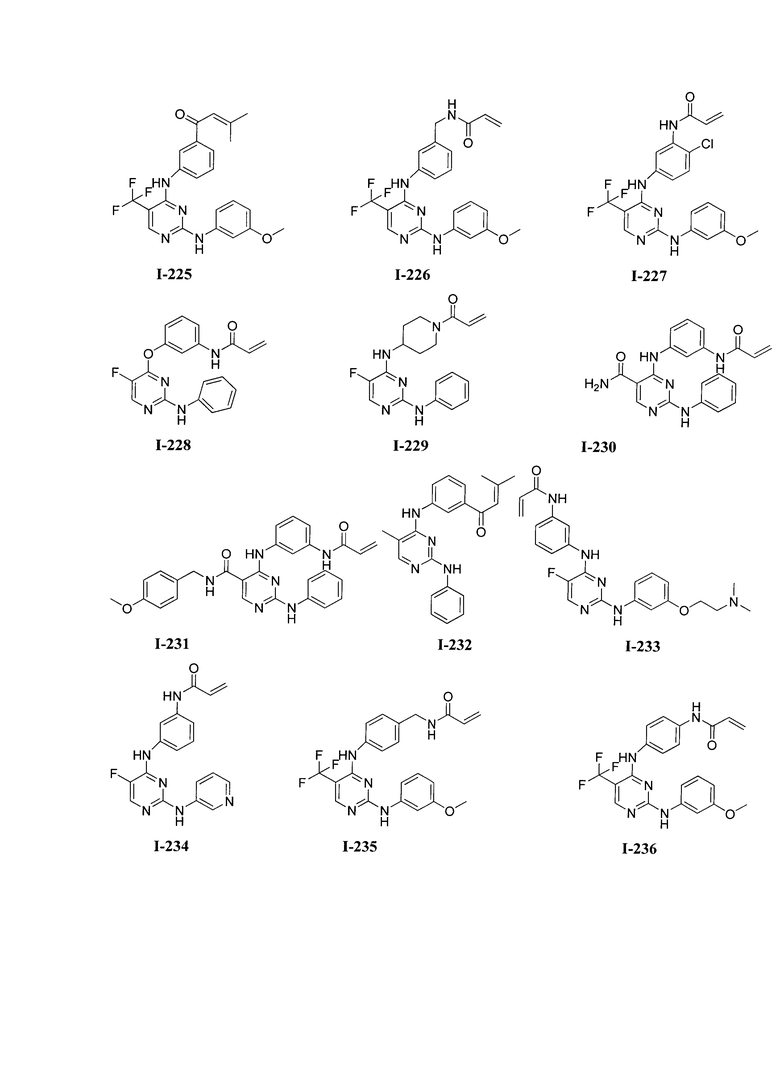
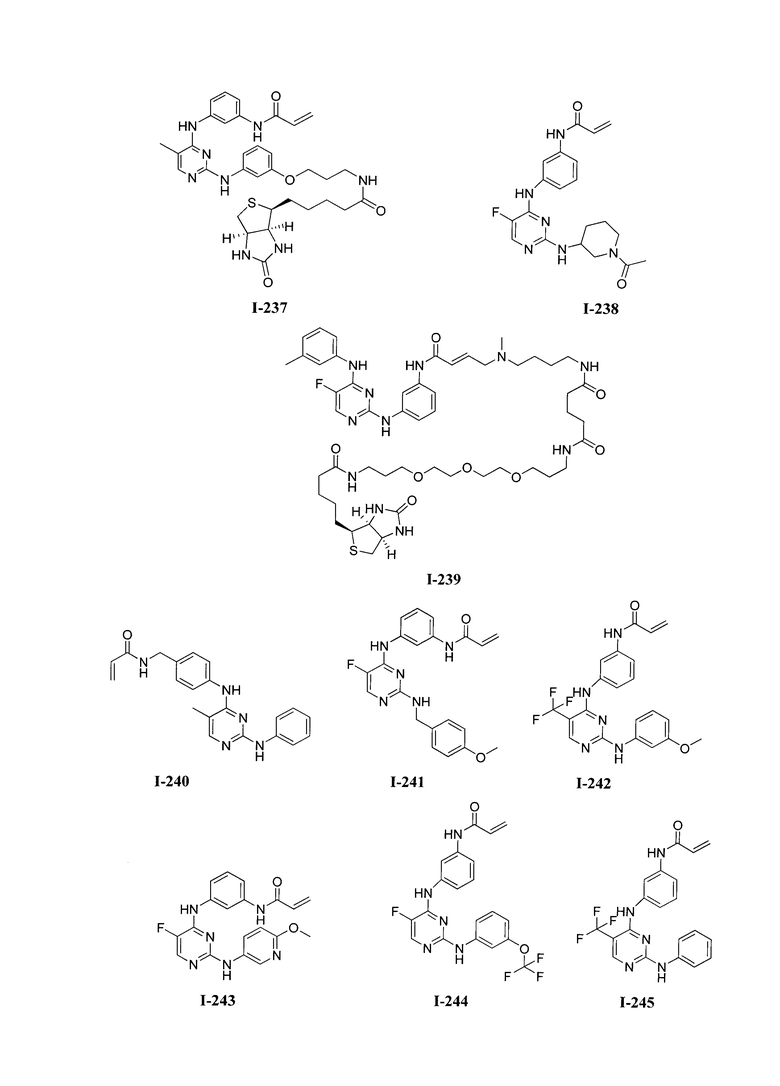
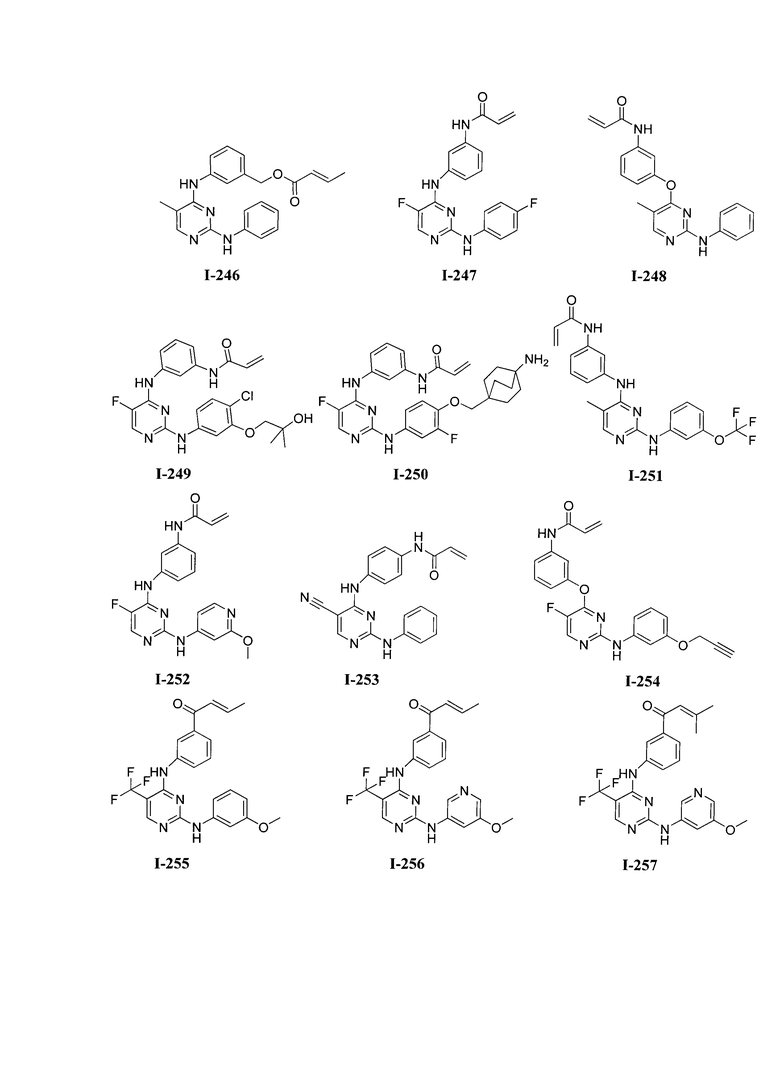
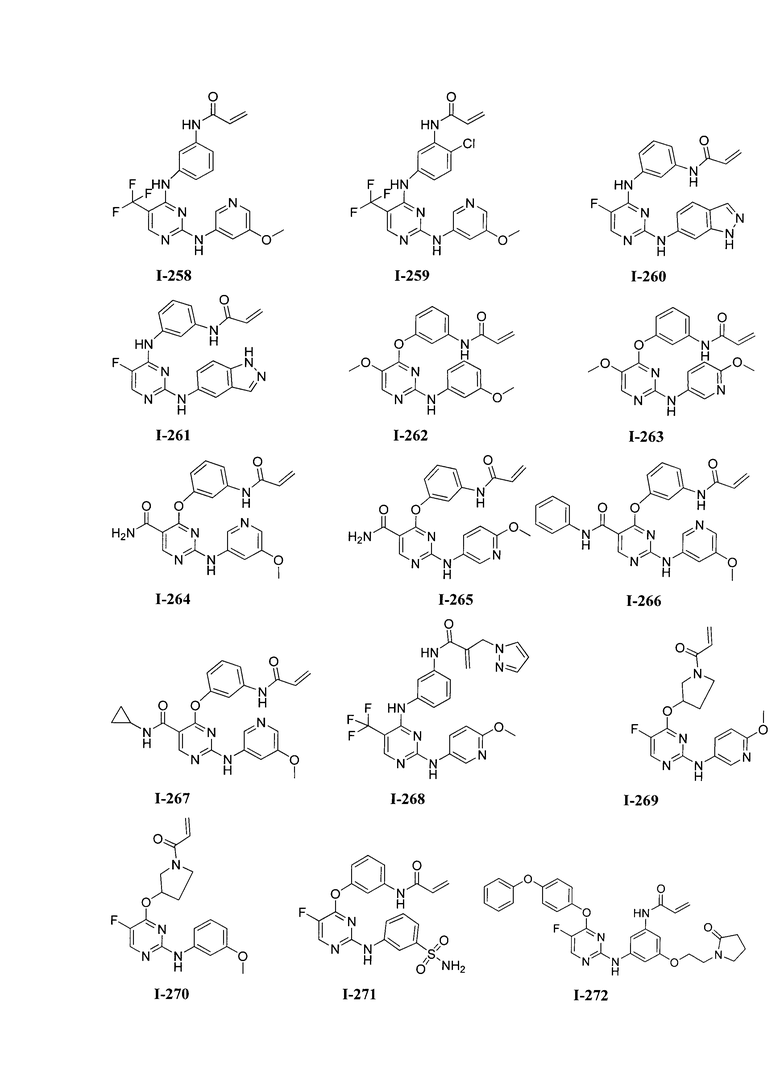
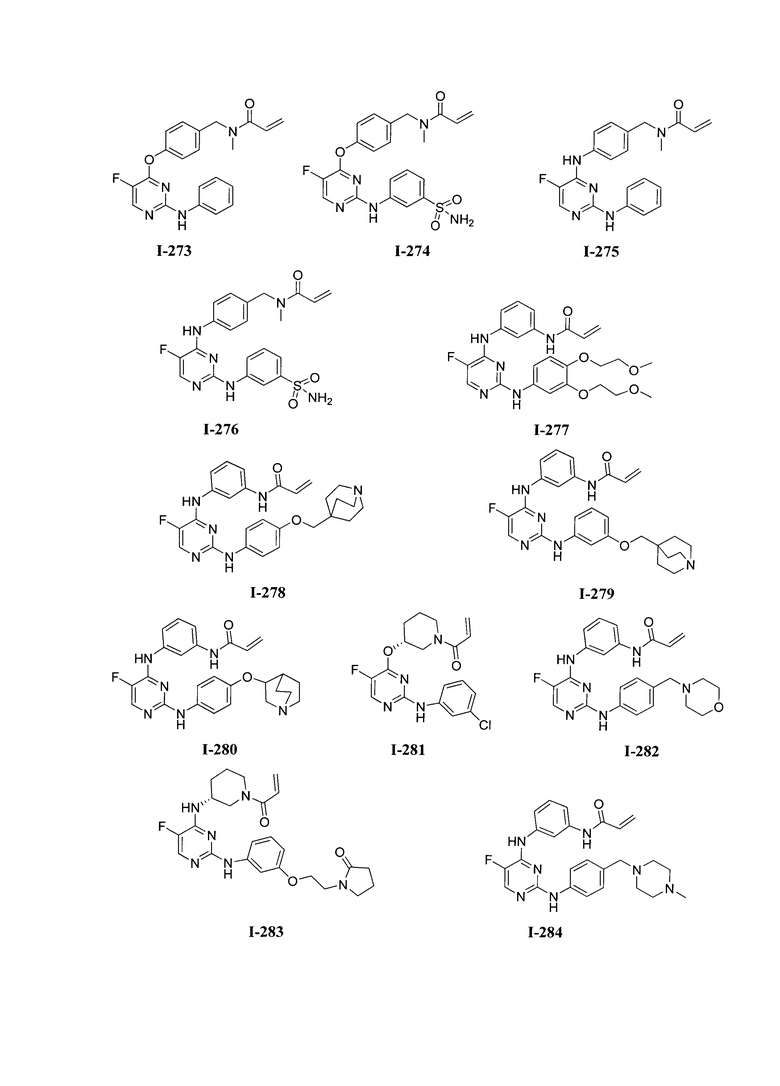
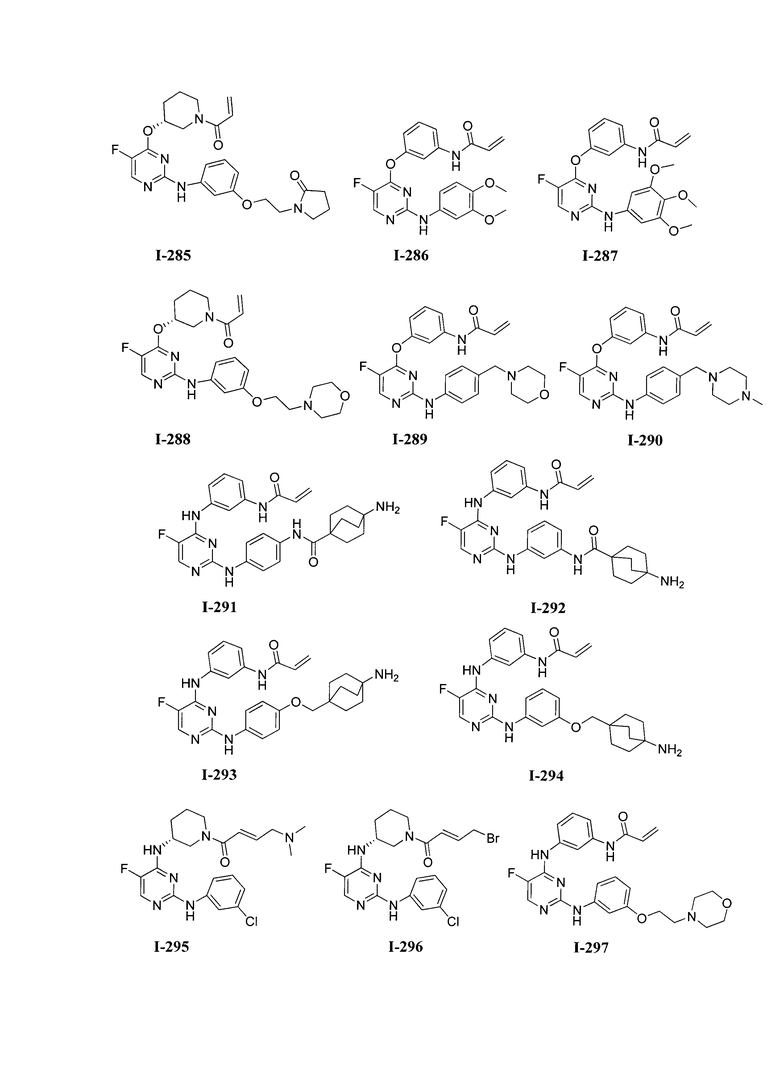
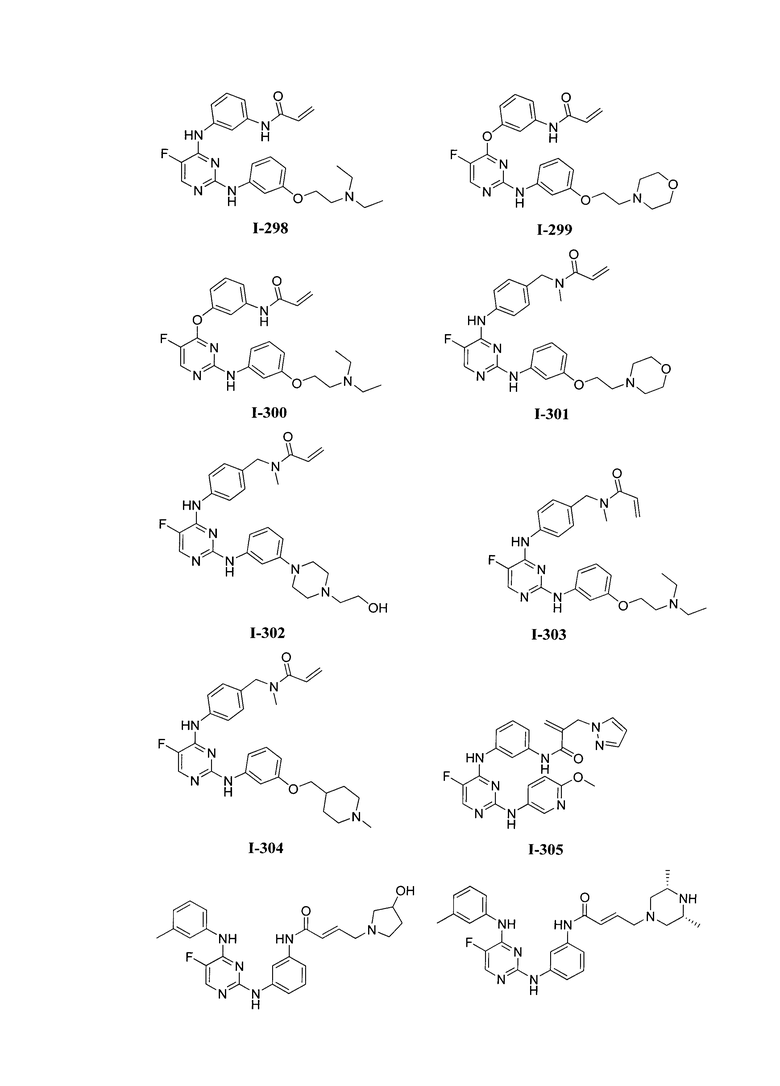
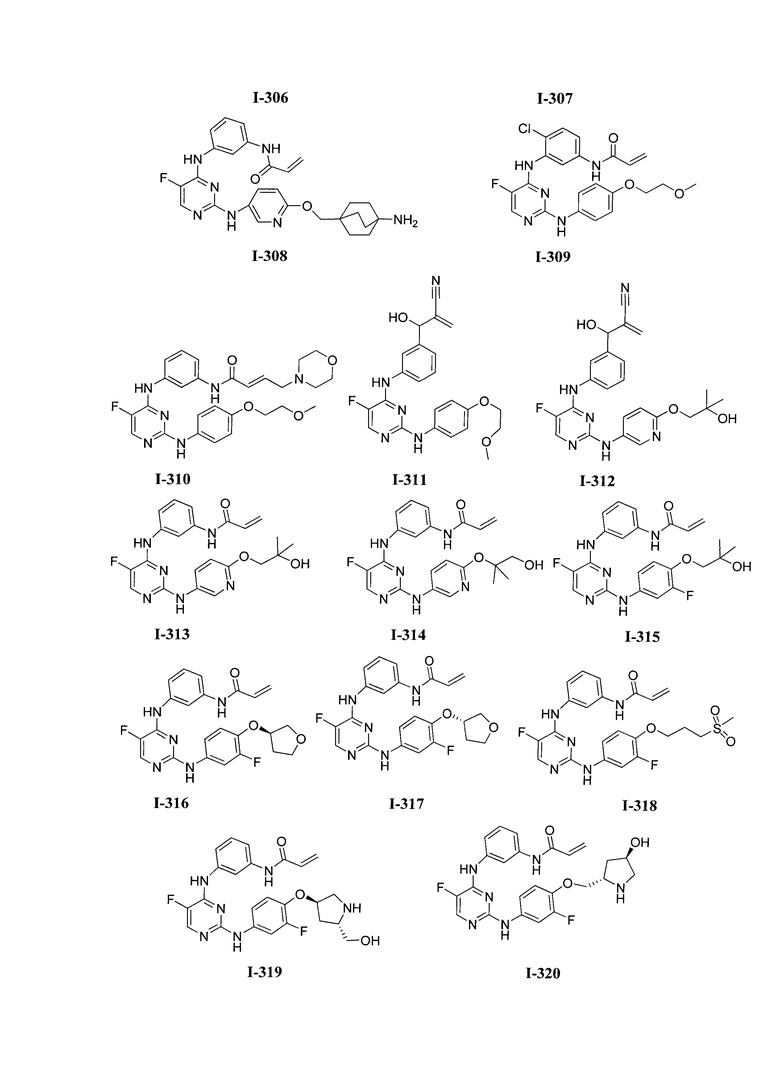
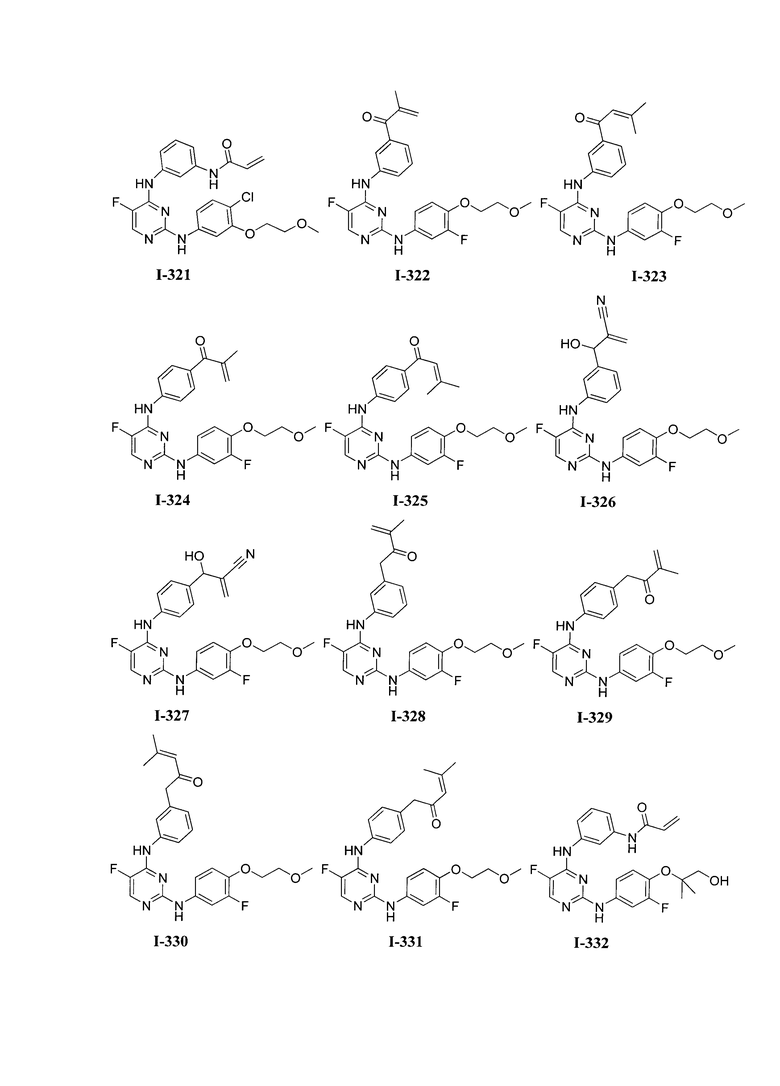
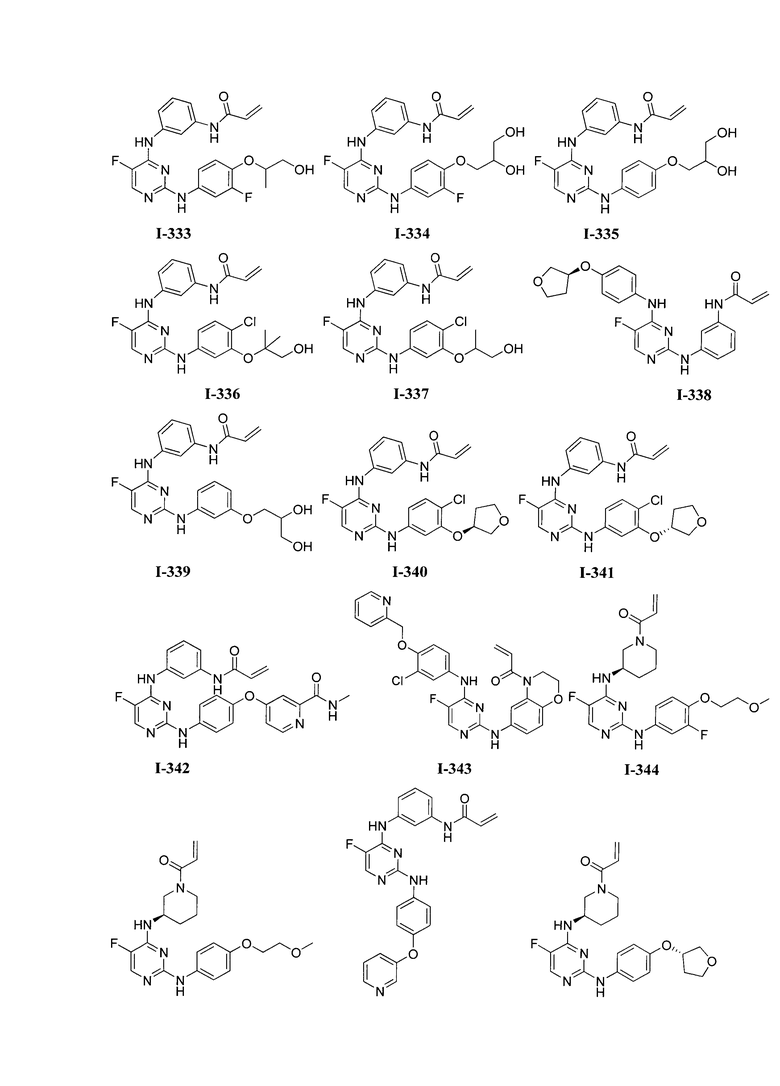
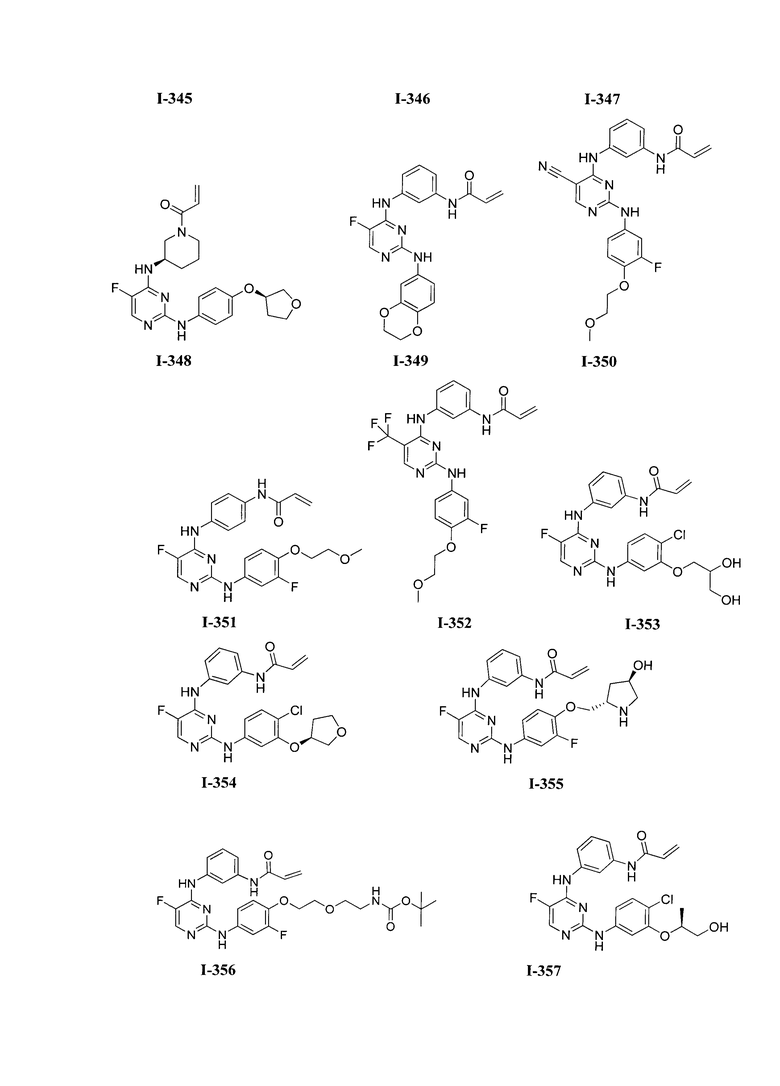
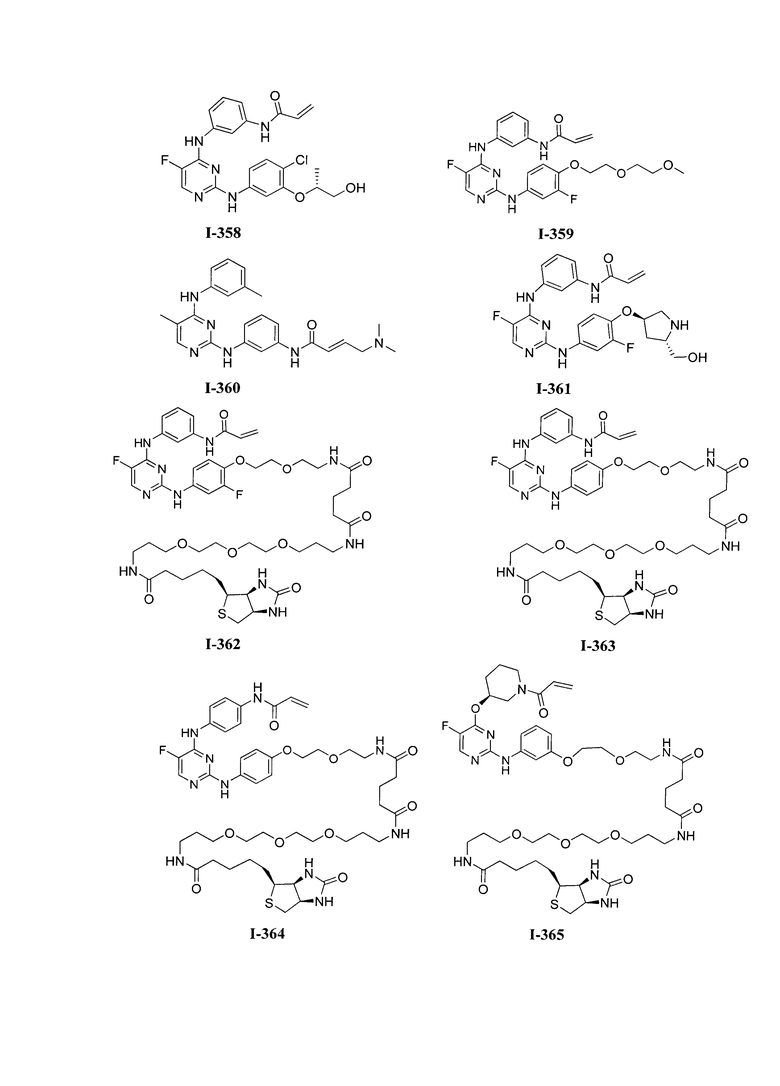
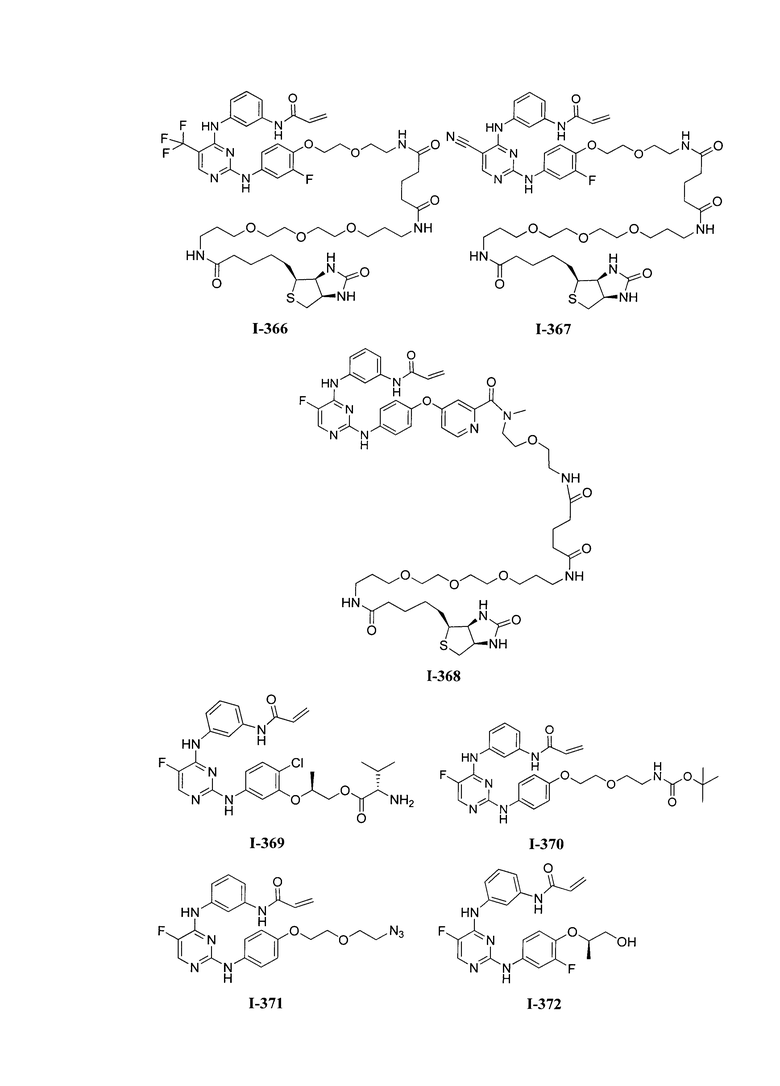
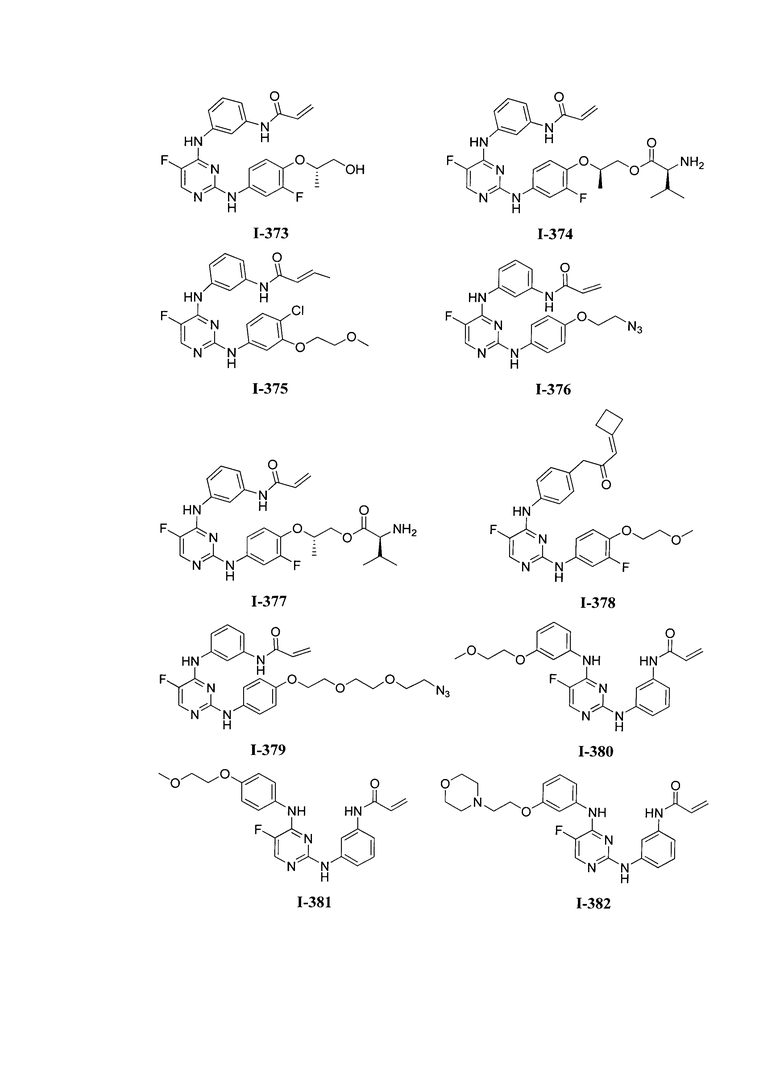
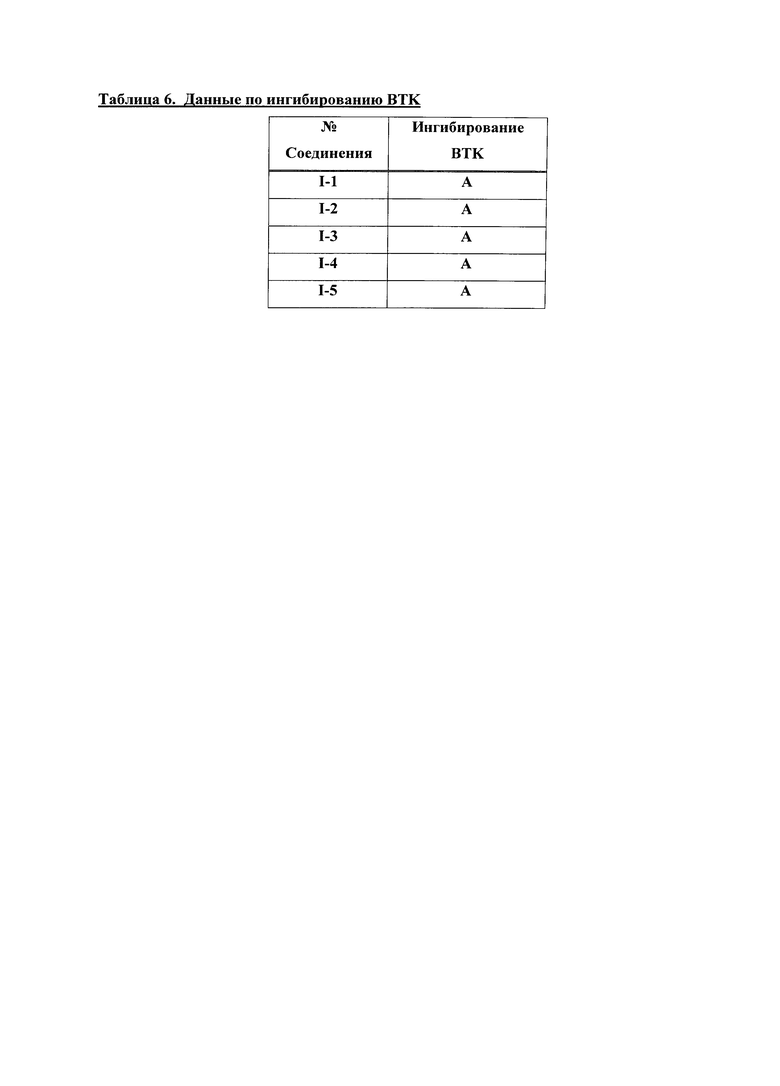
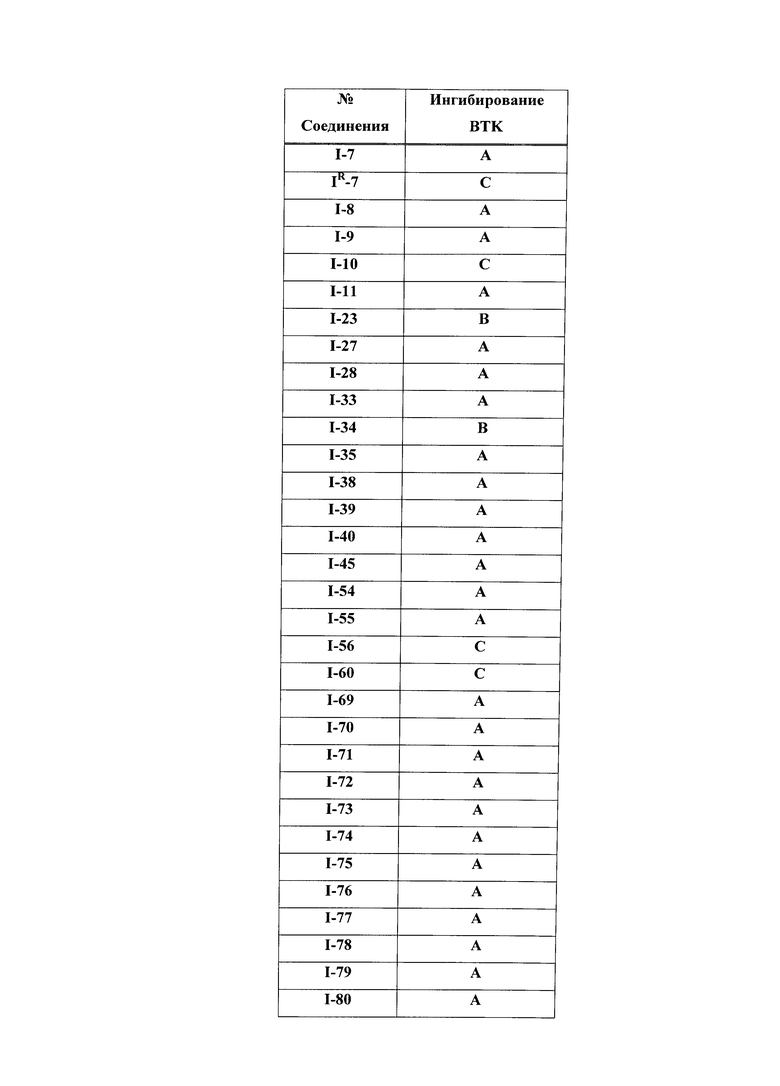
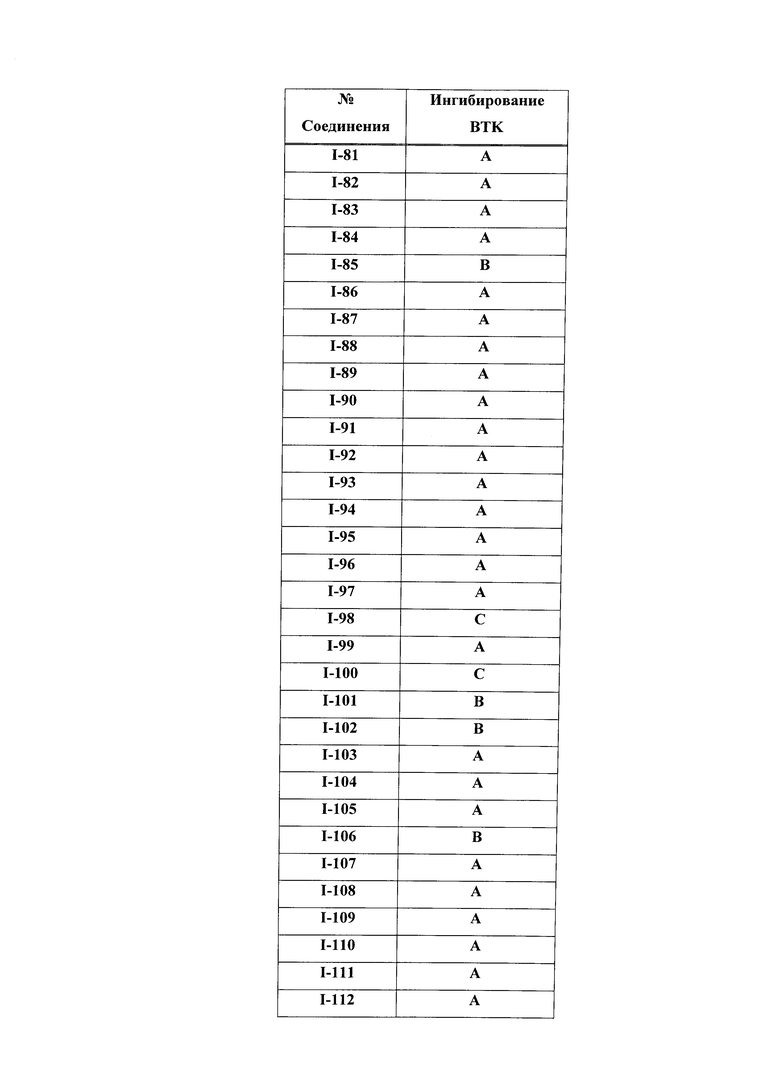
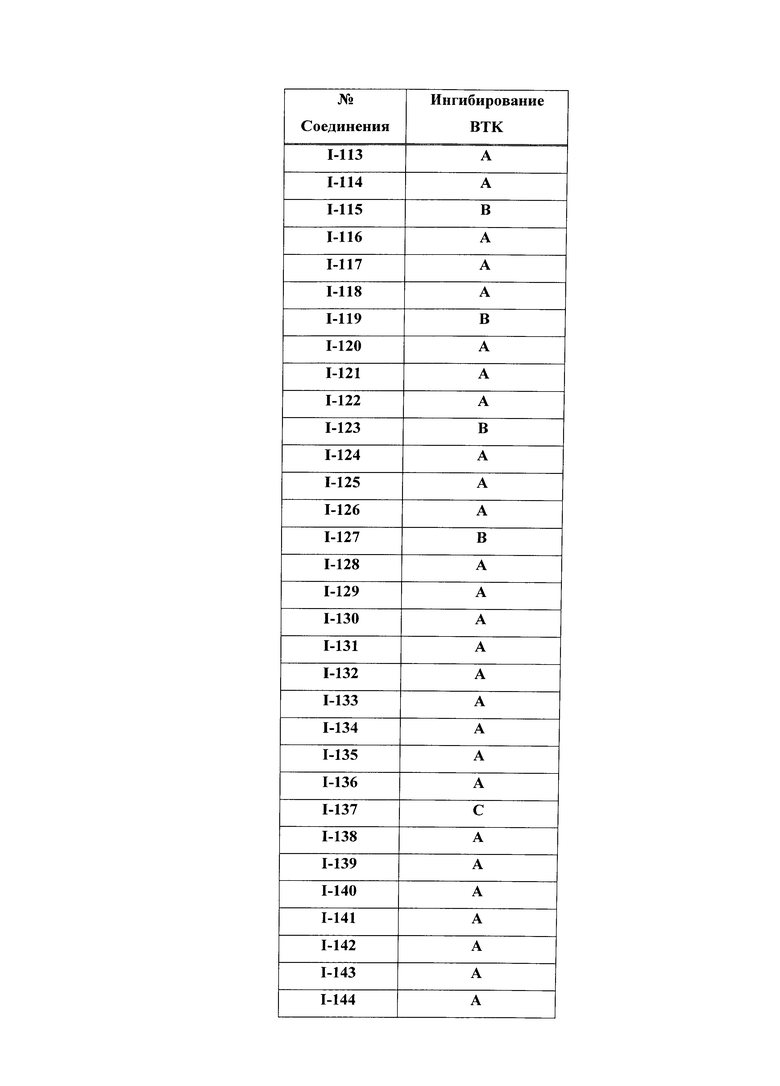
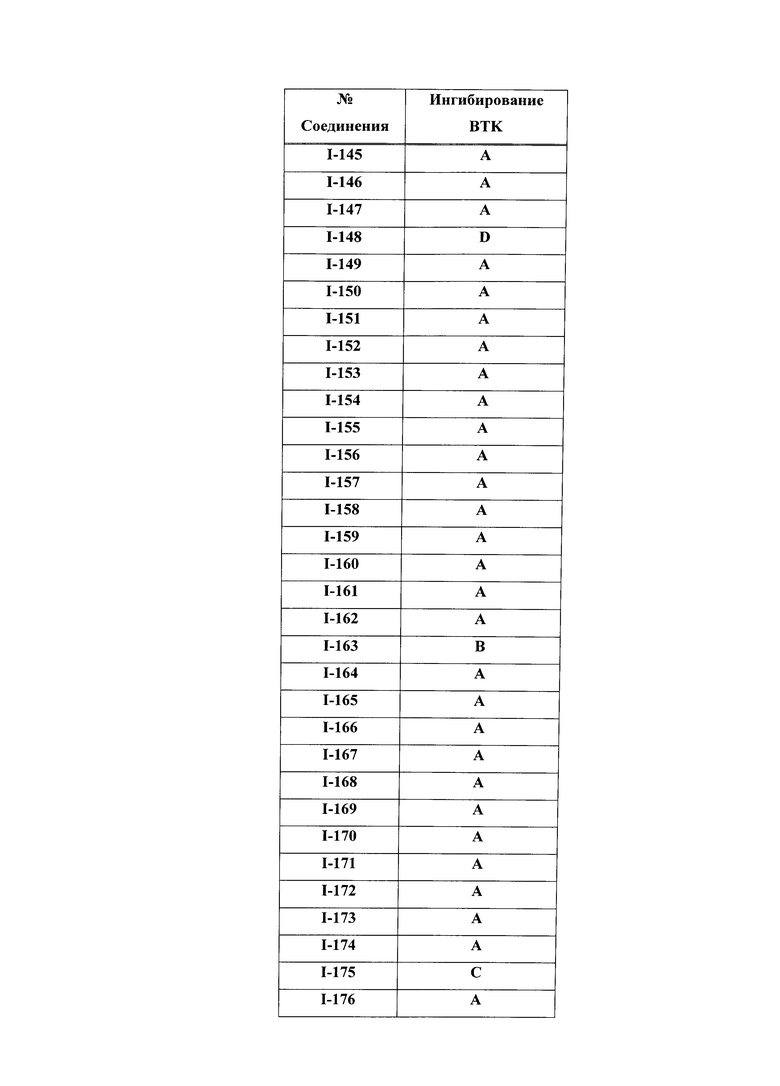
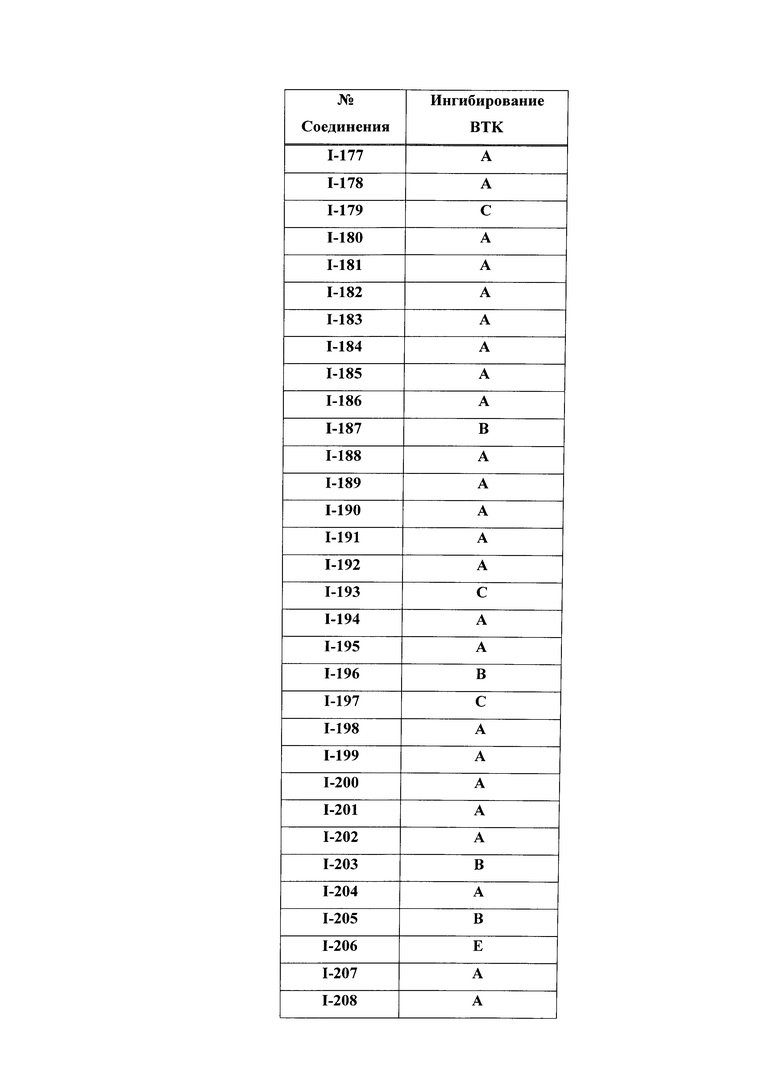
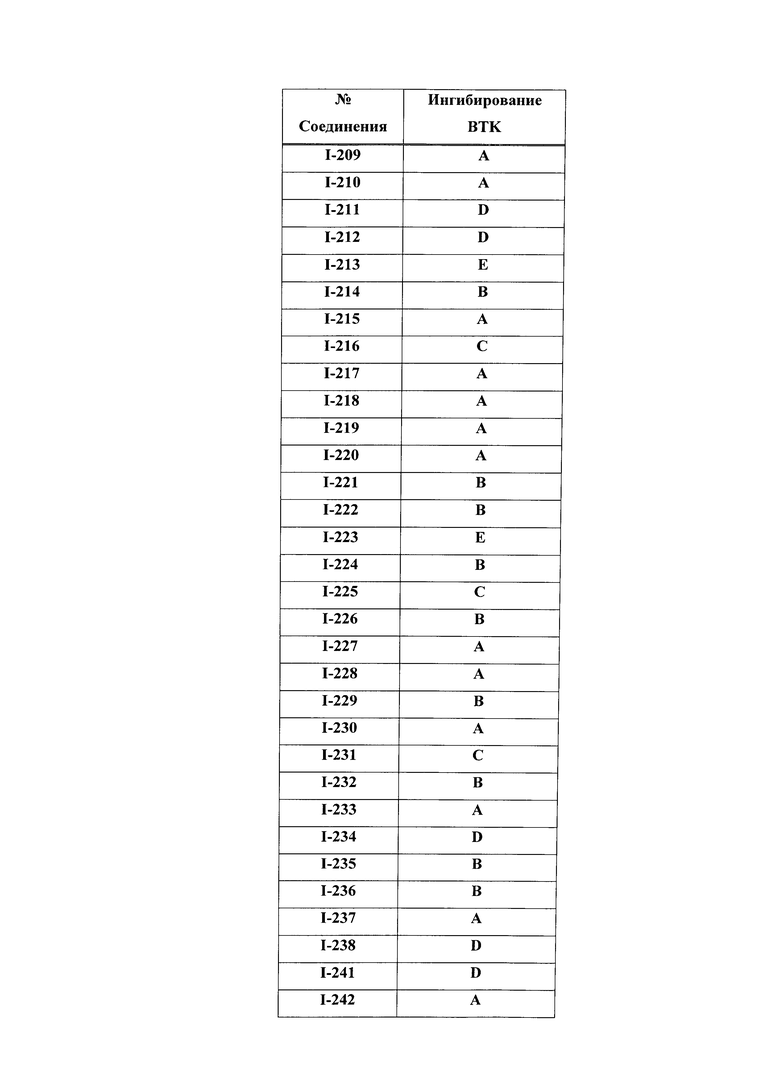
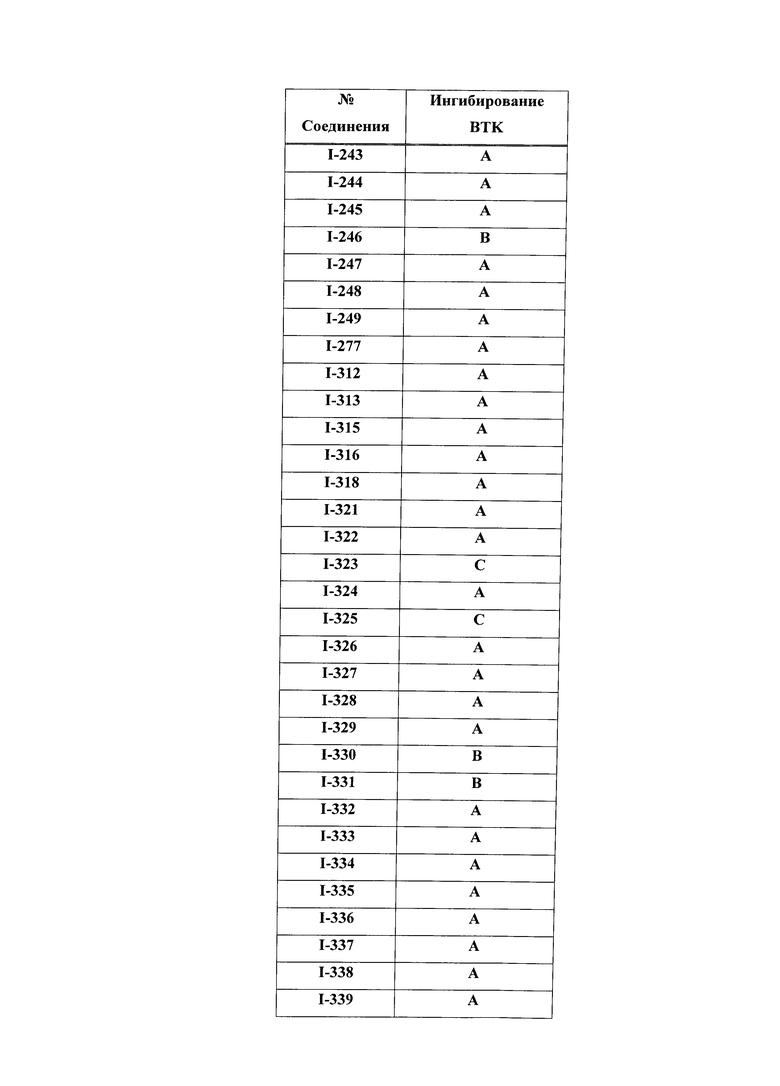
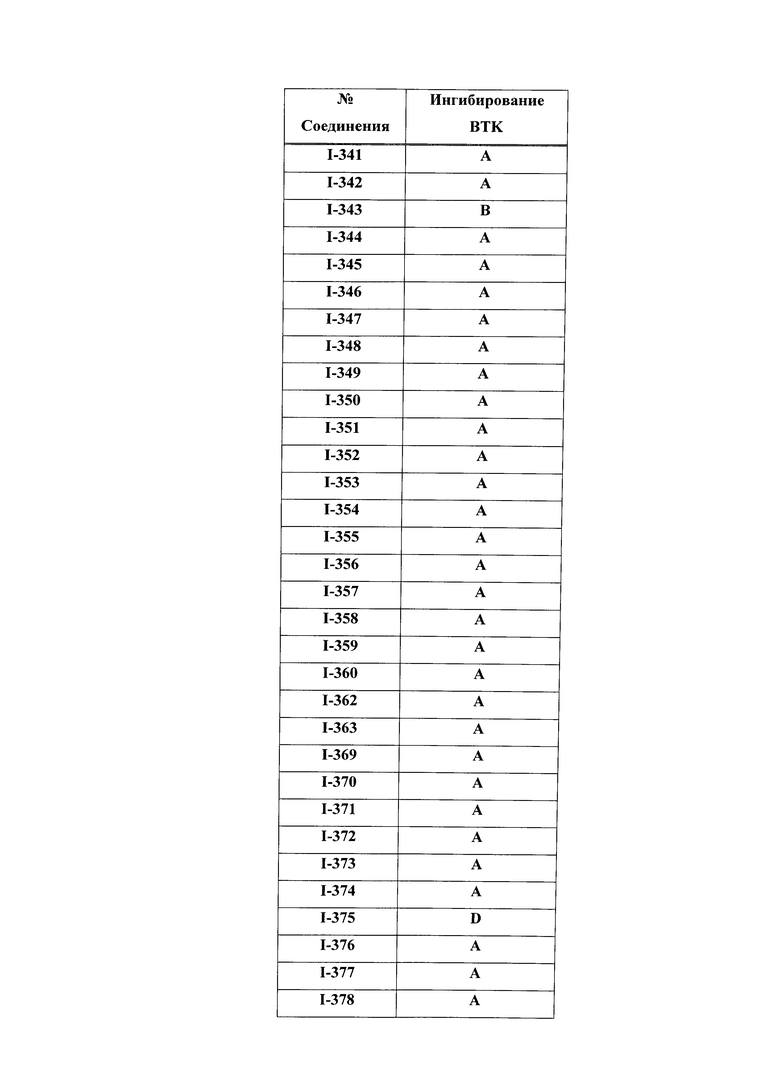
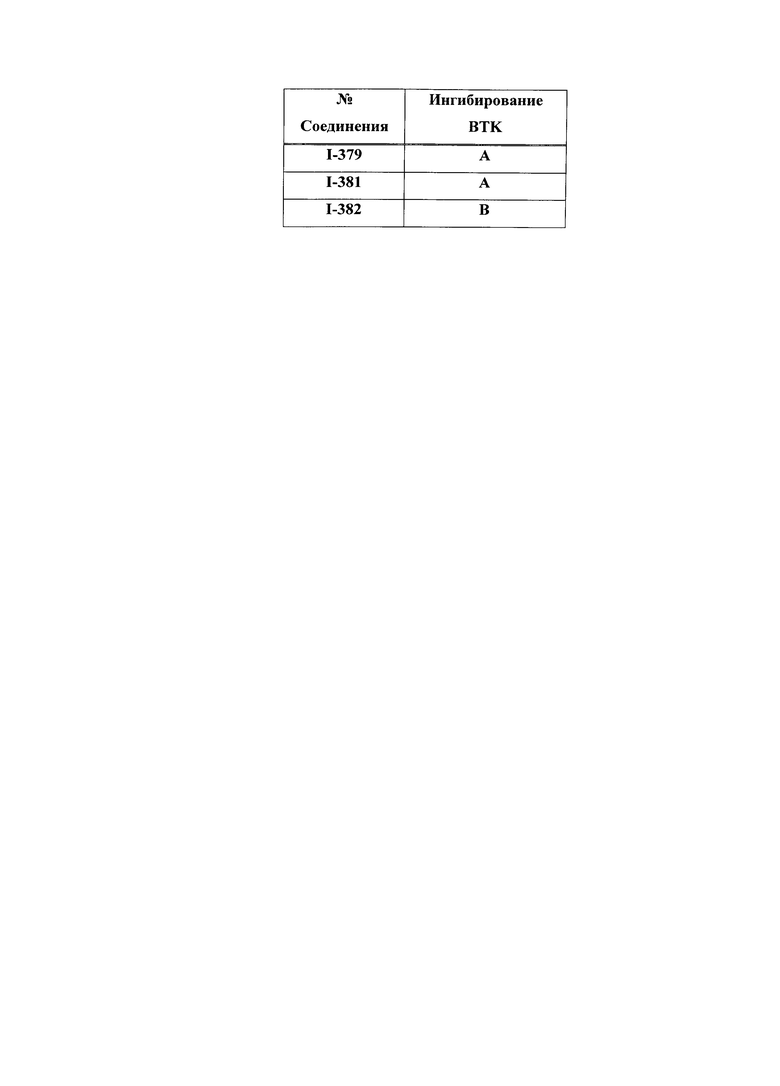
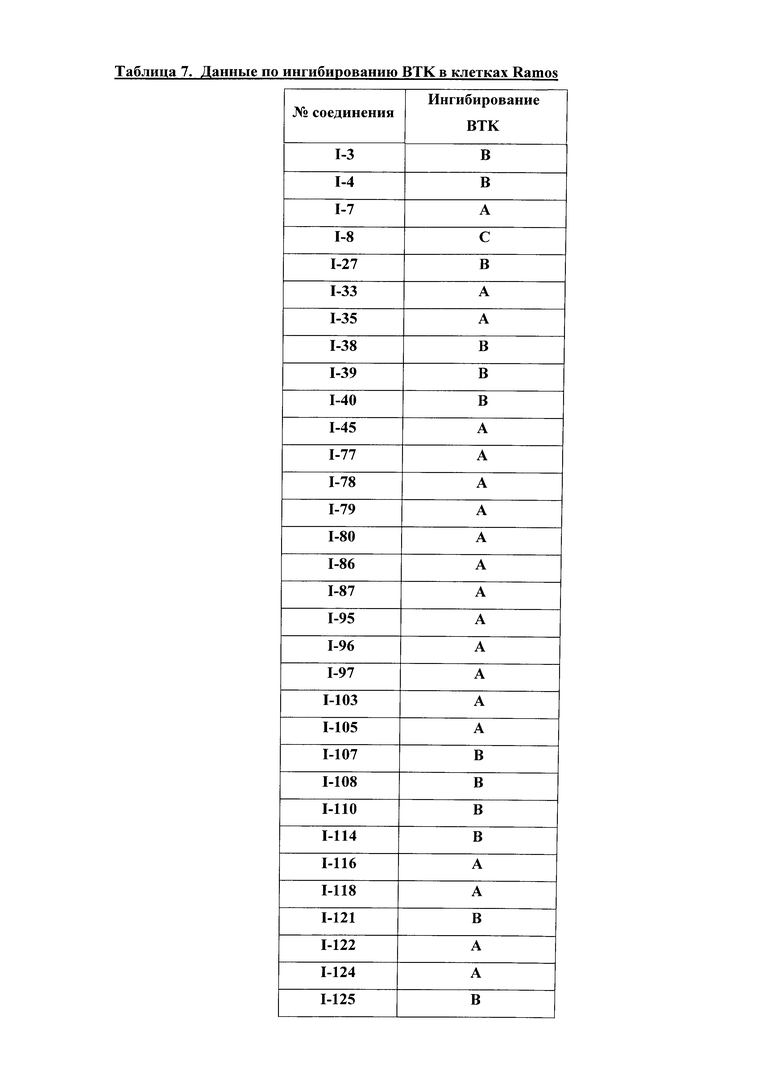
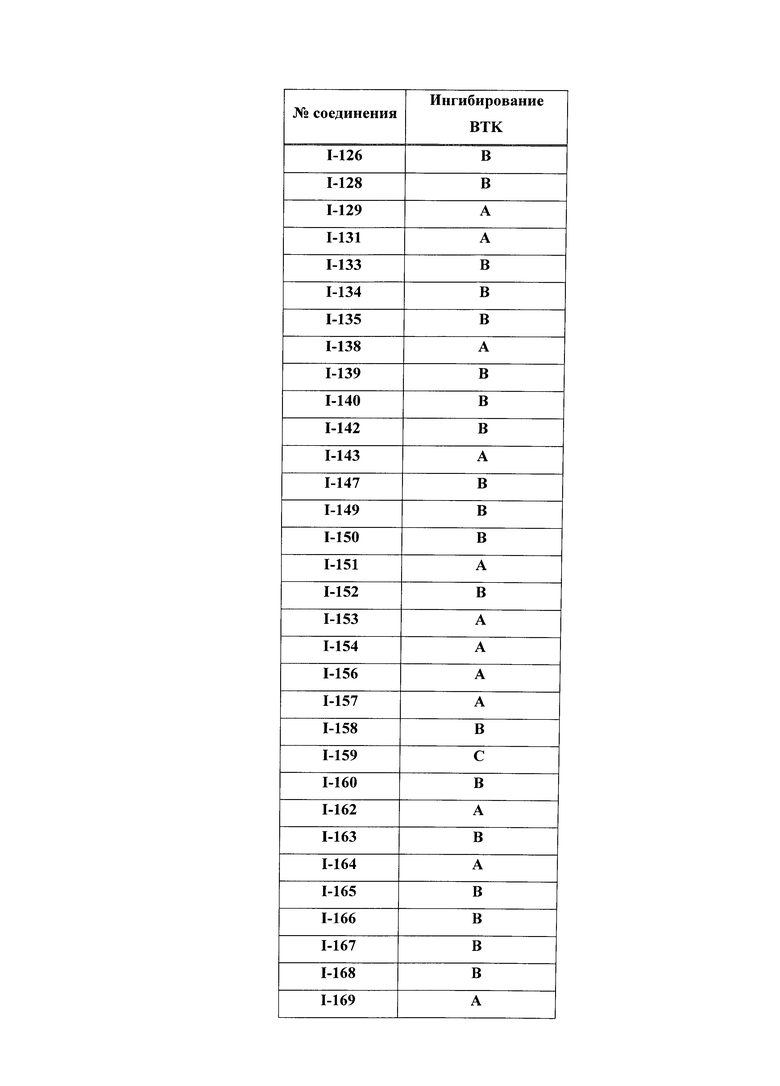
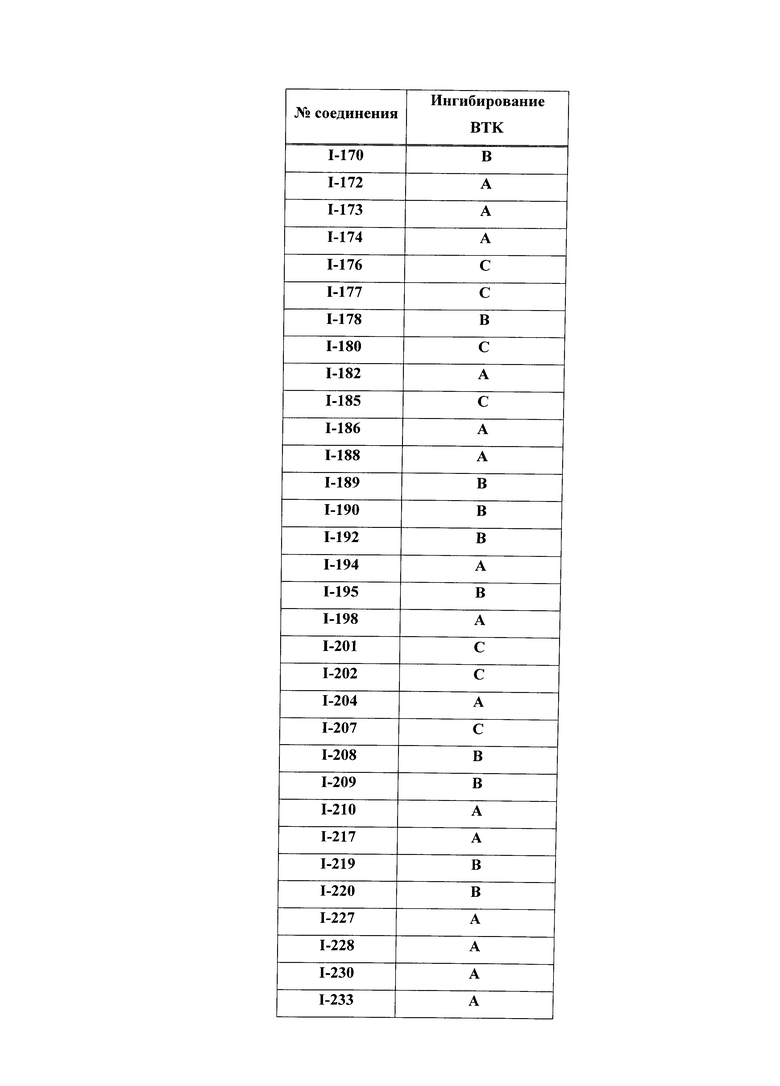
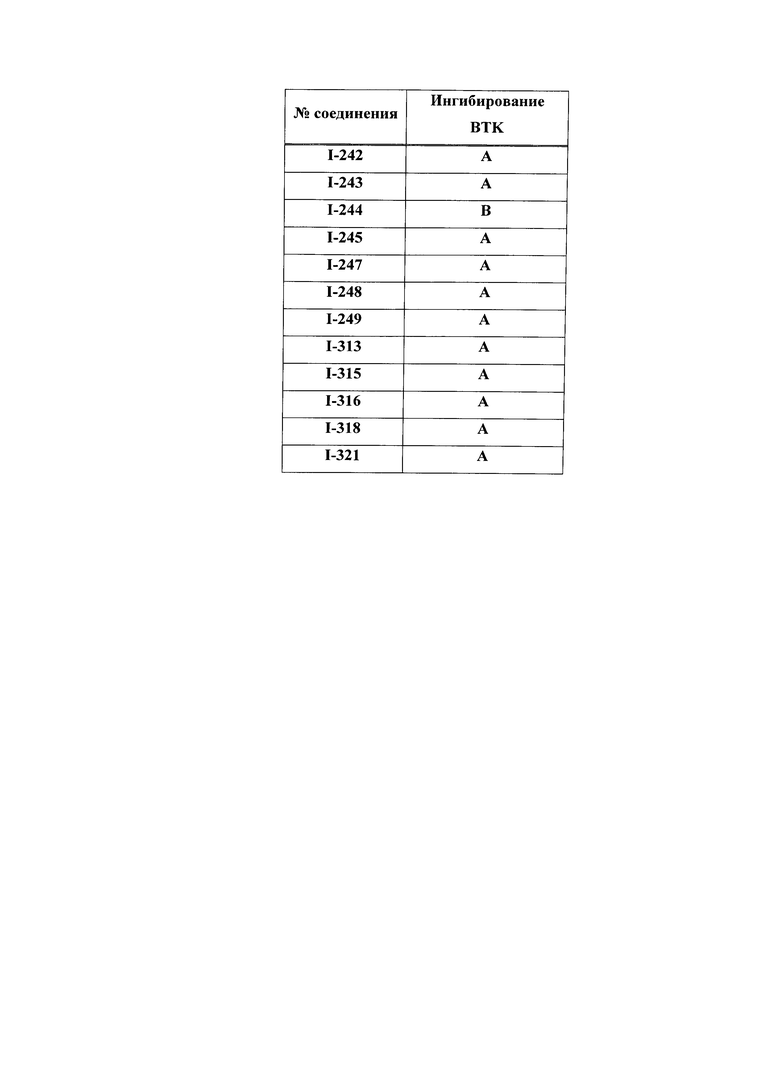
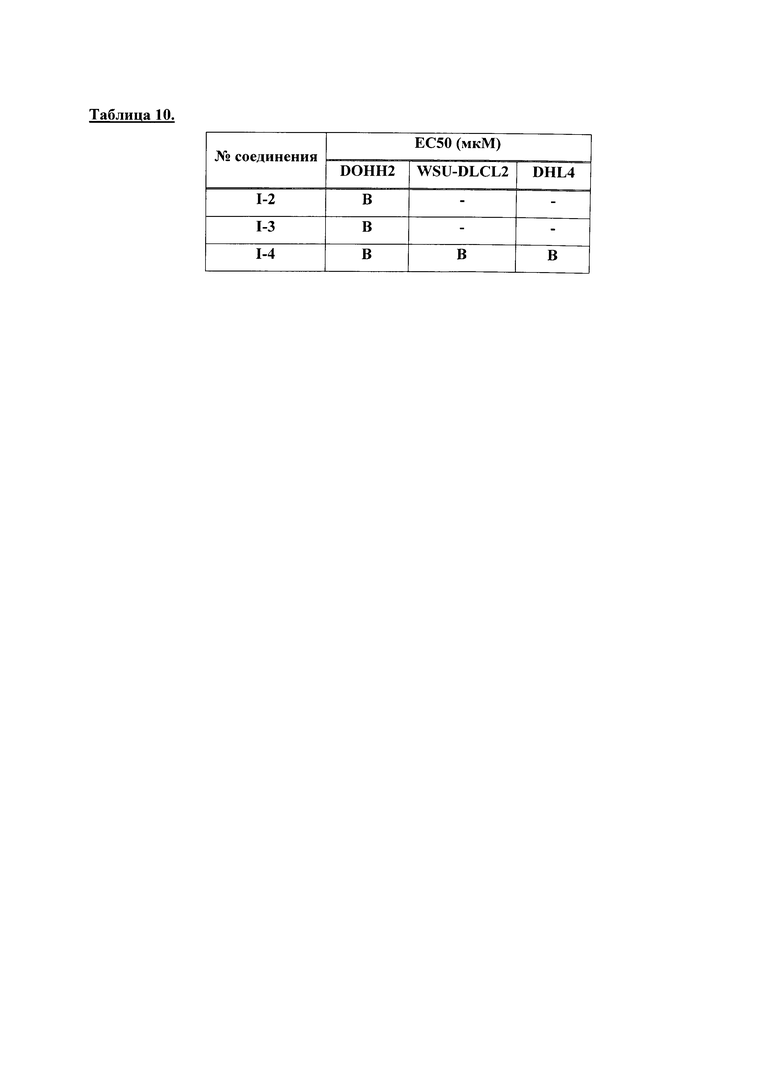
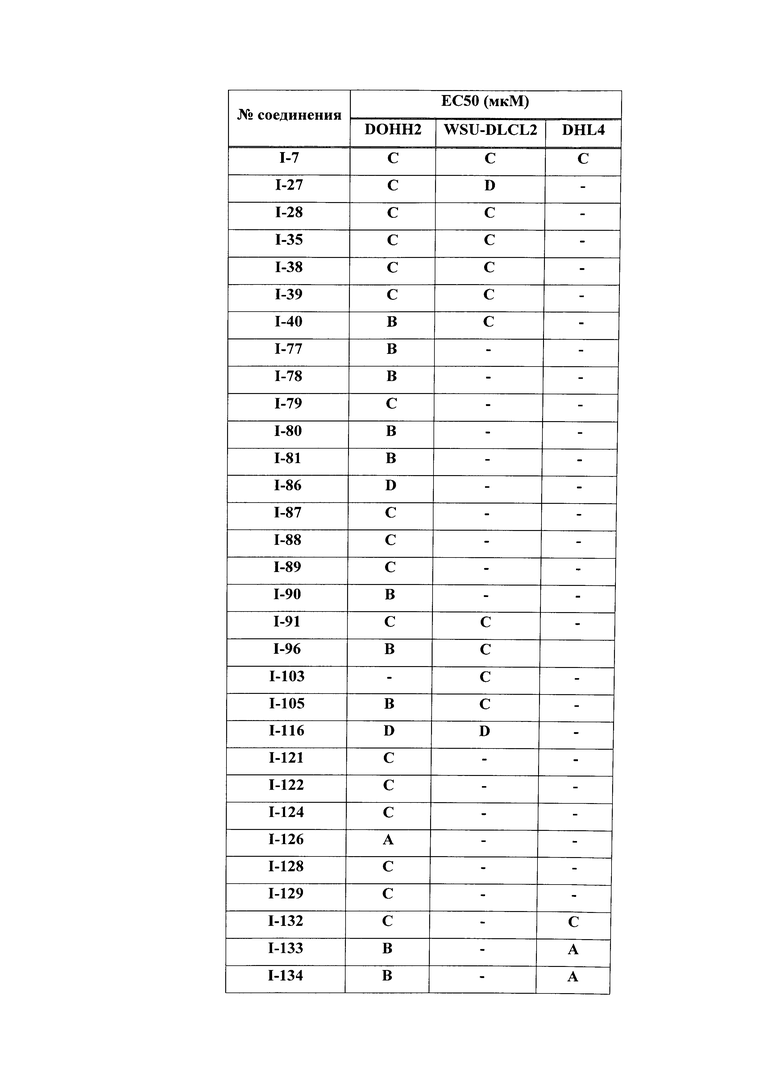
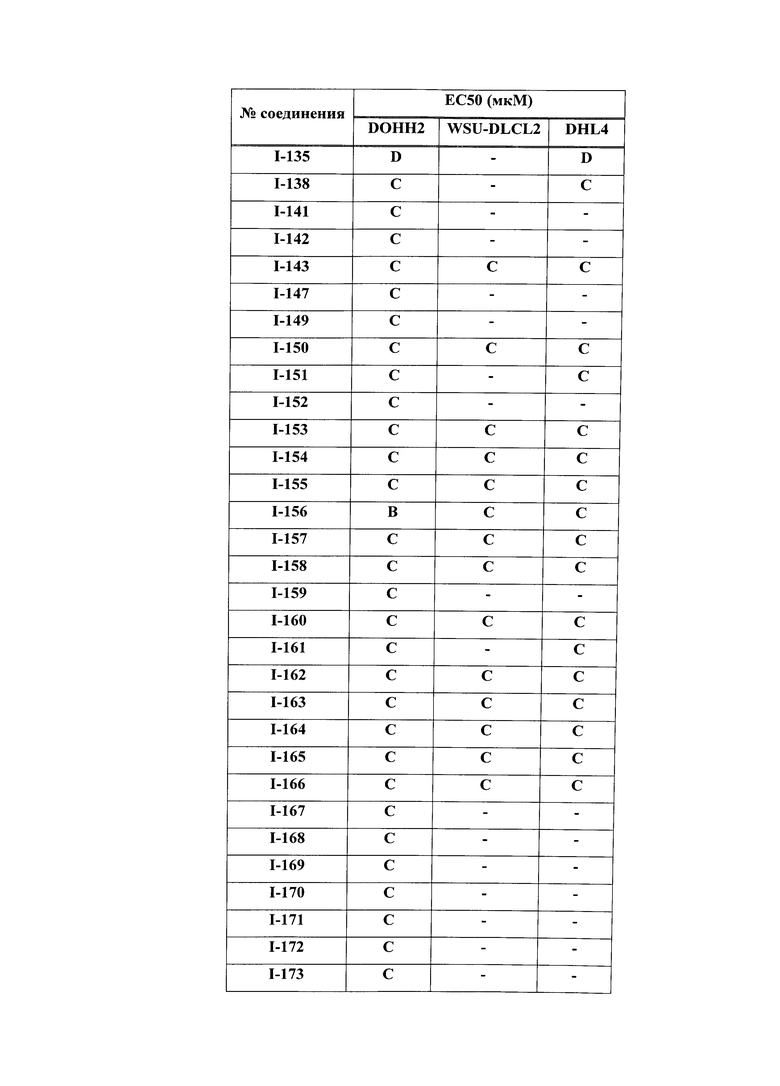
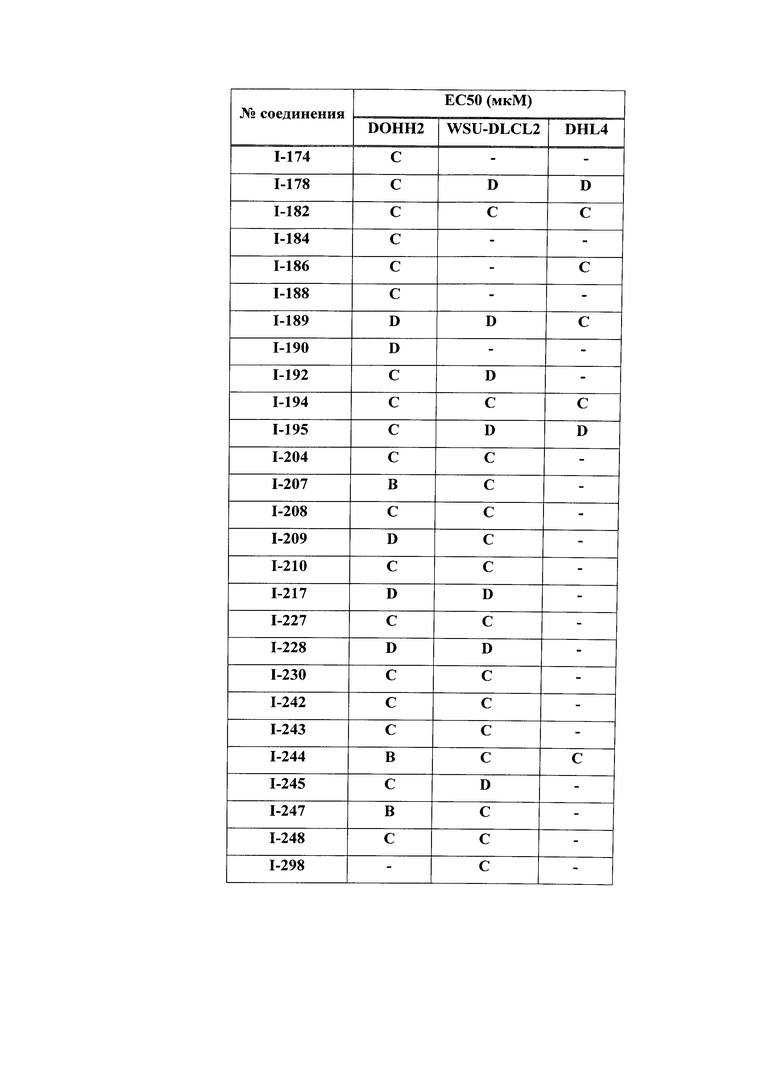

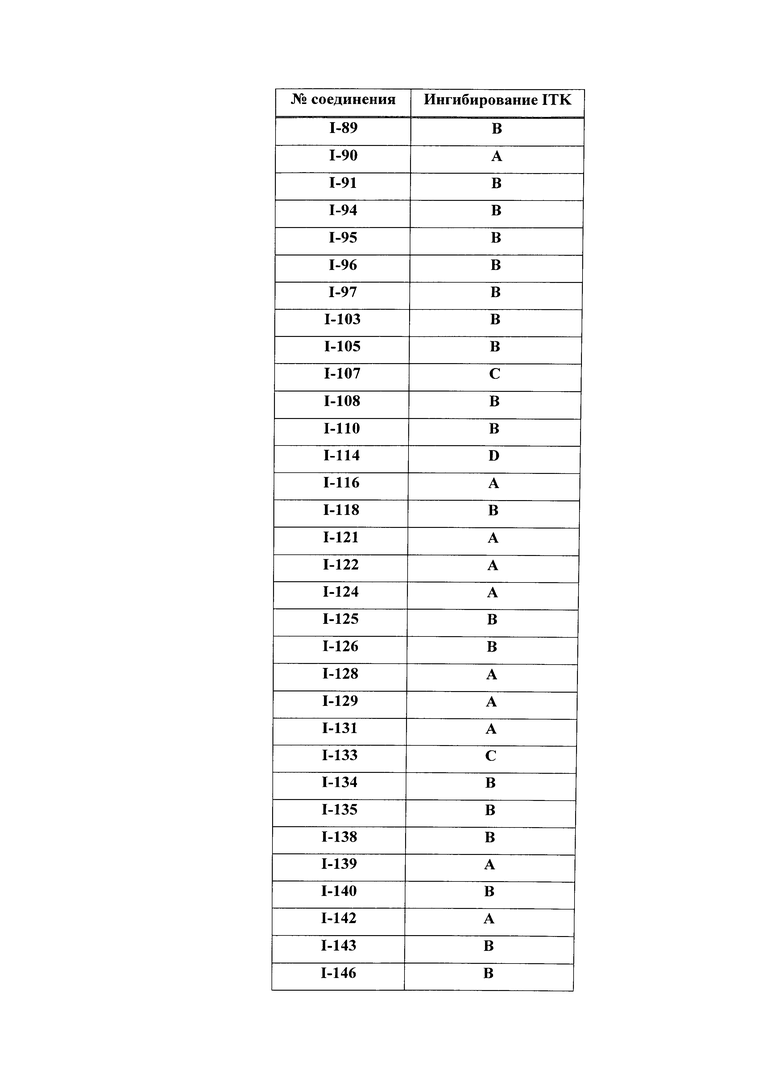
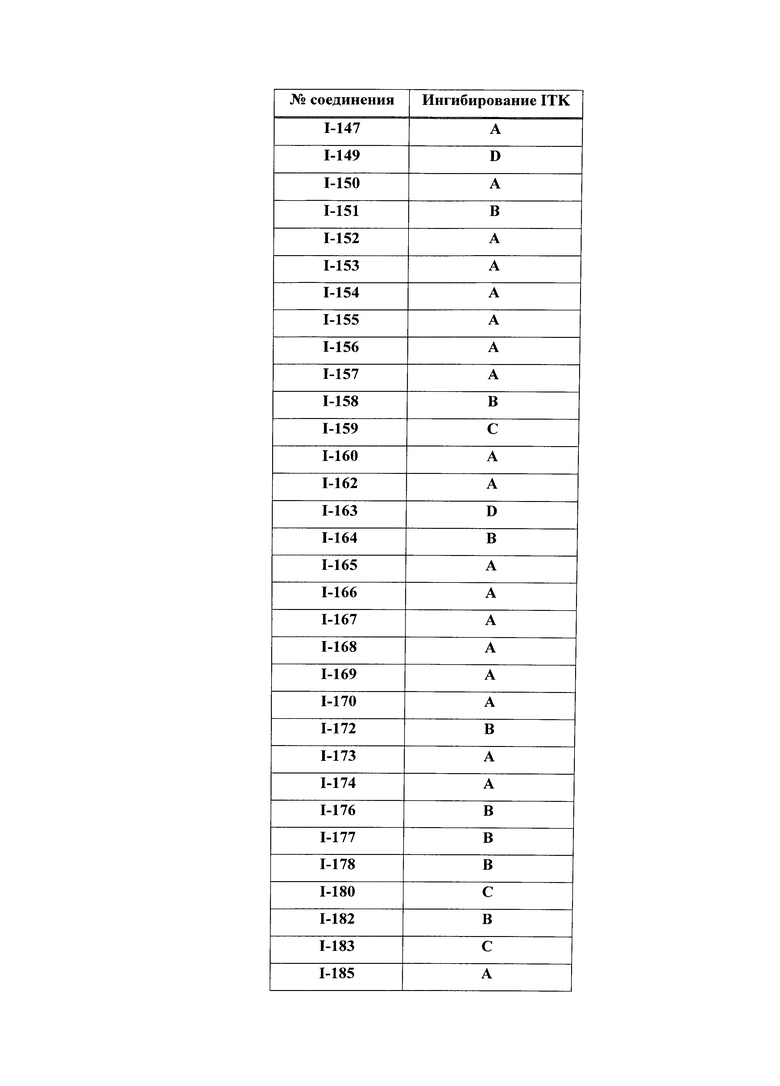
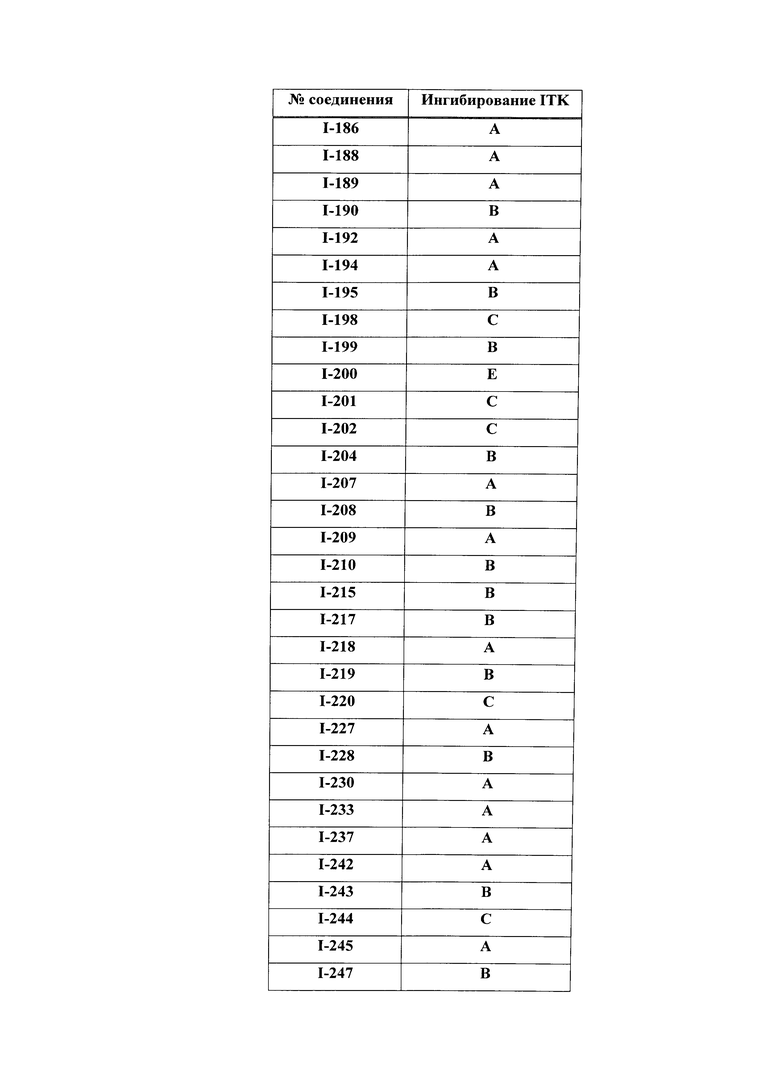
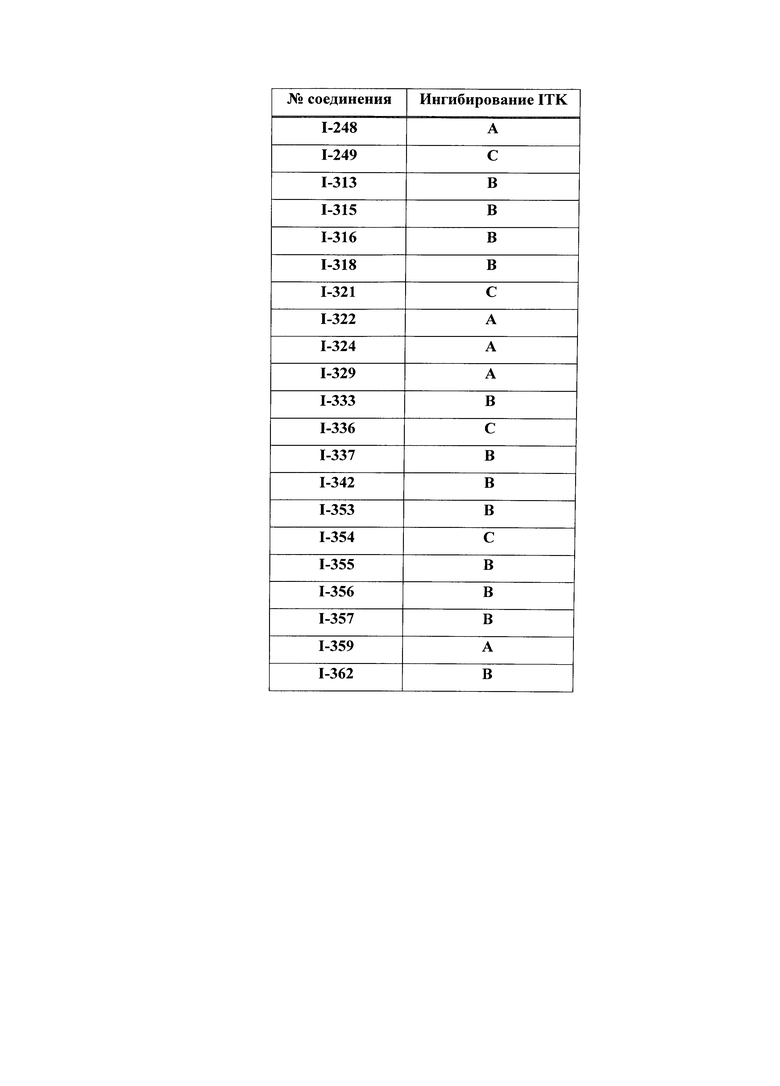
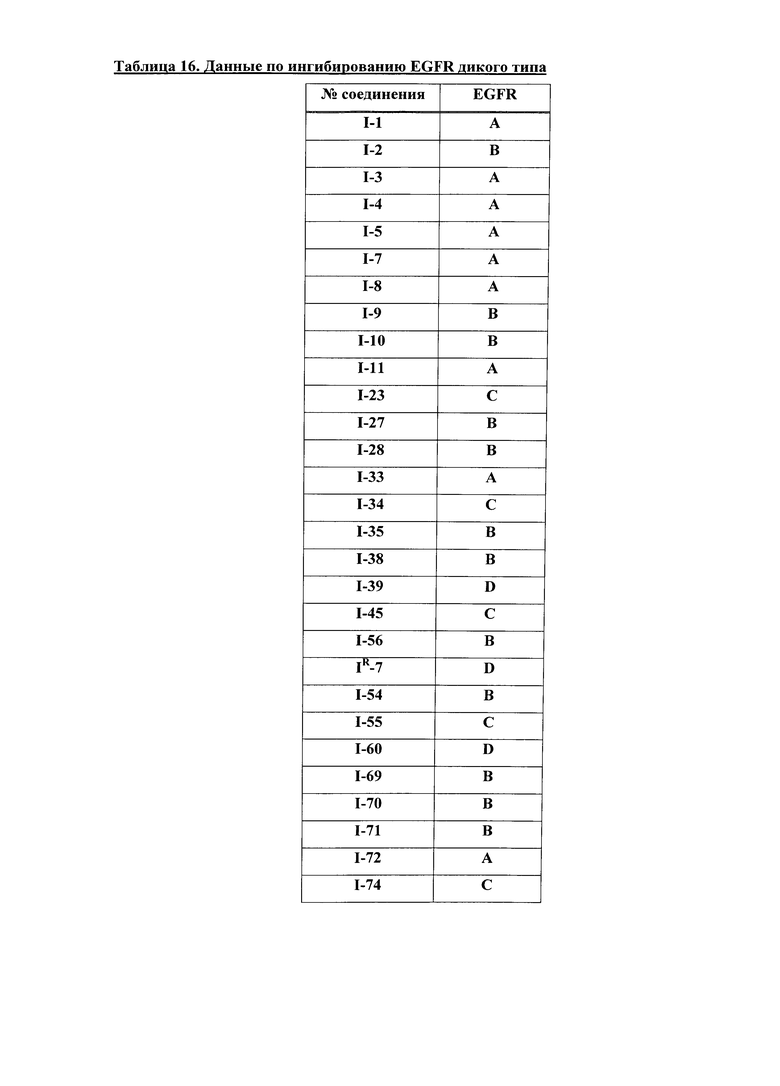
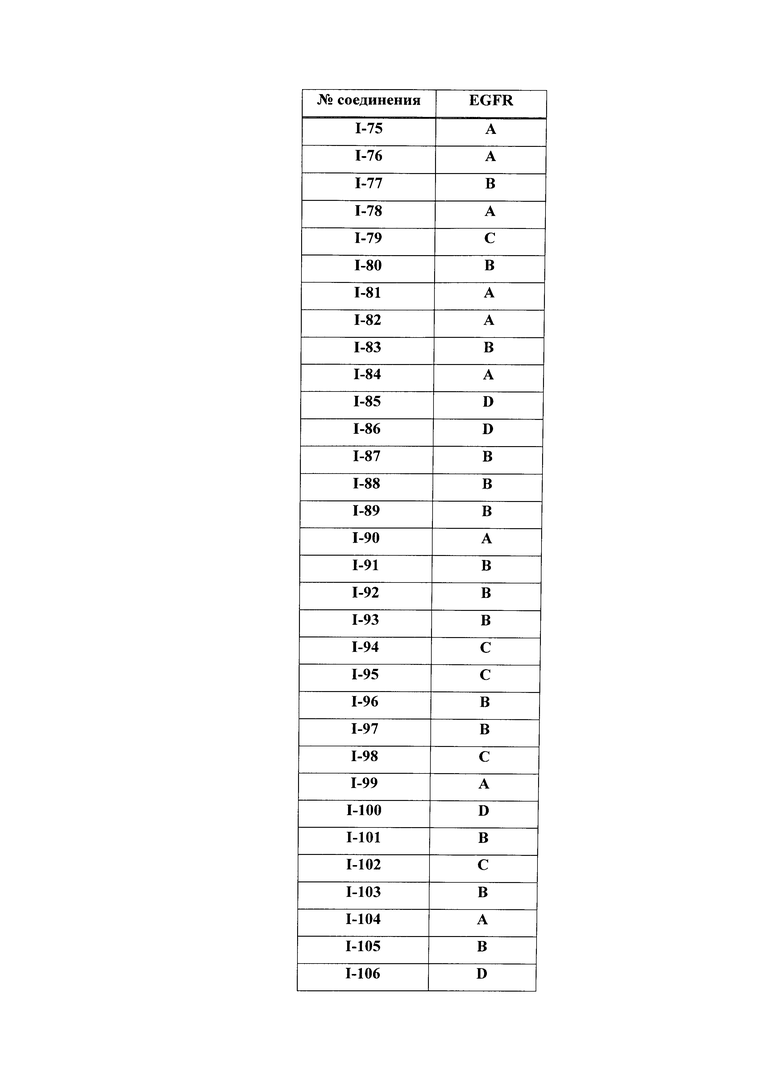
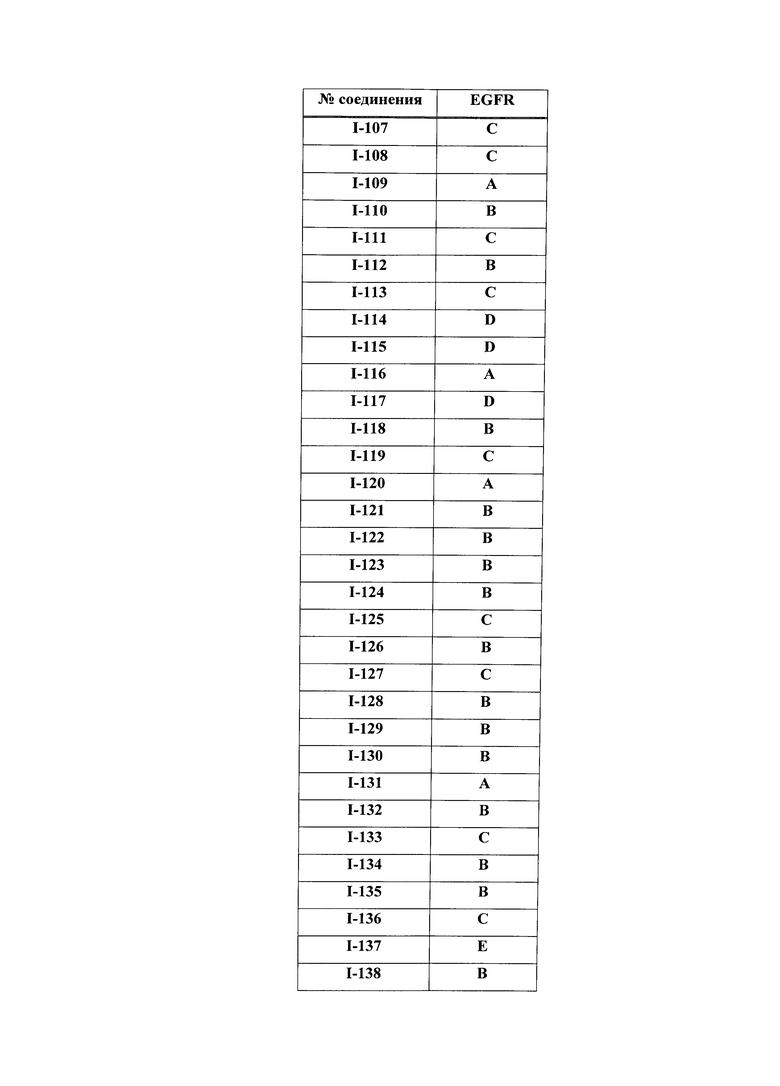
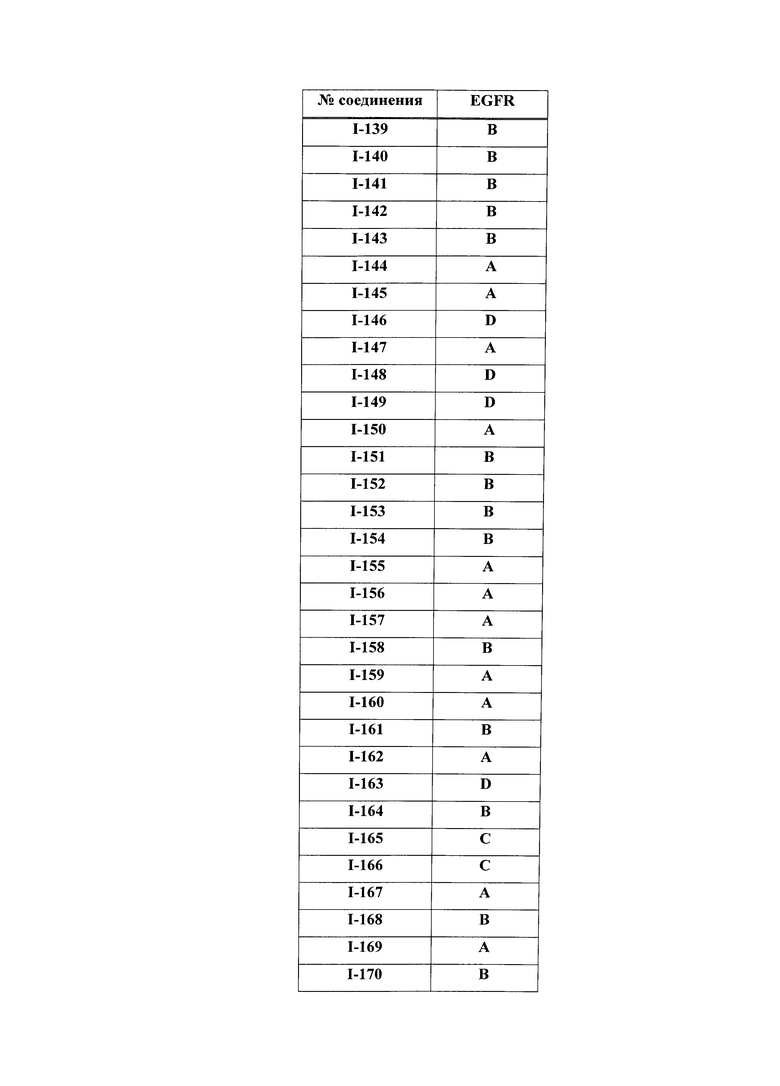
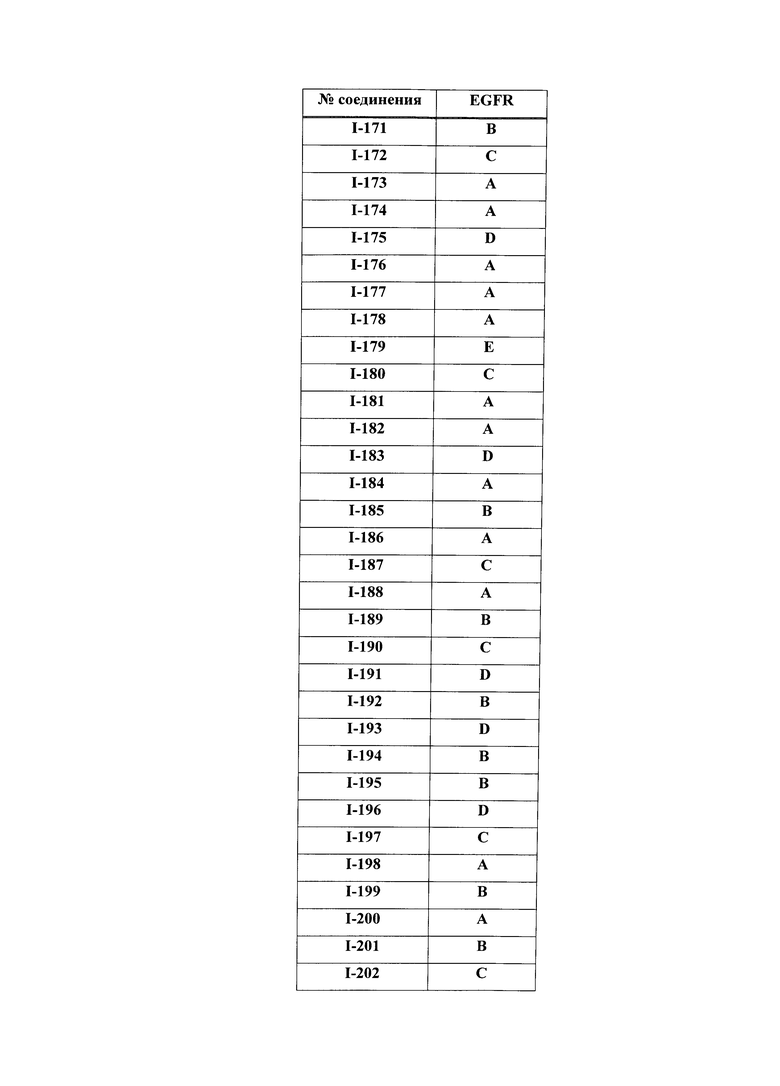

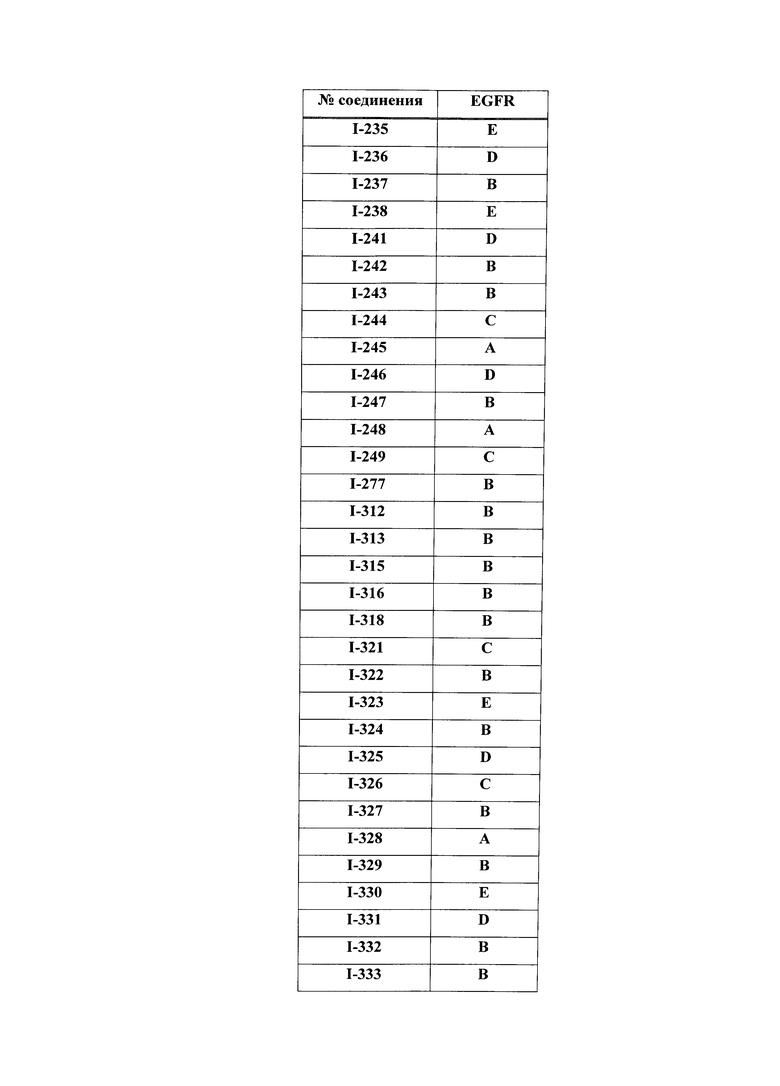
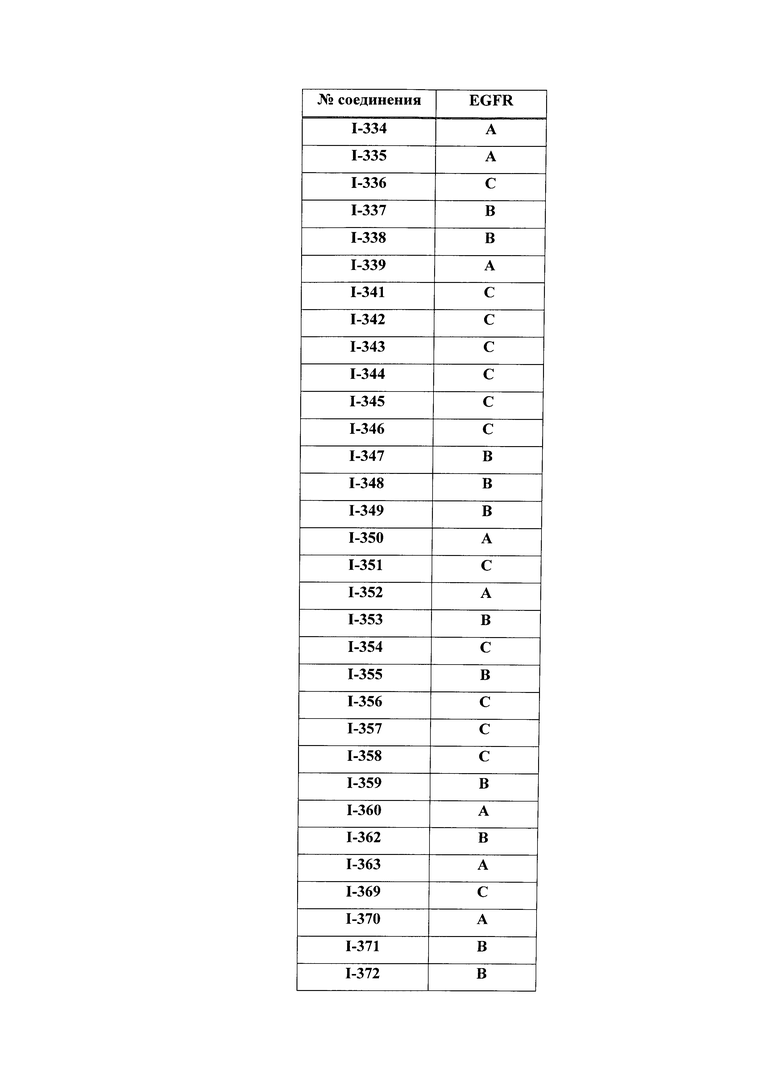
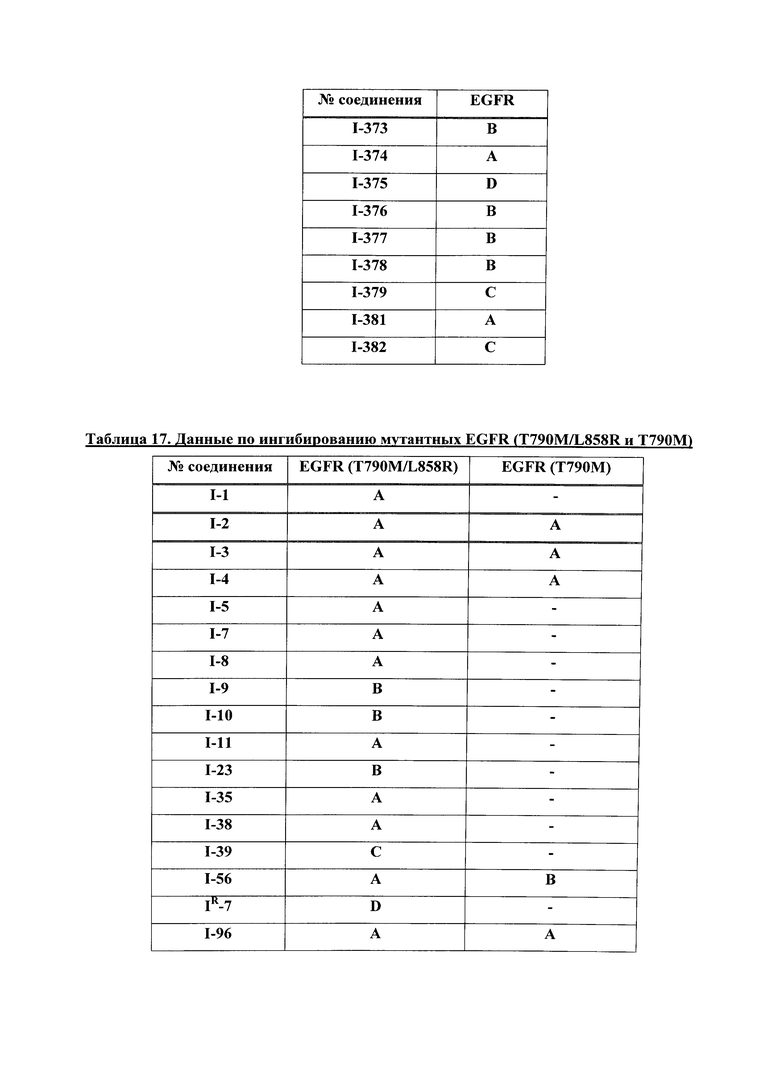


















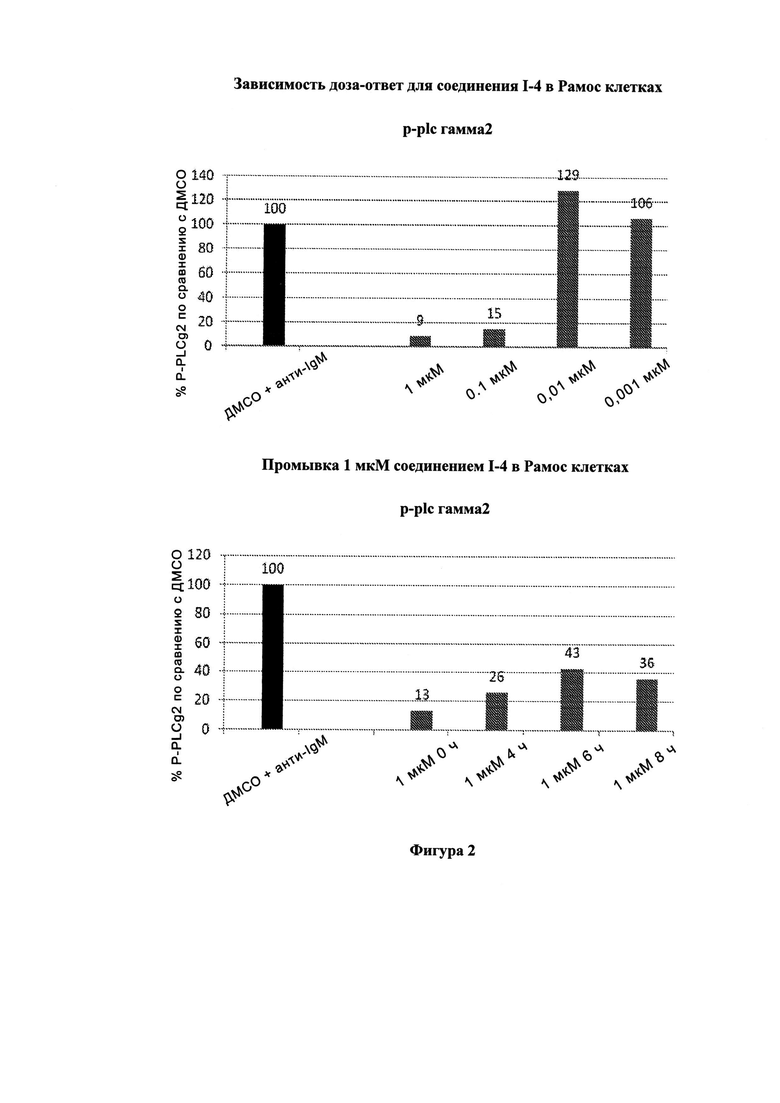
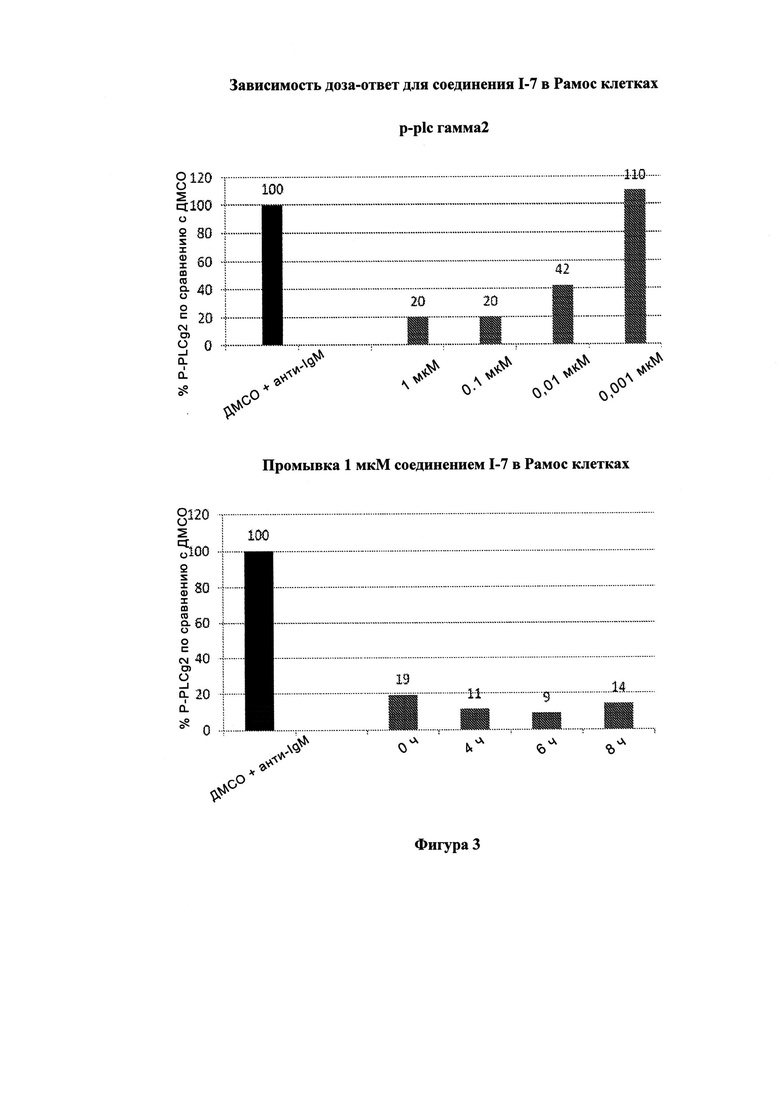
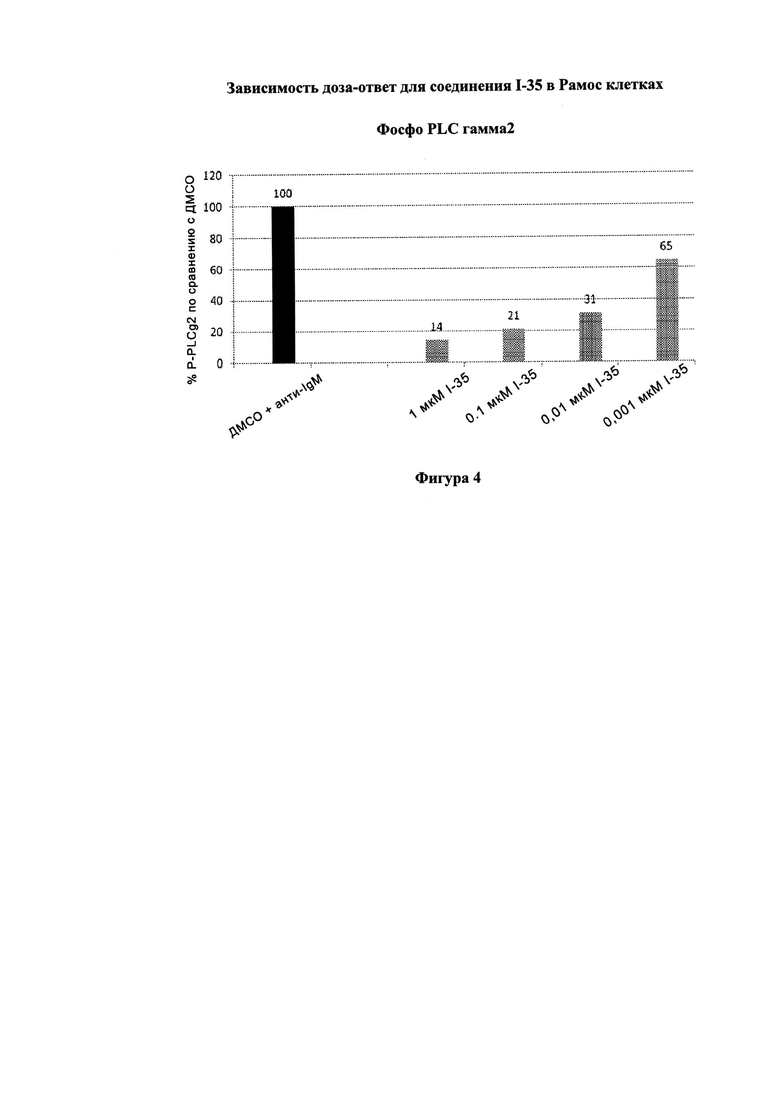
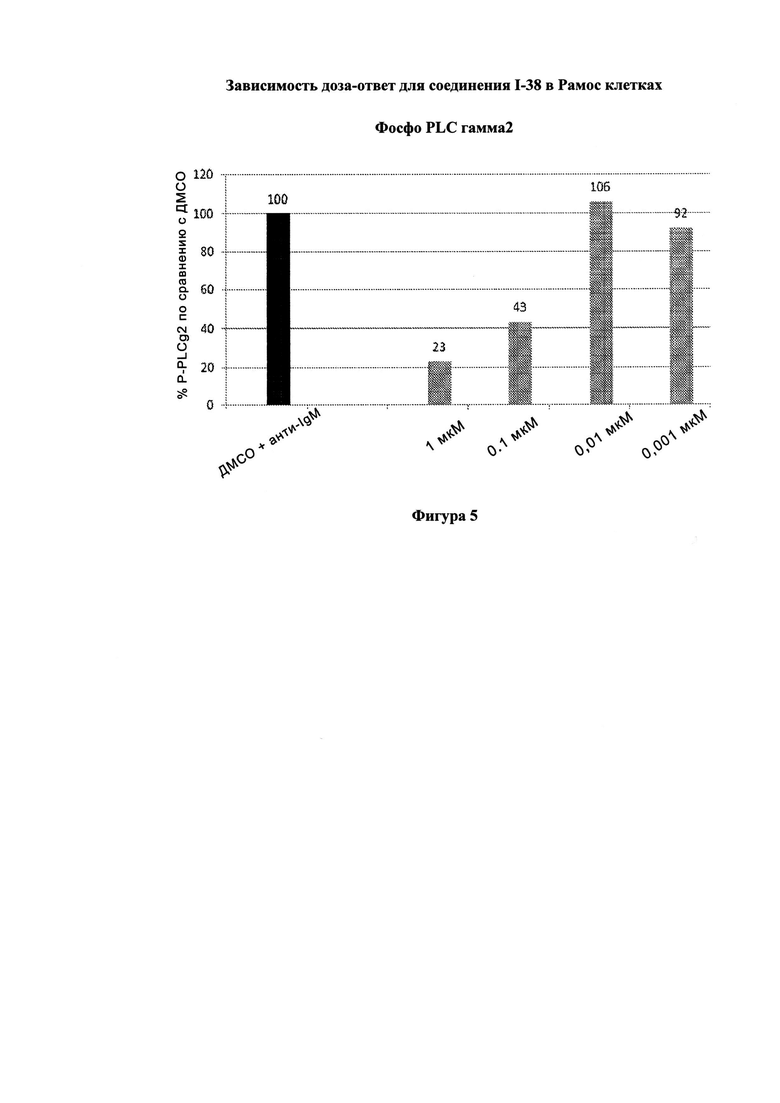

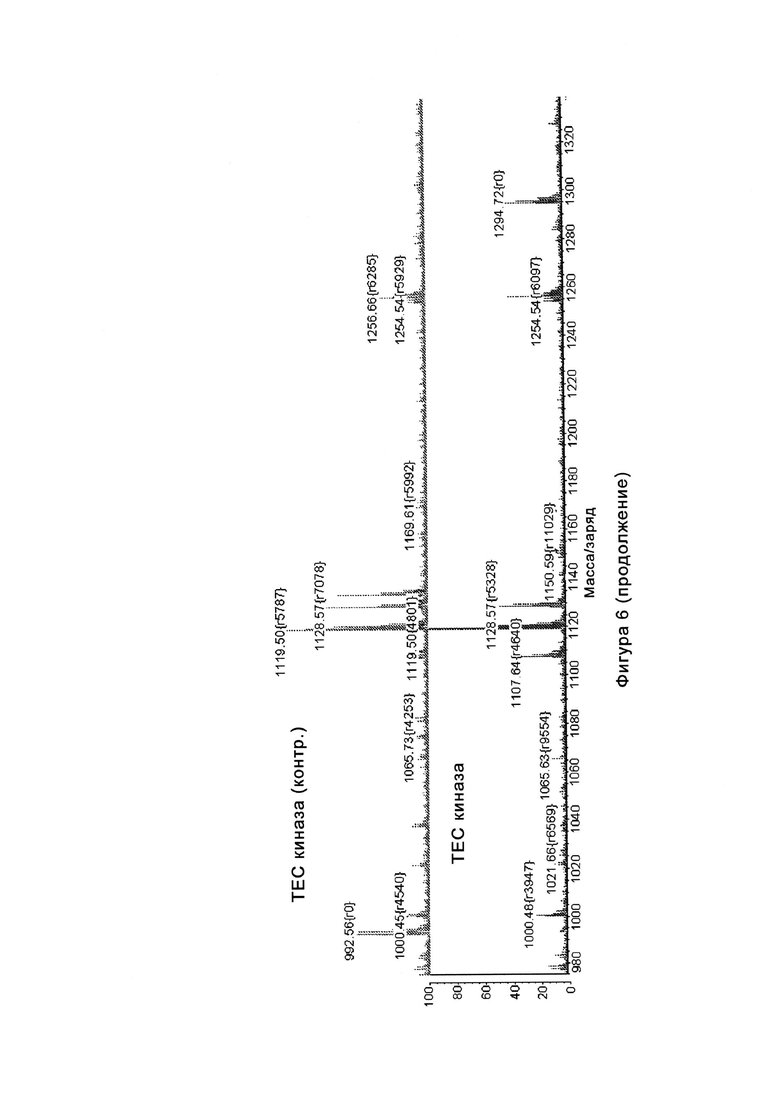



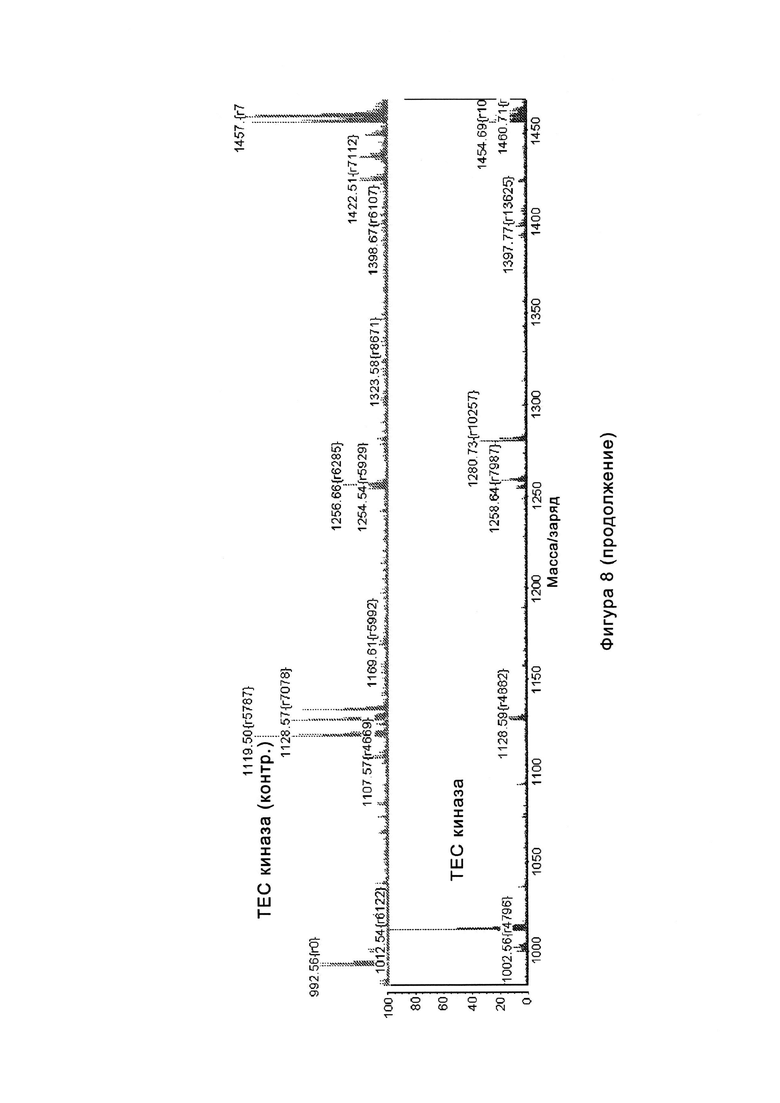

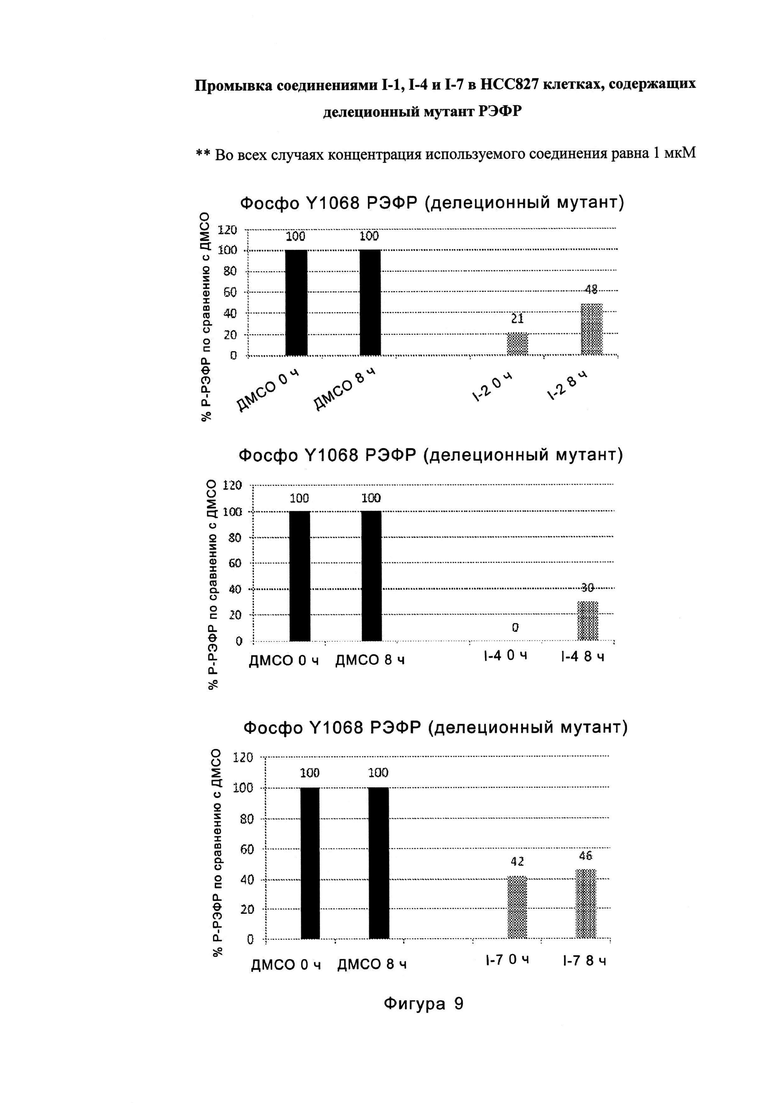
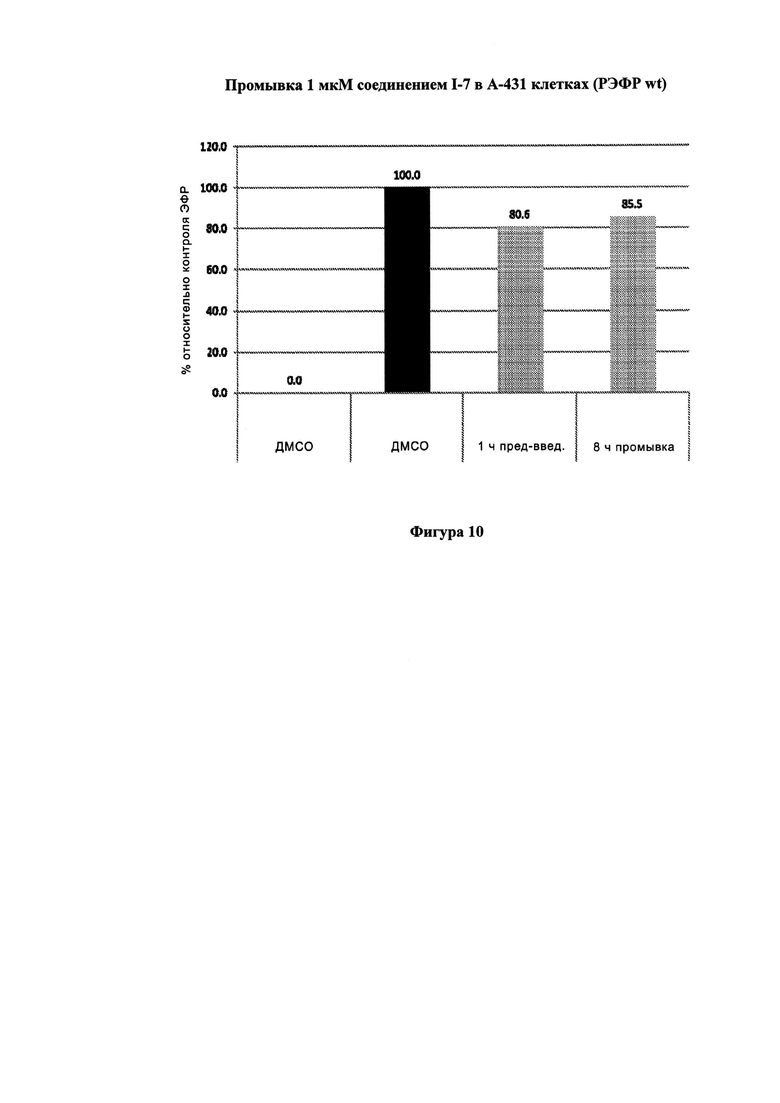

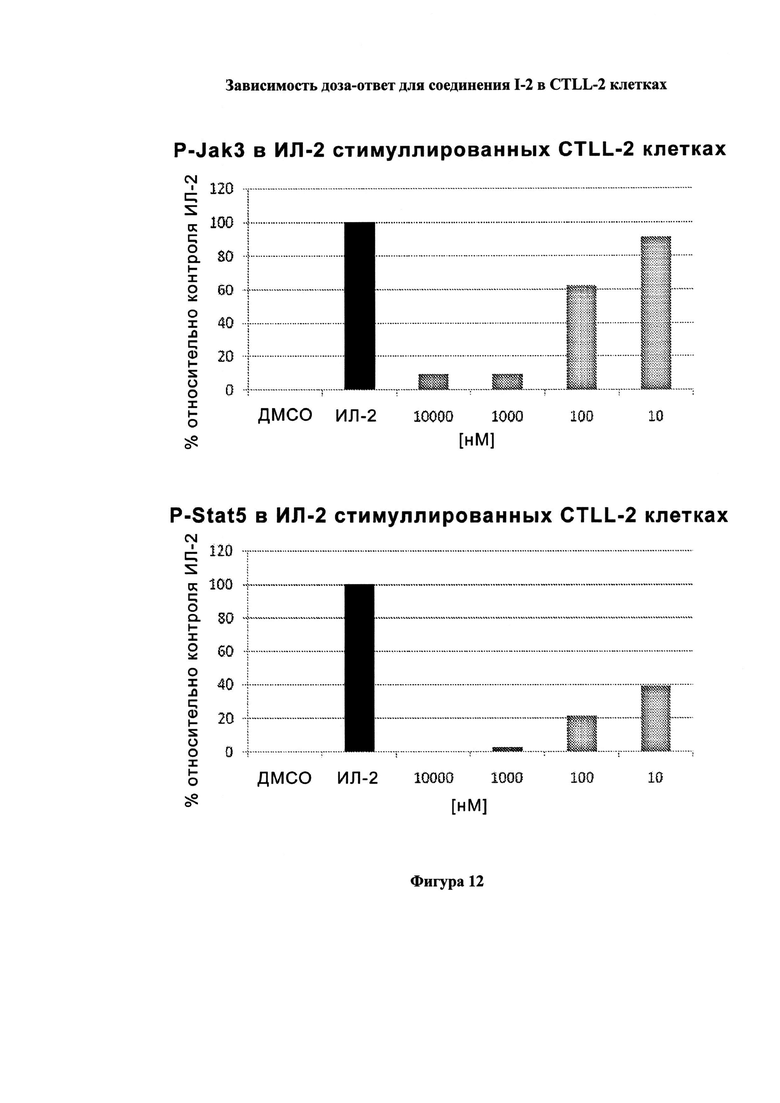
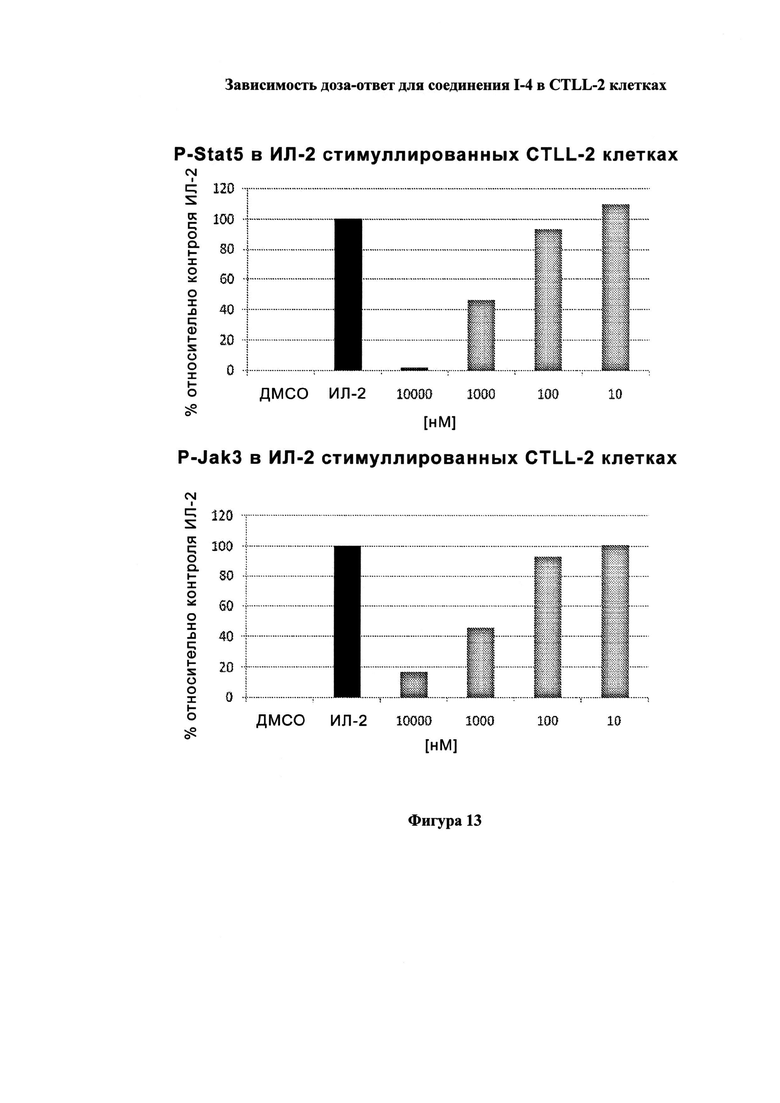
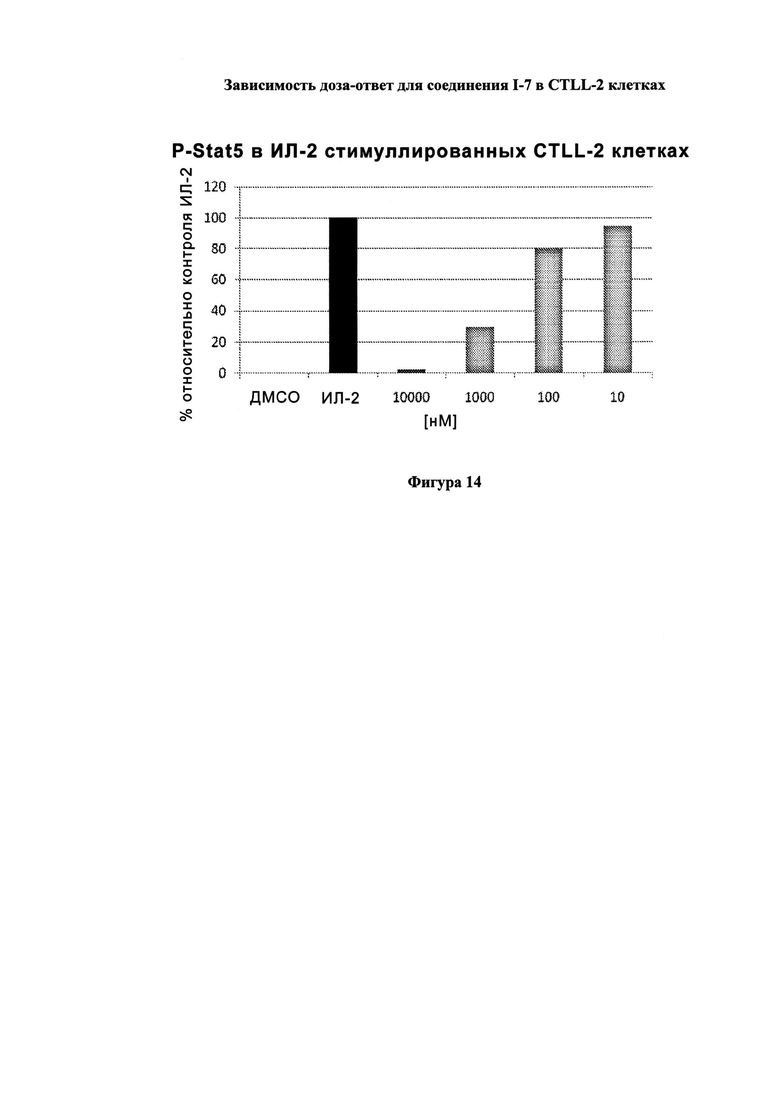
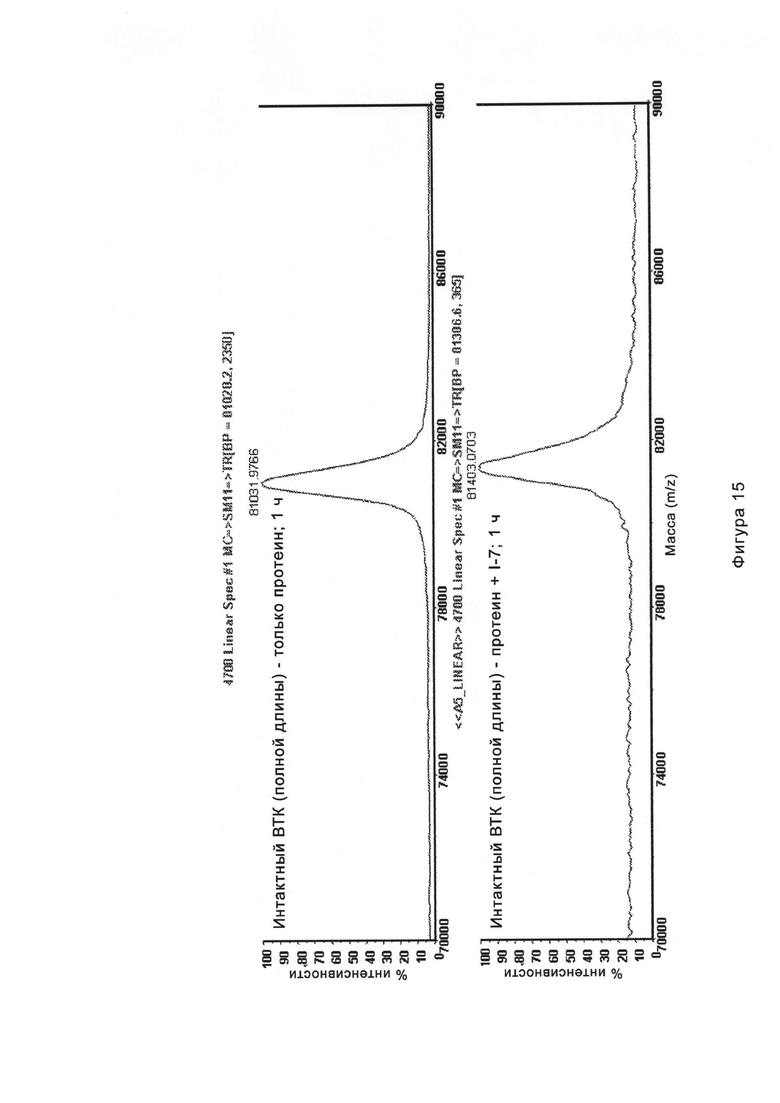
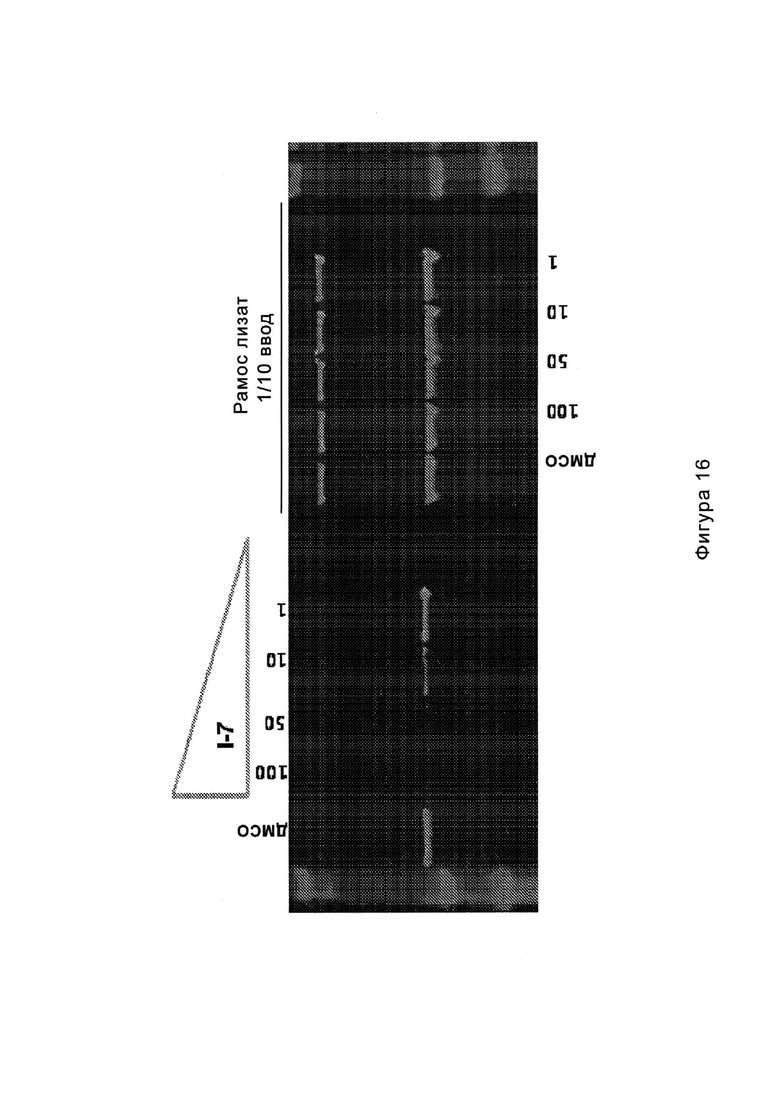
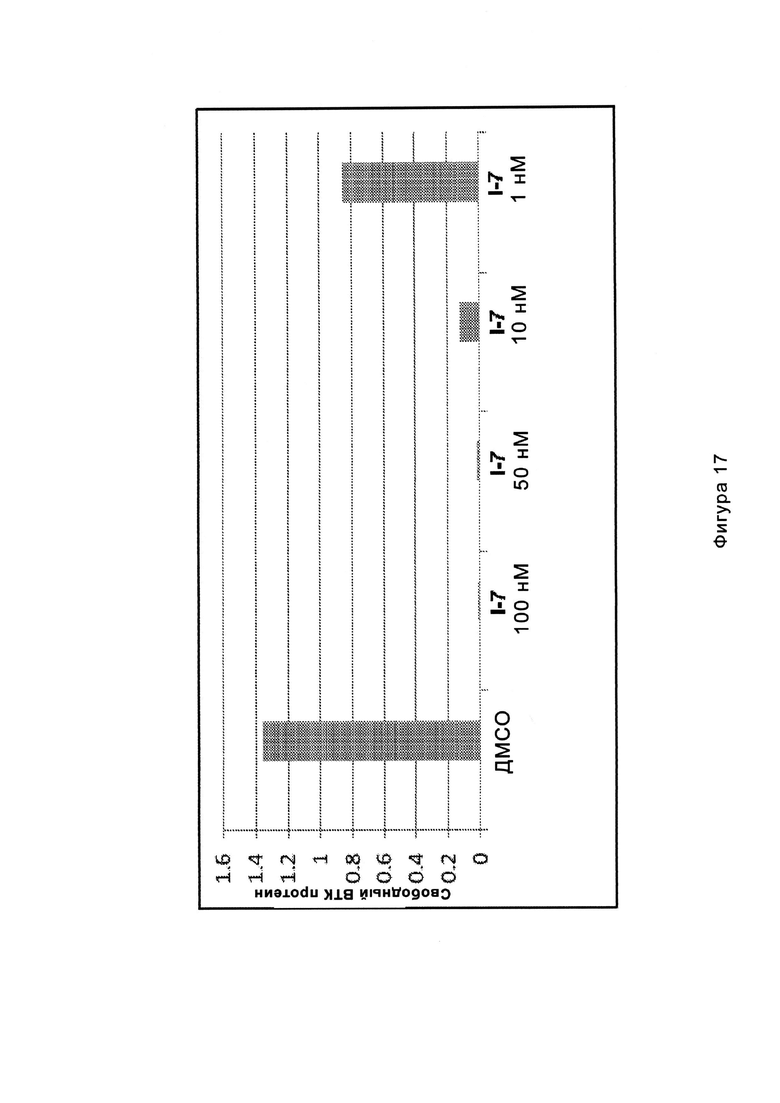
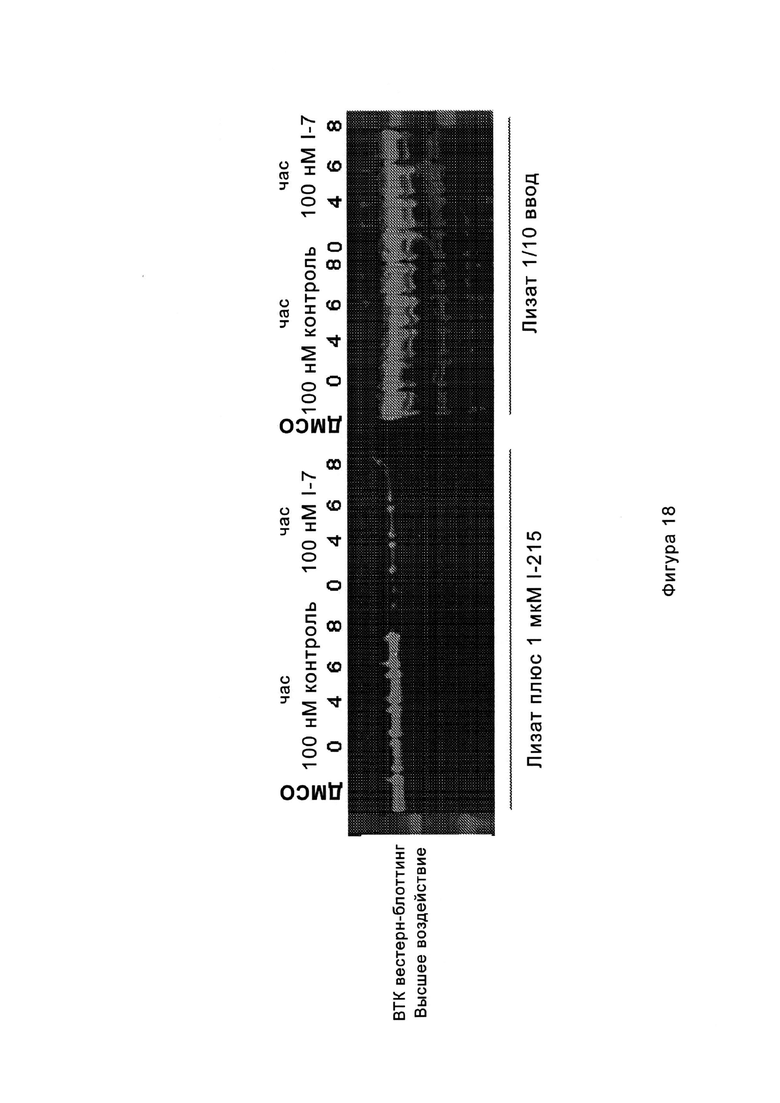
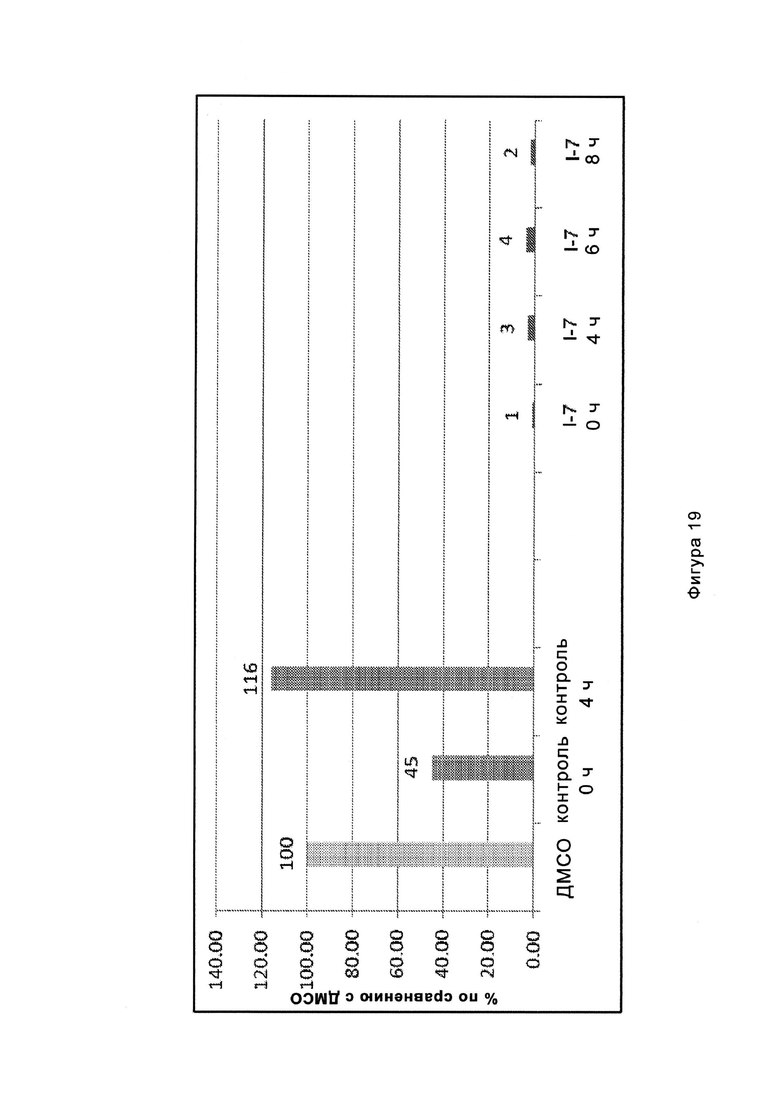





Изобретение относится к новым соединениям, выбранным из группы соединений, указанных ниже, или их фармацевтически приемлемым солям, которые обладают свойствами ингибиторов активности киназы, выбранной из BTK, ErbB1, ErbB2, ErbB3, ErbB4, TEC, ITK, ВМХ, или мутанта указанной киназы. При этом одна или более киназ могут ингибироваться необратимо за счет ковалентной модификации цистеина (Cys). Соединения могут быть использованы при лечении ревматоидного артрита, рассеянного склероза, диабета, В-клеточного хронического или острого лимфоцитарного лейкоза, лейкоза ворсистых клеток, неходжкинской лимфомы, ходжкинской лимфомы, множественной миеломы, колоректального рака, рака поджелудочной железы, рака костей, метастаз в кости, остеопороза, диабета, синдрома раздраженного кишечника, болезни Крона, системной красной волчанки или нарушений, связанных с ренальным трансплантатом, карциномы, выбранной из рака молочной железы, глиобластомы, рака легких, рака головы и шеи, колоректального рака, рака мочевого пузыря, немелкоклеточного рака легких, карциномы сквамозных клеток, карциномы слюнных желез, карциномы яичников, колоректального рака или рака поджелудочной железы. Соединения выбраны из группы соединений
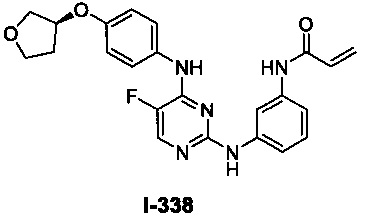 ,
, 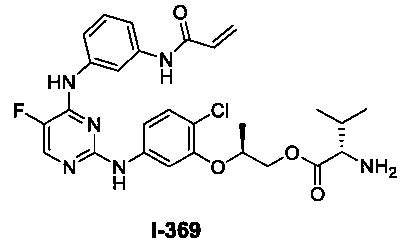
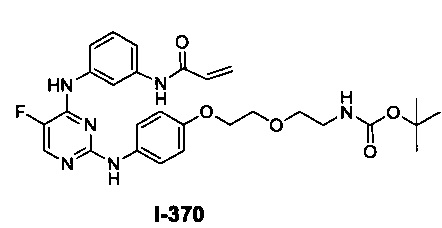 ,
, 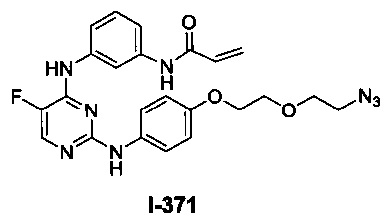
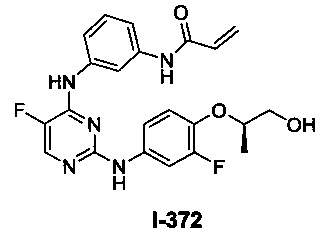 ,
, 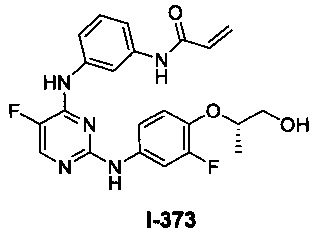
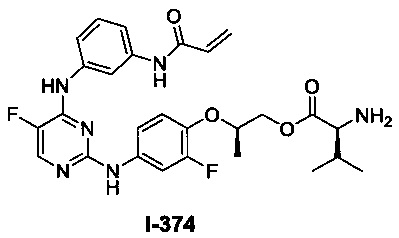 ,
, 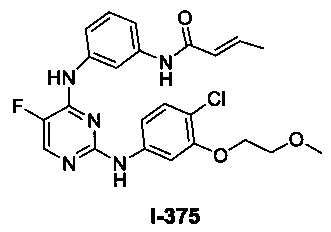
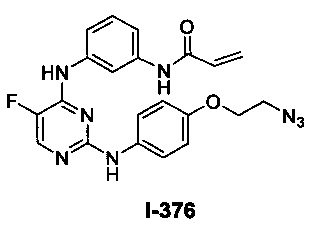 ,
, 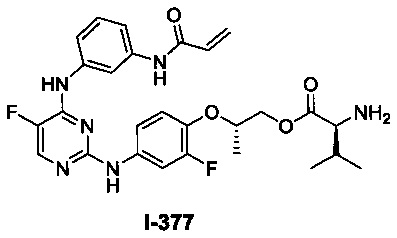
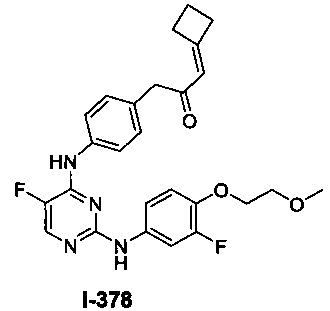 ,
, 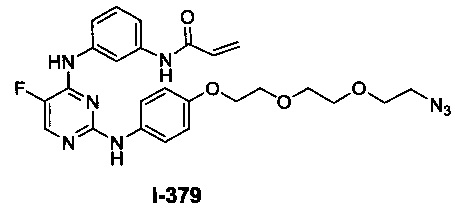
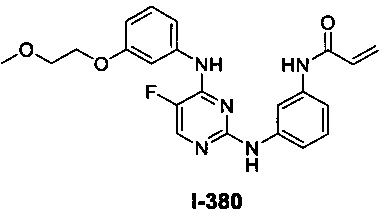 ,
, 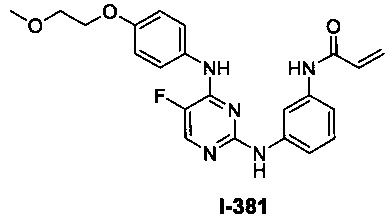
и соединений (I-382)-(I-393), указанных в формуле изобретения. 6. н. и 10 з.п. ф-лы, 25 ил., 20 табл., 302 пр.
1. Соединение, выбранное из группы, состоящей из:
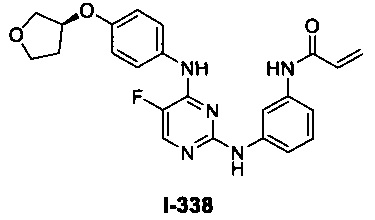
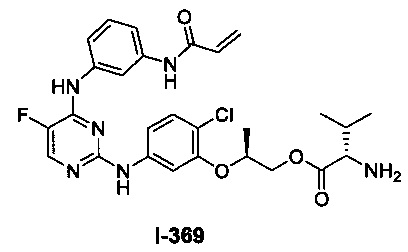
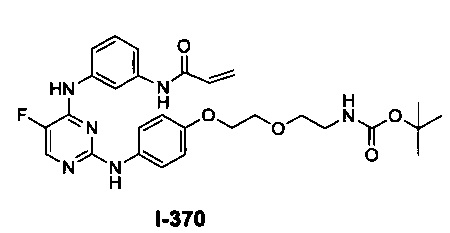
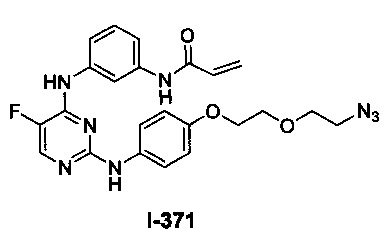
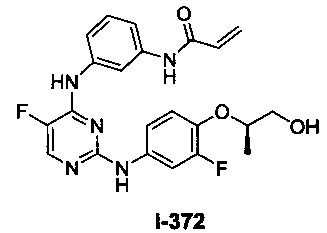
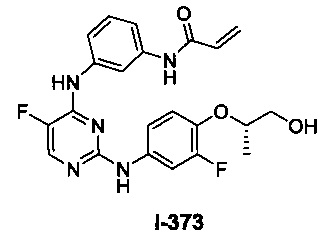
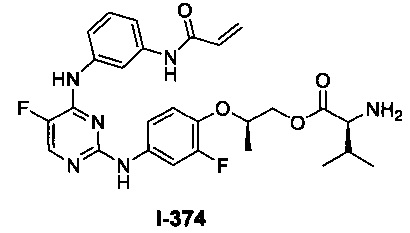
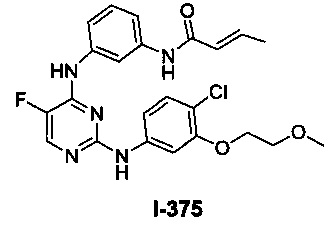
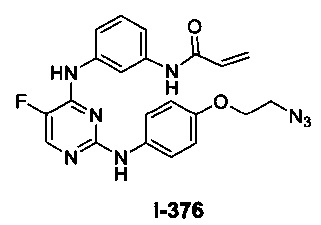
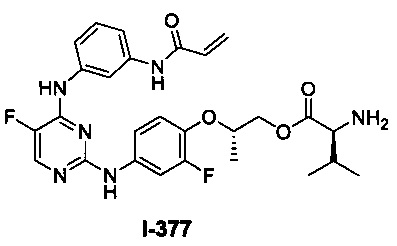
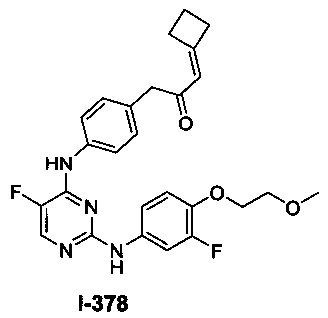
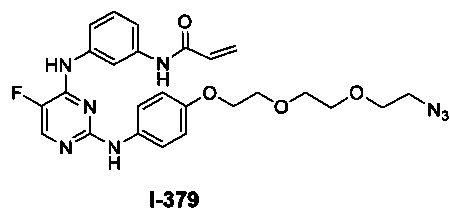
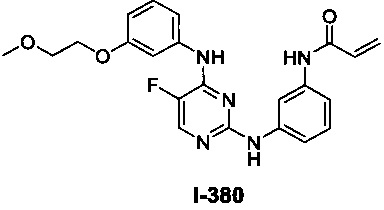
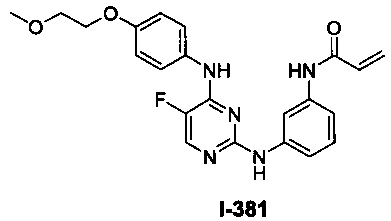
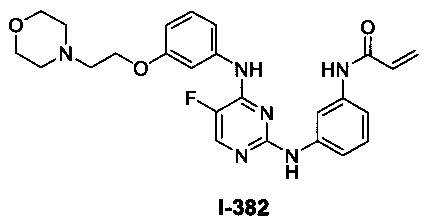
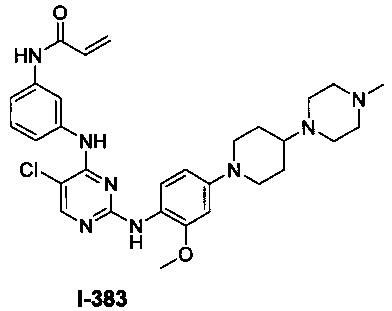
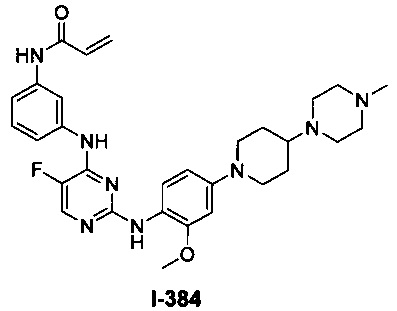
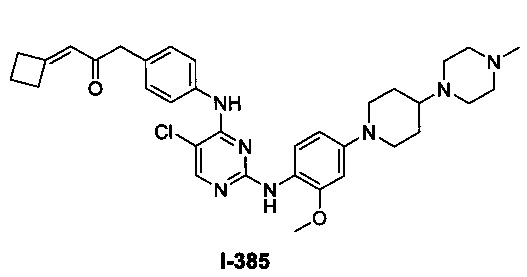
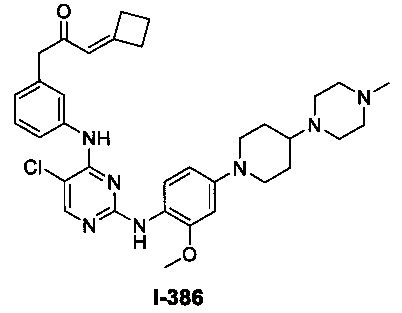
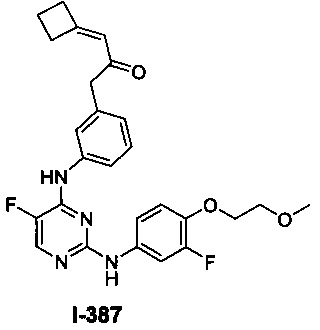
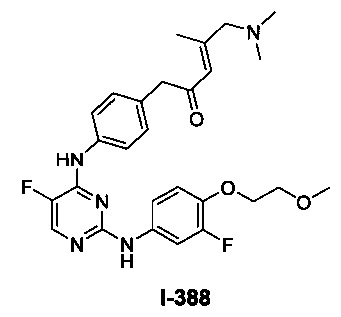
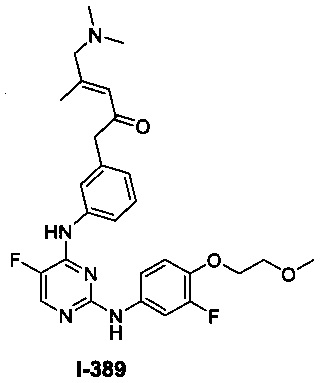
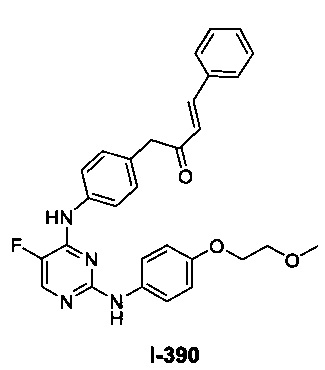
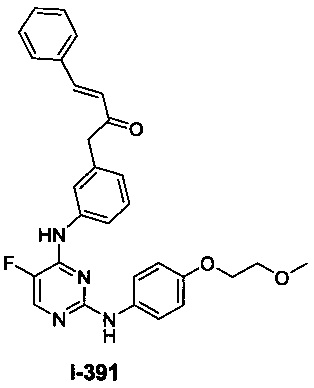

и 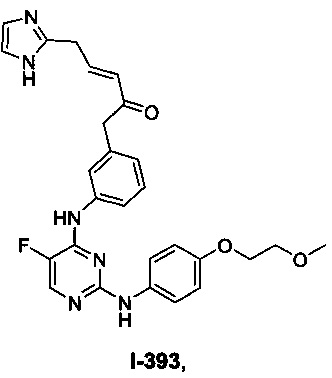
или его фармацевтически приемлемая соль.
2. Фармацевтическая композиция для ингибирования активности киназы, выбранной из BTK, ErbB1, ErbB2, ErbB3, ErbB4, TEC, ITK или ВМХ или мутанта указанной киназы, содержащая эффективное количество соединения по п. 1 и фармацевтически приемлемое вспомогательное вещество, носитель или разбавитель.
3. Соединение, выбранное из:
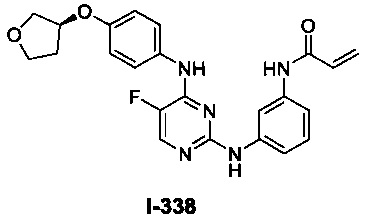
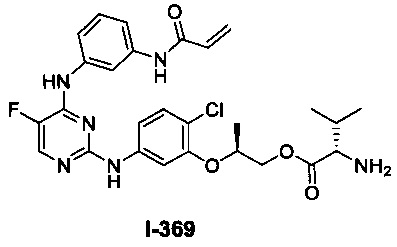
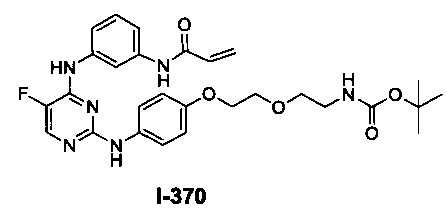
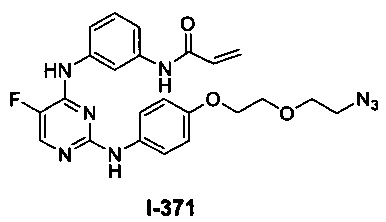
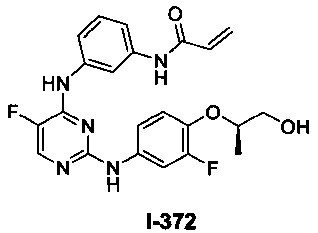
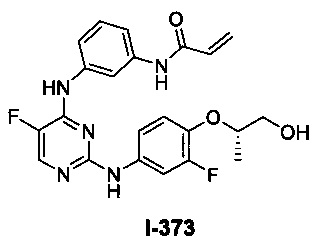
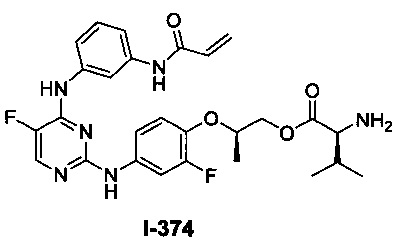
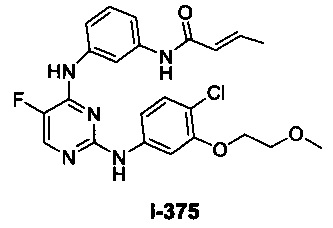
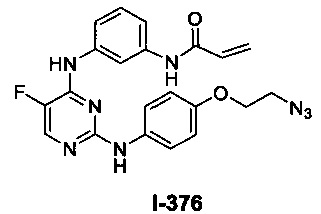
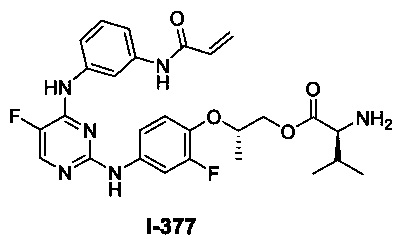
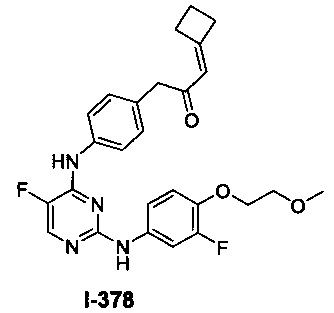
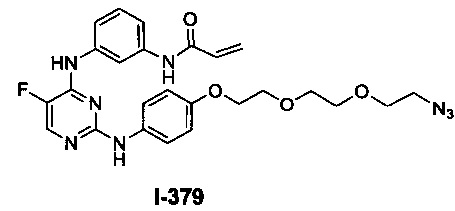
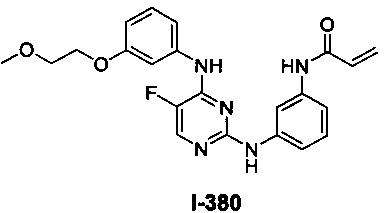
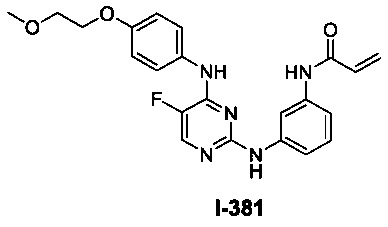
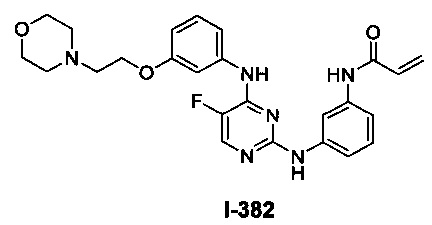
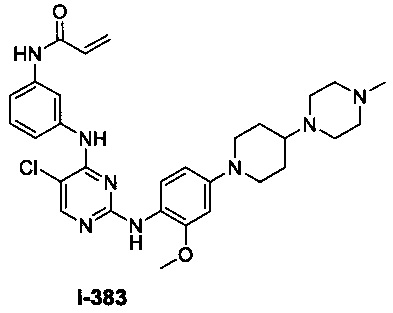
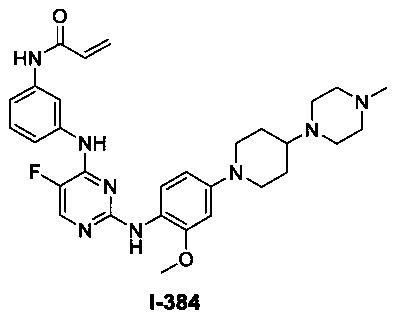
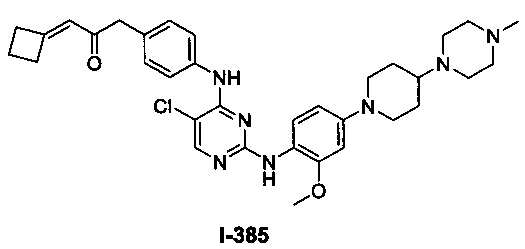
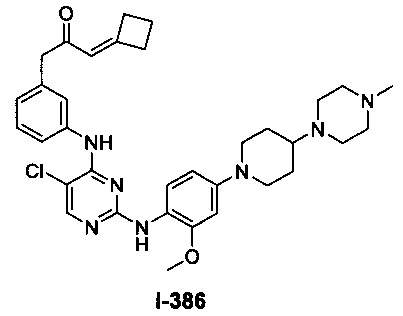
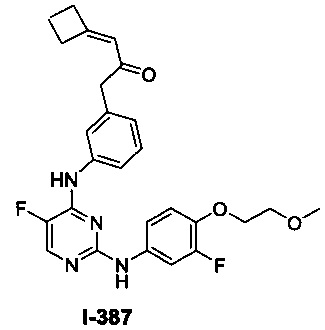
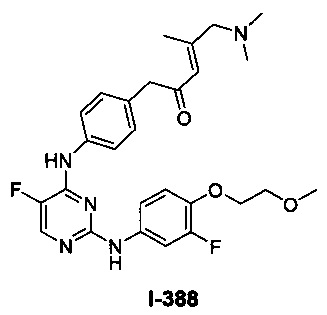
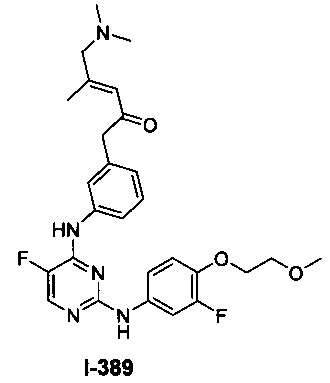
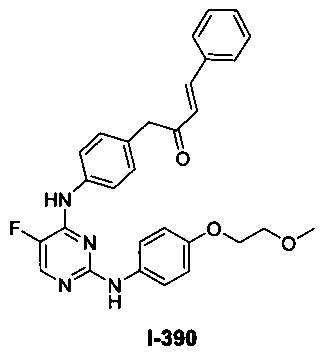
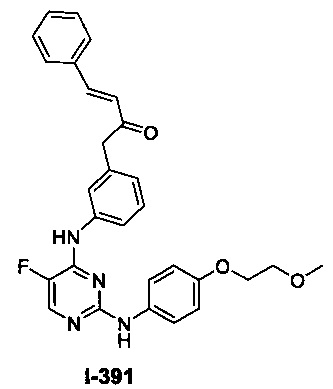
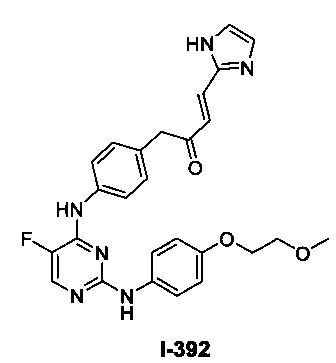
и 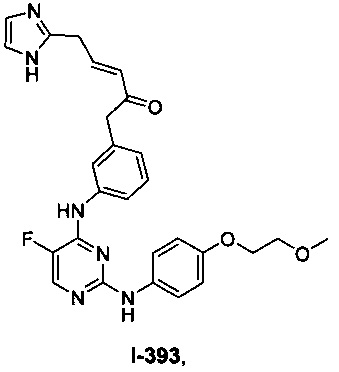
или его фармацевтически приемлемая соль,
для ингибирования активности киназы, выбранной из BTK, ErbB1, ErbB2, ErbB3 или ErbB4 или ее мутанта.
4. Соединение по п. 3, отличающееся тем, что киназная активность указанной BTK, ErbB1, ErbB2, ErbB3 или ErbB4 или ее мутанта ингибируется необратимо.
5. Соединение по п. 4, отличающееся тем, что киназная активность указанной BTK, ErbB1, ErbB2, ErbB3 или ErbB4, или ее мутанта, ингибируется необратимо за счет ковалентной модификации цистеина (Cys), выбранного из Cys 481 указанной BTK, Cys 797 указанной ErbB1, Cys 805 указанной ErbB2 и Cys 803 указанной ErbB4.
6. Соединение, выбранное из:
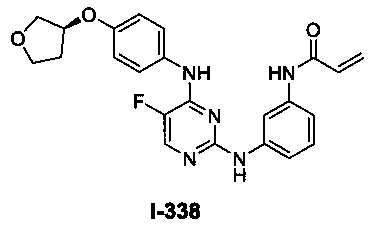
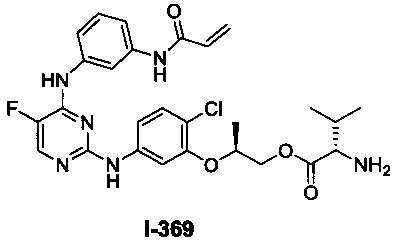
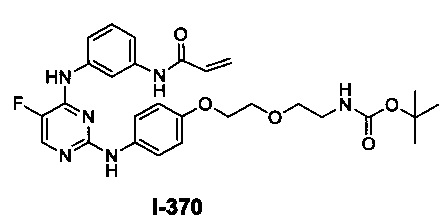
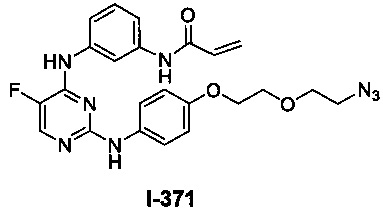
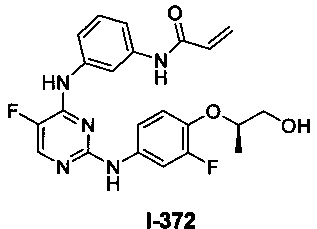
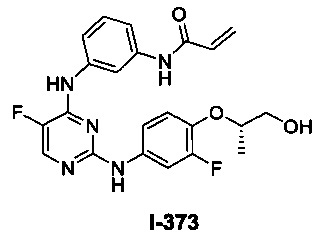
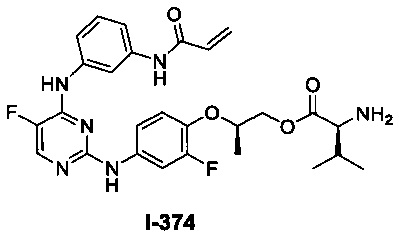
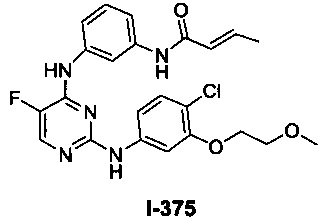
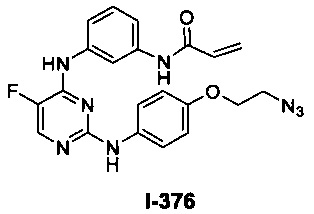

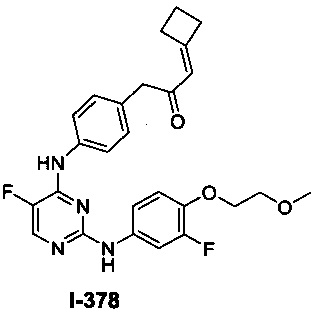
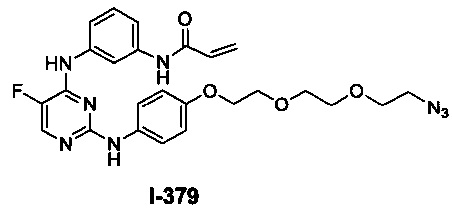
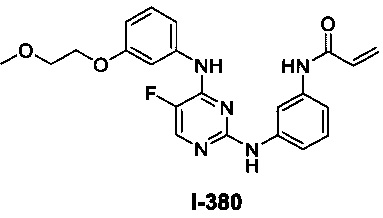
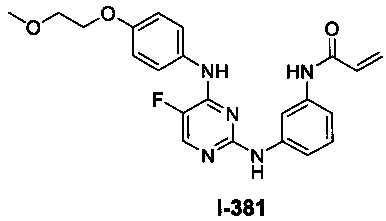
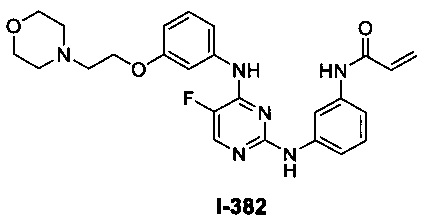
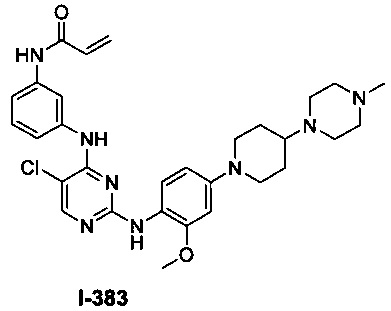
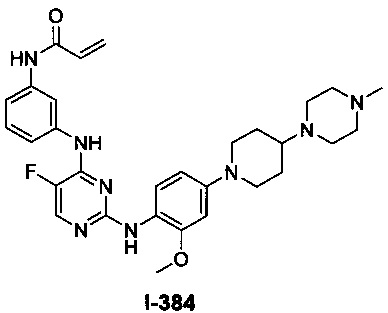
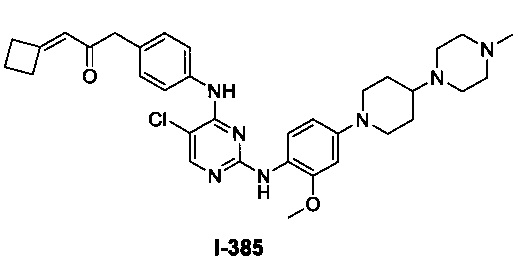
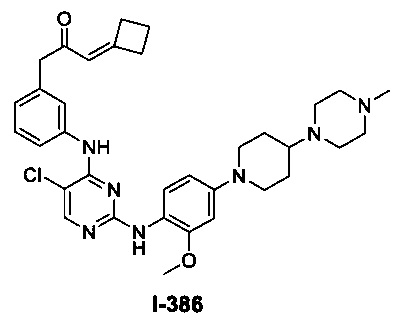
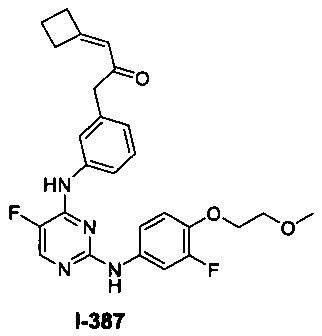
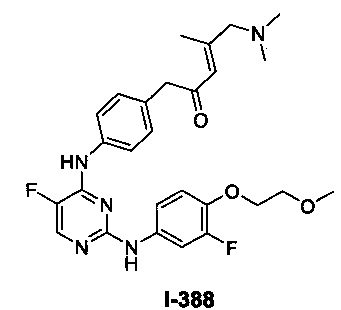
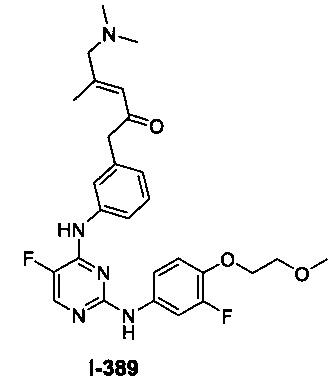
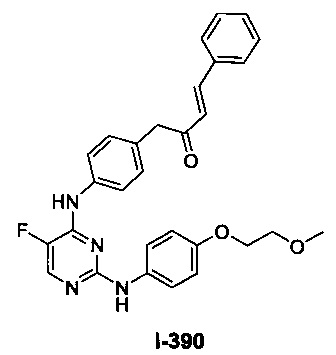
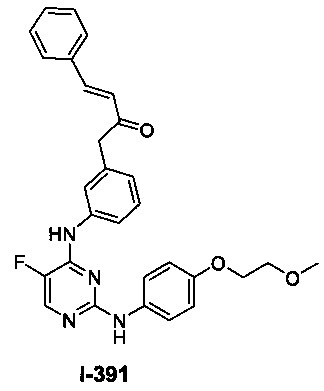

и 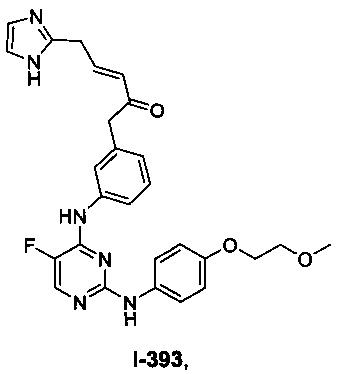
или его фармацевтически приемлемая соль,
для лечения нарушения, опосредованного киназой, выбранной из BTK, ErbB1, ErbB2, ErbB3 или ErbB4.
7. Соединение по п. 6, отличающееся тем, что указанное нарушение представляет собой нарушение, опосредованное киназой BTK, выбранное из аутоимунного заболевания, гетероиммунного заболевания, воспалительного заболевания, рака, заболевания костей и суставов или тромбоэмболического нарушения.
8. Соединение по п. 7, отличающееся тем, что указанное BTK-опосредованное нарушение выбрано из ревматоидного артрита, рассеянного склероза, диабета, В-клеточного хронического лимфоцитарного лейкоза, острого лимфоцитарного лейкоза, лейкоза ворсистых клеток, неходжкинской лимфомы, ходжкинской лимфомы, множественной миеломы, колоректального рака, рака поджелудочной железы, рака костей, метастаз в кости, остеопороза, синдрома раздраженного кишечника, болезни Крона, системной красной волчанки или нарушений, связанных с ренальным трансплантатом.
9. Соединение, выбранное из:
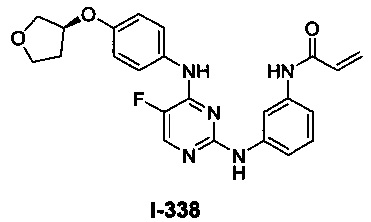
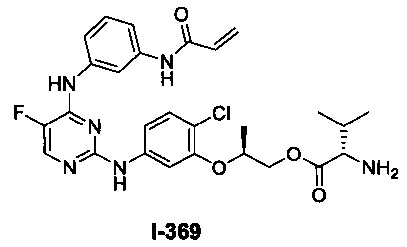
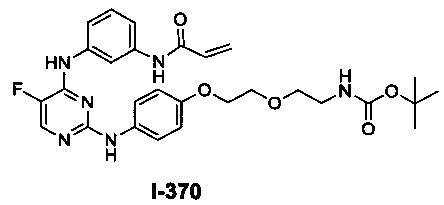
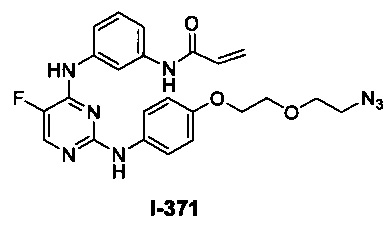
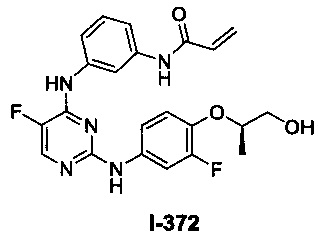
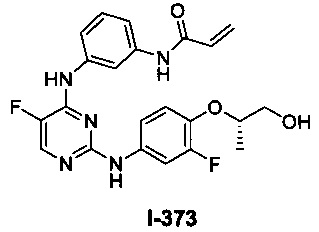
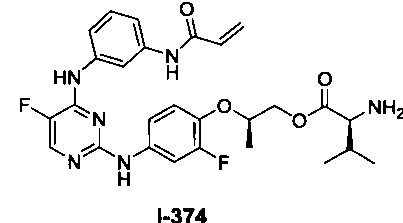
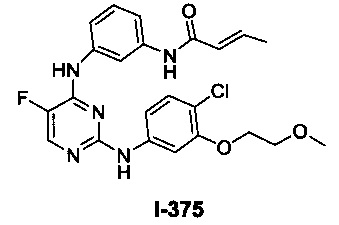
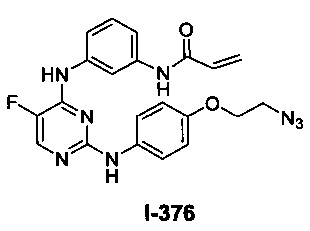
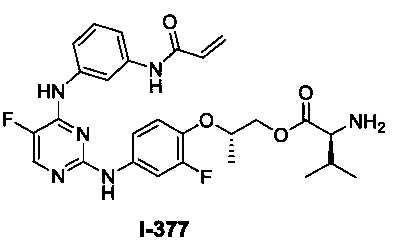
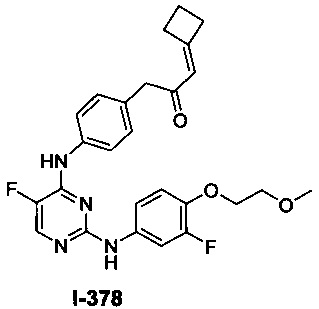
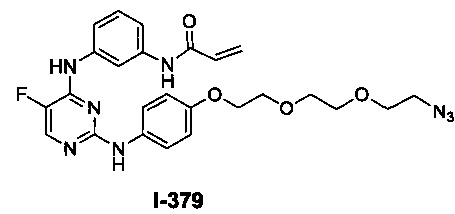
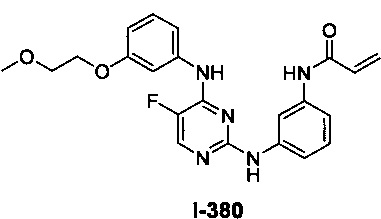
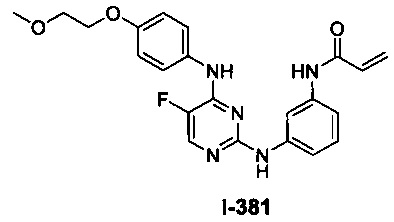
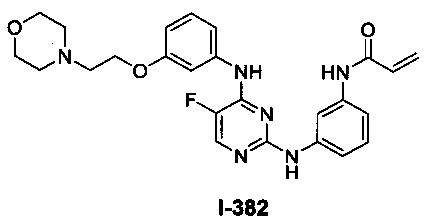
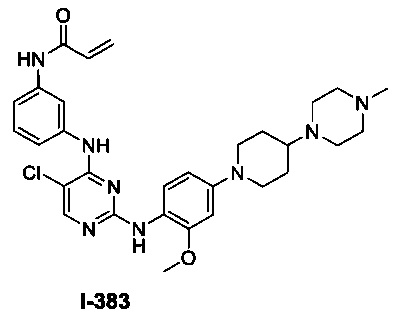
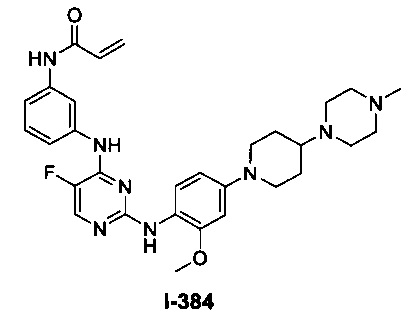
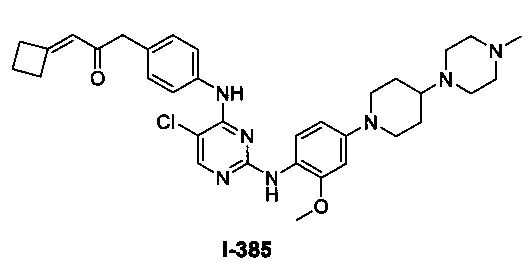
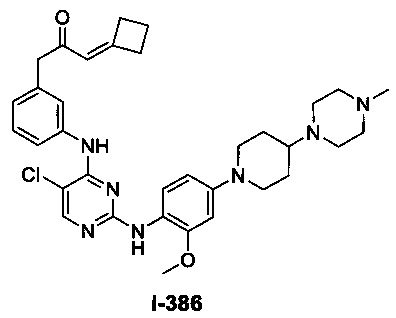
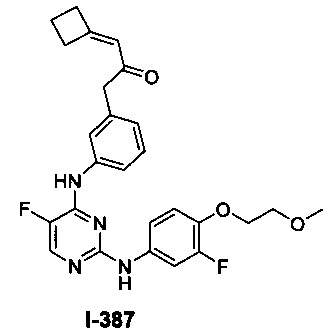
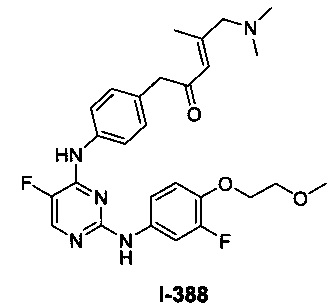
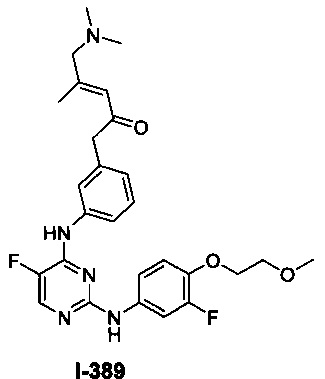
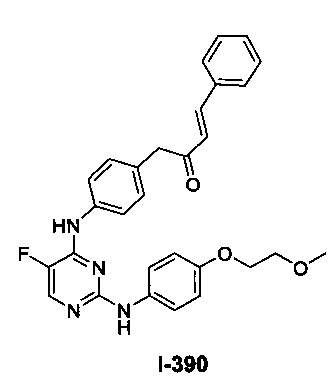
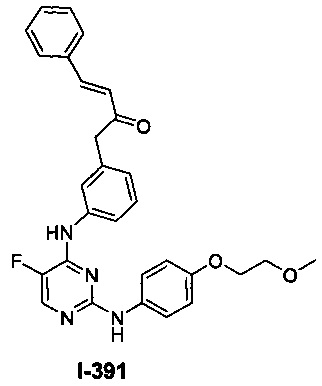
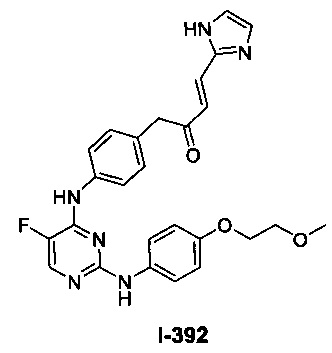
и 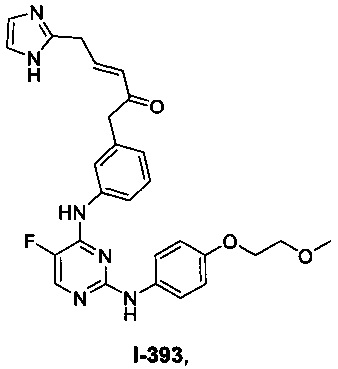
или его фармацевтически приемлемая соль,
для ингибирования активности одной или более киназ семейства ТЕС или их мутантов.
10. Соединение по п. 9, отличающееся тем, что активность указанной киназы семейства ТЕС или ее мутанта ингибируется необратимо.
11. Соединение по п. 10, отличающееся тем, что указанная киназа семейства ТЕС выбрана из одной или более киназ TEC, ITK или ВМХ.
12. Соединение по п. 11, отличающееся тем, что активность одной или более указанных киназ TEC, ITK или ВМХ ингибируется необратимо за счет ковалентной модификации Cys 449 указанной TEC, Cys 442 указанной ITK или Cys 496 указанной ВМХ.
13. Соединение, выбранное из:
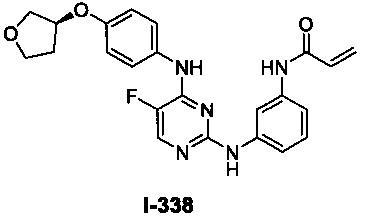
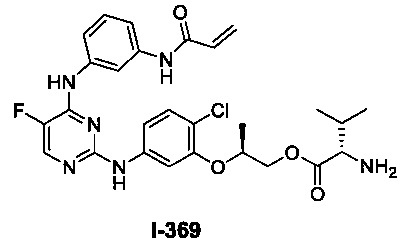
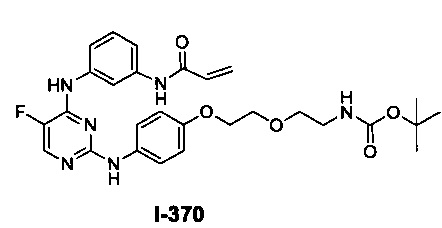
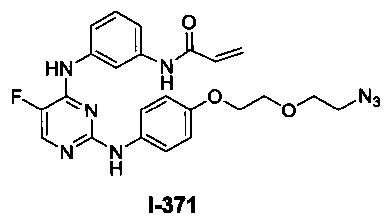
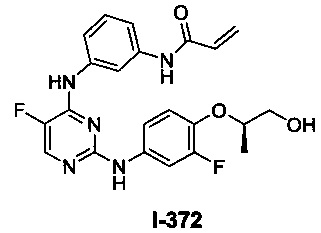
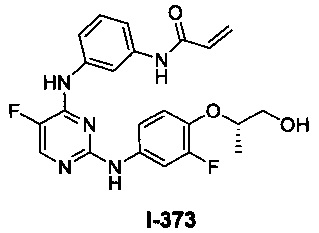
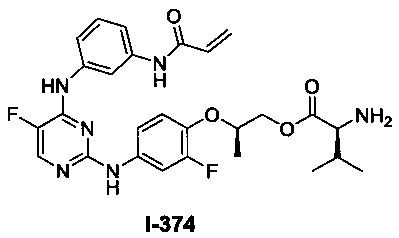
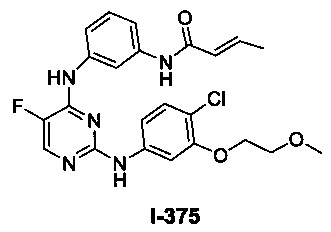
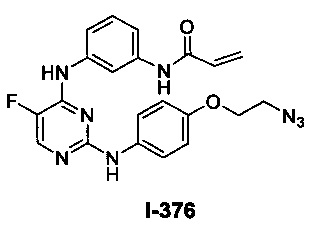
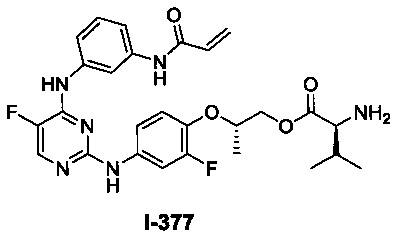
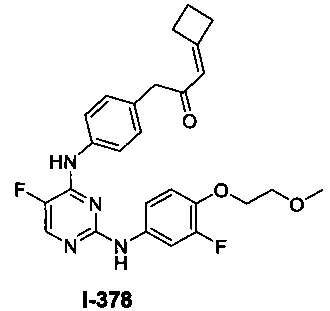
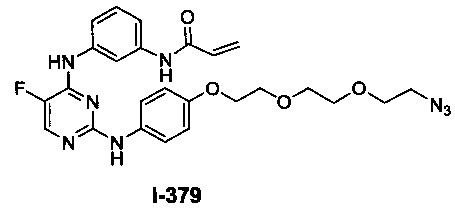
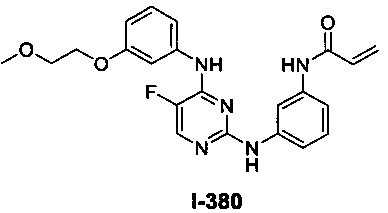
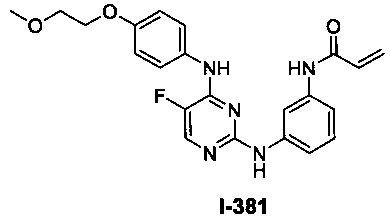
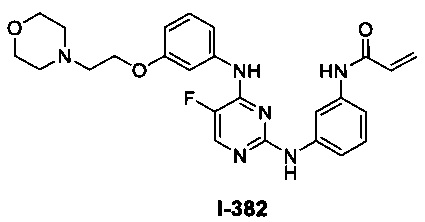
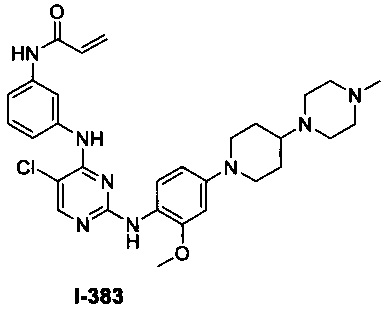
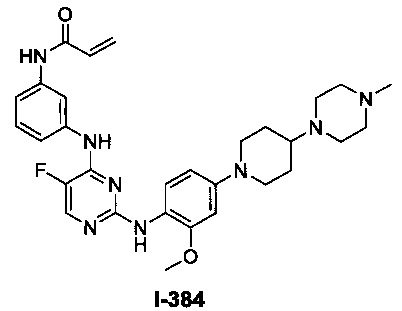
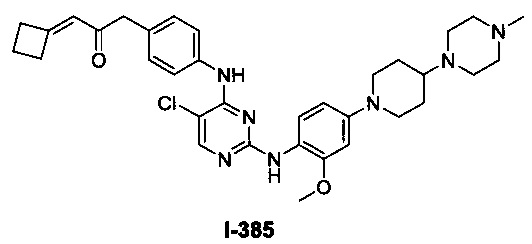
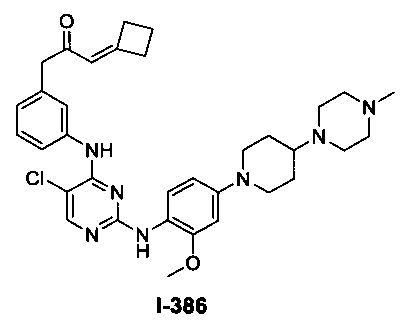
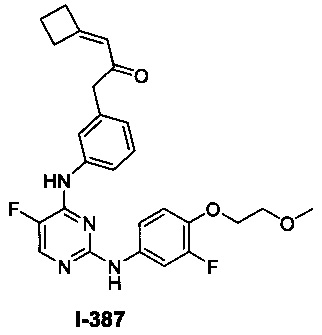
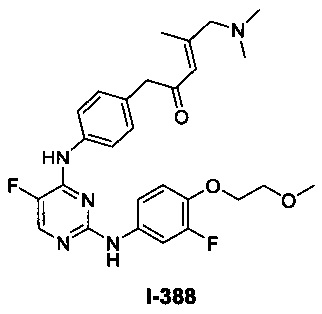
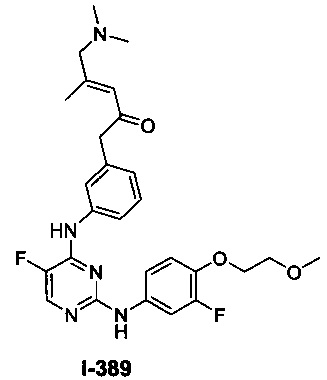
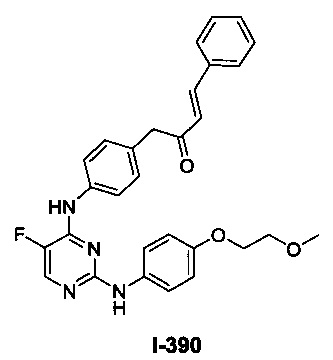
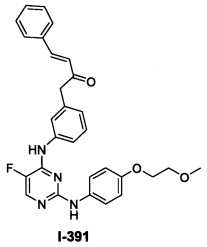
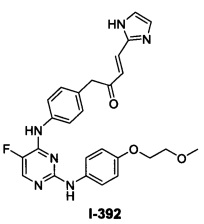
и 
или его фармацевтически приемлемая соль,
для лечения нарушения, опосредованного киназой семейства ТЕС.
14. Соединение по п. 13, отличающееся тем, что нарушение представляет собой опосредованное ТЕС нарушение, выбранное из аутоиммунного нарушения, воспалительного нарушения, пролиферативного нарушения, гиперпролиферативного заболевания, иммунноопосредованных заболеваний, заболевания дыхательных путей, заболевания костей и суставов, кожного нарушения, нарушения желудочно-кишечного тракта, системного заболевания или отторжения аллотрансплантата.
15. Соединение по п. 6, отличающееся тем, что указанное нарушение представляет собой нарушение, опосредованное ErbB1, ErbB2, ErbB3 или ErbB4, выбранное из карциномы, выбранной из рака молочной железы, глиобластомы, рака легких, рака головы и шеи, колоректального рака, рака мочевого пузыря, немелкоклеточного рака легких, карциномы сквамозных клеток, карциномы слюнных желез, карциномы яичников, колоректального рака или рака поджелудочной железы.
16. Соединение по п. 15, отличающееся тем, что указанное нарушение, опосредованное ErbB1, ErbB2, ErbB3 или ErbB4, выбрано из нейрофиброматоза I типа (NF1), нейрофиброматоза II типа (NF2), неоплазмы шванновских клеток (например, MPNST) или невриномы.
| US 2009137588 A1, 28.05.2009 | |||
| Wenjun Zhou et al., Novel mutant-selective EGFR kinase inhibitors against EGFR T790M Nature, 20091224 not Macmillan Journals Ltd., etc | |||
| ВОДЯНАЯ ТУРБИНА | 1922 |
|
SU462A1 |
| WO 2009017838 A2, 05.02.2009 | |||
| US 2008194603 A1, 14.08.2008 | |||
| US 2005085637 A1, 21/04/2005 | |||
| US 2006270694 A1, 30/11 | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| US 2008300268 A1, 04.12 | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
| Pubchem, 20100201 CID 44594695 | |||
| ПРОИЗВОДНЫЕ ПИРИМИДИНА, СПОСОБ ИХ ПОЛУЧЕНИЯ (ВАРИАНТЫ), ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ (ВАРИАНТЫ) И СПОСОБ ИНГИБИРОВАНИЯ | 2001 |
|
RU2299201C2 |
Авторы
Даты
2017-11-24—Публикация
2010-12-29—Подача