Изобретение относится к области биохимии, а также паразитологии, и может быть использовано для изучения биологических свойств личинок паразитических гельминтов, определения качества инвазионной продукции (тушек, мяса животных, субпродуктов животного происхождения) и тестирование средств и методов обезвреживания зараженного материала.
Значимость гликогена в жизнедеятельности биологических организмов сложно переоценить. Представляя собой основной запасной полисахарид, построенный из остатков глюкозы, он является легкодоступным источником энергии для различных метаболических процессов в клетках. Еще важнее его роль показана для организмов, обитающих в анаэробных условиях среды, где в отсутствии кислорода невозможен катаболизм жирных кислот, а, следовательно, и использование липидов в качестве источника энергии. В процессе анаэробного гликолиза АТФ образуется в небольшом количестве, поэтому, гликогена расходуется больше, и запасы его должны быть значительнее, чем у животных, обитающих в кислорододоступной среде. К таким организмам относятся многие эндопаразиты, например, трихинеллы, скрябингилюсы, стронгиляты, запасающие гликоген в личиночной стадии развития. Накопление гликогена личинками трихинелл играет несомненную роль в выживаемости их в мышцах, приживаемости в кишечнике последующих их хозяев, а также в наступлении половой зрелости взрослых нематод. Количество гликогена в личинках трихинелл, таким образом, влияет на инвазионные свойства гельминта.
Трихинеллез - гельминтозное заболевание человека и животных, относящееся к группе опасных гельминтозоонозов. При обнаружении в мясе или мясных продуктах личинок или капсул трихинелл независимо от их физиологического состояния, согласно ветеринарному законодательству, вся продукция подлежит полному уничтожению (утилизации). Для профилактики распространения инвазии среди людей в настоящее время имеется много методов и способов обезвреживания инвазионного материала в тушках, мясе, субпродуктах животных от личинок гельминта. После процесса обезвреживания от трихинелл животноводческую продукцию можно использовать для промышленной технической переработки (приготовления мясокостной муки).
В настоящее время в области паразитологии существуют разные методы определения концентрации гликогена, в основном качественного характера. Они основаны на биохимических реакциях и физико-химических методах. Определение гликогена в личинках и взрослых гельминтах производится также микроскопическим путем.
Наиболее используемым методом определения гликогена в организмах различных видов паразитических червей, в том числе и в личинках трихинелл, является ШИК-реакция (по названию реактивов - Шифф-йодная кислота) по Мак-Манусу [2, 5, 8]. Данный гистохимический метод представляет собой качественную реакцию с использованием раствора йодной кислоты, окисляющей оксигруппы до альдегидных, и фуксин-сернистой кислоты (реактив Шиффа), в результате взаимодействия с которой они окрашиваются в фиолетово-красный цвет. Помимо гликогена ШИК положительную реакцию дают и другие вещества углеводной природы: гликопротеины, полисахариды, некоторые мукополисахариды, гликолипиды и другие. Дифференциация гликогена от этих составных осуществляется путем предварительной обработки образцов амилазой или диастазой, после чего гликоген более не окрашивается. Также применяется модифицированная ШИК-реакция по Шабадашу [2, 5], в которой окисление групп производится периодатом калия или натрия.
Реже, в паразитологии, упоминается менее специфический метод Морриса [2, 5] по определению гликогена, основанный на расщеплении сложных углеводов до моносахаров в сильнокислой среде с последующей их дегидратацией и образованием гидроксиметилфурфурола, образующего при реакции с антроном комплексное соединение синевато-зеленого цвета. Интенсивность образовавшейся окраски прямо пропорциональна содержанию Сахаров в реакционной среде.
Электронная микроскопия (метод морфологического исследования объектов с помощью потока электронов) позволяет изучать структуру сколецид на макромолекулярном и субклеточном уровнях, в том числе выявлять гранулы гликогена. Объекты обычно фиксируют химическими реагентами (альдегидами, четырехокисью осмия), обезвоживают (спиртом, ацетоном), пропитывают эпоксидными смолами и режут на специальных микротомах на ультратонкие срезы (толщиной 100-600  ). Для повышения контраста изображения клеток их обрабатывают «электронными красителями», сильно рассеивающими электроны (уранилацетатом, гидроокисью свинца) [3-5].
). Для повышения контраста изображения клеток их обрабатывают «электронными красителями», сильно рассеивающими электроны (уранилацетатом, гидроокисью свинца) [3-5].
В основе используемого нами метода по определению концентрации гликогена в личинках трихинелл легла методика Е.О. Данченко и А.А. Чиркина (2010) [1] по определению гликогена в тканях человека (биопсийного материала при жизни или в трупном материале при судебно-медицинской экспертизе), основанная на окраске данных молекул йодом. Концентрацию гликогена рассчитывают по градуировочному графику [1]. Способ определения качественного и количественного содержания гликогена в органах и тканях человека основан на использовании биохимических реакций и измерения оптической плотности на фотоэлектрическом микроколориметре.
Прототип является наиболее используемым в области биохимической диагностики судебно-медицинской экспертизы, при которой разрешаются вопросы дифференциальной диагностики смерти человека при различных обстоятельствах. Для исследования используют определение концентрации гликогена в скелетных мышцах, сердце, печени. Данный прототип можно также применять в отраслях сельскохозяйственной биологии (определение гликогена в икре рыб, личинках пчел и другом материале), ветеринарно-санитарной экспертизы (содержание гликогена в мясе и субпродуктах промысловых животных и птиц), а также в области паразитологии. Данный способ в разделах гельминтологии можно использовать для изучения биологических свойств личинок и взрослых гельминтов, физиологического состояния, для определения качества инвазированной продукции (тушек, мяса животных, субпродуктов животного происхождения) и тестирование средств и методов обезвреживания зараженного материала.
Цель изобретения заключалась в определении чувствительности способа, отработке методики определения количественной концентрации гликогена в личинках разных видов трихинелл, в установлении динамики содержания гликогена в мышечных личинках гельминта, хранившихся в тушках экспериментально инвазированных крыс в зимне-весенний период, а также в исследовании качества метода обезвреживания инвазионного материала в тушках промысловых животных.
Принцип изобретения заключается в окраске молекул гликогена личинок трихинелл йодным реактивом. Максимальную положительную реакцию на присутствие гликогена у трихинелл проявляют стихоциты - клетки стихозомы, хорошо выраженные на переднем конце тела личинки. В отличие от прототипа нами использовался фотоэлектрический колориметр МКМФ-02 для измерения оптического пути при длине волны 425 нм против холостой пробы.
Выделение личинок трихинелл путем пассивного пептолиза проводили следующим образом. Личинки трихинелл выделяли из трупов экспериментально инвазированных лабораторных животных методом пассивного переваривания в искусственном желудочном соке (ИЖС). ИЖС готовили путем растворения в 1 литре воды 10 мл концентрированной соляной кислоты и 3 г пепсина. Зараженных трихинеллезом крыс подвергали эвтаназии медицинским эфиром, снимали шкуры, удаляли внутренние органы и пропускали через мясорубку. Костно-мышечный фарш делили на небольшие порции по 5-15 г и помещали в сетчатые мешки (диаметр ячеек 0,34 мм), которые погружали в стеклянные стаканы объемом 1 л, наполненные ИЖС. Емкости оставляли в термостате при температуре 37°С на 3 ч для личинок трихинелл вида Trichinella pseudospiralis и на 18 ч для личинок Т. nativa (пассивный метод переваривания по Ю.А. Березанцеву, 1960). В процессе пептолиза личинки проходят через ячейки и концентрируются на дне емкости. После истечения указанного времени осадок промывали водопроводной водой и отстаивали, повторяли при необходимости до тех пор, пока надосадочная жидкость не станет прозрачной (3-5 раз). Осажденных личинок собирали пипеткой и переносили в стерильный 0,9% раствор хлорида натрия. Полученную взвесь личинок трихинелл исследовали на наличие гликогена.
Для вычисления содержания гликогена в одной личинке делили получившееся значение на количество личинок в одной капле, предварительно рассчитанное для каждой пробы. Подсчет личинок трихинелл в капле проводили в камере Мигачевой-Котельникова (1987), предназначенная для подсчета яиц, личинок гельминтов, ооцист простейших [7]. Для этого в 10 мл воды помещали 1 каплю личинок трихинелл, тщательно перемешивали ресуспензированием полиэтиленовой пипеткой и быстро отбирали 0,25 мл взвеси. Раскапывали по 6 лункам. Производили подсчет личинок при увеличении микроскопа ×10. Повторяли операцию 3 раза. Определяли общее среднее количество личинок в объеме 0,25 мл. Затем, полученное число умножали на количественное разведение (х40).
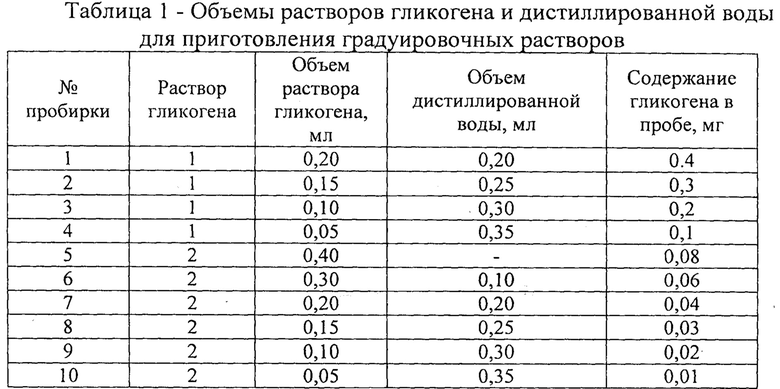
Подготовку реагентов для проведения биохимической реакции проводили последовательно (табл. 1). Водный раствор йода в йодиде калия получали растворением в 10 мл дистиллированной воды 0,26 г кристаллического йода и 2,6 г йодида калия. Йодный реактив готовили, смешивая 130 мл насыщенного раствора хлорида кальция с 0,5 мл раствора йода в йодиде калия, непосредственно перед добавлением к пробам. Для построения градуировочного графика были приготовлены градуировочные растворы гликогена, содержащие от 0,01 до 0,4 мг гликогена в пробе. Для этого 10 мг гликогена (Sigma, Германия) растворяли в 5 мл дистиллированной воды (раствор 1, концентрация 2 мг/мл). К 1 мл раствора 1 добавляли 9 мл дистиллированной воды (раствор 2, концентрация 0,2 мг/мл). Для приготовления градуировочных растворов смешивали указанные в таблице 1 объемы растворов гликогена и дистиллированной воды.
К градуировочным растворам добавляли 2,6 мл йодного реактива. Холостую пробу готовили смешиванием 0,4 мл дистиллированной воды и 2,6 мл йодного реактива. Оптическую плотность градуировочных растворов измеряли на медицинском фотоэлектрическом микроколориметре МКМФ-02 в кювете с длиной оптического пути 5 мм при длине волны 425 нм против холостой пробы.
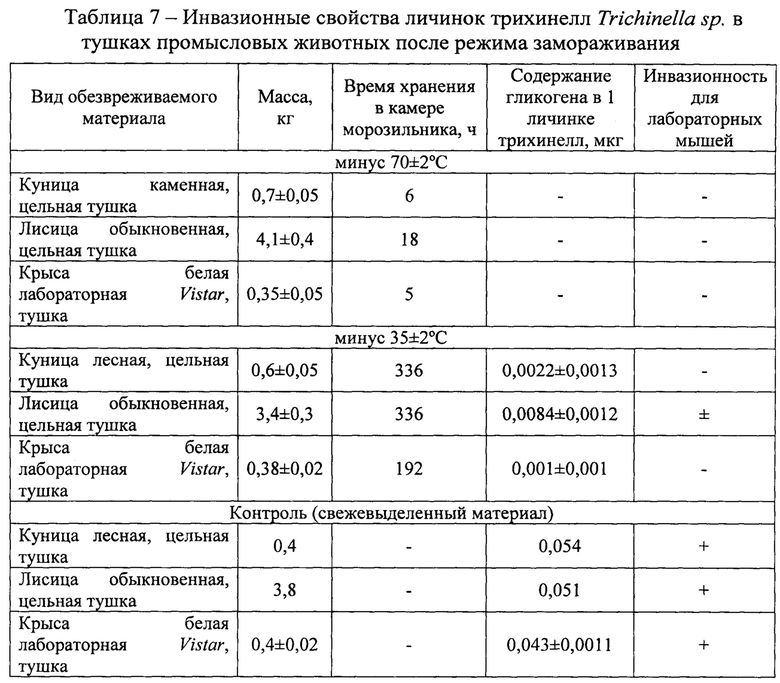
Градуировочный график строили, откладывая по оси абсцисс содержание гликогена в пробе (в мг), по оси ординат - величины оптической плотности градуировочных растворов (рис. 1).
Расчет концентрации гликогена в одной личинке трихинелл проводили по формуле:
С=E×k/F×N,
где, С - концентрация гликогена в одной личинке трихинелл (мг),
Е - оптическая плотность анализируемой пробы,
k - отношение коэффициента разведения пробы к количеству капель исследуемой взвеси,
F - тангенс угла наклона градуировочной кривой,
N - количество личинок трихинелл в одной капле.
Определение концентрации гликогена в личинках трихинелл проводили в следующем порядке. Вначале, в центрифужные пробирки (по 3 параллельные пробы) помещали по 1 (или более) капле личинок нематод. Далее, добавляли 0,9 мл 33% раствора гидроксида калия. Пробирки нагревали в течение 20 мин при 100°С на водяной бане и охлаждали под проточной водой. Потом, добавляли 1,3 мл 96% этилового спирта и перемешивали. Пробирки помещали на водяную баню, нагревали раствор в течение 5 мин. и быстро охлаждали под проточной водой для преципитации гликогена. После охлаждения пробирки центрифугировали в течение 15 мин. при 3000 об./мин.. Надосадочную жидкость сливали и пробирки высушивали, перевернув их на фильтровальную бумагу. При необходимости проводили репреципитацию гликогена после добавления 0,9 мл дистиллированной воды, 1,3 мл 96% этилового спирта и повторяли кипячение с последующим охлаждением, центифугирование и высушивание осадка в пробирках. В пробирки по стенке добавляли по 0,2 мл насыщенного раствора хлорида аммония и осадок тщательно перемешивали стеклянной палочкой. Этот этап необходим для нейтрализации избытка щелочи, поскольку из-за образования гипойодида при рН>7,0 оптическая плотность растворов уменьшается. Пробирки нагревали в течение 5 мин. на водяной бане при 100°С и охлаждали под проточной водой. Добавляли по 0,2 мл дистиллированной воды и 2,6 мл йодного реактива. Для приготовления холостой пробы смешивали 0,2 мл насыщенного раствора хлорида аммония, 0,2 мл дистиллированной воды и 2,6 мл йодного реактива. Измеряли оптическую плотность на микроколориметре медицинском фотоэлектрическом МКМФ-02 в кювете с длиной оптического пути 5 мм при длине волны 425 нм против холостой пробы.
При определении концентрации гликогена в пробах личинок, полученных из мышц экспериментально инвазированных белых крыс, использовался градуировочный график, который строили согласно измеренным на микроколориметре показателям оптической плотности градуировочных растворов. Тангенс угла наклона составил 1,3. За единицу измерения концентрации гликогена для удобства принимали микрограммы на 1 каплю личинок трихинелл, хотя данные единицы не относятся к СИ.
По результатам полученных исследований впервые предложена методика по качественному и количественному определению содержания гликогена в личинках трихинелл. На примере возбудителей трихинеллеза T.nativa и Т. pseudospiralis установлена концентрация гликогена в мышечных личинках. Определена динамика количественного содержания гликогена в мышечных личинках трихинелл, хранившихся в естественных условиях в зимне-весенний период, и изучены инвазионные свойства возбудителя гельминтоза в тушках лабораторных и промысловых животных.
Предлагаемый метод определения гликогена в личинках трихинелл отражен в следующих примерах.
Пример 1. Изучение влияния положительных температур на количество гликогена в личинках трихинелл
В исследованиях были использованы личинки трихинелл видов Т. nativa и Т. pseudospiralis [10]. Выделенных с помощью пассивного пептолиза [6] личинок трихинелл, из мышечного фарша экспериментально инвазированных крыс, помещали в физиологический раствор в условия термостата при 37±2°С. Каждые сутки (часы) оценивали жизнеспособность личинок до тех пор, пока все особи не потеряли двигательную активность. Далее, определяли количество гликогена в неподвижных личинках трихинелл. Как известно, при данной температуре личинки обладают подвижностью до тех пор, пока запасы источников энергии, т.е гликогена, не снизятся до предельного уровня.
В первом опыте определяли содержание гликогена в свежевыделенных личинках трихинелл и полностью утративших свою двигательную активность при хранении в физиологическом растворе личинках Т. nativa при температуре термостата 37±2°С. Концентрацию гликогена в личинках определяли по представленному градуировочному графику. В начале эксперимента уровень гликогена у свежевыделенных капсулообразующих личинок трихинелл составил 0,042 мкг в пересчете на одну личинку трихинелл. На третьи сутки, когда личинки утратили двигательную активность и при этом еще хранились в термостате, уровень гликогена составил 0,007 мкг в пересчете на одну личинку трихинелл.
Во втором опыте личинок безкапсульных трихинелл Т. pseudospiralis в процессе пептолиза мышечной ткани хозяина оставили в термостате на ночь.
Через 18 часов при нахождении в ИЖС и температуре 37±2°С количество подвижных личинок снизилось до значения 3,5%. Концентрация гликогена в таких личинках составила 0,0047 мкг (в пересчете на одну личинку трихинелл).
Пример 2. Определение чувствительности метода определения содержания гликогена в личинках трихинелл.
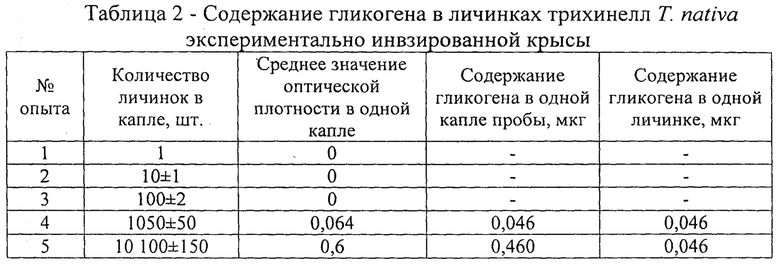
Содержание гликогена определяли на примере возбудителя 71 nativa, локализованный в мышечной ткани экспериментально зараженной белой крысе. Для исследования брали каплю взвеси выделенных трихинелл из мышечной ткани животных после аутамназии. Число выделенных личинок трихинелл в капле составляло 1, 10, 100, 1050 и 10 100 экземпляров (табл. 2).
Подсчет личинок трихинелл проводили в камере Могилевой-Котельникова в трех исследуемых пробах каждого поставленного опыта. Значения оптической плотности на фотоэлектрическом микроколориметре МКМФ-02 в кювете с длиной оптического пути 5 мм при длине волны 425 нм определили только в каплях, где содержание личинок трихинелл было 1050 и 10 100 экземпляров.
Показатели ее значения составили 0,064 и 0,6. Содержание гликогена в пересчете на одну личинку трихинеллы составило 0,046 мкг. Таким образом, достоверный интервал определения гликогена на вышеуказанном приборе составляет от 1000 до 10000 личинок трихинелл в капле исследуемой взвеси.
Пример 3. Определение уровня гликогена личинок трихинелл в тушках инвазированных крыс во время хранения в естественных условиях в зимне-весенний период
Уровень гликогена мышечных личинок трихинелл изучали на протяжении 5 месяцев (с января по май) в естественных условиях Центрального региона России. Цельные тушки лабораторных крыс, инвазированных Т. nativa и Т. pseudospiralis, закладывали на хранение на территории охотохозяйства Рязанской области. Инвазионный материал закрывали полиэтиленовыми пакетами и металлической сеткой от крупных хищников и птиц. Отбор проб проводили ежемесячно, начиная с января.
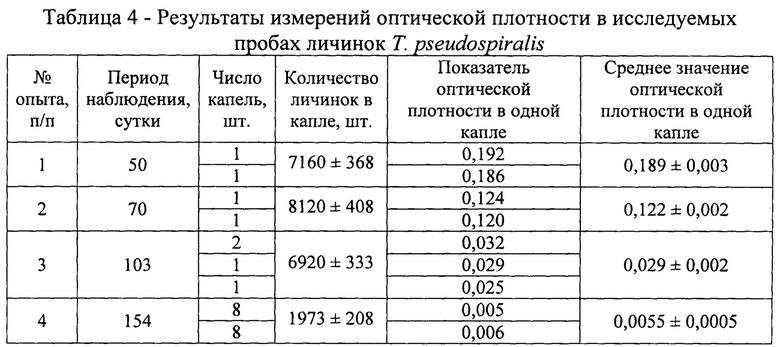
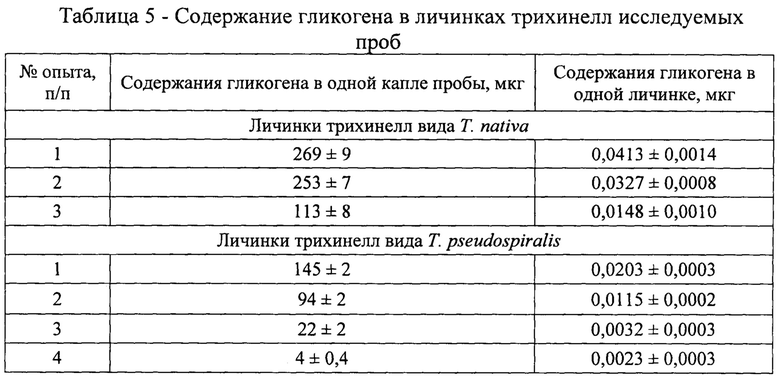
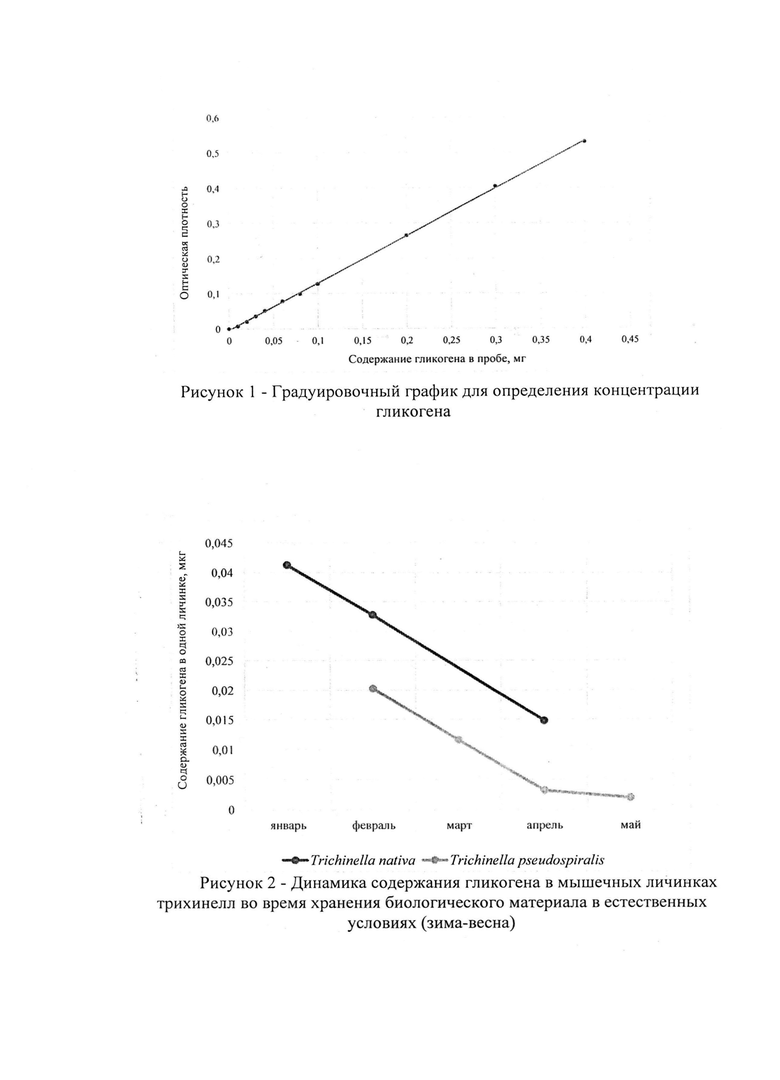
Оптическую плотность определяли в одной (январь - апрель), двух (апрель), восьми (май) каплях, содержащих личинок гельминтов, учитывая их концентрацию гликогена за время хранения биологического материала в условиях эксперимента. Показатели оптической плотности по средним значениям снижались в проведенных исследованиях от 0,350 в январе до 0,147 в апреле для трихинелл Т. nativa и от 0,189 в феврале до 0,0055 в мае для Т. pseudospiralis (табл. 3 - 4). С использованием полученных сведений было установлено среднее содержание гликогена в одной капле и одной личинке трихинелл. Результаты представлены в таблице 5 и рисунке 2.
Анализируя приведенные выше данные, можно заметить, что концентрация гликогена последовательно уменьшается в личинках трихинелл обоих видов с течением времени. Так, содержание гликогена в одной личинке Т. nativa в январе составляет 0,0413±0,0014 мкг, в феврале - 0,0327±0,0008 мкг, в апреле - 0,0148±0,0010 мкг. В опытах с Т. pseudospiralis получены несколько иные результаты. В феврале в личинках гликоген содержится в количестве 0,0203±0,0003 мкг, в марте - 0,0115±0,0002 мкг, в апреле - 0,0032±0,0003 мкг, в мае - 0,0023±0,0003 мкг.
На рисунке 2 также видно, что динамика содержания гликогена в личинках трихинелл двух разных видов Т. nativa и Т. pseudospiralis, во время хранения биологического материала в естественных условиях в зимне-весенний период, схожа между собой. Это подтверждает факт наличия единых механизмов сохранения возбудителя трихинеллеза в природе.
Пример 4. Определение инвазионной способности личинок трихинелл хранившихся в естественных условиях в зимне-весенний период
Инвазионную способность личинок определяли на последнем сроке исследований (для Т. nativa в апреле, для Т. pseudospiralis в мае) по показателю приживаемости и инвазионности на лабораторных мышах (табл. 6). Приживаемость трихинелл определяли по отношению числа обнаруженных в кишечнике лабораторных мышей взрослых гельминтов к числу заданных, выраженное в процентах. Доза инвазирования животных составляла 100±2 личинок на голову. Учет результатов приживаемости проводили через 7 суток путем аутамназии животных, вскрытия трупов, препарирования кишечника и подсчета взрослых гельминтов на компрессории при увеличении ×4. Инвазионность личинок трихинелл определяли по образованию новорожденных личинок в мышечной ткани лабораторных мышей на 45 сутки после пероральной дачи возбудителя. Доза инвазирования была аналогичной, что и при определении показателя приживаемости. После вышеуказанного срока животных подвергали аутамназии, а мышечную ткань исследовали на наличие личинок трихинелл. При обнаружении личинок трихинелл в мышечной ткани биопроба считалась положительной. Концентрацию гликогена определяли по вышеуказанной методике. В качестве контроля использовали свежевыделенные личинки трихинелл обоих видов из тушки экспреиментально инвазированных крыс (возраст личинок после заражения составил 5 мес.).
В результате проведенной работы выяснилось, что приживаемость личинок трихинелл для Т. nativa на крайнем сроке хранения составила 5,3%, для 71 pseudospiralis - 3,3%. Инвазионность личинок трихинелл после периода хранения зараженных тушек крыс для возбудителя Т. nativa оказалось иной. Из трех лабораторных мышей заразилась одно животное. Для возбудителя Т. pseudospiralis инвазионность была отрицательной. При этом, содержание гликогена в одной личинке трихинеллы Т. nativa в апреле составило 0,0148 мкг, а у возбудителя Т. pseudospiralis 0,0023 мкг.
В контроле же показатель приживаемости для обоих видов трихинелл составил 18,2% и 16,7% соответственно. Биопроба на мышах обоих возбудителей оказалось положительной.
Пример 5. Определение инвазионности личинок трихинелл тушек промысловых животных после обезвреживания зараженного материала замораживанием
Инвазионную способность личинок трихинелл в тушках промысловых животных определяли после режима замораживания при минус 35±2°С и минус 70±2°С (табл. 7). Для исследования использовались естественно инвазированные капсулообразующим возбудителем трихинеллеза Trichinella sp.цельные тушки 5-х куниц, 5-х лисиц и экспериментально зараженных возбудителем трихинеллеза Trichinella sp. 9-ти лабораторных крыс природным изолятом трихинелл (возраст личинок в мышцах лабораторных животных составил 48 суток после заражения). В качестве контроля использовали по одной тушке лисицы и куницы и 3-х инвазированных крыс без проведения замораживания мышечной ткани. Для проверки на инвазионность личинок природного возбудителя трихинеллеза использовали лабораторных мышей по 3 головы в каждой исследуемой группе.
На первом этапе исследований, когда замораживали тушки животных инвазированные личинками гельминта при минус 70±2°С, результаты эксперимента были следующими. При экспозиции 2-х тушек куниц в течение 6 часов, 2-х тушек лисиц в течение 18 часов и 3-х тушек лабораторных крыс в течение 5 часов, содержание гликогена у выделенных личинок трихинелл из мышечной ткани мы не обнаружили, так как число выпавших личинок в осадок было от 40 до 112 экземпляров с тушки. Трихинеллы оказались не инвазионными для лабораторных мышей при введенной перорально дозе 100±2 личинок гельминта на голову лабораторной мыши. В период быстрого охлаждения трихинеллы частично теряли гликоген и быстро погибали через несколько часов за счет кристаллизации воды во внутренних органах и тканях возбудителя.
У замороженных тушек животных при минус 35±2°С результаты исследований были отличны от первого этапа. У личинок трихинелл выделенных из тушек куниц содержание гликогена было 0,0022 мкг, из лисиц 0,0084 мг, а из крыс 0,001 мкг. Биологическая проба личинок трихинелл выделенных из тушек куниц и крыс, была отрицательной. Трихинеллы, выделенные из мышечной ткани тушек лисиц инвазировали 2-ух из 3-ех лабораторных животных. Личинки гельминта, вероятно, частично погибали также после кристаллизации воды во внутренних органах и тканях, но при этом уровень гликогена для сохранения жизнеспособности был исчерпан значительно. Тушки куниц и крыс вымерзли достаточно быстро из-за своей относительно небольшой массы мышечной ткани, поэтому в них возбудитель трихинеллеза достаточно быстро израсходовал гликоген (за 14 и 8 суток) и погиб. В тушках лисиц возбудитель трихинеллеза сохранил инвазионную способность за счет недостаточного промерзания и, наверняка, возраст мышечных личинок (тушек промысловых животных) был значительно высоким по сравнению с личинками трихинелл локализовавшихся в мышечной ткани лабораторных крыс.
В контроле у инвазированных капсулообразующим возбудителем трихинеллеза Trichinella sp.тушек куницы, лисицы и лабораторных крыс личинки трихинелл содержали 0,054, 0,051 и 0,043 мкг гликогена. Биологическая проба на лабораторных мышах оказалась положительной, все 9 животных на 45 сутки опыта содержали мышечные личинки возбудителя.
Таким образом, при содержании гликогена не более 0,002 мкг в одной личинке трихинелл, выделенных из тушек животных, материал считается обезвреженным.
Источники информации принятые во внимание при составлении заявки
1. Чиркин А.А., Данченко Е.О. Новый методический подход к определению концентрации гликогена в тканях и некоторые комментарии по интерпретации результатов // Судебно-медицинская экспертиза. - 2010. - №3. - С. 25-28.
2. Геллер Э.Р. Трихинеллез / Э.Р. Геллер. - М. - 1976. - С. 6-41.
3. Корнакова Е.Е. Ультрастурктура паренхимы и экстраклеточного матрикса Passerilepis crenata (Cestoda: Cyclophyllidae) II Журнал Паразитология. - 1994. - №28, 2. - С. 119-126.
4. Корнева Ж.В., Давыдов В.Г., Бисерова Н.М. Адаптационныые преобразования мышечных клеток прикрепительных аппаратов цестод // Журнал Паразитология. - 1998. - №32, 3. - С. 193-202.
5. Гинецинская Т.А., Добровольский А.А., Оксов И.В. Роль гликогена в биологии личиночных стадий развития трематод // Работы по гельминтологии. - М.: Наука. - 1981. - С. 82-87.
6. Березанцев Ю.А. Простой способ исследования мышц на трихинел- лез методом переваривания в искусственном желудочном соке // Лабораторное дело. 1960. №6. С. 7, 8.
7. Мигачева Л.Д., Котельников Г.А. Рекламации Госагропрома СССР по внедрению достижений науки и практики в производство. // М. - 1987. - №6. - С. 85-87.
8. RU 2256320, A01K 67/00, G01N 33/52, 2005.
9. RU 1370568, А01, G01N 33/48, 1988.
10. Тулов А.В., Звержановский М.И., Янагида Т., Коняев СВ., Андреянов О.Н., Малкина А.В., Однокурцев В.А., Бондарев А.Я., Середкин И.В., Есаулова Н.В., Накау М., Сако Я., Ито А. Видовое и генетическое разнообразие трихинелл у представителей семейства Псовых (Canidae) в России // Журнал: Актуальные вопросы ветеринарной биологии. - 2013, №1, С. 35-41.
ПРИЛОЖЕНИЕ


| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ОБЕЗВРЕЖИВАНИЯ ЛИЧИНОК ТРИХИНЕЛЛ МЕТОДОМ ЗАМОРАЖИВАНИЯ В ТУШКАХ НЕКОТОРЫХ ПУШНЫХ ЗВЕРЕЙ | 2012 |
|
RU2489026C1 |
| Способ обеззараживания проб мышечных тканей плотоядных животных, инвазированных личинками трихинелл в лабораторных условиях | 2023 |
|
RU2820538C1 |
| СПОСОБ ПОЛУЧЕНИЯ ИММУНОГЕННОГО АНТИГЕНА Trichinella spiralis | 2005 |
|
RU2287342C1 |
| АДЪЮВАНТНАЯ КОМПОЗИЦИЯ ДЛЯ ИНЪЕКЦИОННЫХ ВАКЦИН ПРОТИВ ТКАНЕВЫХ ГЕЛЬМИНТОЗОВ | 2007 |
|
RU2348427C2 |
| СПОСОБ ПОЛУЧЕНИЯ ДИАГНОСТИЧЕСКОГО АНТИГЕНА ПРИ ТРИХИНЕЛЛЕЗЕ | 2006 |
|
RU2322994C2 |
| СПОСОБ ВЫДЕЛЕНИЯ ЛИЧИНОК T.canis МЕТОДОМ ПЕРЕВАРИВАНИЯ ПАРЕНХИМЫ ЛЕГКИХ И ПЕЧЕНИ ПЛОТОЯДНЫХ ЖИВОТНЫХ | 2014 |
|
RU2567845C1 |
| Способ активирования онкосфер цестод для лабораторной наработки антигена | 2020 |
|
RU2725248C1 |
| Способ выделения личинок Toxocara canis из яиц для наработки диагностического антигена | 2022 |
|
RU2783666C1 |
| СПОСОБ ДИАГНОСТИКИ ТРИХИНЕЛЛЕЗА У ЭКСПЕРИМЕНТАЛЬНО ЗАРАЖЕННЫХ ЛАБОРАТОРНЫХ ЖИВОТНЫХ | 2008 |
|
RU2384299C1 |
| СОСТАВ КОМПОНЕНТОВ ПЕРЕВАРИВАЮЩЕЙ ЖИДКОСТИ ДЛЯ ЭКСПЕРТИЗЫ МЯСНЫХ ПРОДУКТОВ НА ТРИХИНЕЛЛЕЗ | 2010 |
|
RU2440572C1 |
Изобретение относится к области биохимии и паразитологии и может быть использовано для изучения биологических свойств личинок паразитических гельминтов, определения качества инвазионной продукции (тушек, мяса животных, субпродуктов животного происхождения) и тестирования средств и методов обезвреживания зараженного трихинеллезом материала. Способ определения количества гликогена в личинках трихинелл включает проведение ряда биохимических реакций с гликогеном исследуемых личинок, подготовку градуировочных растворов и построение градуировочного графика по оптической плотности в зависимости от содержания гликогена в пробе. Расчёт концентрации гликогена осуществляют по формуле с учетом относительной плотности анализируемой пробы, коэффициента, характеризующего разведение пробы, тангенса угла наклона градуировочной кривой и количества личинок трихинелл в одной капле взвеси. При содержании гликогена в одной личинке трихинелл не более 0,002 мкг инвазионный материал считают обезвреженным. Изобретение позволяет повысить точность определения инвазивности биоматериалов. 2 ил., 7 табл., 5 пр.
Способ определения количества гликогена в личинках трихинелл, выделенных из мышечной ткани инвазированных тушек животных, для контроля качества обезвреживания инвазионного материала, предусматривающий выделение личинок трихинелл из исследуемого материала, добавление 33%-ного раствора гидроксида калия, доведение до кипячения с последующим охлаждением раствора, смешивание его с 96%-ным этиловым спиртом, нагрев раствора в течение 5 мин, его охлаждение, центрифугирование, отделение и высушивание осадка гликогена, растворение осадка гликогена в насыщенном растворе хлорида аммония с последующим нагревом в течение 5 мин, охлаждение и добавление к исследуемой пробе дистиллированной воды и йодного реактива, при этом проводят смешивание насыщенного раствора хлорида аммония, йодного реактива и дистиллированной воды в контрольной пробирке с последующим измерением оптической плотности на фотоэлектрическом микроколориметре с длиной оптического пути 5 мм при длине волны 425 нм против холостой пробы, построение градуировочного графика с последующим определением количества гликогена в одной личинке при наличии в одной капле взвеси 1000-10000 личинок трихинелл по следующей формуле:
С=E×k/F×N,
где С - концентрация гликогена в одной личинке трихинелл (мг),
Е - оптическая плотность анализируемой пробы,
k - отношение коэффициента разведения пробы к количеству капель исследуемой взвеси,
F - тангенс угла наклона градуировочной кривой,
N - количество личинок трихинелл в одной капле взвеси,
и при содержании гликогена в одной личинке трихинелл не более 0,002 мкг инвазионный материал считают обезвреженным.
| ДАНЧЕНКО Е.О | |||
| и др | |||
| Новый методический подход к определению концентрации гликогена в тканях и некоторые комментарии по интерпретации результатов, Судебно-медицинская экспертиза, 2010, N 3, с.25-28 | |||
| КУЗНЕЦОВА И.Ю | |||
| Модификация биохимического определения гликогена в трупных тканях по методу KEMP- KITZEN VAN HEIJNINGEN с учетом современных лабораторно-методологических требований, Судебно-медицинская экспертиза, 2004, N3, с.32-34 | |||
| СПОСОБ ОПРЕДЕЛЕНИЯ ГЛИКОГЕНА В ЭКСТРАКТЕ ИЗ ОРГАНОВ И ТКАНЕЙ ПЧЕЛ | 2003 |
|
RU2256320C2 |
| Способ определения гликогена в тканях животных | 1984 |
|
SU1270704A1 |
Авторы
Даты
2019-03-04—Публикация
2018-02-22—Подача