СИСТЕМА ЭКСТРАКОРПОРАЛЬНОГО ЖИЗНЕОБЕСПЕЧЕНИЯ И СПОСОБЫ ЕЕ ИСПОЛЬЗОВАНИЯ
В этой заявке заявлен приоритет согласно §119(e) раздела 35 Кодекса США по предварительной заявке на патент США №61/788052, поданной на регистрацию 15 марта 2013 года. Вышеупомянутая заявка содержится в данном документе посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ
Настоящее изобретение относится к области неонатального ухода. Более конкретно, настоящее изобретение предлагает устройства и способы поддержания гомеостаза недоношенного плода за пределами матки.
УРОВЕНЬ ТЕХНИКИ
Для описания существующего уровня области техники, к которой относится данное изобретение, этот документ содержит ссылки на несколько публикаций и патентных документов. Полные цитаты по указанным ссылкам можно найти по всему документу. Каждая из этих цитат в полном объеме включена в данный документ посредством ссылки в установленном порядке.
В случае крайней незрелости выживание плода за пределами матки усложняется неудовлетворительным органогенезом, включая недостаточный рост и созревание легких, необходимых для обеспечения газообмена. Кроме того, в случае врожденных аномалий развития, влияющих на рост и развитие легких, таких как врожденная диафрагмальная грыжа и другие причины гипоплазии легких, недостаточная легочная функция может ограничить длительное выживание. Разработка экстракорпоральной системы поддержания непрерывного роста и развития плода без возмущающего воздействия, создаваемого постнатальной интенсивной терапией, дала бы шанс на выживание таким младенцам со снижением смертности и долгосрочной заболеваемости. Способность поддерживать гомеостаз недоношенного плода в течение недель или месяцев может также изменить действующие стандарты оценки жизнеспособности за пределами матки.
РАСКРЫТИЕ ИЗОБРЕТЕНИЯ
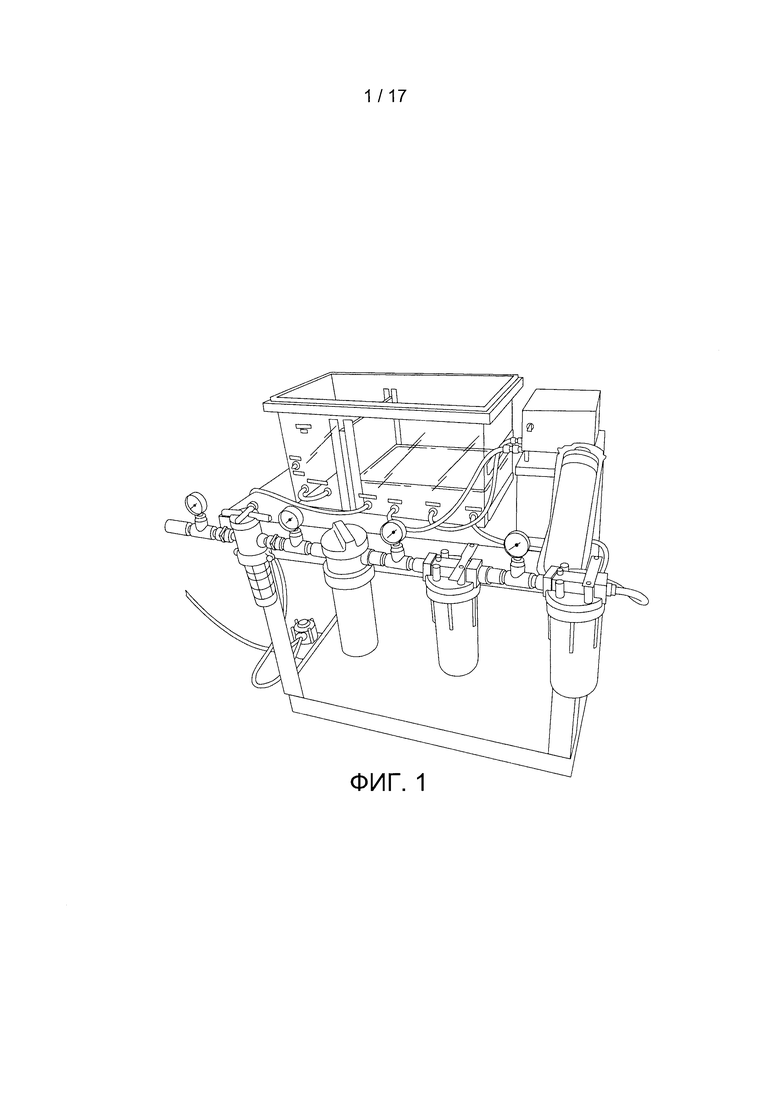
В соответствии с настоящим изобретением, предложена система экстракорпоральной мембранной оксигенации (искусственная плацента). В конкретном варианте реализации настоящего изобретения указанная система является безнасосной и содержит оксигенатор с очень низким сопротивлением. Такая система/устройство может также дополнительно содержать инкубационную камеру для размещения объекта и стерильную жидкость, в которую объект погружен. Такая система/устройство может дополнительно содержать насос и систему фильтрации для стерильной жидкости. Примеры системы/устройства по данному изобретению показаны на Фигурах 1 и 7 А.
В соответствии с другим аспектом настоящего изобретения, предложены способы экстракорпоральной оксигенации объекта (например, поддержание жизнедеятельности плода во внематочных условиях для обеспечения его роста и созревания). В конкретном варианте реализации настоящего изобретения указанный способ содержит соединение объекта с системой экстракорпоральной мембранной оксигенации по данному изобретению. Указанный объект может быть соединен с оксигенатором через сосуды шеи. В конкретном варианте реализации настоящего изобретения объект является незрелым плодом, крайне незрелым плодом или недоношенным плодом плодом. В конкретном варианте реализации настоящего изобретения оксигенатор заполняется фетальной кровью. Объект также может поддерживаться в погруженном состоянии в инкубационной камере, содержащей стерильную жидкость, в частности, когда стерильная жидкость подогревается и непрерывно закачивается через систему фильтрации.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фигура 1 содержит фотографию примера устройства по данному изобретению.
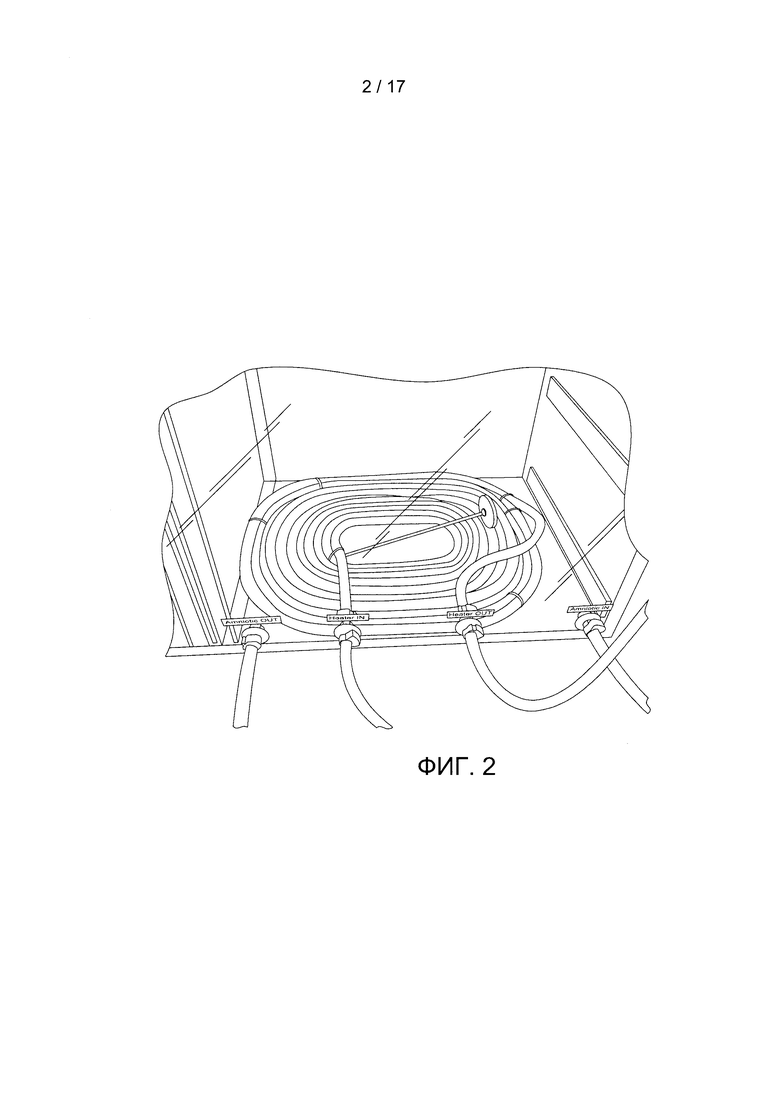
Фигура 2 содержит фотографию примера инкубационной камеры. Четко определены четыре отверстия в камере. Два отверстия предназначены для циркуляции стерильной жидкости в камере (помечены как «амниотический вход» и «амниотический выход»). Другие два отверстия предназначены для циркуляции теплой жидкости внутри закрытого устройства в камере для поддержания температуры тела объекта.
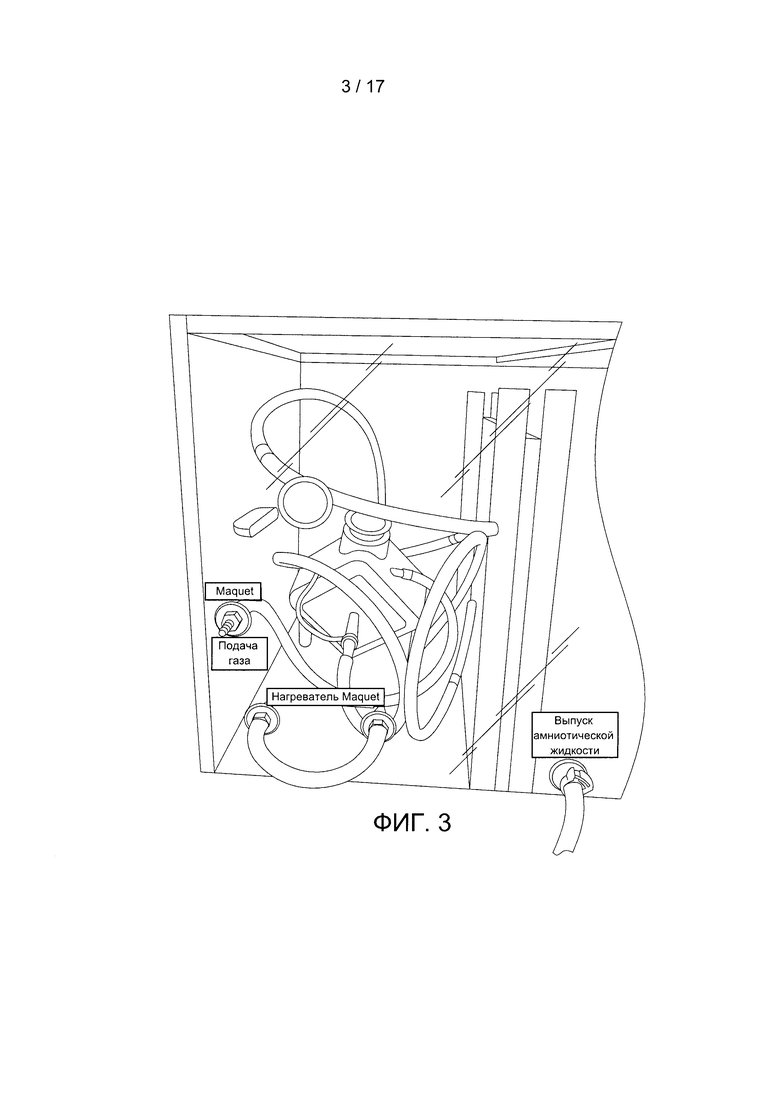
Фигура 3 содержит фотографию примера сухой камеры, содержащей оксигенатор.
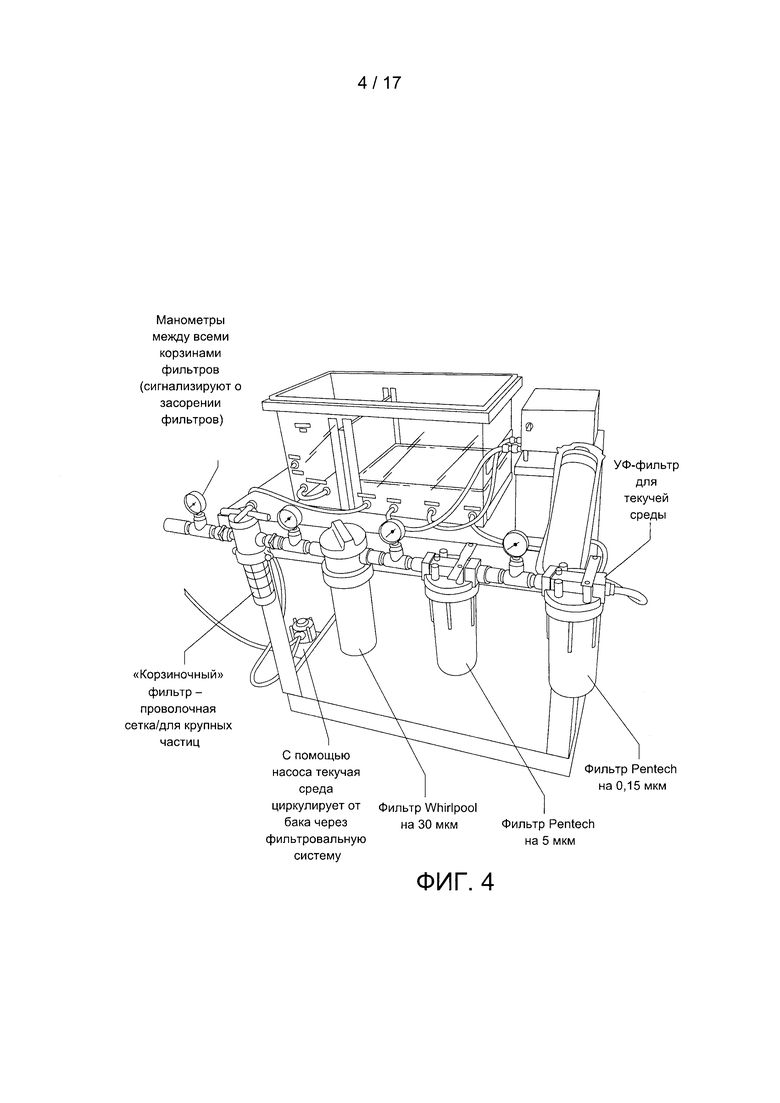
Фигура 4 содержит фотографию системы фильтрации.
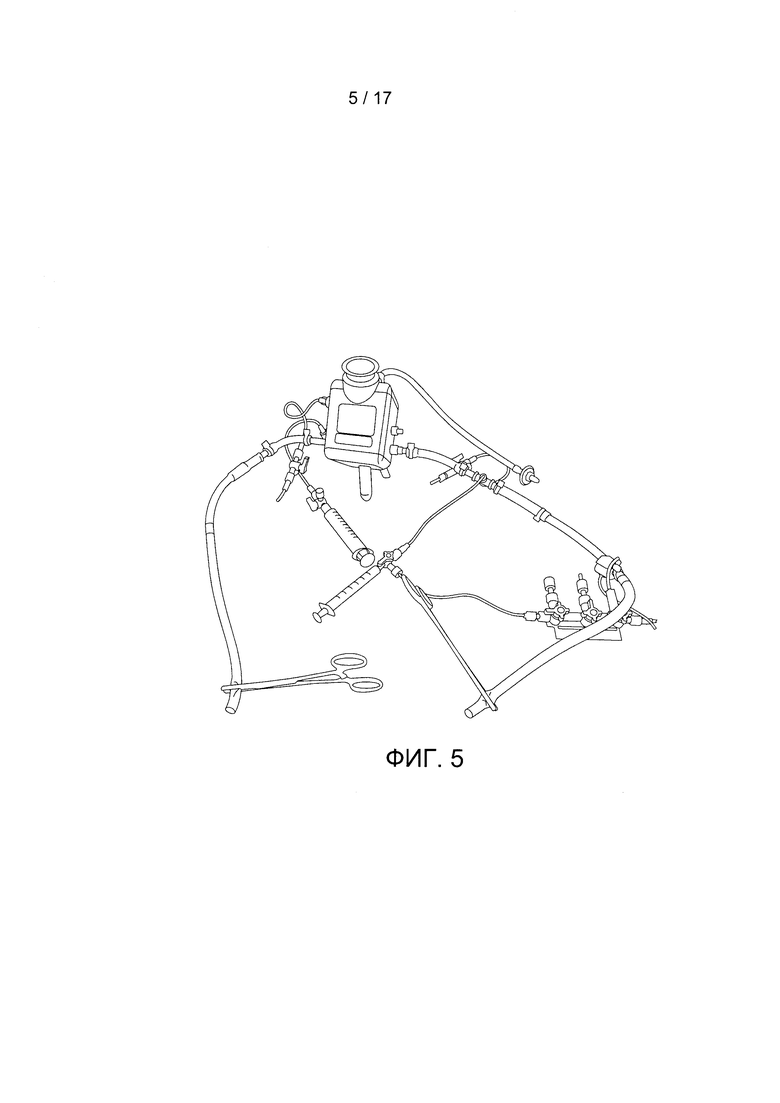
Фигура 5 содержит фотографию конструкции контура с оксигенатором.
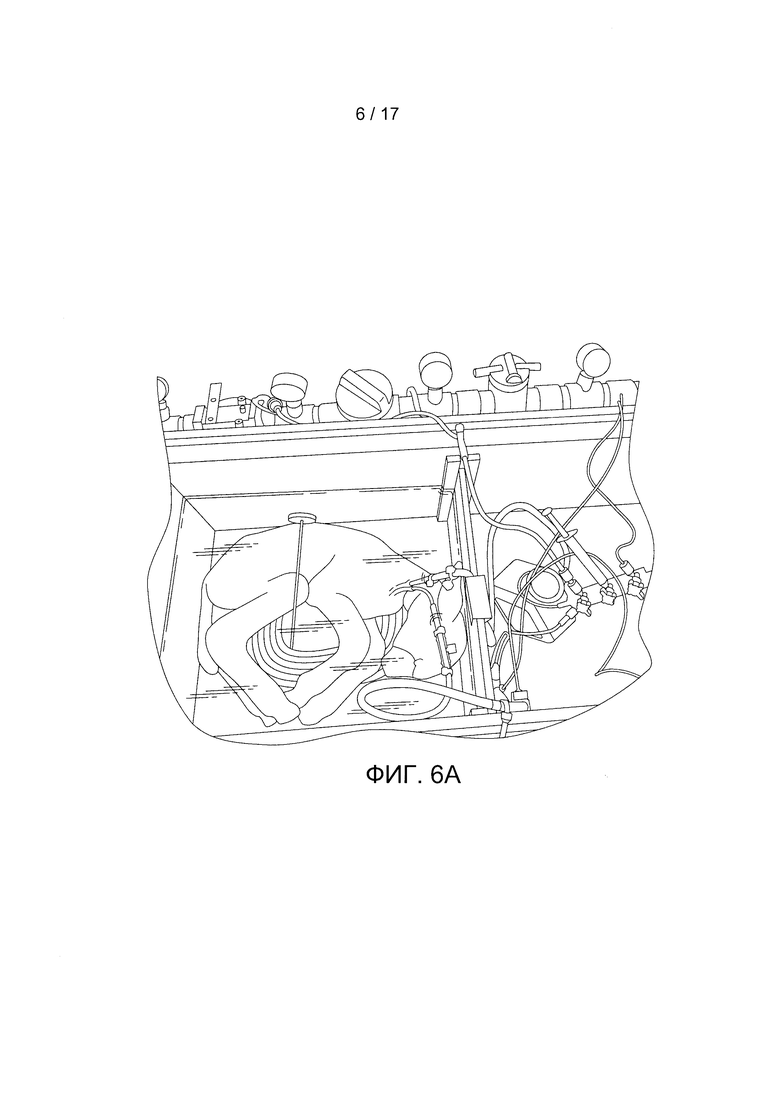
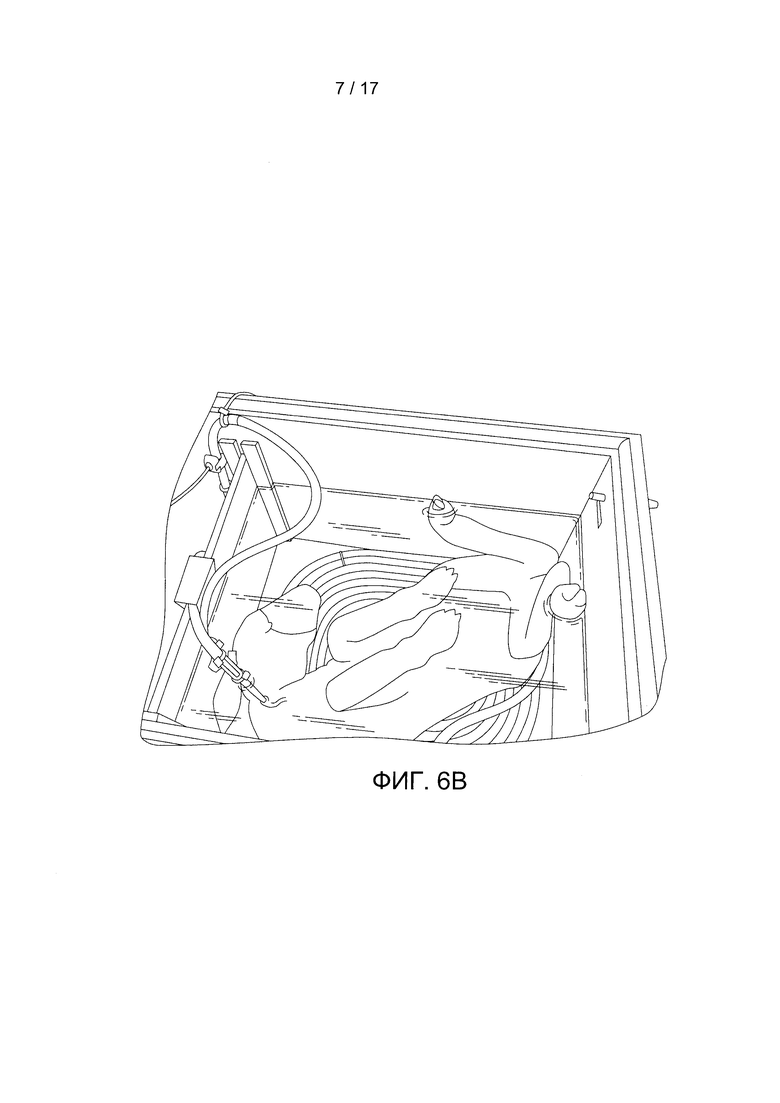
Фигура 6А содержит фотографию незрелого ягненка, соединенного с устройством по данному изобретению. Фигура 6В содержит фотографию ягненка после 5 дней роста.
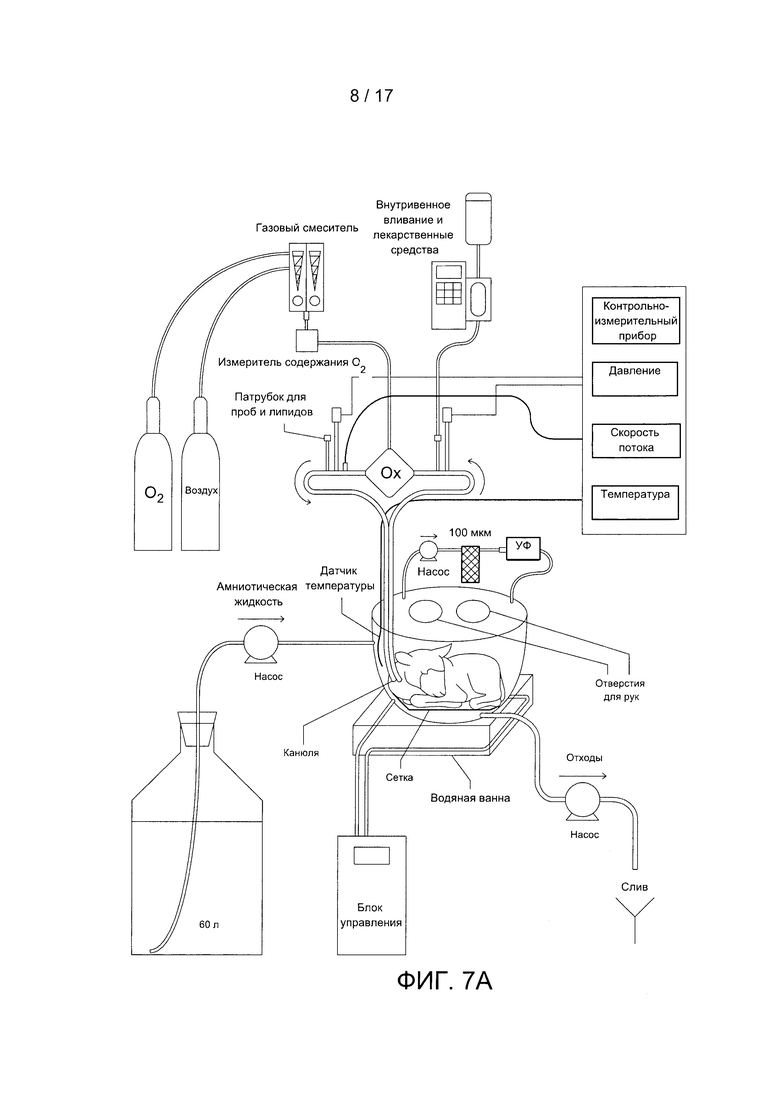
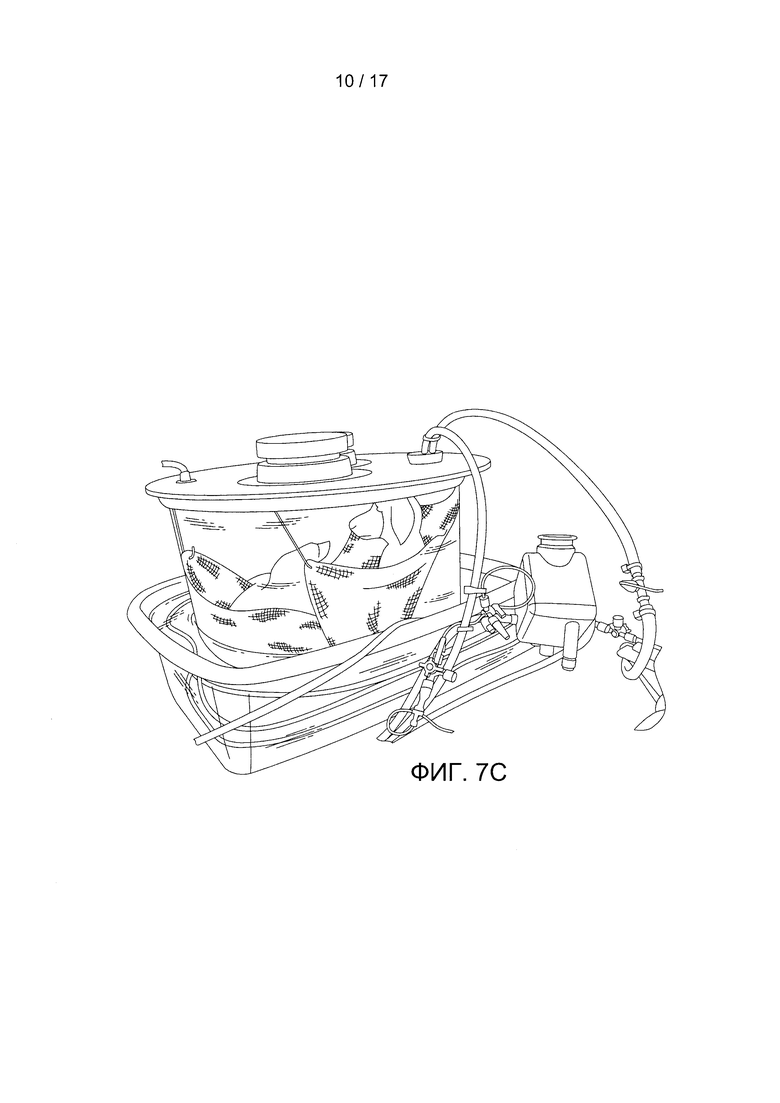
Фигура 7А содержит схему примера устройства по данному изобретению. Фигура 7В содержит фотографию примера устройства по данному изобретению. Фигура 7С содержит фотографию примера контура устройства по данному изобретению.
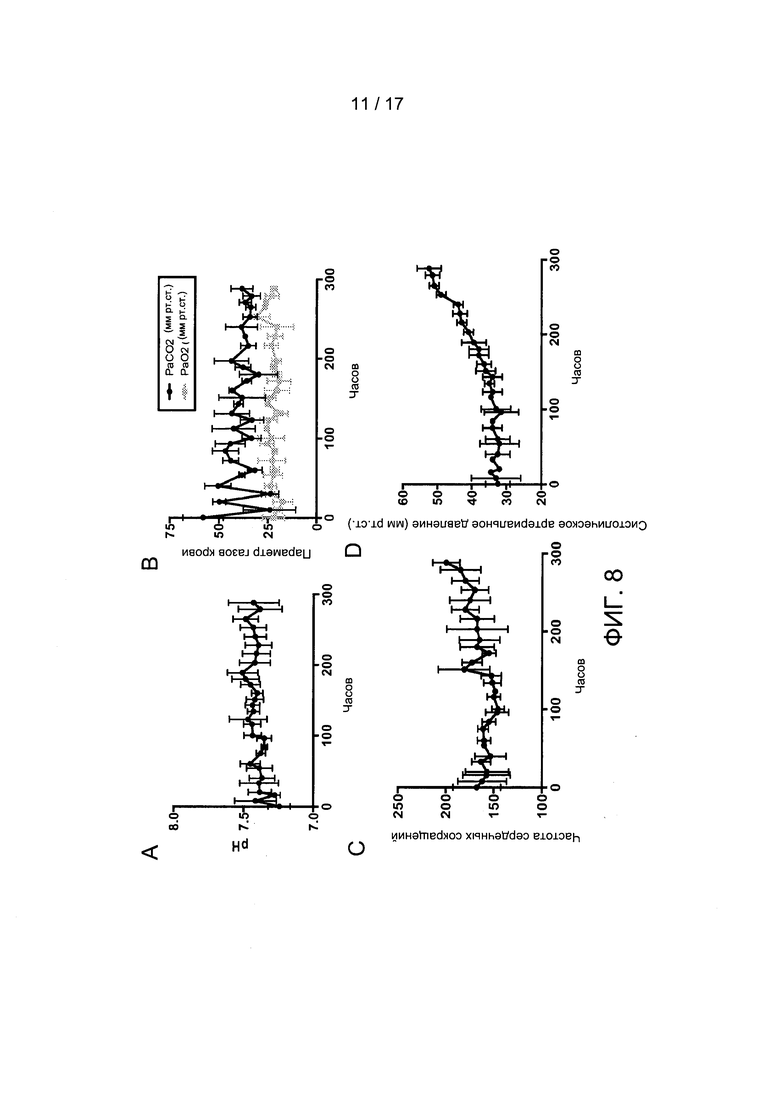
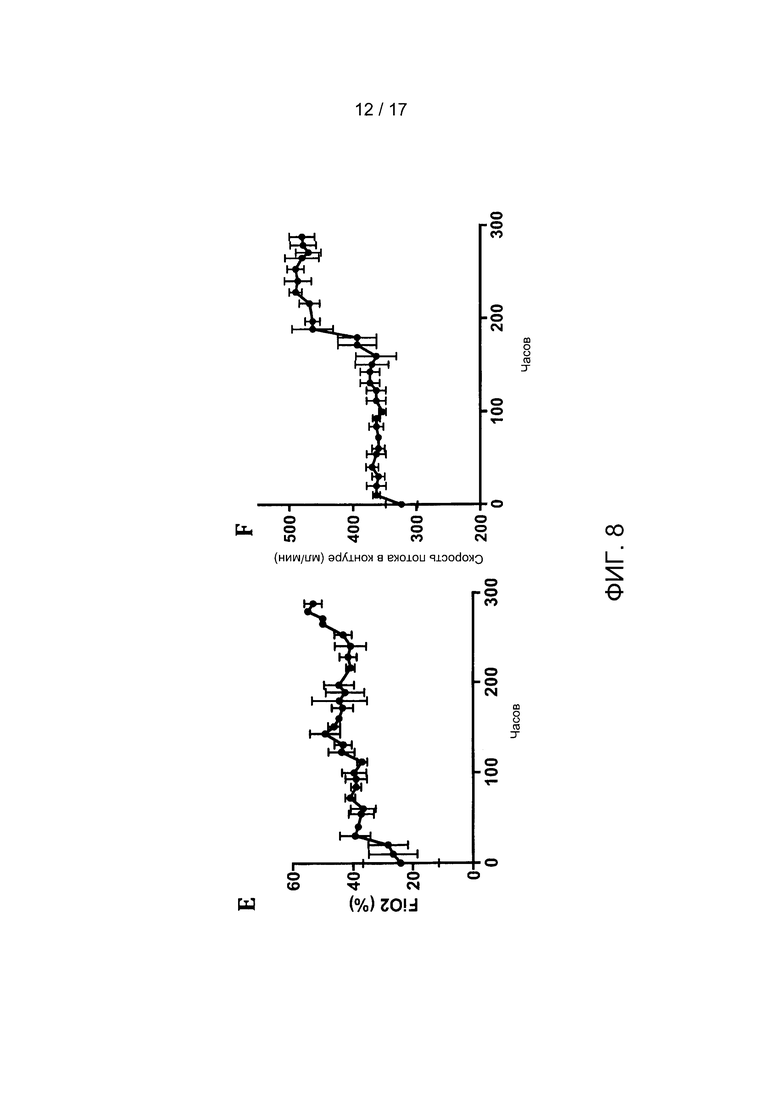
Фигуры 8A-8F иллюстрируют стабильность биохимических и гемодинамических параметров плода. Показаны отбор проб рН в сонной артерии (Фиг. 8А) и парциальное давление СО2 и О2 (Фиг. 8В). Также показаны записанная частота сердечных сокращений плода (Фиг. 8С), систолическое артериальное давление (Фиг. 8D), доставка FiO2 к оксигенатору (Фиг. 8Е) и скорости кровотока в контуре (Фиг. 8F) в течение 300 часов. Планки погрешностей отображают пять независимых экспериментов.
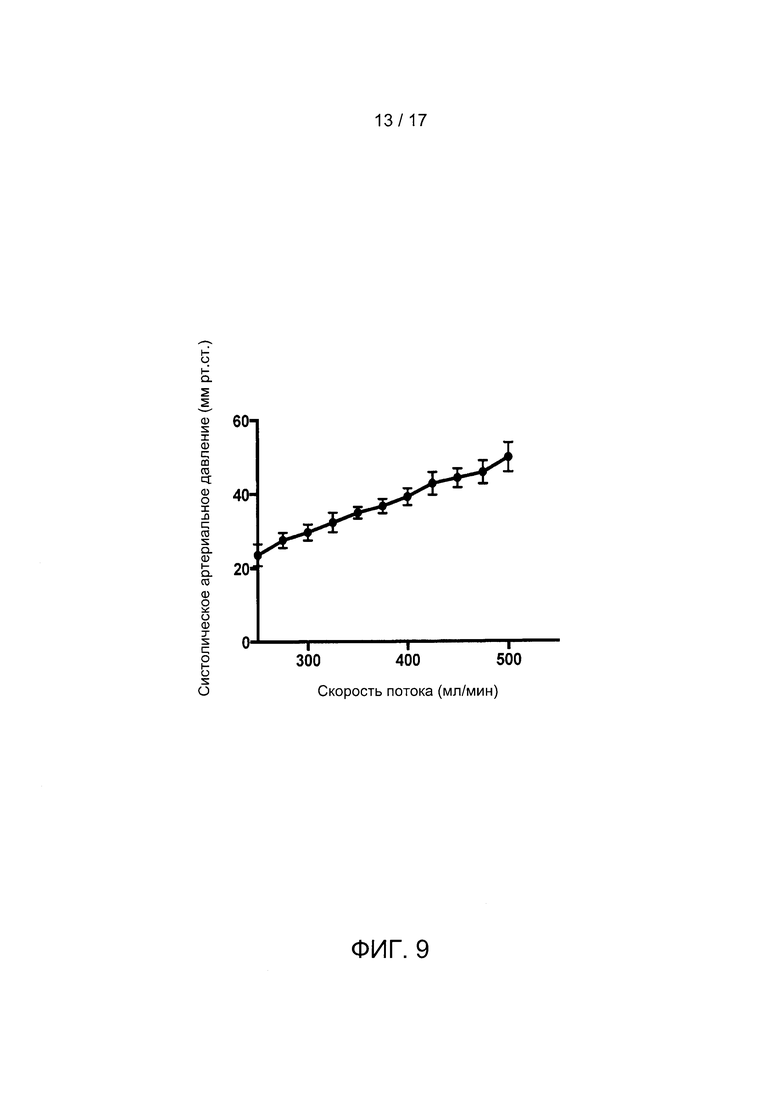
Фигура 9 содержит график, отображающий линейную зависимость систолического артериального давления (мм рт. ст.) от скорости кровотока в контуре (мл/мин). Планки погрешностей отображают четыре независимых эксперимента.
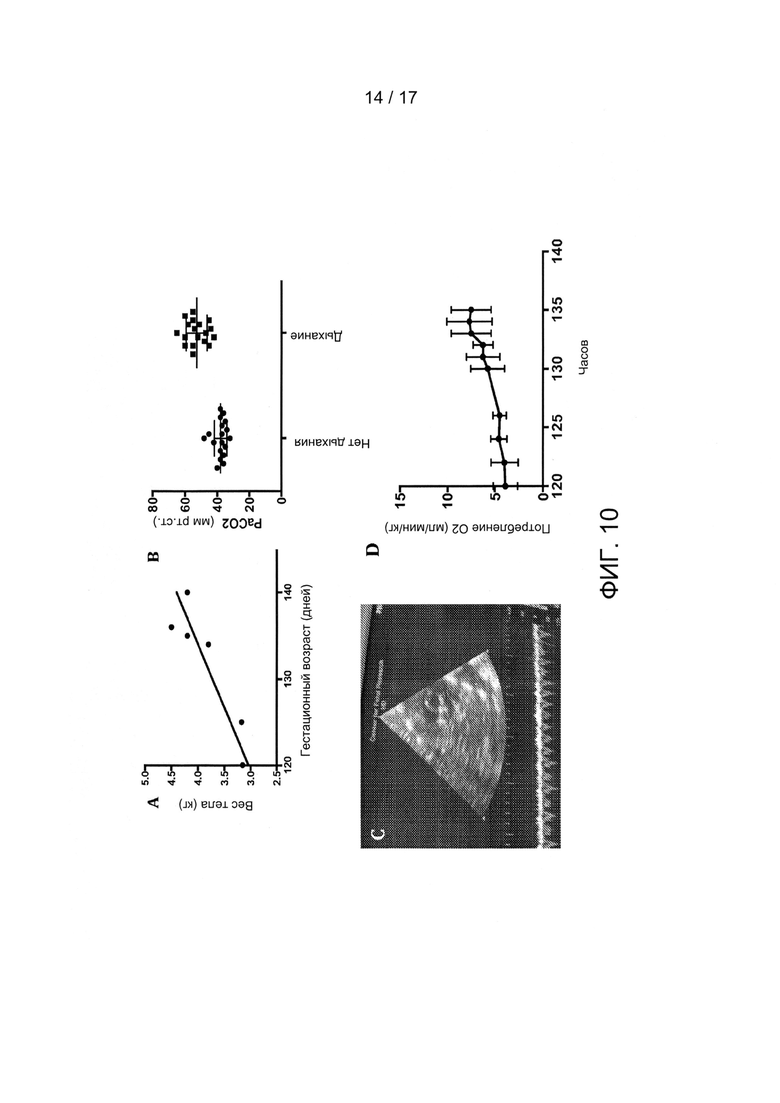
Фигуры 10A-10D показывают рост и метаболизм плода по настоящему изобретению. Фигура 10А показывает увеличение массы в течение инкубации плода. Фигура 10В показывает реакцию дыхания плода на увеличение артериальных уровней РаСО2. Фигура 10С показывает раскрытое состояние артериального протока (белая стрелочка), подтвержденное эхокардиографией плода. Фигура 10D показывает потребление кислорода плодом в течение инкубации.
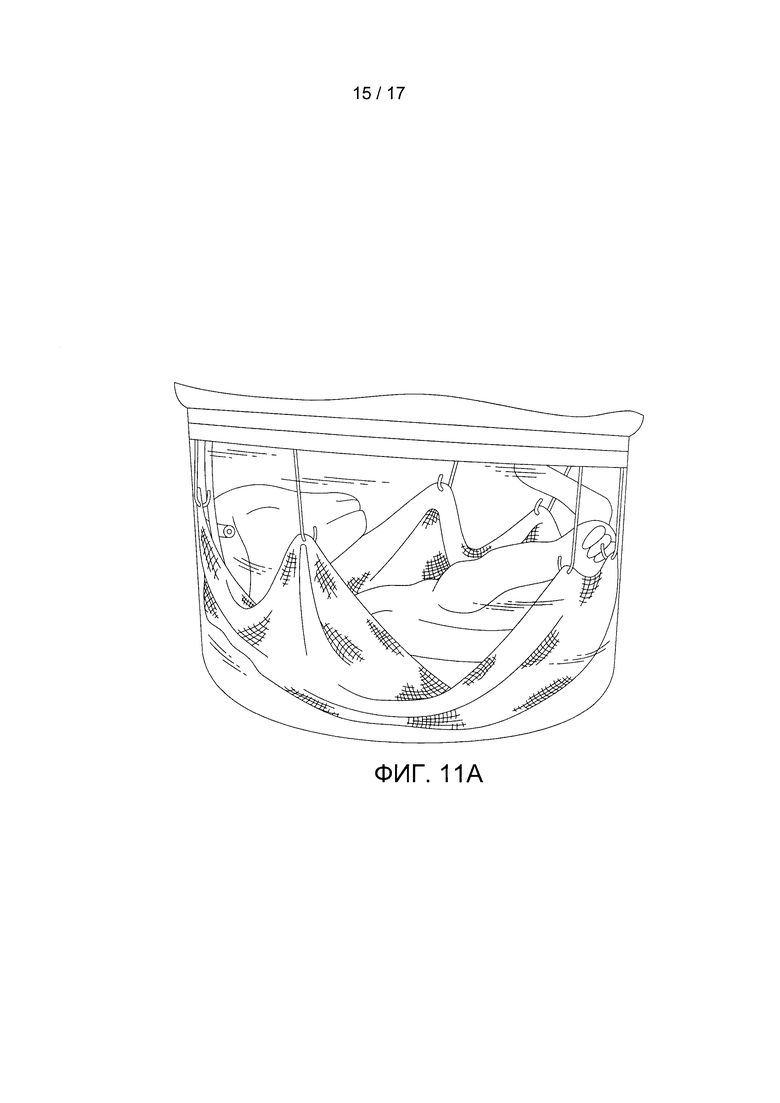
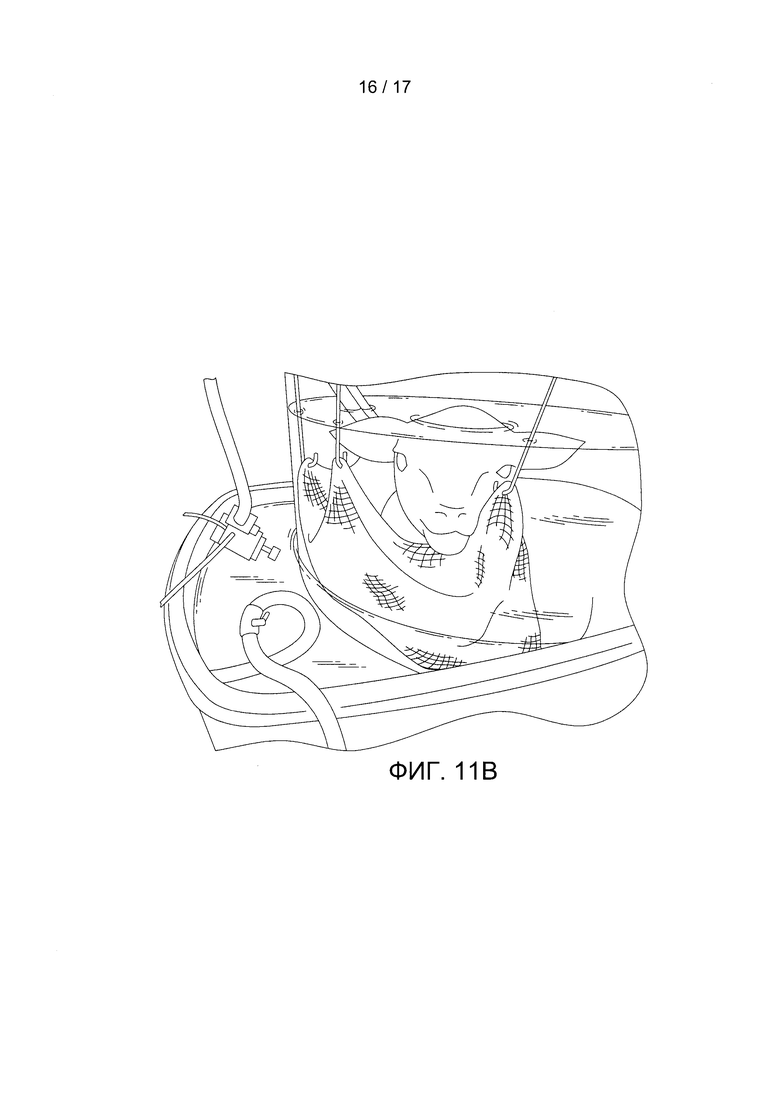
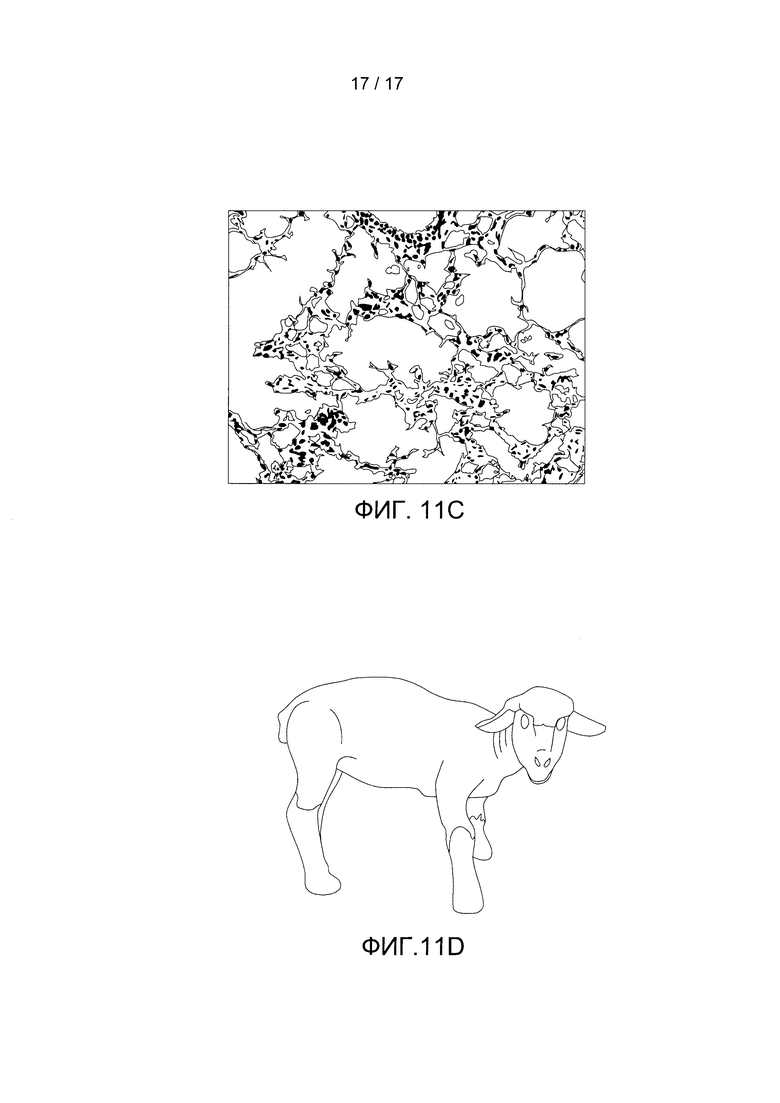
Фигуры 11A-11D показывают рост и развитие ягненка. Фигура 11А содержит фотографию плода ягненка на 1-й день (гестационный возраст 120 дней). Фигура 11В содержит фотографию плода ягненка на 14-й день (гестационный возраст 134 дня). Фигура 11С содержит изображение гематоксилин-эозинового (г/э) окрашивания легкого залитого парафином ягненка после 14-го дня. Фигура 11D содержит фотографию нормального роста и развития ягненка через 6 месяцев после инкубации.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Дыхательная недостаточность остается главной проблемой в вопросе выживания крайне незрелого ребенка. Разработка внематочной системы для поддержания непрерывного роста и развития плода могла бы олицетворять парадигму ухода за такими пациентами. Концепция искусственной плаценты была предложена более 50 лет назад, но многочисленные исследования, в которых использовались обычные поддерживаемые насосом экстракорпоральные системы оксигенации, имели ограниченный успех вследствие перегрузки системы кровообращения и сердечной недостаточности. Долго была перспективной идея безнасосного контура оксигенации, который, как предполагалось, должен был иметь преимущества по сравнению с существующей технологией ЭКМО, включая сокращение объемов первичного заполнения и распределения, сокращение времени взаимодействия крови с тромбогенными поверхностями и достижение естественной регуляции скорости и давления кровотока самим сердцем плода.
Однако создание такого контура все еще остается труднодостижимой задачей, и результатом нескольких тщательно выполненных исследований было быстрое нарушение кровообращения. В этом документе сообщается о полном физиологическом обеспечении внематочных фетальных ягнят с безнасосной искусственной плацентой, стабильной гемодинамикой, поддержанием кровообращения плода, нормальным ростом и метаболизмом. Это первая успешная демонстрация долговременного сохранения плода во внематочной среде с ауторегуляцией большого круга кровообращения способом, аналогичным фетально-плацентарному контуру.
Преждевременные роды могут произойти вследствие одной или нескольких причин. Например, преждевременные роды могут неожиданно произойти вследствие преждевременного разрыва плодного пузыря (ПРПП), особенностей строения матки, таких как укороченная шейка, вследствие травматических или инфекционных раздражителей или вследствие многоплодной беременности. Преждевременные родовые схватки и родоразрешение также часто встречаются в связи с эндоскопией плода или фетальной хирургией, когда применение инструментов для матки часто стимулирует неконтролируемые родовые схватки несмотря на максимальную токолитическую терапию.
В Национальном отчете по статистике рождаемости Центра по контролю заболеваний за 2010 год указано, что показатель рождаемости в США для гестационного возраста менее 28 недель за последнее десятилетие оставался стабильным и составлял приблизительно 0,7% или 30000 рождений ежегодно. Аналогично, показатель рождаемости в США для гестационных возрастов 28-32 недель за последнее десятилетие оставался стабильным и составлял 1,2% или 50000 случаев рождений ежегодно. Количество пациентов с гипоплазией легких вследствие врожденной диафрагмальной грыжи, олигогидрамниона или дефектов стенок брюшной полости также является значительным. Национальная сеть по предотвращению врожденных дефектов сообщает о заболеваемости в США врожденной диафрагмальной грыжей в пределах от 0,9 до 5,8 на 10000 живорожденных или приблизительно на 375 - 2500 случаев рождений ежегодно. По заболеваемости по другим причинам гипоплазии легких нет хорошо задокументированных данных.
Главным физиологическим ограничением, отрицательно влияющим на выживание незрелого новорожденного, является недостаточность клапана легочной артерии вследствие недостаточного легочного роста и созревания, которая не обеспечивает газообмен. Разработка системы экстракорпоральной оксигенации плода стала бы главным достижением перед завершением создания искусственной плаценты. В предыдущих попытках получить надлежащую оксигенацию плода в экспериментальных моделях на животных использовалась традиционная экстракорпоральная мембранная оксигенация (ЭКМО) с поддержкой насосом, которая была ограничена перегрузкой системы кровообращения и сердечной недостаточностью в изучаемых животных. Reoma и др. (J. Ped. Surg. (2009) 44:53-59) описывают артериально-венозную систему экстракорпорального жизнеобеспечения, в которой используется оксигенатор с низким сопротивлением (МС3; Ann Arbor, MI). Однако, безнасосная система Reoma и др. оказалась неудачной, поскольку 2 плода из 7 умерли в пределах трех часов, а остальные плоды на протяжении четырех часов демонстрировали гемодинамическую нестабильность с фетальной гипотензией, брадикардией и ацидозом. На протяжении четырех часов Reoma и др. наблюдали снижение скорости потока в устройстве, снижение доставки кислорода и снижение скорости артериального кровотока, и в конечном счете пришли к выводу, что для надлежащего длительного жизнеобеспечения в систему необходимо ввести насос.
Система, предлагаемая в настоящем изобретении, поддерживает жизнеобеспечение, постоянный рост плода и созревание его органов, в то же время обеспечивая физиологию плода во внематочной среде. Данная система позволяет существенно снизить летальность, заболеваемость и расходы, связанные с незрелостью и тяжелыми поражениями легких. Действительно, в отчете Института медицины за 2007 год (Behrman et al., ed., Institute of Medicine (US) Committee on Understanding Premature Birth and Assuring Healthy Outcomes; Washington DC: National Academies Press; 2007) оценка расходов, связанных с преждевременными родами, только за один 2005 год дает сумму, превышающую 26,2 миллиардов долларов США, при этом большая часть расходов пришлась на начальное консервативное лечение в отделении интенсивной терапии.
В соответствии с настоящим изобретением, для приведения в движение потока крови через контур и оксигенатор используется сердце плода (то есть, это безнасосная система). При использовании безнасосной системы сердце плода не подвергается чрезмерной преднагрузке, которая возникает в контурах с непульсирующим потоком крови, использующих поддержку насоса. Безнасосная система также обеспечивает врожденное регулирование динамики кровообращения плода. Оксигенатор по данному изобретению предпочтительно имеет очень низкое сопротивление, малый объем первичного заполнения, низкий перепад трансмембранного давления и обеспечивает эффективный газообмен. В конкретном варианте реализации настоящего изобретения оксигенатор имеет перепад давления меньший, чем приблизительно 50 мм рт. ст. или приблизительно 40 мм рт. ст. при скорости кровотока 1,5 л/мин. В конкретном варианте реализации настоящего изобретения объем первичного заполнения оксигенатора составляет меньше, чем приблизительно 100 мл, в частности меньше, чем приблизительно 85 мл. В конкретном варианте реализации настоящего изобретения оксигенатор имеет скорость кровотока до приблизительно 2,0 л/мин, до приблизительно 2,5 л/мин, до приблизительно 2,8 л/мин и выше. В конкретном варианте реализации настоящего изобретения оксигенатор имеет скорость переноса газа около 150 мл/мин, около 160 мл/мин, около 180 мл/мин и выше для О2. В конкретном варианте реализации настоящего изобретения оксигенатор является половолоконным мембранным оксигенатором (например, половолоконным мембранным оксигенатором из полиметилпентена). В конкретном варианте реализации настоящего изобретения оксигенатор покрыт изнутри средствами/составами, препятствующими свертыванию крови (например, иммобилизованным полипептидом и/или гепарином). В конкретном варианте реализации настоящего изобретения оксигенатор является педиатрическим оксигенатором Quadrox-iD™ (Maquet; Wayne, NJ).
Объектами данного изобретения могут быть новорожденные, включая доношенных и недоношенных новорожденных. Недоношенный новорожденный может быть незрелым ребенком (то есть, предполагаемый гестационный возраст составляет меньше 37 недель, в частности 28-32 недель), крайне незрелый (то есть, 24-28 недель) или недоношенным плодом (например, 20-24 недель). Сроки гестации указаны для людей, хотя могут использоваться соответствующие недоношенные новорожденные животные. В конкретном варианте реализации настоящего изобретения недоношенный новорожденный не имеет основополагающего врожденного заболевания. В конкретном варианте реализации настоящего изобретения доношенный или недоношенный новорожденный имеет ограниченную способность к легочному газообмену, например, вследствие гипоплазии легкого или врожденной аномалии, отрицательно влияющей на развитие легких, такой как врожденная диафрагмальная грыжа. В конкретном варианте реализации настоящего изобретения объектом может быть недоношенный или доношенный новорожденный, ожидающий трансплантации легкого, например, вследствие врожденного заболевания легких (например, бронхоальвеолярной дисплазии, дефицита поверхностно-активного белка В и т.д.). Такая трансплантационная хирургия в настоящее время в США выполняется редко (Huddleston et al. (2002) Ann Surg., 236:270-6). Однако, количество трансплантационных хирургических операций могло бы увеличиться при использовании более стабильного способа пульмональной поддержки, который предложен в настоящем изобретении. Объект также может быть кандидатом на внематочную интранатальную терапию (EXIT), включая пациентов с тяжелыми повреждениями дыхательных путей и прогнозируемым длительным периодом протекания болезни перед полным удалением органа. Объект также может быть пациентом для фетального хирургического вмешательства или фетоскопии, в частности с преждевременными предродовыми схватками, провоцирующими преждевременное родоразрешение. В соответствии с настоящим изобретением, жизнедеятельность объекта может поддерживаться в устройстве столько времени, сколько это будет необходимо (например, на протяжении дней, недель или месяцев).
В конкретном варианте реализации настоящего изобретения в крупных сосудах шеи (например, в сонной артерии) объекта установлены канюли для соединения кровеносной системы объекта с оксигенатором. Благодаря размещению канюлей в крупных сосудах шеи устраняются проблемы с вазоспазмом и неустойчивым положением канюли в пуповинных сосудах. Чтобы уменьшить объем крови за пределами объекта, соединительные трубки (например, силиконовые) между оксигенатором и канюлями предпочтительно должны иметь минимально возможные длину и внутренний диаметр. Однако, при выборе длины трубок необходимо учитывать потенциально возможные движения объекта. В конкретном варианте реализации настоящего изобретения длина трубки от канюли до оксигенатора составляет около 12 дюймов или меньше. В конкретном варианте реализации настоящего изобретения трубка покрыта изнутри средствами/составами, препятствующими свертывание крови (например, иммобилизованным полипептидом и/или гепарином) (то есть, трубка устойчива к образованию сгустков крови). Как объяснено ниже, внешняя часть канюлей может быть оснащена манжетой (например, чтобы обеспечить усиленное натяжение стабилизирующих швов). Манжета может быть изготовлена из силикона и может, например, иметь длину около 1-10 см, в частности около 3-5 см. Чтобы надежно прикрепить канюли к шее животного, они могут быть пришиты к его телу (например, с помощью установленной манжеты).
В конкретном варианте реализации настоящего изобретения устройство оксигенатора заполняется кровью. Устройство оксигенатора может заполняться, например, материнской кровью и/или фетальной кровью. Заполнение оксигенатора фетальным гемоглобином обеспечивает оптимальный кислородный обмен через мембрану. Действительно, кривая диссоциации фетального кислорода сдвинута влево, и это означает, что значения давления фетального артериального кислорода находятся ниже значений давления артериального кислорода взрослого человека. В конкретном варианте реализации настоящего изобретения кровь содержит гепарин.
В конкретном варианте реализации настоящего изобретения газ, поступающий в оксигенатор, является смесью медицинского воздуха и кислорода.
В конкретном варианте реализации настоящего изобретения объект размещен в кувезе. В конкретном варианте реализации настоящего изобретения кувез является камерой, заполненной стерильной жидкостью так, что объект в нее погружен (например, с приближенным соответствием среде внутри матки). Инкубационная камера может быть герметично закрыта для предотвращения загрязнения стерильной жидкости внутри нее. В конкретном варианте реализации настоящего изобретения верхняя часть камеры съемная или является крышкой для обеспечения доступа к объекту. Однако, верхняя часть должна образовывать герметичное соединение с другой частью камеры (например, через прокладку). В конкретном варианте реализации настоящего изобретения камера является жесткой конструкцией, такой как бокс или чашеобразная емкость, изготовленной из стекла, металла, инертной медицинской пластмассы или силикона. В конкретном варианте реализации настоящего изобретения камера является сумкой или мешком (например, изготовленным из водонепроницаемой инертной медицинской пластмассы или силикона), благодаря чему воспроизводится амниотический мешок. Камера может включать подвесную или навесную сетку или гамак для размещения объекта внутри камеры (смотрите, например, Фигуры 11А и 11В). Благодаря подвесной/навесной сетке (например, бандажу или гамаку) у плода уменьшается чувство беспокойства, вследствие чего уменьшаются движения плода и снижается риск разрыва или отсоединения прикрепленных зондов или канюлей. Подвесная/навесная сетка (например, бандаж или гамак) может быть изготовлена из стерильного и инертного материала для использования в медицине, такого металл и нейлон. Инкубационная камера может также включать перчаточные отверстия для стерильного доступа к объекту (например, для пеленания объекта, чтобы его успокоить, или для доступа к объектам внутри камеры).
Стерильная жидкость внутри инкубационной камеры может быть амниотической жидкостью, стерильной искусственной/синтетической амниотической жидкостью, лактированным раствором Рингера и т.д. Стерильная жидкость может содержать антибиотики (например, пенициллин) и/или лизоцим. Стерильная жидкость и/или кувез могут нагреваться для поддержания температуры тела объекта. Стерильная жидкость может нагреваться за пределами кувеза и закачиваться теплой и/или может нагреваться внутри камеры. В конкретном варианте реализации настоящего изобретения теплая жидкость (например, вода) закачивается внутрь замкнутого устройства (например, трубки (например, силиконовой), в частности в форме петли или спирали) внутри камеры и возвращается обратно в нагреватель, чтобы затем снова закачиваться внутрь замкнутого устройства. В конкретном варианте реализации настоящего изобретения теплая жидкость закачивается внутрь нагревательной спирали при температуре около 50°С.
В конкретном варианте реализации настоящего изобретения жидкость внутри инкубационной камеры соединена с насосом и с одним или несколькими фильтрами (например, для удаления твердых частиц, выделенных организмом объекта в камере). В конкретном варианте реализации настоящего изобретения указанное устройство содержит последовательность фильтров, между которыми могут быть установлены дополнительные манометры для быстрого обнаружения засорения какого-либо фильтра. Указанная система фильтрации может также содержать УФ-фильтр для жидкостей. Пример системы фильтрации показан на Фигуре 4. На Фигуре 4 изображен фильтр для крупных частиц инородных веществ или остатков органических веществ, последовательно соединенный с фильтром на 30 микрон, фильтром на 5 микрон и фильтром на 0,15 микрон. Такая система фильтрации может содержать любое количество фильтров с отверстиями любого размера. Например, система фильтрации может содержать фильтр для крупных частиц инородных веществ или остатков органических веществ, последовательно соединенный с фильтром на 1 микрон, фильтром на 30 микрон, фильтром на 1 микрон, фильтром на 5 микрон, фильтром на 0,2 микрона и фильтром на 0,15 микрона. Пример другой системы фильтрации показан на Фигуре 7А, на которой насос соединен с фильтром на 100 мкм и источником УФ-излучения.
В конкретном варианте реализации настоящего изобретения жидкость внутри инкубационной камеры меняется приблизительно от 1 до 10 раз за день, в частности приблизительно от 1 до 5 раз в день или приблизительно от 2 до 4 раз в день. Стерильная жидкость может закачиваться в камеру по меньшей мере через одно отверстие. Жидкость может удаляться из камеры через по меньшей мере одно отверстие, при этом жидкость может удаляться из камеры с помощью насоса. Пример системы замены жидкости показан на Фигуре 7А, на которой насос закачивает стерильную жидкость в камеру через первое отверстие, и второй насос удаляет старую жидкость из камеры через второе отверстие. В конкретном варианте реализации настоящего изобретения устройство и способы по данному изобретению используют замену жидкости и/или фильтрацию для поддержания стерильности жидкости (например, замена жидкости может выполняться без дополнительной фильтрации, хотя комплексное использование фильтров повышает стерильность).
В конкретном варианте реализации настоящего изобретения объект получает парентеральное питание через питательные трубки или с помощью системы для внутривенного введения в инкубационной камере. Объекту также могут вводить седативные средства для ограничения его движений, но настоящее изобретение не позволяет выполнять некоторые движения внутри камеры, и поэтому такая мера может не понадобиться. Объекту также могут вводить антибиотики (например, ампициллин, гентамицин и т.д.). Объекту также могут вводить антикоагулянт (например, гепарин). Объекту также могут вводить простагландин (например, простагландин-E1 или Е2). Также обычно осуществляется мониторинг показателей жизнедеятельности, веса, функции печени и кровотока объекта.
Также могут отслеживаться уровни билирубина.
На Фигурах 1 и 7 показаны примеры устройства по данному изобретению. На Фигуре 7А представлена схема устройства по данному изобретению. Такое устройство может быть одним блоком или содержать блоки в отдельных корпусах, соединенных между собой трубками. Также показанное устройство может иметь соответствующий размер для ягненка. Размер данного устройства может быть подобран под размер объекта. Например, устройство может составлять около 1/3 размера испытуемого человека.
На Фигуре 2 крупным планом показана инкубационная камера. Данная инкубационная камера может включать любое количество входных и выходных отверстий. В конкретном варианте реализации настоящего изобретения камера включает по меньшей мере одно входное отверстие и одно выходное отверстие для циркуляции стерильной жидкости внутри камеры. Инкубационная камера может также включать перчаточные отверстия для стерильного доступа к объекту (например, для пеленания объекта, чтобы его успокоить, или для доступа к объектам внутри камеры). Камера может также включать по меньшей мере одно отверстие для системы внутривенного введения для объекта. Камера может также иметь ряд отверстий (например, отверстия с восстанавливаемой герметичностью) для доступа к любому устройству из ряда контрольно-измерительных устройств. Например, камера может иметь отверстия для доступа к ультразвуковому устройству и/или к установке для диализа. Камера может также включать блок УФ-излучения (например, для обработки/прекращения разлития желчи).
Фигура 3 демонстрирует изображение оксигенатора, содержащегося внутри дополнительной сухой камеры. Фигуры 5 и 7С иллюстрируют пример конструкции контура с оксигенатором без сухой камеры. Хотя эта камера показана отделенной от инкубационной камеры разделительной перегородкой в одном блоке, обе камеры могут быть разделены на отдельные блоки (при этом они должны быть соединены трубками и т.д.). Канюли от объекта могут быть соединены непосредственно с оксигенатором в сухой камере или через отверстия в сухой камере. Сухая камера может также включать по меньшей мере одно отверстие для подачи на оксигенатор потока газа. Это отверстие может соединяться с оксигенатором через трубку в сухой камере. На Фигуре 3 также показаны дополнительные отверстия для добавления в сухую камеру нагревателя (например, с помощью теплой жидкости и трубки) для поддержания температуры крови, которая циркулирует по трубке и оксигенатору. Кроме того, трубки, подходящие к оксигенатору и/или отходящие от него, могут быть соединены с контрольно-измерительными устройствами (например, с контрольно-измерительными устройствами температуры, содержания газа и т.д.).
На Фигуре 7А показана схема примера устройства по данному изобретению. Камера изображена в виде чашеобразной емкости, расположенной внутри водяной ванны для поддержания температуры в системе. Инкубационная камера показана с двумя отверстиями для перчаток/рук в верхней части камеры (хотя отверстия могут быть расположены в любом месте, в том числе на боковых сторонах камеры) для стерильного доступа к внутреннему объему камеры. Камера содержит впускное отверстие для закачивания внутрь стерильной амниотической жидкости и выпускное отверстие для вывода использованной/старой амниотической жидкости. Камера также показана с системой фильтрации, содержащей насос, по меньшей мере один фильтр и УФ-фильтр для устранения бактерий и загрязнителей. В камере также показана сетка, на которой может быть расположен объект. На Фигуре 7А также показан оксигенатор (Ох) в жидкостном соединении с кровеносной системой объекта, в частности через канюли в шейных сосудах объекта. Оксигенатор соединен с газовым смесителем, к которому подведены воздух и кислород. Трубка системы оксигенатора может содержать по меньшей мере одно отверстие для ввода препаратов (например, питательных веществ, антибиотиков, лекарств и т.д.) в кровоток объекта. Контрольно-измерительные устройства (мониторы), например, для измерения давления, скорости потока и температуры, могут быть соединены с системой оксигенатора и/или с объектом напрямую.
Определения
Формы единственного числа английских артиклей "a," "an" и "the" включают ссылки на множественное число, если контекст явно не требует иное.
Используемые в данном документе термины «организм-носитель», «объект» и «пациент» относятся к любому животному, в частности к млекопитающим, включая человеческие существа.
Приведенные ниже примеры иллюстрируют различные варианты осуществления настоящего изобретения. Указанные примеры являются только иллюстративными и ни в коей мере не ограничивают объем данного изобретения.
ПРИМЕР 1
Недоношенный ягненок (28 недель) поддерживался в устройстве с помощью способов, указанных в данном изобретении. Артериальные канюли ЭКМО 8F-10F были установлены в сонной артерии и в яремной внутренней вене (размер был определен во время хирургического вмешательства).
Для подключения к канюлям использовались трубки ЭКМО длиной около 12 дюймов на входе и выходе кровотока. Предоставлялось парентеральное питание типа «полное парентеральное питание». На Фигуре 6А показано изображение ягненка, соединенного с данным устройством, и на Фигуре 6В показан ягненок через 5 дней роста. Рост незрелого ягненка на протяжении пяти дней демонстрирует способность данного изобретения поддерживать жизнеобеспечение плода за пределами матки.
ПРИМЕР 2
Осложнения, связанные с преждевременными родами, приводят к значительной заболеваемости и смертности, при этом третья часть всех смертей младенцев была отнесена к незрелого и хроническим осложнениям, отрицательно влияющих на большинство систем важных органов в выживших. В 2010 году 12,0% всех родов в США были преждевременными (меньше 37 недель полной гестации), 3,5% были с ранними сроками (меньше 34 недель гестации) (Martin et al. (2013) MMWR Surveill. Summ., 62(Suppl 3): 136-138). Дыхательная недостаточность является наиболее распространенной и сложной проблемой, с которой сталкиваются такие пациенты, поскольку газообмен у критически недоношенных новорожденных страдает от структурной и функциональной неразвитости легких. Достижения неонатальной интенсивной терапии, включая антенатальное введение стероидов, замену поверхностно-активных веществ, пульмональную сосудорасширяющую терапию и высокочастотную осцилляторную искусственную вентиляцию легких, позволили улучшить результаты и сдвинуть предельные сроки выживаемости с каналикулярной до саккулярной стадии развития легких на 22-24 неделях гестации. Однако неполное развитие большинства систем важных органов остается фактором, ограничивающим результаты выживания и оптимального функционирования для многих пациентов. Разработка внематочной системы поддержания непрерывного роста и развития плода без возмущающих воздействий, связанных с постнатальной интенсивной терапией, дала бы шанс на выживание критически недоношенных новорожденных с потенциальным снижением смертности и долгосрочной заболеваемости.
Концепция экстракорпоральной мембранной оксигенации (ЭКМО) плода стала популярной благодаря сходным чертам с врожденной фетальной физиологией, в которой экстракорпоральный газообмен выполняется плацентой. Искусственная плацента стала объектом экспериментальных исследований с 60-х годов прошлого столетия, когда была проведена серия коротких экспериментов, в которых плоды ягнят были канюлированы через пуповинные сосуды и перфузированы пузырьковыми мембранными генераторами первого поколения с временем поддержания перфузии от 40 минут до 2 дней (Callaghan et al. (1963) Circulation 27:686-690; Zapol et al. (1969) Science 166:617-618). Благодаря значительному прогрессу в технологии изготовления оксигенаторов и насосов, произошедшему в следующие два десятилетия, длительность поддержания внематочной жизни плода была увеличена с помощью контуров ЭКМО, приводимых в движение обычными насосами, и достигла трех недель до наступления нарушения кровообращения (Kuwabara et al. (1986) Artificial Organs 11:224-277; Kuwabara et al. (1989) Artificial Organs 13:527-531; Unno et al. (1993) Artificial Organs 17:996-1003; Unno et al. (1997) Artificial Organs 21: 1239-1246). Несмотря на увеличение продолжительности выживания, указанные исследования были ограничены перегрузкой системы кровообращения и сердечной недостаточностью, что приводило к развитию перегруженного состояния жидкости и смерти животных, участвующих в экспериментах.
Некоторые характеристики обычного венозно-артериального контура ЭКМО с использованием насоса воспринимаются как проблема для применения этой технологии поддержания жизнедеятельности плода. Большой объем первичного заполнения контура существенно выше, чем избыток врожденного плацентарного резерва, что приводит к увеличению объема распределения. Поддерживаемый насосом непульсирующий поток крови также является отклонением от врожденной физиологии плода с потенциальным риском значительного увеличения кардиальной постнагрузки и возникающим вследствие этого миокардиальным напряжением в дополнение к потере врожденной ауторегуляции кровотока. Наконец, вследствие большой площади поверхности таких контуров возникает требование обеспечения высоких уровней антикоагуляции во всем теле. Безнасосный контур может обладать преимуществами по сравнению с существующей технологией ЭКМО, включая объемы первичного заполнения и распределения, сокращение времени взаимодействия крови с тромбогенными поверхностями и достижение естественной регуляции скорости и давления кровотока самим сердцем плода.
Разработка безнасосной экстракорпоральной системы оксигенации остается пока несбыточной мечтой. В литературе сообщалось только о пяти попытках достигнуть фетальной оксигенации в безнасосной системе, и все они были однозначно неудачными исследованиями с летальным исходом плода в пределах от нескольких минут до 29 часов вследствие уменьшения скорости кровотока и требования ввода прессора для искусственного продления перфузии (A wad et al. (1995) J. Invest. Surg., 8:21-30, Reoma et al. (2009) J. Pediatr. Surg., 44:53-59; Mima et al. (2012) Pediatr. Res., 72:490-494; Schoberer et al. (2014) Artificial Organs 38:208-14).
Недавний прогресс в экстракорпоральной мембранной технологии привел к появлению поколения устройств с очень низким сопротивлением, малым объемом первичного заполнения и высокоэффективным газообменом, позволяющих лучше воспроизводить свойства плаценты. В частности, педиатрический оксигенатор MaquetQuadrox-ID поддерживает возможность достижения безнасосной оксигенации фетальной крови с использованием собственного сердца, которое приводит в движение поток крови в контуре. Этот оксигенатор с большим успехом использовался педиатрическими пациентами в качестве безнасосного искусственного легкого (Boston et al. (2013) J. Thorac. Cardiovasc. Surg., 146:е42-е43). Подход здесь состоял в обеспечении оксигенации фетальной крови и стабильной гемодинамики с помощью модифицированного безнасосного контура, который позволяет сердцу плода работать как насос, воспроизводящий врожденную фетальную гемодинамику. Главные проблемы состояли в достижении стабильной перфузии, автоматически регулируемой врожденным кровообращением плода, воспроизведении стерильной, внутриматочной, жидкой погружной среды и обеспечении надлежащего роста и развития плода.
В данном документе представлена первая демонстрация безнасосной внематочной системы поддержания жизнедеятельности плода (БВСПЖП), которая обеспечивает длительную стабильную инкубацию плода млекопитающего на протяжении периода времени до трех недель с нормальным ростом, метаболизмом и поддержанием ауторегуляции кровообращения плода.
СПОСОБЫ
Хирургическое вмешательство
Использовались суягные овцы с известными гестационными возрастами, находившимися в пределах от 120 до 135 дней (нормальный срок = 145 дней). Животные подвергались воздействию и изучались в соответствии с утвержденными протоколами Институционального комитета по содержанию и использованию лабораторных животных в детской клинике в Филадельфии.
Овцы получали анестезию 15 мг/кг внутримышечного кетамина с поддержанием общей анестезии путем вдыхания 2-4% изофлурана в О2. Интраоперационное гемодинамическое мониторирование включало пульсовую оксиметрию с постоянной инфузией изотонического раствора, вводимого через центральный венозный катетер, установленный в правой яремной вене, для поддержания баланса материнской жидкости.
Была выполнена умеренная срединная лапаротомия, чтобы открыть матку, и малая гистеротомия - чтобы открыть голову и шею плода овцы. В случае ягнят-двойнят фетальная кровь отбиралась у животного-донора для последующего наполнения контура. Животному-донору выполнялся малый разрез с правой стороны шеи, чтобы открыть яремную вену, вводились одна доза бупренорфина (0,005 мг/кг) внутримышечно и одна доза гепарина натрия (150 единиц Американской фармакопеи, АРР Pharmaceuticals, Schaumburg, IL) внутривенно, после чего выполнялся малый разрез с правой стороны шеи для открытия яремной вены и ввода катетера для сбора всего объема крови животного. В случае одного плода материнская кровь собиралась и затем наполняла контур. Для всех животных производился сбор и хранение материнской крови для последующего вливания во время выполнения эксперимента.
Подопытным ягнятам выполнялся малый разрез с правой стороны шеи для открытия сонной артерии и яремной вены. Животные получали одну дозу бупренорфина (0,005 мг/кг) внутримышечно и одну дозу гепарина натрия (300 единиц Американской фармакопеи) внутривенно. После определения максимального размера канюли для каждого сосуда устанавливались канюли ЭКМО (размеры в пределах 8-12 Шаррьер, Avalon Laboratories, LLC, Rancho Dominguez, CA) со стабилизирующими швами по внешней длине канюли на шее. В подгруппе животных на внешнюю часть канюль устанавливалась силиконовая «манжета» длиной 3-5 см для обеспечения повышенного натяжения стабилизирующих швов. Подгруппе животных также устанавливались электроды из нескольких изолированных витых проводов из нержавеющей стали для выполнения измерений глазной электромиографии (ЭОГ) и электроэнцефалографии (ЭЭГ). Электроды для ЭМГ были имплантированы подкожно в верхней и нижней крайних частях мышцы, покрывающей орбиту одного глаза, и пара электродов для ЭЭГ была закреплена на твердой мозговой оболочке парасагиттальной теменной коры цианоакриловым клеем, при этом электрод сравнения был пришит к затылку.
После создания контура оксигенатора и заполнения его кровью, как будет описано ниже, было выполнено подсоединение канюлей к контуру в условиях ультрасонографической визуализации сердца плода. Сразу же после установления в контуре кровотока было выполнено закупоривание пуповинного канатика с вводом дополнительного объема крови и/или атропина (0,1 мг) и/или эпинефрина (0,1 мг) в подгруппе животных, в которых была выявлена плохая сократимость сердца сразу же после установления кровотока в контуре. После подтверждения стабильной сердечной деятельности и устойчивого кровотока в контуре по внешней длине канюлей были наложены швы-держалки для прикрепления канюлей к шее животного. После этого было последовательно выполнено взвешивание, купание в теплом стерильном физиологическом растворе и перемещение плодов ягнят в кувез со стерильной жидкостью для дальнейшего проведения эксперимента, как описано в этом документе.
Чтобы получить исходные данные для плода овцы в матке, была выполнена лапаротомия двух суягных овцематок с гестационным возрастом 118 дней для имплантации фетальных васкулярных катетеров и электродов, как описано в литературе (Crossley et al. (1997) Reprod. Fertil. Dev., 9:767-73). Если вкратце, то после применения общей анестезии и эксплантации плода в сонную артерию и яремную вену плода были имплантированы катетеры в дополнение к катетеру сравнения, введенному в амниотический мешок, с последующим размещением проводных электродов ЭОГ и дуральных электродов ЭЭГ, как было описано выше. В дополнение к этим исследованиям, проводные электроды для ЭМГ устанавливались в мышцах затылка и диафрагмы. Для доступа к левой задней части диафрагмы был выполнен средний аксилярный разрез, где затем были пришиты два электрода на расстоянии 1,0 см друг от друга, и также один электрод был зашит в длинную мышцу шеи для регистрации затылочной деятельности. Фетальные катетеры и электроды выводились через материнскую боковую поверхность, и матка и брюшная полость были закрыты. После 48-72 часов восстановления овцематки были помещены в клетку для мониторинга состояния плода.
Контур
Контур безнасосной внематочной системы поддержания жизнедеятельности плода (БВСПЖП) состоял из половолоконного оксигенатора с низким сопротивлением (Quadrox-ID, Maquet, Rastatt, Германия), соединенным с канюлями ЭКМО с покрытыми изнутри гепарином трубками BIOLINE 3/16'' производства Medtronic (Medtronic, Миннеаполис, Миннесота). Соединения составили артериально-венозный экстракорпоральный контур оксигенации, в котором выходящий из сонной артерии и находящийся под пульсирующим давлением кровеносной системы кровоток был соединен с отверстием оксигенатора для впуска кровотока, а обратный кровоток был соединен с отверстием оксигенатора для выпуска кровотока. Объем первичного заполнения составлял 81 мл, и гепаринизированная фетальная кровь использовалась, при наличии, с материнской кровью, которая циркулировала в случае одноплодной беременности. Скорость кровотока в контуре измерялась датчиком расхода (Transonic Systems Inc, Ithaca NY), а продувочный газ, подаваемый в оксигенатор, был смесью медицинского воздуха и кислорода, титрированной до значений газов в фетальной крови.
Жидкостная инкубация
В исследовании конструкция кувеза включала 30-литровую подогреваемую емкость из нержавеющей стали, заполненную стерильной искусственной амниотической жидкостью («стальная емкость»), 40-литровый сосуд из поликарбоната с непрерывной рециркуляцией жидкости через последовательность стерильных фильтров («рециркуляционная фильтрация») и, наконец, 60-литровый сосуд между трубками для ввода и вывода потока, установленный на перистальтическом насосе с двойным напором для облегчения выполнения непрерывного обмена стерильной жидкости («непрерывный обмен»). В последней системе полный объем сосуда увеличен в три раза и заменен 180-литровой емкостью стерильного входного потока, рассчитанной на 24 часа. Искусственная амниотическая жидкость состояла из сбалансированного солевого раствора Na+ (109 ммоль), CI- (104 ммоль), НСО3- (19 ммоль), K+ (6,5 ммоль), Са2+ (1,6 ммоль), рН 7,0-7,1, осмолярность 235,8 мосм/кг воды. К конечной концентрации были добавлены антибиотики - 18 мг/л гентамицина и 30 мг/л ципрофлоксацина, и в емкости с жидкостью был установлен погружной насос ультрафиолетового стерилизатора для непрерывной стерилизации рециркулирующей жидкости на протяжении всего времени проведения исследования.
Подержание жизнедеятельности плода ягненка в контуре После стабилизации и перевода животных в кувез с жидкостью выполнялась непрерывная внутривенная инфузия гепарина (80-200 единиц Американской фармакопеи в час) и простагландина EI (0,1 мкг/кг/мин, Pfizer Inc, New York, NY). Через каждые 1-4 часа выполнялся забор крови для определения содержания газов, электролитов и коагуляционной способности с помощью анализатора i-Stat® System (Abbott Point of Care Inc, Princeton, NJ) с титрированием инфузии гепарина до заданного активированного времени свертывания крови 180-200 секунд (100-400 единиц Американской фармакопеи в час) и титрированием продувочного газа оксигенатора до заданных значений фетального парциального давления О2 (РаО2 20-30 мм рт. ст.) и CO2 (РаСО2 35-45 мм рт. ст.) (FiO2 21-55%, продувочный газ 0,125-1,5 л/мин). Хранящаяся цельная материнская кровь использовалась для поддержания уровней фетального гемоглобина свыше 9 мг/дл. Анальгетики (бупренорфин, 0,005 мг/кг IV через каждые 3-5 часов по необходимости) и малые транквилизаторы (мидазолам, 0,4 мг/кг IV через каждые 3-5 часов по необходимости) вводились в периоды очевидного угнетения плода (беспокойных повторяющихся движений плода, тахикардии, повышенного кровяного давления). На протяжении всего инкубационного периода плода вводилось полное парентеральное питание с дозировкой 3,5 г/кг аминокислот (TrophAmine® 10%), 5-10% декстрозы и 3 г/кг липидов (Intralipid® 20%).
Получение данных
Давление фетальной крови, частота сердечных сокращений, скорости потоков в контуре, трансмембранный перепад давлений, скорости потока продувочного газа и температура жидкости в ванной непрерывно регистрировались с отбором дискретных данных через каждые 0,1 секунды (LabChart 5, ADInstrumentsInc, Colorado Springs CO). Исходя из данных измерений по содержанию кислорода и диоксида углерода на выходе оксигенатора, ежедневно подсчитывались потребление кислорода и дыхательный коэффициент. Для этого использовались следующие формулы:
Содержание кислорода в крови (О2С)=1,34 × Hgb × SaO2/100+0,003 × РаО2 (мм рт. ст.)
Доставка кислорода (OD) = послемембранное О2С × скорость кровотока в контуре/100/масса тела
Потребление кислорода (ОС) = (послемембранное О2С предмембранное О2С) × скорость кровотока в контуре/100
Коэффициент поглощения кислорода тканями (OER)=(OC/OD) × 100.
Мониторинг состояния плодов ягнят с введенными катетерами в матке начинался через 48-72 часов после проведения хирургического вмешательства и осуществлялся на протяжении 24-часовых интервалов через день вплоть до выполнения протокола эксперимента после достижения гестационного возраста 140 дней. Непрерывная регистрация данных ЭЭГ, ЭМГ и артериального давления выполнялась с фиксацией данных через каждые 0,1 секунды (LabChart 5, ADInstrumentsInc, Colorado Springs CO).
Деканюляция
После завершения запланированного периода инкубации животные извлекались из ванны с жидкостью с эндотрахеальной интубацией и отсасыванием для удаления излишней жидкости из легких. Общая анестезия поддерживалась путем вдыхания 2-4% изофлурана в 100% О2, и проводился интраоперационный гемодинамический мониторинг, включая пульсовую оксиметрию, с постоянной инфузией изотонического раствора, вводимого через периферийную венозную канюлю. Артериальная и венозная канюли ЭКМО были удалены с лигированием соответствующих сосудов, а разрез на шее был закрыт с помощью рассасывающегося шва. Затем было прекращено поддержание анестезии и была выполнена экстубация сразу же после стимулирования самостоятельного дыхания с газами артериальной крови, демонстрирующими надлежащий газообмен (РаО2>75 мм рт. ст., РаСО2<50 мм рт. ст. во вдыхаемом медицинском воздухе, FiO2 21%).
РЕЗУЛЬТАТЫ
Пробные исследования
Для определения стабильности состояния плода в контуре БВСПЖП было проведено 5 пробных экспериментов (Таблица 1). Гестационные возрасты плодов лежали в пределах от 120 до 140 дней при массах плодов в пределах от 3,20 до 4,89 кг. Во время поддержания жизнедеятельности в контуре все животные демонстрировали замечательную гемодинамическую стабильность без признаков ацидоза или увеличения лактата, уменьшения скорости кровотока в контуре или нарушения кровообращения. Неожиданно сразу после начального открытия кровообращения плода в контур БВСПЖП у двоих животных проявилась брадикардия, что потребовало введения эпинефрина и атрофина для восстановления нормальной сердечной деятельности. После этого начального осложнения на протяжении всего периода исследования животным не потребовалась вазопрессорная поддержка. В контурах всех животных обеспечивалось торможение свертывания крови и поддерживалось полное парентеральное питание.
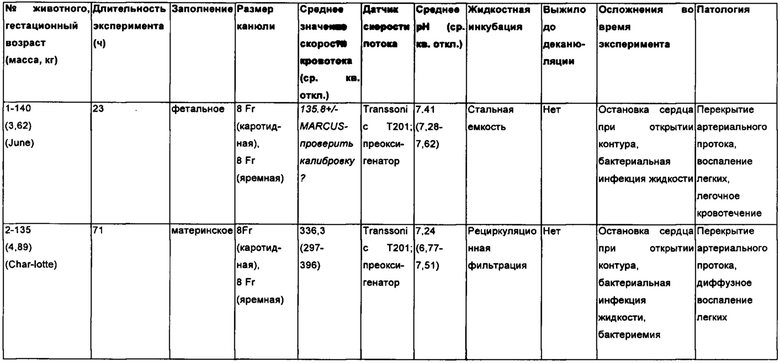

Таблица 1: исследование животных.
Было обнаружено несколько отрицательно влияющих на продолжительное жизнеобеспечение плода факторов, связанных с бактериальным загрязнением кувеза с жидкостью, выявленное у четырех из пяти животных (Таблица 1). В начальном пробном исследовании использовался подогреваемый открытый кувез, заполненный стерильной амниотической жидкостью, которая доливалась только для возмещения потерь на испарение без внутреннего перемешивания и использования антибиотиков. В пределах 12 часов в жидкости кувеза развился избыточный бактериальный рост, который через 23 часа охватил весь контур, вследствие чего у животного развилось массивное легочное кровотечение. Результаты гистологического исследования подтвердили значительные диффузные воспалительные изменения по всему объему легких, указывающие на тяжелую бактериальную пневмонию. Затем конструкция кувеза была доработана для закрытой системы с рециркуляцией амниотической жидкости, содержащей антибиотики (30 мг/л ципрофлоксацина, 18 мг/л гентамицина), через ряд фильтров с увеличивающейся тонкостью фильтрации (1 мм, 10 мкм, 5 мкм, 2 мкм, 0,2 мкм) для удаления крупных частиц инородных веществ или остатков органических веществи поддержания стерильности. В таком кувезе были выполнены два исследования. В обоих случаях в пределах 48 часов инкубации было подтверждено размножение бактерий в культуре пробной жидкости в ванной. У одного животного на протяжении инкубационного периода развилась повышенная потребность в FiO2, и с помощью эхокардиографии было обнаружено значительное сужение артериального протока, что привело к замедлению смешивания оксигенированной крови через полую верхнюю вену. Второе животное на протяжении 96-часового периода инкубации не имело осложнений. Было выполнено его извлечение и деканюляция в гестационном возрасте (сроке) 140 дней, но был обнаружен нарушенный газообмен, несмотря на активные самопроизвольные дыхательные усилия. У обоих животных было обнаружено выраженное воспаление легких, указывающее на пневмонию и бактериемию. Была разработана закрытая стерильная система с непрерывной заменой жидкости, в которой искусственная амниотическая жидкость проходила через ряд фильтров 0,22 мкм перед входом в кувез, скорость входящего потока равнялась скорости выходящего потока, и полная замена 60-литрового объема жидкости в кувезе выполнялась 2-4 раза в день (Фигура 7).
Были установлены дополнительные технические ограничения, включавшие преждевременное закрытие артериального протока в двух животных, которых подвергли воздействию эпинефрина, образование сгустка крови в контуре, включавшем участок трубки без покрытия, препятствующего свертыванию крови, и травматическую деканюляцию в одного животного, приведшую к его геморрагической гибели (Таблица 1). Эти результаты привели к добавлению непрерывной инфузии простагландина-Е2 для поддержания фетальных анастомозов, внедрению контура, содержащего трубки с полным покрытием, препятствующим свертыванию крови, и добавлению стерильной силиконовой манжеты, покрывающей каждую канюлю для повышения устойчивости фиксации шва-держалки.
Биохимические и гемодинамические параметры плода После описанной выше доработки системы в контуре БВСПЖП поддерживалась жизнедеятельность пяти подопытных животных на протяжении 343,8 +/- 93,5 часов (Таблица 2). На Фигуре 8 показаны графики изменения газов фетальной крови, гемодинамики и скоростей потоков в контуре на протяжении выполнения пяти независимых экспериментов. Уровень рН оставался стабильным в течение всего периода инкубации (Фигура 8А), а парциальные давления кислорода и диоксида углерода поддерживались на заданных фетальных уровнях на протяжении всего эксперимента (Фигура 8В). В то время как фоновая частота сердечных сокращений оставалась стабильной в течение всего периода инкубации (Фигура 8С), систолическое артериальное давление крови у животных равномерно возрастало (Фигура 8D) в соответствии с ожидаемыми темпами роста. Аналогично, скорости кровотока в контуре возрастали пропорционально увеличению давления крови (Фигура 8Е), и также равномерно увеличивалась концентрация подводимого кислорода, необходимого для поддержания заданных уровней оксигенации артериальной крови, отразившая возрастание метаболической потребности плода (Фигура 8F).
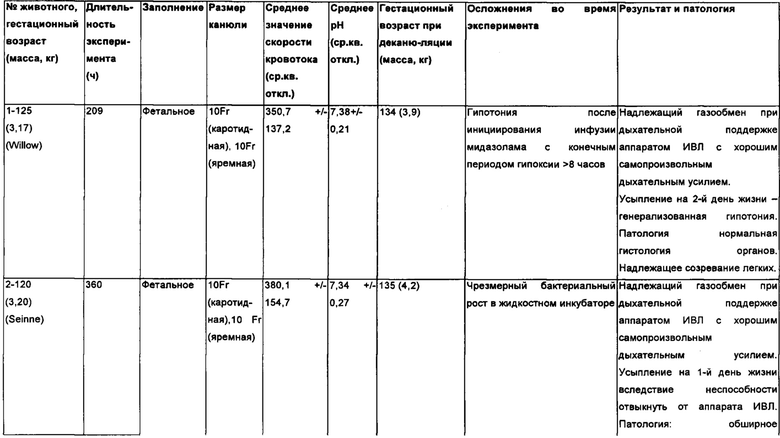
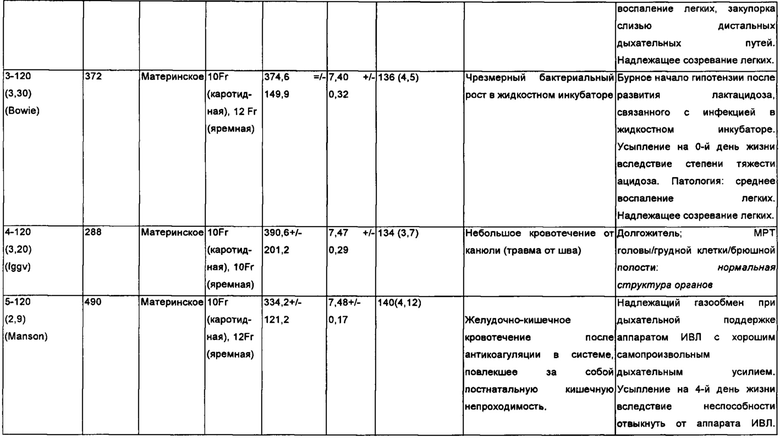

Таблица 2: исследование животных.
Характеристики кровотока в БВСПЖП
Скорость кровотока плода во время нахождения в БВСПЖП линейно зависит от систолического артериального давления животного (Фигура 9), является пульсирующей и прямо коррелирует с измеренным сердечным выбросом. Ауторегуляция кровотока в контуре последовательно демонстрировалась как реакция на гипоксию, при этом систолическое артериальное давление и скорость кровотока в контуре для восстановления равновесия возрастают в ответ на снижение скорости потока продувочного газа к оксигенатору, и скорость кровотока и давление крови восстанавливаются до начального уровня после восстановления скорости потока продувочного газа.
Фетальный рост и метаболизм в БВСПЖП
В ходе пяти независимых экспериментов, продолжавшихся в течение от 209 до 490 часов, животные вырастали в среднем на 930+/-278 грамм (Фигура 10А). Дыхательные движения плода регулярно отмечались на протяжении всего периода инкубации и коррелировали с парциальным давлением диоксида углерода, измеренным в большом круге кровообращения (Фигура 10В). Была выполнена эхокардиография для подтверждения раскрытого состояния фетальных кровеносных анастомозов, включая артериальный проток (Фигура 10С). Суммарное потребление кислорода постоянно увеличивалось в ходе пяти независимых экспериментов (Фигура 10D) в соответствии с ростом и пропорциональным увеличением метаболической потребности плода. Было установлено, что после того, как масса плода достигла расчетного значения, полученного из кривой роста, рассчитанной на основе масс, измеренных до и после БВСПЖП, скорости потребления кислорода оставались постоянными на протяжении всего периода инкубации.
С помощью ЭЭГ, ЭОГ и ЭМГ регистрировались циклы сна-бодрствования, дыхательные движения и движения всего тела двух постоянно катетеризированных плодов ягнят и сравнивались с двумя ягнятами, жизнедеятельность которых поддерживалась в искусственной плаценте на протяжении того же самого периода гестации. Информация с катетеризированного плода ягненка в матке записывалась на 125 и 140 день гестации, и информация с плода ягненка в искусственной плаценте регистрировалась в те же самые гестационные сроки. Прогрессирующее развитие от фрагментарного до крепкого непрерывного сна между двумя гестационными возрастами было очевидными как для животного в матке, так и для животного в БВСПЖП.
На протяжении всего периода инкубации наблюдались непрерывный рост и развитие плода, причем было отмечено, что веки развиваются от сросшегося до открытого состояния, и были отмечены усиленный рост шерсти и повышенный уровень активности и бодрствования (Фигуры 11А и 11В). По сравнению с контрольными легкими ягнят со сроком гестации 120 дней, также последовательно проявлялись гистологические признаки созревания легких с утончением альвеолярных стенок и вторичным разделением на перегородки после завершения эксперимента в БВСПЖП, длившегося 200 часов (Фигура 11С, Таблица 2).
Одно животное поддерживалось в искусственной плаценте 288 часов в условиях отсутствия инфекции, и было успешно извлечено из нее и переведено в условия внеутробной жизни (Фигура 5D). Магнитно-резонансная томография подтвердила нормальную структуру мозга, органов грудной и брюшной полости, и животное демонстрировало надлежащий рост и развитие на протяжении восьми месяцев перед переводом в лабораторию для длительного адоптивного пребывания.
Оптимальной конструкцией для искусственной плаценты может быть безнасосный контур, обеспечивающий длительную поддержку внематочного плода. Однако предыдущие попытки в этом направлении были ограничены низкими скоростями кровотока и плохой перфузией. В данном документе описана система безнасосного внематочного поддержания жизнедеятельности плода (БВСПЖП), которая обеспечивает длительную инкубацию плода млекопитающего животного в течение трех недель или дольше. С помощью высококачественного оксигенатора с крайне низким сопротивлением и низкими объемами первичного заполнения был создан контур, который более точно воссоздает условия плаценты. В литературе сообщалось, что объем плацентарной крови овцы лежит в пределах от 23,1 до 48,1 мл/кг (Creasy et al. (1970) Circ. Res., 27:487-494), а скорость кровотока в плаценте составляет 199+/- 20 мл/мин/кг (Faber et al. (1972) J. Pysiol., 223:375-393). Для описанного здесь контура требуется объем первичного заполнения 80-90 мл или 27 мл/кг среднего 120-дневного 3-килограмового плода ягненка, а скорости кровотока в системе составляли в среднем 120-140 мл/мин/кг.
В случаях применения экстракорпоральной оксигенации плода заполнение контура оксигенатора фетальной кровью могло бы иметь преимущества с точки зрения разгрузки кислорода и поддержания периферической перфузии. Однако, полное заполнение контура фетальной кровью достигалось только в случае беременности двумя плодами, в случае одноплодной беременности контур заполнялся материнской кровью (Таблицы 1 и 2), и на протяжении длительной фетальной инкубации не наблюдались различия в содержании кислорода в артериальной крови, образовании молочной кислоты или сердечной деятельности.
Безнасосный контур, в котором с помощью ауторегуляции может поддерживаться врожденная гемодинамика, может представлять интерес для нормального развития плода. До настоящего изобретения наиболее длительные эксперименты с внематочной инкубацией плодов животных проводились с использованием контура, содержащего силиконовый половолоконный мембранный оксигенатор и перистальтический насос, и животных, канюлированных через пуповинные сосуды (Kuwabara et al. (1986) Artificial Organs 1 1:224-277; Kuwabara et al. (1989) Artificial Organs 13:527-531). У 6 животных, у которых кровообращение непосредственно регулировалось перистальтическим насосом, максимальная продолжительность инкубации составляла 8 часов с быстрым наступлением сердечной недостаточности, которая стала причиной смерти плода в большинстве экспериментов. В этом исследовании длительность эксперимента была значительно увеличена путем добавления емкости для крови, которая пассивно заполнялась пуповинным потоком артериальной крови и которая автоматически регулировала скорость кровотока через насос в соответствии со скоростью наполнения емкости. Скорости кровотока у всех животных поддерживались в пределах от 100 до 200 мл/мин, и уровни фетальных газов поддерживались в заданных пределах на протяжении всего периода инкубации. Хотя это была и не безнасосная система, такая модификация действительно позволила скорости кровотока лучше воспроизводить врожденную циркуляцию крови и действительно увеличила время выживания до 165 часов. Однако, сердечная недостаточность и выраженный подкожный отек неизбежно развивались у всех животных, которые не поддавались ятрогенным осложнениям, таким как кровотечение или эмболия. В следующем исследовании этот контур с поддержкой в виде емкости был доработан путем добавления гемодиализа для улучшения водно-солевого баланса, благодаря чему удалось достигнуть продолжительности инкубации 236 часов со скоростью кровотока в пределах от 50 до 100 мл/мин/кг. Но опять-таки, хотя три животных умерли из-за неисправностей катетера, причиной всех нетехнических летальных исходов была сердечная недостаточность с прогрессирующей недостаточностью кровообращения и последующей смертью в контуре. Исходя из подозрения, что движение плода могло вносить вклад в дисбаланс жидкостей, нарушения кровотока и геморрагические осложнения, последующее исследование, использующее этот контур с постоянным введением парализующих препаратов, привело к стабильному поддержанию жизнедеятельности двух родившихся преждевременно плодов козы на протяжении, соответственно, 494 и 543 часов со скоростями кровотоков от 80 до 180 мл/мин/кг и успешному извлечению из кувеза и переводу на искусственную вентиляцию легких (Unno et al. (1993) Artificial Organs 17:996-1003). Однако животные не продемонстрировали самопроизвольное дыхательное усилие и скончались вследствие дыхательной недостаточности. В дальнейших исследованиях работы этого контура с усовершенствованиями, включая установку трубки закупоривания для создания фиксированной точки сопротивления в артериальном кровотоке, продолжительность инкубации увеличилась до 236 часов, но все животные умерли вследствие нарушения кровообращения, для которого было характерно снижение скорости кровотока и давления крови, а также рецидивирующие аритмии (Unno et al. (1997) Artificial Organs 21: 1239-1246).
В дополнительных исследованиях были предприняты попытки добиться улучшения кровообращения после продолжительной внематочной инкубации плода, но были получены аналогичные результаты летального исхода вследствие нарушения кровообращения. В 1998 году проводились исследования четырех плодов козы, которые были канюлированы через пуповинные сосуды и поддерживались в контуре, содержащем половолоконный оксигенатор и центробежный насос (Yasufuku et al. (1998) J. Pediatr. Surg., 33:442- 448). По сравнению с данными из ранее опубликованных отчетов, этот контур обеспечивал доставку пульсирующего кровотока с более высокими скоростями, лежащими в пределах от 113 до 193 мл/мин/кг. Суммарная длительность поддержания жизнедеятельности составляла от 87 до 237 часов, при этом все животные умерли из-за отеков вследствие нарушения кровообращения. В 2002 году проводилось исследование 12 плодов козы, которые были канюлированы через пуповинные сосуды и поддерживались в контуре, содержащем перистальтический насос с ручной регулировкой скорости кровотока, с целью увеличения скорости оттока в пуповинной артерии. В этом исследовании 3 животных умерло из-за проблем с канюлями, одно животное умерло вследствие гипоксии после образования сгустка крови в контуре, а в оставшихся 8 животных развилось нарушение кровообращения. Были достигнуты скорости кровотока от 103,0+/-17,0 до 176,0+/-15,0 (мл/мин/кг) и получен надлежащий газообмен, однако, как было определено, отток в пуповинной артерии с помощью перистальтического насоса привел к прикладыванию увеличенной постнагрузки к миокарду.
Продолжительная демонстрация перегрузки системы кровообращения в поддерживаемой насосом фетальной ЭКМО свидетельствует о неприемлемой постнагрузке, налагаемой этими контурами, что приводит к последующей сердечной недостаточности. Более того, в идеальной искусственной плаценте будет поддерживаться кровообращение плода, аналогичное достигнутому в здоровой фетоплацентарной единице, в которой перфузия определяется фетальным сердечным выбросом. Однако, в предыдущих попытках разработать безнасосную систему для фетальной перфузии были получены удручающие результаты. Например, сообщалось об использовании безнасосного контура в исследовании ряда ягнят с созданными хирургическим путем, присутствующими при рождении диафрагмальными грыжами (A wad et al. (1995) J. Invest. Surg., 8:21-30). Перфузирование животных длилось до 6 часов, но скорости кровотока в контуре не превышали 75 мл/мин, и уровни оксигенации были недостаточными для поддержания устойчивой длительной инкубации. В 2009 году сообщалось о безнасосном экстракорпоральном контуре, в котором использовались половолоконный оксигенатор и пуповинная катетеризация четырех почти доношенных ягнят (Reoma et al. (2009) J. Pediatr. Surg., 44:53-59). В этой системе жизнедеятельность животных поддерживалась до четырех часов с постепенным снижением в контуре скорости кровотока и систолического артериального давления в течение этого короткого периода инкубации. Был сделан вывод о том, что в системе, работающей от насоса, необходимо поддерживать надлежащую скорость кровотока и перфузию плода. В 2012 году сообщалось о безнасосном экстракорпоральном контуре для ягнят с гестационным возрастом 130+/- 1,6 дней с катетеризацией единственной артерией пуповины и пуповинной вены (Mima et al. (2012) Pediatr. Res., 72:490-494). 5 подопытных животных доживали в среднем до 18,2+/- 3,2 часов, но затем прогрессирующий лактацидоз приводил к сердечной недостаточности и смерти. При введении прессоров для повышения сердечной сократимости и инотропных средств для расширения периферических кровеносных сосудов длительное выживание в этой системе достигнуто не было. Наконец, было сообщение о разработке миниатюрного малообъемного оксигенатора с объемом первичного заполнения 12 мл и площадью поверхности газообмена 0,12 м2 (Schoberer et al. (2014) Artificial Organs 38:208-14). Животные были канюлированы через пуповинные сосуды, но в дополнение к экстракорпоральной оксигенации их жизнедеятельность поддерживалась с помощью искусственной вентиляции легких. В этой системе безнасосное экстракорпоральное поддержание жизнедеятельности 6 из 7 исследуемых животных продолжалось на протяжении 6 часов, до заданной конечной точки, однако у всех животных развились метаболический ацидоз, повышенный уровень лактата в крови и непрерывное падение кровяного давления, и поэтому трем животным для достижения конечной точки эксперимента в конечном счете потребовалось введение катехоламинов. В системе по данному изобретению на протяжении трех недель поддержания жизнедеятельности ни одному животному не потребовалось введение прессора для поддержания стабильной гемодинамики и перфузии.
В этом исследовании была достигнута стерильность жидкой инкубационной фетальной системы на протяжении длительного периода времени. В предыдущих отчетах об исследованиях, в которых использовались жидкостные погружные системы, подробно не описывались скорость бактериального загрязнения и пути повышения стерильности. В частности, был описан кувез, наполненный искусственной амниотической жидкостью и антибиотиками, с ежедневной прямоточной фильтрацией и полной заменой жидкости один раз в два дня (Kuwabara et al. (1989) Artificial Organs 13:527-531). В этом исследовании наибольшая продолжительность инкубации плода составляла 236 часа. В настоящем исследовании в окончательном варианте конструкции кувеза инфекция обычно не появлялась до 12-го дня или 288 часов. При увеличении длительности периода инкубации вероятно возрастут сложности с поддержанием стерильности.
На протяжении всей серии экспериментов с животными в конструкцию кувеза было внесено несколько усовершенствований, включая прикрепление перчаток для облегчения выполнения манипуляций и изменения положения животного без нарушения стерильности, а также установку внутренне закрепленного герметичного отсасывающего устройства для обеспечения удаления продуктов жизнедеятельности и инородных веществ или остатков органических веществ. Кроме того, внутри емкости с жидкостью была установлена аквариумная ультрафиолетовая система фильтрации для обеспечения дополнительного уровня антибактериальной защиты. С использованием этих усовершенствований стерильность поддерживалась до трех недель инкубации плода, что являлось значительным периодом для роста и развития критически недоношенного новорожденного.
Одним из преимуществ безнасосной системы перфузии плода является обеспечение регулирования церебрального кровотока по врожденным ауторегуляторным путям. Обеспечение надлежащей оксигенации развивающегося мозга является ключевым моментом при разработке конструкции искусственной плаценты с церебральной ауторегуляцией, которая, как считают, представляет собой один важный компонент церебральной перфузии. Церебральная ауторегуляция была хорошо описана для совокупности новорожденных младенцев, которым требовалась интенсивная терапия, но понята была плохо. Существует такая большая межиндивидуальная вариабельность в отношении измеренных пределов скорости кровотока через мозговую артерию, пороговых значений вазореактивности и ауто регуляции, что нормативные значения для этих пациентов остаются неопределенными (Vutskis, L. (2014) Pediatr. Anesth., 24:22-29). Церебральная ауторегуляция также наблюдалась у человеческого плода, при этом увеличенная пиковая систолическая скорость через среднюю мозговую артерию была описана у плодов с задержкой внутриутробного развития (Hanif et al. (2007) Am. J. Perinatol, 24:501-505). Воздействие обычной поддерживаемой насосом ЭКМО на церебральную перфузию в новорожденных показало хорошо задокументированную потерю ауторегуляции в качестве реакции на гипоксию плода в нескольких системах, включая модели ягненка в веноартериальной ЭКМО (Short et al. (1993) Pediatr. Res., 33:289-294; Stolar et al. (1988) J. Pediatr. Surg., 23: 1 163-1168), исследования новорожденных ягнят, поддерживаемых в веноартериальной ЭКМО (Walker et al. (1996) Crit. Care Med., 24:2001-2006), а также младенцев, поддерживаемых в веноартериальной ЭКМО (Papademetriou et al. (2013) Adv. Exp. Med. Biol., 765:203-209), из чего можно заключить о значительных изменениях церебральной перфузии в условиях поддерживаемого насосом потока ЭКМО. Примечательно, что многочисленные исследования показывают, что продолжительное нейроонтогенетическое воздействие ЭКМО ослабляется функциональным результатом таких пациентов (Kumar et al. (1994) Pediatrics 93:951-955; Iisselstiin et al. (2014) Semin. Perinatol., 38: 1 14-121). В настоящей работе исследования ЭЭГ выявили формы колебаний, соответствующие формам колебаний, которые наблюдались в постоянно катетеризированных ягнят в матке. Поддержание церебральной ауторегуляции вероятно позволяет достигнуть оптимальной перфузии мозга и развития в искусственной плаценте, улучшая результаты в этой совокупности с потенциально разрушительными нейроонтогенетическими осложнениями после лечения по общепринятой схеме.
Значение системы полного внематочного обеспечения жизни плода (ПВОЖП) выходит за рамки клинических инноваций и предоставляет основу для постановки фундаментальных вопросов о роли плаценты в развитии плода. Впервые было достигнуто длительное стабильное поддержание жизнедеятельности плода, отрезанного от материнской плацентарной оси, благодаря чему стало возможным изучение относительного вклада этого органа в созревание плода. Эта система может также использоваться как мост для перехода от внутриутробного к постнатальному периоду, который может применяться в моделях врожденного заболевания легких для расширения периода времени для терапевтического воздействия. Поэтому система ПВОЖП предоставляет возможность, которая не была ранее доступна в исследованиях фетальной физиологии, и представляет собой новое мощное средство для многочисленных междисциплинарных клинических исследований.
Хотя выше были описаны и проиллюстрированы конкретными примерами некоторые из предпочтительных вариантов осуществления настоящего изобретения, не предполагается, что это изобретение будет ограничено такими вариантами. В настоящее изобретение могут быть внесены изменения без отступления от его объема и сущности, как установлено в изложенной ниже формуле изобретения.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ И УСТРОЙСТВО ДЛЯ ЭКСТРАКОРПОРАЛЬНОГО ЖИЗНЕОБЕСПЕЧЕНИЯ НЕДОНОШЕННОГО ПЛОДА | 2016 |
|
RU2721192C2 |
| Способ временной экстракорпоральной перфузии конечности | 2023 |
|
RU2812597C1 |
| Устройство управления потоком крови в аппаратах сердечно-легочного обхода | 2020 |
|
RU2732312C1 |
| Способ искусственного кровообращения у реципиента сердца при его трансплантации и система для его осуществления | 2024 |
|
RU2826522C1 |
| СПОСОБ НЕПРЯМОГО ДРЕНИРОВАНИЯ ЛЕВОГО ЖЕЛУДОЧКА ПРИ ПРОТЕЗИРОВАНИИ ФУНКЦИИ СЕРДЦА МЕТОДОМ ВЕНО-АРТЕРИАЛЬНОЙ ЭКСТРАКОРПОРАЛЬНОЙ МЕМБРАННОЙ ОКСИГЕНАЦИИ (ЭКМО) | 2022 |
|
RU2782145C1 |
| СПОСОБ БИВЕНТРИКУЛЯРНОЙ МЕХАНИЧЕСКОЙ ЦИРКУЛЯТОРНОЙ ПОДДЕРЖКИ СЕРДЦА ПРИ ПРОВЕДЕНИИ ПЕРИФЕРИЧЕСКОЙ ВЕНО-АРТЕРИАЛЬНОЙ МЕМБРАННОЙ ОКСИГЕНАЦИИ | 2023 |
|
RU2822652C1 |
| Устройство и способ управления потоком крови в аппаратах сердечно-легочного обхода | 2018 |
|
RU2665180C1 |
| СПОСОБ ЭКСТРАКОРПОРАЛЬНОГО ВОССТАНОВЛЕНИЯ ПЕРФУЗИИ И ОКСИГЕНАЦИИ ВНУТРИ ТЕЛА ДОНОРА | 2017 |
|
RU2666515C2 |
| Двунаправленная артериальная канюля для экстракорпоральной мембранной оксигенации, стилет-интродьюсер и стилет удаления | 2020 |
|
RU2825107C1 |
| РАСТВОР КРОВЕЗАМЕНИТЕЛЯ НА ВОДНОЙ ОСНОВЕ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1994 |
|
RU2142282C1 |

Изобретение относится к медицинской технике. Инкубационное устройство, выполненное с возможностью поддержания плода во внематочных условиях, содержит инкубационную камеру, выполненную с возможностью удерживания объема стерильной жидкости и плода, при этом объем стерильной жидкости является достаточным для обеспечения возможности погружения плода в стерильную жидкость в инкубационной камере, причем инкубационная камера является сумкой или мешком, выполненной из инертной медицинской пластмассы или силикона. Инкубационная камера содержит входное отверстие и выходное отверстие, при этом входное отверстие выполнено с возможностью обеспечения канала для введения стерильной жидкости в инкубационную камеру, а выходное отверстие выполнено с возможностью обеспечения канала для выведения стерильной жидкости из инкубационной камеры. Безнасосный оксигенационный контур содержит оксигенатор, имеющий впускное отверстие и выпускное отверстие, и выполнен с возможностью соединения с плодом, так что он образует канал, включающий первую часть, выполненную с возможностью обеспечения артериального оттока от плода к впускному отверстию оксигенатора, и вторую часть, выполненную с возможностью обеспечения возврата потока от выпускного отверстия к плоду. Запасной резервуар выполнен с возможностью хранения запаса стерильной жидкости большего, чем объем стерильной жидкости в инкубационной камере. Сток выполнен с возможностью приема использованной жидкости из инкубационной камеры. Насос выполнен с возможностью нагнетания стерильной жидкости из указанного запасного резервуара через впускное отверстие в инкубационную камеру и через выпускное отверстие. Технический результат состоит в поддержании гомеостаза недоношенного плода в течение длительного времени и решении проблемы бактериального роста. 13 з.п. ф-лы, 11 ил., 2 табл.
1. Инкубационное устройство, выполненное с возможностью поддержания плода во внематочных условиях, содержащее:
- инкубационную камеру, выполненную с возможностью удерживания объема стерильной жидкости и плода, при этом объем стерильной жидкости является достаточным для обеспечения возможности погружения плода в стерильную жидкость в инкубационной камере, причем инкубационная камера является сумкой или мешком, выполненной из инертной медицинской пластмассы или силикона,
причем инкубационная камера содержит входное отверстие и выходное отверстие, при этом входное отверстие выполнено с возможностью обеспечения канала для введения стерильной жидкости в инкубационную камеру, а выходное отверстие выполнено с возможностью обеспечения канала для выведения стерильной жидкости из инкубационной камеры;
- безнасосный оксигенационный контур, содержащий
оксигенатор, имеющий впускное отверстие и выпускное отверстие;
при этом безнасосный оксигенационный контур выполнен с возможностью соединения с плодом, так что он образует канал, включающий:
1) первую часть, выполненную с возможностью обеспечения артериального оттока от плода к впускному отверстию оксигенатора, и
2) вторую часть, выполненную с возможностью обеспечения возврата потока от выпускного отверстия к плоду;
запасной резервуар, выполненный с возможностью хранения запаса стерильной жидкости большего, чем объем стерильной жидкости в инкубационной камере; и
сток, выполненный с возможностью приема использованной жидкости из инкубационной камеры;
насос, выполненный с возможностью нагнетания стерильной жидкости из указанного запасного резервуара через впускное отверстие в инкубационную камеру и через выпускное отверстие.
2. Инкубационное устройство по п. 1, в котором оксигенатор имеет перепад давления, меньший чем 40 мм рт.ст., при скорости кровотока 1,5 л/мин, при измерении между впускным отверстием и выпускным отверстием.
3. Инкубационное устройство по п. 1, в котором инкубационная камера удерживает объем стерильной жидкости, при этом оксигенатор расположен за пределами этого объема стерильной жидкости.
4. Инкубационное устройство по п. 1, в котором безнасосный оксигенационный контур выполнен с возможностью обеспечения потока крови при скорости около 2,0 л/мин или больше.
5. Инкубационное устройство по п. 1, в котором инкубационная камера удерживает объем стерильной жидкости и герметизирована для предотвращения загрязнения объема стерильной жидкости в инкубационной камере.
6. Инкубационное устройство по п. 1, содержащее отсасывающий механизм, выполненный с возможностью обеспечения доступа к объему стерильной жидкости для обеспечения возможности удаления отходов и инородных веществ или остатков органических веществ из объема жидкости в инкубационной камере.
7. Инкубационное устройство по п. 1, в котором инкубационная камера содержит по меньшей мере одно перчаточное отверстие для обеспечения стерильного доступа к плоду, когда он находится в объеме стерильной жидкости.
8. Инкубационное устройство по п. 1, в котором стерильная жидкость в инкубационной камере содержит синтетическую амниотическую жидкость.
9. Инкубационное устройство по п. 1, также содержащее газовый смеситель, выполненный с возможностью смешивания воздуха и кислорода с образованием продувочного газа, который связан с оксигенатором.
10. Инкубационное устройство по п. 1, в котором оксигенационный контур выполнен с возможностью обеспечения скорости перемещения газа около 150 мл/мин или больше.
11. Инкубационное устройство по п. 1, также содержащее фильтр, выполненный с возможностью фильтрации стерильной жидкости, причем обеспечена возможность нагнетания стерильной жидкости через указанный фильтр и возможность последующего нагнетания отфильтрованной стерильной жидкости в инкубационную камеру.
12. Инкубационное устройство по п. 1, в котором камера является закрытой стерильной системой с непрерывным обменом жидкости.
13. Инкубационное устройство по п. 1, содержащее фильтровальную систему, выполненную с возможностью удаления загрязнений из стерильной жидкости.
14. Инкубационное устройство по п. 13, в котором фильтровальная система содержит фильтр, выполненный с возможностью удаления инородных веществ или остатков органических веществ из стерильной жидкости, при этом фильтровальная система содержит источник ультрафиолетового излучения, выполненный с возможностью устранения бактерий из стерильной жидкости.
| УСТРОЙСТВО ДЛЯ ВЫХАЖИВАНИЯ НЕДОНОШЕННЫХ НОВОРОЖДЕННЫХ | 2008 |
|
RU2376969C1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Многоступенчатая активно-реактивная турбина | 1924 |
|
SU2013A1 |
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| Переносной станок для обрезки сучьев с растущих деревьев | 1972 |
|
SU447256A1 |
Авторы
Даты
2019-04-09—Публикация
2014-03-17—Подача