Область техники
Изобретение относится к области медицины и клинической лабораторной диагностики. Более подробно изобретение относится к способу (методу) определения уровня эндотоксина, основанному на реакции in vitro между бактериальным эндотоксином (БЭ) и ЛАЛ-реактивом в биологических жидкостях (плазме крови и моче и т.п.).
Уровень техники
Известен ряд способов (методов) определения бактериальных эндотоксинов (БЭ) в биологических жидкостях, например, по следующим патентным документам: патенту РФ RU 2325645 (МПК G01N 33/48, G01N 33/579, опубл. 27.05.2008 Бюл. №15), японскому патенту JP 4761448 (МПК G01N 33/48; G01N 33/579, опубл. 2011-08-31), японской патентной заявке JP 2003232794 (МПК G01N 33/579, опубл. 2003-08-22), китайскому патенту CN 1696636 (МПК G01N 1/28, опубл. 2005-11-16), международной РСТ-заявке WO 2009005231 (МПК G01N 33/49, G01N 33/579, опубл. 2009-01-08).
По патенту RU 2325645 СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ БАКТЕРИАЛЬНЫХ ЭНДОТОКСИНОВ С ИСПОЛЬЗОВАНИЕМ ТАЛ-ТЕСТА, В КОТОРОМ РЕГИСТРАЦИЮ ОБРАЗОВАНИЯ ПОЛИМЕРА КОАГУЛОГЕНА ПРОИЗВОДЯТ ПО СТРУКТУРЕ ОБРАЗУЮЩИХСЯ БЕЛКОВЫХ ФРАКТАЛОВ, проводят в биологических средах и лекарственных средствах. Сущность способа: смешивают тахплеус лизат (ТАЛ) и разведения исследуемого образца нанесением на апирогенную поверхность, инкубируют с закрытой крышкой в течение 30…60 мин при 37°С, выдерживают апирогенную поверхность в термостате при открытой крышке до высыхания капель смеси реагентов, регистрируют образование полимера коагулогена под увеличением по образующимся белковым фракталам и при их наличии определяют активность эндотоксина в последнем разведении.
Недостатком способа является его невысокая точность из-за субъективного визуального контроля результатов теста, в отличие от измерения оптической плотности в результате хромогенного анализа, использующегося в предлагаемом способе. Кроме того, использование ТАЛ-реагента (лизат мечехвостов вида Tachypleus tridentatus) также накладывает определенные ограничения на его применение, в связи со сложностью его приобретения на территории РФ (необходимо ждать поставок из Китая), в отличие от ЛАЛ-реактива, который широко и активно применяется повсеместно.
Способ по патенту JP 4761448 BLOOD ENDOTOXIN MEASURING METHOD направлен на количественное измерение эндотоксина в крови, которое не может быть получено обычными методами, и уточняет связь между количеством эндотоксина в крови и клиническим состоянием. В способе отделяются только эритроциты и удаляются из цельной крови, а количество эндотоксина, содержащегося в оставшейся частице крови, измеряется, тем самым корректируя эндотоксин, содержащийся в лейкоцитах и эндотоксине, содержащемся в плазме.
Недостатком способа является возможность его применения исключительно для анализа крови, в отличие от предлагаемого способа, позволяющего оценивать содержание БЭ в разных биологических жидкостях.
Способ по патентной заявке JP 2003232794 METHOD FOR MEASURING ENDOTOXIN ACTIVITY предназначен для точного и быстрого измерения активности эндотоксина методом ЛАЛ-теста (реагент Limulus Amebocyte Lysate (лимулус лизат, сокращенно ЛАЛ) с применением предварительной обработки образца, которая включает в себя стадии добавления поверхностно-активного вещества в образец с последующей ультразвуковой обработкой. Поверхностно-активное вещество представляет собой анионное вещество, его концентрация в образце составляет менее 0,01%. Измерение содержания бактериального эндотоксина проводят методом турбидиметрического ЛАЛ-теста.
Особенностью этого способа является специфичная предварительная обработка, существенно отличающаяся от обработки, используемой в предлагаемом способе.
Аналог по подготовке образцов крови для тестирования БЭ - способ по патенту CN 1696636 METHOD FOR PREPARING BLOOD FOR TESTING ENDOTOXIN OF BACTERIA включает приготовление сыворотки крови, добавление нескольких раз 0,1…0,3% qulatong (Х-100) в небольшое количество сыворотки крови, нагревание в водяной бане, обработку в ледяной бане, разбавление апирогенной водой и смешивание небольшого количества разбавленной жидкости с таким же количеством реагента лизата Tachypleus tridentatus для получения кровяного продукта, который используется для обнаружения бактериальных эндотоксинов.
Недостатком способа является сложность предварительной обработки образцов для исследования, а также узость его применения только в крови, а не в разных биологических жидкостях, как в предлагаемом способе. Кроме того, также, как и в патенте RU 2325645 в качестве реагента для определения используется лизат, выделенный из мечехвостов вида Tachypleus tridentatus, в отличие от применяемого в нашем изобретении лизата амебоцитов Limulus Polyphemus, являющегося более распространенным и легкодоступным реагентом.
Способ по РСТ-заявке WO 2009005231 METHODS FOR QUANTITATIVELY DETERMINING ENDOTOXIN (количественного определения эндотоксина в биологическом образце) включает в себя этапы: (а) получение биологического образца; (б) термическая обработка биологического образца; (в) получение реакционного раствора путем добавления ЛАЛ-реагента (реагента Limulus Amebocyte Lysate (сокращенно ЛАЛ) в инактивированный биологический образец; и (г) измерение значения оптической плотности реакционного раствора после определенного времени реакции или измерения времени, когда раствор достигает заданного значения оптической плотности. С помощью изобретения можно определять количество эндотоксина в биологическом образце более точным и удобным образом.
Основным недостатком этого способа является использование турбидиметрического ЛАЛ-теста (кинетического и по конечной точке). Такая модификация ЛАЛ-теста требует дорогостоящего и узкоспецифичного оборудования - микропланшетного ридера для регистрации изменения оптической плотности, вызванной помутнением исследуемых образцов. В отличие от этого в предлагаемом способе определение содержания БЭ происходит при помощи хромогенного ЛАЛ-теста, что позволяет использовать любой лабораторный спектрофотометр.
Раскрытие изобретения
Задачей изобретения является разработка более универсального способа, пригодного для количественного определения БЭ в разных видах биологических жидкостей, в т.ч. в плазме крови и в моче, используя метод хромогенного ЛАЛ-теста для определения БЭ со специфичной предварительной обработкой образцов из разных видов биологических жидкостей. Преимуществом хромогенного метода анализа является отсутствие необходимости использовать дорогостоящее оборудование, а также высокая чувствительность и специфичность метода.
Задача решается способом определения бактериального эндотоксина в биологических жидкостях, характеризующимся зависящей от вида биологической жидкости предварительной подготовкой образцов для последующего хромогенного ЛАЛ-теста, проведение реакции подготовленных образцов с ЛАЛ-реактивом и спектрофотометрическое определение концентрации бактериального эндотоксина в образцах после реакции с ЛАЛ-реактивом, при этом реакция образцов с ЛАЛ-реактивом включает: внесение в стерильные пробирки 100 мкл обработанных образцов биологических жидкостей, загрязненных эндотоксином, и добавление 100 мкл ЛАЛ-реактива (прим.: в реальных анализах заранее наведенные растворы с известными концентрациями БЭ используют в качестве калибровочной кривой. При анализе биологической жидкости больного, в которой необходимо определить содержание БЭ, она обрабатывается по методике, описанной в примерах осуществления способа. В результате определяется значение оптической плотности при длине волны 388 нм (этой длине волны соответствует максимум поглощения комплекса хромогенного ЛАЛ субстрата с БЭ), далее это значение сравнивается со значениями, полученными для конкретных концентраций эндотоксина, и делается вывод, сколько БЭ было в биологической жидкости больного). Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты; спектрофотометрическое определение концентрации бактериального эндотоксина в образцах включает измерение концентрации БЭ по показателю оптической плотности образца после ЛАЛ-теста на длине волны λ=388 нм. При этом в реальных анализах и моделирующих экспериментах всегда делается ЛАЛ тест на каждом образце не менее чем в 3 повторностях.
Предварительная подготовка образцов из плазмы крови включает разбавление образцов плазмы крови физиологическим раствором в 10…100 раз и последующую термическую обработку при 45…85°С в течение 30…60 мин. При этом после проведения ЛАЛ-теста в ходе спектрофотометрического определения концентрации БЭ в образцах плазмы крови при помощи термической обработки и разведения возможно определение наличия БЭ в растворе с концентрацией БЭ на границе между 0,005 ЕЭ/мл и 0,010 ЕЭ/мл и с более высокими концентрациями БЭ.
Предварительная подготовка образцов из мочи включает экстракцию мочи при помощи хлорорганического растворителя, включающего, но не ограничивающегося одним из следующих: хлористый метилен, 1,2-дихлорэтан. При этом после проведения ЛАЛ-теста в ходе спектрофотометрического определения концентрации БЭ в образцах мочи при помощи экстракции хлор-органическим растворителем возможно определение наличия БЭ в растворе с концентрацией БЭ на границе между 1,00 ЕЭ/мл и 2,00 ЕЭ/мл и с более высокими концентрациями БЭ.
Идея предлагаемого способа заключается в том, что фермент фактор С, содержащийся в лизате амебоцитов мечехвостов Limulus Amebocyte Lysate (ЛАЛ-реагент), реагирует с БЭ, что запускает каскад ферментативных реакций, приводящий к активации свертывающего фермента. Этот фермент в свою очередь гидролизует особый хромогенный субстрат с образованием окрашенного продукта. Регистрация сигнала происходит спектрофотометрически по изменению оптической плотности (т.е. по интенсивности окраски).
Преимущества предлагаемого способа от найденных аналогов следующие:
1) RU 2325645 - предлагаемый метод является более точным и позволяет количественно определять содержание бактериального эндотоксина в биологических жидкостях, благодаря применению хромогенной модификации ЛАЛ-теста в отличие от визуального контроля, использующегося авторами в данном патенте;
2) JP 761448 (В2) - преимущество предлагаемого способа в большей универсальности, так как в японском методе определяют бактериальный эндотоксин только в крови, тогда как в предлагаемом способе не только в крови и плазме крови, но и в моче, т.е. более широко применимый, универсальный способ;
3) JP 2003232794 (А) - метод, используемый авторами в данном патенте, позволяет проводить определение БЭ в специфичных условиях применения, существенно отличных от признаков предлагаемого способа.
4) CN 1696636 (A) - близкий1 аналог предварительной обработки образцов крови, включающая в себя обработку раствором тритон Х-100, нагревание-охлаждение и разбавление. Отличие от предлагаемого способа: а) другие концентрации реагента тритон Х-100; б) другие температуры охлаждения; и в предлагаемом способе это разные методики: либо нагревание и разбавление, либо обработка тритон Х-100, с последующей кислотно-щелочной обработкой образцов, тогда как в приведенном патенте все операции необходимо применять к каждому образцу (усложнение), по сравнению с предлагаемым способом требуется больше стадий по предварительные обработки крови. Кроме того, также описывается определение БЭ только в крови (сыворотке крови).
5) WO 2009005231 (А1) - по сравнению с данным методом, из преимуществ предлагаемого способа можно указать, что определение содержания БЭ происходит при помощи хромогенного ЛАЛ-теста, что позволяет использовать любой сравнительно недорогой и доступный лабораторный спектрофотометр.
Примеры осуществление изобретения Примеры 1, 2, 3 - для образцов плазмы крови, примеры 4, 5, 6 -для образцов мочи. Общими приемами для всех примеров являлись проведение реакции подготовленных образцов с ЛАЛ-реактивом и спектрофотометрическое определение концентрации бактериального эндотоксина в образцах после реакции с ЛАЛ-реактивом.
Пример 1.
1. Приготовление раствора бактериального эндотоксина
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Подготовка плазмы
Образцы крови были отцентрифугированы при 1200 g в течение 10 минут. Отделенная плазма была отобрана в стерильные пробирки 10×75 мм.
3. Загрязнение плазмы
Образцы плазмы были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5, 0,5, 0,05, 0,005, 0,0025 ЕЭ/мл.
4. Обработка образцов
А) В стерильных пробирках к 0,1 мл плазмы было добавлено 0,9 мл физиологического раствора хлорида натрия. Таким образом, кровь была разведена в 10 раз.
Б) Пробирки были термостатированы при 45°С в течение 60 минут (при термостатировании их не закрывают).
5. Проведение реакции с ЛАЛ-реактивом
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл не загрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
6. Спектрофотометрическое определение концентрации БЭ в образцах
Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
7. Результаты анализа
Пробирки с отрицательным контролем (незагрязненная плазма) после часа термсотатирования при 37°С, а также пробирки, содержащие 0,005; 0,0025 ЕЭ/мл остались прозрачными. В пробирках с содержанием бактериального эндотоксина в концентрации 5,00; 0.50. 0,05, 0,01 ЕЭ/мл раствор окрасился в желтый цвет. Оптическая плотность для каждой концентрации при λ=388 нм определялась как среднее значение из трех повторностей (таблица 1).

Таким образом, в плазме крови при помощи термической обработки и разведения возможно определение наличия БЭ в растворе с концентрацией БЭ на границе между 0,005 ЕЭ/мл и 0,010 ЕЭ/мл и с более высокими концентрациями БЭ.
Пример 2.
1. Приготовление раствора бактериального эндотоксина
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Подготовка плазмы
Образцы крови были отцентрифугированы при 1200g в течение 10 минут. Отделенная плазма была отобрана в стерильные пробирки 10×75 мм.
3. Загрязнение плазмы:
Образцы плазмы были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5, 0,5,0,05, 0,005, 0,0025 ЕЭ/мл.
4. Обработка образцов
А) В стерильных пробирках к 0,1 мл плазмы было добавлено 4,9 мл физиологического раствора хлорида натрия. Таким образом, кровь была разведена в 50 раз.
Б) Пробирки были термостатированы при 60°С в течение 30 минут.
5. Проведение реакции с ЛАЛ-реактивом
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл не загрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
6. Спектрофотометрическое определение концентрации БЭ в образцах
Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
7. Результаты анализа аналогичны результатам анализа примера 1.
Пример 3.
1. Приготовление раствора бактериального эндотоксина
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Подготовка плазмы
Образцы крови были отцентрифугированы при 1200g в течение 10 минут. Отделенная плазма была отобрана в стерильные пробирки 10×75 мм.
3. Загрязнение плазмы
Образцы плазмы были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5, 0,5, 0,05, 0,005, 0,0025 ЕЭ/мл.
4. Обработка образцов
А) В стерильных пробирках к 0,1 мл плазмы было добавлено 9,9 мл физиологического раствора хлорида натрия. Таким образом, кровь была разведена в 100 раз.
Б) Пробирки были термостатированы при 85°С в течение 60 минут.
5. Проведение реакции с ЛАЛ-реактивом
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл не загрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
6. Спектрофотометрическое определение концентрации БЭ в образцах Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
7. Результаты анализа аналогичны результатам анализа примера 1.
Пример 4.
1. Приготовление раствора бактериального эндотоксина:
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Загрязнение мочи:
Образцы мочи были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5,0; 2,0; 1,0; 0,5; 0,1; 0,05 ЕЭ/мл.
3. Обработка образцов.
А) В стерильных пробирках к 1 мл мочи было добавлено 0,25 мл хлороформа и смесь была перемешана на вибрационном встряхивателе в течение 4 часов.
Б) Содержимое пробирок было отцентрифугировано при 4000 об/мин в течение 10 минут. Средний мутный слой был отобран и использовался для проведения ЛАЛ-теста.
4. Проведение реакции с ЛАЛ-реактивом:
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл незагрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
5. Спектрофотометрическое определение концентрации БЭ в образцах Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
6. Результаты анализа
Пробирки с отрицательным контролем (незагрязненная моча) после часа термсотатирования при 37°С, а также пробирки, содержащие 0,5; 0,1; 0,05 ЕЭ/мл. остались прозрачными. В пробирках с содержанием бактериального эндотоксина в концентрации 5,0; 2,0; 1,0 ЕЭ/мл раствор окрасился в желтый цвет. Оптическая плотность для каждой концентрации при λ=388 нм определялась как среднее значение из трех повторностей (таблица 2).
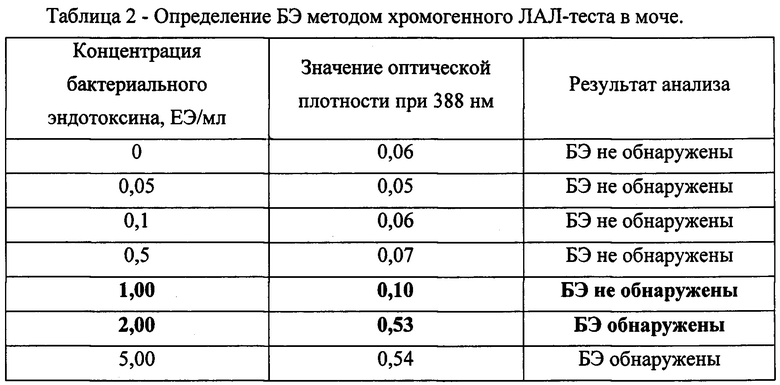
Таким образом, в моче при помощи экстракции хлор-органическим растворителем возможно определение наличия БЭ в растворе с концентрацией БЭ на границе между 1,00 ЕЭ/мл и 2,00 ЕЭ/мл и с более высокими концентрациями БЭ.
Пример 5.
1. Приготовление раствора бактериального эндотоксина:
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Загрязнение мочи:
Образцы мочи были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5,0; 2,0; 1,0; 0,5; 0,1; 0,05 ЕЭ/мл.
3. Обработка образцов.
А) В стерильных пробирках к 1 мл мочи было добавлено 0,25 мл хлористого метилена и смесь была перемешана на вибрационном встряхивателе в течение 4 часов.
Б) Содержимое пробирок было отцентрифугировано при 4000 об/мин в течение 10 минут. Средний мутный слой был отобран и использовался для проведения ЛАЛ-теста.
4. Проведение реакции с ЛАЛ-реактивом:
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл не загрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
5. Спектрофотометрическое определение концентрации БЭ в образцах Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
6. Результаты анализа аналогичны результатам анализа примера 4.
Пример 6.
1. Приготовление раствора бактериального эндотоксина:
Стандарт бактериального эндотоксина был разбавлен 3,4 мл апирогенной воды и получена концентрация 50 ЕЭ/мл.
2. Загрязнение мочи:
Образцы мочи были загрязнены раствором бактериального эндотоксина (50 ЕЭ/мл) до концентрации последнего соответственно: 5,0; 2,0; 1,0; 0,5; 0,1; 0,05 ЕЭ/мл.
3. Обработка образцов.
А) В стерильных пробирках к 1 мл мочи было добавлено 0,3 мл 1,2-дихлорэтана и смесь была перемешана на вибрационном встряхивателе в течение 4 часов.
Б) Содержимое пробирок было отцентрифугировано при 4000 об/мин в течение 10 минут Средний мутный слой был отобран и использовался для проведения ЛАЛ-теста.
4. Проведение реакции с ЛАЛ-реактивом:
В стерильные пробирки было налито 100 мкл обработанных образцов, загрязненных до определенных концентраций эндотоксина, и туда же добавлено 100 мкл ЛАЛ-реактива. Также был образец сравнения: это 100 мкл не загрязненной плазмы и 100 мкл ЛАЛ-реактива. Все концентрации и образец сравнения были приготовлены в 3 повторностях. Пробирки были термостатированы в течение 1 часа при 37°С. Для прекращения реакции в каждую пробирку было добавлено по 50 мкл 50% уксусной кислоты.
5. Спектрофотометрическое определение концентрации БЭ в образцах Концентрацию эндотоксина измеряли по показателю оптической плотности на длине волны λ=388 нм.
6. Результаты анализа аналогичны результатам анализа примера 4.
Предлагаемый способ разработан и апробирован в рамках выполнения работы по Соглашению №14.577.21.0165 между Министерством образования и науки Российской Федерации (Госзаказчик) и МГТУ им. Н.Э.Баумана.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ удаления эндотоксинов из биологических жидкостей с помощью ковалентно иммобилизованного лизоцима в качестве лиганда | 2018 |
|
RU2684639C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ БАКТЕРИАЛЬНЫХ ЭНДОТОКСИНОВ С ИСПОЛЬЗОВАНИЕМ ТАЛ-ТЕСТА, В КОТОРОМ РЕГИСТРАЦИЮ ОБРАЗОВАНИЯ ПОЛИМЕРА КОАГУЛОГЕНА ПРОИЗВОДЯТ ПО СТРУКТУРЕ ОБРАЗУЮЩИХСЯ БЕЛКОВЫХ ФРАКТАЛОВ | 2006 |
|
RU2325645C1 |
| Сорбционный материал, способ его получения и способ его применения | 2016 |
|
RU2641924C1 |
| Способ N2 получения сорбента на основе ковалентно иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736150C1 |
| Способ N1 получения сорбента на основе ковалентного иммобилизованного и химически модифицированного лизоцима для сорбции бактериальных эндотоксинов и сам сорбент | 2019 |
|
RU2736149C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЭНДОТОКСИНА (ВАРИАНТЫ) | 2000 |
|
RU2169367C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ БЕТА-N-АЦЕТИЛГЛЮКОЗАМИНИДАЗЫ STRH ИЗ STREPTOCOCCUS PNEUMONIAE | 2018 |
|
RU2693660C1 |
| СПОСОБ ПОЛУЧЕНИЯ РЕАКТИВА ДЛЯ ОПРЕДЕЛЕНИЯ БАКТЕРИАЛЬНЫХ ЭНДОТОКСИНОВ | 2006 |
|
RU2332458C2 |
| СПОСОБ ПОЛУЧЕНИЯ РЕКОМБИНАНТНОЙ НЕЙРАМИНИДАЗЫ NANH ИЗ CLOSTRIDIUM PERERINGENS | 2018 |
|
RU2698774C1 |
| Способ ковалентной иммобилизации лизоцима для последующего применения иммобилизованного лизоцима для снижения бактериальной обсемененности биологических жидкостей | 2018 |
|
RU2694883C1 |
Изобретение относится к области клинической лабораторной диагностики и представляет собой способ определения бактериального эндотоксина (БЭ) в плазме крови и моче, отличающийся тем, что предварительная подготовка образцов плазмы крови включает разбавление образцов плазмы крови физиологическим раствором в 10-100 раз и их термическую обработку при 45-85°С в течение 30-60 мин, а предварительная подготовка образцов мочи включает экстракцию мочи при помощи хлористого метилена или 1,2-дихлорэтана; после чего реакцию образцов с ЛАЛ-реактивом проводят в следующей последовательности: в стерильные пробирки наливают 100 мкл обработанных образцов, содержащих БЭ, и туда же добавляют 100 мкл ЛАЛ-реактива, пробирки термостатируют в течение 1 часа при 37°С, для прекращения реакции в каждую пробирку добавляют по 50 мкл 50%-ной уксусной кислоты, далее проводят спектрофотометрическое определение концентрации БЭ в образцах, включающее измерение концентрации БЭ по показателю оптической плотности образца после ЛАЛ-теста на длине волны λ=388 нм. Изобретение обеспечивает снижение числа ложноположительных результатов и увеличение чувствительности при определении БЭ. 2 табл., 6 пр.
Способ определения бактериального эндотоксина (БЭ) в плазме крови и моче, включающий предварительную подготовку образцов, зависящую от вида биологической жидкости, проведение реакции подготовленных образцов с ЛАЛ-реактивом и спектрофотометрическое определение концентрации БЭ в образцах после реакции с ЛАЛ-реактивом, отличающийся тем, что предварительная подготовка образцов плазмы крови включает разбавление образцов плазмы крови физиологическим раствором в 10-100 раз и их термическую обработку при 45-85°С в течение 30-60 мин, а предварительная подготовка образцов мочи включает экстракцию мочи при помощи хлористого метилена или 1,2-дихлорэтана; после чего реакцию образцов с ЛАЛ-реактивом проводят в следующей последовательности: в стерильные пробирки наливают 100 мкл обработанных образцов, содержащих БЭ, и туда же добавляют 100 мкл ЛАЛ-реактива, пробирки термостатируют в течение 1 часа при 37°С, для прекращения реакции в каждую пробирку добавляют по 50 мкл 50%-ной уксусной кислоты, далее проводят спектрофотометрическое определение концентрации БЭ в образцах, включающее измерение концентрации БЭ по показателю оптической плотности образца после ЛАЛ-теста на длине волны λ=388 нм.
| LINDSAY G.K | |||
| et al | |||
| Single-step, chromogenic limulus amebocyte lysate assay for endotoxin // Journal of clinical microbiology | |||
| Механизм для сообщения поршню рабочего цилиндра возвратно-поступательного движения | 1918 |
|
SU1989A1 |
| Прибор с двумя призмами | 1917 |
|
SU27A1 |
| Аэроплан | 1924 |
|
SU947A1 |
| LU C | |||
| еt al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Токарный резец | 1924 |
|
SU2016A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Станок для распиловки блоков мрамора, туфа и других облицовочных камней | 1949 |
|
SU88762A1 |
| LAUGERETTE F | |||
| еt al | |||
| Endotoxemia Analysis by the Limulus Amoebocyte Lysate Assay in Different Mammal Species Used in Metabolic Studies // J Anal Bioanal | |||
| Tech | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ модулирования для радиотелефона | 1921 |
|
SU251A1 |
| MARSHALL J.C | |||
| et al | |||
| Measurement of endotoxin activity in critically ill patients using whole blood neutrophil dependent chemiluminescence // Critical Care | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Трепальная машина для обработки лубовых растений | 1923 |
|
SU342A1 |
| NACHUM R | |||
| et al | |||
| Chromogenic Limulus Amoebocyte Lysate Assay for Rapid Detection of Gram-Negative Bacteriuria // Journal of clinical microbiology | |||
| Приспособление для установки двигателя в топках с получающими возвратно-поступательное перемещение колосниками | 1917 |
|
SU1985A1 |
| Выбрасывающий ячеистый аппарат для рядовых сеялок | 1922 |
|
SU21A1 |
| Прибор для измерения коэффициента мощности (cos ф) в цепях переменного тока низкой и высокой частоты | 1924 |
|
SU759A1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОДЕРЖАНИЯ БАКТЕРИАЛЬНЫХ ЭНДОТОКСИНОВ С ИСПОЛЬЗОВАНИЕМ ТАЛ-ТЕСТА, В КОТОРОМ РЕГИСТРАЦИЮ ОБРАЗОВАНИЯ ПОЛИМЕРА КОАГУЛОГЕНА ПРОИЗВОДЯТ ПО СТРУКТУРЕ ОБРАЗУЮЩИХСЯ БЕЛКОВЫХ ФРАКТАЛОВ | 2006 |
|
RU2325645C1 |
Авторы
Даты
2019-06-13—Публикация
2017-12-26—Подача