ПЕРЕКРЕСТНАЯ ССЫЛКА
Данная заявка испрашивает приоритет в соответствии с предварительной заявкой на патент США № 62/612062, поданной 29 декабря 2017, которая включена в данный документ посредством ссылки во всей полноте.
ЗАЯВЛЕНИЕ ОБ ИССЛЕДОВАНИИ, СПОНСИРУЕМОМ ФЕДЕРАЛЬНЫМ БЮДЖЕТОМ
Настоящее изобретение, раскрытое в данном документе, по меньшей мере частично было осуществлено при поддержке правительства США в рамках гранта № R35 GM118178/GM/NIGMS, выданного Национальными институтами здравоохранения (NIH). Соответственно, правительство США обладает определенными правами на настоящее изобретение.
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
Настоящая заявка содержит перечень последовательностей, который был подан в электронном виде в формате с кодировкой ASCII и включен в данный документ посредством ссылки во всей своей полноте. Копия указанного файла с кодировкой ASCII, созданная 20 декабря 2018 года, имеет название 46085-712_601_SL.txt, а ее размер составляет 116287 байтов.
ПРЕДПОСЫЛКИ СОЗДАНИЯ ИЗОБРЕТЕНИЯ
Использование способности синтезировать/амплифицировать олигонуклеотиды (ДНК или РНК), специфически по отношению к последовательности, с помощью полимераз лимитировано ограниченным химическим/физическим разнообразием, присутствующим в природном генетическом алфавите (четыре природных нуклеотида в ДНК: A, C, G и T, и четыре природных нуклеотида в РНК: A, C, G и U). Расширенный генетический алфавит, включающий неприродные нуклеиновые кислоты, увеличивает количество информации, которое может храниться в клетке, и облегчает создание полусинтетических организмов (SSO), которые используют эту увеличенное количество информации для создания новых форм продуктов экспрессии генов.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
В данном документе в определенных вариантах осуществления описаны способы, клетки, сконструированные микроорганизмы, плазмиды и наборы для повышения продуцирования молекулы нуклеиновой кислоты, которая содержит неприродный нуклеотид. Некоторые варианты осуществления, также описанные в данном документе, включают клетки, сконструированные микроорганизмы, плазмиды и способы применения, в которых используются модифицированный белок, ассоциированный с транспозицией, модифицированный белок для репарации ДНК или их комбинация для повышения продуцирования молекулы нуклеиновой кислоты, которая содержит неприродный нуклеотид.
В аспектах, раскрытых в данном документе, представлены сконструированные клетки-хозяева, содержащие: первую молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид; и необязательно вторую молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с транспозицией, или транспонируемый элемент. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит третью молекулу нуклеиновой кислоты, кодирующую модифицированный транспортер нуклеозидтрифосфата, где третья молекула нуклеиновой кислоты встроена в геномную последовательность сконструированной клетки-хозяина, или содержит плазмиду, кодирующую модифицированный транспортер нуклеозидтрифосфата. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата характеризуется повышенной стабильностью экспрессии в сконструированной клетке-хозяине по сравнению с экспрессией в эквивалентной сконструированной клетке-хозяине, которая не содержит вторую молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с транспозицией. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию всей молекулы нуклеиновой кислоты, кодирующей транспортер нуклеозидтрифосфата, N-концевое усечение, С-концевое усечение или усечение обоих концов. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата включает транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2). В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию. В некоторых вариантах осуществления делеция представляет собой концевую делецию или внутреннюю делецию. В некоторых вариантах осуществления делеция представляет собой N-концевое усечение, C-концевое усечение или усечение обоих концов. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 66 аминокислотных остатков. В некоторых вариантах осуществления PtNTT2 находится под контролем промотора, выбранного из промотора из плазмиды pSC или промотора из lac-оперона. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полипептид Cas9 или его варианты и одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его вариантов и sgRNA обеспечивает модуляцию репликации первой молекулы нуклеиновой кислоты, кодирующей неприродный нуклеотид. В некоторых вариантах осуществления sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в молекуле нуклеиновой кислоты. В некоторых вариантах осуществления sgRNA дополнительно содержит элемент распознавания мотива, прилегающего к протоспейсеру (PAM). В некоторых вариантах осуществления элемент PAM прилегает к 3'-концу целевого мотива. В некоторых вариантах осуществления длина целевого мотива составляет от 15 до 30 нуклеотидов. В некоторых вариантах осуществления комбинация полипептида Cas9 или его вариантов и sgRNA снижает скорость репликации молекулы нуклеиновой кислоты, содержащей модификацию, на приблизительно 80%, 85%, 95%, 99% или больше. В некоторых вариантах осуществления полипептид Cas9 представляет собой Cas9 дикого типа. В некоторых вариантах осуществления вторая молекула нуклеиновой кислоты содержит ген, предусматривающий ген каталазы (cat), ген белка insB-4 для IS1 (insB-4), ген белка insA-4 для IS1 (insA-4) или их комбинацию. В некоторых вариантах осуществления модифицированный белок, ассоциированный с транспозицией, предусматривает белок InsB4 для инсерционного элемента IS1, белок InsA4 для инсерционного элемента IS1 или их комбинацию; и где модифицированный транспонируемый элемент предусматривает IS1. В некоторых вариантах осуществления ген содержит одну или несколько делеций, где одна или несколько делеций предусматривают N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию всего гена. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит пятую молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, предусматривает RecA, Rad51, RadA или LexA или их комбинацию. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой прокариотическую клетку, предусматривающую клетку Escherichia coli, клетку Escherichia coli BL21 (DE3). В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из:

В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полимеразу. В некоторых вариантах осуществления полимераза экспрессируется конститутивно. В некоторых вариантах осуществления полимераза сверхэкспрессируется. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу. В некоторых вариантах осуществления ДНК-полимераза представляет собой ДНК-полимеразу II. В некоторых вариантах осуществления полимераза кодируется геном polB. В некоторых вариантах осуществления ген polB является дерепрессированным. В некоторых вариантах осуществления ген polB дерепрессируется посредством интеграции на место полусайта оператора. В некоторых вариантах осуществления оператор представляет собой оператор lexA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу I. В некоторых вариантах осуществления данная полимераза кодируется геном polA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу III. В некоторых вариантах осуществления полимераза кодируется геном dnaQ.
В аспектах, раскрытых в данном документе, представлены способы повышения продуцирования молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, предусматривающие: инкубирование сконструированной клетки-хозяина со множеством неприродных нуклеотидов, где сконструированная клетка-хозяин содержит модифицированный транспортер нуклеозидтрифосфата и необязательно модифицированный белок, ассоциированный с транспозицией, или транспонируемый элемент; и встраивание нескольких неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется молекула неприродной нуклеиновой кислоты; где модифицированный белок, ассоциированный с транспозицией, или транспонируемый элемент и модифицированный транспортер нуклеозидтрифосфата обеспечивают повышение показателя сохранения неприродных пар оснований, предусматривающих неприродные нуклеотиды, в одной или нескольких новых синтезированных нитях ДНК. В некоторых вариантах осуществления модифицированный белок, ассоциированный с транспозицией, предусматривает белок InsB4 для инсерционного элемента IS1, белок InsA4 для инсерционного элемента IS1 или их комбинацию; и где модифицированный транспонируемый элемент предусматривает IS1. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает кодон-оптимизированный транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2). В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию. В некоторых вариантах осуществления делеция представляет собой концевую делецию или внутреннюю делецию. В некоторых вариантах осуществления делеция представляет собой N-концевое усечение, C-концевое усечение или усечение обоих концов. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 66 аминокислотных остатков. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полипептид Cas9 или его варианты и одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его вариантов и sgRNA обеспечивает модуляцию репликации первой молекулы нуклеиновой кислоты, кодирующей неприродный нуклеотид. В некоторых вариантах осуществления sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в молекуле нуклеиновой кислоты. В некоторых вариантах осуществления sgRNA дополнительно содержит элемент распознавания мотива, прилегающего к протоспейсеру (PAM). В некоторых вариантах осуществления элемент PAM прилегает к 3'-концу целевого мотива. В некоторых вариантах осуществления длина целевого мотива составляет от 15 до 30 нуклеотидов. В некоторых вариантах осуществления комбинация полипептида Cas9 или его вариантов и sgRNA снижает скорость репликации молекулы нуклеиновой кислоты, содержащей модификацию, на приблизительно 80%, 85%, 95%, 99% или больше. В некоторых вариантах осуществления полипептид Cas9 представляет собой Cas9 дикого типа. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из:
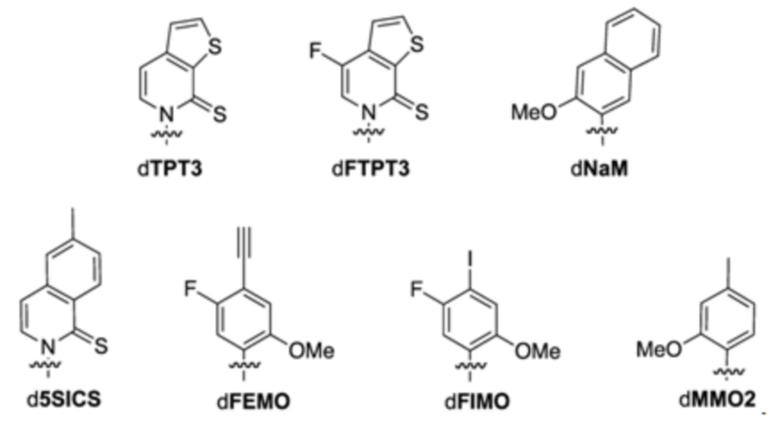
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полимеразу. В некоторых вариантах осуществления полимераза экспрессируется конститутивно. В некоторых вариантах осуществления полимераза сверхэкспрессируется. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу. В некоторых вариантах осуществления ДНК-полимераза представляет собой ДНК-полимеразу II. В некоторых вариантах осуществления полимераза кодируется геном polB. В некоторых вариантах осуществления ген polB является дерепрессированным. В некоторых вариантах осуществления ген polB дерепрессируется посредством интеграции на место полусайта оператора. В некоторых вариантах осуществления оператор представляет собой оператор lexA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу I. В некоторых вариантах осуществления данная полимераза кодируется геном polA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу III. В некоторых вариантах осуществления полимераза кодируется геном dnaQ.
В аспектах, раскрытых в данном документе, представлены способы получения модифицированного полипептида, содержащего неприродную аминокислоту, предусматривающие: инкубирование сконструированной клетки-хозяина со множеством неприродных нуклеотид, где сконструированная клетка-хозяин содержит модифицированный транспортер нуклеозидтрифосфата и необязательно модифицированный белок, ассоциированный с транспозицией, или транспонируемый элемент; и встраивание нескольких неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется молекула неприродной нуклеиновой кислоты; где модифицированный белок, ассоциированный с транспозицией, или транспонируемый элемент и модифицированный транспортер нуклеозидтрифосфата обеспечивают повышение показателя сохранения неприродных пар оснований, что способствует встраиванию нескольких неприродных нуклеотидов в новый синтезированный полипептид с получением модифицированного полипептида. В некоторых вариантах осуществления модифицированный белок, ассоциированный с транспозицией, предусматривает белок InsB4 для инсерционного элемента IS1, белок InsA4 для инсерционного элемента IS1 или их комбинацию; и где модифицированный транспонируемый элемент предусматривает IS1. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает кодон-оптимизированный транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2). В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию. В некоторых вариантах осуществления делеция представляет собой концевую делецию или внутреннюю делецию. В некоторых вариантах осуществления делеция представляет собой N-концевое усечение, C-концевое усечение или усечение обоих концов. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 66 аминокислотных остатков. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полипептид Cas9 или его варианты и одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его вариантов и sgRNA обеспечивает модуляцию репликации первой молекулы нуклеиновой кислоты, кодирующей неприродный нуклеотид. В некоторых вариантах осуществления sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в молекуле нуклеиновой кислоты. В некоторых вариантах осуществления sgRNA дополнительно содержит элемент распознавания мотива, прилегающего к протоспейсеру (PAM). В некоторых вариантах осуществления элемент PAM прилегает к 3'-концу целевого мотива. В некоторых вариантах осуществления длина целевого мотива составляет от 15 до 30 нуклеотидов. В некоторых вариантах осуществления комбинация полипептида Cas9 или его вариантов и sgRNA снижает скорость репликации молекулы нуклеиновой кислоты, содержащей модификацию, на приблизительно 80%, 85%, 95%, 99% или больше. В некоторых вариантах осуществления полипептид Cas9 представляет собой Cas9 дикого типа. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из:

В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент, выбранный из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полимеразу. В некоторых вариантах осуществления полимераза экспрессируется конститутивно. В некоторых вариантах осуществления полимераза сверхэкспрессируется. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу. В некоторых вариантах осуществления ДНК-полимераза представляет собой ДНК-полимеразу II. В некоторых вариантах осуществления полимераза кодируется геном polB. В некоторых вариантах осуществления ген polB является дерепрессированным. В некоторых вариантах осуществления ген polB дерепрессируется посредством интеграции на место полусайта оператора. В некоторых вариантах осуществления оператор представляет собой оператор lexA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу I. В некоторых вариантах осуществления данная полимераза кодируется геном polA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу III. В некоторых вариантах осуществления полимераза кодируется геном dnaQ.
В аспектах, раскрытых в данном документе, представлены сконструированные клетки-хозяева для продуцирования неприродного продукта, содержащего модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой прокариотическую клетку, эукариотическую клетку или дрожжевую клетку. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой прокариотическую клетку. В некоторых вариантах осуществления прокариотическая клетка представляет собой клетку Escherichia coli. В некоторых вариантах осуществления клетка Escherichia coli представляет собой клетку Escherichia coli BL21 (DE3). В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления сконструированная клетка-хозяин сконструирована для экспрессии гена, кодирующего RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления сконструированная клетка-хозяин сконструирована для экспрессии гена, кодирующего Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полимеразу. В некоторых вариантах осуществления полимераза экспрессируется конститутивно. В некоторых вариантах осуществления полимераза сверхэкспрессируется. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу. В некоторых вариантах осуществления ДНК-полимераза представляет собой ДНК-полимеразу II. В некоторых вариантах осуществления полимераза кодируется геном polB. В некоторых вариантах осуществления ген polB является дерепрессированным. В некоторых вариантах осуществления ген polB дерепрессируется посредством интеграции на место полусайта оператора. В некоторых вариантах осуществления оператор представляет собой оператор lexA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу I. В некоторых вариантах осуществления данная полимераза кодируется геном polA. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу III. В некоторых вариантах осуществления полимераза кодируется геном dnaQ.
В аспектах, раскрытых в данном документе, представлены сконструированные клетки-хозяева для получения неприродного продукта, содержащего модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, и полимеразу, где полимераза характеризуется повышенным уровнем экспрессии по сравнению с эквивалентной клеткой-хозяином, содержащей эквивалентную полимеразу с базальным уровнем экспрессии. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления полимераза экспрессируется конститутивно. В некоторых вариантах осуществления полимераза представляет собой ДНК-полимеразу II. В некоторых вариантах ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой прокариотическую клетку, эукариотическую клетку или дрожжевую клетку. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой прокариотическую клетку. В некоторых вариантах осуществления прокариотическая клетка представляет собой клетку Escherichia coli. В некоторых вариантах осуществления клетка Escherichia coli представляет собой клетку Escherichia coli BL21 (DE3). В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий дефектный белок, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2). В некоторых вариантах осуществления транспортер нуклеозидтрифосфата из PtNTT2 является модифицированным. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата кодируется молекулой нуклеиновой кислоты. В некоторых вариантах осуществления молекула нуклеиновой кислоты, кодирующая модифицированный транспортер нуклеозидтрифосфата, встроена в геномную последовательность сконструированной клетки-хозяина. В некоторых вариантах осуществления сконструированная клетка-хозяин содержит плазмиду, содержащую молекулу нуклеиновой кислоты, кодирующую модифицированный транспортер нуклеозидтрифосфата. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата является кодон-оптимизированным транспортером нуклеозидтрифосфата из Phaeodactylum tricornutum . В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию. В некоторых вариантах осуществления делеция представляет собой концевую делецию или внутреннюю делецию. В некоторых вариантах осуществления делеция представляет собой N-концевое усечение, C-концевое усечение или усечение обоих концов. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 5, 10, 15, 20, 22, 25, 30, 40, 44, 50, 60, 66, 70 или больше аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата на N-конце предусматривает делецию, составляющую приблизительно 66 аминокислотных остатков. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата находится под контролем промотора, выбранного из промотора из плазмиды pSC или промотора из lac-оперона. В некоторых вариантах осуществления lac-оперон представляет собой lac-оперон E. coli. В некоторых вариантах осуществления lac-оперон выбран из Pbla, Plac, PlacUV5, PH207, Pλ, Ptac или PN25. В некоторых вариантах осуществления модифицированный транспортер нуклеозидтрифосфата находится под контролем промотора PlacUV5. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит полипептид Cas9 или его варианты и одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его вариантов и sgRNA обеспечивает модуляцию репликации молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид. В некоторых вариантах осуществления sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в молекуле нуклеиновой кислоты. В некоторых вариантах осуществления sgRNA дополнительно содержит элемент распознавания мотива, прилегающего к протоспейсеру (PAM). В некоторых вариантах осуществления элемент PAM прилегает к 3'-концу целевого мотива. В некоторых вариантах осуществления длина целевого мотива составляет от 15 до 30 нуклеотидов. В некоторых вариантах осуществления комбинация полипептида Cas9 или его вариантов и sgRNA снижает скорость репликации молекулы нуклеиновой кислоты, содержащей модификацию, на приблизительно 80%, 85%, 95%, 99% или больше. В некоторых вариантах осуществления полипептид Cas9 представляет собой Cas9 дикого типа. В некоторых вариантах осуществления сконструированная клетка-хозяин дополнительно содержит неприродный нуклеотид. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
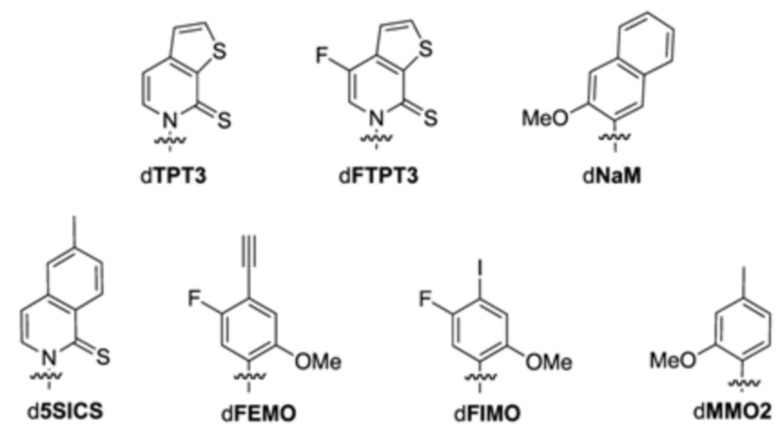 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 . В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше по сравнению с эквивалентной сконструированной клетки-хозяина при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, или при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, в комбинации со сверхэкспрессируемой полимеразой. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на по меньшей мере 50% после более чем 50, более чем 100, более чем 120, более чем 130, более чем 150 или более чем 200 поколений. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на по меньшей мере 55% после более чем 50, более чем 100, более чем 120, более чем 130, более чем 137, более чем 150 или более чем 200 поколений. В некоторых вариантах осуществления неприродный продукт представляет собой молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид. В некоторых вариантах осуществления неприродный продукт представляет собой полипептид, содержащий неприродную аминокислоту. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой полусинтетический организм.
. В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на приблизительно 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или больше по сравнению с эквивалентной сконструированной клетки-хозяина при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, или при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, в комбинации со сверхэкспрессируемой полимеразой. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на по меньшей мере 50% после более чем 50, более чем 100, более чем 120, более чем 130, более чем 150 или более чем 200 поколений. В некоторых вариантах осуществления сконструированная клетка-хозяин обеспечивает сохранение неприродных пар оснований на по меньшей мере 55% после более чем 50, более чем 100, более чем 120, более чем 130, более чем 137, более чем 150 или более чем 200 поколений. В некоторых вариантах осуществления неприродный продукт представляет собой молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид. В некоторых вариантах осуществления неприродный продукт представляет собой полипептид, содержащий неприродную аминокислоту. В некоторых вариантах осуществления сконструированная клетка-хозяин представляет собой полусинтетический организм.
В аспектах, раскрытых в данном документе, представлены молекулы нуклеиновой кислоты, содержащие неприродный нуклеотид, продуцируемый сконструированной клеткой-хозяином, описанной в данном документе.
В аспектах, раскрытых в данном документе, представлен полипептид, содержащий одну или несколько неприродных аминокислот, продуцируемый сконструированной клеткой-хозяином, описанной в данном документе.
В аспектах, раскрытых в данном документе, представлены способы повышения точности репликации молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, предусматривающие: (a) инкубирование сконструированной клетки-хозяина, описанной в данном документе, со множеством неприродных нуклеотидов и (b) встраивание множества неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется молекула неприродной нуклеиновой кислоты; где модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемая полимераза повышают точность репликации неприродных пар оснований, в том числе неприродных нуклеотидов, в одной или нескольких новых синтезированных нитях ДНК. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления продуцирование молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышено по сравнению с продуцированием молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты на по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 99% превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты в более чем 1 раз, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 15 раз, 20 раз, 25 раз, 30 раз, 40 раз, 50 раз, 100 раз или выше превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты в 1-5 раз, 5-10 раз, 10-15 раз, 15-20 раз, 20-25 раз, 25-30 раз, 30-40 раз, 40-50 раз, 50-60 раз, 60-70 раз, 70-80 раз, 80-90 раз, 90-100 раз или 100-200 раз превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
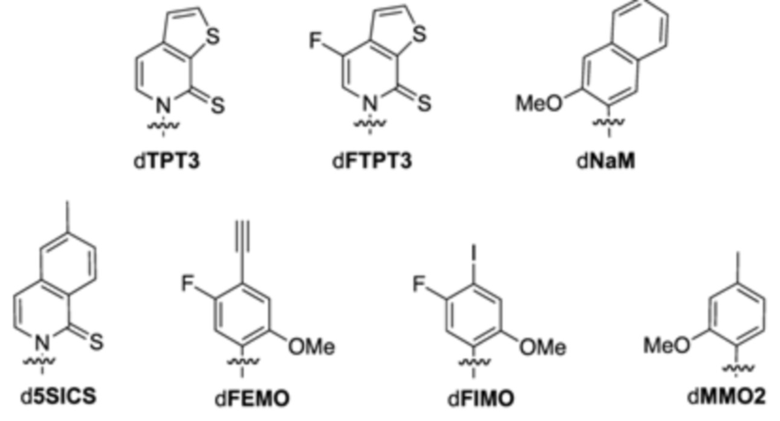 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A.
В аспектах, раскрытых в данном документе, представлены способы повышения продуцирования молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, предусматривающие: (a) инкубирование сконструированной клетки-хозяина, описанной в данном документе, со множеством неприродных нуклеотидов и (b) встраивание множества неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется молекула неприродной нуклеиновой кислоты; где модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемая полимераза повышают показатель сохранения неприродных пар оснований, предусматривающих неприродные нуклеотиды, в одной или нескольких новых синтезированных нитях ДНК. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления продуцирование молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышено по сравнению с продуцированием молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты на по меньшей мере 5%, 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90% или 99% превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты в более чем 1 раз, 2 раза, 3 раза, 4 раза, 5 раз, 10 раз, 15 раз, 20 раз, 25 раз, 30 раз, 40 раз, 50 раз, 100 раз или выше превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления повышенное продуцирование молекулы нуклеиновой кислоты в 1-5 раз, 5-10 раз, 10-15 раз, 15-20 раз, 20-25 раз, 25-30 раз, 30-40 раз, 40-50 раз, 50-60 раз, 60-70 раз, 70-80 раз, 80-90 раз, 90-100 раз или 100-200 раз превышает продуцирование молекулы нуклеиновой кислоты в эквивалентной клетке-хозяине при отсутствии модифицированного белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемой полимеразы. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
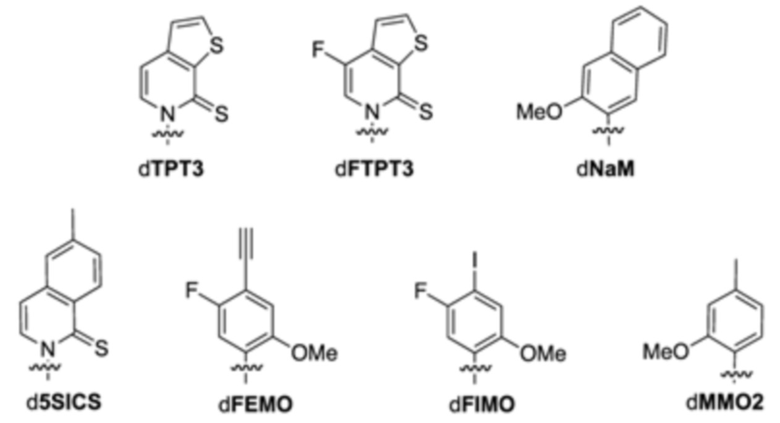 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A.
В аспектах, раскрытых в данном документе, представлены способы получения модифицированного полипептида, содержащего неприродную аминокислоту, предусматривающие: (a) инкубирование сконструированной клетки-хозяина, описанной в данном документе, со множеством неприродных аминокислот и (b) встраивание множества неприродных аминокислот в новый синтезированный полипептид, за счет чего образуется модифицированный полипептид; где модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемая полимераза повышают показатель сохранения неприродных пар оснований, что способствует встраиванию множества неприродных аминокислот в новый синтезированный полипептид с получением модифицированного полипептида. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления модифицированный полипептид дополнительно конъюгируют с конъюгирующим фрагментом с получением модифицированного полипептидного конъюгата. В некоторых вариантах осуществления конъюгирующий фрагмент представляет собой белок или его связывающий фрагмент, полимер, терапевтическое средство, средство для визуализации или их комбинацию. В некоторых вариантах осуществления модифицированный полипептид дополнительно конъюгирован с терапевтическим средством. В некоторых вариантах осуществления модифицированный полипептид представляет собой средство для визуализации. В некоторых вариантах осуществления модифицированный полипептидный конъюгат дополнительно составляют с фармацевтическим вспомогательным средством с получением фармацевтической композиции. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
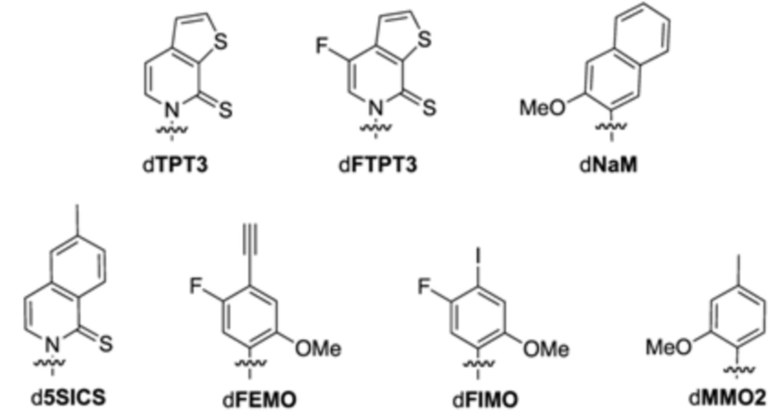 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 . В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A.
. В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RecA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой Rad51. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой RadA. В некоторых вариантах осуществления модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, представляет собой LexA. В некоторых вариантах осуществления ген, кодирующий модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA, rad51, и/или radA содержат одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления каждый из recA, rad51 и radA независимо содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347. В некоторых вариантах осуществления lexA содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления lexA содержит мутацию в положении аминокислоты S119, необязательно мутацию S119A.
В аспектах, раскрытых в данном документе, представлены способы лечения заболевания или состояния, предусматривающие введение нуждающемуся в этом субъекту фармацевтической композиции, содержащей модифицированный полипептид, полученный с помощью способов, раскрытых в данном документе, за счет чего обеспечивается лечение заболевания или состояния.
В аспектах, раскрытых в данном документе, представлены наборы, содержащие сконструированные клетки-хозяева, описанные в данном документе.
В аспектах, раскрытых в данном документе, представлены сконструированные клетки-хозяева для продуцирования неприродного продукта, содержащего модифицированный RecA. В некоторых вариантах осуществления ген, кодирующий модифицированный RecA, содержит одну или несколько мутаций, одну или несколько делеций или их комбинацию. В некоторых вариантах осуществления ген содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит N-концевую делецию, C-концевую делецию, усечение на обоих концах или внутреннюю делецию. В некоторых вариантах осуществления recA содержит внутреннюю делецию остатков 2-347.
В аспектах, раскрытых в данном документе, представлены сконструированные клетки-хозяева для получения неприродного продукта, содержащего модифицированный RecA и сверхэкспрессируемую ДНК-полимеразу II, где уровень экспрессии сверхэкспрессируемой ДНК-полимеразы II определяют по сравнению с эквивалентной клеткой-хозяином, содержащей эквивалентную ДНК-полимеразу II с базальным уровнем экспрессии.
В аспектах, раскрытых в данном документе, представлены способы повышения продуцирования молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, предусматривающие: (a) инкубирование сконструированной клетки-хозяина со множеством неприродных нуклеотидов, где сконструированная клетка-хозяин содержит модифицированный RecA и необязательно сверхэкспрессируемую ДНК-полимеразу II, и где уровень экспрессии сверхэкспрессируемой ДНК-полимеразы II определяют по сравнению с эквивалентной клеткой-хозяином, содержащей эквивалентную ДНК-полимеразу II с базальным уровнем экспрессии и (b) встраивание множества неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется неприродная молекула нуклеиновой кислоты; где модифицированный белок, ассоциированный с транспозицией, и необязательно сверхэкспрессируемая полимераза повышают показатель сохранения неприродных пар оснований, предусматривающих неприродные нуклеотиды, в одной или нескольких новых синтезированных нитях ДНК.
В аспектах, раскрытых в данном документе, представлены способы получения модифицированного полипептида, содержащего неприродную аминокислоту, предусматривающие: (a) инкубирование сконструированной клетки-хозяина со множеством неприродных аминокислот, где сконструированная клетка-хозяин содержит модифицированный RecA и необязательно сверхэкспрессируемую ДНК-полимеразу II, и где уровень экспрессии сверхэкспрессируемой ДНК-полимеразы II определяют в сравнении с эквивалентной клеткой-хозяином, содержащей эквивалентную ДНК-полимеразу II с базальным уровнем экспрессии; и (b) встраивание множества неприродных аминокислот в новый синтезированный полипептид, за счет чего образуется модифицированный полипептид; где модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, и необязательно сверхэкспрессируемая полимераза повышают показатель сохранения неприродных пар оснований, что способствует встраиванию множества неприродных аминокислот в новый синтезированный полипептид с получением модифицированного полипептида. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой рекомбинационную репарацию. В некоторых вариантах осуществления ответ, представляющий собой репарацию ДНК, представляет собой SOS-ответ. В некоторых вариантах осуществления неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила и 5-фторурацила, 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом.
В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 .
.
В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный сахарный фрагмент. В некоторых вариантах осуществления неприродный сахарный фрагмент выбран из группы, состоящей из предусматривающего модификацию в 2'-положении: OH; замещенный низший алкил, алкарил, аралкил, O-алкарил или O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2F; O-алкил, S-алкил, N-алкил; О-алкенил, S-алкенил, N-алкенил; O-алкинил, S-алкинил, N-алкинил; O-алкил-O-алкил, 2'-F, 2'-OCH3, 2'-O(CH2)2OCH3, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил, C2-С10алкенил, C2-С10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m составляют от 1 до приблизительно 10; и/или модификацию в 5'-положении: 5'-винил, 5'-метил (R или S), модификацию в 4'-положении, 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и любую их комбинацию. В некоторых вариантах осуществления неприродное основание выбрано из группы, состоящей из
 . В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB.
. В некоторых вариантах осуществления неприродный нуклеотид дополнительно содержит неприродный остов. В некоторых вариантах осуществления неприродный остов выбран из группы, состоящей из фосфоротиоата, хирального фосфоротиоата, фосфородитиоата, сложного фосфотриэфира, сложного аминоалкилфосфотриэфира, C1-С10фосфонатов, 3'-алкиленфосфоната, хиральных фосфонатов, фосфинатов, фосфорамидатов, 3'-аминофосфорамидата, аминоалкилфосфорамидатов, тионофосфорамидатов, тионоалкилфосфонатов, сложных тионоалкилфосфотриэфиров и боранофосфатов. В некоторых вариантах осуществления неприродный нуклеотид представляет собой dNaMTP и/или dTPT3TP. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в геном сконструированной клетки-хозяина. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в хромосому. В некоторых вариантах осуществления неприродный нуклеотид интегрирован в локус arsB.
КРАТКОЕ ОПИСАНИЕ ГРАФИЧЕСКИХ МАТЕРИАЛОВ
Различные аспекты настоящего изобретения подробно изложены в прилагаемой формуле изобретения. Лучшее понимание признаков и преимуществ настоящего изобретения будет достигнуто со ссылкой на следующее подробное описание, в котором изложены иллюстративные варианты осуществления, в которых используются принципы настоящего изобретения, и прилагаемые графические материалы, в которых:
на фиг. 1A - фиг. 1E показаны неприродные пары оснований (UBP) и вклад сигнальных путей, связанных с переносимостью и повреждением ДНК, в их сохранение. На фиг. 1А показана UBP dNaM-dTPT3 и природная пара оснований dG-dC. На фиг. 1В показаны штаммы, дефектные по NER (ΔuvrC), MMR (ΔmutH) или RER (ΔrecA). На фиг. 1С показаны штаммы, дефектные по RER и SOS (ΔrecA), и штаммы, дефектные только по SOS (lexA (S119A)). На фигуре 1D показаны штаммы, дефектные по SOS-регулируемым полимеразам Pol II (ΔpolB), или Pol IV и Pol V (ΔdinBΔumuCD), или RER и SOS (ΔrecA). На фиг. 1E показаны штаммы с Pol Iexo- (polA(D424A, K890R)) или Pol IIIexo- (dnaQ(D12N)) на фоне дикого типа ΔpolB или ΔpolBΔrecA. В каждом случае указанные штаммы подвергали инфицированию с использованием реплицирующейся плазмиды с UBP, встроенной в указанную последовательность (X=dNaM). n ≥ 3 для всех показанных данных; точки представляют отдельные копии; столбцы представляют среднее значение выборки; планки погрешностей представляют S.D.
На фиг. 2A - фиг. 2C показаны результаты перепрограммирования реплисомы в отношении оптимизированного показателя сохранения UBP. На фиг. 2A показан данный показатель сохранения UBP в отдельных клонах WT-Opt (умеренно-серый цвет), ΔrecA-Opt (темно-серый цвет) и Pol II+ΔrecA-Opt (светло-серый цвет) после отбора на твердых ростовых средах. Каждый штамм подвергали инфицированию с использованием реплицирующихся pINF-переносимых UBP в контекстах последовательности различной сложности (GTAXAGA<TCCXCGT<TCCXGGT). Каждая точка представляет и отдельный клон, и n ≥ 12 для каждого распределения. На фиг. 2B показаны кривые роста хромосомных UBP-интегрантов клеток WT-Opt (умеренно-серый цвет), ΔrecA-Opt (темно-серый цвет) и Pol II+ΔrecA-Opt (светло-серый цвет) в ходе экспоненциальной фазы роста в средах с присутствием (круги/сплошные линии) и без присутствия (квадраты/пунктирные линии) dNaMTP и dTPT3TP. Данные приведены в соответствие с теоретическими экспоненциальными кривыми роста. n=3; маленькие точки представляют отдельные репликаты; большие точки представляют средние значения выборки; планки погрешностей для времени и OD600 представляют S.D. На фиг. 2C показано, что показатель сохранения хромосомной UBP dNaM-dTPT3 в клетках WT-Opt (умеренно-серый цвет), ΔrecA-Opt (темно-серый цвет) и Pol II+ΔrecA-Opt (светло-серый цвет) измеряли в течение длительного роста. n=3; маленькие точки представляют отдельные репликаты; большие точки представляют средние значения выборки; планки погрешностей представляют два S.D. как для удвоения клеток, так и для сохранения, за исключением данных для Pol II+ΔrecA-Opt. После примерно семидесяти удвоений один репликат штамма Pol II+ΔrecA-Opt был контаминирован клетками WT-Opt. Поэтому данные под черной стрелкой и после представляют собой среднее значение только для двух независимых экспериментов для Pol II+ΔrecA-Opt.
На фиг. 3 показана повышенная активность PtNTT2 на протяжении длительного роста (10 пассажей) у штаммов с нокаутом по IS1 по сравнению со штаммом YZ3, который сконструировали для конститутивной экспрессии модифицированного гена транспортера нуклеотидов PtNTT2 из хромосомного локуса lacZYA.
На фиг. 4A - фиг. 4C проиллюстрированы конструкции для экспрессии PtNTT2. Показаны конструкции для экспрессии PtNTT2(66-575). На фиг. 4A показано, что для получения всех данных, представленных на фигуре 1, за исключением штаммов Pol IIIExo- , использовали pACS2. На фиг. 4B показано, что для получения данных о штамме Pol IIIexo- использовали pACS2+dnaQ(D12N). На фиг. 4C показано, что для получения всех данных на фигуре 3 использовали хромосомную экспрессию из локуса lacZYA.
На фиг. 5 показаны данные репликации дефектных по экзонуклеазной активности полимераз, реплицирующих TCAXAGT pINF, для штаммов с полимеразами, дефектными по экзонуклеазной активности. Те же штаммы из фигуры 1E также тестировали в отношении их способности реплицировать TCAXAGT (X=dNaM). N> ≥ 3 для всех показанных данных; планки погрешностей представляют 95% доверительные интервалы, определенные методом эмпирического бутстрэпа.
На фиг. 6А - фиг. 6B показана конструкция polA (D424A, K890R), P_polB. Показаны стратегии конструирования polA (D424A, K890R) и дерепрессированного PpolB. На фиг. 6A показано, что polA был усечен до его 5'′--‐3'′ экзонуклеазного домена (соответствует PolA (1-341)). Затем осуществили введение требуемой мутации D424A. Мутацию K890R осуществляли с помощью ПЦР, и прогнозировали, что она оказывала ограниченное воздействие на функцию Pol I. На фиг. 6B показано, что PpolB был дерепрессирован (PPol II+) посредством интеграции на место одного из полусайтов оператора lexA (выделены жирным), присутствующих выше -35 последовательности промотора.
На фиг. 7A - фиг. 7C показана хромосомная интеграция UBP. На фиг. 7A показана стратегия конструирования интеграционной кассеты arsB::UBP. Интеграционную кассету сконструировали посредством ПЦР с перекрывающимися праймерами короткой ДНК, содержащей UBP, и кассеты neo плазмиды pKD13. На фиг. 7B показана успешная интеграция хромосомной UBP, подтвержденная с помощью ПЦР и ПЦР со смещением меченных биотином фрагментов. Показано подтверждение интегрантов ΔrecA-Opt и Pol II+ΔrecA-Opt SSO (соответственно, A2 и B3). Бирюзовые полосы указывают на передержку. На фиг. 7C показано, что при пересеве исходных интегрантов и выделении отдельных клонов быстро идентифицировали клоны со 100% показателем сохранением ΔrecA-Opt и Pol II+ΔrecA-Opt (соответственно, A2.1 и B3.1). Эта же процедура для интегранта WT-Opt (C1) не показала аналогичного результата. Показана репрезентативная субпопуляция пересеянных клонов. Красные полосы указывают на передержку. На панелях B и C идентификаторы наборов праймеров, использованных для получения результатов в каждом геле, приведены над каждым гелем. Молекулярные массы приведены рядом со стандартами размера в количестве пар оснований. Соответствующие значения % сдвига приведены под дорожками, а соединения стрептавидин-ДНК и ДНК обозначены соответственно черными и красными стрелками.
На фиг. 8A - фиг. 8B показаны характеристики перепрограммированных штаммов и времени удвоения для хромосомных интегрантов. На фиг. 8A показаны кривые роста для перепрограммированных штаммов без хромосомной UBP (WT-Opt (красным цветом), ΔrecA-Opt (синим цветом) и Pol II+ΔrecA-Opt (золотистым цветом)) и BL21(DE3) дикого типа с устойчивостью к хлорамфениколу (lacZYA::cat (черным цветом)). Кругами/сплошными линиями представлен рост в средах с dNaMTP и dTPT3TP. Квадратами/пунктирными линиями представлен рост в средах без dNaMTP и dTPT3TP. На фиг. 8B показаны средние измеренные показатели времени удвоения (n=3) для всех штаммов с хромосомной UBP и без нее, с добавлением и без добавления dXTP. На фиг. 6B раскрыты SEQ ID NO 28 и 29 соответственно в порядке появления.
На фиг. 9A - фиг. 9B показано контаминирование хромосомной UBP Pol II+ΔrecA-Opt клетками WT-Opt. Репликат 3 интегранта Pol II+ΔrecA-Opt был контаминирован клетками WT-Opt при пассаже 13. На фиг. 9A показано, что локус PpolB контролировали с помощью ПЦР образцов gDNA, полученных при пассаже репликата 3 интегранта Pol II+ΔrecA-Opt. Штаммы с мутацией PPol II+ продуцируют более крупный ампликон, чем BL21(DE3) дикого типа с устойчивостью к хлорамфениколу (lacZYA::cat) (a), что по результатам анализа Pol II+ΔrecA-Opt до интеграции UBP (b). На фиг. 9B показано, что локус recA контролировали с помощью ПЦР образцов gDNA, полученных при пассаже репликата 3 интегранта Pol II+ΔrecA-Opt. Штаммы с мутацией ΔrecA продуцируют ампликон меньшего размера, чем BL21(DE3) дикого типа с устойчивостью к хлорамфениколу (lacZYA::cat) (a), что видно из результатов анализа Pol II+ΔrecA-Opt до интеграции UBP (b).
На фиг. 10А - фиг. 10В показана мутация PtNTT2(66-575) хромосомных интегрантов UBP WT-Opt в ходе пассажирования. Изображена мутация PtNTT2(66-575) в ходе пассажирования WT-Opt и ее характеристика. На фиг. 10А показано, что в ходе пассажирования мутанты WT-Opt возникали тогда, когда участок между cat и IS1 (верхняя панель) был усечен до С-конца PtNTT2(66-575) и IS1 (средняя панель). Секвенирование подтвердило эту транспозицию (нижняя панель). На фиг. 10A раскрыты SEQ ID NO 30-32 соответственно в порядке появления. На фиг. 10В показана инактивация PtNTT2(66-575) транспозоном IS1, что контролировали с помощью ПЦР gDNA, полученной при пассажировании WT-Opt (см. таблицу S1 для праймеров). События транспозиции инактивируют PtNTT2(66-575) и имеют размер в диапазоне ~3000-4000 п.о. Инактивация происходит в ходе быстрой фазы потери UBP. Дополнительный ампликон (размером примерно 1500 п. о.) также получают при использовании данных праймеров в BL21(DE3) дикого типа с устойчивостью к хлорамфениколу (lacZYA::cat) (a), WT-Opt до интеграции UBP (b) и BL21(DE3) дикого типа (с).
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Разработка неприродной пары оснований (UBP), позволяющая клеткам хранить и извлекать увеличенное количество информации, оказывает глубокое влияние на практические применения, в том числе в сфере здравоохранения, за счет облегчения продуцирования белков, содержащих неприродные аминокислоты, с целью их дальнейшей разработки в качестве терапевтических средств. Однако сохранение UBP в популяции клеток зависит от последовательности, а в некоторых последовательностях UBP поддерживается на недостаточном или пониженном как для практических применений (например, для экспрессии белка) уровне, что ограничивает количество кодонов, доступных для использования.
Хотя потеря UBP в ходе длительного роста может быть уменьшена путем применения давления отбора в отношении поглощения трифосфата и сохранения UBP посредством экспрессии Cas9, направленной на расщепление, и, таким образом, на деградацию последовательностей ДНК, которые утратили UBP, сохранение остается проблематичным в некоторых контекстах последовательностей. Кроме того, данный подход требует оптимизации разных направляющих РНК для каждой последовательности, подлежащей сохранению, что является проблематичным для многих применений, например тех, которые включают размножение случайных последовательностей ДНК. Кроме того, ожидалось, что кодирование информации с помощью UBP в хромосоме в противоположность плазмиде несовместимо с применением этого давления отбора из-за нежелательного расщепления UBP-содержащих последовательностей и/или из-за того, что расщепление приведет к разрушению хромосомы в противоположность менее значимому устранению одной из многих копий плазмиды.
В настоящем описании в некоторых вариантах осуществления раскрыты способы, композиции, клетки, сконструированные микроорганизмы, плазмиды и наборы для повышенного сохранения UBP с использованием модифицированных белков, ассоциированных с репарацией ДНК, например белков, вовлеченных в рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований и/или модифицированных белков, ассоциированных с транспозицией, например, белка InsB4 для инсерционного элемента IS1, белка InsA4 для инсерционного элемента IS1. В некоторых случаях конститутивная экспрессия или сверхэкспрессия белков, ассоциированных с репарацией ДНК, и/или делеция или сниженная экспрессия белков, ассоциированных с транспозицией, способствует повышенной стабильности транспортера нуклеозидтрифосфата, что приводит в результате к образованию SSO, характеризующихся повышенным сохранением хромосомной UBP.
В данном документе в определенных вариантах осуществления раскрыты способы, композиции, клетки, сконструированные микроорганизмы, плазмиды и наборы для повышения продуцирования молекул нуклеиновых кислот, которые содержат неприродный нуклеотид. В некоторых случаях, в данном документе раскрыты сконструированные клетки, содержащие: (a) первую молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид; и (b) вторую молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с транспозицией. В некоторых вариантах осуществления сконструированная клетка дополнительно содержит третью молекулу нуклеиновой кислоты, кодирующую модифицированный транспортер нуклеозидтрифосфата, где третья молекула нуклеиновой кислоты встроена в геномную последовательность сконструированной клетки-хозяина, или содержит плазмиду, кодирующую модифицированный транспортер нуклеозидтрифосфата. В некоторых вариантах осуществления сконструированная клетка дополнительно содержит полипептид Cas9 или его варианты и одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его вариантов и sgRNA обеспечивает модуляцию репликации первой молекулы нуклеиновой кислоты, кодирующей неприродный нуклеотид. В определенных вариантах осуществления сконструированная клетка дополнительно содержит: (а) четвертую молекулу нуклеиновой кислоты, кодирующую полипептид Cas9 или его варианты; и (b) пятую молекулу нуклеиновой кислоты, кодирующую одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA. В некоторых случаях первая, вторая, третья, четвертая и пятая молекулы нуклеиновой кислоты кодируются одной или несколькими плазмидами, а sgRNA, кодируемая пятой молекулой нуклеиновой кислоты, содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в первой молекуле нуклеиновой кислоты.
В некоторых вариантах осуществления, дополнительно представленных в данном документе, включена молекула нуклеиновой кислоты, содержащая неприродный нуклеотид, полученный с помощью способа, предусматривающего инкубирование сконструированной клетки с: (а) первой молекулой нуклеиновой кислоты, содержащей неприродный нуклеотид; (b) второй молекулой нуклеиновой кислоты, кодирующей модифицированный белок, ассоциированный с транспозицией; (в) третьей молекулой нуклеиновой кислоты, кодирующей модифицированный транспортер нуклеозидтрифосфата; (d) четвертой молекулой нуклеиновой кислоты, кодирующей полипептид Cas9 или его варианты; и (e) пятой молекулой нуклеиновой кислоты, кодирующей одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA. В некоторых случаях модификация в положении неприродного нуклеотида в первой молекуле нуклеиновой кислоты обеспечивает образование модифицированной первой молекулы нуклеиновой кислоты, а комбинация полипептида Cas9 или его вариантов с sgRNA обеспечивает модуляцию репликации модифицированной первой молекулы нуклеиновой кислоты, что в результате приводит к продуцированию молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид. В некоторых случаях экспрессия модифицированного белка, ассоциированного с транспозицией, в сконструированной клетке увеличивает стабильность транспортера трифосфата. В некоторых вариантах осуществления повышенная стабильность транспортера трифосфата способствует повышению (i) продуцирования модифицированного полипептида, содержащего неприродную аминокислоту, кодируемую неприродным нуклеотидом, и/или (ii) повышенному сохранению неприродного нуклеотида в геноме сконструированной клетки.
В некоторых вариантах осуществления, дополнительно представленных в данном документе, включен полусинтетический организм (SSO), полученный с помощью способа, предусматривающего инкубирование организма с: (а) первой молекулой нуклеиновой кислоты, содержащей неприродный нуклеотид; (b) второй молекулой нуклеиновой кислоты, кодирующей модифицированный белок, ассоциированный с транспозицией; (в) третьей молекулой нуклеиновой кислоты, кодирующей модифицированный транспортер нуклеозидтрифосфата; (d) четвертой молекулой нуклеиновой кислоты, кодирующей полипептид Cas9 или его варианты; и (e) пятой молекулой нуклеиновой кислоты, кодирующей одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA. В некоторых случаях модификация в положении неприродного нуклеотида в первой молекуле нуклеиновой кислоты обеспечивает образование модифицированной первой молекулы нуклеиновой кислоты, а комбинация полипептида Cas9 или его вариантов с sgRNA обеспечивает модуляцию репликации модифицированной первой молекулы нуклеиновой кислоты, что в результате приводит к продуцированию полусинтетического организма, содержащего молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид. В некоторых случаях экспрессия модифицированного белка, ассоциированного с транспозицией, в сконструированной клетке увеличивает стабильность транспортера трифосфата. В некоторых вариантах осуществления повышенная стабильность транспортера трифосфата способствует повышению (i) продуцирования модифицированного полипептида, содержащего неприродную аминокислоту, кодируемую неприродным нуклеотидом, и/или (ii) повышенному сохранению неприродного нуклеотида в геноме SSO.
Аппарат репарации ДНК
Механизмы репарации ДНК включают эксцизионную репарацию нуклеотидов (NER), эксцизионную репарацию рибонуклеотидов (RER), SOS-ответ, метил-направленную репарацию ошибочно спаренных оснований (MMR) и рекомбинационную репарацию. NER, MMR, RER и SOS-ответ индуцируются сигналами, которые могут имитироваться за счет введения UBP в геном хозяина. Неограничивающие примеры ассоциированных с репарацией ДНК белков в прокариотических клетках, вовлеченных в рекомбинационную репарацию и/или SOS-ответ, включают RecA, Rad51, RadA и LexA. Неограничивающие примеры ассоциированных с репарацией ДНК белков в прокариотических клетках, вовлеченных в рекомбинационную репарацию, включают RecO, RecR, RecN и RuvABC. Неограничивающие примеры ассоциированных с репарацией ДНК белков в прокариотических клетках, вовлеченных в NER, включают UvrA и UvrB. Неограничивающие примеры ассоциированных с репарацией ДНК белков в прокариотических клетках, вовлеченных в MMR, включают MutS, MutH и MutL.
В некоторых вариантах осуществления модифицированные белки, ассоциированные с репарацией ДНК, вводят в сконструированную клетку или SSO, описанные в данном документе, с целью повышения сохранения хромосомной UBP. В некоторых вариантах осуществления модифицированные белки, ассоциированные с репарацией ДНК, содержат делецию RecA, Rad51, RadA, LexA, RecO, RecR, RecN, RuvABC, MutS, MutH, MutL, UvrA и/или UvrB. В некоторых вариантах осуществления делеция предусматривает N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию всего гена. В некоторых вариантах осуществления делеция или мутация в молекуле нуклеиновой кислоты, кодирующей белок, ассоциированный с репарацией ДНК, модифицирована с достижением делеции.
Белки, ассоциированные с транспозицией
В E. coli существуют репликативные и консервативные (нерепликативные) механизмы транспозиции транспонируемого элемента (например, IS1), содержащего последовательность нуклеиновой кислоты. В репликативном пути в событии транспонирования создается новая копия транспонируемого элемента. В результате транспонирования одна копия появляется в новом сайте, а одна копия остается в старом сайте. В консервативном пути репликация отсутствует. Вместо этого элемент вырезается из хромосомы или плазмиды и интегрируется в новый сайт. В этих случаях репликация ДНК в элементе не происходит, а происходит потеря элемента в сайте исходной хромосомы. Делеции транспонируемых элементов вызывают высокую частоту делеций в непосредственной близости от них (например, делеция транспонируемого элемента в дополнение к фланкирующей или окружающей ДНК).
Гены insB-4 и insA-4 кодируют два белка, InsB и InsA, необходимые для транспозиции транспозона IS1. Транспозиция IS1 приводит в результате к целевой дупликации от 9 до 8 пар оснований. Делеция insB-4 приводит в результате к репрессии аберрантных событий транспозиции, опосредованных InsB.
В некоторых вариантах осуществления способы, сконструированные клетки и полусинтетические организмы, описанные в данном документе, предусматривают модифицированную молекулу нуклеиновой кислоты, кодирующую белок, ассоциированный с транспозицией. В некоторых вариантах осуществления белок, ассоциированный с транспозицией, предусматривает insB и/или insA. В некоторых вариантах осуществления модифицированная молекула нуклеиновой кислоты, кодирующая белок, ассоциированный с транспозицией, предусматривает делецию или мутацию. В некоторых вариантах осуществления делеция предусматривает N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию всего гена. В некоторых вариантах осуществления мутация в результате приводит к снижению экспрессии insB и/или InsA. В некоторых вариантах осуществления делеция или мутация модифицированной молекулы нуклеиновой кислоты, кодирующей белок, ассоциированный с транспозицией, эффективна для стабилизации экспрессии и/или активности транспортера нуклеотидтрифосфатов, за счет чего повышается сохранение UBP.
В некоторых вариантах осуществления способы, сконструированные клетки и полусинтетические организмы, описанные в данном документе, предусматривают модифицированную молекулу нуклеиновой кислоты, кодирующую транспонируемый элемент IS1. В некоторых вариантах осуществления модифицированная молекула нуклеиновой кислоты, кодирующая транспонируемый элемент IS1, предусматривает делецию или мутацию. В некоторых вариантах осуществления делеция предусматривает нокаут или нокдаун всей или части молекулы нуклеиновой кислоты, кодирующей транспозон IS1. В некоторых вариантах осуществления мутация в результате приводит к снижению экспрессии транспозона IS1. В некоторых вариантах осуществления делеция или мутация модифицированной молекулы нуклеиновой кислоты, кодирующей транспозон IS1, является эффективной для стабилизации экспрессии и/или активности транспортера нуклеотидтрифосфатов, за счет чего повышается сохранение UBP. В некоторых случаях модифицированная молекула нуклеиновой кислоты, кодирующая транспонируемый элемент IS1, содержит SEQ ID NO: 4.
CRISPR/CRISPR-ассоциированная (Cas) редактирующая система
В некоторых вариантах осуществления в способах, клетках и сконструированных микроорганизмах, раскрытых в данном документе, используется CRISPR/CRISPR-ассоциированная (Cas) система для модификации молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид. В некоторых случаях система CRISPR/Cas модулирует сохранение модифицированной молекулы нуклеиновой кислоты, которая содержит модификацию в положении ее неприродного нуклеотида. В некоторых случаях сохранение представляет собой уменьшение репликации модифицированной молекулы нуклеиновой кислоты. В некоторых случаях система CRISPR/Cas обеспечивает создание двухнитевого разрыва в модифицированной молекуле нуклеиновой кислоты, что приводит к деградации с участием белков для репарации ДНК, такого как RecBCD и ассоциированные с ним нуклеазы.
В некоторых вариантах осуществления система CRISPR/Cas включает (1) интеграцию коротких участков генетического материала, которые гомологичны представляющей интерес молекуле нуклеиновой кислоты, содержащей неприродный нуклеотид, называемых "спейсерами", в кластерных массивах в геном хозяина, (2) экспрессию коротких направляющих РНК (crRNA) из спейсеров, (3) связывание crRNA со специфическими частями представляющей молекулы нуклеиновой кислоты, называемыми протоспейсерами, и (4) деградацию протоспейсеров CRISPR-ассоциированными нуклеазами (Cas). В некоторых случаях система CRISPR типа II была описана в бактерии Streptococcus pyogenes, в которой Cas9 и две некодирующие малые РНК (pre-crRNA и tracrRNA (транс-активирующая РНК CRISPR)) действуют согласованно для нацеливания на представляющую интерес молекулу нуклеиновой кислоты и ее деградации специфически в отношении последовательности (Jinek et al., "A Programmable Dual-RNA-Guided DNA Endonuclease in Adaptive Bacterial Immunity," Science 337(6096):816-821 (август 2012 г., электронная публикация 28 июня 2012 г.)).
В некоторых случаях две некодирующие РНК затем сливаются в одну одиночную направляющую РНК (sgRNA). В некоторых случаях sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых вариантах осуществления модификация представляет собой замену, вставку или делецию. В некоторых случаях sgRNA содержит целевой мотив, который распознает замену в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых случаях sgRNA содержит целевой мотив, который распознает делецию в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых случаях sgRNA содержит целевой мотив, который распознает вставку в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты.
В некоторых случаях длина целевого мотива составляет от 10 до 30 нуклеотидов. В некоторых случаях длина целевого мотива составляет от 15 до 30 нуклеотидов. В некоторых случаях длина целевого мотива составляет приблизительно 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 или 30 нуклеотидов. В некоторых случаях длина целевого мотива составляет приблизительно 15, 16, 17, 18, 19, 20, 21 или 22 нуклеотидов.
В некоторых случаях sgRNA дополнительно содержит элемент распознавания мотива, прилегающего к протоспейсеру (PAM). В некоторых случаях PAM прилегает к 3'-концу целевого мотива. В некоторых случаях нуклеотид в целевом мотиве, который образует спаривание оснований по Уотсону-Крику, с модификацией в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты, расположен на расстоянии 3-22, 5-20, 5-18, 5-15, 5-12 или 5-10 нуклеотидов от 5'-конца PAM. В некоторых случаях нуклеотид в целевом мотиве, который образует спаривание оснований по Уотсону-Крику, с модификацией в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты, расположен на расстоянии приблизительно 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14 или 15 нуклеотидов от 5'-конца PAM.
В некоторых случаях в системе CRISPR/Cas используется полипептид Cas9 или его вариант. Cas9 представляет собой двухнитевую нуклеазу с двумя активными разрезающими сайтами, по одному на каждую нить двойной спирали. В некоторых случаях полипептид Cas9 или его варианты образуют двухнитевой разрыв. В некоторых случаях полипептид Cas9 представляет собой Cas9 дикого типа. В некоторых случаях полипептид Cas9 представляет собой оптимизированный Cas9 для экспрессии в клетке и/или сконструированном микроорганизме, описанном в данном документе.
В некоторых вариантах осуществления комплекс Cas9/sgRNA связывается с частью представляющей интерес молекулы нуклеиновой кислоты (например, ДНК), которая содержит последовательность, соответствующую, например, 17-20 нуклеотидам sgRNA выше PAM. После связывания каждый из двух независимых нуклеазных доменов Cas9 расщепляет одну из нитей ДНК на 3 основания выше PAM, оставляя двухнитевой разрыв (DSB) ДНК с тупым концом. Присутствие DSB затем приводит, в ряде случаев, к деградации представляющей интерес ДНК посредством RecBCD и ассоциированных с ним нуклеаз.
В некоторых случаях комплекс Cas9/sgRNA модулирует сохранение модифицированной молекулы нуклеиновой кислоты, которая содержит модификацию в положении неприродного нуклеотида. В некоторых случаях сохранение представляет собой уменьшение репликации модифицированной молекулы нуклеиновой кислоты. В некоторых случаях Cas9/sgRNA снижает скорость репликации модифицированной молекулы нуклеиновой кислоты на приблизительно 80%, 85%, 95%, 99% или выше.
В некоторых случаях продуцирование молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышается на приблизительно 30%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или выше. В некоторых случаях продуцирование молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышается на приблизительно 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или выше.
В некоторых случаях сохранение молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышается на приблизительно 30%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или выше. В некоторых случаях сохранение молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, повышается на приблизительно 50%, 60%, 70%, 80%, 90%, 95%, 96%, 97%, 98%, 99% или выше.
В некоторых вариантах осуществления система CRISPR/Cas содержит две или более sgRNA. В некоторых случаях каждая из двух или более sgRNA содержит целевой мотив, который распознает модификацию в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых вариантах осуществления модификация представляет собой замену, вставку или делецию. В некоторых случаях каждая из двух или более sgRNA содержит целевой мотив, который распознает замену в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых случаях каждая из двух или более sgRNA содержит целевой мотив, который распознает делецию в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты. В некоторых случаях каждая из двух или более sgRNA содержит целевой мотив, который распознает вставку в положении неприродного нуклеотида в представляющей интерес молекуле нуклеиновой кислоты.
В некоторых вариантах осуществления специфичность связывания компонентов CRISPR с представляющей интерес молекулой нуклеиновой кислоты контролируется неповторяющимися спейсерными элементами в pre-crRNA-части sgRNA, которая при транскрипции вместе с tracrRNA-частью направляет нуклеазу Cas9 к гетеродуплексу протоспейсер:crRNA и индуцирует образование двухнитевых разрывов (DSB). В некоторых случаях специфичность sgRNA составляет приблизительно 80%, 85%, 90%, 95%, 96%, 97%, 98%, 99% или выше. В некоторых случаях sgRNA характеризуется показателем нецелевого связывания, составляющим менее приблизительно 20%, 15%, 10%, 5%, 3%, 1% или меньше.
Молекулы нуклеиновой кислоты
В некоторых вариантах осуществления нуклеиновая кислота (например, также упоминаемая в данном документе как представляющая интерес молекула нуклеиновой кислоты) происходит из любого источника или композиции, такой как ДНК, cDNA, gDNA (геномная ДНК), РНК, siRNA (короткая ингибирующая РНК), RNAi, tRNA, мРНК или rRNA (рибосомальная РНК), например, и находится в любой форме (например, линейной, циклической, сверхспирализованной, однонитевой, двухнитевой и т. п.). В некоторых вариантах осуществления нуклеиновые кислоты включают нуклеотиды, нуклеозиды или полинуклеотиды. В некоторых случаях нуклеиновые кислоты включают природные и неприродные нуклеиновые кислоты. В некоторых случаях нуклеиновая кислота также включает неприродные нуклеиновые кислоты, такие как аналоги ДНК или РНК (например, содержащие аналоги оснований, аналоги сахаров и/или ненативный остов и т. п.). Понятно, что термин "нуклеиновая кислота" не относится к конкретной длине полинуклеотидной цепи или не подразумевает ее, таким образом, полинуклеотиды и олигонуклеотиды также включены в определение. Иллюстративные природные нуклеотиды включают без ограничения ATP, UTP, CTP, GTP, ADP, UDP, CDP, GDP, AMP, UMP, CMP, GMP, dATP, dTTP, dCTP, dGTP, dADP, dTDP, dCDP, dGDP, dAMP, dTMP, dCMP и dGMP. Иллюстративные природные дезоксирибонуклеотиды включают dATP, dTTP, dCTP, dGTP, dADP, dTDP, dCDP, dGDP, dAMP, dTMP, dCMP и dGMP. Иллюстративные природные рибонуклеотиды включают ATP, UTP, CTP, GTP, ADP, UDP, CDP, GDP, AMP, UMP, CMP и GMP. Для РНК урациловое основание представляет собой уридин. Нуклеиновая кислота иногда представляет собой вектор, плазмиду, фагмиду, автономно реплицирующуюся последовательность (ARS), центромеру, искусственную хромосому, дрожжевую искусственную хромосому (например, YAC) или другую нуклеиновую кислоту, способную реплицироваться или реплицирующуюся в клетке-хозяине. В некоторых случаях неприродная нуклеиновая кислота является аналогом нуклеиновой кислоты. В дополнительных случаях неприродная нуклеиновая кислота происходит из внеклеточного источника. В других случаях неприродная нуклеиновая кислота доступна для внутриклеточного пространства организма, предусмотренного в данном документе, например, генетически модифицированного организма.
Неприродные нуклеиновые кислоты
Нуклеотидный аналог или неприродный нуклеотид включает нуклеотид, который содержит ту или иную модификацию основания, сахарного или фосфатного фрагментов. В некоторых вариантах осуществления модификация включает химическую модификацию. В некоторых случаях модификации происходят в группе 3'OΗ или 5'OΗ, в остове, в сахарном компоненте или в нуклеотидном основании. В некоторых случаях модификации необязательно включают не встречающиеся в природе линкерные молекулы и/или межнитевые или внутринитевые поперечные сшивки. В одном аспекте модифицированная нуклеиновая кислота содержит модификацию одного или нескольких из группы 3'OH или 5'OΗ, остова, сахарного компонента или нуклеотидного основания и/или добавление не встречающихся в природе линкерных молекул. В одном аспекте модифицированный остов включает остов, отличающийся от фосфодиэфирного остова. В одном аспекте модифицированный сахар включает сахар, отличный от дезоксирибозы (в модифицированной ДНК) или отличный от рибозы (в модифицированной РНК). В одном аспекте модифицированное основание включает основание, отличное от аденина, гуанина, цитозина или тимина (в модифицированной ДНК) или основание, отличное от аденина, гуанина, цитозина или урацила (в модифицированной РНК).
В некоторых вариантах осуществления нуклеиновая кислота содержит по меньшей мере одно модифицированное основание. В некоторых случаях нуклеиновая кислота содержит 2, 3, 4, 5, 6, 7, 8, 9, 10, 15, 20 или более модифицированных оснований. В некоторых случаях модификации фрагмента основания включают природные и синтетические модификации A, C, G и T/U, а также различные пуриновые или пиримидиновые основания. В некоторых вариантах осуществления модификация относится к модифицированной форме аденина, гуанина, цитозина или тимина (в модифицированной ДНК) или модифицированной форме аденина, гуанина, цитозина или урацила (в модифицированной РНК).
Модифицированное основание неприродной нуклеиновой кислоты включает без ограничения урацил-5-ил, гипоксантин-9-ил (I), 2-аминоаденин-9-ил, 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил- и другие алкильные производные аденина и гуанина, 2-пропил- и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил и -цитозин, 5-пропинилурацил и -цитозин, 6-азоурацил, -цитозин и -тимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности 5-бром, 5-трифторметил и другие 5-замещенные урацилы и цитозины, 7-метилгуанин и 7-метиладенин, 8-азагуанин и 8-азааденин, 7-дезазагуанин и 7-дезазааденин, и 3-дезазагуанин и 3-дезазааденин. Определенные неприродные нуклеиновые кислоты, такие как 5-замещенные пиримидины, 6-азапиримидины и N-2-замещенные пурины, N-6-замещенные пурины, O-6-замещенные пурины, 2-аминопропиладенин, 5-пропинилурацил, 5-пропинилцитозин, 5-метилцитозин, те, которые повышают стабильность образования дуплекса, универсальные нуклеиновые кислоты, гидрофобные нуклеиновые кислоты, разнородные нуклеиновые кислоты, нуклеиновые кислоты с увеличенным размером, фторированные нуклеиновые кислоты, 5-замещенные пиримидины, 6-азапиримидины и N-2, N-6 и О-6 замещенные пурины, в том числе 2-аминопропиладенин, 5-пропинилурацил и 5-пропинилцитозин, 5-метилцитозин (5-me-C), 5-гидроксиметилцитозин, ксантин, гипоксантин, 2-аминоаденин, 6-метил, другие алкильные производные аденина и гуанина, 2-пропил и другие алкильные производные аденина и гуанина, 2-тиоурацил, 2-тиотимин и 2-тиоцитозин, 5-галогенурацил, 5-галогенцитозин, 5-пропинил (-C≡C-CI¼) урацил, 5-пропинилцитозин, другие алкинильные производные пиримидиновых нуклеиновых кислот, 6-азоурацил, 6-азоцитозин, 6-азотимин, 5-урацил (псевдоурацил), 4-тиоурацил, 8-галоген, 8-амино, 8-тиол, 8-тиоалкил, 8-гидроксил и другие 8-замещенные аденины и гуанины, 5-галоген, в частности 5-бром, 5-трифторметил, другие 5-замещенные урацилы и цитозины, 7-метилгуанин, 7-метиладенин, 2-F-аденин, 2-аминоаденин, 8-азагуанин, 8-азааденин, 7-дезазагуанин, 7-дезазааденин, 3-дезазагуанин, 3-дезазааденин, трициклические пиримидины, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3Н)-он), фенотиазинцитидин(1Н-пиримидо[5,4-b][1,4] бензотиазин-2(3H)-он), G-зажимы, феноксазинцитидин (например, 9-(2-аминоэтокси)-H-пиримидо[5,4-b][1,4]бензоксазин-2(3H)-он), карбазолцитидин (2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин (H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), те, в которых пуриновое или пиримидиновое основание заменено другими гетероциклами, 7-дезазааденин, 7-дезазагуанозин, 2-аминопиридин, 2-пиридон, азацитозин, 5-бромоцитозин, бромурацил, 5-хлорцитозин, хлорированный цитозин, циклоцитозин, цитозина арабинозид, 5-фторцитозин, фторпиримидин, фторурацил, 5,6-дигидроцитозин, 5-йодцитозин, гидроксимочевина, йодурацил, 5-нитроцитозин, 5-бромурацил, 5-хлорурацил, 5-фторурацил и 5-йодурацил, 2-аминоаденин, 6-тиогуанин, 2-тиотимин, 4-тиотимин, 5-пропинилурацил, 4-тиоурацил, N4-этилцитозин, 7-дезазагуанин, 7-дезаза-8-азагуанин, 5-гидроксицитозин, 2'-дезоксиуридин, 2-амино-2'-дезоксиаденозин и те, которые описаны в патентах США №№ 3687808; 4845205; 4910300; 4948882; 5093232; 5130302; 5134066; 5175273; 5367066; 5432272; 5457187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121; 5596091; 5614617; 5645985; 5681941; 5750692; 5763588; 5830653 и 6005096; WO 99/62923; Kandimalla et al., (2001) Bioorg. Med. Chem. 9:807-813; The Concise Encyclopedia of Polymer Science and Engineering, Kroschwitz, J.I., Ed., John Wiley & Sons, 1990, 858-859; Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613 и Sanghvi, Chapter 15, Antisense Research and Applications, Crooke and Lebleu Eds., CRC Press, 1993, 273-288. Дополнительные модификации оснований можно найти, например, в патенте США № 3687808; Englisch et al., Angewandte Chemie, International Edition, 1991, 30, 613; и Sanghvi, Chapter 15, Antisense Research and Applications, страницы 289-302, Crooke and Lebleu ed., CRC Press, 1993.
Неприродные нуклеиновые кислоты, содержащие различные гетероциклические основания и различные сахарные фрагменты (и аналоги сахаров), доступны из уровня техники, и нуклеиновая кислота в некоторых случаях содержит одно или несколько гетероциклических оснований, отличных от основных пяти компонентов-оснований встречающихся в природе нуклеиновых кислот. Например, гетероциклическое основание включает в некоторых случаях урацил-5-ильные, цитозин-5-ильные, аденин-7-ильные, аденин-8-ильные, гуанин-7-ильные, гуанин-8-ильные, 4-аминопирроло[2,3-d]пиримидин-5-ильные, 2-амино-4-оксопирроло[2,3-d]пиримидин-5-ильные, 2-амино-4-оксопирроло[2,3-d]пиримидин-3-ильные группы, где пурины присоединены к сахарному фрагменту нуклеиновой кислоты через положение 9, пиримидины через положение 1, пирролопиримидины через положение 7 и пиразолопиримидины через положение 1.
В некоторых вариантах осуществления модифицированное основание неприродной нуклеиновой кислоты изображено ниже, где волнистая линия обозначает точку присоединения к (дезокси)рибозе или рибозе.
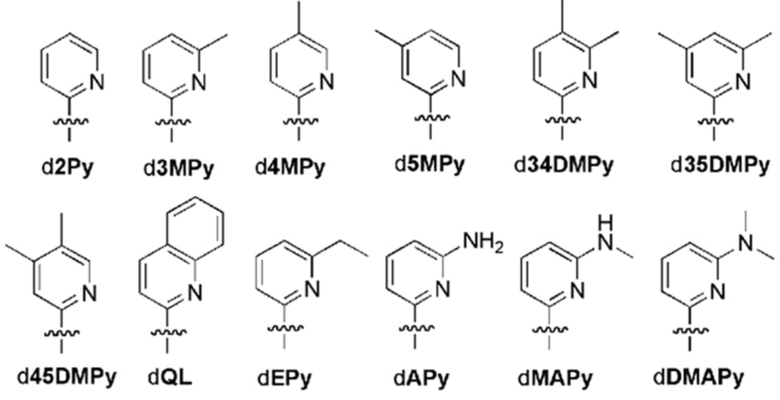
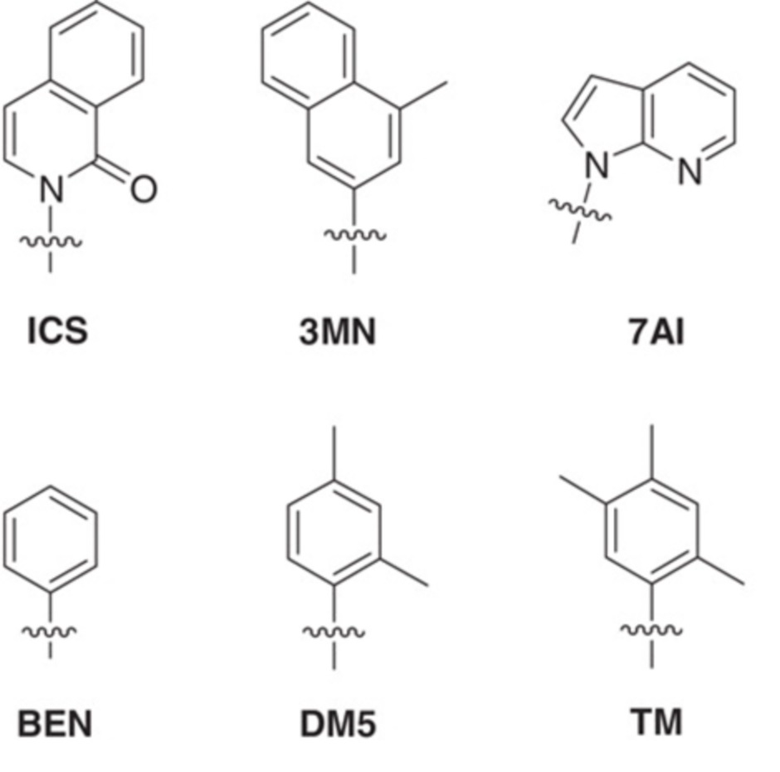

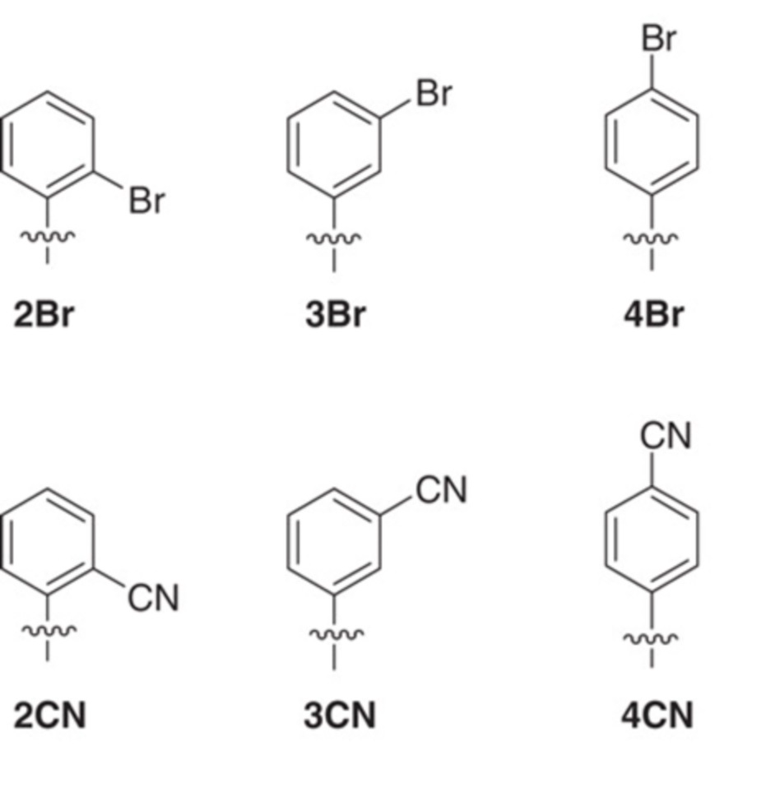




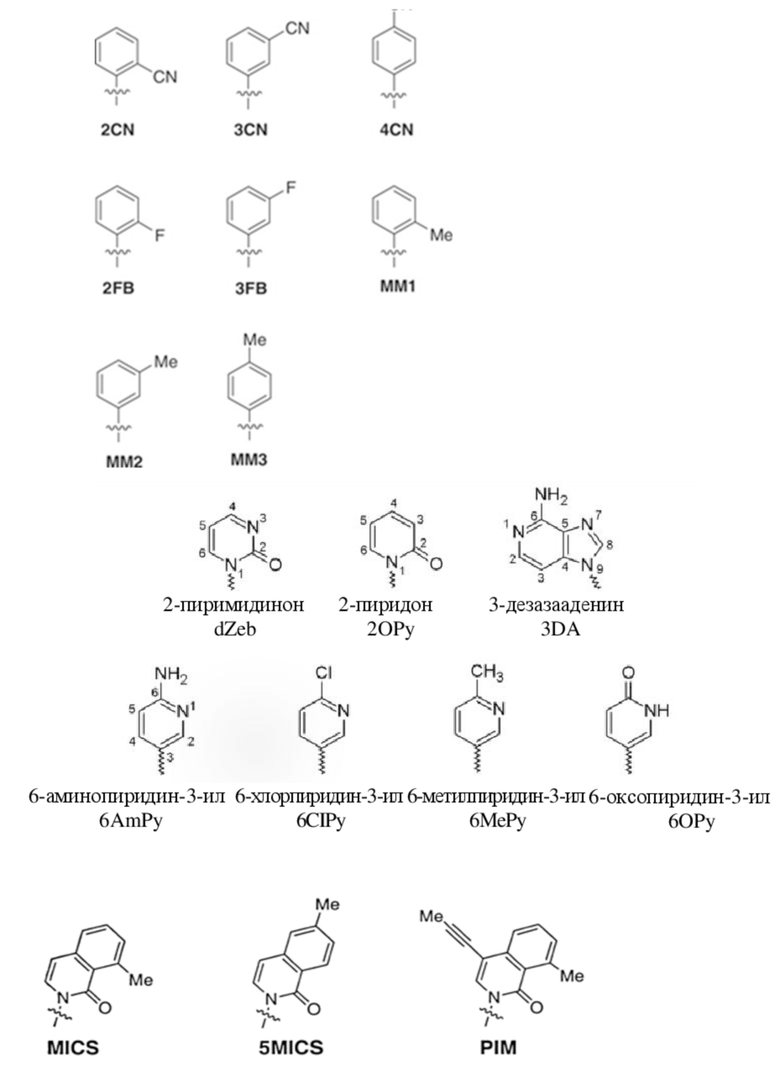
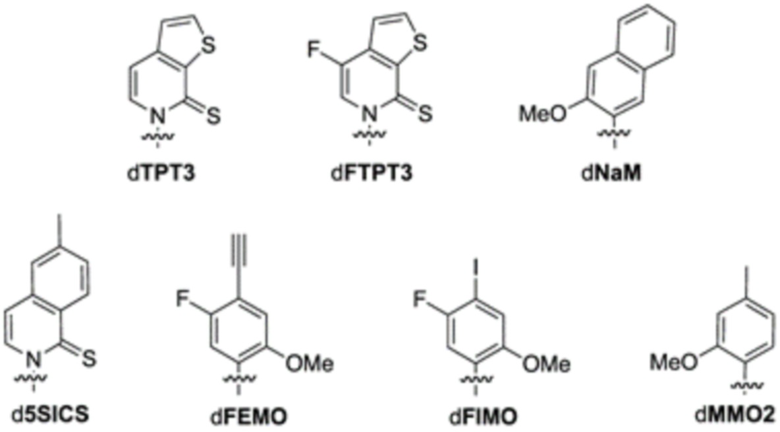


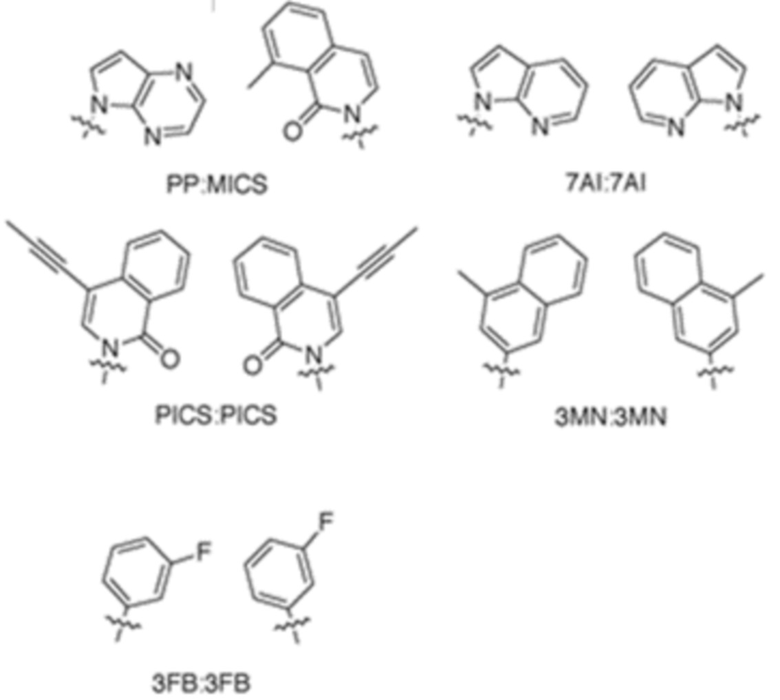 .
.
В некоторых вариантах осуществления нуклеотидные аналоги также модифицированы в фосфатном фрагменте. Модифицированные фосфатные фрагменты включают без ограничения фрагменты с модификацией в связи между двумя нуклеотидами и содержат, например, фосфоротиоат, хиральный фосфоротиоат, фосфородитиоат, фосфотриэфир, аминоалкилфосфотриэфир, метил и другие алкилфосфонаты, включая 3'-алкиленфосфонат и хиральные фосфонаты, фосфинаты, фосфорамидаты, включая 3'-аминофосфорамидат и аминоалкилфосфорамидаты, тионофосфорамидаты, тионоалкилфосфонаты, тионоалкилфосфотриэфиры и боранофосфаты. Понятно, что эти фосфатные или модифицированные фосфатные связи между двумя нуклеотидами образованы посредством 3'-5' связи или 2'-5' связи, и эта связь содержит обратную полярность, такую как с 3'-5' на 5'-3' или с 2'-5' на 5'-2'. Также включены различные соли, смешанные соли и формы свободной кислоты. Во многих патентах США описывается, как получать и применять нуклеотиды, содержащие модифицированные фосфаты, и они включают без ограничения №№ 3687808; 4469863; 4476301; 5023243; 5177196; 5188897; 5264423; 5276019; 5278302; 5286717; 5321131; 5399676; 5405939; 5453496; 5455233; 5466677; 5476925; 5519126; 5536821; 5541306; 5550111; 5563253; 5571799; 5587361 и 5625050.
В некоторых вариантах осуществления неприродные нуклеиновые кислоты включают 2',3'-дидезокси-2',3'-дидегидронуклеозиды (PCT/US2002/006460), 5'-замещенные производные ДНК и РНК (PCT/US2011/033961; Saha et al., J. Org Chem., 1995, 60, 788-789; Wang et al., Bioorganic & Medicinal Chemistry Letters, 1999, 9, 885-890; и Mikhailov et al., Nucleosides & Nucleotides, 1991, 10(1-3), 339-343; Leonid et al., 1995, 14(3-5), 901-905; и Eppacher et al., Helvetica Chimica Acta, 2004, 87, 3004-3020; PCT/JP2000/004720; PCT/JP2003/002342; PCT/JP2004/013216; PCT/JP2005/020435; PCT/JP2006/315479; PCT/JP2006/324484; PCT/JP2009/056718; PCT/JP2010/067560), или 5'-замещенные мономеры, полученные в виде монофосфата с модифицированными основаниями (Wang et al., Nucleosides Nucleotides & Nucleic Acids, 2004, 23 (1 & 2), 317-337).
В некоторых вариантах осуществления неприродные нуклеиновые кислоты содержат модификации в 5'-положении и 2'-положении сахарного кольца (PCT/US94/02993), такие как 5'-CH2-замещенные 2'-O-защищенные нуклеозиды (Wu et al., Helvetica Chimica Acta, 2000, 83, 1127-1143 и Wu et al., Bioconjugate Chem. 1999, 10, 921-924). В некоторых случаях неприродные нуклеиновые кислоты включают нуклеозидные димеры с амидной связью, полученные для включения в олигонуклеотиды, где 3'-связанный нуклеозид в димере (от 5' к 3') содержит 2'-OCH3 и 5'-(S)-CH3 (Mesmaeker et al., Synlett, 1997, 1287-1290). Неприродные нуклеиновые кислоты могут включать 2'-замещенные 5'-CH2 (или O) модифицированные нуклеозиды (PCT/US92/01020). Неприродные нуклеиновые кислоты могут включать 5'-метиленфосфонатные мономеры ДНК и РНК и димеры (Bohringer et al., Tet. Lett., 1993, 34, 2723-2726; Collingwood et al., Synlett, 1995, 7, 703-705; и Hutter et al., Helvetica Chimica Acta, 2002, 85, 2777-2806). Неприродные нуклеиновые кислоты могут включать 5'-фосфонатные мономеры, имеющие 2'-замену (US2006/0074035), и другие модифицированные 5'-фосфонатные мономеры (WO1997/35869). Неприродные нуклеиновые кислоты могут включать 5'-модифицированные метиленфосфонатные мономеры (EP614907 и EP629633). Неприродные нуклеиновые кислоты могут включать аналоги 5' или 6'-фосфонатных рибонуклеозидов, содержащие гидроксильную группу в 5'- и/или 6'-положении (Chen et al., Phosphorus, Sulfur and Silicon, 2002, 777, 1783-1786; Jung et al., Bioorg. Med. Chem., 2000, 8, 2501-2509; Gallier et al., Eur. J. Org. Chem., 2007, 925-933; и Hampton et al., J. Med. Chem., 1976, 19(8), 1029-1033). Неприродные нуклеиновые кислоты могут включать 5'-фосфонатные дезоксирибонуклеозидные мономеры и димеры, имеющие 5'-фосфатную группу (Nawrot et al., Oligonucleotides, 2006, 16(1), 68-82). Неприродные нуклеиновые кислоты могут включать нуклеозиды, имеющие 6'-фосфонатную группу, где 5'- или/и 6'-положение является незамещенным или замещенным тио-трет-бутильной группой (SC(CH3)3) (и ее аналогами); метиленаминогруппой (CH2NH2) (и ее аналогами) или цианогруппой (CN) (и ее аналогами) (Fairhurst et al., Synlett, 2001, 4, 467-472; Kappler et al., J. Med. Chem., 1986, 29, 1030-1038; Kappler et al., J. Med. Chem., 1982, 25, 1179-1184; Vrudhula et al., J. Med. Chem., 1987, 30, 888-894; Hampton et al., J. Med. Chem., 1976, 19, 1371-1377; Geze et al., J. Am. Chem. Soc, 1983, 105(26), 7638-7640; и Hampton et al., J. Am. Chem. Soc, 1973, 95(13), 4404-4414).
В некоторых вариантах осуществления неприродные нуклеиновые кислоты также включают модификации сахарного фрагмента. В некоторых случаях нуклеиновые кислоты содержат один или несколько нуклеозидов, где сахарная группа была модифицирована. Такие нуклеозиды с модифицированным сахаром могут придавать повышенную стабильность в отношении нуклеазы, повышенную аффинность связывания или некоторые другие полезные биологические свойства. В определенных вариантах осуществления нуклеиновые кислоты включают химически модифицированный фрагмент рибофуранозного кольца. Примеры химически модифицированных рибофуранозных колец включают без ограничения добавление замещающих групп (включая 5'- и/или 2'-замещающие группы), сшивание двух кольцевых атомов с образованием бициклических нуклеиновых кислот (BNA), замену атома кислорода рибозильного кольца на S, N(R) или C(Ri)(R2) (R=H, C1-С12алкил или защитную группу) и их комбинации. Примеры химически модифицированных сахаров можно найти в WO2008/101157, US2005/0130923 и WO2007/134181.
В некоторых случаях модифицированная нуклеиновая кислота содержит модифицированные сахара или аналоги сахаров. Таким образом, в дополнение к рибозе и дезоксирибозе сахарный фрагмент может представлять собой пентозу, дезоксипентозу, гексозу, дезоксигексозу, глюкозу, арабинозу, ксилозу, ликсозу или циклопентильную группу, представляющую собой "аналог" сахаров. Сахар может быть в пиранозильной или фуранозильной форме. Сахарный фрагмент может представлять собой фуранозид рибозы, дезоксирибозы, арабинозы или 2'-O-алкилрибозы, и сахар может быть присоединен к соответствующим гетероциклическим основаниям либо в [альфа], либо в [бета]-аномерной конфигурации. Модификации сахара включают без ограничения 2'-алкокси-РНК-аналоги, 2'-амино-РНК-аналоги, 2'-фтор-ДНК и химеры 2'-алкокси- или амино-РНК/ДНК. Например, модификация сахара может включать 2'-O-метилуридин или 2'-O-метилцитидин. Модификации сахара включают 2'-O-алкилзамещенные дезоксирибонуклеозиды и 2'-O-этиленгликольподобные рибонуклеозиды. Известно получение этих сахаров или аналогов сахаров и соответствующих "нуклеозидов", где такие сахара или аналоги присоединены к гетероциклическому основанию (основанию нуклеиновой кислоты). Модификации сахара также могут быть выполнены и объединены с другими модификациями.
Модификации сахарного фрагмента включают природные модификации рибозы и дезоксирибозы, а также неприродные модификации. Модификации сахара включают без ограничения следующие модификации в 2'-положении: OH; F; O-, S- или N-алкил; O-, S- или N-алкенил; O-, S- или N-алкинил; или O-алкил-O-алкил, где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-С10алкил или C2-С10алкенил и алкинил. 2'-Модификации сахара также включают без ограничения -O[(CH2)nO]m CH3, -O(CH2)nOCH3, -O(CH2)nNH2, -O(CH2)nCH3, -O(CH2)nONH2 и -O(CH2)nON[(CH2)n CH3)]2, где n и m равняются от 1 до приблизительно 10.
Другие модификации в 2'-положении включают без ограничения низший C1-С10алкил, замещенный низший алкил, алкарил, аралкил, O-алкарил, O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3, NH2, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, расщепляющую РНК группу, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида и другие заместители с аналогичными свойствами. Аналогичные модификации также могут быть осуществлены в других положениях в сахаре, в частности в 3'-положении сахара в 3'-концевом нуклеотиде или в олигонуклеотидах с 2'-5' связями и в 5'-положении 5'-концевого нуклеотида. Модифицированные сахара также включают те, которые содержат модификации в мостиковом кислороде кольца, такие как CH2 и S. Нуклеотиды с аналогами сахаров также могут содержать миметики сахаров, такие как циклобутильные фрагменты, вместо пентофуранозильного сахара. Существует множество патентов США, в которых описывается получение таких модифицированных структур сахаров и в которых подробно излагается и описывается ряд модификаций оснований, например, патенты США №№ 4981957; 5118800; 5319080; 5359044; 5393878; 5446137; 5466786; 5514785; 5519134; 5567811; 5576427; 5591722; 5597909; 5610300; 5627053; 5639873; 5646265; 5658873; 5670633; 4845205; 5130302; 5134066; 5175273; 5367066; 5432272; 5,457,187; 5459255; 5484908; 5502177; 5525711; 5552540; 5587469; 5594121, 5596091; 5614617; 5681941 и 5700920, каждый из которых включен в данный документ посредством ссылки во всей своей полноте.
Примеры нуклеиновых кислот, имеющих модифицированные сахарные фрагменты, включают без ограничения нуклеиновые кислоты, содержащие замещающие группы 5'-винильную, 5'-метильную (R или S), 4'-S, 2'-F, 2'-OCH3 и 2'-O(CH2)2OCH3. Заместитель в 2'-положении также может быть выбран из аллила, амино, азидо, тио, O-аллила, O-(C1-С10алкила), OCF3, O(CH2)2SCH3, O(CH2)2-O-N(Rm)(Rn) и O-CH2-C(=O)-N(Rm)(Rn), где каждый Rm и Rn независимо представляет собой H или замещенный или незамещенный C1-С10алкил.
В определенных вариантах осуществления нуклеиновые кислоты, описанные в данном документе, включают одну или несколько бициклических нуклеиновых кислот. В определенных таких вариантах осуществления бициклическая нуклеиновая кислота содержит мостик между 4' и 2' атомами рибозильного кольца. В определенных вариантах осуществления нуклеиновые кислоты, предусмотренные в данном документе, включают одну или несколько бициклических нуклеиновых кислот, где мостик содержит 4'-2' бициклическую нуклеиновую кислоту. Примеры таких 4'-2' бициклических нуклеиновых кислот включают без ограничения одну из следующих формул: 4'-(CH2)-O-2' (LNA); 4'-(CH2)-S-2'; 4'-(CH2)2-O-2' (ENA); 4'-CH(CH3)-O-2' и 4'-CH(CH2OCH3)-O-2' и их аналоги (см. патент США № 7399845); 4'-C(CH3)(CH3)-O-2' и ее аналоги (см. WO2009/006478, WO2008/150729, US2004/0171570, патент США № 7427672, Chattopadhyaya et al., J. Org. Chem., 209, 74, 118-134 и WO2008/154401). Также см., например, Singh et al., Chem. Commun., 1998, 4, 455-456; Koshkin et al., Tetrahedron, 1998, 54, 3607-3630; Wahlestedt et al., Proc. Natl. Acad. Sci. U. S. A., 2000, 97, 5633-5638; Kumar et al., Bioorg. Med. Chem. Lett., 1998, 8, 2219-2222; Singh et al., J. Org. Chem., 1998, 63, 10035-10039; Srivastava et al., J. Am. Chem. Soc., 2007, 129(26) 8362-8379; Elayadi et al., Curr. Opinion Invens. Drugs, 2001, 2, 558-561; Braasch et al., Chem. Biol, 2001, 8, 1-7; Oram et al., Curr. Opinion Mol. Ther., 2001, 3, 239-243; патенты США №№ 4849513; 5015733; 5118800; 5118802; 7053207; 6268490; 6770748; 6794499; 7034133; 6525191; 6670461 и 7399845; международные публикации №№ WO2004/106356, WO1994/14226, WO2005/021570, WO2007/090071 и WO2007/134181; публикации заявок на патент США №№ US2004/0171570, US2007/0287831 и US2008/0039618; предварительные заявки на патент США №№ 60/989574, 61/026995, 61/026998, 61/056564, 61/086,231, 61/097787 и 61/099844 и международные заявки №№ PCT/US2008/064591, PCT US2008/066154, PCT US2008/068922 и PCT/DK98/00393.
В определенных вариантах осуществления нуклеиновые кислоты включают связанные нуклеиновые кислоты. Нуклеиновые кислоты могут быть связаны вместе с применением любой связи между нуклеиновыми кислотами. Два основных класса групп, связывающих между собой нуклеиновые кислоты, определяются наличием или отсутствием атома фосфора. Типичные фосфорсодержащие связи между нуклеиновыми кислотами содержаться без ограничения в фосфодиэфирах, фосфотриэфирах, метилфосфонатах, фосфорамидатах и фосфоротиоатах (P=S). Типичные не содержащие фосфор группы, связывающие между собой нуклеиновые кислоты, включают без ограничения метиленметилимино (-CH2-N(CH3)-O-CH2-), тиодиэфир (-O-C(O)-S-), тионокарбамат (-O-C(O)(NH)-S-); силоксан (-O-Si(H)2-O-) и N, N*-диметилгидразин (-CH2-N(CH3)-N(CH3)). В определенных вариантах осуществления связи между нуклеиновыми кислотами, имеющие хиральный атом, можно получить в виде рацемической смеси, в виде отдельных энантиомеров, например, алкилфосфонатов и фосфоротиоатов. Неприродные нуклеиновые кислоты могут содержать одну модификацию. Неприродные нуклеиновые кислоты могут содержать несколько модификаций в одном из фрагментов или между различными фрагментами.
Модификации фосфата остова в нуклеиновой кислоте включают без ограничения метилфосфонат, фосфоротиоат, фосфорамидат (мостиковый или не мостиковый), фосфотриэфир, фосфородитиоат, фосфодитиоат и боранофосфат и могут применяться в любой комбинации. Другие нефосфатные связи также можно применять.
В некоторых вариантах осуществления модификации остова (например, метилфосфонатные, фосфоротиоатные, фосфорамидатные и фосфородитиоатные межнуклеотидные связи) могут придавать иммуномодулирующую активность модифицированной нуклеиновой кислоте и/или повышать ее стабильность in vivo.
В некоторых случаях производное фосфора (или модифицированная фосфатная группа) присоединена к сахарному фрагменту или фрагменту аналога сахаров и может представлять собой монофосфат, дифосфат, трифосфат, алкилфосфонат, фосфоротиоат, фосфородитиоат, фосфорамидат или тому подобное. Иллюстративные полинуклеотиды, содержащие модифицированные фосфатные связи или нефосфатные связи, можно найти в Peyrottes et al., 1996, Nucleic Acids Res. 24: 1841-1848; Chaturvedi et al., 1996, Nucleic Acids Res. 24:2318-2323; и Schultz et al., (1996) Nucleic Acids Res. 24:2966-2973; Matteucci, 1997, "Oligonucleotide Analogs: an Overview" in Oligonucleotides as Therapeutic Agents, (Chadwick and Cardew, ed.) John Wiley and Sons, New York, NY; Zon, 1993, "Oligonucleoside Phosphorothioates" в Protocols for Oligonucleotides and Analogs, Synthesis and Properties, Humana Press, pp. 165-190; Miller et al., 1971, JACS 93:6657-6665; Jager et al., 1988, Biochem. 27:7247-7246; Nelson et al., 1997, JOC 62:7278-7287; патент США № 5453496 и Micklefield, 2001, Curr. Med. Chem. 8: 1157-1179.
В некоторых случаях модификация остова включает замену фосфодиэфирной связи альтернативным фрагментом, таким как анионная, нейтральная или катионная группа. Примеры таких модификаций включают анионную межнуклеозидную связь; модификацию фосфорамидата N3'-P5'; боранофосфатную ДНК; проолигонуклеотиды; нейтральные межнуклеозидные связи, такие как метилфосфонаты; ДНК с амидной связью; метиленовые(метилимино) связи; формацетальные и тиоформацетальные связи; остовы, содержащие сульфонильные группы; морфолиноолигонуклеотиды; пептидные нуклеиновые кислоты (PNA) и положительно заряженные дезоксирибонуклеиновые гуанидиновые (DNG) олигонуклеотиды (Micklefield, 2001, Current Medicinal Chemistry 8: 1157-1179). Модифицированная нуклеиновая кислота может содержать химерный или смешанный остов, содержащий одну или несколько модификаций, например, комбинацию фосфатных связей, такую как комбинация фосфодиэфирных и фосфоротиоатных связей.
Заместители для фосфата включают, например, алкильные или циклоалкильные межнуклеозидные связи с короткой цепью, смешанные гетероатомные и алкильные или циклоалкильные межнуклеозидные связи или одну или несколько гетероатомных или гетероциклических межнуклеозидных связей с короткой цепью. К ним относятся те, которые имеют морфолиновые связи (образованные частично из сахарной части нуклеозида); силоксановые остовы; сульфидные, сульфоксидные и сульфоновые остовы; формацетильные и тиоформацетильные остовы; метиленформацетильные и тиоформацетильные остовы; алкенсодержащие остовы; сульфаматные остовы; метилениминовые и метиленгидразиновые остовы; сульфонатные и сульфонамидные остовы; амидные остовы и другие, имеющие смешанные части компонентов N, O, S и CH2. Во многих патентах США раскрывают, как получать и применять эти типы заменителей фосфата, и они включают без ограничения патенты США №№ 5034506; 5166315; 5185444; 5214134; 5216141; 5235033; 5264562; 5264564; 5405938; 5434257; 5466677; 5470967; 5489677; 5541307; 5561225; 5596086; 5602240; 5610289; 5602240; 5608046; 5610289; 5618704; 5623070; 5663312; 5633360; 5677437 и 5677439. Также понятно, что при замене нуклеотида можно заменить как сахарный, так и фосфатный фрагменты нуклеотида, например, с помощью связи амидного типа (аминоэтилглицин) (PNA). В патентах США №№ 5539082; 5714331 и 5719262 описывается, как получать и применять молекулы PNA, каждый из которых включен в данный документ посредством ссылки. См. также Nielsen et al., Science, 1991, 254, 1497-1500. Также возможно связать другие типы молекул (конъюгатов) с нуклеотидами или аналогами нуклеотидов, чтобы усилить, например, клеточный захват. Конъюгаты могут быть химически связаны с нуклеотидами или аналогами нуклеотидов. Такие конъюгаты включают без ограничения липидные фрагменты, такие как холестериновый фрагмент (Letsinger et al., Proc. Natl. Acad. Sci. USA, 1989, 86, 6553-6556), холиновую кислоту (Manoharan et al., Bioorg. Med. Chem. Let., 1994, 4, 1053-1060), простой тиоэфир, например, гексил-S-тритилтиол (Manoharan et al., Ann. KY. Acad. Sci., 1992, 660, 306-309; Manoharan et al., Bioorg. Med. Chem. Let., 1993, 3, 2765-2770), тиохолестерин (Oberhauser et al., Nucl. Acids Res., 1992, 20, 533-538), алифатическую цепь, например, додекандиоловые или ундециловые остатки (Saison-Behmoaras et al., EM5OJ, 1991, 10, 1111-1118; Kabanov et al., FEBS Lett., 1990, 259, 327-330; Svinarchuk et al., Biochimie, 1993, 75, 49-54), фосфолипид, например, ди-гексадецил-рац-глицерин или 1-ди-O-гексадецил-рац-глицеро-S-H-фосфонат триэтиламмония (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654; Shea et al., Nucl. Acids Res., 1990, 18, 3777-3783), полиаминовую или полиэтиленгликолевую цепь (Manoharan et al., Nucleosides & Nucleotides, 1995, 14, 969-973) или адамантануксусную кислоту (Manoharan et al., Tetrahedron Lett., 1995, 36, 3651-3654), пальмитиловый фрагмент (Mishra et al., Biochem. Biophys. Acta, 1995, 1264, 229-237) или октадециламиновый или гексиламинокарбонилоксихолестериновый фрагмент (Crooke et al., J. Pharmacol. Exp. Ther., 1996, 277, 923-937). Во множестве патентов США описывается получение таких конъюгатов, и они включают без ограничения патенты США №№ 4828979; 4948882; 5218105; 5525465; 5541313; 5545730; 5552538; 5578717, 5580731; 5580731; 5591584; 5109124; 5118802; 5138045; 5414077; 5486603; 5512439; 5578718; 5608046; 4587044; 4605735; 4667025; 4762779; 4789737; 4824941; 4835263; 4876335; 4904582; 4958013; 5082830; 5112963; 5214136; 5082830; 5112963; 5214136; 5245022; 5254469; 5258506; 5262536; 5272250; 5292873; 5317098; 5371241, 5391723; 5416203, 5451463; 5510475; 5512667; 5514785; 5565552; 5567810; 5574142; 5585481; 5587371; 5595726; 5597696; 5599923; 5599928 и 5688941.
Свойства спаривания оснований нуклеиновых кислот
В некоторых вариантах осуществления неприродная нуклеиновая кислота образует пару оснований с другой нуклеиновой кислотой. В некоторых вариантах осуществления стабильно интегрированная неприродная нуклеиновая кислота представляет собой неприродную нуклеиновую кислоту, которая может образовывать пару оснований с другой нуклеиновой кислотой, например, природной или неприродной нуклеиновой кислотой. В некоторых вариантах осуществления стабильно интегрированная неприродная нуклеиновая кислота представляет собой неприродную нуклеиновую кислоту, которая может образовывать пару оснований с другой неприродной нуклеиновой кислотой (неприродная пара оснований нуклеиновых кислот (UBP)). Например, первая неприродная нуклеиновая кислота может образовывать пару оснований со второй неприродной нуклеиновой кислотой. Например, одна пара неприродных нуклеотидтрифосфатов, которые могут образовывать пару оснований при встраивании в нуклеиновые кислоты, включает трифосфат d5SICS (d5SICSTP) и трифосфат dNaM (dNaMTP). Такие неприродные нуклеотиды могут иметь рибозный или дезоксирибозный сахарный фрагмент. В некоторых вариантах осуществления неприродная нуклеиновая кислота по сути не образует пару оснований с азотистыми основаниями природной нуклеиновой кислотой (A, T, G, C). В некоторых вариантах осуществления стабильно интегрированная неприродная нуклеиновая кислота может образовывать пару оснований с природной нуклеиновой кислотой.
В некоторых вариантах осуществления стабильно интегрированная неприродная нуклеиновая кислота представляет собой неприродную нуклеиновую кислоту, которая может образовывать UBP, но по сути не образует пару оснований с каждым из четырех оснований природных нуклеиновых кислот. В некоторых вариантах осуществления стабильно интегрированная неприродная нуклеиновая кислота представляет собой неприродную нуклеиновую кислоту, которая может образовывать UBP, но по сути не образует пару оснований с одной или несколькими природными нуклеиновыми кислотами. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A, T и C, но может образовывать пару оснований с G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A, T и G, но может образовывать пару оснований с C. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с C, G и A, но может образовывать пару оснований с T. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с C, G и T, но может образовывать пару оснований с A. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A и T, но может образовывать пару оснований с C и G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A и C, но может образовывать пару оснований с T и G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A и G, но может образовывать пару оснований с C и T. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с C и T, но может образовывать пару оснований с A и G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с C и G, но может образовывать пару оснований с T и G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с T и G, но может образовывать пару оснований с A и G. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с G, но может образовывать пару оснований с A, T и C. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с A, но может образовывать пару оснований с G, T и C. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с T, но может образовывать пару оснований с G, A и C. Например, стабильно интегрированная неприродная нуклеиновая кислота может по сути не образовывать пару оснований с C, но может образовывать пару оснований с G, T и A.
Иллюстративные неприродные нуклеотиды, способные образовывать неприродную пару оснований ДНК или РНК (UBP) в условиях in vivo, включают без ограничения 5SICS, d5SICS, NAM, dNaM, dTPT3 и их комбинации. В некоторых вариантах осуществления неприродные нуклеотиды включают:
 .
.
Сконструированный организм
В некоторых вариантах осуществления способы и плазмиды, раскрытые в данном документе, дополнительно применяют для получения сконструированного организма, например, организма, который включает и реплицирует неприродный нуклеотид или неприродную пару оснований нуклеиновых кислот (UBP) с улучшенным сохранением UBP, а также транскрибирует и транслирует нуклеиновую кислоту, содержащую неприродный нуклеотид или неприродную пару оснований нуклеиновых кислот, в белок, содержащий неприродный аминокислотный остаток. В некоторых случаях организм представляет собой полусинтетический организм (SSO). В некоторых случаях SSO представляет собой клетку.
В некоторых случаях применяемую клетку генетически трансформируют с помощью кассеты экспрессии, кодирующей гетерологичный белок, например, нуклеозидтрифосфатный транспортер, способный транспортировать неприродные нуклеотидтрифосфаты в клетку, модифицированный белок, связанный с транспозицией, для повышения стабильности нуклеотидтрифосфатного транспортера, систему CRISPR/Cas9 для удаления модификаций в положениях неприродного нуклеотидтрифосфата и/или полимеразу с высокой точностью для неприродной нуклеиновой кислоты, таким образом, что неприродные нуклеотиды встраиваются в нуклеиновые кислоты клетки и, например, образуют неприродные пары оснований в условиях in vivo. В некоторых случаях клетки дополнительно обладают повышенной активностью в отношении поглощения неприродных нуклеиновых кислот. В некоторых случаях клетки дополнительно обладают повышенной активностью в отношении импорта неприродных нуклеиновых кислот. В некоторых случаях клетки дополнительно обладают повышенной полимеразной активностью в отношении неприродных нуклеиновых кислот.
В некоторых вариантах осуществления Cas9 и sgRNA кодируются в отдельных плазмидах. В некоторых случаях Cas9 и sgRNA кодируются в той же плазмиде. В некоторых случаях молекула нуклеиновой кислоты, кодирующая Cas9, sgRNA или молекула нуклеиновой кислоты, содержащая неприродный нуклеотид, расположены в одной или нескольких плазмидах. В некоторых случаях Cas9 кодируется в первой плазмиде, а sgRNA и молекула нуклеиновой кислоты, содержащая неприродный нуклеотид, кодируются во второй плазмиде. В некоторых случаях Cas9, sgRNA и молекула нуклеиновой кислоты, содержащая неприродный нуклеотид, кодируются в той же плазмиде. В некоторых случаях молекула нуклеиновой кислоты содержит два или более неприродных нуклеотидов.
В некоторых случаях первую плазмиду, кодирующую Cas9 и sgRNA, и вторую плазмиду, кодирующую молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид, вводят в сконструированный микроорганизм. В некоторых случаях первую плазмиду, кодирующую Cas9, и вторую плазмиду, кодирующую sgRNA и молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид, вводят в сконструированный микроорганизм. В некоторых случаях плазмиду, кодирующую Cas9, sgRNA и молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид, вводят в сконструированный микроорганизм. В некоторых случаях молекула нуклеиновой кислоты содержит два или более неприродных нуклеотидов.
В некоторых вариантах осуществления получают живую клетку, которая встраивает в свои нуклеиновые кислоты по меньшей мере один неприродный нуклеотид и/или по меньшей мере одну неприродную пару оснований (UBP). В некоторых случаях неприродная пара оснований включает пару неприродных взаимно спаривающихся нуклеотидов, способных образовывать неприродную пару оснований в условиях in vivo, когда неприродные взаимно спаривающиеся нуклеотиды в виде соответствующих трифосфатов попадают в клетку под действием нуклеотидтрифосфатного транспортера. Клетка может быть генетически трансформирована с помощью кассеты экспрессии, кодирующей нуклеотидтрифосфатный транспортер, так что нуклеотидтрифосфатный транспортер экспрессируется и становится доступным для транспорта неприродных нуклеотидов в клетку. Клетка может быть генетически трансформирована с помощью кассеты экспрессии, кодирующей полимеразу, так что полимераза экспрессируется и доступна для встраивания неприродных нуклеотидов в нуклеиновые кислоты клетки. Клетка может представлять собой прокариотическую или эукариотическую клетку, и пара неприродных взаимно спаривающихся нуклеотидов в виде их соответствующих трифосфатов может представлять собой трифосфат d5SICS (d5SICSTP) и трифосфат dNaM (dNaMTP).
В некоторых вариантах осуществления клетки являются генетически трансформированными клетками с нуклеиновой кислотой, например, кассетой экспрессии, кодирующей нуклеотидтрифосфатный транспортер, способный транспортировать такие неприродные нуклеотиды в клетку. Клетка может содержать гетерологичный нуклеотидтрифосфатный транспортер, где гетерологичный нуклеотидтрифосфатный транспортер может транспортировать природные и неприродные нуклеотидтрифосфаты в клетку. Клетка может содержать гетерологичную полимеразу, где гетерологичная полимераза обладает активностью в отношении неприродной нуклеиновой кислоты.
В некоторых случаях способ, описанный в данном документе, также включает приведение в контакт генетически трансформированной клетки с соответствующими трифосфатными формами неприродных нуклеотидов в присутствии фосфата калия и/или ингибитора фосфатаз или нуклеотидаз. Во время или после такого контакта клетку можно помещать в жизнеобеспечивающую среду, подходящую для роста и репликации клетки. Клетку можно содержать в поддерживающей среде, так что соответствующие трифосфатные формы неприродных нуклеотидов встраиваются в нуклеиновые кислоты в клетках и проходят через по меньшей мере один цикл репликации клетки. Пара неприродных взаимно спаривающихся нуклеотидов в виде соответствующего трифосфата может содержать трифосфат d5SICS (d5SICSTP) и трифосфат dNaM (dNaMTP), при этом клетка может представлять собой E. coli, и при этом d5SICSTP и dNaMTP могут эффективно импортироваться в E. coli транспортером PtNTT2, где полимераза E. coli, такая как Pol I, может эффективно использовать неприродные трифосфаты для репликации ДНК, тем самым встраивая неприродные нуклеотиды и/или неприродные пары оснований в нуклеиновые кислоты клетки в клеточной среде.
При реализации на практике способа по настоящему изобретению специалист в данной области может получить популяцию живых и размножающихся клеток, которая содержит по меньшей мере один неприродный нуклеотид и/или по меньшей мере одну неприродную пару оснований (UBP) в пределах по меньшей мере одной нуклеиновой кислоты, содержащейся в по меньшей мере некоторых из отдельных клеток, где по меньшей мере одна нуклеиновая кислота стабильно репродуцируется в клетке и где клетка экспрессирует нуклеотидтрифосфатный транспортер, подходящий для обеспечения клеточного захвата трифосфатных форм одного или нескольких неприродных нуклеотидов при контакте с неприродным(неприродными) нуклеотидом(нуклеотидами) (например, выращивании в его(их) присутствии) в жизнеобеспечивающей среде, подходящей для роста и репликации организма.
После транспорта в клетку с помощью нуклеотидтрифосфатного транспортера неприродные спаривающиеся нуклеотиды встраиваются в нуклеиновые кислоты в клетке с помощью клеточного механизма, например, собственных ДНК- и/или РНК-полимераз клетки, гетерологичной полимеразы или полимеразы, которая была разработана с применением направленной эволюции (Chen T, Romesberg FE, FEBS Lett. 2014 Jan 21;588(2):219-29; Betz K et al., J Am Chem Soc. 2013 Dec 11;135(49):18637-43). Неприродные нуклеотиды могут быть встроены в нуклеиновые кислоты клетки, такие как геномная ДНК, геномная РНК, мРНК, структурная РНК, микроРНК и автономно реплицирующиеся нуклеиновые кислоты (например, плазмиды, вирусы или векторы).
В некоторых случаях полученные методами генной инженерии клетки получают путем введения нуклеиновых кислот, например, гетерологичных нуклеиновых кислот, в клетки. Любая клетка, описанная в данном документе, может представлять собой клетку-хозяина и может содержать вектор экспрессии. В одном варианте осуществления клетка-хозяин представляет собой прокариотическую клетку. В другом варианте осуществления клетка-хозяин представляет собой E. coli. В некоторых вариантах осуществления клетка содержит один или несколько гетерологичных полинуклеотидов. Реагенты на основе нуклеиновых кислот можно вводить в микроорганизмы с применением различных методик. Неограничивающие примеры способов, используемых для введения гетерологичных нуклеиновых кислот в различные организмы, включают трансформацию, трансфекцию, трансдукцию, электропорацию, опосредованную ультразвуком трансформацию, бомбардировку частицами и т. п. В некоторых случаях добавление молекул-носителей (например, бис-бензимдазолильных соединений, например, см. патент США № 5595899) может обеспечить увеличение захвата ДНК в клетках, которые, как правило, трудно трансформировать обычными способами. Обычные способы трансформации легко доступны специалисту в данной области техники и их можно найти в Maniatis, T., E. F. Fritsch and J. Sambrook (1982) Molecular Cloning: a Laboratory Manual; Cold Spring Harbor Laboratory, Cold Spring Harbor, N.Y.
В некоторых случаях генетическую трансформацию получают с применением прямого переноса кассеты экспрессии без ограничения в плазмидах, вирусных векторах, вирусных нуклеиновых кислотах, фаговых нуклеиновых кислотах, фагах, космидах и искусственных хромосомах или путем переноса генетического материала в клетках или носителях, таких как катионные липосомы. Такие способы доступны из уровня техники и легко адаптируются для применения в способе, описанном в данном документе. Векторы для переноса могут представлять собой любую нуклеотидную конструкцию, применяемую для доставки генов в клетки (например, плазмиду), или часть общей стратегии доставки генов, например, часть рекомбинантного ретровируса или аденовируса (Ram et al. Cancer Res. 53:83-88, (1993)). Подходящие средства для трансфекции, включая вирусные векторы, химические трансфектанты или физико-механические способы, такие как электропорация и прямая диффузия ДНК, описаны, например, у Wolff, J. A., et al., Science, 247, 1465-1468, (1990); и Wolff, J. A. Nature, 352, 815-818, (1991).
Например, нуклеотидтрифосфатный транспортер или молекулу полимеразы нуклеиновых кислот, кассету экспрессии и/или вектор можно вводить в клетку любым способом, включая без ограничения опосредованную кальцием трансформацию, электропорацию, микроинъекцию, липофекцию, бомбардировку частицами и т. п.
В некоторых случаях клетка содержит неприродные нуклеотидтрифосфаты, встроенные в одну или несколько нуклеиновых кислот в клетке. Например, клетка может представлять собой живую клетку, способную к встраиванию по меньшей мере одного неприродного нуклеотида в ДНК или РНК, содержащихся в клетке. В клетку также можно встраивать по меньшей мере одну неприродную пару оснований (UBP), содержащую пару неприродных взаимно спаривающихся нуклеотидов, в нуклеиновые кислоты внутри клетки в условиях in vivo, где неприродные взаимно спаривающиеся нуклеотиды, например, их соответствующие трифосфаты, попадают в клетку под действием нуклеотидтрифосфатного транспортера, ген которого присутствует (например, был введен) в клетку путем генетической трансформации. Например, после встраивания в нуклеиновую кислоту, содержащуюся в клетке, d5SICS и dNaM могут образовывать стабильную неприродную пару оснований, которая может стабильно репродуцироваться посредством механизма репликации ДНК организма, например, при выращивании в жизнеобеспечивающей среде, содержащей d5SICS и dNaM.
В некоторых случаях клетки способны реплицировать неприродную нуклеиновую кислоту. Такие способы могут включать генетическую трансформацию клетки с помощью кассеты экспрессии, кодирующей нуклеотидтрифосфатный транспортер, способный транспортировать в клетку в виде соответствующего трифосфата один или несколько неприродных нуклеотидов в условиях in vivo. В качестве альтернативы можно применять клетку, которая ранее была генетически трансформирована с помощью кассеты экспрессии, которая может экспрессировать закодированный нуклеотидтрифосфатный транспортер. Способ также может включать приведение в контакт или подвергание генетически трансформированной клетки воздействию фосфата калия и соответствующих трифосфатных форм по меньшей мере одного неприродного нуклеотида (например, двух взаимно спаривающихся нуклеотидов, способных образовывать неприродную пару оснований (UBP)) в поддерживающей жизнь среде, подходящей для роста и репликации клетки, и содержание трансформированной клетки в жизнеобеспечивающей среде в присутствии соответствующих трифосфатных форм по меньшей мере одного неприродного нуклеотида (например, двух взаимно спаривающихся нуклеотидов, способных образовывать неприродную пару оснований (UBP) в условиях in vivo в течение по меньшей мере одного цикла репликации клетки.
В некоторых вариантах осуществления клетка содержит стабильно встроенную неприродную нуклеиновую кислоту. Некоторые варианты осуществления предусматривают клетку (например, как E. coli), в которую стабильно встроены нуклеотиды, отличные от A, G, T и C, в нуклеиновых кислотах, содержащихся в клетке. Например, нуклеотиды, отличные от A, G, T и C, могут представлять собой d5SICS, dNaM и dTPT3, которые при встраивании в нуклеиновые кислоты клетки могут образовывать стабильную неприродную пару оснований в нуклеиновых кислотах. В одном аспекте неприродные нуклеотиды и неприродные пары оснований могут стабильно репродуцироваться с помощью аппарата репликации организма, когда организм, трансформированный геном для трифосфатного транспортера, выращивают в жизнеобеспечивающей среде, которая содержит фосфат калия и трифосфатные формы d5SICS, dNaM и dTPT3.
В некоторых случаях клетка содержит расширенный генетический алфавит. Клетка может содержать стабильно встроенную неприродную нуклеиновую кислоту. В некоторых вариантах осуществления клетка с расширенным генетическим алфавитом содержит неприродную нуклеиновую кислоту, которая может образовывать пару оснований (bp) с другой нуклеиновой кислотой, например, природной или неприродной нуклеиновой кислотой. В некоторых вариантах осуществления клетка с расширенным генетическим алфавитом содержит неприродную нуклеиновую кислоту, которая связана водородной связью с другой нуклеиновой кислотой. В некоторых вариантах осуществления клетка с расширенным генетическим алфавитом содержит неприродную нуклеиновую кислоту, которая не связана водородной связью с другой нуклеиновой кислотой, с которой она является спаренной основаниями. В некоторых вариантах осуществления клетка с расширенным генетическим алфавитом содержит неприродную нуклеиновую кислоту, которая спаривается основаниями с другой нуклеиновой кислотой посредством гидрофобных взаимодействий. В некоторых вариантах осуществления клетка с расширенным генетическим алфавитом содержит неприродную нуклеиновую кислоту, которая спаривается основаниями с другой нуклеиновой кислотой посредством взаимодействий, отличных от водородной связи. Клетка с расширенным генетическим алфавитом может представлять собой клетку, которая способна копировать гомологичную нуклеиновую кислоту с образованием нуклеиновой кислоты, предусматривающей неприродную нуклеиновую кислоту. Клетка с расширенным генетическим алфавитом может представлять собой клетку, содержащую неприродное основание нуклеиновой кислоты, спаренное с другой неприродной нуклеиновой кислотой (неприродная пара оснований нуклеиновых кислот (UBP)).
В некоторых вариантах осуществления клетки образуют неприродные пары оснований ДНК (UBP) из импортированных неприродных нуклеотидов в условиях in vivo. В некоторых вариантах осуществления фосфат калия и/или ингибиторы фосфатазной и/или нуклеотидазной активности могут облегчать транспорт неприродных нуклеиновых кислот. Способы включают применение клетки, которая экспрессирует гетерологичный нуклеотидтрифосфатный транспортер. Когда такая клетка вступает в контакт с одним или несколькими нуклеотидтрифосфатами, нуклеотидтрифосфаты транспортируются в клетку. Клетка может находиться в присутствии фосфата калия и/или ингибиторов фосфатазы и нуклеотидазы. Неприродные нуклеотидтрифосфаты могут быть встроены в нуклеиновые кислоты в клетке с помощью природного механизма клетки и, например, могут взаимно спариваться с образованием неприродных пар оснований в нуклеиновых кислотах клетки.
В некоторых вариантах осуществления UBP может быть встроена в клетку или популяцию клеток при воздействии неприродных трифосфатов. В некоторых вариантах осуществления UBP может быть встроена в клетку или популяцию клеток при по сути постоянном воздействии неприродных трифосфатов. В некоторых вариантах осуществления репликация UBP не приводит к существенному снижению скорости роста. В некоторых вариантах осуществления при репликации экспрессия гетерологичного белка, например, нуклеотидтрифосфатного транспортера, не приводит к существенному снижению скорости роста.
В некоторых вариантах осуществления индуцирование экспрессии гетерологичного гена, например, NTT, в клетке может приводить к более медленному росту клеток и увеличению поглощения неприродных нуклеиновых кислот по сравнению с ростом и поглощением клетки без индуцирования экспрессии гетерологичного гена. В некоторых вариантах осуществления индуцирование экспрессии гетерологичного гена, например, NTT, в клетке может приводить к увеличению роста клеток и увеличению поглощения неприродных нуклеиновых кислот по сравнению с ростом и поглощением клетки без индуцирования экспрессии гетерологичного гена.
В некоторых вариантах осуществления UBP встраивается во время логарифмической фазы роста. В некоторых вариантах осуществления UBP встраивается во время нелогарифмической фазы роста. В некоторых вариантах осуществления UBP встраивается во время по сути линейной фазы роста. В некоторых вариантах осуществления UBP стабильно встраивается в клетку или популяцию клеток после роста в течение некоторого периода времени. Например, UBP может стабильно встраиваться в клетку или популяцию клеток после роста в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45 или 50 или больше удвоений. Например, UBP может стабильно встраиваться в клетку или популяцию клеток после роста в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23 или 24 часов роста. Например, UBP может стабильно встраиваться в клетку или популяцию клеток после роста в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30 или 31 дня роста. Например, UBP может стабильно встраиваться в клетку или популяцию клеток после роста в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 месяцев роста. Например, UBP может стабильно встраиваться в клетку или популяцию клеток после роста в течение по меньшей мере приблизительно 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 50 лет роста.
В некоторых вариантах осуществления в клетке дополнительно применяют полимеразу, описанную в данном документе, для получения мутантной мРНК, которая содержит мутантный кодон, содержащий одно или несколько неприродных оснований нуклеиновых кислот. В некоторых случаях в клетке дополнительно применяют полимеразу, раскрытую в данном документе, для получения мутантной tRNA, которая содержит мутантный антикодон, содержащий одно или несколько неприродных оснований нуклеиновых кислот. В некоторых случаях мутантный антикодон представляет собой неприродную аминокислоту. В некоторых случаях антикодон мутантной tRNA образует пару с кодоном мутантной мРНК во время трансляции для синтеза белка, который содержит неприродную аминокислоту.
Используемый в данном документе термин "аминокислотный остаток" может относиться к молекуле, содержащей как аминогруппу, так и карбоксильную группу. Подходящие аминокислоты включают без ограничения как D-, так и L-изомеры встречающихся в природе аминокислот, а также не встречающихся в природе аминокислот, полученных посредством органического синтеза или других путей метаболизма. Используемый в данном документе термин "аминокислота" включает без ограничения α-аминокислоты, природные аминокислоты, не являющиеся природными аминокислоты и аминокислотные аналоги.
Термин "α-аминокислота" может относиться к молекуле, содержащей как аминогруппу, так и карбоксильную группу, связанную с углеродом, который обозначен как α-углерод.
Термин "β-аминокислота" может относиться к молекуле, содержащей как аминогруппу, так и карбоксильную группу в β-конфигурации.
Термин "встречающаяся в природе аминокислота" может относиться к любой из двадцати аминокислот, обычно встречающихся в пептидах, синтезируемых в природе, и известных под однобуквенными сокращениями A, R, N, C, D, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y и V.
В следующей таблице приведено краткое описание свойств природных аминокислот.
Термин "гидрофобные аминокислоты" включают небольшие гидрофобные аминокислоты и крупные гидрофобные аминокислоты. "Небольшая гидрофобная аминокислота" может представлять собой глицин, аланин, пролин и их аналоги. "Крупные гидрофобные аминокислоты" могут представлять собой валин, лейцин, изолейцин, фенилаланин, метионин, триптофан и их аналоги. "Полярные аминокислоты" могут представлять собой серин, треонин, аспарагин, глутамин, цистеин, тирозин и их аналоги. "Заряженные аминокислоты" могут представлять собой лизин, аргинин, гистидин, аспартат, глутамат и их аналоги.
"Аминокислотный аналог" может представлять собой молекулу, которая структурно аналогична аминокислоте и которая может заменить аминокислоту при образовании пептидомиметического макроцикла. Аминокислотные аналоги включают без ограничения β-аминокислоты и аминокислоты, где амино- или карбоксигруппа замещена аналогичной реакционноспособной группой (например, замещение первичного амина вторичным или третичным амином или замещение карбоксигруппы сложным эфиром).
"Не являющаяся природной аминокислота" может представлять собой аминокислоту, которая не является одной из двадцати аминокислот, обычно встречающихся в пептидах, синтезируемых в природе, и известных под однобуквенными сокращениями A, R, N, C, D, Q, E, G, H, I, L, K, M, F, P, S, T, W, Y и V.
Аминокислотные аналоги могут включать аналоги β-аминокислот. Примеры аналогов β-аминокислот включают без ограничения следующие: циклические аналоги β-аминокислот; β-аланин; (R)-β-фенилаланин; (R)-1,2,3,4-тетрагидроизохинолин-3-уксусная кислота; (R)-3-амино-4-(1-нафтил)-масляная кислота; (R)-3-амино-4-(2,4-дихлорфенил)-масляная кислота; (R)-3-амино-4-(2-хлорфенил)-масляная кислота; (R)-3-амино-4-(2-цианофенил)-масляная кислота; (R)-3-амино-4-(2-фторфенил)-масляная кислота; (R)-3-амино-4-(2-фурил)-масляная кислота; (R)-3-амино-4-(2-метилфенил)-масляная кислота; (R)-3-амино-4-(2-нафтил)-масляная кислота; (R)-3-амино-4-(2-тиенил)-масляная кислота; (R)-3-амино-4-(2-трифторметилфенил)-масляная кислота; (R)-3-амино-4-(3,4-дихлорфенил)-масляная кислота; (R)-3-амино-4-(3,4-дифторфенил)-масляная кислота; (R)-3-амино-4-(3-бензотиенил)-масляная кислота; (R)-3-амино-4-(3-хлорфенил)-масляная кислота; (R)-3-амино-4-(3-цианофенил)-масляная кислота; (R)-3-амино-4-(3-фторфенил)-масляная кислота; (R)-3-амино-4-(3-метилфенил)-масляная кислота; (R)-3-амино-4-(3-пиридил)-масляная кислота; (R)-3-амино-4-(3-тиенил)-масляная кислота; (R)-3-амино-4-(3-трифторметилфенил)-масляная кислота; (R)-3-амино-4-(4-бромфенил)-масляная кислота; (R)-3-амино-4-(4-хлорфенил)-масляная кислота; (R)-3-амино-4-(4-цианофенил)-масляная кислота; (R)-3-амино-4-(4-фторфенил)-масляная кислота; (R)-3-амино-4-(4-йодфенил)-масляная кислота; (R)-3-амино-4-(4-метилфенил)-масляная кислота; (R)-3-амино-4-(4-нитрофенил)-масляная кислота; (R)-3-амино-4-(4-пиридил)-масляная кислота; (R)-3-амино-4-(4-трифторметилфенил)-масляная кислота; (R)-3-амино-4-пентафторфенилмасляная кислота; (R)-3-амино-5-гексеновая кислота; (R)-3-амино-5-гексиновая кислота; (R)-3-амино-5-фенилпентановая кислота; (R)-3-амино-6-фенил-5-гексеновая кислота; (S)-1,2,3,4-тетрагидроизохинолин-3-уксусная кислота; (S)-3-амино-4-(1-нафтил)-масляная кислота; (S)-3-амино-4-(2,4-дихлорфенил)-масляная кислота; (S)-3-амино-4-(2-хлорфенил)-масляная кислота; (S)-3-амино-4-(2-цианофенил)-масляная кислота; (S)-3-амино-4-(2-фторфенил)-масляная кислота; (S)-3-амино-4-(2-фурил)-масляная кислота; (S)-3-амино-4-(2-метилфенил)-масляная кислота; (S)-3-амино-4-(2-нафтил)-масляная кислота; (S)-3-амино-4-(2-тиенил)-масляная кислота; (S)-3-амино-4-(2-трифторметилфенил)-масляная кислота; (S)-3-амино-4-(3,4-дихлорфенил)-масляная кислота; (S)-3-амино-4-(3,4-дифторфенил)-масляная кислота; (S)-3-амино-4-(3-бензотиенил)-масляная кислота; (S)-3-амино-4-(3-хлорфенил)-масляная кислота; (S)-3-амино-4-(3-цианофенил)-масляная кислота; (S)-3-амино-4-(3-фторфенил)-масляная кислота; (S)-3-амино-4-(3-метилфенил)-масляная кислота; (S)-3-амино-4-(3-пиридил)-масляная кислота; (S)-3-амино-4-(3-тиенил)-масляная кислота; (S)-3-амино-4-(3-трифторметилфенил)-масляная кислота; (S)-3-амино-4-(4-бромфенил)-масляная кислота; (S)-3-амино-4-(4-хлорфенил)-масляная кислота; (S)-3-амино-4-(4-цианофенил)-масляная кислота; (S)-3-амино-4-(4-фторфенил)-масляная кислота; (S)-3-амино-4-(4-йодфенил)-масляная кислота; (S)-3-амино-4-(4-метилфенил)-масляная кислота; (S)-3-амино-4-(4-нитрофенил)-масляная кислота; (S)-3-амино-4-(4-пиридил)-масляная кислота; (S)-3-амино-4-(4-трифторметилфенил)-масляная кислота; (S)-3-амино-4-пентафторфенилмасляная кислота; (S)-3-амино-5-гексеновая кислота; (S)-3-амино-5-гексиновая кислота; (S)-3-амино-5-фенилпентановая кислота; (S)-3-амино-6-фенил-5-гексеновая кислота; 1,2,5,6-тетрагидропиридин-3-карбоновая кислота; 1,2,5,6-тетрагидропиридин-4-карбоновая кислота; 3-амино-3-(2-хлорфенил)-пропионовая кислота; 3-амино-3-(2-тиенил)-пропионовая кислота; 3-амино-3-(3-бромфенил)-пропионовая кислота; 3-амино-3-(4-хлорфенил)-пропионовая кислота; 3-амино-3-(4-метоксифенил)-пропионовая кислота; 3-амино-4,4,4-трифтормасляная кислота; 3-аминоадипиновая кислота; D-β-фенилаланин; β-лейцин; L-β-гомоаланин; γ-бензиловый эфир L-β-гомоаспарагиновой кислоты; Δ-бензиловый эфир L-β-гомоглутаминовой кислоты; L-β-гомоизолейцин; L-β-гомолейцин; L-β-гомометионин; L-β-гомофенилаланин; L-β-гомопролин; L-β-гомотриптофан; L-β-гомовалин; L-Nω-бензилоксикарбонил-β-гомолизин; Nω-L-β-гомоаргинин; O-бензил-L-β-гомогидроксипролин; O-бензил-L-β-гомосерин; O-бензил-L-β-гомотреонин; O-бензил-L-β-гомотирозин; γ-тритил-L-β-гомоаспарагин; (R)-β-фенилаланин; γ-трет-бутиловый эфир L-β-гомоаспарагиновой кислоты; Δ-трет-бутиловый эфир L-β-гомоглутаминовой кислоты; L-Nω-β-гомолизин; NΔ-тритил-L-β-гомоглутамин; Nω-2,2,4,6,7-пентаметилдигидробензофуран-5-сульфонил-L-β-гомоаргинин; O-трет-бутил-L-β-гомогидроксипролин; O-трет-бутил-L-β-гомосерин; O-трет-бутил-L-β-гомотреонин; O-трет-бутил-L-β-гомотирозин; 2-аминоциклопентанкарбоновая кислота и 2-аминоциклогексанкарбоновая кислота.
Аминокислотные аналоги могут включать аналоги аланина, валина, глицина или лейцина. Примеры аминокислотных аналогов аланина, валина, глицина и лейцина включают без ограничения следующие: α-метоксиглицин; α-аллил-L-аланин; α-аминоизомасляная кислота; α-метиллейцин; β-(1-нафтил)-D-аланин; β-(1-нафтил)-L-аланин; β-(2-нафтил)-D-аланин; β-(2-нафтил)-L-аланин; β-(2-пиридил)-D-аланин; β-(2-пиридил)-L-аланин; β-(2-тиенил)-D-аланин; β-(2-тиенил)-L-аланин; β-(3-бензотиенил)-D-аланин; β-(3-бензотиенил)-L-аланин; β-(3-пиридил)-D-аланин; β-(3-пиридил)-L-аланин; β-(4-пиридил)-D-аланин; β-(4-пиридил)-L-аланин; β-хлор-L-аланин; β-циано-L-аланин; β-циклогексил-D-аланин; β-циклогексил-L-аланин; β-циклопентен-1-илаланин; β-циклопентилаланин; дициклогексиламмониевая соль β-циклопропил-L-Ala-OH; β-трет-бутил-D-аланин; β-трет-бутил-L-аланин; γ-аминомасляная кислота; L-α,β-диаминопропионовая кислота; 2,4-динитрофенилглицин; 2,5-дигидро-D-фенилглицин; 2-амино-4,4,4-трифтормасляная кислота; 2-фторфенилглицин; 3-амино-4,4,4-трифтормасляная кислота; 3-фторвалин; 4,4,4-трифторвалин; дициклогексиламмониевая соль 4,5-дегидро-L-leu-OH; 4-фтор-D-фенилглицин; 4-фтор-L-фенилглицин; 4-гидрокси-D-фенилглицин; 5,5,5-трифторлейцин; 6-аминогексановая кислота; дициклогексиламмониевая соль циклопентил-D-Gly-OH; дициклогексиламмониевая соль циклопентил-Gly-OH; D-α,β-диаминопропионовая кислота; D-α-аминомасляная кислота; D-α-трет-бутилглицин; D-(2-тиенил)глицин; D-(3-тиенил)глицин; D-2-аминокапроновая кислота; D-2-инданилглицин; D-аллилглициндициклогексиламмониевая соль; D-циклогексилглицин; D-норвалин; D-фенилглицин; β-аминомасляная кислота; β-аминоизомасляная кислота; (2-бромфенил)глицин; (2-метоксифенил)глицин; (2-метилфенил)глицин; (2-тиазоил)глицин; (2-тиенил)глицин; 2-амино-3-(диметиламино)-пропионовая кислота; L-α,β-диаминопропионовая кислота; L-α-аминомасляная кислота; L-α-трет-бутилглицин; L-(3-тиенил)глицин; L-2-амино-3-(диметиламино)-пропионовая кислота; дициклогексиламмониевая соль L-2-аминокапроновой кислоты; L-2-инданилглицин; дициклогексиламмониевая соль L-аллилглицина; L-циклогексилглицин; L-фенилглицин; L-пропаргилглицин; L-норвалин; N-α-аминометил-L-аланин; D-α,γ-диаминомасляная кислота; L-α,γ-диаминомасляная кислота; β-циклопропил-L-аланин; (N-β-(2,4-динитрофенил))-L-α,β-диаминопропионовая кислота; (N-β-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-D-α,β-диаминопропионовая кислота; (N-β-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-L-α,β-диаминопропионовая кислота; (N-β-4-метилтритил)-L-α,β-диаминопропионовая кислота; (N-β-аллилоксикарбонил)-L-α,β-диаминопропионовая кислота; (N-γ-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-D-α,γ-диаминомасляная кислота; (N-γ-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-L-α,γ-диаминомасляная кислота; (N-γ-4-метилтритил)-D-α,γ-диаминомасляная кислота; (N-γ-4-метилтритил)-L-α,γ-диаминомасляная кислота; (N-γ-аллилоксикарбонил)-L-α,γ-диаминомасляная кислота; D-α,γ-диаминомасляная кислота; 4,5-дегидро-L-лейцин; циклопентил-D-Gly-OH; циклопентил-Gly-OH; D-аллилглицин; D-гомоциклогексилаланин; L-1-пиренилаланин; L-2-аминокапроновая кислота; L-аллилглицин; L-гомоциклогексилаланин и N-(2-гидрокси-4-метокси-Bzl)-Gly-OH.
Аминокислотные аналоги могут включать аналоги аргинина или лизина. Примеры аминокислотных аналогов аргинина и лизина включают без ограничения следующие: цитруллин; L-2-амино-3-гуанидинпропионовая кислота; L-2-амино-3-уреидопропионовая кислота; L-цитруллин; Lys(Me)2-OH; Lys(N3)-OH; NΔ-бензилоксикарбонил-L-орнитин; Nω-нитро-D-аргинин; Nω-нитро-L-аргинин; α-метилорнитин; 2,6-диаминогептандикарбоновая кислота; L-орнитин; (NΔ-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-D-орнитин; (NΔ-1-(4,4-диметил-2,6-диоксоциклогекс-1-илиден)этил)-L-орнитин; (NΔ-4-метилтритил)-D-орнитин; (NΔ-4-метилтритил)-L-орнитин; D-орнитин; L-орнитин; Arg(Me)(Pbf)-OH; Arg(Me)2-OH (асимметричный); Arg(Me)2-OH (симметричный); Lys(ivDde)-OH; Lys(Me)2-OH·HCl; хлорид Lys(Me3)-OH; Nω-нитро-D-аргинин и Nω-нитро-L-аргинин.
Аминокислотные аналоги могут включать аналоги аспарагиновой или глутаминовой кислот. Примеры аминокислотных аналогов аспарагиновой и глутаминовой кислот включают без ограничения следующие: α-метил-D-аспарагиновая кислота; α-метилглутаминовая кислота; α-метил-L-аспарагиновая кислота; γ-метиленглутаминовая кислота; (N-γ-этил)-L-глутамин; [N-α-(4-аминобензоил)]-L-глутаминовая кислота; 2,6-диаминопимелиновая кислота; L-α-аминосубериновая кислота; D-2-аминоадипиновая кислота; D-α-аминосубериновая кислота; α-аминопимелиновая кислота; иминодиуксусная кислота; L-2-аминоадипиновая кислота; трео-β-метиласпарагиновая кислота; γ,γ-ди-трет-бутиловый эфир γ-карбокси-D-глутаминовой кислоты; γ,γ-ди-трет-бутиловый эфир γ-карбокси-L-глутаминовой кислоты; Glu(OAll)-OH; L-Asu(OtBu)-OH и пироглутаминовая кислота.
Аминокислотные аналоги могут включать аналоги цистеина и метионина. Примеры аминокислотных аналогов цистеина и метионина включают без ограничения Cys(фарнезил)-OH, Cys(фарнезил)-OMe, α-метилметионин, Cys(2-гидроксиэтил)-OH, Cys(3-аминопропил)-OH, 2-амино-4-(этилтио)-масляную кислоту, бутионин, бутионинсульфоксимин, этионин, метилметионинсульфония хлорид, селенометионин, цистеиновую кислоту, [2-(4-пиридил)этил]-DL-пеницилламин, [2-(4-пиридил)этил]-L-цистеин, 4-метоксибензил-D-пеницилламин, 4-метоксибензил-L-пеницилламин, 4-метилбензил-D-пеницилламин, 4-метилбензил-L-пеницилламин, бензил-D-цистеин, бензил-L-цистеин, бензил-DL-гомоцистеин, карбамоил-L-цистеин, карбоксиэтил-L-цистеин, карбоксиметил-L-цистеин, дифенилметил-L-цистеин, этил-L-цистеин, метил-L-цистеин, трет-бутил-D-цистеин, тритил-L-гомоцистеин, тритил-D-пеницилламин, цистатионин, гомоцистин, L-гомоцистин, (2-аминоэтил)-L-цистеин, селено-L-цистин, цистатионин, Cys(StBu)-OH и ацетамидометил-D-пеницилламин.
Аминокислотные аналоги могут включать аналоги фенилаланина и тирозина. Примеры аминокислотных аналогов фенилаланина и тирозина включают β-метилфенилаланин, β-гидроксифенилаланин, α-метил-3-метокси-DL-фенилаланин, α-метил-D-фенилаланин, α-метил-L-фенилаланин, 1,2,3,4-тетрагидроизохинолин-3-карбоновую кислоту, 2,4-дихлорфенилаланин, 2-(трифторметил)-D-фенилаланин, 2-(трифторметил)-L-фенилаланин, 2-бром-D-фенилаланин, 2-бром-L-фенилаланин, 2-хлор-D-фенилаланин, 2-хлор-L-фенилаланин, 2-циано-D-фенилаланин, 2-циано-L-фенилаланин, 2-фтор-D-фенилаланин, 2-фтор-L-фенилаланин, 2-метил-D-фенилаланин, 2-метил-L-фенилаланин, 2-нитро-D-фенилаланин, 2-нитро-L-фенилаланин, 2;4;5-тригидроксифенилаланин, 3,4,5-трифтор-D-фенилаланин, 3,4,5-трифтор-L-фенилаланин, 3,4-дихлор-D-фенилаланин, 3,4-дихлор-L-фенилаланин, 3,4-дифтор-D-фенилаланин, 3,4-дифтор-L-фенилаланин, 3,4-дигидрокси-L-фенилаланин, 3,4-диметокси-L-фенилаланин, 3,5,3′-трийод-L-тиронин, 3,5-дийод-D-тирозин, 3,5-дийод-L-тирозин, 3,5-дийод-L-тиронин, 3-(трифторметил)-D-фенилаланин, 3-(трифторметил)-L-фенилаланин, 3-амино-L-тирозин, 3-бром-D-фенилаланин, 3-бром-L-фенилаланин, 3-хлор-D-фенилаланин, 3-хлор-L-фенилаланин, 3-хлор-L-тирозин, 3-циано-D-фенилаланин, 3-циано-L-фенилаланин, 3-фтор-D-фенилаланин, 3-фтор-L-фенилаланин, 3-фтортирозин, 3-йод-D-фенилаланин, 3-йод-L-фенилаланин, 3-йод-L-тирозин, 3-метокси-L-тирозин, 3-метил-D-фенилаланин, 3-метил-L-фенилаланин, 3-нитро-D-фенилаланин, 3-нитро-L-фенилаланин, 3-нитро-L-тирозин, 4-(трифторметил)-D-фенилаланин, 4-(трифторметил)-L-фенилаланин, 4-амино-D-фенилаланин, 4-амино-L-фенилаланин, 4-бензоил-D-фенилаланин, 4-бензоил-L-фенилаланин, 4-бис(2-хлорэтил)амино-L-фенилаланин, 4-бром-D-фенилаланин, 4-бром-L-фенилаланин, 4-хлор-D-фенилаланин, 4-хлор-L-фенилаланин, 4-циано-D-фенилаланин, 4-циано-L-фенилаланин, 4-фтор-D-фенилаланин, 4-фтор-L-фенилаланин, 4-йод-D-фенилаланин, 4-йод-L-фенилаланин, гомофенилаланин, тироксин, 3,3-дифенилаланин, тиронин, этилтирозин и метилтирозин.
Аминокислотные аналоги могут включать аналоги пролина. Примеры аминокислотных аналогов пролина включают без ограничения 3,4-дегидропролин, 4-фторпролин, цис-4-гидроксипролин, тиазолидин-2-карбоновую кислоту и транс-4-фторпролин.
Аминокислотные аналоги могут включать аналоги серина и треонина. Примеры аминокислотных аналогов серина и треонина включают без ограничения 3-амино-2-гидрокси-5-метилгексановую кислоту, 2-амино-3-гидрокси-4-метилпентановую кислоту, 2-амино-3-этоксибутановую кислоту, 2-амино-3-метоксибутановую кислоту, 4-амино-3-гидрокси-6-метилгептановую кислоту, 2-амино-3-бензилоксипропионовую кислоту, 2-амино-3-бензилоксипропионовую кислоту, 2-амино-3-этоксипропионовую кислоту, 4-амино-3-гидроксибутановую кислоту и α-метилсерин.
Аминокислотные аналоги могут включать аналоги триптофана. Примеры аминокислотных аналогов триптофана включают без ограничения следующие: α-метилтриптофан; β-(3-бензотиенил)-D-аланин; β-(3-бензотиенил)-L-аланин; 1-метилтриптофан; 4-метилтриптофан; 5-бензилокситриптофан; 5-бромтриптофан; 5-хлортриптофан; 5-фтортриптофан; 5-гидрокситриптофан; 5-гидрокси-L-триптофан; 5-метокситриптофан; 5-метокси-L-триптофан; 5-метилтриптофан; 6-бромтриптофан; 6-хлор-D-триптофан; 6-хлортриптофан; 6-фтортриптофан; 6-метилтриптофан; 7-бензилокситриптофан; 7-бромтриптофан; 7-метилтриптофан; D-1,2,3,4-тетрагидроноргарман-3-карбоновая кислота; 6-метокси-1,2,3,4-тетрагидроноргарман-1-карбоновая кислота; 7-азатриптофан; L-1,2,3,4-тетрагидроноргарман-3-карбоновая кислота; 5-метокси-2-метилтриптофан и 6-хлор-L-триптофан.
Аминокислотные аналоги могут быть рацемическими. В некоторых случаях применяют D-изомер аминокислотного аналога. В некоторых случаях применяют L-изомер аминокислотного аналога. В некоторых случаях аминокислотный аналог содержит хиральные центры, которые находятся в R- или S-конфигурации. Иногда аминогруппа(аминогруппы) аналога β-аминокислоты замещена защитной группой, например, трет-бутилоксикарбонилом (группой BOC), 9-флуоренилметилоксикарбонилом (FMOC), тозилом и т. п. Иногда функциональная группа карбоновой кислоты аналога β-аминокислоты защищена и находится, например, в виде ее сложноэфирного производного. В некоторых случаях применяют соль аналога аминокислоты.
В некоторых вариантах осуществления неприродная аминокислота представляет собой неприродную аминокислоту, описанную в Liu C.C., Schultz, P.G. Annu. Rev. Biochem. 2010, 79, 413. В некоторых вариантах осуществления неприродная аминокислота включает N6(2-азидоэтокси)-карбонил-L-лизин.
Типы клеток
В некоторых вариантах осуществления многие типы клеток/микроорганизмов применяют, например, для трансформации или генной инженерии. В некоторых вариантах осуществления клетка представляет собой прокариотическую или эукариотическую клетку. В некоторых случаях клетка представляет собой микроорганизм, такой как бактериальная клетка, клетка гриба, дрожжи или одноклеточное простейшее. В других случаях клетка представляет собой эукариотическую клетку, такую как культивируемая клетка животного, растения или человека. В дополнительных случаях клетка присутствует в организме, таком как растение или животное.
В некоторых вариантах осуществления сконструированный микроорганизм представляет собой одноклеточный организм, часто способный делиться и пролиферировать. Микроорганизм может иметь один или несколько из следующих признаков: аэроб, анаэроб, нитчатый, ненитчатый, моноплоидный, диплоидный, ауксотрофный и/или неауксотрофный. В некоторых вариантах осуществления сконструированный микроорганизм представляет собой прокариотический микроорганизм (например, бактерию), и в определенных вариантах осуществления сконструированный микроорганизм представляет собой микроорганизм, не являющийся прокариотическим. В некоторых вариантах осуществления сконструированный микроорганизм представляет собой эукариотический микроорганизм (например, дрожжи, грибы, амебу). В некоторых вариантах осуществления сконструированный микроорганизм представляет собой гриб. В некоторых вариантах осуществления сконструированный организм представляет собой дрожжи.
Любые подходящие дрожжи могут быть выбраны в качестве микроорганизма-хозяина, сконструированного микроорганизма, генетически модифицированного организма или источника гетерологичного или модифицированного полинуклеотида. Дрожжи включают без ограничения дрожжи Yarrowia (например, Y. lipolytica (ранее классифицированные как Candida lipolytica)), дрожжи Candida (например, C. revkaufi, C. viswanathii, C. pulcherrima, C. tropicalis, C. utilis), дрожжи Rhodotorula (например, R. glutinus, R. graminis), дрожжи Rhodosporidium (например, R. toruloides), дрожжи Saccharomyces (например, S. cerevisiae, S. bayanus, S. pastorianus, S. carlsbergensis), дрожжи Cryptococcus, дрожжи Trichosporon (например, T. pullans, T. cutaneum), дрожжи Pichia (например, P. pastoris) и дрожжи Lipomyces (например, L. starkeyii, L. lipoferus). В некоторых вариантах осуществления подходящие дрожжи происходят из рода Arachniotus, Aspergillus, Aureobasidium, Auxarthron, Blastomyces, Candida, Chrysosporuim, Chrysosporuim, Debaryomyces, Coccidiodes, Cryptococcus, Gymnoascus, Hansenula, Histoplasma, Issatchenkia, Kluyveromyces, Lipomyces, Lssatchenkia, Microsporum, Myxotrichum, Myxozyma, Oidiodendron, Pachysolen, Penicillium, Pichia, Rhodosporidium, Rhodotorula, Rhodotorula, Saccharomyces, Schizosaccharomyces, Scopulariopsis, Sepedonium, Trichosporon или Yarrowia. В некоторых вариантах осуществления подходящие дрожжи относятся к виду Arachniotus flavoluteus, Aspergillus flavus, Aspergillus fumigatus, Aspergillus niger, Aureobasidium pullulans, Auxarthron thaxteri, Blastomyces dermatitidis, Candida albicans, Candida dubliniensis, Candida famata, Candida glabrata, Candida guilliermondii, Candida kefyr, Candida krusei, Candida lambica, Candida lipolytica, Candida lustitaniae, Candida parapsilosis, Candida pulcherrima, Candida revkaufi, Candida rugosa, Candida tropicalis, Candida utilis, Candida viswanathii, Candida xestobii, Chrysosporuim keratinophilum, Coccidiodes immitis, Cryptococcus albidus var. diffluens, Cryptococcus laurentii, Cryptococcus neofomans, Debaryomyces hansenii, Gymnoascus dugwayensis, Hansenula anomala, Histoplasma capsulatum, Issatchenkia occidentalis, Isstachenkia orientalis, Kluyveromyces lactis, Kluyveromyces marxianus, Kluyveromyces thermotolerans, Kluyveromyces waltii, Lipomyces lipoferus, Lipomyces starkeyii, Microsporum gypseum, Myxotrichum deflexum, Oidiodendron echinulatum, Pachysolen tannophilis, Penicillium notatum, Pichia anomala, Pichia pastoris, Pichia stipitis, Rhodosporidium toruloides, Rhodotorula glutinus, Rhodotorula graminis, Saccharomyces cerevisiae, Saccharomyces kluyveri, Schizosaccharomyces pombe, Scopulariopsis acremonium, Sepedonium chrysospermum, Trichosporon cutaneum, Trichosporon pullans, Yarrowia lipolytica или Yarrowia lipolytica (ранее классифицированные как Candida lipolytica). В некоторых вариантах осуществления дрожжи представляют собой один из штаммов Y. lipolytica, которые включают без ограничения штаммы ATCC20362, ATCC8862, ATCC18944, ATCC20228, ATCC76982 и LGAM S(7)1 (Papanikolaou S., and Aggelis G., Bioresour. Technol. 82(1):43-9 (2002)). В определенных вариантах осуществления дрожжи представляют собой дрожжи вида Candida (т. e., Candida spp.). Любые подходящие виды Candida можно применять и/или генетически модифицировать для получения жирной дикарбоновой кислоты (например, октандикарбоновой кислоты, декандикарбоновой кислоты, додекандикарбоновой кислоты, тетрадекандикарбоновой кислоты, гексадекандикарбоновой кислоты, октадекандикарбоновой кислоты, эйкозандикарбоновой кислоты). В некоторых вариантах осуществления подходящие виды Candida включают без ограничения Candida albicans, Candida dubliniensis, Candida famata, Candida glabrata, Candida guilliermondii, Candida kefyr, Candida krusei, Candida lambica, Candida lipolytica, Candida lustitaniae, Candida parapsilosis, Candida pulcherrima, Candida revkaufi, Candida rugosa, Candida tropicalis, Candida utilis, Candida viswanathii, Candida xestobii и любые другие дрожжи Candida spp., описанные в данном документе. Неограничивающие примеры штаммов Candida spp. включают без ограничения штаммы sAA001 (ATCC20336), sAA002 (ATCC20913), sAA003 (ATCC20962), sAA496 (US2012/0077252), sAA106 (US2012/0077252), SU-2 (ura3-/ura3-), H5343 (блокировано бета-окисление; патент США № 5648247). Любые подходящие штаммы дрожжей Candida spp. можно применять в качестве родительских штаммов для генетической модификации.
Роды, виды и штаммы дрожжей часто являются настолько близкородственными по генетическому составу, что их трудно различить, классифицировать и/или назвать. В некоторых случаях штаммы C. lipolytica и Y. lipolytica трудно различить, классифицировать и/или назвать, и в некоторых случаях их можно принять за тот же организм. В некоторых случаях различные штаммы C. tropicalis и C. viswanathii трудно различить, классифицировать и/или назвать (например, см. Arie et.al., J. Gen. Appl.Microbiol., 46, 257-262 (2000). Некоторые штаммы C. tropicalis и C. viswanathii, полученные из ATCC, а также из других коммерческих или академических источников, могут считаться эквивалентными и одинаково подходящими для вариантов осуществления, описанных в данном документе. В некоторых вариантах осуществления считается, что некоторые родительские штаммы C. tropicalis и C. viswanathii отличаются только названием.
Любой подходящий гриб может быть выбран в качестве микроорганизма-хозяина, сконструированного микроорганизма или источника гетерологичного полинуклеотида. Неограничивающие примеры грибов включают без ограничения грибы Aspergillus (например, A. parasiticus, A. nidulans), грибы Thraustochytrium, грибы Schizochytrium и грибы Rhizopus (например, R. arrhizus, R. oryzae, R. nigricans). В некоторых вариантах осуществления гриб относится к штамму A. parasiticus, который включает без ограничения штамм ATCC24690, и в определенных вариантах осуществления гриб относится к штамму A. nidulans, который включает без ограничения штамм ATCC38163.
Любой подходящий прокариот может быть выбран в качестве микроорганизма-хозяина, сконструированного микроорганизма или источника гетерологичного полинуклеотида. Могут быть выбраны грамотрицательные или грамположительные бактерии. Примеры бактерий включают без ограничения бактерии Bacillus (например, B. subtilis, B. megaterium), бактерии Acinetobacter, бактерии Norcardia, бактерии Xanthobacter, бактерии Escherichia (например, E. coli (например, штаммы DH10B, Stbl2, DH5-alpha, DB3, DB3.1, DB4, DB5, JDP682 и ccdA-over (например, заявка на патент США № 09/518188))), бактерии Streptomyces, бактерии Erwinia, бактерии Klebsiella, бактерии Serratia (например, S. marcessans), бактерии Pseudomonas (например, P. aeruginosa), бактерии Salmonella (например, S. typhimurium, S. typhi), бактерии Megasphaera (например, Megasphaera elsdenii). Бактерии также включают без ограничения фотосинтезирующие бактерии (например, зеленые бактерии, не относящиеся к серобактериям (например, бактерии Choroflexus (например, C. aurantiacus), бактерии Chloronema (например, C. gigateum)), зеленые серобактерии (например, бактерии Chlorobium (например, C. limicola), бактерии Pelodictyon (например, P. luteolum), пурпурные серобактерии (например, бактерии Chromatium (например, C. okenii)) и пурпурные бактерии, не относящиеся к серобактериям (например, бактерии Rhodospirillum (например, R. rubrum), бактерии Rhodobacter (например, R. sphaeroides, R. capsulatus) и бактерии Rhodomicrobium (например, R. vanellii)).
Клетки из организмов, не относящихся к микробным, можно применять в качестве микроорганизма-хозяина, сконструированного микроорганизма или источника гетерологичного полинуклеотида. Примеры таких клеток включают без ограничения клетки насекомых (например, Drosophila (например, D. melanogaster), Spodoptera (например, клетки Sf9 или Sf21 из S. frugiperda) и Trichoplusa (например, клетки High-Five); клетки нематоды (например, клетки C. elegans); клетки птиц; клетки амфибий (например, клетки Xenopus laevis); клетки рептилий; клетки млекопитающих (например, клетки NIH3T3, 293, CHO, COS, VERO, C127, BHK, Per-C6, меланомы Боуэса и HeLa) и клетки растений (например, Arabidopsis thaliana, Nicotania tabacum, Cuphea acinifolia, Cuphea aequipetala, Cuphea angustifolia, Cuphea appendiculata, Cuphea avigera, Cuphea avigera var. pulcherrima, Cuphea axilliflora, Cuphea bahiensis, Cuphea baillonis, Cuphea brachypoda, Cuphea bustamanta, Cuphea calcarata, Cuphea calophylla, Cuphea calophylla subsp. mesostemon, Cuphea carthagenensis, Cuphea circaeoides, Cuphea confertiflora, Cuphea cordata, Cuphea crassiflora, Cuphea cyanea, Cuphea decandra, Cuphea denticulata, Cuphea disperma, Cuphea epilobiifolia, Cuphea ericoides, Cuphea flava, Cuphea flavisetula, Cuphea fuchsiifolia, Cuphea gaumeri, Cuphea glutinosa, Cuphea heterophylla, Cuphea hookeriana, Cuphea hyssopifolia (мексиканский вереск), Cuphea hyssopoides, Cuphea ignea, Cuphea ingrata, Cuphea jorullensis, Cuphea lanceolata, Cuphea linarioides, Cuphea llavea, Cuphea lophostoma, Cuphea lutea, Cuphea lutescens, Cuphea melanium, Cuphea melvilla, Cuphea micrantha, Cuphea micropetala, Cuphea mimuloides, Cuphea nitidula, Cuphea palustris, Cuphea parsonsia, Cuphea pascuorum, Cuphea paucipetala, Cuphea procumbens, Cuphea pseudosilene, Cuphea pseudovaccinium, Cuphea pulchra, Cuphea racemosa, Cuphea repens, Cuphea salicifolia, Cuphea salvadorensis, Cuphea schumannii, Cuphea sessiliflora, Cuphea sessilifolia, Cuphea setosa, Cuphea spectabilis, Cuphea spermacoce, Cuphea splendida, Cuphea splendida var. viridiflava, Cuphea strigulosa, Cuphea subuligera, Cuphea teleandra, Cuphea thymoides, Cuphea tolucana, Cuphea urens, Cuphea utriculosa, Cuphea viscosissima, Cuphea watsoniana, Cuphea wrightii, Cuphea lanceolata).
Микроорганизмы или клетки, применяемые в качестве организмов-хозяев или источника гетерологичного полинуклеотида, являются коммерчески доступными. Микроорганизмы и клетки, описанные в данном документе, и другие подходящие микроорганизмы и клетки доступны, например, от Invitrogen Corporation (Карлсбад, Калифорния), Американской коллекции типовых культур (Манассас, Вирджиния) и Коллекции сельскохозяйственных исследовательских культур (NRRL; Пеория, Иллинойс). Микроорганизмы-хозяева и сконструированные микроорганизмы могут быть предоставлены в любой подходящей форме. Например, такие микроорганизмы могут быть предоставлены в жидкой культуре или твердой культуре (например, в среде на основе агара), которая может представлять собой первичную культуру или может быть пересеяна (например, разбавлена и культивирована) один или несколько раз. Микроорганизмы также могут быть предоставлены в замороженном виде или в сухом виде (например, лиофилизированном). Микроорганизмы могут быть предоставлены в любой подходящей концентрации.
Полимераза
Особенно применимая функция полимеразы состоит в том, чтобы катализировать полимеризацию нити нуклеиновой кислоты с применением существующей нуклеиновой кислоты в качестве матрицы. Другие применимые функции описаны в другой части данного документа. Примеры применимых полимераз включают ДНК-полимеразы и РНК-полимеразы.
Способность улучшать специфичность, процессивность или другие свойства полимераз неприродных нуклеиновых кислот была бы весьма необходима в различных контекстах, где, например, требуется встраивание неприродных нуклеиновых кислот, включая амплификацию, секвенирование, мечение, детекцию, клонирование и многие другие. В настоящем изобретении предусматриваются полимеразы с модифицированными свойствами для неприродных нуклеиновых кислот, способы получения таких полимераз, способы применения таких полимераз и многие другие признаки, которые станут очевидными после полного обзора нижеследующего.
В некоторых случаях раскрытое в данном документе включает полимеразы, которые встраивают неприродные нуклеиновые кислоты в растущую копию матрицы, например, во время амплификации ДНК. В некоторых вариантах осуществления полимеразы могут быть модифицированы таким образом, что активный сайт полимеразы модифицируется для уменьшения стерического ингибирования проникновения неприродной нуклеиновой кислоты в активный сайт. В некоторых вариантах осуществления полимеразы могут быть модифицированы для обеспечения комплементарности с одним или несколькими неприродными признаками неприродных нуклеиновых кислот. Такие полимеразы можно сконструировать или обеспечить их экспрессию в клетках для стабильного встраивания UBP в клетки. Соответственно, настоящее изобретение предусматривает композиции, которые содержат гетерологичную или рекомбинантную полимеразу, и способы их применения.
Полимеразы могут быть модифицированы с применением способов, относящихся к белковой инженерии. Например, молекулярное моделирование можно провести на основе кристаллических структур, чтобы идентифицировать местоположения в полимеразах, где можно выполнить мутации для модификации целевой активности. Остаток, идентифицированный как мишень для замены, можно заменить остатком, выбранным с применением моделирования минимизации энергии, моделирования гомологии и/или консервативных аминокислотных замен, таких как описано в Bordo, et al. J Mol Biol 217: 721-729 (1991) и Hayes, et al. Proc Natl Acad Sci, USA 99: 15926-15931 (2002).
Любую из множества полимераз можно применять в способе или композиции, изложенных в данном документе, включая, например, ферменты на основе белка, выделенные из биологических систем, и их функциональные варианты. Следует понимать, что ссылка на конкретную полимеразу, такую как полимеразы, приведенные ниже, включает ее функциональные варианты, если не указано иное. В некоторых вариантах осуществления полимераза представляет собой полимеразу дикого типа. В некоторых вариантах осуществления полимераза представляет собой модифицированную или мутантную полимеразу.
Также можно применять полимеразы со свойствами, обеспечивающими улучшение проникновения неприродных нуклеиновых кислот в области активного сайта и координации с неприродными нуклеотидами в области активного сайта. В некоторых вариантах осуществления модифицированная полимераза имеет модифицированный сайт связывания нуклеотидов.
В некоторых вариантах осуществления модифицированная полимераза характеризуется специфичностью к неприродной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к неприродной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированный сахар, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к природной нуклеиновой кислоте и/или неприродной нуклеиновой кислоте без модифицированного сахара. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированное основание, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к природной нуклеиновой кислоте и/или неприродной нуклеиновой кислоте без модифицированного основания. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей трифосфат, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к нуклеиновой кислоте, содержащей трифосфат, и/или неприродной нуклеиновой кислоте без трифосфата. Например, модифицированная полимераза или полимераза дикого типа может характеризоваться специфичностью к неприродной нуклеиновой кислоте, содержащей трифосфат, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к неприродной нуклеиновой кислоте с дифосфатом или монофосфатом, или без фосфата, или с их комбинацией.
В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется ослабленной специфичностью к неприродной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированный сахар, и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированное основание, и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности полимеразы дикого типа по отношению к природной нуклеиновой кислоте.
Отсутствие экзонуклеазной активности может быть характеристикой дикого типа или характеристикой, придаваемой вариантной или сконструированной полимеразе. Например, фрагмент Кленова exo minus является мутированной версией фрагмента Кленова, у которого отсутствует 3'-5'-корректирующая экзонуклеазная активность.
Способ по настоящему изобретению можно применять для расширения диапазона субстратов любой ДНК-полимеразы, которая не обладает собственной 3'-5'-корректирующей экзонуклеазной активностью или у которой 3'-5'-корректирующая экзонуклеазная активность была заблокирована, например, посредством мутации. Примеры ДНК-полимераз включают polA, polB (см., например, Parrel & Loeb, Nature Struc Biol 2001), polC, polD, polY, polX и обратные транскриптазы (RT), но предпочтительно представляют собой процессивные полимеразы высокой точности (PCT/GB2004/004643). В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа по сути не характеризуется 3'-5'-корректирующей экзонуклеазной активностью. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа по сути не характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении неприродной нуклеиновой кислоты. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется 3'-5'-корректирующей экзонуклеазной активностью. В некоторых вариантах осуществления модифицированная полимераза или полимераза дикого типа характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении природной нуклеиновой кислоты и по сути не характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении неприродной нуклеиновой кислоты.
В некоторых вариантах осуществления модифицированная полимераза характеризуется 3'-5'-корректирующей экзонуклеазной активностью, которая составляет по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% корректирующей экзонуклеазной активности полимеразы дикого типа. В некоторых вариантах осуществления модифицированная полимераза характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении неприродной нуклеиновой кислоты, которая составляет по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% корректирующей экзонуклеазной активности полимеразы дикого типа в отношении природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении неприродной нуклеиновой кислоты и 3'-5'-корректирующей экзонуклеазной активностью в отношении природной нуклеиновой кислоты, которая составляет по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% корректирующей экзонуклеазной активности полимеразы дикого типа в отношении природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированная полимераза характеризуется 3'-5'-корректирующей экзонуклеазной активностью в отношении природной нуклеиновой кислоты, которая составляет по меньшей мере приблизительно 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% корректирующей экзонуклеазной активности полимеразы дикого типа в отношении природной нуклеиновой кислоте.
В некоторых вариантах осуществления характеристики полимераз определяют в зависимости от скорости их диссоциации с нуклеиновыми кислотами. В некоторых вариантах осуществления полимераза характеризуется относительно низкой скоростью диссоциации для одной или нескольких природных и неприродных нуклеиновых кислот. В некоторых вариантах осуществления полимераза характеризуется относительно высокой скоростью диссоциации для одной или нескольких природных и неприродных нуклеиновых кислот. Скорость диссоциации представляет собой активность полимеразы, которую можно регулировать для настройки скоростей реакции в способах, изложенных в данном документе.
В некоторых вариантах осуществления характеристики полимераз определяют в зависимости от их точности при применении с конкретной природной и/или неприродной нуклеиновой кислотой или коллекциями природных и/или неприродных нуклеиновых кислот. Под точностью обычно понимают безошибочность, с которой полимераза встраивает надлежащие нуклеиновые кислоты в растущую цепь нуклеиновой кислоты при получении копии матрицы нуклеиновой кислоты. Точность ДНК-полимеразы может измеряться в виде соотношения надлежащих и ненадлежащих включений природной и неприродной нуклеиновой кислоты, когда присутствуют природная и неприродная нуклеиновая кислота, например, в равных концентрациях, для конкуренции за синтез нити в том же сайте двойного комплекса полимераза-нить-матрица нуклеиновой кислоты. Точность ДНК-полимеразы можно рассчитать как соотношение (kcat/Km) для природной и неприродной нуклеиновой кислоты и (kcat/Km) для ненадлежащей природной и неприродной нуклеиновой кислоты; где kcat и Km представляют собой параметры Михаэлиса-Ментена для кинетики ферментов в равновесном состоянии (Fersht, A. R. (1985) Enzyme Structure and Mechanism, 2nd ed., p 350, W. H. Freeman & Co., New York., включенная в данный документ посредством ссылки). В некоторых вариантах осуществления полимераза характеризуется значением точности, составляющим по меньшей мере приблизительно 100, 1000, 10000, 100000 или 1×106, с корректирующей активностью или без нее.
В некоторых вариантах осуществления полимеразы из нативных источников или их варианты подвергают скринингу с применением анализа, который обеспечивает обнаружение встраивания неприродной нуклеиновой кислоты, характеризующейся конкретной структурой. В одном примере полимеразы можно подвергать скринингу в отношении способности встраивать неприродную нуклеиновую кислоту или UBP; например, d5SICSTP, dNaMTP или d5SICSTP-dNaMTP UBP. Можно применять полимеразу, например, гетерологичную полимеразу, которая проявляет модифицированное свойство в отношении неприродной нуклеиновой кислоты по сравнению с полимеразой дикого типа. Например, модифицированным свойством может быть, например, Km, kcat, Vmax, процессивность полимеразы в присутствии неприродной нуклеиновой кислоты (или встречающегося в природе нуклеотида), средняя длина считывания матрицы полимеразой в присутствии неприродной нуклеиновой кислоты, специфичность полимеразы к неприродной нуклеиновой кислоте, скорость связывания неприродной нуклеиновой кислоты, скорость высвобождения продукта (пирофосфата, трифосфата и т. д.), скорость ветвления или любая их комбинация. В одном варианте осуществления модифицированное свойство представляет собой пониженную Km для неприродной нуклеиновой кислоты и/или повышенное kcat/Km или Vmax/Km для неприродной нуклеиновой кислоты. Аналогично, полимераза необязательно характеризуется повышенной скоростью связывания неприродной нуклеиновой кислоты, повышенной скоростью высвобождения продукта и/или пониженной скоростью ветвления по сравнению с полимеразой дикого типа.
В то же время полимераза может встраивать природные нуклеиновые кислоты, например, A, C, G и T, в растущую копию нуклеиновой кислоты. Например, полимераза необязательно проявляет специфическую активность в отношении природной нуклеиновой кислоты, которая на по меньшей мере приблизительно 5% выше (например, 5%, 10%, 25%, 50%, 75%, 100% или выше), чем у соответствующей полимеразы дикого типа, и процессивность с природными нуклеиновыми кислотами в присутствии матрицы, которая на по меньшей мере 5% выше (например, 5%, 10%, 25%, 50%, 75%, 100% или выше), чем у полимеразы дикого типа в присутствии природной нуклеиновой кислоты. Необязательно полимераза проявляет kcat/Km или Vmax/Km в отношении встречающегося в природе нуклеотида, которое на по меньшей мере приблизительно 5% выше (например, приблизительно на 5%, 10%, 25%, 50%, 75% или 100% или выше), чем у полимеразы дикого типа.
Используемые в данном документе полимеразы, которые способны встраивать неприродную нуклеиновую кислоту определенной структуры, также можно получать с применением подхода направленной эволюции. Анализ синтеза нуклеиновой кислоты можно применять для скрининга вариантов полимеразы, характеризующихся специфичностью к любой из множества неприродных нуклеиновых кислот. Например, варианты полимеразы могут быть подвергнуты скринингу в отношении способности встраивать неприродную нуклеиновую кислоту или UBP, например, d5SICSTP, dNaMTP или d5SICSTP-dNaMTP UBP, в нуклеиновые кислоты. В некоторых вариантах осуществления такой анализ представляет собой анализ in vitro, например, с применением рекомбинантного варианта полимеразы. В некоторых вариантах осуществления такой анализ представляет собой анализ in vivo, например, экспрессию варианта полимеразы в клетке. Такие методики направленной эволюции можно применять для скрининга вариантов любой подходящей полимеразы в отношении активности по отношению к любой из неприродных нуклеиновых кислот, изложенных в данном документе.
Модифицированные полимеразы описанных композиций могут необязательно представлять собой модифицированную и/или рекомбинантную ДНК-полимеразу типа Φ29. Необязательно полимераза может представлять собой модифицированную и/или рекомбинантную полимеразу Φ29, B103, GA-1, PZA, Φ15, BS32, M2Y, Nf, G1, Cp-1, PRD1, PZE, SF5, Cp-5, Cp-7, PR4, PR5, PR722 или L17.
Модифицированные полимеразы описанных композиций необязательно могут представлять собой модифицированную и/или рекомбинантную прокариотическую ДНК-полимеразу, например, ДНК-полимеразу II (Pol II), ДНК-полимеразу III (Pol III), ДНК-полимеразу IV (Pol IV), ДНК-полимеразу V (Pol V). В некоторых вариантах осуществления модифицированные полимеразы включают полимеразы, которые опосредуют синтез ДНК между поврежденными неинструктивными нуклеотидами. В некоторых вариантах осуществления гены, кодирующие Pol I, Pol II (polB), Poll IV (dinB) и/или Pol V (umuCD), конститутивно экспрессируются или сверхэкспрессируются в сконструированной клетке или SSO. В некоторых вариантах осуществления повышение экспрессии или сверхэкспрессии Pol II способствует увеличению сохранения неприродных пар оснований (UBP) в сконструированной клетке или SSO.
Полимеразы нуклеиновых кислот, обычно применимые в настоящем изобретении, включают ДНК-полимеразы, РНК-полимеразы, обратные транскриптазы и их мутантные или измененные формы. ДНК-полимеразы и их свойства подробно описаны, в частности, в DNA Replication 2nd edition, Kornberg and Baker, W. H. Freeman, New York, N. Y. (1991). Известные обычные ДНК-полимеразы, применимые в настоящем изобретении, включают без ограничения ДНК-полимеразу Pyrococcus furiosus (Pfu) (Lundberg et al., 1991, Gene, 108: 1, Stratagene), ДНК-полимеразу Pyrococcus woesei (Pwo) (Hinnisdaels et al., 1996, Biotechniques, 20:186-8, Boehringer Mannheim), ДНК-полимеразу Thermus thermophilus (Tth) (Myers and Gelfand 1991, Biochemistry 30:7661), ДНК-полимеразу Bacillus stearothermophilus (Stenesh and McGowan, 1977, Biochim Biophys Acta 475:32), ДНК-полимеразу Thermococcus litoralis (TIi) (также называемую ДНК-полимеразой Vent™, Cariello et al, 1991, Polynucleotides Res, 19: 4193, New England Biolabs), ДНК-полимеразу 9°Nm™ (New England Biolabs), фрагмент Штоффеля, Thermo Sequenase® (Amersham Pharmacia Biotech UK), Therminator™ (New England Biolabs), ДНК-полимеразу Thermotoga maritima (Tma) (Diaz and Sabino, 1998 Braz J Med. Res, 31:1239), ДНК-полимеразу Thermus aquaticus (Taq) (Chien et al, 1976, J. Bacteoriol, 127: 1550), ДНК-полимеразу, ДНК-полимеразу Pyrococcus kodakaraensis KOD (Takagi et al., 1997, Appl. Environ. Microbiol. 63:4504), ДНК-полимеразу JDF-3 (из Thermococcus sp. JDF-3, заявка на патент № WO 0132887), ДНК-полимеразу Pyrococcus GB-D (PGB-D) (также называемую ДНК-полимеразой Deep Vent™, Juncosa-Ginesta et al., 1994, Biotechniques, 16:820, New England Biolabs), ДНК-полимеразу UlTma (из термофильной Thermotoga maritima; Diaz and Sabino, 1998 Braz J. Med. Res, 31:1239; PE Applied Biosystems), ДНК-полимеразу Tgo (из Thermococcus gorgonarius, Roche Molecular Biochemicals), ДНК-полимеразу I из E. coli (Lecomte and Doubleday, 1983, Polynucleotides Res. 11:7505), ДНК-полимеразу T7 (Nordstrom et al, 1981, J Biol. Chem. 256:3112) и ДНК-полимеразу II DP1I/DP2 из простейших (Cann et al, 1998, Proc. Natl. Acad. Sci. USA 95:14250). Рассматриваются как мезофильные полимеразы, так и термофильные полимеразы. Термофильные ДНК-полимеразы включают без ограничения ThermoSequenase®, 9°Nm™, Therminator™, Taq, Tne, Tma, Pfu, TfI, Tth, TIi, фрагмент Штоффеля, ДНК-полимеразу Vent™ и Deep Vent™, ДНК-полимеразу KOD, Tgo, JDF-3 и их мутанты, варианты и производные. Полимераза, которая является 3'-экзонуклеазо-дефицитным мутантом, также рассматривается. Обратные транскриптазы, применимые в настоящем изобретении, включают без ограничения обратные транскриптазы из HIV, HTLV-I, HTLV-II, FeLV, FIV, SIV, AMV, MMTV, MoMuLV и других ретровирусов (см. Levin, Cell 88:5-8 (1997); Verma, Biochim Biophys Acta. 473:1-38 (1977); Wu et al, CRC Crit Rev Biochem. 3:289-347(1975)). Дополнительные примеры полимераз включают без ограничения ДНК-полимеразу 9°N, ДНК-полимеразу Taq, ДНК-полимеразу Phusion®, ДНК-полимеразу Pfu, ДНК-полимеразу RB69, ДНК-полимеразу KOD и ДНК-полимеразу VentR® Gardner et al. (2004) "Comparative Kinetics of Nucleotide Analog Incorporation by Vent DNA Polymerase (J. Biol. Chem., 279(12), 11834-11842; Gardner and Jack "Determinants of nucleotide sugar recognition in an archaeon DNA polymerase" Nucleic Acids Research, 27(12) 2545-2553.) Полимеразы, выделенные из нетермофильных организмов, могут быть инактивируемыми при нагревании. Примерами являются ДНК-полимеразы из фага. Понятно, что полимеразы из любого из множества источников могут быть модифицированы для повышения или снижения их устойчивости к условиям высокой температуры. В некоторых вариантах осуществления полимераза может быть термофильной. В некоторых вариантах осуществления термофильная полимераза может быть инактивируемой при нагревании. Термофильные полимеразы обычно применимы в условиях высокой температуры или в условиях термоциклирования, таких как те, которые применяются в методиках полимеразной цепной реакции (ПЦР).
В некоторых вариантах осуществления полимераза включает Φ29, B103, GA-1, PZA, Φ15, BS32, M2Y, Nf, G1, Cp-1, PRD1, PZE, SF5, Cp-5, Cp-7, PR4, PR5, PR722, L17, ThermoSequenase®, 9°Nm™, ДНК-полимеразу Therminator™, Tne, Tma, TfI, Tth, TIi, фрагмент Штоффеля, ДНК-полимеразу Vent™ и Deep Vent™, ДНК-полимеразу KOD, Tgo, JDF-3, Pfu, Taq, ДНК-полимеразу T7, РНК-полимеразу T7, PGB-D, ДНК-полимеразу UlTma, ДНК-полимеразу I из E. coli, ДНК-полимеразу III из E. coli, ДНК-полимеразу II DP1I/DP2 из простейших, ДНК-полимеразу 9°N, ДНК-полимеразу Taq, ДНК-полимеразу Phusion®, ДНК-полимеразу Pfu, РНК-полимеразу SP6, ДНК-полимеразу RB69, обратную транскриптазу вируса птичьего миелобластоза (AMV), обратную транскриптазу вируса мышиного лейкоза Молони (MMLV), обратную транскриптазу SuperScript® II и обратную транскриптазу SuperScript® III.
В некоторых вариантах осуществления полимераза представляет собой фрагмент Кленова ДНК-полимеразы 1, полимеразу Vent, ДНК-полимеразу Phusion®, ДНК-полимеразу KOD, Taq-полимеразу, ДНК-полимеразу T7, РНК-полимеразу T7, ДНК-полимеразу Therminator™, полимеразу POLB, РНК-полимеразу SP6, ДНК-полимеразу I из E. coli, ДНК-полимеразу III из E. coli, обратную транскриптазу вируса птичьего миелобластоза (AMV), обратную транскриптазу вируса мышиного лейкоза Молони (MMLV), обратную транскриптазу SuperScript® II или обратную транскриптазу SuperScript® III.
Кроме того, такие полимеразы могут быть использованы для вариантов применения в амплификации и/или секвенировании ДНК, включая варианты применения в реальном времени, например, в контексте амплификации или секвенирования, которые включают встраивание неприродных остатков нуклеиновой кислоты в ДНК с помощью полимеразы. В других вариантах осуществления неприродная нуклеиновая кислота, которая встроена, может быть такой же, как природный остаток, например, когда метку или другой фрагмент неприродной нуклеиновой кислоты удаляют под действием полимеразы во время встраивания, или неприродная нуклеиновая кислота может иметь один или несколько признаков, которые отличают ее от природной нуклеиновой кислоты.
Транспортер нуклеотидов
Транспортеры нуклеотидов (NT) представляют собой группу мембранных транспортных белков, которые способствуют проникновению нуклеозидных субстратов через клеточные мембраны и везикулы. В некоторых вариантах осуществления есть два типа транспортеров нуклеозидов, концентрирующие транспортеры нуклеозидов и равновесные транспортеры нуклеозидов. В некоторых случаях NT также охватывают транспортеры органических анионов (ΌαΤ) и транспортеры органических катионов (OCT). В некоторых случаях транспортер нуклеотидов является транспортером нуклеозидтрифосфата.
В некоторых вариантах осуществления транспортер нуклеотидтрифосфата (NTT) происходит из бактерии, растения или водоросли. В некоторых вариантах осуществления транспортер нуклеотид/нуклеозидтрифосфата представляет собой TpNTT1, TpNTT2, TpNTT3, TpNTT4, TpNTT5, TpNTT6, TpNTT7, TpNTT8 (T. pseudonana), PtNTT1, PtNTT2, PtNTT3, PtNTT4, PtNTT5, PtNTT6 (P. tricornutum), GsNTT (Galdieria sulphuraria), AtNTT1, AtNTT2 (Arabidopsis thaliana), CtNTT1, CtNTT2 (Chlamydia trachomatis), PamNTT1, PamNTT2 (Protochlamydia amoebophila), CcNTT (Caedibacter caryophilus), RpNTT1 (Rickettsia prowazekii).
В некоторых вариантах осуществления NTT представляет собой CNT1, CNT2, CNT3, ENT1, ENT2, OAT1, OAT3 или OCT1.
В некоторых вариантах осуществления NTT импортирует неприродные нуклеиновые кислоты в организм, например, в клетку. В некоторых вариантах осуществления NTT могут быть модифицированы таким образом, что сайт связывания нуклеотидов NTT модифицируется для уменьшения стерического ингибирования проникновения неприродной нуклеиновой кислоты в сайт связывания нуклеотидов. В некоторых вариантах осуществления NTT могут быть модифицированы для обеспечения повышенного взаимодействия с одной или несколькими неприродными характеристиками неприродных нуклеиновых кислот. Такие NTT можно сконструировать или обеспечить их экспрессию в клетках для стабильного импортирования UBP в клетки. Соответственно, настоящее изобретение предусматривает композиции, которые содержат гетерологичный или рекомбинантный NTT, и способы их применения.
NTT могут быть модифицированы с применением способов, относящихся к белковой инженерии. Например, молекулярное моделирование можно провести на основе кристаллических структур, чтобы идентифицировать местоположения в NTT, где можно выполнить мутации для модификации целевой активности или сайта связывания. Остаток, идентифицированный как мишень для замены, можно заменить остатком, выбранным с применением моделирования минимизации энергии, моделирования гомологии и/или консервативных аминокислотных замен, таких как описано в Bordo, et al. J Mol Biol 217: 721-729 (1991) и Hayes, et al. Proc Natl Acad Sci, USA 99: 15926-15931 (2002).
Любой из множества NTT можно применять в способе или композиции, изложенных в данном документе, включая, например, ферменты на основе белка, выделенные из биологических систем, и их функциональные варианты. Следует понимать, что ссылка на конкретный NTT, такой как NTT, приведенный ниже, включает его функциональные варианты, если не указано иное. В некоторых вариантах осуществления NTT представляет собой NTT дикого типа. В некоторых вариантах осуществления NTT представляет собой модифицированный или мутантный NTT.
Также можно применять NTT со свойствами, обеспечивающими улучшение проникновения неприродных нуклеиновых кислот в клетки и координации с неприродными нуклеотидами в области связывания нуклеотидов. В некоторых вариантах осуществления модифицированный NTT имеет модифицированный сайт связывания нуклеотидов. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется ослабленной специфичностью к неприродной нуклеиновой кислоте.
В некоторых вариантах осуществления модифицированный NTT характеризуется специфичностью к неприродной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к неприродной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированный сахар, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к природной нуклеиновой кислоте и/или неприродной нуклеиновой кислоте без модифицированного сахара. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированное основание, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к природной нуклеиновой кислоте и/или неприродной нуклеиновой кислоте без модифицированного основания. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей трифосфат, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к нуклеиновой кислоте, содержащей трифосфат, и/или неприродной нуклеиновой кислоте без трифосфата. Например, модифицированный NTT или NTT дикого типа может характеризоваться специфичностью к неприродной нуклеиновой кислоте, содержащей трифосфат, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к неприродной нуклеиновой кислоте с дифосфатом или монофосфатом, или без фосфата, или с их комбинацией.
В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированный сахар, и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к природной нуклеиновой кислоте. В некоторых вариантах осуществления модифицированный NTT или NTT дикого типа характеризуется специфичностью к неприродной нуклеиновой кислоте, содержащей модифицированное основание, и специфичностью к природной нуклеиновой кислоте, которая составляет по меньшей мере приблизительно 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80%, 90%, 95%, 97%, 98%, 99%, 99,5%, 99,99% специфичности NTT дикого типа по отношению к природной нуклеиновой кислоте.
Характеристики NTT можно определить в зависимости от скорости их диссоциации с нуклеиновыми кислотами. В некоторых вариантах осуществления NTT характеризуется относительно низкой скоростью диссоциации для одной или нескольких природных и неприродных нуклеиновых кислот. В некоторых вариантах осуществления NTT характеризуется относительно высокой скоростью диссоциации для одной или нескольких природных и неприродных нуклеиновых кислот. Скорость диссоциации представляет собой активность NTT, которую можно регулировать для настройки скоростей реакции в способах, изложенных в данном документе.
NTT из нативных источников или их варианты можно подвергать скринингу с применением анализа, который обеспечивает обнаружение импортирования неприродной нуклеиновой кислоты, характеризующейся конкретной структурой. В одном примере NTT можно подвергать скринингу в отношении способности импортировать неприродную нуклеиновую кислоту или UBP; например, d5SICSTP, dNaMTP или d5SICSTP-dNaMTP UBP. Можно применять NTT, например, гетерологичный NTT, который проявляет модифицированное свойство в отношении неприродной нуклеиновой кислоты по сравнению с NTT дикого типа. Например, модифицированным свойством может быть, например, Km, kcat, Vmax, импортирование NTT в присутствии неприродной нуклеиновой кислоты (или встречающегося в природе нуклеотида), средняя длина считывания матрицы клеткой с NTT в присутствии неприродной нуклеиновой кислоты, специфичность NTT к неприродной нуклеиновой кислоте, скорость связывания неприродной нуклеиновой кислоты или скорость высвобождения продукта или любая их комбинация. В одном варианте осуществления модифицированное свойство представляет собой пониженную Km для неприродной нуклеиновой кислоты и/или повышенное kcat/Km или Vmax/Km для неприродной нуклеиновой кислоты. Аналогично, NTT необязательно характеризуется повышенной скоростью связывания неприродной нуклеиновой кислоты, повышенной скоростью высвобождения продукта и/или повышенной скоростью импортирования в клетку по сравнению с NTT дикого типа.
В то же время NTT может импортировать природные нуклеиновые кислоты, например, A, C, G и T, в клетку. Например, NTT необязательно проявляет специфическую активность импортирования в отношении природной нуклеиновой кислоты, которая на по меньшей мере приблизительно 5% выше (например, 5%, 10%, 25%, 50%, 75%, 100% или выше), чем у соответствующего NTT дикого типа. Необязательно NTT проявляет kcat/Km или Vmax/Km в отношении встречающегося в природе нуклеотида, которое на по меньшей мере приблизительно 5% выше (например, приблизительно на 5%, 10%, 25%, 50%, 75% или 100% или выше), чем у NTT дикого типа.
Используемые в данном документе NTT, которые способны импортировать неприродную нуклеиновую кислоту определенной структуры, также можно получать с применением подхода направленной эволюции. Анализ синтеза нуклеиновой кислоты можно применять для скрининга вариантов NTT, характеризующихся специфичностью к любой из множества неприродных нуклеиновых кислот. Например, варианты NTT могут быть подвергнуты скринингу в отношении способности импортировать неприродную нуклеиновую кислоту или UBP; например, d5SICSTP, dNaMTP или d5SICSTP-dNaMTP UBP, в нуклеиновые кислоты. В некоторых вариантах осуществления такой анализ представляет собой анализ in vitro, например, с применением рекомбинантного варианта NTT. В некоторых вариантах осуществления такой анализ представляет собой анализ in vivo, например, экспрессию варианта NTT в клетке. Такие методики направленной эволюции можно применять для скрининга вариантов любого подходящего NTT в отношении активности по отношению к любой из неприродных нуклеиновых кислот, изложенных в данном документе.
Инструментарий и реагенты на основе нуклеиновых кислот
Реагент на основе нуклеиновых кислот для применения со способом, клеткой или сконструированным микроорганизмом, описанным в данном документе, содержит одну или несколько ORF. ORF может быть из любого подходящего источника, иногда из геномной ДНК, мРНК, обратно транскрибированной РНК или комплементарной ДНК (cDNA) или библиотеки нуклеиновых кислот, включающей одно или несколько из вышеперечисленных, и из любого вида организмов, который содержит представляющую интерес последовательность нуклеиновой кислоты, представляющий интерес белок или имеет представляющую интерес активность. Неограничивающие примеры организмов, из которых можно получить ORF, включают, например, бактерии, дрожжи, грибы, человека, насекомое, нематоду, корову, лошадь, собаку, кошку, крысу или мышь. В некоторых вариантах осуществления реагент на основе нуклеиновых кислот или другой реагент, описанный в данном документе, выделяют или очищают.
Реагент на основе нуклеиновых кислот иногда содержит нуклеотидную последовательность, смежную с ORF, которая транслируется вместе с ORF и кодирует аминокислотную метку. Кодирующая метку нуклеотидная последовательность расположена на 3' и/или 5' ORF в реагенте на основе нуклеиновых кислот, тем самым кодируя метку на С-конце или N-конце белка или пептида, кодируемого ORF. Любая метка, которая не отменяет транскрипцию и/или трансляцию in vitro, может быть использована и может быть надлежащим образом выбрана специалистом в данной области техники. Метки могут облегчать выделение и/или очистку требуемого продукта ORF из культуральной или ферментационной среды.
Нуклеиновая кислота или реагент на основе нуклеиновых кислот может содержать определенные элементы, например, регуляторные элементы, часто выбираемые в соответствии с предполагаемым применением нуклеиновой кислоты. Любой из следующих элементов может быть включен в реагент на основе нуклеиновых кислот или исключен из него. Реагент на основе нуклеиновых кислот например, может включать один или несколько или все из следующих нуклеотидных элементов: один или несколько промоторных элементов, один или несколько 5'-нетранслируемых участков (5'UTR), один или несколько участков, в которые может быть вставлена целевая нуклеотидная последовательность ("инсерционный элемент"), один или несколько целевых нуклеотидных последовательностей, один или несколько 3'-нетранслируемых участков (3'UTR) и один или несколько элементов отбора. Реагент на основе нуклеиновых кислот может быть предусмотрен с одним или несколькими такими элементами, и другие элементы могут быть вставлены в нуклеиновую кислоту до того, как эту нуклеиновую кислоту встраивают в требуемый организм. В некоторых вариантах осуществления предусмотренный реагент на основе нуклеиновых кислот содержит промотор, 5'UTR, необязательный 3'UTR и инсерционный(-е) элемент(-ы), с помощью которого(-ых) целевую нуклеотидную последовательность вставляют (то есть клонируют) в реагент на основе нуклеиновых кислот. В определенных вариантах осуществления предусмотренный реагент на основе нуклеиновых кислот содержит промотор, инсерционный(-е) элемент(-ы) и необязательный 3'UTR, и 5'UTR/целевую нуклеотидную последовательность вставляют с необязательным 3'UTR. Элементы могут располагаться в любом порядке, подходящем для экспрессии в выбранной системе экспрессии (например, экспрессии в выбранном организме или экспрессии в бесклеточной системе, например), и в некоторых вариантах осуществления реагент на основе нуклеиновых кислот содержит следующие элементы в направление от 5' к 3': (1) промоторный элемент, 5'UTR и инсерционный(-е) элемент(-ы); (2) промоторный элемент, 5'UTR и целевая нуклеотидная последовательность; (3) промоторный элемент, 5'UTR, инсерционный(-е) элемент(-ы) и 3'UTR; и (4) промоторный элемент, 5'UTR, целевая нуклеотидная последовательность и 3'UTR.
Реагенты на основе нуклеиновых кислот, например, кассеты экспрессии и/или векторы экспрессии, могут содержать множество регуляторных элементов, включая промоторы, энхансеры, последовательности инициации трансляции, последовательности терминации транскрипции и другие элементы. "Промотор", как правило, представляет собой последовательность или последовательности ДНК, которые функционируют, когда находятся в относительно фиксированном местоположении по отношению к сайту начала транскрипции. Например, промотор может находиться выше сегмента нуклеиновой кислоты нуклеотидтрифосфатного транспортера. "Промотор" содержит ключевые элементы, необходимые для первичного взаимодействия РНК-полимеразы и факторов транскрипции, и может содержать расположенные выше элементы и элементы ответа. "Энхансер" обычно относится к последовательности ДНК, которая функционирует на нефиксированном расстоянии от сайта начала транскрипции и может находиться или на 5' или на 3'' от единицы транскрипции. Кроме того, энхансеры могут находиться как внутри интрона, так и внутри самой кодирующей последовательности. Обычно они составляют от 10 до 300 п. н. в длину и функционируют в цис-положении. Функция энхансера состоит в увеличении транскрипции от ближайших промоторов. Энхансеры, как и промоторы, также часто содержат элементы ответа, которые опосредуют регуляцию транскрипции. Энхансеры часто определяют регуляцию экспрессии.
Как отмечено выше, реагенты на основе нуклеиновых кислот также могут содержать одну или несколько 5'UTR и один или несколько 3'UTR. Например, векторы экспрессии, используемые в эукариотических клетках-хозяевах (например, клетках дрожжей, грибов, насекомых, растений, животных, людей или ядросодержащих клетках) и прокариотических клетках-хозяевах (например, вирусах, бактериях), могут содержать последовательности, которые сигнализируют о терминации транскрипции, что может влиять на экспрессию мРНК. Эти области могут транскрибироваться как полиаденилированные сегменты в нетранслируемой части мРНК, кодирующей белок тканевого фактора. 3''-нетранслируемые области также содержат сайты терминации транскрипции. В некоторых предпочтительных вариантах осуществления единица транскрипции содержит область полиаденилирования. Одним из преимуществ этой области является то, что она обеспечивает увеличение вероятности того, что транскрибированная единица будет процессироваться и транспортироваться как мРНК. Идентификация и применение сигналов полиаденилирования в экспрессионных конструкциях хорошо известны. В некоторых предпочтительных вариантах осуществления гомологичные сигналы полиаденилирования можно использовать в трансгенных конструкциях.
5'UTR может содержать один или несколько элементов, эндогенных по отношению к нуклеотидной последовательности, из которой она происходит, и иногда содержит один или несколько экзогенных элементов. 5'UTR может происходить из любой подходящей нуклеиновой кислоты, такой как геномная ДНК, плазмидная ДНК, РНК или мРНК, например, из любого подходящего организма (например, вируса, бактерии, дрожжей, грибов, растения, насекомого или млекопитающего). Специалист в данной области техники может выбрать подходящие элементы для 5'UTR на основе выбранной системы экспрессии (например, экспрессия в выбранном организме или экспрессия в бесклеточной системе, например). 5'UTR иногда содержит один или несколько из следующих элементов, известных специалисту в данной области техники: энхансерные последовательности (например, транскрипционные или трансляционные), сайт инициации транскрипции, сайт связывания фактора транскрипции, сайт регуляции трансляции, сайт инициации трансляции, сайт связывания фактора трансляции, сайт связывания вспомогательного белка, сайты связывания с регулятором обратной связи, бокс Pribnow, бокс TATA, элемент -35, E-box (связывающий элемент спираль-петля-спираль), сайт связывания рибосомы, репликон, внутренний участок посадки рибосомы (IRES), сайленсерный элемент и т. п. В некоторых вариантах осуществления промоторный элемент может быть выделен таким образом, что все элементы 5'UTR, необходимые для надлежащей обусловленной регуляции, содержатся во фрагменте промоторного элемента или в функциональной подпоследовательности фрагмента промоторного элемента.
5'UTR в реагенте на основе нуклеиновых кислот может содержать нуклеотидную последовательность трансляционного энхансера. Нуклеотидная последовательность трансляционного энхансера часто располагается между промотором и целевой нуклеотидной последовательностью в реагенте на основе нуклеиновых кислот. Последовательность трансляционного энхансера часто связывается с рибосомой, иногда представляет собой рибонуклеотидную последовательность, связывающуюся с 18S rRNA (т. е. последовательность, связывающую рибосому 40S), и иногда является внутренним участком посадки рибосомы (IRES). IRES обычно образует каркас РНК с точно расположенными третичными структурами РНК, которые вступают в контакт с рибосомальной субъединицей 40S посредством ряда специфических межмолекулярных взаимодействий. Примеры рибосомальных энхансерных последовательностей известны и могут быть идентифицированы специалистом в данной области техники (например, Mignone et al., Nucleic Acids Research 33: D141-D146 (2005); Paulous et al., Nucleic Acids Research 31: 722-733 (2003); Akbergenov et al., Nucleic Acids Research 32: 239-247 (2004); Mignone et al., Genome Biology 3(3): reviews 0004.1-0001.10 (2002); Gallie, Nucleic Acids Research 30: 3401-3411 (2002); Shaloiko et al., DOI: 10.1002/bit.20267 и Gallie et al., Nucleic Acids Research 15: 3257-3273 (1987)).
Последовательность трансляционного энхансера иногда представляет собой эукариотическую последовательность, такую как консенсусная последовательность Kozak или другая последовательность (например, последовательность гидроидных полипов, номер доступа в GenBank U07128). Последовательность трансляционного энхансера иногда представляет собой прокариотическую последовательность, такую как консенсусная последовательность Шайна-Дальгарно. В определенных вариантах осуществления последовательность трансляционного энхансера представляет собой вирусную нуклеотидную последовательность. Последовательность трансляционного энхансера иногда происходит из 5'UTR вируса растения, такого как вирус табачной мозаики (TMV), вирус мозаики люцерны (AMV); вирус гравировки табака (ETV); Y-вирус картофеля (PVY); вирус мозаики турнепса (poty) и вирус мозаики гороха, например. В определенных вариантах осуществления омега-последовательность длиной приблизительно 67 оснований из TMV включена в реагент на основе нуклеиновых кислот в качестве последовательности трансляционного энхансера (например, лишена нуклеотидов гуанозина и содержит центральную область поли(САА) длиной 25 нуклеотидов).
3'UTR может содержать один или несколько элементов, эндогенных по отношению к нуклеотидной последовательности, из которой она происходит, и иногда содержит один или несколько экзогенных элементов. 3'UTR может происходить из любой подходящей нуклеиновой кислоты, такой как геномная ДНК, плазмидная ДНК, РНК или мРНК, например, из любого подходящего организма (например, вируса, бактерии, дрожжей, грибов, растения, насекомого или млекопитающего). Специалист в данной области техники может выбрать подходящие элементы для 3'UTR на основе выбранной системы экспрессии (например, экспрессия в выбранном организме, например). 3'UTR иногда содержит один или несколько из следующих элементов, известных специалисту в данной области техники: сайт регуляции транскрипции, сайт инициации транскрипции, сайт терминации транскрипции, сайт связывания фактора транскрипции, сайт регуляции трансляции, сайт терминации трансляции, сайт инициации трансляции, сайт связывания фактора трансляции, сайт связывания рибосомы, репликон, энхансерный элемент, сайленсерный элемент и полиаденозиновый хвост. 3'UTR часто содержит полиаденозиновый хвост, а иногда его нет, и, если присутствует полиаденозиновый хвост, один или несколько фрагментов аденозина могут быть добавлены или удалены из него (например, приблизительно 5, приблизительно 10, приблизительно 15, приблизительно 20, приблизительно 25, приблизительно 30, приблизительно 35, приблизительно 40, приблизительно 45 или приблизительно 50 фрагментов аденозина могут быть добавлены или удалены).
В некоторых вариантах осуществления модификацию 5'UTR и/или 3'UTR применяют для изменения (например, увеличения, добавления, снижения или уменьшения или по сути устранения) активности промотора. Изменение активности промотора может, в свою очередь, изменять активность пептида, полипептида или белка (например, активность фермента, например) путем изменения транскрипции представляющей(-их) интерес нуклеотидной(-ых) последовательности(-ей) из функционально связанного промоторного элемента, содержащего модифицированную 5' или 3'UTR. Например, микроорганизм может быть сконструирован путем генетической модификации для обеспечения экспрессии реагента на основе нуклеиновых кислот, содержащего модифицированную 5' или 3'UTR, который может обеспечить добавление новой активность (например, активности, обычно не обнаруживаемой у организма-хозяина) или увеличение экспрессии существующей активности путем увеличения транскрипции с гомологичного или гетерологичного промотора, функционально связанного с представляющей интерес нуклеотидной последовательностью (например, представляющей интерес гомологичной или гетерологичной нуклеотидной последовательностью), в определенных вариантах осуществления. В некоторых вариантах осуществления микроорганизм может быть сконструирован путем генетической модификации для обеспечения экспрессии реагента на основе нуклеиновых кислот, содержащего модифицированную 5' или 3'UTR, который может обеспечить снижение экспрессии активности путем уменьшения или по сути устранения транскрипции с гомологичного или гетерологичного промотора, функционально связанного с представляющей интерес нуклеотидной последовательностью, в определенных вариантах осуществления.
Экспрессия нуклеотидтрифосфатного транспортера с кассеты экспрессии или вектора экспрессии может контролироваться любым промотором, способным к экспрессии в прокариотических клетках или эукариотических клетках. Промоторный элемент обычно требуется для синтеза ДНК и/или синтеза РНК. Промоторный элемент часто содержит участок ДНК, который может облегчать транскрипцию конкретного гена, обеспечивая сайт начала для синтеза РНК, соответствующей гену. Промоторы обычно расположены рядом с генами, которые они регулируют, расположены выше гена (например, в направлении 5' от гена) и в некоторых вариантах осуществления находятся в той же нити ДНК, что и смысловая нить гена. В некоторых вариантах осуществления промоторный элемент можно выделить из гена или организма и вставить в функциональной связи с полинуклеотидной последовательностью для обеспечения измененной и/или регулируемой экспрессии. Ненативный промотор (например, промотор, обычно не связанный с данной последовательностью нуклеиновой кислоты), применяемый для экспрессии нуклеиновой кислоты, часто называют гетерологичным промотором. В определенных вариантах осуществления гетерологичный промотор и/или 5'UTR могут быть вставлены в функциональной связи с полинуклеотидом, который кодирует полипептид, имеющий требуемую активность, как описано в данном документе. Термины "функционально связанный" и "в функциональной связи с", используемые в данном документе в отношении промоторов, относятся к взаимосвязи между кодирующей последовательностью и промоторным элементом. Промотор функционально связан или находится в функциональной связи с кодирующей последовательностью, когда экспрессия с кодирующей последовательности посредством транскрипции регулируется или контролируется промоторным элементом. Термины "функционально связан" и "в функциональной связи с" используются в данном документе взаимозаменяемо в отношении промоторных элементов.
Промотор часто взаимодействует с РНК-полимеразой. Полимераза представляет собой фермент, который катализирует синтез нуклеиновых кислот с применением ранее существующего реагента на основе нуклеиновых кислот. Когда матрица представляет собой матрицу ДНК, молекула РНК транскрибируется до синтеза белка. Ферменты, имеющие полимеразную активность, подходящие для применения в способах по настоящему изобретению, включают любую полимеразу, которая активна в выбранной системе с выбранной матрицей для синтеза белка. В некоторых вариантах осуществления промотор (например, гетерологичный промотор), также упоминаемый в данном документе как промоторный элемент, может быть функционально связан с нуклеотидной последовательностью или открытой рамкой считывания (ORF). Транскрипция с промоторного элемента может катализировать синтез РНК, соответствующей нуклеотидной последовательности или последовательности ORF, функционально связанной с промотором, что, в свою очередь, приводит к синтезу требуемого пептида, полипептида или белка.
Промоторные элементы иногда демонстрируют чувствительность к регуляторному контролю. Промоторные элементы также иногда могут регулироваться селективным средством. То есть транскрипция с промоторных элементов иногда может быть включена, выключена, активирована или подавлена в ответ на изменение условий окружающей среды, питания или внутренних условий или сигналов (например, индуцируемые теплом промоторы, регулируемые светом промоторы, регулируемые по механизму обратной связи промоторы, промоторы под влиянием гормонов, тканеспецифичные промоторы, промоторы под влиянием кислорода и рН, промоторы, которые реагируют на селективные средства (например, канамицин) и т. п., например). Промоторы, на которые влияют сигналы окружающей среды, пищевые или внутренние сигналы, часто находятся под влиянием сигнала (прямого или косвенного), который связывается с промотором или рядом с ним и обеспечивает увеличение или снижение экспрессии целевой последовательности в определенных условиях.
Неограничивающие примеры селективных или регуляторных средств, которые влияют на транскрипцию с промоторного элемента, используемого в вариантах осуществления, описанных в данном документе, включают без ограничения (1) сегменты нуклеиновых кислот, кодирующие продукты, которые обеспечивают устойчивость к токсичным в противном случае соединениям (например, антибиотикам); (2) сегменты нуклеиновых кислот, кодирующие продукты, которые в противном случае отсутствуют в клетке реципиента (например, незаменимые продукты, гены tRNA, ауксотрофные маркеры); (3) сегменты нуклеиновых кислот, кодирующие продукты, которые подавляют активность генного продукта; (4) сегменты нуклеиновых кислот, кодирующие продукты, которые могут быть легко идентифицированы (например, фенотипические маркеры, такие как антибиотики (например, β-лактамаза), β-галактозидаза, зеленый флуоресцентный белок (GFP), желтый флуоресцентный белок (YFP), красный флуоресцентный белок (RFP), голубой флуоресцентный белок (CFP) и белки клеточной поверхности); (5) сегменты нуклеиновых кислот, связывающие продукты, которые в противном случае вредны для выживания и/или функционирования клеток; (6) сегменты нуклеиновых кислот, которые иным образом ингибируют активность любого из сегментов нуклеиновой кислоты, описанных в пунктах 1-5 выше (например, антисмысловые олигонуклеотиды); (7) сегменты нуклеиновых кислот, связывающие продукты, которые модифицируют субстрат (например, эндонуклеазы рестрикции); (8) сегменты нуклеиновых кислот, которые можно использовать для выделения или идентификации требуемой молекулы (например, специфические сайты связывания белка); (9) сегменты нуклеиновых кислот, кодирующие специфическую нуклеотидную последовательность, которая в противном случае может быть нефункциональной (например, для ПЦР-амплификации субпопуляций молекул); (10) сегменты нуклеиновых кислот, которые при отсутствии прямо или косвенно придают устойчивость или чувствительность к конкретным соединениям; (11) сегменты нуклеиновых кислот, кодирующие продукты, которые либо являются токсичными, либо преобразуют относительно нетоксичное соединение в токсичное соединение (например, тимидинкиназа Herpes simplex, цитозиндеаминаза) в клетках реципиента; (12) сегменты нуклеиновых кислот, ингибирующие репликацию, разделение или наследуемость молекул нуклеиновых кислот, которые их содержат; и/или (13) сегменты нуклеиновых кислот, которые кодируют функции зависящей от условий репликации, например, репликацию у определенных хозяев или штаммов клеток-хозяев или при определенных условиях окружающей среды (например, температура, условия питания и т. п.). В некоторых вариантах осуществления регуляторное или селективное средство можно добавлять для изменения существующих условий роста, которым подвергается организм (например, рост в жидкой культуре, рост в ферментере, рост на чашках с твердой питательной средой и т. п., например).
В некоторых вариантах осуществления регуляцию промоторного элемента можно применять для изменения (например, увеличения, добавления, уменьшения или по сути устранения) активности пептида, полипептида или белка (например, активности фермента, например). Например, микроорганизм может быть сконструирован путем генетической модификации для обеспечения экспрессии реагента на основе нуклеиновых кислот, который может обеспечить добавление новой активность (например, активности, обычно не обнаруживаемой у организма-хозяина) или увеличение экспрессии существующей активности путем увеличения транскрипции с гомологичного или гетерологичного промотора, функционально связанного с представляющей интерес нуклеотидной последовательностью (например, представляющей интерес гомологичной или гетерологичной нуклеотидной последовательностью), в определенных вариантах осуществления. В некоторых вариантах осуществления микроорганизм может быть сконструирован путем генетической модификации для обеспечения экспрессии реагента на основе нуклеиновых кислот, который может обеспечить снижение экспрессии активности путем уменьшения или по сути устранения транскрипции с гомологичного или гетерологичного промотора, функционально связанного с представляющей интерес нуклеотидной последовательностью, в определенных вариантах осуществления.
Нуклеиновые кислоты, кодирующие гетерологичные белки, например, нуклеотидтрифосфатные транспортеры, можно применять с любой подходящей системой экспрессии или вставлять в нее. В некоторых вариантах осуществления реагент на основе нуклеиновых кислот иногда стабильно интегрируется в хромосому организма-хозяина, или реагент на основе нуклеиновых кислот может представлять собой делецию части хромосомы хозяина в определенных вариантах осуществления (например, в генетически модифицированных организмах, где изменение генома хозяина дает возможность избирательно или предпочтительно поддерживать требуемый организм, несущий генетическую модификацию). Такие реагенты на основе нуклеиновых кислот (например, нуклеиновые кислоты или генетически модифицированные организмы, чей измененный геном придает организму селектируемый признак) могут быть выбраны по их способности направлять продуцирование требуемого белка или молекулы нуклеиновой кислоты. При необходимости реагент на основе нуклеиновых кислот можно изменить так, что кодоны кодируют (i) ту же аминокислоту с применением другой tRNA, чем та, которая указана в нативной последовательности, или (ii) другую аминокислоту, отличную от нормальной, включая нестандартные или неприродные аминокислоты (в том числе детектируемые меченые аминокислоты).
Рекомбинантная экспрессия успешно осуществляется с применением кассеты экспрессии, которая может быть частью вектора, такого как плазмида. Вектор может содержать промотор, функционально связанный с нуклеиновой кислотой, кодирующей нуклеотидтрифосфатный транспортер. Вектор также может содержать другие элементы, необходимые для транскрипции и трансляции, как описано в данном документе. Кассета экспрессии, вектор экспрессии и последовательности в кассете или векторе могут быть гетерологичными по отношению к клетке, с которой вступают в контакт неприродные нуклеотиды. Например, последовательность нуклеотидтрифосфатного транспортера может быть гетерологичной по отношению к клетке.
Можно получить разнообразные прокариотические и эукариотические векторы экспрессии, подходящие для переноса, кодирования и/или экспрессии нуклеотидтрифосфатных транспортеров. Такие векторы экспрессии включают, например, pET, pET3d, pCR2.1, pBAD, pUC и дрожжевые векторы. Векторы могут быть использованы, например, в различных ситуациях in vivo и in vitro. Неограничивающие примеры прокариотических промоторов, которые можно использовать, включают SP6, T7, T5, tac, bla, trp, gal, lac или мальтозные промоторы. Неограничивающие примеры эукариотических промоторов, которые можно использовать, включают конститутивные промоторы, например, вирусные промоторы, такие как промоторы CMV, SV40 и RSV, а также регулируемые промоторы, например, индуцибельный или репрессируемый промотор, такой как промотор tet, промотор hsp70 и синтетический промотор, регулируемый CRE. Векторы для бактериальной экспрессии включают pGEX-5X-3, а для эукариотической экспрессии включают pCIneo-CMV. Вирусные векторы, которые можно использовать, включают те, которые относятся к лентивирусу, аденовирусу, аденоассоциированному вирусу, вирусу герпеса, вирусу коровьей оспы, вирусу полиомиелита, вирусу СПИДа, вирусу нервной трофики, Синдбис и другим вирусам. Также применимы любые семейства вирусов, которые обладают свойствами этих вирусов, делающими их пригодными для применения в качестве векторов. Ретровирусные векторы, которые можно использовать, включают те, которые описаны в Verma, American Society for Microbiology, pp. 229-232, Washington, (1985). Например, такие ретровирусные векторы могут включать вирус мышиного лейкоза Малони, MMLV и другие ретровирусы, которые проявляют требуемые свойства. Как правило, вирусные векторы содержат неструктурные ранние гены, структурные поздние гены, транскрипт РНК-полимеразы III, инвертированные концевые повторы, необходимые для репликации и инкапсидирования, и промоторы для контроля транскрипции и репликации вирусного генома. При конструировании в качестве векторов у вирусов, как правило, удаляют один или несколько ранних генов и ген или кассету ген/промотор вставляют в вирусный геном вместо удаленной вирусной нуклеиновой кислоты.
Клонирование
Любую удобную стратегию клонирования, известную из уровня техники, можно использовать для встраивания элемента, такого как ORF, в реагент на основе нуклеиновых кислот. Известные способы можно использовать для вставки элемента в матрицу независимо от инсерционного элемента, такие как (1) расщепление матрицы в одном или нескольких существующих сайтах рестрикционных ферментов и лигирование представляющего интерес элемента и (2) добавление сайтов рестрикционных ферментов в матрицу путем гибридизации олигонуклеотидных праймеров, которые содержат один или несколько подходящих сайтов рестрикционных ферментов, и амплификацию с помощью полимеразной цепной реакции (более подробно описанную в данном документе). В других стратегиях клонирования используют преимущества одного или нескольких сайтов встраивания, присутствующих или встроенных в реагент на основе нуклеиновых кислот, таких как, например, сайт гибридизации олигонуклеотидного праймера для ПЦР и другие, описанные в данном документе. В некоторых вариантах осуществления стратегию клонирования можно комбинировать с генетическими манипуляциями, такими как рекомбинация (например, рекомбинация реагента на основе нуклеиновых кислот с представляющей интерес последовательностью нуклеиновой кислоты в геноме организма, подлежащего модификации, как дополнительно описано в данном документе). В некоторых вариантах осуществления клонированная(-ые) ORF может(могут) обеспечивать продуцирование (прямо или косвенно) модифицированных нуклеотидтрифосфатных транспортеров и/или полимераз или нуклеотидтрифосфатных транспортеров и/или полимераз дикого типа при конструировании микроорганизма с одной или несколькими представляющими интерес ORF, при этом у микроорганизма предусмотрены измененные виды активности, представляющие собой активность нуклеотидтрифосфатного транспортера или полимеразную активность.
Нуклеиновую кислоту можно специфически расщепить посредством приведения в контакт нуклеиновой кислоты с одним или несколькими средствами для специфического расщепления. Средства для специфического расщепления часто будут специфически расщеплять в соответствии с конкретной нуклеотидной последовательностью в конкретном сайте. Примеры ферментных средств для специфического расщепления включают без ограничения эндонуклеазы (например, ДНКазу (например, ДНКазу I, II); РНКазу (например, РНКазу E, F, H, P); фермент Cleavase™; ДНК-полимеразу Taq; ДНК-полимеразу I из E. coli и эукариотические специфические в отношении структуры эндонуклеазы, мышиные эндонуклеазы FEN-1, рестрикционные эндонуклеазы типа I, II или III, такие как Acc I, Afl III, Alu I, Alw44 I, Apa I, Asn I, Ava I, Ava II, BamH I, Ban II, Bcl I, Bgl I, Bgl II, Bln I, BsaI, Bsm I, BsmBI, BssH II, BstE II, Cfo I, CIa I, Dde I, Dpn I, Dra I, EcIX I, EcoR I, EcoR I, EcoR II, EcoR V, Hae II, Hae II, Hind II, Hind III, Hpa I, Hpa II, Kpn I, Ksp I, Mlu I, MIuN I, Msp I, Nci I, Nco I, Nde I, Nde II, Nhe I, Not I, Nru I, Nsi I, Pst I, Pvu I, Pvu II, Rsa I, Sac I, Sal I, Sau3A I, Sca I, ScrF I, Sfi I, Sma I, Spe I, Sph I, Ssp I, Stu I, Sty I, Swa I, Taq I, Xba I, Xho I); гликозилазы (например, урацил-ДНК-гликолизилазу (UDG), 3-метиладенин-ДНК-гликозилазу, 3-метиладенин-ДНК-гликозилазу II, пиримидингидрат-ДНК-гликозилазу, FaPy-ДНК-гликозилазу, ошибочную по тимину ДНК-гликозилазу, гипоксантин-ДНК-гликозилазу, 5-гидроксиметилурацил-ДНК-гликозилазу (HmUDG), 5-гидроксиметилцитозин-ДНК-гликозилазу или 1,N6-этеноаденин-ДНК-гликозилазу); экзонуклеазы (например, экзонуклеазу III); рибозимы и ДНКзимы. Образец нуклеиновой кислоты можно обработать химическим средством или синтезировать с применением модифицированных нуклеотидов, и модифицированную нуклеиновую кислоту можно расщепить. В неограничивающих примерах образец нуклеиновой кислоты можно обработать (i) алкилирующими средствами, такими как метилнитрозомочевина, которая обеспечивает получение нескольких алкилированных оснований, включая N3-метиладенин и N3-метилгуанин, которые распознаются и расщепляются алкил-пурин-ДНК-гликозилазой; (ii) бисульфитом натрия, который вызывает дезаминирование остатков цитозина в ДНК с образованием остатков урацила, которые могут расщепляться урацил-N-гликозилазой; и (iii) химическим средством, которое превращает гуанин в его окисленную форму, 8-гидроксигуанин, который может расщепляться формамидопиримидин-ДНК-N-гликозилазой. Примеры процессов химического расщепления включают без ограничения алкилирование (например, алкилирование модифицированной фосфоротиоатом нуклеиновой кислоты); расщепление кислотонеустойчивого участка P3'-N5'-фосфороамидатсодержащей нуклеиновой кислоты; обработку нуклеиновой кислоты тетроксидом осмия и пиперидином.
В некоторых вариантах осуществления реагент на основе нуклеиновых кислот содержит один или несколько сайтов встраивания рекомбиназы. Сайт встраивания рекомбиназы представляет собой последовательность распознавания в молекуле нуклеиновой кислоты, которая участвует в реакции интеграции/рекомбинации при воздействии рекомбинационных белков. Например, сайтом рекомбинации для рекомбиназы Cre является loxP, который представляет собой последовательность из 34 пар оснований, состоящую из двух инвертированных повторов из 13 пар оснований (служащих сайтами связывания рекомбиназы), фланкирующих основную последовательность из 8 пар оснований (например, Sauer, Curr. Opin. Biotech. 5:521-527 (1994)). Другие примеры сайтов рекомбинации включают последовательности attB, attP, attL и attR и их мутанты, фрагменты, варианты и производные, которые распознаются рекомбинационным белком λ Int и клеточным фактором интеграции вспомогательных белков (IHF), FIS и эксцизионазой (Xis) (например, патенты США №№ 5888732; 6143557; 6171861; 6270969; 6277608; 6720140; заявки на патент США №№ 09/517466 и 09/732914; публикация заявки на патент США № US2002/0007051 и Landy, Curr. Opin. Biotech. 3:699-707 (1993)).
Примеры нуклеиновых кислот с рекомбинационным клонированием находятся в системах Gateway® (Invitrogen, Калифорния), которые содержат по меньшей мере один сайт рекомбинации для клонирования требуемых молекул нуклеиновой кислоты in vivo или in vitro. В некоторых вариантах осуществления в системе используют векторы, которые содержат по меньшей мере два разных сайт-специфических сайта рекомбинации, часто основанных на системе бактериофага лямбда (например, att1 и att2) и мутированных из сайтов дикого типа (att0). Каждый мутированный сайт характеризуется уникальной специфичностью для сайта att своего родственного партнера (т. е. сайта рекомбинации своего партнера по связыванию) того же типа (например, attB1 с attP1 или attL1 с attR1) и не будет перекрестно реагировать с сайтами рекомбинации другого мутантного типа или с сайтом att0 дикого типа. Различные специфичности сайта обеспечивают возможность направленного клонирования или связывания требуемых молекул, таким образом обеспечивая требуемую ориентацию клонированных молекул. Фрагменты нуклеиновой кислоты, фланкированные сайтами рекомбинации, клонируют и субклонируют с применением системы Gateway® путем замены селектируемого маркера (например, ccdB), фланкированного сайтами att на молекуле реципиентной плазмиды, иногда называемой вектором назначения. Требуемые клоны затем отбирают путем трансформации чувствительного к ccdB штамма-хозяина и положительного отбора на маркер на реципиентной молекуле. Аналогичные стратегии отрицательного отбора (например, с применением токсичных генов) можно использовать в других организмах, например, тимидинкиназу (ТК) у млекопитающих и насекомых.
Реагент на основе нуклеиновых кислот иногда содержит один или несколько элементов начала репликации (ORI). В некоторых вариантах осуществления матрица содержит два или более ORI, где один эффективно функционирует в одном организме (например, бактерии), а другой эффективно функционирует в другом организме (например, эукариоте, таком как дрожжи, например). В некоторых вариантах осуществления один ORI может эффективно функционировать у одного вида (например, S. cerevisiae, например), а другой ORI может эффективно функционировать у отличающегося вида (например, S. pombe, например). Реагент на основе нуклеиновых кислот также иногда содержит один или несколько сайтов регуляции транскрипции.
Реагент на основе нуклеиновых кислот, например, кассета экспрессии или вектор, может содержать последовательность нуклеиновой кислоты, кодирующую маркерный продукт. Маркерный продукт используют для определения того, был ли ген доставлен в клетку и экспрессируется ли после доставки. Примеры маркерных генов включают ген lacZ из E. coli, который кодирует β-галактозидазу и зеленый флуоресцентный белок. В некоторых вариантах осуществления маркер может быть селектируемым маркером. Когда такие селектируемые маркеры успешно переносятся в клетку-хозяина, трансформированная клетка-хозяин может выжить, если находится под давлением отбора. Существуют две отличающиеся широко используемые категории схем отбора. Первая категория основана на метаболизме клеток и применении мутантной клеточной линии, которая лишена способности расти независимо от добавленной среды. Вторая категория представляет собой доминантный отбор, который относится к схеме отбора, используемой в клетках любого типа, и не требует применения мутантной клеточной линии. В этих схемах обычно применяют лекарственное средство для остановки роста клетки-хозяина. Те клетки, которые имеют новый ген, будут экспрессировать белок, сообщающий устойчивость к лекарственному средству, и выживут при отборе. В примерах такого доминантного отбора применяют лекарственные средства неомицин (Southern et al., J. Molec. Appl. Genet. 1: 327 (1982)), микофеноловую кислоту, (Mulligan et al., Science 209: 1422 (1980)) или гигромицин (Sugden, et al., Mol. Cell. Biol. 5: 410-413 (1985)).
Реагент на основе нуклеиновых кислот может содержать один или несколько элементов отбора (например, элементы для отбора присутствия реагента на основе нуклеиновых кислот, а не для активации промоторного элемента, который можно селективно регулировать). Элементы отбора часто используют с применением известных способов для определения того, включен ли реагент на основе нуклеиновых кислот в клетку. В некоторых вариантах осуществления реагент на основе нуклеиновых кислот содержит два или более элементов отбора, где один эффективно функционирует в одном организме, а другой эффективно функционирует в другом организме. Примеры элементов отбора включают без ограничения (1) сегменты нуклеиновых кислот, кодирующие продукты, которые обеспечивают устойчивость к токсичным в противном случае соединениям (например, антибиотикам); (2) сегменты нуклеиновых кислот, кодирующие продукты, которые в противном случае отсутствуют в клетке реципиента (например, незаменимые продукты, гены tRNA, ауксотрофные маркеры); (3) сегменты нуклеиновых кислот, кодирующие продукты, которые подавляют активность генного продукта; (4) сегменты нуклеиновых кислот, кодирующие продукты, которые могут быть легко идентифицированы (например, фенотипические маркеры, такие как антибиотики (например, β-лактамаза), β-галактозидаза, зеленый флуоресцентный белок (GFP), желтый флуоресцентный белок (YFP), красный флуоресцентный белок (RFP), голубой флуоресцентный белок (CFP) и белки клеточной поверхности); (5) сегменты нуклеиновых кислот, связывающие продукты, которые в противном случае вредны для выживания и/или функционирования клеток; (6) сегменты нуклеиновых кислот, которые иным образом ингибируют активность любого из сегментов нуклеиновой кислоты, описанных в пунктах 1-5 выше (например, антисмысловые олигонуклеотиды); (7) сегменты нуклеиновых кислот, связывающие продукты, которые модифицируют субстрат (например, эндонуклеазы рестрикции); (8) сегменты нуклеиновых кислот, которые можно использовать для выделения или идентификации требуемой молекулы (например, специфические сайты связывания белка); (9) сегменты нуклеиновых кислот, кодирующие специфическую нуклеотидную последовательность, которая в противном случае может быть нефункциональной (например, для ПЦР-амплификации субпопуляций молекул); (10) сегменты нуклеиновых кислот, которые при отсутствии прямо или косвенно придают устойчивость или чувствительность к конкретным соединениям; (11) сегменты нуклеиновых кислот, кодирующие продукты, которые либо являются токсичными, либо преобразуют относительно нетоксичное соединение в токсичное соединение (например, тимидинкиназа Herpes simplex, цитозиндеаминаза) в клетках реципиента; (12) сегменты нуклеиновых кислот, ингибирующие репликацию, разделение или наследуемость молекул нуклеиновых кислот, которые их содержат; и/или (13) сегменты нуклеиновых кислот, которые кодируют функции зависящей от условий репликации, например, репликацию у определенных хозяев или штаммов клеток-хозяев или при определенных условиях окружающей среды (например, температура, условия питания и т. п.).
Реагент на основе нуклеиновых кислот может иметь любую форму, применимую для транскрипции и/или трансляции in vivo. Нуклеиновая кислота иногда представляет собой плазмиду, такую как сверхспирализованная плазмида, иногда представляет собой дрожжевую искусственную хромосому (например, YAC), иногда представляет собой линейную нуклеиновую кислоту (например, линейную нуклеиновую кислоту, получаемую с помощью ПЦР, или фрагмент рестрикции), иногда является однонитевой, а иногда двухнитевой. Реагент на основе нуклеиновых кислот иногда получают с помощью способа, предусматривающего амплификацию, такого как способ полимеразной цепной реакции (ПЦР) или способ амплификации, опосредованной транскрипцией (ТМА). В ТМА два фермента используют в изотермической реакции с получением продуктов амплификации, детектируемых с помощью оптического излучения (например, Biochemistry, 1996 Jun 25;35(25):8429-38). Стандартные способы ПЦР известны (например, патенты США №№ 4683202; 4683195; 4965188 и 5656493) и обычно проводятся циклами. Каждый цикл включает тепловую денатурацию, при которой гибридные нуклеиновые кислоты диссоциируют; охлаждение, при котором олигонуклеотиды праймера гибридизируются; и удлинение олигонуклеотидов с помощью полимеразы (то есть Taq-полимеразы). Примером циклического способа ПЦР является обработка образца при 95°С в течение 5 минут; повторение сорока пяти циклов, предусматривающих 95°С в течение 1 минуты, 59°С в течение 1 минуты 10 секунд и 72°С в течение 1 минуты 30 секунд; и затем обработка образца при 72°С в течение 5 минут. Многократные циклы часто выполняют с применением коммерчески доступного термоциклера. Продукты амплификации ПЦР иногда хранят в течение некоторого времени при более низкой температуре (например, при 4°С) и иногда замораживают (например, при -20°С) до анализа.
Наборы/готовые изделия
В данном документе в определенных вариантах осуществления раскрыты наборы и готовые изделия для применения с одним или несколькими способами, описанными в данном документе. Такие наборы включают носитель, упаковку или контейнер, который разделен на части для приема одного или нескольких контейнеров, таких как флаконы, пробирки и т. п., причем каждый из контейнеров содержит один из отдельных элементов, которые должны использоваться в способе, описанном в данном документе. Подходящие контейнеры включают, например, бутылки, флаконы, шприцы и пробирки. В одном варианте осуществления контейнеры изготовлены из различных материалов, таких как стекло или пластик.
В некоторых вариантах осуществления набор включает подходящий упаковочный материал для размещения содержимого набора. В некоторых случаях упаковочный материал изготавливают хорошо известными способами предпочтительно с обеспечением стерильной неконтаминированной среды. Используемые в данном документе упаковочные материалы могут включать, например, материалы, обычно используемые в коммерческих наборах, продаваемых для применения с системами секвенирования нуклеиновых кислот. Иллюстративные упаковочные материалы включают без ограничения стекло, пластик, бумагу, фольгу и т. п., способные удерживать в установленных пределах компонент, изложенный в данном документе.
Упаковочный материал может предусматривать этикетку, на которой указано конкретное применение компонентов. Применение набора, которое указано на этикетке, может представлять собой один или несколько способов, изложенных в данном документе, в зависимости от конкретной комбинации компонентов, присутствующих в наборе. Например, на этикетке может быть указано, что набор применим для способа синтеза полинуклеотида или для способа определения последовательности нуклеиновой кислоты.
Инструкции по применению упакованных реагентов или компонентов также могут быть включены в набор. Инструкции, как правило, включают материальное выражение, описывающее параметры реакции, такие как относительные количества компонентов набора и образца, подлежащие смешиванию, периоды сохранения при смешивании реагента/образца, температура, буферные условия и т. п.
Понятно, что не все компоненты, необходимые для конкретной реакции, должны присутствовать в конкретном наборе. Скорее один или несколько дополнительных компонентов могут быть предоставлены из других источников. В инструкциях, поставляемых с набором, может(-гут) идентифицироваться дополнительный(-е) компонент(-ы), который(-е) должны быть предоставлены, и где их можно получить.
В некоторых вариантах осуществления предусматривается набор, который применим для стабильного встраивания неприродной нуклеиновой кислоты в клеточную нуклеиновую кислоту, например, с применением способов, предусмотренных настоящим изобретением для получения полученных методами генной инженерии клеток. Водном варианте осуществления набор, описанный в данном документе, включает полученную методами генной инженерии клетку и одну или несколько неприродных нуклеиновых кислот. В другом варианте осуществления описанный в данном документе набор включает выделенную и очищенную плазмиду, содержащую последовательность, выбранную из SEQ ID NO: 1-32.
В дополнительных вариантах осуществления в наборе, описанном в данном документе, предоставляют клетку и молекулу нуклеиновой кислоты, содержащую гетерологичный ген, для встраивания в клетку, чтобы тем самым обеспечить полученную методами генной инженерии клетку, такую как векторы экспрессии, содержащие нуклеиновую кислоту по любому из вариантов осуществления, описанных выше в данном параграфе.
Определенная терминология
Если не указано иное, все технические и научные термины, используемые в данном документе, имеют то же значение, которое обычно подразумевается специалистом в данной области техники, к которой принадлежит заявленный объект изобретения. Следует понимать, что приведенное выше общее описание и нижеследующее подробное описание являются лишь иллюстративными и пояснительными и не ограничивают какой-либо заявленный объект изобретения. В данной заявке применение единственного числа включает множественное число, если специально не указано иное. Следует отметить, что использованные в описании и прилагаемой формуле изобретения формы единственного числа, включают определяемые объекты во множественном числе, если из контекста явно не следует иное. В данной заявке применение "или" означает "и/или", если не указано иное. Кроме того, применение термина "включая", а также других форм, таких как "включать", "включает" и "включенный", не является ограничивающим.
Как используется в данном документе, диапазоны и количества могут быть выражены как "приблизительно" конкретное значение или диапазон. Термин "приблизительно" также включает точное количество. Следовательно "приблизительно 5 мкл" означает "приблизительно 5 мкл", а также "5 мкл." Как правило, термин "приблизительно" включает количество, которое, как ожидается, будет находиться в пределах ошибки эксперимента.
Применяемые в данном документе заголовки разделов служат только в организационных целях и не должны пониматься как ограничивающие описываемый объект.
ПРИМЕРЫ
Данные примеры представлены исключительно в иллюстративных целях и не ограничивают объем представленной в данном документе формулы изобретения.
Пример 1. Определение способности клеток удерживать или терять UBP в E. coli
В условиях равновесного состояния ДНК, содержащая UBP dNaM-dTPT3, реплицировалась in vitro с эффективностью, близкой к эффективности полностью природного аналога; однако эти показатели, вероятно, ограничены диссоциацией продукта. Репликация in vivo является более процессивной и, соответственно, с меньшей вероятностью будет ограничена диссоциацией продукта. Следовательно, репликация ДНК, содержащей UBP, в SSO может быть менее эффективной, чем репликация полностью природной ДНК, и, в свою очередь, может привести к прерыванию репликативных вилок. Кроме того, исследования структур показали, что UBP принимает форму подобной модели Уотсона-Крика структуры во время вставки трифосфата, но после вставки UBP принимает форму интеркалированной структуры с перекрещивающейся нитью, которая индуцирует локальные нарушения спирали.8,9 Клетки воспринимают как прерванные репликативные вилки, так и нарушения спирали как признаки повреждения ДНК и инициируют программы восстановления или допускают нуклеотиды, приводящие к нарушениям, что, как предполагают авторы настоящего изобретения, может способствовать потере UBP.
Чтобы определить, как клетки сохраняют или теряют UBP, изучали эффекты блокирования этих путей. Результаты показывают, что ни эксцизионная репарация нуклеотидов (NER), ни SOS-ответ не вносят значительного вклада в сохранение или потерю UBP. И наоборот, все из нормальной полимеразы в реплисоме, ДНК-полимеразы III (Pol III), Pol II и метил-направленной репарации ошибочно спаренных оснований (MMR) способствуют сохранению UBP; в то время как рекомбинационная репарация (RER) репликативных вилок, которые прерываются, обеспечивает основной путь к потере UBP. Затем реплисома SOO перепрограммировалась с обеспечением способности не только лучше удерживать UBP в плазмиде, но также стабильно сохранять UBP в ее хромосоме.
Эксцизионная репарация нуклеотидов не способствует сохранению или потере UBP
Как правило, E. coli реагирует на повреждение ДНК посредством прямого обращения повреждения, эксцизионной репарации оснований, NER, MMR, RER и SOS-ответа. Ни прямое обращение повреждения, ни эксцизионная репарация оснований, вероятно, не способствуют сохранению или потере UBP, потому что эти пути зависят от ферментов, которые распознают специфические формы повреждения ДНК, которые с низкой вероятностью будут имитироваться UBP. Напротив, NER, MMR, RER и SOS-ответ индуцируются сигналами, менее специфическими в отношении структуры. Чтобы начать исследовать, как клеткам удается удерживать UBP в своих ДНК, исследовали NER, которая опосредована независимо от репликации комплексом белков, которые сканируют ДНК на предмет нарушений, возникающих в результате объемных повреждений, которые могут имитироваться UBP. Вклад NER в сохранение или потерю UBP изучали путем делеции uvrC, которая кодирует важный компонент NER, из родительского SSO (E. coli BL21(DE3)+pACS2 (фигура 4)). Репликация ДНК, содержащей UBP dNaM-dTPT3, расположенной в двух разных контекстах последовательности в плазмидах pINF1 и pINF2, не была затронута делецией uvrC, что указывает на то, что NER не вносит вклад в сохранение или потерю UBP (фигура 1B).
Метил-направленная репарация ошибочно спаренных оснований повышает сохранение UBP
Затем исследовали MMR, которая обеспечивает критическую первую проверку новой синтезированной ДНК, когда она выходит из ДНК-полимеразы во время репликации и опосредуется комплексом белков, который распознает нарушения спирали, вызванные ошибочно спаренными природными нуклеотидами. При выявлении ошибки комплекс MMR разрывает новую синтезированную неметилированную нить, что, в свою очередь, приводит к образованию гэпа и последующему повторному синтезу ДНК. В отличие от NER, инактивация MMR посредством делеции mutH приводила к снижению сохранения UBP как в отношении pINF1, так и в отношении pINF2 (фигура 1B). Эти результаты показывают, что нарушения спирали, связанные с UBP, не являются достаточно серьезными, чтобы активировать MMR, или что неприродные нуклеотиды не могут быть удалены, но при этом нарушения, вызванные спариванием неприродного и природного нуклеотида, распознаются и обрабатываются посредством MMR. Таким образом, MMR, по-видимому, эффективно распознает UBP как подобную природной и селективно удаляет ошибочно спаренные природные нуклеотиды, тем самым поддерживая стабильное расширение генетического алфавита.
Рекомбинационная репарация обеспечивает основной путь к потере UBP
RER опосредуется RecA, который формирует филаменты на однонитевой ДНК перед прерванными репликативными вилками, что, в свою очередь, способствует образованию промежуточных продуктов рекомбинации и переключению на гомологичную матрицу для продолжения репликации ДНК. SOS-ответ индуцируется, когда одни и те же филаменты, сформированные с помощью RecA, способствуют расщеплению SOS-репрессора LexA, что приводит к дерепрессии ряда генов, связанных устойчивостью к повреждению ДНК/репарацией поврежденной ДНК, что вызывает прерывание вилки. Авторы настоящего изобретения исследовали совокупный вклад RER и SOS-ответа посредством делеции recA и наблюдали значительное повышение сохранения UBP в отношении pINF1 (фигура 1B). Для дальнейшего изучения вклада RecA сохранение UBP в более проблематичных последовательностях, обеспечиваемых pINF3, pINF4 и pINF5, измеряли в ΔrecA SSO (фигура 1C). В этих контекстах последовательности отсутствие recA приводило к более значительному повышению сохранения UBP.
Чтобы определить, облегчает ли делеция recA сохранение UBP путем абляции RER или путем предотвращения индукции SOS-ответа, исследовали SSO, который не способен индуцировать SOS-ответ, но который является компетентным в отношении RER (SSO lexA(S119A)) (фигура 1C). В то время как селективное подавление SOS-ответа приводило к умеренному повышению сохранения UBP в отношении pINF3, это повышение было меньше, чем наблюдаемое с ΔrecA SSO. В отношении pINF4 и pINF5 селективное подавление SOS-ответа приводило только к умеренным повышениям сохранения UBP, которое было значительно ниже наблюдаемых с recA SSO. Эти результаты демонстрируют, что потеря UBP, опосредованная RecA, в большей степени происходит посредством RER, а не посредством индукции SOS-ответа.
Pol II способствует репликации ДНК, содержащей UBP
Хотя данные свидетельствуют о том, что потеря UBP в большей степени опосредуется RER, предельное и специфическое в отношении последовательности повышение сохранения UBP с lexA(S119A) SSO указывает на то, что один или несколько белков, регулируемых SOS-ответом, также могут вносить свой вклад. Исследовали вклад трех SOS-регулируемых ДНК-полимераз Pol II, Pol IV и Pol V. Действительно, Pol IV и Pol V являются полимеразами, участвующими в синтезе ДНК "через повреждения", которые хорошо известны своей способностью опосредовать синтез ДНК через "неинструктивные" поврежденные нуклеотиды. Однако делеция и dinB, и umuCD (которые кодируют Pol IV и предшественника Pol V, соответственно) не влияла на сохранение UBP ни в отношении pINF1, ни в отношении pINF2 (фигура 1D). В отличие от ΔdinBΔumuDC SSO делеция polB (который кодирует Pol II) приводила к резкому повышению потери UBP как в отношении pINF1, так и в отношении pINF2 (фигура 1D). В целом, эти данные демонстрируют, что RER представляет основной путь к потере UBP, и что Pol II обеспечивает важный путь для сохранения UBP. В то время как продуцирование Pol II повышается вследствие индукции SOS-ответа, данные свидетельствуют о том, что его полезные эффекты превышаются вредными эффектами параллельно индуцированной RER.
ДНК-полимеразы III также способствуют репликации ДНК, содержащей UBP
Уменьшенное, но все еще выявляемое сохранение UBP в ΔpolB SSO, наряду с незначительными эффектами делеции генов, кодирующих Pol IV и Pol V, убедительно свидетельствуют о том, что одна или обе оставшиеся ДНК-полимеразы Pol I и Pol III также должны способствовать сохранению UBP. Чтобы специфически исследовать, способствуют ли Pol I или Pol III репликации ДНК, содержащей UBP, авторы настоящего изобретения сконструировали и охарактеризовали штаммы, у которых их 3'-5'-экзонуклеазная ("корректирующая") активность была устранена или нарушена мутацией (Pol Iexo-, polA(D424A, K890R) и Pol IIIexo-, dnaQ(D12N), соответственно (фигура 4 и фигура 6). Хотя устранение экзонуклеазной активности Pol I не влияло на сохранение UBP, мутант с дефицитом экзонуклеазы Pol III продемонстрировал резкое снижение сохранения UBP. Эти данные четко показывают то, что в клетках дикого типа Pol III, но не Pol I, способствует репликации ДНК, содержащей UBP.
Чтобы определить, были ли какие-либо эффекты мутаций Pol I или Pol III замаскированы посредством активностей Pol II и/или RER, исследовали сохранение UBP в ΔpolB или ΔpolBΔrecA SSO. Результаты показывают, что UBP хорошо удерживалась с ΔpolBΔrecA SSO, демонстрируя, что полимеразы, отличные от Pol II, способны опосредовать высокий уровень сохранения UBP в отсутствие конкуренции с потерей, опосредованной RER (фигура 1D). Мутант экзонуклеазы Pol III снова показал снижение сохранение UBP как в ΔpolB, так и в ΔpolBΔrecA SSO. Однако в отличие от клеток дикого типа устранение активности экзонуклеазы Pol I имело значительные и противоположные эффекты в отношении ΔpolB и ΔpolBΔrecA SSO, при которых сохранение повышалось и снижалось, соответственно. Эти данные показывают, что в дополнение к Pol II Pol III способствует сохранению UBP, а в отсутствие RER Pol I также способствует этому.
Модель для репликации ДНК, содержащей UBP
Не ограничиваясь какой-либо конкретной теорией, результаты, описанные в данном документе, подсказывают следующую модель для репликации ДНК, содержащей dNaM-dTPT3 UBP в E. coli SSO (фигура 2). Если реплисома с Pol III встречается с неприродным нуклеотидом в ходе процессивной репликации ведущей или отстающей нити, Pol III включает либо природный, либо неприродный нуклеотид. Если включается природный нуклеотид, то скорость коррекции является конкурентоспособной и, возможно, более эффективной, чем продолжающееся удлинение, и, таким образом, природный нуклеотид обычно вырезается вследствие корректирующей активности Pol III. Однако, если синтезируется корректная UBP, более эффективное удлинение предотвращает вырезание, и реплисома продолжает синтезировать ДНК. При выходе из полимеразы растущий дуплекс сканируется комплексом MMR, что дополнительно повышает сохранение UBP, преимущественно устраняя любые ошибочно спаренные природные нуклеотиды, которые избежали коррекции.
Поскольку удлинение даже корректной UBP, вероятно, будет менее эффективным, чем природный синтез, Pol III также может диссоциировать. Прерванная вилка, вероятно, с удлиняющейся нитью, оканчивающейся непосредственно перед неприродным нуклеотидом в матрице, теперь является субстратом для RER, которая повторно инициирует синтез с использованием гомологичной природной последовательности и, таким образом, обеспечивает доминантный механизм потери UBP. Однако в конкуренции с RER, опосредованной RecA, Pol II может спасти прерванную вилку и возобновить синтез с высоким уровнем сохранения UBP, после чего она предположительно уступает Pol III и восстановлению нормальной репликативной вилки. Вклад Pol I является более сложным. В клетках дикого типа Pol I, по-видимому, не способствует репликации ДНК, содержащей UBP. Напротив, в отсутствие Pol II и RecA Pol I действительно вносит вклад, и, соответственно, устранение экзонуклеазной активности Pol I приводит к снижению сохранения UBP. Однако, если экзонуклеазная активность устраняется, Pol I может вносить свой вклад, если Pol II устраняется, и в этом случае она повышает показатель сохранения за счет конкуренции с RER.
Принято считать, что Pol II выполняет две предполагаемые роли: (1) при повторном старте репликации, когда Pol II спасает прерванные вилки после того, как в результате синтеза с участием Pol III образуется ошибочное спаривание, которое она не может эффективно удлинить; и (2) Pol II должна конкурировать с RER, чтобы заполнить гэпы, созданные NER, как часть клеточного ответа на ДНК с межнитевой поперечной сшивкой. Интересно отметить, что вызванная роль Pol II в спасении репликативных вилок, прерванных на UBP, в конкуренции с RER, поразительно похожа на аспекты обеих предполагаемых природных ролей. Однако этот эффект в отношении репликации ДНК, содержащей UBP, приводит к образованию наиболее значимого фенотипа, когда-либо наблюдавшегося при его устранении.
Оптимизация SSO
Удержание UBP может быть оптимизировано путем манипуляции с RecA и Pol II. Чтобы исследовать эту возможность, SSO оптимизировали с отсутствием recA и с или без Pol II, конститутивно экспрессируемой на SOS-дерепрессируемых уровнях (ΔrecA и Pol II+ΔrecA, соответственно (фигура 6). Эти штаммы (YZ3) также экспрессировали оптимизированный транспортер PtNTT2 из хромосомного локуса (ΔlacZYA::PlacUV5-PtNTT2(66-575)) (фигура 4). Для сравнения использовали штамм дикого типа с тем же интегрированным в хромосому транспортером (WT-Opt). SSO трансформировали с помощью pINF1, pINF5 или pINF6 (фигура 3А), при этом pINF6 встраивала UBP в последовательность, где его сохранение является особенно проблематичным, и плазмиды извлекали из отдельных колоний для характеристики сохранения UBP. В этом случае вводили отбор на твердой ростовой среде для анализа сохранения UBP в отдельных клонах, в отличие от средних сохранений UBP, определяемых в предыдущих экспериментах. Распределение сохранений UBP наблюдали с каждой плазмидой во всех SSO, однако распределения были смещены в сторону более высокого уровня сохранения с ΔrecA-Opt и особенно Pol II+ΔrecA SSO по сравнению с WT-Opt SSO. Кроме того, только Pol II+ΔrecA SSO продуцировал клоны с не поддающейся выявлению потерей UBP в контексте каждой исследемой последовательности. Следует отметить, что это было даже верно для pINF6, для которой сохранение в SSO дикого типа не поддавалось выявлению, и только умеренным (<60%), при обеспечении отбором с помощью Cas9.
Оценивали способность генетически оптимизированных ΔrecA-Opt и Pol II+ΔrecA SSO облегчать интеграцию UBP в хромосому. Конструировали интеграционную кассету, которая нацеливает последовательность GTAXTGA (X=NaM) в локус arsB, и использовали метод рекомбинационной инженерии с Lambda Red для интеграции кассеты в хромосомы WT-Opt, ΔrecA-Opt и Pol II+ΔrecA SSO. В результате скрининга интегрантов в отношении сохранения UBP идентифицировали клоны со 100% сохранением из ΔrecA-Opt и Pol II+ΔrecA SSO, но, несмотря на значительные усилия, авторам настоящего изобретения не удалось выделить клоны WT-Opt с более чем 91% сохранением UBP (фигура 7), что свидетельствует о том, что значительная потеря UBP произошла во время необходимой стадии роста. Чтобы охарактеризовать эффект интегрированной в хромосому UBP, аликвоты клеток в середине логарифмической фазы роста инокулировали в ростовую среду с dNaMTP и dTPT3TP или без таковых (фигура 3B, фигура 8). Интегранты ΔrecA-Opt и Pol II+ΔrecA плохо росли, если не было обеспечено наличие не встречающихся в природе трифосфатов, что согласуется с моделью, согласно которой RER требуется для эффективного обхода неприродного нуклеотида в матрице. Однако этот дефект роста был почти полностью устранен в обоих SSO при обеспечении dNaMTP и dTPT3TP. Таким образом, делеция recA и надэкспрессия Pol II способствуют высокому уровню сохранения UBP в хромосоме только лишь с минимальными последствиями для приспособленности.
Наконец, оценивали, способствуют ли генетически оптимизированные штаммы долгосрочной стабильности интегрированной в хромосому UBP. Предыдущие исследования продемонстрировали, что без Cas9-опосредованного отбора в отношении сохранения передающаяся через плазмиду UBP утрачивается во время длительного роста. Интегранты WT-Opt, ΔrecA-Opt и Pol II+ΔrecA последовательно пересевали на протяжении периода роста многих поколений и характеризовали сохранение UBP (фигура 3C). С WT-Opt потеря UBP происходила медленно примерно к 40му поколению, а затем происходила быстрее с полной потерей, наблюдаемой в 90ом поколении. По-видимому, двухфазная кинетика потери предполагает, что по меньшей мере один дополнительный процесс вносит вклад в дополнение к RER. В самом деле, секвенирование выявило крупную хромосомную перестройку, в результате которой происходило устранение гена PtNTT2 во время резкого снижения сохранения UBP (фигура 10). В отличие от WT-Opt, как ΔrecA-Opt, так и Pol II+ΔrecA SSO PtNTT2 оставался интактным и сохранение геномной UBP оставалось высоким, особенно с Pol II+ΔrecA SSO, где оно оставалось > 55% после 137 поколений.
Эти результаты демонстрируют, что делеция recA не только способствует сохранению UBP во время репликации, но и значительно повышает стабильность транспортера при длительном росте. Наблюдаемое сохранение соответствует точности на удвоение, превышающей 99,6%, что, в свою очередь, соответствует потере хромосомной UBP только в небольшой части клеток (< 0,4%) на удвоение. Таким образом, наряду с системой устранения ошибок Cas9, которая не использовалась в данной работе, эта система предотвращения ошибок должна обеспечивать сохранение UBP в широком диапазоне контекстов последовательности, что, в свою очередь, должно обеспечивать возможность сохранения совокупности новой информации, обеспечиваемой за счет UBP.
Со времени последнего общего предка всего живого на Земле биологическая информация хранилась в четырехбуквенном алфавите. Перепрограммированная реплисома Pol II+ΔrecA SSO представляет значительный прогресс в направлении неограниченного расширения этого алфавита, и первый прогресс был опосредован оптимизацией самой клетки. В то время как основные цели исследования заключались в том, чтобы понять, как реплицируется UBP, и использовать эту информацию для оптимизации SSO, результаты также обеспечивают новый путь к изучению того, как обычно управляется проблематичная репликация. Например, хотя данные свидетельствуют о том, что значительная часть ДНК, содержащей UBP, реплицируется с помощью Pol III, также четко показано, что значительное количество не делает этого, и в этих случаях данные показывают интересную конкуренцию между опосредованным Pol II повторным стартом репликации и RecA-опосредованной RER. Такие виды конкуренции могут быть распространены во время проблематичной репликации, которая могла способствовать проблемам в идентификации обычных ролей Pol II. Более того, неспособность MMR распознавать UBP позволяет предположить, что одних только нарушений спирали недостаточно, и что процесс требует специфических взаимодействий с нуклеотидными основаниями, которые недоступны с неприродными нуклеотидами. Наконец, повышенная генетическая стабильность, обеспечиваемая делецией recA, может также иметь существенное значение для способов, направленных на расширение генетического кода посредством амбер-супрессии, поскольку при осуществлении этих способов также возникают трудности вследствие генетической нестабильности при длительном росте.23 Независимо от этих интересных вопросов, теперь перепрограммированный SSO позволяет более стабильно удерживать расширенную биологическую информацию, в том числе в пределах его хромосомы, и с предыдущей демонстрацией того, что эта информация может быть получена в форме белков с неканоническими аминокислотами, должна обеспечивать платформу для достижения центральной цели синтетической биологии - создания жизни с новыми формами и функциями.
Пример 2. Способы и материалы
Конструкция на основе ДНК, содержащая pINF/UBP
pINF (фигура S8) конструировали посредством сборки Golden Gate pUCX2 и вставки dsDNA, содержащей пару dNaM-dTPT3, как описано ранее3 со следующими модификациями. dsDNA, содержащую UBP, получали посредством ПЦР с объемом реакционной смеси 50 мкл с химически синтезированными содержащими UBP олигонуклеотидами (0,025 нг/мкл), праймерами, обеспечивающими введение сайтов BsaI и характеризующимися гомологией по отношению к вектору (1 мкМ, таблица S1), dTPT3TP (100 мкМ), dNaMTP (100 мкМ), dNTP (200 мкМ), MgSO4 (1,2 мМ), ДНК-полимеразой OneTaq (0,025 ед./мкл) и стандартным реакционным буфером OneTaq (1×, New England Biolabs). Реакцию периодически повторяли в следующем температурном режиме в системе MJ Research PTC-200 (время в минутах:секундах): [94°C 00:30 | 25 × (94°C 00:30 | 47°C 00:30 | 68°C 04:00)]. Полученную dsDNA, содержащую UBP, очищали с использованием DNA Clean & Concentrator-5 (Zymo Research) в соответствии с рекомендациями производителя. Для сборки pINF объединяли pUCX2 (1 мкг) и вставленную ДНК при молярном соотношении 1:4 в реакционном объеме 80 мкл с АТФ (1 мМ), T4 ДНК-лигазой (6,65 ед./мкл, New England Biolabs), BsaI-HF (0,66 ед./мкл, New England Biolabs) и буфером CutSmart (1×, New England Biolabs) и подвергали следующему температурному режиму: [37°C 20 мин. | 40 × (37°C 5 мин. | 16°C 10 мин. | 22°C 5 мин.) | 37°C 20 мин. | 50°C 15 мин. | 70°C 30 мин.]. Затем добавляли BsaI-HF (0,33 ед./мкл) и экзонуклеазу T5 (0,16 ед./мкл, New England Biolabs) и реакционную смесь инкубировали при 37°C в течение 1 часа для удаления какого-либо pUCX2 без вставки. Эту реакционную смесь очищали с использованием DNA Clean & Concentrator-5 в соответствии с рекомендациями производителя, за исключением того, что реакционные смеси смешивали с 3 объемами 1:1 буфера для промывания ДНК:буфера для связывания ДНК перед связыванием с колонкой с диоксидом кремния.
Получали кассету нокина UBP для локуса arsB (фигура S4) посредством ПЦР с перекрывающимися праймерами с участием dsDNA размером 150 п. о., содержащей UBP и ген устойчивости к канамицину pKD13. ДНК размером 150 п. о. получали посредством ПЦР с объемом реакционной смеси 50 мкл с использованием тех же условий для реакционного раствора, что описаны выше, и следующего температурного режима (время в минутах:секундах): [98°C 02:00 | 5 × (98°C 00:10 | 50°C 00:10 | 68°C 04:00) | 15 × (98°C 00:10 | 58°C 00:10 | 68°C 04:00)]. Ампликон гена устойчивости к канамицину получали посредством ПЦР-амплификации pKD13 с использованием ДНК-полимеразы Q5 согласно рекомендациям производителя. Амплификацию длинных ДНК (приблизительно 200 п. о. или длиннее) ингибировали присутствием dTPT3TP. Поэтому, выполняли сборочную ПЦР с перекрыванием ампликона, содержащего UBP, и ампликона гена устойчивости к канамицину в большом масштабе (2 мл реакционной смеси, разделенной на 40 отдельных реакционных объемов по 50 мкл) со следующими условиями для раствора: Ампликон, содержащий UBP (0,02 нг/мкл), ампликон гена устойчивости к канамицину (0,02 нг/мкл), праймеры (1 мкМ, таблица S1), dTPT3TP (5 мкМ), dNaMTP (100 мкМ), dNTP (200 мкМ), MgSO4 (1,2 мМ), ДНК-полимераза OneTaq (0,025 ед./мкл) и стандартный реакционный буфер OneTaq (1×). Реакционные смеси подвергали следующему температурному режиму (время в минутах:секундах): [98°C 02:00 | 5 × (98°C 00:10 | 50°C 00:10 | 68°C 04:00) | 15 × (98°C 00:10 | 58°C 00:10 | 68°C 04:00)]. Данные реакционные смеси объединяли и концентрировали с использованием DNA Clean & Concentrator-5 в соответствии с рекомендациями производителя.
Репликация UBP in vivo в клетках с нокаутом генов
Все генетические нокауты (фигура 1 и фигура S2) анализировали по их способности реплицировать переносимые pINF UBP согласно следующему протоколу. Электрокомпетентные клетки получали из 45 мл культуры клеток в середине логарифмической фазы роста (OD600 0,35-0,7) путем осаждения клеток центрифугированием и двукратного промывания с 50 мл стерильной diH2O при 4°C. Промытые клетки повторно суспендировали в стерильной diH2O при 4°C при конечной OD600 40-60. 50 мкл клеток смешивали с 2 нг собранной посредством Golden Gate pINF и переносили в кювету для электропорации (с 2 мм щелью, № по каталогу FB102, Fisher Scientific). Электропорацию выполняли с использованием Gene Pulser II (BioRad) в соответствии с рекомендациями производителя (напряжение 25 кВ, конденсатор 2,5 мкФ, резистор 200 ω). Трансформированные клетки разбавляли в 950 мкл 2×YT, содержащей хлорамфеникол (33 мкг/мл) и фосфат калия (50 мМ, pH 7). 40 мкл разбавленных клеток далее разбавляли в конечном объеме 200 мкл 2×YT, содержащей хлорамфеникол (33 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), переносили в пробирку объемом 1,5 мл, и обеспечивали восстановление в течение 1 часа при 37°C и 230 об./мин. 10 мкл восстановленных клеток разбавляли в конечном объеме 100 мкл 2×YT, содержащей хлорамфеникол (33 мкг/мл) и ампициллин (100 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и фосфат калия (50 мМ, pH 7), в лунке 96-луночного планшета (исходный № 655161, Greiner Bio-One). Кроме того, восстановленные клетки высевали на агаровую 2×YT (2%), содержащую ампициллин (100 мкг/мл) и фосфат калия (50 мМ, pH 7), для оценивания эффективности трансформации. 96-Луночный планшет и планшет для оценивания эффективности трансформации держали при 4°C и 37°C на протяжении ночи (приблизительно 12 часов), соответственно. Планшет для оценивания эффективности трансформации проверяли, чтобы убедиться, что все образцы в 96-луночном планшете получали по меньшей мере 50 колониеобразующих единиц перед охлаждением. Затем 96-луночному планшету обеспечивали условия 37°C и 230 об./мин. Клетки осаждали посредством центрифугирования, декантировали и замораживали после достижения 0,6-0,92 OD600. Реплицированные in vivo pINF выделяли с использованием набора ZR Plasmid Miniprep-Classic (Zymo Research) и 5-мкг колонки с диоксидом кремния (№ по каталогу D4003, Zymo Research) в соответствии с рекомендациями производителя и переходили к ПЦР-анализу со сдвигом биотина (см. вспомогательную информацию). Эту процедуру выполняли по меньшей мере в трех параллелях для каждого нокаутного штамма, начиная с получения электрокомпетентных клеток.
Следует отметить, что при данных условиях репликаты и штаммы подвергаются сходному, но не идентичному числу удвоений клеток в ходе эксперимента по репликации pINF. Однако из-за нерегулируемого начала репликации pINF совпадение удвоений клеток между репликатами и штаммами действительно соответствует совпадению числа событий репликации pINF. Следовательно, данные на фигурах 1 и 3А представлены в виде значений сохранения в % (см. дополнительную информацию для дальнейшего обсуждения) в отличие от оцениваемых значений точности и должны интерпретироваться как таковые.
Изучение клональных pINF
Способность оптимизированных штаммов клонировать pINF оценивали (фигура 3А), как описано выше, со следующими модификациями. После восстановления разбавления восстановленной культуры высевали на 2×YT, содержащую агар (2%), карбенициллин (100 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7). Планшеты инкубировали при 37°C в течение приблизительно 12 часов. Отдельные колонии отбирали и переносили в 100 мкл 2×YT, содержащей карбенициллин (100 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), в лунке 96-луночного планшета. 96-луночный планшет держали при 4°C в течение приблизительно 12 часов, а затем ему обеспечивали условия 37°C и 230 об./мин. Клетки осаждали посредством центрифугирования, декантировали и замораживали после достижения OD600 0,6-0,9. Реплицированные in vivo pINF выделяли с использованием набора ZR Plasmid Miniprep-Classic в соответствии с рекомендациями производителя и передавали на ПЦР-анализ со сдвигом биотина (см. вспомогательную информацию).
Следует отметить, что штамм Pol II+ΔrecA, используемый в данных экспериментах (фигура 3A), имел кассету neo в прежнем локусе recA (P_polB(-)lexA-polB+FRT+ΔrecA+KanR+lacZYA:: P_lacUV5-ΔΔ(CoOp) col 2.1, таблица S1).
Интеграция UBP в arsB
Интеграционную кассету UBP для локуса arsB конструировали, как описано выше и изображено на фигуре S4. Интеграцию этой кассеты выполняли с использованием стандартного метода рекомбинационной инженерии с Lambda Red 24 со следующими модификациями. Инкубируемые на протяжении ночи культуры штаммов (WT-Opt, ΔrecA-Opt и Pol II+ΔrecA-Opt в 2×YT, содержащей хлорамфеникол (5 мкг/мл) и KPi (50 мМ, pH 7)), имеющих pKD46, разбавляли до 0,03 OD600 в 2×YT, содержащей ампициллин (100 мкг/мл), хлорамфеникол (5 мкг/мл) и KPi (50 мМ, pH 7). Культуры выращивали до приблизительно 0,1 OD600, затем индуцировали с помощью 0,4% L-(+)-арабинозы и обеспечивали продолжение роста до приблизительно 0,4 OD600. Из этих культур получали электрокомпетентные клетки, как описано выше. Смешивали 50 мкл электрокомпетентных клеток с 960 нг (5 мкл при 192 нг/мкл) интеграционной кассеты, описанной выше и электропорировали, как описано выше. Трансформированные клетки разбавляли до конечного объема 1 мл 2×YT, содержащей хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), переносили в пробирку объемом 1,5 мл, и обеспечивали восстановление в течение 2 часов при 37°C и 230 об./мин. Клетки осаждали посредством центрифугирования и повторно суспендировали в 115 мкл 2×YT, содержащей хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ), KPi (50 мМ, pH 7). 15 мкл образцов этой клеточной суспензии высевали на 2×YT, содержащую агар (2%), канамицин (50 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7). Планшеты инкубировали в течение 14-24 часов при 37°C. Колонии отбирали и переносили в 500 мкл 2×YT, содержащей канамицин (50 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ), KPi (50 мМ, pH 7) в 48-луночный планшет (исходный № 677180, Greiner Bio-One). Планшеты либо охлаждали при 4°C в течение ~ 12 часов с последующей инкубацией при 37°C и 230 об./мин., либо подвергали непосредственно инкубации. После достижения 0,6-1 OD600 из культур отбирали образцы следующим образом: 100 мкл объединяли с 100 мкл глицерина (50%) и замораживали при -80°C; 350 мкл осаждали посредством центрифугирования и замораживали для дальнейшего выделения геномной ДНК; 50 мкл осаждали посредством центрифугирования, один раз промывали 200 мкл diH2O, осаждали посредством центрифугирования и повторно суспендировали в 200 мкл.
Клеточные суспензии анализировали посредством ПЦР со сдвигом биотина в колонии (см. вспомогательную информацию). Геномную ДНК выделяли из сохраненных замороженных клеточных осадков для образцов, которые демонстрировали высокие процентные значения сдвига в отношении ПЦР со сдвигом биотина в колонии (≥ 80%) с набором PureLink Genomic DNA Mini (Thermo Fisher Scientific) в соответствии с рекомендациями производителя. Геномную ДНК анализировали посредством ПЦР со сдвигом биотина (см. вспомогательную информацию). Этот анализ выявил клоны с высоким уровнем сохранения (сохранениеВ ≥ 90%) для всех генетических фонов. Хотя эти результаты подтвердили успешную хромосомную интеграцию UBP и чрезвычайно высокий уровень сохранения UBP в хромосомной ДНК, предполагалось, что клетки расходовали dTPT3TP и dNaMTP в своей среде во время протокола интеграции с учетом требования протокола инкубировать клетки при высокой плотности клеток. Известно, что активно растущие культуры E. coli разлагают внеклеточные dTPT3TP и dNaMTP до соответствующих им ди- и монофосфата и нуклеозидных соединений.5 Чтобы оценить эту возможность, исходные глицериновые растворы образцов с наивысшим уровнем сохранения использовали для инокуляции 100 мкл 2×YT, содержащей канамицин (50 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), в 96-луночном планшете. Культуры выращивали до приблизительно 0,6 OD600 при 37°C и 230 об./мин. Клетки из этой культуры высевали, отбирали, выращивали и отбирали из них образцы, как описано выше. С помощью этой процедуры "пересева" быстро выявляли клоны из ΔrecA-Opt и Pol II+ΔrecA-Opt SSO с не поддающейся выявлению хромосомной потерей UBP (сохранениеВ=100%). Однако несмотря на скрининг 12 клонов для WT-Opt SSO клоны с сохранениемВ > 91% не обнаруживали. Поэтому авторы настоящего изобретения решили использовать интегрант WT-Opt (сохранениеВ=91%), который не подвергался процедуре пересева для экспериментов по времени удвоения и пассажированию. В случае ΔrecA-Opt и Pol II+ΔrecA-Opt авторы настоящего изобретения отбирали по одному клону с сохранениемВ=100% для экспериментов по времени удвоения и пассажированию.
Следует отметить, что штамм Pol II+ΔrecA, используемый в данных экспериментах (фигура 3B и фигура 3C), не имел кассеты neo в прежнем локусе recA (P_polB(-)lexA-polB+ΔrecA+FRT+lacZYA: :P_lacUV5-ΔΔ(CoOp) col 1.1, таблица S1).
Определение времени удвоения для штамма
Клетки в середине логарифмической фазы роста WT-Opt, ΔrecA-Opt и Pol II+ΔrecA-Opt SSO и соответствующие им интегранты хромосомной UBP (описанные выше) получали с использованием следующей процедуры. Насыщенные инкубированные на протяжении ночи культуры получали путем инокуляции 2×YT, содержащей хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), из исходных культур, хранящихся в глицериновом растворе, посредством укола в столбик со средой и выращивания на протяжении ночи (приблизительно 14 часов) при 37°C и 230 об./мин. Эти клетки разбавляли до 0,03 OD600 в 500 мкл 2×YT, содержащей хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), и выращивали при 37°C и 230 об./мин. Рост контролировали с помощью OD600. Как только клетки достигли середины логарифмической фазы роста (0,3-0,5 OD600), их разбавляли до 0,013 OD600 в 500 мкл 2×YT, содержащей хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), или 2×YT, содержащей хлорамфеникол (5 мкг/мл) и KPi (50 мМ, pH 7), в 48-луночном планшете и выращивали при 37°C и 230 об./мин. OD600 измеряли каждые 30 минут. Эту процедуру выполняли в трех параллелях для каждого штамма, начиная с инокуляции инкубированных на протяжении ночи культур.
Данные OD600 каждого эксперимента анализировали для получения теоретического времени удвоения клеток (фигура 3B и фигура S5). Измерения OD600, соответствующие экспоненциальной фазе роста (0,01-0,9), соответствовали следующей модели экспоненциального роста с использованием версии R 3.2.4:25
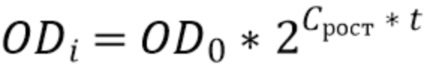
где ODi представляет собой OD600 в момент времени (t), OD0 представляет собой минимальное значение OD600 для данного набора данных, и СРост представляет собой константу роста. СРост подбирали с использованием команды "nls()". Время удвоения (DT) вычисляли с использованием следующего уравнения:
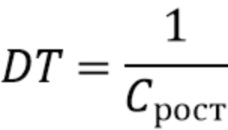
Пассажирование штаммов, несущих геномную UBP
Исходные культуры, хранящиеся в глицериновом растворе, интегрантов хромосомной UBP из WT-Opt, ΔrecA-Opt, и Pol II+ΔrecA-Opt SSO (описанной выше), полученные посредством укола в столбик со средой, использовали для инокуляции 500 мкл 2×YT, содержащей канамицин (50 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7). Клетки выращивали до середины логарифмической фазы роста (0,5-0,8 OD600) при 37°C и 230 об./мин, а затем разбавляли до 0,03 OD600 в 500 мкл 2×YT, содержащей канамицин (50 мкг/мл), хлорамфеникол (5 мкг/мл), dTPT3TP (37,5 мкМ), dNaMTP (150 мкМ) и KPi (50 мМ, pH 7), в 48-луночном планшете и выращивали при 37°C и 230 об./мин. Культуры, инокулированные при 0,03 OD600, считали отправной точкой (удвоения=0) для пассажирования. Культуры выращивали до 1-1,5 OD600, что соответствует приблизительно 5 удвоениям клеток. Этот рост от 0,03 до 1-1,5 OD600 считали одним "пассажем", при этом один пассаж соответствует приблизительно 5 удвоениям клеток. После достижения этими образцами 1-1,5 OD600 начинали другой пассаж путем разбавления клеток до 0,03 OD600 в свежей среде того же состава. После разбавления из культуры с 1-1,5 OD600 отбирали образцы следующим образом: 100 мкл объединяли со 100 мкл глицерина (50%) и замораживали при -80°C; 350 мкл осаждали посредством центрифугирования и замораживали для дальнейшего выделения геномной ДНК; и 50 мкл осаждали посредством центрифугирования, один раз промывали 200 мкл diH2O, осаждали посредством центрифугирования и повторно суспендировали в 200 мкл. Процесс пассажирования повторяли для в общей сложности 15 пассажей, что соответствует приблизительно 80 удвоениям клеток для всех трех штаммов.
На протяжении пассажирования проводили ПЦР-анализ со сдвигом биотина в колонии (см. вспомогательную информацию) в образцах клеточной суспензии. Это показало, что сохранение снизилось до < 10% в WT-Opt после 15 пассажей. Следовательно, этот штамм больше не пассажировали. Напротив, сохранение оставалось на уровне 60-80% в ΔrecA-Opt и Pol II+ΔrecA-Opt. Поэтому для этих штаммов был выполнен дополнительный пассаж, как указано выше. Теперь сохранение оставалось без изменений всего 16 пассажей. Следовательно, данные штаммы подвергали 4 дополнительным пассажам при более высоком коэффициенте разбавления, который соответствовал приблизительно 13 удвоениям клеток на пассаж (рост от приблизительно 0,0001 до 1-1,5 OD600). К этому моменту интегранты ΔrecA-Opt и Pol II+ΔrecA-Opt испытывали приблизительно 130 удвоений клеток, и сохранение UBP оставалось на уровне > 40% согласно ПЦР-анализу со сдвигом биотина в колонии. Дальнейшее пассажирование считали ненужным и эксперимент останавливали для более тщательного анализа образцов геномной ДНК, собранных во время пассажирования. Этот эксперимент выполняли в трех параллелях, начиная с инокуляции среды исходными культурами геномных интегрантов, хранящимися в глицериновом растворе, полученными посредством укола в столбик со средой.
После завершения эксперимента с пассажированием геномную ДНК выделяли и анализировали с помощью ПЦР со сдвигом биотина (фигура 3C) (см. вспомогательную информацию). Медленная, а затем быстрая потеря UBP в WT-Opt предполагала, что потере UBP способствовали несколько процессов. Предполагалось, что PlacUV5-PtNTT2(66-575) мог мутировать во время эксперимента, так как экспрессия PtNTT2 вызывает незначительный дефект роста.3 Таким образом, клетки, которые инактивируют транспортер посредством мутации, приобретают преимущество в отношении приспособленности, и могут быстро доминировать в экспериментальной популяции. Эту гипотезу изучали путем выделения отдельных клонов после окончания пассажирования WT-Opt и ПЦР-анализа очищенной геномной ДНК (см. вспомогательную информацию и фигуру S7). Праймер, "блуждающий" по нескольким клонам, показал, что все гены между cat и insB-4, включая PtNTT2 (66-575), были делетированы в этих клетках. Ген insB-4 кодирует один из двух белков, необходимых для транспозиции транспозона IS1.26 Секвенирование одного клона подтвердило, что IS1 вставлен в PtNTT2 (66-575) (T1495), что соответствует делеции пары оснований 15890.
После подтверждения события мутации PtNTT2 (66-575) появление делеционных мутантов оценивали с помощью ПЦР-анализа образцов геномной ДНК из пассажирования интегранта WT-Opt (см. вспомогательную информацию и фигуру S7B). Этот анализ показал, что несколько ампликонов с размерами, соответствующими IS1-опосредованным событиям делеции PtNTT2 (66-575), появляются в образцах пассажирования во время быстрой фазы потери UBP.
Также наблюдали, что один репликат интегранта Pol II+ΔrecA-Opt быстро терял UBP за то же время, что и интегранты WT-Opt, что убедительно свидетельствует о том, что этот репликат мог быть загрязнен клетками WT-Opt во время пассажирования. Эту возможность подтверждали с помощью ПЦР-анализа в колонии, который показал, что этот репликат загрязнялся клетками WT-Opt при пассажах, соответствующих быстрой потере UBP (см. вспомогательную информацию и фигуру S6). Поэтому данные по этому репликату использовали только из образцов без загрязнения клетками WT-Opt.
Бактериальные штаммы и плазмиды
Все штаммы, использованные в этом исследовании (таблица S1; предоставлена в виде отдельного вспомогательного файла), конструировали из E. coli-BL21 (DE3) посредством метода рекомбинационной инженерии с Lambda Red, если не указано иное. Кассеты нокаута гена получали посредством ПЦР-амплификации (с использованием либо OneTaq, либо Q5 в соответствии с рекомендациями производителя (New England Biolabs)) либо геномной ДНК штаммов из коллекции Keio, либо pKD13 с соответствующими праймерами (таблица S1). Функциональные генетические кассеты нокина polA(D424A, K890R) и Pol II+ (фигура S4) конструировали посредством ПЦР с перекрывающимися праймерами. Штаммы делали компетентными для импорта dXTP либо путем трансформации с помощью pACS2 или pACS2-dnaQ(D12N), либо путем интеграции кассеты PlacUV5-PtNTT2(66-575)+cat в локус lacZYA (фигура S1). Конструкция pACS2 и PlacUV5-PtNTT2 (66-575)+cat была описана ранее.3 pACS2-dnaQ(D12N) конструировали посредством сборки ПЦР-ампликонов методом Гибсона. Функцию PtNTT2 подтверждали в каждом соответствующем штамме с использованием анализа поглощения радиоактивного dATP.
Дефицит экзонуклеаз Pol I и III
Гены ДНК Pol I и III являются условно необходимыми и незаменимыми соответственно. Следовательно, в отличие от SOS-регулируемых полимераз, они не могут быть исследованы с помощью генетического нокаута. Вместо этого авторы настоящего изобретения конструировали мутантов с дефицитом 3'-5'-экзонуклеазы для этих ферментов. Pol I (polA) делали дефицитной по 3'-5'-экзонуклеазе путем мутации активного сайта его домена экзонуклеазы (D424A). Это осуществляли посредством двух фаз метода рекомбинационной инженерии с Lambda Red (фигура S4). Первую polA усекали до ее домена 5'-3'-экзонуклеазы (удаляя домены как полимеразы, так и 3'-5'-экзонуклеазы). Вторые домены полимеразы и 3'-5'-экзонуклеазы повторно вводили с мутацией D424A. Из-за длины гена ПЦР-мутации создавали в ампликоне, используемом для интеграций. Это привело к мутации K890R. Однако, поскольку K890 представляет собой поверхностный остаток в неупорядоченной петле белка, предполагали, что его мутация с заменой на аргинин будет оказывать минимальное влияние на функцию белка. Более того, мутация с заменой лизина на аргинин поддерживает приблизительный заряд и размер остатка.
Полный фермент ДНК Pol III представляет собой мультиферментный комплекс с отдельными ферментами полимеразы и 3'-5'-экзонуклеазы. Считают, что экзонуклеазный фермент (dnaQ) играет структурную роль в полном ферменте Pol III в дополнение к его редактирующей активности. Следовательно, делеция dnaQ устраняет редактирующую активность Pol III, а также предотвращает рост клеток, если только компенсаторные мутации не добавлены в другие части полного фермента. Поэтому авторы настоящего изобретения решили исследовать роль Pol III в репликации UBP посредством экспрессии мутанта мутатора dnaQ (D12N) из плазмиды pACS2+dnaQ(D12N) (фигура S1). Ранее было продемонстрировано, что экспрессия dnaQ(D12N) из мультикопийной плазмиды приводит к образованию фенотипа доминантного мутатора в E. coli, несмотря на экспрессию DnaQ дикого типа из хромосомной копии гена. pACS2+dnaQ(D12N) экспрессирует dnaQ(D12N) с обоими промоторами нативного гена.
Затраты на приспособленность генетической оптимизации SSO
Делеция recA явно приводит к значительному улучшению сохранения UBP во многих последовательностях. Хотя и очень желательная, делеция recA действительно влечет за собой определенные затраты на приспособленность. Известно, что штаммы с дефицитом recA характеризуются меньшей переносимостью повреждения ДНК. Однако, учитывая, что все краткосрочные применения SSO будут осуществляться в строго контролируемых средах, авторы настоящего изобретения предполагают, что это не будет проблематичным. Кроме того, делеция recA увеличивает время удвоения, как показано на фигуре S5. Однако эти эксперименты выполняли главным образом для иллюстрации различия в скорости роста для несущих хромосомную UBP штаммов, выращиваемых в присутствии или в отсутствии dNaMTP и dTPT3TP. Несколько факторов усложняют непосредственное отношение приспособленности штамма к измеряемому времени удвоения. Основным осложнением является то, что клетки в растворе могут увеличивать OD600, изменяя свою морфологию, а не увеличивая фактическое количество клеток. Несмотря на это, измеряемое время удвоения для L recA-Opt (на ~ 18 минут дольше, чем для WT-Opt) предполагает, что делеция recA приводит к значительному снижению скорости роста. Однако, учитывая преимущества этой модификации, эта сниженная скорость роста является приемлемым компромиссом. Следует также отметить, что некоторые точки данных на фигуре 8 трудно рационализировать. Например, присутствие хромосомной UBP, по-видимому, уменьшает время удвоения L recA-Opt и Pol II+L recA-Opt.
Анализ со сдвигом биотина
Сохранение UBP в pINF и хромосомной ДНК измеряли, как описано ранее, со следующими модификациями. Все ПЦР со сдвигом биотина выполняли в 15 мкл объеме с праймерами (1 мкМ, таблица S1), d5SICSTP (65 мкМ), dMMO2bioTP (65 мкМ), dNTP (400 мкМ), MgSO4 (2,2 мМ), ДНК-полимеразой OneTaq (0,018 ед./мкл), ДНК-полимеразой DeepVent (0,007 ед./мкл, New England Biolabs), SYBR Green I (1x, Thermo Fisher Scientific) и стандартным реакционным буфером OneTaq (1x). Количество ДНК образца, добавленное в ПЦР со сдвигом биотина, и температурный режим варьировали в зависимости от природы образца.
Для in vivo реплицированных pINF (фигура 1) из экспериментов с генетическим нокаутом точная концентрация ДНК pINF не может быть определена, поскольку ДНК pINF и pACS2 захватывали с помощью набора ZR Plasmid Miniprep-Classic. Поэтому 0,5 мкл (приблизительно 3 нг общей ДНК) очищенного образца использовали в качестве ДНК-матрицы для ПЦР со сдвигом биотина. Реакционные смеси подвергали следующему температурному режиму (время в минутах:секундах) с CFX Connect Real-Time PCR Detection System (BioRad): [96°C 02:00 | 12-18 x (96°C 00:15 | 48°C 00:15 | 68°C 04:00)]. Протекание реакции контролировали с помощью флуоресценции SYBR Green I, реакции останавливали и реакционные смеси хранили при 4°C в конце стадии с 68°C сразу после того, как реакция выходила из экспоненциальной фазы ПЦР (обычно 17 циклов) Для экспериментов с клональной pINF (фигура 3А) 3 нг очищенной плазмидной ДНК использовали в качестве ДНК-матрицы для ПЦР-анализа со сдвигом биотина. Реакционные смеси подвергали тому же температурному режиму и контролю, описанному выше.
Сконструированные с помощью Golden Gate pINF и содержащие UBP олигонуклеотиды амплифицировали, как описано выше, с использованием 1 нг и 7,5 пг, соответственно, образца в качестве ДНК-матрицы для ПЦР со сдвигом биотина.
Для экспериментов с хромосомной UBP выполняли ПЦР со сдвигом биотина в колонии и ПЦР-амплификацию со сдвигом биотина очищенной геномной ДНК. Для ПЦР со сдвигом биотина в колонии 2 мкл клеточной суспензии (см. выше) добавляли к смеси для ПЦР со сдвигом биотина в качестве матрицы. Реакционные смеси подвергали следующему температурному режиму и контролировали, как описано выше (время в минутах:секундах): [96°C 02:00 | 5 x (96°C 00:15 | 60°C 00:15 | 68°C 04:00) | 20-22 x (96°C 00:15 | 48°C 00:15 | 68°C 04:00)]. Для ПЦР-амплификации со сдвигом биотина очищенной геномной ДНК использовали 30-125 нг очищенной геномной ДНК в качестве матрицы для ПЦР со сдвигом биотина. Эти реакционные смеси подвергали следующему температурному режиму и контролировали, как описано выше (время в минутах:секундах): [96°C 02:00 | 5 x (96°C 00:15 | 60°C 00:15 | 68°C 04:00) | 10-16 x (96°C 00:15 | 48°C 00:15 | 68°C 04:00)].
Процент меченных биотином ампликонов из любой из описанных выше ПЦР со сдвигом биотина определяли путем смешивания 1 мкл реакционной смеси для ПЦР со сдвигом биотина с 2,5 мкл стрептавидина (2 мкг/мкл, Promega) и 1 мкл Purple Loading Dye (6x, New England Biolabs) и разделения комплексов стрептавидин-ДНК в нативном 6% полиакриламидном геле. Гели окрашивали в 50 мл TBE 1x SYBR Gold (Thermo Fisher Scientific). Гели визуализировали с помощью Molecular Imager Gel Doc XR System (Bio-Rad, Hercules, CA) с фильтром 520DF30 62 мм (Bio-Rad). Время экспозиции изображения ограничивали, чтобы предотвратить насыщение CCD для пикселей в представляющих интерес полосах. Интенсивность флуоресценции полос ДНК и стрептавидина-ДНК определяли количественно с использованием программного обеспечения Quantity One v4.6.9 (Bio-Rad) с использованием локального вычитания фона. Затем рассчитывали процент сдвига (S) для каждого образца на основе объема пикселей в полосах ДНК (VDNA) и стрептавидина-ДНК (VSA-DNA).
Для количественного определения сохранения UBP с помощью ПЦР-анализа со сдвигом биотина требуется нормализация значений сдвига образца до значения сдвига сконструированной in vitro ДНК, содержащей UBP. Для экспериментов по репликации in vivo в клетках с нокаутом генов (фигура 1) значения процента сдвига образца (SS) нормализовали по проценту сдвига собранной с помощью Golden Gate pINF (SGG), используемой для инициации эксперимента по репликации in vivo (сохранениеА).
Хотя было показано, что dTPT3-dNaM и родственные аналоги должны реплицироваться при ПЦР с высокой точностью10 и с ограниченным смещением контекста последовательности11, UBP при ПЦР мутирует с некоторой частотой. Следовательно, получение pINF путем сборки Golden Gate полученной с помощью ПЦР ДНК, содержащей UBP, приводит к получению некоторых мутантных полностью природных pINF. Учитывая, что в экспериментах, представленных на фигуре 1, не выделяли отдельные трансформанты pINF, эти полностью природные pINF будут трансформированы в экспериментальные клетки и реплицированы совместно с содержащими UBP pINF. Это накладывает верхнюю границу на теоретическое максимальное значение процента сдвига для данного образца. Если потеря UBP не происходит in vivo, процент сдвига образца in vivo будет равен таковому собранной с помощью Golden Gate pINF, использованной для инициации эксперимента (сохранениеА=100%). Некоторые репликаты (особенно на фонах ΔrecA) демонстрируют превышающее 100% сохранениеА. Это, вероятно, является результатом выборки собранных с помощью Golden Gate pINF. Если в результате трансформации происходит трансформация только содержащих UBP плазмид, и клетки реплицируют эти плазмиды без потери UBP, то нормализация SS по SGG приведет к значению, превышающему 100%. Если репликация UBP происходит с безупречной точностью, та же логика применяется к любой выборке собранных с помощью Golden Gate pINF, что приводит к более высокому проценту содержащих UBP pINF в клетках, чем у полученных с помощью Golden Gate продуктов. Таким образом, это наиболее очевидно у штаммов с ΔrecA из-за их высокого уровня сохранения UBP.
Эксперименты по клональной pINF и хромосомной UBP (фигура 3) действительно исследовали отдельные трансформанты pINF. Следовательно, мутированные с помощью ПЦР полностью природные pINF могут продуцировать отдельные клоны, которые демонстрируют отсутствие сохранения UBP (SS=0%), но они не влияют на сохранение других клонов, которые получили содержащую UBP pINF. Таким образом, можно ожидать, что SSO, которые получают и точно реплицируют содержащую UBP pINF, имеют значения сдвига, которые соответствуют значению сдвига в ПЦР-анализе со сдвигом биотина химически синтезированного содержащего UBP олигонуклеотида (предполагается, наличие 100% содержания UBP). Чтобы преобразовать значения сдвига образца в значения сохранения (сохранениеВ) для экспериментов, показанных на фигуре 3, значения сдвига образца (SS) нормализовали по значениям сдвига химически синтезированных содержащих UBP олигонуклеотидов (SO). Если потеря UBP не происходит in vivo, процент сдвига образца in vivo будет равен таковому химически синтезированного содержащего UBP олигонуклеотида (сохранениеВ=100%).
Удаление выпадающих и низких значений в отношении собранных с помощью Golden Gate pINF
Все собранные данные представлены со следующими исключениями. Одно выпадание (по критерию Граббса) было удалено с фигуры 1B. Эта точка данных не показала сохранения для мутанта ΔuvrC, реплицирующего последовательность TCAXAGT. Как описано выше, сохранение UBP в собранных с помощью Golden Gate pINF, используемых для инициирования экспериментов, показанных на фигуре 1, устанавливает верхнюю границу сохранения, достигаемую после репликации in vivo. Некоторые препараты собранных с помощью Golden Gate pINF демонстрировали очень низкий уровень сохранения. Данные репликации in vivo, собранные с помощью этих конструкций, не представлены. В частности, данные отбрасывали, если значения % сдвига собранных с помощью Golden Gate pINF были ниже следующих порогов отсечения для каждой последовательности: GTAXAGA-60%, TCAXAGT-70%, TCGXGGT-55%, TCTXGGT-50%, TCCXCGT-55% и TCCXGGT-55%.
Пример 3. Нокаут IS1 повышает стабильность транспортера нуклеозидтрифосфата PtNTT2
Чтобы оценить, способствовало ли отклонение транспонируемого элемента IS1 повышению стабильности (о чем свидетельствует активность) транспортера нуклеозидтрифосфата PtNTT2 во время длительного роста, YZ3 и ΔIS1 серийно пассажировали в трех параллелях на 2xYT+50 мМ KPi+5 мкг/мл Chlor (Media) и анализировали на предмет активности PtNTT2 (Rad/OD600). Пассаж 1 начинали с инокуляции 700 мкл среды культурами, хранящимися в глицериновом растворе, полученными посредством укола в столбик со средой. Культуры выращивали на протяжении ночи (~ 15 часов) до насыщения. Клетки разбавляли в 350 раз в 700 мкл свежей среды. Это повторяли для 6 полных пассажей. Затем клетки пассажировали еще 4 раза с коэффициентом разбавления, увеличенным в 350000 раз. Оценка пассажированных популяций по активности PtNTT2 показывает, что штамм ΔIS1 поддерживает более высокую активность PtNTT2 на протяжении периода длительного роста, предположительно, за счет исключения пути опосредованной IS1 делеции PtNTT2. Поскольку делеция PtNTT2 способствовала потере неприродных пар оснований (UBP), эти результаты свидетельствуют о том, что модифицированная методами генной инженерии клетка-хозяин или полусинтетический организм, лишенный пути опосредованной IS1 делеции PtNTT2, будет демонстрировать повышенное сохранение неприродных пар оснований, и, таким образом, увеличение в продуцировании полипептидов, содержащих неприродные аминокислоты, а также молекул нуклеиновых кислот, кодирующих их.
Хотя предпочтительные варианты осуществления настоящего изобретения были показаны и описаны в данном документе, для специалистов в данной области будет очевидно, что такие варианты осуществления представлены исключительно в качестве примера. Специалисты в данной области теперь смогут осуществить многочисленные вариации, изменения и замещения без отступления от настоящего изобретения. Следует понимать, что различные альтернативы вариантам осуществления настоящего изобретения, описанные в данном документе, могут использоваться при осуществлении на практике настоящего изобретения. Предполагается, что следующая формула изобретения определяет объем настоящего изобретения, и что таким образом охватывает способы и структуры в пределах объема формулы изобретения и их эквиваленты.
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> SYNTHORX, INC.
<120> КОМПОЗИЦИИ НА ОСНОВЕ НЕПРИРОДНЫХ ПАР ОСНОВАНИЙ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ
<130> 46085-712.601
<140>
<141>
<150> 62/612,062
<151> 2017-12-29
<160> 32
<170> PatentIn версия 3.5
<210> 1
<211> 2540
<212> ДНК
<213> Escherichia coli
<400> 1
aaaccaggct cccccaagcc tggttgtagg ctggagctgc ttcgaagttc ctatactttc 60
tagagaatag gaacttcgaa ctgcaggtcg acggatcccc ggaatttttt tataaataca 120
cagccaatca aacgaaacca ggctataatc aagcctggtt ttttgatgga attacagcgt 180
ggcgcaggca ggttttatct taacccgaca ctggcgggac accccgcaag ggacagaagt 240
ctccttctgg ctggcgacgg acaacgggcc gttgcaggtt acgcttgcac cgcaagagtc 300
cgtggcgttt attcccgccg atcaggttcc ccgcgctcag catattttgc agggtgaaca 360
aggcgttcgc ctgacaccgc tggcgttaaa ggattttcac cgccagccgg tgtatggcct 420
ttactgtcgc gcccatcgcc aattgatgaa ttacgaaaag cgcctgcgtg aaggtggcgt 480
taccgtctac gaggccgatg tgcgcccgcc agaacgctat ctgatggagc ggtttatcac 540
ctcaccggtg tgggtcgagg gtgatatgca caatggcgct atcgttaatg cccgtctgaa 600
accgcatccc gactatcgtc cgccgctcaa gtgggtttct attgatattg aaaccacccg 660
ccacggtgag ctgtactgca tcggcctgga aggctgcggg cagcgcatcg tttatatgct 720
ggggccagag aatggcgacg cctccgcgct cgattttgaa ctggaatacg tcgccagccg 780
cccgcagcta ctggaaaaac tcaacgcctg gtttgccaac tacgatcctg atgtgatcat 840
cggttggaac gtggtgcagt tcgatctgcg aatgctgcaa aaacatgccg agcgttaccg 900
tattccgctg cggctggggc gcgataacag tgagctggag tggcgcgagc acggctttaa 960
aaacggcgtc ttttttgccc aggctaaagg tcggctaatt atcgacggta tcgaggcgct 1020
gaaatccgcg ttctggaatt tctcttcatt ctcgctggaa accgtcgctc aggagttatt 1080
aggcgaagga aaatctatcg ataacccgtg ggatcgaatg gacgaaattg accgccgttt 1140
cgccgaagat aaacctgcgc tggcgactta taacctgaaa gattgcgagc tggtgacgca 1200
gattttccat aaaactgaaa tcatgccatt tttactcgaa cgagcgacgg tgaacggcct 1260
gccggtagac cgccacgggg gatcggtggc ggcgtttggt catctctatt ttcctcgtat 1320
gcaccgcgct ggttatgtcg cgcctaatct cggcgaagtg ccgccacacg ccagccctgg 1380
cggctacgtg atggattcac ggccagggct ttatgattcg gtactggtgc tggactataa 1440
aagcctgtac ccgtcgatca tccgcacctt tctgattgat cccgtcgggc tggtggaagg 1500
catggcgcag cctgatccag agcacagtac cgaaggtttt ctcgatgcct ggttctcgcg 1560
agaaaaacat tgcctgccgg agattgtgac taacatctgg cacgggcgcg atgaagccaa 1620
acgccagggt aacaaaccgc tgtcgcaggc gctgaaaatc atcatgaatg ccttttatgg 1680
cgtgctcggc accaccgcct gccgcttctt cgatccgcgg ctggcatcgt cgatcaccat 1740
gcgtggtcat cagatcatgc ggcaaaccaa agcgttgatt gaagcacagg gctacgacgt 1800
tatctacggc gataccgact caacgtttgt ctggctgaaa ggcgcacatt cggaagaaga 1860
agcggcgaaa atcggtcgtg cactggtgca gcacgttaac gcctggtggg cggaaacgct 1920
gcaaaaacaa cggctgacca gcgcattaga actggagtat gaaacccatt tctgccgttt 1980
tctgatgcca accattcgcg gagccgatac cggcagtaaa aagcgttatg ccggactgat 2040
tcaggagggc gacaagcagc ggatggtgtt taaagggctg gaaaccgtgc gcaccgactg 2100
gacgccgctg gcccagcagt ttcagcagga gctatacctg cgcatcttcc gcaacgagcc 2160
atatcaggaa tatgtacgcg aaaccatcga caaactgatg gcgggtgaac tggatgcgcg 2220
actggtttac cgtaaacgcc ttcgccgtcc gctgagcgag tatcagcgta atgtgccgcc 2280
tcatgtacgc gccgctcgcc ttgccgatga agaaaaccaa aagcgtggtc gccccttgca 2340
atatcagaat cgcggcacca ttaagtacgt atggaccacc aacggcccgg agccgctgga 2400
ctaccaacgt tcaccactgg attacgaaca ctatctgacc cgccagctac aacccgtggc 2460
ggagggaata ctccctttta ttgaggataa ttttgctaca cttatgaccg ggcaacttgg 2520
gctattttga gcaaaaaaaa 2540
<210> 2
<211> 2436
<212> ДНК
<213> Escherichia coli
<400> 2
tgactgtata aaaccacagc caatcaaacg aaaccaggct ataatcaagc ctggtttttt 60
gatggaatta cagcgtggcg caggcaggtt ttatcttaac ccgacactgg cgggacaccc 120
cgcaagggac agaagtctcc ttctggctgg cgacggacaa cgggccgttg caggttacgc 180
ttgcaccgca agagtccgtg gcgtttattc ccgccgatca ggttccccgc gctcagcata 240
ttttgcaggg tgaacaaggc gttcgcctga caccgctggc gttaaaggat tttcaccgcc 300
agccggtgta tggcctttac tgtcgcgccc atcgccaatt gatgaattac gaaaagcgcc 360
tgcgtgaagg tggcgttacc gtctacgagg ccgatgtgcg cccgccagaa cgctatctga 420
tggagcggtt tatcacctca ccggtgtggg tcgagggtga tatgcacaat ggcgctatcg 480
ttaatgcccg tctgaaaccg catcccgact atcgtccgcc gctcaagtgg gtttctattg 540
atattgaaac cacccgccac ggtgagctgt actgcatcgg cctggaaggc tgcgggcagc 600
gcatcgttta tatgctgggg ccagagaatg gcgacgcctc cgcgctcgat tttgaactgg 660
aatacgtcgc cagccgcccg cagctactgg aaaaactcaa cgcctggttt gccaactacg 720
atcctgatgt gatcatcggt tggaacgtgg tgcagttcga tctgcgaatg ctgcaaaaac 780
atgccgagcg ttaccgtatt ccgctgcggc tggggcgcga taacagtgag ctggagtggc 840
gcgagcacgg ctttaaaaac ggcgtctttt ttgcccaggc taaaggtcgg ctaattatcg 900
acggtatcga ggcgctgaaa tccgcgttct ggaatttctc ttcattctcg ctggaaaccg 960
tcgctcagga gttattaggc gaaggaaaat ctatcgataa cccgtgggat cgaatggacg 1020
aaattgaccg ccgtttcgcc gaagataaac ctgcgctggc gacttataac ctgaaagatt 1080
gcgagctggt gacgcagatt ttccataaaa ctgaaatcat gccattttta ctcgaacgag 1140
cgacggtgaa cggcctgccg gtagaccgcc acgggggatc ggtggcggcg tttggtcatc 1200
tctattttcc tcgtatgcac cgcgctggtt atgtcgcgcc taatctcggc gaagtgccgc 1260
cacacgccag ccctggcggc tacgtgatgg attcacggcc agggctttat gattcggtac 1320
tggtgctgga ctataaaagc ctgtacccgt cgatcatccg cacctttctg attgatcccg 1380
tcgggctggt ggaaggcatg gcgcagcctg atccagagca cagtaccgaa ggttttctcg 1440
atgcctggtt ctcgcgagaa aaacattgcc tgccggagat tgtgactaac atctggcacg 1500
ggcgcgatga agccaaacgc cagggtaaca aaccgctgtc gcaggcgctg aaaatcatca 1560
tgaatgcctt ttatggcgtg ctcggcacca ccgcctgccg cttcttcgat ccgcggctgg 1620
catcgtcgat caccatgcgt ggtcatcaga tcatgcggca aaccaaagcg ttgattgaag 1680
cacagggcta cgacgttatc tacggcgata ccgactcaac gtttgtctgg ctgaaaggcg 1740
cacattcgga agaagaagcg gcgaaaatcg gtcgtgcact ggtgcagcac gttaacgcct 1800
ggtgggcgga aacgctgcaa aaacaacggc tgaccagcgc attagaactg gagtatgaaa 1860
cccatttctg ccgttttctg atgccaacca ttcgcggagc cgataccggc agtaaaaagc 1920
gttatgccgg actgattcag gagggcgaca agcagcggat ggtgtttaaa gggctggaaa 1980
ccgtgcgcac cgactggacg ccgctggccc agcagtttca gcaggagcta tacctgcgca 2040
tcttccgcaa cgagccatat caggaatatg tacgcgaaac catcgacaaa ctgatggcgg 2100
gtgaactgga tgcgcgactg gtttaccgta aacgccttcg ccgtccgctg agcgagtatc 2160
agcgtaatgt gccgcctcat gtacgcgccg ctcgccttgc cgatgaagaa aaccaaaagc 2220
gtggtcgccc cttgcaatat cagaatcgcg gcaccattaa gtacgtatgg accaccaacg 2280
gcccggagcc gctggactac caacgttcac cactggatta cgaacactat ctgacccgcc 2340
agctacaacc cgtggcggag ggaatactcc cttttattga ggataatttt gctacactta 2400
tgaccgggca acttgggcta ttttgagcaa aaaaaa 2436
<210> 3
<211> 2008
<212> ДНК
<213> Escherichia coli
<400> 3
ttattgcacg aagcgcgagg taacgtactg gctgtaatca ttcgctacag ccgggacctt 60
gccctgctct ttcaaaaact gcgcggtgtc gatgatcgct ttgttcaccg gtccggtcag 120
ttctgccgtt tgttgctgcg gcgtcagata ggtattcccc ttcaccagcc ccggaacgtc 180
accttcaggc acgccgctta accgcgccag tttgctgatg ttttccggct gtttcagcca 240
cgcgtctggg ttagcaatgt acggttgctg agcatcgatg gcgcttttgg cgaacgcttt 300
caccacctca ggatgtttct cggcaaaatc tttgcgcacc acccagacgt ccagcgttgg 360
cgcaccccac tgcccgacct gttcagaatc ggtcagcact ttgccgtctt tttccagggc 420
gttaaccgcc ggtgcccaga cataagcacc atcaatatct ccccgctgcc atgcagcgat 480
aatcgcgggc ggctgcaggt tcacaatctc cacttgccca ggtttaatgc cccagtgttt 540
cagcgctgcc agcaggctgt agtgggtggt agagataaac ggtacggcga tgcgtttgcc 600
aatcagatct tccggtttgc tgatagtttt ctttaccacc agcgcttctg agttacccag 660
ttttgacgcc agcaagaaga cttcaatcgg cacctgttgg ctggctgcaa ccgctaacgg 720
gctggaacca aggttgccga tttgcacgtc gccagaagcc agcgcccgca cgatgctggc 780
tccgctgtca aacttacgcc agtccacggt tgctccgctt tctttagcaa aggtgttgtc 840
ggcctgagcc actttcgccg gttcggctga ggtttgatac gccacggtga cgttcaccgc 900
ctgtgcctga aaagcgatga atgccagtgc ggcaagaagt gtgtttcgcg atgaaattgc 960
catgattgtc tgctcccctg tcttgttatg ggagcagtat tcaggaataa aaacattcat 1020
taaaagaatt agtcgttatc gcacagatga ttttattctt agcaaaaaaa cggtgatgct 1080
gccaacttac tgatttagtg tatgatggtg tttttgaggt gctccagtgg cttctgtttc 1140
tatcagctgt ccctcctgtt cagctactga cggggtggtg cgtaacggca aaagcaccgc 1200
cggacatcag cgctatctct gctctcactg ccgtaaaaca tggcaactgc agttcactta 1260
caccgcttct caacccggta cgcaccagaa aatcattgat atggccatga atggcgttgg 1320
atgccgggca actgcccgca ttatgggcgt tggcctcaac acgattttac gtcacttaaa 1380
aaactcaggc cgcagtcggt aacctcgcgc atacagccgg gcagtgacgt catcgtctgc 1440
gcggaaatgg acgaacagtg gggctatgtc ggggctaaat cgcgccagcg ctggctgttt 1500
tacgcgtatg acaggctccg gaagacggtt gttgcgcacg tattcggtga acgcactatg 1560
gcgacgctgg ggcgtcttat gagcctgatg tcaccctttg acgtggtgat atggatgacg 1620
gatggctggc cgctgtatga atcccgcctg aagggaaagc tgcacgtaat cagcaagcga 1680
tatacgcagc gaattgagcg gcataacctg aatctgaggc agcacctggc acggctggga 1740
cggaagtcgc tgtcgttctc aaaatcggtg gagctgcatg acaaagtcat cgggcattat 1800
ctgaacataa aacactatca ataagttgga gtcattacca ggccgacaaa atggaggcaa 1860
agaccaacaa agaaaagtag ttaacctagg ctgctgccac cgctgagcaa taagactcct 1920
gttgatagat ccagtaatga cctcagaact ccatctggat ttgttcagaa cgctcggttg 1980
ccgccgggcg ttttttattg gtgagaat 2008
<210> 4
<211> 17210
<212> ДНК
<213> Escherichia coli
<400> 4
ttattgcacg aagcgcgagg taacgtactg gctgtaatca ttcgctacag ccgggacctt 60
gccctgctct ttcaaaaact gcgcggtgtc gatgatcgct ttgttcaccg gtccggtcag 120
ttctgccgtt tgttgctgcg gcgtcagata ggtattcccc ttcaccagcc ccggaacgtc 180
accttcaggc acgccgctta accgcgccag tttgctgatg ttttccggct gtttcagcca 240
cgcgtctggg ttagcaatgt acggttgctg agcatcgatg gcgcttttgg cgaacgcttt 300
caccacctca ggatgtttct cggcaaaatc tttgcgcacc acccagacgt ccagcgttgg 360
cgcaccccac tgcccgacct gttcagaatc ggtcagcact ttgccgtctt tttccagggc 420
gttaaccgcc ggtgcccaga cataagcacc atcaatatct ccccgctgcc atgcagcgat 480
aatcgcgggc ggctgcaggt tcacaatctc cacttgccca ggtttaatgc cccagtgttt 540
cagcgctgcc agcaggctgt agtgggtggt agagataaac ggtacggcga tgcgtttgcc 600
aatcagatct tccggtttgc tgatagtttt ctttaccacc agcgcttctg agttacccag 660
ttttgacgcc agcaagaaga cttcaatcgg cacctgttgg ctggctgcaa ccgctaacgg 720
gctggaacca aggttgccga tttgcacgtc gccagaagcc agcgcccgca cgatgctggc 780
tccgctgtca aacttacgcc agtccacggt tgctccgctt tctttagcaa aggtgttgtc 840
ggcctgagcc actttcgccg gttcggctga ggtttgatac gccacggtga cgttcaccgc 900
ctgtgcctga aaagcgatga atgccagtgc ggcaagaagt gtgtttcgcg atgaaattgc 960
catgattgtc tgctcccctg tcttgttatg ggagcagtat tcaggaataa aaacattcat 1020
taaaagaatt agtcgttatc gcacagatga ttttattctt agcaaaaaaa ctgtaggctg 1080
gagctgcttg aagttcctat actttctaga gaataggaac ttcgaactgc aggtcgacgg 1140
atccccggaa ttagaacgta atttacctgc cggaacttat tcactccgac aagaacttat 1200
ccgtacagga gattaaaatg ataaaacgga cgttattagc ggcggccatt tttagcgcat 1260
tgcccgctta tgccgggtta acttccatta ccgcgggcta cgattttacc gattattctg 1320
gcgatcatgg caaccgtaat ttagcgtatg ctgaactggt ggcgaaagtt gaaaacgcaa 1380
cgctgctttt taatctttcc caggggcgtc gtgattatga aactgaacat ttcaatgcca 1440
ctcgcggtca gggtgcggtc tggtataaat ggaataactg gctgacaacc cgaacgggta 1500
ttgcctttgc ggataatacg ccggtctttg cccgccagga ttttcgtcag gatattaacc 1560
tggccctgtt gccaaaaacg cttttcacga ccggttatcg ctacactaaa tattacgatg 1620
atgtcgaagt cgatgcctgg caaggcggcg tatcactcta tactggcccg gtgatcacca 1680
gctaccgcta tacccattat gactccagcg atgcaggtgg tagttatagc aatatgattt 1740
ccgtgcgtct gaatgacccg cgcggcactg gttatacgca actatggcta agccgcggaa 1800
caggcgctta cacctatgac tggacgccag aaacacgcta cggcagcatg aagagcgtca 1860
gtctgcaacg tattcaaccg ctgactgagc aacttaatct cgggctgacg gcaggtaaag 1920
tgtggtacga caccccaacc gatgattata acggtctgca acttgcagcc catctgacct 1980
ggaaattctg attccttctg ccgcccgcta tccggggcgg ccttccctgc cgattagccc 2040
ccccctttcc tctttgtttt ccgaccacat tcaccggata aattttattc tccagtgtta 2100
tatactatag gggggtatgc attgacatat agcatacccc cctatagtat attgcgtgca 2160
gataatgagg tgcgaaatgc ccagtactcc ggaagagaag aaaaaggtcc ttactcgagt 2220
tcgtcgtatt cgagggcaga ttgatgctct ggaacggtcg ctggagggtg atgccgaatg 2280
ccgtgccata ctccaacaga tcgctgccgt tcggggcgcg gctaatgggc tgatggcaga 2340
agtgcttgaa agccatatcc gggaaacgtt tgaccgaaat gactgctaca gccgcgaagt 2400
cagccaatcc gttgacgaca ctattgaact ggttcgagcc tatcttaaat agctgaatct 2460
attaccatat tgaggaagag cgagagatga aatcacgtgc tgccgttgca tttgctcccg 2520
gtaaaccgct ggaaatcgtt gaaattgacg ttgcaccacc gaaaaaaggt gaagtgctga 2580
ttaaagtcac ccataccggc gtttgccata ccgacgcatt taccctctcc ggggatgacc 2640
cggaaggtgt attcccggtg gttctcggtc acgaaggggc cggcgttgtg gttgaagtcg 2700
gtgaaggcgt aaccagcgtc aaacctggcg accatgtgat cccgctttac accgcggagt 2760
gcggcgagtg tgagttctgt cgttctggca aaactaacct ctgtgttgcg gttcgcgaaa 2820
cccagggtaa aggcttgatg ccagacggca ccacccgttt ttcttacaac gggcagccgc 2880
tttatcacta catgggatgc tcaacattca gtgaatacac cgtggtcgcg gaagtgtctc 2940
tggccaaaat taatccagaa gcaaaccatg aacacgtctg cctgctgggc tgtggcgtga 3000
ccaccggtat tggcgcggtg cacaacacag ctaaagtcca gccaggtgat tctgttgccg 3060
tgtttggtct tggcgcgatt ggtctggcag tggttcaggg cgcgcgtcag gcgaaagcgg 3120
gacggattat cgctatcgat accaacccga agaaattcga tctggctcgt cgcttcggtg 3180
ctaccgactg cattaacccg aatgactacg acaaaccgat taaagatgtc ctgctggata 3240
tcaacaaatg gggtatcgac catacctttg aatgcatcgg taacgtcaac gtgatgcgtg 3300
cggcgctgga aagtgcgcac cgcggctggg gtcagtcggt gatcatcggg gtagcaggtg 3360
ccggtcagga aatctccacc cgaccattcc agttggtcac cggtcgcgta tggaaaggtt 3420
ccgcgtttgg cggcgtgaaa ggtcgttccc agttaccggg tatggttgaa gatgcgatga 3480
aaggtgatat cgatctggaa ccgtttgtca cgcataccat gagccttgat gaaattaatg 3540
acgccttcga cctgatgcat gaaggcaaat ccattcgaac cgtaattcgt tactgatttc 3600
ccgcaggtat accccgtcca cttcagacgg ggttcttaat actctccctg ggcagccgtc 3660
cgggggatta accgtgagat aatgactgat ggaactcatt gaaaaacatg ccagctttgg 3720
cggctggcaa aatgtgtatc ggcattattc ccaatcactg aaatgtgaaa tgaatgtcgg 3780
cgtctatctc ccaccaaaag ccgcgaatga aaaattgccg gtgttgtact ggctttcagg 3840
cctgacttgc aacgagcaga atttcattac taaatcgggg atgcagcgtt acgcggctga 3900
gcacaacatt attgttgttg cgccggacac cagtccgcga ggcagtcatg tcgcagatgc 3960
tgaccgttac gatctcgggc aaggtgccgg gttttacctg aacgcgacgc aagcgccgtg 4020
gaatgaacat tacaaaatgt atgactatat ccgcaacgag ctgccggatt tagtgatgca 4080
tcattttccg gcaacggcca aaaagtctat ctctggtcat tctatgggcg ggctgggcgc 4140
gctggtgctg gcgttacgta acccagatga atatgtcagc gtctcggcgt tttcgcccat 4200
tgtctcccca tcgcaagtgc cgtggggaca gcaagccttt gctgcatatc ttgctgaaaa 4260
taaagatgcc tggttggatt acgacccggt gagtcttatt tcacaaggtc aacgcgttgc 4320
ggaaatcatg gttgatcagg ggttgagtga tgatttttac gcagaacagc tgcggactcc 4380
aaatcttgaa aagatctgcc aggagatgaa tatcaagacg ttaatccgtt atcacgaggg 4440
ttatgatcac agctattatt ttgtctccag ttttattggc gagcatattg cctaccacgc 4500
caataaactg aatatgcgtt gataatagtg cacgactgcc ggatgcggcg tgaacgcctt 4560
atccggccta cacttcgccc gtaaaccgta ggcctgataa gacgcgcaaa gcgtcgcatc 4620
aggcatggcg cacgactgcc ggatgcggcg tgaacgcctt atccggtcta cacttcgccc 4680
ataaaccgta ggcctgataa gacgcgcata gcgtcgcatc aggcatctgc gcacgactta 4740
tctatgttta ccacatcaaa tcatcaggca ctttgaagtc ggcatacggg tcgtcttcat 4800
cctgctcttc ggcgctgagc gcgctgtgca acactatact gctggcatcg cgctgagcaa 4860
ttttatcggc aacgctggcg ggaataatgg cgtattcacc ttcgctattg ttatcgacca 4920
acaagcgggc aatcgccaga cgaccattaa tcaactgcgc ctgtgtgagc ttatcgacaa 4980
aaatcttctt aatcagattg ccgtcagtga agttaaaacc aatatcgcca ttggcaatgg 5040
tgattcggtt catttcaata agctgcttca cctgagcttt atattctttc gccaacgccg 5100
cttgtttttg ctgttcgcta agctgtttat cacgctcaag ctgtgccttt ttattttctt 5160
ctaccgccgc ccgagcttca cgcgcctgaa cgcgcgattt tttcgccgtt ctctccacct 5220
tcgccgcttt tttgctggtg actaatcctg ctttgagcaa ctgctcttgt aaggtaagtt 5280
ttgccatctt tgtttccaaa cccgctgaat aatttttagc gagtatacct gtaaacgccg 5340
taggtgtatt ggggtgaagt ccctttcgcc cctgcctaat aaggcacgtc aggcatcggc 5400
gcacggctgt attcgtgatc tccggctcat caaaataaac accgccaacc cagcaacaag 5460
aatacccggt gcagaagcgg ccattacgcc gaccgtgcca gtgcctaatg ccagcatttt 5520
cccggccagt aacggaccgc tcatagcccc cagacgccct accgccacgg ctgttcccac 5580
acctgttgcg cggatctgcg aactgtaaaa caacggtgcc agggcataca aaacgctttg 5640
cccacctgtc gcaaacaacc ccgcgacaaa tcccgccagc aacataccgt taaatgacga 5700
caccgttcca agcgccagca gcgaagctaa catgccgcta taaatcagta gcgacatggt 5760
tactggacgc agcttatcca tcaatgcgcc caacattaac gtcccgcttg ccgcccccat 5820
ttgcagggca aacatcaccc ctgccgcctg cgatggctgg aatccttgct ccaccaaaag 5880
tagcggtagc cagttgatca acatgtagac caccagcaga gtgaagaaat aacacaacca 5940
cagcagcagc gtcgcggttg ccgtttctgg cgcaaataag gcacgcagtg gtggcgcaga 6000
ctgtttttcg ccagcgaaaa ccgccgactc cggcagccag cgcattaata gcggcaccag 6060
aatcaacggc accacaccac ctacccaaaa caccgtttgc catgctaagt ttgcccccgc 6120
gaaacccagt gtcgccgcca gcgccgcgcc aatgggaaca ccgcaataca tcaggctcac 6180
tgccgtccca cgaaaacgtg gacccgcggc ttcagacgtc agggcgataa gattcggcaa 6240
cgccgccccc agcccgacac cggtcatcag ccgcgcaaag accagtgagg ggaaatccca 6300
ggcaatcgcc gttgccagtg agaacaaacc aaacagcgca actgagccaa tcaaaatacg 6360
cttacgacca taacggtccg ccagcattcc gccaaccaac gcgccgggta gcaaaccgag 6420
tattccggcg ctaaatatcc agcccatttg cattttatcg agtgcgaaag cctgggcgat 6480
gccacccgcc gcaatgccag ccgcctgaag atccagccct tccatcagag cgaccaaaaa 6540
acaaagcccg atggtcagca tcaggcggga tgaagatgat gaaggggtac gagtcgacat 6600
aagatgaacc tcattgcgag tgcaggtgaa tcgcgactga tacattgcca gccgcgtaat 6660
cagaactatt gaatgactgc ctacgggcga aatgtaggcc ggataaggcg ttcacgccgc 6720
atccggcagt cgtgtgcaga tgcctgatgc gacgcttgcg cgtcttatca ggcctacaaa 6780
ttcccgcgcc atccgtaggc cggataaggc gtttacgccg catccggcag tcgtgcgcag 6840
atgcctgatg cgacgctaac gcgtcttatc aggcctacaa attctcgcgc catccgtagg 6900
ccggacaaga cgttcacgcc gcatccggca gtcgtgctgg gatgggcata caaaatgcac 6960
attctcggca gtcaatatta tttgttgttg cgcagatcca gcgccacgtc gacgatcata 7020
tcctcctggc cgccaaccat ccggcgtttg cccagctcaa cgagaatatc caccgcgctt 7080
aagccataac gcgccgccgc cgtttcacag tgacgcagga agctggagta aacaccagcg 7140
tatcccagcg ccagcgtttc gcgatcgact cgtaccggtc gatcctgcaa cggacgcacc 7200
aggtcgtcag cggcatccat taacgcatag agatcggtcc catgctgcca gcccagttta 7260
tccgcggcgg caataaatac ttccagcggc gcgttacctg cgcccgcgcc cattcccgcg 7320
aggctggcgt cgattcggtc gcagccctct tccaccgcct cgatagagtt cgccacgcca 7380
agactcaggt tatggtgagc gtgcatgccg gtttgcgttt ctggtttcaa cactgctttc 7440
agggcgcgga aacggtcacg gatatcgctc atgttcatcg caccgccaga atccaccaca 7500
taaatacagg tcgcaccgta gccttccatc agctttgcct gctttgcgag attctctggc 7560
gtggtcatat ggctcatcat cagaaaacca acggtgtcca ttccgagctc gcgggcatac 7620
tgaatatgct gggcggaaac atcagcttcg gtacagtgcg tagccacacg aaccacccgc 7680
gcgccagctt gccaggcatt tttcagatcg tgaatagtgc cgattcctgg cagcaacaac 7740
gtcgcgattt tggcgtgctt caccacatcc gccgctgctt caatccattc aaggtcgcta 7800
tgtgcgccga aaccatagtt aaagctggaa ccctgcaaac cgtcgccgtg ggccacttca 7860
atcgaatcca cgtgggcatc gtccagtgct ttggcaatct ggcgaacgtt ttccagcgaa 7920
tactgatgac gaatggcgtg cataccgtca cgcaacgtga cgtccgagat ataaagtttt 7980
ttaccgttca tgccgcttct cctgccttgc gcgccagtga ctgggccatt ttttccgctg 8040
tcgccagcgc actggaagtc ataatgtcga ggttgcccgc ataggcaggc agataatgcg 8100
ctgcgccttc gacttccagc cagaccgctg ttttcagtcc ggagaattgc cccacgcccg 8160
gtaaattgac cggtttatcc tgcgggataa cttcaaactg cacgcgctgt ttcaggcgat 8220
aacccggtac gtaagcctgc accgcctcag ccatttcatt gattgaggct tcgatatcat 8280
cttgtgaagc ttcgtcgctc aatacataca ccgtgtcacg catcatcaac ggtggctctg 8340
ctgggttaag cacaataatc gccttccctt ttgccgcgcc gcccaccact tcaatggctc 8400
gggaagtggt ttccgtaaat tcatcgatat tggcacgcgt gccaggtccg gcagatttac 8460
tggcgataga agcgataatt tcggcgtaat gaacacgcgc cacgcgtgaa actgccgcca 8520
ccattggaat ggtggcctgg ccgccgcagg tgaccatgtt gacgttcagt tgatcgacgt 8580
tcgcctcgag gttaaccacc ggcacgcagt aagggccgat ggcagcaggc gtcaggtcaa 8640
ttaagcgaat atccggtttc gcttcgcgta aagcggcatc gtttttcaca tgagcaccgg 8700
cgctggtcgc atcaaataca atgtcgatat cagcaaattc aggcatgttc atcagtccga 8760
tcaccccttc atgggtggtg gcgacgccca tacgtctggc gcgcgccaga ccgtcggact 8820
gaggatcaat gccaaccatc accgccatct ccagatgctg accgtgacgc aaaattttaa 8880
tcatcagatc ggtgccaatg ttgccagaac cgataatggc gactttacgc ttactcatga 8940
cagacttcct tttggggctg cgcttgaaaa tgtcgcagca actgaaccta tgccttcaat 9000
atgggcttca aaacgatcgc ccgcattcac cgccaccatc ggacctaatg ccccggtaag 9060
aatgatatct ccggtgcgca gcggttcacc cagactggcc attttgcgtg ccagccagac 9120
ggccgcatta agcggatgtc ccaggcattc gctgccgcgc ccgctagaaa cctcttcgtt 9180
attacgcgtc atcttcatgg cgcagttttt caggtctaac cccgccggac gttgcgccgg 9240
accgccgatg acatacaccc cacaggaggc gttatctgcc acggtatcga caaactgaat 9300
cgaccagtcg cgaatgcggc tccccaccac ttccagcgcc ggaagtaccc attcaatggc 9360
gttatacaat tcgtcgaagg tgatatcggt tgcgggcaaa tcgcggttca acaccagtgc 9420
gatctccgct tcaatgcggg gttgcagaac acgggaaaaa ggaatgattt cgttatcgcc 9480
ataacacatg tcggcaaata atgtcccgaa atccggttga tcaacgccca gttgttgctg 9540
cactttcgga tgcgtcaggc ccactttacg ccctaccacg cgacgcccct gcgcaacgtc 9600
atattgcaca tttatgtgct gaatggcgta ggccgcttca gcgttatcga taccaatcag 9660
atcgcgcagc ggcgcaatcg cttcgccctg ctctgcggcg cggcgtaaat ccgccgccag 9720
ttgctcaaga gtatgcttcg tcatgaccat tccttaaggg cgtgcgagga aattcagcac 9780
caattgattg aaagcgtcgg catgttccca ctgcgcccag tgaccacagt cgcggaagat 9840
atgcagttca gaaccggcaa tgccggacag cagacgcaga cccgcatcca tcggcacaaa 9900
gcggtcgttg cgcccccaga caatcagggt ttgcgctttg atttccgcca gacgtgggcc 9960
aaaatccggg aactgtttcg gattagcttc caggctctta acgaagtttt ccaggtgatc 10020
gcggcgcgac agcatattat tcaggcgcgc ttcaaacagg gcgtcggtca aatcgctggt 10080
atcgaaaacg aagatatcca tcatcagctt caggttttcg atagtcggct gacgataaag 10140
ctgattcagt cgcttaatac cttcggttgg catcggcgta aacaaactca tgccgcccgt 10200
accgccgccc atcagcacca gtttgccgac gcgctccggc cagttaaggg tgaacgccac 10260
agaactatgg ccgcccatcg agttgcccag caggtggatt ttggcgatat ccagttgatc 10320
caccacgctt ttcaggattc gtgcattaag atccgatcgt gaaccactat taacgatcga 10380
atcgcttttg ccccaacccg gacaatccag caggatcacc cgatagcccg cctctaccag 10440
cggatcgata ttgcggctga agttcgccca gccagtagca cccgggccgg aaccatgcag 10500
caggacaacg gtttcgtcgc cttgtccgca gtcattaaaa tggatgcgca gcgttttacc 10560
cgcttcttct acattcagaa aacggctggt ggcggcttcg gtttgtggct gataactcat 10620
catcttctcc tgcatattca gttctctgtt ctggcgctta acgagccaaa tccggcaatc 10680
cactccggga ttgggcggta ataacgccct tcgctacgcc agttgccaaa tgcagaaata 10740
gcggcaaaag cggcgaccca ggttttgatt tcatgtgtcg actttccggc aatggcggaa 10800
agctcttcgt tactgacggc atccagttcc tgtatgcgtc cctgctccag caaagtcatg 10860
aactggttat cccaaatcgg gttgagcgga tgcagagttc tctgatcctc aacaaacttc 10920
tcagcggcgc taatcacccg ttgctgacgc aattcgcgct cactggcggg taaatctttc 10980
ccgctcccca acagacggtc gcgcatatgg gcatcggctt tcgccagttc gggcaccggc 11040
ggctgatggg aaagcccacc ggaacccagg aacagcacgc gtttattgag agtgctggtg 11100
aaacgtccaa tggcttcacc caacatgcgg gtacgctgga aaccgggcag cggcgtggcg 11160
acaccgttga tgaacacagg cagaactggc accttatcca gcccgccgag caggaactcc 11220
agtggctggg cgaacccgtg gtccacctgc atacagtaag aaacggcaag atcgatcccg 11280
ctcttcatga cggcatgcgc acaggcctcc gccagctcca caggcacggg cagctctcct 11340
gccgcactgc cgaaatcacc aattgccgtc gccccaacgc ctaaacagaa cggtggcatc 11400
acgtcataga aaaagccgtt gtagtgatct ggcgcaaaca gcaccaccag ttcaggggag 11460
aaagccgcaa tacgctcgcg ggcgctggca atcacgccat tgacctcatc gagtacctct 11520
tgcgccgggt cgacatatcc caccagcggc gagtgggaaa gacagtgaag ataagcgtgc 11580
atatcaggct accttttcga cagaaacgtc ggcatcaggg cgggtcagcg tcatcaccga 11640
cgccagttta ttcagcgtat tacccagggt ttgcggaatg gcggtggcgg caacaaagcg 11700
atccgggcgc atcaccacca gcgaagcatt atgttgtgcg aaccagctac gcaggcgacc 11760
ttgcgtatcc cccacgcgta gtacgccgtc gtggttatcc tgtgcggtat gaatttgcac 11820
ttccggcacc acctgaatga agcgggtgcc caacgcgcgc cactgctgga tttgctcgtc 11880
gctcatcccc cacagtggat tgcatcccca gccaattacc gcgaagttcg cgccgatcgc 11940
gttatcgagc agcgtcacgt cgccgttttc cagcgtgact ttcggctgaa taaacatctt 12000
gccgaccgga gagtgcttcg cttcgccctc tcgcaccagc gcaccgccgt aatattgcgg 12060
catcggcttg aagcgcattt cgaggaagta gcgttttact ggcggcagat aattcaacag 12120
ccaggaaacg ccgtcacgta acgtaccctg ccagcgtttc ggcggagcca gcacgttgcc 12180
cgccgtcacg gacaggtcaa tcatcgcttt ggcgtgatcg cgtcgttctt gttgataggt 12240
atcgagcagc gcatcacggg ctttcccctg gataaccaac gccagtttcc aggcgaggtt 12300
aaaggcgtcg cgcataccgc tgttatagcc ctgcccctgc cataccggca tgatgtgcgc 12360
ggcatcgccc gccagcagta cgcgatcaat acggaaacgt tgcgccagtc gcgcgttgtg 12420
ggtgtagaca cgctggcgaa tcaattcaac attgtccgga ttaggcagca ctttgcttaa 12480
cagcttgcgc atattttgcg gctcacgcag ctgttcttcg gtttctcctg gcatcaccat 12540
aaattcaaag cgacgtaccg catgaggtag cgcggcagaa acatacgggc gcaccggatc 12600
gcaacacaaa tagatatgcg gcgtacttaa cggatcgttg gcgatatcta ccacaatcca 12660
ctgatttggc gcagttttac cttcaaacgg cacattcagg gtgcgacgga caaaacttgc 12720
cccaccatca caggccacca gccactgggc tttgactatt tcccgctgcc cttctgccgt 12780
tttcaggtgc aaggtcactt cgtcatcttg ctgactgaag gcctccagct cgcgggaaaa 12840
caagcagcgc acattcggaa aacgcgacac cccttccagc atcaccgcat cgacctgcgg 12900
ctgaataaag gcgttacggc gcggccagcc aaattcatcg gtcattggct gaatatcagc 12960
aaaacagcgg cctttcgggg tgagaaaacg catcgcgtgc cacggcgtag tgtgcggcag 13020
aacatcatcg accaggccga ccgactgcat ggtgcgcagc gcctcgtcat caataccaat 13080
cgcacgcggg tagtcgatca acttatcgag tttctccacc accagcacgt caatgcccat 13140
ctggccgaga tagttcgcca tcatcagccc aaccgggccg gcaccagcga tcgccacctg 13200
aacgctatgg ttaacagcag gctggatgtc agggtgttgt attgccattt cagtacctca 13260
cgactcggac aaaatgtcgt tgcgcgcaca gtacagcgca acttattttg ttaaaaacat 13320
gtaaatgatt ttttattgtg cgctcagtat aggaagggtg ttttcggcta caatcaaaac 13380
atgcccgaat gtgcaccagg tgcaccacgt tgttttaact atagaaatgt caattaatat 13440
gcagaacaat gagcagacgg aatacaaaac cgtgcgcggc ttaacccgcg gtctaatgtt 13500
attaaatatg ttaaataaac ttgatggcgg tgccagcgtc gggctgctgg cggaactcag 13560
cggcctgcat cgcaccactg tgcggcgact gctggagacg ctgcaggaag agggatatgt 13620
ccgccgtagc ccctccgatg atagttttcg actgaccatc aaagtgcggc aattaagcga 13680
aggatttcgt gacgaacagt ggatttctgc actggcggcc ccactgctgg gcgatctgtt 13740
gcgcgaagtg gtatggccga cagatgtgtc cacgctggat gttgatgcaa tggtggtacg 13800
cgaaaccact caccgtttca gccgcttatc ctttcaccgg gcaatggtcg ggcgacgttt 13860
gccgcttctg aaaaccgcct cgggcctgac ctggctggcc ttttgcccgg aacaagaccg 13920
caaggaatta atcgaaatgt tagcctcccg ccccggtgat gactatcaac tggcacggga 13980
accgttaaag ctggaagcca ttctggcgcg cgcgcgcaaa gagggttacg gacagaacta 14040
ccgcggctgg gatcaggagg agaagatcgc ctctatcgcc gtaccgctgc gcagtgaaca 14100
acgggtgatt ggctgtctga atctggtgta tatggcgagc gcaatgacca ttgaacaggc 14160
agcggaaaag catcttccgg cgctacaacg ggtagcaaaa cagatcgaag aaggggttga 14220
atcgcaggct attctggtgg ccggaaggcg aagcggcatg catttacgtt gacaccatcg 14280
aatggcgcaa aacctttcgc ggtatggcat gatagcgccc ggaagagagt caattcaggg 14340
tggtgaatgt gaaaccagta acgttatacg atgtcgcaga gtatgccggt gtctcttatc 14400
agaccgtttc ccgcgtggtg aaccaggcca gccacgtttc tgcgaaaacg cgggaaaaag 14460
tggaagcggc gatggcggag ctgaattaca ttcccaaccg cgtggcacaa caactggcgg 14520
gcaaacagtc gttgctgatt ggcgttgcca cctccagtct ggccctgcac gcgccgtcgc 14580
aaattgtcgc ggcgattaaa tctcgcgccg atcaactggg tgccagcgtg gtggtgtcga 14640
tggtagaacg aagcggcgtc gaagcctgta aagcggcggt gcacaatctt ctcgcgcaac 14700
gcgtcagtgg gctgatcatt aactatccgc tggatgacca ggatgccatt gctgtggaag 14760
ctgcctgcac taatgttccg gcgttatttc ttgatgtctc tgaccagaca cccatcaaca 14820
gtattatttt ctcccatgaa gacggtacgc gactgggcgt ggagcatctg gtcgcattgg 14880
gtcaccagca aatcgcgctg ttagcgggcc cattaagttc tgtctcggcg cgtctgcgtc 14940
tggctggctg gcataaatat ctcactcgca atcaaattca gccgatagcg gaacgggaag 15000
gcgactggag tgccatgtcc ggttttcaac aaaccatgca aatgctgaat gagggcatcg 15060
ttcccactgc gatgctggtt gccaacgatc agatggcgct gggcgcaatg cgcgccatta 15120
ccgagtccgg gctgcgcgtt ggtgcggata tctcggtagt gggatacgac gataccgaag 15180
acagctcatg ttatatcccg ccgttaacca ccatcaaaca ggattttcgc ctgctggggc 15240
aaaccagcgt ggaccgcttg ctgcaactct ctcagggcca ggcggtgaag ggcaatcagc 15300
tgttgcccgt ctcactggtg aaaagaaaaa ccaccctggc gcccaatacg caaaccgcct 15360
ctccccgcgc gttggccgat tcattaatgc agctggcacg acaggtttcc cgactggaaa 15420
gcgggcagtg agcgcaacgc aattaatgta actaggcacc ccaggcttta cactttatgc 15480
ttccggctgg tataatgtgt ggacctgtag aaataatttt gtttaacttt aataaggaga 15540
tataccatgg gaggcagtac tgttgcacca actacaccgt tggcaaccgg cggtgcgctc 15600
cgcaaagtgc gacaagccgt ctttcccatc tacggaaacc aagaagtcac caaatttctg 15660
ctcatcggat ccattaaatt ctttataatc ttggcactca cgctcacgcg tgataccaag 15720
gacacgttga ttgtcacgca atgtggtgcc gaagcgattg cctttctcaa aatatacggg 15780
gtgctacccg cagcgaccgc atttatcgcg ctctattcca aaatgtccaa cgccatgggc 15840
aaaaaaatgc tattttattc cacttgcatt cctttcttta cctttttcgg gctgtttgat 15900
gttttcattt acccgaacgc ggagcgactg caccctagtt tggaagccgt gcaggcaatt 15960
ctcccgggcg gtgccgcatc tggcggcatg gcggttctgg ccaagattgc gacacactgg 16020
acatcggcct tattttacgt catggcggaa atatattctt ccgtatcggt ggggctattg 16080
ttttggcagt ttgcgaacga cgtcgtcaac gtggatcagg ccaagcgctt ttatccatta 16140
tttgctcaaa tgagtggcct cgctccagtt ttagcgggcc agtatgtggt acggtttgcc 16200
agcaaagcgg tcaactttga ggcatccatg catcgactca cggcggccgt aacatttgct 16260
ggtattatga tttgcatctt ttaccaactc agttcgtcat atgtggagcg aacggaatca 16320
gcaaagccag cggcagataa cgagcagtct atcaaaccga aaaagaagaa acccaaaatg 16380
tccatggttg aatcggggaa atttctcgcg tcaagtcagt acctgcgtct aattgccatg 16440
ctggtgctgg gatacggcct cagtattaac tttaccgaaa tcatgtggaa aagcttggtg 16500
aagaaacaat atccagaccc gctagattat caacgattta tgggtaactt ctcgtcagcg 16560
gttggtttga gcacatgcat tgttattttc ttcggtgtgc acgtgatccg tttgttgggg 16620
tggaaagtcg gagcgttggc tacacctggg atcatggcca ttctagcgtt accctttttt 16680
gcttgcattt tgttgggttt ggatagtcca gcacgattgg agatcgccgt aatctttgga 16740
acaattcaga gtttgctgag caaaacctcc aagtatgccc ttttcgaccc taccacacaa 16800
atggcttata ttcctctgga cgacgaatca aaggtcaaag gaaaagcggc aattgatgtt 16860
ttgggatcgc ggattggcaa gagtggaggc tcactgatcc agcagggctt ggtctttgtt 16920
tttggaaata tcattaatgc cgcacctgta gtaggggttg tctactacag tgtccttgtt 16980
gcgtggatga gcgcagctgg ccgactaagt gggctttttc aagcacaaac agaaatggat 17040
aaggccgaca aaatggaggc aaagaccaac aaagaaaagt agttaaccta ggctgctgcc 17100
accgctgagc aataagactc ctgttgatag atccagtaat gacctcagaa ctccatctgg 17160
atttgttcag aacgctcggt tgccgccggg cgttttttat tggtgagaat 17210
<210> 5
<211> 17898
<212> ДНК
<213> Escherichia coli
<400> 5
ttattgcacg aagcgcgagg taacgtactg gctgtaatca ttcgctacag ccgggacctt 60
gccctgctct ttcaaaaact gcgcggtgtc gatgatcgct ttgttcaccg gtccggtcag 120
ttctgccgtt tgttgctgcg gcgtcagata ggtattcccc ttcaccagcc ccggaacgtc 180
accttcaggc acgccgctta accgcgccag tttgctgatg ttttccggct gtttcagcca 240
cgcgtctggg ttagcaatgt acggttgctg agcatcgatg gcgcttttgg cgaacgcttt 300
caccacctca ggatgtttct cggcaaaatc tttgcgcacc acccagacgt ccagcgttgg 360
cgcaccccac tgcccgacct gttcagaatc ggtcagcact ttgccgtctt tttccagggc 420
gttaaccgcc ggtgcccaga cataagcacc atcaatatct ccccgctgcc atgcagcgat 480
aatcgcgggc ggctgcaggt tcacaatctc cacttgccca ggtttaatgc cccagtgttt 540
cagcgctgcc agcaggctgt agtgggtggt agagataaac ggtacggcga tgcgtttgcc 600
aatcagatct tccggtttgc tgatagtttt ctttaccacc agcgcttctg agttacccag 660
ttttgacgcc agcaagaaga cttcaatcgg cacctgttgg ctggctgcaa ccgctaacgg 720
gctggaacca aggttgccga tttgcacgtc gccagaagcc agcgcccgca cgatgctggc 780
tccgctgtca aacttacgcc agtccacggt tgctccgctt tctttagcaa aggtgttgtc 840
ggcctgagcc actttcgccg gttcggctga ggtttgatac gccacggtga cgttcaccgc 900
ctgtgcctga aaagcgatga atgccagtgc ggcaagaagt gtgtttcgcg atgaaattgc 960
catgattgtc tgctcccctg tcttgttatg ggagcagtat tcaggaataa aaacattcat 1020
taaaagaatt agtcgttatc gcacagatga ttttattctt agcaaaaaaa cggtgatgct 1080
gccaacttac tgatttagtg tatgatggtg tttttgaggt gctccagtgg cttctgtttc 1140
tatcagctgt ccctcctgtt cagctactga cggggtggtg cgtaacggca aaagcaccgc 1200
cggacatcag cgctatctct gctctcactg ccgtaaaaca tggcaactgc agttcactta 1260
caccgcttct caacccggta cgcaccagaa aatcattgat atggccatga atggcgttgg 1320
atgccgggca actgcccgca ttatgggcgt tggcctcaac acgattttac gtcacttaaa 1380
aaactcaggc cgcagtcggt aacctcgcgc atacagccgg gcagtgacgt catcgtctgc 1440
gcggaaatgg acgaacagtg gggctatgtc ggggctaaat cgcgccagcg ctggctgttt 1500
tacgcgtatg acaggctccg gaagacggtt gttgcgcacg tattcggtga acgcactatg 1560
gcgacgctgg ggcgtcttat gagcctgatg tcaccctttg acgtggtgat atggatgacg 1620
gatggctggc cgctgtatga atcccgcctg aagggaaagc tgcacgtaat cagcaagcga 1680
tatacgcagc gaattgagcg gcataacctg aatctgaggc agcacctggc acggctggga 1740
cggaagtcgc tgtcgttctc aaaatcggtg gagctgcatg acaaagtcat cgggcattat 1800
ctgaacataa aacactatca ataagttgga gtcattacct agaacgtaat ttacctgccg 1860
gaacttattc actccgacaa gaacttatcc gtacaggaga ttaaaatgat aaaacggacg 1920
ttattagcgg cggccatttt tagcgcattg cccgcttatg ccgggttaac ttccattacc 1980
gcgggctacg attttaccga ttattctggc gatcatggca accgtaattt agcgtatgct 2040
gaactggtgg cgaaagttga aaacgcaacg ctgcttttta atctttccca ggggcgtcgt 2100
gattatgaaa ctgaacattt caatgccact cgcggtcagg gtgcggtctg gtataaatgg 2160
aataactggc tgacaacccg aacgggtatt gcctttgcgg ataatacgcc ggtctttgcc 2220
cgccaggatt ttcgtcagga tattaacctg gccctgttgc caaaaacgct tttcacgacc 2280
ggttatcgct acactaaata ttacgatgat gtcgaagtcg atgcctggca aggcggcgta 2340
tcactctata ctggcccggt gatcaccagc taccgctata cccattatga ctccagcgat 2400
gcaggtggta gttatagcaa tatgatttcc gtgcgtctga atgacccgcg cggcactggt 2460
tatacgcaac tatggctaag ccgcggaaca ggcgcttaca cctatgactg gacgccagaa 2520
acacgctacg gcagcatgaa gagcgtcagt ctgcaacgta ttcaaccgct gactgagcaa 2580
cttaatctcg ggctgacggc aggtaaagtg tggtacgaca ccccaaccga tgattataac 2640
ggtctgcaac ttgcagccca tctgacctgg aaattctgat tccttctgcc gcccgctatc 2700
cggggcggcc ttccctgccg attagccccc ccctttcctc tttgttttcc gaccacattc 2760
accggataaa ttttattctc cagtgttata tactataggg gggtatgcat tgacatatag 2820
catacccccc tatagtatat tgcgtgcaga taatgaggtg cgaaatgccc agtactccgg 2880
aagagaagaa aaaggtcctt actcgagttc gtcgtattcg agggcagatt gatgctctgg 2940
aacggtcgct ggagggtgat gccgaatgcc gtgccatact ccaacagatc gctgccgttc 3000
ggggcgcggc taatgggctg atggcagaag tgcttgaaag ccatatccgg gaaacgtttg 3060
accgaaatga ctgctacagc cgcgaagtca gccaatccgt tgacgacact attgaactgg 3120
ttcgagccta tcttaaatag ctgaatctat taccatattg aggaagagcg agagatgaaa 3180
tcacgtgctg ccgttgcatt tgctcccggt aaaccgctgg aaatcgttga aattgacgtt 3240
gcaccaccga aaaaaggtga agtgctgatt aaagtcaccc ataccggcgt ttgccatacc 3300
gacgcattta ccctctccgg ggatgacccg gaaggtgtat tcccggtggt tctcggtcac 3360
gaaggggccg gcgttgtggt tgaagtcggt gaaggcgtaa ccagcgtcaa acctggcgac 3420
catgtgatcc cgctttacac cgcggagtgc ggcgagtgtg agttctgtcg ttctggcaaa 3480
actaacctct gtgttgcggt tcgcgaaacc cagggtaaag gcttgatgcc agacggcacc 3540
acccgttttt cttacaacgg gcagccgctt tatcactaca tgggatgctc aacattcagt 3600
gaatacaccg tggtcgcgga agtgtctctg gccaaaatta atccagaagc aaaccatgaa 3660
cacgtctgcc tgctgggctg tggcgtgacc accggtattg gcgcggtgca caacacagct 3720
aaagtccagc caggtgattc tgttgccgtg tttggtcttg gcgcgattgg tctggcagtg 3780
gttcagggcg cgcgtcaggc gaaagcggga cggattatcg ctatcgatac caacccgaag 3840
aaattcgatc tggctcgtcg cttcggtgct accgactgca ttaacccgaa tgactacgac 3900
aaaccgatta aagatgtcct gctggatatc aacaaatggg gtatcgacca tacctttgaa 3960
tgcatcggta acgtcaacgt gatgcgtgcg gcgctggaaa gtgcgcaccg cggctggggt 4020
cagtcggtga tcatcggggt agcaggtgcc ggtcaggaaa tctccacccg accattccag 4080
ttggtcaccg gtcgcgtatg gaaaggttcc gcgtttggcg gcgtgaaagg tcgttcccag 4140
ttaccgggta tggttgaaga tgcgatgaaa ggtgatatcg atctggaacc gtttgtcacg 4200
cataccatga gccttgatga aattaatgac gccttcgacc tgatgcatga aggcaaatcc 4260
attcgaaccg taattcgtta ctgatttccc gcaggtatac cccgtccact tcagacgggg 4320
ttcttaatac tctccctggg cagccgtccg ggggattaac cgtgagataa tgactgatgg 4380
aactcattga aaaacatgcc agctttggcg gctggcaaaa tgtgtatcgg cattattccc 4440
aatcactgaa atgtgaaatg aatgtcggcg tctatctccc accaaaagcc gcgaatgaaa 4500
aattgccggt gttgtactgg ctttcaggcc tgacttgcaa cgagcagaat ttcattacta 4560
aatcggggat gcagcgttac gcggctgagc acaacattat tgttgttgcg ccggacacca 4620
gtccgcgagg cagtcatgtc gcagatgctg accgttacga tctcgggcaa ggtgccgggt 4680
tttacctgaa cgcgacgcaa gcgccgtgga atgaacatta caaaatgtat gactatatcc 4740
gcaacgagct gccggattta gtgatgcatc attttccggc aacggccaaa aagtctatct 4800
ctggtcattc tatgggcggg ctgggcgcgc tggtgctggc gttacgtaac ccagatgaat 4860
atgtcagcgt ctcggcgttt tcgcccattg tctccccatc gcaagtgccg tggggacagc 4920
aagcctttgc tgcatatctt gctgaaaata aagatgcctg gttggattac gacccggtga 4980
gtcttatttc acaaggtcaa cgcgttgcgg aaatcatggt tgatcagggg ttgagtgatg 5040
atttttacgc agaacagctg cggactccaa atcttgaaaa gatctgccag gagatgaata 5100
tcaagacgtt aatccgttat cacgagggtt atgatcacag ctattatttt gtctccagtt 5160
ttattggcga gcatattgcc taccacgcca ataaactgaa tatgcgttga taatagtgca 5220
cgactgccgg atgcggcgtg aacgccttat ccggcctaca cttcgcccgt aaaccgtagg 5280
cctgataaga cgcgcaaagc gtcgcatcag gcatggcgca cgactgccgg atgcggcgtg 5340
aacgccttat ccggtctaca cttcgcccat aaaccgtagg cctgataaga cgcgcatagc 5400
gtcgcatcag gcatctgcgc acgacttatc tatgtttacc acatcaaatc atcaggcact 5460
ttgaagtcgg catacgggtc gtcttcatcc tgctcttcgg cgctgagcgc gctgtgcaac 5520
actatactgc tggcatcgcg ctgagcaatt ttatcggcaa cgctggcggg aataatggcg 5580
tattcacctt cgctattgtt atcgaccaac aagcgggcaa tcgccagacg accattaatc 5640
aactgcgcct gtgtgagctt atcgacaaaa atcttcttaa tcagattgcc gtcagtgaag 5700
ttaaaaccaa tatcgccatt ggcaatggtg attcggttca tttcaataag ctgcttcacc 5760
tgagctttat attctttcgc caacgccgct tgtttttgct gttcgctaag ctgtttatca 5820
cgctcaagct gtgccttttt attttcttct accgccgccc gagcttcacg cgcctgaacg 5880
cgcgattttt tcgccgttct ctccaccttc gccgcttttt tgctggtgac taatcctgct 5940
ttgagcaact gctcttgtaa ggtaagtttt gccatctttg tttccaaacc cgctgaataa 6000
tttttagcga gtatacctgt aaacgccgta ggtgtattgg ggtgaagtcc ctttcgcccc 6060
tgcctaataa ggcacgtcag gcatcggcgc acggctgtat tcgtgatctc cggctcatca 6120
aaataaacac cgccaaccca gcaacaagaa tacccggtgc agaagcggcc attacgccga 6180
ccgtgccagt gcctaatgcc agcattttcc cggccagtaa cggaccgctc atagccccca 6240
gacgccctac cgccacggct gttcccacac ctgttgcgcg gatctgcgaa ctgtaaaaca 6300
acggtgccag ggcatacaaa acgctttgcc cacctgtcgc aaacaacccc gcgacaaatc 6360
ccgccagcaa cataccgtta aatgacgaca ccgttccaag cgccagcagc gaagctaaca 6420
tgccgctata aatcagtagc gacatggtta ctggacgcag cttatccatc aatgcgccca 6480
acattaacgt cccgcttgcc gcccccattt gcagggcaaa catcacccct gccgcctgcg 6540
atggctggaa tccttgctcc accaaaagta gcggtagcca gttgatcaac atgtagacca 6600
ccagcagagt gaagaaataa cacaaccaca gcagcagcgt cgcggttgcc gtttctggcg 6660
caaataaggc acgcagtggt ggcgcagact gtttttcgcc agcgaaaacc gccgactccg 6720
gcagccagcg cattaatagc ggcaccagaa tcaacggcac cacaccacct acccaaaaca 6780
ccgtttgcca tgctaagttt gcccccgcga aacccagtgt cgccgccagc gccgcgccaa 6840
tgggaacacc gcaatacatc aggctcactg ccgtcccacg aaaacgtgga cccgcggctt 6900
cagacgtcag ggcgataaga ttcggcaacg ccgcccccag cccgacaccg gtcatcagcc 6960
gcgcaaagac cagtgagggg aaatcccagg caatcgccgt tgccagtgag aacaaaccaa 7020
acagcgcaac tgagccaatc aaaatacgct tacgaccata acggtccgcc agcattccgc 7080
caaccaacgc gccgggtagc aaaccgagta ttccggcgct aaatatccag cccatttgca 7140
ttttatcgag tgcgaaagcc tgggcgatgc cacccgccgc aatgccagcc gcctgaagat 7200
ccagcccttc catcagagcg accaaaaaac aaagcccgat ggtcagcatc aggcgggatg 7260
aagatgatga aggggtacga gtcgacataa gatgaacctc attgcgagtg caggtgaatc 7320
gcgactgata cattgccagc cgcgtaatca gaactattga atgactgcct acgggcgaaa 7380
tgtaggccgg ataaggcgtt cacgccgcat ccggcagtcg tgtgcagatg cctgatgcga 7440
cgcttgcgcg tcttatcagg cctacaaatt cccgcgccat ccgtaggccg gataaggcgt 7500
ttacgccgca tccggcagtc gtgcgcagat gcctgatgcg acgctaacgc gtcttatcag 7560
gcctacaaat tctcgcgcca tccgtaggcc ggacaagacg ttcacgccgc atccggcagt 7620
cgtgctggga tgggcataca aaatgcacat tctcggcagt caatattatt tgttgttgcg 7680
cagatccagc gccacgtcga cgatcatatc ctcctggccg ccaaccatcc ggcgtttgcc 7740
cagctcaacg agaatatcca ccgcgcttaa gccataacgc gccgccgccg tttcacagtg 7800
acgcaggaag ctggagtaaa caccagcgta tcccagcgcc agcgtttcgc gatcgactcg 7860
taccggtcga tcctgcaacg gacgcaccag gtcgtcagcg gcatccatta acgcatagag 7920
atcggtccca tgctgccagc ccagtttatc cgcggcggca ataaatactt ccagcggcgc 7980
gttacctgcg cccgcgccca ttcccgcgag gctggcgtcg attcggtcgc agccctcttc 8040
caccgcctcg atagagttcg ccacgccaag actcaggtta tggtgagcgt gcatgccggt 8100
ttgcgtttct ggtttcaaca ctgctttcag ggcgcggaaa cggtcacgga tatcgctcat 8160
gttcatcgca ccgccagaat ccaccacata aatacaggtc gcaccgtagc cttccatcag 8220
ctttgcctgc tttgcgagat tctctggcgt ggtcatatgg ctcatcatca gaaaaccaac 8280
ggtgtccatt ccgagctcgc gggcatactg aatatgctgg gcggaaacat cagcttcggt 8340
acagtgcgta gccacacgaa ccacccgcgc gccagcttgc caggcatttt tcagatcgtg 8400
aatagtgccg attcctggca gcaacaacgt cgcgattttg gcgtgcttca ccacatccgc 8460
cgctgcttca atccattcaa ggtcgctatg tgcgccgaaa ccatagttaa agctggaacc 8520
ctgcaaaccg tcgccgtggg ccacttcaat cgaatccacg tgggcatcgt ccagtgcttt 8580
ggcaatctgg cgaacgtttt ccagcgaata ctgatgacga atggcgtgca taccgtcacg 8640
caacgtgacg tccgagatat aaagtttttt accgttcatg ccgcttctcc tgccttgcgc 8700
gccagtgact gggccatttt ttccgctgtc gccagcgcac tggaagtcat aatgtcgagg 8760
ttgcccgcat aggcaggcag ataatgcgct gcgccttcga cttccagcca gaccgctgtt 8820
ttcagtccgg agaattgccc cacgcccggt aaattgaccg gtttatcctg cgggataact 8880
tcaaactgca cgcgctgttt caggcgataa cccggtacgt aagcctgcac cgcctcagcc 8940
atttcattga ttgaggcttc gatatcatct tgtgaagctt cgtcgctcaa tacatacacc 9000
gtgtcacgca tcatcaacgg tggctctgct gggttaagca caataatcgc cttccctttt 9060
gccgcgccgc ccaccacttc aatggctcgg gaagtggttt ccgtaaattc atcgatattg 9120
gcacgcgtgc caggtccggc agatttactg gcgatagaag cgataatttc ggcgtaatga 9180
acacgcgcca cgcgtgaaac tgccgccacc attggaatgg tggcctggcc gccgcaggtg 9240
accatgttga cgttcagttg atcgacgttc gcctcgaggt taaccaccgg cacgcagtaa 9300
gggccgatgg cagcaggcgt caggtcaatt aagcgaatat ccggtttcgc ttcgcgtaaa 9360
gcggcatcgt ttttcacatg agcaccggcg ctggtcgcat caaatacaat gtcgatatca 9420
gcaaattcag gcatgttcat cagtccgatc accccttcat gggtggtggc gacgcccata 9480
cgtctggcgc gcgccagacc gtcggactga ggatcaatgc caaccatcac cgccatctcc 9540
agatgctgac cgtgacgcaa aattttaatc atcagatcgg tgccaatgtt gccagaaccg 9600
ataatggcga ctttacgctt actcatgaca gacttccttt tggggctgcg cttgaaaatg 9660
tcgcagcaac tgaacctatg ccttcaatat gggcttcaaa acgatcgccc gcattcaccg 9720
ccaccatcgg acctaatgcc ccggtaagaa tgatatctcc ggtgcgcagc ggttcaccca 9780
gactggccat tttgcgtgcc agccagacgg ccgcattaag cggatgtccc aggcattcgc 9840
tgccgcgccc gctagaaacc tcttcgttat tacgcgtcat cttcatggcg cagtttttca 9900
ggtctaaccc cgccggacgt tgcgccggac cgccgatgac atacacccca caggaggcgt 9960
tatctgccac ggtatcgaca aactgaatcg accagtcgcg aatgcggctc cccaccactt 10020
ccagcgccgg aagtacccat tcaatggcgt tatacaattc gtcgaaggtg atatcggttg 10080
cgggcaaatc gcggttcaac accagtgcga tctccgcttc aatgcggggt tgcagaacac 10140
gggaaaaagg aatgatttcg ttatcgccat aacacatgtc ggcaaataat gtcccgaaat 10200
ccggttgatc aacgcccagt tgttgctgca ctttcggatg cgtcaggccc actttacgcc 10260
ctaccacgcg acgcccctgc gcaacgtcat attgcacatt tatgtgctga atggcgtagg 10320
ccgcttcagc gttatcgata ccaatcagat cgcgcagcgg cgcaatcgct tcgccctgct 10380
ctgcggcgcg gcgtaaatcc gccgccagtt gctcaagagt atgcttcgtc atgaccattc 10440
cttaagggcg tgcgaggaaa ttcagcacca attgattgaa agcgtcggca tgttcccact 10500
gcgcccagtg accacagtcg cggaagatat gcagttcaga accggcaatg ccggacagca 10560
gacgcagacc cgcatccatc ggcacaaagc ggtcgttgcg cccccagaca atcagggttt 10620
gcgctttgat ttccgccaga cgtgggccaa aatccgggaa ctgtttcgga ttagcttcca 10680
ggctcttaac gaagttttcc aggtgatcgc ggcgcgacag catattattc aggcgcgctt 10740
caaacagggc gtcggtcaaa tcgctggtat cgaaaacgaa gatatccatc atcagcttca 10800
ggttttcgat agtcggctga cgataaagct gattcagtcg cttaatacct tcggttggca 10860
tcggcgtaaa caaactcatg ccgcccgtac cgccgcccat cagcaccagt ttgccgacgc 10920
gctccggcca gttaagggtg aacgccacag aactatggcc gcccatcgag ttgcccagca 10980
ggtggatttt ggcgatatcc agttgatcca ccacgctttt caggattcgt gcattaagat 11040
ccgatcgtga accactatta acgatcgaat cgcttttgcc ccaacccgga caatccagca 11100
ggatcacccg atagcccgcc tctaccagcg gatcgatatt gcggctgaag ttcgcccagc 11160
cagtagcacc cgggccggaa ccatgcagca ggacaacggt ttcgtcgcct tgtccgcagt 11220
cattaaaatg gatgcgcagc gttttacccg cttcttctac attcagaaaa cggctggtgg 11280
cggcttcggt ttgtggctga taactcatca tcttctcctg catattcagt tctctgttct 11340
ggcgcttaac gagccaaatc cggcaatcca ctccgggatt gggcggtaat aacgcccttc 11400
gctacgccag ttgccaaatg cagaaatagc ggcaaaagcg gcgacccagg ttttgatttc 11460
atgtgtcgac tttccggcaa tggcggaaag ctcttcgtta ctgacggcat ccagttcctg 11520
tatgcgtccc tgctccagca aagtcatgaa ctggttatcc caaatcgggt tgagcggatg 11580
cagagttctc tgatcctcaa caaacttctc agcggcgcta atcacccgtt gctgacgcaa 11640
ttcgcgctca ctggcgggta aatctttccc gctccccaac agacggtcgc gcatatgggc 11700
atcggctttc gccagttcgg gcaccggcgg ctgatgggaa agcccaccgg aacccaggaa 11760
cagcacgcgt ttattgagag tgctggtgaa acgtccaatg gcttcaccca acatgcgggt 11820
acgctggaaa ccgggcagcg gcgtggcgac accgttgatg aacacaggca gaactggcac 11880
cttatccagc ccgccgagca ggaactccag tggctgggcg aacccgtggt ccacctgcat 11940
acagtaagaa acggcaagat cgatcccgct cttcatgacg gcatgcgcac aggcctccgc 12000
cagctccaca ggcacgggca gctctcctgc cgcactgccg aaatcaccaa ttgccgtcgc 12060
cccaacgcct aaacagaacg gtggcatcac gtcatagaaa aagccgttgt agtgatctgg 12120
cgcaaacagc accaccagtt caggggagaa agccgcaata cgctcgcggg cgctggcaat 12180
cacgccattg acctcatcga gtacctcttg cgccgggtcg acatatccca ccagcggcga 12240
gtgggaaaga cagtgaagat aagcgtgcat atcaggctac cttttcgaca gaaacgtcgg 12300
catcagggcg ggtcagcgtc atcaccgacg ccagtttatt cagcgtatta cccagggttt 12360
gcggaatggc ggtggcggca acaaagcgat ccgggcgcat caccaccagc gaagcattat 12420
gttgtgcgaa ccagctacgc aggcgacctt gcgtatcccc cacgcgtagt acgccgtcgt 12480
ggttatcctg tgcggtatga atttgcactt ccggcaccac ctgaatgaag cgggtgccca 12540
acgcgcgcca ctgctggatt tgctcgtcgc tcatccccca cagtggattg catccccagc 12600
caattaccgc gaagttcgcg ccgatcgcgt tatcgagcag cgtcacgtcg ccgttttcca 12660
gcgtgacttt cggctgaata aacatcttgc cgaccggaga gtgcttcgct tcgccctctc 12720
gcaccagcgc accgccgtaa tattgcggca tcggcttgaa gcgcatttcg aggaagtagc 12780
gttttactgg cggcagataa ttcaacagcc aggaaacgcc gtcacgtaac gtaccctgcc 12840
agcgtttcgg cggagccagc acgttgcccg ccgtcacgga caggtcaatc atcgctttgg 12900
cgtgatcgcg tcgttcttgt tgataggtat cgagcagcgc atcacgggct ttcccctgga 12960
taaccaacgc cagtttccag gcgaggttaa aggcgtcgcg cataccgctg ttatagccct 13020
gcccctgcca taccggcatg atgtgcgcgg catcgcccgc cagcagtacg cgatcaatac 13080
ggaaacgttg cgccagtcgc gcgttgtggg tgtagacacg ctggcgaatc aattcaacat 13140
tgtccggatt aggcagcact ttgcttaaca gcttgcgcat attttgcggc tcacgcagct 13200
gttcttcggt ttctcctggc atcaccataa attcaaagcg acgtaccgca tgaggtagcg 13260
cggcagaaac atacgggcgc accggatcgc aacacaaata gatatgcggc gtacttaacg 13320
gatcgttggc gatatctacc acaatccact gatttggcgc agttttacct tcaaacggca 13380
cattcagggt gcgacggaca aaacttgccc caccatcaca ggccaccagc cactgggctt 13440
tgactatttc ccgctgccct tctgccgttt tcaggtgcaa ggtcacttcg tcatcttgct 13500
gactgaaggc ctccagctcg cgggaaaaca agcagcgcac attcggaaaa cgcgacaccc 13560
cttccagcat caccgcatcg acctgcggct gaataaaggc gttacggcgc ggccagccaa 13620
attcatcggt cattggctga atatcagcaa aacagcggcc tttcggggtg agaaaacgca 13680
tcgcgtgcca cggcgtagtg tgcggcagaa catcatcgac caggccgacc gactgcatgg 13740
tgcgcagcgc ctcgtcatca ataccaatcg cacgcgggta gtcgatcaac ttatcgagtt 13800
tctccaccac cagcacgtca atgcccatct ggccgagata gttcgccatc atcagcccaa 13860
ccgggccggc accagcgatc gccacctgaa cgctatggtt aacagcaggc tggatgtcag 13920
ggtgttgtat tgccatttca gtacctcacg actcggacaa aatgtcgttg cgcgcacagt 13980
acagcgcaac ttattttgtt aaaaacatgt aaatgatttt ttattgtgcg ctcagtatag 14040
gaagggtgtt ttcggctaca atcaaaacat gcccgaatgt gcaccaggtg caccacgttg 14100
ttttaactat agaaatgtca attaatatgc agaacaatga gcagacggaa tacaaaaccg 14160
tgcgcggctt aacccgcggt ctaatgttat taaatatgtt aaataaactt gatggcggtg 14220
ccagcgtcgg gctgctggcg gaactcagcg gcctgcatcg caccactgtg cggcgactgc 14280
tggagacgct gcaggaagag ggatatgtcc gccgtagccc ctccgatgat agttttcgac 14340
tgaccatcaa agtgcggcaa ttaagcgaag gatttcgtga cgaacagtgg atttctgcac 14400
tggcggcccc actgctgggc gatctgttgc gcgaagtggt atggccgaca gatgtgtcca 14460
cgctggatgt tgatgcaatg gtggtacgcg aaaccactca ccgtttcagc cgcttatcct 14520
ttcaccgggc aatggtcggg cgacgtttgc cgcttctgaa aaccgcctcg ggcctgacct 14580
ggctggcctt ttgcccggaa caagaccgca aggaattaat cgaaatgtta gcctcccgcc 14640
ccggtgatga ctatcaactg gcacgggaac cgttaaagct ggaagccatt ctggcgcgcg 14700
cgcgcaaaga gggttacgga cagaactacc gcggctggga tcaggaggag aagatcgcct 14760
ctatcgccgt accgctgcgc agtgaacaac gggtgattgg ctgtctgaat ctggtgtata 14820
tggcgagcgc aatgaccatt gaacaggcag cggaaaagca tcttccggcg ctacaacggg 14880
tagcaaaaca gatcgaagaa ggggttgaat cgcaggctat tctggtggcc ggaaggcgaa 14940
gcggcatgca tttacgttga caccatcgaa tggcgcaaaa cctttcgcgg tatggcatga 15000
tagcgcccgg aagagagtca attcagggtg gtgaatgtga aaccagtaac gttatacgat 15060
gtcgcagagt atgccggtgt ctcttatcag accgtttccc gcgtggtgaa ccaggccagc 15120
cacgtttctg cgaaaacgcg ggaaaaagtg gaagcggcga tggcggagct gaattacatt 15180
cccaaccgcg tggcacaaca actggcgggc aaacagtcgt tgctgattgg cgttgccacc 15240
tccagtctgg ccctgcacgc gccgtcgcaa attgtcgcgg cgattaaatc tcgcgccgat 15300
caactgggtg ccagcgtggt ggtgtcgatg gtagaacgaa gcggcgtcga agcctgtaaa 15360
gcggcggtgc acaatcttct cgcgcaacgc gtcagtgggc tgatcattaa ctatccgctg 15420
gatgaccagg atgccattgc tgtggaagct gcctgcacta atgttccggc gttatttctt 15480
gatgtctctg accagacacc catcaacagt attattttct cccatgaaga cggtacgcga 15540
ctgggcgtgg agcatctggt cgcattgggt caccagcaaa tcgcgctgtt agcgggccca 15600
ttaagttctg tctcggcgcg tctgcgtctg gctggctggc ataaatatct cactcgcaat 15660
caaattcagc cgatagcgga acgggaaggc gactggagtg ccatgtccgg ttttcaacaa 15720
accatgcaaa tgctgaatga gggcatcgtt cccactgcga tgctggttgc caacgatcag 15780
atggcgctgg gcgcaatgcg cgccattacc gagtccgggc tgcgcgttgg tgcggatatc 15840
tcggtagtgg gatacgacga taccgaagac agctcatgtt atatcccgcc gttaaccacc 15900
atcaaacagg attttcgcct gctggggcaa accagcgtgg accgcttgct gcaactctct 15960
cagggccagg cggtgaaggg caatcagctg ttgcccgtct cactggtgaa aagaaaaacc 16020
accctggcgc ccaatacgca aaccgcctct ccccgcgcgt tggccgattc attaatgcag 16080
ctggcacgac aggtttcccg actggaaagc gggcagtgag cgcaacgcaa ttaatgtaac 16140
taggcacccc aggctttaca ctttatgctt ccggctggta taatgtgtgg acctgtagaa 16200
ataattttgt ttaactttaa taaggagata taccatggga ggcagtactg ttgcaccaac 16260
tacaccgttg gcaaccggcg gtgcgctccg caaagtgcga caagccgtct ttcccatcta 16320
cggaaaccaa gaagtcacca aatttctgct catcggatcc attaaattct ttataatctt 16380
ggcactcacg ctcacgcgtg ataccaagga cacgttgatt gtcacgcaat gtggtgccga 16440
agcgattgcc tttctcaaaa tatacggggt gctacccgca gcgaccgcat ttatcgcgct 16500
ctattccaaa atgtccaacg ccatgggcaa aaaaatgcta ttttattcca cttgcattcc 16560
tttctttacc tttttcgggc tgtttgatgt tttcatttac ccgaacgcgg agcgactgca 16620
ccctagtttg gaagccgtgc aggcaattct cccgggcggt gccgcatctg gcggcatggc 16680
ggttctggcc aagattgcga cacactggac atcggcctta ttttacgtca tggcggaaat 16740
atattcttcc gtatcggtgg ggctattgtt ttggcagttt gcgaacgacg tcgtcaacgt 16800
ggatcaggcc aagcgctttt atccattatt tgctcaaatg agtggcctcg ctccagtttt 16860
agcgggccag tatgtggtac ggtttgccag caaagcggtc aactttgagg catccatgca 16920
tcgactcacg gcggccgtaa catttgctgg tattatgatt tgcatctttt accaactcag 16980
ttcgtcatat gtggagcgaa cggaatcagc aaagccagcg gcagataacg agcagtctat 17040
caaaccgaaa aagaagaaac ccaaaatgtc catggttgaa tcggggaaat ttctcgcgtc 17100
aagtcagtac ctgcgtctaa ttgccatgct ggtgctggga tacggcctca gtattaactt 17160
taccgaaatc atgtggaaaa gcttggtgaa gaaacaatat ccagacccgc tagattatca 17220
acgatttatg ggtaacttct cgtcagcggt tggtttgagc acatgcattg ttattttctt 17280
cggtgtgcac gtgatccgtt tgttggggtg gaaagtcgga gcgttggcta cacctgggat 17340
catggccatt ctagcgttac ccttttttgc ttgcattttg ttgggtttgg atagtccagc 17400
acgattggag atcgccgtaa tctttggaac aattcagagt ttgctgagca aaacctccaa 17460
gtatgccctt ttcgacccta ccacacaaat ggcttatatt cctctggacg acgaatcaaa 17520
ggtcaaagga aaagcggcaa ttgatgtttt gggatcgcgg attggcaaga gtggaggctc 17580
actgatccag cagggcttgg tctttgtttt tggaaatatc attaatgccg cacctgtagt 17640
aggggttgtc tactacagtg tccttgttgc gtggatgagc gcagctggcc gactaagtgg 17700
gctttttcaa gcacaaacag aaatggataa ggccgacaaa atggaggcaa agaccaacaa 17760
agaaaagtag ttaacctagg ctgctgccac cgctgagcaa taagactcct gttgatagat 17820
ccagtaatga cctcagaact ccatctggat ttgttcagaa cgctcggttg ccgccgggcg 17880
ttttttattg gtgagaat 17898
<210> 6
<211> 125
<212> ДНК
<213> Escherichia coli
<400> 6
aggagtaaaa atgattccgg ggatccgtcg acctgcagtt cgaagttcct attctctaga 60
aagtatagga acttcgaagc agctccagcc tacagaaact aacgaagatt tttaatcgtc 120
ttgtt 125
<210> 7
<211> 1082
<212> ДНК
<213> Escherichia coli
<400> 7
aggagtaaaa atggctatcg acgaaaacaa acagaaagcg ttggcggcag cactgggcca 60
gattgagaaa caatttggta aaggctccat catgcgcctg ggtgaagacc gttccatgga 120
tgtggaaacc atctctaccg gttcgctttc actggatatc gcgcttgggg caggtggtct 180
gccgatgggc cgtatcgtcg aaatctacgg accggaatct tccggtaaaa ccacgctgac 240
gctgcaggtg atcgccgcag cgcagcgtga aggtaaaacc tgtgcgttta tcgatgctga 300
acacgcgctg gacccaatct acgcacgtaa actgggcgtc gatatcgata acctgctgtg 360
ctcccagccg gacaccggcg agcaggcact ggaaatctgt gacgccctgg cgcgttctgg 420
cgcagtagac gttatcgtcg ttgactccgt ggcggcactg acgccgaaag cggaaatcga 480
aggcgaaatc ggcgactctc acatgggcct tgcggcacgt atgatgagcc aggcgatgcg 540
taagctggcg ggtaacctga agcagtccaa cacgctgctg atcttcatca accagatccg 600
tatgaaaatt ggtgtgatgt tcggtaaccc ggaaaccact accggtggta acgcgctgaa 660
attctacgcc tctgttcgtc tcgacatccg tcgtatcggc gcggtgaaag agggcgaaaa 720
cgtggtgggt agcgaaaccc gcgtgaaagt ggtgaagaac aaaatcgctg cgccgtttaa 780
acaggctgaa ttccagatcc tctacggcga aggtatcaac ttctacggcg aactggttga 840
cctgggcgta aaagagaagc tgatcgagaa agcaggcgcg tggtacagct acaaaggtga 900
gaagatcggt cagggtaaag cgaatgcgac tgcctggctg aaagataacc cggaaaccgc 960
gaaagagatc gagaagaaag tacgtgagtt gctgctgagc aacccgaact caacgccgga 1020
tttctctgta gatgatagcg aaggcgtagc agaaactaac gaagattttt aatcgtcttg 1080
tt 1082
<210> 8
<211> 783
<212> БЕЛОК
<213> Escherichia coli
<400> 8
Met Ala Gln Ala Gly Phe Ile Leu Thr Arg His Trp Arg Asp Thr Pro
1 5 10 15
Gln Gly Thr Glu Val Ser Phe Trp Leu Ala Thr Asp Asn Gly Pro Leu
20 25 30
Gln Val Thr Leu Ala Pro Gln Glu Ser Val Ala Phe Ile Pro Ala Asp
35 40 45
Gln Val Pro Arg Ala Gln His Ile Leu Gln Gly Glu Gln Gly Val Arg
50 55 60
Leu Thr Pro Leu Ala Leu Lys Asp Phe His Arg Gln Pro Val Tyr Gly
65 70 75 80
Leu Tyr Cys Arg Ala His Arg Gln Leu Met Asn Tyr Glu Lys Arg Leu
85 90 95
Arg Glu Gly Gly Val Thr Val Tyr Glu Ala Asp Val Arg Pro Pro Glu
100 105 110
Arg Tyr Leu Met Glu Arg Phe Ile Thr Ser Pro Val Trp Val Glu Gly
115 120 125
Asp Met His Asn Gly Ala Ile Val Asn Ala Arg Leu Lys Pro His Pro
130 135 140
Asp Tyr Arg Pro Pro Leu Lys Trp Val Ser Ile Asp Ile Glu Thr Thr
145 150 155 160
Arg His Gly Glu Leu Tyr Cys Ile Gly Leu Glu Gly Cys Gly Gln Arg
165 170 175
Ile Val Tyr Met Leu Gly Pro Glu Asn Gly Asp Ala Ser Ala Leu Asp
180 185 190
Phe Glu Leu Glu Tyr Val Ala Ser Arg Pro Gln Leu Leu Glu Lys Leu
195 200 205
Asn Ala Trp Phe Ala Asn Tyr Asp Pro Asp Val Ile Ile Gly Trp Asn
210 215 220
Val Val Gln Phe Asp Leu Arg Met Leu Gln Lys His Ala Glu Arg Tyr
225 230 235 240
Arg Ile Pro Leu Arg Leu Gly Arg Asp Asn Ser Glu Leu Glu Trp Arg
245 250 255
Glu His Gly Phe Lys Asn Gly Val Phe Phe Ala Gln Ala Lys Gly Arg
260 265 270
Leu Ile Ile Asp Gly Ile Glu Ala Leu Lys Ser Ala Phe Trp Asn Phe
275 280 285
Ser Ser Phe Ser Leu Glu Thr Val Ala Gln Glu Leu Leu Gly Glu Gly
290 295 300
Lys Ser Ile Asp Asn Pro Trp Asp Arg Met Asp Glu Ile Asp Arg Arg
305 310 315 320
Phe Ala Glu Asp Lys Pro Ala Leu Ala Thr Tyr Asn Leu Lys Asp Cys
325 330 335
Glu Leu Val Thr Gln Ile Phe His Lys Thr Glu Ile Met Pro Phe Leu
340 345 350
Leu Glu Arg Ala Thr Val Asn Gly Leu Pro Val Asp Arg His Gly Gly
355 360 365
Ser Val Ala Ala Phe Gly His Leu Tyr Phe Pro Arg Met His Arg Ala
370 375 380
Gly Tyr Val Ala Pro Asn Leu Gly Glu Val Pro Pro His Ala Ser Pro
385 390 395 400
Gly Gly Tyr Val Met Asp Ser Arg Pro Gly Leu Tyr Asp Ser Val Leu
405 410 415
Val Leu Asp Tyr Lys Ser Leu Tyr Pro Ser Ile Ile Arg Thr Phe Leu
420 425 430
Ile Asp Pro Val Gly Leu Val Glu Gly Met Ala Gln Pro Asp Pro Glu
435 440 445
His Ser Thr Glu Gly Phe Leu Asp Ala Trp Phe Ser Arg Glu Lys His
450 455 460
Cys Leu Pro Glu Ile Val Thr Asn Ile Trp His Gly Arg Asp Glu Ala
465 470 475 480
Lys Arg Gln Gly Asn Lys Pro Leu Ser Gln Ala Leu Lys Ile Ile Met
485 490 495
Asn Ala Phe Tyr Gly Val Leu Gly Thr Thr Ala Cys Arg Phe Phe Asp
500 505 510
Pro Arg Leu Ala Ser Ser Ile Thr Met Arg Gly His Gln Ile Met Arg
515 520 525
Gln Thr Lys Ala Leu Ile Glu Ala Gln Gly Tyr Asp Val Ile Tyr Gly
530 535 540
Asp Thr Asp Ser Thr Phe Val Trp Leu Lys Gly Ala His Ser Glu Glu
545 550 555 560
Glu Ala Ala Lys Ile Gly Arg Ala Leu Val Gln His Val Asn Ala Trp
565 570 575
Trp Ala Glu Thr Leu Gln Lys Gln Arg Leu Thr Ser Ala Leu Glu Leu
580 585 590
Glu Tyr Glu Thr His Phe Cys Arg Phe Leu Met Pro Thr Ile Arg Gly
595 600 605
Ala Asp Thr Gly Ser Lys Lys Arg Tyr Ala Gly Leu Ile Gln Glu Gly
610 615 620
Asp Lys Gln Arg Met Val Phe Lys Gly Leu Glu Thr Val Arg Thr Asp
625 630 635 640
Trp Thr Pro Leu Ala Gln Gln Phe Gln Gln Glu Leu Tyr Leu Arg Ile
645 650 655
Phe Arg Asn Glu Pro Tyr Gln Glu Tyr Val Arg Glu Thr Ile Asp Lys
660 665 670
Leu Met Ala Gly Glu Leu Asp Ala Arg Leu Val Tyr Arg Lys Arg Leu
675 680 685
Arg Arg Pro Leu Ser Glu Tyr Gln Arg Asn Val Pro Pro His Val Arg
690 695 700
Ala Ala Arg Leu Ala Asp Glu Glu Asn Gln Lys Arg Gly Arg Pro Leu
705 710 715 720
Gln Tyr Gln Asn Arg Gly Thr Ile Lys Tyr Val Trp Thr Thr Asn Gly
725 730 735
Pro Glu Pro Leu Asp Tyr Gln Arg Ser Pro Leu Asp Tyr Glu His Tyr
740 745 750
Leu Thr Arg Gln Leu Gln Pro Val Ala Glu Gly Ile Leu Pro Phe Ile
755 760 765
Glu Asp Asn Phe Ala Thr Leu Met Thr Gly Gln Leu Gly Leu Phe
770 775 780
<210> 9
<211> 320
<212> БЕЛОК
<213> Escherichia coli
<400> 9
Met Ala Ile Ser Ser Arg Asn Thr Leu Leu Ala Ala Leu Ala Phe Ile
1 5 10 15
Ala Phe Gln Ala Gln Ala Val Asn Val Thr Val Ala Tyr Gln Thr Ser
20 25 30
Ala Glu Pro Ala Lys Val Ala Gln Ala Asp Asn Thr Phe Ala Lys Glu
35 40 45
Ser Gly Ala Thr Val Asp Trp Arg Lys Phe Asp Ser Gly Ala Ser Ile
50 55 60
Val Arg Ala Leu Ala Ser Gly Asp Val Gln Ile Gly Asn Leu Gly Ser
65 70 75 80
Ser Pro Leu Ala Val Ala Ala Ser Gln Gln Val Pro Ile Glu Val Phe
85 90 95
Leu Leu Ala Ser Lys Leu Gly Asn Ser Glu Ala Leu Val Val Lys Lys
100 105 110
Thr Ile Ser Lys Pro Glu Asp Leu Ile Gly Lys Arg Ile Ala Val Pro
115 120 125
Phe Ile Ser Thr Thr His Tyr Ser Leu Leu Ala Ala Leu Lys His Trp
130 135 140
Gly Ile Lys Pro Gly Gln Val Glu Ile Val Asn Leu Gln Pro Pro Ala
145 150 155 160
Ile Ile Ala Ala Trp Gln Arg Gly Asp Ile Asp Gly Ala Tyr Val Trp
165 170 175
Ala Pro Ala Val Asn Ala Leu Glu Lys Asp Gly Lys Val Leu Thr Asp
180 185 190
Ser Glu Gln Val Gly Gln Trp Gly Ala Pro Thr Leu Asp Val Trp Val
195 200 205
Val Arg Lys Asp Phe Ala Glu Lys His Pro Glu Val Val Lys Ala Phe
210 215 220
Ala Lys Ser Ala Ile Asp Ala Gln Gln Pro Tyr Ile Ala Asn Pro Asp
225 230 235 240
Ala Trp Leu Lys Gln Pro Glu Asn Ile Ser Lys Leu Ala Arg Leu Ser
245 250 255
Gly Val Pro Glu Gly Asp Val Pro Gly Leu Val Lys Gly Asn Thr Tyr
260 265 270
Leu Thr Pro Gln Gln Gln Thr Ala Glu Leu Thr Gly Pro Val Asn Lys
275 280 285
Ala Ile Ile Asp Thr Ala Gln Phe Leu Lys Glu Gln Gly Lys Val Pro
290 295 300
Ala Val Ala Asn Asp Tyr Ser Gln Tyr Val Thr Ser Arg Phe Val Gln
305 310 315 320
<210> 10
<211> 91
<212> БЕЛОК
<213> Escherichia coli
<400> 10
Met Ala Ser Val Ser Ile Ser Cys Pro Ser Cys Ser Ala Thr Asp Gly
1 5 10 15
Val Val Arg Asn Gly Lys Ser Thr Ala Gly His Gln Arg Tyr Leu Cys
20 25 30
Ser His Cys Arg Lys Thr Trp Gln Leu Gln Phe Thr Tyr Thr Ala Ser
35 40 45
Gln Pro Gly Thr His Gln Lys Ile Ile Asp Met Ala Met Asn Gly Val
50 55 60
Gly Cys Arg Ala Thr Ala Arg Ile Met Gly Val Gly Leu Asn Thr Ile
65 70 75 80
Leu Arg His Leu Lys Asn Ser Gly Arg Ser Arg
85 90
<210> 11
<211> 167
<212> БЕЛОК
<213> Escherichia coli
<400> 11
Met Pro Gly Asn Cys Pro His Tyr Gly Arg Trp Pro Gln His Asp Phe
1 5 10 15
Thr Ser Leu Lys Lys Leu Arg Pro Gln Ser Val Thr Ser Arg Ile Gln
20 25 30
Pro Gly Ser Asp Val Ile Val Cys Ala Glu Met Asp Glu Gln Trp Gly
35 40 45
Tyr Val Gly Ala Lys Ser Arg Gln Arg Trp Leu Phe Tyr Ala Tyr Asp
50 55 60
Arg Leu Arg Lys Thr Val Val Ala His Val Phe Gly Glu Arg Thr Met
65 70 75 80
Ala Thr Leu Gly Arg Leu Met Ser Leu Met Ser Pro Phe Asp Val Val
85 90 95
Ile Trp Met Thr Asp Gly Trp Pro Leu Tyr Glu Ser Arg Leu Lys Gly
100 105 110
Lys Leu His Val Ile Ser Lys Arg Tyr Thr Gln Arg Ile Glu Arg His
115 120 125
Asn Leu Asn Leu Arg Gln His Leu Ala Arg Leu Gly Arg Lys Ser Leu
130 135 140
Ser Phe Ser Lys Ser Val Glu Leu His Asp Lys Val Ile Gly His Tyr
145 150 155 160
Leu Asn Ile Lys His Tyr Gln
165
<210> 12
<211> 511
<212> БЕЛОК
<213> Escherichia coli
<400> 12
Met Gly Gly Ser Thr Val Ala Pro Thr Thr Pro Leu Ala Thr Gly Gly
1 5 10 15
Ala Leu Arg Lys Val Arg Gln Ala Val Phe Pro Ile Tyr Gly Asn Gln
20 25 30
Glu Val Thr Lys Phe Leu Leu Ile Gly Ser Ile Lys Phe Phe Ile Ile
35 40 45
Leu Ala Leu Thr Leu Thr Arg Asp Thr Lys Asp Thr Leu Ile Val Thr
50 55 60
Gln Cys Gly Ala Glu Ala Ile Ala Phe Leu Lys Ile Tyr Gly Val Leu
65 70 75 80
Pro Ala Ala Thr Ala Phe Ile Ala Leu Tyr Ser Lys Met Ser Asn Ala
85 90 95
Met Gly Lys Lys Met Leu Phe Tyr Ser Thr Cys Ile Pro Phe Phe Thr
100 105 110
Phe Phe Gly Leu Phe Asp Val Phe Ile Tyr Pro Asn Ala Glu Arg Leu
115 120 125
His Pro Ser Leu Glu Ala Val Gln Ala Ile Leu Pro Gly Gly Ala Ala
130 135 140
Ser Gly Gly Met Ala Val Leu Ala Lys Ile Ala Thr His Trp Thr Ser
145 150 155 160
Ala Leu Phe Tyr Val Met Ala Glu Ile Tyr Ser Ser Val Ser Val Gly
165 170 175
Leu Leu Phe Trp Gln Phe Ala Asn Asp Val Val Asn Val Asp Gln Ala
180 185 190
Lys Arg Phe Tyr Pro Leu Phe Ala Gln Met Ser Gly Leu Ala Pro Val
195 200 205
Leu Ala Gly Gln Tyr Val Val Arg Phe Ala Ser Lys Ala Val Asn Phe
210 215 220
Glu Ala Ser Met His Arg Leu Thr Ala Ala Val Thr Phe Ala Gly Ile
225 230 235 240
Met Ile Cys Ile Phe Tyr Gln Leu Ser Ser Ser Tyr Val Glu Arg Thr
245 250 255
Glu Ser Ala Lys Pro Ala Ala Asp Asn Glu Gln Ser Ile Lys Pro Lys
260 265 270
Lys Lys Lys Pro Lys Met Ser Met Val Glu Ser Gly Lys Phe Leu Ala
275 280 285
Ser Ser Gln Tyr Leu Arg Leu Ile Ala Met Leu Val Leu Gly Tyr Gly
290 295 300
Leu Ser Ile Asn Phe Thr Glu Ile Met Trp Lys Ser Leu Val Lys Lys
305 310 315 320
Gln Tyr Pro Asp Pro Leu Asp Tyr Gln Arg Phe Met Gly Asn Phe Ser
325 330 335
Ser Ala Val Gly Leu Ser Thr Cys Ile Val Ile Phe Phe Gly Val His
340 345 350
Val Ile Arg Leu Leu Gly Trp Lys Val Gly Ala Leu Ala Thr Pro Gly
355 360 365
Ile Met Ala Ile Leu Ala Leu Pro Phe Phe Ala Cys Ile Leu Leu Gly
370 375 380
Leu Asp Ser Pro Ala Arg Leu Glu Ile Ala Val Ile Phe Gly Thr Ile
385 390 395 400
Gln Ser Leu Leu Ser Lys Thr Ser Lys Tyr Ala Leu Phe Asp Pro Thr
405 410 415
Thr Gln Met Ala Tyr Ile Pro Leu Asp Asp Glu Ser Lys Val Lys Gly
420 425 430
Lys Ala Ala Ile Asp Val Leu Gly Ser Arg Ile Gly Lys Ser Gly Gly
435 440 445
Ser Leu Ile Gln Gln Gly Leu Val Phe Val Phe Gly Asn Ile Ile Asn
450 455 460
Ala Ala Pro Val Val Gly Val Val Tyr Tyr Ser Val Leu Val Ala Trp
465 470 475 480
Met Ser Ala Ala Gly Arg Leu Ser Gly Leu Phe Gln Ala Gln Thr Glu
485 490 495
Met Asp Lys Ala Asp Lys Met Glu Ala Lys Thr Asn Lys Glu Lys
500 505 510
<210> 13
<211> 257
<212> БЕЛОК
<213> Escherichia coli
<400> 13
Met Ile Lys Arg Thr Leu Leu Ala Ala Ala Ile Phe Ser Ala Leu Pro
1 5 10 15
Ala Tyr Ala Gly Leu Thr Ser Ile Thr Ala Gly Tyr Asp Phe Thr Asp
20 25 30
Tyr Ser Gly Asp His Gly Asn Arg Asn Leu Ala Tyr Ala Glu Leu Val
35 40 45
Ala Lys Val Glu Asn Ala Thr Leu Leu Phe Asn Leu Ser Gln Gly Arg
50 55 60
Arg Asp Tyr Glu Thr Glu His Phe Asn Ala Thr Arg Gly Gln Gly Ala
65 70 75 80
Val Trp Tyr Lys Trp Asn Asn Trp Leu Thr Thr Arg Thr Gly Ile Ala
85 90 95
Phe Ala Asp Asn Thr Pro Val Phe Ala Arg Gln Asp Phe Arg Gln Asp
100 105 110
Ile Asn Leu Ala Leu Leu Pro Lys Thr Leu Phe Thr Thr Gly Tyr Arg
115 120 125
Tyr Thr Lys Tyr Tyr Asp Asp Val Glu Val Asp Ala Trp Gln Gly Gly
130 135 140
Val Ser Leu Tyr Thr Gly Pro Val Ile Thr Ser Tyr Arg Tyr Thr His
145 150 155 160
Tyr Asp Ser Ser Asp Ala Gly Gly Ser Tyr Ser Asn Met Ile Ser Val
165 170 175
Arg Leu Asn Asp Pro Arg Gly Thr Gly Tyr Thr Gln Leu Trp Leu Ser
180 185 190
Arg Gly Thr Gly Ala Tyr Thr Tyr Asp Trp Thr Pro Glu Thr Arg Tyr
195 200 205
Gly Ser Met Lys Ser Val Ser Leu Gln Arg Ile Gln Pro Leu Thr Glu
210 215 220
Gln Leu Asn Leu Gly Leu Thr Ala Gly Lys Val Trp Tyr Asp Thr Pro
225 230 235 240
Thr Asp Asp Tyr Asn Gly Leu Gln Leu Ala Ala His Leu Thr Trp Lys
245 250 255
Phe
<210> 14
<211> 91
<212> БЕЛОК
<213> Escherichia coli
<400> 14
Met Pro Ser Thr Pro Glu Glu Lys Lys Lys Val Leu Thr Arg Val Arg
1 5 10 15
Arg Ile Arg Gly Gln Ile Asp Ala Leu Glu Arg Ser Leu Glu Gly Asp
20 25 30
Ala Glu Cys Arg Ala Ile Leu Gln Gln Ile Ala Ala Val Arg Gly Ala
35 40 45
Ala Asn Gly Leu Met Ala Glu Val Leu Glu Ser His Ile Arg Glu Thr
50 55 60
Phe Asp Arg Asn Asp Cys Tyr Ser Arg Glu Val Ser Gln Ser Val Asp
65 70 75 80
Asp Thr Ile Glu Leu Val Arg Ala Tyr Leu Lys
85 90
<210> 15
<211> 369
<212> БЕЛОК
<213> Escherichia coli
<400> 15
Met Lys Ser Arg Ala Ala Val Ala Phe Ala Pro Gly Lys Pro Leu Glu
1 5 10 15
Ile Val Glu Ile Asp Val Ala Pro Pro Lys Lys Gly Glu Val Leu Ile
20 25 30
Lys Val Thr His Thr Gly Val Cys His Thr Asp Ala Phe Thr Leu Ser
35 40 45
Gly Asp Asp Pro Glu Gly Val Phe Pro Val Val Leu Gly His Glu Gly
50 55 60
Ala Gly Val Val Val Glu Val Gly Glu Gly Val Thr Ser Val Lys Pro
65 70 75 80
Gly Asp His Val Ile Pro Leu Tyr Thr Ala Glu Cys Gly Glu Cys Glu
85 90 95
Phe Cys Arg Ser Gly Lys Thr Asn Leu Cys Val Ala Val Arg Glu Thr
100 105 110
Gln Gly Lys Gly Leu Met Pro Asp Gly Thr Thr Arg Phe Ser Tyr Asn
115 120 125
Gly Gln Pro Leu Tyr His Tyr Met Gly Cys Ser Thr Phe Ser Glu Tyr
130 135 140
Thr Val Val Ala Glu Val Ser Leu Ala Lys Ile Asn Pro Glu Ala Asn
145 150 155 160
His Glu His Val Cys Leu Leu Gly Cys Gly Val Thr Thr Gly Ile Gly
165 170 175
Ala Val His Asn Thr Ala Lys Val Gln Pro Gly Asp Ser Val Ala Val
180 185 190
Phe Gly Leu Gly Ala Ile Gly Leu Ala Val Val Gln Gly Ala Arg Gln
195 200 205
Ala Lys Ala Gly Arg Ile Ile Ala Ile Asp Thr Asn Pro Lys Lys Phe
210 215 220
Asp Leu Ala Arg Arg Phe Gly Ala Thr Asp Cys Ile Asn Pro Asn Asp
225 230 235 240
Tyr Asp Lys Pro Ile Lys Asp Val Leu Leu Asp Ile Asn Lys Trp Gly
245 250 255
Ile Asp His Thr Phe Glu Cys Ile Gly Asn Val Asn Val Met Arg Ala
260 265 270
Ala Leu Glu Ser Ala His Arg Gly Trp Gly Gln Ser Val Ile Ile Gly
275 280 285
Val Ala Gly Ala Gly Gln Glu Ile Ser Thr Arg Pro Phe Gln Leu Val
290 295 300
Thr Gly Arg Val Trp Lys Gly Ser Ala Phe Gly Gly Val Lys Gly Arg
305 310 315 320
Ser Gln Leu Pro Gly Met Val Glu Asp Ala Met Lys Gly Asp Ile Asp
325 330 335
Leu Glu Pro Phe Val Thr His Thr Met Ser Leu Asp Glu Ile Asn Asp
340 345 350
Ala Phe Asp Leu Met His Glu Gly Lys Ser Ile Arg Thr Val Ile Arg
355 360 365
Tyr
<210> 16
<211> 277
<212> БЕЛОК
<213> Escherichia coli
<400> 16
Met Glu Leu Ile Glu Lys His Ala Ser Phe Gly Gly Trp Gln Asn Val
1 5 10 15
Tyr Arg His Tyr Ser Gln Ser Leu Lys Cys Glu Met Asn Val Gly Val
20 25 30
Tyr Leu Pro Pro Lys Ala Ala Asn Glu Lys Leu Pro Val Leu Tyr Trp
35 40 45
Leu Ser Gly Leu Thr Cys Asn Glu Gln Asn Phe Ile Thr Lys Ser Gly
50 55 60
Met Gln Arg Tyr Ala Ala Glu His Asn Ile Ile Val Val Ala Pro Asp
65 70 75 80
Thr Ser Pro Arg Gly Ser His Val Ala Asp Ala Asp Arg Tyr Asp Leu
85 90 95
Gly Gln Gly Ala Gly Phe Tyr Leu Asn Ala Thr Gln Ala Pro Trp Asn
100 105 110
Glu His Tyr Lys Met Tyr Asp Tyr Ile Arg Asn Glu Leu Pro Asp Leu
115 120 125
Val Met His His Phe Pro Ala Thr Ala Lys Lys Ser Ile Ser Gly His
130 135 140
Ser Met Gly Gly Leu Gly Ala Leu Val Leu Ala Leu Arg Asn Pro Asp
145 150 155 160
Glu Tyr Val Ser Val Ser Ala Phe Ser Pro Ile Val Ser Pro Ser Gln
165 170 175
Val Pro Trp Gly Gln Gln Ala Phe Ala Ala Tyr Leu Ala Glu Asn Lys
180 185 190
Asp Ala Trp Leu Asp Tyr Asp Pro Val Ser Leu Ile Ser Gln Gly Gln
195 200 205
Arg Val Ala Glu Ile Met Val Asp Gln Gly Leu Ser Asp Asp Phe Tyr
210 215 220
Ala Glu Gln Leu Arg Thr Pro Asn Leu Glu Lys Ile Cys Gln Glu Met
225 230 235 240
Asn Ile Lys Thr Leu Ile Arg Tyr His Glu Gly Tyr Asp His Ser Tyr
245 250 255
Tyr Phe Val Ser Ser Phe Ile Gly Glu His Ile Ala Tyr His Ala Asn
260 265 270
Lys Leu Asn Met Arg
275
<210> 17
<211> 179
<212> БЕЛОК
<213> Escherichia coli
<400> 17
Met Ala Lys Leu Thr Leu Gln Glu Gln Leu Leu Lys Ala Gly Leu Val
1 5 10 15
Thr Ser Lys Lys Ala Ala Lys Val Glu Arg Thr Ala Lys Lys Ser Arg
20 25 30
Val Gln Ala Arg Glu Ala Arg Ala Ala Val Glu Glu Asn Lys Lys Ala
35 40 45
Gln Leu Glu Arg Asp Lys Gln Leu Ser Glu Gln Gln Lys Gln Ala Ala
50 55 60
Leu Ala Lys Glu Tyr Lys Ala Gln Val Lys Gln Leu Ile Glu Met Asn
65 70 75 80
Arg Ile Thr Ile Ala Asn Gly Asp Ile Gly Phe Asn Phe Thr Asp Gly
85 90 95
Asn Leu Ile Lys Lys Ile Phe Val Asp Lys Leu Thr Gln Ala Gln Leu
100 105 110
Ile Asn Gly Arg Leu Ala Ile Ala Arg Leu Leu Val Asp Asn Asn Ser
115 120 125
Glu Gly Glu Tyr Ala Ile Ile Pro Ala Ser Val Ala Asp Lys Ile Ala
130 135 140
Gln Arg Asp Ala Ser Ser Ile Val Leu His Ser Ala Leu Ser Ala Glu
145 150 155 160
Glu Gln Asp Glu Asp Asp Pro Tyr Ala Asp Phe Lys Val Pro Asp Asp
165 170 175
Leu Met Trp
<210> 18
<211> 403
<212> БЕЛОК
<213> Escherichia coli
<400> 18
Met Ser Thr Arg Thr Pro Ser Ser Ser Ser Ser Arg Leu Met Leu Thr
1 5 10 15
Ile Gly Leu Cys Phe Leu Val Ala Leu Met Glu Gly Leu Asp Leu Gln
20 25 30
Ala Ala Gly Ile Ala Ala Gly Gly Ile Ala Gln Ala Phe Ala Leu Asp
35 40 45
Lys Met Gln Met Gly Trp Ile Phe Ser Ala Gly Ile Leu Gly Leu Leu
50 55 60
Pro Gly Ala Leu Val Gly Gly Met Leu Ala Asp Arg Tyr Gly Arg Lys
65 70 75 80
Arg Ile Leu Ile Gly Ser Val Ala Leu Phe Gly Leu Phe Ser Leu Ala
85 90 95
Thr Ala Ile Ala Trp Asp Phe Pro Ser Leu Val Phe Ala Arg Leu Met
100 105 110
Thr Gly Val Gly Leu Gly Ala Ala Leu Pro Asn Leu Ile Ala Leu Thr
115 120 125
Ser Glu Ala Ala Gly Pro Arg Phe Arg Gly Thr Ala Val Ser Leu Met
130 135 140
Tyr Cys Gly Val Pro Ile Gly Ala Ala Leu Ala Ala Thr Leu Gly Phe
145 150 155 160
Ala Gly Ala Asn Leu Ala Trp Gln Thr Val Phe Trp Val Gly Gly Val
165 170 175
Val Pro Leu Ile Leu Val Pro Leu Leu Met Arg Trp Leu Pro Glu Ser
180 185 190
Ala Val Phe Ala Gly Glu Lys Gln Ser Ala Pro Pro Leu Arg Ala Leu
195 200 205
Phe Ala Pro Glu Thr Ala Thr Ala Thr Leu Leu Leu Trp Leu Cys Tyr
210 215 220
Phe Phe Thr Leu Leu Val Val Tyr Met Leu Ile Asn Trp Leu Pro Leu
225 230 235 240
Leu Leu Val Glu Gln Gly Phe Gln Pro Ser Gln Ala Ala Gly Val Met
245 250 255
Phe Ala Leu Gln Met Gly Ala Ala Ser Gly Thr Leu Met Leu Gly Ala
260 265 270
Leu Met Asp Lys Leu Arg Pro Val Thr Met Ser Leu Leu Ile Tyr Ser
275 280 285
Gly Met Leu Ala Ser Leu Leu Ala Leu Gly Thr Val Ser Ser Phe Asn
290 295 300
Gly Met Leu Leu Ala Gly Phe Val Ala Gly Leu Phe Ala Thr Gly Gly
305 310 315 320
Gln Ser Val Leu Tyr Ala Leu Ala Pro Leu Phe Tyr Ser Ser Gln Ile
325 330 335
Arg Ala Thr Gly Val Gly Thr Ala Val Ala Val Gly Arg Leu Gly Ala
340 345 350
Met Ser Gly Pro Leu Leu Ala Gly Lys Met Leu Ala Leu Gly Thr Gly
355 360 365
Thr Val Gly Val Met Ala Ala Ser Ala Pro Gly Ile Leu Val Ala Gly
370 375 380
Leu Ala Val Phe Ile Leu Met Ser Arg Arg Ser Arg Ile Gln Pro Cys
385 390 395 400
Ala Asp Ala
<210> 19
<211> 337
<212> БЕЛОК
<213> Escherichia coli
<400> 19
Met Asn Gly Lys Lys Leu Tyr Ile Ser Asp Val Thr Leu Arg Asp Gly
1 5 10 15
Met His Ala Ile Arg His Gln Tyr Ser Leu Glu Asn Val Arg Gln Ile
20 25 30
Ala Lys Ala Leu Asp Asp Ala His Val Asp Ser Ile Glu Val Ala His
35 40 45
Gly Asp Gly Leu Gln Gly Ser Ser Phe Asn Tyr Gly Phe Gly Ala His
50 55 60
Ser Asp Leu Glu Trp Ile Glu Ala Ala Ala Asp Val Val Lys His Ala
65 70 75 80
Lys Ile Ala Thr Leu Leu Leu Pro Gly Ile Gly Thr Ile His Asp Leu
85 90 95
Lys Asn Ala Trp Gln Ala Gly Ala Arg Val Val Arg Val Ala Thr His
100 105 110
Cys Thr Glu Ala Asp Val Ser Ala Gln His Ile Gln Tyr Ala Arg Glu
115 120 125
Leu Gly Met Asp Thr Val Gly Phe Leu Met Met Ser His Met Thr Thr
130 135 140
Pro Glu Asn Leu Ala Lys Gln Ala Lys Leu Met Glu Gly Tyr Gly Ala
145 150 155 160
Thr Cys Ile Tyr Val Val Asp Ser Gly Gly Ala Met Asn Met Ser Asp
165 170 175
Ile Arg Asp Arg Phe Arg Ala Leu Lys Ala Val Leu Lys Pro Glu Thr
180 185 190
Gln Thr Gly Met His Ala His His Asn Leu Ser Leu Gly Val Ala Asn
195 200 205
Ser Ile Glu Ala Val Glu Glu Gly Cys Asp Arg Ile Asp Ala Ser Leu
210 215 220
Ala Gly Met Gly Ala Gly Ala Gly Asn Ala Pro Leu Glu Val Phe Ile
225 230 235 240
Ala Ala Ala Asp Lys Leu Gly Trp Gln His Gly Thr Asp Leu Tyr Ala
245 250 255
Leu Met Asp Ala Ala Asp Asp Leu Val Arg Pro Leu Gln Asp Arg Pro
260 265 270
Val Arg Val Asp Arg Glu Thr Leu Ala Leu Gly Tyr Ala Gly Val Tyr
275 280 285
Ser Ser Phe Leu Arg His Cys Glu Thr Ala Ala Ala Arg Tyr Gly Leu
290 295 300
Ser Ala Val Asp Ile Leu Val Glu Leu Gly Lys Arg Arg Met Val Gly
305 310 315 320
Gly Gln Glu Asp Met Ile Val Asp Val Ala Leu Asp Leu Arg Asn Asn
325 330 335
Lys
<210> 20
<211> 316
<212> БЕЛОК
<213> Escherichia coli
<400> 20
Met Ser Lys Arg Lys Val Ala Ile Ile Gly Ser Gly Asn Ile Gly Thr
1 5 10 15
Asp Leu Met Ile Lys Ile Leu Arg His Gly Gln His Leu Glu Met Ala
20 25 30
Val Met Val Gly Ile Asp Pro Gln Ser Asp Gly Leu Ala Arg Ala Arg
35 40 45
Arg Met Gly Val Ala Thr Thr His Glu Gly Val Ile Gly Leu Met Asn
50 55 60
Met Pro Glu Phe Ala Asp Ile Asp Ile Val Phe Asp Ala Thr Ser Ala
65 70 75 80
Gly Ala His Val Lys Asn Asp Ala Ala Leu Arg Glu Ala Lys Pro Asp
85 90 95
Ile Arg Leu Ile Asp Leu Thr Pro Ala Ala Ile Gly Pro Tyr Cys Val
100 105 110
Pro Val Val Asn Leu Glu Ala Asn Val Asp Gln Leu Asn Val Asn Met
115 120 125
Val Thr Cys Gly Gly Gln Ala Thr Ile Pro Met Val Ala Ala Val Ser
130 135 140
Arg Val Ala Arg Val His Tyr Ala Glu Ile Ile Ala Ser Ile Ala Ser
145 150 155 160
Lys Ser Ala Gly Pro Gly Thr Arg Ala Asn Ile Asp Glu Phe Thr Glu
165 170 175
Thr Thr Ser Arg Ala Ile Glu Val Val Gly Gly Ala Ala Lys Gly Lys
180 185 190
Ala Ile Ile Val Leu Asn Pro Ala Glu Pro Pro Leu Met Met Arg Asp
195 200 205
Thr Val Tyr Val Leu Ser Asp Glu Ala Ser Gln Asp Asp Ile Glu Ala
210 215 220
Ser Ile Asn Glu Met Ala Glu Ala Val Gln Ala Tyr Val Pro Gly Tyr
225 230 235 240
Arg Leu Lys Gln Arg Val Gln Phe Glu Val Ile Pro Gln Asp Lys Pro
245 250 255
Val Asn Leu Pro Gly Val Gly Gln Phe Ser Gly Leu Lys Thr Ala Val
260 265 270
Trp Leu Glu Val Glu Gly Ala Ala His Tyr Leu Pro Ala Tyr Ala Gly
275 280 285
Asn Leu Asp Ile Met Thr Ser Ser Ala Leu Ala Thr Ala Glu Lys Met
290 295 300
Ala Gln Ser Leu Ala Arg Lys Ala Gly Glu Ala Ala
305 310 315
<210> 21
<211> 269
<212> БЕЛОК
<213> Escherichia coli
<400> 21
Met Thr Lys His Thr Leu Glu Gln Leu Ala Ala Asp Leu Arg Arg Ala
1 5 10 15
Ala Glu Gln Gly Glu Ala Ile Ala Pro Leu Arg Asp Leu Ile Gly Ile
20 25 30
Asp Asn Ala Glu Ala Ala Tyr Ala Ile Gln His Ile Asn Val Gln Tyr
35 40 45
Asp Val Ala Gln Gly Arg Arg Val Val Gly Arg Lys Val Gly Leu Thr
50 55 60
His Pro Lys Val Gln Gln Gln Leu Gly Val Asp Gln Pro Asp Phe Gly
65 70 75 80
Thr Leu Phe Ala Asp Met Cys Tyr Gly Asp Asn Glu Ile Ile Pro Phe
85 90 95
Ser Arg Val Leu Gln Pro Arg Ile Glu Ala Glu Ile Ala Leu Val Leu
100 105 110
Asn Arg Asp Leu Pro Ala Thr Asp Ile Thr Phe Asp Glu Leu Tyr Asn
115 120 125
Ala Ile Glu Trp Val Leu Pro Ala Leu Glu Val Val Gly Ser Arg Ile
130 135 140
Arg Asp Trp Ser Ile Gln Phe Val Asp Thr Val Ala Asp Asn Ala Ser
145 150 155 160
Cys Gly Val Tyr Val Ile Gly Gly Pro Ala Gln Arg Pro Ala Gly Leu
165 170 175
Asp Leu Lys Asn Cys Ala Met Lys Met Thr Arg Asn Asn Glu Glu Val
180 185 190
Ser Ser Gly Arg Gly Ser Glu Cys Leu Gly His Pro Leu Asn Ala Ala
195 200 205
Val Trp Leu Ala Arg Lys Met Ala Ser Leu Gly Glu Pro Leu Arg Thr
210 215 220
Gly Asp Ile Ile Leu Thr Gly Ala Leu Gly Pro Met Val Ala Val Asn
225 230 235 240
Ala Gly Asp Arg Phe Glu Ala His Ile Glu Gly Ile Gly Ser Val Ala
245 250 255
Ala Thr Phe Ser Ser Ala Ala Pro Lys Gly Ser Leu Ser
260 265
<210> 22
<211> 293
<212> БЕЛОК
<213> Escherichia coli
<400> 22
Met Gln Glu Lys Met Met Ser Tyr Gln Pro Gln Thr Glu Ala Ala Thr
1 5 10 15
Ser Arg Phe Leu Asn Val Glu Glu Ala Gly Lys Thr Leu Arg Ile His
20 25 30
Phe Asn Asp Cys Gly Gln Gly Asp Glu Thr Val Val Leu Leu His Gly
35 40 45
Ser Gly Pro Gly Ala Thr Gly Trp Ala Asn Phe Ser Arg Asn Ile Asp
50 55 60
Pro Leu Val Glu Ala Gly Tyr Arg Val Ile Leu Leu Asp Cys Pro Gly
65 70 75 80
Trp Gly Lys Ser Asp Ser Ile Val Asn Ser Gly Ser Arg Ser Asp Leu
85 90 95
Asn Ala Arg Ile Leu Lys Ser Val Val Asp Gln Leu Asp Ile Ala Lys
100 105 110
Ile His Leu Leu Gly Asn Ser Met Gly Gly His Ser Ser Val Ala Phe
115 120 125
Thr Leu Asn Trp Pro Glu Arg Val Gly Lys Leu Val Leu Met Gly Gly
130 135 140
Gly Thr Gly Gly Met Ser Leu Phe Thr Pro Met Pro Thr Glu Gly Ile
145 150 155 160
Lys Arg Leu Asn Gln Leu Tyr Arg Gln Pro Thr Ile Glu Asn Leu Lys
165 170 175
Leu Met Met Asp Ile Phe Val Phe Asp Thr Ser Asp Leu Thr Asp Ala
180 185 190
Leu Phe Glu Ala Arg Leu Asn Asn Met Leu Ser Arg Arg Asp His Leu
195 200 205
Glu Asn Phe Val Lys Ser Leu Glu Ala Asn Pro Lys Gln Phe Pro Asp
210 215 220
Phe Gly Pro Arg Leu Ala Glu Ile Lys Ala Gln Thr Leu Ile Val Trp
225 230 235 240
Gly Arg Asn Asp Arg Phe Val Pro Met Asp Ala Gly Leu Arg Leu Leu
245 250 255
Ser Gly Ile Ala Gly Ser Glu Leu His Ile Phe Arg Asp Cys Gly His
260 265 270
Trp Ala Gln Trp Glu His Ala Asp Ala Phe Asn Gln Leu Val Leu Asn
275 280 285
Phe Leu Ala Arg Pro
290
<210> 23
<211> 314
<212> БЕЛОК
<213> Escherichia coli
<400> 23
Met His Ala Tyr Leu His Cys Leu Ser His Ser Pro Leu Val Gly Tyr
1 5 10 15
Val Asp Pro Ala Gln Glu Val Leu Asp Glu Val Asn Gly Val Ile Ala
20 25 30
Ser Ala Arg Glu Arg Ile Ala Ala Phe Ser Pro Glu Leu Val Val Leu
35 40 45
Phe Ala Pro Asp His Tyr Asn Gly Phe Phe Tyr Asp Val Met Pro Pro
50 55 60
Phe Cys Leu Gly Val Gly Ala Thr Ala Ile Gly Asp Phe Gly Ser Ala
65 70 75 80
Ala Gly Glu Leu Pro Val Pro Val Glu Leu Ala Glu Ala Cys Ala His
85 90 95
Ala Val Met Lys Ser Gly Ile Asp Leu Ala Val Ser Tyr Cys Met Gln
100 105 110
Val Asp His Gly Phe Ala Gln Pro Leu Glu Phe Leu Leu Gly Gly Leu
115 120 125
Asp Lys Val Pro Val Leu Pro Val Phe Ile Asn Gly Val Ala Thr Pro
130 135 140
Leu Pro Gly Phe Gln Arg Thr Arg Met Leu Gly Glu Ala Ile Gly Arg
145 150 155 160
Phe Thr Ser Thr Leu Asn Lys Arg Val Leu Phe Leu Gly Ser Gly Gly
165 170 175
Leu Ser His Gln Pro Pro Val Pro Glu Leu Ala Lys Ala Asp Ala His
180 185 190
Met Arg Asp Arg Leu Leu Gly Ser Gly Lys Asp Leu Pro Ala Ser Glu
195 200 205
Arg Glu Leu Arg Gln Gln Arg Val Ile Ser Ala Ala Glu Lys Phe Val
210 215 220
Glu Asp Gln Arg Thr Leu His Pro Leu Asn Pro Ile Trp Asp Asn Gln
225 230 235 240
Phe Met Thr Leu Leu Glu Gln Gly Arg Ile Gln Glu Leu Asp Ala Val
245 250 255
Ser Asn Glu Glu Leu Ser Ala Ile Ala Gly Lys Ser Thr His Glu Ile
260 265 270
Lys Thr Trp Val Ala Ala Phe Ala Ala Ile Ser Ala Phe Gly Asn Trp
275 280 285
Arg Ser Glu Gly Arg Tyr Tyr Arg Pro Ile Pro Glu Trp Ile Ala Gly
290 295 300
Phe Gly Ser Leu Ser Ala Arg Thr Glu Asn
305 310
<210> 24
<211> 554
<212> БЕЛОК
<213> Escherichia coli
<400> 24
Met Ala Ile Gln His Pro Asp Ile Gln Pro Ala Val Asn His Ser Val
1 5 10 15
Gln Val Ala Ile Ala Gly Ala Gly Pro Val Gly Leu Met Met Ala Asn
20 25 30
Tyr Leu Gly Gln Met Gly Ile Asp Val Leu Val Val Glu Lys Leu Asp
35 40 45
Lys Leu Ile Asp Tyr Pro Arg Ala Ile Gly Ile Asp Asp Glu Ala Leu
50 55 60
Arg Thr Met Gln Ser Val Gly Leu Val Asp Asp Val Leu Pro His Thr
65 70 75 80
Thr Pro Trp His Ala Met Arg Phe Leu Thr Pro Lys Gly Arg Cys Phe
85 90 95
Ala Asp Ile Gln Pro Met Thr Asp Glu Phe Gly Trp Pro Arg Arg Asn
100 105 110
Ala Phe Ile Gln Pro Gln Val Asp Ala Val Met Leu Glu Gly Val Ser
115 120 125
Arg Phe Pro Asn Val Arg Cys Leu Phe Ser Arg Glu Leu Glu Ala Phe
130 135 140
Ser Gln Gln Asp Asp Glu Val Thr Leu His Leu Lys Thr Ala Glu Gly
145 150 155 160
Gln Arg Glu Ile Val Lys Ala Gln Trp Leu Val Ala Cys Asp Gly Gly
165 170 175
Ala Ser Phe Val Arg Arg Thr Leu Asn Val Pro Phe Glu Gly Lys Thr
180 185 190
Ala Pro Asn Gln Trp Ile Val Val Asp Ile Ala Asn Asp Pro Leu Ser
195 200 205
Thr Pro His Ile Tyr Leu Cys Cys Asp Pro Val Arg Pro Tyr Val Ser
210 215 220
Ala Ala Leu Pro His Ala Val Arg Arg Phe Glu Phe Met Val Met Pro
225 230 235 240
Gly Glu Thr Glu Glu Gln Leu Arg Glu Pro Gln Asn Met Arg Lys Leu
245 250 255
Leu Ser Lys Val Leu Pro Asn Pro Asp Asn Val Glu Leu Ile Arg Gln
260 265 270
Arg Val Tyr Thr His Asn Ala Arg Leu Ala Gln Arg Phe Arg Ile Asp
275 280 285
Arg Val Leu Leu Ala Gly Asp Ala Ala His Ile Met Pro Val Trp Gln
290 295 300
Gly Gln Gly Tyr Asn Ser Gly Met Arg Asp Ala Phe Asn Leu Ala Trp
305 310 315 320
Lys Leu Ala Leu Val Ile Gln Gly Lys Ala Arg Asp Ala Leu Leu Asp
325 330 335
Thr Tyr Gln Gln Glu Arg Arg Asp His Ala Lys Ala Met Ile Asp Leu
340 345 350
Ser Val Thr Ala Gly Asn Val Leu Ala Pro Pro Lys Arg Trp Gln Gly
355 360 365
Thr Leu Arg Asp Gly Val Ser Trp Leu Leu Asn Tyr Leu Pro Pro Val
370 375 380
Lys Arg Tyr Phe Leu Glu Met Arg Phe Lys Pro Met Pro Gln Tyr Tyr
385 390 395 400
Gly Gly Ala Leu Val Arg Glu Gly Glu Ala Lys His Ser Pro Val Gly
405 410 415
Lys Met Phe Ile Gln Pro Lys Val Thr Leu Glu Asn Gly Asp Val Thr
420 425 430
Leu Leu Asp Asn Ala Ile Gly Ala Asn Phe Ala Val Ile Gly Trp Gly
435 440 445
Cys Asn Pro Leu Trp Gly Met Ser Asp Glu Gln Ile Gln Gln Trp Arg
450 455 460
Ala Leu Gly Thr Arg Phe Ile Gln Val Val Pro Glu Val Gln Ile His
465 470 475 480
Thr Ala Gln Asp Asn His Asp Gly Val Leu Arg Val Gly Asp Thr Gln
485 490 495
Gly Arg Leu Arg Ser Trp Phe Ala Gln His Asn Ala Ser Leu Val Val
500 505 510
Met Arg Pro Asp Arg Phe Val Ala Ala Thr Ala Ile Pro Gln Thr Leu
515 520 525
Gly Asn Thr Leu Asn Lys Leu Ala Ser Val Met Thr Leu Thr Arg Pro
530 535 540
Asp Ala Asp Val Ser Val Glu Lys Val Ala
545 550
<210> 25
<211> 315
<212> БЕЛОК
<213> Escherichia coli
<400> 25
Met Ile Phe Tyr Cys Ala Leu Ser Ile Gly Arg Val Phe Ser Ala Thr
1 5 10 15
Ile Lys Thr Cys Pro Asn Val His Gln Val His His Val Val Leu Thr
20 25 30
Ile Glu Met Ser Ile Asn Met Gln Asn Asn Glu Gln Thr Glu Tyr Lys
35 40 45
Thr Val Arg Gly Leu Thr Arg Gly Leu Met Leu Leu Asn Met Leu Asn
50 55 60
Lys Leu Asp Gly Gly Ala Ser Val Gly Leu Leu Ala Glu Leu Ser Gly
65 70 75 80
Leu His Arg Thr Thr Val Arg Arg Leu Leu Glu Thr Leu Gln Glu Glu
85 90 95
Gly Tyr Val Arg Arg Ser Pro Ser Asp Asp Ser Phe Arg Leu Thr Ile
100 105 110
Lys Val Arg Gln Leu Ser Glu Gly Phe Arg Asp Glu Gln Trp Ile Ser
115 120 125
Ala Leu Ala Ala Pro Leu Leu Gly Asp Leu Leu Arg Glu Val Val Trp
130 135 140
Pro Thr Asp Val Ser Thr Leu Asp Val Asp Ala Met Val Val Arg Glu
145 150 155 160
Thr Thr His Arg Phe Ser Arg Leu Ser Phe His Arg Ala Met Val Gly
165 170 175
Arg Arg Leu Pro Leu Leu Lys Thr Ala Ser Gly Leu Thr Trp Leu Ala
180 185 190
Phe Cys Pro Glu Gln Asp Arg Lys Glu Leu Ile Glu Met Leu Ala Ser
195 200 205
Arg Pro Gly Asp Asp Tyr Gln Leu Ala Arg Glu Pro Leu Lys Leu Glu
210 215 220
Ala Ile Leu Ala Arg Ala Arg Lys Glu Gly Tyr Gly Gln Asn Tyr Arg
225 230 235 240
Gly Trp Asp Gln Glu Glu Lys Ile Ala Ser Ile Ala Val Pro Leu Arg
245 250 255
Ser Glu Gln Arg Val Ile Gly Cys Leu Asn Leu Val Tyr Met Ala Ser
260 265 270
Ala Met Thr Ile Glu Gln Ala Ala Glu Lys His Leu Pro Ala Leu Gln
275 280 285
Arg Val Ala Lys Gln Ile Glu Glu Gly Val Glu Ser Gln Ala Ile Leu
290 295 300
Val Ala Gly Arg Arg Ser Gly Met His Leu Arg
305 310 315
<210> 26
<211> 360
<212> БЕЛОК
<213> Escherichia coli
<400> 26
Met Lys Pro Val Thr Leu Tyr Asp Val Ala Glu Tyr Ala Gly Val Ser
1 5 10 15
Tyr Gln Thr Val Ser Arg Val Val Asn Gln Ala Ser His Val Ser Ala
20 25 30
Lys Thr Arg Glu Lys Val Glu Ala Ala Met Ala Glu Leu Asn Tyr Ile
35 40 45
Pro Asn Arg Val Ala Gln Gln Leu Ala Gly Lys Gln Ser Leu Leu Ile
50 55 60
Gly Val Ala Thr Ser Ser Leu Ala Leu His Ala Pro Ser Gln Ile Val
65 70 75 80
Ala Ala Ile Lys Ser Arg Ala Asp Gln Leu Gly Ala Ser Val Val Val
85 90 95
Ser Met Val Glu Arg Ser Gly Val Glu Ala Cys Lys Ala Ala Val His
100 105 110
Asn Leu Leu Ala Gln Arg Val Ser Gly Leu Ile Ile Asn Tyr Pro Leu
115 120 125
Asp Asp Gln Asp Ala Ile Ala Val Glu Ala Ala Cys Thr Asn Val Pro
130 135 140
Ala Leu Phe Leu Asp Val Ser Asp Gln Thr Pro Ile Asn Ser Ile Ile
145 150 155 160
Phe Ser His Glu Asp Gly Thr Arg Leu Gly Val Glu His Leu Val Ala
165 170 175
Leu Gly His Gln Gln Ile Ala Leu Leu Ala Gly Pro Leu Ser Ser Val
180 185 190
Ser Ala Arg Leu Arg Leu Ala Gly Trp His Lys Tyr Leu Thr Arg Asn
195 200 205
Gln Ile Gln Pro Ile Ala Glu Arg Glu Gly Asp Trp Ser Ala Met Ser
210 215 220
Gly Phe Gln Gln Thr Met Gln Met Leu Asn Glu Gly Ile Val Pro Thr
225 230 235 240
Ala Met Leu Val Ala Asn Asp Gln Met Ala Leu Gly Ala Met Arg Ala
245 250 255
Ile Thr Glu Ser Gly Leu Arg Val Gly Ala Asp Ile Ser Val Val Gly
260 265 270
Tyr Asp Asp Thr Glu Asp Ser Ser Cys Tyr Ile Pro Pro Leu Thr Thr
275 280 285
Ile Lys Gln Asp Phe Arg Leu Leu Gly Gln Thr Ser Val Asp Arg Leu
290 295 300
Leu Gln Leu Ser Gln Gly Gln Ala Val Lys Gly Asn Gln Leu Leu Pro
305 310 315 320
Val Ser Leu Val Lys Arg Lys Thr Thr Leu Ala Pro Asn Thr Gln Thr
325 330 335
Ala Ser Pro Arg Ala Leu Ala Asp Ser Leu Met Gln Leu Ala Arg Gln
340 345 350
Val Ser Arg Leu Glu Ser Gly Gln
355 360
<210> 27
<211> 353
<212> БЕЛОК
<213> Escherichia coli
<400> 27
Met Ala Ile Asp Glu Asn Lys Gln Lys Ala Leu Ala Ala Ala Leu Gly
1 5 10 15
Gln Ile Glu Lys Gln Phe Gly Lys Gly Ser Ile Met Arg Leu Gly Glu
20 25 30
Asp Arg Ser Met Asp Val Glu Thr Ile Ser Thr Gly Ser Leu Ser Leu
35 40 45
Asp Ile Ala Leu Gly Ala Gly Gly Leu Pro Met Gly Arg Ile Val Glu
50 55 60
Ile Tyr Gly Pro Glu Ser Ser Gly Lys Thr Thr Leu Thr Leu Gln Val
65 70 75 80
Ile Ala Ala Ala Gln Arg Glu Gly Lys Thr Cys Ala Phe Ile Asp Ala
85 90 95
Glu His Ala Leu Asp Pro Ile Tyr Ala Arg Lys Leu Gly Val Asp Ile
100 105 110
Asp Asn Leu Leu Cys Ser Gln Pro Asp Thr Gly Glu Gln Ala Leu Glu
115 120 125
Ile Cys Asp Ala Leu Ala Arg Ser Gly Ala Val Asp Val Ile Val Val
130 135 140
Asp Ser Val Ala Ala Leu Thr Pro Lys Ala Glu Ile Glu Gly Glu Ile
145 150 155 160
Gly Asp Ser His Met Gly Leu Ala Ala Arg Met Met Ser Gln Ala Met
165 170 175
Arg Lys Leu Ala Gly Asn Leu Lys Gln Ser Asn Thr Leu Leu Ile Phe
180 185 190
Ile Asn Gln Ile Arg Met Lys Ile Gly Val Met Phe Gly Asn Pro Glu
195 200 205
Thr Thr Thr Gly Gly Asn Ala Leu Lys Phe Tyr Ala Ser Val Arg Leu
210 215 220
Asp Ile Arg Arg Ile Gly Ala Val Lys Glu Gly Glu Asn Val Val Gly
225 230 235 240
Ser Glu Thr Arg Val Lys Val Val Lys Asn Lys Ile Ala Ala Pro Phe
245 250 255
Lys Gln Ala Glu Phe Gln Ile Leu Tyr Gly Glu Gly Ile Asn Phe Tyr
260 265 270
Gly Glu Leu Val Asp Leu Gly Val Lys Glu Lys Leu Ile Glu Lys Ala
275 280 285
Gly Ala Trp Tyr Ser Tyr Lys Gly Glu Lys Ile Gly Gln Gly Lys Ala
290 295 300
Asn Ala Thr Ala Trp Leu Lys Asp Asn Pro Glu Thr Ala Lys Glu Ile
305 310 315 320
Glu Lys Lys Val Arg Glu Leu Leu Leu Ser Asn Pro Asn Ser Thr Pro
325 330 335
Asp Phe Ser Val Asp Asp Ser Glu Gly Val Ala Glu Thr Asn Glu Asp
340 345 350
Phe
<210> 28
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 28
ctgtataaaa ccacagccaa tcaaacgaaa ccaggctata ctcaagcct 49
<210> 29
<211> 49
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический олигонуклеотид
<400> 29
ttttataaat acacagccaa tcaaacgaaa ccaggctata ctcaagcct 49
<210> 30
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 30
ctcagcggtg gcagcagcct aggttaacta cttttctttg ttggtctttg cctccatttt 60
gtcggcctgg taatgactcc aacttattga tagtgtttta tgttcagata atgcccgatg 120
actttgtcat gca 133
<210> 31
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<220>
<221> модифицированное_основание
<222> (22)..(22)
<223> a, c, t, g, неизвестное или другое
<400> 31
ctcagcggtg gcagcagcct angttaatca tttttctttg ttggttttgg cttccatttt 60
atctgcttgg taatgactcc aacttattga tagtgtttta tgttcagata atgcccgatg 120
actttgtcat gca 133
<210> 32
<211> 133
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Описание искусственной последовательности: Синтетический полинуклеотид
<400> 32
ctcagcggtg gcagcagcct aggttaatca tttttctttg ttggttttgg cttccatttt 60
atctgcttgg taatgactcc aacttattga tagtgtttta tgttcagata atgcccgatg 120
actttgtcat gca 133
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ КУРОНЫ, И ПУТИ ИХ ПРИМЕНЕНИЯ | 2018 |
|
RU2822800C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2783313C1 |
| НОВЫЙ КОРОНАВИРУС РЫБ | 2020 |
|
RU2813731C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2021 |
|
RU2761879C1 |
| Выделенный модифицированный белок VP1 капсида аденоассоциированного вируса 5 серотипа (AAV5), капсид и вектор на его основе | 2019 |
|
RU2751592C2 |
| Выделенный модифицированный белок VPI капсида аденоассоциированного вируса 9 серотипа (AAV9), капсид и вектор на его основе | 2021 |
|
RU2825667C2 |
| АМИНОАЦИЛ-тРНК-СИНТЕТАЗА ДЛЯ ЭФФЕКТИВНОГО ВВЕДЕНИЯ ПРОИЗВОДНОГО ЛИЗИНА В БЕЛОК | 2020 |
|
RU2799794C2 |
| Кодон-оптимизированная нуклеиновая кислота, которая кодирует белок SMN1, и ее применение | 2020 |
|
RU2742837C1 |
| НОВЫЕ ФЕРМЕНТЫ И СИСТЕМЫ CRISPR | 2016 |
|
RU2777988C2 |
| Вакцина на основе AAV5 для индукции специфического иммунитета к вирусу SARS-CoV-2 и/или профилактики коронавирусной инфекции, вызванной SARS-CoV-2 | 2020 |
|
RU2760301C1 |

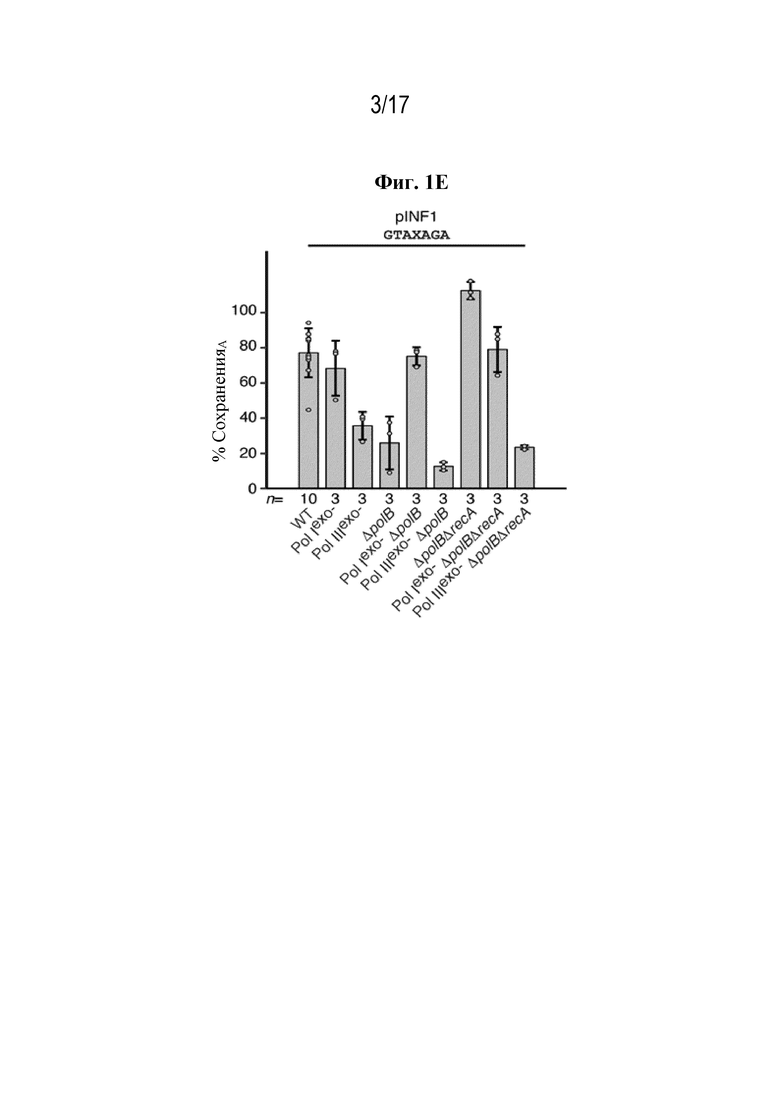




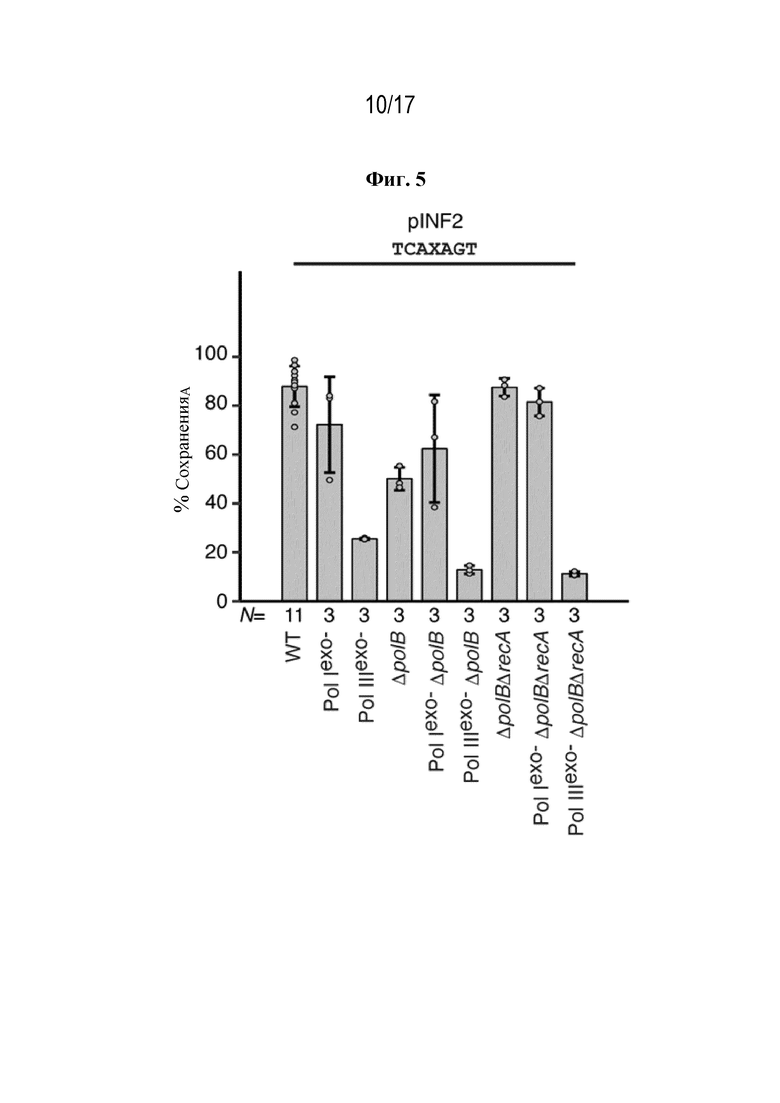





Группа изобретений относится к биотехнологии. Представлены: сконструированная клетка-хозяин для получения модифицированного полипептида, содержащего неприродную аминокислоту, способ повышения продуцирования первой молекулы нуклеиновой кислоты и способ получения модифицированного полипептида, содержащего неприродную аминокислоту. Изобретение используется для повышения показателя сохранения неприродных нуклеиновых кислот, кодирующих неприродные аминокислоты, в сконструированной клетке или полусинтетическом организме. 3 н. и 36 з.п. ф-лы, 1 табл., 10 ил., 3 пр.
1. Сконструированная клетка-хозяин для получения модифицированного полипептида, содержащего неприродную аминокислоту, и/или сохранения неприродного нуклеотида, где сконструированная клетка-хозяин представляет собой клетку Escherichia coli и содержит:
a. первую молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид;
b. вторую молекулу нуклеиновой кислоты, содержащую:
(i) делецию гена, кодирующего белок, ассоциированный с транспозицией, или транспонируемый элемент, необязательно где делеция представляет собой N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию целого гена, или
(ii) ген, кодирующий мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент, где мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент не экспрессируется или экспрессируется на сниженных уровнях, и/или
(iii) (A) молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, включает рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию; или (B) делецию белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и
с. третью молекулу нуклеиновой кислоты, кодирующую транспортер нуклеозидтрифосфата, который доставляет неприродные нуклеиновые кислоты в клетку, где третья молекула нуклеиновой кислоты встроена в геномную последовательность сконструированной клетки-хозяина, или содержит плазмиду, кодирующую транспортер нуклеозидтрифосфата,
где сконструированная клетка-хозяин конститутивно экспрессирует или сверхэкспрессирует ДНК-полимеразу II.
2. Сконструированная клетка-хозяин по п. 1, где транспортер нуклеозидтрифосфата характеризуется повышенной стабильностью экспрессии в сконструированной клетке-хозяине по сравнению с экспрессией в эквивалентной сконструированной клетке-хозяине, которая не содержит вторую молекулу нуклеиновой кислоты.
3. Сконструированная клетка-хозяин по п. 1 или 2, где транспортер нуклеозидтрифосфата предусматривает N-концевое усечение, С-концевое усечение или усечение обоих концов.
4. Сконструированная клетка-хозяин по любому из пп. 1-3, где транспортер нуклеозидтрифосфата предусматривает транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum.
5. Сконструированная клетка-хозяин по любому из пп. 1-4, где транспортер нуклеозидтрифосфата включает PtNTT2.
6. Сконструированная клетка-хозяин по п. 4 или 5, где транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum или PtNTT2 находится под контролем промотора, выбранного из плазмиды pSC или промотора из lac-оперона.
7. Сконструированная клетка-хозяин по любому из пп. 1-6, дополнительно содержащая:
a. полипептид Cas9 или его вариант и
b. одиночную направляющую РНК (sgRNA), содержащую остов crRNA-tracrRNA, где комбинация полипептида Cas9 или его варианта и sgRNA обеспечивает модуляцию репликации первой молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид.
8. Сконструированная клетка-хозяин по любому из пп. 1-7, где ген, кодирующий белок, ассоциированный с транспозицией, содержит insB-4 и/или insA-4 или ген, кодирующий мутированный белок, ассоциированный с транспозицией, содержит мутированный ген insB-4 и/или мутированный ген insA-4.
9. Сконструированная клетка-хозяин по любому из пп. 1-7, где вторая молекула нуклеиновой кислоты содержит делецию гена, кодирующего транспонируемый элемент, где транспонируемый элемент предусматривает IS1.
10. Сконструированная клетка-хозяин по п. 1, где вторая молекула нуклеиновой кислоты содержит делецию гена, кодирующего белок, ассоциированный с транспозицией, и дополнительно где делеция предусматривает N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию всего гена.
11. Сконструированная клетка-хозяин по любому из пп. 1-10, содержащая (А) молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, предусматривает рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию, или (B) делецию белка, ассоциированного с ответом, представляющим собой репарацию ДНК.
12. Сконструированная клетка-хозяин по п. 11, где модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, предусматривает RecA, RadA или LexA или их комбинацию.
13. Сконструированная клетка-хозяин по любому из пп. 1-12, где сконструированная клетка-хозяин представляет собой клетку Escherichia coli BL21 (DE3).
14. Сконструированная клетка-хозяин по любому из пп. 1-13, где неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила, 5-фторурацила и 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом.
15. Сконструированная клетка-хозяин по любому из пп. 1-13, где неприродный нуклеотид включает неприродное основание, выбранное из группы, состоящей из:
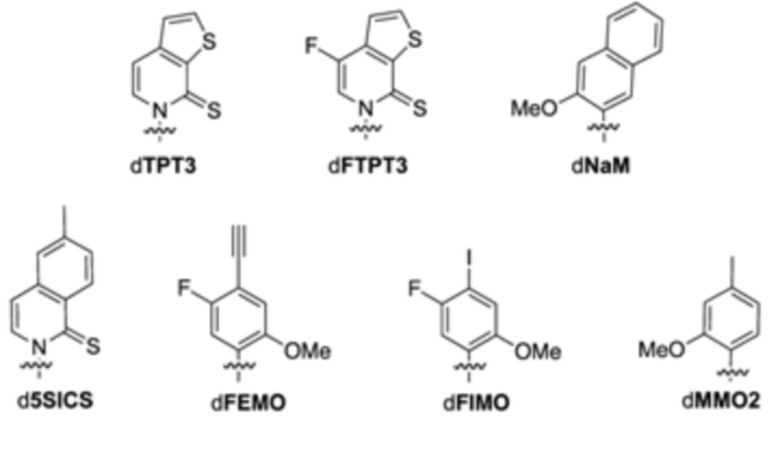 .
.
16. Сконструированная клетка-хозяин по любому из пп. 1-15, где неприродный нуклеотид дополнительно содержит модифицированный сахарный фрагмент.
17. Сконструированная клетка-хозяин по п. 16, где модифицированный сахарный фрагмент выбран из группы, состоящей из:
(а) модификации в 2'-положении, включающей:
(i)OH;
(ii) замещенный низший алкил, алкарил, аралкил, O-алкарил O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3 или NH2F;
(iii) O-алкил, S-алкил или N-алкил;
(iv) О-алкенил, S-алкенил или N-алкенил;
(v) O-алкинил, S-алкинил или N-алкинил; или
(vi) O-алкил-O-алкил, 2'-F, 2'-OCH3 или 2'-O(CH2)2OCH3,
где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10алкил, C2-C10алкенил, C2-C10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2 и где n и m составляют от 1 до приблизительно 10;
(b) модификации в 5'-положении, включающей: 5'-винил, 5'-метил (R или S);
(с) модификации в 4'-положении, включающей 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида, и
(d) любой комбинации (a)-(c).
18. Сконструированная клетка-хозяин по любому из пп. 1-17, дополнительно включающая дерепрессированный ген polB.
19. Способ повышения продуцирования первой молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, предусматривающий:
a) инкубирование сконструированной клетки-хозяина со множеством неприродных нуклеотидов, где сконструированная клетка-хозяин представляет собой клетку Escherichia coli, где сконструированная клетка-хозяин конститутивно экспрессирует или сверхэкспрессирует ДНК-полимеразу II, и дополнительно где сконструированная клетка-хозяин содержит транспортер нуклеозидтрифосфата, который доставляет неприродные нуклеиновые кислоты в клетку, и вторую молекулу нуклеиновой кислоты, содержащую (i) делецию гена, кодирующего белок, ассоциированный с транспозицией, или транспонируемый элемент, необязательно где делеция представляет собой N-концевую делецию, С-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию целого гена, или (ii) ген, кодирующий мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент, где мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент не экспрессируется или экспрессируется на сниженных уровнях, и/или (iii) (A) молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, включает рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию; или (B) делецию белка, ассоциированного с ответом, представляющим собой репарацию ДНК; и
b) встраивание множества неприродных нуклеотидов в новую синтезированную первую молекулу нуклеиновой кислоты;
где (i) (А) вторая молекула нуклеиновой кислоты или (В) молекула нуклеиновой кислоты, кодирующая модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, или делеция белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и (ii) транспортер нуклеозидтрифосфата обеспечивают повышение показателя сохранения неприродных пар оснований, предусматривающих неприродные нуклеотиды, в новой синтезированной первой молекуле нуклеиновой кислоты.
20. Способ по п. 19, где ген, кодирующий белок, ассоциированный с транспозицией, предусматривает InsB4 и/или InsA4.
21. Способ по п. 19, где вторая молекула нуклеиновой кислоты содержит делецию гена, кодирующего транспонируемый элемент, где транспонируемый элемент предусматривает IS1.
22. Способ по любому из пп. 19-21, где транспортер нуклеозидтрифосфата предусматривает кодон-оптимизированный транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2).
23. Способ по любому из пп. 19-22, где неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила, 5-фторурацила и 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом.
24. Способ по любому из пп. 19-23, где неприродный нуклеотид включает неприродное основание, выбранное из группы, состоящей из:
 .
.
25. Способ по любому из пп. 19-24, где неприродный нуклеотид дополнительно содержит модифицированный сахарный фрагмент.
26. Способ по п. 25, где модифицированный сахарный фрагмент выбран из группы, состоящей из:
(а) модификации в 2'-положении, включающей:
(i) OH;
(ii) замещенный низший алкил, алкарил, аралкил, O-алкарил, O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3 или NH2F;
(iii) O-алкил, S-алкил или N-алкил;
(iv) О-алкенил, S-алкенил или N-алкенил;
(v) O-алкинил, S-алкинил или N-алкинил; или
(vi) O-алкил-O-алкил, 2'-F, 2'-OCH3 или 2'-O(CH2)2OCH3,
где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10алкил, C2-C10алкенил, C2-C10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2 и где n и m составляют от 1 до приблизительно 10;
(b) модификации в 5'-положении, включающей 5'-винил или 5'-метил (R или S);
(с) модификации в 4'-положении, включающей 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида; и
(d) любой комбинации (а)-(с).
27. Способ получения модифицированного полипептида, содержащего неприродную аминокислоту, предусматривающий:
а) инкубирование сконструированной клетки-хозяина со множеством неприродных нуклеотидов, где сконструированная клетка-хозяин представляет собой клетку Escherichia coli, где сконструированная клетка-хозяин конститутивно экспрессирует или сверхэкспрессирует ДНК-полимеразу II и дополнительно где сконструированная клетка-хозяин содержит первую молекулу нуклеиновой кислоты, содержащую неприродный нуклеотид, вторую молекулу нуклеиновой кислоты, содержащую (i) делецию гена, кодирующего белок, ассоциированный с транспозицией, или транспонируемый элемент, необязательно где делеция представляет собой N-концевую делецию, С-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию целого гена, или (ii) ген, кодирующий мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент, где мутированный белок, ассоциированный с транспозицией, или транспонируемый элемент не экспрессируется или экспрессируется на сниженных уровнях, и/или (iii) (A) молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, включает рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию; или (B) делецию белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и третью молекулу нуклеиновой кислоты, кодирующую транспортер нуклеозидтрифосфата, который доставляет неприродные нуклеиновые кислоты в клетку; и
b) встраивание множества неприродных нуклеотидов в одну или несколько новых синтезированных нитей ДНК, за счет чего образуется молекула неприродной нуклеиновой кислоты;
где (i) (A) белок, ассоциированный с транспозицией, или транспонируемый элемент или (В) молекула нуклеиновой кислоты, кодирующая модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, или делеция белка, ассоциированного с ответом, представляющим собой репарацию ДНК, и (ii) транспортер нуклеозидтрифосфата обеспечивают повышение показателя сохранения неприродных пар оснований, что способствует встраиванию неприродных аминокислот в новый синтезированный полипептид с получением модифицированного полипептида.
28. Способ по п. 27, где ген, кодирующий белок, ассоциированный с транспозицией, предусматривает InsB4 и/или InsA4, или ген, кодирующий мутированный белок, ассоциированный с транспозицией, предусматривает мутированный ген insB-4 и/или мутированный ген insA-4.
29. Способ по п. 27, где вторая молекула нуклеиновой кислоты содержит делецию гена, кодирующего транспонируемый элемент, где транспонируемый элемент предусматривает IS1.
30. Способ по любому из пп. 27-29, где транспортер нуклеозидтрифосфата предусматривает кодон-оптимизированный транспортер нуклеозидтрифосфата из Phaeodactylum tricornutum (PtNTT2).
31. Способ по любому из пп. 27-30, где неприродный нуклеотид содержит неприродное основание, выбранное из группы, состоящей из 2-аминоаденин-9-ила, 2-аминоаденина, 2-F-аденина, 2-тиоурацила, 2-тиотимина, 2-тиоцитозина, 2-пропильных и алкильных производных аденина и гуанина, 2-аминоаденина, 2-аминопропиладенина, 2-аминопиридина, 2-пиридона, 2'-дезоксиуридина, 2-амино-2'-дезоксиаденозина, 3-дезазагуанина, 3-дезазааденина, 4-тиоурацила, 4-тиотимина, урацил-5-ила, гипоксантин-9-ила (I), 5-метилцитозина, 5-гидроксиметилцитозина, ксантина, гипоксантина, 5-бром- и 5-трифторметилурацилов и цитозинов; 5-галогенурацила, 5-галогенцитозина, 5-пропинилурацила, 5-пропинилцитозина, 5-урацила, 5-замещенного, 5-галоген-, 5-замещенных пиримидинов, 5-гидроксицитозина, 5-бромцитозина, 5-бромурацила, 5-хлорцитозина, хлорированного цитозина, циклоцитозина, цитозинарабинозида, 5-фторцитозина, фторпиримидина, фторурацила, 5,6-дигидроцитозина, 5-йодцитозина, гидроксимочевины, йодурацила, 5-нитроцитозина, 5-бромурацила, 5-хлорурацила, 5-фторурацила и 5-йодурацила, 6-алкильных производных аденина и гуанина, 6-азапиримидинов, 6-азоурацила, 6-азоцитозина, азацитозина, 6-азотимина, 6-тиогуанина, 7-метилгуанина, 7-метиладенина, 7-дезазагуанина, 7-дезазагуанозина, 7-дезазааденина, 7-дезаза-8-азагуанина, 8-азагуанина, 8-азааденина, 8-галоген-, 8-амино-, 8-тиол-, 8-тиоалкил- и 8-гидроксил-замещенных аденинов и гуанинов; N4-этилцитозина, N-2-замещенных пуринов, N-6-замещенных пуринов, O-6-замещенных пуринов, тех, которые повышают стабильность образования дуплекса, универсальных нуклеиновых кислот, гидрофобных нуклеиновых кислот, промискуитентных нуклеиновых кислот, нуклеиновых кислот, увеличенных в размере, фторированных нуклеиновых кислот, трициклических пиримидинов, феноксазинцитидин([5,4-b][1,4]бензоксазин-2(3H)-он), фенотиазинцитидин(1H-пиримидо[5,4-b][1,4]бензотиазин-2(3Н)-он), гуанин-фиксирующих оснований (G-clamps), феноксазинцитидин(9-(2-аминоэтокси)-Н-пиримидо[5,4-b] [1,4-бензоксазин-2(3Н)-он), карбазолцитидин(2H-пиримидо[4,5-b]индол-2-он), пиридоиндолцитидин(H-пиридо[3',2':4,5]пирроло[2,3-d]пиримидин-2-он), 5-фторурацила, 5-бромурацила, 5-хлорурацила, 5-йодурацила, гипоксантина, ксантина, 4-ацетилцитозина, 5-(карбоксигидроксиметил)урацила, 5-карбоксиметиламинометил-2-тиоуридина, 5-карбоксиметиламинометилурацила, дигидроурацила, бета-D-галактозилквеуозина, инозина, N6-изопентениладенина, 1-метилгуанина, 1-метилинозина, 2,2-диметилгуанина, 2-метиладенина, 2-метилгуанина, 3-метилцитозина, 5-метилцитозина, N6-аденина, 7-метилгуанина, 5-метиламинометилурацила, 5-метоксиаминометил-2-тиоурацила, бета-D-маннозилквеуозина, 5'-метоксикарбоксиметилурацила, 5-метоксиурацила, 2-метилтио-N6-изопентениладенина, урацил-5-оксиуксусной кислоты, вибутоксозина, псевдоурацила, квеуозина, 2-тиоцитозина, 5-метил-2-тиоурацила, 2-тиоурацила, 4-тиоурацила, 5-метилурацила, сложного метилового эфира урацил-5-оксиуксусной кислоты, урацил-5-оксиуксусной кислоты, 5-метил-2-тиоурацила, 3-(3-амино-3-N-2-карбоксипропил)урацила, (acp3)w и 2,6-диаминопурина и тех, в которых пуриновое или пиримидиновое основание заменено гетероциклом.
32. Способ по любому из пп. 27-30, где неприродный нуклеотид включает неприродное основание, выбранное из группы, состоящей из:
 .
.
33. Способ по любому из пп. 27-32, где неприродный нуклеотид дополнительно содержит модифицированный сахарный фрагмент, выбранный из группы, состоящей из:
(а) модификации в 2'-положении, включающей:
(i) OH;
(ii) замещенный низший алкил, алкарил, аралкил, O-алкарил, O-аралкил, SH, SCH3, OCN, Cl, Br, CN, CF3, OCF3, SOCH3, SO2 CH3, ONO2, NO2, N3 или NH2F;
(iii) O-алкил, S-алкил или N-алкил;
(iv) О-алкенил, S-алкенил или N-алкенил;
(v) O-алкинил, S-алкинил или N-алкинил; или
(vi) O-алкил-O-алкил, 2'-F, 2'-OCH3 или 2'-O(CH2)2OCH3,
где алкил, алкенил и алкинил могут представлять собой замещенный или незамещенный C1-C10алкил, C2-C10алкенил, C2-C10алкинил, -O[(CH2)n O]mCH3, -O(CH2)nOCH3, -O(CH2)n NH2, -O(CH2)n CH3, -O(CH2)n -ONH2 и -O(CH2)nON[(CH2)n CH3)]2 и где n и m составляют от 1 до приблизительно 10;
(b) модификации в 5'-положении, включающей 5'-винил или 5'-метил (R или S);
(с) модификации в 4'-положении, включающей 4'-S, гетероциклоалкил, гетероциклоалкарил, аминоалкиламино, полиалкиламино, замещенный силил, группу, расщепляющую РНК, репортерную группу, интеркалятор, группу для улучшения фармакокинетических свойств олигонуклеотида или группу для улучшения фармакодинамических свойств олигонуклеотида; и
(d) любой комбинации (а)-(с).
34 Способ по любому из пп. 19-33, где сконструированная клетка-хозяин дополнительно включает дерепрессированный ген polB.
35. Способ по любому из пп. 19-34, где сконструированная клетка-хозяин содержит (А) молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, где ответ, представляющий собой репарацию ДНК, предусматривает рекомбинационную репарацию, SOS-ответ, эксцизионную репарацию нуклеотидов или метил-направленную репарацию ошибочно спаренных оснований или их комбинацию, или (В) сконструированная клетка-хозяин содержит делецию белка, ассоциированного с ответом, представляющим собой репарацию ДНК.
36. Способ по п. 35, где белок, ассоциированный с ответом, представляющим собой репарацию ДНК, предусматривает RecA, RadA или LexA или их комбинацию.
37. Сконструированная клетка-хозяин по любому из пп. 11-18, где молекула нуклеиновой кислоты, кодирующая модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК, предусматривает N-концевую делецию, C-концевую делецию, усечение на обоих концах, внутреннюю делецию и/или делецию всего гена.
38. Сконструированная клетка-хозяин по любому из пп. 11-18, где сконструированная клетка-хозяин проявляет улучшенное удержание молекулы нуклеиновой кислоты, содержащей неприродный нуклеотид, во время репликации ДНК по сравнению с молекулой нуклеиновой кислоты, содержащей неприродный нуклеотид, в эквивалентной сконструированной клетке-хозяине, которая не содержит молекулу нуклеиновой кислоты, кодирующую модифицированный белок, ассоциированный с ответом, представляющим собой репарацию ДНК.
39. Способ по любому из пп. 19-26, где транспортер нуклеозидтрифосфата проявляет повышенную стабильность экспрессии в сконструированной клетке-хозяине относительно экспрессии в эквивалентной сконструированной клетке-хозяине, которая не содержит вторую молекулу нуклеиновой кислоты.
| WO 2017223528 A1, 28.12.2017 | |||
| YING et al | |||
| "Molecular Variation and Horizontal Gene Transfer of the Homocysteine Methyltransferase Gene mmuM and its Distribution in Clinical Pathogens," International Journal of Biological Sciences, 01.01.2015, Vol | |||
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Походная разборная печь для варки пищи и печения хлеба | 1920 |
|
SU11A1 |
| US 20070054381 A1, 08.03.2007 | |||
| FELDMAN et al | |||
| "A Tool for the Import of | |||
Авторы
Даты
2023-07-05—Публикация
2018-12-28—Подача