УРОВЕНЬ ТЕХНИКИ
1. ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
[0001] Настоящее изобретение раскрывает металлоорганическую структуру и способ ее производства.
2. ОПИСАНИЕ ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
[0002] Металлоорганическая структура (в дальнейшем также упоминаемая как «MOF»), которая является пористым соединением, была исследована и разработана как материал, имеющий такую функцию, как хранение газов или разделение газов.
[0003] В качестве методики, относящейся к MOF, например, публикация H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381 раскрывает MOF (MOF-808), включающую в себя Zr4+ в качестве иона металла, ион тримезата в качестве мультидентатного лиганда и ион формиата в качестве монодентатного лиганда. Публикация W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, раскрывает MOF, включающую в себя Zr4+ в качестве иона металла, ион тримезата в качестве мультидентатного лиганда, а также ион формиата, ион ацетата или ион пропаноата в качестве монодентатного лиганда.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0004] MOF, раскрытые в публикации H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381, а также в публикации W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, показывают характеристики адсорбирования и десорбирования водяного пара в соответствии с изменением относительной влажности, но оставляют пространство для увеличения количества адсорбируемого и десорбируемого водяного пара. В дополнение к этому в MOF, раскрытых в публикации H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381, а также в публикации W. Liang et al. «Turning pore size in a zirconium-tricarboxylate metal-organic framework», Cryst. Eng. Comm. 2014, 16, 6530-6533, в том случае, когда водяной пар адсорбируется и десорбируется при условиях, в которых изменение относительной влажности является относительно малым, существует проблема того, что десорбция не развивается в достаточной степени, и адсорбированный водяной пар не может быть полностью использован. Например, публикация H. Furukawa et al. «Water adsorption in porous metal-organic frameworks and related materials» J. Am. Chem. Soc. 2014, 136, 4369-4381 описывает следующее. В том случае, когда относительная влажность увеличивается от 20% до 40% во время адсорбции водяного пара и измерения количества десорбции с использованием MOF-808, количество адсорбции водяного пара составляет приблизительно 600 мл/г (при стандартных температуре и давлении). С другой стороны, даже в том случае, когда относительная влажность уменьшается с 40% до 20%, количество десорбируемого водяного пара составляет всего около 400 мл/г (при стандартных температуре и давлении).
[0005] Настоящее раскрытие предлагает металлоорганическую структуру, в которой адсорбируемое и десорбируемое количества водяного пара являются дополнительно улучшенными, а также способ ее производства.
[0006] Первый аспект настоящего изобретения относится к металлоорганической структуре, включающей в себя: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; а также ион первой органической молекулы, имеющей скелет тримезиновой кислоты, или ион второй органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
[0007] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион металла может быть по меньшей мере одним ионом, выбираемым из группы, состоящей из Zr4+, Hf4+ и Ce4+.
[0008] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион металла может представлять собой Zr4+.
[0009] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион первой органической молекулы, имеющей скелет тримезиновой кислоты, может быть ионом тримезата.
[0010] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения полный электрический заряд иона второй органической молекулы, имеющей скелет изофталевой кислоты, может быть равен -2 или больше.
[0011] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион второй органической молекулы, имеющей скелет изофталевой кислоты, может быть по меньшей мере одним ионом, выбираемым из группы, состоящей из иона изофталата, иона 5-гидроксиизофталата, иона 5-нитроизофталата, иона 5-трет-бутилизофталата, иона 5-хлоризофталата, иона 4-бромизофталата и иона 4,6-диметилизофталата.
[0012] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения ион второй органической молекулы, имеющей скелет изофталевой кислоты, может быть ионом изофталата.
[0013] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения доля иона второй органической молекулы, имеющей скелет изофталевой кислоты, может быть меньше чем 8,4 мол.% относительно всех мультидентатных лигандов.
[0014] Металлоорганическая структура в соответствии с первым аспектом настоящего изобретения может дополнительно включать в себя ион одновалентного линейного насыщенного алифатического карбоксилата, имеющий от 1 до 3 атомов углерода, в качестве монодентатного лиганда.
[0015] В металлоорганической структуре в соответствии с первым аспектом настоящего изобретения монодентатный лиганд может быть по меньшей мере любым из иона формиата или иона ацетата.
[0016] Второй аспект настоящего изобретения относится к способу производства металлоорганической структуры, включающему в себя нагревание раствора, включающего в себя источник иона металла, который включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента, первую органическую молекулу, имеющую скелет тримезиновой кислоты или ее соли, вторую органическую молекулу, имеющую скелет изофталевой кислоты или ее соли, и растворитель.
[0017] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения источник иона металла может быть соединением циркония.
[0018] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения соединение циркония может быть по меньшей мере либо оксихлоридом октогидрата циркония, либо хлоридом циркония.
[0019] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения первая органическая молекула, имеющая скелет тримезиновой кислоты, может быть тримезиновой кислотой.
[0020] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может не иметь функциональной группы, имеющей более низкое значение pKa, чем карбоксильная группа изофталевой кислоты.
[0021] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может быть по меньшей мере одним веществом, выбираемым из группы, состоящей из изофталевой кислоты, 5-гидроксиизофталевой кислоты, 5-нитроизофталевой кислоты, 5-трет-бутилизофталевой кислоты, 5-хлоризофталевой кислоты, 4-бромизофталевой кислоты и 4,6-диметилизофталевой кислоты.
[0022] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения вторая органическая молекула, имеющая скелет изофталевой кислоты, может быть изофталевой кислотой.
[0023] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения доля второй органической молекулы, имеющей скелет изофталевой кислоты, может быть меньше, чем 40 мол.% относительно общей суммы первой органической молекулы, имеющей скелет тримезиновой кислоты, и второй органической молекулы, имеющей скелет изофталевой кислоты.
[0024] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения в качестве растворителя могут использоваться амид и карбоновая кислота.
[0025] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения амид может быть по меньшей мере N,N-диметилформамидом или N,N-диэтилформамидом.
[0026] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения карбоновая кислота может быть одновалентной линейной насыщенной алифатической карбоновой кислотой, имеющей 1-3 атома углерода.
[0027] В способе производства металлоорганической структуры в соответствии со вторым аспектом настоящего изобретения карбоновая кислота может быть по меньшей мере муравьиной кислотой или уксусной кислотой.
[0028] Настоящее изобретение может обеспечить металлоорганическую структуру, в которой адсорбируемое и десорбируемое количества водяного пара являются дополнительно улучшенными, а также способ ее производства.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
[0029] Особенности, преимущества, а также техническое и промышленное значение примерных вариантов осуществления настоящего изобретения будут описаны ниже со ссылками на сопроводительные чертежи, в которых одинаковые ссылочные цифры обозначают одинаковые элементы, и в которых:
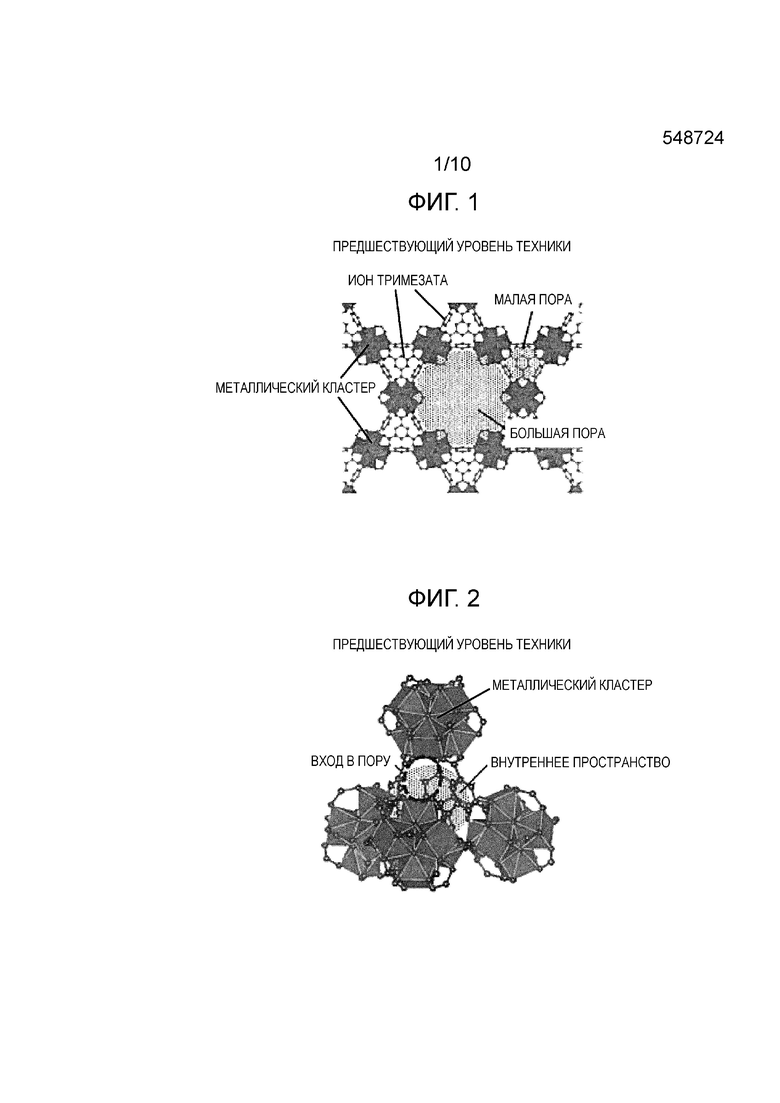
Фиг. 1 представляет собой диаграмму, показывающую кристаллическую структуру MOF (MOF-808) в соответствии с предшествующим уровнем техники;
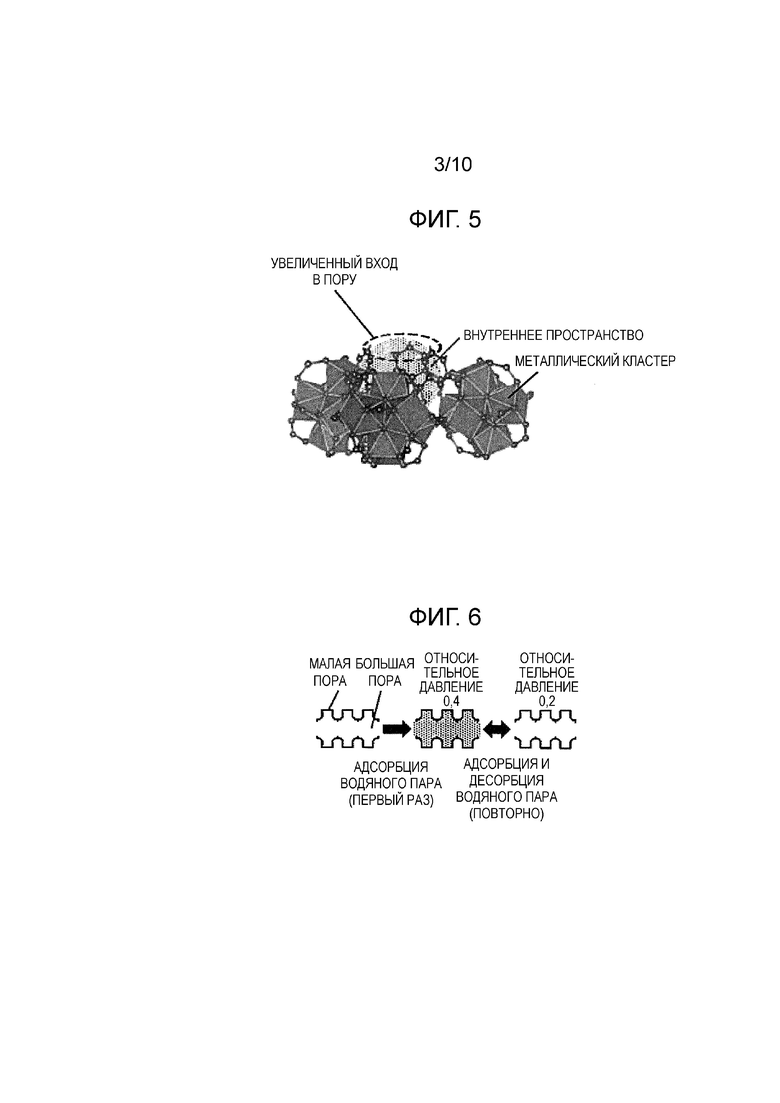
Фиг. 2 представляет собой диаграмму, показывающую незаполненное пространство кристаллической структуры (клетку), которое формирует малую пору в кристаллической структуре MOF в соответствии с предшествующим уровнем техники;
Фиг. 3 представляет собой диаграмму, схематично показывающую позиционное соотношение между большими порами и малыми порами в MOF в соответствии с предшествующим уровнем техники, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара;
Фиг. 4 представляет собой диаграмму, соответствующую Фиг. 1, показывающую примерную кристаллическую структуру MOF в соответствии с настоящим изобретением;
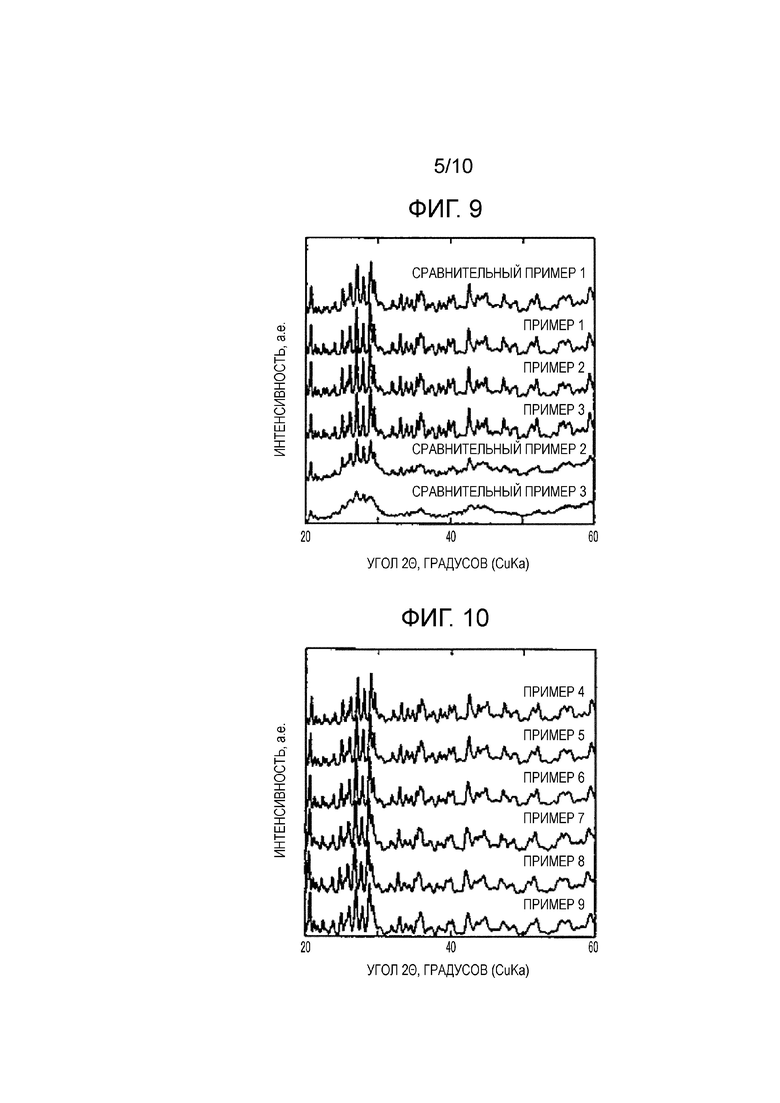
Фиг. 5 представляет собой диаграмму, соответствующую Фиг. 2, показывающую клетку, в которую введен дефект в примерной кристаллической структуре MOF в соответствии с настоящим изобретением;
Фиг. 6 представляет собой диаграмму, соответствующую Фиг. 3, схематично показывающую позиционное соотношение между большими порами и малыми порами в MOF в соответствии с настоящим изобретением, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара;
Фиг. 7 представляет собой блок-схему, показывающую один пример способа производства MOF в соответствии с настоящим изобретением;
Фиг. 8 представляет собой блок-схему, показывающую способ производства MOF в соответствии с Примером 1;
Фиг. 9 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 1-3 и Сравнительными примерами 1-3;
Фиг. 10 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 4-9;
Фиг. 11 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии со Сравнительными примерами 4-9;
Фиг. 12 представляет собой график, показывающий рентгеновскую дифракцию для MOF в соответствии с Примерами 10-12 и Сравнительными примерами 10-12;
Фиг. 13 представляет собой график, показывающий изотермы адсорбции азота для MOF в соответствии с Примером 1 и Сравнительным примером 1;
Фиг. 14 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 1-3 и Сравнительными примерами 1-3;
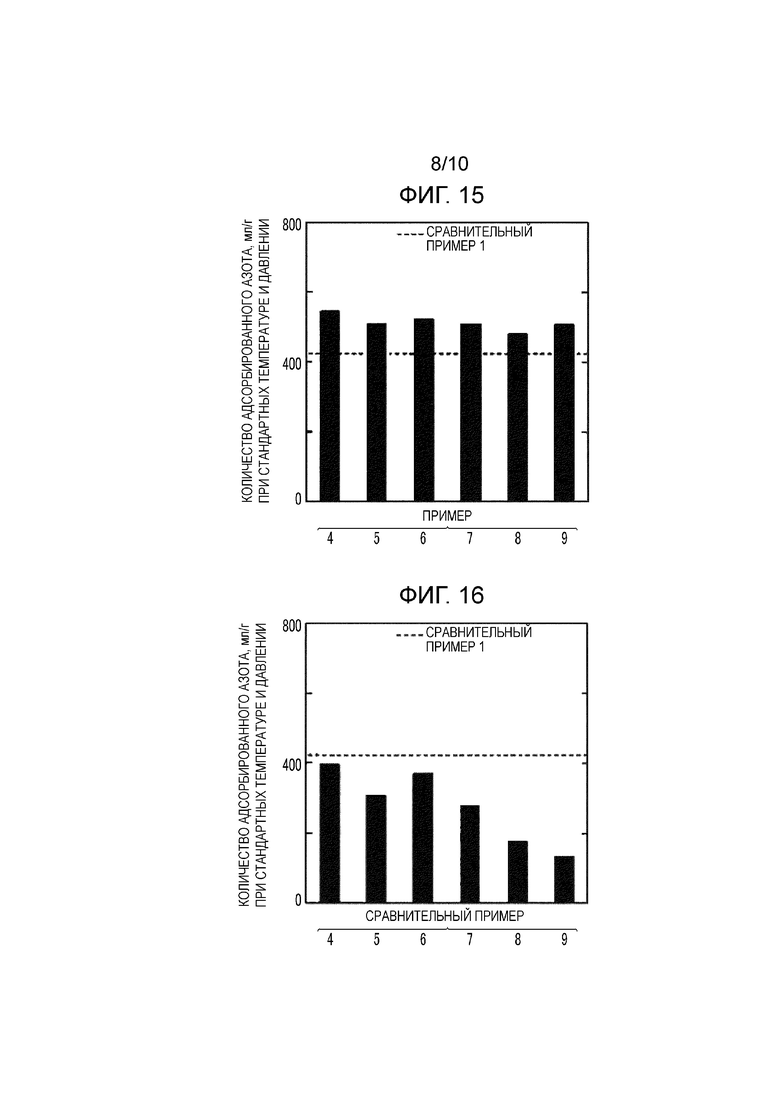
Фиг. 15 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 4-9;
Фиг. 16 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии со Сравнительными примерами 4-9;
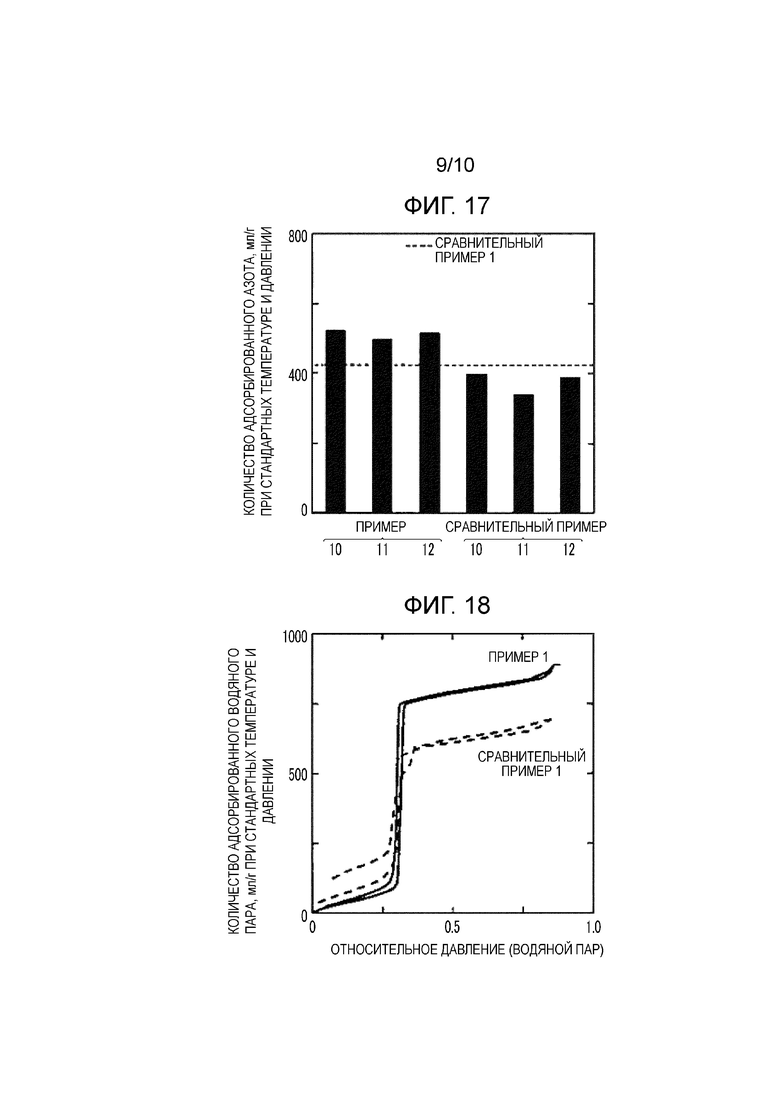
Фиг. 17 представляет собой график, показывающий величины адсорбции азота для MOF в соответствии с Примерами 10-12 и Сравнительными примерами 10-12;
Фиг. 18 представляет собой график, показывающий изотермы адсорбции и десорбции водяного пара для MOF в соответствии с Примером 1 и Сравнительным примером 1; и
Фиг. 19 представляет собой график, показывающий величины адсорбции и десорбции водяного пара для MOF в соответствии с Примерами 1-12 и Сравнительным примером 1.
ПОДРОБНОЕ ОПИСАНИЕ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0030] Далее настоящее изобретение будет описано со ссылкой на чертежи. Следующий вариант осуществления представляет собой один пример настоящего изобретения и не ограничивает настоящее изобретение.
1. Металлоорганическая структура (MOF)
[0031] Первый вариант осуществления настоящего изобретения относится к металлоорганической структуре (MOF), включающей в себя: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; а также ион органической молекулы, имеющей скелет тримезиновой кислоты, или ион органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
[0032] При использовании MOF в соответствии с настоящим изобретением величины адсорбции и десорбции водяного пара могут быть улучшены по сравнению с MOF предшествующего уровня техники. MOF в соответствии с настоящим изобретением может в достаточной степени выполнять десорбцию при условиях, в которых изменение относительной влажности является относительно малым. Предполагаемая причина этого будет описана со ссылкой на Фиг. 1-6. Фиг. 1-3 представляют собой диаграммы, показывающие кристаллическую структуру MOF-808 в соответствии с предшествующим уровнем техники, а Фиг. 4-6 представляют собой диаграммы, показывающие примерную кристаллическую структуру MOF в соответствии с настоящим изобретением. Фиг. 1-3 соответствуют Фиг. 4-6, соответственно.
[0033] Фиг. 1 представляет собой диаграмму, показывающую кристаллическую структуру MOF (MOF-808) в соответствии с предшествующим уровнем техники; Как показано на Фиг. 1, MOF в соответствии с предшествующим уровнем техники имеет трехмерную структуру, в которой кластеры металла (в примере, показанном на Фиг. 1 и 2, Zr6O4(OH)4(-CO2)6), включающие в себя Zr4+, которые являются вторичными строительными блоками (SBU), связаны друг с другом через ион органической молекулы, имеющей скелет тримезиновой кислоты (тридентатный лиганд; в примере, показанном на Фиг. 1 и 2, ион тримезата), который является органическим связывающим агентом, и включает в себя два вида пор (большие поры и малые поры), имеющие различные размеры. Фиг. 2 представляет собой диаграмму, показывающую незаполненное пространство кристаллической структуры (клетку), которое формирует малую пору в кристаллической структуре MOF в соответствии с предшествующим уровнем техники. Как показано на Фиг. 2, малая пора формируется в тетраэдрической клетке, которая формируется путем связывания четырех кластеров металла друг с другом через ион тримезата, располагающийся в вершине тетраэдра. Как показано на Фиг. 2, используется структура (так называемая структура пузырька для чернил), в которой вход в малую пору является более узким, чем внутреннее пространство. Фиг. 3 представляет собой диаграмму, схематично показывающую позиционное соотношение между большими порами и малыми порами, а также схематично показывающую состояние внутренней части пор во время адсорбции и десорбции водяного пара. Как показано на Фиг. 3, большие поры и малые поры имеют некоторое позиционное соотношение, в котором малая пора присутствует на задней стороне положения, в котором связаны большие поры, и малая пора имеет описанную выше структуру пузырька для чернил. Поскольку MOF в соответствии с предшествующим уровнем техники имеет эту структуру, предполагается следующее. Водяной пар может адсорбироваться как большими порами, так и малыми порами во время адсорбции, но во время десорбции трудно десорбировать водяной пар, адсорбированный в малых порах. В частности, адсорбция и десорбция повторяются при условиях, когда изменение относительной влажности является относительно малым (например, относительное давление меняется от 0,2 до 0,4), десорбция водяного пара, адсорбированного в малых порах, происходит в недостаточной степени, и водяной пар, адсорбированный в малых порах, не может быть полностью использован.
[0034] С другой стороны, в MOF в соответствии с настоящим изобретением предполагается следующее. Некоторые ионы органической молекулы, имеющей скелет тримезиновой кислоты (тридентатные лиганды; в примере, показанном на Фиг. 4 и 5, ионы тримезата), обмениваются с ионами органической молекулы, имеющей скелет изофталевой кислоты (бидентатные лиганды; в примере, показанном на Фиг. 4 и 5, ионы изофталата). В результате функциональные групп, координированных с ионами металла, и отрицательных электрических зарядов становится недостаточно, и, как показано на Фиг. 4 и 6, дефекты вводятся в структуру MOF для компенсации заряда. Таким образом предполагается, что увеличивается новое пространство, способное к адсорбции, и вес уменьшается благодаря уменьшению плотности скелета, так что величины адсорбции и десорбции водяного пара увеличиваются. В дополнение к этому, как показано на Фиг. 4 и 6, предполагается, что входы малых пор увеличиваются в размерах благодаря введение дефектов, и структура пузырька для чернил деформируется. В результате предполагается, что водяной пар, адсорбированный в малых порах, вероятно будет десорбирован при условиях, когда изменение относительной влажности является относительно малым. Далее каждый из компонентов, составляющих MOF в соответствии с настоящим изобретением, будет описан по порядку.
1.1. Ион металла
[0035] MOF в соответствии с настоящим изобретением включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла. Для того, чтобы получить кристаллическую структуру MOF в соответствии с настоящим изобретением, ион металла должен быть четырехвалентным. Примеры иона четырехвалентного элемента Группы 4 включают в себя Ti4+, Zr4+ и Hf4+. Примеры иона четырехвалентного редкоземельного элемента включают в себя Ce4+, Pr4+, Tb4+ и Dy4+. MOF в соответствии с настоящим изобретением включает в себя множество видов ионов металла, выбираемых из примеров иона четырехвалентного элемента Группы 4 и примеров иона четырехвалентного редкоземельного элемента. Ион металла особенно не ограничивается, но должен быть восьмикоординирован с оксидным ионом (O2-) для формирования металлического кластера, который является вторичным строительным блоком (SBU) для MOF. Следовательно, ион металла, имеющий относительно большой ионный радиус, является подходящим. С учетом доступности и стабильности четырехвалентного иона, предпочтительным является по меньшей мере один вид иона, выбираемый из группы, состоящей из Zr4+, Hf4+ и Ce4+, и Zr4+ является более предпочтительным.
1.2. Мультидентатный лиганд
[0036] MOF в соответствии с настоящим изобретением включает в себя ион органической молекулы, имеющей скелет тримезиновой кислоты, и ион органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
1.2.1. Ион органической молекулы, имеющей скелет тримезиновой кислоты
[0037] Ион органической молекулы, имеющей скелет тримезиновой кислоты, относится, например, к иону, имеющему структуру, представленную следующей Формулой (1).
[0038] В Формуле (1) R представляет собой заместитель, а n - натуральное число от 1 до 3. Заместитель R особенно не ограничивается, при условии, что он может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0039] Конкретные примеры иона органической молекулы, имеющей скелет тримезиновой кислоты, который имеет эту структуру и может формировать MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере один ион, выбираемый из группы, состоящей из иона тримезата (BTC3-), иона 2-гидрокси-1,3,5-бензолтрикарбоксилата, иона 2-нитро-1,3,5-бензолтрикарбоксилата, иона 2-хлор-1,3,5-бензолтрикарбоксилата, иона 2-бром-1,3,5-бензолтрикарбоксилата и иона 2-метил-1,3,5-бензолтрикарбоксилата. В частности, ион органической молекулы, имеющей скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является ионом тримезата (BTC3-).
1.2.2. Ион органической молекулы, имеющей скелет изофталевой кислоты
[0040] Ион органической молекулы, имеющей скелет изофталевой кислоты, относится, например, к иону, имеющему структуру, представленную следующей Формулой (2).
[0041] В Формуле (2) R представляет собой заместитель, а n - натуральное число от 1 до 4. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0042] Полный электрический заряд иона органической молекулы, имеющей скелет изофталевой кислоты, должен составлять -2 или больше. Предполагается, что в том случае, когда полный электрический заряд иона органической молекулы, имеющей скелет изофталевой кислоты, составляет -3 или меньше, полный электрический заряд обмениваемого иона органической молекулы, имеющей скелет тримезиновой кислоты, составляет -3, и таким образом компенсация не нужна, и введение дефектов (дефектов положительно заряженных ионов металла) не происходит. В том случае, когда полный электрический заряд иона составляет -1, ион органической молекулы, имеющей скелет изофталевой кислоты, является, например, положительно заряженным заместителем, таким как группа триметиламмония [N(CH3)3+] или группа триэтиламмония [N(C2H5)3+].
[0043] Конкретные примеры иона органической молекулы, имеющей скелет изофталевой кислоты, который имеет структуру и может формировать MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере один ион, выбираемый из группы, состоящей из иона изофталата (м-BDC2-), иона 5-гидроксиизофталата (5-OH-м-BDC2-), иона 5-нитроизофталата (5-NO2-м-BDC2-), иона 5-трет-бутилизофталата (5-трет-Bu-м-BDC2-), иона 5-хлоризофталата (5-Cl-м-BDC2-), иона 4-бромизофталата (4-Br-м-BDC2-) и иона 4,6-диметилизофталата (4,6-2CH3-м-BDC2-). В частности, ион органической молекулы, имеющей скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является ионом изофталата (м-BDC2-).
[0044] В MOF в соответствии с настоящим изобретением предпочтительно, чтобы доля иона органической молекулы, имеющей скелет изофталевой кислоты, была меньше, чем 8,4 мол.% относительно всех мультидентатных лигандов. В том случае, когда доля иона органической молекулы, имеющей скелет изофталевой кислоты, составляет 8,4 мол.% или больше относительно всех мультидентатных лигандов, количество дефектов увеличивается, и кристаллическая структура MOF вряд ли будет поддерживаться.
1.3. Монодентатный лиганд
[0045] MOF в соответствии с настоящим изобретением может включать в себя монодентатный лиганд. Например, в одном предпочтительном варианте осуществления способа производства металлоорганической структуры согласно описанному ниже второму варианту осуществления настоящего изобретения монодентатный лиганд используется для ограничения количества мультидентатных лигандов, скоординированных с металлическим кластером, и легкого формирования кристаллической структуры MOF в соответствии с настоящим изобретением, и координируется с металлическим кластером для формирования части MOF в соответствии с настоящим изобретением. Примеры монодентатного лиганда включают в себя ион одновалентного линейного насыщенного алифатического карбоксилата, имеющий от 1 до 3 атомов углерода. Монодентатный лиганд предпочтительно представляет собой по меньшей мере один ион, выбираемый из группы, состоящей из иона формиата, иона ацетата и иона пропаноата, и более предпочтительно представляет собой по меньшей мере один ион из иона формиата или иона ацетата. Металлоорганическая структура в соответствии с настоящим изобретением может быть произведена, например, с использованием способа производства металлоорганической структуры согласно второму варианту осуществления настоящего изобретения.
2. Способ производства металлоорганической структуры (MOF)
[0046] Второй вариант осуществления настоящего изобретения относится к способу производства металлоорганической структуры (MOF), включающему в себя стадию нагревания раствора, включающего в себя источник иона металла, который включает в себя ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента, органическую молекулу, имеющую скелет тримезиновой кислоты или ее соли, органическую молекулу, имеющую скелет изофталевой кислоты или ее соли, и растворитель.
[0047] Фиг. 7 представляет собой диаграмму, схематично показывающую один пример способа производства в соответствии с настоящим изобретением. В способе производства, показанном на Фиг. 7, MOF производится посредством стадии (стадии нагрева (S1)) добавления в контейнер источника ионов металла, органической молекулы, имеющей скелет тримезиновой кислоты, или ее соли, органической молекулы, имеющей скелет изофталевой кислоты, или ее соли, а также растворителя для получения раствора, и нагревания полученного раствора.
2.1. Источник ионов металла
[0048] Источник ионов металла, используемый в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что он может обеспечивать ион металла, образующий MOF в соответствии с настоящим изобретением. Например, в том случае, когда ион металла представляет собой по меньшей мере один ион, выбираемый из группы, состоящей из Zr4+, Hf4+ и Ce4+, в качестве источника ионов металла может использоваться по меньшей мере одно соединение, выбираемое из группы, состоящей из известного соединения циркония, известного соединения гафния и известного соединения церия. В частности, источник иона металла особенно не ограничивается и предпочтительно является соединением циркония с точки зрения доступности и т.п. Примеры соединения циркония включают в себя по меньшей мере одно из оксихлорида октогидрата циркония (ZrOCl2⋅8H2O) или хлорида циркония (ZrCl4).
2.2. Органическая молекула, имеющая скелет тримезиновой кислоты
[0049] Органическая молекула, имеющая скелет тримезиновой кислоты, относится, например, к органической молекуле, имеющей структуру, представленную следующей Формулой (3).
[0050] В Формуле (3) R представляет собой заместитель, а n - натуральное число от 1 до 3. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу и этиловую группу.
[0051] Конкретные примеры органической молекулы, имеющей скелет тримезиновой кислоты, которая имеет структуру и может использоваться в способе производства MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере одну кислоту, выбираемую из группы, состоящей из тримезиновой кислоты (H3BTC), 2-гидрокси-1,3,5-бензолтрикарбоновой кислоты, 2-нитро-1,3,5-бензолтрикарбоновой кислоты, 2-хлор-1,3,5-бензолтрикарбоновой кислоты, 2-бром-1,3,5-бензолтрикарбоновой кислоты и 2-метил-1,3,5-бензолтрикарбоновой кислоты. В частности, органическая молекула, имеющая скелет тримезиновой кислоты, особенно не ограничивается и предпочтительно является тримезиновой кислотой (H3BTC).
[0052] Примеры соли органической молекулы, имеющей скелет тримезиновой кислоты, включают в себя калийную соль, натриевую соль, литиевую соль, соль аммония или ангидрид примеров органической молекулы, имеющей скелет тримезиновой кислоты.
2.3. Органическая молекула, имеющая скелет изофталевой кислоты
[0053] Органическая молекула, имеющая скелет изофталевой кислоты, относится, например, к органической молекуле, имеющей структуру, представленную следующей Формулой (4).
[0054] В Формуле (4) R представляет собой заместитель, а n - натуральное число от 1 до 4. Заместитель R особенно не ограничивается, при условии, что он может позволять иону органической молекулы функционировать в качестве органического связывающего агента и может образовывать MOF в соответствии с настоящим изобретением, и его примеры включают в себя гидроксильную группу, нитрогруппу, фторную группу, хлорную группу, бромную группу, йодную группу, метиловую группу, этиловую группу и группу трет-бутила.
[0055] Предпочтительно, чтобы органическая молекула, имеющая скелет изофталевой кислоты, не имела функциональной группы, имеющей более низкое значение pKa (константы диссоциации кислоты), чем карбоксильная группа изофталевой кислоты (м-H2BDC). Предполагается, что в том случае, когда органическая молекула, имеющая скелет изофталевой кислоты, имеет функциональную группу, имеющую более низкое значение pKa, чем карбоксильная группа изофталевой кислоты (м-H2BDC), ион имеет электрический заряд -3 или меньше, и таким образом компенсация заряда не нужна, и введение дефектов не происходит, как было описано выше. Примеры функциональной группы, имеющей более низкое значение pKa (константы диссоциации кислоты), чем карбоксильная группа изофталевой кислоты (м-H2BDC), включают в себя сульфогруппу, сульфеновую группу, фосфиновую группу и фосфоновую группу.
[0056] Конкретные примеры органической молекулы, имеющей скелет изофталевой кислоты, которая имеет структуру и может использоваться в способе производства MOF в соответствии с настоящим изобретением, включают в себя по меньшей мере одну кислоту, выбираемую из группы, состоящей из изофталевой кислоты (м-H2BDC), 5-гидроксиизофталевой кислоты (5-OH-м-H2BDC), 5-нитроизофталевой кислоты (5-NO2-м-H2BDC), 5-трет-бутилизофталевой кислоты (5-трет-Bu-м-H2BDC), 5-хлоризофталевой кислоты (5-Cl-м-H2BDC), 4-бромизофталевой кислоты (4-Br-м-H2BDC) и 4,6-диметилизофталевой кислоты (4,6-(CH3)2-м-H2BDC). В частности, органическая молекула, имеющая скелет изофталевой кислоты, особенно не ограничивается и предпочтительно является изофталевой кислотой (м-H2BDC).
[0057] Примеры соли органической молекулы, имеющей скелет изофталевой кислоты, включают в себя калийную соль, натриевую соль, литиевую соль, соль аммония или ангидрид примеров органической молекулы, имеющей скелет изофталевой кислоты.
[0058] Ион органической молекулы, имеющей скелет фталевой кислоты (например, фталевая кислота (o-H2BDC)), или ион органической молекулы, имеющей скелет терефталевой кислоты (например, терефталевая кислота (п-H2BDC)), в котором карбоксильная группа присутствует в орто-положении или пара-положении в Формуле (4), также является бидентатным лигандом, в котором две карбоксильные группы связаны с бензольным кольцом, как и в ионе органической молекулы, имеющей скелет изофталевой кислоты. Однако предполагается, что ион органической молекулы, имеющей скелет фталевой кислоты, в котором угол между двумя карбоксильными группами составляет 60°, или ион органической молекулы, имеющей скелет терефталевой кислоты, в котором угол между двумя карбоксильными группами составляет 180°, не может быть обменен с ионом органической молекулы, имеющей скелет тримезиновой кислоты, в котором угол между тремя карбоксильными группами составляет 120°, и таким образом кристаллическая структура разрушается.
2.4. Растворитель
[0059] Растворитель, используемый в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что источник иона металла, органическая молекула, имеющая скелет изофталевой кислоты, или ее соль и органическая молекула, имеющая скелет тримезиновой кислоты, или ее соль, описанные выше, могут быть диспергированы в нем, и MOF может быть синтезирована на стадии нагревания, описываемой ниже. С точки зрения ускорения синтеза MOF предпочтительно, чтобы использовался амид или карбоновая кислота.
2.4.1. Амид
[0060] Примеры амида, используемого в способе производства в соответствии с настоящим изобретением, включают в себя по меньшей мере одно из N,N-диметилформамида (DMF) или N,N-диэтилформамида (DEF).
2.4.2. Карбоновая кислота
[0061] В способе производства в соответствии с настоящим изобретением при использовании карбоновой кислоты в качестве растворителя ион карбоновой кислоты функционирует как монодентатный лиганд, так что количество мультидентатных лигандов, скоординированных с металлическим кластером, может быть ограничено, и может быть легко сформирована кристаллическая структура MOF в соответствии с настоящим изобретением. Карбоновая кислота, используемая в способе производства в соответствии с настоящим изобретением, особенно не ограничивается, при условии, что она может обеспечивать ион карбоновой кислоты, который функционирует как монодентатный лиганд MOF в соответствии с настоящим изобретением. Примеры карбоновой кислоты включают в себя одновалентную линейную насыщенную алифатическую карбоновую кислоту, имеющую от 1 до 3 атомов углерода. В частности, карбоновая кислота особенно не ограничивается и предпочтительно является по меньшей мере одной кислотой, выбираемой из группы, состоящей из муравьиной кислоты, уксусной кислоты и пропановой кислоты, и более предпочтительно по меньшей мере одной из муравьиной кислоты или уксусной кислоты.
2.5. Стадия нагревания (S1)
[0062] Стадия нагревания (S1) является стадией нагревания раствора, включающего в себя источник иона металла, органическую молекулу, имеющую скелет тримезиновой кислоты, или соль органической молекулы, имеющей скелет тримезиновой кислоты, органическую молекулу, имеющую скелет изофталевой кислоты, или ее соль, а также растворитель.
[0063] Температура нагрева на стадии нагревания (S1) особенно не ограничивается, при условии, что она является температурой, при которой MOF может быть произведена, и предпочтительно составляет 100-150°C. В том случае, когда температура нагрева является более низкой, чем 100°C, реакционная способность является низкой, и MOF навряд ли будет произведена. В том случае, когда температура нагрева является более высокой, чем 150°C, давление пара является высоким, и может произойти утечка пара. Предпочтительно, чтобы время нагрева на стадии нагрева (S1) составляло 6 час или больше. В том случае, когда время нагрева составляет менее 6 час, сырье может не успеть прореагировать друг с другом полностью.
Синтез металлоорганической структуры (MOF)
[0064] С использованием следующих реагентов были синтезированы металлоорганические структуры (MOF) в соответствии с Примерами 1-12 и Сравнительными примерами 1-12.
Реагент
- Оксихлорид октогидрата циркония (ZrOCl2⋅8H2O; производства компании Sigma-Aldrich Corporation)
- Хлорид циркония (ZrCl4, производства компании Sigma-Aldrich Corporation)
- Тримезиновая кислота (H3BTC, производства компании Sigma-Aldrich Corporation)
- Изофталевая кислота (м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-гидроксиизофталевая кислота (5-OH-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-нитроизофталевая кислота (5-NO2-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-трет-бутилизофталевая кислота (5-трет-Bu-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-метилизофталевая кислота (5-CH3-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 4,6-диметилизофталевая кислота (4,6-(CH3)2-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 4-бромизофталевая кислота (4-Br-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- Терефталевая кислота (п-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- 5-сульфоизофталат натрия (5-SO3Na-м-H2BDC, производства компании Tokyo Chemical Industry Co., Ltd.)
- Уксусная кислота (производства компании Wako Pure Chemical Industries Ltd.)
- Муравьиная кислота (производства компании Wako Pure Chemical Industries Ltd.)
- N,N-диметилформамид (DMF, производства компании Wako Pure Chemical Industries Ltd.)
- N,N-диэтилформамид (DEF, производства компании Tokyo Chemical Industry Co., Ltd.)
Пример 1
[0065] (1) 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O), 76 мг (36 ммоль) тримезиновой кислоты (H3BTC), 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC), 20 мл уксусной кислоты и 20 мл N,N-диметилформамида (DMF) было добавлено в контейнер из политетрафторэтилена емкостью 100 мл (HUT-100, производства компании SAN-AI Kagaku Co., Ltd.).
(2) Контейнер из политетрафторэтилена был помещен во внешний цилиндр высокого давления из нержавеющей стали (HUS-100, производства компании SAN-AI Kagaku Co., Ltd.), и нагревался при 130°C в течение 48 час.
(3) Продукт был отфильтрован, промыт с помощью 10 мл DMF три раза, промыт с помощью 10 мл ацетона (производства компании Wako Pure Chemical Industries Ltd.) три раза, и был нагрет и высушен при 60°C в течение ночи при уменьшении давления до 10-1 Па или ниже. В результате было получено 280 мг продукта (MOF согласно Примеру 1). Фиг. 8 показывает блок-схему способа производства в соответствии с Примером 1.
Пример 2
[0066] (1) MOF согласно Примеру 2 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 13 мг (8 ммоль).
Пример 3
[0067] (1) MOF согласно Примеру 3 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 20 мг (12 ммоль).
Пример 4
[0068] (1) MOF согласно Примеру 4 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) 5-гидроксиизофталевой кислоты (5-OH-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 5
[0069] (1) MOF согласно Примеру 5 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 8 мг (4 ммоль) 5-нитроизофталевой кислоты (5-NO2-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 6
[0070] (1) MOF согласно Примеру 6 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 9 мг (4 ммоль) 5-трет-бутилизофталевой кислоты (5-трет-Bu-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 7
[0071] (1) MOF согласно Примеру 7 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) 5-метилизофталевой кислоты (5-CH3-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 8
[0072] (1) MOF согласно Примеру 8 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 8 мг (4 ммоль) 4,6-диметилизофталевой кислоты (4,6-CH3-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 9
[0073] (1) MOF согласно Примеру 9 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 10 мг (4 ммоль) 4-бромизофталевой кислоты (4-Br-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Пример 10
[0074] (1) MOF согласно Примеру 10 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 280 мг (120 ммоль) хлорида циркония (ZrCl4) использовалось вместо 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O).
Пример 11
[0075] (1) MOF согласно Примеру 11 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 20 мл муравьиной кислоты использовалось вместо 20 мл уксусной кислоты.
Пример 12
[0076] (1) MOF согласно Примеру 12 была получена с использованием того же самого способа, что и в Примере 3, за исключением того, что 20 мл N,N-диэтилформамида (DEF) использовалось вместо 20 мл N,N-диметилформамида (DMF).
Сравнительный пример 1
[0077] (1) MOF согласно Сравнительному примеру 1 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 84 мг (40 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 0 мг (0 ммоль).
Сравнительный пример 2
[0078] (1) MOF согласно Сравнительному примеру 2 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 50 мг (24 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 27 мг (16 ммоль).
Сравнительный пример 3
[0079] (1) MOF согласно Сравнительному примеру 3 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 42 мг (20 ммоль), а количество изофталевой кислоты (м-H2BDC) было изменено на 33 мг (20 ммоль).
Сравнительный пример 4
[0080] (1) MOF согласно Сравнительному примеру 4 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 11 мг (4 ммоль) 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Сравнительный пример 5
[0081] (1) MOF согласно Сравнительному примеру 5 была получена с использованием того же самого способа, что и в Сравнительном примере 4, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) было изменено на 21 мг (8 ммоль).
Сравнительный пример 6
[0082] (1) MOF согласно Сравнительному примеру 6 была получена с использованием того же самого способа, что и в Сравнительном примере 4, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC) было изменено на 32 мг (12 ммоль).
Сравнительный пример 7
[0083] (1) MOF согласно Сравнительному примеру 7 была получена с использованием того же самого способа, что и в Примере 1, за исключением того, что 7 мг (4 ммоль) терефталевой кислоты (п-H2BDC) использовалось вместо 7 мг (4 ммоль) изофталевой кислоты (м-H2BDC).
Сравнительный пример 8
[0084] (1) MOF согласно Сравнительному примеру 8 была получена с использованием того же самого способа, что и в Сравнительном примере 7, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 67 мг (32 ммоль), а количество терефталевой кислоты (п-H2BDC) было изменено на 13 мг (8 ммоль).
Сравнительный пример 9
[0085] (1) MOF согласно Сравнительному примеру 9 была получена с использованием того же самого способа, что и в Сравнительном примере 7, за исключением того, что количество тримезиновой кислоты (H3BTC) было изменено на 59 мг (28 ммоль), а количество терефталевой кислоты (п-H2BDC) было изменено на 20 мг (12 ммоль).
Сравнительный пример 10
[0086] (1) MOF согласно Сравнительному примеру 10 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 280 мг (120 ммоль) хлорида циркония (ZrCl4) использовалось вместо 387 мг (120 ммоль) оксихлорида октогидрата циркония (ZrOCl2⋅8H2O).
Сравнительный пример 11
[0087] (1) MOF согласно Сравнительному примеру 11 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 20 мл муравьиной кислоты использовалось вместо 20 мл уксусной кислоты.
Сравнительный пример 12
[0088] (1) MOF согласно Сравнительному примеру 12 была получена с использованием того же самого способа, что и в Сравнительном примере 1, за исключением того, что 20 мл N,N-диэтилформамида (DEF) использовалось вместо 20 мл N,N-диметилформамида (DMF).
Измерения
(1) Рентгеновское дифракционное измерение (проверка кристаллической структуры)
[0089] Для каждой из MOF согласно Примерам 1-12 и Сравнительным примерам 1-12 было выполнено рентгеновское дифракционное измерение. Измерительный прибор и условия измерения были следующими.
- Измерительный прибор: RINTRAPID II (производства компании Rigaku Corporation)
- Условия измерения: напряжение=50 В, ток=100 мА, диаметр коллиматора ϕ=0,3, наклон образца ω=15°
Фиг. 9 показывает результаты измерений Примеров 1-3 и Сравнительных примеров 1-3, Фиг. 10 показывает результаты измерений Примеров 4-9, Фиг. 11 показывает результаты измерений Сравнительных примеров 4-9, и Фиг. 12 показывает результаты измерений Примеров 10-12 и Сравнительных примеров 10-12.
(2) Измерение величины адсорбции азота (Проверка объема порового пространства)
[0090] Для каждой из MOF согласно Примерам 1-12 и Сравнительным примерам 1-12 была измерена изотерма адсорбции азота после предварительной обработки, и была получена величина адсорбции азота при относительном давлении 0-0,5. Устройство предварительной обработки, условия предварительной обработки, измерительный прибор и условия измерения были следующими.
- Устройство предварительной обработки: BELPREP-vac II (производства компании MicrotracBEL Corporation)
- Условия предварительной обработки: степень вакуума < 10-2 кПа, нагрев при 130°C в течение 6 час
- Измерительный прибор: BELSORP-max (производства компании MicrotracBEL Corporation)
- Условия измерения: температура: 77 K, адсорбция азота измерялась при относительном давлении 0-0,99
Фиг. 13 показывает изотермы адсорбции азота для MOF согласно Примеру 1 и Сравнительному примеру 1. Фиг. 14 показывает величины адсорбции азота для MOF согласно Примерам 1-3 и Сравнительным примерам 1-3, Фиг. 15 показывает величины адсорбции азота для MOF согласно Примерам 4-9, Фиг. 16 показывает величины адсорбции азота для MOF согласно Сравнительным примерам 4-9, и Фиг. 17 показывает величины адсорбции азота для MOF согласно Примерам 10-12 и Сравнительным примерам 10-12.
(3) Измерение 1H-ЯМР (анализ состава MOF)
[0091] Для каждого из продуктов (MOF согласно Примерам 1-12 и Сравнительным примерам 1-3) был измерен 1H-ЯМР спектр раствора после разложения, и пропорция лигандов в MOF была получена на основе соотношения интегралов. Условия разложения, измерительный прибор и условия измерения были следующими.
- Условия разложения: приблизительно 10 мг продукта (MOF) были разложены с использованием 1 мл дейтеросерной кислоты (D2SO4)
- Измерительный прибор: JNM-AL400 (производства компании JEOL Ltd.)
- Условия измерения: 1H-ЯМР спектр раствора измерялся с использованием тетраметилсилана (TMS) в качестве внутреннего стандарта
Таблица 1 показывает виды и соотношения лигандов в MOF согласно Примерам 1-12 и Сравнительным примерам 1-3.
(4) Измерение адсорбции и десорбции водяного пара (оценка характеристик адсорбции и десорбции водяного пара)
[0092] Для каждого из продуктов (MOF согласно Примерам 1-12 и Сравнительным примерам 1), были измерены изотермы адсорбции и десорбции водяного пара после предварительной обработки, и были получены величина адсорбции водяного пара при относительном давлении 0,2-0,4 и величина десорбции водяного пара при относительном давлении 0,4-0,2. Устройство предварительной обработки, условия предварительной обработки, измерительный прибор и условия измерения были следующими.
- Устройство предварительной обработки: BELPREP-vac II (производства компании MicrotracBEL Corporation)
- Условия предварительной обработки: степень вакуума < 10-2 Па, нагрев при 130°C в течение 6 час
- Измерительный прибор: BELSORP-max (производства компании MicrotracBEL Corporation)
- Условия измерения: величина адсорбции водяного пара при относительном давлении 0-0,85 и величина десорбции водяного пара при относительном давлении 0,85-0,05 были измерены при температуре 20°C
Фиг. 18 показывает кривые адсорбции и десорбции водяного пара Примера 1 и Сравнительного примера 1 при 20°C. Фиг. 19 показывает результаты измерения величин адсорбции и десорбции водяного пара Примеров 1-12 и Сравнительного примера 1.
Таблица 1
Результаты
(1) Рентгеновское дифракционное измерение
[0093] Как показано на Фиг. 9, в Примерах 1-3 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. С другой стороны, в Сравнительных примерах 2 и 3 кристалличность явно ухудшилась по сравнению со Сравнительным примером 1. Причиной этого предположительно является то, что в том случае, когда количество добавляемой изофталевой кислоты (м-H2BDC) является более высоким, чем 40 мол.%, количество дефектов увеличивается, и становится трудно поддерживать кристаллическую структуру. Как показано на Фиг. 10, в Примерах 4-9 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. Из этого результата было найдено, что любая органическая молекула, имеющая скелет изофталевой кислоты, показывает тот же самый эффект, что и изофталевая кислота (м-H2BDC), независимо от вида, положения и количества функциональных групп. Как показано на Фиг. 11, в Сравнительных примерах 4-6 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. Причиной этого предположительно является то, что поскольку в качестве соли органической молекулы, имеющей скелет изофталевой кислоты, добавлялся 5-сульфоизофталат натрия (5-SO3Na-м-H2BDC), был показан тот же самый эффект, что и при добавлении изофталевой кислоты (м-H2BDC). С другой стороны, в Сравнительных примерах 7-9 по мере того, как добавляемое количество терефталевой кислоты (п-H2BDC) увеличивалось, кристалличность ухудшалась. Причина этого предполагается следующей. Терефталевая кислота (п-H2BDC) является также бидентатным лигандом, в котором две карбоксильные группы связаны с бензольным кольцом, как в случае изофталевой кислоты (м-H2BDC). Однако терефталевая кислота (п-H2BDC), в которой угол между двумя карбоксильными группами составляет 180°, не могла быть обмененной с тримезиновой кислотой (H3BTC), в которой угол между тремя карбоксильными группами составляет 120°, и таким образом кристаллическая структура разрушалась. Как показано на Фиг. 12, в Примерах 10-12 и Сравнительных примерах 10-12 был получен тот же самый график рентгеновской дифракции, что и в Сравнительном примере 1. В результате было найдено, что та же самая кристаллическая структура была произведена независимо от вида источника ионов металла или растворителя.
(2) Измерение величины адсорбции азота
[0094] Как показано на Фиг. 13, в Примере 1 количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. При обмене иона тримезата (BTC3-, тридентатный лиганд) с ионом изофталата (м-BDC2-, бидентатный лиганд) функциональные группы координировались с ионами металла, и отрицательных электрических зарядов было недостаточно, и дефекты вводились в структуру для компенсации заряда. В результате вес уменьшился благодаря уменьшению плотности скелета, и увеличилось новое пространство, способное к адсорбции.
Как показано на Фиг. 14, в Примерах 1-3 количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. С другой стороны, в Сравнительных примерах 2 и 3 количество адсорбируемого азота было меньше, чем в Сравнительном примере 1. Причиной этого предположительно является то, что в том случае, когда количество добавляемой изофталевой кислоты (м-H2BDC) является более высоким, чем 40 мол.%, количество дефектов увеличивается, и становится трудно поддерживать кристаллическую структуру.
Как показано на Фиг. 15, в Примерах 4-9, как и в Примерах 1-3, количество адсорбируемого азота увеличилось по сравнению со Сравнительным примером 1. Причиной этого предположительно является то, что любая органическая молекула, имеющая скелет изофталевой кислоты, показывает тот же самый эффект, что и изофталевая кислота (м-H2BDC), независимо от вида, положения и количества функциональных групп.
Как показано на Фиг. 16, в Сравнительных примерах 4-6 количество адсорбируемого азота не увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. Благодаря группе SO3-, образующейся при электролитической диссоциации иона Na+ из группы SO3Na в пятом положении 5-сульфоизофталата натрия (5-SO3Na-м-H2BDC), ион 5-сульфоизофталата (5-SO3-м-BTC3-) функционировал как отрицательный трехвалентный ион, и его валентность была той же самой, что и у обмениваемого иона тримезата (BTC3-). Следовательно, компенсация заряда не требовалась, и введения дефектов (дефектов положительно заряженных ионов металла) не происходило. В Сравнительных примерах 7-9 количество адсорбируемого азота уменьшилось по сравнению со Сравнительным примером 1, и по мере того, как количество добавляемой терефталевой кислоты (п-H2BDC) увеличивалось, количество адсорбируемого азота уменьшалось. Как было описано выше со ссылкой на Фиг. 11, причиной этого предположительно является то, что терефталевая кислота (п-H2BDC) не могла быть обменена с тримезиновой кислотой (H3BTC) в неизменном виде, и таким образом кристаллическая структура разрушалась.
Как показано на Фиг. 17, в Примерах 10-12 количество адсорбируемого азота увеличилось по сравнению со Сравнительными примерами 10-12. В результате было найдено, что та же самая кристаллическая структура была произведена независимо от вида источника ионов металла или растворителя.
(3) Измерение 1H-ЯМР
[0095] Как показано в Таблице 1, было найдено, что в Примерах 1-12 ион тримезата (тридентатный лиганд) обменивался с ионом, имеющим скелет изофталевой кислоты (бидентатным лигандом). В Сравнительных примерах 2 и 3 предполагается, что количество, обмененное на ион изофталата (м-BDC2-), было большим, и в том случае, когда это количество составляло 8,4 мол.% или выше, кристаллическая структура не могла поддерживаться.
(4) Измерение адсорбции и десорбции водяного пара
[0096] Как показано на Фиг. 18, в Примере 1 количество адсорбируемого водяного пара увеличилось по сравнению со Сравнительным примером 1. Как описано выше со ссылкой на Фиг. 16, причина этого предполагается следующей. При обмене иона тримезата (BTC3-, тридентатный лиганд) с ионом изофталата (м-BDC2-, бидентатный лиганд) функциональные группы координировались с ионами металла, и отрицательных электрических зарядов было недостаточно, и дефекты вводились в структуру для компенсации заряда. В результате вес уменьшился благодаря уменьшению плотности скелета, и увеличилось новое пространство, способное к адсорбции. В Примере 1 количество десорбируемого водяного пара увеличилось по сравнению со Сравнительным примером 1. Причина этого предполагается следующей. Благодаря введению дефектов входы малых пор увеличились, и структура пузырька для чернил была деформирована. В результате водяной пар, адсорбированный в малых порах, легко десорбировался. Как показано на Фиг. 19, в Примерах 1-12 количество адсорбируемого водяного пара и количество десорбируемого водяного пара были улучшены по сравнению со Сравнительным примером 1.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ КООРДИНАЦИОННО НЕНАСЫЩЕННОГО МЕТАЛЛ-ОРГАНИЧЕСКОГО КАРКАСА И КООРДИНАЦИОННО НЕНАСЫЩЕННЫЙ МЕТАЛЛ-ОРГАНИЧЕСКИЙ КАРКАС | 2019 |
|
RU2716125C1 |
| МЕТАЛЛООРГАНИЧЕСКИЙ КАРКАС | 2020 |
|
RU2741968C1 |
| СПОСОБ АЛКОКСИЛИРОВАНИЯ МОНОСПИРТОВ В ПРИСУТСТВИИ МЕТАЛЛООРГАНИЧЕСКИХ КАРКАСНЫХ МАТЕРИАЛОВ | 2004 |
|
RU2346925C2 |
| Металлоорганический координационный полимер для аккумулирования природного газа, метана, и способ его получения | 2021 |
|
RU2782623C1 |
| Металлорганическая каркасная структура бензолтрикарбоксилата церия (III) Ce-BTC и способ её получения | 2022 |
|
RU2800447C1 |
| СПОСОБ ПОЛУЧЕНИЯ СУСПЕНЗИИ, СОДЕРЖАЩЕЙ НАНОРАЗМЕРНЫЕ ЧАСТИЦЫ ЛЕКАРСТВА | 2020 |
|
RU2756757C1 |
| АДСОРБЦИОННЫЙ СПОСОБ РАЗДЕЛЕНИЯ C АРОМАТИЧЕСКИХ УГЛЕВОДОРОДОВ | 2011 |
|
RU2521386C1 |
| Адсорбирующий SO материал, способ его получения и его применение, и способ удаления SO из дымового газа, содержащего SO | 2020 |
|
RU2802727C1 |
| СОДЕРЖАЩАЯ ОБЛАДАЮЩИЙ МЕТАЛЛООРГАНИЧЕСКОЙ КАРКАСНОЙ СТРУКТУРОЙ МАТЕРИАЛ РАЗДЕЛИТЕЛЬНАЯ МЕМБРАНА, СПОСОБ ЕЕ ПОЛУЧЕНИЯ И ЕЕ ПРИМЕНЕНИЕ | 2020 |
|
RU2830611C1 |
| СПОСОБ ПОЛИМЕРИЗАЦИИ ДЛЯ СИНТЕЗА ВИНИЛАРОМАТИЧЕСКИХ ПОЛИМЕРОВ С КОНТРОЛИРУЕМОЙ СТРУКТУРОЙ | 2019 |
|
RU2795681C2 |





Изобретение относится к металлоорганическим структурам и способу их производства. Описана металлоорганическая структура для адсорбции водяного пара, содержащая: ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; и ион первой органической молекулы, имеющей скелет тримезиновой кислоты, и ион второй органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов. Также описан способ производства металлоорганической структуры. Технический результат: улучшенная способность при адсорбции и десорбции водяного пара, обеспечивающаяся с использованием металлоорганической структуры. 2 н. и 19 з.п. ф-лы, 1 табл., 19 ил., 12 пр.
1. Металлоорганическая структура для адсорбции водяного пара, содержащая:
ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента в качестве иона металла; и
ион первой органической молекулы, имеющей скелет тримезиновой кислоты, и ион второй органической молекулы, имеющей скелет изофталевой кислоты, в качестве мультидентатных лигандов.
2. Металлоорганическая структура по п. 1, в которой ион металла представляет собой по меньшей мере один ион, выбираемый из группы, состоящей из Zr4+, Hf4+ и Ce4+.
3. Металлоорганическая структура по п. 1 или 2, в которой ион металла представляет собой Zr4+.
4. Металлоорганическая структура по п. 1 или 2, в которой ион первой органической молекулы, имеющей скелет тримезиновой кислоты, является ионом тримезата.
5. Металлоорганическая структура по п. 1 или 2, в которой полный электрический заряд иона второй органической молекулы, имеющей скелет изофталевой кислоты, составляет -2 или больше.
6. Металлоорганическая структура по п. 1 или 2, в которой ион второй органической молекулы, имеющей скелет изофталевой кислоты, является по меньшей мере одним ионом, выбираемым из группы, состоящей из иона изофталата, иона 5-гидроксиизофталата, иона 5-нитроизофталата, иона 5-трет-бутилизофталата, иона 5-хлоризофталата, иона 4-бромизофталата и иона 4,6-диметилизофталата.
7. Металлоорганическая структура по п. 1 или 2, в которой ион второй органической молекулы, имеющей скелет изофталевой кислоты, является ионом изофталата.
8. Металлоорганическая структура по п. 1 или 2, в которой доля иона второй органической молекулы, имеющей скелет изофталевой кислоты, составляет меньше чем 8,4 мол.% относительно всех мультидентатных лигандов.
9. Металлоорганическая структура по п. 1 или 2, дополнительно содержащая ион одновалентного линейного насыщенного алифатического карбоксилата, имеющий от 1 до 3 атомов углерода, в качестве монодентатного лиганда.
10. Металлоорганическая структура по п. 9, в которой монодентатный лиганд является по меньшей мере любым из иона формиата или иона ацетата.
11. Способ производства металлоорганической структуры, включающий нагревание раствора, включающего источник иона металла, который включает ион четырехвалентного элемента Группы 4 или ион четырехвалентного редкоземельного элемента, первую органическую молекулу, имеющую скелет тримезиновой кислоты, или соль первой органической молекулы, имеющей скелет тримезиновой кислоты, вторую органическую молекулу, имеющую скелет изофталевой кислоты, или соль второй органической молекулы, имеющей скелет изофталевой кислоты, а также растворитель, выбранный из группы, состоящей из амида и карбоновой кислоты.
12. Способ по п. 11, в котором источник иона металла является соединением циркония.
13. Способ по п. 12, в котором соединение циркония является по меньшей мере одним из оксихлорида октогидрата циркония или хлорида циркония.
14. Способ по любому из пп. 11-13, в котором первая органическая молекула, имеющая скелет тримезиновой кислоты, является тримезиновой кислотой.
15. Способ по любому из пп. 11-13, в котором вторая органическая молекула, имеющая скелет изофталевой кислоты, не имеет функциональной группы, имеющей более низкое значение pKa, чем карбоксильная группа изофталевой кислоты.
16. Способ по любому из пп. 11-13, в котором вторая органическая молекула, имеющая скелет изофталевой кислоты, является по меньшей мере одной молекулой, выбираемой из группы, состоящей из изофталевой кислоты, 5-гидроксиизофталевой кислоты, 5-нитроизофталевой кислоты, 5-трет-бутилизофталевой кислоты, 5-хлоризофталевой кислоты, 4-бромизофталевой кислоты и 4,6-диметилизофталевой кислоты.
17. Способ по любому из пп. 11-13, в котором вторая органическая молекула, имеющая скелет изофталевой кислоты, является изофталевой кислотой.
18. Способ по любому из пп. 11-13, в котором доля второй органической молекулы, имеющей скелет изофталевой кислоты, является более низкой чем 40 мол.% относительно общей суммы первой органической молекулы, имеющей скелет тримезиновой кислоты, и второй органической молекулы, имеющей скелет изофталевой кислоты.
19. Способ по п. 11, в котором амид представляет собой по меньшей мере N,N-диметилформамид или N,N-диэтилформамид.
20. Способ по п. 11, в котором карбоновая кислота является одновалентной линейной насыщенной алифатической карбоновой кислотой, имеющей от 1 до 3 атомов углерода.
21. Способ по п. 11, в котором карбоновая кислота является по меньшей мере муравьиной кислотой или уксусной кислотой.
| US 20160361702 A1, 15.12.2016 | |||
| CN 106544010 A, 29.03.2017 | |||
| RU 2012138958 A, 20.03.2014 | |||
| WO 2016100847 A2, 23.06.2016 | |||
| US 8691748 B2, 08.04.2014. |
Авторы
Даты
2019-05-06—Публикация
2018-03-27—Подача