Настоящее изобретение относится к [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амиду 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты для применения в лечении боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом.
Соединение [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амид 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты (называемое в данном документе как соединение A) и способы получения описаны, например, в WO 2004022553 и WO 2013083553. Соединение A представляет собой ингибитор IKKβ. В документе WO 2004022057 описано применение ингибиторов IKKβ для лечения различных хронических и острых болей, который включают связанную с остеоартритом боль, ревматоидный артрит, хронические заболевания опорно-двигательного аппарата и т. д.
Остеоартрит (OA) является наиболее распространенной формой артрита в мире, основной причиной боли в суставах и инвалидности и наиболее частой причиной тотального эндопротезирования тазобедренного сустава и эндопротезирования коленного сустава. По оценкам практически половина взрослого населения США к 85 годам будут страдать от OA коленного сустава с клиническими проявлениями, при этом наиболее высокому риску подвержены людей с ожирением. OA имеет огромные экономические последствия вследствие увеличения количества эндопротезирований суставов, увеличения затрат на госпитализацию и старения населения. Остеоартрит является главной причиной инвалидности у пожилых людей, поражая колена, бедра, поясницу, шею и кисти рук. Он характеризуется разрушением хрящей, новыми костными наростами, болью, деформацией суставов и потерей функции. Ранее считавшийся результатом механического изнашивания и старения, сейчас патогенез рассматривают как сложное взаимодействие генетических, метаболических, биохимических и биомеханических факторов с вторичными компонентами воспаления (Sun BH, Wu CW, Kalunian KC (2007),Rheum Dis ClinN Am 33: 135-148).
Однако симптомы OA часто включают боль в суставах, отечность и скованность, что указывает по меньшей мере на локальное воспаление. В последние годы внимание привлекла важная роль синовита в OA, хотя OA обычно не считают классической воспалительной артропатией, вследствие относительного отсутствия нейтрофилов в синовиальной жидкости и отсутствия систематических проявлений воспаления.
Сейчас полагают, что синовит является распространенным как при OA на ранних стадиях, так и на поздних стадиях OA и это обеспечивает возможную мишень для лечения как симптома, так и возможной модификации структуры (Ther Adv Musculoskel Dis (2010) 2(6) 349-359; Hayashi et al. Arthritis Research & Therapy 2010, 12:R172).
Однако существует реальная нехватка безопасных и эффективных средств лечения для OA, за исключением операции и ацетаминофена, и крайне необходимы дополнительные средства лечения. Поскольку в настоящее время отсутствуют сдерживающие болезнь или восстановительные терапевтические средства, то варианты лечения для OA главным образом основаны на обеспечении облегчения симптомов (т. е., боли). Однако ни один из них не является идеальным, учитывая их профили польза/риск. Основные средства лечения также включают снижение веса и физические упражнения, а также лекарственные средства NSAID/COX-2 для перорального и местного применения. Однако многие пациенты плохо переносят NSAID и/или имеют противопоказания к NSAID. Стероиды для внутрисуставного введения являются эффективными при OA коленного сустава, в том числе у пациентов с выпотом, но имеют короткую длительность эффекта (1-3 недели) и их можно вводить максимум 4 раза в год.
Таким образом, даже только для облегчения симптомов существует неудовлетворенная медицинская потребность в безопасном, эффективном и хорошо переносимом средстве для лечения связанной с остеоартритом боли, особенно у пациентов с выпотом.
Путь NFkB является уникальным из-за его сложного и быстрого механизма активации, большого разнообразия индуцирующих стимулов и большого количества генов, которые он регулирует. Сигнальный путь NFkB функционирует практически во всех типах клеток млекопитающего и активируется в ответ на повреждение, инфекцию, воспаление, стрессовые условия, и, следовательно, он вовлечен в патогенез нескольких заболеваний человека, как например OA и ревматоидного артрита (Roman-Blas JA, Jimenez SA (2006). NFkB as a potential therapeutic target in osteoarthritis and rheumatoid arthritis. Osteoarthritis Cartilage 14: 839-848).
IkB-киназа (IKK) представляет собой ключевой фермент в "классическом" пути NFkB. IKK представляет собой комплекс с высокой молекулярной массой (~700-900 кДа), состоящий из двух каталитических субъединиц, IKKβ (IKK2) и IKKα (IKK1), и регуляторного компонента NEMO (IKKγ). Провоспалительные стимулы, такие как IL1β, LPS и TNFα, активируют IKK, который, в свою очередь, фосфорилирует ингибитор NFkB (IkB) в Ser32 и Ser36, что приводит к его деградации посредством убиквитин-протеасомного пути. Деградация IkB высвобождает фактор транскрипции NFkB, который перемещается в ядро и индуцирует экспрессию различных связанных с заболеваниями генов (например, IL1β, TNFα, COX2, -5-LOX, MMP, ICAM), участвующих в воспалении, боли и разрушении тканей. Исследования на животных показали, что активация IKK является ключевым моментом в инициации синовита. Таким образом, ингибирование IKK должно привести в результате к снижению количества провоспалительных цитокинов (например, IL1 β, TNFα) и ферментов, образующих медиаторы боли, (например, COX2, 5- LOX) и делает IKK интересной мишенью для терапевтического воздействия на боль в суставах, которая является одним из основных симптомов при OA.
Во время клинических испытаний с соединением A, которое представляет собой эффективный и селективный ингибитор IKKβ, наблюдали, что это соединение обладает значительным эффектом у пациентов, страдающих от боли, связанной с выпотом на исходном уровне, при оценивании WOMAC (университетов Западного Онтарио и МакМастера), в котором оценивают боль, скованность и физическое функционирование с применением 5-бальной шкалы Лайкерта.
Следовательно, настоящее изобретение относится к [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амиду 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты для применения в лечении боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом.
Настоящее изобретение относится к [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амиду 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты для применения в лечении боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и/или синовитом, в частности, с выпотом и синовитом, как оценено с помощью показателя индекса WOMAC.
Настоящее изобретение также относится к [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амиду 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты, при этом его вводят в виде однократной дозы для внутрисуставного введения. Эта однократная доза для внутрисуставного введения может находится в диапазоне от 15 до 60 мг, в частности 60 мг.
Настоящее изобретение также относится к фармацевтической композиции, содержащей эффективное количество [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амида 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты в качестве активного ингредиента и фармацевтически приемлемые вспомогательные средства.
Эффективное количество может составлять от 15 до 60 мг, в частности 60 мг.
Примеры фармацевтических композиций представляют собой суспензии для внутрисуставной инъекции и лиофилизированные осадки, которые необходимо ресуспендировать в воде для инъекции при внутрисуставном введении.
Согласно другим его аспектам настоящее изобретение также относится к способу лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и/или синовитом, как указано выше, который включает введение пациенту эффективной дозы соединения A или его фармацевтически приемлемой соли.
Другие объекты настоящего изобретения представляют собой способы лечения для различных аспектов настоящего изобретения, описанных выше, и способы лечения, включающие применения соединения A у пациентов, как описано выше.
В другом аспекте настоящее изобретение относится к изделию, содержащему упаковочный материал, соединение A и этикетку или листок-вкладыш, помещенные в упаковочный материал, указывающие, что пациентов, получающих лечение с помощью вышеупомянутой фармацевтической композиции, можно лечить от боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом.
Определения:
Соединение A представляет собой [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амид 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты, имеющий структуру, представленную в виде формулы I:

Остеоартрит (OA) является наиболее распространенной формой артрита, поражая колена, бедра, кисти рук и позвоночник. Он связан со старением и включает потерю хряща, который защищает и покрывает поверхность кости. Обычные симптомы включают боль, скованность и иногда отечность, известную как выпот, который является результатом накопления избыточной жидкости в суставе.
Связанная с остеоартритом боль (OA боль) является широко распространенным симптомом остеоартрита, который обычно ухудшается при активности.
Суставной выпот (выпот) представляет собой присутствие повышенного количества внутрисуставной жидкости, которое является результатом накопления избыточной жидкости в суставе и которое может привести к отечности вокруг сустава, например, вокруг коленного сустава. Присутствие выпота в колене можно определить, например, посредством ультразвукового осмотра коленного сустава (Ann Rheum Dis 2005, 64:1703-1709; Ann Rheum Dis 2005, 64:1710-1714) и/или физического осмотра, как например посредством испытания на подвижность колена (Klaus Buckup, Clinical Tests for the Musculoskeletal System, 2008 Thieme, 2е издание, стр. 202-203).
Синовит представляет собой воспаление синовиальной мембраны. Обычная синовиальная оболочка состоит из 1-4 слоев клеток, которые соединены посредством внешней поверхности с зоной упорядоченной фиброколагенной ткани, содержащей адипоциты, фибробласты, тучные клетки и макрофаги. Синовиальная мембрана обладает обильным кровоснабжением и иннервацией, проходящей через неплотную фиброколагенную ткань. При OA это варьирует от выраженной гиперплазии выстилающего слоя с плотным клеточным инфильтратом, главным образом состоящим из лимфоцитов и моноцитов, до синовиальной мембраны, которая уплотнена посредством фиброзной ткани. Поверхностное отложение фибрина и фиброз в синовиальной оболочке являются распространенными при OA, особенно на поздних стадиях. Наблюдаемый при OA коленного сустава синовит имеет склонность быть диффузным и обычно не локализован в областях хрящевых дефектов, хотя наблюдали связь между хрящевыми дефектами и сопутствующим синовитом в среднем большеберцово-бедренном отделе колена.
Показатель индекса университетов Западного Онтарио и МакМастера (WOMAC) оценивает боль, скованность и физическое функционирование с применением 5-бальной шкалы Лайкерта, с 5, 2 и 17 вопросами, соответственно. Он является широко применяемым средством для измерения симптомов и физической инвалидности, изначально разработанный для людей с OA тазобедренного сустава и/или коленного сустава (Bellamy N. Osteoarthritis - An evaluative index for clinical trials. MSc Thesis. McMaster University, Hamilton, Canada. 1982; Bellamy N. et al. J. Rheumatol. 1988; 15: 1833-1840). Версию Лайкерта индекса WOMAC оценивают по обычной шкале от 0 до 4, где более низкие баллы, указывают на более низкий уровень симптомов или физической инвалидности. Каждую подшкалу суммируют до максимального балла 20, 8 и 68, соответственно. Также существует показатель индекса или глобальный показатель, который наиболее часто рассчитывают путем суммирования баллов для 3 подшкал. Версия визуальной аналоговой шкалы (VAS) для индекса WOMAC также является доступной. Анкета заполняется опрашиваемым лицом и заполнение занимает 5-10 минут.
"Пациент" означает человек.
"Осуществление лечения", или "лечить", или "лечение" относится либо к предупреждению, обеспечению облегчения симптомов, либо к излечению у пациента заболевания, нарушения или состояния.
"Терапевтическое количество/эффективное количество" означает достаточное количество соединения, которое становится доступным посредством соответствующего способа введения, для лечения пациента от нарушения, состояния или заболевания.
В некоторых вариантах осуществления введение можно осуществлять либо утром или вечером, непосредственно перед периодом сна, либо в любое время суток.
Однако в конкретных случаях могут быть необходимы различные дозирования; эти дозирования включены в объем настоящего изобретения. В соответствии с обычной практикой, дозирование, подходящее для каждого пациента, определяется врачом в соответствии с, например, способом введения, весом и реакцией пациента.
Список сокращений:
AE: Нежелательное явление
ALT: Аланинаминотрансфераза
CI: Доверительный интервал
HA: Гиалуроновая кислота
hsCRP: Высокочувствительный C-реактивный белок
IKKβ: Ингибитор ядерного фактора каппа-B киназы субъединицы бета
INR: Международное нормализованное отношение
MRI: Магнитно-резонансная томография
NF-κB: Ядерный фактор каппа-B
NSAID: Нестероидные противовоспалительные лекарственные средства
OA: Остеоартрит
SF: Синовиальная жидкость
TEAE: Нежелательное явление, возникшее в ходе лечения
WOMAC: Университеты Западного Онтарио и МакМастера
Фигуры
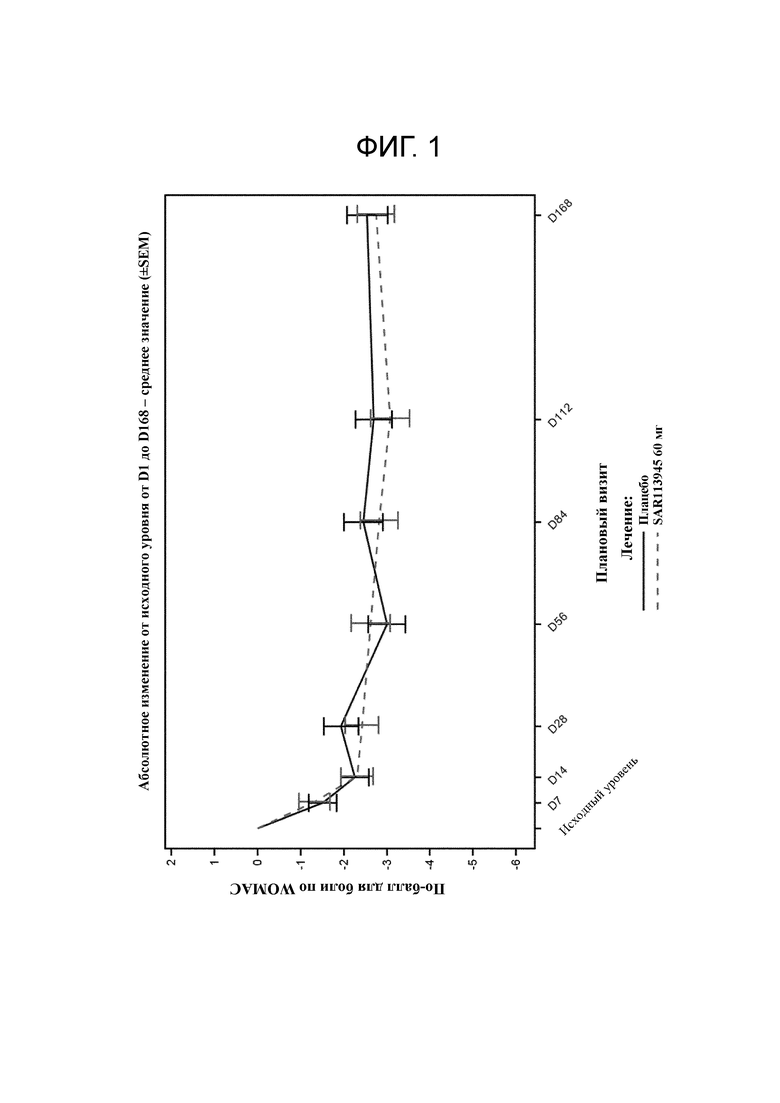
Фигура 1: Суммирующий график подшкалы для боли по WOMAC (абсолютное изменение от исходного уровня) популяции для оценки эффективности в зависимости от средства лечения.
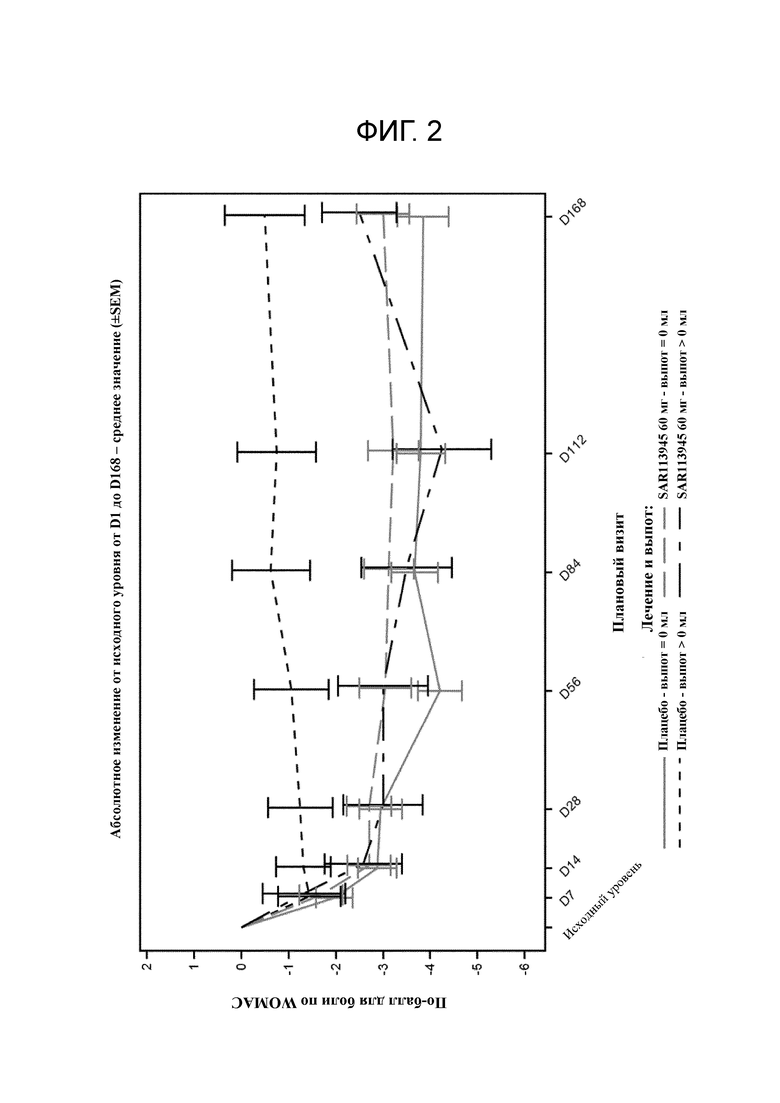
Фигура 2: Суммирующий график подшкалы для боли по WOMAC (абсолютное изменение от исходного уровня) популяции для оценки эффективности лечения в зависимости от средства лечения и наличия выпота на исходном уровне.
Настоящее изобретение проиллюстрировано клиническими данными, приведенными ниже.
Пример 1. Клиническое испытание для оценивания клинической эффективности однократной дозы соединения A в облегчении симптомов у пациентов с OA коленного сустава
Цель настоящего исследования заключалась в оценивании у пациентов с OA коленного сустава эффективности, безопасности и переносимости однократной дозы соединения A для внутрисуставного введения.
Оно представляло собой двуцентровое, двойное слепое, рандомизированное, плацебо-контролируемое исследование однократной дозы. После рассмотрения данных по безопасности до дня 28 из части 1 данного исследования, во второй части исследования оценивали эффективность однократной дозы соединения A, выбранного из максимальной введенной/переносимой дозы из части 1 (60 мг), в облегчении симптомов пациентов с OA коленного сустава.
Скрининг проводили в течение 28 дней после введения дозы. После введения однократной дозы исследуемого лекарственного препарата посредством внутрисуставной инъекции в день 1, каждый пациент оставался в исследовательском отделе в течение 4 часов после введения дозы и при условии, что не было сложности с переносимостью, пациентов выписывали и они периодически возвращались для амбулаторного приема. За каждым пациентом наблюдали до дня 168 (последний визит в исследовании); таким образом исследуемый период составлял 28 недель.
Соединение A предоставляли в виде лиофилизованного осадка (для ресуспендирования в воде для инъекции при внутрисуставном введении) во флаконах, содержащих 20, 40 и 80 мг всего активного соединения A. Плацебо представляло собой коммерчески доступный 0,9% солевой раствор для инъекции.
Безопасность оценивали с помощью отслеживания за нежелательными явлениями (AE), стандартных клинико-инструментальных оцениваний, физического обследования, оценивания основных показателей состояния организма и электрокардиограмы (ECG), оценивания местной переносимости в месте инъекции и оцениваний коленного сустава (выпот/ухудшение состояния выпота).
Применяли следующие подшкалы из индекса WOMAC для оценивания активности лекарственного средства при боли, скованности и физическом функционировании. Каждый показатель был оценен на основе симптомов пациента на протяжении последних 48 ч. посредством 5-бальной шкалы Лайкерта: отсутствует, слабый, средний, сильный или очень сильный.
1. Подшкала боли
Пять показателей:
i. Боль при ходьбе,
ii. Боль при подъеме по лестнице,
iii. Боль ночью,
iv. Боль при отдыхе,
v. Боль при весовой нагрузке.
2. Подшкала скованности
Два показателя:
i. Утренняя скованность,
ii. Скованность позже днем.
3. Подшкала физического функционирования
Семнадцать показателей:
i. Спуск по лестнице,
ii. Подъем по лестнице,
iii. Вставание из положения сидя,
iv. Стояние,
v. Наклон к полу,
vi. Ходьба по квартире,
vii. При посадке в машину и выходе из машины,
viii. Поход по магазинам,
ix. Надевание носков,
x. Вставание из кровати,
xi. Снятие носков,
xii. В положении лежа в кровати,
xiii. При усаживании в ванну и вылезании из ванной,
xiv. В положении сидя,
xv. При усаживании на унитаз или вставании с унитаза,
xvi. При тяжелых домашних обязанностях,
xvii. При легких домашних обязанностях.
Первичной конечной точкой являлась подшкала боли по WOMAC в день 56 для доказательства эффективности (изменение от исходного уровня).
Критериями включения являлись
- Диагноз первичного остеоартрита коленного сустава, исходя из следующего:
• рентгеновское или MRI доказательство, полученное на протяжении последних 6 месяцев, сужения суставной щели и образования остеофита - пациентам со значениями по классификации Келлгрена и Лоуренса II/III,
• общим баллом по WOMAC 24-72 и
• удовлетворяющие клинический и рентгенографический критерий Американской коллегии ревматологов для OA.
Критериями исключения являлись
• пациенты моложе 40 лет,
• женщины, способные к деторождению (для включения женщины должны быть либо стерилизованными более 3 месяцев, либо с постменопаузой на протяжении более 12 месяцев. Менопаузу определяют при возрасте женщин более 60 лет или если они являются аменорейными на протяжении по меньшей мере 2 лет с уровнем FSH в плазме крови >30 МЕ/л),
• любое неконтролируемое, хроническое состояние либо лабораторные данные, которые по мнению главного исследователя могут возможно подвергнуть пациента повышенному риску,
• аномальные параметры коагуляции: вне диапазона INR 0,85-1,14, активированное частичное тромбопластиновое время > 33 с, тромбоциты <140×109/л,
• от среднего до тяжелого нарушения функции почек - расчетный клиренс креатинина (Кокрофта-Голта) < 50 мл/мин.,
• изначальная болезнь печени и желчных путей и/или повышенная ALT > 2ULN,
• hsCRP > 2ULN,
• гемоглобин < 10 г/дл, уровень лейкоцитов в крови (WBC) < 3×109/л,
• вторичный остеоартрит: например, аутоиммунное заболевание, дисплазия суставов, асептический остеонекроз, акромегалия, заболевание Паджета, синдром Элерса-Данлоса, заболевание Гоше, синдром Стиклера, суставная инфекция, гемофилия, гемохромотоз, заболевание отложения пирофосфата кальция или нейропатическая артропатия, независимо от причины,
• присутствие местного кожного образования в пораженном коленном суставе,
• внутрисуставная инъекция в течение 3 месяцев,
• неспособность поддержания в течение по меньшей мере 2 недель до включения в исследование с помощью парацетамола или метамизола в качестве анальгетиков (после дня 84 пациентам можно давать нестероидное противовоспалительное лекарственное средство, если необходимо обеспечить лучший контроль симптомов OA),
• любой экспериментальный продукт в течение 3 месяцев или
• любой пациент, который будет маловероятно следовать требованиям исследования.
Анализ переменных эффективности
Для первичного анализа популяции для оценивания эффективности и для под-балла по WOMAC для боли на 56 день, разницы средних значений между видами лечения (соединение A минус плацебо) в изменении от исходного уровня и их односторонний 95% верхний предел доверительного интервала рассчитывали с применением линейных моделей фиксированных эффектов с фиксированными значениями для группы лечения и группы по полу, и с неструктурированной R дисперсионной/ковариционной матрицей по группе лечения для пациента в группе по полу, с применением SAS Proc Mixed®. В случае проблем со сходимостью были изучены дисперсионно-ковариационные структуры.
Описание переменной(переменных) эффективности
Признаки и симптомы OA измеряли с помощью индекса WOMAC в качестве стандартного инструмента.
Индекс WOMAC состоит из 24 вопросов в подшкалах из 3 параметров:
• Подшкала боли (5 показателей)
• Подшкала скованности (2 показателя)
• Подшкала физического функционирования (17 показателей)
Каждый показатель оценивали с помощью 5-бальной шкалы Лайкерта: отсутствует (=0), слабый (=1), средний (=2), сильный (=3) и очень сильный (=4)
Рассчитывали общий балл по WOMAC и под-балл по WOMAC для каждого параметра.
Анализы разницы средних значений баллов по WOMAC между видами лечения
Дополнительно к первичному анализу проводили дополнительный анализ над пациентами из популяции для оценивания эффективности и по меньшей мере с одним измерением под-балла по WOMAC после введения дозы с применением подхода переноса последнего документированного значения (LOCF) до дня 56.
Общий балл по WOMAC и под-балл по WOMAC для скованности и физического функционирования анализировали аналогичным образом, как и для первичного анализа под-балла по WOMAC для боли.
Рассчитывали разницу средних значений между видами лечения для групп с их односторонним 95% верхним пределом CI для всех других дней для всех баллов. Были представлены графики временной зависимости разницы средних значений между видами лечения с их односторонним 95% верхним пределом CI.
Для каждого балла по WOMAC (общий и под-баллы) была представлена величина эффекта, исходя из рассчитанной (в рамках модели с фиксированными эффектами) средней разницы между видами лечения в изменении от исходного уровня между группами (с активным веществом по сравнению с плацебо) в каждый день с их соответствующим 95% CI.
РЕЗУЛЬТАТЫ
Безопасность
Анализ безопасности был основан на анализе описательной статистики и отдельных данных для AE, клинических лабораторных данных, основных показателей состояния организма и параметров ECG. Нежелательные явления были закодированы в соответствии c Медицинским словарем терминологии регулятивной деятельности (версия 15.1) и количества субъектов с возникшими в ходе лечения AE (TEAE) группировали (по количеству и процентам). Анализы отклонений от нормы для клинических лабораторных данных, основных показателей состояния организма и данных ECG были основаны на определениях потенциально клинически значимых отклонений от нормы (PCSA; определения в соответствии с версией 2.0, датированной 14 сентября 2009). С помощью описательной статистики подытоживали местное раздражающее действие/переносимость в месте инъекции.
Однократные дозы соединения A в количестве 60 мг хорошо переносились пациентами с OA коленного сустава. Артралгия являлась наиболее частым TEAE, наблюдаемым после введения соединения A или плацебо, после чего следуют реакции в месте инъекции. В целом, не было различий между соединением A и плацебо (0,9% солевой раствор) для наблюдаемых TEAE и в их тяжести, в том числе местных реакций в месте инъекций.
Демографические характеристики на исходном уровне представлены в таблице 1. В целом, средний возраст и индекс массы тела (BMI) были подобными между двумя группами лечения и были типичными для данной популяции пациентов. Во всей популяции, женщин было незначительно больше, но отношение мужчины:женщины было сравнимым в 2 группах лечения; однако в группе плацебо с выпотом было больше мужчин.
Таблица 1. Демография и характеристики субъекта на исходном уровне в зависимости от средства лечения и наличия выпота (популяции для оценки безопасности)
(N=66)
(N=64)
выпота
(N=50)
выпотом
(N=16)
(N=66)
выпота
(N=52)
выпотом
(N=12)
(N=64)
белый
восточной расы
140,9
109,0
140,9
137,4
116,9
137,4
45,5
36,5
45,5
47,5
48,0
48,0
Эффективность
Первичной конечной точкой эффективности для исследования был эффект, исходя из подшкалы боли по WOMAC в день 56. Соединение A не обладало ни клинически значимым, ни статистически значимым эффектом либо на под-балл боли по WOMAC (фигура 1 и таблица 2), либо на другой под-балл по WOMAC или общий балл. Величины эффекта для под-баллов по WOMAC находились в диапазоне от 0,12 до -0,04 (отрицательное значение указывает на положительный эффект лекарственного средства по сравнению с плацебо).
Таблица 2. Обобщенные результаты статистического анализа абсолютных изменений от исходного уровня балла по WOMAC в день 56 (популяция для оценки эффективности)
60 мг
в сравнении с
плацебо
p-значение
(90% CI)
Тем не менее, проводили дополнительный анализ для данного исследования на тех пациентах, которые имели выпот, у которых удалили SF (находящуюся в диапазоне от 0,2 мл до 113 мл).
Проводили анализ пациентов с выпотом на исходном уровне (28 пациентов из всех 130 пациентов [21,5%]) (16 пациентам вводили плацебо и 12 пациентам вводили соединение A) и он показал неожиданно значительный эффект соединения A на балл для боли по WOMAC, общий балл по WOMAC и баллы для физического функционирования по WOMAC в день 56, соответствующий величинам эффекта 0,55, 0,66 и 0,66 соответственно (соответствующие p-значениям 0,07, 0,04 и 0,04 соответственно), см. фигуру 2 и таблицу 3.
Таблица 3. Обобщенные результаты статистического анализа абсолютного изменения от исходного уровня балла по WOMAC в день 56 в популяции для оценки эффективности для пациентов с выпотом
60 мг
в сравнении с
плацебо
p-значение
Пациента с выпотом определяют как с синовиальной жидкостью >0 мл и пациента без выпота определяют как с синовиальной жидкостью =0 мл.
Таким образом соединение A продемонстрировало значительную эффективность в подгруппе пациентов с OA, т. е. пациентов с наблюдаемым остеоартритом в коленном суставе и с выпотом; таким образом, его можно безопасно применять в лечении связанной с остеоартритом боли в данной подгруппе пациентов.
| название | год | авторы | номер документа |
|---|---|---|---|
| КРИСТАЛЛИЧЕСКИЕ ФОРМЫ [(S)-1-КАРБАМОИЛ-2-(ФЕНИЛПИРИМИДИН-2-ИЛАМИНО)ЭТИЛ]АМИДА 2-(2-МЕТИЛАМИНОПИРИМИДИН-4-ИЛ)-1Н-ИНДОЛ-5-КАРБОНОВОЙ КИСЛОТЫ | 2012 |
|
RU2631320C2 |
| Способ лечения остеоартрита коленного сустава | 2024 |
|
RU2822321C1 |
| ФАРМАЦЕВТИЧЕСКИЕ КОМПОЗИЦИИ, ПОДХОДЯЩИЕ ДЛЯ СУСТАВНОЙ ДОСТАВКИ, И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ СУСТАВНОЙ БОЛИ | 2019 |
|
RU2810788C2 |
| КОМБИНАЦИЯ ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА | 2010 |
|
RU2560844C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОСТЕОАРТРИТА, СОДЕРЖАЩАЯ КЛОДРОНОВУЮ КИСЛОТУ И ГИАЛУРОНОВУЮ КИСЛОТУ | 2006 |
|
RU2414908C2 |
| Гель для лечения остеоартрита коленного сустава | 2024 |
|
RU2833711C1 |
| Лечение остеоартрита | 2009 |
|
RU2712273C2 |
| СПОСОБ ЛЕЧЕНИЯ ХРОНИЧЕСКИХ ГОНАРТРИТОВ У БОЛЬНЫХ ОСТЕОАРТРОЗОМ | 2005 |
|
RU2293560C2 |
| Способ лечения остеоартрита коленного сустава | 2019 |
|
RU2717345C1 |
| КОМПОЗИЦИИ НА ОСНОВЕ ДИКЛОФЕНАКА ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ И СВЯЗАННЫЕ С НИМИ СПОСОБЫ | 2021 |
|
RU2830586C1 |
Изобретение относится к применению [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амид 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты для лечения боли, связанной с остеоартритом в коленном суставе, в том числе у пациентов с выпотом и синовитом. Указанное соединение используют в качестве активного компонента для фармацевтической композиции, выполненной в виде однократной дозы для внутрисуставного введения. При этом доза для внутрисуставного введения составляет от 15 до 60 мг, преимущественно 60 мг. Изобретение также относится к фармацевтической композиции для лечения боли, связанной с остеоартритом в коленном суставе, в том числе у пациентов с выпотом и синовитом. Композиция содержит эффективное количество [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амида 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты в качестве активного ингредиента и фармацевтически приемлемые вспомогательные средства. 4 н. и 9 з.п. ф-лы, 2 ил., 3 табл., 1 пр.
1. Применение [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амида 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом.
2. Применение по п. 1 для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и синовитом.
3. Применение [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амида 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты в качестве активного компонента для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом.
4. Применение по п. 3 для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и синовитом.
5. Применение по любому из пп. 3 и 4, где активный компонент используют для фармацевтической композиции, выполненной в виде однократной дозы для внутрисуставного введения.
6. Применение по п. 5, где однократная доза для внутрисуставного введения составляет от 15 до 60 мг.
7. Применение по п. 6, где однократная доза для внутрисуставного введения составляет 60 мг.
8. Фармацевтическая композиция для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом, содержащая эффективное количество [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амида 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты в качестве активного ингредиента и фармацевтически приемлемые вспомогательные средства.
9. Фармацевтическая композиция по п. 8 для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и синовитом.
10. Фармацевтическая композиция по любому из пп. 8 или 9, где эффективное количество составляет от 15 до 60 мг.
11. Фармацевтическая композиция по п. 10, где эффективное количество составляет 60 мг.
12. Изделие для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом, содержащее
- упаковочный материал;
- [(S)-1-карбамоил-2-(фенилпиримидин-2-иламино)этил]амид 2-(2-метиламинопиримидин-4-ил)-1H-индол-5-карбоновой кислоты в качестве активного ингредиента; и
- этикетку или листок-вкладыш, помещенные в упаковочный материал.
13. Изделие по п. 12 для лечения боли, связанной с остеоартритом в коленном суставе, у пациентов с выпотом и синовитом.
| WO 2004022553 А1, 18.03.2004 & RU 2318820 C2, 10.03.2008 | |||
| WO 2013083553 A1, 13.06.2013 & US 9067918 B2, 30.06.2015 | |||
| Johanne Martel-Pelletier, et al | |||
| Future therapeutics for osteoarthritis, BONE, 2012, vol.51, no.2, pp.297-311 (REVIEW) | |||
| Флюс для пайки алюминия | 1957 |
|
SU113945A1 |
| Машина для добывания торфа и т.п. | 1922 |
|
SU22A1 |
| Эциклопедия лекарств, ежегодный сборник, Москва, "РЛС-2007", 2006, стр | |||
| Мяльно-трепальный станок | 1923 |
|
SU828A1 |
Авторы
Даты
2019-05-07—Публикация
2015-06-30—Подача