Изобретение относится к фармацевтической промышленности и представляет собой комбинированную фармацевтическую композицию антисептического действия для лечения инфицированных ран различного генеза.
Проблема заживления гнойных ран относится к серьезным, актуальным и нерешенным проблемам в медицине. Число послеоперационных гнойных осложнений составляет примерно 30% после плановых и экстренных оперативных вмешательств и не имеет тенденции к снижению. Одним из направлений поиска эффективного способа лечения инфицированных ран стала разработка местных средств мультифункционального действия, содержащих в своем составе несколько лекарственных компонентов, обладающих комплексной терапевтической активностью в отношении основных субстратов сложной, длительно незаживающей раны. В свете вышесказанного является актуальным и необходимым разработка лекарственного средства, способного очистить раневую поверхность от гнойно-некротических масс, обеспечить антимикробное действие, максимально снизить болевой синдром и, в конечном итоге, осуществить заживление раны в максимально короткие сроки.
Имеется патент №2323748 (от 21.02.2006) «Медицинская повязка, содержащая комплекс ферментов из гепатопакреаса краба, и способ ее получения». Повязка состоит из целлюлозы, модифицированной методом перйодатного окисления и обработанной кислоторастворимым хитозаном, с иммобилизованным протеолитическим комплексом на основе гепатопанкреаса краба.
Известен «Материал, обладающий биологической активностью, способ его получения и терапевтическое средство на его основе» (патент №2357753 от 24.03.2005), который представляет собой модифицированную целлюлозу с соиммобилизованными на ней тремя лекарственными средствами (трипсин, лизоцим, инсулин).
Известен «Способ получения аппликации атравматической одноразовой», в котором раскрывается способ получения раневого покрытия, содержащего сухую гелевую пластину на основе полиакриламидного геля (ПААГ) с гемостатическим порошком (патент №2448738 от 24.11.2009).
Прямых аналогов предлагаемому лекарственному средству авторам неизвестно. К косвенным аналогам, т.е. аналогам по назначению, можно отнести мазь «Левомеколь», порошок «Банеоцин», мазь и гель «Солкосерил». Однако перечисленные выше препараты не содержат протеолитиков, без которых невозможно полноценное очищение раны от нежизнеспособных тканей и экссудата, следовательно, нет благоприятных условий для образования грануляций и регенерации. Также отсутствуют и анестетики. Таким образом, новое ранозаживляющее средство существенно дополнит сегодняшний арсенал средств по уходу за сложными ранами.
Как уже было отмечено, на современном фармацевтическом рынке России существуют препараты, созданные для лечения и заживления инфицированных ран, в том числе представляющие собой комбинации.
Например, в патенте RU2115418 («Комбинированное химиотерапевтическое средство "бутол" для лечения местной раневой инфекции и воспалительных заболеваний» от 23.01.98 г. ) описано комбинированное химиотерапевтическое средство для лечения местной раневой инфекции и воспалительных заболеваний, содержащее антисептик -хинозол, отличающееся тем, что дополнительно содержит антибиотик -стрептомицин. Однако данная фармацевтическая композиция выполнена в виде раствора, что заметно отражается на пролонгированности действия композиции, а также ее биодоступности. Кроме того, средство не соответствует описанным выше критериям.
Другой препарат, активно используемый в лечении инфицированных ран, - «Левомеколь» (Производитель ОАО «Нижфарм», Россия). Этот комбинированный препарат для местного применения оказывает противовоспалительное и противомикробное действие, активен в отношении грамположительных и грамотрицательных микроорганизмов (стафилококков, синегнойных и кишечных палочек). Легко проникает вглубь тканей без повреждения биологических мембран, стимулирует процессы регенерации. В присутствии гноя и некротических масс антибактериальное действие сохраняется. Однако спектр действия на патогенную микрофлору входящих в состав препарата активных субстанций недостаточно широк. При применении мази «Левомеколь» возможны аллергические реакции в случаях гиперчувствительности к компонентам препарата.
Известные из уровня техники средства не лишены недостатков и имеют довольно высокую адгезию к раневой поверхности, что в отдельных случаях приводит к травмированию поврежденной поверхности, кровотечениям и болевым ощущениям.
Целью настоящего изобретения является устранение указанных недостатков.
Заявленная композиция с комплексной терапевтической активностью на основе производных глюкозамина и акриловых полимеров для лечения инфицированных ран различного генеза представляет собой полупрозрачный гель на основе оксипропилметилцеллюлозы и полиакриламида с включением в качестве фармацевтических агентов хитозана, химопсина, мирамистина и лидокаина гидрохлорида. Механизм действия разработанного лекарственного средства многофункционален и включает следующие терапевтические эффекты: ферментативное биохимическое очищение раны за счет лизиса денатурированных белков без повреждения здоровых тканей, косвенное антимикробное действие (химопсин) за счет снижения количества патогенных микроорганизмов в связи с лизисом их питательной среды; полноценное антимикробное действие благодаря мирамистину и снятие болевого синдрома не только за счет охлаждающего эффекта геля, но и за счет включения в состав препарата лидокаина.
Терапевтический эффект достигается благодаря сочетанию различных видов биологической активности составных компонентов геля. Каждое лекарственное и биологически активное вещество вносит свой вклад в ускорение процесса очищения и заживления ран:
- Мирамистин обладает выраженным бактерицидным действием в отношении аэробных и анаэробных бактерий, грамположительных и грамотрицательных организмов, как в виде монокультур, так и в виде ассоциаций, включая госпитальные штаммы, обладающие полирезистентностью к антибиотикам. Молекулы препарата воздействуют на наружную оболочку микробной клетки, что приводит к ее разрушению и гибели.
- Компоненты химопсина расщепляют различные пептидные связи в белковой молекуле: трипсин гидролизует пептидные связи, содержащие остатки аргинина и лизина; химотрипсин расщепляет пептидные связи с остатками ароматических аминокислот - тирозина и триптофана. Химопсин восстанавливает микроциркуляцию в стенках раны, улучшает обменные процессы, что клинически проявляется уменьшением местного воспаления.
- Хитозан является носителем ферментного комплекса и мирамистина, обеспечивает пролонгированное терапевтическое действие фермента и антисептика, обладает бактерицидными свойствами и оказывает ранозаживляющее действие.
- Лидокаина гидрохлорид - местный анестетик, применяется для проводниковой, инфильтрационной, терминальной анестезии. Механизм местноанестезирующего действия проявляется в угнетении нервной проводимости за счет блокады каналов натрия в нервных волокнах и окончаниях.
Таким образом, фармацевтическая композиция на основе двух субстанций для лечения инфицированных ран обладает четырьмя видами фармакологического эффекта - некролитическим, антимикробным, ранозаживляющим и обезболивающим. Гелевая форма препарата обладает косвенным обезболивающим эффектом благодаря охлаждающему эффекту при апплицировании на поврежденную поверхность.
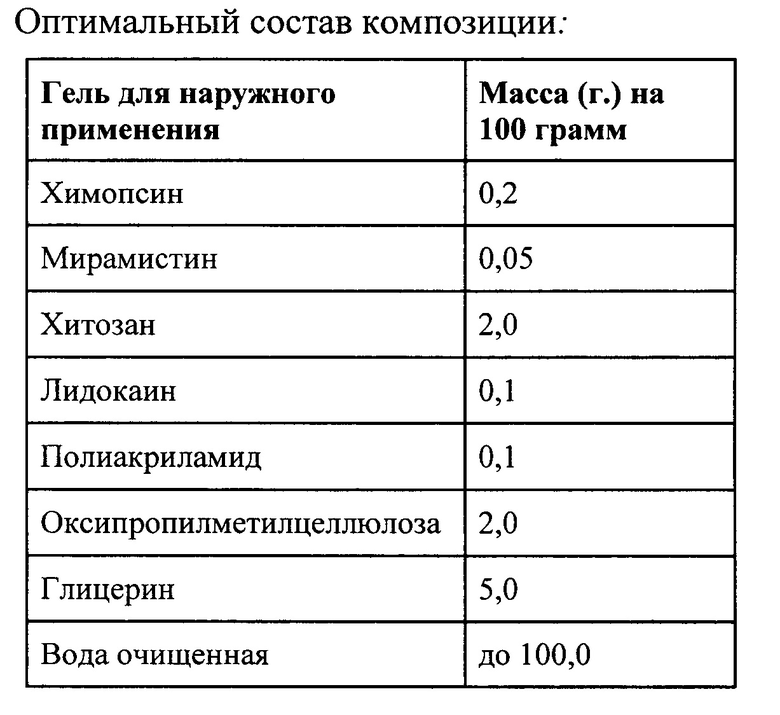
В случае разработки наружного лекарственного средства для лечения ран важную роль играет выбор, как самой лекарственной формы, так и формирующих ее вспомогательных веществ, исходя из конечной цели -максимальной биодоступности биологически активного ингредиента в лекарственном средстве при нанесении на поврежденную поверхность - раневой дефект.
Средства местного лечения ран должны обладать комплексными многоплановыми эффектами, которые реализуются как за счет активных компонентов (действующего начала), а также за счет основы препарата.
Учитывая особенности места введения (раневая поверхность), к предполагаемому комплексу предъявляются следующие требования: биосовместимость с тканями человека, отсутствие аллергических реакций, пирогенного и токсического действия на здоровые ткани.
Исходя из специфики течения раневого процесса, состава лекарственных препаратов, применяемых на первой стадии раневого процесса - стадии воспаления, можно предполагать, что способствовать очищению и ускоренному заживлению раны будут гели комплексного состава, обладающие протеолитическим, противовоспалительным, антимикробным, обезболивающим, ранозаживляющим действием.
Обобщая данные о средствах, применяемых для лечения инфицированных ран, в качестве основных компонентов для разработки ранозаживляющего геля выбраны следующие вещества: протеолитик химопсин в комплексе с хитозаном, антисептик мирамистин в комплексе с хитозаном, анестетик лидокаин и вспомогательные вещества -гидроксипропилметилцелюлоза, полиакриламид, глицерин.
Влажная воздушная среда оптимальна для течения процессов репаративной регенерации покровных тканей человека и животных. Введение в состав гелевой основы специфических лекарственных форм обеспечивает комплексное и многоплановое воздействие на раневой процесс, при этом заживление проходит в условиях умеренно-влажной воздушной среды, благоприятной для репарации.
Подробное описание изобретения
Далее изобретение описывается примерами его осуществления.
Пример 1. Технология получения геля ранозаживляющего
На аналитических весах взвешивают 16,0 г лиофилизированного порошка субстанции ферментного комплекса хитозан-химопсин (КХХ); 14,0 г лиофилизированного порошка субстанции комплекса хитозан-мирамистин (КХМ); 1,0 г лидокаина; 20,0 г гидроксипропилметилцеллюлозы (ГГТМЦ); 1,0 г полиакриламида (ПАА); отмеривают мерным цилиндром 50,0 мл (62,5 г) глицерина; относительная плотность при 20° С 1,25 г/см3.
Изготовление геля начинают с подготовки лекарственных веществ и основы. В операцию подготовки основы входит процесс растворения и набухания.
В производственную емкость отмеривают рассчитанное количество воды очищенной, предварительно подогретой до 60-65°С. Порошок ГПМЦ в количестве, взвешенном на аналитических весах, наслаивают на поверхность воды и оставляют на 2-3 часа для набухания и исчезновения комочков, затем систему перемешивают с помощью пропеллерной мешалки до получения гомогенного геля. После этого при постоянном перемешивании добавляют рассчитанное количество полиакриламида с предварительно растворенным в нем анестетиком лидокаином. Введение еще одного гелеобразующего агента приводит к загущению системы и повышает уровень вязкости.
Фармацевтические субстанции КХХ и КХМ на основе кислоторастворимого хитозана получают заранее.
С этой целью готовят 1% раствор хитозана с добавлением уксусной кислоты, раствор оставляют для набухания и структурирования на одни сутки. Затем добавляют определенное количество химопсина, из расчета 2,0 г на 100 г препарата. В целях включения протеолитика в структуру хитозана гелеобразный раствор оставляют на два часа при комнатной температуре. Аналогично готовят субстанцию КХМ, добавляя в раствор хитозана антисептик мирамистин, из расчета 0,05 г на 100 г препарата. Раствор оставляют на два часа при комнатной температуре.
Приготовленные гелеобразные растворы подвергают лиофильной сушке. Лиофилизация гелеобразных растворов ферментов и антисептиков в хитозане проводится в замороженном состоянии под вакуумом, при этом вода удаляется из замороженной субстанции путем сублимации льда, т.е. превращения его в пар, минуя жидкую фазу. Водяной пар откачивается из рабочей камеры вакуумным насосом и конденсируется на змеевиках низкотемпературного конденсора. Высушенный материал сохраняет свою структурную целостность и биологическую активность в большей мере, чем пленки, высушенные на воздухе. При увлажнении материал восстанавливает свои первоначальные свойства. Кроме перечисленных достоинств данного метода, имеет место удаление избыточного количества уксусной кислоты, используемой для растворения хитозана. Лиофилизаты готовят заранее.
Лиофилизаты КХХ и КХМ в необходимых количествах, предварительно растворенные в небольшом количестве воды, добавляют в основу. Ингредиенты тщательно гомогенизируют с помощью высокоскоростной мешалки.
Полученный гель оставляют до полного завершения структурообразования в течение 24 часов для удаления пузырьков воздуха (дегазация).
Пример 2
В тестах in vivo на модели плоской гнойной раны мирамистин активен в отношении различных патогенных микроорганизмов. Уже на третий день обсемененность раны в исследуемых группах существенно отставала от группы контроля.
В тестах in vitro мирамистин обладает выраженным биоцидными действием, как против грамположительных, так и грамотрицательных бактерий, а также грибов - возбудителей инфекций.
Хитозан способствует более быстрому заживлению ран по сравнению с контролем. В тестах in vitro хитозан способствует пролонгированному действию химопсина и стабилизирует эго за счет образования комплекса с образованием нековалентных связей.
Результаты исследования кинетики инактивации нативного фермента (инактивация проводилась в условиях отсутствия автолиза) и системы фермент-хитозан при различных температурах показывают, что хитозан способен стабилизировать фермент, о чем свидетельствуют полученные значения эффективных констант скорости инактивации систем (0 в зависимости от температуры от 1.2 до 2.0). Это может происходить, в основном, за счет многоточечного связывания молекулы белка с молекулой полисахарида, которое не затрагивает активный центр фермента
Лидокаин в концентрации, используемой в исследуемом лекарственном средстве, оказывает выраженное антиноцицептивное действие в тестах горячая пластина и Tail Flick.
Пример 3
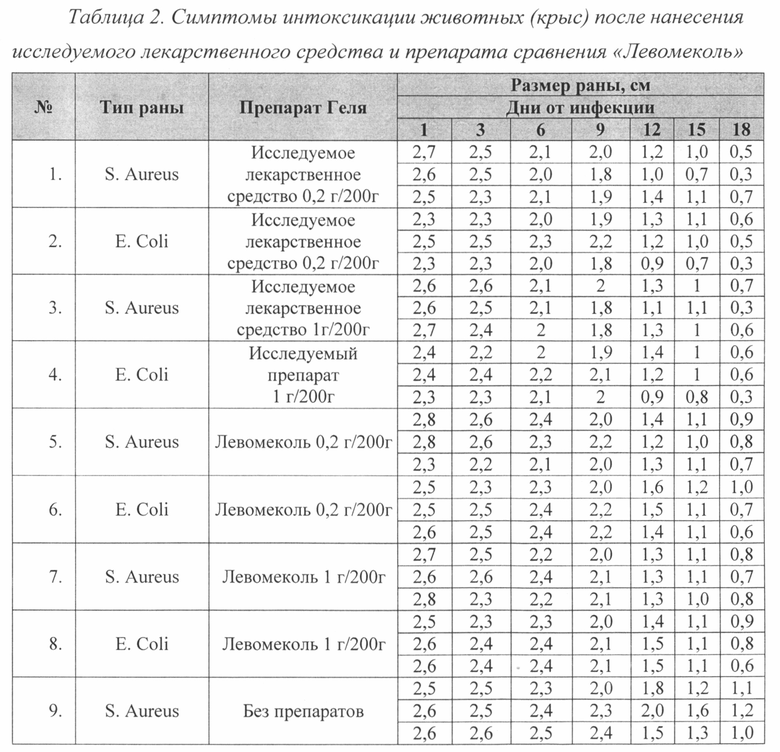
Животным под наркозом в стерильных условиях моделируют гнойную рану по методике П.И. Толстых (1976). Для этого на выбритом от шерсти участке спины, обработанном антисептиком, иссекают кожу с подкожной клетчаткой диаметром 25 мм. В полученную рану вводят марлевый шарик, содержащий 1,2×109 микробных тел суточной культуры S. Aureus или 2,6x109 Е. Coli, после чего рану ушивают. На следующие сутки (через 24 часа) после моделирования у всех животных формируется абсцесс со всеми характерными признаками воспаления. После снятия швов верхний лоскут кожи снимают, марлевый тампон удаляют, эвакуируют гной. Площадь исходной раны определяют путем нанесения контура на прозрачную пленку, затем выполняют обработку раны исследуемым лекарственным средством или препаратом сравнения «Левомеколь». Для изучения ранозаживляющей способности лекарственное средство и контрольные образцы наносят через 24 часа после моделирования гнойной раны. Препараты наносят в течение 18 дней. В процессе лечения раз в три дня измеряют диаметр раны.
Течение раневого процесса у экспериментальных животных оценивают планиметрическим методом.
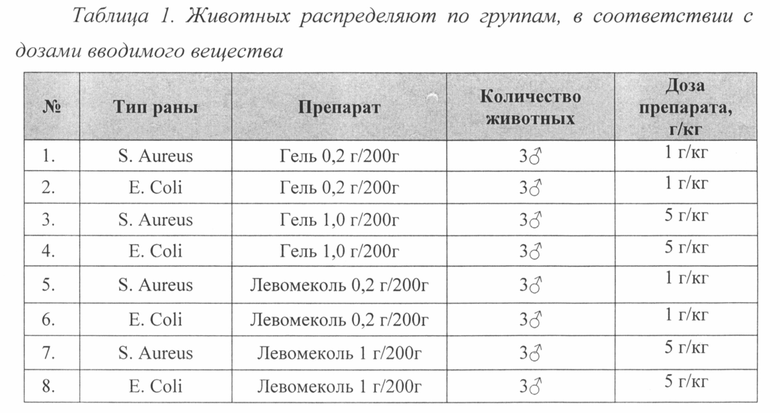
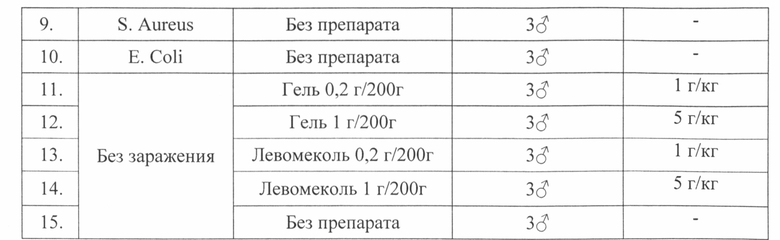
После моделирования гнойной раны крысы во всех группах исследуемого лекарственного средства, препарата сравнения «Левомеколь» и раны без препаратов были вялыми в первые два дня исследования.
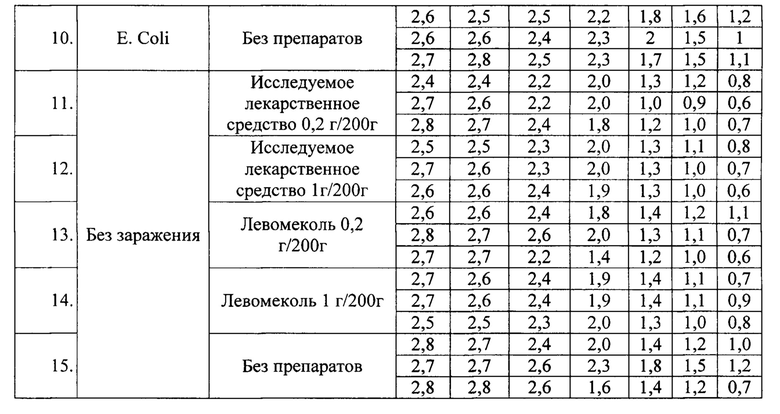
Пример 4
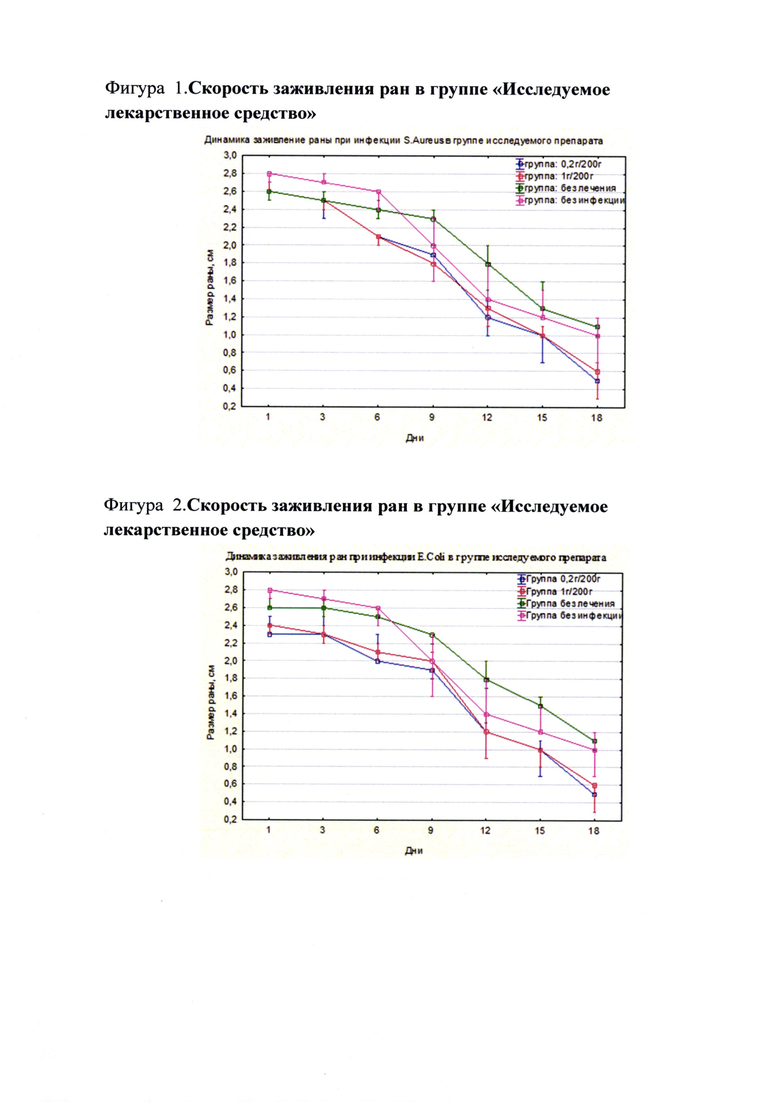
Различий в скорости заживления ран между дозами 0,2 г/200 г жив. и 1 г/200 г жив. как в группе «Исследуемое лекарственное средство», так и в группе «Левомеколь» не было. То есть увеличение дозы препаратов более 0,2 г на 200 г жив. не оказывало большего заживляющего эффекта как при инфцировании S. Aureus, так и при E.Coli (Фиг. 1, 2).
При инфицировании раны культурой S. Aureus скорость заживления в группе с исследуемым лекарственным средством выше, чем в группе с препаратом сравнения «Левомеколь» (Фиг. 3).
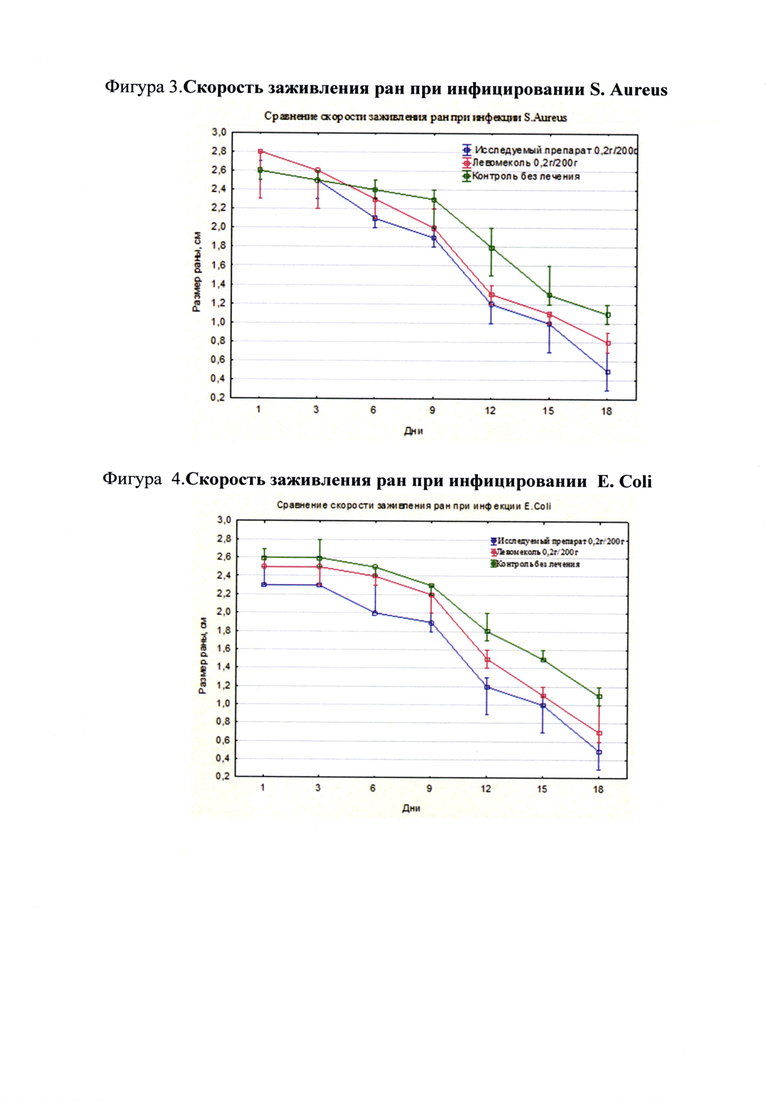
При инфицировании раны культурой E.Coli скорость заживления в группе с исследуемым лекарственным средством выше, чем в группе с препаратом сравнения «Левомеколь» (Фиг. 4).
Полученные данные демонстрируют специфическое действие лекарственного средства с комплексной терапевтической активностью на основе производных глюкозамина и акриловых полимеров для лечения инфицированных ран различного генеза на модели плоской раны. При инфицировании S. Aureus и E.Coli исследуемое лекарственное средство показывает лучший результат в заживлении ран по сравнению с препаратом сравнения.
Исследуемая лекарственная форма оказывает широкий спектр антимикробного действия, способствует очищению раны от некротических тканей и струпа, оказывает эффективное ранозаживляющее и антиноцицептивное действие. Благодаря оригинальной композиции общая эффективность исследуемого лекарственного средства выше, чем эффективность каждого компонента по отдельности.
Таким образом, в результате исследований была показана высокая эффективность предлагаемой фармацевтической композиции с комплексной терапевтической активностью. Внедрение в практику разрабатываемого лекарственного средства на основе производных глюкозамина и акриловых полимеров позволит оптимизировать результаты лечения пациентов с инфицированными ранами различной этиологии, значительно сократить сроки лечения, минимизировать лекарственную нагрузку, а также сократить общие затраты государства, что имеет большую социальную значимость.
| название | год | авторы | номер документа |
|---|---|---|---|
| Фармацевтическая субстанция для лечения инфицированных ран различного генеза | 2018 |
|
RU2697869C1 |
| Фармацевтическая субстанция для лечения инфицированных ран различного генеза | 2018 |
|
RU2687102C1 |
| Ранозаживляющее средство | 2017 |
|
RU2644255C1 |
| Противовоспалительная мазь для лечения ран и способ ее получения | 2024 |
|
RU2834852C1 |
| СРЕДСТВО ДЛЯ ЛЕЧЕНИЯ РАН, ОЖОГОВ И ИНФЕКЦИОННО-ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ КОЖИ, ПРИДАТКОВ КОЖИ И СЛИЗИСТЫХ ОБОЛОЧЕК | 2010 |
|
RU2452475C2 |
| ФАРМАЦЕВТИЧЕСКАЯ АНТИБАКТЕРИАЛЬНАЯ КОМПОЗИЦИЯ ДЛЯ МЕСТНОГО ПРИМЕНЕНИЯ НА ОСНОВЕ АКТИВНЫХ БИОМЕТАЛЛОКОМПЛЕКСОВ | 2011 |
|
RU2489147C2 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ НА ОСНОВЕ КОЛЛАГЕНАЗЫ МИКРОБНОГО ПРОИСХОЖДЕНИЯ | 2000 |
|
RU2166950C1 |
| Фармацевтическая комбинированная композиция для местного и наружного применения на основе диоксидина | 2016 |
|
RU2667974C2 |
| Мазевая сетчатая атравматическая повязка | 2022 |
|
RU2784202C1 |
| Фармацевтическая комбинированная композиция для лечения гнойных ран на основе фторхинолонов (варианты) | 2016 |
|
RU2682171C2 |
Изобретение относится к фармацевтической промышленности и представляет собой комбинированную фармацевтическую композицию антисептического действия для лечения инфицированных ран различного генеза. Отличается тем, что представляет собой фармацевтическую композицию в виде комбинации, где в качестве активных фармацевтических агентов выступают хитозан, химопсин, мирамистин и лидокаина гидрохлорид. Изобретение обеспечивает повышение терапевтического эффекта за счет расширения спектра действия препарата, включающего комплексное воздействие на очаг повреждения, а также за счет пролонгированного лечебного действия препарата. 4 пр., 2 табл., 4 ил.
Комбинированная фармацевтическая композиция в форме геля антисептического действия для лечения инфицированных ран различного генеза, включающая в качестве активных фармацевтических агентов хитозан, химопсин, мирамистин и лидокаина гидрохлорид при следующем соотношении компонентов, г:
| RU 2014113441 A, 27.10.2015 | |||
| КОМБИНИРОВАННОЕ ХИМИОТЕРАПЕВТИЧЕСКОЕ СРЕДСТВО "БУТОЛ" ДЛЯ ЛЕЧЕНИЯ МЕСТНОЙ РАНЕВОЙ ИНФЕКЦИИ И ВОСПАЛИТЕЛЬНЫХ ЗАБОЛЕВАНИЙ | 1998 |
|
RU2115418C1 |
| МАЗЬ ДЛЯ ЛЕЧЕНИЯ ИНФИЦИРОВАННЫХ РАН "АРГОЛОН" | 2008 |
|
RU2397752C2 |
| WO 2008094002 A1, 07.08.2008. | |||
Авторы
Даты
2019-06-11—Публикация
2018-04-28—Подача