Настоящее изобретение относится к микобактериальным полинуклеотидам и полипептидам, к их фрагментам или вариантам, к антителам, которые связываются с ними, к векторам и микробным носителям, к терапевтическим композициям, таким как вакцины против микобактериальных инфекций, и к композициям и способам для определения микобактериальной инфекции.
Микроорганизмы, такие как виды Salmonella, Yersinia, Shigella, Campylobacter, Chlamydia и Mycobacterium, способны вызывать внутриклеточные инфекции. Такие инфекции могут быть исключительно внутриклеточными, или могут содержать и внутриклеточные и внеклеточные компоненты. Обычно такие микроорганизмы свободно не циркулируют в организме (например, в кровотоке) и часто не отвечают на схемы лечения лекарственными средствами.
Трудности, ассоциированные с лечением внутриклеточных инфекций, усугубляются развитием множества микроорганизмов, резистентных к лекарственным средствам. Терапия вакцинами не доказана эффективной против внутриклеточных микроорганизмов, из-за трудностей в способности доступа к патогену защиты организма хозяина.
Mycobacterium tuberculosis (MTB) и тесно связанные виды формируют небольшую группу микобактерий, известных как комплекс микобактерий туберкулеза (КМТ) (MTC)). Указанная группа включает пять отдельных видов: M. tuberculosis, M. microti, M. bovis, M. caneti, и M. africanum. M. avium subsp. paratuberculosis вызывает болезнь Джонса у жвачных животных, M. bovis вызывает туберкулез у скота, M. avium и M. intracellulare вызывают туберкулез у иммуноскомпроментированных пациентов (например, пациентов со СПИД и пациентов после трансплантации костного мозга), и M. leprae вызывает проказу у человека. Другим важным видом микобактерий является M. vaccae.
В качестве этиологического агента инфекции туберкулеза, Mycobacterium tuberculosis (M. tuberculosis) является ведущей причиной смерти от бактериальных заболеваний во всем мире - латентная инфекция поражает до одной трети мировой популяции. Всемирная Организация Здравоохранения (ВОЗ) оценивает, что более восьми миллионов новых случаев ТБ и более одного миллиона смертей, имеют место в целом каждый год. Наибольшее количество новых случаев ТБ в 2005 развилось в Юго-Восточной Азии (34% характерных случаев в целом), и оцененная частота в области Африки, расположенной к югу от Сахары, составляет около 350 случаев на 100000 популяции. Однако инфекция ТБ не ограничивается развивающимся миром: в Великобритании наблюдают возвращение туберкулеза с поздних 1980х и в настоящее время более 8000 новых случаев каждый год - частота 14,0 на 100000 популяции. Около 40% таких новых случаев развивается в регионе Лондона, где частота инфекции составляет 44,8 на 100000 популяции.
Оптимальное ведение пациента требует раннего начала лекарственной терапии и изоляции инфицированных пациентов насколько возможно скоро. При отсутствии лечения каждый пациент с активным заболеванием ТБ заразит в среднем от 10 до 15 человек каждый год. Инфекция ТБ может обычно быть излечена посредством 6 месячного курса антибиотиков; однако, приверженность пациентов к длительному лекарственному лечению варьируется, пациенты часто прекращают лечение при облегчении симптомов. Незавершение лечения может обеспечить развитие мультирезистентных микробактерий.
Термин ʹлатентное состояниеʹ является синонимом ʹперсистированияʹ, и описывает обратимое состояние низкой метаболической активности, при котором микобактериальные клетки могут выживать в течение длительных периодов с ограниченным или отсутствием деления клеток. В течение латентного состояния (т.е. латентной инфекции), клинические симптомы, ассоциированные с микобактериальной инфекцией, не становятся манифестными. Однако, реактивация латентных микобактерий может быть индуцирована стимулами окружающей среды. В течение активной инфекции микобактерии демонстрируют высокую метаболическую активность и быстро реплицируются, приводя к развитию активной инфекции с клиническими симптомами.
Исследования in vitro продемонстрировали, что микобактерии, такие как M. tuberculosis, способны адаптироваться и выживать в условиях, лишенных питательных веществ и кислорода, и могут расти в диапазоне доступности питательных веществ и напряжения кислорода. Адаптация к истощению углерода и/или низкому напряжению растворенного кислорода in vitro запускает переход в нереплицирующееся персистирующее состояние, которое может быть аналогичным латентному состоянию in vivo. Внутриклеточная выживаемость и размножение, вероятно, являются главными поддерживающими факторами прогрессирования микобактериальной инфекции. Присутствие большого резервуара бессимптомных носителей, латентно инфицированных микобактериями, является основной проблемой для контроля за микобактериальными инфекциями, особенно инфекциями M. tuberculosis. Кроме того, обычные методы определения латентной микобактериальной инфекции посредством кожных тестов могут быть скомпрометированы вакцинацией БЦЖ и воздействием микобактерий окружающей среды.
Эффективность вакцинальной профилактики против M. tuberculosis широко варьирует. Существующая вакцина M. tuberculosis, БЦЖ, является аттенуированным штаммом M. bovis. Она является эффективной против тяжелых осложнений ТБ у детей, но существенно варьируется по эффективности у взрослых в различных странах, особенно в этнических группах. Вакцинацию БЦЖ используют для профилактики туберкулезного менингита, и она помогает предотвратить распространение M. tuberculosis во внелегочные участки, но не предотвращает инфицирования. Ограниченная эффективность БЦЖ и глобальная распространенность ТБ привела к международным попыткам создать новые, более эффективные вакцины. Это, в свою очередь, требует идентификации новых вакцин кандидатов. В свете увеличения угрозы и глобальной частоты микобактериальной инфекции, новые стратегии требуются для более эффективной профилактики, лечения и диагностики микобактериальной инфекции.
Изобретение относится к антигенной композиции, включающей микобактериальный антиген, где указанный антиген включает:
(i) последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности аминокислот относительно последовательности аминокислот полипептида, выбираемой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16 и 18, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот; или
(ii) полинуклеотидную последовательность, кодирующую последовательность полипептида в соответствии с (i); или полинуклеотидную последовательность, имеющую по меньшей мере 70% идентичность последовательности нуклеотидов относительно последовательности нуклеиновой кислоты полинуклеотида, выбираемой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15 и 17, или ее фрагмента, имеющего по меньшей мере 150 ее последовательных нуклеотидов.
В рамках изобретения, термин ʺмикобактериальныйʺ или ʺмикобактерияʺ охватывает виды M. phlei, M. smegmatis, M. africanum, M. caneti, M. fortuitum, M. marinum, M. ulcerans, M. tuberculosis, M. bovis, M. microti, M. avium, M. paratuberculosis, M. leprae, M. lepraemurium, M. intracellulare, M. scrofulaceum, M. xenopi, M. genavense, M. kansasii, M. simiae, M. szulgai, M. haemophilum, M. asiaticum, M. malmoense, M. vaccae, M. caneti, и M. shimoidei. Особенный интерес представляют члены КМТ, такие как M. tuberculosis.
Термин антиген обозначает любое вещество, которое может быть распознано иммунной системой и/или которое стимулирует иммунный ответ. Например, антиген может стимулировать клеточный иммунный ответ и/или может стимулировать образование антител.
В одном варианте осуществления изобретения микобактериальный антиген по изобретению обеспечивает клеточный ответ на инфекцию, включающий иммунные клетки, такие как T клетки (CD4+ и/или CD8+ T клетки), и/или способность отвечать на цитокины Th1-типа, такие как IFN-γ. В одном варианте осуществления изобретения микобактериальный антиген индуцирует IFN-γ-секретирующие клетки (например, преимущественно CD4+ T клетки). В таком отношении последние исследования позволяют предположить, что ответы иммунных клеток (особенно Т клеточные иммунные ответы в, например, легких) могут быть критическими для защиты от легочного микобактериального поражения.
В одном варианте осуществления изобретения микобактериальный антиген по изобретению обеспечивает защиту (такую как длительная защита) против поражения микобактериями, такими как M. tuberculosis. В качестве примера, микобактериальный антиген по изобретению может индуцировать ʹT клетки памятиʹ, которые могут продолжать стимулировать протективный иммунитет длительно (например, десятилетия). Иммунные ответы памяти обусловлены реактивацией длительно живущих, антиген-специфических T лимфоцитов, которые развиваются непосредственно из дифференцированных эффекторных T клеток и персистируют в состоянии покоя. Т клетки памяти являются гетерогенными; идентифицированы по меньшей мере две подгруппы, имеющие различную миграционную способность и эффекторную функцию. T клетки памяти первой подгруппы известны как ʹэффекторные Т клетки памятиʹ (TEM), так как они имеют сходство с эффекторными Т клетками, образующимися при первичном ответе, в том, что они не имеют рецепторов наведения на лимфатические узлы для миграции в воспаленные ткани. При повторной встрече с антигеном, TEM быстро продуцируют IFN-γ или IL-4, или высвобождают ранее хранящийся перфорин. Т клетки памяти второй подгруппы (известные как ʹцентральные клетки памятиʹ (TCM)) экспрессируют L-селектин и CCR7 и не имеют немедленной эффекторной функции. TCM имеют низкий порог активации и пролиферируют и дифференцируются в эффекторы при рестимуляции во вторичных лимфоидных органах.
В одном варианте осуществления изобретения микобактериальный антиген обеспечивает ответ нейтрализующего антитела на микобактериальную инфекцию (например, M. tuberculosis). В одном варианте осуществления изобретения каждый микобактериальный антиген в антигенной композиции по настоящему изобретению независимо индуцирует эффективный иммунный ответ (например, клеточный иммунный ответ или ответ антител). Следовательно, в соответствии с настоящим вариантом осуществления изобретения после введения антигенной композиции пациенту, иммунный ответ индуцируется у пациента на каждый микобактериальный антиген в антигенной композиции.
В одном варианте осуществления изобретения микобактериальный антиген включает (например, состоит из) последовательность полипептида. Альтернативно, или в добавление, микобактериальный антиген включает последовательность полинуклеотида (например, ДНК или РНК).
Специфическая подгруппа микобактериальных полипептидов, представленная SEQ ID N: 2, 4, 6, 8, 10, 12, 14, 16 и 18, представляет собой ʹполипептиды, регулируемые латентным состояниемʹ. Специфическая подгруппа микобактериальных полинуклеотидов, представленных SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15 и 17, представляют собой ʹполинуклеотиды, регулируемые латентным состояниемʹ.
В одном варианте осуществления изобретения ʹполипептид, регулируемый латентным состояниемʹ кодируется ʹполинуклеотидом, регулируемым латентным состояниемʹ. В качестве примера, полипептид, регулируемый латентным состоянием, SEQ ID NO: 2 кодируется полинуклеотидом, регулируемым латентным состоянием, SEQ ID NO: 1; SEQ ID NO: 4 кодируется SEQ ID NO: 3; SEQ ID NO: 6 кодируется SEQ ID NO: 5; SEQ ID NO: 8 кодируется SEQ ID NO: 7; SEQ ID NO: 10 кодируется SEQ ID NO: 9; SEQ ID NO: 12 кодируется SEQ ID NO: 11; SEQ ID NO: 14 кодируется SEQ ID NO: 13; SEQ ID NO: 16 кодируется SEQ ID NO: 15; и SEQ ID NO: 18 кодируется SEQ ID NO: 17.
Экспрессия или активность полипептида или полинуклеотида, регулируемых латентным состоянием, модулируется в ответ на микобактериальную латентность - например, в ответ на рост микобактерий (например, MTB) в условиях, которые индуцируют или поддерживают латентное состояние микобактерий.
В одном варианте осуществления изобретения, ʺмодуляцияʺ экспрессии или активности полипептида или полинуклеотида, регулируемых латентным состоянием, в ответ на латентное состояние микобактерий, обозначает, что экспрессия или активность индуцируется или стимулируется в ответ на латентное состояние. Следовательно, полипептид или полинуклеотид, регулируемые латентным состоянием, могут быть ʹлатентно-индуцированнымʹ или ʹлатентно-стимулированнымʹ полипептидом или полинуклеотидом.
Например, экспрессия или активность стимулируемого латентным состоянием полипептида или полинуклеотида может быть стимулирована по меньшей мере в 1,5-раза, 2-раза, 5-раз, 10-раз, 20-раз или 50-раз в условиях латентного состояния по сравнению с нелатентными состояниями. Альтернативно, эффективность вакцины полипептидов/полинуклеотидов по настоящему изобретению может быть измерена в отношении высвобождения интерферона гаммы мышиными спленоцитами (IFN-γ) - например, указанный полипептид/полинуклеотид демонстрирует по меньшей мере в 380, по меньшей мере 400, по меньшей мере 420, по меньшей мере 450, по меньшей мере 500, по меньшей мере 550, по меньшей мере 600 или больше единиц, формирующих бляшки/106 (высвобождение IFN-γ мышиными спленоцитами) -см. фиг. 1. Альтернативно, эффективность вакцины полипептидов/полинуклеотидов по настоящему изобретению может быть измерена в отношении защитной эффективности (%) относительно БЦЖ отдельно (т.е. при введении в качестве бустера к прайм-вакцине БЦЖ), например, указанный полипептид/полинуклеотид демонстрирует увеличение протективной эффективности на по меньшей мере 120 по меньшей мере 150 по меньшей мере 180, по меньшей мере 200, по меньшей мере 220, по меньшей мере 250, по меньшей мере 300% например, измеренной по бактериальной нагрузке (например, в мышиной селезенке и/или легких) - см. фиг. 2 & 3.
Экспрессия или активность индуцируемых латентным состоянием и стимулируемых латентным состоянием полипептидов и полинуклеотидов может быть индуцирована или стимулирована in vivo в латентном состоянии в натуральном окружении микобактерий. По существу, авторы настоящего изобретения считают, что индуцированные латентным состоянием или стимулированные латентным состоянием микобактериальные полипептиды и полинуклеотиды представляют собой хорошие вакцины кандидаты для профилактики развития, распространения и реактивации заболевания и/или для получения хороших диагностических средств для латентной инфекции.
В одном варианте осуществления изобретения микобактериальный антиген включает (или состоит из) последовательности полипептида, имеющей по меньшей мере 70% идентичность последовательности аминокислоты (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности аминокислоты) относительно последовательности аминокислот полипептида, выбираемой из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16 и 18, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот. SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16 и 18 определены в таблице 1, ниже:
Следовательно, в контексте настоящей заявки ʺполипептидный антиген Rv0982ʺ включает или состоит из SEQ ID NO: 2 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv1462ʺ включает или состоит из SEQ ID NO: 4 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv1937ʺ включает или состоит из SEQ ID NO: 6 (или последовательности его ʹвариантаʹ или ʹфрагментаʹ как определено в настоящем описании); ʺполипептидный антиген Rv2500cʺ включает или состоит из SEQ ID NO: 8 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv2504cʺ включает или состоит из SEQ ID NO: 10 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv3270ʺ включает или состоит из SEQ ID NO: 12 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv3537ʺ включает или состоит из SEQ ID NO: 14 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполипептидный антиген Rv3608cʺ включает или состоит из SEQ ID NO: 16 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); и ʺполипептидный антиген Rv3879cʺ включает или состоит из SEQ ID NO: 18 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании).
В одном варианте осуществления изобретения идентичность последовательности аминокислот существует на участке последовательности полипептидов, которая имеет по меньшей мере 50 последовательных остатков аминокислот в длину (например, по меньшей мере 75, 100, 150, 200, 250, 300 последовательных остатков аминокислот в длину). Обычные методы для определения идентичности последовательности аминокислот обсуждаются подробно далее в спецификации.
В контексте первого микобактериального антигена, фрагмент полипептида включает (или состоит из) по меньшей мере 50 последовательных остатков аминокислот указанного полипептида (например, по меньшей мере 75, 100, 125, 150, 175, 200, 225, 250, 275, 300 последовательных остатков аминокислот указанного полипептида). Указанный фрагмент включает по меньшей мере один эпитоп полипептида. Фрагмент полипептида имеет длину последовательности, которая составляет по меньшей мере 25%, 50%, 60%, 70%, 80%, или 90% таковой последовательности полнодлиннового полипептида.
В одном варианте осуществления изобретения в контексте первого микобактериального антигена фрагмент полипептида включает (или состоит из) усеченную форму указанного полипептида. Например, фрагмент полипептида может иметь N-концевое усечение (по сравнению с полипептидом), или фрагмент полипептида может иметь C-концевое усечение (по сравнению с полипептидом).
В одном варианте осуществления изобретения в контексте первого микобактериального антигена, фрагмент полипептида включает (или состоит из) зрелую форму полипептида. Например, полипептид может включать сигнальную последовательность (т.е. секретирующую/нацеливающую последовательность) (например, на N-конце), и фрагмент полипептида может не иметь такой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент образуется путем отщепления сигнальной последовательности от полипептида.
В одном варианте осуществления изобретения фрагмент полипептида SEQ ID NO: 2 представляет собой N-концевую усеченную форму SEQ ID NO: 2. В одном варианте осуществления изобретения фрагмент полипептида SEQ ID NO: 2 имеет N-концевое усечение на 50, 100, 150, 200 или 250 остатков аминокислот по сравнению с последовательностью аминокислот SEQ ID NO: 2. В одном варианте осуществления изобретения фрагмент SEQ ID NO: 2 включает по меньшей мере C-концевую последовательность 50, 100, 150, 200 или 250 аминокислот SEQ ID NO: 2. Сходным образом в одном варианте осуществления изобретения фрагмент полипептида SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 представляет собой N-концевую усеченную форму SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно). В одном варианте осуществления изобретения фрагмент SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 представляет собой последовательность зрелого полипептида, которая отличается от последовательности SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно) по удалению N-концевой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент полипептида SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 имеет N-концевое усечение на 5, 10, 15, 20, 25, 30, 35, 40, 50, 100, 150, 200 или 250 остатков аминокислот по сравнению с последовательностью аминокислот SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно). В одном варианте осуществления изобретения фрагмент SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 включает по меньшей мере C-концевую последовательность 50, 100, 150, 200 или 250 аминокислот SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно).
В одном варианте осуществления изобретения микобактериальный антиген по изобретению включает полипептид или его фрагмент, который имеет обычную антигенную перекрестную реакцию и/или по существу такую же in vivo биологическую активность, как полипептид, выбираемый из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18. В рамках изобретения, ʹобычная антигенная перекрестная реакцияʹ обозначает, что микобактериальный полипептид или фрагмент по изобретению и регулируемый латентным состоянием полипептид, выбираемый из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, разделяют общую способность индуцировать ʺповторный ответʺ иммунной клетки, такой как T-лимфоцит (например, CD4+, CD8+, эффекторная T клетка или T клетка памяти, такая как TEM или TCM), которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции. Новые иммунологические исследования для измерения и количественной оценки ответов иммунных клеток (например, T клеточный ответ) были обнаружены в течение последних 10+ лет. Например, ELISPOT анализ интерферона гамма (IFN-γ) является применимым в качестве иммунологического считывания показаний, так как секреция IFN-γ из антиген-специфических иммунных клеток, таких как T клетки, является хорошей корреляцией защиты против M. tuberculosis. Более того, анализ ELISPOT является очень воспроизводимым и чувствительным методом количественной оценки количества IFN-γ секретирующих антиген-специфических иммунных клеток, таких как T клетки. Альтернативно, или в добавление, ʹобычная антигенная перекрестная реакцияʹ обозначает, что антитело, способное связываться с микобактериальным полипептидом или фрагментом по изобретению, также способно связываться с соответствующим регулируемым латентным состоянием полипептидом (SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18).
В одном варианте осуществления изобретения микобактериальный антиген включает или состоит из полинуклеотидной последовательности, которая кодирует соответствующий микобактериальный полипептид, как определено выше.
Следовательно, в одном варианте осуществления изобретения первый микобактериальный антиген включает (или состоит из нее) полинуклеотидную последовательность, которая кодирует полипептид, который включает (или состоит из) последовательность аминокислот, имеющую по меньшей мере 70% идентичность последовательности аминокислот (такую как по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности аминокислот) относительно последовательности аминокислот регулируемого латентным состоянием полипептида, выбираемого из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот (например, как определено выше). В одном варианте осуществления изобретения микобактериальный антиген включает (или состоит из) полинуклеотидной последовательности, имеющей по меньшей мере 70% идентичность последовательности нуклеотидов (по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности нуклеотидов) относительно последовательности нуклеиновой кислоты регулируемого латентным состоянием полинуклеотида, выбираемого из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, или их фрагмента, имеющего по меньшей мере 150 ее последовательных нуклеотидов. В употреблении указанный полинуклеотид находится в форме (например, вектора), которая обеспечивает соответствующий микобактериальный антигенный пептид/белок. Следовательно, в одном варианте осуществления изобретения микобактериальным антигеном является ʹмикобактериальный полинуклеотидʹ (или фрагмент), как определено выше. SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15 и 17 определены в таблице 2, ниже:
Следовательно, в контексте настоящей заявки, ʺполинуклеотидный антиген Rv0982ʺ включает или состоит из SEQ ID NO: 1 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv1462ʺ включает или состоит из SEQ ID NO: 3 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv1937ʺ включает или состоит из SEQ ID NO: 5 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv2500cʺ включает или состоит из SEQ ID NO: 7 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv2504cʺ включает или состоит из SEQ ID NO: 9 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv3270ʺ включает или состоит из SEQ ID NO: 11 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv3537 ʺвключает или состоит из SEQ ID NO: 13 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); ʺполинуклеотидный антиген Rv3608cʺ включает или состоит из SEQ ID NO: 15 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании); и ʺполинуклеотидный антиген Rv3879cʺ включает или состоит из SEQ ID NO: 17 (или последовательности ее ʹвариантаʹ или ʹфрагментаʹ, как определено в настоящем описании).
В одном варианте осуществления изобретения идентичность последовательности нуклеотидов существует в области полинуклеотидных последовательностей, которая имеет по меньшей мере 150 последовательных остатков нуклеотидов в длину (например, по меньшей мере 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 последовательных остатков нуклеотидов в длину). Обычные методы для определения идентичности последовательности обсуждаются более подробно далее в спецификации.
В контексте микобактериального антигена фрагмент указанного полинуклеотида включает (или состоит из) по меньшей мере 150 последовательных остатков нуклеотидов указанного полинуклеотида 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 последовательных остатков нуклеотидов указанного полинуклеотида). В одном варианте осуществления изобретения длина последовательности фрагмента полинуклеотида составляет по меньшей мере 25%, 50%, 60%, 70%, 80%, или 90% таковой полинуклеотида.
В одном варианте осуществления изобретения в контексте микобактериального антигена фрагмент полинуклеотида включает (или состоит из) усеченную форму указанного полинуклеотида. В одном варианте осуществления изобретения фрагмент полинуклеотида является усеченным на 5ʹ конце и/или 3ʹ конце, по сравнению с полнодлинновой последовательностью полинуклеотида. В одном варианте осуществления изобретения фрагмент полинуклеотида кодирует усеченную форму указанного полипептида. Например, фрагмент полинуклеотида может кодировать полипептид, который является N-концево усеченным и/или C-концево усеченным полипептидом (по сравнению с полипептидом, кодируемым полнодлинновым полинуклеотидом). В одном варианте осуществления изобретения в контексте первого микобактериального антигена фрагмент полинуклеотида кодирует полипептид, который включает (или состоит из) зрелый полипептид. Например, полнодлинновой полипептид включает сигнальную последовательность (т.е. секретирующую/нацеливающую последовательность) (например, на N-конце), и полинуклеотидный фрагмент кодирует зрелый полипептид, который не имеет такой сигнальной последовательности.
В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 1 представляет собой 5ʹ усеченную форму SEQ ID NO: 1. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 1 имеет 5ʹ усечение на 100, 200 или 300 остатков нуклеотидов по сравнению с последовательностью нуклеотидов SEQ ID NO: 1. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 1 кодирует N-концево усеченную форму SEQ ID NO: 2. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 1 кодирует полипептид, имеющий N-концевое усечение на 50, 100, 150, 200 или 250 остатков аминокислот по сравнению с последовательностью аминокислот SEQ ID NO: 2. В одном варианте осуществления изобретения фрагмент SEQ ID NO: 1 включает 3ʹ концевые 100, 200 или 300 остатков нуклеотидов по сравнению с последовательностью нуклеотидов SEQ ID NO: 1. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 1 кодирует полипептид, включающий по меньшей мере C-концевую последовательность 50, 100, 150, 200, 250 или 300 аминокислот SEQ ID NO: 2.
В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 представляет собой 5ʹ усеченную форму SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 имеет 5ʹ усечение на 25, 50, 75, 100 или 125 остатков нуклеотидов по сравнению с последовательностью нуклеотидов SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 кодирует N-концево усеченную форму SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 кодирует зрелую полипептидную последовательность, которая отличается от последовательности SEQ ID NO: SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно) путем удаления N-концевой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 кодирует полипептид, который имеет N-концевое усечение на 5, 10, 15, 20, 25, 30, 35, 40, 50, 100, 150, 200 или 250 остатков аминокислот по сравнению с последовательностью аминокислот SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно). В одном варианте осуществления изобретения фрагмент SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 включает 3ʹ концевые 150, 300, 450, 600 или 750 остатков нуклеотидов по сравнению с последовательностью нуклеотидов SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 (соответственно). В одном варианте осуществления изобретения фрагмент SEQ ID NO: 3, 5, 7, 9, 11, 13, 15, 17 кодирует полипептид, который включает по меньшей мере C-концевую последовательность 50, 100, 150, 200 или 250 аминокислот SEQ ID NO: 4, 6, 8, 10, 12, 14, 16, 18 (соответственно).
В одном варианте осуществления изобретения указанный микобактериальный полинуклеотид или его фрагмент кодирует полипептид, который имеет обычную антигенную перекрестную реакцию и/или по существу такую же in vivo биологическую активность, как регулируемый латентным состоянием полипептид, выбираемый из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, или 18. Например, указанный первый микобактериальный антиген может включать (или состоять из) полинуклеотидную последовательность, которая кодирует последовательность полипептида, которая способна вызывать ответ защитных иммунных клеток (например, T-клеточный ответ) против микобактериальной инфекции. В качестве примера, полипептид, кодируемый первым микобактериальным полинуклеотидом или фрагментом, разделяет с регулируемым латентным состоянием полипептидом, общую способность индуцировать ʺповторный ответʺ иммунных клеток, таких как T-лимфоцит (например, CD4+, CD8+, эффекторные T клетки или Т клетки памяти, такие как TEM или TCM), которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции. В таком отношении секреция IFN-γ из антиген-специфических иммунных клеток, таких как T клетки, является хорошей корреляцией защиты от M. tuberculosis. Соответственно анализ интерферона гамма (IFN-γ) ELISPOT является применимой иммунологической оценкой и позволяет получить воспроизводимую и чувствительную количественную оценку IFN-γ-секретирующих антиген специфических иммунных клеток, таких как T клетки. Альтернативно, или в добавление, антитело, способное связываться с полипептидом, кодируемым микобактериальным полинуклеотидом или фрагментом по изобретению, также способно связываться с регулируемым латентным состоянием полипептидом (SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16 или 18).
Антигенная композиция по изобретению может включать, по меньшей мере, второй микобактериальный антиген, в добавление к первому микобактериальному антигену. Вторым микобактериальным антигеном может быть любой из вышеупомянутых микобактериальных антигенов и предпочтительно он отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения второй микобактериальный антиген способен вызывать защитные иммунные ответы (например, T-клеточный ответ) против микобактериальной инфекции. В одном варианте осуществления изобретения второй микобактериальный антиген включает (например, состоит из) последовательность полипептида. В одном варианте осуществления изобретения второй микобактериальный антиген включает (например, состоит из) полинуклеотидную последовательность, такую как последовательность ДНК или РНК, или микобактериальный гликолипид, такой как микобактериальный сульфогликолипид. В одном варианте осуществления изобретения второй микобактериальный антиген включает (например, состоит из) микобактериальный углеводный антиген, такой как микобактериальный сахарид или полисахарид. Необязательно, сахарид может быть связан (например, химически конъюгирован) с носителем (например, полипептидом) для усиления иммуногенности.
В одном варианте осуществления изобретения ʹразличиеʹ между вторым микобактериальным антигеном и первым микобактериальным антигеном определяют по специфичности иммунного ответа на первый и второй микобактериальные антигены. Например, в одном варианте осуществления изобретения каждый из первого и второго антигенов индуцирует иммунный ответ, который является по существу специфическим для антигена. ʹРазличиеʹ между вторым микобактериальным антигеном и первым микобактериальным антигеном может быть определено в отношении по существу недостатка (например, отсутствия) обычной антигенной перекрестной реакции между первым и вторым микобактериальными антигенами. ʹРазличиеʹ между вторым микобактериальным антигеном и первым микобактериальным антигеном может альтернативно (или в добавление) быть определено как по существу недостаток (например, отсутствие) обычной in vivo биологической активности между первым и вторым микобактериальными антигенами.
Например, в одном варианте осуществления изобретения первый и второй микобактериальные антигены могут не проявлять (по существу) обычной перекрестной антигенной реактивности. В одном варианте осуществления изобретения первый и второй микобактериальные антигены могут не проявлять (по существу) обычной in vivo биологической активности. Например, первый и второй микобактериальные антигены индуцируют различные иммунные ответы и/или имеют различные in vivo биологические активности.
В одном варианте осуществления первый и второй микобактериальные антигены включают полипептиды (как определено в настоящем описании), и второй микобактериальный антиген не имеет по существу общей антигенной перекрестной реакции с первым микобактериальным антигеном и/или имеет по существу in vivo биологическую активность, отличную от первого микобактериального антигена. В одном варианте осуществления изобретения первый и второй микобактериальные антигены включают полинуклеотиды (как определено в настоящем описании), и второй микобактериальный антиген кодирует полипептид, который по существу не имеет общей антигенной перекрестной реакции с полипептидом, кодируемым первым микобактериальным антигеном. В одном варианте осуществления изобретения первый и второй микобактериальные антигены включают полинуклеотиды (как определено в настоящем описании), и второй микобактериальный антиген имеет по существу in vivo биологическую активность, отличную от первого микобактериального антигена и/или кодирует полипептид, который имеет по существу in vivo биологическую активность, отличную от полипептида, кодируемого первым микобактериальным антигеном.
В одном варианте осуществления изобретения первый микобактериальный антиген включает полинуклеотид (как определено в настоящем описании), и второй микобактериальный антиген или полипептид, кодируемый им, не имеет по существу обычной антигенной перекрестной реакции с первым микобактериальным антигеном и/или имеет по существу отличную in vivo биологическую активность от первого микобактериального антигена.
В одном варианте осуществления изобретения первый микобактериальный антиген включает полинуклеотид и второй микобактериальный антиген включает полипептид (как определено в настоящем описании), и второй микобактериальный антиген по существу не имеет антигенной перекрестной реакции с первым микобактериальным антигеном или полипептидом, кодируемым им, и/или имеет по существу отличную in vivo биологическую активность от первого микобактериального антигена или полипептида, кодируемого им. В качестве примера, в одном варианте осуществления изобретения первый и второй микобактериальные антигены не разделяют общей способности индуцировать ʺповторный ответʺ иммунных клеток, таких как T-лимфоцит (например, CD4+, CD8+, эффекторные или Т клетки памяти, такие как TEM или TCM), которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции. Иными словами, первый и второй микобактериальные антигены являются ʹразличнымиʹ, так как они индуцируют повторные ответы в различных иммунных клетках (например, T клетках).
В одном варианте осуществления изобретения второй микобактериальный полипептид включает (или состоит из) антигенный микобактериальный полипептид - т.е. микобактериальный полипептид, который способен вызывать защитный T-клеточный ответ против микобактериальной инфекции.
В одном варианте осуществления изобретения второй микобактериальный антиген включает полипептид, который выбирают из той же группы полипептидов, как обсуждается выше, в сочетании с первым микобактериальным антигеном (предпочтительно второй микобактериальный полипептид отличается от первого микобактериального полипептида).
Следовательно, в одном варианте осуществления изобретения, второй микобактериальный агент включает (или состоит из) последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности аминокислот (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности аминокислот) последовательности аминокислот регулируемого латентным состоянием полипептида, выбираемого из SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, или их фрагмента, имеющего по меньшей мере 50 его последовательных аминокислот (например, по меньшей мере 75, 100, 125, 150, 175, 200, 225 или 250 их последовательных остатков аминокислот).
В одном варианте осуществления изобретения второй микобактериальный агент включает полипептид, который не выбирают из той же группы полипептидов, как обсуждается выше в сочетании с первым микобактериальным антигеном. Например, в одном варианте осуществления изобретения второй микобактериальный антиген включает (или состоит из) полипептидную последовательность, имеющую по меньшей мере 70% идентичность последовательности аминокислот (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности аминокислот) последовательности аминокислот, выбираемых из SEQ ID NO: 19-41, или их фрагмента, имеющего по меньшей мере 50 последовательных аминокислот. SEQ ID NO: 19-41 проиллюстрированы в таблице 3, ниже:
Полипептид ʺAg85Aʺ, представленный SEQ ID NO: 19 настоящей заявки (каталожные No. CAA17868 и BX842584), является членом семейства белков (ʺкомплекс Ag85ʺ), которое также включает Ag85B (SEQ ID NO: 20 настоящей заявки) и Ag85C. Указанное семейство белков секретируется M. tuberculosis, M. bovis БЦЖ, и множеством других видов микобактерий. Ag85A является высоко консервативным среди всех микобактериальных видов и является иммунодоминантным в исследованиях у животных и людей.
Полипептиды, представленные SEQ ID NO: 30 и 36-41, содержатся в DosR регулоне (также известном, как DevR регулон), который включает полипептиды, представленные Rv2623-2631 и Rv3126-3134. Экспрессия таких полипептидов регулируется DosR (DevR). Полипептиды, представленные SEQ ID NO: 31-35, являются членами семейства RPF полипептидов (RPFA, RPFB, RPFC, RPFD и RPFE, соответственно).
В одном варианте осуществления изобретения идентичность последовательности аминокислот существует на участке последовательности полипептида, который имеет по меньшей мере 50 последовательных остатков аминокислот в длину (например, по меньшей мере 75, 100, 125, 150, 175, 200, 225 или 250 последовательных остатков аминокислот в длину). В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент указанного полипептида включает по меньшей мере 50 последовательных остатков аминокислот указанной последовательности полипептида. В одном варианте осуществления изобретения фрагмент включает (или состоит из) по меньшей мере 75, 100, 125, 150, 175, 200, 225 или 250 последовательных остатков аминокислот указанной последовательности полипептида. В одном варианте осуществления изобретения фрагмент полипептида имеет по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80%, или 90% длины микобактериального полипептида. Фрагмент полипептида включает по меньшей мере один эпитоп полипептида.
В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент полипептида включает (или состоит из) усеченную форму указанного полипептида. Например, фрагмент полипептида может иметь N-концевое усечение (по сравнению с полипептидом), или фрагмент полипептида может иметь C-концевое усечение (по сравнению с полипептидом). В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент полипептида включает (или состоит из) зрелую форму полипептида. Например, полипептид может включать сигнальную последовательность (т.е. секретирующую/нацеливающую последовательность) (например, на N-конце), и фрагмент полипептида может не иметь такой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент образуется путем отщепления сигнальной последовательности от полипептида.
В одном варианте осуществления изобретения, фрагмент полипептида SEQ ID NO: 19-41 является N-концево усеченной формой SEQ ID NO: 19-41. В одном варианте осуществления изобретения фрагмент SEQ ID NO: 19-41 является последовательностью зрелого полипептида, которая отличается от последовательности SEQ ID NO: 19-41 по удалению N-концевой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент полипептида SEQ ID NO: 19-41 имеет N-концевое усечение на 10, 20, 30 или 40 остатков аминокислот, по сравнению с последовательностью аминокислот SEQ ID NO: 19-41. В одном варианте осуществления изобретения фрагмент SEQ ID NO: 19-41 включает по меньшей мере C-концевую последовательность 50, 100, 150, 200 или 250 аминокислот SEQ ID NO: 19-41. В одном варианте осуществления изобретения второй микобактериальный полипептид или его фрагмент имеет обычную антигенную перекрестную реакцию и/или по существу такую же in vivo биологическую активность как полипептид, выбираемый из SEQ ID NO: 19-41. В одном варианте осуществления изобретения ʹобычная антигенная перекрестная реакцияʹ обозначает, что второй микобактериальный полипептид или фрагмент разделяет обычную способность с полипептидом, выбранным из SEQ ID NO: 19-41, индукции ʺповторного ответаʺ иммунной клетки, такой как T-лимфоцит, который ранее подвергался воздействию антигенного компонента микобактериальной инфекции. Например, анализ интерферона гамма (IFN-γ) ELISPOT является применимым в качестве иммунологической оценки, так как секреция IFN-γ из антиген-специфичных иммунных клеток, таких как T клетки, хорошо коррелирует с защитой против M. tuberculosis. Более того, анализ ELISPOT является очень воспроизводимым и чувствительным методом количественной оценки количества IFN-γ секретирующих антиген-специфических иммунных клеток, таких как T клетки. Альтернативно, или в добавление, ʹобычная антигенная перекрестная реакцияʹ обозначает, что антитело, способное связываться со вторым микобактериальным полипептидом, или фрагментом, также способно связываться с полипептидом, выбранным из SEQ ID NO: 19-41.
В одном варианте осуществления изобретения второй микобактериальный антиген включает (или состоит из) антигенный микобактериальный полинуклеотид, который способен (после трансляции) вызывать ответ защитных иммунных клеток (например, T-клеточный ответ) против микобактериальной инфекции. В одном варианте осуществления изобретения, второй микобактериальный полинуклеотид кодирует антигенный микобактериальный полипептид, который способен вызывать ответ защитных иммунных клеток (например, T-клеточный ответ) против микобактериальной инфекции. Следовательно, в одном варианте осуществления изобретения вторым микобактериальным антигеном является ʹвторой микобактериальный полинуклеотидʹ (или фрагмент), как определено выше. В одном варианте осуществления изобретения второй микобактериальный антиген включает полинуклеотид, выбираемый из полинуклеотидов, обсуждаемых выше, в сочетании с первым микобактериальным антигеном (хотя предпочтительно отличается от первого микобактериального полинуклеотида).
Следовательно, в одном варианте осуществления изобретения второй микобактериальный антиген включает (или состоит из нее) полинуклеотидную последовательность, которая кодирует полипептид, выбираемый из полипептидов, обсуждаемых выше, в сочетании с первым микобактериальным антигеном (хотя полипептид, кодируемый вторым микобактериальным полинуклеотидом, отличается от полипептида, кодируемого первым микобактериальным полинуклеотидом). Следовательно, указанный второй микобактериальный полинуклеотид включает полинуклеотидную последовательность (например, в виде вектора или плазмиды), кодирующую второй микобактериальный полипептид по изобретению, как определено выше.
В одном варианте осуществления изобретения указанный кодируемый второй микобактериальный полипептид включает последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 2, 4, 6, 8, 10, 12, 14, 16, 18, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот. В одном варианте осуществления изобретения второй микобактериальный антиген включает (или состоит из нее) полинуклеотидную последовательность, имеющую по меньшей мере 70% идентичность последовательности нуклеотидов (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности нуклеотидов) относительно последовательности нуклеиновой кислоты регулируемого латентным состоянием полинуклеотида, выбираемой из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, или ее фрагмента, имеющего по меньшей мере 150 его последовательных нуклеотидов (например, по меньшей мере 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 ее последовательных нуклеотидов). В одном варианте осуществления изобретения второй микобактериальный полипептид включает (или состоит из) последовательность полинуклеотидов, имеющую по меньшей мере 70% идентичность полинуклеотидной последовательности относительно последовательности нуклеиновой кислоты SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, или ее фрагмента, имеющего по меньшей мере 150 последовательных ее нуклеотидов. В одном варианте осуществления изобретения ограничения, обсуждаемые выше, в отношении первого микобактериального полипептида, применяются равно в настоящем варианте осуществления второго микобактериального полипептида.
В одном варианте осуществления изобретения второй микобактериальный антиген включает полинуклеотид, который не выбирают из той же группы полинуклеотидов, как обсуждается выше, в сочетании с первым микобактериальным антигеном. В одном варианте осуществления изобретения второй микобактериальный антиген включает полинуклеотид, который кодирует полипептид, который не выбирают из той же группы полипептидов, как обсуждается выше, в сочетании с первым микобактериальным антигеном. В одном варианте осуществления изобретения второй микобактериальный антиген включает последовательность полинуклеотидов, которая кодирует второй микобактериальный полипептид, как обсуждается выше.
Следовательно, в одном варианте осуществления изобретения второй микобактериальный антиген включает (или состоит из нее) полинуклеотидную последовательность, где указанная полинуклеотидная последовательность кодирует полипептид, который включает (или состоит из) последовательность аминокислот, имеющую по меньшей мере 70% идентичность последовательности аминокислот (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности аминокислот) относительно последовательности аминокислот, выбираемой из SEQ ID NO: 19-41, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных остатков аминокислот. В одном варианте осуществления изобретения, второй микобактериальный антиген включает (или состоит из нее) полинуклеотидную последовательность, имеющую по меньшей мере 70% идентичность последовательности нуклеотидов (например, по меньшей мере 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичность последовательности нуклеотидов) относительно последовательности нуклеотидов, выбираемой из SEQ ID NO: 42-64, или ее фрагмента, имеющего по меньшей мере 150 ее последовательных нуклеотидов. SEQ ID NO: 42-64 проиллюстрированы в таблице 4, ниже:
Полинуклеотид ʺAg85Aʺ, представленный SEQ ID NO: 42 по настоящей заявке (каталожные No. CAA17868 и BX842584), является членом семейства генов (ʺAg85 комплексʺ), которое также включает Ag85B (SEQ ID NO: 43 по настоящей заявке) и Ag85C. Указанное семейство генов кодирует белки, которые секретируются M. tuberculosis, M. bovis БЦЖ, и многими другими видами микобактерий. Ag85A является высоко консервативным среди всех видов микобактерий и является иммунодоминантным в исследованиях у животных и людей.
Полинуклеотиды, представленные SEQ ID NO: 53 и 59-64, включены в DosR регулон (также известный как DevR регулон), который включает полинуклеотиды, представленные Rv2623-2631 и Rv3126-3134. Экспрессия указанных полинуклеотидов регулируется посредством DosR (DevR). Полинуклеотиды, представленные SEQ ID NO: 54-49, являются членами семейства полинуклеотидов RPF (RPFA, RPFB, RPFC, RPFD и RPFE, соответственно).
В одном варианте осуществления изобретения идентичность последовательности нуклеотидов существует в области полинуклеотидных последовательностей, которые имеют по меньшей мере 150 последовательных остатков нуклеотидов в длину (например, по меньшей мере 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 последовательных нуклеотидных остатков в длину).
В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент полинуклеотида включает по меньшей мере 150 последовательных остатков нуклеотидов указанной полинуклеотидной последовательности. В одном варианте осуществления изобретения фрагмент включает (или состоит из) по меньшей мере 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 последовательных остатков нуклеотидов указанной полинуклеотидной последовательности. В одном варианте осуществления изобретения, фрагмент указанного полинуклеотида имеет по меньшей мере 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90% длины полинуклеотида.
В одном варианте осуществления изобретения в контексте второго микобактериального антигена фрагмент полинуклеотида включает (или состоит из) усеченную форму указанного полинуклеотида. Например, фрагмент полинуклеотида может иметь 5ʹ усечение и/или 3ʹ усечение по сравнению с полинуклеотидом. В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент полинуклеотида кодирует полипептид, который является усеченным по сравнению с последовательностью полипептида, кодируемой полнодлинновым полинуклеотидом. Например, фрагмент полинуклеотида может кодировать полипептид, который является N-концево усеченным и/или C-концево усеченным, при сравнении с полипептидом, кодируемым полнодлинновым полинуклеотидом. В одном варианте осуществления изобретения в контексте второго микобактериального антигена, фрагмент полинуклеотида кодирует зрелый полипептид. Например, полипептид может включать сигнальную последовательность (т.е. секреторную/нацеливающую последовательность) (например, на N-конце), и полинуклеотидный фрагмент может кодировать полипептидный фрагмент, который не имеет такой сигнальной последовательности.
В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 представляет собой 5ʹ-усеченную форму SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 имеет N-концевое усечение на 25, 50, 75, 100 или 125 остатков нуклеотидов по сравнению с последовательностью нуклеотидов SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 включает по меньшей мере C-концевые 150, 300, 450, 600 или 750 остатков нуклеотидов SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 кодирует N-концево усеченную форму SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 кодирует последовательность зрелого полипептида, которая отличается от последовательности SEQ ID NO: 42-64 (соответственно) по удалению N-концевой сигнальной последовательности. В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 кодирует полипептидный фрагмент SEQ ID NO: 42-64 (соответственно), который имеет N-концевое усечение на 10, 20, 30, 40, 50, 100, 150 остатков аминокислот по сравнению с последовательностью аминокислот SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения фрагмент полинуклеотида SEQ ID NO: 42-64 кодирует полипептидный фрагмент SEQ ID NO: 42-64 (соответственно), который включает по меньшей мере C-концевые 50, 100, 150, 200 или 250 остатков аминокислот SEQ ID NO: 42-64 (соответственно). В одном варианте осуществления изобретения полипептид, кодируемый вторым микобактериальным полинуклеотидом или фрагментом, имеет общую антигенную перекрестную реакцию и/или по существу ту же in vivo биологическую активность, как полипептид, выбираемый из SEQ ID NO: 19-41. В качестве примера, полипептид, кодируемый вторым микобактериальным полинуклеотидом, или фрагментом, разделяет общую способность с полипептидом, выбранным из SEQ ID NO: 19-41, индукции ʺповторного ответаʺ иммунных клеток, таких как T-лимфоцит, которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции. Например, анализ интерферона гамма (IFN-γ) ELISPOT является применимым в качестве иммунологической оценки, так как секреция IFN-γ из антиген-специфических иммунных клеток, таких как T-клетки, является хорошей корреляцией защиты от M. tuberculosis. Более того, анализ ELISPOT является очень воспроизводимым и чувствительным методом количественной оценки количества IFN-γ секретирующих антиген-специфичных иммунных клеток, таких как T-клетки. Альтернативно, или в добавление, антитело, способное связываться с полипептидом, кодируемым вторым микобактериальным полинуклеотидом, или фрагментом, также способно связываться с полипептидом, выбранным из SEQ ID NO: 19-41.
В одном варианте осуществления изобретения антигенная композиция включает и Rv0111 антиген (антигенный полипептид или полинуклеотид) и Rv0198 антиген (антигенный полипептид или полинуклеотид).
В одном варианте осуществления изобретения, где есть множественные дополнительные микобактериальные антигены (например, 2 или более дополнительных микобактериальных антигенов, а также первый и второй микобактериальные антигены), каждый из указанных дополнительных микобактериальных антигенов отличается друг от друга. В одном варианте осуществления изобретения ʹразличиеʹ между дополнительным микобактериальным антигеном(ами) и первым и вторым микобактериальными антигеном(ами) определяют по специфичности иммунного ответа на микобактериальные антигены. Например, в одном варианте осуществления изобретения, каждый из первого, второго и дополнительных антигенов индуцирует иммунный ответ, который является по существу специфичным для антигена. ʹРазницаʹ между первым, вторым и дополнительными микобактериальными антигенами может быть определена в отношении по существу недостатка (например, отсутствия) обычной антигенной перекрестной реакции между микобактериальными антигенами. ʹРазличиеʹ между первым, вторым и дополнительными микобактериальными антигенами может альтернативно (или в добавление) быть определено как по существу недостаток (например, отсутствие) обычной in vivo биологической активности между микобактериальными антигенами. Например, в одном варианте осуществления изобретения первый, второй и дополнительные микобактериальные антигены (например, первый, второй и дополнительные микобактериальные антигенные полипептиды, или первый, второй и дополнительные микобактериальные антигенные полинуклеотиды или полипептиды, кодируемые ими) могут не проявлять (по существу) обычной антигенной перекрестной реакции.
В одном варианте осуществления изобретения первый, второй и дополнительные микобактериальные антигены (например, первый, второй и дополнительные микобактериальные антигенные полипептиды или первый, второй и дополнительные микобактериальные антигенные полинуклеотиды или полипептиды, кодируемые ими) не проявляют (по существу) обычной in vivo биологической активности. Например, первый, второй и дополнительные микобактериальные антигены (например, первый, второй и дополнительные микобактериальные антигенные полипептиды или первый, второй и дополнительные микобактериальные антигенные полинуклеотиды или полипептиды, кодируемые ими) каждый могут индуцировать различные иммунные ответы и/или каждый имеют различную in vivo биологическую активность. В качестве примера, в одном варианте осуществления изобретения первый, второй и дополнительные микобактериальные антигены (например, первый, второй и дополнительные микобактериальные антигенные полипептиды или первый, второй и дополнительные микобактериальные антигенные полинуклеотиды или полипептиды, кодируемые ими) не разделяют общей способности индуцировать ʺповторный ответʺ иммунных клеток, таких как T лимфоцит (например, CD4+, CD8+, эффекторные Т клетки или Т клетки памяти - TEM или TCM), которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции. Иными словами, в одном варианте осуществления изобретения первый, второй и дополнительные микобактериальные антигены являются ʹразличнымиʹ, так как они индуцируют повторные ответы в различных иммунных клетках (например, различных T клетках).
В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов(а) экспрессируются или стимулируются в различных условиях культивирования и/или состоянии микобактериальной инфекции по сравнению с первым и/или вторым микобактериальными антигенами. В одном варианте осуществления изобретения активность одного или более дополнительных микобактериальных антигенов стимулируется в различных условиях культивирования и/или состоянии микобактериальной инфекции по сравнению с первым и/или вторым микобактериальными антигенами. Следовательно, в одном варианте осуществления изобретения экспрессия или активность первого микобактериального антигена стимулируется в условиях латентного состояния микобактерий, тогда как экспрессия или активность второго и/или дополнительного микобактериального антигена стимулируется во время активной микобактериальной инфекции или при реактивации из латентного состояния (и/или подавляются во время условий микобактериальной латентности). В одном варианте осуществления изобретения, где есть множество дополнительных микобактериальных антигенов (например, 2 или более дополнительных микобактериальных антигенов, а также первого и второго микобактериальных антигенов), каждый дополнительный микобактериальный антиген экспрессируется/стимулируется на различных стадиях микобактериальной инфекции, или активность каждого дополнительного микобактериального антигена стимулируется на различных стадиях микобактериальной инфекции.
В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов получают от микобактерий, иных, чем M. tuberculosis. Например, один или более дополнительных микобактериальных антигенов могут быть от другого члена КМТ, таких как M. microti, M. bovis, M. canetti или M. africanum, или не-MTC микобактерий, таких как M. avium-intracellulare, M. kansasii, M. marinum или M. ulcerans.
В одном варианте осуществления изобретения антигенная композиция включает по меньшей мере 1, 2, 3, 4 или 5 дополнительных микобактериальных антигенов, в добавление к первому и второму микобактериальным антигенам, обсуждаемым выше. В одном варианте осуществления изобретения каждый из указанных по меньшей мере 1, 2, 3, 4 или 5 дополнительных микобактериальных антигенов отличается друг от друга и от первого и второго микобактериальных антигенов. В одном варианте осуществления изобретения антигенная композиция включает до около 10 различных микобактериальных антигенов (например, включая первый и второй микобактериальные антигены, обсуждаемые выше). В одном варианте осуществления изобретения антигенная композиция включает 1 дополнительный микобактериальный антиген, и следовательно, включает всего 3 различных микобактериальных антигена (т.е. антигенная композиция является тримерной). В одном варианте осуществления изобретения антигенная композиция включает 2 дополнительных микобактериальных антигена, и следовательно, включает всего 4 различных микобактериальных антигена (т.е. антигенная композиция является тетрамерной). В одном варианте осуществления изобретения антигенная композиция включает 3 дополнительных микобактериальных антигена, и следовательно, включает всего 5 различных микобактериальных антигенов (т.е. антигенная композиция является пентамерной). В одном варианте осуществления изобретения антигенная композиция включает до 8 дополнительных микобактериальных антигенов, и следовательно, включает всего до 10 различных микобактериальных антигенов (т.е. антигенная композиция является до декамерной).
В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов включает (или состоит из) последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности аминокислот относительно последовательности аминокислот регулируемого латентным состоянием полипептида, выбираемого из SEQ ID NO: 1, 3, 5, 7 и 56, или ее фрагмента, имеющего по меньшей мере 150 ее последовательных аминокислот, как определено выше в отношении первого микобактериального антигена (пока один или более дополнительных микобактериальных антигенов отличаются от первого микобактериального антигена). Альтернативно, или в добавление, один или более дополнительных микобактериальных антигенов могут включать (или состоять из) последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности аминокислот, выбираемой из SEQ ID NO: 19-41, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот, как определено выше, в отношении второго микобактериального антигена (пока один или более микобактериальных антигенов отличаются от второго микобактериального антигена).
В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов включает (или состоит из нее) полинуклеотидную последовательность, которая кодирует последовательность полипептида, как описано выше в отношении первого микобактериального антигенного полипептида (предпочтительно отличного от первого микобактериального антигена). В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов включает (или состоит из нее) полинуклеотидную последовательность, которая кодирует последовательность полипептида, как описано выше в отношении второго микобактериального антигенного полипептида (предпочтительно отличного от второго микобактериального антигена).
В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов включает (или состоит из) последовательность полипептида, имеющую по меньшей мере 70% идентичность последовательности нуклеотидов относительно последовательности нуклеиновой кислоты регулируемого латентным состоянием полинуклеотида, выбираемого из SEQ ID NO: 1, 3, 5, 7, 9, 11, 13, 15, 17, или его фрагмента, имеющего по меньшей мере 150 его последовательных нуклеотидов, как описано выше в отношении первого микобактериального антигена (пока один или более микобактериальных антигенов отличаются от первого микобактериального антигена). Альтернативно, или в добавление, один или более дополнительных микобактериальных антигенов могут включать (или состоять из нее) полинуклеотидную последовательность, имеющую по меньшей мере 70% идентичность последовательности нуклеотидов относительно последовательности нуклеиновой кислоты, выбираемой из SEQ ID NO: 42-64, или ее фрагмента, имеющего по меньшей мере 150 ее последовательных нуклеотидов, как описано выше в отношении второго микобактериального антигена (при условии, что один или более дополнительных микобактериальных антигенов отличаются от второго микобактериального антигена).
В одном варианте осуществления изобретения по меньшей мере два из микобактериальных антигенов в антигенной композиции включают (или состоят из) последовательность полипептида, и указанные по меньшей мере две последовательности полипептида необязательно объединены вместе с образованием сшитого белка. В качестве примера, в одном варианте осуществления изобретения, первый микобактериальный антиген и второй микобактериальный антиген каждый включают (или состоят из) последовательность полипептида, как определено выше, и указанные первая и вторая последовательности полипептида необязательно объединены вместе с образованием сшитого белка.
В одном варианте осуществления изобретения, указанный сшитый белок дополнительно включает по меньшей мере одну дополнительную последовательность микобактериального антигенного полипептида, необязательно объединенную с указанными первой и/или второй последовательностью полипептида, где каждый из указанных дополнительных микобактериальных антигенов отличается друг от друга и от первого и второго микобактериальных антигенов. Например, сшитый белок может включать по меньшей мере 1, 2, 3, 4 или 5 дополнительных микобактериальных антигенов, в добавление к указанным первому и второму микобактериальным антигенам, где каждый из указанных дополнительных микобактериальных антигенов отличается друг от друга и от первого и второго микобактериальных антигенов. В одном варианте осуществления изобретения сшитый белок может включать до 10 различных микобактериальных антигенов (например, включая первый и второй микобактериальные антигены).
В одном варианте осуществления изобретения антигенная композиция включает по меньшей мере один дополнительный микобактериальный антиген (например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дополнительных микобактериальных антигенов) и первый микобактериальный антиген и указанный по меньшей мере один дополнительный микобактериальный антиген каждый включает (или состоит из) последовательность полипептида, как определено выше, и указанные последовательности полипептидов необязательно объединены вместе с образованием сшитого белка. В одном варианте осуществления изобретения антигенная композиция включает по меньшей мере один дополнительный микобактериальный антиген (например, по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 дополнительных микобактериальных антигенов), и второй микобактериальный антиген и указанный по меньшей мере один дополнительный микобактериальный антиген каждый включает (или состоит из) последовательность полипептида, как определено выше, и указанные последовательности полипептида необязательно объединены вместе с образованием сшитого белка. Альтернативно, в одном варианте осуществления изобретения антигенная композиция включает по меньшей мере два дополнительных микобактериальных антигена (например, по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9 или 10 дополнительных микобактериальных антигенов), и указанные по меньшей мере два дополнительных микобактериальных антигена каждый включают (или состоят из) последовательность полипептида, как определено выше, и указанные последовательности полипептидов необязательно объединены вместе с образованием сшитого белка.
В одном варианте осуществления изобретения рекомбинантный сшитый белок может быть получен посредством экспрессии рекомбинантной полинуклеотидной последовательности, которая кодирует указанный сшитый белок. В качестве примера, полинуклеотидные последовательности, кодирующие микобактериальные антигенные полипептиды по изобретению, могут быть расположены в той же рамке считывания после промотора в векторе экспрессии, посредством этого позволяя транскрипцию через последовательности полинуклеотидов и трансляцию в виде одного белкового продукта. В одном варианте осуществления изобретения вмешивающиеся ʹлинкерныеʹ последовательности расположены между полинуклеотидными последовательностями для каждого полипептидного антигена, образуясь в результате включения сайтов рестрикции. В общем, аминокислоты, кодируемые указанными линкерными последовательностями, не являются вредными для иммуногенности полученного сшитого белка, и могут даже быть полезными для иммуногенности. Альтернативно, сшитый белок по изобретению может быть получен как антигенная последовательность, посредством экспрессии полинуклеотидных последовательностей, которые связаны без вмешивающихся нуклеотидов. Отсутствие вмешивающейся линкерной последовательности позволяет избежать присутствия нежелательного материала нуклеиновой кислоты и/или аминокислоты. Альтернативно, сшитый белок по изобретению может быть получен путем химической конъюгации микобактериальных антигенных полипептидов по изобретению. В качестве примера, первый и/или второй и/или дополнительные микобактериальные полипептиды по изобретению могут быть связаны друг с другом с использованием обычных методик химической конъюгации.
В одном варианте осуществления изобретения по меньшей мере два из микобактериальных антигенов в антигенной композиции включают (или состоят из) полинуклеотидную последовательность и указанные по меньшей мере две полинуклеотидные последовательности необязательно объединены вместе с образованием последовательности полицистронной нуклеиновой кислоты. В качестве примера, в одном варианте осуществления изобретения, первый микобактериальный антиген и второй микобактериальный антиген каждый включает (или состоит из нее) полинуклеотидную последовательность, как определено выше, и указанные первая и вторая полинуклеотидные последовательности необязательно объединены вместе с образованием последовательности полицистронной нуклеиновой кислоты.
В одном варианте осуществления изобретения указанная последовательность полицистронной нуклеиновой кислоты включает или состоит из (в любом порядке от 5ʹ до 3ʹ конца):
(i) первый микобактериальный полинуклеотид, где указанный первый микобактериальный полинуклеотид включает (или состоит из нее) полинуклеотидную последовательность, как определено ранее; и
(ii) второй микобактериальный полинуклеотид, где указанный второй микобактериальный полинуклеотид включает (или состоит из нее) полинуклеотидную последовательность, как определено ранее.
В одном варианте осуществления изобретения указанная полицистронная последовательность дополнительно включает по меньшей мере одну дополнительную микобактериальную антигенную полинуклеотидную последовательность, объединенную с указанными первой и второй полинуклеотидными последовательностями. Альтернативно, в одном варианте осуществления изобретения антигенная композиция включает по меньшей мере один дополнительный микобактериальный антиген, и первый микобактериальный антиген и по меньшей мере один дополнительный микобактериальный антиген каждый включают (или состоят из нее) полинуклеотидную последовательность, как определено выше, и указанные полинуклеотидные последовательности объединены вместе с образованием последовательности полицистронной нуклеиновой кислоты. Альтернативно, в одном варианте осуществления изобретения, антигенная композиция включает по меньшей мере один дополнительный микобактериальный антиген, и второй микобактериальный антиген и по меньшей мере один дополнительный микобактериальный антиген, каждый включает (или состоит из нее) полинуклеотидную последовательность, как определено выше, и указанные полинуклеотидные последовательности объединены вместе с образованием последовательности полицистронной нуклеиновой кислоты. Альтернативно, в одном варианте осуществления изобретения антигенная композиция включает по меньшей мере два дополнительных микобактериальных антигена, и указанные по меньшей мере два дополнительных микобактериальных антигена каждый включают (или состоит из нее) полинуклеотидную последовательность, как определено выше, и указанные полинуклеотидные последовательности объединены вместе с образованием последовательности полицистронной нуклеиновой кислоты.
В одном варианте осуществления изобретения полицистронная последовательность нуклеиновой кислоты по изобретению располагается после промотора в рамке в векторе (например, векторе экспрессии или вирусном векторе, как обсуждается ниже), таким образом допуская транскрипцию через полинуклеотидные последовательности и необязательную трансляцию в виде одного продукта ʹсшитого белкаʹ. Соответственно, в одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты кодирует сшитый белок, как обсуждается выше. Альтернативно, в одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты кодирует отдельные последовательности антигенных полипептидов, как обсуждается выше. В одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты гибко связана с последовательностью нуклеиновой кислоты, кодирующей полипептидную метку, так что кодируемая метка ковалентно связана с кодируемым антигенным полипептидом(ами) при трансляции. Метка может облегчать определение экспрессии антигенного полипептида, или определение клонов, которые экспрессируют антиген и/или может приводить к увеличению антигенной эффективности. Подходящие полипептидные метки включают PK метку, FLAG метку, MYC метку, полигистидиновую метку или любую определяемую метку (например, метка может быть определена посредством антитела, такого как моноклональное антитело). Другие примеры меток будут очевидны специалистам в области техники. Последовательность нуклеиновой кислоты, кодирующей полипептидную метку, может быть расположена так, что после трансляции, метка располагается на C-конце экспрессируемого антигенного полипептида (т.е. в порядке: антигенный полипептид-метка). Альтернативно, последовательность нуклеиновой кислоты, кодирующая полипептидную метку, может быть расположена так, что после трансляции, метка располагается на N-конце экспрессируемого антигенного полипептида (т.е. в порядке: метка-антигенный полипептид). Альтернативно, последовательность нуклеиновой кислоты, кодирующая полипептидную метку, может быть расположена так что, после трансляции, метка располагается внутри экспрессируемого антигенного полипептида, или между экспрессируемыми антигенными полипептидами кодируемого сшитого белка.
Нуклеотиды, кодирующие линкерную последовательность, могут быть вставлены между полицистронной последовательностью нуклеиновой кислоты, кодирующей антигенный полипептид(ы), и последовательностью нуклеиновой кислоты, кодирующей полипептидную метку. В одном варианте осуществления изобретения линкерная последовательность кодирует последовательность аминокислот Gly-Ser-Ile. В одном варианте осуществления изобретения закодированная линкерная последовательность располагается между экспрессируемым антигенным полипептидом и полипептидной меткой (т.е. в порядке: антигенный полипептид-линкер-метка, или метка-линкер-антигенный полипептид). В одном варианте осуществления изобретения последовательность нуклеиновой кислоты, кодирующая полипептидную метку, и нуклеотиды, кодирующие линкерную последовательность, расположены так, что после трансляции, линкерная последовательность (например, Gly-Ser-Ile) располагается на C-конце экспрессируемого антигенного полипептида и метка располагается на C-конце экспрессируемой линкерной последовательности (например, в порядке антигенный полипептид-линкер-метка). Вносимые ʹлинкерныеʹ последовательности могут альтернативно (или дополнительно) быть расположены между последовательностями микобактериального полинуклеотида полицистронной последовательности, образуясь в результате включения сайтов рестрикции (например, в форме: микобактериальный полинуклеотид-линкер-микобактериальный полинуклеотид). Однако, во избежание присутствия ненужного материала нуклеиновой кислоты и/или аминокислоты, полинуклеотидные последовательности могут быть связаны без вставленных нуклеотидов.
В одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты гибко связана с лидерной последовательностью. Например, лидерная последовательность может быть сшита с N-концом полицистронной последовательности (т.е. форме: лидер-полицистронная последовательность) или C-концом полицистронной последовательности (т.е. в форме: полицистронная последовательность-лидер). Лидерная последовательность может влиять на обработку первичного транскрипта ДНК в мРНК и/или может влиять на стабильность и эффективность трансляции РНК. В одном варианте осуществления изобретения лидерная последовательность обеспечивает, тот факт, что кодируемый полипептидный антиген направлен на секреторный аппарат клетки-хозяина. В одном варианте осуществления изобретения лидерная последовательность усиливает экспрессию и/или иммуногенность антигена. Усиленная экспрессия может быть определена обычным анализом, таким как использование антитела (например, моноклонального антитела) для определения количества продуцируемого белка. Усиленная иммуногенность может быть определена с использованием обычного анализа, такого как ELISPOT анализ в культуре или ex vivo. В одном варианте осуществления изобретения присутствие лидерной последовательности усиливает экспрессию и/или иммуногенность антигенного полипептида в 2 раза, 3 раза или более при сравнении с антигенным полипептидом, экспрессируемым без лидерной последовательности. Примером подходящей лидерной последовательности является t-PA (тканевой активатор плазминогена).
Соответственно, в одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты, кодирующая указанные микобактериальные антигенные полипептиды, гибко связана с лидерной последовательностью и последовательностью метки. Например, лидерная последовательность может быть сшита с N-концом полицистронной последовательности и последовательность метки может быть сшита с C-концом полицистронной последовательности (т.е. в форме: лидер-полицистронная последовательность-метка). В одном варианте осуществления изобретения линкерная последовательность расположена между полицистронной последовательностью и последовательностью нуклеиновой кислоты, кодирующей метку (т.е. в форме лидер-полицистронная последовательность-линкер-метка). В одном варианте осуществления изобретения лидерной последовательностью является t-PA лидерная последовательность и/или последовательностью метки является последовательность PK метки (т.е. в форме: t-PA лидер-полицистронная последовательность-PK метка). В одном варианте осуществления изобретения линкерная последовательность располагается между полицистронной последовательностью и последовательностью нуклеиновой кислоты, кодирующей метку (т.е. в форме t-PA лидер-полицистронная последовательность-линкер-PK метка). В одном варианте осуществления изобретения, вносимые лидерные последовательности располагаются между одной или более последовательностями микобактериального полинуклеотида полицистронной последовательности (т.е. в форме: микобактериальный полинуклеотид-лидер-микобактериальный полинуклеотид). В одном варианте осуществления изобретения последовательность полицистронной нуклеиновой кислоты, кодирующая микобактериальные антигенные полипептиды, гибко связана с N-концевой лидерной последовательностью, внутренней лидерной последовательностью и последовательностью метки (т.е. в форме: лидер-первый микобактериальный полинуклеотид-лидер-второй микобактериальный полинуклеотид-метка). В одном варианте осуществления изобретения линкерная последовательность располагается между полицистронной последовательностью и последовательностью нуклеиновой кислоты, кодирующей метку (т.е. в форме: лидер-первый микобактериальный полинуклеотид-лидер-второй микобактериальный полинуклеотид-линкер-метка). В одном варианте осуществления изобретения лидерной последовательностью является t-PA лидерная последовательность и/или последовательностью метки является последовательность PK метки (т.е. в форме: t-PA лидер-первый микобактериальный полинуклеотид-t-PA лидер-второй микобактериальный полинуклеотид-PK метка). В одном варианте осуществления изобретения линкерная последовательность располагается между полицистронной последовательностью и последовательностью нуклеиновой кислоты, кодирующей метку (т.е. в форме t-PA лидер-первый микобактериальный полинуклеотид-t-PA лидер -второй микобактериальный полинуклеотид-линкер-PK метка). В одном варианте осуществления изобретения полицистронная последовательность нуклеиновой кислоты дополнительно включает сигнал полиаденилирования, такой как сигнал полиаденилирования бычьего гормона роста (BGH).
В одном варианте осуществления изобретения антигенная композиция включает одну или более клеток, где указанные клетки включают по меньшей мере один из микобактериальных антигенов. В одном варианте осуществления изобретения указанная одна или более клеток включают первый микобактериальный антиген и/или второй микобактериальный антиген, как определено выше. В одном варианте осуществления изобретения указанная одна или более клеток включают один или более дополнительных микобактериальных антигенов, как определено выше. В одном варианте осуществления изобретения один или более указанных дополнительных микобактериальных антигенов включают последовательность полипептида, как определено выше. В одном варианте осуществления изобретения один или более указанных дополнительных микобактериальных антигенов включают полинуклеотидную последовательность, как указано выше.
В одном варианте осуществления изобретения, указанный по меньшей мере один микобактериальный антиген (например, полипептид) по меньшей мере частично экспонирован на поверхности клетки(ок). В альтернативном варианте осуществления изобретения клетки разрушаются in vivo, так что по меньшей мере часть микобактериального антигена (например, полипептида) подвергается воздействию иммунной системы организма хозяина. В альтернативном варианте осуществления изобретения клетки по меньшей мере частично высвобождают (например, секретируют или экспортируют) микобактериальный антиген (например, полипептид) из клетки, так что он подвергается воздействию иммунной системы организма-хозяина. В одном варианте осуществления изобретения указанная антигенная композиция включает отдельную клетку, где указанная клетка включает по меньшей мере два из указанных микобактериальных антигенов. В качестве примера, в одном варианте осуществления изобретения указанная антигенная композиция включает отдельную клетку, где указанная клетка включает оба указанных первых микобактериальных антигена и указанных вторых микобактериальных антигена. В одном варианте осуществления изобретения указанная отдельная клетка дополнительно включает один или более дополнительных указанных микобактериальных антигенов.
В одном варианте осуществления изобретения указанная антигенная композиция включает отдельную клетку, где указанная клетка включает указанный первый микобактериальный антиген и указанный один или более дополнительных микобактериальных антигенов. В одном варианте осуществления изобретения указанная антигенная композиция включает отдельную клетку, где указанная клетка включает указанный второй микобактериальный антиген и указанный один или более дополнительных микобактериальных антигенов. В одном варианте осуществления изобретения указанная антигенная композиция включает отдельную клетку, где указанная клетка включает указанные по меньшей мере два из указанных дополнительных микобактериальных антигенов. В альтернативном варианте осуществления изобретения антигенная композиция включает по меньшей мере первую и вторую клетки, где указанная первая клетка включает указанный первый микобактериальный антиген (как определено выше) и где указанная вторая клетка включает указанный второй микобактериальный антиген (как определено выше). В указанном варианте осуществления изобретения первый и второй микобактериальные антигены не присутствуют в той же клетке; скорее первый и второй микобактериальные антигены находятся в разных клетках. В одном варианте осуществления изобретения указанная антигенная композиция дополнительно включает по меньшей мере третью клетку, где указанная клетка включает дополнительный микобактериальный антиген, как определено выше.
В одном варианте осуществления изобретения указанная по меньшей мере одна клетка является аттенуированным микробным носителем. Аттенуированным носителем является клетка (такая как бактериальная клетка), которая неспособна вызывать значительный патологический эффект у животного, обычно млекопитающего, такого как человек, корова, свинья или лошадь. Подходящие примеры аттенуированных микробных носителей включают аттенуированную сальмонеллу, аттенуированную M. tuberculosis, или аттенуированную M. bovis (например, штамм БЦЖ).
В одном варианте осуществления изобретения антигенная композиция включает один или более векторов, где указанные векторы включают по меньшей мере один из микобактериальных антигенов. В одном варианте осуществления изобретения, указанный один или более векторов включают первый микобактериальный антиген, как определено выше. В одном варианте осуществления изобретения указанный первый микобактериальный антиген включает последовательность полипептида, как определено выше. В одном варианте осуществления изобретения указанный один или более векторов включает второй микобактериальный антиген, как определено выше. В одном варианте осуществления изобретения указанный вектор включает указанный первый микобактериальный антиген и указанный второй (и необязательно дополнительный) микобактериальный антиген. В качестве примера, указанный вектор может включать первый микобактериальный полинуклеотид, как определено в настоящем описании и второй (и необязательно дополнительный) микобактериальный полинуклеотид, как определено в настоящем описании. В одном варианте осуществления изобретения, указанный вектор включает:
(i) первый микобактериальный полинуклеотид, где указанный первый микобактериальный полинуклеотид включает (или состоит из нее) полинуклеотидную последовательность, как определено ранее; и необязательно
(ii) второй микобактериальный полинуклеотид, где указанный второй микобактериальный полинуклеотид включает (или состоит из нее) полинуклеотидную последовательность, как определено ранее.
В одном варианте осуществления изобретения указанный один или более векторов включают один или более указанных дополнительных микобактериальных антигена, как определено выше. В одном варианте осуществления изобретения один или более указанных дополнительных микобактериальных антигенов включают последовательность полипептида, как определено выше. В одном варианте осуществления изобретения один или более указанных дополнительных микобактериальных антигенов включают полинуклеотидную последовательность, как определено выше.
Примеры векторов включают ДНК векторы (например, векторы Vaccinia virus, такие как MVA) и РНК векторы (например, вирусные векторы Sinbis или Semiliki Forest). Термин ʹвекторʹ охватывает векторы экспрессии (которые могут быть применимыми для получения микобактериальных антигенов по изобретению), и вирусные векторы (которые могут быть применимыми для репликации и/или доставки микобактериальных антигенов по изобретению). Векторы необязательно включают соответствующие контрольные последовательности, такие как промотор и/или терминатор. В одном варианте осуществления изобретения вектор включает одну или более полинуклеотидных последовательностей(и), кодирующие указанный микобактериальный антиген(ы). Указанная полинуклеотидная последовательность может быть гибко связана с последовательностью нуклеиновой кислоты, кодирующей полипептидную метку, так что кодируемая метка ковалентно связывается с антигеном при трансляции. Метка может облегчать определение экспрессии антигена, или клонов, которые экспрессируют антиген, и/или может приводить к увеличению эффективности антигена. Подходящие полипептидные метки включают PK метку, FLAG метку, MYC метку, полигистидиновую метку или любую определяемую метку (например, метку, которая может быть определена с помощью антитела, такого как моноклональное антитело). Последовательность нуклеиновой кислоты, кодирующая полипептидную метку, может быть расположена так что, после трансляции, метка располагается на C-конце экспрессируемого антигена. Альтернативно, последовательность нуклеиновой кислоты, кодирующая полипептидную метку, может быть расположена так что, после трансляции, метка располагается на N-конце экспрессируемого антигена. Альтернативно, последовательность нуклеиновой кислоты, кодирующая полипептидную метку, может быть расположена так, что после трансляции, метка располагается внутри экспрессируемого антигена. Нуклеотиды, кодирующие линкерную последовательность, могут быть вставлены между полинуклеотидом, кодирующим экспрессируемый антиген и последовательностью нуклеиновой кислоты, кодирующей полипептидную метку. В одном варианте осуществления изобретения кодируемая линкерная последовательность располагается между экспрессируемым антигенным полипептидом и полипептидной меткой. В одном варианте осуществления изобретения последовательность нуклеиновой кислоты, кодирующая полипептидную метку, и нуклеотиды, кодирующие линкерную последовательность, располагаются так что, после трансляции, линкерная последовательность располагается на С-конце экспрессируемого антигена и метка располагается на С-конце экспрессируемой линкерной последовательности.
В одном варианте осуществления изобретения вектор включает одну или более полинуклеотидных последовательностей, кодирующих микобактериальный антигенный полипептид(ы), где указанная полинуклеотидная последовательность гибко связана с лидерной последовательностью. Лидерная последовательность может влиять на обработку первичного транскрипта в мРНК и/или может влиять на стабильность или эффективность трансляции РНК. В одном варианте осуществления изобретения лидерная последовательность обеспечивает то, что кодируемый полипептидный антиген направлен на секреторный аппарат клетки-хозяина. В одном варианте осуществления изобретения лидерная последовательность усиливает экспрессию и/или иммуногенность антигена. Усиленная иммуногенность может быть определена с использованием обычного анализа, такого как ELISPOT анализ в культуре или ex vivo. Усиленная экспрессия может быть определена обычным анализом, например, с использованием антитела (например, моноклонального антитела) для определения количества продуцируемого белка. В одном варианте осуществления изобретения присутствие лидерной последовательности усиливает экспрессию и/или иммуногенность микобактериального антигена в 2 раза, 3 раза или более при сравнении с антигеном, экспрессируемым без лидерной последовательности. Примером подходящей лидерной последовательности является t-PA (тканевой активатор плазминогена). В одном варианте осуществления изобретения вектор включает C-концево усеченный полинуклеотид, кодирующий указанный микобактериальный антиген, сшитый с t-PA лидерной последовательностью. В одном варианте осуществления изобретения вектор включает C-концево усеченный полинуклеотид, кодирующий указанный микобактериальный антиген, сшитый с t-PA лидерной последовательностью и последовательностью PK метки. Например, лидерная последовательность может быть сшита с N-концом полинуклеотида, кодирующего антиген, и последовательность метки может быть сшита с C-концом полинуклеотида, кодирующего антиген. В одном варианте осуществления изобретения линкерная последовательность (например, Gly-Ser-Ile) располагается между полинуклеотидом, кодирующим антиген, и последовательностью нуклеиновой кислоты, кодирующей метку.
В одном варианте осуществления изобретения указанная антигенная композиция включает индивидуальный вектор, где указанный вектор включает указанный первый микобактериальный антиген и указанный второй микобактериальный антиген. В одном варианте осуществления изобретения указанный индивидуальный вектор дополнительно включает один или более указанных дополнительных микобактериальных антигенов. В одном варианте осуществления изобретения указанная антигенная композиция включает индивидуальный вектор, где указанный вектор включает указанный первый микобактериальный антиген и указанный один или более дополнительных микобактериальных антигенов. В одном варианте осуществления изобретения указанная антигенная композиция включает индивидуальный вектор, где указанный вектор включает указанный второй микобактериальный антиген и указанный один или более дополнительных микобактериальных антигенов. В одном варианте осуществления изобретения указанная антигенная композиция включает индивидуальный вектор, где указанная клетка включает указанный один или более дополнительных микобактериальных антигенов. В альтернативном варианте осуществления изобретения антигенная композиция включает по меньшей мере первый и второй векторы, где указанный первый вектор включает указанный первый микобактериальный антиген (как определено выше) и где указанный второй вектор включает указанный второй микобактериальный антиген (как определено выше). В таком варианте осуществления изобретения первый и второй микобактериальные антигены не присутствуют в одном и том же векторе; скорее, первый и второй микобактериальные антигены находятся в различных векторах. В одном варианте осуществления изобретения указанная антигенная композиция дополнительно включает по меньшей мере третий вектор, где указанный третий вектор включает (один или более) дополнительных микобактериальных антигенов(а), как определено выше.
В одном варианте осуществления изобретения вектором (или по меньшей мере одним из указанных векторов) является вирусный вектор. Вирусные векторы являются обычно не реплицирующимися векторами или векторами с нарушенной репликацией, что означает, что вирусный вектор не может реплицироваться в какой либо значительной степени в нормальных клетках (например, нормальных человеческих клетках), что оценивают обычными средствами - например, посредством измерения синтеза ДНК и/или вирусного титра. Нереплицирующиеся векторы или векторы с нарушенной репликацией могут становиться такими естественно (т.е. их выделили такими из природы) или искусственно (например, путем разведения in vitro или путем генетических манипуляций). Обычно есть по меньшей мере один тип клеток, в которых вирусный вектор с нарушенной репликацией может быть выращен - например, модифицированная vaccinia Ankara (MVA) может быть выращена в клетках CEF. Обычно, вирусный вектор неспособен вызывать достоверное инфицирование животного, обычно пациента млекопитающего, такого как пациент человек, корова, свинья или лошадь. Примеры вирусных векторов, которые являются применимыми в таком контексте, включают векторы аттенуированного вируса коровьей оспы, такие как модифицированный vaccinia Ankara (MVA) и NYVAC, или штаммы, полученные из них. Другие подходящие вирусные векторы включают векторы оспы, такие как векторы avipox, например аттенуированные векторы fowlpox (например, FP9) или векторы canarypox (например, ALVAC и штаммы, полученные из них). Альтернативные вирусные векторы, применимые в настоящем изобретении, включают аденовирусные векторы (например, нечеловеческие аденовирусные векторы), альфавирусные векторы, флавивирусные векторы, герпесвирусные векторы, векторы вируса гриппа и ретровирусные векторы.
В одном варианте осуществления изобретения вектор (или по меньшей мере один из указанных векторов) является вектором экспрессии. Векторы экспрессии являются молекулами нуклеиновой кислоты (линейными или кольцевыми), которые включают одну или более полинуклеотидных последовательностей, кодирующих интересующий полипептид(ы), гибко связанные с дополнительными регуляторными элементами для его экспрессии. В таком отношении, векторы экспрессии обычно включают последовательности промотора и терминатора, и необязательно одну или более энхансерных последовательностей, сигналов полиаденилирования и подобные. Векторы экспрессии также могут включать подходящие трансляционные регуляторные элементы, включая сайты связывания рибосом и последовательности инициации и терминирования трансляции. Транскрипционные и трансляционные регуляторные элементы, используемые в векторах экспрессии по изобретению, являются функциональными в клетке хозяине, используемой для экспрессии, и могут включать таковые, естественно ассоциированные с микобактериальными генами.
Выбор подходящих промоторов, терминаторов, выбираемых маркеров и других элементов является предметом рутинного дизайна на уровне обычного специалиста в области техники. Промоторы, такие как trp, lac и phage промоторы, тРНК промоторы и промоторы гликолитического фермента могут быть использованы у хозяев прокариот. Применимые дрожжевые промоторы включают промоторные участки для металлотионеина, 3-фосфоглицерат киназы и других гликолитических ферментов, таких как енолаза или глицеральдегид-3-фосфат дегидрогеназа, ферменты, ответственные за утилизацию мальтозы и галактозы, и другие. Соответствующие не-нативные промоторы млекопитающих могут включать ранние и поздние промоторы от SV40 или промоторы, полученные из мышиного вируса лейкоза moloney, мышиной опухоли молочной железы, вирусов птичьей саркомы, аденовируса II, вируса бычьей папилломы или полиомы. В одном варианте осуществления изобретения вектор экспрессии включает CMV промотор.
Обычно, ʺгибко связанныйʺ обозначает, что связанные последовательности нуклеиновой кислоты, являются смежными и расположены так, что они действуют совместно для предназначенных целей - например, транскрипция начинается в промоторе и протекает через кодирующий полинуклеотидный сегмент до терминатора. Когда необходимо объединить две области, кодирующие белок, полинуклеотидные кодирующие последовательности должны быть соседними и находиться в рамке считывания.
В одном варианте осуществления изобретение относится к клетке-хозяину, включающей антигенную композицию по изобретению, как определено выше. Следовательно, клетка-хозяин включает первый микобактериальный антиген и второй микобактериальный антиген по изобретению, где указанные микобактериальные антигены могут включать полипептидную и/или полинуклеотидную последовательности, как обсуждается выше.
Соответственно, в одном варианте осуществления изобретения клетка-хозяин включает антигенную композицию, включающую первый микобактериальный антиген и второй микобактериальный антиген; где указанный микобактериальный антиген включает:
(i) последовательность первого микобактериального полипептида, как определено ранее; и необязательно
(ii) вторую (и необязательно дополнительные) микобактериальные полинуклеотидные последовательности, как определено ранее;
и где второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения указанная клетка-хозяин включает или:
(i) первый микобактериальный антигенный полипептид, как определено ранее; или
(ii) первый микобактериальный полинуклеотид, где указанный первый микобактериальный полинуклеотид включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
и необязательно или:
(iii) второй микобактериальный антигенный полипептид, как определено ранее; или
(iv) второй микобактериальный полинуклеотид, где указанный второй микобактериальный полинуклеотид включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный полипептид.
Антигенные композиции, полинуклеотиды или полипептиды по настоящему изобретению могут быть получены путем экспрессии полинуклеотидных последовательностей по изобретению в векторах или других экспрессирующих носителях в совместимых клетках хозяевах прокариот или эукариот с использованием стандартных методов молекулярной биологии (например, Sambrook et al. 1989, Molecular Cloning a Laboratory Manual, Second Edition, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, New York; включенные в настоящее описание в виде ссылки).
Наиболее часто используемые хозяева прокариоты являются штаммами E. coli, хотя могут быть использованы другие прокариоты, такие как B. subtilis или Pseudomonas. Клетки хозяева млекопитающих или других эукариот, такие как дрожжи, волокнистые грибы, растения, насекомые, амфибии или птицы, также могут быть использованы в настоящем изобретении. Репродукция клеток млекопитающих в культуре как таковая хорошо известна. Примеры обычно используемых линий клеток-хозяев млекопитающих представляют собой клетки VERO и HeLa, клетки яичника китайского хомяка (CHO), и клеточные линии WI38, BHK, и COS, хотя другие клеточные линии могут быть соответствующими, например, для обеспечения более высокой экспрессии. В рамках изобретения, "рекомбинантные клетки хозяева", "клетки хозяева", "клетки", "клеточные линии", "клеточные культуры", и другие такие термины, обозначающие микроорганизмы или клеточные линии высших эукариот, культивируемые как одноклеточные сущности, относятся к клеткам, которые могут быть, или были, использованы как реципиенты для рекомбинантного вектора или другой переносящей ДНК, и включают предшественников оригинальной клетки, которая была трансформирована. Понимают, что предшественники единственной родительской клетки не обязательно должны быть полностью идентичны по морфологии или содержанию геномной или общей ДНК, как оригинальный родитель, из-за естественной, случайной или преднамеренной мутации.
Целевые полинуклеотидные последовательности могут быть транскрибированы in vitro и полученная РНК введена в клетку хозяин (например, путем инъекции), или полинуклеотидные последовательности могут быть внесены непосредственно в клетки хозяева посредством методов, которые варьируют в зависимости от клеточного хозяина, включая электропорирование; трансфекцию с использованием хлорида кальция, хлорида рубидия, фосфата кальция, DEAE-декстрана, или других веществ; микропроекционной бомбардировки; липофекции; инфекции (где вектором является инфекционный агент, такой как ретровирусный геном). "Трансформация" относится к вставке экзогенного полинуклеотида в клетку хозяин, вне зависимости от метода, используемого для вставки, например, прямого поглощения, трансдукции, f-матирования или электропорирования.
Векторы могут реплицироваться автономно, или могут реплицироваться путем вставки в геном клетки-хозяина, в указанном случае они могут включать вставочную последовательность. Экспрессированные и клонированные векторы могут содержать выбираемый маркер, ген, кодирующий белок, необходимый для выживания или роста клетки-хозяина, трансформированной вектором. Такой ген обеспечивает рост только тех клеток-хозяев, которые экспрессируют вставки. Обычные выбранные гены кодируют белки, которые (a) придают устойчивость к антибиотикам или другим токсическим веществам, например, ампициллину, неомицину, метотрексату, и др.; (b) дополняют ауксотрофный дефицит; или (c) поставляют критические питательные вещества, не доступные из комплексной среды, например, ген, кодирующий D-аланин рацемазу для бацилл. Выбор соответствующего выбираемого маркера зависит от клетки-хозяина. Трансформированные клетки хозяева могут быть культивированы в соответствии с известными методами, и экспрессируемый полипептид может быть восстановлен и выделен (например, из культуральной среды) с использованием обычных протоколов.
В одном аспекте настоящее изобретение относится к способу получения антигенной композиции, включающему (по меньшей мере) первый микобактериальный антиген и необязательно второй микобактериальный антиген, как определено выше; причем указанный способ включает:
(a) экспрессию полинуклеотидной последовательности, как определено выше, которая кодирует указанный по меньшей мере первый и необязательно второй микобактериальные антигены; или
(b) культивирование клетки-хозяина как описано выше, посредством чего указанная клетка дает указанные по меньшей мере первый и необязательно второй микобактериальные антигены;
и восстановление экспрессируемого антигена(ов).
Изобретение также относится к антителам, которые связывают первый микобактериальный антиген (например, полипептид), как определено выше, и второй микобактериальный антиген (например, полипептид), как определено выше. Следовательно, в одном варианте осуществления изобретение относится к иммуногенной композиции, включающую первое антитело и необязательно второе антитело, где указанное первое антитело связывает первый микобактериальный антиген и указанное второе антитело связывает второй микобактериальный антиген;
где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, кодирующую последовательность полипептида (i), как определено ранее;
и где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения иммуногенная композиция включает первое антитело и второе антитело, где указанное первое антитело связывается с первым микобактериальным антигенным полипептидом и указанное второе антитело связывается со вторым антигенным полипептидом, как определено ранее. Необязательно, указанная иммуногенная композиция дополнительно включает по меньшей мере третье антитело (например, по меньшей мере 3, 4, 5, 6, 7, 8 дополнительных антител), где указанное третье антитело связывается с третьим микобактериальным антигеном, которое отличается от первого и второго микобактериальных антигенов.
Термин ʹантителоʹ охватывает любой полипептид, который включает антиген связывающий фрагмент или антиген связывающий домен. Примеры включают, без ограничения, поликлональные, моноклональные, специфические, моноспецифические, полиспецифические, неспецифические, гуманизированные, человеческие, одноцепочечные, химерные, аффитела, синтетические, рекомбинантные, гибридные, мутированные, привитые и in vitro созданные антитела. Если не предшествует слово ʺинтактныйʺ, термин ʺантителоʺ включает фрагменты антител, такие как Fab, F(ab')2, Fv, scFv, Fd, dAb, и другие фрагменты антител, которые сохраняют функцию связывания антитела. В одном варианте осуществления изобретения антитела, принадлежат к семействам изотипов IgG, IgM или IgA. Ссылки на изотип IgA включают секреторную форму такого антитела (т.е. sIgA). Секреторный компонент (SC) sIgA может быть добавлен in vitro или in vivo. В последнем случае может быть использовано применение натурального аппарата метки SC пациента. В одном варианте осуществления изобретения антитело специфически связывается с интересующим микобактериальным антигеном. ʺСпецифическое связываниеʺ обозначает образование комплекса между двумя или более молекулами, который является относительно стабильным в физиологических условиях. Специфическое связывание характеризуется высокой афинностью и от низкой до умеренной емкости, что отличается от неспецифического связывания, которое обычно имеет низкую афинность с от умеренной до высокой емкости. Типично, связывание между антителом и антигеном расценивается как специфическое, когда константа ассоциации KA составляет выше, чем 106 M1. Если необходимо, неспецифическое связывание может быть уменьшено без существенного влияния на специфическое связывание путем варьирования условий связывания. Соответствующие условия связывания, такие как концентрация антитела, ионная сила раствора, температура, время, необходимое для связывания, концентрация блокирующего агента (например, альбумина сыворотки, молочного казеина), и др., могут быть оптимизированы специалистом с использованием рутинных методик. В одном варианте осуществления изобретения указанные первое и второе антитела были получены против первого и второго микобактериальных антигенов по изобретению, как описано в настоящем описании, соответственно. В одном варианте осуществления изобретения указанные первое и второе антитела были получены против первого и второго микобактериальных антигенных полипептидов по изобретению, как описано в настоящем описании, соответственно. В одном варианте осуществления изобретение обеспечивает антисыворотку, выделенную от животных, которые были иммунизированы антигенной композицией по изобретению. В рамках изобретения, термин ʹантисывороткаʹ относится к антителам в сыворотке, которые обладают определяемым связыванием, например, посредством ELISA или поточной цитометрии, для определенного антигена. Способы получения иммунной сыворотки известны в области техники. Например, первое и второе антитела (и необязательные дополнительные антитела) по изобретению, или иммуногенная композиция по изобретению, могут быть введены животному (такому как млекопитающее, например, лошади или человеку), пока формируется ответ антител (например, нейтрализующий ответ антител) на первый и второй микобактериальные антигены.
Антитела, полученные против антигенных фрагментов, описанных в настоящем описании (например, полипептидных фрагментов), могут иметь свойство распознавания полнодлиннового антигена (например, полнодлиннового полипептида) из которого их получали. В таком отношении, полипептидные фрагменты несут антигенные детерминанты, которые определяются обычными иммуноанализами. Одна или более антигенных детерминант разделяются полнодлинновыми антигенами по изобретению и их фрагментами, следовательно, антитела, полученные против антигенного фрагмента, также могут связывать соответствующие полнодлинновые антигены по изобретению. В одном варианте осуществления изобретения антитела получают в изолированной форме. Антитела могут быть помечены определяемой или функциональной меткой. Такие метки включают радиометки (например, 131I или 99Tc), ферментативные метки (например, пероксидаза хрена или щелочная фосфатаза), и другие химические компоненты (например, биотин).
Вышеописанные антитела могут обеспечивать улучшенную выживаемость при введении млекопитающему, такому как человек, до или сразу после воздействия микобактерий, таких как M. tuberculosis. Соответственно, первое и второе антитела (и необязательные дополнительные антитела) по изобретению (или иммуногенная, содержащая антитела композиция по изобретению) могут быть использованы как пассивная иммунная сыворотка для предотвращения микобактериальной инфекции, или для лечения пациентов, подвергшихся воздействию микобактерий (таких как M. tuberculosis). В одном варианте осуществления изобретения связывание антител с микобактериальными антигенами по изобретению может инициировать покрытие оболочкой микобактерий, экспрессирующих указанный антиген. Покрытие оболочкой микобактерий предпочтительно приводит к их опсонизации, что приводит к разрушению бактерий. Опсонизация антителами может влиять на вход в клетку и распространение микобактерий в фагоцитирующих и нефагоцитирующих клетках путем предотвращения или модуляции рецептор-опосредованного входа и репликации в макрофагах. Без связи с какой-либо теорией, авторы изобретения считают, что лизис макрофагов может приводить к высвобождению бацилл. На этой стадии микобактерии расцениваются как наиболее уязвимые к атаке антител. Следовательно, антитела по настоящему изобретению могут действовать на высвобожденные бациллы, и таким образом проявлять постинфекционный эффект. Следовательно, возможно, что пассивная защита (т.е. доставка антител по настоящему изобретению) облегчается улучшенным доступом антител по настоящему изобретению к антигенам на микобактериальных бациллах, и что связывание антител может блокировать инфицирование макрофагов посредством стерического препятствия или нарушения его олигомерной структуры. Следовательно, антитела, действующие на микобактериальные бациллы, высвобождаемые из убитых, инфицированных макрофагов, могут влиять на распространение реинфекции на свежие макрофаги. Такая гипотеза включает синергическое действие между антителами и цитотоксическими Т клетками, действующими рано после инфицирования, например, T клетки NK, но могут позже вовлекать также CD8 и CD4 цитотоксические T клетки.
В контексте терапевтического применения и способов, обсуждаемых ниже, ʹпациентомʹ является любое животное, которое получит преимущество от стимуляции иммунного ответа против микобактерий, таких как M. tuberculosis. Типичными пациентами животными являются млекопитающие, например, пациенты люди, коровы, свиньи, овцы, козы, лошади, вороны, собаки или кошки. В одном варианте осуществления изобретения пациентом является человек, корова, свинья или лошадь.
В соответствии с одним аспектом, настоящего изобретение относится к применению первого микобактериального антигена и (необязательно) второго микобактериального антигена для получения лекарственного средства для стимуляции иммунного ответа у пациента, такого как млекопитающее, (например, человек, корова, свинья или лошадь); где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида в соответствии с (i);
и где указанный необязательный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
Изобретение также относится к первому микобактериальному антигену и (необязательно) второму микобактериальному антигену для применения в стимуляции иммунного ответа у пациента, такого как млекопитающее, (например, человек, корова, свинья или лошадь); где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида в соответствии с (i);
и где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения указанный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена).
В одном варианте осуществления изобретение обеспечивает (a) первый микобактериальный антигенный полипептид или первый микобактериальный полинуклеотид, и необязательно (b) второй микобактериальный антигенный полипептид или второй микобактериальный полинуклеотид, для применения в стимуляции иммунного ответа у пациента; где
(i) указанный первый микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанная первая микобактериальная полинуклеотидная последовательность, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный необязательный второй микобактериальный антигенный полипептид, как определено ранее; и
(iv) указанная вторая микобактериальная полинуклеотидная последовательность, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный антигенный полипептид.
В одном варианте осуществления изобретение обеспечивает (a) первый микобактериальный антигенный полипептид или первый микобактериальный полинуклеотид, и необязательно (b) второй микобактериальный антигенный полипептид или второй микобактериальный полинуклеотид, для применения в стимуляции иммунного ответа у пациента; где
(i) указанный первый микобактериальный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанная первая микобактериальная полинуклеотидная последовательность как ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный необязательный второй микобактериальный антигенный полипептид включает полипептидную последовательность, как определено ранее; и
(iv) указанная вторая микобактериальная полинуклеотидная последовательность, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный антигенный полипептид.
В одном варианте осуществления изобретения иммунную стимуляцию оценивают по защитному эффекту в анализе выживаемости in vivo. В одном варианте осуществления изобретения, иммунную стимуляцию оценивают по увеличенной частоте иммунных клеток, таких как T лимфоциты, специфичных для антигена в вакцине - т.е. иммунных клеток ответа (например, T клеточный иммунный ответ). В одном варианте осуществления изобретения иммунной стимуляцией является иммунный ответ Т клеток памяти, такой как ответ центральных Т клеток памяти (например, CCR7+ ответ). В одном варианте осуществления изобретения иммунную стимуляцию оценивают по увеличению титра антител, которые являются специфичными для антигена в вакцине.
В одном варианте осуществления изобретения указанное лекарственное средство дополнительно включает один или более дополнительных микобактериальных антигенов, как описано в настоящем описании. В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов, как описано в настоящем описании, также предназначены для применения с указанными первым и вторым микобактериальными антигенами. В одном варианте осуществления указанного терапевтического применения, указанные первый и необязательно второй (и необязательно дополнительный микобактериальный антиген(ы)) получают в форме антигенной композиции, как указано в настоящем описании. В одном варианте осуществления изобретения, один или более из указанных первого, второго и/или необязательно дополнительных микобактериальных антигенов могут быть включены в один или более векторов или клеток, как описано в настоящем описании. В одном варианте осуществления такого терапевтического применения, указанные первый и второй микобактериальные антигены (и необязательный дополнительный микобактериальный антиген(ы)) предназначены для введения пациенту по существу одновременно или последовательно. Схемы одновременного и последовательного введения обсуждаются более подробно ниже.
Настоящее изобретение также обеспечивает применение первого микобактериального антигена и необязательно второго микобактериального антигена для получения лекарственного средства для лечения или профилактики микобактериальной инфекции (например, инфекции M. tuberculosis) у пациента, такого как пациент млекопитающее (например, пациент человек, корова, свинья или лошадь); где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида в соответствии с (i);
и где указанный второй микобактериальный антиген отличается от первого микобактериального антигена.
Изобретение также относится к первому микобактериальному антигену и необязательно второму микобактериальному антигену для применения в лечении или профилактике микобактериальной инфекции (например, инфекции M. tuberculosis) у пациента, такого как млекопитающее (например, человек, корова, свинья или лошадь); где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, кодирующую последовательность полипептида, как указано ранее, в соответствии с (i);
и где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения указанный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от первого микобактериального антигена).
В одном варианте осуществления изобретение относится к (a) первому микобактериальному антигенному полипептиду или первому микобактериальному полинуклеотиду, и необязательно (b) второму микобактериальному антигенному полипептиду или второму микобактериальному полинуклеотиду, для применения в лечении или профилактике микобактериальной инфекции (например, инфекции M. tuberculosis) у пациента; где:
(i) указанный первый микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанная первая микобактериальная полинуклеотидная последовательность, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный необязательный второй микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; и
(iv) указанная вторая микобактериальная полинуклеотидная последовательность, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный антигенный полипептид.
Например, указанное применение или лекарственное средство могут защищать пациента от инфекции микобактериями, такими как M. tuberculosis. Например, подходящие пациенты включают человека, коров, свиней или лошадей. В одном варианте осуществления изобретения указанное лекарственное средство дополнительно включает один или более дополнительных микобактериальных антигенов, как описано в настоящем описании. В одном варианте осуществления изобретения один или более дополнительных микобактериальных антигенов, как описано в настоящем описании, также предназначены для применения с указанным первым и вторым микобактериальными антигенами.
В одном варианте осуществления указанного терапевтического применения, указанный первый и второй (и необязательно дополнительный микобактериальный антиген(ы)) получают в форме антигенной композиции, как описано в настоящем описании. В одном варианте осуществления изобретения один или более из указанных первого, второго и/или необязательно дополнительных микобактериальных антигенов могут содержаться в одном или более векторов или клеток, как описано в настоящем описании. В одном варианте осуществления такого терапевтического применения, указанный первый и второй микобактериальные антигены (и необязательно дополнительный микобактериальный антиген(ы)) предназначены для введения пациенту по существу одновременно или последовательно.
Связанный аспект включает способ стимуляции иммунного ответа у пациента, включающий введение пациенту, такому как млекопитающее (например, пациент человек, корова, свинья или лошадь) эффективного количества первого микобактериального антигена и необязательно второго микобактериального антигена;
где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, описанную ранее; или
(ii) полинуклеотидную последовательность, кодирующую последовательность полипептида, как определено ранее, в соответствии с (i);
и где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения указанный необязательный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена).
В одном варианте осуществления изобретение относится к способу стимуляции иммунного ответа у пациента, включающему введение указанному пациенту: (a) первого микобактериального антигенного полипептида или первого микобактериального полинуклеотида, и необязательно (b) второго микобактериального антигенного полипептида или второго микобактериального полинуклеотида; где:
(i) указанный первый микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанный первый микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный второй микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; и
(iv) указанный второй микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую микобактериальный полипептид.
В одном варианте осуществления изобретения иммунную стимуляцию оценивают по защитному эффекту в анализе выживаемости in vivo. В одном варианте осуществления изобретения иммунную стимуляцию оценивают по увеличенной частоте иммунных клеток, таких как T лимфоциты, специфичных для антигена в вакцине - т.е. ответ иммунных клеток (например, иммунный ответ Т клеток). В одном варианте осуществления изобретения иммунной стимуляцией является Т клеточный иммунный ответ, такой как ответ центральных Т клеток памяти (например, ответ CCR7+). В одном варианте осуществления изобретения иммунную стимуляцию оценивают по увеличению титра антител, которые являются специфическими для антигена в вакцине. В одном варианте осуществления изобретения указанный метод дополнительно включает введение одного или более дополнительных микобактериальных антигенов, как описано в настоящем описании. В одном варианте осуществления настоящего терапевтического метода, указанный первый и необязательно второй (и необязательно дополнительный микобактериальный антиген(ы)) получают в форме антигенной композиции или рецептуры, как описано в настоящем описании. В одном варианте осуществления изобретения один или более из указанных первого, второго и/или необязательных дополнительных микобактериальных антигенов, могут содержаться в одном или более векторах или клетках, как описано в настоящем описании. В одном варианте осуществления изобретения такого терапевтического способа, любое из ограничений, описанных в настоящем описании, в отношении указанного первого и/или второго микобактериальных антигенов (и/или необязательно дополнительных микобактериальных антигенов) применяются равно к его терапевтическим применениям. В одном варианте осуществления изобретения способ включает введение указанного первого и второго микобактериальных антигенов пациенту по существу одновременно или последовательно. Схемы одновременного и последовательного введения обсуждаются более подробно ниже.
В связанном аспекте изобретение относится к способу лечения или профилактики микобактериальной инфекции (например, инфекции M. tuberculosis), включающему введение пациенту, такому как млекопитающее (например, человек, корова, свинья или лошадь) эффективного количества первого микобактериального антигена и необязательно второго микобактериального антигена;
где указанный микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида по (i);
и где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена.
В одном варианте осуществления изобретения указанный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена). В одном варианте осуществления изобретение обеспечивает способ лечения или профилактики микобактериальной инфекции (например, инфекции M. tuberculosis) у пациента; включающий введение указанному пациенту: (a) первого микобактериального антигенного полипептида или первого микобактериального полинуклеотида, и необязательно (b) второго микобактериального антигенного полипептида или второго микобактериального полинуклеотида; где:
(i) указанный первый микобактериальный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанный первый микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный второй микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; и
(iv) указанный второй микобактериальный полинуклеотид, как определено ранее.
Например, указанный метод может защищать пациента от инфицирования микобактериями, такими как M. tuberculosis. Например, указанный метод может лечить ТБ у пациента. В одном варианте осуществления изобретения указанный метод может защищать пациента от ранней стадии инфицирования микобактериями, такими как M. tuberculosis. Ранние стадии микобактериальной инфекции определены выше. В одном варианте осуществления изобретения указанный метод дополнительно включает введение одного или более дополнительных микобактериальных антигенов, как описано в настоящем описании. В одном варианте осуществления указанного терапевтического метода указанный первый и необязательно второй (и необязательные дополнительные микобактериальные антиген(ы)) получают в форме антигенной композиции, как описано в настоящем описании. В одном варианте осуществления изобретения один или более из указанных первого, второго и/или необязательно дополнительных микобактериальных антигенов могут содержаться в одном или более векторах или клетках, описанных в настоящем описании. В одном варианте осуществления изобретения способ включает введение указанного первого и второго микобактериальных антигенов пациенту, по существу одновременно или последовательно. В связанном аспекте, первый и второй (не обязательно дополнительные) микобактериальные антигены, антигенные композиции, антитела, иммуногенная композиция или лекарственное средство по настоящему изобретению, как определено в настоящем описании, могут быть использованы в качестве терапии (включая профилактическое лечение) для диапазона микобактериальных заболеваний, не ограниченных туберкулезом (ТБ), лепрой, инфекцией M. avium, инфекцией M. bovis, инфекцией M. paratuberculosis, инфекцией M. ulcerans (например, язва Бурули), или другой нетуберкулезной микобактериальной инфекцией.
Первый и второй (и необязательно дополнительные) микобактериальные антигены, антигенная композиция, антитела, иммуногенная композиция или лекарственное средство по настоящему изобретению могут быть использованы для индукции диапазона иммунных ответов, и следовательно, могут быть использованы в способах лечения ряда заболеваний. В одном варианте осуществления изобретения первый и необязательно второй (и необязательно дополнительные) микобактериальные антигены, антигенная композиция или лекарственное средство по настоящему изобретению могут быть использованы для лечения или профилактики ряда немикобактериальных заболеваний, в которых участвуют микобактерии. Например, заболевания, при которых может быть полезно лекарственное средство по изобретению, включают воспалительные заболевания, такие как аутоиммунные заболевания, рак, (например, рак мочевого пузыря), воспалительные заболевания кишечника, болезнь Крона, болезнь Джона, болезнь Хансена, остеомиелит, лимфаденит, натуральная оспа или оспа обезьян.
В рамках изобретения, термин ʺлечениеʺ или ʺтерапияʺ охватывает терапевтические или превентивные/профилактические меры, и включает постинфекционную терапию и облегчение/подавление микобактериальной инфекции. В рамках изобретения, термин "предотвращение" включает предотвращение развития микобактериальной инфекции и/или уменьшение тяжести или выраженности микобактериальной инфекции. В рамках изобретения, термин ʺэффективность вакциныʺ описывает способность вакцины защищать пациента (обычно млекопитающего, например, человека, коровы, свиньи или лошади) от инфицирования микобактериями, такими как M. tuberculosis. В качестве примера, ʺэффективность вакциныʺ может относиться к эффективности вакцины в профилактике развития микобактериальной инфекции и/или уменьшении тяжести/выраженности микобактериальной инфекции.
Терапевтическая/профилактическая композиция или лекарственное средство можно вводить пациенту (обычно млекопитающему, такому как человек, корова, свинья или лошадь), уже имеющему микобактериальную инфекцию, состояние или симптомы, ассоциированные с микобактериальной инфекцией, для лечения или профилактики указанной микобактериальной инфекции. В одном варианте осуществления изобретения пациент, вероятно, контактировал с микобактериями, или имел известный контакт с микобактериями, но еще не проявляет симптомов инфицирования. В одном варианте осуществления изобретения пациент имеет инфекцию на ранней стадии. При введении пациенту (например, млекопитающему, такому как человек, корова, свинья или лошадь), который уже имеет микобактериальную инфекцию или заболевание, или проявляет симптомы, ассоциированные с микобактериальной инфекцией, терапевтическая композиция/лекарственное средство могут лечить, замедлять, уменьшать тяжесть или облегчать один или более симптомов и/или продлевать выживаемость пациента относительно того, что ожидается в отсутствие такого лечения. Альтернативно, терапевтическая/профилактическая композиция или лекарственное средство могут быть введены пациенту (например, млекопитающему, такому как человек, корова, свинья или лошадь), который в конечном счете может приобрести микобактериальную инфекцию, с целью предотвращения, лечения, отсрочки, уменьшения тяжести или облегчения одного или более симптомов указанной микобактериальной инфекции или с целью продления выживаемости пациента относительно таковой, которую ожидали в отсутствие такого лечения. В одном варианте осуществления изобретения пациент ранее подвергался воздействию микобактерий. Например, пациент может иметь микобактериальную инфекцию в прошлом (но необязательно в настоящее время не инфицирован микобактериями). Пациент может быть латентно инфицирован микобактериями. Альтернативно, или в добавление пациент может быть вакцинирован против микобактериальной инфекции в прошлом (например, пациент ранее получал вакцинацию БЦЖ).
Лечение и профилактическая терапия по настоящему изобретению могут быть использованы в отношении множества различных пациентов различного возраста. В контексте человека, терапия может быть использована у детей (например, младенцев, детей в возрасте до 5 лет, детей более старшего возраста или подростков) и взрослых. В контексте других животных (например, млекопитающих, таких как коровы, свиньи или лошади), терапия может быть использована у незрелых пациентов (например, телят, поросят, жеребят) и зрелых/взрослых пациентов. Терапевтическое и профилактическое лечение по настоящему изобретению могут быть использованы у пациентов, которые иммуноскомпрометированы или имеют иммуносупрессию (например, люди, которые имеют ВИЧ или СПИД, или другие животные со сравнимыми иммунодефицитными заболеваниями), пациенты, которые подверглись трансплантации органов, трансплантации костного мозга или которые имеют генетический иммунодефицит.
Изобретение относится к терапевтическим композициям, лекарственным средствам и профилактическим композициям (например, вакцинам), включающим фармацевтически приемлемый носитель, первый микобактериальный антиген по изобретению, как определено выше, и второй микобактериальный антиген по изобретению, как описано выше (и необязательно один или более дополнительных микобактериальных антигенов по изобретению, как описано выше). В одном варианте осуществления изобретение относится к терапевтической или профилактической композиции (например, вакцине), включающей фармацевтически приемлемый носитель и:
(a) первый микобактериальный антиген, где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида по (i);
и необязательно
(b) второй микобактериальный антиген, где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена;
где указанная композиция предназначена для одновременного или последовательного введения указанных первого и второго микобактериальных антигенов.
В одном варианте осуществления изобретения указанный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена).
В одном варианте осуществления изобретения указанная терапевтическая или профилактическая композиция (например, вакцина), включает (a) фармацевтически приемлемый носитель; (b) первый микобактериальный антигенный полипептид или первый микобактериальный полинуклеотид; и необязательно (c) второй микобактериальный антигенный полипептид или второй микобактериальный полинуклеотид; где:
(i) указанный первый микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее;
(ii) указанный первый микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид;
(iii) указанный второй микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; и
(iv) указанный второй микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный полипептид;
где указанная композиция предназначена для одновременного или последовательного введения указанного первого микобактериального антигенного полипептида или полинуклеотида и указанного второго микобактериального антигенного полипептида или полинуклеотида.
В одном варианте осуществления изобретения указанная терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) по изобретению включает антигенную композицию по изобретению, как определено выше. В одном варианте осуществления изобретения указанная терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) включает антигенную композицию, включающую один или более векторов или клеток, как описано выше, где указанные векторы или клетки включают по меньшей мере один из микобактериальных антигенов. В одном варианте осуществления изобретения указанная терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина), любое из ограничений, описанных в настоящем описании в отношении указанных первого и/или второго (или дополнительных) микобактериальных антигенов применяется равно к указанной терапевтической композиции, лекарственному средству или профилактической композиции (например, вакцине). В одном варианте осуществления изобретения вакцина по изобретению является ʺвекторной вакцинойʺ, включающей один или более векторов, как описано выше.
В одном варианте осуществления изобретения терапевтические композиции, лекарственные средства или профилактические композиции (например, вакцины) по изобретению предназначены для одновременного введения указанного первого и второго (и/или необязательно дополнительных) микобактериальных антигенов. В альтернативном варианте осуществления изобретения терапевтические композиции, лекарственные средства или профилактические композиции (например, вакцины) по изобретению предназначены для последовательного введения указанного первого и второго (и/или необязательно дополнительных) микобактериальных антигенов. Терапевтические композиции, лекарственные средства и профилактические композиции (например, вакцины) по изобретению включают фармацевтически приемлемый носитель и необязательно одно или более из соли, вспомогательного вещества, разбавителя и/или добавки. В одном варианте осуществления изобретения терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) по изобретению может включать один или более иммунорегуляторных агентов, выбираемых из, например, иммуноглобулинов, антибиотиков, интерлейкинов (например, IL-2, IL-12), и/или цитокинов (например, IFN-γ). В одном варианте осуществления изобретения терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) по изобретению может включать одного или более антимикробных соединений, таких как обычные противотуберкулезные лекарственные средства (например, рифампицин, изониазид, этамбутол или пиразинамид).
Соответственно, в одном аспекте, изобретение относится к способу получения терапевтической или профилактической композиции (например, вакцины), включающему комбинацию фармацевтически приемлемого носителя с первым микобактериальным антигеном по изобретению, как определено выше; и вторым микобактериальным антигеном по изобретению, как определено выше (и необязательно одним или более дополнительными микобактериальными антигенами, как определено выше).
Следовательно, в одном варианте осуществления изобретение относится к способу получения терапевтической или профилактической композиции (например, вакцины), включающему комбинацию фармацевтически приемлемого носителя с:
(a) первым микобактериальным антигеном, где указанный первый микобактериальный антиген включает:
(i) последовательность полипептида, как определено ранее; или
(ii) полинуклеотидную последовательность, как определено ранее, кодирующую последовательность полипептида в соответствии с (i);
и необязательно
(b) вторым микобактериальным антигеном, где указанный микобактериальный антиген отличается от первого микобактериального антигена.
В одном варианте осуществления изобретения указанный второй микобактериальный антиген включает или состоит из последовательности микобактериального антигенного полипептида или полинуклеотида, такой как последовательность микобактериального антигенного полипептида или полинуклеотида, как определено в (i) или (ii) (где указанный второй микобактериальный антиген отличается от указанного первого микобактериального антигена).
В одном варианте осуществления изобретение относится к способу получения терапевтической или профилактической композиции (например, вакцины), включающему:
смешивание фармацевтически приемлемого носителя с или:
(i) первым микобактериальным антигенным полипептидом, где указанный первый микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; или
(ii) первым микобактериальным полинуклеотидом, где указанный первый микобактериальный полинуклеотид включает полинуклеотидную последовательность, как определено ранее, кодирующую указанный первый микобактериальный антигенный полипептид;
и необязательно с любым:
(iii) вторым микобактериальным антигенным полипептидом, где указанный второй микобактериальный антигенный полипептид включает последовательность полипептида, как определено ранее; или
(iv) вторым микобактериальным полинуклеотидом, где указанный второй микобактериальный полинуклеотид, как определено ранее, включает полинуклеотидную последовательность, кодирующую указанный второй микобактериальный полипептид.
В одном варианте осуществления изобретения указанные микобактериальные антигены находятся в форме антигенной композиции по изобретению, как определено выше. В одном варианте осуществления изобретения способ дополнительно включает смешивание указанного фармацевтически приемлемого носителя и микобактериальных антигенов (или антигенной композиции) с одним или более из соли, вспомогательного вещества, разбавителя, иммунорегуляторного агента и/или антимикробного соединения.
В рамках изобретения ʺвакцинаʺ представляет собой композицию, которая, при введении животному, такому как млекопитающее (например, человек, корова, свинья, овца, коза, лошадь, ворона, собака или кошка), стимулирует защитный иммунный ответ против микобактериальной инфекции. Иммунный ответ может быть гуморальным и/или клеточным иммунным ответом (например, Т клеточным ответом). Вакцина по изобретению может быть использована, например, для защиты животного от эффектов микобактериальной инфекции (например, инфекции M. tuberculosis), такой как инфекция на ранней стадии. Иммуногенность эпитопов первого и второго микобактериальных антигенов (например, полипептидов) по изобретению может быть усилена путем получения их в системах млекопитающих или дрожжей, сшитых с или соединенных с белками, формирующими частицы, такими как, например, таковые, ассоциированные с поверхностным антигеном гепатита B. В одном варианте осуществления изобретения вакцина включает по меньшей мере один микобактериальный полипептид, который был обработан химическим модифицирующим агентом (таким как формальдегид) для получения вакцины с улучшенной эффективностью.
Полипептиды и/или полинуклеотиды по изобретению могут быть рецептированы в вакцине в виде нейтральных или солевых форм. Фармацевтически приемлемые соли включают аддитивные соли кислот, образованные с неорганическими кислотами, такими как, например, соляная или фосфорная кислоты, или с органическими кислотами, такими как уксусная, щавелевая, виннокаменная, малеиновая и подобные. Соли, образованные со свободными карбоксильными группами, также могут быть получены из неорганических оснований, таких как, например, гидроксиды натрия, калия, аммония, кальция или железа и такими органическими основаниями, как изопропиламин, триметиламин, 2-этиламиноэтанол, гистидин, прокаин и подобные.
Введение терапевтических композиций, лекарственных препаратов и профилактических композиций (например, вакцин) обычно осуществляют обычными путями, например, внутривенным, подкожным, интраперитонеальным или чресслизистым (например, интраназальным) путями. Введение может осуществляться посредством парентеральной инъекции, например, подкожной или внутримышечной инъекции. Композиции, включающие нейтрализующие антитела, могут быть особо подходящими для введения внутривенно, внутримышечно, внутрикожно или подкожно. Соответственно, терапевтические композиции, лекарственные средства и профилактические композиции (например, вакцины) по изобретению обычно получают как инъекционные препараты, или в виде жидких растворов или суспензий. Твердые формы, подходящие для растворения или суспендирования в жидкости перед инъекцией, могут альтернативно быть получены. Препарат также может быть эмульгирован или являться пептидом, инкапсулированным в липосомах или микрокапсулах. Активные иммуногенные ингредиенты часто смешивают с вспомогательными веществами, которые являются фармацевтически приемлемыми и совместимыми с активным ингредиентом. Подходящими вспомогательными веществами являются, например, вода, солевой раствор, декстроза, глицерин, этанол или подобные и их комбинации. Кроме того, при желании, вакцина может содержать минорные количества вспомогательных веществ, таких как увлажняющие или эмульгирующие агенты, рН буферы и/или добавки, которые усиливают эффективность вакцины. Обычно носителем является фармацевтически приемлемый носитель. Неограничивающие примеры фармацевтически приемлемых носителей включают воду, солевой раствор и фосфатный буферный раствор. В некоторых вариантах осуществления изобретения, однако, композиция находится в лиофилизированной форме, в таком случае она может включать стабилизатор, такой как BSA. В некоторых вариантах осуществления изобретения может быть желательно рецептировать композицию с консервантом, таким как тиомерсал или азид натрия, для облегчения длительного хранения. Примеры добавок, которые могут быть эффективными, включают, без ограничения: полный адъювант Фрейнда (CFA), неполный адъювант Фрейнда (IVA), сапонин, очищенную фракцию экстракта сапонина, такую как Quil A, производное сапонина, такое как QS-21, липидные частицы на основе сапонина, такие как ISCOM/ISCOMATIX, мутанты теплолабильного токсина E. coli (LT) такие как LTK63 и/или LTK72, гидроксид алюминия, N-ацетилмурамил-L-треонил-D-изоглютамин (thr-MDP), N-ацетил-нор-мурамил-L-аланил-D-изоглютамин (CGP 11637, называемый как нор-MDP), N-ацетилмурамил-L-аланил-D-изоглютаминил-L-аланин-2-(1'-2'-дипальмитоил-sn-глицеро-3-гидроксифосфорилокси)этиламин (CGP 19835A, называемый как MTP-PE), и RIBI, каждый содержит три компонента, экстрагированные из бактерий, монофосфориллипид A, димиколат трегалозы и скелет клеточной стенки (MPL+TDM+CWS) в 2% эмульсии сквалана/Tween 80. Примеры буферов включают, без ограничения, сукцинат натрия (pH 6,5), и фосфатный буферный раствор (PBS; pH 6,5 и 7,5). Дополнительные композиции, которые являются подходящими для других путей введения, включают суппозитории и, в некоторых случаях, пероральные композиции или композиции, подходящие для доставки в виде аэрозолей. Для суппозиториев традиционные вяжущие вещества и носители могут включать, например, полиалкиленгликоли или триглицериды; такие суппозитории могут быть получены из смесей, содержащих активный ингредиент в диапазоне от 0,5% до 10%, предпочтительно 1%-2%. Пероральные композиции включают такие обычно используемые вспомогательные вещества как, например, фармацевтической чистоты маннит, лактозу, крахмал, стеарат магния, сахарин натрия, целлюлозу, карбонат магния и подобные. Такие композиции имеют форму растворов, суспензий, таблеток, пилюль, капсул, композиций длительного высвобождения или порошков.
В случае микобактериальной респираторной инфекции (например, инфекции M. tuberculosis), эффективная транспортировка терапевтической/профилактической композиции или лекарственного средства в место инфекции в легких может быть достигнута путем перорального или интраназального введения (и.н.). Такие пути доставки соответствуют пути доставки инфекции M. tuberculosis. В случае композиций на основе антител, такие пути доставки обеспечивают, чтобы антитела присутствовали в месте инфекции для борьбы с бактерией до того как она станет внутриклеточной и также в течение периода, когда она распространяется между клетками. Композиции для интраназального введения могут находиться в форме назальных капель или назального спрея. Интраназальная композиция может включать капли, имеющие приблизительный диаметр в диапазоне 100-5000 мкм, например, 500-4000 мкм, 1000-3000 мкм или 100-1000 мкм. Альтернативно, в отношении объема, капли могут находиться в диапазоне около 0,001-100 мкл, например, 0,1-50 мкл или 1,0-25 мкл, или например, 0,001-1 мкл. Альтернативно, терапевтическая/профилактическая композиция или лекарственное средство могут находиться в аэрозольной композиции. Аэрозольная композиция может иметь форму порошка, суспензии или раствора. Размер частиц аэрозоля является важным для способности доставки аэрозоля. Меньшие частицы могут проходить через дыхательные пути дальше в направлении альвеол, чем более крупные частицы. В одном варианте осуществления изобретения аэрозольные частицы имеют распределение диаметров для облечения доставки по всей длине бронхов, бронхиол и альвеол. Альтернативно, распределение размера частиц может быть выбрано для нацеливания на определенный отдел дыхательного тракта, например, альвеолы. В случае аэрозольной доставки лекарственного средства, частицы могут иметь диаметр в приблизительном диапазоне 0,1-50 мкм, предпочтительно 1-25 мкм, более предпочтительно 1-5 мкм. Аэрозольные частицы могут быть предназначены для доставки с использованием небулайзера (например, через рот) или назального спрея. Аэрозольная композиция может необязательно содержать пропеллент и/или поверхностно-активное вещество. Возможно, чтобы после и.н. доставки микобактериальных антигенов или антител, их прохождение в легкие облегчалось посредством обратного тока секрета слизи, хотя считают, что мукоцилиарное действие в дыхательном тракте принимает частицы в слизь из легких. Относительно длительное персистирование в отделяемом из легких, быстрое выделение из желчи и отсутствие транспорта в слюне некоторых антител предполагает роль специфических для слизистых оболочек механизмов. Путем регуляции размера капель/частиц в рамках определенного диапазона по настоящему изобретению, возможно избежать (или минимизировать) непреднамеренную доставку антигена в альвеолы и следовательно избежать патологических проблем в альвеолах, таких как воспаление и фиброзное рубцевание легких. И.н. вакцинация запускает и T и B клеточный эффекторный механизм в слизистых оболочках полости носа и бронхов, которые отличаются от других ассоциированных со слизистой оболочкой лимфоидных тканей. Защитные механизмы, реализуемые при интраназальном пути введения, могут включать: активацию T лимфоцитов с предпочтительной локализацией в легких; стимуляцию ко-стимуляторных молекул (например, B7.2); и/или активацию макрофагов или секреторных IgA антител. Интраназальная доставка антигенов может облегчать запуск ответа антител слизистых оболочек, что осуществляется путем сдвига Т клеточного ответа в направлении Th2 фенотипа, который способствует продукции антител. Ответ слизистых оболочек характеризуется усиленной продукцией IgA, и Th2 ответ характеризуется усиленной продукцией IL-4. Интраназальная доставка микобактериальных антигенов по изобретению позволяет нацеливание антигенов на субклеточные B клетки дыхательной системы. Такие B клетки являются главными локальными IgA-продуцирующими клетками у млекопитающих и интраназальная доставка облегчает быстрое увеличение продукции такими клетками IgA против микобактериальных антигенов. В одном варианте осуществления изобретения терапевтическая/профилактическая композиция или лекарственное средство по изобретению стимулируют слизистую оболочку и/или Th2 иммунный ответ. В другом варианте осуществления изобретения продукция IgA стимулируется и IgA антитела связываются с микобактериальным антигеном.
В одном варианте осуществления изобретения первый и второй (и необязательно дополнительный) микобактериальные антигены или антитела по изобретению предназначены для одновременного введения. Следовательно, в одном варианте осуществления изобретения способы/применение по изобретению включают одновременное введение первого и второго (и необязательно дополнительных) микобактериальных антигенов. Одновременное введение обозначает введение (по существу) в одно и то же время. Например, в одном варианте осуществления изобретения первый и второй (и необязательно дополнительные) микобактериальные антигены вводят пациенту в течение 5 минут друг от друга, например, в течение 4, 3, 2 или 1 минуты друг от друга, например, в рамках 30 секунд друг от друга. В одном варианте осуществления ʹодновременного введенияʹ, по меньшей мере два компонента (например, антигены) по изобретению смешивают в одной композиции (например, одной антигенной композиции или иммуногенной композиции по изобретению, как определено в настоящем описании). Такую композицию вводят пациенту (такому как млекопитающее, например, человек, корова, свинья, овца, коза, лошадь, ворона, собака или кошка), таким образом доставляя оба компонента пациенту одновременно. В альтернативном варианте осуществления ʹодновременного введенияʹ по меньшей мере два из компонентов (например, антигены) по изобретению используют отдельно друг от друга, но вводят пациенту (такому как млекопитающее - например, человеку, корове, свинье, овце, козе, лошади, вороне, собаке или кошке) в (по существу) одно и то же время. Сопутствующее/параллельное введение указанных отдельных композиций доставляет оба компонента пациенту в (по существу) одно и то же время. В качестве примера терапевтическая или профилактическая композиция (например, вакцина) по изобретению может включать первый микобактериальный антиген в первой композиции и второй микобактериальный антиген во второй композиции. В одном варианте осуществления изобретения первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению предназначены для одновременного введения в (по существу) одно и то же место. Следовательно, в одном варианте осуществления изобретения способы/применение по изобретению включают одновременное введение первого и второго (и необязательно дополнительных) микобактериальных антигенов в (по существу) одно и то же место. В таком отношении считается преимущественным вводить каждый различный антигенный компонент обычных мультивалентных вакцин в различные участки тела организма, с целью стимуляции различных лимфатических узлов. Введение различных антигенных компонентов обычных мультивалентных вакцин в различные участки также расценивается преимущественным с целью уменьшения или избегания нежелательного антигенного соревнования.
В одном варианте осуществления настоящее изобретение преимущественно позволяет избежать необходимости вводить каждый различный антигенный компонент в различные участки/места тела пациента. В таком отношении первый и второй (и необязательно дополнительные) антигены по настоящему изобретению (по существу) не конкурируют друг с другом или ассоциированы с относительно низким уровнем антигенной конкуренции, по сравнению с конкурентным эффектом, который можно ожидать в свете известных композиций мультивалентных вакцин. Если по меньшей мере два компонента (например, антигены) по изобретению смешивают в одной композиции (например, одной антигенной композиции или иммуногенной композиции по изобретению, как определено в настоящем описании), очевидно, что все компоненты по изобретению вводят пациенту в одно и то же место. В одном варианте осуществления изобретения, если первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению используют отдельно друг от друга для одновременного, параллельного введения пациенту в (по существу) одно и то же время, отдельные композиции вводят в одно и то же (или по существу одно и то же) область на/в пациенте.
В одном варианте осуществления изобретения введение в (по существу) одно и то же место на/в пациенте, означает, что область, в которую вводят каждый микобактериальный антиген по изобретению, находится поблизости от или очень близко от области, в которую вводят другие микобактериальные антигены по изобретению. Альтернативно, введение в (по существу) ту же самую область на/в пациенте означает, что область, в которую вводят каждый микобактериальный антиген по изобретению, находится в том же месте, в которое вводят другие микобактериальные антигены по изобретению. В качестве примера, первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут предназначаться для введения в ту же вену, артерию или мышцу пациента, или посредством одной и той же ноздри пациента; или той же конечности (например, руки) пациента (например, в то же плечо пациента); или первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут быть предназначены для перорального или сублингвального введения. В одном варианте осуществления изобретения первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут все быть предназначены для введения в или в непосредственной близости от одного и того же лимфатического узла. Альтернативно, микобактериальные антигены по изобретению предназначены для введения пациенту (например, млекопитающему, такому как человек, корова, свинья, овца, коза, лошадь, ворона, собака или кошка) последовательно (т.е. один после другого). В указанном варианте осуществления изобретения по меньшей мере два из компонентов (например, антигенов) по изобретению обеспечивают отдельно друг от друга и вводят пациенту последовательно. В качестве примера, терапевтическая или профилактическая композиция (например, вакцина) по изобретению может включать первый микобактериальный антиген в первой композиции и второй микобактериальный антиген во второй композиции. Последовательное введение указанных первой и второй композиции обеспечивает два компонента пациенту один за другим. Следовательно, в одном варианте осуществления изобретения способы по изобретению включают введение первого микобактериального антигена и затем введение второго микобактериального антигена. Альтернативно, можно вводить второй микобактериальный антиген и затем вводить первый микобактериальный антиген. Любые дополнительные микобактериальные антигены можно вводить вместе с первым и/или вторым микобактериальными антигенами. Альтернативно, любые дополнительные микобактериальные антигены можно вводить до или после первого и/или второго микобактериального антигена.
В одном варианте осуществления изобретения каждое последовательное введение антигена осуществляют непосредственно одно после другого. В одном варианте осуществления изобретения существует временной интервал или пауза между одним или более (например, между каждыми) введениями. Временной интервал или пауза между последовательными введениями может составлять, по меньшей мере, 5, 10, 15, или 30 минут или может составлять по меньшей мере 1, 2, 5, 12, 18 или 24 часов или может составлять по меньшей мере 1, 2, или 5 дней, или может составлять по меньшей мере 1 или 2 недели. В одном варианте осуществления изобретения первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению предназначены для последовательного введения в (по существу) одно и то же место. Следовательно, в одном варианте осуществления изобретения способы/применение по изобретению включают последовательное введение первого и второго (и необязательно дополнительных) микобактериальных антигенов в (по существу) одно и то же место. В одном варианте осуществления изобретения введение в (по существу) одно и то же место на/в пациенте обозначает, что место, в которое вводят каждый микобактериальный антиген по изобретению, расположено близко от или в непосредственной близости к месту, в которое вводили другие микобактериальные антигены. Альтернативно, введение в (по существу) одно и то же место на/в пациенте обозначает, что место, в которое вводят каждый микобактериальный антиген по изобретению, находится в том же месте, в которое вводят другие микобактериальные антигены по изобретению. В качестве примера, первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут предназначаться для введения в одну и ту же вену, артерию или мышцу пациента или посредством той же ноздри пациента; или в одну и ту же конечность (например, руку) пациента (например в то же самое плечо пациента); или первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут предназначаться для перорального или сублингвального введения. В одном варианте осуществления изобретения первый и второй (и необязательно дополнительные) микобактериальные антигены по изобретению могут все предназначаться для введение в или в тесной близости от одного и того же лимфатического узла.
Терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) по изобретению могут быть даны по схеме одной дозы (т.е. полную дозу дают по существу в одно время). Альтернативно, терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) по изобретению может быть дана по схеме нескольких доз. Схема нескольких доз представляет собой таковую, в которой первичный курс лечения (например, вакцинация) может проводиться с 1-6 отдельными дозами, с последующими дозами, даваемыми с последующими временными интервалами, требуемыми для поддержания с/или для усиления иммунного ответа, например, (для пациентов людей), через 1-4 месяца для второй дозы и если необходимо, последующей доз(ы) через еще 1-4 месяцев. Схема введения определяется, по меньшей мере частично, по потребности индивида и зависит от мнения практикующего врача (например, доктора или ветеринара). В одном варианте осуществления изобретения вакцину по настоящему изобретению можно вводить как часть режима вакцинации ʹпрайм-бустʹ.
Схемы вакцинации прайм-буст включают: примирование - т.е. воздействие на пациента одного или более антигенов или вакцины; и впоследствии: бустер-иммунизацию - т.е. воздействие на пациента одного или более антигенов или вакцины. ʹБустерныеʹ антигены/вакцины обычно отличаются от ʹпраймеровʹ антигенов/вакцин (известные как ʺгетерологичныйʺ прайм-буст). В этом отношении было показано, что гетерологичные стратегии иммунизации прайм-буст индуцируют более высокий уровень ответа иммунных клеток (например, ответа эффекторных Т клеток) у пациентов при сравнении с гомологичным бустингом той же самой вакциной. Например, повторная вакцинация обычными вакцинами, такими как БЦЖ, вероятно дополнительно не усиливает защиты против ТБ. Однако, включение БЦЖ в гетерологичный режим прайм-буст может сохранять защитные эффекты БЦЖ. Следовательно, в одном варианте осуществления изобретение обеспечивает способ вакцинации против микобактериальной инфекции, включающий ʹпримированиеʹ иммунной системы пациента путем введения гетерологичной обычной вакцины (например, вакцины БЦЖ) и затем ʹбустер-иммунизацииʹ иммунной системы путем введения вакцины по настоящему изобретению. В одном варианте осуществления изобретение обеспечивает способ вакцинации против микобактериальной инфекции, включающий введение вакцины по настоящему изобретению пациенту, который ранее подвергался воздействию гетерологичной обычной вакцины, такой как БЦЖ. Альтернативно, иммунная система пациента может быть ʹпримированаʹ путем введения вакцины по настоящему изобретению и затем буст-иммунизирована путем введения гетерологичной обычной вакцины (например, вакцины БЦЖ). Соответственно, в одном варианте осуществления изобретения вакцину вводят пациенту, которого впоследствии подвергают воздействию гетерологичной обычной вакцины, такой как БЦЖ. Стадию ʹпримированияʹ можно осуществлять у пациента в любом возрасте - в случае пациентов млекопитающих (например, пациентов людей, коров, свиней, овец, коз, лошадей, ворон, собак или кошек), примирование БЦЖ обычно проводят неонатально, или в течение младенчества, подросткового возраста или взрослого состояния. Стадию ʹбуст-иммунизацииʹ можно осуществлять в любое время после стадии ʹпримированияʹ. В случае пациентов млекопитающих (например, пациентов людей, коров, свиней, овец, коз, лошадей, ворон, собак или кошек), стадию буст-иммунизации можно проводить через, по меньшей мере, около 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 недель после стадии примирования, или, по меньшей мере, через около 3, 6, 8 или 12 месяцев после стадии примирования или, по меньшей мере, около 2, 5, 10, 15, 20, 25, 30, 35, или 40 или более лет после стадии буст-иммунизации. В одном варианте осуществления изобретения для пациента человека стадию примирования проводят во время младенчества и стадию буст-иммунизации проводят в течение подросткового возраста. В одном варианте осуществления изобретения терапевтическую композицию или профилактическую композицию (например, вакцину) по изобретению можно вводить пациенту, такому как млекопитающее (например, пациенты люди, коровы, свиньи, овцы, козы, лошади, вороны, собаки или кошки) в сочетании с (одновременно или последовательно) одним или более иммунорегуляторными агентами, выбираемыми из, например, иммуноглобулинов, антибиотиков, интерлейкинов (например, IL-2, IL-12), и/или цитокинов (например, IFNγ). В одном варианте осуществления изобретения терапевтическую композицию, лекарственное средство или профилактическую композицию (например, вакцину) по изобретению можно вводить пациенту, такому как млекопитающее (например, человеку, коровам, свиньям, овцам, козам, лошадям, воронам, собакам или кошкам) в сочетании с (одновременно или последовательно) одним или более антимикробными соединениями, такими как одно или более антимикробных соединений, таких как обычные противотуберкулезные лекарственные средства (например, рифампицин, изониазид, этамбутол или пиразинамид).
Терапевтическая композиция, лекарственное средство или профилактическая композиция (например, вакцина) может содержать от 5% до 95% активного ингредиента, например, по меньшей мере 10% или 25% активного ингредиента, или, по меньшей мере, 40% активного ингредиента или по меньшей мере 50, 55, 60, 70 или 75% активного ингредиента. Терапевтическую композицию, лекарственное средство или профилактическую композицию (например, вакцину) вводят образом, совместимым с лекарственной формой, и в таком количестве, которое будет профилактически и/или терапевтически эффективно. В таком отношении, в рамках изобретения, ʺэффективное количествоʺ представляет собой дозировку или количество, которое является достаточным для достижения желаемого биологического результата. В рамках изобретения, ʺтерапевтически эффективное количествоʺ представляет собой количество, которое является эффективным при введении одной или нескольких доз пациенту (такому как млекопитающее - например, человеку, корове, свинье, овце, козе, лошади, вороне, собаке или кошке) для лечения, профилактики, излечения, отсрочки, уменьшения тяжести, облегчения по меньшей мере одного симптома расстройства или рецидива расстройства или пролонгирования выживаемости пациента больше ожидаемой в отсутствие такого лечения. Соответственно, количество вводимого активного ингредиента, которое обычно находится в диапазоне от 5 микрограмм до 250 микрограмм антигена на дозу (или выше при введении перорально или в форме вирусных векторов), зависит от пациента, которого лечат, способности иммунной системы пациента создавать защитный иммунный ответ и степени желаемой защиты. Точные количества активного ингредиента, которые требуется вводить, зависят от мнения практикующего врача и могут быть определены для каждого пациента.
В соответствии с дополнительным аспектом изобретения первый и второй микобактериальные антигены (и необязательные дополнительные микобактериальные антигены) по изобретению, как описано в настоящем описании, могут быть использованы в иммуноанализах для определения присутствия в тестируемом образце антител к указанным первому и второму микобактериальным антигенам. В одном варианте осуществления изобретения указанные первый и второй микобактериальные антигены (и необязательные дополнительные антигены) используют в форме антигенной композиции, как описано в настоящем описании. В соответствии с другим аспектом изобретения первое и второе антитела (и необязательно дополнительные антитела) по изобретению, как описано в настоящем описании, являются применимыми в иммуноанализах для определения присутствия в тестируемом образце указанных первого и второго микобактериальных антигенов. В одном варианте осуществления изобретения указанные первое и второе антитела (и необязательно дополнительные антитела) используют в форме композиции, содержащей иммуногенные антитела, как описано в настоящем описании.
Тестируемым образцом может быть биологический образец, такой как клинический образец или образец окружающей среды. В рамках изобретения ʹклинический образецʹ относится к образцу ткани или жидкости, выделенной от пациента, включающему, без ограничения, например, плазму, сыворотку, спинномозговую жидкость, лимфу, наружные отделы кожи, дыхательного, кишечного и мочеполового тракта, слезы, слюну, молоко, кровяные клетки, опухоли, органы и также образцы компонентов культур клеток in vitro (включая, без ограничения, кондиционированную среду, полученную в результате роста клеток в среде для культивирования клеток, предположительно инфицированные клетки и компоненты клеток). В контексте диагностических методов, обсуждаемых ниже, ʹпациентомʹ является любое животное, которое получит преимущество от определения микобактериальной инфекции, такой как инфекция M. tuberculosis. Типичными пациентами животными являются млекопитающие, например, человек, коровы, свиньи, овцы, козы, лошади, вороны, собаки или кошки. В одном варианте осуществления изобретения пациентом является человек, корова, свинья или лошадь.
Дизайн иммуноанализов подвержен большому количеству вариаций и в области техники известно множество форм. Протоколы могут быть основаны, например, на конкуренции, прямой реакции или анализах типа сэндвич. В протоколах могут также использовать, например, твердые подложки, или могут использовать иммунопреципитацию. В большинстве анализов используют меченные антитела или полипептиды; метки могут быть, например, ферментативными, флуоресцентными, хемилюминесцентными, радиоактивными или красящими молекулами. Анализы, которые включают амплификацию сигнала, также известны; например, анализы, в которых используют биотин и авидин, или ферментативно меченные и опосредованные иммуноанализы, такие как анализы ELISA. В одном аспекте изобретения первый и второй микобактериальные антигены (или антигенная композиция) по изобретению являются применимыми для определения присутствия T-лимфоцитов, которые ранее подвергались воздействию антигенного компонента микобактериальной инфекции у пациента. Соответственно, в одном варианте осуществления изобретение обеспечивает in vitro метод диагностики микобактериальной инфекции, такой как микобактериальная инфекция на ранней стадии, включающий инкубацию (ʹпровокациюʹ) тестируемого образца, содержащего иммунные клетки, такие как T-лимфоцит, от пациента (например, млекопитающего, такого как пациент человек, корова, свинья или лошадь) с первым микобактериальным антигеном по изобретению и вторым микобактериальным антигеном по изобретению, как определено в настоящем описании; или антигенной композицией по изобретению, как определено в настоящем описании; и определение активации указанной иммунной клетки (например, T-лимфоцита). Активация указанной иммунной клетки является показательной для микобактериальной инфекции у пациента.
В одном варианте осуществления указанного метода in vitro, указанный первый микобактериальный антиген выбирают из (i) первого микобактериального антигенного полипептида, включающего последовательность полипептида, имеющую по меньшей мере 70% идентичности последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 1 или 7, или ее фрагмента, имеющего по меньшей мере 50 ее последовательных аминокислот; или (ii) первой микобактериальной полинуклеотидной последовательности, включающей полинуклеотидную последовательность, кодирующую указанный первый микобактериальный антигенный полипептид. В одном варианте осуществления указанного in vitro метода, указанный второй микобактериальный антиген выбирают из (iii) второго микобактериального антигенного полипептида, включающего последовательность полипептида, имеющую по меньшей мере 70% идентичности последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 5, или ее фрагмента, имеющего по меньшей мере 7 его последовательных аминокислот; или (iv) второй микобактериальной полинуклеотидной последовательности, включающей полинуклеотидную последовательность, кодирующую указанный второй микобактериальный антигенный полипептид.
Иммунная клетка, такая как T-лимфоцит, которая ранее подвергалась воздействию одного или обоих из первого и второго микобактериальных антигенов, становится ʹактивированнойʹ при последующих воздействиях того же антигена. По существу, активация указанной иммунной клетки (например, T-лимфоцита) является показателем микобактериальной инфекции у пациента и обеспечивает средство для идентификации положительного диагноза микобактериальной инфекции. Наоборот, та же активация не достигается иммунными клетками (например, T-лимфоцитами), которые ранее подвергались воздействию определенного антигена. Вышеописанную ʹактивациюʹ иммунной клетки (например, T-лимфоцита) иногда называют как ʹвторичный иммунный ответʹ и она может быть оценена, например, путем определения высвобождения интерферона (например, IFN-γ) из активированной иммунной клетки (например, T-лимфоцита). Следовательно, присутствие микобактериальной инфекции у пациента может быть определено посредством определения активации иммунных клеток (например, T-лимфоцитов) в ответ на in vitro воздействие первого и второго микобактериальных антигенов (или антигенной композиции) по настоящему изобретению - и например, посредством определения высвобождения минимальной концентрации интерферона из иммунных клеток (например, T-лимфоцита) спустя определенный временной период после введения. Диагностические анализы вышеуказанных иммунных клеток (например, Т-лимфоциты) могут дополнительно включать антиген-представляющие клетки (APC), экспрессирующие, по меньшей мере, одну молекулу главного комплекса гистосовместимости (MHC) класс II, экспрессируемые у интересующего пациента. APC может быть по существу обеспечен в биологическом образце, или может быть добавлен экзогенно. В одном варианте осуществления изобретения T-лимфоцитом является CD4 T-лимфоцит.
Альтернативные иммуноанализы для диагностики микобактериальной инфекции зависят от определения антител к первому и второму микобактериальным антигенам (например, полипептидам) по изобретению. Такие анализы могут включать инкубацию тестируемого образца (например, биологического образца), вероятно содержащего антитела, с указанным первым и вторым антигенами (или антигенной композицией) по изобретению. Соответственно изобретение также обеспечивает метод in vitro диагностики микобактериальной инфекции, такой как микобактериальная инфекция ранней стадии, включающий инкубацию тестируемого образца от пациента (например, млекопитающего, такого как пациент человек, корова, свинья или лошадь) с первым микобактериальным антигеном и вторым микобактериальным антигеном, как определено в настоящем описании; или антигенной композицией по изобретению, как определено в настоящем описании; где указанную инкубацию проводят в условиях, которые позволяют связывание указанного первого и второго микобактериальных антигенов с антителами в образце для получения комплексов антиген-антитело; и затем определение образования таких комплексов. Присутствие комплексов антиген-антитело является показательным для микобактериальной инфекции у пациента.
В одном варианте осуществления указанного метода in vitro, указанный первый микобактериальный антиген выбирают из (i) первого микобактериального антигенного полипептида, включающего последовательность полипептида, как определено ранее; или (ii) первую микобактериальную полинуклеотидную последовательность, включающую полинуклеотидную последовательность как определено ранее, кодирующую указанный первый микобактериальный антигенный полипептид; и необязательно указанный второй микобактериальный антиген выбирают из (iii) второго микобактериального антигенного полипептида, включающего последовательность полипептида, как определено ранее; и (iv) второй микобактериальной полинуклеотидной последовательности, как определено ранее, включающей полинуклеотидную последовательность, кодирующую указанный второй микобактериальный антигенный полипептид. Комплексы антиген-антитело (или в случае конкурентного анализа, количество конкурентного антитела) могут быть определены любой из ряда известных методик, в зависимости от формата. Например, немеченые антитела в комплексе могут быть определены с использованием конъюгата анти-ксеногенного Ig в комплексе с меткой (например, ферментной меткой). Иммуноанализ может быть стандартного или конкурентного типа. В одном варианте осуществления изобретения первый и второй микобактериальные антигены связаны с одной или более твердыми подложками для облегчения отделения образца от антигенов после инкубации. Примеры твердых подложек, которые могут быть использованы, представляют собой нитроцеллюлозу (например, в форме мембраны или ячейках микротитратора), поливинилхлорид (например, в листах или ячейках микротитраторов), полистиролового латекса (например, в шариках или планшетах микротитратора, поливинилидин фторид (известный как Иммулон), диазотированная бумага, нейлоновые мембраны, активированные шарики, и шарики белка А. Например, могут быть использованы планшеты микротитратора Dynatech Immulon или полистироловые шарики 60 мм в диаметре (Precision Plastic Ball). Твердую поддержку(и), содержащую первый и второй микобактериальный антигены, обычно промывают после отделения ее от тестируемого образца, и до определения связанных антител. Изобретение также охватывает иммуноанализы для определения присутствия первого и второго микобактериальных антигенов (например, полипептидов) по изобретению в тестируемом образце (например, биологическом образце). В таких методах, тестируемый образец, предположительно содержащий указанные микобактериальные антигены, может быть инкубирован с антителами, направленными против первого и второго микобактериальных антигенов.
Соответственно, изобретение относится к способу диагностики in vitro микобактериальной инфекции, такой как микобактериальная инфекция на ранней стадии, включающему инкубацию тестируемого образца от пациента (например, млекопитающего, такого как пациент человек, корова, свинья или лошадь) с первым антителом и вторым антителом по изобретению, как определено в настоящем описании; или иммуногенной композицией по изобретению, как определено в настоящем описании; где указанную инкубацию проводят в условиях, которые обеспечивают связывание указанного первого и второго антител с антигенами в образце для получения комплексов антиген-антител; и затем определение образования таких комплексов, где присутствие комплексов антиген-антитело является показательным для микобактериальной инфекции у пациента. В одном варианте осуществления указанного способа in vitro, указанное первое антитело связывается с первым микобактериальным антигенным полипептидом; и указанное необязательное второе антитело связывается со вторым микобактериальным антигенным полипептидом. Может быть желательно обработать биологический образец до исследования для высвобождения обработки предполагаемых бактериальных компонентов. Различные форматы могут быть использованы. Например, может быть использован "сэндвич анализ", где антитела, связанные с твердой подложкой, инкубируют с тестируемым образцом; промывают; инкубируют со вторыми, меченными антителами к первым и вторым антигенам и подложку снова промывают. Первый и второй микобактериальные антигены определяют путем определения, связывается ли второе антитело с подложкой. В конкурентном формате тестируемый образец обычно инкубируют с антителами и меченный конкурентный антиген также инкубируют, или последовательно или одновременно.
В одном аспекте изобретение относится к набору для иммуноанализа, включающему антигенную композицию по изобретению, или антитела к указанному первому и второму микобактериальным антигенам. Набор для иммуноанализа может дополнительно включать буфер. Термин ʺполипептидʺ на всем протяжении настоящей спецификации является синонимом терминов ʺолигопептидʺ, ʺпептидʺ и ʺбелокʺ. Указанные термины используются взаимозаменяемо и не относятся к специфической длине продукта. Такие термины охватывают посттрансляционные модификации, такие как гликозилирование, ацетилирование и фосфорилирование. В одном варианте осуществления изобретения изолированные полипептиды по изобретению по существу не содержат других белков, с которыми они совместно образуются, а также других загрязнителей. Например, изолированный полипептид является по существу свободным от материала или других белков из клетки, бактериального или тканевого источника, из которого их получали.
Настоящее изобретение охватывает полипептиды, которые являются по существу гомологичными полипептиду на основании любой из контрольных SEQ ID NO, идентифицированных в настоящей заявке (включая их фрагменты). Термины ʺидентичность последовательностиʺ и ʺгомология последовательностиʺ в настоящей спецификации расцениваются синонимами. В качестве примера, целевой полипептид может включать последовательность аминокислот, имеющую по меньшей мере 70, 75, 80, 82, 84, 86, 88, 90, 92, 94, 96, 98, 99 или 100% идентичности последовательности аминокислот с последовательностью аминокислоты контрольного полипептида.
Существует множество установленных алгоритмов, доступных для выравнивания двух последовательностей аминокислот. Типично, одна последовательность действует как контрольная последовательность, с которой можно сравнить тестируемые последовательности. Алгоритм сравнения последовательностей рассчитывает процент идентичности последовательности для тестируемой последовательности(ей) относительно контрольной последовательности, на основании определенных параметров программы. Выравнивание последовательностей аминокислот для сравнения может быть проведено, например, посредством компьютерных алгоритмов (например, GAP, BESTFIT, FASTA или TFASTA), BLAST и BLAST 2.0 алгоритмы, или BLOSUM62 - Henikoff & Henikoff, Proc. Natl. Acad. Sci. USA 89:10915-10919, 1992; включенные в настоящее описание в виде ссылки). В сравнении гомологии, идентичность может существовать в большой области последовательностей, которые имеют по меньшей мере 50 остатков аминокислот в длину (например, по меньшей мере 75, 100, 150, 200, 250, 300, 350, 400, 450, 500, 550, 600 или 650 остатков аминокислот в длину - например, до полной длины контрольной последовательности. По существу гомологичные полипептиды имеют одну или более замен, делеций или добавлений аминокислот. Во множестве вариантов осуществления изобретения такие изменения имеют минимальную природу, например, включая только консервативные замены аминокислот. Консервативными заменами являются такие, сделанные путем замены одной аминокислоты другой аминокислотой в следующих группах: основные: аргинин, лизин, гистидин; кислые: глютаминовая кислота, аспарагиновая кислота; полярные: глютамин, аспарагин; гидрофобные: лейцин, изолейцин, валин; ароматические: фенилаланин, триптофан, тирозин; небольшие: глицин, аланин, серин, треонин, метионин. По существу гомологичные полипептиды также охватывают таковые, включающие другие замены, которые по существу не влияют на складчатость или активность полипептида; небольшие делеции, типично от 1 до около 30 аминокислот (такие как 1-10, или 1-5 аминокислот); и мелкие амино- или карбокси терминальные удлинения, такие как аминоконцевой метиониновый остаток, небольшой линкерный пептид до около 20-25 остатков или афинная метка.
Полипептиды по настоящему изобретению также могут включать остатки неприродных аминокислот. В таком отношении в добавление к 20 стандартным аминокислотам, нестандартные аминокислоты (такие как 4-гидроксипролин, 6-N-метиллизин, 2-аминоизомасляная кислота, изовалин и α-метилсерин) могут быть заменены аминокислотными остатками микобактериальных полипептидов по настоящему изобретению. Ограниченное количество неконсервативных аминокислот, аминокислот, которые не кодируются генетическим кодом, и неприродных аминокислот могут быть заменены остатками аминокислот микобактериального полипептида. Неприродные аминокислоты включают, без ограничения, транс-3-метилпролин, 2,4-метанопролин, цис-4-гидроксипролин, транс-4-гидроксипролин, N-метилглицин, алло-треонин, метил-треонин, гидроксиэтилцистеин, гидроксиэтилгомоцистеин, нитроглютамин, гомоглютамин, пипеколовая кислота, трет-лейцин, норвалин, 2-азафенилаланин, 3-азафенилаланин, 4-азафенилаланин, и 4-фторфенилаланин.
Рутинные анализы делеции молекул нуклеиновой кислоты могут быть проведены для получения функциональных фрагментов молекулы нуклеиновой кислоты, которая кодирует полипептид по изобретению. В качестве иллюстрации, молекулы ДНК могут быть переварены Bal31 нуклеазой для получения серии гнездовых делеций. Такие фрагменты ДНК затем вставляют в векторы экспрессии в соответствующую рамку считывания, и экспрессируемые полипептиды выделяют и тестируют в отношении желаемой активности. Альтернативой перевариванию экзонуклеазой является применение олигонуклеотид-направленного мутагенеза для индукции делеций или стопкодонов для спецификации продукции желаемого фрагмента. Альтернативно, определенные полинуклеотидные фрагменты могут быть синтезированы с использованием полимеразной цепной реакции. Мутант полипептида по изобретению может одержать один или более аналогов аминокислоты (например, ненатуральной аминокислоты), или замещенной связи, по сравнению с последовательностью контрольного полипептида. В дополнительном варианте осуществления изобретения целевой полипептид может быть имитатором контрольного полипептида, такой имитатор воспроизводит по меньшей мере один эпитоп контрольного полипептида. Мутанты описанных последовательностей полинуклеотида и полипептида по изобретению могут быть получены посредством перестановки ДНК. Коротко, мутантные ДНК создавали посредством in vitro гомологичной рекомбинации путем случайной фрагментации исходной ДНК с последующей повторной сборкой с использованием ПЦР, приводя к случайно вносимым точечным мутациям. Такая методика может быть модифицирована с использованием семейства исходных ДНК для внесения дополнительной вариабельности в процесс. Выбор или скрининг желаемой активности, с последующими вариантами мутагенеза и анализов обеспечивают быструю ʺэволюциюʺ последовательностей путем выбора желаемых мутаций при одновременном выборе исключая вредные изменения. Методы мутагенеза, как описано выше, могут быть скомбинированы с методами скрининга с высоким выходом для определения активности клонированных мутантных полипептидов. Мутированные молекулы нуклеиновой кислоты, которые кодируют полипептиды по изобретению, или их фрагменты, могут быть получены из клеток-хозяев и быстро секвенированы с использованием современного оборудования. Указанные методы позволяют быстрое определение важности отдельных остатков аминокислоты в интересующем полипептиде, и могут быть применены к полипептидам неизвестной структуры.
ʺФрагментʺ целевого полипептида включает серию консервативных остатков аминокислот из последовательности указанного полипептида. В качестве примера ʺфрагментʺ интересующего полипептида может включать (или состоять из) по меньшей мере 50 последовательных остатков аминокислот из последовательности указанного полипептида (например, по меньшей мере 75, 100, 125, 150, 175, 200, 225, 250, 275, 300 последовательных остатков аминокислот указанного полипептида). Фрагмент включает по меньшей мере один эпитоп интересующего полипептида.
В рамках изобретения, термины ʺпоследовательность нуклеиновой кислотыʺ и ʺполинуклеотидʺ используют взаимозаменяемо и не включают какого-либо ограничения длины. В рамках изобретения, термины ʺнуклеиновая кислотаʺ и ʺнуклеотидʺ используют взаимозаменяемо. Термины ʺпоследовательность нуклеиновой кислотыʺ и ʺполинуклеотидʺ охватывает ДНК (включая кДНК) и РНК последовательности. Полинуклеотидные последовательности по настоящему изобретению включают последовательности нуклеиновой кислоты, которые были удалены из их естественного окружения, рекомбинантные или клонированные ДНК изоляты, и химически синтезированные аналоги или аналоги, биологически синтезированные гетерологичными системами. Натуральные или синтетические фрагменты ДНК, кодирующие желаемый фрагмент, могут быть включены в рекомбинантные конструкты нуклеиновой кислоты, обычно конструкты ДНК, способные вноситься в и реплицироваться в клетках прокариот или эукариот. Обычно конструкты ДНК подходят для автономной репликации в одноклеточном хозяине, таком как дрожжи или бактерии, но также могут быть предназначены для внесения в и интеграции в геном культивируемых клеточных линий насекомых, млекопитающих, растений или других эукариот. Термин ʺрекомбинантныйʺ, в рамках изобретения, имеет ввиду полинуклеотид геномного, кДНК, полусинтетического или синтетического происхождения, который, посредством его происхождения или манипуляций: (1) не ассоциирован со всем или частью полинуклеотида, с которым он ассоциирован в природе; или (2) связан с полинуклеотидом, иным, чем таковой, с которым он связан в природе; и (3) не встречается в природе. При применении к последовательности нуклеиновой кислоты термин ʺвыделенныйʺ в контексте настоящего изобретения означает, что полинуклеотидная последовательность была удалена из ее натурального генетического окружения, и, следовательно, свободна от других внешних или нежелательных кодирующих последовательностей (но может включать натуральные 5' и 3' нетранслируемые участки, такие как промоторы и терминаторы), и находится в форме, подходящей для применения в генетически созданных системах продукции белка. Такие изолированные молекулы представляют собой таковые, которые отделены от их натурального окружения. ʺВариантʺ последовательности нуклеиновой кислоты имеет существенную гомологию или существенное сходство с контрольной последовательностью нуклеиновой кислоты (или ее фрагмента). Последовательность нуклеиновой кислоты или ее фрагмент является ʺпо существу гомологичнымʺ (или ʺпо существу идентичнымʺ) контрольной последовательности, если, при оптимальном выравнивании (с соответствующими вставками или делециями нуклеотида) с другой нуклеиновой кислотой (или ее комплементарной цепью), существует идентичность последовательности нуклеотидов в, по меньшей мере, около 70%, 75%, 80%, 82, 84, 86, 88, 90, 92, 94, 96, 98 или 99% оснований нуклеотидов. Определение гомологии проводили, как описано выше для полипептидов. Альтернативно, ʺвариантʺ последовательности нуклеиновой кислоты является по существу гомологичным с (или по существу идентичным) контрольной последовательностью (или ее фрагментом), если ʺвариантʺ и контрольная последовательность способны гибридизоваться в строгих (например, очень строгих) условиях гибридизации. Гибридизация последовательности нуклеиновой кислоты подвержена таким условиям, как концентрация соли (например, NaCl), температура или органические растворители, в добавление к составу основания, длине комплементарных цепей, и количеству несоответствий оснований нуклеотидов между гибридизованными нуклеиновыми кислотами, как легко понимает специалист в области техники. Предпочтительно используют четкие температурные условия и обычно включают температуры более 30°C, типично более 37°C и предпочтительно более 45°C. Четкие солевые условия обычно составляют менее чем 1000 мM, типично менее чем 500 мM, и предпочтительно менее чем 200 мM. pH типично составляет между 7,0 и 8,3. Комбинация параметров является существенно более важной, чем любой отдельный параметр. ʺФрагментʺ интересующего полинуклеотида включает ряд последовательных остатков аминокислот из последовательности указанного полнодлиннового полинуклеотида. В качестве примера ʺфрагментʺ интересующего полинуклеотида может включать (или состоять из) по меньшей мере 150 последовательных остатков нуклеиновой кислоты из последовательности указанного полипептида (например, по меньшей мере 200, 250, 300, 350, 400, 450, 500, 550, 600, 650, 700 или 750 последовательных остатков нуклеиновых кислот указанного полинуклеотида). Фрагмент кодирует по меньшей мере один антигенный эпитоп соответствующего целевого полипептида.
SEQ ID No. 1
atgtggtggttccgccgccgagaccgggcgccgctgcgcgccaccagctcattatccctgcggtggcgggtcatgctgctggcgatgtccatggtcgcgatggtggttgtgctgatgtcgttcgccgtctatgcggtgatctcggccgcgctctacagcgacatcgacaaccaactgcagagccgggcgcaactgctcatcgccagtggctcgctggcagctgatccgggtaaggcaatcgagggtaccgcctattcggatgtcaacgcgatgctggtcaaccccggccagtccatctacaccgctcaacagccgggccagacgctgccggtcggtgctgccgagaaggcggtgatccgtggcgagttgttcatgtcgcggcgcaccaccgccgaccaacgggtgcttgccatccgtctgaccaacggtagttcgctgctgatctccaaaagtctcaagcccaccgaagcagtcatgaacaagctgcgttgggtgctattgatcgtgggtgggatcggggtggcggtcgccgcggtggccggggggatggtcacccgggccgggctgaggccggtgggccgcctcaccgaagcggccgagcgggtggcgcgaaccgacgacctgcggcccatccccgtcttcggcagcgacgaattggccaggctgacagaggcattcaatttaatgctgcgggcgctggccgagtcacgggaacggcaggcaaggctggttaccgacgccggacatgaattgcgtaccccgctaacgtcgctgcgcaccaatgtcgaactcttgatggcctcgatggccccgggggctccgcggctacccaagcaggagatggtcgacctgcgtgccgatgtgctggctcaaatcgaggaattgtccacactggtaggcgatttggtggacctgtcccgaggcgacgccggagaagtggtgcacgagccggtcgacatggctgacgtcgtcgaccgcagcctggagcgggtcaggcggcggcgcaacgatatccttttcgacgtcgaggtgattgggtggcaggtttatggcgataccgctggattgtcgcggatggcgcttaacctgatggacaacgccgcgaagtggagcccgccgggcggccacgtgggtgtcaggctgagccagctcgacgcgtcgcacgctgagctggtggtttccgaccgcggcccgggcattcccgtgcaggagcgccgtctggtgtttgaacggttttaccggtcggcatcggcacgggcgttgccgggttcgggcctcgggttggcgatcgtcaaacaggtggtgctcaaccacggcggattgctgcgcatcgaagacaccgacccaggcggccagccccctggaacgtcgatttacgtgctgctccccggccgtcggatgccgattccgcagcttcccggtgcgacggctggcgctcggagcacggacatcgagaactctcggggttcggcgaacgttatctcagtggaatctcagtccacgcgcgcaacctag
SEQ ID No. 2
MWWFRRRDRAPLRATSSLSLRWRVMLLAMSMVAMVVVLMSFAVYAVISAALYSDIDNQLQSRAQLLIASGSLAADPGKAIEGTAYSDVNAMLVNPGQSIYTAQQPGQTLPVGAAEKAVIRGELFMSRRTTADQRVLAIRLTNGSSLLISKSLKPTEAVMNKLRWVLLIVGGIGVAVAAVAGGMVTRAGLRPVGRLTEAAERVARTDDLRPIPVFGSDELARLTEAFNLMLRALAESRERQARLVTDAGHELRTPLTSLRTNVELLMASMAPGAPRLPKQEMVDLRADVLAQIEELSTLVGDLVDLSRGDAGEVVHEPVDMADVVDRSLERVRRRRNDILFDVEVIGWQVYGDTAGLSRMALNLMDNAAKWSPPGGHVGVRLSQLDASHAELVVSDRGPGIPVQERRLVFERFYRSASARALPGSGLGLAIVKQVVLNHGGLLRIEDTDPGGQPPGTSIYVLLPGRRMPIPQLPGATAGARSTDIENSRGSANVISVESQSTRAT
SEQ ID No. 3
atgacggctccgggactgacagcagccgtcgaggggatcgcacacaacaagggcgagctgttcgcctcctttgacgtggacgcgttcgaggttccgcacggccgcgacgagatctggcggttcaccccgttgcggcggctgcgtggcctgcacgacggctccgcgcgggccaccggtagcgccacgatcacggtcagcgagcggccgggcgtatacacccagaccgtgcgccgcggcgatccacgactgggcgagggcggcgtacccaccgaccgcgttgccgcccaagcgttttcgtcgttcaactccgcgactctggtcaccgtcgagcgcgacacccaggtcgtcgagccggtaggcatcaccgtgaccgggccgggggagggcgcggtggcctatgggcacctgcaggtgcgtatcgaggagcttggcgaggcggtcgtggtcatcgaccaccggggcggcggaacctacgccgacaacgtcgagttcgttgtcgacgacgccgctcggctgaccgccgtgtggatcgccgactgggccgacaacaccgttcacctcagcgcgcaccatgctcggatcggcaaggacgcggtgctgcgccacgtcaccgtcatgttgggcggcgacgtggtgcgaatgtcggcgggcgtgcggttctgcggtgcgggtggggacgcggaactgctggggctgtatttcgccgacgacggccagcacctggagtcgcggctgctggtggaccacgcccaccccgactgcaagtcgaacgtgctgtataagggtgcactgcaaggtgatccggcgtcgtcgttgcccgacgcacacacggtctgggtgggtgacgtgctgatccgtgcgcaggccaccggcaccgacaccttcgaggtgaaccggaacctggtgctcaccgacggcgcgcgtgccgactcggtgcccaacctggagatcgagaccggcgagatcgtcggcgccggacacgccagcgccaccggtcgcttcgacgatgagcaattgttctacctgcgttcgcgcggtattcccgaagcacaggcccgccggctggtggtccgcggcttcttcggtgagatcatcgccaagatcgcggtgcccgaggtacgcgagcgcctgaccgcagccatcgaacacgagctggaaatcacggaatcaacggaaaagacaacagtctcatga
SEQ ID No. 4
MTAPGLTAAVEGIAHNKGELFASFDVDAFEVPHGRDEIWRFTPLRRLRGLHDGSARATGSATITVSERPGVYTQTVRRGDPRLGEGGVPTDRVAAQAFSSFNSATLVTVERDTQVVEPVGITVTGPGEGAVAYGHLQVRIEELGEAVVVIDHRGGGTYADNVEFVVDDAARLTAVWIADWADNTVHLSAHHARIGKDAVLRHVTVMLGGDVVRMSAGVRFCGAGGDAELLGLYFADDGQHLESRLLVDHAHPDCKSNVLYKGALQGDPASSLPDAHTVWVGDVLIRAQATGTDTFEVNRNLVLTDGARADSVPNLEIETGEIVGAGHASATGRFDDEQLFYLRSRGIPEAQARRLVVRGFFGEIIAKIAVPEVRERLTAAIEHELEITESTEKTTVS
SEQ ID No. 5
atggcggttcgtcaggtcaccgtcggctattcggacggcacgcacaagacgatgccggtgcggtgcgaccagacggtcctggatgccgccgaggaacacggcgtggccatcgtcaacgaatgccaaagcgggatatgtggcacctgcgtggccacctgcaccgccggccgctaccagatgggacgcaccgagggactgtccgatgtcgagcgggcggcgcgaaagatcctcacctgccagacgtttgttacctccgattgccggatcgagctgcagtatccggtcgacgacaacgccgccctgctggtcaccggtgacggtgtggtgaccgcggtcgagttggtgtcgcccagcaccgccatcctgcgggtggacacctctggcatggccggcgcgctgagataccgggccggccagttcgcccaattgcaggttcccggtaccaacgtatggcgcaactactcctacgcccatccggccgacggccgcggtgagtgcgagttcatcatcaggttgctgccggacggcgtgatgtcgaattatcttcgcgaccgcgcccagcccggtgaccatatcgcgctgcgctgcagcaagggcagcttttatctgcgcccgatcgtgcgaccggtgatcctggtcgccggaggaaccggcctgtcagcgatcctggcgatggcccagagcctggatgccgatgtcgctcacccggtctacctgctctacggggtcgagcgcaccgaagacctgtgcaagctcgacgaactcaccgagctgcgccgccgcgttggccgcctggaggtgcacgtcgtcgtcgctcgcccggaccccgactgggatgggcgcaccgggctggtcaccgacctgctcgacgagcggatgctggcgagcggtgacgccgacgtgtatctgtgcggtccggtcgccatggtcgacgcagcccgaacctggctggaccacaatggctttcaccgtgtcgggttgtactacgagaagttcgtggccagcggggcggcgcgccgccgcaccccggctcggctggattacgcgggcgtggacattgccgaggtgtgccgccgcggccgcggcaccgcggtggtcatcggcggcagcatcgcgggcatcgcggcggcgaaaatgctcagcgagaccttcgatcgcgtcatcgtgctggagaaggacggcccgcaccgtcgccgcgagggcaggccgggcgcggcacagggttggcacctgcaccacctgctgaccgccgggcagatcgagctggagcgcatcttccctggcatcgtcgacgacatggtgcgcgagggagcgttcaaggtcgacatggccgcgcagtaccgtatccggctgggcggcacctggaagaagcccggcactagtgacatcgagatcgtctgcgcgggaaggccgctgctcgaatggtgtgtgcgccgccggctcgacgacgaaccgcgcatcgacttccgctacgaatcggaggtggccgatctcgccttcgaccgcgccaacaatgccatcgtcggcgtcgccgtggacaatggcgacgccgacggaggcgacggtttgcaggtggtgcccgccgagttcgtcgtggacgcgtcgggcaagaacacccgcgtgccggagttcttggagcgtctcggtgttggcgctcccgaggccgagcaggacatcatcaactgcttctactccacgatgcagcaccgggttccgccggagcggcggtggcaggacaaggtgatggtgatctgctatgcgtaccgccctttcgaggatacctacgccgcgcagtactacaccgacagctcccgcaccatcctgtccacctcactggtggcctacaactgctattcgccgccgcgtaccgcccgagaattccgcgcgttcgccgacctgatgccgtccccggtcatcggggagaacatcgacgggctggagccggcatcgcccatctacaatttccgctatcccaacatgctgcggctgcgctacgagaagaagcgcaacctgccgcgggctttgctggcggtgggcgatgcctacaccagcgccgacccggtgtcgggtctgggtatgagcctggcgctcaaggaagttcgggagatgcaggcgctgctggctaaatacggcgccggtcaccgggatctgccgcgccggtactaccgggcgatcgccaagatggccgacacggcctggttcgtgatccgcgagcagaacctgcgcttcgactggatgaaggacgtcgacaagaagcgcccgttctatttcggtgtgctgacctggtacatggaccgcgtgctggagctggtgcatgacgatctcgacgcgtaccgggaattcttggccgtcgtccatctggtcaagccgccgtcggcgctgatgcgacccaggatcgccagccgcgtcctcggcaaatgggcacgaacccgattgtcgggccagaagacgttgattgcccgcaactacgaaaatcatccgataccagccgaacccgcggaccaacttgtaaacgcttag
SEQ ID No. 6
MAVRQVTVGYSDGTHKTMPVRCDQTVLDAAEEHGVAIVNECQSGICGTCVATCTAGRYQMGRTEGLSDVERAARKILTCQTFVTSDCRIELQYPVDDNAALLVTGDGVVTAVELVSPSTAILRVDTSGMAGALRYRAGQFAQLQVPGTNVWRNYSYAHPADGRGECEFIIRLLPDGVMSNYLRDRAQPGDHIALRCSKGSFYLRPIVRPVILVAGGTGLSAILAMAQSLDADVAHPVYLLYGVERTEDLCKLDELTELRRRVGRLEVHVVVARPDPDWDGRTGLVTDLLDERMLASGDADVYLCGPVAMVDAARTWLDHNGFHRVGLYYEKFVASGAARRRTPARLDYAGVDIAEVCRRGRGTAVVIGGSIAGIAAAKMLSETFDRVIVLEKDGPHRRREGRPGAAQGWHLHHLLTAGQIELERIFPGIVDDMVREGAFKVDMAAQYRIRLGGTWKKPGTSDIEIVCAGRPLLEWCVRRRLDDEPRIDFRYESEVADLAFDRANNAIVGVAVDNGDADGGDGLQVVPAEFVVDASGKNTRVPEFLERLGVGAPEAEQDIINCFYSTMQHRVPPERRWQDKVMVICYAYRPFEDTYAAQYYTDSSRTILSTSLVAYNCYSPPRTAREFRAFADLMPSPVIGENIDGLEPASPIYNFRYPNMLRLRYEKKRNLPRALLAVGDAYTSADPVSGLGMSLALKEVREMQALLAKYGAGHRDLPRRYYRAIAKMADTAWFVIREQNLRFDWMKDVDKKRPFYFGVLTWYMDRVLELVHDDLDAYREFLAVVHLVKPPSALMRPRIASRVLGKWARTRLSGQKTLIARNYENHPIPAEPADQLVNA
SEQ ID No. 7
atgaccacaacgactacaacgatttctggggggatattacccaaggaataccaagatcttcgggatacggtggccgattttgcgcgcaccgtggtcgcgccggtatcggccaaacacgatgcggaacacagcttcccatacgaaattgtcgccaagatgggagagatgggcctgttcgggctgccgtttccggaggagtacggcggcatgggcggcgactacttcgcgctgtcgctggtacttgaggagctgggcaaggttgaccaatcggtagcgatcacgctggaggccgcggtgggcctgggtgcgatgccgatctaccggttcggtaccgaggagcagaaacagaagtggttgcccgacttgacgtctggccgtgcgctcgccggttttggtctcaccgagccgggagcgggatcggacgcgggcagcacccgcaccacggcgcgtctcgaaggtgacgagtggatcatcaacggctccaagcaatttatcaccaactcgggcaccgacatcacatcgctggtcaccgtcactgcggttaccgggaccaccggaaccgctgcggatgccaagaaagagatttcgacgatcatcgtgcccagcggcacaccgggattcaccgtggaaccggtctataacaaggtcggctggaacgcctcggacacccacccactgacatttgccgatgcgcgggtcccgagggagaacctgctgggagcccgggggagcggctatgccaacttcttgtccatcctggacgagggccggattgcgattgcagcgctggccaccggcgcggcgcagggctgtgttgacgagagcgtcaagtacgccaaccagcgtcagtcgtttggccagccgatcggcgcttatcaggcgatcggcttcaagatcgcgcggatggaggcacgcgcccatgttgcccgcacagcgtactatgatgccgccgcaaagatgttggcgggcaagcccttcaagaaggaggcggcgatcgcgaagatgatctcctcggaggcggcgatggacaactcccgcgatgccacccagatacacggcggatacggctttatgaacgaatatccggtggcgcgtcattaccgcgacagcaaggtgctcgagattggtgagggcaccacggaagtgcagctgatgcttatcgcgcgatcgttgggactgcagtga
SEQ ID No. 8
MTTTTTTISGGILPKEYQDLRDTVADFARTVVAPVSAKHDAEHSFPYEIVAKMGEMGLFGLPFPEEYGGMGGDYFALSLVLEELGKVDQSVAITLEAAVGLGAMPIYRFGTEEQKQKWLPDLTSGRALAGFGLTEPGAGSDAGSTRTTARLEGDEWIINGSKQFITNSGTDITSLVTVTAVTGTTGTAADAKKEISTIIVPSGTPGFTVEPVYNKVGWNASDTHPLTFADARVPRENLLGARGSGYANFLSILDEGRIAIAALATGAAQGCVDESVKYANQRQSFGQPIGAYQAIGFKIARMEARAHVARTAYYDAAAKMLAGKPFKKEAAIAKMISSEAAMDNSRDATQIHGGYGFMNEYPVARHYRDSKVLEIGEGTTEVQLMLIARSLGLQ
SEQ ID No. 9
atggacaaggtggtggccaccgccgcggaggcggtcgcagacatagccaacgggtcgtcgcttgcggttggtggattcgggctttgcggcatccccgaagcactgatcgcagcgttggtggatagcggtgtcaccgacctggaaacagtctcgaacaactgcggaatcgacggtgttggtctgggactattgttgcaacacaagcgaattcgccggacagtctcctcctacgtgggggagaacaaggagttcgcccgccagttcctcgcgggcgagctcgaggtggaactgaccccgcagggcacgctggccgagcggttgcgggccggagggatgggcataccggccttctatacaccggcaggggtcggtacccaggtcgccgacggcgggttgccgtggcgctacgacgcctcgggcggggtggcggtggtgtcgccggccaaggagactcgggagttcgatggtgtcacctatgtcctcgagcgggggatccggaccgacttcgcactggtgcatgcctggcagggggaccggcacggcaacctgatgtaccgccacgccgcggccaacttcaacccggagtgcgcatccgcaggcaggatcacgatcgccgaggtcgagcacttggtcgagccgggtgagatcgaccctgccaccgtacacaccccgggcgtgtttgtgcaccgggtggttcatgtgcccaaccccgccaagaagatcgagagggagacggtgcggcaatga
SEQ ID No.10
MDKVVATAAEAVADIANGSSLAVGGFGLCGIPEALIAALVDSGVTDLETVSNNCGIDGVGLGLLLQHKRIRRTVSSYVGENKEFARQFLAGELEVELTPQGTLAERLRAGGMGIPAFYTPAGVGTQVADGGLPWRYDASGGVAVVSPAKETREFDGVTYVLERGIRTDFALVHAWQGDRHGNLMYRHAAANFNPECASAGRITIAEVEHLVEPGEIDPATVHTPGVFVHRVVHVPNPAKKIERETVRQ
SEQ ID No.11
atgaccctggaagtggtatcggacgcggccggacgcatgcgggtcaaagtcgactgggtccgttgcgattcccggcgcgcggtcgcggtcgaagaggccgttgccaagcagaacggtgtgcgcgtcgtgcacgcctacccgcgcaccgggtccgtggtcgtgtggtattcacccagacgcgccgaccgcgcggcggtgctggcggcgatcaagggcgccgcgcacgtcgccgccgaactgatccccgcgcgtgcgccgcactcggccgagatccgcaacaccgacgtgctccggatggtcatcggcggggtggcactggccttgctcggggtgcgccgctacgtgttcgcgcggccaccgctgctcggaaccaccgggcggacggtggccaccggtgtcaccattttcaccgggtatccgttcctgcgtggcgcgctgcgctcgctgcgctccggaaaggccggcaccgatgccctggtctccgcggcgacggtggcaagcctcatcctgcgcgagaacgtggtcgcactcaccgtcctgtggttgctcaacatcggtgagtacctgcaggatctgacgctgcggcggacccggcgggccatctcggagctgctgcgcggcaaccaggacacggcctgggtgcgcctcaccgatccttctgcaggctccgacgcggccaccgaaatccaggtcccgatcgacaccgtgcagatcggtgacgaggtggtggtccacgagcacgtcgcgataccggtcgacggtgaggtggtcgacggcgaagcgatcgtcaatcagtccgcgatcaccggggaaaacctgccggtcagcgtcgtggtcggaacgcgcgtgcacgccggttcggtcgtggtgcgcggacgcgtggtggtgcgcgcccacgcggtaggcaaccaaaccaccatcggtcgcatcattagcagggtcgaagaggctcagctcgaccgggcacccatccagacggtgggcgagaacttctcccgccgcttcgttcccacctcgttcatcgtctcggccatcgcgttgctgatcaccggcgacgtgcggcgcgcgatgaccatgttgttgatcgcatgcccgtgcgcggtgggactgtccaccccgaccgcgatcagcgcagcgatcggcaacggcgcgcgccgtggcatcctgatcaagggcggatcccacctcgagcaggcgggccgcgtcgacgccatcgtgttcgacaagaccgggacgttgaccgtgggccgccccgtggtcaccaatatcgttgccatgcataaagattgggagcccgagcaagtgctggcctatgccgccagctcggagatccactcacgtcatccgctggccgaggcggtgatccgctcgacggaggaacgccgcatcagcatcccaccacacgaggagtgcgaggtgctggtcggcctgggcatgcggacctgggccgacggtcggaccctgctgctgggcagtccgtcgttgctgcgcgccgaaaaagttcgggtgtccaagaaggcgtcggagtgggtcgacaagctgcgccgccaggcggagaccccgctgctgctcgcggtggacggcacgctggtcggcctgatcagcctgcgcgacgaggtgcgtccggaggcggcccaggtgctgacgaagctgcgggccaatgggattcgccggatcgtcatgctcaccggcgaccacccggagatcgcccaggttgtcgccgacgaactggggattgatgagtggcgcgccgaggtcatgccggaggacaagctcgcggcggtgcgcgagctgcaggacgacggctacgtcgtcgggatggtcggcgacggcatcaacgacgccccggcgctggccgccgccgatatcgggatcgccatgggccttgccggaaccgacgtcgccgtcgagaccgccgatgtcgcgctggccaacgacgacctgcaccgcctgctcgacgttggggacctgggcgagcgggcagtggatgtaatccggcagaactacggcatgtccatcgccgtcaacgcggccgggctgctgatcggcgcgggcggtgcgctctcgccggtgctggcggcgatcctgcacaacgcgtcgtcggtggcggtggtggccaacagttcccggttgatccgctaccgcctggaccgctag
SEQ ID No.12
MTLEVVSDAAGRMRVKVDWVRCDSRRAVAVEEAVAKQNGVRVVHAYPRTGSVVVWYSPRRADRAAVLAAIKGAAHVAAELIPARAPHSAEIRNTDVLRMVIGGVALALLGVRRYVFARPPLLGTTGRTVATGVTIFTGYPFLRGALRSLRSGKAGTDALVSAATVASLILRENVVALTVLWLLNIGEYLQDLTLRRTRRAISELLRGNQDTAWVRLTDPSAGSDAATEIQVPIDTVQIGDEVVVHEHVAIPVDGEVVDGEAIVNQSAITGENLPVSVVVGTRVHAGSVVVRGRVVVRAHAVGNQTTIGRIISRVEEAQLDRAPIQTVGENFSRRFVPTSFIVSAIALLITGDVRRAMTMLLIACPCAVGLSTPTAISAAIGNGARRGILIKGGSHLEQAGRVDAIVFDKTGTLTVGRPVVTNIVAMHKDWEPEQVLAYAASSEIHSRHPLAEAVIRSTEERRISIPPHEECEVLVGLGMRTWADGRTLLLGSPSLLRAEKVRVSKKASEWVDKLRRQAETPLLLAVDGTLVGLISLRDEVRPEAAQVLTKLRANGIRRIVMLTGDHPEIAQVVADELGIDEWRAEVMPEDKLAAVRELQDDGYVVGMVGDGINDAPALAAADIGIAMGLAGTDVAVETADVALANDDLHRLLDVGDLGERAVDVIRQNYGMSIAVNAAGLLIGAGGALSPVLAAILHNASSVAVVANSSRLIRYRLDR
SEQ ID No.13
atgactgtgcaggagttcgacgtcgtggtggtcggcagcggcgccgccggcatggttgctgcgctggtcgccgctcaccgaggtctctcgacggtagtcgtcgagaaggccccgcactacggcggctccaccgcacgctcgggcggcggcgtctggatccccaacaacgaggtcctcaagcgccgcggcgttcgagatacaccggaggcggcacgcacctatctgcacggcatcgtcggcgaaatcgtcgagccggaacgcatcgatgcttacctcgaccgcgggcccgagatgctgtcgttcgtgctgaagcacacgccgctgaagatgtgctgggtacccggctactccgactactaccccgaggctccgggcggccgcccgggcggacgttcgatcgagccgaaaccgttcaacgcgcgcaagcttggtgccgacatggccgggctggagcccgcgtatggcaaggttccgctcaatgtggttgtgatgcagcaggactacgttcgcctcaatcagctcaaacgtcacccccgtggcgtgctgcgcagcatgaaggtcggcgcccgcacgatgtgggcgaaggcaacaggtaagaacctggtcggcatgggtcgagccctcattgggccgttgcggatcgggttgcagcgcgccggagtgccggtcgaactcaacaccgccttcaccgatcttttcgtcgaaaatggcgtcgtgtccggggtatacgtccgcgattcccacgaggcggaatccgctgagccgcagctgatccgggctcgccgcggcgtgatcctggcctgtggtggtttcgagcataacgagcagatgcgaatcaagtaccagcgggcacccatcaccaccgagtggaccgtgggcgccagcgccaataccggtgacggcattctcgccgccgaaaagctcggcgcagcactggatctgatggatgacgcttggtggggcccgacggtaccgctggtcggcaaaccatggttcgcgctctcggagcgcaactctcccggttcgatcatcgtcaacatgtcaggcaagcgattcatgaacgaatcgatgccatacgtcgaagcctgtcatcatatgtacggcggcgaacacggccaggggcccggaccgggcgagaacattccggcgtggctggtgttcgaccagcgataccgggaccgctacatcttcgcgggactacaaccagggcaacgcattccgagcaggtggctggattccggcgtcatcgtccaggccgatacccttgcggagctggccggcaaggccggtctacccgcggacgaactcactgccaccgtccagcgtttcaacgcattcgcccggtccggtgtcgacgaggactaccaccgcggggaaagtgcctacgatcgctactacggcgacccgagcaacaagcccaatccgaacctcggcgaggtcggccacccgccctattatggcgccaagatggttccgggcgacctggggaccaagggcggtatccgcaccgatgtcaacggacgtgctctgcgggacgacggcagcatcatcgacggcctttacgctgcaggcaatgtcagtgccccagtgatgggacacacctaccccggtccgggcggcacgataggcccggcgatgacgttcgggtacctggcggcgctgcacattgccgatcaggcgggaaagcgctga
SEQ ID No.14
MTVQEFDVVVVGSGAAGMVAALVAAHRGLSTVVVEKAPHYGGSTARSGGGVWIPNNEVLKRRGVRDTPEAARTYLHGIVGEIVEPERIDAYLDRGPEMLSFVLKHTPLKMCWVPGYSDYYPEAPGGRPGGRSIEPKPFNARKLGADMAGLEPAYGKVPLNVVVMQQDYVRLNQLKRHPRGVLRSMKVGARTMWAKATGKNLVGMGRALIGPLRIGLQRAGVPVELNTAFTDLFVENGVVSGVYVRDSHEAESAEPQLIRARRGVILACGGFEHNEQMRIKYQRAPITTEWTVGASANTGDGILAAEKLGAALDLMDDAWWGPTVPLVGKPWFALSERNSPGSIIVNMSGKRFMNESMPYVEACHHMYGGEHGQGPGPGENIPAWLVFDQRYRDRYIFAGLQPGQRIPSRWLDSGVIVQADTLAELAGKAGLPADELTATVQRFNAFARSGVDEDYHRGESAYDRYYGDPSNKPNPNLGEVGHPPYYGAKMVPGDLGTKGGIRTDVNGRALRDDGSIIDGLYAAGNVSAPVMGHTYPGPGGTIGPAMTFGYLAALHIADQAGKR
SEQ ID No.15
gtgagtccggcgcccgtgcaggtgatgggggttctaaacgtcacggacgactctttctcggacggcgggtgttatctcgatctcgacgatgcggtgaagcacggtctggcgatggcagccgcaggtgcgggcatcgtcgacgtcggtggtgagtcgagccggcccggtgccactcgggttgacccggcggtggagacgtctcgtgtcatacccgtcgtcaaagagcttgcagcacaaggcatcaccgtcagcatcgataccatgcgcgcggatgtcgctcgggcggcgttgcagaacggtgcccagatggtcaacgacgtgtcgggtgggcgggccgatccggcgatggggccgctgttggccgaggccgatgtgccgtgggtgttgatgcactggcgggcggtatcggccgataccccgcatgtgcctgtgcgctacggcaacgtggtggccgaggtccgtgccgacctgctggccagcgtcgccgacgcggtggccgcaggcgtcgacccggcaaggctggtgctcgatcccgggcttggattcgccaagacggcgcaacataattgggcgatcttgcatgcccttccggaactggtcgcgaccggaatcccagtgctggtgggtgcttcgcgcaagcgcttcctcggtgcgttgttggccgggcccgacggcgtgatgcggccaaccgatgggcgtgacaccgcgacggcggtgatttccgcgctggccgcactgcacggggcctggggtgtgcgggtgcatgatgtgcgggcctcggtcgatgccatcaaggtggtcgaagcgtggatgggagcggaaaggatagaacgcgatggctga
SEQ ID No.16
VSPAPVQVMGVLNVTDDSFSDGGCYLDLDDAVKHGLAMAAAGAGIVDVGGESSRPGATRVDPAVETSRVIPVVKELAAQGITVSIDTMRADVARAALQNGAQMVNDVSGGRADPAMGPLLAEADVPWVLMHWRAVSADTPHVPVRYGNVVAEVRADLLASVADAVAAGVDPARLVLDPGLGFAKTAQHNWAILHALPELVATGIPVLVGASRKRFLGALLAGPDGVMRPTDGRDTATAVISALAALHGAWGVRVHDVRASVDAIKVVEAWMGAERIERDG
SEQ ID No.17
atgagtattaccaggccgacgggcagctatgccagacagatgctggatccgggcggctgggtggaagccgatgaagacactttctatgaccgggcccaggaatatagccaggttttgcaaagggtcaccgatgtattggacacctgccgccagcagaaaggccacgtcttcgaaggcggcctatggtccggcggcgccgccaatgctgccaacggcgccctgggtgcaaacatcaatcaattgatgacgctgcaggattatctcgccacggtgattacctggcacaggcatattgccgggttgattgagcaagctaaatccgatatcggcaataatgtggatggcgctcaacgggagatcgatatcctggagaatgaccctagcctggatgctgatgagcgccataccgccatcaattcattggtcacggcgacgcatggggccaatgtcagtctggtcgccgagaccgctgagcgggtgctggaatccaagaattggaaacctccgaagaacgcactcgaggatttgcttcagcagaagtcgccgccacccccagacgtgcctaccctggtcgtgccatccccgggcacaccgggcacaccgggaaccccgatcaccccgggaaccccgatcaccccgggaaccccaatcacacccatcccgggagcgccggtaactccgatcacaccaacgcccggcactcccgtcacgccggtgaccccgggcaagccggtcaccccggtgaccccggtcaaaccgggcacaccaggcgagccaaccccgatcacgccggtcacccccccggtcgccccggccacaccggcaaccccggccacgcccgttaccccagctcccgctccacacccgcagccggctccggcaccggcgccatcgcctgggccccagccggttacaccggccactcccggtccgtctggtccagcaacaccgggcaccccagggggcgagccggcgccgcacgtcaaacccgcggcgttggcggagcaacctggtgtgccgggccagcatgcgggcggggggacgcagtcggggcctgcccatgcggacgaatccgccgcgtcggtgacgccggctgcggcgtccggtgtcccgggcgcacgggcggcggccgccgcgccgagcggtaccgccgtgggagcgggcgcgcgttcgagcgtgggtacggccgcggcctcgggcgcggggtcgcatgctgccactgggcgggcgccggtggctacctcggacaaggcggcggcaccgagcacgcgggcggcctcggcgcggacggcacctcctgcccgcccgccgtcgaccgatcacatcgacaaacccgatcgcagcgagtctgcagatgacggtacgccggtgtcgatgatcccggtgtcggcggctcgggcggcacgcgacgccgccactgcagctgccagcgcccgccagcgtggccgcggtgatgcgctgcggttggcgcgacgcatcgcggcggcgctcaacgcgtccgacaacaacgcgggcgactacgggttcttctggatcaccgcggtgaccaccgacggttccatcgtcgtggccaacagctatgggctggcctacatacccgacgggatggaattgccgaataaggtgtacttggccagcgcggatcacgcaatcccggttgacgaaattgcacgctgtgccacctacccggttttggccgtgcaagcctgggcggctttccacgacatgacgctgcgggcggtgatcggtaccgcggagcagttggccagttcggatcccggtgtggccaagattgtgctggagccagatgacattccggagagcggcaaaatgacgggccggtcgcggctggaggtcgtcgacccctcggcggcggctcagctggccgacactaccgatcagcgtttgctcgacttgttgccgccggcgccggtggatgtcaatccaccgggcgatgagcggcacatgctgtggttcgagctgatgaagcccatgaccagcaccgctaccggccgcgaggccgctcatctgcgggcgttccgggcctacgctgcccactcacaggagattgccctgcaccaagcgcacactgcgactgacgcggccgtccagcgtgtggccgtcgcggactggctgtactggcaatacgtcaccgggttgctcgaccgggccctggccgccgcatgctga
SEQ ID No.18
MSITRPTGSYARQMLDPGGWVEADEDTFYDRAQEYSQVLQRVTDVLDTCRQQKGHVFEGGLWSGGAANAANGALGANINQLMTLQDYLATVITWHRHIAGLIEQAKSDIGNNVDGAQREIDILENDPSLDADERHTAINSLVTATHGANVSLVAETAERVLESKNWKPPKNALEDLLQQKSPPPPDVPTLVVPSPGTPGTPGTPITPGTPITPGTPITPIPGAPVTPITPTPGTPVTPVTPGKPVTPVTPVKPGTPGEPTPITPVTPPVAPATPATPATPVTPAPAPHPQPAPAPAPSPGPQPVTPATPGPSGPATPGTPGGEPAPHVKPAALAEQPGVPGQHAGGGTQSGPAHADESAASVTPAAASGVPGARAAAAAPSGTAVGAGARSSVGTAAASGAGSHAATGRAPVATSDKAAAPSTRAASARTAPPARPPSTDHIDKPDRSESADDGTPVSMIPVSAARAARDAATAAASARQRGRGDALRLARRIAAALNASDNNAGDYGFFWITAVTTDGSIVVANSYGLAYIPDGMELPNKVYLASADHAIPVDEIARCATYPVLAVQAWAAFHDMTLRAVIGTAEQLASSDPGVAKIVLEPDDIPESGKMTGRSRLEVVDPSAAAQLADTTDQRLLDLLPPAPVDVNPPGDERHMLWFELMKPMTSTATGREAAHLRAFRAYAAHSQEIALHQAHTATDAAVQRVAVADWLYWQYVTGLLDRALAAAC
SEQ ID NO: 19
MQLVDRVRGAVTGMSRRLVVGAVGAALVSGLVGAVGGTATAGAFSRPGLPVEYLQVPSPSMGRDIKVQFQSGGANSPALYLLDGLRAQDDFSGWDINTPAFEWYDQSGLSVVMPVGGQSSFYSDWYQPACGKAGCQTYKWETFLTSELPGWLQANRHVKPTGSAVVGLSMAASSALTLAIYHPQQFVYAGAMSGLLDPSQAMGPTLIGLAMGDAGGYKASDMWGPKEDPAWQRNDPLLNVGKLIANNTRVWVYCGNGKPSDLGGNNLPAKFLEGFVRTSNIKFQDAYNAGGGHNGVFDFPDSGTHSWEYWGAQLNAMKPDLQRALGATPNTGPAPQGA
SEQ ID NO: 20
MTDVSRKIRAWGRRLMIGTAAAVVLPGLVGLAGGAATAGAFSRPGLPVEYLQVPSPSMGRDIKVQFQSGGNNSPAVYLLDGLRAQDDYNGWDINTPAFEWYYQSGLSIVMPVGGQSSFYSDWYSPACGKAGCQTYKWETFLTSELPQWLSANRAVKPTGSAAIGLSMAGSSAMILAAYHPQQFIYAGSLSALLDPSQGMGPSLIGLAMGDAGGYKAADMWGPSSDPAWERNDPTQQIPKLVANNTRLWVYCGNGTPNELGGANIPAEFLENFVRSSNLKFQDAYNAAGGHNAVFNFPPNGTHSWEYWGAQLNAMKGDLQSSLGAG
SEQ ID NO: 21
MTEQQWNFAGIEAAASAIQGNVTSIHSLLDEGKQSLTKLAAAWGGSGSEAYQGVQQKWDATATELNNALQNLARTISEAGQAMASTEGNVTGMFA
SEQ ID NO: 22
MSQIMYNYPAMLGHAGDMAGYAGTLQSLGAEIAVEQAALQSAWQGDTGITYQAWQAQWNQAMEDLVRAYHAMSSTHEANTMAMMARDTAEAAKWGG
SEQ ID NO: 23
MSNSRRRSLRWSWLLSVLAAVGLGLATAPAQAAPPALSQDRFADFPALPLDPSAMVAQVGPQVVNINTKLGYNNAVGAGTGIVIDPNGVVLTNNHVIAGATDINAFSVGSGQTYGVDVVGYDRTQDVAVLQLRGAGGLPSAAIGGGVAVGEPVVAMGNSGGQGGTPRAVPGRVVALGQTVQASDSLTGAEETLNGLIQFDAAIQPGDSGGPVVNGLGQVVGMNTAASDNFQLSQGGQGFAIPIGQAMAIAGQIRSGGGSPTVHIGPTAFLGLGVVDNNGNGARVQRVVGSAPAASLGISTGDVITAVDGAPINSATAMADALNGHHPGDVISVTWQTKSGGTRTGNVTLAEGPPA
SEQ ID NO: 24
MVDFGALPPEINSARMYAGPGSASLVAAAQMWDSVASDLFSAASAFQSVVWGLTVGSWIGSSAGLMVAAASPYVAWMSVTAGQAELTAAQVRVAAAAYETAYGLTVPPPVIAENRAELMILIATNLLGQNTPAIAVNEAEYGEMWAQDAAAMFGYAAATATATATLLPFEEAPEMTSAGGLLEQAAAVEEASDTAAANQLMNNVPQALQQLAQPTQGTTPSSKLGGLWKTVSPHRSPISNMVSMANNHMSMTNSGVSMTNTLSSMLKGFAPAAAAQAVQTAAQNGVRAMSSLGSSLGSSGLGGGVAANLGRAASVGSLSVPQAWAAANQAVTPAARALPLTSLTSAAERGPGQMLGGLPVGQMGARAGGGLSGVLRVPPRPYVMPHSPAAG
SEQ ID NO: 25
MRTPRRHCRRIAVLAAVSIAATVVAGCSSGSKPSGGPLPDAKPLVEEATAQTKALKSAHMVLTVNGKIPGLSLKTLSGDLTTNPTAATGNVKLTLGGSDIDADFVVFDGILYATLTPNQWSDFGPAADIYDPAQVLNPDTGLANVLANFADAKAEGRDTINGQNTIRISGKVSAQAVNQIAPPFNATQPVPATVWIQETGDHQLAQAQLDRGSGNSVQMTLSKWGEKVQVTKPPVS
SEQ ID NO: 26
MAKTIAYDEEARRGLERGLNALADAVKVTLGPKGRNVVLEKKWGAPTITNDGVSIAKEIELEDPYEKIGAELVKEVAKKTDDVAGDGTTTATVLAQALVREGLRNVAAGANPLGLKRGIEKAVEKVTETLLKGAKEVETKEQIAATAAISAGDQSIGDLIAEAMDKVGNEGVITVEESNTFGLQLELTEGMRFDKGYISGYFVTDPERQEAVLEDPYILLVSSKVSTVKDLLPLLEKVIGAGKPLLIIAEDVEGEALSTLVVNKIRGTFKSVAVKAPGFGDRRKAMLQDMAILTGGQVISEEVGLTLENADLSLLGKARKVVVTKDETTIVEGAGDTDAIAGRVAQIRQEIENSDSDYDREKLQERLAKLAGGVAVIKAGAATEVELKERKHRIEDAVRNAKAAVEEGIVAGGGVTLLQAAPTLDELKLEGDEATGANIVKVALEAPLKQIAFNSGLEPGVVAEKVRNLPAGHGLNAQTGVYEDLLAAGVADPVKVTRSALQNAASIAGLFLTTEAVVADKPEKEKASVPGGGDMGGMDF
SEQ ID NO: 27
MAENSNIDDIKAPLLAALGAADLALATVNELITNLRERAEETRTDTRSRVEESRARLTKLQEDLPEQLTELREKFTAEELRKAAEGYLEAATSRYNELVERGEAALERLRSQQSFEEVSARAEGYVDQAVELTQEALGTVASQTRAVGERAAKLVGIELPKKAAPAKKAAPAKKAAPAKKAAAKKAPAKKAAAKKVTQK
SEQ ID NO: 28
VTQTGKRQRRKFGRIRQFNSGRWQASYTGPDGRVYIAPKTFNAKIDAEAWLTDRRREIDRQLWSPASGQEDRPGAPFGEYAEGWLKQRGIKDRTRAHYRKLLDNHILATFADTDLRDITPAAVRRWYATTAVGTPTMRAHSYSLLRAIMQTALADDLIDSNPCRISGASTARRVHKIRPATLDELETITKAMPDPYQAFVLMAAWLAMRYGELTELRRKDIDLHGEVARVRRAVVRVGEGFKVTTPKSDAGVRDISIPPHLIPAIEDHLHKHVNPGRESLLFPSVNDPNRHLAPSALYRMFYKARKAAGRPDLRVHDLRHSGAVLAASTGATLAELMQRLGHSTAGAALRYQHAAKGRDREIAALLSKLAENQEM
SEQ ID NO: 29
VIAGVDQALAATGQASQRAAGASGGVTVGVGVGTEQRNLSVVAPSQFTFSSRSPDFVDETAGQSWCAILGLNQFH
SEQ ID NO: 30
MATTLPVQRHPRSLFPEFSELFAAFPSFAGLRPTFDTRLMRLEDEMKEGRYEVRAELPGVDPDKDVDIMVRDGQLTIKAERTEQKDFDGRSEFAYGSFVRTVSLPVGADEDDIKATYDKGILTVSVAVSEGKPTEKHIQIRSTN
SEQ ID NO: 31
MSGRHRKPTTSNVSVAKIAFTGAVLGGGGIAMAAQATAATDGEWDQVARCESGGNWSINTGNGYLGGLQFTQSTWAAHGGGEFAPSAQLASREQQIAVGERVLATQGRGAWPVCGRGLSNATPREVLPASAAMDAPLDAAAVNGEPAPLAPPPADPAPPVELAANDLPAPLGEPLPAAPADPAPPADLAPPAPADVAPPVELAVNDLPAPLGEPLPAAPADPAPPADLAPPAPADLAPPAPADLAPPAPADLAPPVELAVNDLPAPLGEPLPAAPAELAPPADLAPASADLAPPAPADLAPPAPAELAPPAPADLAPPAAVNEQTAPGDQPATAPGGPVGLATDLELPEPDPQPADAPPPGDVTEAPAETPQVSNIAYTKKLWQAIRAQDVCGNDALDSLAQPYVIG
SEQ ID NO: 32
MLRLVVGALLLVLAFAGGYAVAACKTVTLTVDGTAMRVTTMKSRVIDIVEENGFSVDDRDDLYPAAGVQVHDADTIVLRRSRPLQISLDGHDAKQVWTTASTVDEALAQLAMTDTAPAAASRASRVPLSGMALPVVSAKTVQLNDGGLVRTVHLPAPNVAGLLSAAGVPLLQSDHVVPAATAPIVEGMQIQVTRNRIKKVTERLPLPPNARRVEDPEMNMSREVVEDPGVPGTQDVTFAVAEVNGVETGRLPVANVVVTPAHEAVVRVGTKPGTEVPPVIDGSIWDAIAGCEAGGNWAINTGNGYYGGVQFDQGTWEANGGLRYAPRADLATREEQIAVAEVTRLRQGWGAWPVCAARAGAR
SEQ ID NO: 33
VHPLPADHGRSRCNRHPISPLSLIGNASATSGDMSSMTRIAKPLIKSAMAAGLVTASMSLSTAVAHAGPSPNWDAVAQCESGGNWAANTGNGKYGGLQFKPATWAAFGGVGNPAAASREQQIAVANRVLAEQGLDAWPTCGAASGLPIALWSKPAQGIKQIINEIIWAGIQASIPR
SEQ ID NO: 34
MTPGLLTTAGAGRPRDRCARIVCTVFIETAVVATMFVALLGLSTISSKADDIDWDAIAQCESGGNWAANTGNGLYGGLQISQATWDSNGGVGSPAAASPQQQIEVADNIMKTQGPGAWPKCSSCSQGDAPLGSLTHILTFLAAETGGCSGSRDD
SEQ ID NO: 35
LKNARTTLIAAAIAGTLVTTSPAGIANADDAGLDPNAAAGPDAVGFDPNLPPAPDAAPVDTPPAPEDAGFDPNLPPPLAPDFLSPPAEEAPPVPVAYSVNWDAIAQCESGGNWSINTGNGYYGGLRFTAGTWRANGGSGSAANASREEQIRVAENVLRSQGIRAWPVCGRRG
SEQ ID NO: 36
MIATTRDREGATMITFRLRLPCRTILRVFSRNPLVRGTDRLEAVVMLLAVTVSLLTIPFAAAAGTAVQDSRSHVYAHQAQTRHPATATVIDHEGVIDSNTTATSAPPRTKITVPARWVVNGIERSGEVNAKPGTKSGDRVGIWVDSAGQLVDEPAPPARAIADAALAALGLWLSVAAVAGALLALTRAILIRVRNASWQHDIDSLFCTQR
SEQ ID NO: 37
MTEPAAWDEGKPRIITLTMNPALDITTSVDVVRPTEKMRCGAPRYDPGGGGINVARIVHVLGGCSTALFPAGGSTGSLLMALLGDAGVPFRVIPIAASTRESFTVNESRTAKQYRFVLPGPSLTVAEQEQCLDELRGAAASAAFVVASGSLPPGVAADYYQRVADICRRSSTPLILDTSGGGLQHISSGVFLLKASVRELRECVGSELLTEPEQLAAAHELIDRGRAEVVVVSLGSQGALLATRHASHRFSSIPMTAVSGVGAGDAMVAAITVGLSRGWSLIKSVRLGNAAGAAMLLTPGTAACNRDDVERFFELAAEPTEVGQDQYVWHPIVNPEASP
SEQ ID NO: 38
MPDTMVTTDVIKSAVQLACRAPSLHNSQPWRWIAEDHTVALFLDKDRVLYATDHSGREALLGCGAVLDHFRVAMAAAGTTANVERFPNPNDPLHLASIDFSPADFVTEGHRLRADAILLRRTDRLPFAEPPDWDLVESQLRTTVTADTVRIDVIADDMRPELAAASKLTESLRLYDSSYHAELFWWTGAFETSEGIPHSSLVSAAESDRVTFGRDFPVVANTDRRPEFGHDRSKVLVLSTYDNERASLLRCGEMLSAVLLDATMAGLATCTLTHITELHASRDLVAALIGQPATPQALVRVGLAPEMEEPPPATPRRPIDEVFHVRAKDHR
SEQ ID NO: 39
MTTARDIMNAGVTCVGEHETLTAAAQYMREHDIGALPICGDDDRLHGMLTDRDIVIKGLAAGLDPNTATAGELARDSIYYVDANASIQEMLNVMEEHQVRRVPVISEHRLVGIVTEADIARHLPEHAIVQFVKAICSPMALAS
SEQ ID NO: 40
MASSASDGTHERSAFRLSPPVLSGAMGPFMHTGLYVAQSWRDYLGQQPDKLPIARPTIALAAQAFRDEIVLLGLKARRPVSNHRVFERISQEVAAGLEFYGNRRWLEKPSGFFAQPPPLTEVAVRKVKDRRRSFYRIFFDSGFTPHPGEPGSQRWLSYTANNREYALLLRHPEPRPWLVCVHGTEMGRAPLDLAVFRAWKLHDELGLNIVMPVLPMHGPRGQGLPKGAVFPGEDVLDDVHGTAQAVWDIRRLLSWIRSQEEESLIGLNGLSLGGYIASLVASLEEGLACAILGVPVADLIELLGRHCGLRHKDPRRHTVKMAEPIGRMISPLSLTPLVPMPGRFIYAGIADRLVHPREQVTRLWEHWGKPEIVWYPGGHTGFFQSRPVRRFVQAALEQSGLLDAPRTQRDRSA
SEQ ID NO: 41
MSTQRPRHSGIRAVGPYAWAGRCGRIGRWGVHQEAMMNLAIWHPRKVQSATIYQVTDRSHDGRTARVPGDEITSTVSGWLSELGTQSPLADELARAVRIGDWPAAYAIGEHLSVEIAVAV
SEQ ID NO: 42
atgcagcttgttgacagggttcgtggcgccgtcacgggtatgtcgcgtcgactcgtggtcggggccgtcggcgcggccctagtgtcgggtctggtcggcgccgtcggtggcacggcgaccgcgggggcattttcccggccgggcttgccggtggagtacctgcaggtgccgtcgccgtcgatgggccgtgacatcaaggtccaattccaaagtggtggtgccaactcgcccgccctgtacctgctcgacggcctgcgcgcgcaggacgacttcagcggctgggacatcaacaccccggcgttcgagtggtacgaccagtcgggcctgtcggtggtcatgccggtgggtggccagtcaagcttctactccgactggtaccagcccgcctgcggcaaggccggttgccagacttacaagtgggagaccttcctgaccagcgagctgccggggtggctgcaggccaacaggcacgtcaagcccaccggaagcgccgtcgtcggtctttcgatggctgcttcttcggcgctgacgctggcgatctatcacccccagcagttcgtctacgcgggagcgatgtcgggcctgttggacccctcccaggcgatgggtcccaccctgatcggcctggcgatgggtgacgctggcggctacaaggcctccgacatgtggggcccgaaggaggacccggcgtggcagcgcaacgacccgctgttgaacgtcgggaagctgatcgccaacaacacccgcgtctgggtgtactgcggcaacggcaagccgtcggatctgggtggcaacaacctgccggccaagttcctcgagggcttcgtgcggaccagcaacatcaagttccaagacgcctacaacgccggtggcggccacaacggcgtgttcgacttcccggacagcggtacgcacagctgggagtactggggcgcgcagctcaacgctatgaagcccgacctgcaacgggcactgggtgccacgcccaacaccgggcccgcgccccagggcgcctag
SEQ ID NO: 43
atgacagacgtgagccgaaagattcgagcttggggacgccgattgatgatcggcacggcagcggctgtagtccttccgggcctggtggggcttgccggcggagcggcaaccgcgggcgcgttctcccggccggggctgccggtcgagtacctgcaggtgccgtcgccgtcgatgggccgcgacatcaaggttcagttccagagcggtgggaacaactcacctgcggtttatctgctcgacggcctgcgcgcccaagacgactacaacggctgggatatcaacaccccggcgttcgagtggtactaccagtcgggactgtcgatagtcatgccggtcggcgggcagtccagcttctacagcgactggtacagcccggcctgcggtaaggctggctgccagacttacaagtgggaaaccttcctgaccagcgagctgccgcaatggttgtccgccaacagggccgtgaagcccaccggcagcgctgcaatcggcttgtcgatggccggctcgtcggcaatgatcttggccgcctaccacccccagcagttcatctacgccggctcgctgtcggccctgctggacccctctcaggggatggggcctagcctgatcggcctcgcgatgggtgacgccggcggttacaaggccgcagacatgtggggtccctcgagtgacccggcatgggagcgcaacgaccctacgcagcagatccccaagctggtcgcaaacaacacccggctatgggtttattgcgggaacggcaccccgaacgagttgggcggtgccaacatacccgccgagttcttggagaacttcgttcgtagcagcaacctgaagttccaggatgcgtacaacgccgcgggcgggcacaacgccgtgttcaacttcccgcccaacggcacgcacagctgggagtactggggcgctcagctcaacgccatgaagggtgacctgcagagttcgttaggcgccggctga
SEQ ID NO: 44
atgacagagcagcagtggaatttcgcgggtatcgaggccgcggcaagcgcaatccagggaaatgtcacgtccattcattccctccttgacgaggggaagcagtccctgaccaagctcgcagcggcctggggcggtagcggttcggaggcgtaccagggtgtccagcaaaaatgggacgccacggctaccgagctgaacaacgcgctgcagaacctggcgcggacgatcagcgaagccggtcaggcaatggcttcgaccgaaggcaacgtcactgggatgttcgcatag
SEQ ID NO: 45
atgtcgcaaatcatgtacaactaccccgcgatgttgggtcacgccggggatatggccggatatgccggcacgctgcagagcttgggtgccgagatcgccgtggagcaggccgcgttgcagagtgcgtggcagggcgataccgggatcacgtatcaggcgtggcaggcacagtggaaccaggccatggaagatttggtgcgggcctatcatgcgatgtccagcacccatgaagccaacaccatggcgatgatggcccgcgacacggccgaagccgccaaatggggcggctag
SEQ ID NO: 46
atgagcaattcgcgccgccgctcactcaggtggtcatggttgctgagcgtgctggctgccgtcgggctgggcctggccacggcgccggcccaggcggccccgccggccttgtcgcaggaccggttcgccgacttccccgcgctgcccctcgacccgtccgcgatggtcgcccaagtggggccacaggtggtcaacatcaacaccaaactgggctacaacaacgccgtgggcgccgggaccggcatcgtcatcgatcccaacggtgtcgtgctgaccaacaaccacgtgatcgcgggcgccaccgacatcaatgcgttcagcgtcggctccggccaaacctacggcgtcgatgtggtcgggtatgaccgcacccaggatgtcgcggtgctgcagctgcgcggtgccggtggcctgccgtcggcggcgatcggtggcggcgtcgcggttggtgagcccgtcgtcgcgatgggcaacagcggtgggcagggcggaacgccccgtgcggtgcctggcagggtggtcgcgctcggccaaaccgtgcaggcgtcggattcgctgaccggtgccgaagagacattgaacgggttgatccagttcgatgccgcgatccagcccggtgattcgggcgggcccgtcgtcaacggcctaggacaggtggtcggtatgaacacggccgcgtccgataacttccagctgtcccagggtgggcagggattcgccattccgatcgggcaggcgatggcgatcgcgggccagatccgatcgggtggggggtcacccaccgttcatatcgggcctaccgccttcctcggcttgggtgttgtcgacaacaacggcaacggcgcacgagtccaacgcgtggtcgggagcgctccggcggcaagtctcggcatctccaccggcgacgtgatcaccgcggtcgacggcgctccgatcaactcggccaccgcgatggcggacgcgcttaacgggcatcatcccggtgacgtcatctcggtgacctggcaaaccaagtcgggcggcacgcgtacagggaacgtgacattggccgagggacccccggcctga
SEQ ID NO: 47
atggtggatttcggggcgttaccaccggagatcaactccgcgaggatgtacgccggcccgggttcggcctcgctggtggccgcggctcagatgtgggacagcgtggcgagtgacctgttttcggccgcgtcggcgtttcagtcggtggtctggggtctgacggtggggtcgtggataggttcgtcggcgggtctgatggtggcggcggcctcgccgtatgtggcgtggatgagcgtcaccgcggggcaggccgagctgaccgccgcccaggtccgggttgctgcggcggcctacgagacggcgtatgggctgacggtgcccccgccggtgatcgccgagaaccgtgctgaactgatgattctgatagcgaccaacctcttggggcaaaacaccccggcgatcgcggtcaacgaggccgaatacggcgagatgtgggcccaagacgccgccgcgatgtttggctacgccgcggcgacggcgacggcgacggcgacgttgctgccgttcgaggaggcgccggagatgaccagcgcgggtgggctcctcgagcaggccgccgcggtcgaggaggcctccgacaccgccgcggcgaaccagttgatgaacaatgtgccccaggcgctgcaacagctggcccagcccacgcagggcaccacgccttcttccaagctgggtggcctgtggaagacggtctcgccgcatcggtcgccgatcagcaacatggtgtcgatggccaacaaccacatgtcgatgaccaactcgggtgtgtcgatgaccaacaccttgagctcgatgttgaagggctttgctccggcggcggccgcccaggccgtgcaaaccgcggcgcaaaacggggtccgggcgatgagctcgctgggcagctcgctgggttcttcgggtctgggcggtggggtggccgccaacttgggtcgggcggcctcggtcggttcgttgtcggtgccgcaggcctgggccgcggccaaccaggcagtcaccccggcggcgcgggcgctgccgctgaccagcctgaccagcgccgcggaaagagggcccgggcagatgctgggcgggctgccggtggggcagatgggcgccagggccggtggtgggctcagtggtgtgctgcgtgttccgccgcgaccctatgtgatgccgcattctccggcggccggctag
SEQ ID NO: 48
atgcggacccccagacgccactgccgtcgcatcgccgtcctcgccgccgttagcatcgccgccactgtcgttgccggctgctcgtcgggctcgaagccaagcggcggaccacttccggacgcgaagccgctggtcgaggaggccaccgcgcagaccaaggctctcaagagcgcgcacatggtgctgacggtcaacggcaagatcccgggactgtctctgaagacgctgagcggcgatctcaccaccaaccccaccgccgcgacgggaaacgtcaagctcacgctgggtgggtctgatatcgatgccgacttcgtggtgttcgacgggatcctgtacgccaccctgacgcccaaccagtggagcgatttcggtcccgccgccgacatctacgaccccgcccaggtgctgaatccggataccggcctggccaacgtgctggcgaatttcgccgacgcaaaagccgaagggcgggataccatcaacggccagaacaccatccgcatcagcgggaaggtatcggcacaggcggtgaaccagatagcgccgccgttcaacgcgacgcagccggtgccggcgaccgtctggattcaggagaccggcgatcatcaactggcacaggcccagttggaccgcggctcgggcaattccgtccagatgaccttgtcgaaatggggcgagaaggtccaggtcacgaagcccccggtgagctga
SEQ ID NO: 49
atggccaagacaattgcgtacgacgaagaggcccgtcgcggcctcgagcggggcttgaacgccctcgccgatgcggtaaaggtgacattgggccccaagggccgcaacgtcgtcctggaaaagaagtggggtgcccccacgatcaccaacgatggtgtgtccatcgccaaggagatcgagctggaggatccgtacgagaagatcggcgccgagctggtcaaagaggtagccaagaagaccgatgacgtcgccggtgacggcaccacgacggccaccgtgctggcccaggcgttggttcgcgagggcctgcgcaacgtcgcggccggcgccaacccgctcggtctcaaacgcggcatcgaaaaggccgtggagaaggtcaccgagaccctgctcaagggcgccaaggaggtcgagaccaaggagcagattgcggccaccgcagcgatttcggcgggtgaccagtccatcggtgacctgatcgccgaggcgatggacaaggtgggcaacgagggcgtcatcaccgtcgaggagtccaacacctttgggctgcagctcgagctcaccgagggtatgcggttcgacaagggctacatctcggggtacttcgtgaccgacccggagcgtcaggaggcggtcctggaggacccctacatcctgctggtcagctccaaggtgtccactgtcaaggatctgctgccgctgctcgagaaggtcatcggagccggtaagccgctgctgatcatcgccgaggacgtcgagggcgaggcgctgtccaccctggtcgtcaacaagatccgcggcaccttcaagtcggtggcggtcaaggctcccggcttcggcgaccgccgcaaggcgatgctgcaggatatggccattctcaccggtggtcaggtgatcagcgaagaggtcggcctgacgctggagaacgccgacctgtcgctgctaggcaaggcccgcaaggtcgtggtcaccaaggacgagaccaccatcgtcgagggcgccggtgacaccgacgccatcgccggacgagtggcccagatccgccaggagatcgagaacagcgactccgactacgaccgtgagaagctgcaggagcggctggccaagctggccggtggtgtcgcggtgatcaaggccggtgccgccaccgaggtcgaactcaaggagcgcaagcaccgcatcgaggatgcggttcgcaatgccaaggccgccgtcgaggagggcatcgtcgccggtgggggtgtgacgctgttgcaagcggccccgaccctggacgagctgaagctcgaaggcgacgaggcgaccggcgccaacatcgtgaaggtggcgctggaggccccgctgaagcagatcgccttcaactccgggctggagccgggcgtggtggccgagaaggtgcgcaacctgccggctggccacggactgaacgctcagaccggtgtctacgaggatctgctcgctgccggcgttgctgacccggtcaaggtgacccgttcggcgctgcagaatgcggcgtccatcgcggggctgttcctgaccaccgaggccgtcgttgccgacaagccggaaaaggagaaggcttccgttcccggtggcggcgacatgggtggcatggatttctga
SEQ ID NO: 50
atggctgaaaactcgaacattgatgacatcaaggctccgttgcttgccgcgcttggagcggccgacctggccttggccactgtcaacgagttgatcacgaacctgcgtgagcgtgcggaggagactcgtacggacacccgcagccgggtcgaggagagccgtgctcgcctgaccaagctgcaggaagatctgcccgagcagctcaccgagctgcgtgagaagttcaccgccgaggagctgcgtaaggccgccgagggctacctcgaggccgcgactagccggtacaacgagctggtcgagcgcggtgaggccgctctagagcggctgcgcagccagcagagcttcgaggaagtgtcggcgcgcgccgaaggctacgtggaccaggcggtggagttgacccaggaggcgttgggtacggtcgcatcgcagacccgcgcggtcggtgagcgtgccgccaagctggtcggcatcgagctgcctaagaaggctgctccggccaagaaggccgctccggccaagaaggccgctccggccaagaaggcggcggccaagaaggcgcccgcgaagaaggcggcggccaagaaggtcacccagaagtag
SEQ ID NO: 51
gtgacgcaaaccggcaagcgtcagagacgcaaattcggtcgcatccgacagttcaactccggccgctggcaagccagctacaccggccccgacggccgcgtgtacatcgcccccaaaaccttcaacgccaagatcgacgccgaagcatggctcaccgaccgccgccgcgaaatcgaccgacaactatggtccccggcatcgggtcaggaagaccgccccggagccccattcggtgagtacgccgaaggatggctgaagcagcgtggaatcaaggaccgcacccgcgcccactatcgcaaactgctggacaaccacatcctggccaccttcgctgacaccgacctacgcgacatcaccccggccgccgtgcgccgctggtacgccaccaccgccgtgggcacaccgaccatgcgggcacactcctacagcttgctgcgcgcaatcatgcagaccgccttggccgacgacctgatcgactccaacccctgccgcatctcaggcgcgtccaccgcccgccgcgtccacaagatcaggcccgccaccctcgacgagctggaaaccatcaccaaagccatgcccgacccctaccaggcgttcgtgctgatggcggcatggctggccatgcgctacggcgagctgaccgaattacgccgcaaagacatcgacctgcacggcgaggttgcgcgggtgcggcgggctgtcgttcgggtgggcgaaggcttcaaggtgacgacaccgaaaagcgatgcgggagtgcgcgacataagtatcccgccacatctgatacccgccatcgaagaccaccttcacaaacacgtcaaccccggccgggagtccctgctgttcccatcggtcaacgaccccaaccgtcacctagcaccctcggcgctgtaccgcatgttctacaaggcccgaaaagccgccggccgaccagacttacgggtgcacgaccttcgacactccggcgccgtgttggctgcatccaccggcgccacactggccgaactgatgcagcggctaggacacagcacagccggcgccgcactccgctaccagcacgccgccaagggccgggaccgcgaaatcgccgcactgttaagcaaactggccgagaaccaggagatgtga
SEQ ID NO: 52
gtgatagcgggcgtcgaccaggcgcttgcagcaacaggccaggctagccagcgggcggcaggcgcatctggtggggtcaccgtcggtgtcggcgtgggcacggaacagaggaacctttcggtggttgcaccgagtcagttcacatttagttcacgcagcccagattttgtggatgaaaccgcaggtcaatcgtggtgcgcgatactgggattgaaccagtttcactag
SEQ ID NO: 53
atggccaccacccttcccgttcagcgccacccgcggtccctcttccccgagttttctgagctgttcgcggccttcccgtcattcgccggactccggcccaccttcgacacccggttgatgcggctggaagacgagatgaaagaggggcgctacgaggtacgcgcggagcttcccggggtcgaccccgacaaggacgtcgacattatggtccgcgatggtcagctgaccatcaaggccgagcgcaccgagcagaaggacttcgacggtcgctcggaattcgcgtacggttccttcgttcgcacggtgtcgctgccggtaggtgctgacgaggacgacattaaggccacctacgacaagggcattcttactgtgtcggtggcggtttcggaagggaagccaaccgaaaagcacattcagatccggtccaccaactga
SEQ ID NO: 54
atgagtggacgccaccgtaagcccaccacatccaacgtcagcgtcgccaagatcgcctttaccggcgcagtactcggtggcggcggcatcgccatggccgctcaggcgaccgcggccaccgacggggaatgggatcaggtggcccgctgcgagtcgggcggcaactggtcgatcaacaccggcaacggttacctcggtggcttgcagttcactcaaagcacctgggccgcacatggtggcggcgagttcgccccgtcggctcagctggccagccgggagcagcagattgccgtcggtgagcgggtgctggccacccagggtcgcggcgcctggccggtgtgcggccgcgggttatcgaacgcaacaccccgcgaagtgcttcccgcttcggcagcgatggacgctccgttggacgcggccgcggtcaacggcgaaccagcaccgctggccccgccgcccgccgacccggcgccacccgtggaacttgccgctaacgacctgcccgcaccgctgggtgaacccctcccggcagctcccgccgacccggcaccacccgccgacctggcaccacccgcgcccgccgacgtcgcgccacccgtggaacttgccgtaaacgacctgcccgcaccgctgggtgaacccctcccggcagctcccgccgacccggcaccacccgccgacctggcaccacccgcgcccgccgacctggcgccacccgcgcccgccgacctggcgccacccgcgcccgccgacctggcaccacccgtggaacttgccgtaaacgacctgcccgcgccgctgggtgaacccctcccggcagctcccgccgaactggcgccacccgccgatctggcacccgcgtccgccgacctggcgccacccgcgcccgccgacctggcgccacccgcgcccgccgaactggcgccacccgcgcccgccgacctggcaccacccgctgcggtgaacgagcaaaccgcgccgggcgatcagcccgccacagctccaggcggcccggttggccttgccaccgatttggaactccccgagcccgacccccaaccagctgacgcaccgccgcccggcgacgtcaccgaggcgcccgccgaaacgccccaagtctcgaacatcgcctatacgaagaagctgtggcaggcgattcgggcccaggacgtctgcggcaacgatgcgctggactcgctcgcacagccgtacgtcatcggctga
SEQ ID NO: 55
atgttgcgcctggtagtcggtgcgctgctgctggtgttggcgttcgccggtggctatgcggtcgccgcatgcaaaacggtgacgttgaccgtcgacggaaccgcgatgcgggtgaccacgatgaaatcgcgggtgatcgacatcgtcgaagagaacgggttctcagtcgacgaccgcgacgacctgtatcccgcggccggcgtgcaggtccatgacgccgacaccatcgtgctgcggcgtagccgtccgctgcagatctcgctggatggtcacgacgctaagcaggtgtggacgaccgcgtcgacggtggacgaggcgctggcccaactcgcgatgaccgacacggcgccggccgcggcttctcgcgccagccgcgtcccgctgtccgggatggcgctaccggtcgtcagcgccaagacggtgcagctcaacgacggcgggttggtgcgcacggtgcacttgccggcccccaatgtcgcggggctgctgagtgcggccggcgtgccgctgttgcaaagcgaccacgtggtgcccgccgcgacggccccgatcgtcgaaggcatgcagatccaggtgacccgcaatcggatcaagaaggtcaccgagcggctgccgctgccgccgaacgcgcgtcgtgtcgaggacccggagatgaacatgagccgggaggtcgtcgaagacccgggggttccggggacccaggatgtgacgttcgcggtagctgaggtcaacggcgtcgagaccggccgtttgcccgtcgccaacgtcgtggtgaccccggcccacgaagccgtggtgcgggtgggcaccaagcccggtaccgaggtgcccccggtgatcgacggaagcatctgggacgcgatcgccggctgtgaggccggtggcaactgggcgatcaacaccggcaacgggtattacggtggtgtgcagtttgaccagggcacctgggaggccaacggcgggctgcggtatgcaccccgcgctgacctcgccacccgcgaagagcagatcgccgttgccgaggtgacccgactgcgtcaaggttggggcgcctggccggtatgtgctgcacgagcgggtgcgcgctga
SEQ ID NO: 56
gtgcatcctttgccggccgaccacggccggtcgcggtgcaatagacacccgatctcaccactctctctaatcggtaacgcttcggccacttccggcgatatgtcgagcatgacaagaatcgccaagccgctcatcaagtccgccatggccgcaggactcgtcacggcatccatgtcgctctccaccgccgttgcccacgccggtcccagcccgaactgggacgccgtcgcgcagtgcgaatccgggggcaactgggcggccaacaccggaaacggcaaatacggcggactgcagttcaagccggccacctgggccgcattcggcggtgtcggcaacccagcagctgcctctcgggaacaacaaatcgcagttgccaatcgggttctcgccgaacagggattggacgcgtggccgacgtgcggcgccgcctctggccttccgatcgcactgtggtcgaaacccgcgcagggcatcaagcaaatcatcaacgagatcatttgggcaggcattcaggcaagtattccgcgctga
SEQ ID NO: 57
atgacaccgggtttgcttactactgcgggtgctggccgaccacgtgacaggtgcgccaggatcgtatgcacggtgttcatcgaaaccgccgttgtcgcgaccatgtttgtcgcgttgttgggtctgtccaccatcagctcgaaagccgacgacatcgattgggacgccatcgcgcaatgcgaatccggcggcaattgggcggccaacaccggtaacgggttatacggtggtctgcagatcagccaggcgacgtgggattccaacggtggtgtcgggtcgccggcggccgcgagtccccagcaacagatcgaggtcgcagacaacattatgaaaacccaaggcccgggtgcgtggccgaaatgtagttcttgtagtcagggagacgcaccgctgggctcgctcacccacatcctgacgttcctcgcggccgagactggaggttgttcggggagcagggacgattga
SEQ ID NO: 58
ttgaagaacgcccgtacgacgctcatcgccgccgcgattgccgggacgttggtgaccacgtcaccagccggtatcgccaatgccgacgacgcgggcttggacccaaacgccgcagccggcccggatgccgtgggctttgacccgaacctgccgccggccccggacgctgcacccgtcgatactccgccggctccggaggacgcgggctttgatcccaacctccccccgccgctggccccggacttcctgtccccgcctgcggaggaagcgcctcccgtgcccgtggcctacagcgtgaactgggacgcgatcgcgcagtgcgagtccggtggaaactggtcgatcaacaccggtaacggttactacggcggcctgcggttcaccgccggcacctggcgtgccaacggtggctcggggtccgcggccaacgcgagccgggaggagcagatccgggtggctgagaacgtgctgcgttcgcagggtatccgcgcctggccggtctgcggccgccgcggctga
SEQ ID NO: 59
atgatcgccacaacccgcgatcgtgaaggagccaccatgatcacgtttaggctgcgcttgccgtgccggacgatactgcgggtgttcagccgcaatccgctggtgcgtgggacggatcgactcgaggcggtcgtcatgctgctggccgtcacggtctcgctgctgactatcccgttcgccgccgcggccggcaccgcagtccaggattcccgcagccacgtctatgcccaccaggcccagacccgccatcccgcaaccgcgaccgtgatcgatcacgagggggtgatcgacagcaacacgaccgccacgtcagcgccgccgcgcacgaagatcaccgtgcctgcccgatgggtcgtgaacggaatagaacgcagcggtgaggtcaacgcgaagccgggaaccaaatccggtgaccgcgtcggcatttgggtcgacagtgccggtcagctggtcgatgaaccagctccgccggcccgtgccattgcggatgcggccctggccgccttgggactctggttgagcgtcgccgcggttgcgggcgccctgctggcgctcactcgggcgattctgatccgcgttcgcaacgccagttggcaacacgacatcgacagcctgttctgcacgcagcggtga
SEQ ID NO: 60
atgacggagccagcggcgtgggacgaaggcaagccgcgaatcatcactttgaccatgaaccccgccttggacatcacgacgagcgtcgacgtggtgcgcccgaccgagaaaatgcgttgtggcgcacctcgctacgatcccggcggcggcggtatcaatgtcgcccgcattgtgcatgtcctcggcggttgctcgacagcactgttcccggccggcgggtcgaccgggagcctgctgatggcgctgctcggtgatgcgggagtgccatttcgcgtcattccgatcgcggcctcgacgcgggagagcttcacggtcaacgagtccaggaccgccaagcagtatcgtttcgtgcttccggggccgtcgctgaccgtcgcggagcaggagcaatgcctcgacgaactgcgcggtgcggcggcttcggccgcctttgtggtggccagtggcagcctgccgccaggtgtggctgccgactactatcagcgggttgccgacatctgccgccgatcgagcactccgctgatcctggatacatctggtggcgggttgcagcacatttcgtccggggtgtttcttctcaaggcgagcgtgcgggaactgcgcgagtgcgtcggatccgaactgctgaccgagcccgaacaactggccgccgcacacgaactcattgaccgtgggcgcgccgaggtcgtggtggtctcgcttggatctcagggcgcgctattggccacacgacatgcgagccatcgattttcgtcgattccgatgaccgcggttagcggtgtcggcgccggcgacgcgatggtggccgcgattaccgtgggcctcagccgtggctggtcgctcatcaagtccgttcgcttgggaaacgcggcaggtgcagccatgctgctgacgccaggcaccgcggcctgcaatcgcgacgatgtggagaggttcttcgagctggcggccgaacccaccgaagtcgggcaggatcaatacgtttggcacccgatcgttaacccggaagcctcgccatga
SEQ ID NO: 61
atgccggacaccatggtgaccaccgatgtcatcaagagcgcggtgcagttggcctgccgcgcaccgtcgctccacaacagccagccctggcgctggatagccgaggaccacacggttgcgctgttcctcgacaaggatcgggtgctttacgcgaccgaccactccggccgggaagcgctgctggggtgcggcgccgtactcgaccactttcgggtggcgatggcggccgcgggtaccaccgccaatgtggaacggtttcccaaccccaacgatcctttgcatctggcgtcaattgacttcagcccggccgatttcgtcaccgagggccaccgtctaagggcggatgcgatcctactgcgccgtaccgaccggctgcctttcgccgagccgccggattgggacttggtggagtcgcagttgcgcacgaccgtcaccgccgacacggtgcgcatcgacgtcatcgccgacgatatgcgtcccgaactggcggcggcgtccaaactcaccgaatcgctgcggctctacgattcgtcgtatcatgccgaactcttttggtggacaggggcttttgagacttctgagggcataccgcacagttcattggtatcggcggccgaaagtgaccgggtcaccttcggacgcgacttcccggtcgtcgccaacaccgataggcgcccggagtttggccacgaccgctctaaggtcctggtgctctccacctacgacaacgaacgcgccagcctactgcgctgcggcgagatgctttccgccgtattgcttgacgccaccatggctgggcttgccacctgcacgctgacccacatcaccgaactgcacgccagccgagacctggtcgcagcgctgattgggcagcccgcaactccgcaagccttggttcgcgtcggtctggccccggagatggaagagccgccaccggcaacgcctcggcgaccaatcgatgaagtgtttcacgttcgggctaaggatcaccggtag
SEQ ID NO: 62
atgaccaccgcacgcgacatcatgaacgcaggtgtgacctgtgttggcgaacacgagacgctaaccgctgccgctcaatacatgcgtgagcacgacatcggcgcgttgccgatctgcggggacgacgaccggctgcacggcatgctcaccgaccgcgacattgtgatcaaaggcctggctgcgggcctagacccgaataccgccacggctggcgagttggcccgggacagcatctactacgtcgatgcgaacgcaagcatccaggagatgctcaacgtcatggaagaacatcaggtccgccgtgttccggtcatctcagagcaccgcttggtcggaatcgtcaccgaagccgacatcgcccgacacctgcccgagcacgccattgtgcagttcgtcaaggcaatctgctcgcccatggccctcgccagctag
SEQ ID NO: 63
atggcaagttctgcgagcgacggcacccacgaacgctcggcttttcgcctgagtccaccggtcttgagcggcgccatgggaccgttcatgcacaccggtctgtacgtcgctcaatcgtggcgcgactatctgggtcaacagcccgataaactgccgatcgcacggcccactattgccttagcggcgcaagcctttcgagacgaaatcgtcctgctgggcctcaaggcacgacgtccggtcagcaatcatcgagtgttcgagcgcatcagccaagaagtggccgctggactggagttctatgggaatcgcagatggctggagaagcctagcggattttttgcccagcccccaccgctcaccgaggtcgcggtccgaaaggtcaaggaccgcagacgctccttttatcgcatcttcttcgacagtgggtttacgccgcatccgggtgaaccgggcagccaacggtggctctcatacactgcgaacaatcgcgagtacgccctgttactgcggcacccagagccgcgtccctggctggtttgtgtacacggcaccgagatgggcagggccccgttggatctcgcggtgttccgcgcctggaagctgcatgacgaactcggcctgaacattgtcatgccggttcttccgatgcatggtccccgcgggcaaggtctgccgaagggcgccgtttttcccggagaagatgttctcgacgatgtgcatgggacggctcaagcggtgtgggatatccggcggctgttgtcctggatacgatcgcaggaggaggagtcgctgatcgggttgaacggtctctcgctgggcggctacatcgcgtcattggtcgccagcctcgaagaaggtctcgcctgcgcgattctcggtgtcccagtggctgatctgatcgagttgttgggccgccactgcggtcttcggcacaaagacccccgccgccacaccgtcaagatggccgaaccgatcggccgaatgatctcgccgctctcacttacgccactggtgcccatg
ccgggccgctttatctacgcgggcattgccgaccgactcgtgcatccacgcgaacaggtgactcgcctctgggagcactggggcaaacccgaaatcgtgtggtatccaggcggtcacactggcttcttccagtcgcggccggtacgacggtttgtccaggctgcgctggagcagtcgggcctgttggacgcgccacggacacagcgcgaccgttccgcctaa
SEQ ID NO: 64
atgtccacgcaacgaccgaggcactccggtattcgggctgttggcccctacgcatgggccggccgatgtggtcggataggcaggtggggggtgcaccaggaggcgatgatgaatctagcgatatggcacccgcgcaaggtgcaatccgccaccatctatcaggtgaccgatcgctcgcacgacgggcgcacagcacgggtgcctggtgacgagatcactagcaccgtgtccggttggttgtcggagttgggcacccaaagcccgttggccgatgagcttgcgcgtgcggtgcggatcggcgactggcccgctgcgtacgcaatcggtgagcacctgtccgttgagattgccgttgcggtctaa
SEQ ID NO: 65
LDFATLPPEINSARMYSGAGSAPMLAAASAWHGLSAELRASALSYSSVLSTLTGEEWHGPASASMTAAAAPYVAWMSVTAVRAEQAGAQAEAAAAAYEAAFAATVPPPVIEANRAQLMALIATNVLGQNAPAIAATEAQYAEMWSQDAMAMYGYAGASAAATQLTPFTEPVQTTNASGLAAQSAAIAHATGASAGAQQTTLSQLIAAIPSVLQGLSSSTAATFASGPSGLLGIVGSGSSWLDKLWALLDPNSNFWNTIASSGLFLPSNTIAPFLGLLGGVAAADAAGDVLGEATSGGLGGALVAPLGSAGGLGGTVAAGLGNAATVGTLSVPPSWTAAAPLASPLGSALGGTPMVAPPPAVAAGMPGMPFGTMGGQGFGRAVPQYGFRPNFVARPPAAG
ПРИМЕРЫ - Изобретение будет уточнено следующими примерами, которые предназначены только для иллюстрации изобретения и никак не ограничивают его.
Пример 1 - Субъединичные вакцины, содержащие полипептиды по изобретению
Для получения субъединичных вакцин, включающих полипептиды, сначала необходимо получить источник полипептида для получения вакцины. Это может быть достигнуто путем очистки интересующих белков из культуры ТБ, или путем клонирования интересующего гена и получения рекомбинантного белка. Кодирующие последовательности для интересующих генов амплифицируют посредством ПЦР с сайтами рестрикции, вставленными на N конце и C конце, для возможности клонирования в рамке в векторе экспрессии белка, таком как pET-15b. Гены вставляют после индуцибельного промотора, такого как lacZ. Затем вектор трансформируют в E. сoli, которую выращивают в культуре. Рекомбинантный белок избыточно экспрессируют и очищают. Одним из обычных методов очистки является получение рекомбинантного белка с N-концевой меткой для очистки, например, His-меткой. Затем белок может быть очищен на основании афинности His-метки к ионам металла на колонке Ni-NTA, после чего His-метку отщепляют. Очищенный белок затем вводят животным в подходящем адъюванте.
Пример 2 - Применение БЦЖ в качестве микробного носителя
Интересующую полинуклеотидную последовательность амплифицируют посредством ПЦР. Амплифицированный продукт затем очищают и клонируют в плазмиде (pMV306), которая интегрирует сайт специфически в микобактериальный геном в сайте прикрепления (attB) для микобактериофага L5. БЦЖ трансформируется с плазмидой БЦЖ путем электропорирования, что включает повреждение оболочки клетки электрическими импульсами высокого напряжения, приводя к поглощению ДНК. Плазмида встраивается в хромосому БЦЖ в сайте attB, создавая стабильные рекомбинанты. Рекомбинантов выбирают и проверяют посредством ПЦР или Саузерн блоттинга, чтобы удостовериться, что ген был интегрирован. Рекомбинантный штамм затем используют для исследований защиты.
Пример 3 - Вирусные векторы (например, аттенуированный вирус осповакцины), экспрессирующие микобактериальные гены
Общая схема вирусных векторов, экспрессирующих микобактериальные гены, представлена на Фигуре 4.
Методологии, позволяющие рекомбинацию инородных генов или целевых генов в геном MVA, хорошо известны в области техники [1,2]. Вставка целевого гена(ов) опосредуется переносом ДНК с характеристиками, сходными с таковыми, показанными выше. Перенесенная ДНК может быть в форме плазмиды, которая может быть размножена в бактериальном штамме, оптимизированном для обычных методик клонирования. Целевой ген(ы) вводят в кассету после промотора, такого как mH5, p7.5 или другой. Целевой ген(ы) может включать одну или более из нуклеотидных Seq ID 1-18 и/или их фрагментов. Целевой ген(ы) также может включать дополнительные кофакторы, такие как B7-1 или IL-12, как хорошо описано в области техники [3]. Целевые ген(ы) должны быть расположены после и в рамке с оптимизированной последовательностью Kozak, например, GCCACCATGG. Целевые ген(ы) также могут быть расположены ниже и в рамке с лидерной последовательностью, например, tPA. Целевой ген(ы) могут быть расположены раньше метки в рамке, например, V5, HIS или другого. Перенос кассеты в геном MVA опосредуется гомологичными фланкирующими областями, хорошо известными в области техники, например, Del I - VI.
1. Generation of recombinant vaccinia viruses. (2001) Earl PL et al. Current Protocols in Protein Science
2. Preparation of cell cultures and vaccine virus stocks.
(2001) Earl PL et al. Current Protocols in Protein Science
3. Construction and characterisation of a triple-recombinant vaccine virus encoding B7-1, Interleukin 12 and a model tumor antigen. (1998) Carroll MW et al. Journal of the National Cancer Institute Dec 16, 1998; 90(24): 1881-1887
Пример 4 - Получение векторов экспрессии ДНК
Вакцины ДНК состоят из интересующей последовательности ДНК, клонированной в бактериальной плазмиде. Плазмидный вектор pVAX1 обычно используют в получении ДНК вакцин. Вектор создают для облегчения репликации большого количества копий в E. coli и высокой транзиторной экспрессии интересующего пептида в большинстве клеток млекопитающих (для подробностей см. протокол производителя для pVAX1 (каталожный No. V260-20 www.invitrogen.com).
Вектор содержит следующие элементы:
- человеческий непосредственный-ранний промотор цитомегаловируса (ЦМВ) для высокого уровня экспрессии во множестве клеток млекопитающих
- T7 промотор/сайт примирования для возможности in vitro транскрипции в смысловой ориентации и секвенировании посредством вставки
- сигнал полиаденилирования бычьего гормона роста (BGH) для эффективного терминирования транскрипции и полиаденилирования мРНК
- ген устойчивости к канамицину для селекции в E. coli
- участок множественного клонирования
- pUC источник для репликации большого количества копий и роста в E. coli
- сайт обратного примирования BGH для возможности секвенирования через вставку
Векторы могут быть получены посредством стандартных рекомбинантных методик, которые известны в области техники, например, Sambrook et al. (1989). Ключевыми стадиями в получении вакцины являются следующие:
- интересующий полинуклеотид лигируют в pVAX1 посредством одного из множества сайтов клонирования
- лигированную смесь затем трансформируют в компетентный штамм E. coli (например, TOP10) и LB планшеты, содержащие 50 мкг/мл канамицина, используют для выбора трансформантов.
- Клоны выбирают и секвенируют для подтверждения присутствия и ориентации интересующего гена.
- После подтверждения присутствия гена, вектор может быть использован для трансфекции клеточной линии млекопитающих для проверки экспрессии белка. Методы трансфекции известны в области техники и включают, например, электропорирование, фосфат кальция и липофекцию.
- После подтверждения экспрессии полипептида, большие количества вектора могут быть получены и очищены из соответствующей клетки-хозяина, например, E. coli.
pVAX1 не встраивается в хромосомы хозяина. Все необязательные последовательности были удалены для минимизации возможности интеграции. При создании специфического вектора, лидерная последовательность может быть включена для прямого выбора кодированного белка, при экспрессии внутри клеток эукариот. Другие примеры векторов, которые могут быть использованы, включают V1Jns.tPA и pCMV4. Могут быть использованы векторы экспрессии, которые встраиваются в геном хозяина, однако более часто и более предпочтительно использовать вектор, который не встраивается. Интеграция приводит к образованию генетически модифицированного хозяина, что вызывает другие проблемы.
Пример 5 - Вакцины плазмидной ДНК, несущие микобактериальный полинуклеотиды
Интересующую полинуклеотидную последовательность амплифицировали посредством ПЦР, очищали и вставляли в специализированные векторы, разработанные для получения вакцин, такие как pVAX1. Как указано выше (пример 4), такие векторы содержат промоторные последовательности (например, промоторы ЦМВ или SV40), которые направляют сильную экспрессию внесенного полинуклеотида (кодирующего антиген кандидат) в клетках эукариот; и сигналы полиаденилирования (например, SV40 или бычий гормон роста) для стабилизации транскрипта мРНК. Целевой ген(ы) располагается после и в рамке с оптимизированной последовательностью Kozak, например, GCCACCATGG. Целевой ген(ы) также может быть расположен после и в рамке с лидерной последовательностью, например, tPA. Целевой ген(ы) может быть расположен раньше метки в рамке, например, V5. Вектор трансформируют в E. coli и трансформанты выбирают с использованием маркера, такого как устойчивость к канамицину, кодируемого плазмидой. Затем плазмиду восстанавливают из трансформированных колоний и секвенируют для проверки, что интересующий полинуклеотид присутствует и кодирует точно, без мутаций, образованных ПЦР. Большие количества плазмид затем продуцируют в E. coli и плазмиду восстанавливают и очищают с использованием коммерчески доступных наборов (например, Qiagen Endofree-plasmid preparation). Затем вакцину вводят животным (например, путем внутримышечной инъекции) в присутствии или отсутствие адъюванта.
Пример 6 - РНК вакцина
РНК может быть внесена непосредственно в организм хозяин. Следовательно, векторный конструкт может быть использован для получения РНК in vitro и очищенную РНК затем вводят в организм-хозяин. Затем РНК служит как матрица для трансляции в клетке хозяине. В указанном варианте осуществления изобретения, интеграция обычно не развивается.
Альтернативным вариантом является использование инфекционного агента, такого как ретровирусный геном, несущий РНК, соответствующую интересующему гену. В указанном варианте осуществления изобретения развивается интеграция в геном хозяина. Другим вариантом является применение вакцин репликона РНК, которые могут быть получены из вирусных векторов, таких как вирус Sindbis или вирус Semliki. Такие вакцины являются самореплицирующимися и самоограничивающимися и могут быть введены как или РНК или ДНК, которые затем транскрибируются в РНК репликоны in vivo. Вектор в конечном счете вызывает лизис трансфицированных клеток, посредством чего уменьшая проблемы интеграции в геном хозяина.
Пример 7 - Диагностические анализы на основе оценки Т клеточного ответа
Для диагностического анализа на основании оценки Т клеточных ответов будет достаточно получить образец крови от пациента. Мононуклеарные клетки (моноциты, T и B лимфоциты) могут быть выделены из крови с использованием градиентов плотности, таких как градиенты Фиколл.
И моноциты и B-лимфоциты все способны представлять антиген, хотя менее эффективно, чем профессиональные антиген-представляющие клетки (APC), такие как дендритные клетки. Последние более локализованы в лимфоидной ткани.
Самым простым подходом будет добавить антиген к выделенным мононуклеарным клеткам и инкубировать в течение недели и затем оценить степень пролиферации. Если пациент подвергался воздействию антигена ранее посредством инфицирования, тогда клоны T-клеток, специфичные для антигена, должны быть более преобладающими в образце и должны отвечать. Также возможно выделить различные клеточные популяции, что может быть желательно для контроля соотношения Т клеток к APC. Другим вариантом такого типа анализа является измерение продукции цитокинов посредством отвечающих лимфоцитов, как показателя ответа. Анализ ELISPOT является подходящим примером указанного анализа.
Пример 8 - Определение латентных микобактерий
Присутствие антигена, ассоциированного с латентными микобактериями, может быть определено или путем определения антиген-специфического антитела или путем определения T-клеток в образцах крови.
96-луночный планшет покрывают цитокин-(например, интерфероном-γ, IL-2)-специфическим антителом. Моноциты периферической крови затем выделяют из цельной крови пациента и наносят в ячейки. Антиген добавляют для стимуляции специфических Т клеток, которые могут присутствовать, и планшеты инкубируют в течение 24 ч. Антиген стимулирует T-клетки к продукции цитокинов, которые связываются со специфическим антителом. Планшеты промывают, получая отпечатки, где присутствуют антиген-специфические Т клетки. Второе антитело, связанное с подходящей системой определения, например, ферментом, затем добавляют и подсчитывают количество пятен после добавления соответствующего субстрата. Количество пятен, каждое соответствующее отдельной антиген-специфической Т клетке, связано с общим количеством исходно добавленных клеток. Вышеописанный анализ также может быть использован для различия ТБ инфицированных лиц от лиц, вакцинированных БЦЖ.
Пример 9 - Антигенная активность
Мышей иммунизировали микобактериальным антигеном. Системы доставки включают, но не ограничены ДНК вакцинами, рекомбинантными MVA, адъювантным белком. Пути доставки включают, без ограничения, подкожный, внутрикожный, внутримышечный или аэрозольное введение. Схема иммунизации иногда включает гетерологичный прайм-бустинг, например, ДНК вакцина с последующей MVA вакциной. Схема иммунизации также может включать несколько доз.
После вакцинации, например, 2 недели спустя, спленоциты удаляли у вакцинированных животных и стимулировали полипептидом, характерным для иммунизирующего антигена. Иммунный ответ измеряли посредством антиген-специфической индукции высвобождения цитокинов, например, IFN-γ, что является свидетельством иммунизации против целевого антигена.
Пример 10 - Демонстрация эффективности вакцины в экспериментальной модели
Эффективность вакцин кандидатов у морских свинок или мышей может быть оценена на основании снижения бактериальной нагрузки M. tuberculosis в легких и/или селезенках через 6-24 недель после аэрозольной нагрузки - см. фиг. 1 и 2.
Микобактериальные антигены доставляли как субъединичные ДНК вакцины или белок в Th1-индуцирующем адъюванте, таком как DDA/MPL, или посредством векторов экспрессии, таких как рекомбинантные вирусы или БЦЖ (см. примеры 1-4). Микобактериальные антигены могут быть доставлены как бустер к исходному праймингу, обеспечиваемому посредством БЦЖ. Могут быть дополнительные буст-иммунизации, обеспечиваемые посредством повторного введения или ДНК, или полипептида или вирусного вектора или (менее часто) рекомбинантной БЦЖ. Группы из шести-восьми животных иммунизировали и затем оставляли в течение 6 недель до провокации. Группе животных положительного контроля вводили подкожно 5×104 колоний-образующих единиц (КОЕ) БЦЖ Danish (1331), и группа животных отрицательного контроля оставалась невакцинированной. Через шесть недель после конечной вакцинации, аэрозоли мелких частиц M. tuberculosis (2 мкм средний диаметр; образующиеся в небулайзере Collison), доставляли непосредственно в глотку животного с использованием аппарата Хендерсона. Через 6 недель после провокации аэрозолем, животных умерщвляли, и легкие и селезенки удаляли для определения КОЕ. Гомогенизированные образцы серийно разводили и сеяли на Middlebrook 7H11 селективный агар и определяли среднее КОЕ для каждой группы лечения. Эффективность вакцины оценивали в отношении уменьшения количества бактерий в легких или селезенках по сравнению с невакцинированной контрольной группой. Уменьшение бактериальной нагрузки тестируемых групп может быть выражено как доля уменьшения, достигнутая только посредством БЦЖ. Защитная эффективность в моделях на животных является показателем способности микобактериального антигена защищать человека и животных от патогенной микобактериальной инфекции.
Пример 11 - Демонстрация эффективности вакцины в экспериментальной модели
Эффективность вакцин кандидатов у морских свинок или мышей может быть оценена на основании снижения бактериальной нагрузки M. tuberculosis в легких и/или селезенках через 6-24 недель после провокации аэрозолем, см. фиг. 3.
Микобактериальные антигены доставляли как субъединичные ДНК вакцины или белок в Th1-индуцирующем адъюванте, таком как DDA/MPL, или посредством векторов экспрессии, таких как рекомбинантные вирусы или БЦЖ (см. примеры 1-4). Микобактериальные антигены могут быть доставлены как бустер к исходному прайму, обеспеченному БЦЖ. Могут быть дополнительные буст-иммунизации, обеспечиваемые путем повторного введения или ДНК, или полипептида или вирусного вектора или (менее часто) рекомбинантной БЦЖ. Группы от шести до восьми животных иммунизировали и затем оставляли на 6 недель до провокации. Группе животных положительного контроля вводили подкожно 5×104 колоний-образующих единиц (КОЕ) БЦЖ Danish (1331), и группа животных отрицательного контроля оставалась невакцинированной. Через шесть недель после конечной вакцинации, аэрозоли мелких частиц M. tuberculosis (2 мкм средний диаметр; полученные в небулайзере Collison), доставляли непосредственно в глотку животного с использованием аппарата Хендерсона. Через 24 недели после провокации аэрозолем животных умерщвляли, и легкие и селезенки удаляли для определения КОЕ. Гомогенизированные образцы серийно разводили и сеяли на Middlebrook 7H11 селективный агар, и определяли среднее КОЕ для каждой группы лечения. Эффективность вакцины оценивали в отношении количества бактерий в легких или селезенках по сравнению с невакцинированной контрольной группой. Уменьшение бактериальной нагрузки тестируемых групп может быть выражено как доля уменьшения, достигаемого посредством БЦЖ отдельно, или как дополнительное уменьшение достигаемой бактериальной нагрузки. Защитная эффективность в моделях на животных является показательным способности микобактериального антигена защищать людей и животных от патогенной микобактериальной инфекции.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> ГОСУДАРСТВЕННЫЙ СЕКРЕТАРЬ ЗДРАВООХРАНЕНИЯ
<120> КОМПОЗИЦИЯ МИКОБАКТЕРИАЛЬНОГО АНТИГЕНА
<130> P33528WO
<150> GB 1400819.7
<151> 2014-01-17
<160> 65
<170> PatentIn version 3.5
<210> 1
<211> 1515
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 1
atgtggtggt tccgccgccg agaccgggcg ccgctgcgcg ccaccagctc attatccctg 60
cggtggcggg tcatgctgct ggcgatgtcc atggtcgcga tggtggttgt gctgatgtcg 120
ttcgccgtct atgcggtgat ctcggccgcg ctctacagcg acatcgacaa ccaactgcag 180
agccgggcgc aactgctcat cgccagtggc tcgctggcag ctgatccggg taaggcaatc 240
gagggtaccg cctattcgga tgtcaacgcg atgctggtca accccggcca gtccatctac 300
accgctcaac agccgggcca gacgctgccg gtcggtgctg ccgagaaggc ggtgatccgt 360
ggcgagttgt tcatgtcgcg gcgcaccacc gccgaccaac gggtgcttgc catccgtctg 420
accaacggta gttcgctgct gatctccaaa agtctcaagc ccaccgaagc agtcatgaac 480
aagctgcgtt gggtgctatt gatcgtgggt gggatcgggg tggcggtcgc cgcggtggcc 540
ggggggatgg tcacccgggc cgggctgagg ccggtgggcc gcctcaccga agcggccgag 600
cgggtggcgc gaaccgacga cctgcggccc atccccgtct tcggcagcga cgaattggcc 660
aggctgacag aggcattcaa tttaatgctg cgggcgctgg ccgagtcacg ggaacggcag 720
gcaaggctgg ttaccgacgc cggacatgaa ttgcgtaccc cgctaacgtc gctgcgcacc 780
aatgtcgaac tcttgatggc ctcgatggcc ccgggggctc cgcggctacc caagcaggag 840
atggtcgacc tgcgtgccga tgtgctggct caaatcgagg aattgtccac actggtaggc 900
gatttggtgg acctgtcccg aggcgacgcc ggagaagtgg tgcacgagcc ggtcgacatg 960
gctgacgtcg tcgaccgcag cctggagcgg gtcaggcggc ggcgcaacga tatccttttc 1020
gacgtcgagg tgattgggtg gcaggtttat ggcgataccg ctggattgtc gcggatggcg 1080
cttaacctga tggacaacgc cgcgaagtgg agcccgccgg gcggccacgt gggtgtcagg 1140
ctgagccagc tcgacgcgtc gcacgctgag ctggtggttt ccgaccgcgg cccgggcatt 1200
cccgtgcagg agcgccgtct ggtgtttgaa cggttttacc ggtcggcatc ggcacgggcg 1260
ttgccgggtt cgggcctcgg gttggcgatc gtcaaacagg tggtgctcaa ccacggcgga 1320
ttgctgcgca tcgaagacac cgacccaggc ggccagcccc ctggaacgtc gatttacgtg 1380
ctgctccccg gccgtcggat gccgattccg cagcttcccg gtgcgacggc tggcgctcgg 1440
agcacggaca tcgagaactc tcggggttcg gcgaacgtta tctcagtgga atctcagtcc 1500
acgcgcgcaa cctag 1515
<210> 2
<211> 504
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 2
Met Trp Trp Phe Arg Arg Arg Asp Arg Ala Pro Leu Arg Ala Thr Ser
1 5 10 15
Ser Leu Ser Leu Arg Trp Arg Val Met Leu Leu Ala Met Ser Met Val
20 25 30
Ala Met Val Val Val Leu Met Ser Phe Ala Val Tyr Ala Val Ile Ser
35 40 45
Ala Ala Leu Tyr Ser Asp Ile Asp Asn Gln Leu Gln Ser Arg Ala Gln
50 55 60
Leu Leu Ile Ala Ser Gly Ser Leu Ala Ala Asp Pro Gly Lys Ala Ile
65 70 75 80
Glu Gly Thr Ala Tyr Ser Asp Val Asn Ala Met Leu Val Asn Pro Gly
85 90 95
Gln Ser Ile Tyr Thr Ala Gln Gln Pro Gly Gln Thr Leu Pro Val Gly
100 105 110
Ala Ala Glu Lys Ala Val Ile Arg Gly Glu Leu Phe Met Ser Arg Arg
115 120 125
Thr Thr Ala Asp Gln Arg Val Leu Ala Ile Arg Leu Thr Asn Gly Ser
130 135 140
Ser Leu Leu Ile Ser Lys Ser Leu Lys Pro Thr Glu Ala Val Met Asn
145 150 155 160
Lys Leu Arg Trp Val Leu Leu Ile Val Gly Gly Ile Gly Val Ala Val
165 170 175
Ala Ala Val Ala Gly Gly Met Val Thr Arg Ala Gly Leu Arg Pro Val
180 185 190
Gly Arg Leu Thr Glu Ala Ala Glu Arg Val Ala Arg Thr Asp Asp Leu
195 200 205
Arg Pro Ile Pro Val Phe Gly Ser Asp Glu Leu Ala Arg Leu Thr Glu
210 215 220
Ala Phe Asn Leu Met Leu Arg Ala Leu Ala Glu Ser Arg Glu Arg Gln
225 230 235 240
Ala Arg Leu Val Thr Asp Ala Gly His Glu Leu Arg Thr Pro Leu Thr
245 250 255
Ser Leu Arg Thr Asn Val Glu Leu Leu Met Ala Ser Met Ala Pro Gly
260 265 270
Ala Pro Arg Leu Pro Lys Gln Glu Met Val Asp Leu Arg Ala Asp Val
275 280 285
Leu Ala Gln Ile Glu Glu Leu Ser Thr Leu Val Gly Asp Leu Val Asp
290 295 300
Leu Ser Arg Gly Asp Ala Gly Glu Val Val His Glu Pro Val Asp Met
305 310 315 320
Ala Asp Val Val Asp Arg Ser Leu Glu Arg Val Arg Arg Arg Arg Asn
325 330 335
Asp Ile Leu Phe Asp Val Glu Val Ile Gly Trp Gln Val Tyr Gly Asp
340 345 350
Thr Ala Gly Leu Ser Arg Met Ala Leu Asn Leu Met Asp Asn Ala Ala
355 360 365
Lys Trp Ser Pro Pro Gly Gly His Val Gly Val Arg Leu Ser Gln Leu
370 375 380
Asp Ala Ser His Ala Glu Leu Val Val Ser Asp Arg Gly Pro Gly Ile
385 390 395 400
Pro Val Gln Glu Arg Arg Leu Val Phe Glu Arg Phe Tyr Arg Ser Ala
405 410 415
Ser Ala Arg Ala Leu Pro Gly Ser Gly Leu Gly Leu Ala Ile Val Lys
420 425 430
Gln Val Val Leu Asn His Gly Gly Leu Leu Arg Ile Glu Asp Thr Asp
435 440 445
Pro Gly Gly Gln Pro Pro Gly Thr Ser Ile Tyr Val Leu Leu Pro Gly
450 455 460
Arg Arg Met Pro Ile Pro Gln Leu Pro Gly Ala Thr Ala Gly Ala Arg
465 470 475 480
Ser Thr Asp Ile Glu Asn Ser Arg Gly Ser Ala Asn Val Ile Ser Val
485 490 495
Glu Ser Gln Ser Thr Arg Ala Thr
500
<210> 3
<211> 1194
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 3
atgacggctc cgggactgac agcagccgtc gaggggatcg cacacaacaa gggcgagctg 60
ttcgcctcct ttgacgtgga cgcgttcgag gttccgcacg gccgcgacga gatctggcgg 120
ttcaccccgt tgcggcggct gcgtggcctg cacgacggct ccgcgcgggc caccggtagc 180
gccacgatca cggtcagcga gcggccgggc gtatacaccc agaccgtgcg ccgcggcgat 240
ccacgactgg gcgagggcgg cgtacccacc gaccgcgttg ccgcccaagc gttttcgtcg 300
ttcaactccg cgactctggt caccgtcgag cgcgacaccc aggtcgtcga gccggtaggc 360
atcaccgtga ccgggccggg ggagggcgcg gtggcctatg ggcacctgca ggtgcgtatc 420
gaggagcttg gcgaggcggt cgtggtcatc gaccaccggg gcggcggaac ctacgccgac 480
aacgtcgagt tcgttgtcga cgacgccgct cggctgaccg ccgtgtggat cgccgactgg 540
gccgacaaca ccgttcacct cagcgcgcac catgctcgga tcggcaagga cgcggtgctg 600
cgccacgtca ccgtcatgtt gggcggcgac gtggtgcgaa tgtcggcggg cgtgcggttc 660
tgcggtgcgg gtggggacgc ggaactgctg gggctgtatt tcgccgacga cggccagcac 720
ctggagtcgc ggctgctggt ggaccacgcc caccccgact gcaagtcgaa cgtgctgtat 780
aagggtgcac tgcaaggtga tccggcgtcg tcgttgcccg acgcacacac ggtctgggtg 840
ggtgacgtgc tgatccgtgc gcaggccacc ggcaccgaca ccttcgaggt gaaccggaac 900
ctggtgctca ccgacggcgc gcgtgccgac tcggtgccca acctggagat cgagaccggc 960
gagatcgtcg gcgccggaca cgccagcgcc accggtcgct tcgacgatga gcaattgttc 1020
tacctgcgtt cgcgcggtat tcccgaagca caggcccgcc ggctggtggt ccgcggcttc 1080
ttcggtgaga tcatcgccaa gatcgcggtg cccgaggtac gcgagcgcct gaccgcagcc 1140
atcgaacacg agctggaaat cacggaatca acggaaaaga caacagtctc atga 1194
<210> 4
<211> 397
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 4
Met Thr Ala Pro Gly Leu Thr Ala Ala Val Glu Gly Ile Ala His Asn
1 5 10 15
Lys Gly Glu Leu Phe Ala Ser Phe Asp Val Asp Ala Phe Glu Val Pro
20 25 30
His Gly Arg Asp Glu Ile Trp Arg Phe Thr Pro Leu Arg Arg Leu Arg
35 40 45
Gly Leu His Asp Gly Ser Ala Arg Ala Thr Gly Ser Ala Thr Ile Thr
50 55 60
Val Ser Glu Arg Pro Gly Val Tyr Thr Gln Thr Val Arg Arg Gly Asp
65 70 75 80
Pro Arg Leu Gly Glu Gly Gly Val Pro Thr Asp Arg Val Ala Ala Gln
85 90 95
Ala Phe Ser Ser Phe Asn Ser Ala Thr Leu Val Thr Val Glu Arg Asp
100 105 110
Thr Gln Val Val Glu Pro Val Gly Ile Thr Val Thr Gly Pro Gly Glu
115 120 125
Gly Ala Val Ala Tyr Gly His Leu Gln Val Arg Ile Glu Glu Leu Gly
130 135 140
Glu Ala Val Val Val Ile Asp His Arg Gly Gly Gly Thr Tyr Ala Asp
145 150 155 160
Asn Val Glu Phe Val Val Asp Asp Ala Ala Arg Leu Thr Ala Val Trp
165 170 175
Ile Ala Asp Trp Ala Asp Asn Thr Val His Leu Ser Ala His His Ala
180 185 190
Arg Ile Gly Lys Asp Ala Val Leu Arg His Val Thr Val Met Leu Gly
195 200 205
Gly Asp Val Val Arg Met Ser Ala Gly Val Arg Phe Cys Gly Ala Gly
210 215 220
Gly Asp Ala Glu Leu Leu Gly Leu Tyr Phe Ala Asp Asp Gly Gln His
225 230 235 240
Leu Glu Ser Arg Leu Leu Val Asp His Ala His Pro Asp Cys Lys Ser
245 250 255
Asn Val Leu Tyr Lys Gly Ala Leu Gln Gly Asp Pro Ala Ser Ser Leu
260 265 270
Pro Asp Ala His Thr Val Trp Val Gly Asp Val Leu Ile Arg Ala Gln
275 280 285
Ala Thr Gly Thr Asp Thr Phe Glu Val Asn Arg Asn Leu Val Leu Thr
290 295 300
Asp Gly Ala Arg Ala Asp Ser Val Pro Asn Leu Glu Ile Glu Thr Gly
305 310 315 320
Glu Ile Val Gly Ala Gly His Ala Ser Ala Thr Gly Arg Phe Asp Asp
325 330 335
Glu Gln Leu Phe Tyr Leu Arg Ser Arg Gly Ile Pro Glu Ala Gln Ala
340 345 350
Arg Arg Leu Val Val Arg Gly Phe Phe Gly Glu Ile Ile Ala Lys Ile
355 360 365
Ala Val Pro Glu Val Arg Glu Arg Leu Thr Ala Ala Ile Glu His Glu
370 375 380
Leu Glu Ile Thr Glu Ser Thr Glu Lys Thr Thr Val Ser
385 390 395
<210> 5
<211> 2520
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 5
atggcggttc gtcaggtcac cgtcggctat tcggacggca cgcacaagac gatgccggtg 60
cggtgcgacc agacggtcct ggatgccgcc gaggaacacg gcgtggccat cgtcaacgaa 120
tgccaaagcg ggatatgtgg cacctgcgtg gccacctgca ccgccggccg ctaccagatg 180
ggacgcaccg agggactgtc cgatgtcgag cgggcggcgc gaaagatcct cacctgccag 240
acgtttgtta cctccgattg ccggatcgag ctgcagtatc cggtcgacga caacgccgcc 300
ctgctggtca ccggtgacgg tgtggtgacc gcggtcgagt tggtgtcgcc cagcaccgcc 360
atcctgcggg tggacacctc tggcatggcc ggcgcgctga gataccgggc cggccagttc 420
gcccaattgc aggttcccgg taccaacgta tggcgcaact actcctacgc ccatccggcc 480
gacggccgcg gtgagtgcga gttcatcatc aggttgctgc cggacggcgt gatgtcgaat 540
tatcttcgcg accgcgccca gcccggtgac catatcgcgc tgcgctgcag caagggcagc 600
ttttatctgc gcccgatcgt gcgaccggtg atcctggtcg ccggaggaac cggcctgtca 660
gcgatcctgg cgatggccca gagcctggat gccgatgtcg ctcacccggt ctacctgctc 720
tacggggtcg agcgcaccga agacctgtgc aagctcgacg aactcaccga gctgcgccgc 780
cgcgttggcc gcctggaggt gcacgtcgtc gtcgctcgcc cggaccccga ctgggatggg 840
cgcaccgggc tggtcaccga cctgctcgac gagcggatgc tggcgagcgg tgacgccgac 900
gtgtatctgt gcggtccggt cgccatggtc gacgcagccc gaacctggct ggaccacaat 960
ggctttcacc gtgtcgggtt gtactacgag aagttcgtgg ccagcggggc ggcgcgccgc 1020
cgcaccccgg ctcggctgga ttacgcgggc gtggacattg ccgaggtgtg ccgccgcggc 1080
cgcggcaccg cggtggtcat cggcggcagc atcgcgggca tcgcggcggc gaaaatgctc 1140
agcgagacct tcgatcgcgt catcgtgctg gagaaggacg gcccgcaccg tcgccgcgag 1200
ggcaggccgg gcgcggcaca gggttggcac ctgcaccacc tgctgaccgc cgggcagatc 1260
gagctggagc gcatcttccc tggcatcgtc gacgacatgg tgcgcgaggg agcgttcaag 1320
gtcgacatgg ccgcgcagta ccgtatccgg ctgggcggca cctggaagaa gcccggcact 1380
agtgacatcg agatcgtctg cgcgggaagg ccgctgctcg aatggtgtgt gcgccgccgg 1440
ctcgacgacg aaccgcgcat cgacttccgc tacgaatcgg aggtggccga tctcgccttc 1500
gaccgcgcca acaatgccat cgtcggcgtc gccgtggaca atggcgacgc cgacggaggc 1560
gacggtttgc aggtggtgcc cgccgagttc gtcgtggacg cgtcgggcaa gaacacccgc 1620
gtgccggagt tcttggagcg tctcggtgtt ggcgctcccg aggccgagca ggacatcatc 1680
aactgcttct actccacgat gcagcaccgg gttccgccgg agcggcggtg gcaggacaag 1740
gtgatggtga tctgctatgc gtaccgccct ttcgaggata cctacgccgc gcagtactac 1800
accgacagct cccgcaccat cctgtccacc tcactggtgg cctacaactg ctattcgccg 1860
ccgcgtaccg cccgagaatt ccgcgcgttc gccgacctga tgccgtcccc ggtcatcggg 1920
gagaacatcg acgggctgga gccggcatcg cccatctaca atttccgcta tcccaacatg 1980
ctgcggctgc gctacgagaa gaagcgcaac ctgccgcggg ctttgctggc ggtgggcgat 2040
gcctacacca gcgccgaccc ggtgtcgggt ctgggtatga gcctggcgct caaggaagtt 2100
cgggagatgc aggcgctgct ggctaaatac ggcgccggtc accgggatct gccgcgccgg 2160
tactaccggg cgatcgccaa gatggccgac acggcctggt tcgtgatccg cgagcagaac 2220
ctgcgcttcg actggatgaa ggacgtcgac aagaagcgcc cgttctattt cggtgtgctg 2280
acctggtaca tggaccgcgt gctggagctg gtgcatgacg atctcgacgc gtaccgggaa 2340
ttcttggccg tcgtccatct ggtcaagccg ccgtcggcgc tgatgcgacc caggatcgcc 2400
agccgcgtcc tcggcaaatg ggcacgaacc cgattgtcgg gccagaagac gttgattgcc 2460
cgcaactacg aaaatcatcc gataccagcc gaacccgcgg accaacttgt aaacgcttag 2520
<210> 6
<211> 839
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 6
Met Ala Val Arg Gln Val Thr Val Gly Tyr Ser Asp Gly Thr His Lys
1 5 10 15
Thr Met Pro Val Arg Cys Asp Gln Thr Val Leu Asp Ala Ala Glu Glu
20 25 30
His Gly Val Ala Ile Val Asn Glu Cys Gln Ser Gly Ile Cys Gly Thr
35 40 45
Cys Val Ala Thr Cys Thr Ala Gly Arg Tyr Gln Met Gly Arg Thr Glu
50 55 60
Gly Leu Ser Asp Val Glu Arg Ala Ala Arg Lys Ile Leu Thr Cys Gln
65 70 75 80
Thr Phe Val Thr Ser Asp Cys Arg Ile Glu Leu Gln Tyr Pro Val Asp
85 90 95
Asp Asn Ala Ala Leu Leu Val Thr Gly Asp Gly Val Val Thr Ala Val
100 105 110
Glu Leu Val Ser Pro Ser Thr Ala Ile Leu Arg Val Asp Thr Ser Gly
115 120 125
Met Ala Gly Ala Leu Arg Tyr Arg Ala Gly Gln Phe Ala Gln Leu Gln
130 135 140
Val Pro Gly Thr Asn Val Trp Arg Asn Tyr Ser Tyr Ala His Pro Ala
145 150 155 160
Asp Gly Arg Gly Glu Cys Glu Phe Ile Ile Arg Leu Leu Pro Asp Gly
165 170 175
Val Met Ser Asn Tyr Leu Arg Asp Arg Ala Gln Pro Gly Asp His Ile
180 185 190
Ala Leu Arg Cys Ser Lys Gly Ser Phe Tyr Leu Arg Pro Ile Val Arg
195 200 205
Pro Val Ile Leu Val Ala Gly Gly Thr Gly Leu Ser Ala Ile Leu Ala
210 215 220
Met Ala Gln Ser Leu Asp Ala Asp Val Ala His Pro Val Tyr Leu Leu
225 230 235 240
Tyr Gly Val Glu Arg Thr Glu Asp Leu Cys Lys Leu Asp Glu Leu Thr
245 250 255
Glu Leu Arg Arg Arg Val Gly Arg Leu Glu Val His Val Val Val Ala
260 265 270
Arg Pro Asp Pro Asp Trp Asp Gly Arg Thr Gly Leu Val Thr Asp Leu
275 280 285
Leu Asp Glu Arg Met Leu Ala Ser Gly Asp Ala Asp Val Tyr Leu Cys
290 295 300
Gly Pro Val Ala Met Val Asp Ala Ala Arg Thr Trp Leu Asp His Asn
305 310 315 320
Gly Phe His Arg Val Gly Leu Tyr Tyr Glu Lys Phe Val Ala Ser Gly
325 330 335
Ala Ala Arg Arg Arg Thr Pro Ala Arg Leu Asp Tyr Ala Gly Val Asp
340 345 350
Ile Ala Glu Val Cys Arg Arg Gly Arg Gly Thr Ala Val Val Ile Gly
355 360 365
Gly Ser Ile Ala Gly Ile Ala Ala Ala Lys Met Leu Ser Glu Thr Phe
370 375 380
Asp Arg Val Ile Val Leu Glu Lys Asp Gly Pro His Arg Arg Arg Glu
385 390 395 400
Gly Arg Pro Gly Ala Ala Gln Gly Trp His Leu His His Leu Leu Thr
405 410 415
Ala Gly Gln Ile Glu Leu Glu Arg Ile Phe Pro Gly Ile Val Asp Asp
420 425 430
Met Val Arg Glu Gly Ala Phe Lys Val Asp Met Ala Ala Gln Tyr Arg
435 440 445
Ile Arg Leu Gly Gly Thr Trp Lys Lys Pro Gly Thr Ser Asp Ile Glu
450 455 460
Ile Val Cys Ala Gly Arg Pro Leu Leu Glu Trp Cys Val Arg Arg Arg
465 470 475 480
Leu Asp Asp Glu Pro Arg Ile Asp Phe Arg Tyr Glu Ser Glu Val Ala
485 490 495
Asp Leu Ala Phe Asp Arg Ala Asn Asn Ala Ile Val Gly Val Ala Val
500 505 510
Asp Asn Gly Asp Ala Asp Gly Gly Asp Gly Leu Gln Val Val Pro Ala
515 520 525
Glu Phe Val Val Asp Ala Ser Gly Lys Asn Thr Arg Val Pro Glu Phe
530 535 540
Leu Glu Arg Leu Gly Val Gly Ala Pro Glu Ala Glu Gln Asp Ile Ile
545 550 555 560
Asn Cys Phe Tyr Ser Thr Met Gln His Arg Val Pro Pro Glu Arg Arg
565 570 575
Trp Gln Asp Lys Val Met Val Ile Cys Tyr Ala Tyr Arg Pro Phe Glu
580 585 590
Asp Thr Tyr Ala Ala Gln Tyr Tyr Thr Asp Ser Ser Arg Thr Ile Leu
595 600 605
Ser Thr Ser Leu Val Ala Tyr Asn Cys Tyr Ser Pro Pro Arg Thr Ala
610 615 620
Arg Glu Phe Arg Ala Phe Ala Asp Leu Met Pro Ser Pro Val Ile Gly
625 630 635 640
Glu Asn Ile Asp Gly Leu Glu Pro Ala Ser Pro Ile Tyr Asn Phe Arg
645 650 655
Tyr Pro Asn Met Leu Arg Leu Arg Tyr Glu Lys Lys Arg Asn Leu Pro
660 665 670
Arg Ala Leu Leu Ala Val Gly Asp Ala Tyr Thr Ser Ala Asp Pro Val
675 680 685
Ser Gly Leu Gly Met Ser Leu Ala Leu Lys Glu Val Arg Glu Met Gln
690 695 700
Ala Leu Leu Ala Lys Tyr Gly Ala Gly His Arg Asp Leu Pro Arg Arg
705 710 715 720
Tyr Tyr Arg Ala Ile Ala Lys Met Ala Asp Thr Ala Trp Phe Val Ile
725 730 735
Arg Glu Gln Asn Leu Arg Phe Asp Trp Met Lys Asp Val Asp Lys Lys
740 745 750
Arg Pro Phe Tyr Phe Gly Val Leu Thr Trp Tyr Met Asp Arg Val Leu
755 760 765
Glu Leu Val His Asp Asp Leu Asp Ala Tyr Arg Glu Phe Leu Ala Val
770 775 780
Val His Leu Val Lys Pro Pro Ser Ala Leu Met Arg Pro Arg Ile Ala
785 790 795 800
Ser Arg Val Leu Gly Lys Trp Ala Arg Thr Arg Leu Ser Gly Gln Lys
805 810 815
Thr Leu Ile Ala Arg Asn Tyr Glu Asn His Pro Ile Pro Ala Glu Pro
820 825 830
Ala Asp Gln Leu Val Asn Ala
835
<210> 7
<211> 1185
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 7
atgaccacaa cgactacaac gatttctggg gggatattac ccaaggaata ccaagatctt 60
cgggatacgg tggccgattt tgcgcgcacc gtggtcgcgc cggtatcggc caaacacgat 120
gcggaacaca gcttcccata cgaaattgtc gccaagatgg gagagatggg cctgttcggg 180
ctgccgtttc cggaggagta cggcggcatg ggcggcgact acttcgcgct gtcgctggta 240
cttgaggagc tgggcaaggt tgaccaatcg gtagcgatca cgctggaggc cgcggtgggc 300
ctgggtgcga tgccgatcta ccggttcggt accgaggagc agaaacagaa gtggttgccc 360
gacttgacgt ctggccgtgc gctcgccggt tttggtctca ccgagccggg agcgggatcg 420
gacgcgggca gcacccgcac cacggcgcgt ctcgaaggtg acgagtggat catcaacggc 480
tccaagcaat ttatcaccaa ctcgggcacc gacatcacat cgctggtcac cgtcactgcg 540
gttaccggga ccaccggaac cgctgcggat gccaagaaag agatttcgac gatcatcgtg 600
cccagcggca caccgggatt caccgtggaa ccggtctata acaaggtcgg ctggaacgcc 660
tcggacaccc acccactgac atttgccgat gcgcgggtcc cgagggagaa cctgctggga 720
gcccggggga gcggctatgc caacttcttg tccatcctgg acgagggccg gattgcgatt 780
gcagcgctgg ccaccggcgc ggcgcagggc tgtgttgacg agagcgtcaa gtacgccaac 840
cagcgtcagt cgtttggcca gccgatcggc gcttatcagg cgatcggctt caagatcgcg 900
cggatggagg cacgcgccca tgttgcccgc acagcgtact atgatgccgc cgcaaagatg 960
ttggcgggca agcccttcaa gaaggaggcg gcgatcgcga agatgatctc ctcggaggcg 1020
gcgatggaca actcccgcga tgccacccag atacacggcg gatacggctt tatgaacgaa 1080
tatccggtgg cgcgtcatta ccgcgacagc aaggtgctcg agattggtga gggcaccacg 1140
gaagtgcagc tgatgcttat cgcgcgatcg ttgggactgc agtga 1185
<210> 8
<211> 394
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 8
Met Thr Thr Thr Thr Thr Thr Ile Ser Gly Gly Ile Leu Pro Lys Glu
1 5 10 15
Tyr Gln Asp Leu Arg Asp Thr Val Ala Asp Phe Ala Arg Thr Val Val
20 25 30
Ala Pro Val Ser Ala Lys His Asp Ala Glu His Ser Phe Pro Tyr Glu
35 40 45
Ile Val Ala Lys Met Gly Glu Met Gly Leu Phe Gly Leu Pro Phe Pro
50 55 60
Glu Glu Tyr Gly Gly Met Gly Gly Asp Tyr Phe Ala Leu Ser Leu Val
65 70 75 80
Leu Glu Glu Leu Gly Lys Val Asp Gln Ser Val Ala Ile Thr Leu Glu
85 90 95
Ala Ala Val Gly Leu Gly Ala Met Pro Ile Tyr Arg Phe Gly Thr Glu
100 105 110
Glu Gln Lys Gln Lys Trp Leu Pro Asp Leu Thr Ser Gly Arg Ala Leu
115 120 125
Ala Gly Phe Gly Leu Thr Glu Pro Gly Ala Gly Ser Asp Ala Gly Ser
130 135 140
Thr Arg Thr Thr Ala Arg Leu Glu Gly Asp Glu Trp Ile Ile Asn Gly
145 150 155 160
Ser Lys Gln Phe Ile Thr Asn Ser Gly Thr Asp Ile Thr Ser Leu Val
165 170 175
Thr Val Thr Ala Val Thr Gly Thr Thr Gly Thr Ala Ala Asp Ala Lys
180 185 190
Lys Glu Ile Ser Thr Ile Ile Val Pro Ser Gly Thr Pro Gly Phe Thr
195 200 205
Val Glu Pro Val Tyr Asn Lys Val Gly Trp Asn Ala Ser Asp Thr His
210 215 220
Pro Leu Thr Phe Ala Asp Ala Arg Val Pro Arg Glu Asn Leu Leu Gly
225 230 235 240
Ala Arg Gly Ser Gly Tyr Ala Asn Phe Leu Ser Ile Leu Asp Glu Gly
245 250 255
Arg Ile Ala Ile Ala Ala Leu Ala Thr Gly Ala Ala Gln Gly Cys Val
260 265 270
Asp Glu Ser Val Lys Tyr Ala Asn Gln Arg Gln Ser Phe Gly Gln Pro
275 280 285
Ile Gly Ala Tyr Gln Ala Ile Gly Phe Lys Ile Ala Arg Met Glu Ala
290 295 300
Arg Ala His Val Ala Arg Thr Ala Tyr Tyr Asp Ala Ala Ala Lys Met
305 310 315 320
Leu Ala Gly Lys Pro Phe Lys Lys Glu Ala Ala Ile Ala Lys Met Ile
325 330 335
Ser Ser Glu Ala Ala Met Asp Asn Ser Arg Asp Ala Thr Gln Ile His
340 345 350
Gly Gly Tyr Gly Phe Met Asn Glu Tyr Pro Val Ala Arg His Tyr Arg
355 360 365
Asp Ser Lys Val Leu Glu Ile Gly Glu Gly Thr Thr Glu Val Gln Leu
370 375 380
Met Leu Ile Ala Arg Ser Leu Gly Leu Gln
385 390
<210> 9
<211> 747
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 9
atggacaagg tggtggccac cgccgcggag gcggtcgcag acatagccaa cgggtcgtcg 60
cttgcggttg gtggattcgg gctttgcggc atccccgaag cactgatcgc agcgttggtg 120
gatagcggtg tcaccgacct ggaaacagtc tcgaacaact gcggaatcga cggtgttggt 180
ctgggactat tgttgcaaca caagcgaatt cgccggacag tctcctccta cgtgggggag 240
aacaaggagt tcgcccgcca gttcctcgcg ggcgagctcg aggtggaact gaccccgcag 300
ggcacgctgg ccgagcggtt gcgggccgga gggatgggca taccggcctt ctatacaccg 360
gcaggggtcg gtacccaggt cgccgacggc gggttgccgt ggcgctacga cgcctcgggc 420
ggggtggcgg tggtgtcgcc ggccaaggag actcgggagt tcgatggtgt cacctatgtc 480
ctcgagcggg ggatccggac cgacttcgca ctggtgcatg cctggcaggg ggaccggcac 540
ggcaacctga tgtaccgcca cgccgcggcc aacttcaacc cggagtgcgc atccgcaggc 600
aggatcacga tcgccgaggt cgagcacttg gtcgagccgg gtgagatcga ccctgccacc 660
gtacacaccc cgggcgtgtt tgtgcaccgg gtggttcatg tgcccaaccc cgccaagaag 720
atcgagaggg agacggtgcg gcaatga 747
<210> 10
<211> 248
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 10
Met Asp Lys Val Val Ala Thr Ala Ala Glu Ala Val Ala Asp Ile Ala
1 5 10 15
Asn Gly Ser Ser Leu Ala Val Gly Gly Phe Gly Leu Cys Gly Ile Pro
20 25 30
Glu Ala Leu Ile Ala Ala Leu Val Asp Ser Gly Val Thr Asp Leu Glu
35 40 45
Thr Val Ser Asn Asn Cys Gly Ile Asp Gly Val Gly Leu Gly Leu Leu
50 55 60
Leu Gln His Lys Arg Ile Arg Arg Thr Val Ser Ser Tyr Val Gly Glu
65 70 75 80
Asn Lys Glu Phe Ala Arg Gln Phe Leu Ala Gly Glu Leu Glu Val Glu
85 90 95
Leu Thr Pro Gln Gly Thr Leu Ala Glu Arg Leu Arg Ala Gly Gly Met
100 105 110
Gly Ile Pro Ala Phe Tyr Thr Pro Ala Gly Val Gly Thr Gln Val Ala
115 120 125
Asp Gly Gly Leu Pro Trp Arg Tyr Asp Ala Ser Gly Gly Val Ala Val
130 135 140
Val Ser Pro Ala Lys Glu Thr Arg Glu Phe Asp Gly Val Thr Tyr Val
145 150 155 160
Leu Glu Arg Gly Ile Arg Thr Asp Phe Ala Leu Val His Ala Trp Gln
165 170 175
Gly Asp Arg His Gly Asn Leu Met Tyr Arg His Ala Ala Ala Asn Phe
180 185 190
Asn Pro Glu Cys Ala Ser Ala Gly Arg Ile Thr Ile Ala Glu Val Glu
195 200 205
His Leu Val Glu Pro Gly Glu Ile Asp Pro Ala Thr Val His Thr Pro
210 215 220
Gly Val Phe Val His Arg Val Val His Val Pro Asn Pro Ala Lys Lys
225 230 235 240
Ile Glu Arg Glu Thr Val Arg Gln
245
<210> 11
<211> 2157
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 11
atgaccctgg aagtggtatc ggacgcggcc ggacgcatgc gggtcaaagt cgactgggtc 60
cgttgcgatt cccggcgcgc ggtcgcggtc gaagaggccg ttgccaagca gaacggtgtg 120
cgcgtcgtgc acgcctaccc gcgcaccggg tccgtggtcg tgtggtattc acccagacgc 180
gccgaccgcg cggcggtgct ggcggcgatc aagggcgccg cgcacgtcgc cgccgaactg 240
atccccgcgc gtgcgccgca ctcggccgag atccgcaaca ccgacgtgct ccggatggtc 300
atcggcgggg tggcactggc cttgctcggg gtgcgccgct acgtgttcgc gcggccaccg 360
ctgctcggaa ccaccgggcg gacggtggcc accggtgtca ccattttcac cgggtatccg 420
ttcctgcgtg gcgcgctgcg ctcgctgcgc tccggaaagg ccggcaccga tgccctggtc 480
tccgcggcga cggtggcaag cctcatcctg cgcgagaacg tggtcgcact caccgtcctg 540
tggttgctca acatcggtga gtacctgcag gatctgacgc tgcggcggac ccggcgggcc 600
atctcggagc tgctgcgcgg caaccaggac acggcctggg tgcgcctcac cgatccttct 660
gcaggctccg acgcggccac cgaaatccag gtcccgatcg acaccgtgca gatcggtgac 720
gaggtggtgg tccacgagca cgtcgcgata ccggtcgacg gtgaggtggt cgacggcgaa 780
gcgatcgtca atcagtccgc gatcaccggg gaaaacctgc cggtcagcgt cgtggtcgga 840
acgcgcgtgc acgccggttc ggtcgtggtg cgcggacgcg tggtggtgcg cgcccacgcg 900
gtaggcaacc aaaccaccat cggtcgcatc attagcaggg tcgaagaggc tcagctcgac 960
cgggcaccca tccagacggt gggcgagaac ttctcccgcc gcttcgttcc cacctcgttc 1020
atcgtctcgg ccatcgcgtt gctgatcacc ggcgacgtgc ggcgcgcgat gaccatgttg 1080
ttgatcgcat gcccgtgcgc ggtgggactg tccaccccga ccgcgatcag cgcagcgatc 1140
ggcaacggcg cgcgccgtgg catcctgatc aagggcggat cccacctcga gcaggcgggc 1200
cgcgtcgacg ccatcgtgtt cgacaagacc gggacgttga ccgtgggccg ccccgtggtc 1260
accaatatcg ttgccatgca taaagattgg gagcccgagc aagtgctggc ctatgccgcc 1320
agctcggaga tccactcacg tcatccgctg gccgaggcgg tgatccgctc gacggaggaa 1380
cgccgcatca gcatcccacc acacgaggag tgcgaggtgc tggtcggcct gggcatgcgg 1440
acctgggccg acggtcggac cctgctgctg ggcagtccgt cgttgctgcg cgccgaaaaa 1500
gttcgggtgt ccaagaaggc gtcggagtgg gtcgacaagc tgcgccgcca ggcggagacc 1560
ccgctgctgc tcgcggtgga cggcacgctg gtcggcctga tcagcctgcg cgacgaggtg 1620
cgtccggagg cggcccaggt gctgacgaag ctgcgggcca atgggattcg ccggatcgtc 1680
atgctcaccg gcgaccaccc ggagatcgcc caggttgtcg ccgacgaact ggggattgat 1740
gagtggcgcg ccgaggtcat gccggaggac aagctcgcgg cggtgcgcga gctgcaggac 1800
gacggctacg tcgtcgggat ggtcggcgac ggcatcaacg acgccccggc gctggccgcc 1860
gccgatatcg ggatcgccat gggccttgcc ggaaccgacg tcgccgtcga gaccgccgat 1920
gtcgcgctgg ccaacgacga cctgcaccgc ctgctcgacg ttggggacct gggcgagcgg 1980
gcagtggatg taatccggca gaactacggc atgtccatcg ccgtcaacgc ggccgggctg 2040
ctgatcggcg cgggcggtgc gctctcgccg gtgctggcgg cgatcctgca caacgcgtcg 2100
tcggtggcgg tggtggccaa cagttcccgg ttgatccgct accgcctgga ccgctag 2157
<210> 12
<211> 718
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 12
Met Thr Leu Glu Val Val Ser Asp Ala Ala Gly Arg Met Arg Val Lys
1 5 10 15
Val Asp Trp Val Arg Cys Asp Ser Arg Arg Ala Val Ala Val Glu Glu
20 25 30
Ala Val Ala Lys Gln Asn Gly Val Arg Val Val His Ala Tyr Pro Arg
35 40 45
Thr Gly Ser Val Val Val Trp Tyr Ser Pro Arg Arg Ala Asp Arg Ala
50 55 60
Ala Val Leu Ala Ala Ile Lys Gly Ala Ala His Val Ala Ala Glu Leu
65 70 75 80
Ile Pro Ala Arg Ala Pro His Ser Ala Glu Ile Arg Asn Thr Asp Val
85 90 95
Leu Arg Met Val Ile Gly Gly Val Ala Leu Ala Leu Leu Gly Val Arg
100 105 110
Arg Tyr Val Phe Ala Arg Pro Pro Leu Leu Gly Thr Thr Gly Arg Thr
115 120 125
Val Ala Thr Gly Val Thr Ile Phe Thr Gly Tyr Pro Phe Leu Arg Gly
130 135 140
Ala Leu Arg Ser Leu Arg Ser Gly Lys Ala Gly Thr Asp Ala Leu Val
145 150 155 160
Ser Ala Ala Thr Val Ala Ser Leu Ile Leu Arg Glu Asn Val Val Ala
165 170 175
Leu Thr Val Leu Trp Leu Leu Asn Ile Gly Glu Tyr Leu Gln Asp Leu
180 185 190
Thr Leu Arg Arg Thr Arg Arg Ala Ile Ser Glu Leu Leu Arg Gly Asn
195 200 205
Gln Asp Thr Ala Trp Val Arg Leu Thr Asp Pro Ser Ala Gly Ser Asp
210 215 220
Ala Ala Thr Glu Ile Gln Val Pro Ile Asp Thr Val Gln Ile Gly Asp
225 230 235 240
Glu Val Val Val His Glu His Val Ala Ile Pro Val Asp Gly Glu Val
245 250 255
Val Asp Gly Glu Ala Ile Val Asn Gln Ser Ala Ile Thr Gly Glu Asn
260 265 270
Leu Pro Val Ser Val Val Val Gly Thr Arg Val His Ala Gly Ser Val
275 280 285
Val Val Arg Gly Arg Val Val Val Arg Ala His Ala Val Gly Asn Gln
290 295 300
Thr Thr Ile Gly Arg Ile Ile Ser Arg Val Glu Glu Ala Gln Leu Asp
305 310 315 320
Arg Ala Pro Ile Gln Thr Val Gly Glu Asn Phe Ser Arg Arg Phe Val
325 330 335
Pro Thr Ser Phe Ile Val Ser Ala Ile Ala Leu Leu Ile Thr Gly Asp
340 345 350
Val Arg Arg Ala Met Thr Met Leu Leu Ile Ala Cys Pro Cys Ala Val
355 360 365
Gly Leu Ser Thr Pro Thr Ala Ile Ser Ala Ala Ile Gly Asn Gly Ala
370 375 380
Arg Arg Gly Ile Leu Ile Lys Gly Gly Ser His Leu Glu Gln Ala Gly
385 390 395 400
Arg Val Asp Ala Ile Val Phe Asp Lys Thr Gly Thr Leu Thr Val Gly
405 410 415
Arg Pro Val Val Thr Asn Ile Val Ala Met His Lys Asp Trp Glu Pro
420 425 430
Glu Gln Val Leu Ala Tyr Ala Ala Ser Ser Glu Ile His Ser Arg His
435 440 445
Pro Leu Ala Glu Ala Val Ile Arg Ser Thr Glu Glu Arg Arg Ile Ser
450 455 460
Ile Pro Pro His Glu Glu Cys Glu Val Leu Val Gly Leu Gly Met Arg
465 470 475 480
Thr Trp Ala Asp Gly Arg Thr Leu Leu Leu Gly Ser Pro Ser Leu Leu
485 490 495
Arg Ala Glu Lys Val Arg Val Ser Lys Lys Ala Ser Glu Trp Val Asp
500 505 510
Lys Leu Arg Arg Gln Ala Glu Thr Pro Leu Leu Leu Ala Val Asp Gly
515 520 525
Thr Leu Val Gly Leu Ile Ser Leu Arg Asp Glu Val Arg Pro Glu Ala
530 535 540
Ala Gln Val Leu Thr Lys Leu Arg Ala Asn Gly Ile Arg Arg Ile Val
545 550 555 560
Met Leu Thr Gly Asp His Pro Glu Ile Ala Gln Val Val Ala Asp Glu
565 570 575
Leu Gly Ile Asp Glu Trp Arg Ala Glu Val Met Pro Glu Asp Lys Leu
580 585 590
Ala Ala Val Arg Glu Leu Gln Asp Asp Gly Tyr Val Val Gly Met Val
595 600 605
Gly Asp Gly Ile Asn Asp Ala Pro Ala Leu Ala Ala Ala Asp Ile Gly
610 615 620
Ile Ala Met Gly Leu Ala Gly Thr Asp Val Ala Val Glu Thr Ala Asp
625 630 635 640
Val Ala Leu Ala Asn Asp Asp Leu His Arg Leu Leu Asp Val Gly Asp
645 650 655
Leu Gly Glu Arg Ala Val Asp Val Ile Arg Gln Asn Tyr Gly Met Ser
660 665 670
Ile Ala Val Asn Ala Ala Gly Leu Leu Ile Gly Ala Gly Gly Ala Leu
675 680 685
Ser Pro Val Leu Ala Ala Ile Leu His Asn Ala Ser Ser Val Ala Val
690 695 700
Val Ala Asn Ser Ser Arg Leu Ile Arg Tyr Arg Leu Asp Arg
705 710 715
<210> 13
<211> 1692
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 13
atgactgtgc aggagttcga cgtcgtggtg gtcggcagcg gcgccgccgg catggttgct 60
gcgctggtcg ccgctcaccg aggtctctcg acggtagtcg tcgagaaggc cccgcactac 120
ggcggctcca ccgcacgctc gggcggcggc gtctggatcc ccaacaacga ggtcctcaag 180
cgccgcggcg ttcgagatac accggaggcg gcacgcacct atctgcacgg catcgtcggc 240
gaaatcgtcg agccggaacg catcgatgct tacctcgacc gcgggcccga gatgctgtcg 300
ttcgtgctga agcacacgcc gctgaagatg tgctgggtac ccggctactc cgactactac 360
cccgaggctc cgggcggccg cccgggcgga cgttcgatcg agccgaaacc gttcaacgcg 420
cgcaagcttg gtgccgacat ggccgggctg gagcccgcgt atggcaaggt tccgctcaat 480
gtggttgtga tgcagcagga ctacgttcgc ctcaatcagc tcaaacgtca cccccgtggc 540
gtgctgcgca gcatgaaggt cggcgcccgc acgatgtggg cgaaggcaac aggtaagaac 600
ctggtcggca tgggtcgagc cctcattggg ccgttgcgga tcgggttgca gcgcgccgga 660
gtgccggtcg aactcaacac cgccttcacc gatcttttcg tcgaaaatgg cgtcgtgtcc 720
ggggtatacg tccgcgattc ccacgaggcg gaatccgctg agccgcagct gatccgggct 780
cgccgcggcg tgatcctggc ctgtggtggt ttcgagcata acgagcagat gcgaatcaag 840
taccagcggg cacccatcac caccgagtgg accgtgggcg ccagcgccaa taccggtgac 900
ggcattctcg ccgccgaaaa gctcggcgca gcactggatc tgatggatga cgcttggtgg 960
ggcccgacgg taccgctggt cggcaaacca tggttcgcgc tctcggagcg caactctccc 1020
ggttcgatca tcgtcaacat gtcaggcaag cgattcatga acgaatcgat gccatacgtc 1080
gaagcctgtc atcatatgta cggcggcgaa cacggccagg ggcccggacc gggcgagaac 1140
attccggcgt ggctggtgtt cgaccagcga taccgggacc gctacatctt cgcgggacta 1200
caaccagggc aacgcattcc gagcaggtgg ctggattccg gcgtcatcgt ccaggccgat 1260
acccttgcgg agctggccgg caaggccggt ctacccgcgg acgaactcac tgccaccgtc 1320
cagcgtttca acgcattcgc ccggtccggt gtcgacgagg actaccaccg cggggaaagt 1380
gcctacgatc gctactacgg cgacccgagc aacaagccca atccgaacct cggcgaggtc 1440
ggccacccgc cctattatgg cgccaagatg gttccgggcg acctggggac caagggcggt 1500
atccgcaccg atgtcaacgg acgtgctctg cgggacgacg gcagcatcat cgacggcctt 1560
tacgctgcag gcaatgtcag tgccccagtg atgggacaca cctaccccgg tccgggcggc 1620
acgataggcc cggcgatgac gttcgggtac ctggcggcgc tgcacattgc cgatcaggcg 1680
ggaaagcgct ga 1692
<210> 14
<211> 563
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 14
Met Thr Val Gln Glu Phe Asp Val Val Val Val Gly Ser Gly Ala Ala
1 5 10 15
Gly Met Val Ala Ala Leu Val Ala Ala His Arg Gly Leu Ser Thr Val
20 25 30
Val Val Glu Lys Ala Pro His Tyr Gly Gly Ser Thr Ala Arg Ser Gly
35 40 45
Gly Gly Val Trp Ile Pro Asn Asn Glu Val Leu Lys Arg Arg Gly Val
50 55 60
Arg Asp Thr Pro Glu Ala Ala Arg Thr Tyr Leu His Gly Ile Val Gly
65 70 75 80
Glu Ile Val Glu Pro Glu Arg Ile Asp Ala Tyr Leu Asp Arg Gly Pro
85 90 95
Glu Met Leu Ser Phe Val Leu Lys His Thr Pro Leu Lys Met Cys Trp
100 105 110
Val Pro Gly Tyr Ser Asp Tyr Tyr Pro Glu Ala Pro Gly Gly Arg Pro
115 120 125
Gly Gly Arg Ser Ile Glu Pro Lys Pro Phe Asn Ala Arg Lys Leu Gly
130 135 140
Ala Asp Met Ala Gly Leu Glu Pro Ala Tyr Gly Lys Val Pro Leu Asn
145 150 155 160
Val Val Val Met Gln Gln Asp Tyr Val Arg Leu Asn Gln Leu Lys Arg
165 170 175
His Pro Arg Gly Val Leu Arg Ser Met Lys Val Gly Ala Arg Thr Met
180 185 190
Trp Ala Lys Ala Thr Gly Lys Asn Leu Val Gly Met Gly Arg Ala Leu
195 200 205
Ile Gly Pro Leu Arg Ile Gly Leu Gln Arg Ala Gly Val Pro Val Glu
210 215 220
Leu Asn Thr Ala Phe Thr Asp Leu Phe Val Glu Asn Gly Val Val Ser
225 230 235 240
Gly Val Tyr Val Arg Asp Ser His Glu Ala Glu Ser Ala Glu Pro Gln
245 250 255
Leu Ile Arg Ala Arg Arg Gly Val Ile Leu Ala Cys Gly Gly Phe Glu
260 265 270
His Asn Glu Gln Met Arg Ile Lys Tyr Gln Arg Ala Pro Ile Thr Thr
275 280 285
Glu Trp Thr Val Gly Ala Ser Ala Asn Thr Gly Asp Gly Ile Leu Ala
290 295 300
Ala Glu Lys Leu Gly Ala Ala Leu Asp Leu Met Asp Asp Ala Trp Trp
305 310 315 320
Gly Pro Thr Val Pro Leu Val Gly Lys Pro Trp Phe Ala Leu Ser Glu
325 330 335
Arg Asn Ser Pro Gly Ser Ile Ile Val Asn Met Ser Gly Lys Arg Phe
340 345 350
Met Asn Glu Ser Met Pro Tyr Val Glu Ala Cys His His Met Tyr Gly
355 360 365
Gly Glu His Gly Gln Gly Pro Gly Pro Gly Glu Asn Ile Pro Ala Trp
370 375 380
Leu Val Phe Asp Gln Arg Tyr Arg Asp Arg Tyr Ile Phe Ala Gly Leu
385 390 395 400
Gln Pro Gly Gln Arg Ile Pro Ser Arg Trp Leu Asp Ser Gly Val Ile
405 410 415
Val Gln Ala Asp Thr Leu Ala Glu Leu Ala Gly Lys Ala Gly Leu Pro
420 425 430
Ala Asp Glu Leu Thr Ala Thr Val Gln Arg Phe Asn Ala Phe Ala Arg
435 440 445
Ser Gly Val Asp Glu Asp Tyr His Arg Gly Glu Ser Ala Tyr Asp Arg
450 455 460
Tyr Tyr Gly Asp Pro Ser Asn Lys Pro Asn Pro Asn Leu Gly Glu Val
465 470 475 480
Gly His Pro Pro Tyr Tyr Gly Ala Lys Met Val Pro Gly Asp Leu Gly
485 490 495
Thr Lys Gly Gly Ile Arg Thr Asp Val Asn Gly Arg Ala Leu Arg Asp
500 505 510
Asp Gly Ser Ile Ile Asp Gly Leu Tyr Ala Ala Gly Asn Val Ser Ala
515 520 525
Pro Val Met Gly His Thr Tyr Pro Gly Pro Gly Gly Thr Ile Gly Pro
530 535 540
Ala Met Thr Phe Gly Tyr Leu Ala Ala Leu His Ile Ala Asp Gln Ala
545 550 555 560
Gly Lys Arg
<210> 15
<211> 843
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 15
gtgagtccgg cgcccgtgca ggtgatgggg gttctaaacg tcacggacga ctctttctcg 60
gacggcgggt gttatctcga tctcgacgat gcggtgaagc acggtctggc gatggcagcc 120
gcaggtgcgg gcatcgtcga cgtcggtggt gagtcgagcc ggcccggtgc cactcgggtt 180
gacccggcgg tggagacgtc tcgtgtcata cccgtcgtca aagagcttgc agcacaaggc 240
atcaccgtca gcatcgatac catgcgcgcg gatgtcgctc gggcggcgtt gcagaacggt 300
gcccagatgg tcaacgacgt gtcgggtggg cgggccgatc cggcgatggg gccgctgttg 360
gccgaggccg atgtgccgtg ggtgttgatg cactggcggg cggtatcggc cgataccccg 420
catgtgcctg tgcgctacgg caacgtggtg gccgaggtcc gtgccgacct gctggccagc 480
gtcgccgacg cggtggccgc aggcgtcgac ccggcaaggc tggtgctcga tcccgggctt 540
ggattcgcca agacggcgca acataattgg gcgatcttgc atgcccttcc ggaactggtc 600
gcgaccggaa tcccagtgct ggtgggtgct tcgcgcaagc gcttcctcgg tgcgttgttg 660
gccgggcccg acggcgtgat gcggccaacc gatgggcgtg acaccgcgac ggcggtgatt 720
tccgcgctgg ccgcactgca cggggcctgg ggtgtgcggg tgcatgatgt gcgggcctcg 780
gtcgatgcca tcaaggtggt cgaagcgtgg atgggagcgg aaaggataga acgcgatggc 840
tga 843
<210> 16
<211> 280
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 16
Val Ser Pro Ala Pro Val Gln Val Met Gly Val Leu Asn Val Thr Asp
1 5 10 15
Asp Ser Phe Ser Asp Gly Gly Cys Tyr Leu Asp Leu Asp Asp Ala Val
20 25 30
Lys His Gly Leu Ala Met Ala Ala Ala Gly Ala Gly Ile Val Asp Val
35 40 45
Gly Gly Glu Ser Ser Arg Pro Gly Ala Thr Arg Val Asp Pro Ala Val
50 55 60
Glu Thr Ser Arg Val Ile Pro Val Val Lys Glu Leu Ala Ala Gln Gly
65 70 75 80
Ile Thr Val Ser Ile Asp Thr Met Arg Ala Asp Val Ala Arg Ala Ala
85 90 95
Leu Gln Asn Gly Ala Gln Met Val Asn Asp Val Ser Gly Gly Arg Ala
100 105 110
Asp Pro Ala Met Gly Pro Leu Leu Ala Glu Ala Asp Val Pro Trp Val
115 120 125
Leu Met His Trp Arg Ala Val Ser Ala Asp Thr Pro His Val Pro Val
130 135 140
Arg Tyr Gly Asn Val Val Ala Glu Val Arg Ala Asp Leu Leu Ala Ser
145 150 155 160
Val Ala Asp Ala Val Ala Ala Gly Val Asp Pro Ala Arg Leu Val Leu
165 170 175
Asp Pro Gly Leu Gly Phe Ala Lys Thr Ala Gln His Asn Trp Ala Ile
180 185 190
Leu His Ala Leu Pro Glu Leu Val Ala Thr Gly Ile Pro Val Leu Val
195 200 205
Gly Ala Ser Arg Lys Arg Phe Leu Gly Ala Leu Leu Ala Gly Pro Asp
210 215 220
Gly Val Met Arg Pro Thr Asp Gly Arg Asp Thr Ala Thr Ala Val Ile
225 230 235 240
Ser Ala Leu Ala Ala Leu His Gly Ala Trp Gly Val Arg Val His Asp
245 250 255
Val Arg Ala Ser Val Asp Ala Ile Lys Val Val Glu Ala Trp Met Gly
260 265 270
Ala Glu Arg Ile Glu Arg Asp Gly
275 280
<210> 17
<211> 2190
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 17
atgagtatta ccaggccgac gggcagctat gccagacaga tgctggatcc gggcggctgg 60
gtggaagccg atgaagacac tttctatgac cgggcccagg aatatagcca ggttttgcaa 120
agggtcaccg atgtattgga cacctgccgc cagcagaaag gccacgtctt cgaaggcggc 180
ctatggtccg gcggcgccgc caatgctgcc aacggcgccc tgggtgcaaa catcaatcaa 240
ttgatgacgc tgcaggatta tctcgccacg gtgattacct ggcacaggca tattgccggg 300
ttgattgagc aagctaaatc cgatatcggc aataatgtgg atggcgctca acgggagatc 360
gatatcctgg agaatgaccc tagcctggat gctgatgagc gccataccgc catcaattca 420
ttggtcacgg cgacgcatgg ggccaatgtc agtctggtcg ccgagaccgc tgagcgggtg 480
ctggaatcca agaattggaa acctccgaag aacgcactcg aggatttgct tcagcagaag 540
tcgccgccac ccccagacgt gcctaccctg gtcgtgccat ccccgggcac accgggcaca 600
ccgggaaccc cgatcacccc gggaaccccg atcaccccgg gaaccccaat cacacccatc 660
ccgggagcgc cggtaactcc gatcacacca acgcccggca ctcccgtcac gccggtgacc 720
ccgggcaagc cggtcacccc ggtgaccccg gtcaaaccgg gcacaccagg cgagccaacc 780
ccgatcacgc cggtcacccc cccggtcgcc ccggccacac cggcaacccc ggccacgccc 840
gttaccccag ctcccgctcc acacccgcag ccggctccgg caccggcgcc atcgcctggg 900
ccccagccgg ttacaccggc cactcccggt ccgtctggtc cagcaacacc gggcacccca 960
gggggcgagc cggcgccgca cgtcaaaccc gcggcgttgg cggagcaacc tggtgtgccg 1020
ggccagcatg cgggcggggg gacgcagtcg gggcctgccc atgcggacga atccgccgcg 1080
tcggtgacgc cggctgcggc gtccggtgtc ccgggcgcac gggcggcggc cgccgcgccg 1140
agcggtaccg ccgtgggagc gggcgcgcgt tcgagcgtgg gtacggccgc ggcctcgggc 1200
gcggggtcgc atgctgccac tgggcgggcg ccggtggcta cctcggacaa ggcggcggca 1260
ccgagcacgc gggcggcctc ggcgcggacg gcacctcctg cccgcccgcc gtcgaccgat 1320
cacatcgaca aacccgatcg cagcgagtct gcagatgacg gtacgccggt gtcgatgatc 1380
ccggtgtcgg cggctcgggc ggcacgcgac gccgccactg cagctgccag cgcccgccag 1440
cgtggccgcg gtgatgcgct gcggttggcg cgacgcatcg cggcggcgct caacgcgtcc 1500
gacaacaacg cgggcgacta cgggttcttc tggatcaccg cggtgaccac cgacggttcc 1560
atcgtcgtgg ccaacagcta tgggctggcc tacatacccg acgggatgga attgccgaat 1620
aaggtgtact tggccagcgc ggatcacgca atcccggttg acgaaattgc acgctgtgcc 1680
acctacccgg ttttggccgt gcaagcctgg gcggctttcc acgacatgac gctgcgggcg 1740
gtgatcggta ccgcggagca gttggccagt tcggatcccg gtgtggccaa gattgtgctg 1800
gagccagatg acattccgga gagcggcaaa atgacgggcc ggtcgcggct ggaggtcgtc 1860
gacccctcgg cggcggctca gctggccgac actaccgatc agcgtttgct cgacttgttg 1920
ccgccggcgc cggtggatgt caatccaccg ggcgatgagc ggcacatgct gtggttcgag 1980
ctgatgaagc ccatgaccag caccgctacc ggccgcgagg ccgctcatct gcgggcgttc 2040
cgggcctacg ctgcccactc acaggagatt gccctgcacc aagcgcacac tgcgactgac 2100
gcggccgtcc agcgtgtggc cgtcgcggac tggctgtact ggcaatacgt caccgggttg 2160
ctcgaccggg ccctggccgc cgcatgctga 2190
<210> 18
<211> 729
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 18
Met Ser Ile Thr Arg Pro Thr Gly Ser Tyr Ala Arg Gln Met Leu Asp
1 5 10 15
Pro Gly Gly Trp Val Glu Ala Asp Glu Asp Thr Phe Tyr Asp Arg Ala
20 25 30
Gln Glu Tyr Ser Gln Val Leu Gln Arg Val Thr Asp Val Leu Asp Thr
35 40 45
Cys Arg Gln Gln Lys Gly His Val Phe Glu Gly Gly Leu Trp Ser Gly
50 55 60
Gly Ala Ala Asn Ala Ala Asn Gly Ala Leu Gly Ala Asn Ile Asn Gln
65 70 75 80
Leu Met Thr Leu Gln Asp Tyr Leu Ala Thr Val Ile Thr Trp His Arg
85 90 95
His Ile Ala Gly Leu Ile Glu Gln Ala Lys Ser Asp Ile Gly Asn Asn
100 105 110
Val Asp Gly Ala Gln Arg Glu Ile Asp Ile Leu Glu Asn Asp Pro Ser
115 120 125
Leu Asp Ala Asp Glu Arg His Thr Ala Ile Asn Ser Leu Val Thr Ala
130 135 140
Thr His Gly Ala Asn Val Ser Leu Val Ala Glu Thr Ala Glu Arg Val
145 150 155 160
Leu Glu Ser Lys Asn Trp Lys Pro Pro Lys Asn Ala Leu Glu Asp Leu
165 170 175
Leu Gln Gln Lys Ser Pro Pro Pro Pro Asp Val Pro Thr Leu Val Val
180 185 190
Pro Ser Pro Gly Thr Pro Gly Thr Pro Gly Thr Pro Ile Thr Pro Gly
195 200 205
Thr Pro Ile Thr Pro Gly Thr Pro Ile Thr Pro Ile Pro Gly Ala Pro
210 215 220
Val Thr Pro Ile Thr Pro Thr Pro Gly Thr Pro Val Thr Pro Val Thr
225 230 235 240
Pro Gly Lys Pro Val Thr Pro Val Thr Pro Val Lys Pro Gly Thr Pro
245 250 255
Gly Glu Pro Thr Pro Ile Thr Pro Val Thr Pro Pro Val Ala Pro Ala
260 265 270
Thr Pro Ala Thr Pro Ala Thr Pro Val Thr Pro Ala Pro Ala Pro His
275 280 285
Pro Gln Pro Ala Pro Ala Pro Ala Pro Ser Pro Gly Pro Gln Pro Val
290 295 300
Thr Pro Ala Thr Pro Gly Pro Ser Gly Pro Ala Thr Pro Gly Thr Pro
305 310 315 320
Gly Gly Glu Pro Ala Pro His Val Lys Pro Ala Ala Leu Ala Glu Gln
325 330 335
Pro Gly Val Pro Gly Gln His Ala Gly Gly Gly Thr Gln Ser Gly Pro
340 345 350
Ala His Ala Asp Glu Ser Ala Ala Ser Val Thr Pro Ala Ala Ala Ser
355 360 365
Gly Val Pro Gly Ala Arg Ala Ala Ala Ala Ala Pro Ser Gly Thr Ala
370 375 380
Val Gly Ala Gly Ala Arg Ser Ser Val Gly Thr Ala Ala Ala Ser Gly
385 390 395 400
Ala Gly Ser His Ala Ala Thr Gly Arg Ala Pro Val Ala Thr Ser Asp
405 410 415
Lys Ala Ala Ala Pro Ser Thr Arg Ala Ala Ser Ala Arg Thr Ala Pro
420 425 430
Pro Ala Arg Pro Pro Ser Thr Asp His Ile Asp Lys Pro Asp Arg Ser
435 440 445
Glu Ser Ala Asp Asp Gly Thr Pro Val Ser Met Ile Pro Val Ser Ala
450 455 460
Ala Arg Ala Ala Arg Asp Ala Ala Thr Ala Ala Ala Ser Ala Arg Gln
465 470 475 480
Arg Gly Arg Gly Asp Ala Leu Arg Leu Ala Arg Arg Ile Ala Ala Ala
485 490 495
Leu Asn Ala Ser Asp Asn Asn Ala Gly Asp Tyr Gly Phe Phe Trp Ile
500 505 510
Thr Ala Val Thr Thr Asp Gly Ser Ile Val Val Ala Asn Ser Tyr Gly
515 520 525
Leu Ala Tyr Ile Pro Asp Gly Met Glu Leu Pro Asn Lys Val Tyr Leu
530 535 540
Ala Ser Ala Asp His Ala Ile Pro Val Asp Glu Ile Ala Arg Cys Ala
545 550 555 560
Thr Tyr Pro Val Leu Ala Val Gln Ala Trp Ala Ala Phe His Asp Met
565 570 575
Thr Leu Arg Ala Val Ile Gly Thr Ala Glu Gln Leu Ala Ser Ser Asp
580 585 590
Pro Gly Val Ala Lys Ile Val Leu Glu Pro Asp Asp Ile Pro Glu Ser
595 600 605
Gly Lys Met Thr Gly Arg Ser Arg Leu Glu Val Val Asp Pro Ser Ala
610 615 620
Ala Ala Gln Leu Ala Asp Thr Thr Asp Gln Arg Leu Leu Asp Leu Leu
625 630 635 640
Pro Pro Ala Pro Val Asp Val Asn Pro Pro Gly Asp Glu Arg His Met
645 650 655
Leu Trp Phe Glu Leu Met Lys Pro Met Thr Ser Thr Ala Thr Gly Arg
660 665 670
Glu Ala Ala His Leu Arg Ala Phe Arg Ala Tyr Ala Ala His Ser Gln
675 680 685
Glu Ile Ala Leu His Gln Ala His Thr Ala Thr Asp Ala Ala Val Gln
690 695 700
Arg Val Ala Val Ala Asp Trp Leu Tyr Trp Gln Tyr Val Thr Gly Leu
705 710 715 720
Leu Asp Arg Ala Leu Ala Ala Ala Cys
725
<210> 19
<211> 338
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 19
Met Gln Leu Val Asp Arg Val Arg Gly Ala Val Thr Gly Met Ser Arg
1 5 10 15
Arg Leu Val Val Gly Ala Val Gly Ala Ala Leu Val Ser Gly Leu Val
20 25 30
Gly Ala Val Gly Gly Thr Ala Thr Ala Gly Ala Phe Ser Arg Pro Gly
35 40 45
Leu Pro Val Glu Tyr Leu Gln Val Pro Ser Pro Ser Met Gly Arg Asp
50 55 60
Ile Lys Val Gln Phe Gln Ser Gly Gly Ala Asn Ser Pro Ala Leu Tyr
65 70 75 80
Leu Leu Asp Gly Leu Arg Ala Gln Asp Asp Phe Ser Gly Trp Asp Ile
85 90 95
Asn Thr Pro Ala Phe Glu Trp Tyr Asp Gln Ser Gly Leu Ser Val Val
100 105 110
Met Pro Val Gly Gly Gln Ser Ser Phe Tyr Ser Asp Trp Tyr Gln Pro
115 120 125
Ala Cys Gly Lys Ala Gly Cys Gln Thr Tyr Lys Trp Glu Thr Phe Leu
130 135 140
Thr Ser Glu Leu Pro Gly Trp Leu Gln Ala Asn Arg His Val Lys Pro
145 150 155 160
Thr Gly Ser Ala Val Val Gly Leu Ser Met Ala Ala Ser Ser Ala Leu
165 170 175
Thr Leu Ala Ile Tyr His Pro Gln Gln Phe Val Tyr Ala Gly Ala Met
180 185 190
Ser Gly Leu Leu Asp Pro Ser Gln Ala Met Gly Pro Thr Leu Ile Gly
195 200 205
Leu Ala Met Gly Asp Ala Gly Gly Tyr Lys Ala Ser Asp Met Trp Gly
210 215 220
Pro Lys Glu Asp Pro Ala Trp Gln Arg Asn Asp Pro Leu Leu Asn Val
225 230 235 240
Gly Lys Leu Ile Ala Asn Asn Thr Arg Val Trp Val Tyr Cys Gly Asn
245 250 255
Gly Lys Pro Ser Asp Leu Gly Gly Asn Asn Leu Pro Ala Lys Phe Leu
260 265 270
Glu Gly Phe Val Arg Thr Ser Asn Ile Lys Phe Gln Asp Ala Tyr Asn
275 280 285
Ala Gly Gly Gly His Asn Gly Val Phe Asp Phe Pro Asp Ser Gly Thr
290 295 300
His Ser Trp Glu Tyr Trp Gly Ala Gln Leu Asn Ala Met Lys Pro Asp
305 310 315 320
Leu Gln Arg Ala Leu Gly Ala Thr Pro Asn Thr Gly Pro Ala Pro Gln
325 330 335
Gly Ala
<210> 20
<211> 325
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 20
Met Thr Asp Val Ser Arg Lys Ile Arg Ala Trp Gly Arg Arg Leu Met
1 5 10 15
Ile Gly Thr Ala Ala Ala Val Val Leu Pro Gly Leu Val Gly Leu Ala
20 25 30
Gly Gly Ala Ala Thr Ala Gly Ala Phe Ser Arg Pro Gly Leu Pro Val
35 40 45
Glu Tyr Leu Gln Val Pro Ser Pro Ser Met Gly Arg Asp Ile Lys Val
50 55 60
Gln Phe Gln Ser Gly Gly Asn Asn Ser Pro Ala Val Tyr Leu Leu Asp
65 70 75 80
Gly Leu Arg Ala Gln Asp Asp Tyr Asn Gly Trp Asp Ile Asn Thr Pro
85 90 95
Ala Phe Glu Trp Tyr Tyr Gln Ser Gly Leu Ser Ile Val Met Pro Val
100 105 110
Gly Gly Gln Ser Ser Phe Tyr Ser Asp Trp Tyr Ser Pro Ala Cys Gly
115 120 125
Lys Ala Gly Cys Gln Thr Tyr Lys Trp Glu Thr Phe Leu Thr Ser Glu
130 135 140
Leu Pro Gln Trp Leu Ser Ala Asn Arg Ala Val Lys Pro Thr Gly Ser
145 150 155 160
Ala Ala Ile Gly Leu Ser Met Ala Gly Ser Ser Ala Met Ile Leu Ala
165 170 175
Ala Tyr His Pro Gln Gln Phe Ile Tyr Ala Gly Ser Leu Ser Ala Leu
180 185 190
Leu Asp Pro Ser Gln Gly Met Gly Pro Ser Leu Ile Gly Leu Ala Met
195 200 205
Gly Asp Ala Gly Gly Tyr Lys Ala Ala Asp Met Trp Gly Pro Ser Ser
210 215 220
Asp Pro Ala Trp Glu Arg Asn Asp Pro Thr Gln Gln Ile Pro Lys Leu
225 230 235 240
Val Ala Asn Asn Thr Arg Leu Trp Val Tyr Cys Gly Asn Gly Thr Pro
245 250 255
Asn Glu Leu Gly Gly Ala Asn Ile Pro Ala Glu Phe Leu Glu Asn Phe
260 265 270
Val Arg Ser Ser Asn Leu Lys Phe Gln Asp Ala Tyr Asn Ala Ala Gly
275 280 285
Gly His Asn Ala Val Phe Asn Phe Pro Pro Asn Gly Thr His Ser Trp
290 295 300
Glu Tyr Trp Gly Ala Gln Leu Asn Ala Met Lys Gly Asp Leu Gln Ser
305 310 315 320
Ser Leu Gly Ala Gly
325
<210> 21
<211> 95
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 21
Met Thr Glu Gln Gln Trp Asn Phe Ala Gly Ile Glu Ala Ala Ala Ser
1 5 10 15
Ala Ile Gln Gly Asn Val Thr Ser Ile His Ser Leu Leu Asp Glu Gly
20 25 30
Lys Gln Ser Leu Thr Lys Leu Ala Ala Ala Trp Gly Gly Ser Gly Ser
35 40 45
Glu Ala Tyr Gln Gly Val Gln Gln Lys Trp Asp Ala Thr Ala Thr Glu
50 55 60
Leu Asn Asn Ala Leu Gln Asn Leu Ala Arg Thr Ile Ser Glu Ala Gly
65 70 75 80
Gln Ala Met Ala Ser Thr Glu Gly Asn Val Thr Gly Met Phe Ala
85 90 95
<210> 22
<211> 96
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 22
Met Ser Gln Ile Met Tyr Asn Tyr Pro Ala Met Leu Gly His Ala Gly
1 5 10 15
Asp Met Ala Gly Tyr Ala Gly Thr Leu Gln Ser Leu Gly Ala Glu Ile
20 25 30
Ala Val Glu Gln Ala Ala Leu Gln Ser Ala Trp Gln Gly Asp Thr Gly
35 40 45
Ile Thr Tyr Gln Ala Trp Gln Ala Gln Trp Asn Gln Ala Met Glu Asp
50 55 60
Leu Val Arg Ala Tyr His Ala Met Ser Ser Thr His Glu Ala Asn Thr
65 70 75 80
Met Ala Met Met Ala Arg Asp Thr Ala Glu Ala Ala Lys Trp Gly Gly
85 90 95
<210> 23
<211> 355
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 23
Met Ser Asn Ser Arg Arg Arg Ser Leu Arg Trp Ser Trp Leu Leu Ser
1 5 10 15
Val Leu Ala Ala Val Gly Leu Gly Leu Ala Thr Ala Pro Ala Gln Ala
20 25 30
Ala Pro Pro Ala Leu Ser Gln Asp Arg Phe Ala Asp Phe Pro Ala Leu
35 40 45
Pro Leu Asp Pro Ser Ala Met Val Ala Gln Val Gly Pro Gln Val Val
50 55 60
Asn Ile Asn Thr Lys Leu Gly Tyr Asn Asn Ala Val Gly Ala Gly Thr
65 70 75 80
Gly Ile Val Ile Asp Pro Asn Gly Val Val Leu Thr Asn Asn His Val
85 90 95
Ile Ala Gly Ala Thr Asp Ile Asn Ala Phe Ser Val Gly Ser Gly Gln
100 105 110
Thr Tyr Gly Val Asp Val Val Gly Tyr Asp Arg Thr Gln Asp Val Ala
115 120 125
Val Leu Gln Leu Arg Gly Ala Gly Gly Leu Pro Ser Ala Ala Ile Gly
130 135 140
Gly Gly Val Ala Val Gly Glu Pro Val Val Ala Met Gly Asn Ser Gly
145 150 155 160
Gly Gln Gly Gly Thr Pro Arg Ala Val Pro Gly Arg Val Val Ala Leu
165 170 175
Gly Gln Thr Val Gln Ala Ser Asp Ser Leu Thr Gly Ala Glu Glu Thr
180 185 190
Leu Asn Gly Leu Ile Gln Phe Asp Ala Ala Ile Gln Pro Gly Asp Ser
195 200 205
Gly Gly Pro Val Val Asn Gly Leu Gly Gln Val Val Gly Met Asn Thr
210 215 220
Ala Ala Ser Asp Asn Phe Gln Leu Ser Gln Gly Gly Gln Gly Phe Ala
225 230 235 240
Ile Pro Ile Gly Gln Ala Met Ala Ile Ala Gly Gln Ile Arg Ser Gly
245 250 255
Gly Gly Ser Pro Thr Val His Ile Gly Pro Thr Ala Phe Leu Gly Leu
260 265 270
Gly Val Val Asp Asn Asn Gly Asn Gly Ala Arg Val Gln Arg Val Val
275 280 285
Gly Ser Ala Pro Ala Ala Ser Leu Gly Ile Ser Thr Gly Asp Val Ile
290 295 300
Thr Ala Val Asp Gly Ala Pro Ile Asn Ser Ala Thr Ala Met Ala Asp
305 310 315 320
Ala Leu Asn Gly His His Pro Gly Asp Val Ile Ser Val Thr Trp Gln
325 330 335
Thr Lys Ser Gly Gly Thr Arg Thr Gly Asn Val Thr Leu Ala Glu Gly
340 345 350
Pro Pro Ala
355
<210> 24
<211> 391
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 24
Met Val Asp Phe Gly Ala Leu Pro Pro Glu Ile Asn Ser Ala Arg Met
1 5 10 15
Tyr Ala Gly Pro Gly Ser Ala Ser Leu Val Ala Ala Ala Gln Met Trp
20 25 30
Asp Ser Val Ala Ser Asp Leu Phe Ser Ala Ala Ser Ala Phe Gln Ser
35 40 45
Val Val Trp Gly Leu Thr Val Gly Ser Trp Ile Gly Ser Ser Ala Gly
50 55 60
Leu Met Val Ala Ala Ala Ser Pro Tyr Val Ala Trp Met Ser Val Thr
65 70 75 80
Ala Gly Gln Ala Glu Leu Thr Ala Ala Gln Val Arg Val Ala Ala Ala
85 90 95
Ala Tyr Glu Thr Ala Tyr Gly Leu Thr Val Pro Pro Pro Val Ile Ala
100 105 110
Glu Asn Arg Ala Glu Leu Met Ile Leu Ile Ala Thr Asn Leu Leu Gly
115 120 125
Gln Asn Thr Pro Ala Ile Ala Val Asn Glu Ala Glu Tyr Gly Glu Met
130 135 140
Trp Ala Gln Asp Ala Ala Ala Met Phe Gly Tyr Ala Ala Ala Thr Ala
145 150 155 160
Thr Ala Thr Ala Thr Leu Leu Pro Phe Glu Glu Ala Pro Glu Met Thr
165 170 175
Ser Ala Gly Gly Leu Leu Glu Gln Ala Ala Ala Val Glu Glu Ala Ser
180 185 190
Asp Thr Ala Ala Ala Asn Gln Leu Met Asn Asn Val Pro Gln Ala Leu
195 200 205
Gln Gln Leu Ala Gln Pro Thr Gln Gly Thr Thr Pro Ser Ser Lys Leu
210 215 220
Gly Gly Leu Trp Lys Thr Val Ser Pro His Arg Ser Pro Ile Ser Asn
225 230 235 240
Met Val Ser Met Ala Asn Asn His Met Ser Met Thr Asn Ser Gly Val
245 250 255
Ser Met Thr Asn Thr Leu Ser Ser Met Leu Lys Gly Phe Ala Pro Ala
260 265 270
Ala Ala Ala Gln Ala Val Gln Thr Ala Ala Gln Asn Gly Val Arg Ala
275 280 285
Met Ser Ser Leu Gly Ser Ser Leu Gly Ser Ser Gly Leu Gly Gly Gly
290 295 300
Val Ala Ala Asn Leu Gly Arg Ala Ala Ser Val Gly Ser Leu Ser Val
305 310 315 320
Pro Gln Ala Trp Ala Ala Ala Asn Gln Ala Val Thr Pro Ala Ala Arg
325 330 335
Ala Leu Pro Leu Thr Ser Leu Thr Ser Ala Ala Glu Arg Gly Pro Gly
340 345 350
Gln Met Leu Gly Gly Leu Pro Val Gly Gln Met Gly Ala Arg Ala Gly
355 360 365
Gly Gly Leu Ser Gly Val Leu Arg Val Pro Pro Arg Pro Tyr Val Met
370 375 380
Pro His Ser Pro Ala Ala Gly
385 390
<210> 25
<211> 236
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 25
Met Arg Thr Pro Arg Arg His Cys Arg Arg Ile Ala Val Leu Ala Ala
1 5 10 15
Val Ser Ile Ala Ala Thr Val Val Ala Gly Cys Ser Ser Gly Ser Lys
20 25 30
Pro Ser Gly Gly Pro Leu Pro Asp Ala Lys Pro Leu Val Glu Glu Ala
35 40 45
Thr Ala Gln Thr Lys Ala Leu Lys Ser Ala His Met Val Leu Thr Val
50 55 60
Asn Gly Lys Ile Pro Gly Leu Ser Leu Lys Thr Leu Ser Gly Asp Leu
65 70 75 80
Thr Thr Asn Pro Thr Ala Ala Thr Gly Asn Val Lys Leu Thr Leu Gly
85 90 95
Gly Ser Asp Ile Asp Ala Asp Phe Val Val Phe Asp Gly Ile Leu Tyr
100 105 110
Ala Thr Leu Thr Pro Asn Gln Trp Ser Asp Phe Gly Pro Ala Ala Asp
115 120 125
Ile Tyr Asp Pro Ala Gln Val Leu Asn Pro Asp Thr Gly Leu Ala Asn
130 135 140
Val Leu Ala Asn Phe Ala Asp Ala Lys Ala Glu Gly Arg Asp Thr Ile
145 150 155 160
Asn Gly Gln Asn Thr Ile Arg Ile Ser Gly Lys Val Ser Ala Gln Ala
165 170 175
Val Asn Gln Ile Ala Pro Pro Phe Asn Ala Thr Gln Pro Val Pro Ala
180 185 190
Thr Val Trp Ile Gln Glu Thr Gly Asp His Gln Leu Ala Gln Ala Gln
195 200 205
Leu Asp Arg Gly Ser Gly Asn Ser Val Gln Met Thr Leu Ser Lys Trp
210 215 220
Gly Glu Lys Val Gln Val Thr Lys Pro Pro Val Ser
225 230 235
<210> 26
<211> 540
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 26
Met Ala Lys Thr Ile Ala Tyr Asp Glu Glu Ala Arg Arg Gly Leu Glu
1 5 10 15
Arg Gly Leu Asn Ala Leu Ala Asp Ala Val Lys Val Thr Leu Gly Pro
20 25 30
Lys Gly Arg Asn Val Val Leu Glu Lys Lys Trp Gly Ala Pro Thr Ile
35 40 45
Thr Asn Asp Gly Val Ser Ile Ala Lys Glu Ile Glu Leu Glu Asp Pro
50 55 60
Tyr Glu Lys Ile Gly Ala Glu Leu Val Lys Glu Val Ala Lys Lys Thr
65 70 75 80
Asp Asp Val Ala Gly Asp Gly Thr Thr Thr Ala Thr Val Leu Ala Gln
85 90 95
Ala Leu Val Arg Glu Gly Leu Arg Asn Val Ala Ala Gly Ala Asn Pro
100 105 110
Leu Gly Leu Lys Arg Gly Ile Glu Lys Ala Val Glu Lys Val Thr Glu
115 120 125
Thr Leu Leu Lys Gly Ala Lys Glu Val Glu Thr Lys Glu Gln Ile Ala
130 135 140
Ala Thr Ala Ala Ile Ser Ala Gly Asp Gln Ser Ile Gly Asp Leu Ile
145 150 155 160
Ala Glu Ala Met Asp Lys Val Gly Asn Glu Gly Val Ile Thr Val Glu
165 170 175
Glu Ser Asn Thr Phe Gly Leu Gln Leu Glu Leu Thr Glu Gly Met Arg
180 185 190
Phe Asp Lys Gly Tyr Ile Ser Gly Tyr Phe Val Thr Asp Pro Glu Arg
195 200 205
Gln Glu Ala Val Leu Glu Asp Pro Tyr Ile Leu Leu Val Ser Ser Lys
210 215 220
Val Ser Thr Val Lys Asp Leu Leu Pro Leu Leu Glu Lys Val Ile Gly
225 230 235 240
Ala Gly Lys Pro Leu Leu Ile Ile Ala Glu Asp Val Glu Gly Glu Ala
245 250 255
Leu Ser Thr Leu Val Val Asn Lys Ile Arg Gly Thr Phe Lys Ser Val
260 265 270
Ala Val Lys Ala Pro Gly Phe Gly Asp Arg Arg Lys Ala Met Leu Gln
275 280 285
Asp Met Ala Ile Leu Thr Gly Gly Gln Val Ile Ser Glu Glu Val Gly
290 295 300
Leu Thr Leu Glu Asn Ala Asp Leu Ser Leu Leu Gly Lys Ala Arg Lys
305 310 315 320
Val Val Val Thr Lys Asp Glu Thr Thr Ile Val Glu Gly Ala Gly Asp
325 330 335
Thr Asp Ala Ile Ala Gly Arg Val Ala Gln Ile Arg Gln Glu Ile Glu
340 345 350
Asn Ser Asp Ser Asp Tyr Asp Arg Glu Lys Leu Gln Glu Arg Leu Ala
355 360 365
Lys Leu Ala Gly Gly Val Ala Val Ile Lys Ala Gly Ala Ala Thr Glu
370 375 380
Val Glu Leu Lys Glu Arg Lys His Arg Ile Glu Asp Ala Val Arg Asn
385 390 395 400
Ala Lys Ala Ala Val Glu Glu Gly Ile Val Ala Gly Gly Gly Val Thr
405 410 415
Leu Leu Gln Ala Ala Pro Thr Leu Asp Glu Leu Lys Leu Glu Gly Asp
420 425 430
Glu Ala Thr Gly Ala Asn Ile Val Lys Val Ala Leu Glu Ala Pro Leu
435 440 445
Lys Gln Ile Ala Phe Asn Ser Gly Leu Glu Pro Gly Val Val Ala Glu
450 455 460
Lys Val Arg Asn Leu Pro Ala Gly His Gly Leu Asn Ala Gln Thr Gly
465 470 475 480
Val Tyr Glu Asp Leu Leu Ala Ala Gly Val Ala Asp Pro Val Lys Val
485 490 495
Thr Arg Ser Ala Leu Gln Asn Ala Ala Ser Ile Ala Gly Leu Phe Leu
500 505 510
Thr Thr Glu Ala Val Val Ala Asp Lys Pro Glu Lys Glu Lys Ala Ser
515 520 525
Val Pro Gly Gly Gly Asp Met Gly Gly Met Asp Phe
530 535 540
<210> 27
<211> 199
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 27
Met Ala Glu Asn Ser Asn Ile Asp Asp Ile Lys Ala Pro Leu Leu Ala
1 5 10 15
Ala Leu Gly Ala Ala Asp Leu Ala Leu Ala Thr Val Asn Glu Leu Ile
20 25 30
Thr Asn Leu Arg Glu Arg Ala Glu Glu Thr Arg Thr Asp Thr Arg Ser
35 40 45
Arg Val Glu Glu Ser Arg Ala Arg Leu Thr Lys Leu Gln Glu Asp Leu
50 55 60
Pro Glu Gln Leu Thr Glu Leu Arg Glu Lys Phe Thr Ala Glu Glu Leu
65 70 75 80
Arg Lys Ala Ala Glu Gly Tyr Leu Glu Ala Ala Thr Ser Arg Tyr Asn
85 90 95
Glu Leu Val Glu Arg Gly Glu Ala Ala Leu Glu Arg Leu Arg Ser Gln
100 105 110
Gln Ser Phe Glu Glu Val Ser Ala Arg Ala Glu Gly Tyr Val Asp Gln
115 120 125
Ala Val Glu Leu Thr Gln Glu Ala Leu Gly Thr Val Ala Ser Gln Thr
130 135 140
Arg Ala Val Gly Glu Arg Ala Ala Lys Leu Val Gly Ile Glu Leu Pro
145 150 155 160
Lys Lys Ala Ala Pro Ala Lys Lys Ala Ala Pro Ala Lys Lys Ala Ala
165 170 175
Pro Ala Lys Lys Ala Ala Ala Lys Lys Ala Pro Ala Lys Lys Ala Ala
180 185 190
Ala Lys Lys Val Thr Gln Lys
195
<210> 28
<211> 375
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 28
Val Thr Gln Thr Gly Lys Arg Gln Arg Arg Lys Phe Gly Arg Ile Arg
1 5 10 15
Gln Phe Asn Ser Gly Arg Trp Gln Ala Ser Tyr Thr Gly Pro Asp Gly
20 25 30
Arg Val Tyr Ile Ala Pro Lys Thr Phe Asn Ala Lys Ile Asp Ala Glu
35 40 45
Ala Trp Leu Thr Asp Arg Arg Arg Glu Ile Asp Arg Gln Leu Trp Ser
50 55 60
Pro Ala Ser Gly Gln Glu Asp Arg Pro Gly Ala Pro Phe Gly Glu Tyr
65 70 75 80
Ala Glu Gly Trp Leu Lys Gln Arg Gly Ile Lys Asp Arg Thr Arg Ala
85 90 95
His Tyr Arg Lys Leu Leu Asp Asn His Ile Leu Ala Thr Phe Ala Asp
100 105 110
Thr Asp Leu Arg Asp Ile Thr Pro Ala Ala Val Arg Arg Trp Tyr Ala
115 120 125
Thr Thr Ala Val Gly Thr Pro Thr Met Arg Ala His Ser Tyr Ser Leu
130 135 140
Leu Arg Ala Ile Met Gln Thr Ala Leu Ala Asp Asp Leu Ile Asp Ser
145 150 155 160
Asn Pro Cys Arg Ile Ser Gly Ala Ser Thr Ala Arg Arg Val His Lys
165 170 175
Ile Arg Pro Ala Thr Leu Asp Glu Leu Glu Thr Ile Thr Lys Ala Met
180 185 190
Pro Asp Pro Tyr Gln Ala Phe Val Leu Met Ala Ala Trp Leu Ala Met
195 200 205
Arg Tyr Gly Glu Leu Thr Glu Leu Arg Arg Lys Asp Ile Asp Leu His
210 215 220
Gly Glu Val Ala Arg Val Arg Arg Ala Val Val Arg Val Gly Glu Gly
225 230 235 240
Phe Lys Val Thr Thr Pro Lys Ser Asp Ala Gly Val Arg Asp Ile Ser
245 250 255
Ile Pro Pro His Leu Ile Pro Ala Ile Glu Asp His Leu His Lys His
260 265 270
Val Asn Pro Gly Arg Glu Ser Leu Leu Phe Pro Ser Val Asn Asp Pro
275 280 285
Asn Arg His Leu Ala Pro Ser Ala Leu Tyr Arg Met Phe Tyr Lys Ala
290 295 300
Arg Lys Ala Ala Gly Arg Pro Asp Leu Arg Val His Asp Leu Arg His
305 310 315 320
Ser Gly Ala Val Leu Ala Ala Ser Thr Gly Ala Thr Leu Ala Glu Leu
325 330 335
Met Gln Arg Leu Gly His Ser Thr Ala Gly Ala Ala Leu Arg Tyr Gln
340 345 350
His Ala Ala Lys Gly Arg Asp Arg Glu Ile Ala Ala Leu Leu Ser Lys
355 360 365
Leu Ala Glu Asn Gln Glu Met
370 375
<210> 29
<211> 75
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 29
Val Ile Ala Gly Val Asp Gln Ala Leu Ala Ala Thr Gly Gln Ala Ser
1 5 10 15
Gln Arg Ala Ala Gly Ala Ser Gly Gly Val Thr Val Gly Val Gly Val
20 25 30
Gly Thr Glu Gln Arg Asn Leu Ser Val Val Ala Pro Ser Gln Phe Thr
35 40 45
Phe Ser Ser Arg Ser Pro Asp Phe Val Asp Glu Thr Ala Gly Gln Ser
50 55 60
Trp Cys Ala Ile Leu Gly Leu Asn Gln Phe His
65 70 75
<210> 30
<211> 144
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 30
Met Ala Thr Thr Leu Pro Val Gln Arg His Pro Arg Ser Leu Phe Pro
1 5 10 15
Glu Phe Ser Glu Leu Phe Ala Ala Phe Pro Ser Phe Ala Gly Leu Arg
20 25 30
Pro Thr Phe Asp Thr Arg Leu Met Arg Leu Glu Asp Glu Met Lys Glu
35 40 45
Gly Arg Tyr Glu Val Arg Ala Glu Leu Pro Gly Val Asp Pro Asp Lys
50 55 60
Asp Val Asp Ile Met Val Arg Asp Gly Gln Leu Thr Ile Lys Ala Glu
65 70 75 80
Arg Thr Glu Gln Lys Asp Phe Asp Gly Arg Ser Glu Phe Ala Tyr Gly
85 90 95
Ser Phe Val Arg Thr Val Ser Leu Pro Val Gly Ala Asp Glu Asp Asp
100 105 110
Ile Lys Ala Thr Tyr Asp Lys Gly Ile Leu Thr Val Ser Val Ala Val
115 120 125
Ser Glu Gly Lys Pro Thr Glu Lys His Ile Gln Ile Arg Ser Thr Asn
130 135 140
<210> 31
<211> 407
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 31
Met Ser Gly Arg His Arg Lys Pro Thr Thr Ser Asn Val Ser Val Ala
1 5 10 15
Lys Ile Ala Phe Thr Gly Ala Val Leu Gly Gly Gly Gly Ile Ala Met
20 25 30
Ala Ala Gln Ala Thr Ala Ala Thr Asp Gly Glu Trp Asp Gln Val Ala
35 40 45
Arg Cys Glu Ser Gly Gly Asn Trp Ser Ile Asn Thr Gly Asn Gly Tyr
50 55 60
Leu Gly Gly Leu Gln Phe Thr Gln Ser Thr Trp Ala Ala His Gly Gly
65 70 75 80
Gly Glu Phe Ala Pro Ser Ala Gln Leu Ala Ser Arg Glu Gln Gln Ile
85 90 95
Ala Val Gly Glu Arg Val Leu Ala Thr Gln Gly Arg Gly Ala Trp Pro
100 105 110
Val Cys Gly Arg Gly Leu Ser Asn Ala Thr Pro Arg Glu Val Leu Pro
115 120 125
Ala Ser Ala Ala Met Asp Ala Pro Leu Asp Ala Ala Ala Val Asn Gly
130 135 140
Glu Pro Ala Pro Leu Ala Pro Pro Pro Ala Asp Pro Ala Pro Pro Val
145 150 155 160
Glu Leu Ala Ala Asn Asp Leu Pro Ala Pro Leu Gly Glu Pro Leu Pro
165 170 175
Ala Ala Pro Ala Asp Pro Ala Pro Pro Ala Asp Leu Ala Pro Pro Ala
180 185 190
Pro Ala Asp Val Ala Pro Pro Val Glu Leu Ala Val Asn Asp Leu Pro
195 200 205
Ala Pro Leu Gly Glu Pro Leu Pro Ala Ala Pro Ala Asp Pro Ala Pro
210 215 220
Pro Ala Asp Leu Ala Pro Pro Ala Pro Ala Asp Leu Ala Pro Pro Ala
225 230 235 240
Pro Ala Asp Leu Ala Pro Pro Ala Pro Ala Asp Leu Ala Pro Pro Val
245 250 255
Glu Leu Ala Val Asn Asp Leu Pro Ala Pro Leu Gly Glu Pro Leu Pro
260 265 270
Ala Ala Pro Ala Glu Leu Ala Pro Pro Ala Asp Leu Ala Pro Ala Ser
275 280 285
Ala Asp Leu Ala Pro Pro Ala Pro Ala Asp Leu Ala Pro Pro Ala Pro
290 295 300
Ala Glu Leu Ala Pro Pro Ala Pro Ala Asp Leu Ala Pro Pro Ala Ala
305 310 315 320
Val Asn Glu Gln Thr Ala Pro Gly Asp Gln Pro Ala Thr Ala Pro Gly
325 330 335
Gly Pro Val Gly Leu Ala Thr Asp Leu Glu Leu Pro Glu Pro Asp Pro
340 345 350
Gln Pro Ala Asp Ala Pro Pro Pro Gly Asp Val Thr Glu Ala Pro Ala
355 360 365
Glu Thr Pro Gln Val Ser Asn Ile Ala Tyr Thr Lys Lys Leu Trp Gln
370 375 380
Ala Ile Arg Ala Gln Asp Val Cys Gly Asn Asp Ala Leu Asp Ser Leu
385 390 395 400
Ala Gln Pro Tyr Val Ile Gly
405
<210> 32
<211> 362
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 32
Met Leu Arg Leu Val Val Gly Ala Leu Leu Leu Val Leu Ala Phe Ala
1 5 10 15
Gly Gly Tyr Ala Val Ala Ala Cys Lys Thr Val Thr Leu Thr Val Asp
20 25 30
Gly Thr Ala Met Arg Val Thr Thr Met Lys Ser Arg Val Ile Asp Ile
35 40 45
Val Glu Glu Asn Gly Phe Ser Val Asp Asp Arg Asp Asp Leu Tyr Pro
50 55 60
Ala Ala Gly Val Gln Val His Asp Ala Asp Thr Ile Val Leu Arg Arg
65 70 75 80
Ser Arg Pro Leu Gln Ile Ser Leu Asp Gly His Asp Ala Lys Gln Val
85 90 95
Trp Thr Thr Ala Ser Thr Val Asp Glu Ala Leu Ala Gln Leu Ala Met
100 105 110
Thr Asp Thr Ala Pro Ala Ala Ala Ser Arg Ala Ser Arg Val Pro Leu
115 120 125
Ser Gly Met Ala Leu Pro Val Val Ser Ala Lys Thr Val Gln Leu Asn
130 135 140
Asp Gly Gly Leu Val Arg Thr Val His Leu Pro Ala Pro Asn Val Ala
145 150 155 160
Gly Leu Leu Ser Ala Ala Gly Val Pro Leu Leu Gln Ser Asp His Val
165 170 175
Val Pro Ala Ala Thr Ala Pro Ile Val Glu Gly Met Gln Ile Gln Val
180 185 190
Thr Arg Asn Arg Ile Lys Lys Val Thr Glu Arg Leu Pro Leu Pro Pro
195 200 205
Asn Ala Arg Arg Val Glu Asp Pro Glu Met Asn Met Ser Arg Glu Val
210 215 220
Val Glu Asp Pro Gly Val Pro Gly Thr Gln Asp Val Thr Phe Ala Val
225 230 235 240
Ala Glu Val Asn Gly Val Glu Thr Gly Arg Leu Pro Val Ala Asn Val
245 250 255
Val Val Thr Pro Ala His Glu Ala Val Val Arg Val Gly Thr Lys Pro
260 265 270
Gly Thr Glu Val Pro Pro Val Ile Asp Gly Ser Ile Trp Asp Ala Ile
275 280 285
Ala Gly Cys Glu Ala Gly Gly Asn Trp Ala Ile Asn Thr Gly Asn Gly
290 295 300
Tyr Tyr Gly Gly Val Gln Phe Asp Gln Gly Thr Trp Glu Ala Asn Gly
305 310 315 320
Gly Leu Arg Tyr Ala Pro Arg Ala Asp Leu Ala Thr Arg Glu Glu Gln
325 330 335
Ile Ala Val Ala Glu Val Thr Arg Leu Arg Gln Gly Trp Gly Ala Trp
340 345 350
Pro Val Cys Ala Ala Arg Ala Gly Ala Arg
355 360
<210> 33
<211> 176
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 33
Val His Pro Leu Pro Ala Asp His Gly Arg Ser Arg Cys Asn Arg His
1 5 10 15
Pro Ile Ser Pro Leu Ser Leu Ile Gly Asn Ala Ser Ala Thr Ser Gly
20 25 30
Asp Met Ser Ser Met Thr Arg Ile Ala Lys Pro Leu Ile Lys Ser Ala
35 40 45
Met Ala Ala Gly Leu Val Thr Ala Ser Met Ser Leu Ser Thr Ala Val
50 55 60
Ala His Ala Gly Pro Ser Pro Asn Trp Asp Ala Val Ala Gln Cys Glu
65 70 75 80
Ser Gly Gly Asn Trp Ala Ala Asn Thr Gly Asn Gly Lys Tyr Gly Gly
85 90 95
Leu Gln Phe Lys Pro Ala Thr Trp Ala Ala Phe Gly Gly Val Gly Asn
100 105 110
Pro Ala Ala Ala Ser Arg Glu Gln Gln Ile Ala Val Ala Asn Arg Val
115 120 125
Leu Ala Glu Gln Gly Leu Asp Ala Trp Pro Thr Cys Gly Ala Ala Ser
130 135 140
Gly Leu Pro Ile Ala Leu Trp Ser Lys Pro Ala Gln Gly Ile Lys Gln
145 150 155 160
Ile Ile Asn Glu Ile Ile Trp Ala Gly Ile Gln Ala Ser Ile Pro Arg
165 170 175
<210> 34
<211> 154
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 34
Met Thr Pro Gly Leu Leu Thr Thr Ala Gly Ala Gly Arg Pro Arg Asp
1 5 10 15
Arg Cys Ala Arg Ile Val Cys Thr Val Phe Ile Glu Thr Ala Val Val
20 25 30
Ala Thr Met Phe Val Ala Leu Leu Gly Leu Ser Thr Ile Ser Ser Lys
35 40 45
Ala Asp Asp Ile Asp Trp Asp Ala Ile Ala Gln Cys Glu Ser Gly Gly
50 55 60
Asn Trp Ala Ala Asn Thr Gly Asn Gly Leu Tyr Gly Gly Leu Gln Ile
65 70 75 80
Ser Gln Ala Thr Trp Asp Ser Asn Gly Gly Val Gly Ser Pro Ala Ala
85 90 95
Ala Ser Pro Gln Gln Gln Ile Glu Val Ala Asp Asn Ile Met Lys Thr
100 105 110
Gln Gly Pro Gly Ala Trp Pro Lys Cys Ser Ser Cys Ser Gln Gly Asp
115 120 125
Ala Pro Leu Gly Ser Leu Thr His Ile Leu Thr Phe Leu Ala Ala Glu
130 135 140
Thr Gly Gly Cys Ser Gly Ser Arg Asp Asp
145 150
<210> 35
<211> 172
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 35
Leu Lys Asn Ala Arg Thr Thr Leu Ile Ala Ala Ala Ile Ala Gly Thr
1 5 10 15
Leu Val Thr Thr Ser Pro Ala Gly Ile Ala Asn Ala Asp Asp Ala Gly
20 25 30
Leu Asp Pro Asn Ala Ala Ala Gly Pro Asp Ala Val Gly Phe Asp Pro
35 40 45
Asn Leu Pro Pro Ala Pro Asp Ala Ala Pro Val Asp Thr Pro Pro Ala
50 55 60
Pro Glu Asp Ala Gly Phe Asp Pro Asn Leu Pro Pro Pro Leu Ala Pro
65 70 75 80
Asp Phe Leu Ser Pro Pro Ala Glu Glu Ala Pro Pro Val Pro Val Ala
85 90 95
Tyr Ser Val Asn Trp Asp Ala Ile Ala Gln Cys Glu Ser Gly Gly Asn
100 105 110
Trp Ser Ile Asn Thr Gly Asn Gly Tyr Tyr Gly Gly Leu Arg Phe Thr
115 120 125
Ala Gly Thr Trp Arg Ala Asn Gly Gly Ser Gly Ser Ala Ala Asn Ala
130 135 140
Ser Arg Glu Glu Gln Ile Arg Val Ala Glu Asn Val Leu Arg Ser Gln
145 150 155 160
Gly Ile Arg Ala Trp Pro Val Cys Gly Arg Arg Gly
165 170
<210> 36
<211> 210
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 36
Met Ile Ala Thr Thr Arg Asp Arg Glu Gly Ala Thr Met Ile Thr Phe
1 5 10 15
Arg Leu Arg Leu Pro Cys Arg Thr Ile Leu Arg Val Phe Ser Arg Asn
20 25 30
Pro Leu Val Arg Gly Thr Asp Arg Leu Glu Ala Val Val Met Leu Leu
35 40 45
Ala Val Thr Val Ser Leu Leu Thr Ile Pro Phe Ala Ala Ala Ala Gly
50 55 60
Thr Ala Val Gln Asp Ser Arg Ser His Val Tyr Ala His Gln Ala Gln
65 70 75 80
Thr Arg His Pro Ala Thr Ala Thr Val Ile Asp His Glu Gly Val Ile
85 90 95
Asp Ser Asn Thr Thr Ala Thr Ser Ala Pro Pro Arg Thr Lys Ile Thr
100 105 110
Val Pro Ala Arg Trp Val Val Asn Gly Ile Glu Arg Ser Gly Glu Val
115 120 125
Asn Ala Lys Pro Gly Thr Lys Ser Gly Asp Arg Val Gly Ile Trp Val
130 135 140
Asp Ser Ala Gly Gln Leu Val Asp Glu Pro Ala Pro Pro Ala Arg Ala
145 150 155 160
Ile Ala Asp Ala Ala Leu Ala Ala Leu Gly Leu Trp Leu Ser Val Ala
165 170 175
Ala Val Ala Gly Ala Leu Leu Ala Leu Thr Arg Ala Ile Leu Ile Arg
180 185 190
Val Arg Asn Ala Ser Trp Gln His Asp Ile Asp Ser Leu Phe Cys Thr
195 200 205
Gln Arg
210
<210> 37
<211> 339
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 37
Met Thr Glu Pro Ala Ala Trp Asp Glu Gly Lys Pro Arg Ile Ile Thr
1 5 10 15
Leu Thr Met Asn Pro Ala Leu Asp Ile Thr Thr Ser Val Asp Val Val
20 25 30
Arg Pro Thr Glu Lys Met Arg Cys Gly Ala Pro Arg Tyr Asp Pro Gly
35 40 45
Gly Gly Gly Ile Asn Val Ala Arg Ile Val His Val Leu Gly Gly Cys
50 55 60
Ser Thr Ala Leu Phe Pro Ala Gly Gly Ser Thr Gly Ser Leu Leu Met
65 70 75 80
Ala Leu Leu Gly Asp Ala Gly Val Pro Phe Arg Val Ile Pro Ile Ala
85 90 95
Ala Ser Thr Arg Glu Ser Phe Thr Val Asn Glu Ser Arg Thr Ala Lys
100 105 110
Gln Tyr Arg Phe Val Leu Pro Gly Pro Ser Leu Thr Val Ala Glu Gln
115 120 125
Glu Gln Cys Leu Asp Glu Leu Arg Gly Ala Ala Ala Ser Ala Ala Phe
130 135 140
Val Val Ala Ser Gly Ser Leu Pro Pro Gly Val Ala Ala Asp Tyr Tyr
145 150 155 160
Gln Arg Val Ala Asp Ile Cys Arg Arg Ser Ser Thr Pro Leu Ile Leu
165 170 175
Asp Thr Ser Gly Gly Gly Leu Gln His Ile Ser Ser Gly Val Phe Leu
180 185 190
Leu Lys Ala Ser Val Arg Glu Leu Arg Glu Cys Val Gly Ser Glu Leu
195 200 205
Leu Thr Glu Pro Glu Gln Leu Ala Ala Ala His Glu Leu Ile Asp Arg
210 215 220
Gly Arg Ala Glu Val Val Val Val Ser Leu Gly Ser Gln Gly Ala Leu
225 230 235 240
Leu Ala Thr Arg His Ala Ser His Arg Phe Ser Ser Ile Pro Met Thr
245 250 255
Ala Val Ser Gly Val Gly Ala Gly Asp Ala Met Val Ala Ala Ile Thr
260 265 270
Val Gly Leu Ser Arg Gly Trp Ser Leu Ile Lys Ser Val Arg Leu Gly
275 280 285
Asn Ala Ala Gly Ala Ala Met Leu Leu Thr Pro Gly Thr Ala Ala Cys
290 295 300
Asn Arg Asp Asp Val Glu Arg Phe Phe Glu Leu Ala Ala Glu Pro Thr
305 310 315 320
Glu Val Gly Gln Asp Gln Tyr Val Trp His Pro Ile Val Asn Pro Glu
325 330 335
Ala Ser Pro
<210> 38
<211> 331
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 38
Met Pro Asp Thr Met Val Thr Thr Asp Val Ile Lys Ser Ala Val Gln
1 5 10 15
Leu Ala Cys Arg Ala Pro Ser Leu His Asn Ser Gln Pro Trp Arg Trp
20 25 30
Ile Ala Glu Asp His Thr Val Ala Leu Phe Leu Asp Lys Asp Arg Val
35 40 45
Leu Tyr Ala Thr Asp His Ser Gly Arg Glu Ala Leu Leu Gly Cys Gly
50 55 60
Ala Val Leu Asp His Phe Arg Val Ala Met Ala Ala Ala Gly Thr Thr
65 70 75 80
Ala Asn Val Glu Arg Phe Pro Asn Pro Asn Asp Pro Leu His Leu Ala
85 90 95
Ser Ile Asp Phe Ser Pro Ala Asp Phe Val Thr Glu Gly His Arg Leu
100 105 110
Arg Ala Asp Ala Ile Leu Leu Arg Arg Thr Asp Arg Leu Pro Phe Ala
115 120 125
Glu Pro Pro Asp Trp Asp Leu Val Glu Ser Gln Leu Arg Thr Thr Val
130 135 140
Thr Ala Asp Thr Val Arg Ile Asp Val Ile Ala Asp Asp Met Arg Pro
145 150 155 160
Glu Leu Ala Ala Ala Ser Lys Leu Thr Glu Ser Leu Arg Leu Tyr Asp
165 170 175
Ser Ser Tyr His Ala Glu Leu Phe Trp Trp Thr Gly Ala Phe Glu Thr
180 185 190
Ser Glu Gly Ile Pro His Ser Ser Leu Val Ser Ala Ala Glu Ser Asp
195 200 205
Arg Val Thr Phe Gly Arg Asp Phe Pro Val Val Ala Asn Thr Asp Arg
210 215 220
Arg Pro Glu Phe Gly His Asp Arg Ser Lys Val Leu Val Leu Ser Thr
225 230 235 240
Tyr Asp Asn Glu Arg Ala Ser Leu Leu Arg Cys Gly Glu Met Leu Ser
245 250 255
Ala Val Leu Leu Asp Ala Thr Met Ala Gly Leu Ala Thr Cys Thr Leu
260 265 270
Thr His Ile Thr Glu Leu His Ala Ser Arg Asp Leu Val Ala Ala Leu
275 280 285
Ile Gly Gln Pro Ala Thr Pro Gln Ala Leu Val Arg Val Gly Leu Ala
290 295 300
Pro Glu Met Glu Glu Pro Pro Pro Ala Thr Pro Arg Arg Pro Ile Asp
305 310 315 320
Glu Val Phe His Val Arg Ala Lys Asp His Arg
325 330
<210> 39
<211> 143
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 39
Met Thr Thr Ala Arg Asp Ile Met Asn Ala Gly Val Thr Cys Val Gly
1 5 10 15
Glu His Glu Thr Leu Thr Ala Ala Ala Gln Tyr Met Arg Glu His Asp
20 25 30
Ile Gly Ala Leu Pro Ile Cys Gly Asp Asp Asp Arg Leu His Gly Met
35 40 45
Leu Thr Asp Arg Asp Ile Val Ile Lys Gly Leu Ala Ala Gly Leu Asp
50 55 60
Pro Asn Thr Ala Thr Ala Gly Glu Leu Ala Arg Asp Ser Ile Tyr Tyr
65 70 75 80
Val Asp Ala Asn Ala Ser Ile Gln Glu Met Leu Asn Val Met Glu Glu
85 90 95
His Gln Val Arg Arg Val Pro Val Ile Ser Glu His Arg Leu Val Gly
100 105 110
Ile Val Thr Glu Ala Asp Ile Ala Arg His Leu Pro Glu His Ala Ile
115 120 125
Val Gln Phe Val Lys Ala Ile Cys Ser Pro Met Ala Leu Ala Ser
130 135 140
<210> 40
<211> 413
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 40
Met Ala Ser Ser Ala Ser Asp Gly Thr His Glu Arg Ser Ala Phe Arg
1 5 10 15
Leu Ser Pro Pro Val Leu Ser Gly Ala Met Gly Pro Phe Met His Thr
20 25 30
Gly Leu Tyr Val Ala Gln Ser Trp Arg Asp Tyr Leu Gly Gln Gln Pro
35 40 45
Asp Lys Leu Pro Ile Ala Arg Pro Thr Ile Ala Leu Ala Ala Gln Ala
50 55 60
Phe Arg Asp Glu Ile Val Leu Leu Gly Leu Lys Ala Arg Arg Pro Val
65 70 75 80
Ser Asn His Arg Val Phe Glu Arg Ile Ser Gln Glu Val Ala Ala Gly
85 90 95
Leu Glu Phe Tyr Gly Asn Arg Arg Trp Leu Glu Lys Pro Ser Gly Phe
100 105 110
Phe Ala Gln Pro Pro Pro Leu Thr Glu Val Ala Val Arg Lys Val Lys
115 120 125
Asp Arg Arg Arg Ser Phe Tyr Arg Ile Phe Phe Asp Ser Gly Phe Thr
130 135 140
Pro His Pro Gly Glu Pro Gly Ser Gln Arg Trp Leu Ser Tyr Thr Ala
145 150 155 160
Asn Asn Arg Glu Tyr Ala Leu Leu Leu Arg His Pro Glu Pro Arg Pro
165 170 175
Trp Leu Val Cys Val His Gly Thr Glu Met Gly Arg Ala Pro Leu Asp
180 185 190
Leu Ala Val Phe Arg Ala Trp Lys Leu His Asp Glu Leu Gly Leu Asn
195 200 205
Ile Val Met Pro Val Leu Pro Met His Gly Pro Arg Gly Gln Gly Leu
210 215 220
Pro Lys Gly Ala Val Phe Pro Gly Glu Asp Val Leu Asp Asp Val His
225 230 235 240
Gly Thr Ala Gln Ala Val Trp Asp Ile Arg Arg Leu Leu Ser Trp Ile
245 250 255
Arg Ser Gln Glu Glu Glu Ser Leu Ile Gly Leu Asn Gly Leu Ser Leu
260 265 270
Gly Gly Tyr Ile Ala Ser Leu Val Ala Ser Leu Glu Glu Gly Leu Ala
275 280 285
Cys Ala Ile Leu Gly Val Pro Val Ala Asp Leu Ile Glu Leu Leu Gly
290 295 300
Arg His Cys Gly Leu Arg His Lys Asp Pro Arg Arg His Thr Val Lys
305 310 315 320
Met Ala Glu Pro Ile Gly Arg Met Ile Ser Pro Leu Ser Leu Thr Pro
325 330 335
Leu Val Pro Met Pro Gly Arg Phe Ile Tyr Ala Gly Ile Ala Asp Arg
340 345 350
Leu Val His Pro Arg Glu Gln Val Thr Arg Leu Trp Glu His Trp Gly
355 360 365
Lys Pro Glu Ile Val Trp Tyr Pro Gly Gly His Thr Gly Phe Phe Gln
370 375 380
Ser Arg Pro Val Arg Arg Phe Val Gln Ala Ala Leu Glu Gln Ser Gly
385 390 395 400
Leu Leu Asp Ala Pro Arg Thr Gln Arg Asp Arg Ser Ala
405 410
<210> 41
<211> 120
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 41
Met Ser Thr Gln Arg Pro Arg His Ser Gly Ile Arg Ala Val Gly Pro
1 5 10 15
Tyr Ala Trp Ala Gly Arg Cys Gly Arg Ile Gly Arg Trp Gly Val His
20 25 30
Gln Glu Ala Met Met Asn Leu Ala Ile Trp His Pro Arg Lys Val Gln
35 40 45
Ser Ala Thr Ile Tyr Gln Val Thr Asp Arg Ser His Asp Gly Arg Thr
50 55 60
Ala Arg Val Pro Gly Asp Glu Ile Thr Ser Thr Val Ser Gly Trp Leu
65 70 75 80
Ser Glu Leu Gly Thr Gln Ser Pro Leu Ala Asp Glu Leu Ala Arg Ala
85 90 95
Val Arg Ile Gly Asp Trp Pro Ala Ala Tyr Ala Ile Gly Glu His Leu
100 105 110
Ser Val Glu Ile Ala Val Ala Val
115 120
<210> 42
<211> 1017
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 42
atgcagcttg ttgacagggt tcgtggcgcc gtcacgggta tgtcgcgtcg actcgtggtc 60
ggggccgtcg gcgcggccct agtgtcgggt ctggtcggcg ccgtcggtgg cacggcgacc 120
gcgggggcat tttcccggcc gggcttgccg gtggagtacc tgcaggtgcc gtcgccgtcg 180
atgggccgtg acatcaaggt ccaattccaa agtggtggtg ccaactcgcc cgccctgtac 240
ctgctcgacg gcctgcgcgc gcaggacgac ttcagcggct gggacatcaa caccccggcg 300
ttcgagtggt acgaccagtc gggcctgtcg gtggtcatgc cggtgggtgg ccagtcaagc 360
ttctactccg actggtacca gcccgcctgc ggcaaggccg gttgccagac ttacaagtgg 420
gagaccttcc tgaccagcga gctgccgggg tggctgcagg ccaacaggca cgtcaagccc 480
accggaagcg ccgtcgtcgg tctttcgatg gctgcttctt cggcgctgac gctggcgatc 540
tatcaccccc agcagttcgt ctacgcggga gcgatgtcgg gcctgttgga cccctcccag 600
gcgatgggtc ccaccctgat cggcctggcg atgggtgacg ctggcggcta caaggcctcc 660
gacatgtggg gcccgaagga ggacccggcg tggcagcgca acgacccgct gttgaacgtc 720
gggaagctga tcgccaacaa cacccgcgtc tgggtgtact gcggcaacgg caagccgtcg 780
gatctgggtg gcaacaacct gccggccaag ttcctcgagg gcttcgtgcg gaccagcaac 840
atcaagttcc aagacgccta caacgccggt ggcggccaca acggcgtgtt cgacttcccg 900
gacagcggta cgcacagctg ggagtactgg ggcgcgcagc tcaacgctat gaagcccgac 960
ctgcaacggg cactgggtgc cacgcccaac accgggcccg cgccccaggg cgcctag 1017
<210> 43
<211> 978
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 43
atgacagacg tgagccgaaa gattcgagct tggggacgcc gattgatgat cggcacggca 60
gcggctgtag tccttccggg cctggtgggg cttgccggcg gagcggcaac cgcgggcgcg 120
ttctcccggc cggggctgcc ggtcgagtac ctgcaggtgc cgtcgccgtc gatgggccgc 180
gacatcaagg ttcagttcca gagcggtggg aacaactcac ctgcggttta tctgctcgac 240
ggcctgcgcg cccaagacga ctacaacggc tgggatatca acaccccggc gttcgagtgg 300
tactaccagt cgggactgtc gatagtcatg ccggtcggcg ggcagtccag cttctacagc 360
gactggtaca gcccggcctg cggtaaggct ggctgccaga cttacaagtg ggaaaccttc 420
ctgaccagcg agctgccgca atggttgtcc gccaacaggg ccgtgaagcc caccggcagc 480
gctgcaatcg gcttgtcgat ggccggctcg tcggcaatga tcttggccgc ctaccacccc 540
cagcagttca tctacgccgg ctcgctgtcg gccctgctgg acccctctca ggggatgggg 600
cctagcctga tcggcctcgc gatgggtgac gccggcggtt acaaggccgc agacatgtgg 660
ggtccctcga gtgacccggc atgggagcgc aacgacccta cgcagcagat ccccaagctg 720
gtcgcaaaca acacccggct atgggtttat tgcgggaacg gcaccccgaa cgagttgggc 780
ggtgccaaca tacccgccga gttcttggag aacttcgttc gtagcagcaa cctgaagttc 840
caggatgcgt acaacgccgc gggcgggcac aacgccgtgt tcaacttccc gcccaacggc 900
acgcacagct gggagtactg gggcgctcag ctcaacgcca tgaagggtga cctgcagagt 960
tcgttaggcg ccggctga 978
<210> 44
<211> 288
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 44
atgacagagc agcagtggaa tttcgcgggt atcgaggccg cggcaagcgc aatccaggga 60
aatgtcacgt ccattcattc cctccttgac gaggggaagc agtccctgac caagctcgca 120
gcggcctggg gcggtagcgg ttcggaggcg taccagggtg tccagcaaaa atgggacgcc 180
acggctaccg agctgaacaa cgcgctgcag aacctggcgc ggacgatcag cgaagccggt 240
caggcaatgg cttcgaccga aggcaacgtc actgggatgt tcgcatag 288
<210> 45
<211> 291
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 45
atgtcgcaaa tcatgtacaa ctaccccgcg atgttgggtc acgccgggga tatggccgga 60
tatgccggca cgctgcagag cttgggtgcc gagatcgccg tggagcaggc cgcgttgcag 120
agtgcgtggc agggcgatac cgggatcacg tatcaggcgt ggcaggcaca gtggaaccag 180
gccatggaag atttggtgcg ggcctatcat gcgatgtcca gcacccatga agccaacacc 240
atggcgatga tggcccgcga cacggccgaa gccgccaaat ggggcggcta g 291
<210> 46
<211> 1068
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 46
atgagcaatt cgcgccgccg ctcactcagg tggtcatggt tgctgagcgt gctggctgcc 60
gtcgggctgg gcctggccac ggcgccggcc caggcggccc cgccggcctt gtcgcaggac 120
cggttcgccg acttccccgc gctgcccctc gacccgtccg cgatggtcgc ccaagtgggg 180
ccacaggtgg tcaacatcaa caccaaactg ggctacaaca acgccgtggg cgccgggacc 240
ggcatcgtca tcgatcccaa cggtgtcgtg ctgaccaaca accacgtgat cgcgggcgcc 300
accgacatca atgcgttcag cgtcggctcc ggccaaacct acggcgtcga tgtggtcggg 360
tatgaccgca cccaggatgt cgcggtgctg cagctgcgcg gtgccggtgg cctgccgtcg 420
gcggcgatcg gtggcggcgt cgcggttggt gagcccgtcg tcgcgatggg caacagcggt 480
gggcagggcg gaacgccccg tgcggtgcct ggcagggtgg tcgcgctcgg ccaaaccgtg 540
caggcgtcgg attcgctgac cggtgccgaa gagacattga acgggttgat ccagttcgat 600
gccgcgatcc agcccggtga ttcgggcggg cccgtcgtca acggcctagg acaggtggtc 660
ggtatgaaca cggccgcgtc cgataacttc cagctgtccc agggtgggca gggattcgcc 720
attccgatcg ggcaggcgat ggcgatcgcg ggccagatcc gatcgggtgg ggggtcaccc 780
accgttcata tcgggcctac cgccttcctc ggcttgggtg ttgtcgacaa caacggcaac 840
ggcgcacgag tccaacgcgt ggtcgggagc gctccggcgg caagtctcgg catctccacc 900
ggcgacgtga tcaccgcggt cgacggcgct ccgatcaact cggccaccgc gatggcggac 960
gcgcttaacg ggcatcatcc cggtgacgtc atctcggtga cctggcaaac caagtcgggc 1020
ggcacgcgta cagggaacgt gacattggcc gagggacccc cggcctga 1068
<210> 47
<211> 1176
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 47
atggtggatt tcggggcgtt accaccggag atcaactccg cgaggatgta cgccggcccg 60
ggttcggcct cgctggtggc cgcggctcag atgtgggaca gcgtggcgag tgacctgttt 120
tcggccgcgt cggcgtttca gtcggtggtc tggggtctga cggtggggtc gtggataggt 180
tcgtcggcgg gtctgatggt ggcggcggcc tcgccgtatg tggcgtggat gagcgtcacc 240
gcggggcagg ccgagctgac cgccgcccag gtccgggttg ctgcggcggc ctacgagacg 300
gcgtatgggc tgacggtgcc cccgccggtg atcgccgaga accgtgctga actgatgatt 360
ctgatagcga ccaacctctt ggggcaaaac accccggcga tcgcggtcaa cgaggccgaa 420
tacggcgaga tgtgggccca agacgccgcc gcgatgtttg gctacgccgc ggcgacggcg 480
acggcgacgg cgacgttgct gccgttcgag gaggcgccgg agatgaccag cgcgggtggg 540
ctcctcgagc aggccgccgc ggtcgaggag gcctccgaca ccgccgcggc gaaccagttg 600
atgaacaatg tgccccaggc gctgcaacag ctggcccagc ccacgcaggg caccacgcct 660
tcttccaagc tgggtggcct gtggaagacg gtctcgccgc atcggtcgcc gatcagcaac 720
atggtgtcga tggccaacaa ccacatgtcg atgaccaact cgggtgtgtc gatgaccaac 780
accttgagct cgatgttgaa gggctttgct ccggcggcgg ccgcccaggc cgtgcaaacc 840
gcggcgcaaa acggggtccg ggcgatgagc tcgctgggca gctcgctggg ttcttcgggt 900
ctgggcggtg gggtggccgc caacttgggt cgggcggcct cggtcggttc gttgtcggtg 960
ccgcaggcct gggccgcggc caaccaggca gtcaccccgg cggcgcgggc gctgccgctg 1020
accagcctga ccagcgccgc ggaaagaggg cccgggcaga tgctgggcgg gctgccggtg 1080
gggcagatgg gcgccagggc cggtggtggg ctcagtggtg tgctgcgtgt tccgccgcga 1140
ccctatgtga tgccgcattc tccggcggcc ggctag 1176
<210> 48
<211> 711
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 48
atgcggaccc ccagacgcca ctgccgtcgc atcgccgtcc tcgccgccgt tagcatcgcc 60
gccactgtcg ttgccggctg ctcgtcgggc tcgaagccaa gcggcggacc acttccggac 120
gcgaagccgc tggtcgagga ggccaccgcg cagaccaagg ctctcaagag cgcgcacatg 180
gtgctgacgg tcaacggcaa gatcccggga ctgtctctga agacgctgag cggcgatctc 240
accaccaacc ccaccgccgc gacgggaaac gtcaagctca cgctgggtgg gtctgatatc 300
gatgccgact tcgtggtgtt cgacgggatc ctgtacgcca ccctgacgcc caaccagtgg 360
agcgatttcg gtcccgccgc cgacatctac gaccccgccc aggtgctgaa tccggatacc 420
ggcctggcca acgtgctggc gaatttcgcc gacgcaaaag ccgaagggcg ggataccatc 480
aacggccaga acaccatccg catcagcggg aaggtatcgg cacaggcggt gaaccagata 540
gcgccgccgt tcaacgcgac gcagccggtg ccggcgaccg tctggattca ggagaccggc 600
gatcatcaac tggcacaggc ccagttggac cgcggctcgg gcaattccgt ccagatgacc 660
ttgtcgaaat ggggcgagaa ggtccaggtc acgaagcccc cggtgagctg a 711
<210> 49
<211> 1623
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 49
atggccaaga caattgcgta cgacgaagag gcccgtcgcg gcctcgagcg gggcttgaac 60
gccctcgccg atgcggtaaa ggtgacattg ggccccaagg gccgcaacgt cgtcctggaa 120
aagaagtggg gtgcccccac gatcaccaac gatggtgtgt ccatcgccaa ggagatcgag 180
ctggaggatc cgtacgagaa gatcggcgcc gagctggtca aagaggtagc caagaagacc 240
gatgacgtcg ccggtgacgg caccacgacg gccaccgtgc tggcccaggc gttggttcgc 300
gagggcctgc gcaacgtcgc ggccggcgcc aacccgctcg gtctcaaacg cggcatcgaa 360
aaggccgtgg agaaggtcac cgagaccctg ctcaagggcg ccaaggaggt cgagaccaag 420
gagcagattg cggccaccgc agcgatttcg gcgggtgacc agtccatcgg tgacctgatc 480
gccgaggcga tggacaaggt gggcaacgag ggcgtcatca ccgtcgagga gtccaacacc 540
tttgggctgc agctcgagct caccgagggt atgcggttcg acaagggcta catctcgggg 600
tacttcgtga ccgacccgga gcgtcaggag gcggtcctgg aggaccccta catcctgctg 660
gtcagctcca aggtgtccac tgtcaaggat ctgctgccgc tgctcgagaa ggtcatcgga 720
gccggtaagc cgctgctgat catcgccgag gacgtcgagg gcgaggcgct gtccaccctg 780
gtcgtcaaca agatccgcgg caccttcaag tcggtggcgg tcaaggctcc cggcttcggc 840
gaccgccgca aggcgatgct gcaggatatg gccattctca ccggtggtca ggtgatcagc 900
gaagaggtcg gcctgacgct ggagaacgcc gacctgtcgc tgctaggcaa ggcccgcaag 960
gtcgtggtca ccaaggacga gaccaccatc gtcgagggcg ccggtgacac cgacgccatc 1020
gccggacgag tggcccagat ccgccaggag atcgagaaca gcgactccga ctacgaccgt 1080
gagaagctgc aggagcggct ggccaagctg gccggtggtg tcgcggtgat caaggccggt 1140
gccgccaccg aggtcgaact caaggagcgc aagcaccgca tcgaggatgc ggttcgcaat 1200
gccaaggccg ccgtcgagga gggcatcgtc gccggtgggg gtgtgacgct gttgcaagcg 1260
gccccgaccc tggacgagct gaagctcgaa ggcgacgagg cgaccggcgc caacatcgtg 1320
aaggtggcgc tggaggcccc gctgaagcag atcgccttca actccgggct ggagccgggc 1380
gtggtggccg agaaggtgcg caacctgccg gctggccacg gactgaacgc tcagaccggt 1440
gtctacgagg atctgctcgc tgccggcgtt gctgacccgg tcaaggtgac ccgttcggcg 1500
ctgcagaatg cggcgtccat cgcggggctg ttcctgacca ccgaggccgt cgttgccgac 1560
aagccggaaa aggagaaggc ttccgttccc ggtggcggcg acatgggtgg catggatttc 1620
tga 1623
<210> 50
<211> 600
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 50
atggctgaaa actcgaacat tgatgacatc aaggctccgt tgcttgccgc gcttggagcg 60
gccgacctgg ccttggccac tgtcaacgag ttgatcacga acctgcgtga gcgtgcggag 120
gagactcgta cggacacccg cagccgggtc gaggagagcc gtgctcgcct gaccaagctg 180
caggaagatc tgcccgagca gctcaccgag ctgcgtgaga agttcaccgc cgaggagctg 240
cgtaaggccg ccgagggcta cctcgaggcc gcgactagcc ggtacaacga gctggtcgag 300
cgcggtgagg ccgctctaga gcggctgcgc agccagcaga gcttcgagga agtgtcggcg 360
cgcgccgaag gctacgtgga ccaggcggtg gagttgaccc aggaggcgtt gggtacggtc 420
gcatcgcaga cccgcgcggt cggtgagcgt gccgccaagc tggtcggcat cgagctgcct 480
aagaaggctg ctccggccaa gaaggccgct ccggccaaga aggccgctcc ggccaagaag 540
gcggcggcca agaaggcgcc cgcgaagaag gcggcggcca agaaggtcac ccagaagtag 600
<210> 51
<211> 1128
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 51
gtgacgcaaa ccggcaagcg tcagagacgc aaattcggtc gcatccgaca gttcaactcc 60
ggccgctggc aagccagcta caccggcccc gacggccgcg tgtacatcgc ccccaaaacc 120
ttcaacgcca agatcgacgc cgaagcatgg ctcaccgacc gccgccgcga aatcgaccga 180
caactatggt ccccggcatc gggtcaggaa gaccgccccg gagccccatt cggtgagtac 240
gccgaaggat ggctgaagca gcgtggaatc aaggaccgca cccgcgccca ctatcgcaaa 300
ctgctggaca accacatcct ggccaccttc gctgacaccg acctacgcga catcaccccg 360
gccgccgtgc gccgctggta cgccaccacc gccgtgggca caccgaccat gcgggcacac 420
tcctacagct tgctgcgcgc aatcatgcag accgccttgg ccgacgacct gatcgactcc 480
aacccctgcc gcatctcagg cgcgtccacc gcccgccgcg tccacaagat caggcccgcc 540
accctcgacg agctggaaac catcaccaaa gccatgcccg acccctacca ggcgttcgtg 600
ctgatggcgg catggctggc catgcgctac ggcgagctga ccgaattacg ccgcaaagac 660
atcgacctgc acggcgaggt tgcgcgggtg cggcgggctg tcgttcgggt gggcgaaggc 720
ttcaaggtga cgacaccgaa aagcgatgcg ggagtgcgcg acataagtat cccgccacat 780
ctgatacccg ccatcgaaga ccaccttcac aaacacgtca accccggccg ggagtccctg 840
ctgttcccat cggtcaacga ccccaaccgt cacctagcac cctcggcgct gtaccgcatg 900
ttctacaagg cccgaaaagc cgccggccga ccagacttac gggtgcacga ccttcgacac 960
tccggcgccg tgttggctgc atccaccggc gccacactgg ccgaactgat gcagcggcta 1020
ggacacagca cagccggcgc cgcactccgc taccagcacg ccgccaaggg ccgggaccgc 1080
gaaatcgccg cactgttaag caaactggcc gagaaccagg agatgtga 1128
<210> 52
<211> 228
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 52
gtgatagcgg gcgtcgacca ggcgcttgca gcaacaggcc aggctagcca gcgggcggca 60
ggcgcatctg gtggggtcac cgtcggtgtc ggcgtgggca cggaacagag gaacctttcg 120
gtggttgcac cgagtcagtt cacatttagt tcacgcagcc cagattttgt ggatgaaacc 180
gcaggtcaat cgtggtgcgc gatactggga ttgaaccagt ttcactag 228
<210> 53
<211> 435
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 53
atggccacca cccttcccgt tcagcgccac ccgcggtccc tcttccccga gttttctgag 60
ctgttcgcgg ccttcccgtc attcgccgga ctccggccca ccttcgacac ccggttgatg 120
cggctggaag acgagatgaa agaggggcgc tacgaggtac gcgcggagct tcccggggtc 180
gaccccgaca aggacgtcga cattatggtc cgcgatggtc agctgaccat caaggccgag 240
cgcaccgagc agaaggactt cgacggtcgc tcggaattcg cgtacggttc cttcgttcgc 300
acggtgtcgc tgccggtagg tgctgacgag gacgacatta aggccaccta cgacaagggc 360
attcttactg tgtcggtggc ggtttcggaa gggaagccaa ccgaaaagca cattcagatc 420
cggtccacca actga 435
<210> 54
<211> 1224
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 54
atgagtggac gccaccgtaa gcccaccaca tccaacgtca gcgtcgccaa gatcgccttt 60
accggcgcag tactcggtgg cggcggcatc gccatggccg ctcaggcgac cgcggccacc 120
gacggggaat gggatcaggt ggcccgctgc gagtcgggcg gcaactggtc gatcaacacc 180
ggcaacggtt acctcggtgg cttgcagttc actcaaagca cctgggccgc acatggtggc 240
ggcgagttcg ccccgtcggc tcagctggcc agccgggagc agcagattgc cgtcggtgag 300
cgggtgctgg ccacccaggg tcgcggcgcc tggccggtgt gcggccgcgg gttatcgaac 360
gcaacacccc gcgaagtgct tcccgcttcg gcagcgatgg acgctccgtt ggacgcggcc 420
gcggtcaacg gcgaaccagc accgctggcc ccgccgcccg ccgacccggc gccacccgtg 480
gaacttgccg ctaacgacct gcccgcaccg ctgggtgaac ccctcccggc agctcccgcc 540
gacccggcac cacccgccga cctggcacca cccgcgcccg ccgacgtcgc gccacccgtg 600
gaacttgccg taaacgacct gcccgcaccg ctgggtgaac ccctcccggc agctcccgcc 660
gacccggcac cacccgccga cctggcacca cccgcgcccg ccgacctggc gccacccgcg 720
cccgccgacc tggcgccacc cgcgcccgcc gacctggcac cacccgtgga acttgccgta 780
aacgacctgc ccgcgccgct gggtgaaccc ctcccggcag ctcccgccga actggcgcca 840
cccgccgatc tggcacccgc gtccgccgac ctggcgccac ccgcgcccgc cgacctggcg 900
ccacccgcgc ccgccgaact ggcgccaccc gcgcccgccg acctggcacc acccgctgcg 960
gtgaacgagc aaaccgcgcc gggcgatcag cccgccacag ctccaggcgg cccggttggc 1020
cttgccaccg atttggaact ccccgagccc gacccccaac cagctgacgc accgccgccc 1080
ggcgacgtca ccgaggcgcc cgccgaaacg ccccaagtct cgaacatcgc ctatacgaag 1140
aagctgtggc aggcgattcg ggcccaggac gtctgcggca acgatgcgct ggactcgctc 1200
gcacagccgt acgtcatcgg ctga 1224
<210> 55
<211> 1089
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 55
atgttgcgcc tggtagtcgg tgcgctgctg ctggtgttgg cgttcgccgg tggctatgcg 60
gtcgccgcat gcaaaacggt gacgttgacc gtcgacggaa ccgcgatgcg ggtgaccacg 120
atgaaatcgc gggtgatcga catcgtcgaa gagaacgggt tctcagtcga cgaccgcgac 180
gacctgtatc ccgcggccgg cgtgcaggtc catgacgccg acaccatcgt gctgcggcgt 240
agccgtccgc tgcagatctc gctggatggt cacgacgcta agcaggtgtg gacgaccgcg 300
tcgacggtgg acgaggcgct ggcccaactc gcgatgaccg acacggcgcc ggccgcggct 360
tctcgcgcca gccgcgtccc gctgtccggg atggcgctac cggtcgtcag cgccaagacg 420
gtgcagctca acgacggcgg gttggtgcgc acggtgcact tgccggcccc caatgtcgcg 480
gggctgctga gtgcggccgg cgtgccgctg ttgcaaagcg accacgtggt gcccgccgcg 540
acggccccga tcgtcgaagg catgcagatc caggtgaccc gcaatcggat caagaaggtc 600
accgagcggc tgccgctgcc gccgaacgcg cgtcgtgtcg aggacccgga gatgaacatg 660
agccgggagg tcgtcgaaga cccgggggtt ccggggaccc aggatgtgac gttcgcggta 720
gctgaggtca acggcgtcga gaccggccgt ttgcccgtcg ccaacgtcgt ggtgaccccg 780
gcccacgaag ccgtggtgcg ggtgggcacc aagcccggta ccgaggtgcc cccggtgatc 840
gacggaagca tctgggacgc gatcgccggc tgtgaggccg gtggcaactg ggcgatcaac 900
accggcaacg ggtattacgg tggtgtgcag tttgaccagg gcacctggga ggccaacggc 960
gggctgcggt atgcaccccg cgctgacctc gccacccgcg aagagcagat cgccgttgcc 1020
gaggtgaccc gactgcgtca aggttggggc gcctggccgg tatgtgctgc acgagcgggt 1080
gcgcgctga 1089
<210> 56
<211> 531
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 56
gtgcatcctt tgccggccga ccacggccgg tcgcggtgca atagacaccc gatctcacca 60
ctctctctaa tcggtaacgc ttcggccact tccggcgata tgtcgagcat gacaagaatc 120
gccaagccgc tcatcaagtc cgccatggcc gcaggactcg tcacggcatc catgtcgctc 180
tccaccgccg ttgcccacgc cggtcccagc ccgaactggg acgccgtcgc gcagtgcgaa 240
tccgggggca actgggcggc caacaccgga aacggcaaat acggcggact gcagttcaag 300
ccggccacct gggccgcatt cggcggtgtc ggcaacccag cagctgcctc tcgggaacaa 360
caaatcgcag ttgccaatcg ggttctcgcc gaacagggat tggacgcgtg gccgacgtgc 420
ggcgccgcct ctggccttcc gatcgcactg tggtcgaaac ccgcgcaggg catcaagcaa 480
atcatcaacg agatcatttg ggcaggcatt caggcaagta ttccgcgctg a 531
<210> 57
<211> 465
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 57
atgacaccgg gtttgcttac tactgcgggt gctggccgac cacgtgacag gtgcgccagg 60
atcgtatgca cggtgttcat cgaaaccgcc gttgtcgcga ccatgtttgt cgcgttgttg 120
ggtctgtcca ccatcagctc gaaagccgac gacatcgatt gggacgccat cgcgcaatgc 180
gaatccggcg gcaattgggc ggccaacacc ggtaacgggt tatacggtgg tctgcagatc 240
agccaggcga cgtgggattc caacggtggt gtcgggtcgc cggcggccgc gagtccccag 300
caacagatcg aggtcgcaga caacattatg aaaacccaag gcccgggtgc gtggccgaaa 360
tgtagttctt gtagtcaggg agacgcaccg ctgggctcgc tcacccacat cctgacgttc 420
ctcgcggccg agactggagg ttgttcgggg agcagggacg attga 465
<210> 58
<211> 519
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 58
ttgaagaacg cccgtacgac gctcatcgcc gccgcgattg ccgggacgtt ggtgaccacg 60
tcaccagccg gtatcgccaa tgccgacgac gcgggcttgg acccaaacgc cgcagccggc 120
ccggatgccg tgggctttga cccgaacctg ccgccggccc cggacgctgc acccgtcgat 180
actccgccgg ctccggagga cgcgggcttt gatcccaacc tccccccgcc gctggccccg 240
gacttcctgt ccccgcctgc ggaggaagcg cctcccgtgc ccgtggccta cagcgtgaac 300
tgggacgcga tcgcgcagtg cgagtccggt ggaaactggt cgatcaacac cggtaacggt 360
tactacggcg gcctgcggtt caccgccggc acctggcgtg ccaacggtgg ctcggggtcc 420
gcggccaacg cgagccggga ggagcagatc cgggtggctg agaacgtgct gcgttcgcag 480
ggtatccgcg cctggccggt ctgcggccgc cgcggctga 519
<210> 59
<211> 633
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 59
atgatcgcca caacccgcga tcgtgaagga gccaccatga tcacgtttag gctgcgcttg 60
ccgtgccgga cgatactgcg ggtgttcagc cgcaatccgc tggtgcgtgg gacggatcga 120
ctcgaggcgg tcgtcatgct gctggccgtc acggtctcgc tgctgactat cccgttcgcc 180
gccgcggccg gcaccgcagt ccaggattcc cgcagccacg tctatgccca ccaggcccag 240
acccgccatc ccgcaaccgc gaccgtgatc gatcacgagg gggtgatcga cagcaacacg 300
accgccacgt cagcgccgcc gcgcacgaag atcaccgtgc ctgcccgatg ggtcgtgaac 360
ggaatagaac gcagcggtga ggtcaacgcg aagccgggaa ccaaatccgg tgaccgcgtc 420
ggcatttggg tcgacagtgc cggtcagctg gtcgatgaac cagctccgcc ggcccgtgcc 480
attgcggatg cggccctggc cgccttggga ctctggttga gcgtcgccgc ggttgcgggc 540
gccctgctgg cgctcactcg ggcgattctg atccgcgttc gcaacgccag ttggcaacac 600
gacatcgaca gcctgttctg cacgcagcgg tga 633
<210> 60
<211> 1020
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 60
atgacggagc cagcggcgtg ggacgaaggc aagccgcgaa tcatcacttt gaccatgaac 60
cccgccttgg acatcacgac gagcgtcgac gtggtgcgcc cgaccgagaa aatgcgttgt 120
ggcgcacctc gctacgatcc cggcggcggc ggtatcaatg tcgcccgcat tgtgcatgtc 180
ctcggcggtt gctcgacagc actgttcccg gccggcgggt cgaccgggag cctgctgatg 240
gcgctgctcg gtgatgcggg agtgccattt cgcgtcattc cgatcgcggc ctcgacgcgg 300
gagagcttca cggtcaacga gtccaggacc gccaagcagt atcgtttcgt gcttccgggg 360
ccgtcgctga ccgtcgcgga gcaggagcaa tgcctcgacg aactgcgcgg tgcggcggct 420
tcggccgcct ttgtggtggc cagtggcagc ctgccgccag gtgtggctgc cgactactat 480
cagcgggttg ccgacatctg ccgccgatcg agcactccgc tgatcctgga tacatctggt 540
ggcgggttgc agcacatttc gtccggggtg tttcttctca aggcgagcgt gcgggaactg 600
cgcgagtgcg tcggatccga actgctgacc gagcccgaac aactggccgc cgcacacgaa 660
ctcattgacc gtgggcgcgc cgaggtcgtg gtggtctcgc ttggatctca gggcgcgcta 720
ttggccacac gacatgcgag ccatcgattt tcgtcgattc cgatgaccgc ggttagcggt 780
gtcggcgccg gcgacgcgat ggtggccgcg attaccgtgg gcctcagccg tggctggtcg 840
ctcatcaagt ccgttcgctt gggaaacgcg gcaggtgcag ccatgctgct gacgccaggc 900
accgcggcct gcaatcgcga cgatgtggag aggttcttcg agctggcggc cgaacccacc 960
gaagtcgggc aggatcaata cgtttggcac ccgatcgtta acccggaagc ctcgccatga 1020
<210> 61
<211> 996
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 61
atgccggaca ccatggtgac caccgatgtc atcaagagcg cggtgcagtt ggcctgccgc 60
gcaccgtcgc tccacaacag ccagccctgg cgctggatag ccgaggacca cacggttgcg 120
ctgttcctcg acaaggatcg ggtgctttac gcgaccgacc actccggccg ggaagcgctg 180
ctggggtgcg gcgccgtact cgaccacttt cgggtggcga tggcggccgc gggtaccacc 240
gccaatgtgg aacggtttcc caaccccaac gatcctttgc atctggcgtc aattgacttc 300
agcccggccg atttcgtcac cgagggccac cgtctaaggg cggatgcgat cctactgcgc 360
cgtaccgacc ggctgccttt cgccgagccg ccggattggg acttggtgga gtcgcagttg 420
cgcacgaccg tcaccgccga cacggtgcgc atcgacgtca tcgccgacga tatgcgtccc 480
gaactggcgg cggcgtccaa actcaccgaa tcgctgcggc tctacgattc gtcgtatcat 540
gccgaactct tttggtggac aggggctttt gagacttctg agggcatacc gcacagttca 600
ttggtatcgg cggccgaaag tgaccgggtc accttcggac gcgacttccc ggtcgtcgcc 660
aacaccgata ggcgcccgga gtttggccac gaccgctcta aggtcctggt gctctccacc 720
tacgacaacg aacgcgccag cctactgcgc tgcggcgaga tgctttccgc cgtattgctt 780
gacgccacca tggctgggct tgccacctgc acgctgaccc acatcaccga actgcacgcc 840
agccgagacc tggtcgcagc gctgattggg cagcccgcaa ctccgcaagc cttggttcgc 900
gtcggtctgg ccccggagat ggaagagccg ccaccggcaa cgcctcggcg accaatcgat 960
gaagtgtttc acgttcgggc taaggatcac cggtag 996
<210> 62
<211> 432
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 62
atgaccaccg cacgcgacat catgaacgca ggtgtgacct gtgttggcga acacgagacg 60
ctaaccgctg ccgctcaata catgcgtgag cacgacatcg gcgcgttgcc gatctgcggg 120
gacgacgacc ggctgcacgg catgctcacc gaccgcgaca ttgtgatcaa aggcctggct 180
gcgggcctag acccgaatac cgccacggct ggcgagttgg cccgggacag catctactac 240
gtcgatgcga acgcaagcat ccaggagatg ctcaacgtca tggaagaaca tcaggtccgc 300
cgtgttccgg tcatctcaga gcaccgcttg gtcggaatcg tcaccgaagc cgacatcgcc 360
cgacacctgc ccgagcacgc cattgtgcag ttcgtcaagg caatctgctc gcccatggcc 420
ctcgccagct ag 432
<210> 63
<211> 1242
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 63
atggcaagtt ctgcgagcga cggcacccac gaacgctcgg cttttcgcct gagtccaccg 60
gtcttgagcg gcgccatggg accgttcatg cacaccggtc tgtacgtcgc tcaatcgtgg 120
cgcgactatc tgggtcaaca gcccgataaa ctgccgatcg cacggcccac tattgcctta 180
gcggcgcaag cctttcgaga cgaaatcgtc ctgctgggcc tcaaggcacg acgtccggtc 240
agcaatcatc gagtgttcga gcgcatcagc caagaagtgg ccgctggact ggagttctat 300
gggaatcgca gatggctgga gaagcctagc ggattttttg cccagccccc accgctcacc 360
gaggtcgcgg tccgaaaggt caaggaccgc agacgctcct tttatcgcat cttcttcgac 420
agtgggttta cgccgcatcc gggtgaaccg ggcagccaac ggtggctctc atacactgcg 480
aacaatcgcg agtacgccct gttactgcgg cacccagagc cgcgtccctg gctggtttgt 540
gtacacggca ccgagatggg cagggccccg ttggatctcg cggtgttccg cgcctggaag 600
ctgcatgacg aactcggcct gaacattgtc atgccggttc ttccgatgca tggtccccgc 660
gggcaaggtc tgccgaaggg cgccgttttt cccggagaag atgttctcga cgatgtgcat 720
gggacggctc aagcggtgtg ggatatccgg cggctgttgt cctggatacg atcgcaggag 780
gaggagtcgc tgatcgggtt gaacggtctc tcgctgggcg gctacatcgc gtcattggtc 840
gccagcctcg aagaaggtct cgcctgcgcg attctcggtg tcccagtggc tgatctgatc 900
gagttgttgg gccgccactg cggtcttcgg cacaaagacc cccgccgcca caccgtcaag 960
atggccgaac cgatcggccg aatgatctcg ccgctctcac ttacgccact ggtgcccatg 1020
ccgggccgct ttatctacgc gggcattgcc gaccgactcg tgcatccacg cgaacaggtg 1080
actcgcctct gggagcactg gggcaaaccc gaaatcgtgt ggtatccagg cggtcacact 1140
ggcttcttcc agtcgcggcc ggtacgacgg tttgtccagg ctgcgctgga gcagtcgggc 1200
ctgttggacg cgccacggac acagcgcgac cgttccgcct aa 1242
<210> 64
<211> 363
<212> ДНК
<213> Mycobacterium tuberculosis
<400> 64
atgtccacgc aacgaccgag gcactccggt attcgggctg ttggccccta cgcatgggcc 60
ggccgatgtg gtcggatagg caggtggggg gtgcaccagg aggcgatgat gaatctagcg 120
atatggcacc cgcgcaaggt gcaatccgcc accatctatc aggtgaccga tcgctcgcac 180
gacgggcgca cagcacgggt gcctggtgac gagatcacta gcaccgtgtc cggttggttg 240
tcggagttgg gcacccaaag cccgttggcc gatgagcttg cgcgtgcggt gcggatcggc 300
gactggcccg ctgcgtacgc aatcggtgag cacctgtccg ttgagattgc cgttgcggtc 360
taa 363
<210> 65
<211> 399
<212> БЕЛОК
<213> Mycobacterium tuberculosis
<400> 65
Leu Asp Phe Ala Thr Leu Pro Pro Glu Ile Asn Ser Ala Arg Met Tyr
1 5 10 15
Ser Gly Ala Gly Ser Ala Pro Met Leu Ala Ala Ala Ser Ala Trp His
20 25 30
Gly Leu Ser Ala Glu Leu Arg Ala Ser Ala Leu Ser Tyr Ser Ser Val
35 40 45
Leu Ser Thr Leu Thr Gly Glu Glu Trp His Gly Pro Ala Ser Ala Ser
50 55 60
Met Thr Ala Ala Ala Ala Pro Tyr Val Ala Trp Met Ser Val Thr Ala
65 70 75 80
Val Arg Ala Glu Gln Ala Gly Ala Gln Ala Glu Ala Ala Ala Ala Ala
85 90 95
Tyr Glu Ala Ala Phe Ala Ala Thr Val Pro Pro Pro Val Ile Glu Ala
100 105 110
Asn Arg Ala Gln Leu Met Ala Leu Ile Ala Thr Asn Val Leu Gly Gln
115 120 125
Asn Ala Pro Ala Ile Ala Ala Thr Glu Ala Gln Tyr Ala Glu Met Trp
130 135 140
Ser Gln Asp Ala Met Ala Met Tyr Gly Tyr Ala Gly Ala Ser Ala Ala
145 150 155 160
Ala Thr Gln Leu Thr Pro Phe Thr Glu Pro Val Gln Thr Thr Asn Ala
165 170 175
Ser Gly Leu Ala Ala Gln Ser Ala Ala Ile Ala His Ala Thr Gly Ala
180 185 190
Ser Ala Gly Ala Gln Gln Thr Thr Leu Ser Gln Leu Ile Ala Ala Ile
195 200 205
Pro Ser Val Leu Gln Gly Leu Ser Ser Ser Thr Ala Ala Thr Phe Ala
210 215 220
Ser Gly Pro Ser Gly Leu Leu Gly Ile Val Gly Ser Gly Ser Ser Trp
225 230 235 240
Leu Asp Lys Leu Trp Ala Leu Leu Asp Pro Asn Ser Asn Phe Trp Asn
245 250 255
Thr Ile Ala Ser Ser Gly Leu Phe Leu Pro Ser Asn Thr Ile Ala Pro
260 265 270
Phe Leu Gly Leu Leu Gly Gly Val Ala Ala Ala Asp Ala Ala Gly Asp
275 280 285
Val Leu Gly Glu Ala Thr Ser Gly Gly Leu Gly Gly Ala Leu Val Ala
290 295 300
Pro Leu Gly Ser Ala Gly Gly Leu Gly Gly Thr Val Ala Ala Gly Leu
305 310 315 320
Gly Asn Ala Ala Thr Val Gly Thr Leu Ser Val Pro Pro Ser Trp Thr
325 330 335
Ala Ala Ala Pro Leu Ala Ser Pro Leu Gly Ser Ala Leu Gly Gly Thr
340 345 350
Pro Met Val Ala Pro Pro Pro Ala Val Ala Ala Gly Met Pro Gly Met
355 360 365
Pro Phe Gly Thr Met Gly Gly Gln Gly Phe Gly Arg Ala Val Pro Gln
370 375 380
Tyr Gly Phe Arg Pro Asn Phe Val Ala Arg Pro Pro Ala Ala Gly
385 390 395
| название | год | авторы | номер документа |
|---|---|---|---|
| МУТАНТНЫЙ БЕЛОК F RSV И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2807742C1 |
| ХИМЕРНЫЙ АНТИГЕННЫЙ РЕЦЕПТОР | 2018 |
|
RU2770002C2 |
| РЕКОМБИНАНТНЫЕ ВАКЦИНЫ ОТ FMDV И ИХ ПРИМЕНЕНИЕ | 2015 |
|
RU2745373C2 |
| ТЕРАПЕВТИЧЕСКАЯ ПРОТИВОРАКОВАЯ НЕОЭПИТОПНАЯ ВАКЦИНА | 2017 |
|
RU2782422C2 |
| ДИСПЛЕЙ ИНТЕГРАЛЬНОГО МЕМБРАННОГО БЕЛКА НА ВНЕКЛЕТОЧНЫХ ОБОЛОЧЕЧНЫХ ВИРИОНАХ ПОКСВИРУСА | 2017 |
|
RU2759846C2 |
| Т-КЛЕТКИ С ХИМЕРНЫМИ АНТИГЕННЫМИ РЕЦЕПТОРАМИ (CAR-T) ДЛЯ ЛЕЧЕНИЯ РАКА | 2019 |
|
RU2811466C2 |
| CD3-СВЯЗЫВАЮЩИЙ ДОМЕН | 2015 |
|
RU2742691C2 |
| ВАКЦИНЫ НА ОСНОВЕ ВИРУСОПОДОБНЫХ ЧАСТИЦ (VLP) СОБАЧЬЕГО ПАРВОВИРУСА (CPV) И ИХ ПРИМЕНЕНИЕ | 2016 |
|
RU2710854C1 |
| РЕКОМБИНАНТНЫЕ ВЕКТОРЫ, ЭКСПРЕССИРУЮЩИЕ АНТИГЕНЫ ВИРУСА ПТИЧЬЕГО ГРИППА, И ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2761869C2 |
| СПЕЦИФИЧНЫЕ К MUC16 ХИМЕРНЫЕ АНТИГЕННЫЕ РЕЦЕПТОРЫ И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795198C2 |








































































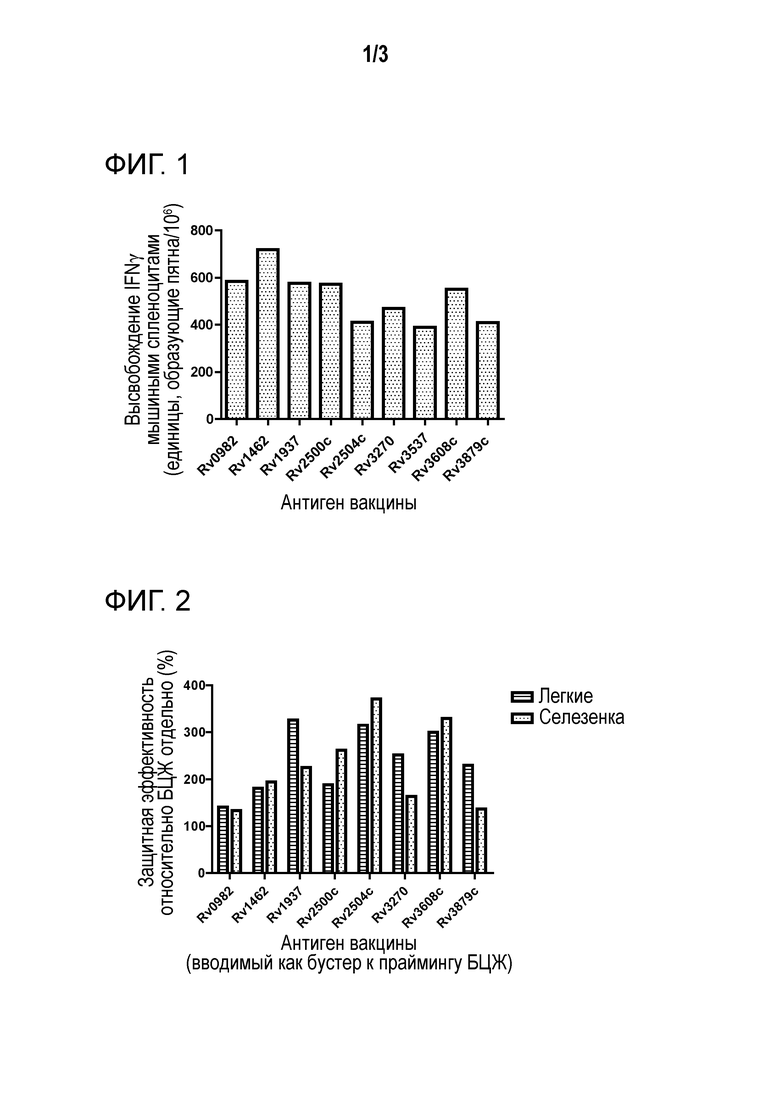
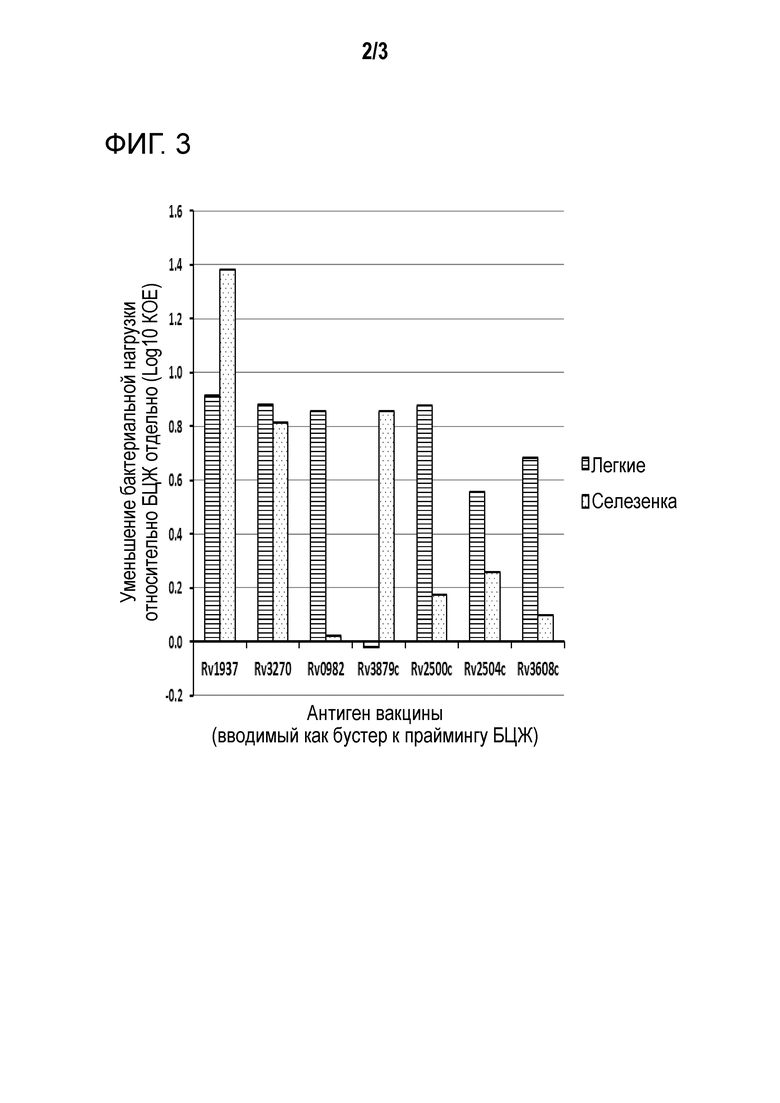

Изобретение относится к области биохимии, в частности к антигенной композиции, включающей эффективное количество микобактериального антигенного полипептида Mycobacterium tuberculosis, предназначенной для применения в лечении, подавлении или профилактике микобактериальной инфекции у пациента, а также к способу ее получения. Также раскрыт способ диагностики in vitro микобактериальной инфекции, предусматривающий использование вышеуказанной композиции. Изобретение также относится к способу лечения, подавления или профилактики микобактериальной инфекции у пациента, включающей введение указанному пациенту вышеуказанной антигенной композиции. Изобретение позволяет эффективно осуществлять лечение, подавление или профилактику микобактериальной инфекции у пациента. 10 н. и 5 з.п. ф-лы, 4 ил., 4 табл., 11 пр.
1. Антигенная композиция, включающая эффективное количество микобактериального антигенного полипептида Mycobacterium tuberculosis, где указанный микобактериальный антигенный полипептид включает последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4;
где указанная антигенная композиция предназначена для применения в лечении, подавлении или профилактике микобактериальной инфекции у пациента.
2. Антигенная композиция, включающая эффективное количество микобактериального полинуклеотида Mycobacterium tuberculosis, где указанный микобактериальный полинуклеотид включает полинуклеотидную последовательность, кодирующую микобактериальный антигенный полипептид, включающий последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4; или
где указанный микобактериальный полинуклеотид включает полинуклеотидную последовательность, выбранную из SEQ ID NO: 5, 11, 1, 17, 7, 9, 15, 3;
где указанная антигенная композиция предназначена для применения в лечении, подавлении или профилактике микобактериальной инфекции у пациента.
3. Антигенная композиция по п. 2, где указанный микобактериальный полинуклеотид включает полинуклеотидную последовательность, имеющую по меньшей мере 90% идентичности последовательности нуклеотидов относительно последовательности нуклеиновой кислоты SEQ ID NO: 5, 11, 1, 17, 7, 9, 15, 3 или ее фрагмента, имеющего по меньшей мере 450 ее последовательных нуклеотидов, где указанный фрагмент кодирует полипептид, который имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4.
4. Антигенная композиция по п. 1 или 2, дополнительно включающая по меньшей мере один дополнительный (второй) микобактериальный полипептид, который отличается от указанного микобактериального антигенного полипептида; или по меньшей мере один дополнительный (второй) микобактериальный полинуклеотид, кодирующий второй микобактериальный антигенный полипептид, где указанный второй микобактериальный полипептид отличается от указанного микобактериального полипептида.
5. Антигенная композиция по п. 2, где указанная антигенная композиция включает по меньшей мере один вектор, и где указанный микобактериальный полинуклеотид(ы) включают в указанный по меньшей мере один вектор.
6. Антигенная композиция по п. 5, где указанный вектор представляет собой вектор экспрессии или вирусный вектор, такой как аттенуированный вирус осповакцины или аденовирусный вектор.
7. Антигенная композиция по п. 1 или 2, где указанная антигенная композиция включает по меньшей мере одну клетку, и где указанная клетка включает по меньшей мере один из указанных микобактериальных антигенных полипептидов и/или микобактериальных полинуклеотидов; например, где указанная клетка является аттенуированным микробным носителем, таким как аттенуированная сальмонелла, аттенуированная M. bovis или аттенуированная M. tuberculosis.
8. Способ получения терапевтической или профилактической композиции, включающий смешивание фармацевтически приемлемого носителя с эффективным количеством микобактериального антигенного полипептида, включающего последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4.
9. Способ получения терапевтической или профилактической композиции, включающий смешивание фармацевтически приемлемого носителя с эффективным количеством микобактериального полинуклеотида, включающего полинуклеотидную последовательность, кодирующую микобактериальный антигенный полипептид, включающий последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4, или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4; или полинуклеотидную последовательность, выбранную из SEQ ID NO: 5, 11, 1, 17, 7, 9, 15, 3.
10. Способ диагностики in vitro микобактериальной инфекции, такой как ранняя стадия микобактериальной инфекции, включающий инкубацию тестируемого образца, содержащего иммунные клетки, такие как Т-лимфоциты, от пациента сантигенной композицией по любому из пп. 1-6;
и определение активации указанной иммунной клетки, где активация указанной иммунной клетки является показателем микобактериальной инфекции у пациента.
11. Способ диагностики in vitro микобактериальной инфекции, такой как ранняя стадия микобактериальной инфекции, включающий инкубацию тестируемого образца, содержащего иммунные клетки, такие как Т-лимфоциты, от пациента с микобактериальным антигенным полипептидом, включающим последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4, или микобактериальным полинуклеотидом, включающим полинуклеотидную последовательность, кодирующую микобактериальный антигенный полипептид, включающий последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4; или
где указанный микобактериальный полинуклеотид включает полинуклеотидную последовательность, выбранную из SEQ ID NO: 5, 11, 1, 17, 7, 9, 15, 3;
и определение активации указанной иммунной клетки, где активация указанной иммунной клетки является показателем микобактериальной инфекции у пациента.
12. Способ диагностики in vitro микобактериальной инфекции, такой как ранняя стадия микобактериальной инфекции, включающий инкубацию тестируемого образца от пациента с антигенной композицией по любому из пп. 1-6;
где указанную инкубацию проводят в условиях, которые позволяют связывание указанного микобактериального антигена с антителами в образце для получения комплексов антиген-антитело; и затем определение образования таких комплексов, где присутствие комплексов антиген-антитело является показателем микобактериальной инфекции у пациента.
13. Способ диагностики in vitro микобактериальной инфекции, такой как ранняя стадия микобактериальной инфекции, включающий инкубацию тестируемого образца от пациента с микобактериальным антигенным полипептидом, включающим последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4, или микобактериальным полинуклеотидом,
включающим полинуклеотидную последовательность, кодирующую микобактериальный антигенный полипептид, включающий последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4; или
где указанный микобактериальный полинуклеотид включает полинуклеотидную последовательность, выбранную из SEQ ID NO: 5, 11, 1, 17, 7, 9, 15, 3;
где указанную инкубацию проводят в условиях, которые позволяют связывание указанного микобактериального антигена с антителами в образце для получения комплексов антиген-антитело; и затем определение образования таких комплексов, где присутствие комплексов антиген-антитело является показателем микобактериальной инфекции у пациента.
14. Способ диагностики in vitro микобактериальной инфекции, такой как ранняя стадия микобактериальной инфекции, включающий инкубацию тестируемого образца от пациента с антителом, где указанное антитело связывается с микобактериальным антигенным полипептидом, включающим последовательность полипептида, имеющую по меньшей мере 90% идентичность последовательности аминокислот относительно последовательности аминокислот SEQ ID NO: 6, 12, 2, 18, 8, 10, 16, 4 или их фрагментов, имеющих по меньшей мере 150 их последовательных аминокислот, где указанный фрагмент имеет общую антигенную перекрестную реакцию с полипептидом, выбранным из SEQ ID NO: 6, 12, 18, 8, 10, 16, 4;
где указанную инкубацию проводят в условиях, которые позволяют связывание антител с антигенами в образце для получения комплексов антиген-антитело; и затем определение образования таких комплексов, где присутствие комплексов антиген-антитело является показателем микобактериальной инфекции у пациента.
15. Способ лечения, подавления или профилактики микобактериальной инфекции у пациента, включающий введение указанному пациенту антигенной композиции по любому из пп. 1-6.
| КОМБИНИРОВАННАЯ СЕЯЛКА ПО ПНЯМ | 1990 |
|
RU2077183C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПИТАТЕЛЬНОЙ СМЕСИ ДЛЯ ВНУТРИКИШЕЧНОГО ЗОНДОВОГО ПИТАНИЯ | 2001 |
|
RU2196473C1 |
| WO 2005090988 A2, 29.09.2005 | |||
| АНТИГЕННАЯ КОМПОЗИЦИЯ И СПОСОБ ОБНАРУЖЕНИЯ ПРИСУТСТВИЯ TREPONEMA PALLIDUM У ЧЕЛОВЕКА | 2000 |
|
RU2244933C2 |
Авторы
Даты
2019-10-04—Публикация
2015-01-16—Подача