Область техники изобретения
Настоящее изобретение относится к противораковой вакцине, содержащей полинуклеотиды или полипептиды, способам лечения рака, в которых используется такая противораковая вакцина, а также способам получения данной вакцины.
Уровень техники
Несмотря на то, что за последние несколько десятилетий наблюдается прогресс в лечении рака, особенно связанный с успехами в ранних выявлении и диагностике, обеспечивших значительное повышение выживаемости, только около 60% пациентов, у которых диагностирован рак, остаются в живых через 5 лет после постановки диагноза.
Большинство применяемых способов лечения рака включают в себя хирургические процедуры, а также лучевую и цитотоксическую химиотерапию, однако все они связаны с серьезными побочными эффектами. В последнее время используется лечение с применением антител против известных антигенов, ассоциированным с раком.
В течение последних нескольких лет привлекает внимание иммунная терапия рака, заключающаяся в нацеливании собственной иммунной системы пациента на раковые клетки, то есть лечение вакцинами против рака, поскольку такая терапия может уменьшать или даже устранять некоторые побочные эффекты, наблюдаемые при традиционной терапии рака.
Иммунология основана на распознавании «своего-чужого». Большинство патогенных микроорганизмов, вызывающих инфекционные заболевания, содержат молекулярные «подписи» (сигнатуры), которые могут распознаваться хостом и вызывать иммунный ответ. Однако опухолевые клетки происходят из нормальных клеток и обычно не экспрессируют никаких молекулярных сигнатур, что с трудом позволяет отличить их от нормальных клеток.
Тем не менее, большинство опухолевых клеток экспрессируют различные типы опухолевых антигенов. Одним из классов опухолевых антигенов являются так называемые ассоциированные с опухолью антигены, т.е. антигены с низким уровнем экспрессии в нормальных тканях и экспрессирущиеся на гораздо более высоком уровне в опухолевой ткани. Такие опухоль-ассоциированные антигены использовались в качестве мишени для противораковых вакцин в течение последнего десятилетия. Однако, иммунологическое лечение, направленное на ассоциированные с опухолью антигены, сопряжено с рядом проблем, обусловленных тем, что опухолевые клетки могут уклоняться от иммунной системы, подавляя экспрессию соответствующего антигена, и что лечение может также приводить к токсичности из-за разрушения нормальных клеток.
Недавно был идентифицирован еще один класс опухолевых антигенов, так называемых опухолевых неоантигенов или опухолеспецифических антигенов. Опухолевые неоантигены возникают из-за одной или нескольких мутаций в опухолевом геноме, что приводит к изменению аминокислотной последовательности соответствующего белка. Поскольку данные мутации отсутствуют в нормальной ткани, побочные эффекты, сопровождающие лечение направленное на ассоциированные с опухолью антигены, не возникают при иммунологическом лечении, направленном на опухолевые неоантигены.
Среднее число соматических, опухолеспецифичных, несинонимичных мутаций для злокачественной меланомы составляет от 100 до 120. Некоторые из генетических изменений могут распознаваться иммунной системой, представляя собой идеальные антигены. Животные модели подтвердили полезность иммунизации опухолевыми неоантигенами, и было начато два клинических испытания: одно с вакциной, содержащей до 10 мутированных белков, и другое с РНК-вакциной (IVAC MUTANOME). РНК-вакцина включает 2 молекулы РНК, каждая из которых содержит пять различных, кодирующих мутации последовательностей.
Однако, при введении нескольких различных белков или нескольких последовательностей РНК трудно контролировать иммунологический ответ на различные белки, вводимые или экспрессированные in vivo.
Соответственно, существует потребность в более эффективной вакцине, обеспечивающей экспрессию мутированных белков как in vivo, так и in vitro, и необходимо обеспечить доставку антигена, а также активацию антигенпрезентирующих клеток, необходимых для выявления сильного Т-клеточного ответа.
Сущность изобретения
Настоящее изобретение относится к терапевтической противораковой вакцине, с множеством неоэпитопов опухолевых неоантигенов, причем данные неоэпитопы презентируются иммунной системе в виде димерного белка, называемого вакцителом (vaccibody). В WO 2004/076489 подробно описываются димерные белки, называемые вакцителами.
В одном варианте осуществления настоящее изобретение относится к терапевтической противораковой неоэпитопной вакцине, содержащей иммунологически эффективное количество
1) полинуклеотида, содержащего нуклеотидную последовательность, кодирующую
- единицу нацеливания
- единицу димеризации
- первый линкер
- антигенную единицу, причем указанная антигенная единица содержит n-1 антигенных субъединиц, причем каждая субъединица содержит, по меньшей мере, часть раковой неоэпитопной последовательности и второй линкер, и упомянутая антигенная единица дополнительно содержит окончательную раковую неоэпитопную последовательность, причем n представляет собой целое число от 3 до 50.
или
2) полипептида, кодируемого полинуклеотидом, как определено в 1), или
3) димерного белка, состоящего из двух полипептидов, кодируемых полинуклеотидом, как определено в 1).
В другом аспекте настоящее изобретение относится к полинуклеотиду, как определено выше. Такой полинуклеотид, например, может быть использован в вакцине в соответствии с изобретением.
В третьем аспекте настоящее изобретение относится к вектору, содержащему полинуклеотид, как определено выше, и в четвертом аспекте настоящее изобретение относится к клетке-хозяину, содержащей полинуклеотид или вектор, как определено выше.
В пятом аспекте настоящее изобретение относится к полипептиду, кодируемому полинуклеотидом, как определено выше. Такой полипептид, например, применим в вакцине в соответствии с изобретением, и в шестом аспекте настоящее изобретение относится к димерному белку, состоящему из двух полипептидов, как определено выше.
В седьмом аспекте настоящее изобретение относится к полипептиду, димерному белку или полинуклеотиду, как определено выше, для применения в качестве лекарственного средства.
Как описано выше, в некоторых вариантах осуществления изобретения вакцина содержит полипептид или димерный белок, и, соответственно, в восьмом аспекте настоящее изобретение относится к способу получения димерного белка или полипептида, как определено выше, причем данный способ включает:
а) трансфекцию полинуклеотида, как определено выше, в популяцию клеток;
b) культивирование популяции клеток;
с) сбор и очистку димерного белка или полипептида, экспрессируемого из популяции клеток.
В других вариантах осуществления изобретения вакцина содержит полинуклеотид, и, соответственно, в девятом аспекте настоящее изобретение относится к способу получения вакцины, такой как ДНК- или РНК-вакцина, содержащей иммунологически эффективное количество полинуклеотида, причем упомянутый способ включает:
a) получение полинуклеотида, как определено выше;
b) смешивание полинуклеотида, полученного на стадии а) в фармацевтически приемлемом носителе, разбавителе или буфере, получая таким образом вакцину.
В десятом аспекте настоящее изобретение относится к способу лечения рака у пациента, причем данный способ включает введение пациенту, нуждающемуся в этом, вакцины, как определено выше. В альтернативном десятом аспекте настоящее изобретение относится к вакцине, как определено выше, для применения в способе лечения рака.
Описание чертежей
Фигура 1 показывает схематическое изображение димерного белка в соответствии с настоящим изобретением, имеющего 3, 10 или 20 неоэпитопов на каждом мономере, соответственно.
Фигура 2 показывает, что вакцительные белки на основе неоантигенов продуцируются и секретируются в качестве функциональных гомодимеров после трансфекции клеток HEK293 конструкциями VB10.NEO. На верхних левых панелях фигуры 2 показаны Вестерн-блоты конструкций VB10.NEO CT26-X (VB4001) и VB10.NEO В16-Х (VB4003), включающих 10 неоэпитопов, и на нижних левых панелях фигуры 2 показаны Вестерн-блоты конструкций VB10.NEO CT26-III (VB4002) и VB10.NEO B16-III (VB4004), включающих 3 неоэпитопа. Образование функциональных гомодимеров показано на левых панелей Вестерн-блотов для каждой конструкции (- восстанавливающий агент). Правые панели иллюстрируют мономеры (+ восстанавливающий агент). На правых панелях фигуры 2 показаны результаты двух ELISA экспериментов по обнаружению вакцительных белков в надосадочной жидкости из клеток HEK293, трансфицированных конструкциями VB10.NEO. Верхняя правая панель показывает уровень экспрессии конструкций VB10.NEO СТ26, VB4001 и VB4002, и нижняя правая панель показывает уровень экспрессии конструкций VB10.NEO В16, VB4003 и VB4004.
Фигура 3 иллюстрирует, что сильные и обширные T-клеточные ответы индуцируются после однократной инъекции вакцительных ДНК-вакцин, содержащих 10 неоэпитопов, при сравнении с вакцительными ДНК-вакцинами, содержащими 3 неоэпитопа. Левая панель отображает IFN-γ-ответы, направленные против отдельных неоэпитопов, в модели меланомы В16, после инъекции конструкций VB10.NEO B16-III (VB4004) или VB10.NEO B16-X (VB4003), содержащих 3 и 10 неоэпитопов, соответственно. Правая панель отображает IFN-γ-ответы, направленные против неоэпитопов, в модели карциномы CT26 толстой кишки, после инъекции конструкций VB10.NEO CT26-III (VB4002) или VB10.NEO CT26-X (VB4001), содержащих 3 и 10 неоэпитопов, соответственно. Ось X представляет 10 различных неоэпитопов, pepM1-M10.
VB10.NEO CT26-X = VB4001 = CT26 pepM1-M10,
VB10.NEO CT26-III = VB4002 = CT26 pepM1-M3,
VB10.NEO B16-X = VB4003 = B16 pepM1-M10,
VB10.NEO B16-III = VB4004 = B16 pepM1-M3.
Фигура 4 иллюстрирует, что вакцительная ДНК-вакцина, содержащая 10 неоэпитопов, индуцирует более сильный и широкий общий иммунный ответ, чем вакцительная ДНК-вакцина, содержащая только 3 неоэпитопа. Верхняя панель: Сравнение иммунных ответов, направленных против неоэпитопов в модели меланомы В16, после инъекции конструкции VB10.NEO B16-X, содержащей 10 неоэпитопов (VB4003), и конструкции VB10.NEO B16-III, содержащей 3 неоэпитопа (VB4004), соответственно. Нижняя панель: Сравнение иммунных ответов, направленных против неоэпитопов в модели карциномы толстой кишки CT26, после инъекции конструкции ING VB10.NEO CT26-X, содержащей 10 неоэпитопов (VB4001), и конструкции VB10.NEO CT26-III, содержащий 3 неоэпитопов (VB4002), соответственно.
VB10.NEO CT26-X = VB4001 = CT26 pepM1-M10,
VB10.NEO CT26-III = VB4002 = CT26 pepM1-M3,
VB10.NEO B16-X = VB4003 = B16 pepM1-M10,
VB10.NEO B16-III = VB4004 = B16 pepM1-M3.
Фигура 5. Вакцительные ДНК-вакцины, содержащие 10 неоэпитопов, вызывают гораздо более сильный иммунный ответ, чем смесь соответствующих 10 пептидов плюс адъювант. Верхняя панель: Сравнение уровня экспрессии вакцител двух вариантов VB10.NEO B16-X с переменным порядком 10 неоэпитопов (VB4003 и VB4014) в надосадочной жидкости клеток НЕК293, трансфицированных соответствующими вакцительными ДНК-конструкциями, детектированного с помощью сэндвич-ELISA. В VB4003 гидрофобные и гидрофильные неоэпитопы размещаются попеременно, тогда как в VB4014 гидрофобные неоэпитопы размещаются по центру в неоэпитопном антигенном модуле. Гидрофобное ядро неоэпитопов в антигенном модуле может улучшить экспрессию и секрецию функциональных вакцительных белков в тех же самых конструкциях. Нижняя панель: Гистограмма показывает иммунные ответы, индуцированные ДНК-вакцинами VB10.NEO В16-Х VB4003 и VB4014, и смесью 10 пептидов плюс адъювант (те же самые 10 неоэпитопов, закодированные в конструкциях VB10.NEO В16-X). Порядок расположения неоэпитопов в неоэпитопном антигенном модуле не изменяет иерархию иммуногенности отдельных неоэпитопов.
VB10.NEO B16-X = VB4003 = B16 pepM1-M10,
VB10.NEO B16 - X = VB4014 = B16 гидрофобное ядро
(pepM9+pepM5+pepM1+pepM4+pepM6+pepM8+pepM10+pepM3+pepM7+pepM2).
Фигура 6. ДНК-вакцина VB10.NEO B16-X, причем 10 неоэпитопов разделены 10-аминокислотными (аа) линкерами (VB4011), индуцируют более сильный общий иммунный ответ, по сравнению с ДНК-вакциной VB10.NEO B16-X, причем 10 неоэпитопов разделены 5-аа линкерами (VB4003). Верхняя панель: Сравнение уровня экспрессии вакцител VB4003 и VB4011 в надосадочной жидкости клеток HEK293, трансфицированных соответствующими вакцительными ДНК-конструкциями, детектированного с помощью сэндвич-ELISA. Аналогичные экспрессия и секреция функциональных вакцительных белков наблюдаются для VB4003 и VB4011. Нижняя панель: Гистограмма, показывающая IFN-γ иммунный ответ, направленный против неоэпитопов из модели B16 меланомы у мышей, инъецированных конструкциями VB4003 или VB4011. Однократная инъекция вакцительными ДНК-вакцинами, содержащими 10 неоэпитопов, разделенных 10-аминокислотными линкерами, приводила к самому сильному полному иммунному ответу. Пустой вектор был включен в качестве отрицательного контроля.
VB10.NEO B16-X = VB4003 = B16 pepM1-M10, 5-aa линкер
VB10.NEO B16-X = VB4011 = B16 pepM1-M10, 10-aa линкер
Фигура 7. Вакцительная ДНК-вакцина, содержащая 2x10 неоэпитопов (VB4018), индуцирует более широкий иммунный ответ против отдельных неоэпитопов по сравнению с вакцительной ДНК-вакциной, содержащей 1x 10 неоэпитопов (VB4003). Верхняя панель: Сравнение уровней экспрессии вакцительных конструкций VB10.NEO B16-X (VB4003) и VB10.NEO B16-XX (VB4018) в надосадочной жидкости клеток НЕК293, трансфицированных соответствующими вакцительными ДНК-конструкциями, детектированных с помощью сэндвич-ELISA. Нижняя панель: Гистограмма, показывающая IFN-γ иммунный ответ, направленный против неоэпитопов из модели B16 меланомы у мышей, инъецированных конструкциями VB4003 или VB4018. Преимущество включения 2-х копий каждого неоэпитопа ограничено относительно полного иммунного ответа, однако, более широкий иммунный ответ наблюдается в отношении отдельных неоэпитопов.
Пустой вектор включен в качестве отрицательного контроля.
VB10.NEO B16-X = VB4003 = B16 pepM1-M10, 5-aa линкер
VB10.NEO B16-XX = VB4018 = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
Фигура 8. Несколько копий каждого неоэпитопа в конструкции вакцитела дают более однородный иммунный ответ против 5 выбранных лучших неоэпитопов. Верхняя панель: Сравнение уровня экспрессии вакцительных конструкций VB10.NEO B16-X (VB4003 и VB4011), VB10.NEO B16-XX (VB4018), VB10.NEO B16-Vx2 (VB4019) и VB10.NEO B16-Vx4 в надосадочной жидкости клеток HEK293, трансфицированных соответствующими вакцительными ДНК-конструкциями, детектированного с помощью сэндвич-ELISA. Нижняя панель: гистограмма, показывающая IFN-γ иммунные ответы против 5 неоэпитопов из модели меланомы B16 (PepM3, PepM4, PepM7, PepM9 и PepM10) у мышей, которым вводили 5 различных вакцительных ДНК-вакцин, которые включают данные 5 неоэпитопов, но в разном контексте. Пустой вектор включен в качестве отрицательного контроля. На фигуре показано, что несколько копий каждого неоэпитопа, как наблюдается для конструкций вакцител VB4019 (Vx2) и VB4021 (Vx4), опосредуют более равномерный иммунный ответ, направленный против 5 общих неоэпитопов, по сравнению с декатопом VB4003, причем 5 выбранных неоэпитопов представлены один раз. Однако, конструкция, содержащая 10 различных неоэпитопов (т.е. только одна копия 5 неоэпитопов, испытанная в данном анализе), таким образом, что важно, с увеличенной длиной линкера (10 аминокислот, VB4011), индуцирует наиболее сильный общий иммунный ответ, направленный против 5 общих неоэпитопов.
VB10.NEO B16-X = VB4003 = B16 pepM1-M10, 5-aa линкер
VB10.NEO B16-X = VB4011 = B16 pepM1-M10, 10-aa линкер
VB10.NEO B16-XX = VB4018 = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
VB10.NEO B16-Vx2 = VB4019 = B16 pepM3+M4+M7+M9+M10 x 2, 5-aa линкер
VB10.NEO B16-Vx4 = VB4021 = B16 pepM3+M4+M7+M9+M10 x 4, 5-aa линкер
Фигура 9 иллюстрирует, что вакцитело VB4018, включающее 20 неоэпитопов, экспрессируются на том же уровне, что и вакцитело VB4017, содержащее 10 неоэпитопов. Вакцительные белки обнаруживаются в надосадочной жидкости клеток HEK293, трансфицированных различными вакцительными ДНК-конструкциями, с помощью сэндвич-ELISA.
VB10.NEO B16-X = VB4017 = B16 pepM1-M4+M11+M6-M10, 5-aa линкер
VB10.NEO B16-XX = VB4018 = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
Фигура 10. Сравниваются уровни экспрессии различных конструкций вакцител, содержащих 3 неоэпитопа. Вакцительные белки обнаруживаются в надосадочной жидкости клеток HEK293, трансфицированных различными вакцительными ДНК-конструкциями, с помощью сэндвич-ELISA. Верхняя панель: Улучшенная экспрессия и секреция функциональных вакцительных белков наблюдается, когда 3 неоэпитопа разделены 10-aa линкером (VB4012) по сравнению с 5-aa линкером (VB4004). Нижняя панель: Фигура иллюстрирует, что изменение порядка следования неоэпитопов может повлиять на экспрессию вакцител.
VB10.NEO B16-III = VB4004 = B16 pepM1-M3, 5-aa линкер
VB10.NEO B16-III = VB4012 = B16 pepM1-M3, 10-aa линкер
VB10.NEO B16-III = VB4015 = B16 pepM1+M8+M3, 5-aa линкер
VB10.NEO B16-III = VB4016 = B16 pepM1+M3+M2, 5-aa линкер
Фигура 11 иллюстрирует иммунные ответы у мышей с меланомой B16, которые индуцируются после однократной инъекции вакцительными ДНК-вакцинами, включающими либо 10 неоэпитопов (VB4011), 15 неоэпитопов (VB4024), либо 20 неоэпитопов (VB4025). Верхняя панель: Уровни экспрессии испытанных конструкций вакцител, содержащих 10-, 15- или 20 неоэпитопов. Вакцительные белки обнаруживаются в надосадочной жидкости клеток HEK293, трансфицированных различными вакцительными ДНК-конструкциями, с помощью сэндвич-ELISA. Нижняя панель: Общий иммунный ответ, направленный против неоэпитопов, у мышей, которым вводили кандидатные ДНК-вакцины VB10. NEO B16-XV, включающую 15 неоэпитопов (VB4024,) или VB10. NEO B16-XX, содержащую 20 неоэпитопов (VB4025), по сравнению с VB10. NEO B16-X, включающей 10 неоэпитопов (VB4011). На фигуре показано общее количество IFN-γ-пятен на 106 спленоцитов. В качестве отрицательного контроля мышам вводили «пустой» вектор, не содержащий неоэпитопов. На фигуре показано, что вакцительные ДНК-вакцины, содержащие 20 неоэпитопов, индуцируют более сильный и более широкий общий иммунный ответ, чем вакцительные ДНК-вакцины, содержащие только 10 неоэпитопов.
Фигура 12 иллюстрирует иммунные ответы у мышей с карциномой толстой кишки CT26, которые индуцируются после однократной инъекции вакцительными ДНК-вакцинами, включающими либо 10 неоэпитопов (VB4009), 15 неоэпитопов (VB4026), либо 20 неоэпитопов (VB4027). Верхняя панель: Экспрессионные уровни испытанной конструкции вакцитела VB10.NEO СТ26-X, содержащей 10 неоэпитопов (левая панель) и конструкций вакцител VB10.NEO СТ26-XV и XX, содержащих 15 и 20 неоэпитопов, соответственно (правая панель). Нижняя панель: Общий иммунный ответ, направленный против неоэпитопов в модели карциномы CT26 толстой кишки у мышей, инъецированных кандидатными ДНК-вакцинами VB10. NEO CT26-XV, содержащей 15 неоэпитопов (VB40 26), или VB10. NEO CT26-XX, содержащей 20 неоэпитопов (VB402 7), по сравнению с VB10. NEO CT26-X, содержащей 10 неоэпитопов (VB40 09). На фигуре показано общее количество IFN-γ-пятен на 106 спленоцитов. В качестве отрицательного контроля мышам вводили пустой вектор, не содержащий неоэпитопов. На фигуре показано, что вакцительные ДНК-вакцины, содержащие 20 или 15 неоэпитопов, индуцируют более сильный и более широкий общий иммунный ответ, чем вакцительные ДНК-вакцины, содержащие только 10 неоэпитопов.
NEO CT26-X = VB4009 = CT26 pepM1-M10, 10-aa линкер
NEO CT26-XV = VB4026 = CT26 pepM1-M15, 10-aa линкер
NEO CT26-XX = VB4027 = CT26 pepM1-M20, 10-aa линкер
Фигура 13 иллюстрирует, что мыши, дважды иммунизированные кандидатами на вакцину VB10.NEO, содержащими 10 неоэпитопов, способны значительно замедлять и уменьшать рост опухоли в a) модели меланомы B16 и b) модели карциномы толстой кишки CT26 по сравнению со служащими отрицательным контролем мышами, получающими только PBS. На фигуре показано развитие объема опухоли с течением времени. В эксперименте с карциномой толстой кишки CT26 мышей разделили на респондентов, которые смогли стабилизировать рост опухоли, и нереспондентов.
Определения
Опухоль используется в настоящем контексте как для солидной опухоли, так и для опухолевых клеток, обнаруженных в жидкости тела, такой как кровь.
Опухолевый неоантиген используется для любого опухолеспецифического антигена, содержащего одну или более мутаций по сравнению с геномом хозяина, и используется синонимично с термином раковый неоантиген.
Опухолевый неопептид используется для любой иммуногенной мутации в опухолевом антигене и используется синонимично с термином раковый неоэпитоп.
Опухолевая неоэпитопная последовательность используется для описания последовательности, содержащей неоэпитоп в антигенной субъединице, и используется синонимично с термином раковая неоэпитопная последовательность.
Терапевтическая противораковая вакцина используется, чтобы описать то, что данная вакцина применяется для уменьшения или уничтожения опухолевых клеток, уже присутствующих у пациента.
Подробное описание изобретения
Рак развивается из нормальной ткани пациента одной или несколькими клетками, начиная с аномальной неконтролируемой пролиферации клеток из-за мутаций. Хотя раковые клетки мутированы, большая часть генома остается нетронутой и идентична остальным клеткам у пациента. Данный факт также служит объяснением некоторых неудач в предыдущих попытках разработать противораковую вакцину, а именно того, что вакцина в какой-то степени также направлена на нормальные клетки пациента. Как обсуждалось выше, подход, заключающийся в атаке на опухоль, как определено в настоящем изобретении, заключается в использовании знаний о том, что любая опухоль, из-за мутаций, экспрессирует мутированные белки, так называемые неоантигены, которые не идентичны ни одному из белков в нормальных клетках пациента, и поэтому неоантигены являются эффективными мишенями для терапевтической противораковой вакцины. Мутации, обнаруженные в опухоли, обычно очень индивидуальны, и, соответственно, вакцина в соответствии с настоящим изобретением персонализирована для применения только у пациента, имеющего рассматриваемую мутацию.
Вакцины согласно настоящему изобретению используют нормальную адаптивную иммунную систему для обеспечения иммунитета против опухолевых клеток. Адаптивная иммунная система специфична тем, что каждый чужеродный антиген вызывает иммунный ответ, направленный конкретно против упомянутого чужеродного антигена, посредством распознавания специфических «не своих» (non-self) антигенов во время процесса, называемого презентацией (представлением) антигена. Клетками адаптивной иммунной системы являются лимфоциты, в частности, В-клетки и Т-клетки. В-клетки участвуют в гуморальном иммунном ответе, тогда как Т-клетки участвуют в клеточно-опосредованном иммунном ответе.
В частности, вакцина в соответствии с настоящим изобретением предназначена для вызывания клеточно-опосредованного иммунного ответа посредством активации Т-клеток против неоантигенов. Т-клетки распознают неоэпитопы после того как они были обработаны и представлены в комплексе с молекулой МНС, как обсуждается ниже.
Основной комплекс гистосовместимости (MHC)
Неоэпитопы в соответствии с настоящим изобретением предназначены для презентации в МНС-неоэпитопных комплексах. Существует два основных класса молекул главного комплекса гистосовместимости (major histocompatibility complex (MHC)), MHC I и MHC II.
MHC I найден на клеточной поверхности всех имеющих ядро клеток в организме. Одна из функций MHC I состоит в том, чтобы демонстрировать пептиды «не своих», находящихся внутри клеток белков цитотоксическим Т-клеткам. МНС I в комплексе с пептидом находится в плазматической мембране клетки, презентируя пептид цитотоксическим Т-клеткам, посредством чего инициируется активация цитотоксических Т-клеток против конкретного комплекса МНС-пептид. Пептид расположен внутри имеющейся в молекуле МНС I бороздке, позволяющей пептиду иметь длину около 8-10 аминокислот.
Молекулы MHC II представляют собой семейство молекул, которые обычно обнаруживаются только на антигенпрезентирующих клетках, таких как дендритные клетки, мононуклеарные фагоциты, некоторые эндотелиальные клетки, тимические эпителиальные клетки и В-клетки.
В противоположность MHC I, антигены, презентируемые пептидами класса II, происходят из внеклеточных белков. Внеклеточные белки подвергаются эндоцитозу, расщепляются в лизосомах, и полученные антигенные пептиды "загружаются" на молекулы МНС класса II, а затем презентируются на поверхности клетки. Антигенсвязывающая бороздка молекул МНС класса II открыта с обоих концов и способна презентировать более длинные пептиды, обычно длиной от 15 до 24 аминокислотных остатков.
Молекулы МНС класса I распознаются CD8 и корецепторами на Т-клетках, обычно называемых CD8+ клетками, тогда как молекулы MHC класса II распознаются CD4 и корецепторами на Т-клетках, обычно называемых CD4+ клетками.
Вакцины
Неоантигенные вакцины по настоящему изобретению содержат полинуклеотид, кодирующий полипептид, содержащий три единицы, то есть единицу нацеливания, единицу димеризации (димеризационный мотив) и антигенную единицу. Благодаря димеризационному мотиву полипептид образует димерный белок, называемый вакцителом.
Гены, кодирующие три единицы, генетически модифицированы, чтобы экспрессироваться как один ген. При экспрессии in vivo полипептиды/димерные белки нацеливаются на антигенпрезентирующие клетки (antigen presenting cells (APC)), что приводит к усилению активности вакцины по сравнению с идентичными нецелевыми антигенами.
Настоящее изобретение относится к вакцинам, в которых антигенная единица содержит антигенные субъединицы, причем каждая субъединица содержит раковую неоэпитопную последовательность или, по меньшей мере, часть раковой неоэпитопной последовательности. Неоэпитопную последовательность получают секвенированием опухолевой ДНК или РНК и выявлением опухолеспецифических мутаций, представляющих неоантигены. Таким образом, получают персонализированную неоантигенную вакцину, которая специально нацелена на идентифицированные опухолевые антигены.
Один аспект настоящего изобретения относится к терапевтической противораковой неоэпитопной вакцине, содержащей иммунологически эффективное количество
полинуклеотида, содержащего нуклеотидную последовательность, кодирующую:
- единицу нацеливания,
- единицу димеризации,
- первый линкер,
- антигенную единицу, причем указанная антигенная единица содержит n-1 антигенных субъединиц, причем каждая субъединица содержит, по меньшей мере, часть раковой неоэпитопной последовательности и второй линкер, и указанная антигенная единица дополнительно содержит окончательную раковую неоэпитопную последовательность, причем n представляет собой целое число от 3 до 50;
или
полипептида, кодируемого полинуклеотидом, как определено в 1), или
димерного белка, состоящего из двух полипептидов, кодируемых полинуклеотидом, как определено в 1).
Таким образом, вакцина содержит n неоэпитопов или неоэпитопных последовательностей и n-1 вторых линкеров, причем n представляет собой целое число от 3 до 50.
Антигенная единица
Антигенная единица согласно настоящему изобретению содержит множество опухолевых неоэпитопов, причем каждый неоэпитоп соответствует мутации, идентифицированной в опухолевом неоантигене. Мутацией может быть любая мутация, приводящая к изменению по меньшей мере одной аминокислоты. Соответственно, мутация может быть одной из следующих:
- несинонимическая мутация, приводящая к изменению в аминокислоте,
- мутация, приводящая к сдвигу рамки и, тем самым, к совершенно другой открытой рамке считывания в направлении после мутации,
- сквозная мутация, в которой стоп-кодон модифицируется или удаляется, приводя к более длинному белку с опухолеспецифическим неоэпитопом,
- сращивание мутаций, что приводит к уникальной опухолеспецифической последовательности белка,
- хромосомные перегруппировки, которые приводят к образованию химерного белка с опухолеспецифическим неоэпитопом на стыке двух белков.
В антигенной единице все опухолевые неоэпитопы, кроме последнего, расположены в антигенных субъединицах, причем каждая субъединица состоит из опухолевой неоэпитопной последовательности и второго линкера, тогда как последняя субъединица содержит только неоэпитоп, то есть без такого второго линкера. Из-за разделения опухолевой неоэпитопных последовательностей упомянутым вторым линкером каждый неоэпитоп представлен оптимальным образом в иммунной системе, благодаря чему обеспечивается эффективность вакцины, как описано ниже.
Раковая неоэпитопная последовательность предпочтительно имеет длину, подходящую для презентации молекулами МНС, рассмотренными выше. Таким образом, в предпочтительном варианте осуществления раковый неоэпитоп имеет длину от 7 до 30 аминокислот. Более предпочтительными являются раковые неоэпитопные последовательности, имеющие длину от 7 до 10 аминокислот, или раковые неоэпитопные последовательности, имеющие длину от 13 до 30 аминокислот.
Чтобы избежать уклонения опухолей от воздействия иммунной системы путем выключения экспрессии мутированного гена, если вакцина направлена на продукт экспрессии упомянутого гена, предпочтительно включать в антигенную субъединицу множество неоэпитопов. В общем, чем больше генов приходится выключать опухоли, тем меньше вероятность того, что опухоль способна выключить все из них и все еще сможет размножаться или даже выживать. Кроме того, опухоль может быть гетерогенной в том, что не каждый неоантиген экспрессируется всеми опухолевыми клетками. Соответственно, в соответствии с настоящим изобретением, подход должен включать как можно больше неоэпитопов в вакцину для эффективной борьбы с опухолью. Кроме того, чтобы гарантировать, что все неоэпитопы эффективно загружаются в одну и ту же антигенпрезентирующую клетку, они расположены как одна аминокислотная цепь, а не как дискретные пептиды. Однако, как описано выше, задачей вакцины является активация Т-клеток против неоэпитопов, и Т-клетки могут быть разбавлены в том случае, если в вакцину включено слишком много неоэпитопов, и поэтому необходим баланс для обеспечения вакцины с оптимальным количеством неоэпитопов в антигенной единице.
Как обсуждается ниже более подробно, опухолевый экзом анализируют для идентификации неоантигенов, а затем выбирают наиболее антигенные неоэпитопы. Автор настоящего изобретения обнаружил, что по меньшей мере 3 неоэпитопа должны быть выбраны для включения в вакцину, например, по меньшей мере 5 неоэпитопов, например, по меньшей мере 7 неоэпитопов, например, по меньшей мере 10 неоэпитопов, чтобы иметь возможность эффективно «поражать» по существу все опухолевые клетки.
Кроме того, авторы настоящего изобретения обнаружили, что увеличение количества неоэпитопов в конструкциях вакцин от 3 неоэпитопов до 10 неоэпитопов приводит к неожиданному увеличению иммунного ответа (см. фигуру 4). Кроме того, было обнаружено, что увеличение количества неоэпитопов в конструкциях вакцин от 10 неоэпитопов до 15 или 20 неоэпитопов приводит к дальнейшему увеличению иммунного ответа (см. фигуры 11 и 12)
Таким образом, в предпочтительном варианте осуществления вакцина в соответствии с настоящим изобретением содержит по меньшей мере 10 неоэпитопов. В другом предпочтительном варианте осуществления вакцина в соответствии с настоящим изобретением содержит по меньшей мере 15 неоэпитопов, например, по меньшей мере 20 неоэпитопов.
В одном варианте осуществления от 3 до 50 неоэпитопов включены в вакцину, чтобы получить наиболее эффективный иммунный ответ без разбавления Т-клеток, например, от 3 до 30 неоэпитопов, например, от 3 до 20 неоэпитопов, например, от 3 до 15 неоэпитопов, например, от 3 до 10 неоэпитопов, и, следовательно, n предпочтительно представляет собой целое число от 3 до 50, такое как от 3 до 30, такое как от 5 до 25, такое как от 3 до 20, такое как от 3 до 15, такое как от 3 до 10.
В другом варианте осуществления от 5 до 50 неоэпитопов могут быть включены в вакцину для получения наиболее эффективного иммунного ответа без разбавления Т-клеток, например, от 5 до 30 неоэпитопов, например, от 5 до 25 неоэпитопов, например, от 5 до 20 неоэпитопов, например, от 5 до 15 неоэпитопов, например, от 5 до 10 неоэпитопов, и, следовательно, n предпочтительно представляет собой целое число от 5 до 50, такое как от 5 до 30, такое как от 5 до 25, такое как от 5 до 20, такое как от 5 до 15, такое как от 5 до 10.
В еще одном варианте осуществления от 10 до 50 неоэпитопов могут быть включены в вакцину для получения наиболее эффективного иммунного ответа без разбавления Т-клеток, например, от 10 до 40 неоэпитопов, например, от 10 до 30 неоэпитопов, например, от 10 до 25 неоэпитопов, например, от 10 до 20 неоэпитопов, например, от 10 до 15 неоэпитопов, и, следовательно, n предпочтительно представляет собой целое число от 10 до 50, например, от 10 до 30, например, от 10 до 20, например, от 10 до 15 неоэпитопов.
Авторы настоящего изобретения показали, что вакцительные ДНК-вакцины, содержащие 10 неоэпитопов, индуцируют более сильный и более широкий общий иммунный ответ, чем вакцительные ДНК-вакцины, содержащие только 3 неоэпитопа (см. фигуру 4 и пример 2). Далее, увеличение количества неоэпитопов до более чем 20 может привести к менее эффективной вакцине из-за разбавления Т-клеток. Более того, включение более 20 неоэпитопов может быть связано с техническими трудностями.
Соответственно, в предпочтительном варианте осуществления настоящего изобретения вакцина содержит от 10 до 2 0 неоэпитопов.
В еще одном варианте осуществления в вакцину включены от 15 до 50 неоэпитопов для получения наиболее эффективного иммунного ответа без разбавления Т-клеток, например, от 15 до 30 неоэпитопов или, например, от 15 до 20 неоэпитопов, и, следовательно, n предпочтительно представляет собой целое число от 15 до 50, например, от 15 до 30 или, например, от 15 до 20 неоэпитопов.
В одном варианте осуществления антигенная единица содержит одну копию каждого ракового неоэпитопа, так что, когда 10 неоэпитопов включены в состав вакцины, может быть вызван клеточно-опосредованный иммунный ответ против 10 различных неоэпитопов.
Если, однако, идентифицированы только несколько соответствующих антигенных мутаций, то антигенная единица может содержать по меньшей мере две копии по меньшей мере одного неоэпитопа для усиления иммунного ответа на данные неоэпитопы. Также, ввиду производственных и регуляторных причин, поддержание длины плазмиды и, следовательно, антигенной единицы постоянной может быть преимуществом, и поэтому может быть преимущественным включение более одной копии одного и того же неоэпитопа в антигенную единицу.
Как обсуждалось выше, может быть преимуществом поддерживать длину антигенной единицы постоянной, и поэтому в одном варианте осуществления предпочтительно, чтобы все раковые неоэпитопные последовательности имели одинаковую длину. Однако, если один или более неоэпитопов являются результатом мутации, приводящей к сдвигу рамки считывания или мутации стоп-кодонов, неоэпитоп может иметь значительную длину, например, состоя, по меньшей мере, из мутированной части белка, наиболее антигенной части мутированного белка или, возможно, всего мутированного белка, причем длина по меньшей мере одного из неоэпитопов существенно больше, чем неоэпитопов, возникающих из-за несинонимической точечной мутации.
Длина антигенной единицы, в основном, определяется длиной неоэпитопов и количеством неоэпитопов, расположенных в антигенной единице, и составляет от около 21 до около 1500, предпочтительно от около 30 аминокислот до около 1000 аминокислот, более предпочтительно от около 50 до около 500 аминокислот, например от около 100 до около 400 аминокислот, от около 100 до около 300 аминокислот.
В частности, когда неоэпитоп короткий, например, несколько аминокислот в длину, раковая неоэпитопная последовательность включает неоэпитоп, фланкированный с обеих сторон аминокислотной последовательностью. Предпочтительно, неоэпитоп расположен, по существу, посередине раковой неоэпитопной последовательности, чтобы гарантировать, что неоэпитоп презентируется антигенпрезентирующими клетками после обработки. Аминокислотные последовательности, фланкирующие неоэпитоп, предпочтительно представляют собой аминокислотные последовательности, фланкирующие неоэпитоп в неоантигене, в результате чего раковая неоэпитопная последовательность является истинной подпоследовательностью раковой неоантигеновой аминокислотной последовательности.
Хотя возможно получить соответствующий иммунный ответ на опухоль, если неоэпитопы случайным образом расположены в антигенной субъединице, предпочтительно следовать, по меньшей мере, одному из следующих способов для упорядочения неоэпитопов в антигенной единице с целью усиления иммунного ответа.
В одном варианте осуществления, в зависимости от выбранных неоэпитопов, антигенные субъединицы расположены в порядке от более антигенной до менее антигенной в направлении от первого линкера к последнему неоэпитопу.
В другом варианте осуществления, в частности, если среди неоэпитопов сильно варьирует гидрофильность/гидрофобность, предпочтительно, чтобы наиболее гидрофобная(ые) антигенная(ые) субъединица(ы) по существу находила(и)сь посередине антигенной единицы, и наиболее гидрофильная(ые) антигенная(ые) субъединица(ы) находилась(находились) в начале и/или в конце антигенной единицы. Альтернативно, неоэпитопы могут быть расположены в чередующемся порядке между гидрофильным и гидрофобным неоэпитопом.
Кроме того, GC-обогащенные неоэпитопы должны быть отделены друг от друга так, чтобы избежать GC-кластеров, предпочтительно GC-обогащенные неоэпитопы разделены по меньшей мере одной субъединицей.
Второй линкер сконструирован так, чтобы быть неиммуногенным и предпочтительно также является гибким линкером, в результате чего опухолевые неопептиды, несмотря на большое количество антигенных субъединиц, присутствующих в антигенной единице, оптимально презентируются Т-клеткам. Предпочтительно, длина второго линкера составляет от 4 до 20 аминокислот для обеспечения гибкости. В другом предпочтительном варианте осуществления длина второго линкера составляет от 8 до 20 аминокислот, например, от 8 до 15 аминокислот, например, от 8 до 12 аминокислот или, например, от 10 до 15 аминокислот. В конкретном варианте осуществления длина второго линкера составляет 10 аминокислот.
В конкретном варианте осуществления вакцина по настоящему изобретению включает в себя 10 неоэпитопов, причем вторые линкеры имеют длину от 8 до 20 аминокислот, например, от 8 до 15 аминокислот, например, от 8 до 12 аминокислот или, например, от 10 до 15 аминокислот. В конкретном варианте осуществления вакцина по настоящему изобретению включает в себя 10 неоэпитопов, и причем вторые линкеры имеют длину 10 аминокислот.
Второй линкер предпочтительно идентичен во всех антигенных субъединицах. Если, однако, один или более неоэпитопов содержат аминокислотный мотив, подобный линкеру, может оказаться преимуществом заменить соседние вторые линкеры вторым линкером другой последовательности. Кроме того, если предсказано, что стык неоэпитопа со вторым линкером будет представлять собой эпитоп само по себе, может быть использован второй линкер другой последовательности.
Второй линкер предпочтительно представляет собой серин-глициновый линкер, такой как гибкий GGGGS-линкер, такой как GGGSS, GGGSG, GGGGS или их несколько вариантов осуществления, такие как GGGGSGGGGS или (GGGGS)m, (GGGSS)m, (GGGSG)m, причем m представляет собой целое число от 1 до 5, от 1 до 4 или от 1 до 3. В предпочтительном варианте осуществления m равно 2.
В предпочтительном варианте осуществления серин-глициновый линкер дополнительно содержит по меньшей мере один лейцин (L), например, по меньшей мере 2 или по меньшей мере 3 лейцина. Серин-глициновый линкер может, например, содержать 1, 2, 3 или 4 лейцин. Предпочтительно, серин-глициновый линкер содержит 1 лейцин или 2 лейцина.
В одном варианте осуществления второй линкер содержит или состоит из последовательности LGGGS, GLGGS, GGLGS, GGGLS или GGGGL. В другом варианте осуществления второй линкер содержит или состоит из последовательности LGGSG, GLGSG, GGLSG, GGGLG или GGGSL. В еще одном варианте осуществления второй линкер содержит или состоит из последовательности LGGSS, GLGSS, GGLSS, GGGLS или GGGSL.
В еще одном варианте осуществления второй линкер содержит или состоит из последовательности LGLGS, GLGLS, GLLGS, LGGLS или GLGGL. В другом варианте осуществления второй линкер содержит или состоит из последовательности LGLSG, GLLSG, GGLSL, GGLLG или GLGSL. В еще одном варианте осуществления второй линкер содержит или состоит из последовательности LGLSS, GLGLS, GGLLS, GLGSL или GLGSL.
В другом варианте осуществления настоящего изобретения второй серин-глициновый линкер имеет длину 10 аминокислот и содержит 1 лейцин или 2 лейцина.
В одном варианте осуществления второй линкер содержит или состоит из последовательности LGGGSGGGGS, GLGGSGGGGS, GGLGSGGGGS, GGGLSGGGGS или GGGGGGGGGS. В другом варианте осуществления второй линкер содержит или состоит из последовательности LGGSGGGGSG, GLGSGGGGSG, GGLSGGGGSG, GGGLGGGGSG или GGGSLGGGSG. В еще одном варианте осуществления второй линкер содержит или состоит из последовательности LGGSSGGGSS, GLGSSGGGSS, GGLSSGGGSS, GGGLSGGGSS или GGGSLGGGSS.
В другом варианте осуществления второй линкер содержит или состоит из последовательности LGGGSLGGGS, GLGGSGLGGS, GGGGGGGGGS, GGGLSGGGLS или GGGGLGGGGL. В другом варианте осуществления второй линкер содержит или состоит из последовательности LGGSGLGGSG, GLGSGGLGSG, GGLSGGGLSG, GGGLGGGGLG или GGGSLGGGSL. В еще одном варианте осуществления второй линкер содержит или состоит из последовательности LGGSSLGGSS, GLGSSGLGSS, GGLSSGGLSS, GGGLSGGGLS или GGGSLGGGSL.
В предпочтительном варианте осуществления вакцина в соответствии с настоящим изобретением содержит по меньшей мере 10 неоэпитопов, которые разделены 10-аминокислотными линкерами. В другом предпочтительном варианте осуществления вакцина в соответствии с настоящим изобретением содержит по меньшей мере 15 неоэпитопов, которые разделены 10-аминокислотными линкерами, например, по меньшей мере 20 неоэпитопов, которые разделены 10-аминокислотными линкерами.
В другом предпочтительном варианте осуществления вакцина содержит от 10 до 20 или от 10 до 25 неоэпитопов, которые разделены вторыми линкерами. Предпочтительно, упомянутые вторые линкеры представляют собой 10 аминокислот. Второй линкер также может иметь любую длину, определенную в настоящем описании выше, такую как, например, от 8 до 12 аминокислот.
Альтернативные линкеры могут быть выбраны из группы, состоящей из линкеров GSAT и линкеров SEG или их нескольких вариантов.
Единица нацеливания
Благодаря единице нацеливания, полипептид/димерный белок по изобретению приводит к привлечению дендритных клеток (DC), нейтрофилов и других иммунных клеток. Таким образом, полипептид/димерный белок, содержащий единицу нацеливания, не только нацеливает антигены на конкретные клетки, но дополнительно облегчает эффект усиления реакции (адъювантный эффект) путем рекрутирования специфических иммунных клеток к месту введения вакцины. Данный уникальный механизм имеет большое значение в клинических условиях, когда пациенты могут получать вакцину без каких-либо дополнительных адъювантов, поскольку сама вакцина оказывает адъювантное действие.
Используемый здесь термин «единица нацеливания» относится к единице, которая доставляет полипептид/белок с его антигеном в антигенпрезентирующую клетку для MHC класса-II рестриктированной презентации CD4+ Т-клеткам или для обеспечения перекрестной презентации CD8+ Т-клеткам при MHC класса-I рестрикции.
Единица нацеливания соединена через единицу димеризации с антигенной единицей, причем последняя находится либо в COOH-конце, либо в NH2-конце полипептида/димерного белка. Предпочтительно, чтобы антигенная единица находилась в COOH-конце полипептида/димерного белка.
Единица нацеливания предназначена, чтобы нацеливать полипептид/димерный белок по изобретению на поверхностные молекулы, экспрессируемые на соответствующих антигенпрезентирующих клетках, такие как молекулы, экспрессируемые исключительно на подмножествах дендритных клеток (DC).
Примерами таких целевых поверхностных молекул на APC являются человеческий лейкоцитарный антиген (human leukocyte antigen (HLA)), дифференцировочный кластер 14 (cluster of differentiation 14 (CD14)), дифференцировочный кластер 40 (cluster of differentiation 40 (CD40)), хемокиновые рецепторы и Toll-подобные рецепторы (Toll-like receptors (TLR)). HLA представляет собой основной комплекс гистосовместимости (major histocompatibility complex (MHC)) у людей. Toll-подобные рецепторы могут, например, включать TLR-2, TLR-4 и/или TLR-5.
Полипептид/димерный белок по изобретению может быть нацелен на упомянутые поверхностные молекулы с помощью единиц нацеливания, включающих, например, области связывания антитела со специфичностью для CD14, CD40 или Toll-подобного рецептора; лиганды, например растворимый CD40-лиганд; природные лиганды, такие как хемокины, например RANTES или MIP-1a; или бактериальные антигены, такие как, например, флагеллин.
В одном варианте осуществления единица нацеливания имеет сродство к белку MHC класса II. Таким образом, в одном варианте осуществления изобретения нуклеотидная последовательность, кодирующая единицу нацеливания, кодирует антительные вариабельные домены (VL и VH) со специфичностью для белков МНС класса II, выбранные из группы, состоящей из анти-HLA-DP, анти-HLA-DR и анти-HLA-II.
В другом варианте осуществления единица нацеливания имеет сродство к поверхностной молекуле, выбранной из группы, состоящей из CD40, TLR-2, TLR-4 и TLR-5. Таким образом, в одном варианте осуществления нуклеотидная последовательность, кодирующая единицу нацеливания, кодирует антительные вариабельные домены (VL и VH) со специфичностью для анти-CD40, анти-TLR-2, анти-TLR-4 и анти-TLR-5. В одном варианте осуществления нуклеотидная последовательность, кодирующая единицу нацеливания, кодирует флагеллин. Флагеллин имеет сродство к TLR-5.
Предпочтительно, единица нацеливания имеет сродство к хемокиновому рецептору, выбранному из CCR1, CCR3 и CCR5. Более предпочтительно, нуклеотидная последовательность, кодирующая единицу нацеливания, кодирует хемокин hMIP-1alpha (LD78beta), который связывается с его родственными рецепторами CCR1, CCR3 и CCR5, экспрессируемыми на поверхности клеток APC.
Связывание полипептида/димерного белка по изобретению с его родственными рецепторами приводит к интернализации в APC и деградации белков до небольших пептидов, которые загружаются на молекулы MHC и презентируются CD4+ и CD8+ T-клеткам, чтобы индуцировать опухолеспецифические иммунные ответы. После стимуляции и с помощью активированных CD4+ Т-клеток CD8+ Т-клетки будут нацеливаться и убивать опухолевые клетки, экспрессирующие те же неоантигены.
В одном варианте осуществления настоящего изобретения единица нацеливания содержит аминокислотную последовательность, имеющую по меньшей мере 80% идентичности последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1. В предпочтительном варианте осуществления единица нацеливания содержит аминокислотную последовательность, обладающей по меньшей мере 85% идентичностью последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере 89%, например, по меньшей мере 90%, например, по меньшей мере 91%, например, по меньшей мере 92%, например, по меньшей мере 93%, например, по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99% идентичностью последовательности.
В более предпочтительном варианте осуществления единица нацеливания состоит из аминокислотной последовательности, обладающей по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1, например, по меньшей мере 85%, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере 89%, например, по меньшей мере 90%, например, по меньшей мере 91%, например, по меньшей мере 92%, например, по меньшей мере 93% по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99%, например, по меньшей мере 100% идентичностью последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1.
Единица димеризации
Используемый в настоящем изобретении термин «единица димеризации» относится к последовательности аминокислот между антигенной единицей и единицей нацеливания. Таким образом, единица димеризации служит для соединения антигенной единицы и единицы нацеливания и облегчает димеризацию двух мономерных полипептидов в димерный белок. Кроме того, единица димеризации также обеспечивает гибкость в полипептиде/димерном белке, чтобы обеспечить оптимальное связывание единицы нацеливания с поверхностными молекулами на антигенпрезентирующих клетках (antigen presenting cells (APC)), даже если они расположены на разных расстояниях. Единица димеризации может быть любой единицей, которая удовлетворяет этим требованиям.
Соответственно, в одном варианте осуществления единица димеризации может содержать шарнирную область и необязательно другой домен, который облегчает димеризацию, и шарнирная область и другой домен могут быть связаны через третий линкер.
Термин «шарнирная область» относится к пептидной последовательности димерного белка, которая облегчает димеризацию. Шарнирная область функционирует как гибкая распорка между единицами, позволяющая двум единицам нацеливания одновременно связываться с двумя молекулами-мишенями на APC, даже если они экспрессируются с переменными расстояниями. Шарнирная область может быть получена из Ig, например, получена из IgG3. Шарнирная область может способствовать димеризации посредством образования ковалентной связи(ей), например дисульфидного мостика(ов). Таким образом, в одном варианте осуществления шарнирная область обладает способностью образовывать одну или более ковалентных связей. Ковалентная связь может представлять собой, например, дисульфидный мостик.
В одном варианте осуществления другой домен, который облегчает димеризацию, представляет собой иммуноглобулиновый домен, такой как карбокситерминальный С-домен, или последовательность, которая по существу идентична С-домену или его варианту. Предпочтительно, другой домен, который облегчает димеризацию, представляет собой карбокситерминальный С-домен, полученный из IgG.
Иммуноглобулиновый домен способствует димеризации посредством нековалентных взаимодействий, например гидрофобных взаимодействий. Например, иммуноглобулиновый домен обладает способностью образовывать димеры через нековалентные взаимодействия. Предпочтительно, нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
Предпочтительно, чтобы единица димеризации не содержала домен CH2.
В предпочтительном варианте осуществления единица димеризации состоит из шарнирных экзонов h1 и h4, соединенных через третий линкер с доменом CH3 человеческого IgG3.
В одном варианте осуществления настоящего изобретения единица димеризации содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 94-237 SEQ ID NO: 3. В предпочтительном варианте осуществления единица димеризации содержит аминокислотную последовательность, обладающую по меньшей мере 85% идентичностью последовательности с аминокислотной последовательностью 94-237 SEQ ID NO: 3, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере 89%, например, по меньшей мере 90%, например, по меньшей мере 91%, например, по меньшей мере 92%, например, по меньшей мере 93%, например, по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99% идентичностью последовательности.
В более предпочтительном варианте осуществления единица димеризации состоит из аминокислотной последовательности, обладающей по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 94-237 SEQ ID NO: 3, например, по меньшей мере 85%, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере, 89%, например, по меньшей мере 90%, например, по меньшей мере, 91%, например, по меньшей мере 92%, например, по меньшей мере 93%, например, по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99%, например, по меньшей мере 100% идентичностью последовательности с аминокислотной последовательностью 94-237 SEQ ID NO: 3.
В одном варианте осуществления третий линкер представляет собой линкер G3S2G3SG.
Следует понимать, что единица димеризации может иметь любую ориентацию относительно антигенной единицы и единицы нацеливания. В одном варианте осуществления антигенная единица находится в COOH-конце единицы димеризации с единицей нацеливания в N-концевом конце единицы димеризации. В другом варианте осуществления антигенная единица находится в N-конце единицы димеризации с единицей нацеливания в COOH-конце единицы димеризации. Предпочтительно, чтобы антигенная единица находилась в COOH-конце единицы димеризации.
Первый линкер
Антигенная единица и единица димеризации предпочтительно соединены через первый линкер. Первый линкер может содержать сайт рестрикции, чтобы облегчить конструкцию полинуклеотида. Предпочтительно, чтобы первый линкер был линкером GLGGL или линкером GLSGL.
Сигнальный пептид
В предпочтительном варианте осуществления полинуклеотид дополнительно содержит нуклеотидную последовательность, кодирующую сигнальный пептид. Сигнальный пептид сконструирован таким образом, чтобы обеспечить секрецию полипептида, кодируемого полинуклеотидом по изобретению, в клетках, трансфицированных упомянутым полинуклеотидом.
Можно использовать любой подходящий сигнальный пептид. Примерами подходящих пептидов являются сигнальный пептид Ig VH, такой как SEQ ID NO: 31, сигнальный пептид TPA человека, такой как SEQ ID NO: 32, и сигнальный пептид, содержащий аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 1-23 SEQ ID NO: 1.
В предпочтительном варианте осуществления сигнальный пептид содержит аминокислотную последовательность, обладающую по меньшей мере 85%, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере 89%, например, по меньшей мере 90%, например, по меньшей мере 91%, например, по меньшей мере 92%, например, по меньшей мере 93%, например, по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99%, например, 100% идентичностью последовательности с аминокислотной последовательностью 1-23 SEQ ID NO: 1.
В более предпочтительном варианте осуществления сигнальный пептид состоит из аминокислотной последовательности, обладающей по меньшей мере 80%, предпочтительно по меньшей мере 85%, например, по меньшей мере 86%, например, по меньшей мере 87%, например, по меньшей мере 88%, например, по меньшей мере 89%, например, по меньшей мере 90%, например, по меньшей мере 91%, например, по меньшей мере 92%, например, по меньшей мере 93%, например, по меньшей мере 94%, например, по меньшей мере 95%, например, по меньшей мере 96%, например, по меньшей мере 97%, например, по меньшей мере 98%, например, по меньшей мере 99%, например, 100% идентичностью последовательности с аминокислотной последовательностью 1-23 SEQ ID NO: 1.
Идентичность последовательности
Идентичность последовательности может быть определена следующим образом: высокий уровень идентичности последовательности указывает на вероятность того, что первая последовательность получена из второй последовательности. Идентичность аминокислотных последовательностей требует идентичных аминокислотных последовательностей между двумя выровненными последовательностями. Таким образом, кандидатная последовательность, разделяющая 70% идентичности аминокислот с эталонной последовательностью, требует, чтобы, после выравнивания, 70% аминокислот в последовательности-кандидате были идентичны соответствующим аминокислотам в эталонной последовательности. Идентичность может быть определена с помощью компьютерного анализа, такого как, без ограничений, компьютерная программа для выполнения выравнивания ClustalW (Higgins D., Thompson J., Gibson T., Thompson J.D., Higgins D.G., Gibson T.J., 1994. CLUSTAL W: improving the sensitivity of progressive multiple sequence alignment through sequence weighting, position-specific gap penalties and weight matrix choice. Nucleic Acids Res. 22:4673-4680) и предложенные в ней параметры по умолчанию. Используя данную программу с настройками по умолчанию, зрелая (биологически активная) часть запроса и эталонный полипептид выравниваются. Количество полностью консервативных остатков подсчитывают и делят на длину эталонного полипептида. При этом любые метки или последовательности слитого белка, которые составляют часть последовательности запроса, не учитываются при выравнивании и последующем определении идентичности последовательности.
Аналогичным образом, алгоритм ClustalW может быть использован для выравнивания нуклеотидных последовательностей. Идентичности последовательности могут быть рассчитаны аналогично упомянутым для аминокислотных последовательностей.
Другим предпочтительным, неограничивающим примером математического алгоритма, используемого для сравнения последовательностей, является алгоритм Майерса и Миллера (Myers and Miller), CABIOS (1989). Такой алгоритм включен в программу ALIGN (версия 2.0), которая является частью программного пакета для выравнивания последовательностей FASTA (Pearson WR, Methods Mol Biol, 2000, 132:185-219). Выравнивание вычисляет идентичности последовательностей на основе глобального выравнивания. Align0 не наказывает за пропуски в конце последовательностей. При использовании программы ALIGN og Align0 для сравнения аминокислотных последовательностей, предпочтительно использовать матрицу замещения BLOSUM50 с штрафами на открытие/удлинение пропуска -12/-2.
Полинуклеотиды
Настоящее изобретение также относится к полинуклеотиду, как описано выше. Полинуклеотид может содержать ДНК-нуклеотидную последовательность или РНК-нуклеотидную последовательность, такую как геномная ДНК, кДНК и последовательности РНК, либо двухцепочечные, либо одноцепочечные.
Предпочтительно, чтобы данный полинуклеотид был оптимизирован в отношении вида для экспрессии полипептида согласно изобретению, то есть предпочтительно, чтобы полинуклеотидная последовательность была оптимизирована по кодонам человека.
Полипептиды и димерные белки
Настоящее изобретение далее относится к полипептиду, кодируемому полинуклеотидной последовательностью, как определено выше. Полипептид может быть экспрессирован in vitro для получения вакцины согласно изобретению, или полипептид может быть экспрессирован in vivo в результате введения полинуклеотида, как определено выше.
Благодаря присутствию единицы димеризации, димерные белки образуются, когда экспрессируется полипептид. Димерный белок может быть гомодимером, то есть в котором две полипептидные цепи идентичны и, следовательно, содержат идентичные неоэпитопы, или димерный белок может быть гетеродимером, содержащим два разных мономерных полипептида, кодируемых в антигенных единицах. Последнее может иметь значение, если количество неоэпитопов превышает верхний предел размера для антигенной единицы. Однако, предпочтительно, чтобы димерный белок являлся гомодимерным белком.
Вектор
Кроме того, настоящее изобретение относится к вектору, содержащему нуклеотидную последовательность, как определено выше. Предпочтительно, чтобы вектор позволял легко обменивать различные единицы, описанные выше, в частности, антигенную единицу. В частности, экспрессионный вектор может представлять собой основы вектора pUMVC4a или вектора NTC9385R. Антигенная единица может обмениваться с кассетой антигенной единицы, ограниченной кассетой рестрикционного фермента SfiI, причем 5'-сайт встроен в линкер GLGGL/GLSGL и 3'-сайт включен после стоп-кодона в векторе.
Клетка-хозяин
Настоящее изобретение также относится к клетке-хозяину, содержащей нуклеотидную последовательность, как определено выше, или содержащую вектор, как определено выше, для экспрессии полипептида согласно изобретению.
Подходящие клетки-хозяева включают прокариоты, дрожжи, насекомые или высшие эукариотические клетки.
Способы получения вакцины
Вакцина в соответствии с изобретением предпочтительно представляет собой персонализированную вакцину в том смысле, что неоантигены идентифицируются в опухоли пациента и, соответственно, вакцина направлена точно против специфических мутированных белков в опухоли пациента.
Соответственно, в одном аспекте настоящее изобретение относится к способу получения вакцины, содержащей иммунологически эффективное количество димерного белка или полипептида, как определено выше, путем получения полипептидов in vitro. In vitro синтез полипептидов и белков может быть выполнен любым подходящим способом, известным специалисту в данной области техники, например, через пептидный синтез или экспрессию полипептида в любом из множества систем экспрессий с последующей очисткой. Соответственно, в одном варианте осуществления данный способ включает:
а) трансфекцию полинуклеотида, как определено выше, в популяцию клеток;
b) культивирование популяции клеток;
c) сбор и очистку димерного белка или полипептида, экспрессированного из популяции клеток, и
d) смешивание димерного белка или полипептида, полученного на стадии с) с фармацевтически приемлемым носителем, получая таким образом вакцину.
В предпочтительном варианте осуществления димерный белок или полипептид, полученный на стадии с), растворяют в упомянутом фармацевтически приемлемом носителе.
Кроме того, к вакцине может быть добавлен адъювант или буфер.
Очистку можно проводить в соответствии с любым подходящим способом, таким как хроматография, центрифугирование или дифференциальная растворимость.
В другом аспекте настоящее изобретение относится к способу получения вакцины, содержащей иммунологически эффективное количество полинуклеотида, как определено выше. В одном варианте осуществления способ включает:
a. получение полинуклеотида, как определено выше;
b. смешивание полинуклеотида, полученного на стадии а), с фармацевтически приемлемым носителем, получая таким образом вакцину.
Полинуклеотид может быть получен любым подходящим способом, известным специалисту. Например, полинуклеотид может быть получен химическим синтезом с использованием олигонуклеотидного синтезатора.
В частности, меньшие нуклеотидные последовательности, такие как, например, нуклеотидные последовательности, кодирующие единицу нацеливания, единицу димеризации и/или субъединицы антигенной единицы, могут быть синтезированы индивидуально и затем лигированы для получения конечного полинуклеотида в векторную основу.
Для разработки персонализированной вакцины вышеизложенным способам предшествует способ идентификации неоэпитопов, которые должны быть включены в полинуклеотид.
Данный способ предпочтительно включает в себя следующие стадии:
- секвенирование генома или экзома опухоли,
- определение опухолевых неоантигенов, содержащих неоэпитопы из упомянутой опухоли,
- выбор неоэпитопов на основе прогнозируемой антигенности.
Опухоль или часть опухоли могут быть получены с помощью любого подходящего способа, такого как получение биопсии опухоли или удаление опухоли, или из любой подходящей жидкости организма, такой как образец крови или образец мочи.
Секвенирование генома или экзома опухоли
Геном или экзом, то есть кодирующая часть генома, могут быть секвенированы с использованием любого подходящего способа, такого как секвенирование целых экзонов. В частности, секвенсером может быть Illumina HiSeq2500), с использованием Paired-end 2x100-125 или PE100-125 (длина считывания), мультиплекс.
Идентификация опухолевых антигенов
Как только опухолевые специфические мутации идентифицированы, следующей стадией является выбор предсказанных антигенных пептидов, содержащих неоэпитопы.
Мутации опухолей обнаруживают секвенированием опухоли и нормальной ткани и проводят сравнение полученных последовательностей. Для обнаружения наличия определенной мутации или аллеля в ДНК или РНК человека доступны различные способы. Например, могут быть применены такие способы, как динамическая аллелеспецифическая гибридизация (dynamic allele-specific hybridization (DASH)), электрофорез в диагональном геле с микропланшетами (microplate array diagonal gel electrophoresis (MADGE)), пиросеквенирование, олигонуклеотид-специфическое лигирование, система TaqMan, а также могут применяться различные технологии ДНК-чипов, такие как чипы Affymetrix SNP.
Альтернативно, может быть осуществлен способ идентификации мутаций посредством прямого секвенирования белка.
Из возможных сотен или тысяч мутаций в экзоме опухоли, неоэпитопы выбираются in silico на основе предсказательных алгоритмов HLA-связывания. Цель состоит в том, чтобы идентифицировать все соответствующие неоэпитопы и после ранжирования или подсчета определить неоэпитопы, которые должны быть включены в вакцину для конкретного пациента, о котором идет речь.
Могут использоваться любые подходящие алгоритмы, например, один из следующих.
Доступный бесплатный программный анализ связывания пептид-MHC (IEDB и NetMHC) можно загрузить со следующих веб-сайтов:
http://www.iedb.org/
http://www.cbs.dtu.dk/services/NetMHC/
Коммерчески доступное расширенное программное обеспечение для прогнозирования оптимальных пептидов для разработки вакцин находится здесь:
http://www.oncoimmunity.com/
https://omictools.com/t-cell-epitopes-category
https://github.com/griffithlab/pVAC-Seq
http://crdd.osdd.net/raghava/cancertope/help.php
http://www.epivax.com/tag/neoantigen/
Каждая мутация оценивается по ее антигенности, и большинство антигенных неоэпитопов выбраны и оптимально сконструированы в полинуклеотиде. Как обсуждалось выше, от 3 до 50 неоэпитопов являются предпочтительными в соответствии с настоящим изобретением.
Вакцина
Затем производится окончательная вакцина, включающая одно из следующего:
- полинуклеотид, как определено выше,
- полипептид, кодируемый полинуклеотидом, как определено выше,
- димерный белок, содержащий полипептидные цепи.
Вакцина может дополнительно включать фармацевтически приемлемый носитель, разбавитель, адъювант или буфер.
Фармацевтически приемлемые носители, разбавители и буферы включают, но не ограничиваются ими, физиологический раствор, забуференный физиологический раствор, декстрозу, воду, глицерин, этанол, стерильный изотонический водный буфер и их комбинации.
В частности, для вакцин, содержащих полипептиды/белки, фармацевтически приемлемые адъюванты включают, но не ограничиваются ими, поли-ICLC, 1018 ISS, соли алюминия, Amplivax, AS 15, BCG, CP-870893, CpG7909, CyaA, dSLIM, GM-CSF, IC30, IC31, Imiquimod, ImuFact EV1P321, IS- Patch, ISS, ISCOMATRIX, Juvlmmune, LipoVac, MF59, монофосфориловый липид A, Montanide IMS 1312, Montanide ISA 206, Montanide ISA 50V, Montanide ISA-51, OK-432, OM-174, OM-197-MP-EC, ONTAK, PepTel.RTM, векторную систему, микрочастицы PLGA, resiquimod, SRL172, виросомы и другие вирусоподобные частицы, YF-17D, ловушку VEGF, R848, бета-глюкан, Pam3Cys, Aquila's QS21 stimulon, вадимезан и/или AsA404 (DMXAA).
В частности, в случае вакцин, содержащих полинуклеотиды, носители могут включать молекулы, которые облегчают трансфекцию клеток и адъювантов, могут включать плазмиды, содержащие нуклеотидные последовательности, кодирующие хемокины или цитокины, для усиления иммунного ответа.
Вакцина составлена в любую подходящую композицию, такую как жидкая композиция для внутрикожной или внутримышечной инъекции.
Введение
Вакцину можно вводить любым подходящим способом либо для полипептидной/белковой вакцины, либо для полинуклеотидной вакцины, таким как введение инъекцией внутрикожно, внутримышечно, подкожно, или путем мукозального или эпителиального применения, например, интраназально, перорально, энтерально или введением в мочевой пузырь.
В частности, вакцину предпочтительно вводят внутримышечно или внутрикожно, когда вакцина является полинуклеотидной вакциной.
В конкретном варианте осуществления вакцину вводят интранодальной инъекцией. Используемый здесь термин «интранодальная инъекция» означает, что вакцину вводят в лимфатические узлы.
Лечение
Полинуклеотиды, полипептиды и димерные белки предпочтительно применяются для лечения рака и формулируются в вакцине, как описано выше. Способом, описанным в настоящем изобретении, можно лечить пациента, страдающего от рака, путем изучения любых мутаций, присутствующих в опухоли у пациента, продуцирования вакцины, а затем иммунизации пациента вакциной, направленной точно на неоантигены, присутствующие в его или ее опухоли. Благодаря быстрым и надежным способам секвенирования, определения эпитопов и продуцирования нуклеотидных последовательностей в настоящее время, стало вероятным, что пациент может получить вакцину в течение 12 недель после удаления опухоли.
Раковым заболеванием может быть любое раковое заболевание, в котором раковые клетки включают мутации. Раковое заболевание может быть первичной опухолью, метастазом или и тем, и другим. Опухоль, исследованная на мутации, может быть первичной опухолью или метастазом. Раковое заболевание, подлежащее лечению, относится, в частности, к раковым заболеваниям, которые, как известно, обладают высокой мутационной нагрузкой, таким как меланомы, рак легких, рак молочной железы, рак предстательной железы или рак толстой кишки.
В предпочтительном варианте осуществления лечение проводят с помощью вакцины, содержащей полинуклеотид, как описано выше, например, причем полинуклеотид представляет собой ДНК или РНК.
Предпочтительно вводить полинуклеотидную вакцину внутримышечно, например, в большие мышцы, например, в плечо, ягодицу или бедро. Было обнаружено, что полипептиды продуцируются локально, и соответствующие иммунные клетки интернализуют полипептиды/протеины по существу в месте продуцирования, и по существу никакие полипептиды или белки не достигают потока крови.
Может быть использован любой подходящий способ для инъекции полинуклеотида, например, с использованием струйного инжектора или при помощи электропорации.
Режим дозирования
Вакцина может вводиться в виде разовой дозы или введение может быть повторено. При повторном введении вакцины предпочтительно, чтобы она вводилась с интервалом не менее 3 недель, чтобы избежать истощения Т-клеток.
Соответственно, в одном варианте осуществления режим дозирования будет представлять собой вакцинации в недели 0, 3, 6, а затем каждые 4 недели и так долго, пока пациент имеет клиническую пользу. Вакцина может вводиться в течение по меньшей мере года.
Вакцину вводят в иммунологически эффективном количестве. Под «иммунологически эффективным количеством» понимается количество вакцины, необходимое для установления эффекта уменьшения опухоли. В конечном счете врач определяет дозировку, которая обычно находится в диапазоне от 0,3 до 6 мг для ДНК-вакцин и в диапазоне от 5 мкг до 5 мг для полипептидных/белковых вакцин.
Комбинированные терапии
Лечение вакциной в соответствии с настоящим изобретением может сочетаться с любым другим противораковым лечением, таким как лучевая терапия, химиотерапия и хирургическое лечение.
Лечение вакциной в соответствии с изобретением можно также объединять с лечением ингибитором-блокатором иммунных контрольных точек.
Конкретные варианты осуществления
1. Терапевтическая противораковая неоэпитопная вакцина, содержащая иммунологически эффективное количество
полинуклеотида, содержащего нуклеотидную последовательность, кодирующую:
- единицу нацеливания,
- единицу димеризации,
- первый линкер,
- антигенную единицу, причем указанная антигенная единица содержит n-1 антигенных субъединиц, причем каждая субъединица содержит, по меньшей мере, часть раковой неоэпитопной последовательности и второй линкер, и упомянутая антигенная единица дополнительно содержит окончательную раковую неоэпитопную последовательность, причем n представляет собой целое число от 3 до 50;
или
полипептида, кодируемого полинуклеотидом, как определено в 1), или
димерного белка, состоящего из двух полипептидов, кодируемых полинуклеотидом, как определено в 1).
2. Вакцина согласно варианту осуществления 1, причем антигенная единица содержит одну копию каждого ракового неоэпитопа.
3. Вакцина согласно варианту осуществления 1, причем антигенная единица содержит по меньшей мере две копии по меньшей мере одного неоэпитопа.
4. Вакцина по любому из предшествующих вариантов осуществления, причем раковая неоэпитопная последовательность имеет длину от 7 до 30 аминокислот.
5. Вакцина согласно варианту осуществления 4, причем раковая неоэпитопная последовательность имеет длину от 7 до 10 аминокислот.
6. Вакцина согласно варианту осуществления 4, причем раковая неоэпитопная последовательность имеет длину от 13 до 30 аминокислот.
7. Вакцина по любому из предыдущих вариантов осуществления, причем каждая раковая неоэпитопная последовательность имеет одинаковую длину.
8. Вакцина по любому из предшествующих вариантов осуществления, причем раковый неоэпитоп расположен по существу посередине раковой неоэпитопной последовательности.
9. Вакцина по любому из предшествующих вариантов осуществления, причем раковая неоэпитопная последовательность представляет собой подпоследовательность ракового неоантигена.
10. Вакцина по любому из предыдущих вариантов осуществления, причем антигенные субъединицы расположены в порядке от более антигенной до менее антигенной, считая от первого линкера.
11. Вакцина по любому из предшествующих вариантов осуществления, причем наиболее гидрофобная антигенная субъединица(ы) являе(ю)тся по существу серединой антигенной единицы, и самая гидрофильная антигенная субъединица(ы) находится/находятся на концах антигенной единицы.
12. Вакцина по любому из предшествующих вариантов осуществления, причем второй линкер представляет собой гибкий линкер.
13. Вакцина по любому из предшествующих вариантов осуществления, причем второй линкер является неиммуногенным.
14. Вакцина по любому из предыдущих вариантов осуществления, причем второй линкер идентичен во всех антигенных субъединицах.
15. Вакцина по любому из предшествующих вариантов осуществления, причем второй линкер представляет собой серин-глициновый линкер.
16. Вакцина по любому из предшествующих вариантов осуществления, причем второй линкер имеет длину от 4 до 20 аминокислот.
17. Вакцина по любому из предыдущих вариантов осуществления, причем второй линкер имеет длину 10 аминокислот.
18. Вакцина по любому из предыдущих вариантов осуществления, причем антигенная единица имеет длину от около 100 аминокислот до около 1000 аминокислот.
19. Вакцина по любому из предыдущих вариантов осуществления, причем n представляет собой целое число от 3 до 30.
20. Вакцина по любому из предыдущих вариантов осуществления, причем единица димеризации содержит шарнирную область и необязательно другой домен, который облегчает димеризацию, необязательно связанный через третий линкер.
21. Вакцина согласно варианту осуществления 20, в которой шарнирная область получена из Ig.
22. Вакцина по любому из вариантов осуществления 20-21, причем шарнирная область обладает способностью образовывать одну или более ковалентных связей.
23. Вакцина согласно варианту осуществления 22, причем ковалентная связь представляет собой дисульфидный мостик.
24. Вакцина по любому из вариантов осуществления 20-23, причем другой домен, который облегчает димеризацию, представляет собой домен иммуноглобулина, предпочтительно карбокситерминальный С-домен, или последовательность, которая по существу идентична упомянутому С-домену или его варианту.
25. Вакцина согласно варианту осуществления 24, причем карбокситерминальный С-домен получен из IgG.
26. Вакцина по любому из вариантов осуществления 24-25, причем иммуноглобулиновый домен единицы димеризации обладает способностью к гомодимеризации.
27. Вакцина по любому из вариантов осуществления 24-26, причем упомянутый иммуноглобулиновый домен обладает способностью к гомодимеризации посредством нековалентных взаимодействий.
28. Вакцина согласно варианту осуществления 27, причем нековалентные взаимодействия представляют собой гидрофобные взаимодействия.
29. Вакцина по любому из вариантов осуществления 20-28, причем упомянутая единица димеризации не содержит домен СН2.
30. Вакцина по любому из вариантов осуществления 20-29, причем единица димеризации состоит из шарнирных экзонов h1 и h4, присоединенных через упомянутый третий линкер к домену СН3 человеческого IgG3.
31. Вакцина по любому из вариантов осуществления 20-30, причем единица димеризации содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 94-237 из SEQ ID NO: 3.
32. Вакцина по любому из вариантов осуществления 30-31, причем упомянутый третий линкер представляет собой линкер G3S2G3SG.
33. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутые антигенная единица и единица димеризации соединены через упомянутый первый линкер.
34. Вакцина согласно варианту осуществления 33, причем первый линкер содержит сайт рестрикции.
35. Вакцина согласно варианту осуществления 33 или 34, причем первый линкер представляет собой линкер GLGGL или линкер GLSGL.
36. Вакцина по любому из предыдущих вариантов осуществления, причем единица нацеливания имеет сродство к хемокиновому рецептору, выбранному из CCR1, CCR3 и CCR5.
37. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутая единица нацеливания содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1.
38. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутая единица нацеливания состоит из аминокислотной последовательности, обладающей по меньшей мере 85% идентичностью последовательности с аминокислотной последовательностью 24-93 SEQ ID NO: 1.
39. Вакцина по любому из предыдущих вариантов осуществления, причем упомянутая нуклеотидная последовательность дополнительно кодирует сигнальный пептид.
40. Вакцина согласно варианту 39, причем упомянутый сигнальный пептид содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичности последовательности, с аминокислотной последовательностью 1-23 SEQ ID NO: 1.
41. Вакцина согласно варианту 39 или 40, причем упомянутый сигнальный пептид состоит из аминокислотной последовательности, обладающей по меньшей мере 85% идентичностью последовательности с аминокислотной последовательностью 1-23 SEQ ID NO: 1.
42. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутые единица нацеливания, единица димеризации и антигенная единица в упомянутом пептиде расположены, в направлении от N-конца к С-концу, в следующем порядке: единица нацеливания, единица димеризации и антигенная единица.
43. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутая полинуклеотидная последовательность является оптимизированной по кодонам человека.
44. Вакцина по любому из предшествующих вариантов осуществления, причем упомянутая полинуклеотидная последовательность представляет собой нуклеотидную последовательность ДНК или нуклеотидную последовательность РНК.
45. Вакцина по любому из предшествующих вариантов осуществления, дополнительно включающая фармацевтически приемлемый носитель и/или адъювант.
46. Полинуклеотид, как определено в любом из вариантов осуществления 1-45.
47. Вектор, содержащий нуклеотидную последовательность, как определено в любом из вариантов осуществления 1-45.
48. Клетка-хозяин, содержащая нуклеотидную последовательность, как определено в любом из вариантов осуществления 1- 45, или содержащая вектор, как определено в варианте осуществления 47.
49. Полинуклеотид согласно варианту осуществления 46, сформулированный для введения пациенту с целью индукции продуцирования димерного белка у упомянутого пациента.
50. Полипептид, кодируемый нуклеотидной последовательностью, как определено в любом из вариантов осуществления 1-45.
51. Димерный белок, состоящий из двух полипептидов, как определено в варианте осуществления 50.
52. Димерный белок согласно варианту осуществления 51, являющийся гомодимерным белком.
53. Полипептид, как определено в варианте осуществления 50, димерный белок, как определено в варианте осуществления 51-52, или полинуклеотид, как определено в варианте осуществления 46, для применения в качестве лекарственного средства.
54. Способ получения вакцины, включающий иммунологически эффективное количество димерного белка, как определено в варианте осуществления 50, или полипептид, как определено в варианте осуществления 50, причем данный способ включает:
e) трансфекцию полинуклеотида, как определено в варианте осуществления 46, в популяцию клеток;
f) культивирование популяции клеток;
g) сбор и очистку димерного белка или полипептида, экспрессируемого из популяции клеток;
h) смешивание димерного белка или полипептида, полученного на стадии с), с фармацевтически приемлемым носителем, получая таким образом вакцину.
55. Способ получения вакцины, содержащий иммунологически эффективное количество полинуклеотида согласно варианту осуществления 46, причем упомянутый способ включает:
a. получение полинуклеотида согласно варианту осуществления 46;
b. смешивание полинуклеотида, полученного на стадии а), с фармацевтически приемлемым носителем, получая таким образом вакцину.
56. Способ согласно варианту осуществления 55, включающий в себя следующие стадии:
- секвенирование экзома опухоли
- определение опухолевых неоантигенов, содержащих неоэпитопы из упомянутой опухоли,
- выбор неоэпитопов на основе антигенности,
до стадии получения полинуклеотида.
57. Способ лечения рака у пациента, причем данный способ включает введение пациенту, нуждающемуся в этом, вакцины, как определено в любом из вариантов осуществления 1-45.
58. Способ согласно варианту осуществления 57, причем вакцина содержит полинуклеотид и вводится внутрикожно или внутримышечно.
59. Способ согласно варианту осуществления 58, причем полинуклеотид представляет собой ДНК.
60. Способ согласно варианту осуществления 59, причем полинуклеотид представляет собой РНК.
61. Способ согласно вариантам осуществления от 57 до 60, причем введение осуществляется с помощью струйного инжектора.
62. Способ согласно вариантам осуществления от 57 до 60, причем введению способствует электропорация.
Примеры
ПРИМЕР 1. Конструирование и экспрессия вакцин
Последовательности генов были разработаны в соответствии со следующей структурой:
1: Нативная лидерная последовательность для LD78b человека.
Сигнальный пептид
2: Полноразмерная последовательность LD78b. Единица нацеливания
3: Человеческая шарнирная область 1 из IgG3.
4: Человеческая шарнирная область из IgG3.
5: Глицин-сериновый линкер.
6: Человеческий домен CH3 из IgG3.
Единица димеризации
7: Глицин-лейциновый линкер.
Первый линкер
8: Неоэпитопная последовательность (см. ниже).
Антигенная единица
Ранее описанные секвенирование экзома и секвенирование РНК клеточной линии B16-F10 рака меланомы мыши и клеточной линии CT26 рака толстой кишки мыши выявили от сотен до тысяч опухолеспецифических несинонимических мутаций (Castle et al., 2012, Castle et al., 2014 и Kreiter et al., 2015). In silico-способы использовались для идентификации потенциальных иммуногенных неоэпитопов. Мышей иммунизировали пептидами, кодирующими мутированные эпитопы, и их иммуногенность наблюдалась как специфические Т-клеточные иммунные ответы (анализ ELISpot). Кроме того, вакцинация мышей наиболее иммуногенными эпитопами, выбранными из ELISpot, обеспечивала сильную противоопухолевую активность (Castle et al., 2012 и Kreiter et al., 2015).
Каждый из неоэпитопов представляет собой пептиды из 27 аминокислот, разделенные гибким линкером GGGGS. Короткие пептиды (<20 аминокислот) обрабатываются, и новые эпитопы могут быть презентированы на молекулах МНС класса I и активировать CD8+ Т-клетки. Однако предпочтительно, чтобы вакцина активировала CD8+и CD4+ Т-клетки, и поэтому были выбраны неоэпитопы, кодирующие длинные пептиды (> 20 аминокислот). Это может обеспечить эффективную обработку пептидов и их презентацию как для MHC класса I, так и для MHC класса II (Kreiter et al 2015). В первых двух конструкциях VB10.NEO-X выбранные гидрофобные и гидрофильные неоэпитопы распределены равномерно. Нейтральный, гибкий линкер GGGGS между неоэпитопами из 27 аминокислот важен, чтобы избежать генерации новых иммуногенных эпитопов в местах соединений объединенных неоэпитопов.
Последовательности неоэпитопов, обнаруженных в клеточных линиях B16-F10 и CT26, показаны в таблице 1 и 2.
Таблица 1. Клеточная линия CT26
Таблица 2. Клеточная линия B16-F10
ПРИМЕР 2. Сравнение вакцител, содержащих 3 или 10 неоэпитопов
Сравнивали вакцительные вакцины, содержащие либо 3, либо 10 неоэпитопов. В вакцительной ДНК-конструкции из 10 неоэпитопов место и порядок для 3 первых (N-концевых) пептидов аналогичны положению в вакцительной ДНК-конструкции из 3 неоэпитопов. Это делается для того, чтобы сравнить иммуногенность данных 3 неоэпитопов в конструкции с иммуногенностью конструкций, содержащих дополнительно 3 и дополнительно 7 эпитопов.
VB4001 (VB10.NEO CT26-X), VB4002 (VB10.NEO CT26-III), VB4003 (VB10.NEO B16-X) and VB4004 (VB10.NEO B16-III) были выбраны в качестве кандидатов на вакцину. Схематический чертеж вакцител показан на фигуре 1.
Неоэпитопы, используемые для вакцин VB4001-VB4021, показаны ниже. Например, VB4015 содержит три неоэпитопа, B16 pepM1+pepM8+pepM3, которые разделены 5-аминокислотными линкерами. VB4018 содержит 2 копии 10 неоэпитопов, B16 pepM1+pepM2+pepM3+pepM4+pepM11+pepM6+pepM7+pepM8+pepM9+pepM10, которые разделены 5-аминокислотными линкерами. Неоэпитопные последовательности показаны в таблицах 1 и 2.
VB4001 = VB10.NEO CT26-X = CT26 pepM1-M10, 5-aa линкер
VB4002 = VB10.NEO CT26-III = CT26 pepM1-M3, 5-aa линкер
VB4003 = VB10.NEO B16-X = B16 pepM1-M10, 5-aa линкер
VB4004 = VB10.NEO B16-III = B16 pepM1-M3, 5-aa линкер
VB4011 = VB10.NEO B16-X = B16 pepM1-M10, 10-aa линкер
VB4012 = VB10.NEO B16 -III = B16 pepM1-M3, 10-aa линкер
VB4014 = VB10.NEO B16-X = B16 гидрофобное ядро, (pepM9+pepM5+pepM1+pepM4+pepM6+pepM8+pepM10+pepM3+pepM7+pepM2), 5-aa линкер
VB4015 = VB10.NEO B16-III = B16 pepM1+M8+M3, 5-aa линкер
VB4016 = VB10.NEO B16-III = B16 pepM1+M3+M2, 5-aa линкер
VB4017 = VB10.NEO B16-X = B16 pepM1-M4+M11+M6-M10, 5-aa линкер
VB4018 = VB10.NEO B16-XX = B 16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
VB4019 = VB10.NEO B16-Vx2 = B16 pepM3+M4+M7+M9+M10 x 2, 5-aa линкер
VB4021 = VB10.NEO B16-Vx4 = B16 pepM3+M4+M7+M9-M10 x 4, 5-aa линкер
Все последовательности генов неоэпитопов заказывали у Genescript (Нью-Джерси, США) и клонировали в вектор экспрессии pUMVC4a, несущий единицу нацеливания LD78beta и единицу димеризации hIgG3.
Все конструкции трансфицировали в клетки HEK293, и вакцительные белки в надосадочной жидкости проверяли с использованием Вестерн-блота и/или сэндвич-ELISA анализа. «Пустой» вектор pUMVC4a был включен в качестве отрицательного контроля. Фигура 2, левые панели: Чтобы проиллюстрировать образование интактных гомодимерных белков, белки в надосадочной жидкости из трансфицированных клеток детектировали в Вестерн-блоте с помощью анти-hMIP-1Alpha антитела, в присутствии или в отсутствие восстанавливающих агентов. Образование гомодимеров показано на левой полосе (-восстанавливающий агент).), тогда как мономеры показаны на правой полосе (+ восстанавливающий агент). Фигура 2, правая панель показывает уровень экспрессии вакцительных белков в надосадочной жидкости клеток НЕК293, трансфицированных различными конструкциями VВ10.NEO, обнаруженными анализом сэндвич-ELISA с использованием антитела против обоих hMIP-1альфа и hIgG3. Правая верхняя панель показывает уровень экспрессии конструкций VB10.NEO CT26-X (VB4001) и VB10.NEO CT26-III (VB4002), содержащих 10 или 3 неоэпитопов, соответственно. Правая нижняя панель показывает уровень экспрессии конструкций VB10.NEO B16 -X (VB4003) и VB10.NEO В16-III (VB4004), содержащих 10 или 3 неоэпитопов, соответственно. Для сравнения иммуногенности вакцител, содержащих 3 или 10 неоэпитопов, 20 мкг плазмидной ДНК каждого вакцитела-кандидата вводили внутримышечно в большеберцовую переднюю мышцу мышей C57BI/6 (для В16 конструкций) или мышей BALB/с (для СТ26 конструкций), с последующей электропорацией с использованием TriGrid, Ichor, (США). На 13-й день мышей умерщвляли и собирали селезенки.
Т-клеточные ответы оценивали с помощью IFN-гамма ELISpot. Результаты показаны на фигуре 3, причем Т-клеточные ответы указаны как число пятен IFN-γ пятен/106 спленоцитов. Видно, что вакцины, содержащие 10 неоэпитопов, индуцируют значительные ответы Т-клеток относительно от 4 до 6 из 10 включенных неоэпитопов у одних и тех же мышей. Пептиды, стимулирующие самый сильный ответ IFN-γ, как правило, имеют лучший показатель связывания MHC I.
Полные неоантиген-специфические иммунные ответы, индуцированные конструкциями вакцител, содержащими 3 или 10 неоэпитопов, изображены на фигуре 4. Вакцитела, содержащие 10 неоэпитопов (VB10.NEO B16-X и VB10.NEO CT26-X), приводили к увеличению общего неоантиген-специфического иммунного ответа по сравнению с вакцителами, включающими 3 неоэпитопа (VB10.NEO B16-III и VB10.NEO CT26-III).
ПРИМЕР 3. Сравнение иммуногенности вакцительных ДНК-вакцин и соответствующих пептид плюс адъювант вакцин
До того, как конструкции VB10.NEO используются в исследованиях по вакцинации мышей, проверяют экспрессию и секрецию вакцительного белка в клетках НЕК293 с использованием анализа сэндвич-ELISA, как описано выше подробно в тексте для фигуры 2. Порядок неоэпитопов может оказывать влияние на экспрессию и секрецию функциональных вакцител. На фигуре 5, верхняя панель, видно, что VB10.NEO В16-Х конструкция VB4014 имеет слегка улучшенную экспрессию и секрецию функциональных вакцительных белков по сравнению с VB10.NEO В16-X конструкцией VB4003. VB4014 содержит 10 неоэпитопов, аналогично, как для VB4003, однако порядок неоэпитопов изменяется и наиболее гидрофобные неоэпитопы локализуются в ядре и в неоэпитопом антигенном модуле. Чтобы проверить иммуногенность вакцительных ДНК-вакцин VB4003 и VB4014 по сравнению с пептидами, включающих только неоэпитопы, доставленные вместе с поли (I:С) адъювантом, С57/BL6 мышам вводили 20 мкг В16-X VB10.NEO конструкций VB4003 и VB4014. Индуцированные иммунные ответы сравнивали с иммунными ответами мышей, которым вводили внутримышечно 20 мкг или 200 мкг пептидной смеси + 50 мкг поли I:C, содержащей 10 неоэпитопов, кодируемых конструкциями VB4003 и VB4014. Т-клеточные ответы оценивали с помощью IFN-gamma ELISpot. Результаты, показанные на нижней панели фигуры 5, демонстрируют, что вакцитела явно вызывают гораздо более сильный ответ, чем пептид+адъювант. Кроме того, некоторые из животных, иммунизированных VB10.NEO B16-X конструкцией VB4014, отвечали на все 10 неоэпитопов, включенных в вакцину.
ПРИМЕР 4. Сравнение вакцител, содержащих вторые линкеры с длиной 5 или 10 аминокислот
Каждый из неоэпитопов отделен вторым линкером. В настоящем примере второй линкер представляет собой гибкий линкер GGGGS. Для того, чтобы проверить, оказывает ли длина второго линкера какое-либо влияние на уровень экспрессии, клетки НЕК293 трансфицировали VB10.NEO В16-Х конструкциями, содержащими вторые линкеры с длиной 5 или 10 аминокислот. На фигуре 6 показано, что изменение длины линкера от 5 (VB4003) до 10 (VB4011) аминокислот не влияет на экспрессию вакцител, содержащих 10 неоэпитопов (фигура 6, верхняя панель). Для того, чтобы проверить, оказывает ли длина второго линкера какое-либо влияние на иммунный ответ, C57BL/6 мышам впрыскивали VB10.NEO В16-X конструкции, содержащие 10 неоэпитопов с 5- (VB4003) или 10- (VB4011) аминокислотными линкерами. На 13-й день мышей умерщвляли, и спленоциты собирали, стимулировали с помощью соответствующих индивидуальных неоэпитопных пептидов в течение 24 часов, и Т-клеточные ответы оценивали количественно в анализе IFN-гамма ELISpot. Результаты показаны на фигуре 6, нижняя панель, и демонстрируют, что конструкции вакцител, содержащие 10-аминокислотные линкеры (VB4011), приводят к увеличению общего иммунного ответа по сравнению с вакцителами, содержащими 5-аминокислотные линкеры (VB4003). «Пустой» вектор был включен в качестве отрицательного контроля.
ПРИМЕР 5. Сравнение вакцител, содержащих различное число копий одинаковых неоэпитопов
Были протестированы следующие конструкции:
VB4003 = VB10.NEO B16-X = B16 pepM1-M10, 5-aa линкер
VB4018 = VB10.NEO B16-XX = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
Уровень экспрессии конструкции VB10.NEO B16-X (VB4003), содержащей 10 неоэпитопов, сравнивали с уровнем экспрессии конструкции VB10.NEO B16-XX (VB4018), содержащей 2x10 неоэпитопов. Результаты показывают, что VB10.NEO B16-XX (VB4018), содержащая 20 неоэпитопов, экспрессируется несколько слабее по сравнению с VB10.NEO B16-X (VB4003), включающей 10 неоэпитопов (фигура 7, верхняя панель).
Иммуногенность вакцител, содержащих либо 10, либо 20 неоэпитопов, была испытана путем внутримышечной инъекции мышам C57Bl/6 вакцительных ДНК-вакцин VВ10.NEO B16-X (VB4003) и VB10.NEO B16-XX (VB4018). На 13-й день мышей умерщвляли, и спленоциты собирали, стимулировали с помощью соответствующих индивидуальных неоэпитопных пептидов в течение 24 часов, и Т-клеточные ответы оценивали количественно в анализе IFN-гамма ELISpot. Результаты, показанные на фигуре 7, нижняя панель, демонстрируют, что преимущество включения 2 копий на неоэпитоп (2x10 неоэпитопов) ограничено в отношении общего иммунного ответа, однако, более широкий иммунный ответ наблюдается в отношении отдельных неоэпитопов.
Далее проверяли уровни экспрессии конструкций вакцител, содержащих одну или более копий 5 выбранных неоэпитопов, PepM3, PepM4, PepM7, PepM9 и PepM10, (фигура 8, верхняя панель).
Мышам C57Bl/6 вводили следующие конструкции вакцител:
VB4003 = VB10.NEO B16-X = B16 pepM1-M10, 5-aa линкер
VB4011 = VB10.NEO B16-X = B16 pepM1-M10, 10-aa линкер
VB4018 = VB10.NEO B16-XX = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
VB4019 = VB10.NEO B16-Vx2 = B16 pepM3+M4+M7+M9+M10 x 2, 5-aa линкер
VB4021 = VB10.NEO B16-Vx4 = B16 pepM3+M4+M7+M9+M10 x 4, 5-aa линкер
Иммунные ответы кандидатов-вакцител для каждого из пяти выбранных неоэпитопов показаны на фигуре 8, нижняя панель. Множественные копии пяти неоэпитопов оказывали ограниченный эффект на общий иммунный ответ. Однако несколько копий каждого неоэпитопа (VB4018, VB4019 и VB4021) дают более равномерный иммунный ответ, направленный против 5 общих неоэпитопов, по сравнению с декатопом VB4003, где 5 неоэпитопов представлены один раз. Интересно, что вакцитела, содержащие второй линкер с 10 аминокислотами и неоэпитопы только один раз (VB4011), показали лучший общий иммунный ответ, чем вакциномы, содержащие несколько копий пяти неоэпитопов.
ПРИМЕР 6. Сравнение вакцител, содержащих различное число неоэпитопов
Иммунный ответ конструкций вакцител, содержащих различные количества неоэпитопов, сравнивали, чтобы протестировать иммунологический эффект добавления дополнительных неоэпитопов.
Общий иммунный ответ был протестирован в мышиной модели меланомы В16 с использованием следующих конструкций:
NEO B16-X = VB4011 = B16 pepM1-M10, 10-aa линкер
NEO B16-XV = VB4024 = B16 pepM1-M15, 10-aa линкер
NEO B16-XX = VB4025 = B16 pepM1-M20, 10-aa линкер
Неоэпитопные последовательности показаны в таблице 2.
Уровни экспрессии трех протестированных конструкций вакцител показаны на фигуре 11, верхняя панель.
Мышам C57BL/6 вводили инъекцией кандидаты на ДНК-вакцины VB10.NEO B16-XV, включающий 15 неоэпитопов (VB4024), или VB10.NEO B16-XX, содержащий 20 неоэпитопов (VB4025), по сравнению с VB10. NEO B16-X, включающим 10 неоэпитопов (VB4011). Фигура 11, нижняя панель, показывает общее количество IFN-γ пятен на 106 спленоцитов. Конструкции с 15 и 20 неоэпитопами приводили к более широкому иммунному ответу против большего числа отдельных неоэпитопов и более высокому общему Т-клеточному ответу по сравнению с конструкциями с только 10 неоэпитопами, В качестве отрицательного контроля мышам вводили пустой вектор, не содержащий неоэпитопов. Как видно из фигуры 11, нижняя панель, инъекции с пустым вектором не привели к существенному иммунному ответу против отдельных неоэпитопов.
Кроме того, общий иммунный ответ тестировали на мышиной модели CT26 меланомы, используя следующие конструкции
NEO CT26-X = VB4009 = CT26 pepM1-M10, 10-aa линкер
NEO CT26-XV = VB4026 = CT26 pepM1-M15, 10-aa линкер
NEO CT26-XX = VB4027 = CT26 pepM1-M20, 10-aa линкер
Неоэпитопные последовательности показаны в таблице 1.
Мышам BALB/c вводили кандидаты на ДНК-вакцины VB10.NEO CT26-XV, включающий 15 неоэпитопов (VB4026), или VB10.NEO CT26-XX, содержащий 20 неоэпитопов (VB4027), по сравнению с VB10.NEO CT26-X, состоящим из 10 неоэпитопов (VB4009). Фигура 12, нижняя панель, показывает общее количество IFN-γ пятен на 106 спленоцитов. Конструкции с 15 и 20 неоэпитопами приводили к более широкому иммунному ответу на более отдельные неоэпитопы и более высокому общему Т-клеточному ответ. по сравнению с конструкциями с только 10 неоэпитопами, В качестве отрицательного контроля мышам вводили пустой вектор, не содержащий неоэпитопов. Как видно из фигуры 12, нижняя панель, инъекции с пустым вектором не привели к существенному иммунному ответу на отдельные неоэпитопы.
ПРИМЕР 7. Уровни экспрессии различных конструкций вакцител сравниваются
Были протестированы следующие конструкции:
VB4004 = VB10.NEO B16-III = B16 pepM1-M3, 5-aa линкер
VB4012 = VB10.NEO B16-III = B16 pepM1-M3, 10-aa линкер
VB4015 = VB10.NEO B16-III = B16 pepM1+M8+M3, 5-aa линкер
VB4016 = VB10.NEO B16-III = B16 pepM1+M3+M2, 5-aa линкер
VB4017 = VB10.NEO B16-X = B16 pepM1-M4+M11+M6-M10, 5-aa линкер
VB4018 = VB10.NEO B16-XX = B16 pepM1-M4+M11+M6-M10 x 2, 5-aa линкер
Аналогичная экспрессия и секреция функциональных вакцительных белков наблюдается для VB10.NEO B16-X (VB4017) и VB10.NEO B16-XX (VB4018) (фигура 9).
Улучшенная экспрессия и секреция функциональных вакцительных белков наблюдается, когда 3 неоэпитопов разделены 10-аа линкером, как в конструкции VB10.NEO В16-III (VB4012), по сравнению с 5-аа линкером в конструкции VB10.NEO B16-III (VB4004) (фигура 10, верхняя панель). Более того, изменяя порядок трех неоэпитопов, как показано путем сравнения VB4004, VB4015 и VB4016 (фигура 10, нижняя панель), можно влиять на уровни экспрессии вакцител.
ПРИМЕР 8. Терапевтический эффект
VB10.NEO были использованы в качестве вакцин-кандидатов для исследований терапевтических вакцин.
7.5x104 B16.F10 клеток или 1x105 CT26 клеток (АТСС) вспрыскивали в область бедра мышей C57BI/6 или мышей BALB/с. Через 1 и 8 дней мышей вакцинировали 20 мкг плазмидной ДНК с последующей электропорацией, TriGrid, Ichor, США. Размеры опухолей измеряли от двух до трех раз в неделю. На фигуре 13 показано, что кандидаты на вакцину ДНК VB10.NEO, содержащие 10 неоэпитопов, способны значительно замедлять и уменьшать рост опухоли.
ПРИМЕР 9. Терапевтическая ДНК-вакцина.
Терапевтическая ДНК-вакцина, предназначенная для применения, может быть получена путем GMP-производства плазмидной вакцины в соответствии с руководящими принципами регулирующих органов и Fill & Finish ДНК-вакцины. ДНК-вакцина может быть приготовлена путем растворения в физиологическом растворе, таком как PBS, в концентрации от 2 до 6 мг/мл. Вакцина может вводиться либо внутрикожно, либо внутримышечно с последующей электропорацией или без нее, или, альтернативно, со струйным инжектором.
ПОСЛЕДОВАТЕЛЬНОСТИ
SEQ ID NO: 1
CC мотив хемокин 3-подобный 1 предшественник, включая сигнальный пептид и зрелый пептид (LD78-бета), aa 24-93:
MQVSTAALAVLLCTMALCNQVLSAPLAADTPTACCFSYTSRQIPQNFIADYFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA
SEQ ID NO: 2
Последовательность ДНК постоянной кодирующей части всех конструкций VB10.NEO
Только с целью иллюстрации, различные области конструкций разделяются «|» с доменами в следующем порядке: сигнальный пептид | человеческий ΜΙΡ-Ια | Шарнир hi | Шарнир h4 I Gly-Ser Линкер или Gly-Leu Линкер | hCH3 IgG3 | Gly-Ser Линкер или Gly-Leu Линкер |
Конструкция представляет собой стандартную конструкцию, которая может быть использована для вставки неоэпитопов. Неоэпитопные последовательности могут быть добавлены после линкера GGCCTCGGTGGCCTG.
ATGCAGGTCTCCACTGCTGCCCTTGCCGTCCTCCTCTGCACCATGGCTCTCTGCAACCAGGTCCTCTCT | GCACCACTT GCTGCTGACACGCCGACCGCCTGCTGCTTCAGCTACACCTCCCGACAGATTCCACAGAATTTCATAGCTGACTACTTTG AGACGAGCAGCCAGTGCTCCAAGCCCAGTGTCATCTTTATAACCAAGAGAGGCCGGCAGGTCTGTGCTGACCCCAGTGA GGAGTGGGTCCAGAAATACGTCAGTGACCTGGAGCTGAGTGCC | GAGCTCAAAACCCCACTTGGTGACACAACTCACAC A | GAGCCCAAATCTTGTGACACACCTCCCCCGTGCCCAAGGTGCCCA | GGCGGTGGAAGCAGCGGAGGTGGAAGTGGA | GGACAGCCCCGAGAACCACAGGTGTACACCCTGCCCCCATCCCGGGAGGAGATGACCAAGAACCAGGTCAGCCTGACCT GCCTGGTCAAAGGCTTCTACCCCAGCGACATCGCCGTGGAGTGGGAGAGCAGCGGGCAGCCGGAGAACAACTACAACAC CACGCCTCCCATGCTGGACTCCGACGGCTCCTTCTTCCTCTACAGCAAGCTCACCGTGGACAAGAGCAGGTGGCAGCAG GGGAACATCTTCTCATGCTCCGTGATGCATGAGGCTCTGCACAACCGCTTCACGCAGAAGAGCCTCTCCCTGTCTCCGG GTAAA I GGCCTCGGTGGCCTG |
SEQ ID NO: 3
Аминокислотная последовательность константной кодирующей части всех белков VB10.NEO: B4001
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL |
SEQ ID NO: 4
B16-F10 мутированный эпитоп, B16-PepM1, аминокислотная последовательность
PSKPSFQEFVDWENVSPELNSTDQPFL
SEQ ID NO: 5
B16-F10 мутированный эпитоп, B16-PepM2, аминокислотная последовательность
REGVELCPGNKYEMRRHGTTHSLVIHD
SEQ ID NO: 6
B16-F10 мутированный эпитоп, B16-PepM3, аминокислотная последовательность
SHCHWNDLAVIPAGVVHNWDFEPRKVS
SEQ ID NO: 7
B16-F10 мутированный эпитоп, B16-PepM4, аминокислотная последовательность
GRGHLLGRLAAIVGKQVLLGRKVVVVR
SEQ ID NO: 8
B16-F10 мутированный эпитоп, B16-PepM5, аминокислотная последовательность
FRRKAFLHWYTGEAMDEMEFTEAESNM
SEQ ID NO: 9
B16-F10 мутированный эпитоп, B16-PepM6, аминокислотная последовательность
VVDRNPQFLDPVLAYLMKGLCEKPLAS
SEQ ID NO: 10
B16-F10 мутированный эпитоп, B16-PepM7, аминокислотная последовательность
SSPDEVALVEGVQSLGFTYLRLKDNYM
SEQ ID NO: 11
B16-F10 мутированный эпитоп, B16-PepM8, аминокислотная последовательность
EFKHIKAFDRTFANNPGPMVVFATPGM
SEQ ID NO: 12
B16-F10 мутированный эпитоп, B16-PepM9, аминокислотная последовательность
STANYNTSHLNNDVWQIFENPVDWKEK
SEQ ID NO: 13
B16-F10-мутированный эпитоп, B16-PepM10, аминокислотная последовательность
DSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 14
CT26-мутантный эпитоп, CT26-PepM1, аминокислотная последовательность
VILPQAPSGPSYATYLQPAQAQMLTPP
SEQ ID NO: 15
CT26-мутантный эпитоп, CT26-PepM2, аминокислотная последовательность
LHSGQNHLKEMAISVLEARACAAAGQS
SEQ ID NO: 16
CT26-мутантный эпитоп, CT26-PepM3, аминокислотная последовательность
PLLPFYPPDEALEIGLELNSSALPPTE
SEQ ID NO: 17
CT26 мутантный эпитоп, CT26-PepM4, аминокислотная последовательность
AGTQCEYWASRALDSEHSIGSMIQLPQ
SEQ ID NO: 18
CT26-мутантный эпитоп, CT26-PepM5, аминокислотная последовательность
AAYKGHHYPGPGNYFWKCLFMSGLSEV
SEQ ID NO: 19
CT26-мутированный эпитоп, CT26-PepM6, аминокислотная последовательность
DTLSAMSNPRAMQVLLQIQQGLQTLAT
SEQ ID NO: 20
CT26-мутантный эпитоп, CT26-PepM7, аминокислотная последовательность
DKPLRRNNSYTSYIMAICGMPLDSFRA
SEQ ID NO: 21
CT26 мутированный эпитоп, CT26-PepM8, аминокислотная последовательность
EVIQTSKYYMRDVIAIESAWLLELAPH
SEQ ID NO: 22
CT26-мутантный эпитоп, CT26-PepM9, аминокислотная последовательность
GYISRVTAGKDSYIALVDKNIMGYIAS
SEQ ID NO: 23
CT26 мутированный эпитоп, CT26-PepM10, аминокислотная последовательность
EHIHRAGGLFVADAIQVGFGRIGKHFW
SEQ ID NO: 24
Первый линкер, аминокислотная последовательность: GLSGL
SEQ ID NO: 25
Первый линкер, аминокислотная последовательность: GLGGL
SEQ ID NO: 26
Шарнирные области (шарнир IgG3 UH), 12 аминокислот: ELKTPLGDTTHT
SEQ ID NO: 27
Шарнирная область (шарнир IgG3, MH, 15 аминокислот): EPKSCDTPPPCPRCP
SEQ ID NO: 28
Gly-Ser Линкер: GGGSSGGGSG
SEQ ID NO: 29
hCH3 IgG3, аминокислотная последовательность: GQPREPQVYTLPPSREEMTKNQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQG NIFSCSVM H EALH N RFTQKSLSLSPGK
SEQ ID NO: 30
Аминокислотная последовательность конструкции VB4001 = VB10.NEO CT26-X = CT26 pepM1-M10, 5-aa линкер
Неоэпитопные последовательности вставлены после GGGSSGGGSG.
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTLHEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFCCKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
VILPQAPSGPSYATYLQPAQAQMLTPPGGGGSLHSGQNHLKEMAISVLEARACAAAGQSGGGGSPLLPFYPPDEALEIGLELNSSALPPTEGGGGSAGTQCEYWASRALDSEHSIGSMIQLPQGGGGSAAYKGHHYPGPGNYFWKCLFMSGLSEVGGGGSDTLSAMSNPRAMQVLLQIQQGLQTLATGGGGSDKPLRRNNSYTSYIMAICGMPLDSFRAGGGGSEVIQTSKYYMRDVIAIESAWLLELAPHGGGGSGYISRVTAGKDSYIALVDKNIMGYIASGGGGSEHIHRAGGLFVADAIQVGFGRIGKHFW
SEQ ID NO: 31
Аминокислотная последовательность конструкции VB4002 VB10.NEO CT26-III = CT26 pepM1-M3, 5-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
VILPQAPSGPSYATYLQPAQAQMLTPPGGGGSLHSGQNHLKEMAISVLEARACAAAGQSGGGGSPLLPFYPPDEALEIGLELNSSALPPTE
SEQ ID NO: 32
Аминокислотная последовательность конструкции VB4003 = VB10.NEO B16-X = B16 pepM1-M10, 5-aa линкер (VB10.Neo-10B)
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSFRRKAFLHWYTGEAMDEMEFTEAESNMGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGS DSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 33
Аминокислотная последовательность конструкции VB4004 = VB10.NEO B16-III = B16 pepM1-M3, 5-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVS
SEQ ID NO: 34
Сигнальный пептид
MNFGLRLIFLVLTLKGVQC
SEQ ID NO: 35
Сигнальный пептид
MDAMKRGLCCVLLLCGAVFVSP
SEQ ID NO: 36
B16-F10 мутированный эпитоп, B16-pepM11, аминокислотная последовательность
ANFESGKHKYRQTAMFTATMPPAVERL
SEQ ID NO: 37
Аминокислотная последовательность конструкции VB40 11 = VB10.NEO B16-X = B16 pepM1-M10, 10-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSGGGGSFRRKAFLHWYTGEAMDEMEFTEAESNMGGGGSGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSGGGGSDSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 38
Аминокислотная последовательность конструкции VB4012 = VB10.NEO B16-III = В16 pepM1-М3, 10-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVS
SEQ ID NO: 39
Аминокислотная последовательность конструкции VB4014 = VB10.NEO B16-X = B16 гидрофобное ядро, (pepM9+M5+M1+M4+M6+M8+M10+M3+M7+M2), 5-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
STANYNTSHLNNDVWQIFENPVDWKEKGGGGSFRRKAFLHWYTGEAMDEMEFTEAESNMGGGGSPSKPSFQEFVDWENVSPELNSTDQPFLGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSREGVELCPGNKYEMRRHGTTHSLVIHD
SEQ ID NO: 40
Аминокислотная последовательность конструкции VB4015 = VB10.NEO B16-III = В16 pepM1-М8-М3, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVS
SEQ ID NO: 41
Аминокислотная последовательность конструкции VB4016 = VB10.NEO B16-III = В16 pepM1-М3-М2, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSREGVELCPGNKYEMRRHGTTHSLVIHD
SEQ ID NO: 42
Аминокислотная последовательность конструкции VB4017 = VB10.NEO В16-В16 X = pepM1-M4+M11+M6-M10, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSANFESGKHKYRQTAMFTATMPPAVERLGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 43
Аминокислотная последовательность конструкции VB4018 = VB10.NEO В16-В16 XX = pepM1-М4+М11+М6-М10 х 2, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSANFESGKHKYRQTAMFTATMPPAVERLGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSPSKPSFQEFVDWENVSPELNSTDQPFLGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSANFESGKHKYRQTAMFTATMPPAVERLGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 44
Аминокислотная последовательность конструкции VB4019 = VB10.NEO В16-В16 = Vx2 pepM3-М4-М7-М9-М10 х 2, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
SHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 45
Аминокислотная последовательность конструкции VB4021 = VB10.NEO В16-В16 = VX4 pepM3-М4-М7-М9-М10 х 4, 5-аа линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
SHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSDSGSPFPAAVILRDALHMARGLKYLHQ
SEQ ID NO: 46
Аминокислотная последовательность конструкции VB40 24 = VB10.NEO B16-XV = B16 pepM1-M15, 10-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSGGGGSFRRKAFLHWYTGEAMDEMEFTEAESNMGGGGSGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSGGGGSANFESGKHKYRQTAMFTATMPPAVERLGGGGSGGGGSNHSGLVTFQAFIDVMSRETTDTDTADQGGGGSGGGGSCGTAFFINFIAIYHHASRAIPFGTMVAGGGGSGGGGSFVVKAYLPVNESFAFTADLRSNTGGQAGGGGSGGGGSTPPPEEAMPFEFNGPAQGDHSQPPLQV
SEQ ID NO: 47
Аминокислотная последовательность конструкции VB40 25 = VB10.NEO B16-XX = B16 pepM1-M20, 10-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
PSKPSFQEFVDWENVSPELNSTDQPFLGGGGSGGGGSREGVELCPGNKYEMRRHGTTHSLVIHDGGGGSGGGGSSHCHWNDLAVIPAGVVHNWDFEPRKVSGGGGSGGGGSGRGHLLGRLAAIVGKQVLLGRKVVVVRGGGGSGGGGSFRRKAFLHWYTGEAMDEMEFTEAESNMGGGGSGGGGSVVDRNPQFLDPVLAYLMKGLCEKPLASGGGGSGGGGSSSPDEVALVEGVQSLGFTYLRLKDNYMGGGGSGGGGSEFKHIKAFDRTFANNPGPMVVFATPGMGGGGSGGGGSSTANYNTSHLNNDVWQIFENPVDWKEKGGGGSGGGGSDSGSPFPAAVILRDALHMARGLKYLHQGGGGSGGGGSANFESGKHKYRQTAMFTATMPPAVERLGGGGSGGGGSNHSGLVTFQAFIDVMSRETTDTDTADQGGGGSGGGGSCGTAFFINFIAIYHHASRAIPFGTMVAGGGGSGGGGSFVVKAYLPVNESFAFTADLRSNTGGQAGGGGSGGGGSTPPPEEAMPFEFNGPAQGDHSQPPLQVGGGGSGGGGSPKPDFSQLQRNILPSNPRVTRFHINWDGGGGSGGGGSIPSGTTILNCFHDVLSGKLSGGSPGVPGGGGSGGGGSGFSQPLRRLVLHVVSAAQAERLARAEEGGGGSGGGGSECRITSNFVIPSEYWVEEKEEKQKLIQGGGGSGGGGSNIEGIDKLTQLKKPFLVNNKINKIENI
SEQ ID NO: 48
Аминокислотная последовательность конструкции VB40 26 = VB10.NEO CT26-XV = CT26 pepM1-M15, 10-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
VILPQAPSGPSYATYLQPAQAQMLTPPGGGGSGGGGSLHSGQNHLKEMAISVLEARACAAAGQSGGGGSGGGGSPLLPFYPPDEALEIGLELNSSALPPTEGGGGSGGGGSAGTQCEYWASRALDSEHSIGSMIQLPQGGGGSGGGGSAAYKGHHYPGPGNYFWKCLFMSGLSEVGGGGSGGGGSDTLSAMSNPRAMQVLLQIQQGLQTLATGGGGSGGGGSDKPLRRNNSYTSYIMAICGMPLDSFRAGGGGSGGGGSEVIQTSKYYMRDVIAIESAWLLELAPHGGGGSGGGGSGYISRVTAGKDSYIALVDKNIMGYIASGGGGSGGGGSEHIHRAGGLFVADAIQVGFGRIGKHFWGGGGSGGGGSQAIVRGCSMPGPWRSGRLLVSRRWSVEGGGGSGGGGSDGQLELLAQGALDNALSSMGALHALRPGGGGSGGGGSSHDSRKSTSFMSVNPSKEIKIVSAVRRGGGGSGGGGSHTPSSYIETLPKAIKRRINALKQLQVRGGGGSGGGGSMKAFIFKYSAKTGFTKLIDASRVSETE
SEQ ID NO: 49
Аминокислотная последовательность конструкции VB40 27 = VB10.NEO CT26-XX = CT26 pepM1-M20, 10-aa линкер
MQVSTAALAVLLCTMALCNQVLS | APLAADTPTACCFSYTSRQIPQNFIAD
YFETSSQCSKPSVIFLTKRGRQVCADPSEEWVQKYVSDLELSA | ELKTPLG
DTTHT I EPKSCDTPPPCPRCP | GGGSSGGGSG | GQPREPQVYTLPPSREEMTK
NQVSLTCLVKGFYPSDIAVEWESSGQPENNYNTTPPMLDSDGSFFLYSKL TVDKSRWQQGNIFSCSVMHEALHNRFTQKSLSLSPGK | GLGGL | MHGDTPTL
HEYMLDLQPETTDLYGYGQLNDSSEEEDEIDGPAGQAEPDRAHYNIVTFC
CKCDSTLRLCVQSTHVDIRTLEDLLMGTLGIVCPICSQKP | GGGSSGGGSG |
VILPQAPSGPSYATYLQPAQAQMLTPPGGGGSGGGGSLHSGQNHLKEMAISVLEARACAAAGQSGGGGSGGGGSPLLPFYPPDEALEIGLELNSSALPPTEGGGGSGGGGSAGTQCEYWASRALDSEHSIGSMIQLPQGGGGSGGGGSAAYKGHHYPGPGNYFWKCLFMSGLSEVGGGGSGGGGSDTLSAMSNPRAMQVLLQIQQGLQTLATGGGGSGGGGSDKPLRRNNSYTSYIMAICGMPLDSFRAGGGGSGGGGSEVIQTSKYYMRDVIAIESAWLLELAPHGGGGSGGGGSGYISRVTAGKDSYIALVDKNIMGYIASGGGGSGGGGSEHIHRAGGLFVADAIQVGFGRIGKHFWGGGGSGGGGSQAIVRGCSMPGPWRSGRLLVSRRWSVEGGGGSGGGGSDGQLELLAQGALDNALSSMGALHALRPGGGGSGGGGSSHDSRKSTSFMSVNPSKEIKIVSAVRRGGGGSGGGGSHTPSSYIETLPKAIKRRINALKQLQVRGGGGSGGGGSMKAFIFKYSAKTGFTKLIDASRVSETEGGGGSGGGGSEGDPCLRSSDCIDEFCCARHFWTKICKGGGGSGGGGSWKGGPVKIDPLALMQAIERYLVVRGYGGGGGSGGGGSVTSIPSVSNALNWKEFSFIQSTLGYVAGGGGSGGGGSYRGANLHLEETLAGFWARLLERLFKQLGGGGSGGGGSKTTLSHTQDSSQSLQSSSDSSKSSRCS
SEQ ID NO: 50
CT26 мутантный эпитоп, CT26-PepM11, аминокислотная последовательность
QAIVRGCSMPGPWRSGRLLVSRRWSVE
SEQ ID NO: 51
CT26 мутантный эпитоп, CT26-PepM12, аминокислотная последовательность
DGQLELLAQGALDNALSSMGALHALRP
SEQ ID NO: 52
CT26 мутантный эпитоп, CT26-PepM13, аминокислотная последовательность
SHDSRKSTSFMSVNPSKEIKIVSAVRR
SEQ ID NO: 53
CT26 мутантный эпитоп, CT26-PepM14, аминокислотная последовательность
TPSSYIETLPKAIKRRINALKQLQVR
SEQ ID NO: 54
CT26 мутантный эпитоп, CT26-PepM15, аминокислотная последовательность
MKAFIFKYSAKTGFTKLIDASRVSETE
SEQ ID NO: 55
CT26 мутантный эпитоп, CT26-PepM16, аминокислотная последовательность
EGDPCLRSSDCIDEFCCARHFWTKICK
SEQ ID NO: 56
CT26 мутантный эпитоп, CT26-PepM17, аминокислотная последовательность
WKGGPVKIDPLALMQAIERYLVVRGYG
SEQ ID NO: 57
CT26 мутантный эпитоп, CT26-PepM18, аминокислотная последовательность
VTSIPSVSNALNWKEFSFIQSTLGYVA
SEQ ID NO: 58
CT26 мутантный эпитоп, CT26-PepM19, аминокислотная последовательность
YRGANLHLEETLAGFWARLLERLFKQL
SEQ ID NO: 59
CT26-мутированный эпитоп, CT26-PepM20, аминокислотная последовательность
KTTLSHTQDSSQSLQSSSDSSKSSRCS
SEQ ID NO: 60
B16-F10 мутантный эпитоп, B16-PepM12, аминокислотная последовательность
NHSGLVTFQAFIDVMSRETTDTDTADQ
SEQ ID NO: 61
B16-F10 мутированный эпитоп, B16-PepM13, аминокислотная последовательность
CGTAFFINFIAIYHHASRAIPFGTMVA
SEQ ID NO: 62
B16-F10-мутированный эпитоп, B16-PepM14, аминокислотная последовательность
FVVKAYLPVNESFAFTADLRSNTGGQA
SEQ ID NO: 63
B16-F10 мутированный эпитоп, B16-PepM15, аминокислотная последовательность
TPPPEEAMPFEFNGPAQGDHSQPPLQV
SEQ ID NO: 4
B16-F10 мутированный эпитоп, B16-PepM16, аминокислотная последовательность
PKPDFSQLQRNILPSNPRVTRFHINWD
SEQ ID NO: 65
B16-F10 мутированный эпитоп, B16-PepM17, аминокислотная последовательность
IPSGTTILNCFHDVLSGKLSGGSPGVP
SEQ ID NO: 66
B16-F10 мутированный эпитоп, B16-PepM18, аминокислотная последовательность
GFSQPLRRLVLHVVSAAQAERLARAEE
SEQ ID NO: 67
B16-F10 мутированный эпитоп, B16-PepM19, аминокислотная последовательность
ECRITSNFVIPSEYWVEEKEEKQKLIQ
SEQ ID NO: 68
B16-F10 мутированный эпитоп, B16-PepM20, аминокислотная последовательность
NIEGIDKLTQLKKPFLVNNKINKIENI
SEQ ID NO: 69. Линкер: GGGSS
SEQ ID NO: 70. Линкер: GGGSG
SEQ ID NO: 71. Линкер: GGGGS
SEQ ID NO: 72. Линкер: LGGGS
SEQ ID NO: 73. Линкер: GLGGS
SEQ ID NO: 74. Линкер: GGLGS
SEQ ID NO: 75. Линкер: GGGLS
SEQ ID NO: 76. Линкер: GGGGL
SEQ ID NO: 77. Линкер: LGGSG
SEQ ID NO: 78. Линкер: GLGSG
SEQ ID NO: 79. Линкер: GGLSG
SEQ ID NO: 80. Линкер: GGGLG
SEQ ID NO: 81. Линкер: GGGSL
SEQ ID NO: 82. Линкер: LGGSS
SEQ ID NO: 83. Линкер: GLGSS
SEQ ID NO: 84. Линкер: GGLSS
SEQ ID NO: 85. Линкер: GGGLS
SEQ ID NO: 86. Линкер: GGGSL
SEQ ID NO: 87. Линкер: LGLGS
SEQ ID NO: 88. Линкер: GLGLS
SEQ ID NO: 89. Линкер: GLLGS
SEQ ID NO: 90. Линкер: LGGLS
SEQ ID NO: 91. Линкер: GLGGL
SEQ ID NO: 92. Линкер: LGLSG
SEQ ID NO: 93. Линкер: GLLSG
SEQ ID NO: 94. Линкер: GGLSL
SEQ ID NO: 95. Линкер: GGLLG
SEQ ID NO: 96. Линкер: GLGSL
SEQ ID NO: 97. Линкер: LGLSS
SEQ ID NO: 98. Линкер: GLGLS
SEQ ID NO: 99. Линкер: GGLLS
SEQ ID NO: 100. Линкер: GLGSL
SEQ ID NO: 101. Линкер: GLGSL
SEQ ID NO: 102. Линкер: LGGGSGGGGS
SEQ ID NO: 103. Линкер: GLGGSGGGGS
SEQ ID NO: 104. Линкер: GGLGSGGGGS
SEQ ID NO: 105. Линкер: GGGLSGGGGS
SEQ ID NO: 106. Линкер: GGGGLGGGGS
SEQ ID NO: 107. Линкер: LGGSGGGGSG
SEQ ID NO: 108. Линкер: GLGSGGGGSG
SEQ ID NO: 109. Линкер: GGLSGGGGSG
SEQ ID NO: 110. Линкер: GGGLGGGGSG
SEQ ID NO: 111. Линкер: GGGSLGGGSG
SEQ ID NO: 112. Линкер: GGGSLGGGSG
SEQ ID NO: 113. Линкер: GLGSSGGGSS
SEQ ID NO: 114. Линкер: GGLSSGGGSS
SEQ ID NO: 115. Линкер: GGGLSGGGSS
SEQ ID NO: 116. Линкер: GGGSLGGGSS
SEQ ID NO: 117. Линкер: LGGGSLGGGS
SEQ ID NO: 118. Линкер: GLGGSGLGGS
SEQ ID NO: 119. Линкер: GGLGSGGLGS
SEQ ID NO: 120. Линкер: GGGLSGGGLS
SEQ ID NO: 121. Линкер: GGGGGGGGGL
SEQ ID NO: 122. Линкер: LGGSGLGGSG
SEQ ID NO: 123. Линкер: GLGSGGLGSG
SEQ ID NO: 124. Линкер: GGLSGGGLSG
SEQ ID NO: 125. Линкер: GGGLGGGGLG
SEQ ID NO: 126. Линкер: GGGSLGGGSL
SEQ ID NO: 127. Линкер: LGGSSLGGSS
SEQ ID NO: 128. Линкер: GLGSSGLGSS
SEQ ID NO: 129. Линкер: GGLSSGGLSS
SEQ ID NO: 130. Линкер: GGGLSGGGL
SEQ ID NO: 131. Линкер: GGGSLGGGSL
--->
ПЕРЕЧНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Ваксибоди АС
<120> Лечебная противоопухолевая неоэпитопная вакцина
<130> P4068PC00
<160> 131
<170> PatentIn version 3.5
<210> 1
<211> 93
<212> PRT
<213> Homo sapiens
<400> 1
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala
85 90
<210> 2
<211> 726
<212> ДНК
<213> Искусственная последовательность
<220>
<223> Вектор
<400> 2
atgcaggtct ccactgctgc ccttgccgtc ctcctctgca ccatggctct ctgcaaccag 60
gtcctctctg caccacttgc tgctgacacg ccgaccgcct gctgcttcag ctacacctcc 120
cgacagattc cacagaattt catagctgac tactttgaga cgagcagcca gtgctccaag 180
cccagtgtca tcttcctaac caagagaggc cggcaggtct gtgctgaccc cagtgaggag 240
tgggtccaga aatacgtcag tgacctggag ctgagtgccg agctcaaaac cccacttggt 300
gacacaactc acacagagcc caaatcttgt gacacacctc ccccgtgccc aaggtgccca 360
ggcggtggaa gcagcggagg tggaagtgga ggacagcccc gagaaccaca ggtgtacacc 420
ctgcccccat cccgggagga gatgaccaag aaccaggtca gcctgacctg cctggtcaaa 480
ggcttctacc ccagcgacat cgccgtggag tgggagagca gcgggcagcc ggagaacaac 540
tacaacacca cgcctcccat gctggactcc gacggctcct tcttcctcta cagcaagctc 600
accgtggaca agagcaggtg gcagcagggg aacatcttct catgctccgt gatgcatgag 660
gctctgcaca accgcttcac gcagaagagc ctctccctgt ctccgggtaa aggcctcggt 720
ggcctg 726
<210> 3
<211> 243
<212> PRT
<213> Искусственная последовательность
<220>
<223> Homodimeric construct
<400> 3
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu
<210> 4
<211> 27
<212> PRT
<213> Mus musculus
<400> 4
Pro Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser
1 5 10 15
Pro Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu
20 25
<210> 5
<211> 27
<212> PRT
<213> Mus musculus
<400> 5
Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg
1 5 10 15
His Gly Thr Thr His Ser Leu Val Ile His Asp
20 25
<210> 6
<211> 27
<212> PRT
<213> Mus musculus
<400> 6
Ser His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val
1 5 10 15
His Asn Trp Asp Phe Glu Pro Arg Lys Val Ser
20 25
<210> 7
<211> 27
<212> PRT
<213> Mus musculus
<400> 7
Gly Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln
1 5 10 15
Val Leu Leu Gly Arg Lys Val Val Val Val Arg
20 25
<210> 8
<211> 27
<212> PRT
<213> Mus musculus
<400> 8
Phe Arg Arg Lys Ala Phe Leu His Trp Tyr Thr Gly Glu Ala Met Asp
1 5 10 15
Glu Met Glu Phe Thr Glu Ala Glu Ser Asn Met
20 25
<210> 9
<211> 27
<212> PRT
<213> Mus musculus
<400> 9
Val Val Asp Arg Asn Pro Gln Phe Leu Asp Pro Val Leu Ala Tyr Leu
1 5 10 15
Met Lys Gly Leu Cys Glu Lys Pro Leu Ala Ser
20 25
<210> 10
<211> 27
<212> PRT
<213> Mus musculus
<400> 10
Ser Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly
1 5 10 15
Phe Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met
20 25
<210> 11
<211> 27
<212> PRT
<213> Mus musculus
<400> 11
Glu Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro
1 5 10 15
Gly Pro Met Val Val Phe Ala Thr Pro Gly Met
20 25
<210> 12
<211> 27
<212> PRT
<213> Mus musculus
<400> 12
Ser Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln
1 5 10 15
Ile Phe Glu Asn Pro Val Asp Trp Lys Glu Lys
20 25
<210> 13
<211> 27
<212> PRT
<213> Mus musculus
<400> 13
Asp Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu
1 5 10 15
His Met Ala Arg Gly Leu Lys Tyr Leu His Gln
20 25
<210> 14
<211> 27
<212> PRT
<213> Mus musculus
<400> 14
Val Ile Leu Pro Gln Ala Pro Ser Gly Pro Ser Tyr Ala Thr Tyr Leu
1 5 10 15
Gln Pro Ala Gln Ala Gln Met Leu Thr Pro Pro
20 25
<210> 15
<211> 27
<212> PRT
<213> Mus musculus
<400> 15
Leu His Ser Gly Gln Asn His Leu Lys Glu Met Ala Ile Ser Val Leu
1 5 10 15
Glu Ala Arg Ala Cys Ala Ala Ala Gly Gln Ser
20 25
<210> 16
<211> 27
<212> PRT
<213> Mus musculus
<400> 16
Pro Leu Leu Pro Phe Tyr Pro Pro Asp Glu Ala Leu Glu Ile Gly Leu
1 5 10 15
Glu Leu Asn Ser Ser Ala Leu Pro Pro Thr Glu
20 25
<210> 17
<211> 27
<212> PRT
<213> Mus musculus
<400> 17
Ala Gly Thr Gln Cys Glu Tyr Trp Ala Ser Arg Ala Leu Asp Ser Glu
1 5 10 15
His Ser Ile Gly Ser Met Ile Gln Leu Pro Gln
20 25
<210> 18
<211> 27
<212> PRT
<213> Mus musculus
<400> 18
Ala Ala Tyr Lys Gly His His Tyr Pro Gly Pro Gly Asn Tyr Phe Trp
1 5 10 15
Lys Cys Leu Phe Met Ser Gly Leu Ser Glu Val
20 25
<210> 19
<211> 27
<212> PRT
<213> Mus musculus
<400> 19
Asp Thr Leu Ser Ala Met Ser Asn Pro Arg Ala Met Gln Val Leu Leu
1 5 10 15
Gln Ile Gln Gln Gly Leu Gln Thr Leu Ala Thr
20 25
<210> 20
<211> 27
<212> PRT
<213> Mus musculus
<400> 20
Asp Lys Pro Leu Arg Arg Asn Asn Ser Tyr Thr Ser Tyr Ile Met Ala
1 5 10 15
Ile Cys Gly Met Pro Leu Asp Ser Phe Arg Ala
20 25
<210> 21
<211> 27
<212> PRT
<213> Mus musculus
<400> 21
Glu Val Ile Gln Thr Ser Lys Tyr Tyr Met Arg Asp Val Ile Ala Ile
1 5 10 15
Glu Ser Ala Trp Leu Leu Glu Leu Ala Pro His
20 25
<210> 22
<211> 27
<212> PRT
<213> Mus musculus
<400> 22
Gly Tyr Ile Ser Arg Val Thr Ala Gly Lys Asp Ser Tyr Ile Ala Leu
1 5 10 15
Val Asp Lys Asn Ile Met Gly Tyr Ile Ala Ser
20 25
<210> 23
<211> 27
<212> PRT
<213> Mus musculus
<400> 23
Glu His Ile His Arg Ala Gly Gly Leu Phe Val Ala Asp Ala Ile Gln
1 5 10 15
Val Gly Phe Gly Arg Ile Gly Lys His Phe Trp
20 25
<210> 24
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 24
Gly Leu Ser Gly Leu
1 5
<210> 25
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 25
Gly Leu Gly Gly Leu
1 5
<210> 26
<211> 12
<212> PRT
<213> Искусственная последовательность
<220>
<223> Hinge region
<400> 26
Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr
1 5 10
<210> 27
<211> 15
<212> PRT
<213> Искусственная последовательность
<220>
<223> Hinge region
<400> 27
Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
1 5 10 15
<210> 28
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 28
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly
1 5 10
<210> 29
<211> 107
<212> PRT
<213> Homo sapiens
<400> 29
Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu
1 5 10 15
Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly Phe
20 25 30
Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly Gln Pro Glu
35 40 45
Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp Gly Ser Phe
50 55 60
Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp Gln Gln Gly
65 70 75 80
Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn Arg Phe
85 90 95
Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
100 105
<210> 30
<211> 666
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 30
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Val
340 345 350
Ile Leu Pro Gln Ala Pro Ser Gly Pro Ser Tyr Ala Thr Tyr Leu Gln
355 360 365
Pro Ala Gln Ala Gln Met Leu Thr Pro Pro Gly Gly Gly Gly Ser Leu
370 375 380
His Ser Gly Gln Asn His Leu Lys Glu Met Ala Ile Ser Val Leu Glu
385 390 395 400
Ala Arg Ala Cys Ala Ala Ala Gly Gln Ser Gly Gly Gly Gly Ser Pro
405 410 415
Leu Leu Pro Phe Tyr Pro Pro Asp Glu Ala Leu Glu Ile Gly Leu Glu
420 425 430
Leu Asn Ser Ser Ala Leu Pro Pro Thr Glu Gly Gly Gly Gly Ser Ala
435 440 445
Gly Thr Gln Cys Glu Tyr Trp Ala Ser Arg Ala Leu Asp Ser Glu His
450 455 460
Ser Ile Gly Ser Met Ile Gln Leu Pro Gln Gly Gly Gly Gly Ser Ala
465 470 475 480
Ala Tyr Lys Gly His His Tyr Pro Gly Pro Gly Asn Tyr Phe Trp Lys
485 490 495
Cys Leu Phe Met Ser Gly Leu Ser Glu Val Gly Gly Gly Gly Ser Asp
500 505 510
Thr Leu Ser Ala Met Ser Asn Pro Arg Ala Met Gln Val Leu Leu Gln
515 520 525
Ile Gln Gln Gly Leu Gln Thr Leu Ala Thr Gly Gly Gly Gly Ser Asp
530 535 540
Lys Pro Leu Arg Arg Asn Asn Ser Tyr Thr Ser Tyr Ile Met Ala Ile
545 550 555 560
Cys Gly Met Pro Leu Asp Ser Phe Arg Ala Gly Gly Gly Gly Ser Glu
565 570 575
Val Ile Gln Thr Ser Lys Tyr Tyr Met Arg Asp Val Ile Ala Ile Glu
580 585 590
Ser Ala Trp Leu Leu Glu Leu Ala Pro His Gly Gly Gly Gly Ser Gly
595 600 605
Tyr Ile Ser Arg Val Thr Ala Gly Lys Asp Ser Tyr Ile Ala Leu Val
610 615 620
Asp Lys Asn Ile Met Gly Tyr Ile Ala Ser Gly Gly Gly Gly Ser Glu
625 630 635 640
His Ile His Arg Ala Gly Gly Leu Phe Val Ala Asp Ala Ile Gln Val
645 650 655
Gly Phe Gly Arg Ile Gly Lys His Phe Trp
660 665
<210> 31
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 31
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Val
340 345 350
Ile Leu Pro Gln Ala Pro Ser Gly Pro Ser Tyr Ala Thr Tyr Leu Gln
355 360 365
Pro Ala Gln Ala Gln Met Leu Thr Pro Pro Gly Gly Gly Gly Ser Leu
370 375 380
His Ser Gly Gln Asn His Leu Lys Glu Met Ala Ile Ser Val Leu Glu
385 390 395 400
Ala Arg Ala Cys Ala Ala Ala Gly Gln Ser Gly Gly Gly Gly Ser Pro
405 410 415
Leu Leu Pro Phe Tyr Pro Pro Asp Glu Ala Leu Glu Ile Gly Leu Glu
420 425 430
Leu Asn Ser Ser Ala Leu Pro Pro Thr Glu
435 440
<210> 32
<211> 817
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 32
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Met Gln Val Ser Thr Ala Ala Leu Ala
145 150 155 160
Val Leu Leu Cys Thr Met Ala Leu Cys Asn Gln Val Leu Ser Ala Pro
165 170 175
Leu Ala Ala Asp Thr Pro Thr Ala Cys Cys Phe Ser Tyr Thr Ser Arg
180 185 190
Gln Ile Pro Gln Asn Phe Ile Ala Asp Tyr Phe Glu Thr Ser Ser Gln
195 200 205
Cys Ser Lys Pro Ser Val Ile Phe Leu Thr Lys Arg Gly Arg Gln Val
210 215 220
Cys Ala Asp Pro Ser Glu Glu Trp Val Gln Lys Tyr Val Ser Asp Leu
225 230 235 240
Glu Leu Ser Ala Glu Leu Lys Thr Pro Leu Gly Asp Thr Thr His Thr
245 250 255
Ile Glu Pro Lys Ser Cys Asp Thr Pro Pro Pro Cys Pro Arg Cys Pro
260 265 270
Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Gly Gln Pro Arg Glu Pro
275 280 285
Gln Val Tyr Thr Leu Pro Pro Ser Arg Glu Glu Met Thr Lys Asn Gln
290 295 300
Val Ser Leu Thr Cys Leu Val Lys Gly Phe Tyr Pro Ser Asp Ile Ala
305 310 315 320
Val Glu Trp Glu Ser Ser Gly Gln Pro Glu Asn Asn Tyr Asn Thr Thr
325 330 335
Pro Pro Met Leu Asp Ser Asp Gly Ser Phe Phe Leu Tyr Ser Lys Leu
340 345 350
Thr Val Asp Lys Ser Arg Trp Gln Gln Gly Asn Ile Phe Ser Cys Ser
355 360 365
Val Met His Glu Ala Leu His Asn Arg Phe Thr Gln Lys Ser Leu Ser
370 375 380
Leu Ser Pro Gly Lys Gly Leu Gly Gly Leu Met His Gly Asp Thr Pro
385 390 395 400
Thr Leu His Glu Tyr Met Leu Asp Leu Gln Pro Glu Thr Thr Asp Leu
405 410 415
Tyr Gly Tyr Gly Gln Leu Asn Asp Ser Ser Glu Glu Glu Asp Glu Ile
420 425 430
Asp Gly Pro Ala Gly Gln Ala Glu Pro Asp Arg Ala His Tyr Asn Ile
435 440 445
Val Thr Phe Cys Cys Lys Cys Asp Ser Thr Leu Arg Leu Cys Val Gln
450 455 460
Ser Thr His Val Asp Ile Arg Thr Leu Glu Asp Leu Leu Met Gly Thr
465 470 475 480
Leu Gly Ile Val Cys Pro Ile Cys Ser Gln Lys Pro Gly Gly Gly Ser
485 490 495
Ser Gly Gly Gly Ser Gly Pro Ser Lys Pro Ser Phe Gln Glu Phe Val
500 505 510
Asp Trp Glu Asn Val Ser Pro Glu Leu Asn Ser Thr Asp Gln Pro Phe
515 520 525
Leu Gly Gly Gly Gly Ser Arg Glu Gly Val Glu Leu Cys Pro Gly Asn
530 535 540
Lys Tyr Glu Met Arg Arg His Gly Thr Thr His Ser Leu Val Ile His
545 550 555 560
Asp Gly Gly Gly Gly Ser Ser His Cys His Trp Asn Asp Leu Ala Val
565 570 575
Ile Pro Ala Gly Val Val His Asn Trp Asp Phe Glu Pro Arg Lys Val
580 585 590
Ser Gly Gly Gly Gly Ser Gly Arg Gly His Leu Leu Gly Arg Leu Ala
595 600 605
Ala Ile Val Gly Lys Gln Val Leu Leu Gly Arg Lys Val Val Val Val
610 615 620
Arg Gly Gly Gly Gly Ser Phe Arg Arg Lys Ala Phe Leu His Trp Tyr
625 630 635 640
Thr Gly Glu Ala Met Asp Glu Met Glu Phe Thr Glu Ala Glu Ser Asn
645 650 655
Met Gly Gly Gly Gly Ser Val Val Asp Arg Asn Pro Gln Phe Leu Asp
660 665 670
Pro Val Leu Ala Tyr Leu Met Lys Gly Leu Cys Glu Lys Pro Leu Ala
675 680 685
Ser Gly Gly Gly Gly Ser Ser Ser Pro Asp Glu Val Ala Leu Val Glu
690 695 700
Gly Val Gln Ser Leu Gly Phe Thr Tyr Leu Arg Leu Lys Asp Asn Tyr
705 710 715 720
Met Gly Gly Gly Gly Ser Glu Phe Lys His Ile Lys Ala Phe Asp Arg
725 730 735
Thr Phe Ala Asn Asn Pro Gly Pro Met Val Val Phe Ala Thr Pro Gly
740 745 750
Met Gly Gly Gly Gly Ser Ser Thr Ala Asn Tyr Asn Thr Ser His Leu
755 760 765
Asn Asn Asp Val Trp Gln Ile Phe Glu Asn Pro Val Asp Trp Lys Glu
770 775 780
Lys Gly Gly Gly Gly Ser Asp Ser Gly Ser Pro Phe Pro Ala Ala Val
785 790 795 800
Ile Leu Arg Asp Ala Leu His Met Ala Arg Gly Leu Lys Tyr Leu His
805 810 815
Gln
<210> 33
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 33
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Arg
370 375 380
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
385 390 395 400
Gly Thr Thr His Ser Leu Val Ile His Asp Gly Gly Gly Gly Ser Ser
405 410 415
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
420 425 430
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser
435 440
<210> 34
<211> 19
<212> PRT
<213> Искусственная последовательность
<220>
<223> Signal peptide
<400> 34
Met Asn Phe Gly Leu Arg Leu Ile Phe Leu Val Leu Thr Leu Lys Gly
1 5 10 15
Val Gln Cys
<210> 35
<211> 22
<212> PRT
<213> Искусственная последовательность
<220>
<223> Signal peptide
<400> 35
Met Asp Ala Met Lys Arg Gly Leu Cys Cys Val Leu Leu Leu Cys Gly
1 5 10 15
Ala Val Phe Val Ser Pro
20
<210> 36
<211> 27
<212> PRT
<213> Mus musculus
<400> 36
Ala Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met Phe
1 5 10 15
Thr Ala Thr Met Pro Pro Ala Val Glu Arg Leu
20 25
<210> 37
<211> 711
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 37
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr
385 390 395 400
Glu Met Arg Arg His Gly Thr Thr His Ser Leu Val Ile His Asp Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Cys His Trp Asn Asp
420 425 430
Leu Ala Val Ile Pro Ala Gly Val Val His Asn Trp Asp Phe Glu Pro
435 440 445
Arg Lys Val Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg
450 455 460
Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val Leu
465 470 475 480
Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Gly Gly
485 490 495
Gly Gly Ser Phe Arg Arg Lys Ala Phe Leu His Trp Tyr Thr Gly Glu
500 505 510
Ala Met Asp Glu Met Glu Phe Thr Glu Ala Glu Ser Asn Met Gly Gly
515 520 525
Gly Gly Ser Gly Gly Gly Gly Ser Val Val Asp Arg Asn Pro Gln Phe
530 535 540
Leu Asp Pro Val Leu Ala Tyr Leu Met Lys Gly Leu Cys Glu Lys Pro
545 550 555 560
Leu Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Pro
565 570 575
Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe Thr Tyr
580 585 590
Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Gly Gly Gly
595 600 605
Gly Ser Glu Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn
610 615 620
Asn Pro Gly Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Gly Ser Ser Thr Ala Asn Tyr Asn Thr Ser His
645 650 655
Leu Asn Asn Asp Val Trp Gln Ile Phe Glu Asn Pro Val Asp Trp Lys
660 665 670
Glu Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ser Gly Ser
675 680 685
Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His Met Ala Arg
690 695 700
Gly Leu Lys Tyr Leu His Gln
705 710
<210> 38
<211> 452
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 38
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr
385 390 395 400
Glu Met Arg Arg His Gly Thr Thr His Ser Leu Val Ile His Asp Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Cys His Trp Asn Asp
420 425 430
Leu Ala Val Ile Pro Ala Gly Val Val His Asn Trp Asp Phe Glu Pro
435 440 445
Arg Lys Val Ser
450
<210> 39
<211> 666
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 39
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Ser
340 345 350
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
355 360 365
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Phe
370 375 380
Arg Arg Lys Ala Phe Leu His Trp Tyr Thr Gly Glu Ala Met Asp Glu
385 390 395 400
Met Glu Phe Thr Glu Ala Glu Ser Asn Met Gly Gly Gly Gly Ser Pro
405 410 415
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
420 425 430
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Gly
435 440 445
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
450 455 460
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Val
465 470 475 480
Val Asp Arg Asn Pro Gln Phe Leu Asp Pro Val Leu Ala Tyr Leu Met
485 490 495
Lys Gly Leu Cys Glu Lys Pro Leu Ala Ser Gly Gly Gly Gly Ser Glu
500 505 510
Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro Gly
515 520 525
Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly Gly Ser Asp
530 535 540
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
545 550 555 560
Met Ala Arg Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Ser
565 570 575
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
580 585 590
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Ser
595 600 605
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
610 615 620
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Arg
625 630 635 640
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
645 650 655
Gly Thr Thr His Ser Leu Val Ile His Asp
660 665
<210> 40
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 40
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Glu
370 375 380
Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro Gly
385 390 395 400
Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly Gly Ser Ser
405 410 415
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
420 425 430
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser
435 440
<210> 41
<211> 442
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 41
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Ser
370 375 380
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
385 390 395 400
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Arg
405 410 415
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
420 425 430
Gly Thr Thr His Ser Leu Val Ile His Asp
435 440
<210> 42
<211> 666
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 42
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Arg
370 375 380
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
385 390 395 400
Gly Thr Thr His Ser Leu Val Ile His Asp Gly Gly Gly Gly Ser Ser
405 410 415
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
420 425 430
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
435 440 445
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
450 455 460
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ala
465 470 475 480
Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met Phe Thr
485 490 495
Ala Thr Met Pro Pro Ala Val Glu Arg Leu Gly Gly Gly Gly Ser Val
500 505 510
Val Asp Arg Asn Pro Gln Phe Leu Asp Pro Val Leu Ala Tyr Leu Met
515 520 525
Lys Gly Leu Cys Glu Lys Pro Leu Ala Ser Gly Gly Gly Gly Ser Ser
530 535 540
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
545 550 555 560
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Glu
565 570 575
Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro Gly
580 585 590
Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly Gly Ser Ser
595 600 605
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
610 615 620
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
625 630 635 640
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
645 650 655
Met Ala Arg Gly Leu Lys Tyr Leu His Gln
660 665
<210> 43
<211> 986
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 43
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Arg
370 375 380
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
385 390 395 400
Gly Thr Thr His Ser Leu Val Ile His Asp Gly Gly Gly Gly Ser Ser
405 410 415
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
420 425 430
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
435 440 445
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
450 455 460
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ala
465 470 475 480
Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met Phe Thr
485 490 495
Ala Thr Met Pro Pro Ala Val Glu Arg Leu Gly Gly Gly Gly Ser Val
500 505 510
Val Asp Arg Asn Pro Gln Phe Leu Asp Pro Val Leu Ala Tyr Leu Met
515 520 525
Lys Gly Leu Cys Glu Lys Pro Leu Ala Ser Gly Gly Gly Gly Ser Ser
530 535 540
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
545 550 555 560
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Glu
565 570 575
Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro Gly
580 585 590
Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly Gly Ser Ser
595 600 605
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
610 615 620
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
625 630 635 640
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
645 650 655
Met Ala Arg Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Pro
660 665 670
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
675 680 685
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Arg
690 695 700
Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr Glu Met Arg Arg His
705 710 715 720
Gly Thr Thr His Ser Leu Val Ile His Asp Gly Gly Gly Gly Ser Ser
725 730 735
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
740 745 750
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
755 760 765
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
770 775 780
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ala
785 790 795 800
Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met Phe Thr
805 810 815
Ala Thr Met Pro Pro Ala Val Glu Arg Leu Gly Gly Gly Gly Ser Val
820 825 830
Val Asp Arg Asn Pro Gln Phe Leu Asp Pro Val Leu Ala Tyr Leu Met
835 840 845
Lys Gly Leu Cys Glu Lys Pro Leu Ala Ser Gly Gly Gly Gly Ser Ser
850 855 860
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
865 870 875 880
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Glu
885 890 895
Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn Asn Pro Gly
900 905 910
Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly Gly Ser Ser
915 920 925
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
930 935 940
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
945 950 955 960
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
965 970 975
Met Ala Arg Gly Leu Lys Tyr Leu His Gln
980 985
<210> 44
<211> 666
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 44
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Ser
340 345 350
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
355 360 365
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
370 375 380
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
385 390 395 400
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ser
405 410 415
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
420 425 430
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Ser
435 440 445
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
450 455 460
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
465 470 475 480
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
485 490 495
Met Ala Arg Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Ser
500 505 510
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
515 520 525
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
530 535 540
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
545 550 555 560
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ser
565 570 575
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
580 585 590
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Ser
595 600 605
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
610 615 620
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
625 630 635 640
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
645 650 655
Met Ala Arg Gly Leu Lys Tyr Leu His Gln
660 665
<210> 45
<211> 826
<212> PRT
<213> Искусственная последовательность
<220>
<223> Construct
<400> 45
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Ser
340 345 350
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
355 360 365
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
370 375 380
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
385 390 395 400
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ser
405 410 415
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
420 425 430
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Ser
435 440 445
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
450 455 460
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
465 470 475 480
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
485 490 495
Met Ala Arg Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Ser
500 505 510
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
515 520 525
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
530 535 540
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
545 550 555 560
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ser
565 570 575
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
580 585 590
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Ser
595 600 605
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
610 615 620
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
625 630 635 640
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
645 650 655
Met Ala Arg Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Ser
660 665 670
His Cys His Trp Asn Asp Leu Ala Val Ile Pro Ala Gly Val Val His
675 680 685
Asn Trp Asp Phe Glu Pro Arg Lys Val Ser Gly Gly Gly Gly Ser Gly
690 695 700
Arg Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val
705 710 715 720
Leu Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Ser
725 730 735
Ser Pro Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe
740 745 750
Thr Tyr Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Ser
755 760 765
Thr Ala Asn Tyr Asn Thr Ser His Leu Asn Asn Asp Val Trp Gln Ile
770 775 780
Phe Glu Asn Pro Val Asp Trp Lys Glu Lys Gly Gly Gly Gly Ser Asp
785 790 795 800
Ser Gly Ser Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His
805 810 815
Met Ala Arg Gly Leu Lys Tyr Leu His Gln
820 825
<210> 46
<211> 896
<212> PRT
<213> Искусственная последовательность
<220>
<223> VB construct
<400> 46
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr
385 390 395 400
Glu Met Arg Arg His Gly Thr Thr His Ser Leu Val Ile His Asp Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Cys His Trp Asn Asp
420 425 430
Leu Ala Val Ile Pro Ala Gly Val Val His Asn Trp Asp Phe Glu Pro
435 440 445
Arg Lys Val Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg
450 455 460
Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val Leu
465 470 475 480
Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Gly Gly
485 490 495
Gly Gly Ser Phe Arg Arg Lys Ala Phe Leu His Trp Tyr Thr Gly Glu
500 505 510
Ala Met Asp Glu Met Glu Phe Thr Glu Ala Glu Ser Asn Met Gly Gly
515 520 525
Gly Gly Ser Gly Gly Gly Gly Ser Val Val Asp Arg Asn Pro Gln Phe
530 535 540
Leu Asp Pro Val Leu Ala Tyr Leu Met Lys Gly Leu Cys Glu Lys Pro
545 550 555 560
Leu Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Pro
565 570 575
Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe Thr Tyr
580 585 590
Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Gly Gly Gly
595 600 605
Gly Ser Glu Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn
610 615 620
Asn Pro Gly Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Gly Ser Ser Thr Ala Asn Tyr Asn Thr Ser His
645 650 655
Leu Asn Asn Asp Val Trp Gln Ile Phe Glu Asn Pro Val Asp Trp Lys
660 665 670
Glu Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ser Gly Ser
675 680 685
Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His Met Ala Arg
690 695 700
Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly
705 710 715 720
Ser Ala Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met
725 730 735
Phe Thr Ala Thr Met Pro Pro Ala Val Glu Arg Leu Gly Gly Gly Gly
740 745 750
Ser Gly Gly Gly Gly Ser Asn His Ser Gly Leu Val Thr Phe Gln Ala
755 760 765
Phe Ile Asp Val Met Ser Arg Glu Thr Thr Asp Thr Asp Thr Ala Asp
770 775 780
Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Cys Gly Thr Ala Phe
785 790 795 800
Phe Ile Asn Phe Ile Ala Ile Tyr His His Ala Ser Arg Ala Ile Pro
805 810 815
Phe Gly Thr Met Val Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
Phe Val Val Lys Ala Tyr Leu Pro Val Asn Glu Ser Phe Ala Phe Thr
835 840 845
Ala Asp Leu Arg Ser Asn Thr Gly Gly Gln Ala Gly Gly Gly Gly Ser
850 855 860
Gly Gly Gly Gly Ser Thr Pro Pro Pro Glu Glu Ala Met Pro Phe Glu
865 870 875 880
Phe Asn Gly Pro Ala Gln Gly Asp His Ser Gln Pro Pro Leu Gln Val
885 890 895
<210> 47
<211> 1081
<212> PRT
<213> Искусственная последовательность
<220>
<223> VB Вектор
<400> 47
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Pro
340 345 350
Ser Lys Pro Ser Phe Gln Glu Phe Val Asp Trp Glu Asn Val Ser Pro
355 360 365
Glu Leu Asn Ser Thr Asp Gln Pro Phe Leu Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Arg Glu Gly Val Glu Leu Cys Pro Gly Asn Lys Tyr
385 390 395 400
Glu Met Arg Arg His Gly Thr Thr His Ser Leu Val Ile His Asp Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Cys His Trp Asn Asp
420 425 430
Leu Ala Val Ile Pro Ala Gly Val Val His Asn Trp Asp Phe Glu Pro
435 440 445
Arg Lys Val Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Arg
450 455 460
Gly His Leu Leu Gly Arg Leu Ala Ala Ile Val Gly Lys Gln Val Leu
465 470 475 480
Leu Gly Arg Lys Val Val Val Val Arg Gly Gly Gly Gly Ser Gly Gly
485 490 495
Gly Gly Ser Phe Arg Arg Lys Ala Phe Leu His Trp Tyr Thr Gly Glu
500 505 510
Ala Met Asp Glu Met Glu Phe Thr Glu Ala Glu Ser Asn Met Gly Gly
515 520 525
Gly Gly Ser Gly Gly Gly Gly Ser Val Val Asp Arg Asn Pro Gln Phe
530 535 540
Leu Asp Pro Val Leu Ala Tyr Leu Met Lys Gly Leu Cys Glu Lys Pro
545 550 555 560
Leu Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser Ser Pro
565 570 575
Asp Glu Val Ala Leu Val Glu Gly Val Gln Ser Leu Gly Phe Thr Tyr
580 585 590
Leu Arg Leu Lys Asp Asn Tyr Met Gly Gly Gly Gly Ser Gly Gly Gly
595 600 605
Gly Ser Glu Phe Lys His Ile Lys Ala Phe Asp Arg Thr Phe Ala Asn
610 615 620
Asn Pro Gly Pro Met Val Val Phe Ala Thr Pro Gly Met Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Gly Ser Ser Thr Ala Asn Tyr Asn Thr Ser His
645 650 655
Leu Asn Asn Asp Val Trp Gln Ile Phe Glu Asn Pro Val Asp Trp Lys
660 665 670
Glu Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ser Gly Ser
675 680 685
Pro Phe Pro Ala Ala Val Ile Leu Arg Asp Ala Leu His Met Ala Arg
690 695 700
Gly Leu Lys Tyr Leu His Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly
705 710 715 720
Ser Ala Asn Phe Glu Ser Gly Lys His Lys Tyr Arg Gln Thr Ala Met
725 730 735
Phe Thr Ala Thr Met Pro Pro Ala Val Glu Arg Leu Gly Gly Gly Gly
740 745 750
Ser Gly Gly Gly Gly Ser Asn His Ser Gly Leu Val Thr Phe Gln Ala
755 760 765
Phe Ile Asp Val Met Ser Arg Glu Thr Thr Asp Thr Asp Thr Ala Asp
770 775 780
Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Cys Gly Thr Ala Phe
785 790 795 800
Phe Ile Asn Phe Ile Ala Ile Tyr His His Ala Ser Arg Ala Ile Pro
805 810 815
Phe Gly Thr Met Val Ala Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
Phe Val Val Lys Ala Tyr Leu Pro Val Asn Glu Ser Phe Ala Phe Thr
835 840 845
Ala Asp Leu Arg Ser Asn Thr Gly Gly Gln Ala Gly Gly Gly Gly Ser
850 855 860
Gly Gly Gly Gly Ser Thr Pro Pro Pro Glu Glu Ala Met Pro Phe Glu
865 870 875 880
Phe Asn Gly Pro Ala Gln Gly Asp His Ser Gln Pro Pro Leu Gln Val
885 890 895
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Pro Lys Pro Asp Phe Ser
900 905 910
Gln Leu Gln Arg Asn Ile Leu Pro Ser Asn Pro Arg Val Thr Arg Phe
915 920 925
His Ile Asn Trp Asp Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ile
930 935 940
Pro Ser Gly Thr Thr Ile Leu Asn Cys Phe His Asp Val Leu Ser Gly
945 950 955 960
Lys Leu Ser Gly Gly Ser Pro Gly Val Pro Gly Gly Gly Gly Ser Gly
965 970 975
Gly Gly Gly Ser Gly Phe Ser Gln Pro Leu Arg Arg Leu Val Leu His
980 985 990
Val Val Ser Ala Ala Gln Ala Glu Arg Leu Ala Arg Ala Glu Glu Gly
995 1000 1005
Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Cys Arg Ile Thr Ser
1010 1015 1020
Asn Phe Val Ile Pro Ser Glu Tyr Trp Val Glu Glu Lys Glu Glu
1025 1030 1035
Lys Gln Lys Leu Ile Gln Gly Gly Gly Gly Ser Gly Gly Gly Gly
1040 1045 1050
Ser Asn Ile Glu Gly Ile Asp Lys Leu Thr Gln Leu Lys Lys Pro
1055 1060 1065
Phe Leu Val Asn Asn Lys Ile Asn Lys Ile Glu Asn Ile
1070 1075 1080
<210> 48
<211> 896
<212> PRT
<213> Искусственная последовательность
<220>
<223> VB construct
<400> 48
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Val
340 345 350
Ile Leu Pro Gln Ala Pro Ser Gly Pro Ser Tyr Ala Thr Tyr Leu Gln
355 360 365
Pro Ala Gln Ala Gln Met Leu Thr Pro Pro Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Leu His Ser Gly Gln Asn His Leu Lys Glu Met Ala
385 390 395 400
Ile Ser Val Leu Glu Ala Arg Ala Cys Ala Ala Ala Gly Gln Ser Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Pro Leu Leu Pro Phe Tyr Pro
420 425 430
Pro Asp Glu Ala Leu Glu Ile Gly Leu Glu Leu Asn Ser Ser Ala Leu
435 440 445
Pro Pro Thr Glu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Gly
450 455 460
Thr Gln Cys Glu Tyr Trp Ala Ser Arg Ala Leu Asp Ser Glu His Ser
465 470 475 480
Ile Gly Ser Met Ile Gln Leu Pro Gln Gly Gly Gly Gly Ser Gly Gly
485 490 495
Gly Gly Ser Ala Ala Tyr Lys Gly His His Tyr Pro Gly Pro Gly Asn
500 505 510
Tyr Phe Trp Lys Cys Leu Phe Met Ser Gly Leu Ser Glu Val Gly Gly
515 520 525
Gly Gly Ser Gly Gly Gly Gly Ser Asp Thr Leu Ser Ala Met Ser Asn
530 535 540
Pro Arg Ala Met Gln Val Leu Leu Gln Ile Gln Gln Gly Leu Gln Thr
545 550 555 560
Leu Ala Thr Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Lys Pro
565 570 575
Leu Arg Arg Asn Asn Ser Tyr Thr Ser Tyr Ile Met Ala Ile Cys Gly
580 585 590
Met Pro Leu Asp Ser Phe Arg Ala Gly Gly Gly Gly Ser Gly Gly Gly
595 600 605
Gly Ser Glu Val Ile Gln Thr Ser Lys Tyr Tyr Met Arg Asp Val Ile
610 615 620
Ala Ile Glu Ser Ala Trp Leu Leu Glu Leu Ala Pro His Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Gly Ser Gly Tyr Ile Ser Arg Val Thr Ala Gly
645 650 655
Lys Asp Ser Tyr Ile Ala Leu Val Asp Lys Asn Ile Met Gly Tyr Ile
660 665 670
Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu His Ile His
675 680 685
Arg Ala Gly Gly Leu Phe Val Ala Asp Ala Ile Gln Val Gly Phe Gly
690 695 700
Arg Ile Gly Lys His Phe Trp Gly Gly Gly Gly Ser Gly Gly Gly Gly
705 710 715 720
Ser Gln Ala Ile Val Arg Gly Cys Ser Met Pro Gly Pro Trp Arg Ser
725 730 735
Gly Arg Leu Leu Val Ser Arg Arg Trp Ser Val Glu Gly Gly Gly Gly
740 745 750
Ser Gly Gly Gly Gly Ser Asp Gly Gln Leu Glu Leu Leu Ala Gln Gly
755 760 765
Ala Leu Asp Asn Ala Leu Ser Ser Met Gly Ala Leu His Ala Leu Arg
770 775 780
Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Asp Ser Arg
785 790 795 800
Lys Ser Thr Ser Phe Met Ser Val Asn Pro Ser Lys Glu Ile Lys Ile
805 810 815
Val Ser Ala Val Arg Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
His Thr Pro Ser Ser Tyr Ile Glu Thr Leu Pro Lys Ala Ile Lys Arg
835 840 845
Arg Ile Asn Ala Leu Lys Gln Leu Gln Val Arg Gly Gly Gly Gly Ser
850 855 860
Gly Gly Gly Gly Ser Met Lys Ala Phe Ile Phe Lys Tyr Ser Ala Lys
865 870 875 880
Thr Gly Phe Thr Lys Leu Ile Asp Ala Ser Arg Val Ser Glu Thr Glu
885 890 895
<210> 49
<211> 1081
<212> PRT
<213> Искусственная последовательность
<220>
<223> VB construct
<400> 49
Met Gln Val Ser Thr Ala Ala Leu Ala Val Leu Leu Cys Thr Met Ala
1 5 10 15
Leu Cys Asn Gln Val Leu Ser Ala Pro Leu Ala Ala Asp Thr Pro Thr
20 25 30
Ala Cys Cys Phe Ser Tyr Thr Ser Arg Gln Ile Pro Gln Asn Phe Ile
35 40 45
Ala Asp Tyr Phe Glu Thr Ser Ser Gln Cys Ser Lys Pro Ser Val Ile
50 55 60
Phe Leu Thr Lys Arg Gly Arg Gln Val Cys Ala Asp Pro Ser Glu Glu
65 70 75 80
Trp Val Gln Lys Tyr Val Ser Asp Leu Glu Leu Ser Ala Glu Leu Lys
85 90 95
Thr Pro Leu Gly Asp Thr Thr His Thr Ile Glu Pro Lys Ser Cys Asp
100 105 110
Thr Pro Pro Pro Cys Pro Arg Cys Pro Gly Gly Gly Ser Ser Gly Gly
115 120 125
Gly Ser Gly Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
130 135 140
Ser Arg Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
145 150 155 160
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Ser Gly
165 170 175
Gln Pro Glu Asn Asn Tyr Asn Thr Thr Pro Pro Met Leu Asp Ser Asp
180 185 190
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
195 200 205
Gln Gln Gly Asn Ile Phe Ser Cys Ser Val Met His Glu Ala Leu His
210 215 220
Asn Arg Phe Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys Gly Leu
225 230 235 240
Gly Gly Leu Met His Gly Asp Thr Pro Thr Leu His Glu Tyr Met Leu
245 250 255
Asp Leu Gln Pro Glu Thr Thr Asp Leu Tyr Gly Tyr Gly Gln Leu Asn
260 265 270
Asp Ser Ser Glu Glu Glu Asp Glu Ile Asp Gly Pro Ala Gly Gln Ala
275 280 285
Glu Pro Asp Arg Ala His Tyr Asn Ile Val Thr Phe Cys Cys Lys Cys
290 295 300
Asp Ser Thr Leu Arg Leu Cys Val Gln Ser Thr His Val Asp Ile Arg
305 310 315 320
Thr Leu Glu Asp Leu Leu Met Gly Thr Leu Gly Ile Val Cys Pro Ile
325 330 335
Cys Ser Gln Lys Pro Gly Gly Gly Ser Ser Gly Gly Gly Ser Gly Val
340 345 350
Ile Leu Pro Gln Ala Pro Ser Gly Pro Ser Tyr Ala Thr Tyr Leu Gln
355 360 365
Pro Ala Gln Ala Gln Met Leu Thr Pro Pro Gly Gly Gly Gly Ser Gly
370 375 380
Gly Gly Gly Ser Leu His Ser Gly Gln Asn His Leu Lys Glu Met Ala
385 390 395 400
Ile Ser Val Leu Glu Ala Arg Ala Cys Ala Ala Ala Gly Gln Ser Gly
405 410 415
Gly Gly Gly Ser Gly Gly Gly Gly Ser Pro Leu Leu Pro Phe Tyr Pro
420 425 430
Pro Asp Glu Ala Leu Glu Ile Gly Leu Glu Leu Asn Ser Ser Ala Leu
435 440 445
Pro Pro Thr Glu Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ala Gly
450 455 460
Thr Gln Cys Glu Tyr Trp Ala Ser Arg Ala Leu Asp Ser Glu His Ser
465 470 475 480
Ile Gly Ser Met Ile Gln Leu Pro Gln Gly Gly Gly Gly Ser Gly Gly
485 490 495
Gly Gly Ser Ala Ala Tyr Lys Gly His His Tyr Pro Gly Pro Gly Asn
500 505 510
Tyr Phe Trp Lys Cys Leu Phe Met Ser Gly Leu Ser Glu Val Gly Gly
515 520 525
Gly Gly Ser Gly Gly Gly Gly Ser Asp Thr Leu Ser Ala Met Ser Asn
530 535 540
Pro Arg Ala Met Gln Val Leu Leu Gln Ile Gln Gln Gly Leu Gln Thr
545 550 555 560
Leu Ala Thr Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Lys Pro
565 570 575
Leu Arg Arg Asn Asn Ser Tyr Thr Ser Tyr Ile Met Ala Ile Cys Gly
580 585 590
Met Pro Leu Asp Ser Phe Arg Ala Gly Gly Gly Gly Ser Gly Gly Gly
595 600 605
Gly Ser Glu Val Ile Gln Thr Ser Lys Tyr Tyr Met Arg Asp Val Ile
610 615 620
Ala Ile Glu Ser Ala Trp Leu Leu Glu Leu Ala Pro His Gly Gly Gly
625 630 635 640
Gly Ser Gly Gly Gly Gly Ser Gly Tyr Ile Ser Arg Val Thr Ala Gly
645 650 655
Lys Asp Ser Tyr Ile Ala Leu Val Asp Lys Asn Ile Met Gly Tyr Ile
660 665 670
Ala Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu His Ile His
675 680 685
Arg Ala Gly Gly Leu Phe Val Ala Asp Ala Ile Gln Val Gly Phe Gly
690 695 700
Arg Ile Gly Lys His Phe Trp Gly Gly Gly Gly Ser Gly Gly Gly Gly
705 710 715 720
Ser Gln Ala Ile Val Arg Gly Cys Ser Met Pro Gly Pro Trp Arg Ser
725 730 735
Gly Arg Leu Leu Val Ser Arg Arg Trp Ser Val Glu Gly Gly Gly Gly
740 745 750
Ser Gly Gly Gly Gly Ser Asp Gly Gln Leu Glu Leu Leu Ala Gln Gly
755 760 765
Ala Leu Asp Asn Ala Leu Ser Ser Met Gly Ala Leu His Ala Leu Arg
770 775 780
Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Ser His Asp Ser Arg
785 790 795 800
Lys Ser Thr Ser Phe Met Ser Val Asn Pro Ser Lys Glu Ile Lys Ile
805 810 815
Val Ser Ala Val Arg Arg Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
820 825 830
His Thr Pro Ser Ser Tyr Ile Glu Thr Leu Pro Lys Ala Ile Lys Arg
835 840 845
Arg Ile Asn Ala Leu Lys Gln Leu Gln Val Arg Gly Gly Gly Gly Ser
850 855 860
Gly Gly Gly Gly Ser Met Lys Ala Phe Ile Phe Lys Tyr Ser Ala Lys
865 870 875 880
Thr Gly Phe Thr Lys Leu Ile Asp Ala Ser Arg Val Ser Glu Thr Glu
885 890 895
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Glu Gly Asp Pro Cys Leu
900 905 910
Arg Ser Ser Asp Cys Ile Asp Glu Phe Cys Cys Ala Arg His Phe Trp
915 920 925
Thr Lys Ile Cys Lys Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Trp
930 935 940
Lys Gly Gly Pro Val Lys Ile Asp Pro Leu Ala Leu Met Gln Ala Ile
945 950 955 960
Glu Arg Tyr Leu Val Val Arg Gly Tyr Gly Gly Gly Gly Gly Ser Gly
965 970 975
Gly Gly Gly Ser Val Thr Ser Ile Pro Ser Val Ser Asn Ala Leu Asn
980 985 990
Trp Lys Glu Phe Ser Phe Ile Gln Ser Thr Leu Gly Tyr Val Ala Gly
995 1000 1005
Gly Gly Gly Ser Gly Gly Gly Gly Ser Tyr Arg Gly Ala Asn Leu
1010 1015 1020
His Leu Glu Glu Thr Leu Ala Gly Phe Trp Ala Arg Leu Leu Glu
1025 1030 1035
Arg Leu Phe Lys Gln Leu Gly Gly Gly Gly Ser Gly Gly Gly Gly
1040 1045 1050
Ser Lys Thr Thr Leu Ser His Thr Gln Asp Ser Ser Gln Ser Leu
1055 1060 1065
Gln Ser Ser Ser Asp Ser Ser Lys Ser Ser Arg Cys Ser
1070 1075 1080
<210> 50
<211> 27
<212> PRT
<213> Mus musculus
<400> 50
Gln Ala Ile Val Arg Gly Cys Ser Met Pro Gly Pro Trp Arg Ser Gly
1 5 10 15
Arg Leu Leu Val Ser Arg Arg Trp Ser Val Glu
20 25
<210> 51
<211> 27
<212> PRT
<213> Mus musculus
<400> 51
Asp Gly Gln Leu Glu Leu Leu Ala Gln Gly Ala Leu Asp Asn Ala Leu
1 5 10 15
Ser Ser Met Gly Ala Leu His Ala Leu Arg Pro
20 25
<210> 52
<211> 27
<212> PRT
<213> Mus musculus
<400> 52
Ser His Asp Ser Arg Lys Ser Thr Ser Phe Met Ser Val Asn Pro Ser
1 5 10 15
Lys Glu Ile Lys Ile Val Ser Ala Val Arg Arg
20 25
<210> 53
<211> 27
<212> PRT
<213> Mus musculus
<400> 53
His Thr Pro Ser Ser Tyr Ile Glu Thr Leu Pro Lys Ala Ile Lys Arg
1 5 10 15
Arg Ile Asn Ala Leu Lys Gln Leu Gln Val Arg
20 25
<210> 54
<211> 27
<212> PRT
<213> Mus musculus
<400> 54
Met Lys Ala Phe Ile Phe Lys Tyr Ser Ala Lys Thr Gly Phe Thr Lys
1 5 10 15
Leu Ile Asp Ala Ser Arg Val Ser Glu Thr Glu
20 25
<210> 55
<211> 27
<212> PRT
<213> Mus musculus
<400> 55
Glu Gly Asp Pro Cys Leu Arg Ser Ser Asp Cys Ile Asp Glu Phe Cys
1 5 10 15
Cys Ala Arg His Phe Trp Thr Lys Ile Cys Lys
20 25
<210> 56
<211> 27
<212> PRT
<213> Mus musculus
<400> 56
Trp Lys Gly Gly Pro Val Lys Ile Asp Pro Leu Ala Leu Met Gln Ala
1 5 10 15
Ile Glu Arg Tyr Leu Val Val Arg Gly Tyr Gly
20 25
<210> 57
<211> 27
<212> PRT
<213> Mus musculus
<400> 57
Val Thr Ser Ile Pro Ser Val Ser Asn Ala Leu Asn Trp Lys Glu Phe
1 5 10 15
Ser Phe Ile Gln Ser Thr Leu Gly Tyr Val Ala
20 25
<210> 58
<211> 27
<212> PRT
<213> Mus musculus
<400> 58
Tyr Arg Gly Ala Asn Leu His Leu Glu Glu Thr Leu Ala Gly Phe Trp
1 5 10 15
Ala Arg Leu Leu Glu Arg Leu Phe Lys Gln Leu
20 25
<210> 59
<211> 27
<212> PRT
<213> Mus musculus
<400> 59
Lys Thr Thr Leu Ser His Thr Gln Asp Ser Ser Gln Ser Leu Gln Ser
1 5 10 15
Ser Ser Asp Ser Ser Lys Ser Ser Arg Cys Ser
20 25
<210> 60
<211> 27
<212> PRT
<213> Mus musculus
<400> 60
Asn His Ser Gly Leu Val Thr Phe Gln Ala Phe Ile Asp Val Met Ser
1 5 10 15
Arg Glu Thr Thr Asp Thr Asp Thr Ala Asp Gln
20 25
<210> 61
<211> 27
<212> PRT
<213> Mus musculus
<400> 61
Cys Gly Thr Ala Phe Phe Ile Asn Phe Ile Ala Ile Tyr His His Ala
1 5 10 15
Ser Arg Ala Ile Pro Phe Gly Thr Met Val Ala
20 25
<210> 62
<211> 27
<212> PRT
<213> Mus musculus
<400> 62
Phe Val Val Lys Ala Tyr Leu Pro Val Asn Glu Ser Phe Ala Phe Thr
1 5 10 15
Ala Asp Leu Arg Ser Asn Thr Gly Gly Gln Ala
20 25
<210> 63
<211> 27
<212> PRT
<213> Mus musculus
<400> 63
Thr Pro Pro Pro Glu Glu Ala Met Pro Phe Glu Phe Asn Gly Pro Ala
1 5 10 15
Gln Gly Asp His Ser Gln Pro Pro Leu Gln Val
20 25
<210> 64
<211> 27
<212> PRT
<213> Mus musculus
<400> 64
Pro Lys Pro Asp Phe Ser Gln Leu Gln Arg Asn Ile Leu Pro Ser Asn
1 5 10 15
Pro Arg Val Thr Arg Phe His Ile Asn Trp Asp
20 25
<210> 65
<211> 27
<212> PRT
<213> Mus musculus
<400> 65
Ile Pro Ser Gly Thr Thr Ile Leu Asn Cys Phe His Asp Val Leu Ser
1 5 10 15
Gly Lys Leu Ser Gly Gly Ser Pro Gly Val Pro
20 25
<210> 66
<211> 27
<212> PRT
<213> Mus musculus
<400> 66
Gly Phe Ser Gln Pro Leu Arg Arg Leu Val Leu His Val Val Ser Ala
1 5 10 15
Ala Gln Ala Glu Arg Leu Ala Arg Ala Glu Glu
20 25
<210> 67
<211> 27
<212> PRT
<213> Mus musculus
<400> 67
Glu Cys Arg Ile Thr Ser Asn Phe Val Ile Pro Ser Glu Tyr Trp Val
1 5 10 15
Glu Glu Lys Glu Glu Lys Gln Lys Leu Ile Gln
20 25
<210> 68
<211> 27
<212> PRT
<213> Mus musculus
<400> 68
Asn Ile Glu Gly Ile Asp Lys Leu Thr Gln Leu Lys Lys Pro Phe Leu
1 5 10 15
Val Asn Asn Lys Ile Asn Lys Ile Glu Asn Ile
20 25
<210> 69
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 69
Gly Gly Gly Ser Ser
1 5
<210> 70
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 70
Gly Gly Gly Ser Gly
1 5
<210> 71
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 71
Gly Gly Gly Gly Ser
1 5
<210> 72
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 72
Leu Gly Gly Gly Ser
1 5
<210> 73
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 73
Gly Leu Gly Gly Ser
1 5
<210> 74
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 74
Gly Gly Leu Gly Ser
1 5
<210> 75
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 75
Gly Gly Gly Leu Ser
1 5
<210> 76
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 76
Gly Gly Gly Gly Leu
1 5
<210> 77
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 77
Leu Gly Gly Ser Gly
1 5
<210> 78
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 78
Gly Leu Gly Ser Gly
1 5
<210> 79
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 79
Gly Gly Leu Ser Gly
1 5
<210> 80
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 80
Gly Gly Gly Leu Gly
1 5
<210> 81
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 81
Gly Gly Gly Ser Leu
1 5
<210> 82
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 82
Leu Gly Gly Ser Ser
1 5
<210> 83
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 83
Gly Leu Gly Ser Ser
1 5
<210> 84
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 84
Gly Gly Leu Ser Ser
1 5
<210> 85
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 85
Gly Gly Gly Leu Ser
1 5
<210> 86
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 86
Gly Gly Gly Ser Leu
1 5
<210> 87
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 87
Leu Gly Leu Gly Ser
1 5
<210> 88
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 88
Gly Leu Gly Leu Ser
1 5
<210> 89
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 89
Gly Leu Leu Gly Ser
1 5
<210> 90
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 90
Leu Gly Gly Leu Ser
1 5
<210> 91
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 91
Gly Leu Gly Gly Leu
1 5
<210> 92
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 92
Leu Gly Leu Ser Gly
1 5
<210> 93
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 93
Gly Leu Leu Ser Gly
1 5
<210> 94
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 94
Gly Gly Leu Ser Leu
1 5
<210> 95
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 95
Gly Gly Leu Leu Gly
1 5
<210> 96
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 96
Gly Leu Gly Ser Leu
1 5
<210> 97
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 97
Leu Gly Leu Ser Ser
1 5
<210> 98
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 98
Gly Leu Gly Leu Ser
1 5
<210> 99
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 99
Gly Gly Leu Leu Ser
1 5
<210> 100
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 100
Gly Leu Gly Ser Leu
1 5
<210> 101
<211> 5
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 101
Gly Leu Gly Ser Leu
1 5
<210> 102
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 102
Leu Gly Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 103
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 103
Gly Leu Gly Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 104
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 104
Gly Gly Leu Gly Ser Gly Gly Gly Gly Ser
1 5 10
<210> 105
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 105
Gly Gly Gly Leu Ser Gly Gly Gly Gly Ser
1 5 10
<210> 106
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 106
Gly Gly Gly Gly Leu Gly Gly Gly Gly Ser
1 5 10
<210> 107
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 107
Leu Gly Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10
<210> 108
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 108
Gly Leu Gly Ser Gly Gly Gly Gly Ser Gly
1 5 10
<210> 109
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 109
Gly Gly Leu Ser Gly Gly Gly Gly Ser Gly
1 5 10
<210> 110
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 110
Gly Gly Gly Leu Gly Gly Gly Gly Ser Gly
1 5 10
<210> 111
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 111
Gly Gly Gly Ser Leu Gly Gly Gly Ser Gly
1 5 10
<210> 112
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 112
Gly Gly Gly Ser Leu Gly Gly Gly Ser Gly
1 5 10
<210> 113
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 113
Gly Leu Gly Ser Ser Gly Gly Gly Ser Ser
1 5 10
<210> 114
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 114
Gly Gly Leu Ser Ser Gly Gly Gly Ser Ser
1 5 10
<210> 115
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 115
Gly Gly Gly Leu Ser Gly Gly Gly Ser Ser
1 5 10
<210> 116
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 116
Gly Gly Gly Ser Leu Gly Gly Gly Ser Ser
1 5 10
<210> 117
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 117
Leu Gly Gly Gly Ser Leu Gly Gly Gly Ser
1 5 10
<210> 118
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 118
Gly Leu Gly Gly Ser Gly Leu Gly Gly Ser
1 5 10
<210> 119
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 119
Gly Gly Leu Gly Ser Gly Gly Leu Gly Ser
1 5 10
<210> 120
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 120
Gly Gly Gly Leu Ser Gly Gly Gly Leu Ser
1 5 10
<210> 121
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 121
Gly Gly Gly Gly Leu Gly Gly Gly Gly Leu
1 5 10
<210> 122
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 122
Leu Gly Gly Ser Gly Leu Gly Gly Ser Gly
1 5 10
<210> 123
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 123
Gly Leu Gly Ser Gly Gly Leu Gly Ser Gly
1 5 10
<210> 124
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 124
Gly Gly Leu Ser Gly Gly Gly Leu Ser Gly
1 5 10
<210> 125
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 125
Gly Gly Gly Leu Gly Gly Gly Gly Leu Gly
1 5 10
<210> 126
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 126
Gly Gly Gly Ser Leu Gly Gly Gly Ser Leu
1 5 10
<210> 127
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 127
Leu Gly Gly Ser Ser Leu Gly Gly Ser Ser
1 5 10
<210> 128
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 128
Gly Leu Gly Ser Ser Gly Leu Gly Ser Ser
1 5 10
<210> 129
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 129
Gly Gly Leu Ser Ser Gly Gly Leu Ser Ser
1 5 10
<210> 130
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 130
Gly Gly Gly Leu Ser Gly Gly Gly Leu Ser
1 5 10
<210> 131
<211> 10
<212> PRT
<213> Искусственная последовательность
<220>
<223> Linker
<400> 131
Gly Gly Gly Ser Leu Gly Gly Gly Ser Leu
1 5 10
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| НЕОАНТИГЕНЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2813924C2 |
| БИОЛОГИЧЕСКИЕ МАТЕРИАЛЫ ДЛЯ МОДУЛЯЦИИ ИММУННЫХ ОТВЕТОВ | 2017 |
|
RU2770060C2 |
| ПЕРСОНАЛИЗИРОВАННАЯ ВАКЦИНА | 2018 |
|
RU2779987C2 |
| СТАБИЛИЗИРОВАННЫЕ БЕЛКИ F RSV И ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2795459C2 |
| НЕОАНТИГЕНЫ И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2805196C2 |
| СУБЪЕДИНИЧНАЯ ВАКЦИНА ДЛЯ ЛЕЧЕНИЯ ИЛИ ПРЕДОТВРАЩЕНИЯ ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ | 2020 |
|
RU2811991C2 |
| СЛИТЫЕ БЕЛКИ С АЛЬБУМИН-СВЯЗЫВАЮЩИМИ ДОМЕНАМИ | 2018 |
|
RU2786444C2 |
| САМОСОБИРАЮЩИЕСЯ НАНОСТРУКТУРНЫЕ ВАКЦИНЫ | 2019 |
|
RU2811439C2 |
| Новые варианты интерлейкина-2 для лечения рака | 2020 |
|
RU2833537C2 |
| КОНЪЮГАТЫ АНТИТЕЛА И ЛЕКАРСТВЕННОГО СРЕДСТВА, СОДЕРЖАЩИЕ МОДУЛЯТОР СПЛАЙСИНГА НА ОСНОВЕ ГЕРБОКСИДИЕНА, И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2820607C2 |
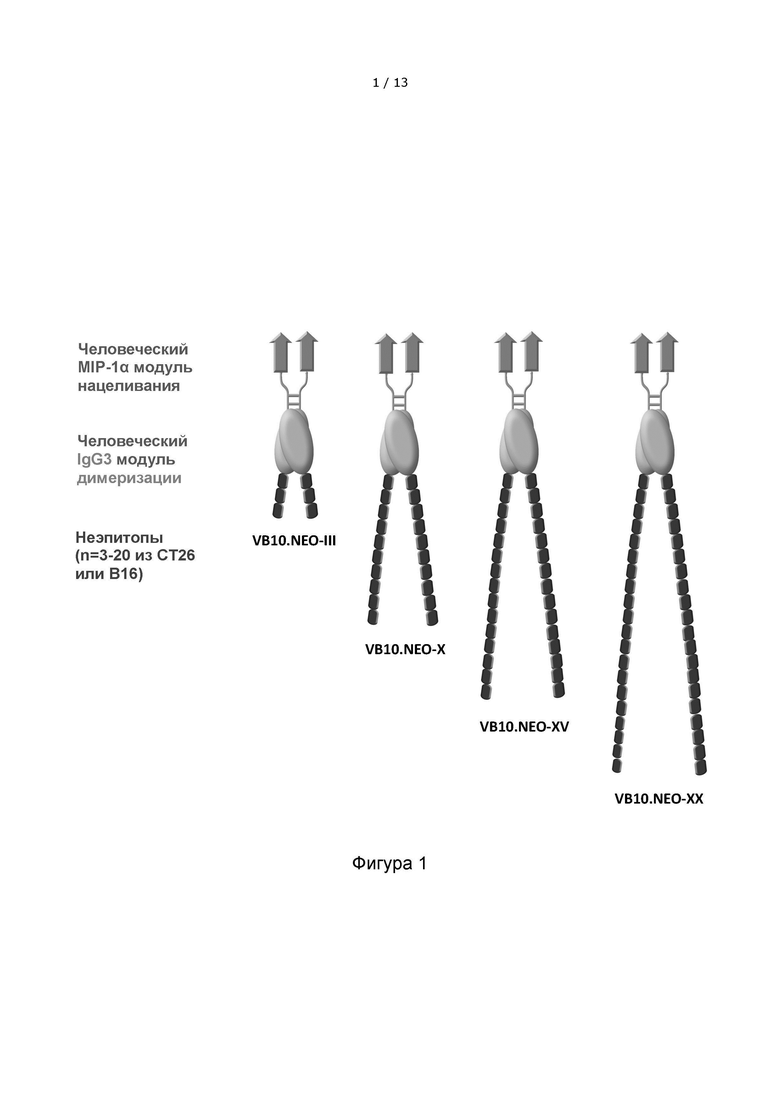
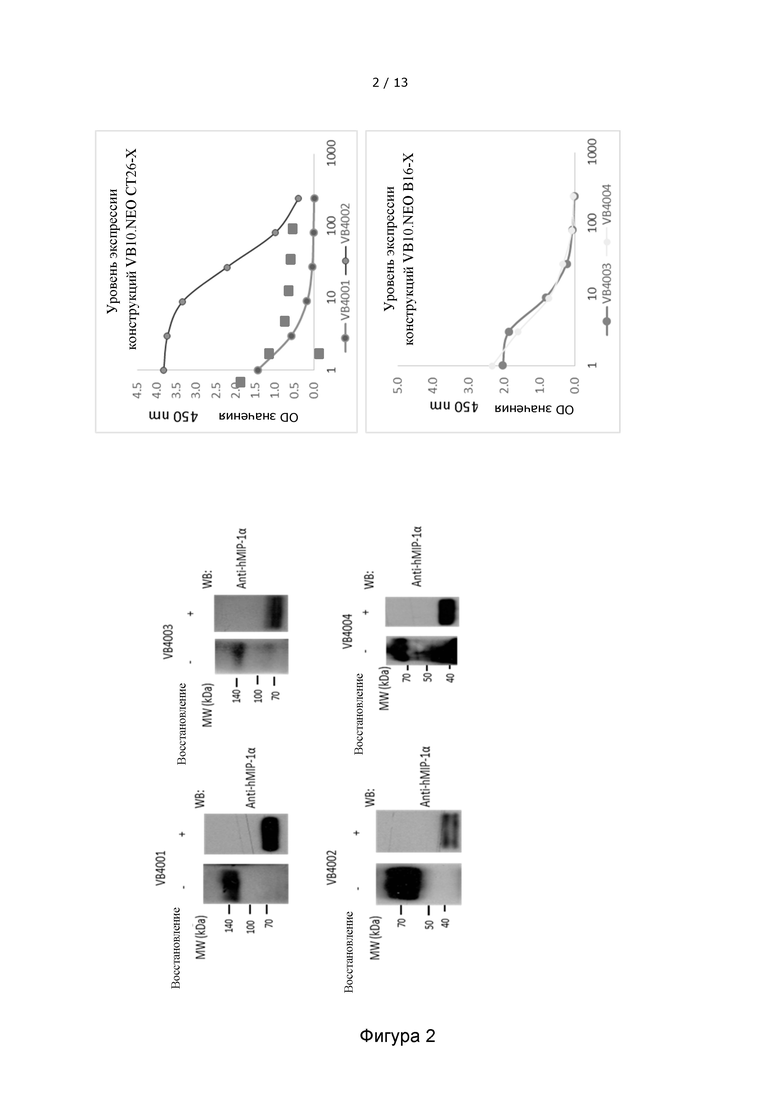
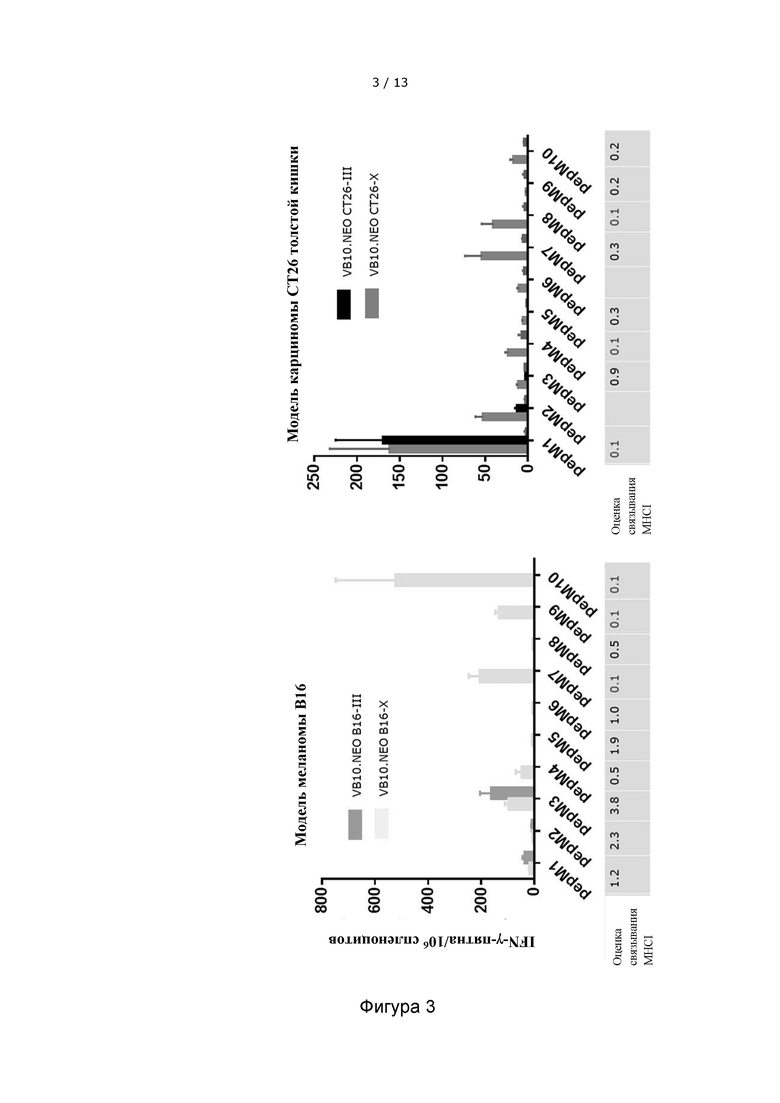
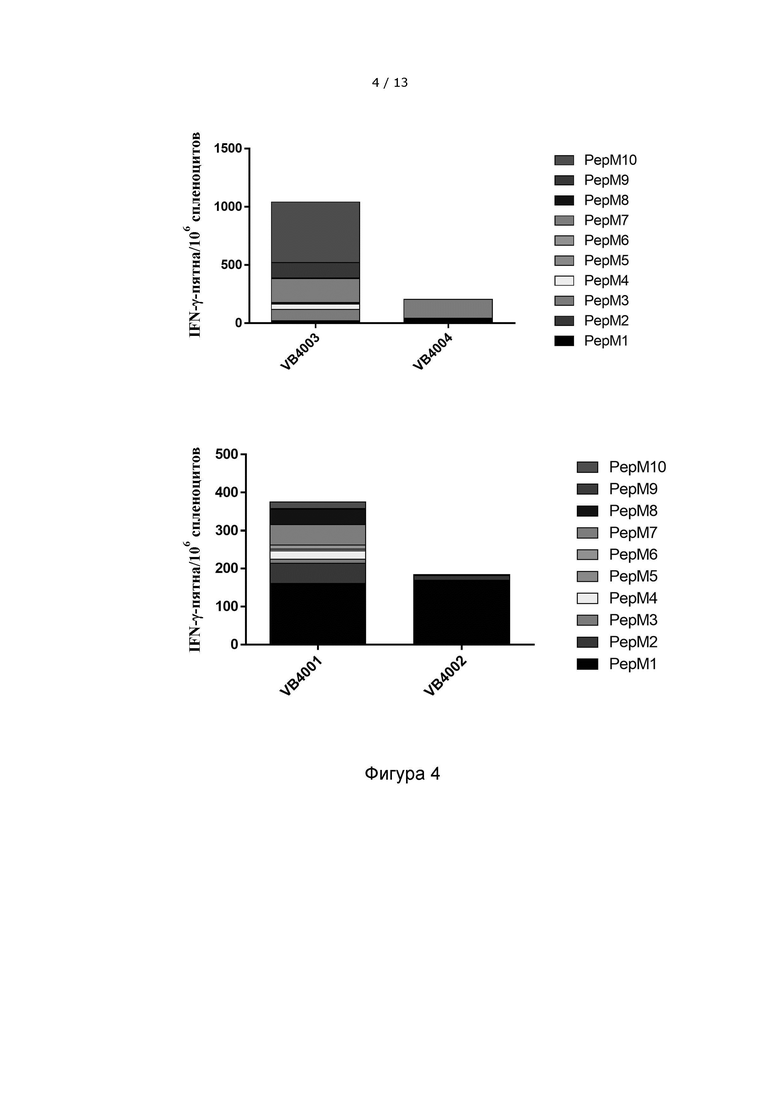
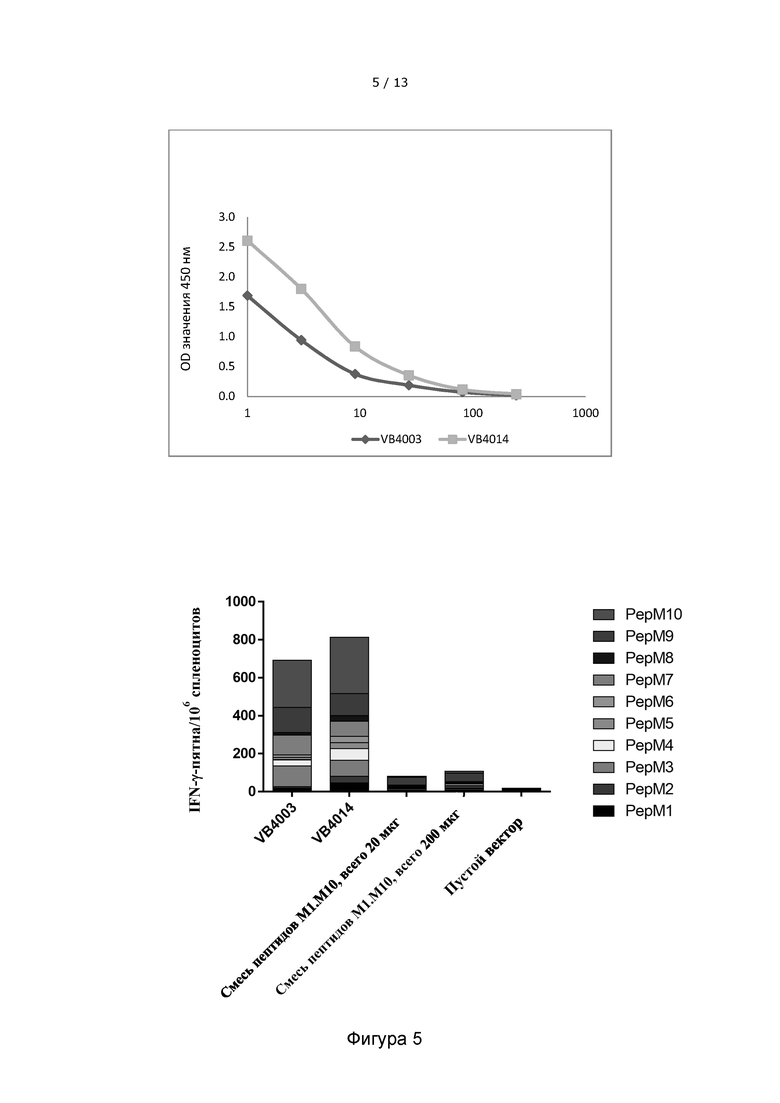
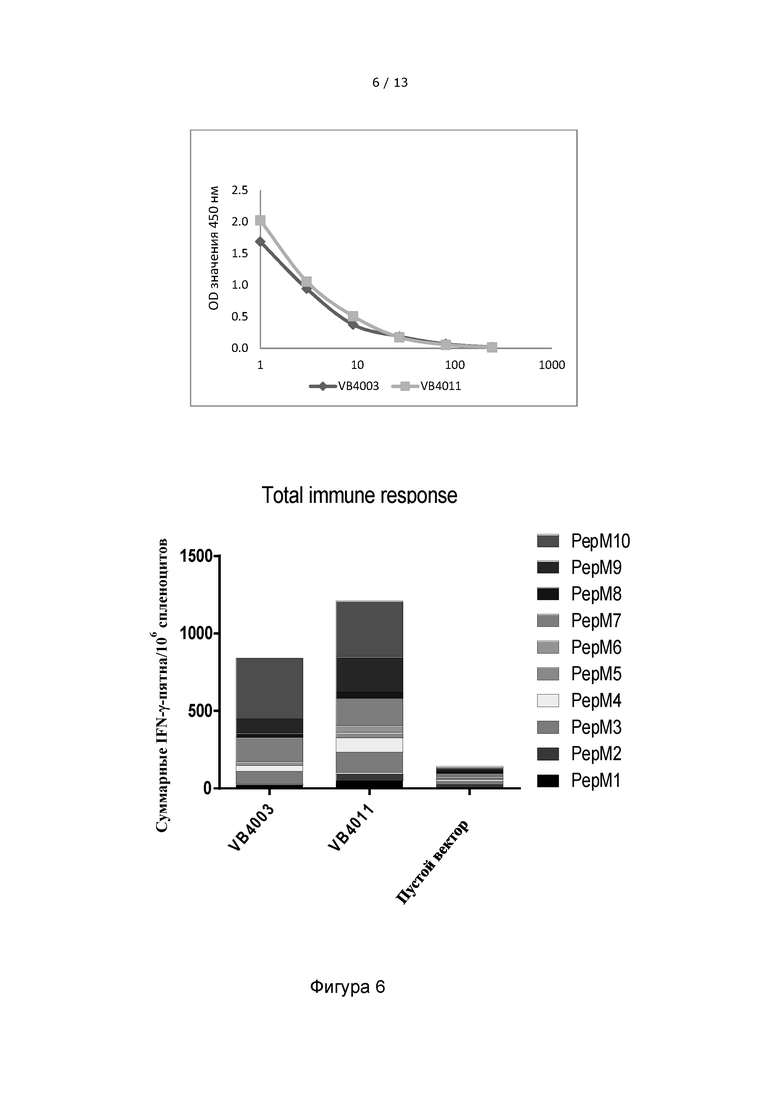
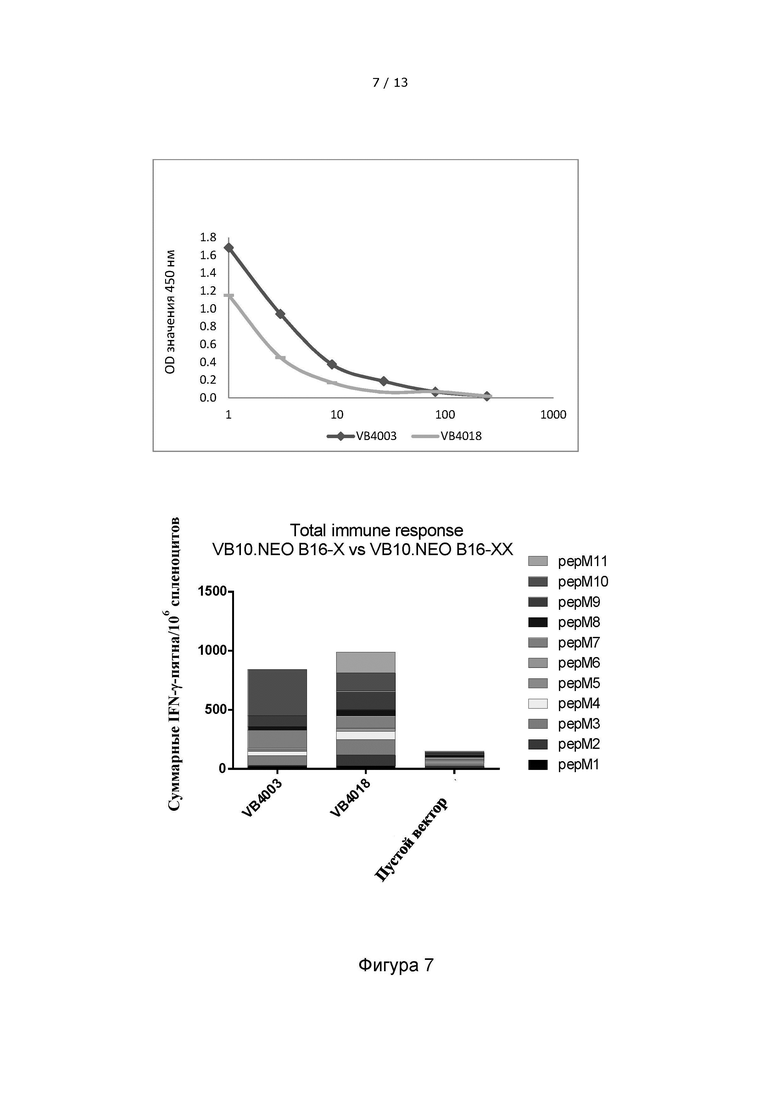
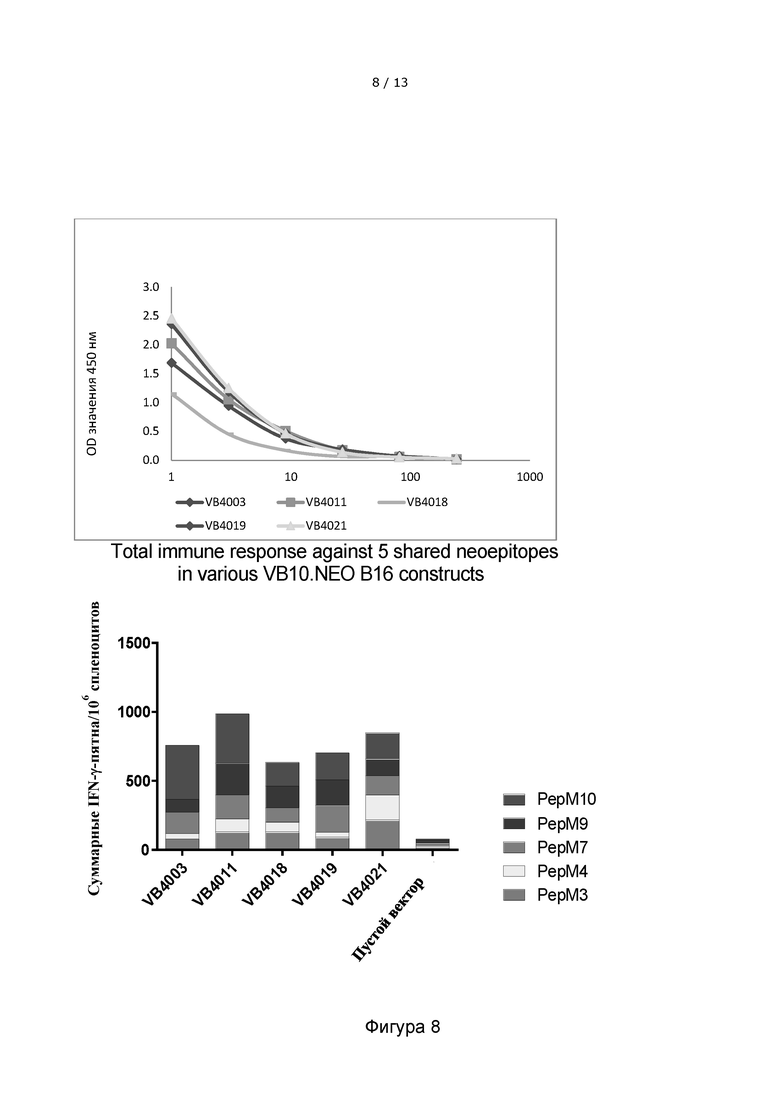
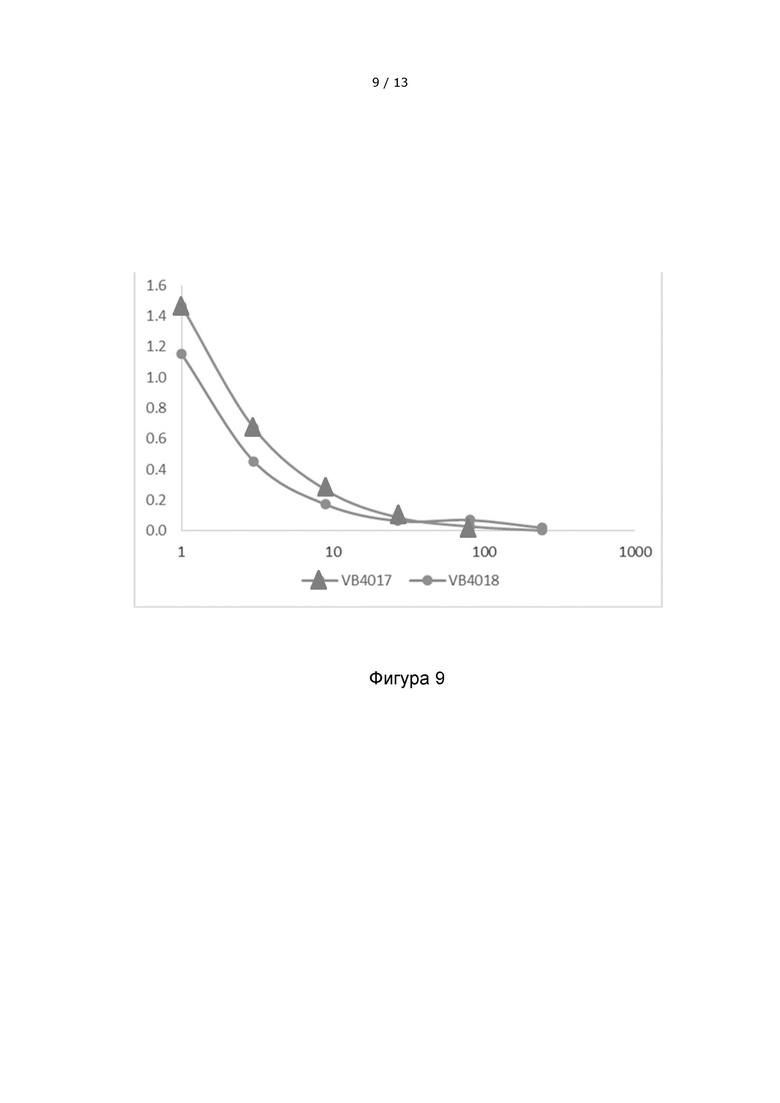
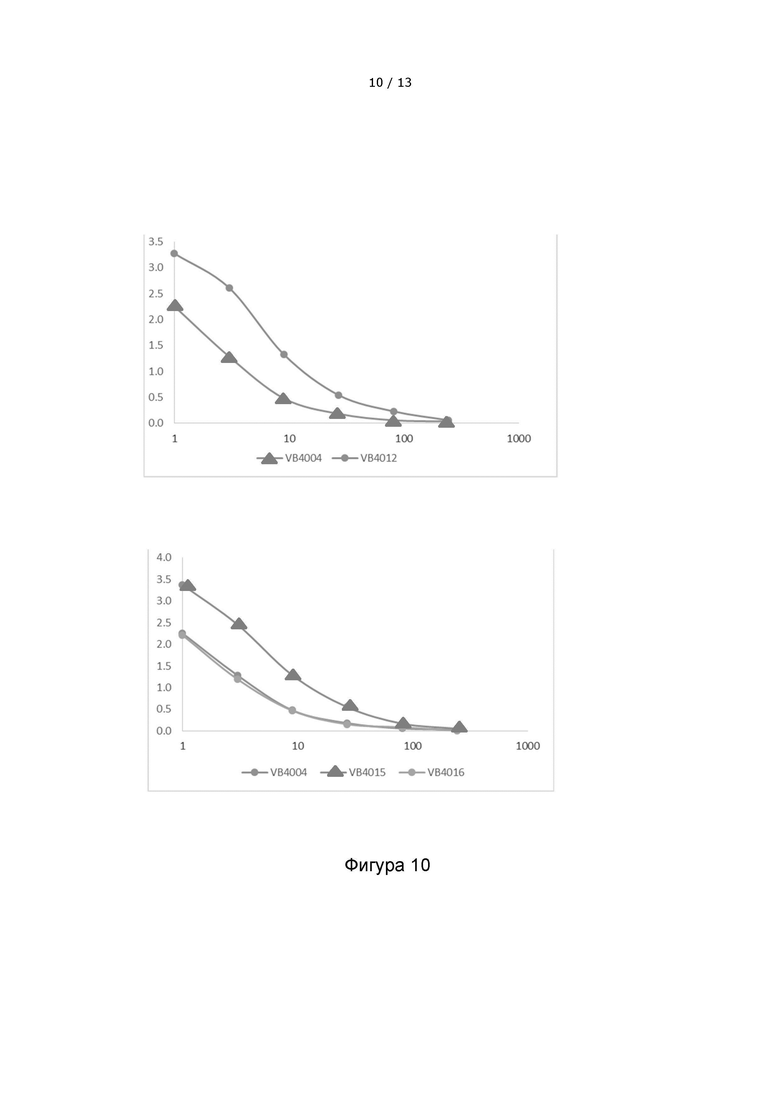
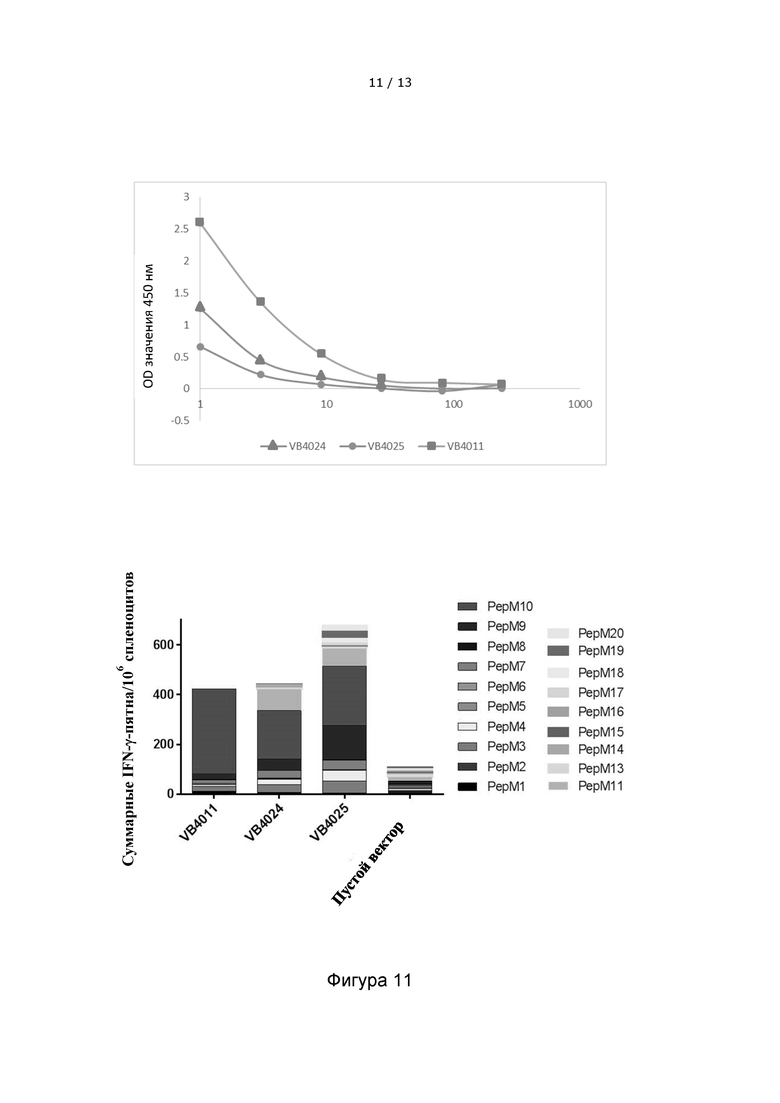
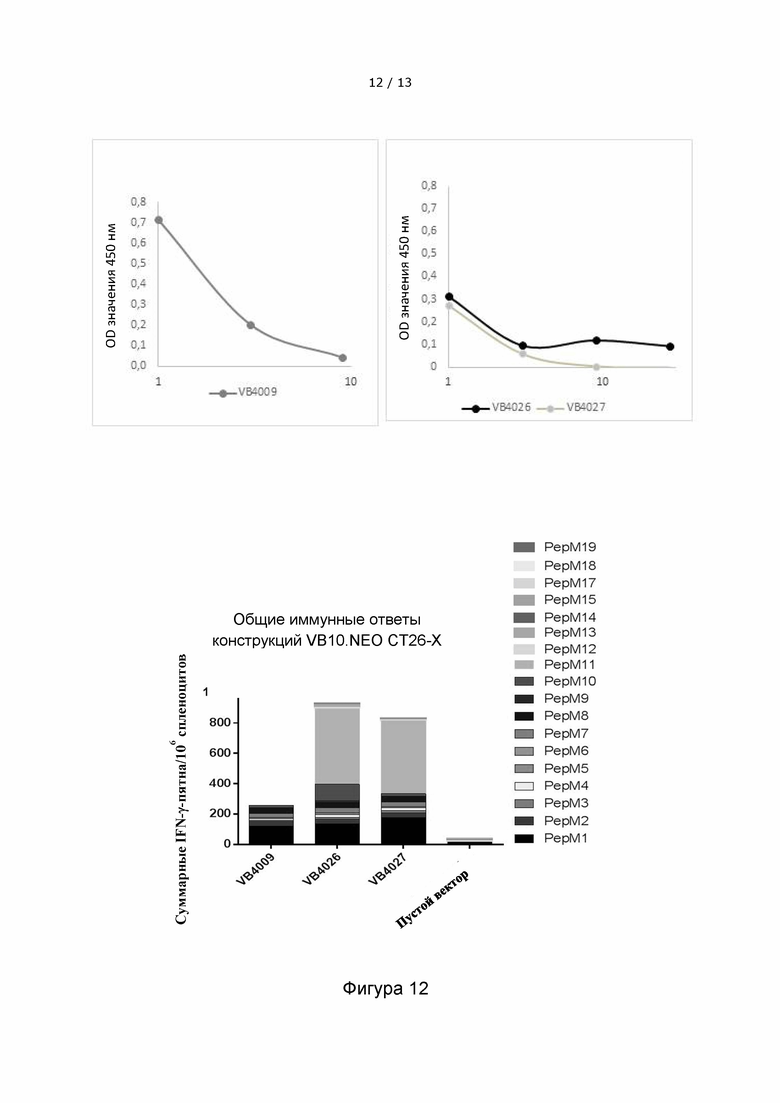
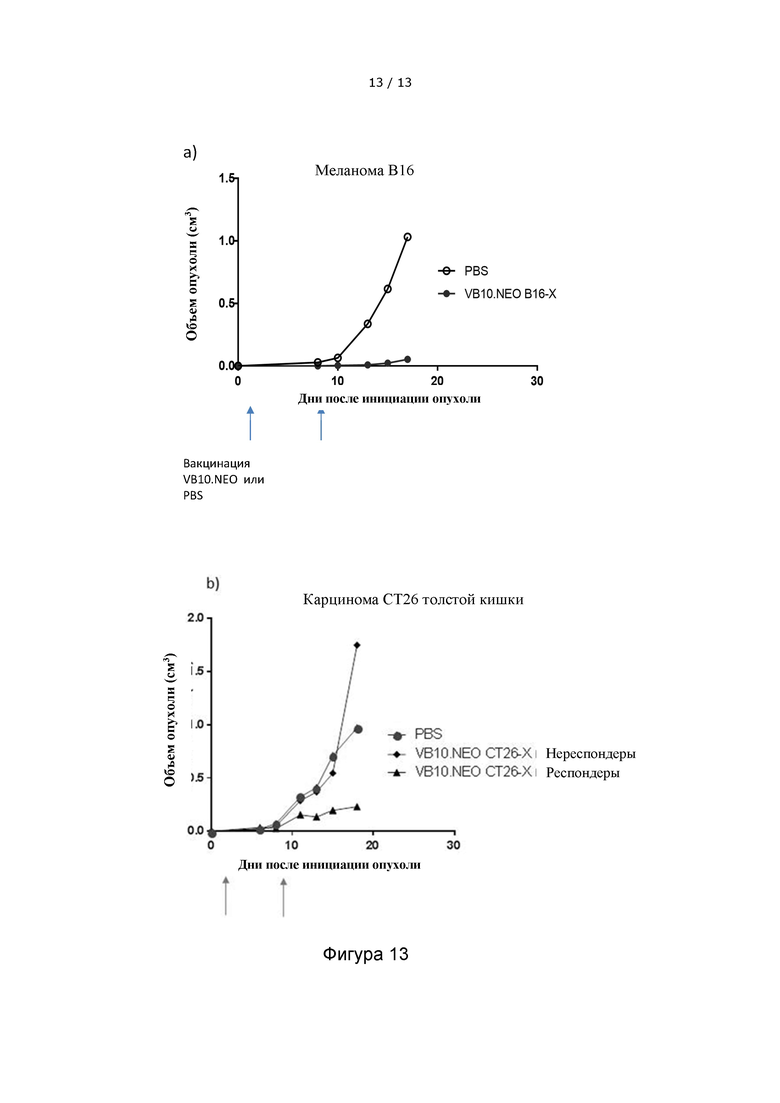
Группа изобретений относится к области фармацевтики и медицины. 1 объект представляет собой терапевтическую противораковую неоэпитопную вакцину, содержащую иммунологически эффективное количество 1) полинуклеотида, содержащего нуклеотидную последовательность, кодирующую единицу нацеливания, которая нацелена на поверхностные молекулы на антигенпрезентирующих клетках, единицу димеризации, содержащую шарнирную область, полученную из Ig, и домен CH3, полученный из Ig, первый линкер и антигенную единицу, содержащую n раковых неоэпитопных последовательностей, причем указанная антигенная единица содержит n-1 антигенных субъединиц, каждая субъединица содержит раковую неоэпитопную последовательность и второй линкер, и причем указанная антигенная единица дополнительно содержит концевую раковую неоэпитопную последовательность, где n представляет собой целое число от 3 до 50, причем антигенная единица и единица димеризации соединены через указанный первый линкер; или 2) полипептида, кодируемого полинуклеотидом, как определено в 1); или 3) димерного белка, состоящего из двух полипептидов, кодируемых полинуклеотидом, как определено в 1). 2 объект – применение вакцины для лечения ракового заболевания, приводящего к возникновению опухоли. Технический результат заключается в эффективности при презентации каждого неоэпитопа иммунной системе и иммуногенности противораковой вакцины, способной вызывать широкий иммунный ответ. 2 н. и 22 з.п. ф-лы, 13 ил., 2 табл., 9 пр.
1. Терапевтическая противораковая неоэпитопная вакцина, содержащая иммунологически эффективное количество:
1) полинуклеотида, содержащего нуклеотидную последовательность, кодирующую
- единицу нацеливания, которая нацелена на поверхностные молекулы на антигенпрезентирующих клетках,
- единицу димеризации, содержащую шарнирную область, полученную из Ig, и домен CH3, полученный из Ig,
- первый линкер и
- антигенную единицу, содержащую n раковых неоэпитопных последовательностей, причем указанная антигенная единица содержит n-1 антигенных субъединиц, каждая субъединица содержит раковую неоэпитопную последовательность и второй линкер, и причем указанная антигенная единица дополнительно содержит концевую раковую неоэпитопную последовательность, где n представляет собой целое число от 3 до 50, причем антигенная единица и единица димеризации соединены через указанный первый линкер,
или
2) полипептида, кодируемого полинуклеотидом, как определено в 1), или
3) димерного белка, состоящего из двух полипептидов, кодируемых полинуклеотидом, как определено в 1).
2. Вакцина по п. 1, причем антигенная единица содержит одну копию каждого ракового неопептида.
3. Вакцина по п. 1, причем антигенная единица содержит по меньшей мере две копии по меньшей мере одного неоэпитопа.
4. Вакцина по любому из предшествующих пунктов, причем раковая неоэпитопная последовательность имеет длину от 7 до 30 аминокислот.
5. Вакцина по любому из предшествующих пунктов, причем каждая раковая неоэпитопная последовательность имеет одинаковую длину.
6. Вакцина по любому из предшествующих пунктов, причем раковый неоэпитоп расположен, по существу, посередине раковой неоэпитопной последовательности.
7. Вакцина по любому из предшествующих пунктов, причем раковая неоэпитопная последовательность является подпоследовательностью ракового неоантигена.
8. Вакцина по любому из предшествующих пунктов, причем антигенные субъединицы расположены в порядке от наиболее антигенной до наименее антигенной, считая от первого линкера.
9. Вакцина по любому из предшествующих пунктов, причем наиболее гидрофобная антигенная субъединица(ы) находи(я)тся по существу в середине антигенной единицы, и наиболее гидрофильная антигенная субъединица(ы) находи(я)тся на концах антигенной единицы.
10. Вакцина по любому из предшествующих пунктов, причем второй линкер представляет собой гибкий линкер.
11. Вакцина по любому из предшествующих пунктов, причем второй линкер идентичен во всех антигенных субъединицах.
12. Вакцина по любому из предшествующих пунктов, причем второй линкер представляет собой серин-глициновый линкер.
13. Вакцина по любому из предшествующих пунктов, причем длина антигенной единицы составляет от около 300 аминокислот до около 1000 аминокислот.
14. Вакцина по любому из предшествующих пунктов, причем единица димеризации содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 94-237 последовательности SEQ ID NO: 3.
15. Вакцина по любому из предшествующих пунктов, причем единица нацеливания имеет сродство к хемокиновому рецептору, выбранному из CCR1, CCR3 и CCR5.
16. Вакцина по любому из предшествующих пунктов, причем единица нацеливания представляет собой hMIP-1alpha.
17. Вакцина по любому из предшествующих пунктов, причем единица нацеливания содержит аминокислотную последовательность, обладающую по меньшей мере 80% идентичностью последовательности с аминокислотной последовательностью 24-93 последовательности SEQ ID NO: 1.
18. Вакцина по любому из предшествующих пунктов, причем указанные единица нацеливания, единица димеризации и антигенная единица в указанном пептиде находятся в направлении от N-конца к С-концу в следующем порядке: единица нацеливания, единица димеризации и антигенная единица.
19. Вакцина по любому из предшествующих пунктов, причем раковая неоэпитопная последовательность происходит от ракового заболевания, приводящего к возникновению опухоли.
20. Вакцина по п. 19, причем указанное раковое заболевание обладает высокой мутационной нагрузкой.
21. Вакцина по любому из пп. 19 и 20, причем раковое заболевание представляет собой меланому, рак легких, рак молочной железы, рак предстательной железы или рак толстой кишки.
22. Применение вакцины по любому из пп. 1-21 для лечения ракового заболевания, приводящего к возникновению опухоли.
23. Применение вакцины по п. 22, причем указанное раковое заболевание обладает высокой мутационной нагрузкой.
24. Применение вакцины по любому из пп. 22 и 23, причем раковое заболевание представляет собой меланому, рак легких, рак молочной железы, рак предстательной железы или рак толстой кишки.
| WO 2011161244 A1, 29.12.2011 | |||
| WO 2012159643 A1, 29.11.2012 | |||
| FREDRIKSEN A.B | |||
| et al., DNA vaccines increase immunogenicity of idiotypic tumor antigen by targeting novel fusion proteins to antigen-presenting cells // Molecular therapy | |||
| Пломбировальные щипцы | 1923 |
|
SU2006A1 |
| - Vol | |||
| Насос | 1917 |
|
SU13A1 |
| - No | |||
| Очаг для массовой варки пищи, выпечки хлеба и кипячения воды | 1921 |
|
SU4A1 |
| - P | |||
| Прибор для вычерчивания участков параболы | 1923 |
|
SU776A1 |
| FREDRIKSEN A.B | |||
| et al., Chemokine-idiotype fusion DNA vaccines are | |||
Авторы
Даты
2022-10-26—Публикация
2017-01-05—Подача