ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
По настоящей заявке испрашивается приоритет на основании лежащей в ее основе Японской патентной заявки № 2013-212103, поданной 9 октября 2013 г.; полное содержание которой включено в настоящий документ посредством ссылки.
ОБЛАСТЬ ТЕХНИКИ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуностимулятору, содержащему в качестве активного ингредиента модифицированный β-глюкан, отличающийся тем, что β-глюкан и поли(гидроксикислота) ковалентно связаны.
УРОВЕНЬ ТЕХНИКИ
Известно, что полисахариды оказывают разнообразное воздействие на организм. В том числе известно, что β-глюканы связываются с рецепторами (например, дектином-1 и тому подобными), существующими на иммунных клетках в организме, активируя иммунную реакцию (смотри не патентный документ 1). Хотя иммуностимуляторы, основанные на иммуностимулирующем эффекте β-глюканов, были изучены и разработаны (смотри патентный документ 1), нельзя сказать, что иммуностимулирующей эффект β-глюканов является сильным, и были проведены исследования относительно их совместного использования с другими иммуностимуляторами для достижения желаемых эффектов (смотри патентный документ 2).
Между тем, полисахариды также известны как биосовместимые материалы и их используют в качестве основы для гидрогеля или материалов замедленного высвобождения, основанных на биологической совместимости полисахаридов. Преобразование биоразлагаемых полимеров в полисахариды может изменять физические свойства, сохраняя при этом биологическую совместимость (смотри патентный документ 3 и не патентный документ 2).
ЛИТЕРАТУРА ПРЕДШЕСТВУЮЩЕГО УРОВНЯ ТЕХНИКИ
Патентные документы
Патентный документ 1
Выложенная публикация японской патентной заявки № 1998-194977
Патентный документ 2
Выложенная публикация японской патентной заявки № 2011-504487
Патентный документ 3
Выложенная публикация японской патентной заявки № 2013-67709
Не патентные документы
Не патентный документ 1
Mycological Research, 2007; 111: 635-652
Не патентный документ 2
Polymer 2003; 44: 3927-3933
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
ПРОБЛЕМЫ, РЕШАЕМЫЕ С ПОМОЩЬЮ ИЗОБРЕТЕНИЯ
Целью настоящего изобретения является предложение эффективного иммуностимулятора за счет усиления иммуностимулирующего эффекта β-глюкана.
СПОСОБЫ РЕШЕНИЯ ПРОБЛЕМ
Для преодоления вышеуказанной проблемы автор настоящего изобретения исследовал способы усиления иммуностимулирующего эффекта β-глюкана и обнаружил, что β-глюкан, модифицированный с помощью поли(гидроксикислоты), обладает высокой иммуностимулирующей активностью in vivo, что явилось сущностью настоящего изобретения.
Иными словами, настоящее изобретение имеет следующие составляющие (1)-(12).
(1) Иммуностимулятор, содержащий в качестве активного ингредиента модифицированный β-глюкан, отличающийся тем, что β-глюкан и поли(гидроксикислота) ковалентно связаны.
(2) Иммуностимулятор по пункту (1), в котором β-глюкан представляет собой полимер глюкозы, связанный по меньшей мере одной β-1,3 связью и/или по меньшей мере одной β-1,6 связью.
(3) Иммуностимулятор по пункту (1) или (2), в котором модифицированный β-глюкан представляет собой привитый полимер, состоящий из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты).
(4) Иммуностимулятор по любому из пунктов (1)-(3), в котором доля сегментов β-глюкана составляет от 1% до 50% (по массе).
(5) Иммуностимулятор по любому из пунктов (1)-(4), в котором β-глюкан представляет собой курдлан, ламинаран, пачиман, лихенан, сизофиран, лентинан, склероглюкан, глюкан Aureobasidium pullulans или пачимаран.
(6) Иммуностимулятор по любому из пунктов (1)-(5), в котором среднечисленная молекулярная масса β-глюкана составляет от 500 до 100000.
(7) Иммуностимулятор по любому из пунктов (1)-(6), в котором поли(гидроксикислота) представляет собой сополимер молочной-гликолевой кислот, полимолочную кислоту или полигликолевую кислоту.
(8) Иммуностимулятор по любому из пунктов (1)-(7), содержащий частицы модифицированного β-глюкана в качестве активного ингредиента.
(9) Лекарственное средство, содержащее иммуностимулятор по любому из пунктов (1)-(8) в качестве активного ингредиента.
(10) Вакцина, содержащая иммуностимулятор по любому из пунктов (1)-(8) и антиген в качестве активных ингредиентов.
(11) Вакцина для лечения и/или предотвращения рака, содержащая иммуностимулятор по любому из пунктов (1)-(8) и раковый антиген в качестве активных ингредиентов.
(12) Способ иммуностимуляции, включающий введение in vivo иммуностимулятора по любому из пунктов (1)-(8) или лекарственного средства по пункту (9).
ЭФФЕКТЫ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуностимулятору, который активирует иммунитет более эффективно, чем обычный иммуностимулятор.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
На фигуре 1 представлены результаты измерения методом ГПХ ламинарана и гидролизатов ламинарана (1)-(3).
На фигуре 2 представлены результаты измерения методом ГПХ модифицированного ламинарана (5).
На фигуре 3 представлены результаты измерения методом 1H-ЯМР триметилсилилированного ламинарана (3).
На фигуре 4 представлены результаты измерения методом 1H-ЯМР модифицированного ламинарана (5).
На фигуре 5 представлены результаты измерения методом ГПХ гидролизатов курдлана (4)-(6).
На фигуре 6 представлены результаты измерения методом ГПХ модифицированного курдлана (9).
На фигуре 7 представлены результаты измерения методом 1H-ЯМР триметилсилилированного курдлана (5).
На фигуре 8 представлены результаты измерения методом 1H-ЯМР модифицированного курдлана (9).
На фигуре 9 представлены результаты теста на in vitro стимуляцию для модифицированного β-глюкана.
На фигуре 10 представлены результаты теста 1 на in vitro стимуляцию для частиц с модифицированным β-глюканом в качестве основного материала.
На фигуре 11 представлены результаты теста 2 на in vitro стимуляцию для частиц с модифицированным β-глюканом в качестве основного материала.
На фигуре 12 представлены результаты in vivo теста 1 для модифицированного β-глюкана.
На фигуре 13 представлены результаты in vivo теста 2 для модифицированного β-глюкана.
На фигуре 14 представлены результаты in vivo теста 3 для модифицированного β-глюкана.
На фигуре 15 представлены результаты измерения методом 1H-ЯМР модифицированного пачимана (16).
На фигуре 16 представлены результаты измерения методом 1H-ЯМР модифицированного сизофирана (17).
На фигуре 17 представлены результаты измерения методом 1H-ЯМР модифицированного глюкана Aureobasidium pullulans (18).
На фигуре 18 представлены результаты измерения методом 1H-ЯМР модифицированного склероглюкана (19).
На фигуре 19 представлены результаты измерения методом 1H-ЯМР модифицированного пачимарана (22).
На фигуре 20 представлены результаты теста 2 на in vitro стимуляцию для модифицированного β-глюкана.
На фигуре 21 представлены результаты теста 3 на in vitro стимуляцию для частиц с модифицированным β-глюканом в качестве основного материала.
На фигуре 22 представлены результаты in vivo теста 4 для модифицированного β-глюкана.
СПОСОБ ОСУЩЕСТВЛЕНИЯ ИЗОБРЕТЕНИЯ
Настоящее изобретение относится к иммуностимулятору, содержащему в качестве активного ингредиента модифицированный β-глюкан, отличающийся тем, что β-глюкан и поли(гидроксикислота) ковалентно связаны.
Глюкан представляет собой полисахарид, содержащий глюкозу, и β-глюкан представляет собой глюкан, содержащий по меньшей мере одну β-связь между субъединицами глюкозы. Иными словами, β-глюкан, используемый по настоящему изобретению, представляет собой глюкан, содержащий β-связь, и может быть глюканом, содержащим только β-связь. β-глюкан, используемый по настоящему изобретению, может быть разветвленным или линейным.
Предпочтительный β-глюкан, используемый по настоящему изобретению, включает β-глюкан, который содержит по меньшей мере одну β-1,3 связь и/или по меньшей мере одну β-1,6 связь, или β-глюкан, который содержит по меньшей мере одну β-1,2 связь и/или β-1,4 связь, более предпочтительно, β-глюкан, который содержит по меньшей мере одну β-1,3 связь и/или по меньшей мере одну β-1,6 связь, и еще более предпочтительно, β-глюкан, который содержит по меньшей мере одну β-1,3 связь. Примеры β-глюкана, содержащего по меньшей мере одну β-1,3 связь, включают курдлан, пачиман, ламинаран, лихенан, сизофиран, лентинан, склероглюкан, глюкан Aureobasidium pullulans (предпочтительно, получаемый из Aureobasidium pullulans β-1,3 глюкан или β-1,6 глюкан) или пачимаран, предпочтительно курдлан, пачиман, ламинаран, сизофиран, склероглюкан, глюкан Aureobasidium pullulans или пачимаран.
Линейный β-глюкан, содержащий по меньшей мере одну β-1,3 связь, включает β-глюкан, в основном содержащий β-1,3 связь (например, курдлан или пачиман), или β-глюкан, содержащий β-1,3 связь и β-связь, отличную от β-1,3 связи (например, ламинаран или лихенан).
Разветвленный β-глюкан, содержащий по меньшей мере одну β-1,3 связь, включает β-глюкан, содержащий β-1,3 связь и β-1,6 связь (например, сизофиран, лентинан, склероглюкан или глюкан Aureobasidium pullulans).
β-глюкан, используемый по настоящему изобретению, может быть дериватизирован. Примеры дериватизации включают реакцию присоединения карбоксиметильной группы или реакцию окислительного расщепления. Примеры дериватизированного β-глюкана включают карбоксиметилкурдлан, в котором карбоксиметильная группа присоединена к курдлану, или пачимаран, подвергнутый расщеплению.
Среднечисленная молекулярная масса β-глюкана не имеет конкретных ограничений, и она составляет предпочтительно от 500 до 100000, более предпочтительно, от 1000 до 50000, и еще более предпочтительно, от 1900 до 25000. Среднечисленная молекулярная масса представляет собой среднюю молекулярную массу, рассчитанную без учета массовых долей молекул каждого размера, и среднечисленную молекулярную массу β-глюкана можно рассчитывать с помощью метода гель-проникающей хроматографии (ГПХ).
Поли(гидроксикислота) не имеет конкретных ограничений, и она предпочтительно представляет собой биосовместимый полимер, не имеющий выраженных неблагоприятных эффектов при введении in vivo в качестве компонента иммуностимулятора. Используемый в настоящем документе термин «биологическая совместимость» означает, что LD50 при пероральном введении полимера крысам составляет 2000 мг/кг или более. Поли(гидроксикислота) может представлять собой сополимер разных видов, и предпочтительно является полимером гидроксикислот двух или менее видов.
Предпочтительные конкретные примеры поли(гидроксикислоты) включают полигликолевую кислоту, полимолочную кислоту, поли(2-гидроксимасляную кислоту), поли(2-гидроксивалериановую кислоту), поли(2-гидроксикапроновую кислоту), поли(2-гидроксикаприновую кислоту), поли(яблочную кислоту) или производное и сополимер этих высокомолекулярных соединений, и сополимер молочной-гликолевой кислот, полимолочная кислота или полигликолевая кислота являются особенно предпочтительными, при этом сополимер молочной-гликолевой кислот является еще более предпочтительным. Соотношение компонентов сополимера молочной-гликолевой кислот (молочная кислота/гликолевая кислота) (моль/моль) в случае, когда поли(гидроксикислота) представляет собой сополимер молочной-гликолевой кислот, не имеет конкретных ограничений при условии, что достигается цель настоящего изобретения, и оно предпочтительно составляет от 100/0 до 30/70, и более предпочтительно, от 60/40 до 40/60.
Среднечисленная молекулярная масса поли(гидроксикислоты) не имеет конкретных ограничений, и она составляет предпочтительно от 500 до 1000000, более предпочтительно, от 10000 до 100000, и еще более предпочтительно, от 14700 до 68300. Среднечисленную молекулярную массу поли(гидроксикислоты) можно рассчитывать как разность между среднечисленной молекулярной массой модифицированного β-глюкана и среднечисленной молекулярной массой β-глюкана.
Структура модифицированного β-глюкана не имеет конкретных ограничений, и его примеры включают линейный полимер блочного типа, в котором β-глюкан связан с поли(гидроксикислотой), разветвленный полимер, имеющий несколько разветвленных цепей β-глюканов или поли(гидроксикислот), привитый полимер, состоящий из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты), или привитый полимер, состоящий из основной цепи из поли(гидроксикислоты) и боковой цепи из β-глюкана, предпочтительно, привитый полимер, состоящий из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты).
Поскольку модифицированный β-глюкан сохраняет иммуностимулирующей эффект в течение длительного времени, он, в целом, предпочтительно является нерастворимым в воде, так что он сразу же не выводится из организма. Используемый в настоящем документе термин «нерастворимый в воде» означает, что растворимость в воде составляет 1 г (модифицированного β-глюкана)/100 мл (воды) или менее.
Среднечисленная молекулярная масса модифицированного β-глюкана не имеет конкретных ограничений, и она составляет предпочтительно от 1000 до 1000000, более предпочтительно, от 10000 до 100000, и еще более предпочтительно, от 13800 до 84000. Среднечисленную молекулярную массу модифицированного β-глюкана можно рассчитывать с помощью метода гель-проникающей хроматографии (ГПХ).
Долевое содержание сегментов β-глюкана в модифицированном β-глюкане (сегменты β-глюкана/модифицированный β-глюкан) не имеет конкретных ограничений, и оно составляет предпочтительно от 1% до 50% (по массе), более предпочтительно, от 5% до 45% (по массе), и еще более предпочтительно, от 8,3% до 42,5% (по массе). Долевое содержание сегментов β-глюкана в модифицированном β-глюкане можно рассчитывать путем деления среднечисленной молекулярной массы β-глюкана на среднечисленную молекулярную массу модифицированного β-глюкана.
Для привитого полимера, состоящего из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты), нет конкретных ограничений в отношении среднечисленной молекулярной массы каждой привитой цепи, и она составляет предпочтительно от 1000 до 10000, и более предпочтительно, от 1300 до 6400. Среднечисленную молекулярную массу каждой привитой цепи можно рассчитывать как отношение пикового интегрального значения концевого остатка к пиковому интегральному значению сайтов, отличных от концевого остатка, при измерении методом ядерного магнитного резонанса (ЯМР).
Для привитого полимера, состоящего из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты), нет конкретных ограничений в отношении числа привитых цепей, и оно составляет предпочтительно от 3 до 15. Число привитых цепей можно рассчитывать путем деления значения, полученного при вычитании среднечисленной молекулярной массы β-глюкана из среднечисленной молекулярной массы модифицированного β-глюкана, на среднечисленную молекулярную массу каждой привитой цепи.
Модифицированный β-глюкан можно получать известными способами, в частности, примеры включают способ получения путем добавления поли(гидроксикислоты) к β-глюкану, с проведением реакции конденсации, или способ получения путем добавления активированных мономеров гидроксикислоты к β-глюкану, с проведением реакции полимеризации.
В частности, если модифицированный β-глюкан представляет собой привитый полимер, состоящий из основной цепи из β-глюкана и боковой цепи из поли(гидроксикислоты), его можно получать следующими способами (1), (2) или (3):
(1) способ получения привитого полимера путем добавления, в присутствии оловянных катализаторов, активированных мономеров гидроксикислоты к β-глюкану, с проведением реакции полимеризации, и путем введения поли(гидроксикислоты) [Macromolecules 1998; 31: p.1032-1039]
(2) способ получения привитого полимера путем активации частично лишенных защиты гидроксильных групп β-глюкана, в котором большинство гидроксильных групп защищены заместителями с основаниями, с последующим добавлением активированных мономеров гидроксикислоты для введения привитых цепей, состоящих из поли(гидроксикислоты), и заключительного удаления защитных групп [Polymer 2003; 44: 3927-3933]
(3) способ получения привитого полимера путем проведения реакции конденсации сополимера поли(гидроксикислоты) с β-глюканом с использованием дегидратирующих реагентов и/или активирующих функциональные группы реагентов [Macromolecules 2000; 33: 3680-3685].
Форма модифицированного β-глюкана, используемого в качестве иммуностимулятора, включает волокна, пленку, частицы и тому подобное, а если иммуностимулятор вводят in vivo, частицы являются предпочтительной формой из-за легкости введения.
Метод получения частиц модифицированного β-глюкана не имеет конкретных ограничений, и он включает метод выпаривания растворителя, метод сушки распылением или метод измельчения, и частицы модифицированного β-глюкана предпочтительно получают методом выпаривания растворителя.
Метод получения частиц путем выпаривания растворителя включает метод с использованием эмульсии O/W, метод с использованием эмульсии W/O/W или метод с использованием эмульсии S/O/W.
В качестве примера получения частиц методом с использованием эмульсии O/W, частицы можно получать способом, в котором несмешивающийся с водой органический растворитель, в котором растворен модифицированный β-глюкан, смешивают с водным раствором модификатора поверхности, с получением эмульсионного раствора O/W, и способом, в котором несмешивающийся с водой органический растворитель удаляют из эмульсионного раствора O/W, с получением частиц.
В качестве примера получения частиц методом с использованием эмульсии W/O/W, частицы можно получать способом, в котором водный растворитель смешивают с несмешивающимся с водой органическим растворителем, в котором растворен модифицированный β-глюкан, с получением эмульсионного раствора W/O, способом, в котором эмульсионный раствор W/O смешивают с водным раствором модификатора поверхности, с получением эмульсионного раствора W/O/W, и способом, в котором несмешивающийся с водой органический растворитель удаляют из эмульсионного раствора W/O/W, с получением частиц.
В качестве примера получения частиц методом с использованием эмульсии S/O/W, частицы можно получать способом, в котором водный растворитель смешивают с несмешивающимся с водой органическим растворителем, в котором растворен модифицированный β-глюкан, с получением эмульсионного раствора W/O, способом, в котором растворитель удаляют из эмульсионного раствора W/O, с получением твердого вещества, способом, в котором твердое вещество диспергируют в несмешивающемся с водой органическом растворителе, с получением суспензионного раствора S/O, способом, в котором суспензионный раствор S/O смешивают с водным раствором модификатора поверхности, с получением эмульсионного раствора S/O/W, и способом, в котором несмешивающийся с водой органический растворитель удаляют из эмульсионного раствора S/O/W, с получением частиц.
Модификатор поверхности, используемый для получения частиц, предпочтительно представляет собой водорастворимый полимер или сурфактант. Используемый в настоящем документе термин «водорастворимый полимер» означает высокомолекулярное соединение, растворимость в воде которого составляет 1 г (гидрофильного полимера)/100 мл (воды) или более.
Примеры водорастворимого полимера в качестве модификатора поверхности включают полиэтиленгликоль, поливинилпирролидон, поливиниловый спирт, полиэтиленимин, полиакриловую кислоту, полиметакриловую кислоту, поли-1,3-диоксолан, полимер 2-метакрилоилоксиэтилфосфорилхолина, поли-1,3,6-триоксан, полиаминокислоту, пептид, белок, сахариды или полисахариды, и более предпочтительно, поливиниловый спирт.
Примеры сурфактанта в качестве модификатора поверхности включают неионные сурфактанты, такие как полиоксиэтилен-полиоксипропиленгликоль, сложный эфир сахарозы и жирной кислоты, сложный эфир полиоксиэтилена и жирной кислоты, сложный эфир полиоксиэтиленсорбитана и одной жирной кислоты, сложный эфир полиоксиэтиленсорбитана и двух жирных кислот, сложный эфир полиоксиэтиленглицерина и одной жирной кислоты, сложный эфир полиоксиэтиленглицерина и двух жирных кислот, сложный эфир полиглицерина и жирной кислоты, полиоксиэтилен-касторовое масло или полиоксиэтилен-отвержденное касторовое масло; алкилсульфаты, такие как лаурилсульфат натрия, лаурилсульфат аммония или стеарилсульфат натрия, или лецитин, и более предпочтительно, полиоксиэтилен-полиоксипропиленгликоль.
В несмешивающемся с водой органическом растворителе, используемом для получения частиц, предпочтительно, модифицированный β-глюкан растворим, а β-глюкан слаборастворим или нерастворим. Растворимость в воде несмешивающегося с водой органического растворителя составляет предпочтительно 30 г (несмешивающегося с водой органического растворителя)/100 мл (воды) или менее. Примеры несмешивающегося с водой органического растворителя включают этилацетат, изопропилацетат, бутилацетат, диметилкарбонат, диэтилкарбонат, метиленхлорид или хлороформ.
Водный растворитель, используемый для получения частиц, представляет собой воду или водный раствор, содержащий водорастворимые компоненты. Примеры водорастворимых компонентов включают неорганические соли, сахариды, органические соли, аминокислоты, пептиды, белки или нуклеиновые кислоты.
На поверхности частиц модифицированного β-глюкана может быть связан модификатор поверхности, используемый в способе получения. Используемый в настоящем документе термин «связь» может означать нековалентную связь или ковалентную связь. Нековалентная связь предпочтительно представляет собой гидрофобное взаимодействие, и может представлять собой электростатическое взаимодействие, водородную связь или силы Ван-дер-Ваальса, либо их сочетание.
Средний размер частиц у частиц составляет предпочтительно 0,01-10 мкм, и более предпочтительно 0,1-1 мкм. В настоящем документе средний размер частиц был рассчитан путем измерения распределения интенсивности рассеянного света и коэффициента диффузии с использованием прибора для измерения динамического рассеяния света (DLS: например, Otsuka Electronics Co., Ltd., ELS-Z) и путем анализа кумулянтным методом.
Иммуностимулятор представляет собой лекарственное средство, которое активирует иммунный ответ in vivo, и иммуностимулятор по настоящему изобретению характеризуется наличием модифицированного β-глюкана в качестве активного ингредиента. Иммунный ответ, активируемый с помощью иммуностимулятора, не имеет конкретных ограничений, и тип вызываемого иммунного ответа включает Th1 иммунный ответ или Th2 иммунный ответ. Известно, что любой иммунный ответ преимущественно развивается в зависимости от типа антигена, зоны введения или способа введения, и иммуностимулятор по настоящему изобретению способен вызывать как Th1, так и Th2 иммунные ответы.
Иммуностимулятор по настоящему изобретению можно использовать в качестве самостоятельного лекарственного средства или в сочетании с другими лекарственными средствами. Если иммуностимулятор по настоящему изобретению используют в сочетании с другими лекарственными средствами, их можно объединять и формулировать, или они могут быть сформулированы независимо для раздельного введения.
Лекарственные средства, используемые в сочетании с иммуностимулятором по настоящему изобретению, не имеют конкретных ограничений, и предпочтительно используют антиген. Используемый в настоящем документе термин «антиген» означает вещество, которое индуцирует иммунитет in vivo и используется в качестве вакцины для лечения и/или предотвращения заболеваний. Одновременное использование иммуностимулятора по настоящему изобретению с антигеном может приводить к усилению иммунного ответа, индуцированного антигеном.
Примеры антигена включают пептид, белок, гликопротеин, гликолипид, липид, углевод, нуклеиновую кислоту или полисахариды, а также вирус, тело бактерии, вызывающее аллергию вещество, ткань или клетку, содержащую их. В частности, они включают антиген из пыльцы, антиген из вируса гепатита A, антиген из вируса гепатита B, антиген из вируса гепатита C, антиген из вируса гепатита D, антиген из вируса гепатита E, антиген из вируса гепатита F, антиген из вируса ВИЧ, антиген из вируса гриппа, антиген из вируса герпеса (HSV-1 или HSV-2), антиген из Bacillus anthracis, антиген из Chlamydia, антиген из Streptococcus pneumoniae, антиген из вируса японского энцефалита, антиген из вируса кори, антиген из вируса краснухи, антиген из Clostridium tetani, антиген из вируса ветряной оспы, антиген из вируса ТОРС (SARS), антиген из вируса Э-Б (EB), антиген из папилломавируса, антиген из Helicobacter pylori, антиген из вируса бешенства, антиген из вируса лихорадки западного Нила, антиген из хантавируса, антиген из Streptococcus, антиген из Staphylococcus, антиген из Bordetella pertussis, антиген из Mycobacterium tuberculosis, антиген из Plasmodium, антиген из вируса полиомиелита, различные антигены из возбудителей зоонозов, различные антигены, вызывающие пищевую аллергию, или собственные антигены.
Другие предпочтительные примеры антигена включают раковый антиген. Раковый антиген представляет собой вещество из белков, которые специфически экспрессируются на раковых клетках, и оказывает свои эффекты на лечение и/или предотвращение рака за счет вызывания иммунного ответа после введения извне in vivo. Иммуностимулятор по настоящему изобретению при одновременном введении с раковым антигеном можно использовать в качестве вакцины для лечения и/или предотвращения рака.
Если иммуностимулятор по настоящему изобретению представляет собой частицы модифицированного β-глюкана, антиген предпочтительно инкапсулирован в частицы. Способ инкапсуляции антигена в частицы модифицированного β-глюкана включает способ получения частиц модифицированного β-глюкана методом с использованием эмульсии W/O/W или методом с использованием эмульсии S/O/W, используя раствор антигена в качестве водного растворителя.
Если антиген инкапсулирован в частицы модифицированного β-глюкана, степень инкапсуляции (антиген/модифицированный β-глюкан) составляет предпочтительно от 0,01% до 20% (по массе), и более предпочтительно, от 0,1% до 10% (по массе). Метод определения степени инкапсуляции включает метод определения степени инкапсуляции с использованием электрофореза в геле или жидкостной хроматографии после того, как антиген экстрагируют из частиц модифицированного β-глюкана с помощью органического растворителя.
В предпочтительном варианте осуществления настоящего изобретения предложен способ иммуностимуляции, включающий введение иммуностимулятора или лекарственного средства по настоящему изобретению в организм (субъекта). Способ активации (стимуляции) иммунной реакции с помощью иммуностимулятора или лекарственного средства по настоящему изобретению не имеет конкретных ограничений, и иммуностимулятор или лекарственное средство можно вводить в организм или можно приводить в контакт с иммунными клетками, извлеченными ex vivo. Способ введения в организм не имеет конкретных ограничений, и примеры включают подкожное введение, внутрикожное введение, внутримышечное введение, трансназальное введение, легочное введение, пероральное введение, чрескожное введение, подъязычное введение, интравагинальное введение, внутрибрюшинную инъекцию или введение в лимфатические узлы, и предпочтительным является внутрикожное введение или подкожное введение. Организм, в который осуществляют введение, может быть человеком или животным, отличным от человека, и предпочтительно является человеком или домашним скотом, или свиньей, крупным рогатым скотом, птицей, овцой, лошадью, ослом, козой, верблюдом, собакой, кошкой, хорьком, кроликом, обезьяной, крысой, мышью или морской свинкой, домашним питомцем или лабораторным животным.
Если иммуностимулятор по настоящему изобретению используют в качестве лекарственного средства (включая вакцину), формулирование можно выполнять путем объединения различных фармацевтически полезных добавок, и примеры добавок включают буфер, антиоксидант, соль, полимер или сахар.
Дозу модифицированного β-глюкана в случае, если иммуностимулятор по настоящему изобретению используют в качестве лекарственного средства, соответствующим образом выбирают в соответствии со способом введения или частотой введения. Например, если иммуностимулятор по настоящему изобретению подкожно вводят людям, вводимое при одном введении количество модифицированного β-глюкана составляет 0,01-1,000 мг.
Доза других лекарственных средств, таких как антиген, если иммуностимулятор по настоящему изобретению используют в сочетании с антигеном, составляет предпочтительно 0,001-100 мг.
В предпочтительном варианте осуществления настоящего изобретения предложен иммуностимулятор, содержащий в качестве активного ингредиента модифицированный β-глюкан, отличающийся тем, что β-глюкан и поли(гидроксикислота) ковалентно связаны, при этом β-глюкан представляет собой курдлан, пачиман, ламинаран, сизофиран, склероглюкан, глюкан Aureobasidium pullulans или пачимаран, и поли(гидроксикислота) представляет собой сополимер молочной-гликолевой кислот.
В другом предпочтительном варианте осуществления настоящего изобретения предложена вакцина, которая содержит иммуностимулятор, содержащий в качестве активного ингредиента модифицированный β-глюкан, отличающийся тем, что β-глюкан и поли(гидроксикислота) ковалентно связаны, и раковый антиген в качестве активного ингредиента, при этом β-глюкан представляет собой курдлан, пачиман, ламинаран, сизофиран, склероглюкан, глюкан Aureobasidium pullulans или пачимаран, и поли(гидроксикислота) представляет собой сополимер молочной-гликолевой кислот.
ПРИМЕРЫ
Ниже приведены примеры, но настоящее изобретение не ограничено данными примерами.
Пример 1: Синтез ламинарана с модификацией сополимером молочной-гликолевой кислот (модифицированные ламинараны (1)-(8))
(1) Реакция гидролиза ламинарана (синтез гидролизатов ламинарана (1)-(3)
10 г ламинарана (среднечисленная молекулярная масса 25000, Tokyo Chemical Industry Co., Ltd.) растворяли в 120 мл диметилсульфоксида и добавляли 15 мл 0,5 Н раствора соляной кислоты, с последующим перемешиванием при температуре 105°C в течение 0,5 часа. Реакционный раствор переносили в диализную мембрану и диализовали в воде, затем лиофилизировали, с получением гидролизата ламинарана (1) (среднечисленная молекулярная масса 12700) в виде порошка. В таких же условиях синтезировали гидролизат ламинарана (2) (среднечисленная молекулярная масса 6700) и гидролизат ламинарана (3) (среднечисленная молекулярная масса 4100), проводя реакцию в течение 1,5 часов и 2 часов, соответственно.
Среднечисленную молекулярную массу ламинарана и гидролизата ламинарана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel G3000PWXL-CP×2, растворитель уксуснокислый буфер [10 мМ, pH=5]; детектор RI; эталонный образец пуллулан) (фигура 1: ламинаран и гидролизаты ламинарана (1)-(3)).
(2) Реакция триметилсилилирования (TMS) ламинарана (синтез триметилсилилированных ламинаранов (1)-(4))
2,4 г ламинарана (среднечисленная молекулярная масса 25000, Tokyo Chemical Industry Co., Ltd.) добавляли к 48 мл формамида и раствор нагревали до 80°C. В этот раствор добавляли по каплям в течение 20 минут 48 мл 1,1,1,3,3,3-гексаметилдисилазана, с последующим перемешиванием при температуре 80°C в течение 2,5 часов. Реакционный раствор переносили в разделительную воронку и оставляли до разделения его на два слоя. Верхний слой собирали и концентрировали при пониженном давлении, затем добавляли 144 мл метанола и полученное твердое вещество отфильтровывали и высушивали, с получением 3,14 г триметилсилилированного ламинарана (1) в виде белого твердого вещества. Таким же образом триметилсилилированный ламинаран (2) синтезировали из гидролизата ламинарана (1), триметилсилилированный ламинаран (3) синтезировали из гидролизата ламинарана (2) и триметилсилилированный ламинаран (4) синтезировали из гидролизата ламинарана (3).
Протекание реакции триметилсилилирования подтверждали путем измерений методом 1H-ЯМР (фигура 3: триметилсилилированный ламинаран (3)).
(3) Реакция модификации ламинарана сополимером молочной-гликолевой кислот (синтез модифицированных ламинаранов (1)-(8))
0,5 г триметилсилилированного ламинарана (1) и 26 мг трет-бутоксикалия (tBuOK) высушивали с нагреванием при пониженном давлении в течение 2 часов и добавляли 10 мл тетрагидрофурана, с последующим перемешиванием при комнатной температуре в течение 1,5 часов, с получением активированного раствора. Мономер (смесь (DL)-лактида и гликолида с молярным соотношением 1:1) в 35-кратном молярном избытке по отношению к tBuOK, используемому для получения активированного раствора, растворяли в тетрагидрофуране, с получением раствора мономера. Раствор мономера добавляли по каплям к активированному раствору, с последующим перемешиванием в течение 30 минут, а затем добавляли 0,5 мл уксусной кислоты для остановки реакции. После завершения реакции раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-метанол (плохой растворитель) и системы хлороформ (хороший растворитель)-циклогексан (плохой растворитель), с получением белого твердого вещества. Полученное белое твердое вещество растворяли в 5 мл хлороформа и добавляли 0,5 мл трифторуксусной кислоты, с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-диэтиловый эфир (плохой растворитель), с получением модифицированного ламинарана (1) в виде белого твердого вещества.
Таким же образом модифицированный ламинаран (2) синтезировали путем проведения реакции триметилсилилированного ламинарана (1) с мономером в 50-кратном молярном избытке по отношению к tBuOK, модифицированный ламинаран (3) синтезировали путем проведения реакции триметилсилилированного ламинарана (2) с мономером в 35-кратном молярном избытке по отношению к tBuOK, модифицированный ламинаран (4) синтезировали путем проведения реакции триметилсилилированного ламинарана (2) с мономером в 50-кратном молярном избытке по отношению к tBuOK, модифицированный ламинаран (5) синтезировали путем проведения реакции триметилсилилированного ламинарана (3) с мономером в 30-кратном молярном избытке по отношению к tBuOK, модифицированный ламинаран (6) синтезировали путем проведения реакции триметилсилилированного ламинарана (3) с мономером в 35-кратном молярном избытке по отношению к tBuOK, модифицированный ламинаран (7) синтезировали путем проведения реакции триметилсилилированного ламинарана (3) с мономером в 50-кратном молярном избытке по отношению к tBuOK и модифицированный ламинаран (8) синтезировали путем проведения реакции триметилсилилированного ламинарана (4) с мономером в 35-кратном молярном избытке по отношению к tBuOK.
Результаты оценки модифицированных ламинаранов (1)-(8) приведены в таблице 1. Среднечисленную молекулярную массу модифицированного ламинарана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel α-5000×2, растворитель ДМФ; детектор RI; эталонный образец пуллулан) (фигура 2: модифицированный ламинаран (5)). Долевое содержание (по массе) сегментов ламинарана в модифицированном ламинаране определяли из среднечисленной молекулярной массы ламинарана, используемого для синтеза, и среднечисленной молекулярной массы модифицированного ламинарана. Среднечисленную молекулярную массу каждой привитой цепи определяли методом 1H-ЯМР (фигура 4: модифицированный ламинаран (5)). Среднее число привитых цепей определяли путем деления значения, полученного при вычитании среднечисленной молекулярной массы ламинарана из среднечисленной молекулярной массы модифицированного ламинарана, на среднечисленную молекулярную массу каждой привитой цепи.
Пример 2: Синтез курдлана с модификацией сополимером молочной-гликолевой кислот (модифицированные курдланы (9)-(14))
(1) Реакция гидролиза курдлана (синтез гидролизатов курдлана (4)-(6))
12,8 г курдлана (среднечисленная молекулярная масса примерно 90000, Wako Pure Chemical Industries, Ltd.) растворяли в 384 мл диметилсульфоксида и добавляли 19,2 мл 1 Н раствора соляной кислоты, с последующим перемешиванием при температуре 110°C в течение 0,75 часа. Реакционный раствор переносили в диализную мембрану и диализовали в воде, затем лиофилизировали, с получением гидролизата курдлана (4) (среднечисленная молекулярная масса 2800) в виде порошка. В таких же условиях синтезировали гидролизат курдлана (5) (среднечисленная молекулярная масса 2300) и гидролизат курдлана (6) (среднечисленная молекулярная масса 1900), проводя реакцию в течение 0,8 часа и 0,85 часа, соответственно.
Среднечисленную молекулярную массу курдлана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel G3000PWXL-CP×2, растворитель уксуснокислый буфер [10 мМ, pH=5]; детектор RI; эталонный образец пуллулан) (фигура 5: гидролизаты курдлана (4)-(6)).
(2) Реакция триметилсилилирования (TMS) курдлана (синтез триметилсилилированных курдланов (5)-(7))
1 г гидролизата курдлана (4) добавляли к 20 мл формамида и раствор нагревали до 80°C. В этот раствор добавляли по каплям в течение 20 минут 20 мл 1,1,1,3,3,3-гексаметилдисилазана, с последующим перемешиванием при температуре 80°C в течение 2,5 часов. Реакционный раствор переносили в разделительную воронку и оставляли до разделения его на два слоя. Верхний слой собирали и концентрировали при пониженном давлении, добавляли 60 мл метанола и затем полученное твердое вещество отфильтровывали и высушивали, с получением 1 г триметилсилилированного курдлана (5) в виде белого твердого вещества. Таким же образом триметилсилилированный курдлан (6) синтезировали из гидролизата курдлана (5) и триметилсилилированный курдлан (7) синтезировали из гидролизата курдлана (6).
Протекание реакции триметилсилилирования подтверждали путем измерений методом 1H-ЯМР (фигура 7: триметилсилилированный курдлан (5)).
(3) Реакция модификации курдлана сополимером молочной-гликолевой кислот (синтез модифицированных курдланов (9)-(14))
0,2 г триметилсилилированного курдлана (5) и 14 мг трет-бутоксикалия (tBuOK) высушивали с нагреванием при пониженном давлении в течение 2 часов и добавляли 5 мл тетрагидрофурана, с последующим перемешиванием при комнатной температуре в течение 1,5 часов, с получением активированного раствора. Мономер (смесь (DL)-лактида и гликолида с молярным соотношением 1:1) в 35-кратном молярном избытке по отношению к tBuOK, используемому для получения активированного раствора, растворяли в тетрагидрофуране, с получением раствора мономера. Раствор мономера добавляли по каплям к активированному раствору, с последующим перемешиванием в течение 30 минут, а затем добавляли 0,2 мл уксусной кислоты для остановки реакции. После завершения реакции раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-метанол (плохой растворитель) и системы хлороформ (хороший растворитель)-циклогексан (плохой растворитель), с получением белого твердого вещества. Полученное белое твердое вещество растворяли в 5 мл хлороформа и добавляли 0,4 мл трифторуксусной кислоты, с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-диэтиловый эфир (плохой растворитель), с получением модифицированного курдлана (9) в виде белого твердого вещества.
Таким же образом модифицированный курдлан (10) синтезировали путем проведения реакции триметилсилилированного курдлана (5) с мономером в 50-кратном молярном избытке по отношению к tBuOK, модифицированный курдлан (11) синтезировали путем проведения реакции триметилсилилированного курдлана (6) с мономером в 35-кратном молярном избытке по отношению к tBuOK, модифицированный курдлан (12) синтезировали путем проведения реакции триметилсилилированного курдлана (6) с мономером в 50-кратном молярном избытке по отношению к tBuOK, модифицированный курдлан (13) синтезировали путем проведения реакции триметилсилилированного курдлана (7) с мономером в 35-кратном молярном избытке по отношению к tBuOK и модифицированный курдлан (14) синтезировали путем проведения реакции триметилсилилированного курдлана (7) с мономером в 50-кратном молярном избытке по отношению к tBuOK.
Результаты оценки модифицированных курдланов (9)-(14) приведены в таблице 2. Среднечисленную молекулярную массу модифицированного курдлана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel α-5000×2, растворитель ДМФ; детектор RI; эталонный образец пуллулан) (фигура 6: модифицированный курдлан (9)). Долевое содержание (по массе) сегментов курдлана в модифицированном курдлане определяли из среднечисленной молекулярной массы курдлана, используемого для синтеза, и среднечисленной молекулярной массы модифицированного курдлана. Среднечисленную молекулярную массу каждой привитой цепи определяли методом 1H-ЯМР (фигура 8: модифицированный курдлан (9)). Среднее число привитых цепей определяли путем деления значения, полученного при вычитании среднечисленной молекулярной массы курдлана из среднечисленной молекулярной массы модифицированного курдлана, на среднечисленную молекулярную массу каждой привитой цепи.
Сравнительный пример 1: Синтез декстрана с модификацией сополимером молочной-гликолевой кислот (модифицированного декстрана (15))
Используя 5 г декстрана (среднечисленная молекулярная масса 4100, SERVA), получали 5,2 г триметилсилилированного декстрана (8) в виде белого твердого вещества, следуя методике примера 1 и примера 2, описанных выше. Затем таким же образом, как в примере 1 и примере 2, описанных выше, проводили реакцию 0,5 г триметилсилилированного декстрана (8) с трет-бутоксикалием (tBuOK) и мономером (смесь (DL)-лактида и гликолида с молярным соотношением 1:1) в 35-кратном молярном избытке по отношению к tBuOK, с получением 0,9 г модифицированного декстрана (15) в виде белого твердого вещества.
Результаты оценки модифицированного декстрана (15) приведены в таблице 3. Каждую величину рассчитывали таким же образом, как в примере 1 и примере 2, описанных выше.
Пример 3: Получение частиц (частицы курдлана (1)-(5), частицы ламинарана (6) и (7), сравнительные частицы ПЛГ (PLGA) (8), сравнительные частицы декстрана (9)) методом с использованием эмульсии O/W
Получали раствор полимера, растворяя 10 мг модифицированных курдланов (9)-(13), приведенных в таблице 4, в 1 мл этилацетата. Раствор полимера добавляли по каплям к 4 мл 1% (масс/об) водного раствора поливинилового спирта, с последующим перемешиванием с помощью миксера (Polytron, PT2100S) при 11000 об/мин в течение 1 минуты, с получением эмульсионного раствора O/W. Затем этилацетат удаляли из эмульсионного раствора O/W методом выпаривания растворителя, и раствор использовали в качестве суспензии частиц. Суспензию переносили в 15-мл пробирку и центрифугировали при 8000 об/мин в течение 10 минут для осаждения частиц. После удаления супернатанта частицы ресуспендировали в 10 мл дистиллированной воды и затем частицы переосаждали центрифугированием в описанных выше условиях. Эту процедуру промывания повторяли еще раз, супернатант удаляли и затем частицы суспендировали в 1,8 мл водного раствора, содержащего 5% (масс/об) маннита и 0,1% (масс/об) полисорбата 80. Суспензию предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки (Tokyo Rikakikai Co., Ltd., FD-1000), с получением частиц курдлана (1)-(5).
Таким же образом получали частицы ламинарана (6) и (7) с модифицированными ламинаранами (3) и (8) в качестве основного материала, соответственно.
В качестве сравнительного примера, таким же образом получали сравнительные частицы ПЛГ (8) с сополимером молочной-гликолевой кислот (ПЛГ, среднечисленная молекулярная масса 5000, Wako Pure Chemical Industries, Ltd.) в качестве основного материала и сравнительные частицы декстрана (9) с модифицированным декстраном (15) в качестве основного материала.
Средний размер частиц у полученных частиц рассчитывали путем измерения распределения интенсивности рассеянного света и коэффициента диффузии с использованием прибора для измерения динамического рассеяния света (Otsuka Electronics Co., Ltd., ELS-Z) и путем анализа кумулянтным методом. Результаты приведены в таблице 4.
Пример 4: Получение частиц (частицы курдлана, содержащие ОВА (10), частицы курдлана (11), частицы ламинарана, содержащие ОВА (12)-(14), сравнительные частицы декстрана, содержащие ОВА (15)) методом с использованием эмульсии S/O/W
Получали раствор полимера, растворяя 100 мг модифицированного курдлана (13) в 1,8 мл диметилкарбоната и 200 мкл трет-бутанола. К раствору полимера по каплям добавляли 1 мл 0,1% (масс/об) водного раствора ОВА (овальбумин, Sigma-Aldrich Co. LLC.), с последующим перемешиванием с помощью миксера (Polytron, PT2100S) при 11000 об/мин в течение 1 минуты, с получением эмульсионного раствора W/O. Эмульсионный раствор W/O предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки (Tokyo Rikakikai Co., Ltd., FD-1000). Полученное твердое вещество диспергировали в 10 мл этилацетата, с получением суспензионного раствора S/O. Суспензионный раствор S/O добавляли по каплям к 40 мл 1% (масс/об) водного раствора поливинилового спирта, с последующим перемешиванием с помощью миксера (Silverson Nippon Ltd, L5M-A) при 6000 об/мин в течение 5 минут, с получением эмульсионного раствора S/O/W. Этилацетат удаляли из эмульсионного раствора S/O/W методом выпаривания растворителя, и раствор использовали в качестве суспензии частиц. Суспензию переносили в 50-мл пробирку и центрифугировали при 8000 об/мин в течение 10 минут для осаждения частиц. После удаления супернатанта частицы ресуспендировали в 50 мл дистиллированной воды и затем частицы переосаждали центрифугированием в описанных выше условиях. Эту процедуру промывания повторяли еще раз, супернатант удаляли и затем частицы суспендировали в 8 мл водного раствора, содержащего 5% (масс/об) маннита и 0,1% (масс/об) полисорбата 80. Суспензию предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки, с получением частиц курдлана, содержащих ОВА (10).
Используя дистиллированную воду вместо раствора ОВА, аналогичным образом получали частицы курдлана, не содержащие ОВА (11). Используя модифицированные ламинараны (1), (3) и (5), аналогичным образом получали частицы ламинарана, содержащие ОВА (12)-(14).
В качестве сравнительного примера, используя модифицированный декстран (15) в качестве основного материала, аналогичным образом получали сравнительные частицы декстрана, содержащие ОВА (15).
Результаты оценки частиц приведены в таблице 5. Средний размер частиц у полученных частиц рассчитывали кумулянтным методом с использованием прибора для измерения динамического рассеяния света (Otsuka Electronics Co., Ltd., ELS-Z). Степень инкапсуляции (по массе) антигена определяли путем экстрагирования антигена из частиц с помощью органического растворителя, проведения электрофореза в геле для экстрагированного антигена на приборе для электрофореза в геле (TEFCO) и последующего окрашивания антигена с использованием набора для окрашивания коллоидным раствором Кумасси ярко-синего (TEFCO).
Справочный пример 1: Индукция дендритных клеток костного мозга (ДККМ) мышей
Самцов мышей C57BL/6 в возрасте 8 недель подвергали эвтаназии двуокисью углерода и извлекали бедренные кости. Оба конца бедренной кости отрезали ножницами, среду RPMI 1640 (далее в настоящем документе называемую средой RPMI), содержащую 10% ЭБС (Sigma-Aldrich Co. LLC.), 100 МЕ/мл пенициллина (Life Technologies, Inc.) и 100 МЕ/мл стрептомицина (Life Technologies, Inc.), вводили инжектором внутрь берцовой кости и собирали раствор костного мозга. Раствор костного мозга центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, и супернатант удаляли. Собранные клетки суспендировали в 1 мл буфера для гемолиза (1,66% [масс/об] водный раствор хлорида аммония) и оставляли при температуре 4°C на 4 минуты для гемолиза клеток. После гемолиза к клеточной суспензии добавляли 10 мл среды RPMI, раствор центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, и супернатант удаляли. Клетки суспендировали в среде RPMI 1640 (далее в настоящем документе называемой культуральной средой), содержащей 10% ЭБС (Sigma-Aldrich Co. LLC.), 10 нг/мл GM-CSF, 100 МЕ/мл пенициллина (Life Technologies, Inc.) и 100 МЕ/мл стрептомицина (Life Technologies, Inc.), и затем высевали в 6-луночный планшет (IWAKI & Co., Ltd., плоскодонный, из полистирола, обработанный для культивирования тканей). Планшет с клетками инкубировали в течение 3 часов в CO2-инкубаторе (NAPCO) в условиях 5% CO2, 37°C и 100% влажности, и клетки энергично суспендировали при помощи микропипетки, чтобы собирать только клетки, не прикрепившиеся к планшету. Собранные клетки ресуспендировали в культуральной среде, затем высевали в 6-луночный планшет и инкубировали в CO2-инкубаторе. Культуральную среду заменяли в дни 2 и 4 культивирования, и клетки энергично суспендировали при помощи микропипетки в день 5 культивирования, чтобы собирать только клетки, не прикрепившиеся к планшету, а именно, индуцированные дендритные клетки.
Пример 5: Тест на in vitro стимуляцию дендритных клеток костного мозга (ДККМ) мышей для модифицированного β-глюкана
Методы
Взвешивали 10 мг модифицированного β-глюкана, полученного в примере 2 (модифицированные курдланы (9)-(12)), модифицированный β-глюкан растворяли в 10 мл ацетонитрила, с получением раствора полимера. 100 мкл раствора полимера (100 мкг полимера) вносили в лунки 6-луночного планшета и высушивали, получая покрытый полимером планшет. На покрытый полимером планшет высевали дендритные клетки, полученные в ссылочном примере 1, с культуральной средой таким образом, чтобы число клеток составляло 1×106 на лунку. Планшет с клетками инкубировали в течение 2 дней в CO2-инкубаторе, а затем клетки энергично суспендировали при помощи микропипетки, чтобы собирать только клетки, не прикрепившиеся к планшету. Собранные клетки центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, супернатант удаляли и клетки суспендировали в 100 мкл среды RPMI. К суспензии клеток добавляли FITC-меченые анти-CD86 антитела и PE-меченые анти-CD11c антитела, и суспензию оставляли при температуре 4°C на 15 минут для проведения реакции мечения антителом. После завершения реакции мечения антителом оценивали уровень экспрессии маркера активации (CD86) на основании средней интенсивности флуоресценции (СИФ) методом проточной цитометрии.
В качестве сравнительного примера использовали планшеты, аналогичным образом покрытые модифицированным декстраном (15), полученным в сравнительном примере 1, триметилсилилированным курдланом (1), полученным в примере 1, или сополимером молочной-гликолевой кислот (ПЛГ, Wako Pure Chemical Industries, Ltd., PLGA-5020), и аналогичным образом оценивали уровень экспрессии маркера активации для сравнения. В качестве другого сравнительного примера, 100 мкг гидролизата курдлана (1), полученного в примере 1, или 100 мкг поли I:C (Sigma-Aldrich Co. LLC.) с известной иммуностимулирующей активностью добавляли к культуральной среде и аналогичным образом оценивали уровень экспрессии маркера активации для сравнения.
Результаты
Данные по средней интенсивности флуоресценции (СИФ), показателю уровня экспрессии CD86, представлены на фигуре 9. CD86 является одним из маркеров активации дендритных клеток. При использовании модифицированных курдланов (9)-(12) уровень экспрессии CD86 был выше, чем уровень в случае использования модифицированного декстрана (15) и сополимера молочной-гликолевой кислот, свидетельствуя о том, что модифицированный β-глюкан обладает сильной способностью к активации дендритных клеток. При использовании гидролизата курдлана (1) и триметилсилилированного курдлана (1) уровень экспрессии CD86 был ниже, чем уровень в случае использования модифицированного β-глюкана, это указывало на то, что модификация поли(гидроксикислотой) β-глюкана важна для активации дендритных клеток.
Пример 6: Тест 1 на in vitro стимуляцию дендритных клеток костного мозга (ДККМ) мышей для частиц с модифицированным β-глюканом в качестве основного материала
Методы
Дендритные клетки, полученные в справочном примере 1, высевали с культуральной средой в 6-луночный планшет таким образом, чтобы число клеток составляло 1×106 на лунку, и затем добавляли 0,2 мг частиц, полученных в примере 3 (частицы курдлана (1)-(5), сравнительные частицы ПЛГ (8), сравнительные частицы декстрана (9)). Планшет с клетками инкубировали в течение 2 дней в CO2-инкубаторе, а затем клетки энергично суспендировали при помощи микропипетки, чтобы собирать только клетки, не прикрепившиеся к планшету. Собранные клетки центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, супернатант удаляли и клетки суспендировали в 100 мкл среды RPMI. К суспензии клеток добавляли FITC-меченые анти-CD86 антитела и PE-меченые анти-CD11c антитела, и суспензию оставляли при температуре 4°C на 15 минут для проведения реакции мечения антителом. После завершения реакции мечения антителом оценивали уровень экспрессии маркера активации (CD86) на основании средней интенсивности флуоресценции (СИФ) методом проточной цитометрии.
В качестве сравнительного примера, 100 мкг поли I:C (Sigma-Aldrich Co. LLC.) добавляли к культуральной среде и аналогичным образом оценивали уровень экспрессии маркера активации для сравнения.
Результаты
Данные по средней интенсивности флуоресценции (СИФ), показателю уровня экспрессии CD86, для каждого вида частиц представлены на фигуре 10. При использовании частиц (частицы курдлана (1)-(5), сравнительные частицы ПЛГ (8), сравнительные частицы декстрана (9)), уровень экспрессии CD86 был выше, чем уровень в случае, когда частицы не добавляли, это указывало на то, что частицы обладают способностью к активации дендритных клеток. Более того, при использовании частиц с модифицированным курдланом в качестве основного материала (частицы курдлана (1)-(5)), оказалось, что они имеют более сильную способность к активации дендритных клеток, чем частицы с модифицированным декстраном в качестве основного материала (сравнительные частицы декстрана (9)) или частицы с ПЛГ в качестве основного материала (сравнительные частицы ПЛГ (8)). Было установлено, что частицы с модифицированным β-глюканом в качестве основного материала обладают сильной иммуностимулирующей активностью.
Пример 7: Тест 2 на in vitro стимуляцию дендритных клеток костного мозга (ДККМ) мышей для частиц с модифицированным β-глюканом в качестве основного материала
Методы
Следуя методике примера 6, 0,2 мг частиц, полученных в примере 3 (частицы ламинарана (6) и (7), сравнительные частицы ПЛГ (8), сравнительные частицы декстрана (9)), добавляли в планшет, в котором были высеяны дендритные клетки, полученные в ссылочном примере 1, и уровень экспрессии маркера активации (CD86) оценивали на основании средней интенсивности флуоресценции (СИФ).
В качестве сравнительного примера, 100 мкг поли I:C (Sigma-Aldrich Co. LLC.) добавляли к культуральной среде и аналогичным образом оценивали уровень экспрессии маркера активации для сравнения.
Результаты
Данные по средней интенсивности флуоресценции (СИФ), показателю уровня экспрессии CD86, для каждого вида частиц представлены на фигуре 11. При использовании частиц с модифицированным ламинараном в качестве основного материала (частицы ламинарана (6) и (7)) было установлено, что они имеют более сильную способность к активации дендритных клеток, чем частицы с модифицированным декстраном в качестве основного материала (сравнительные частицы декстрана (9)) или частицы с ПЛГ в качестве основного материала (сравнительные частицы ПЛГ (8)). Иными словами, было установлено, что частицы с модифицированным ламинараном в качестве основного материала обладают сильной способностью к активации дендритных клеток, аналогично частицам с модифицированным курдланом в качестве основного материала в примере 6.
Пример 8: In vivo тест 1 на мышах для модифицированного β-глюкана (оценка по IFN-γ-продуцирующей способности)
Методы
В эксперименте использовали самцов мышей C57BL/6NCR в возрасте 5 недель, приобретенных у компании Japan SLC, Inc. Мышей содержали в условиях свободного кормления с 12-часовым циклом день/ночь в собственном помещении для содержания животных компании в течение 1 недели и акклиматизировали к местным условиям.
Введение мышам выполняли в соответствии со схемами, приведенными в таблице 6. В случае схем (1) и (2) и сравнительной схемы (3) частицы, полученные в примере 4 (частицы курдлана, содержащие ОВА (10), сравнительные частицы декстрана, содержащие ОВА (15)), диспергировали в 50 мкл 4% (масс/об) водного раствора маннита, и раствор вводили в подушечки обеих задних лап с использованием инъекционной иглы 29 G (Terumo Myjector). В случае сравнительной схемы (4) аналогичным образом вводили ОВА (Sigma-Aldrich Co. LLC.) и поли I:C (Sigma-Aldrich Co. LLC.). В случае сравнительной схемы (5) аналогичным образом вводили раствор, не содержащий антигены.
В случае схемы (2) и сравнительных схем (3) и (4) второе введение выполняли аналогичным образом через 3 дня после первого введения, и третье введение выполняли аналогичным образом через 6 дней после первого введения.
Мышей после введения содержали в условиях свободного кормления с доступом к источнику воды и подвергали эвтаназии двуокисью углерода через 2 недели после первого введения. Подколенные лимфатические узлы вблизи от места введения асептически удаляли, содержащиеся в них клетки диспергировали, а затем фильтровали через 200-мкм фильтр (AS ONE Corporation, FILCONS, 120-22S) для удаления детрита. Собранные клетки суспендировали в среде RPMI 1640 (далее в настоящем документе называемой средой RPMI), содержащей 10% ЭБС (Sigma-Aldrich Co. LLC.), 100 МЕ/мл пенициллина (Life Technologies, Inc.) и 100 МЕ/мл стрептомицина (Life Technologies, Inc.), высаживали на 96-луночный планшет (IWAKI & Co., Ltd., плоскодонный, из полистирола, для культивирования тканей) так, чтобы число клеток составляло 5×105 на лунку, и затем добавляли среду RPMI, содержащую 10 мкг ОВА и 0,75 мкг 2-меркаптоэтанола, для стимуляции клеток. Планшет с клетками инкубировали в CO2-инкубаторе в течение 48 часов, культуральный супернатант собирали, и концентрацию IFN-γ, продуцируемого каждой группой клеток, измеряли методом ELISA (Mabtech AB, Mouse IFN-gamma ELISA kit [HRP]).
Результаты
Количество IFN-γ, продуцируемого клетками лимфатических узлов, представлено на фигуре 12. IFN-γ является показателем активации клеточно-опосредованного иммунитета. В схемах с введением частиц, содержащих ОВА (схемы (1) и (2) и сравнительная схема (3)), было обнаружено более сильное продуцирование IFN-γ, чем в схеме без введения антигена (сравнительная схема (5)) и схеме с введением ОВА и поли I:C (сравнительная схема (4)), это свидетельствовало о том, что частицы, содержащие антиген, эффективны для активации антиген-специфического иммунитета. В схемах с введением частиц с модифицированным курдланом в качестве основного материала (схемы (1) и (2)) было обнаружено более сильное продуцирование IFN-γ, чем в схеме введения частиц с модифицированным декстраном в качестве основного материала (сравнительная схема (3)). Иными словами, установлено, что частицы с модифицированным β-глюканом в качестве основного материала, содержащие антиген, усиливают антиген-специфический иммунитет. В схеме с 3-кратным введением частиц (схема (2)) наблюдали более сильное продуцирование IFN-γ, чем в схеме с однократным введением частиц (схема (1)), это указывало на то, что многократное введение также эффективно для дополнительного усиления иммунитета.
Пример 9: In vivo тест 2 на мышах для модифицированного β-глюкана (оценка по IFN-γ-продуцирующей способности)
Методы
Введение выполняли в соответствии со схемами, приведенными в таблице 7, мышам, содержащимся в таких же условиях, как в примере 8. В схемах (6)-(8) и сравнительной схеме (9) частицы, полученные в примере 4 (частицы ламинарана, содержащие ОВА (12)-(14), сравнительные частицы декстрана, содержащие ОВА (15)), диспергировали в 100 мкл 4% (масс/об) водного раствора маннита, и раствор вводили в подушечки обеих задних лап с использованием инъекционной иглы 29 G (Terumo Myjector). В сравнительной схеме (10) аналогичным образом вводили ОВА (Sigma-Aldrich Co. LLC.) и поли I:C (Sigma-Aldrich Co. LLC.). В сравнительной схеме (11) аналогичным образом вводили ОВА (Sigma-Aldrich Co. LLC.). В сравнительной схеме (12) аналогичным образом вводили раствор, не содержащий антигены.
Мышей после введения содержали в условиях свободного кормления с доступом к источнику воды и подвергали эвтаназии двуокисью углерода через 2 недели после первого введения. Так же, как в примере 8, клетки, содержащиеся в лимфатических узлах, извлекали и измеряли количество IFN-γ, продуцируемое после стимуляции ОВА.
Результаты
Количество IFN-γ, продуцируемое клетками лимфатических узлов, представлено на фигуре 13. В схеме с введением частиц ламинарана, содержащих ОВА (схемы (6)-(8)), наблюдали более сильное продуцирование IFN-γ, чем в случае схемы с введением сравнительных частиц декстрана, содержащих ОВА (сравнительная схема (9)) и схемы с введением ОВА и поли I:C (сравнительная схема (10]). Установлено, что, подобно частицам с модифицированным курдланом в качестве основного материала, содержащим антиген, в примере 8, частицы с модифицированным ламинараном в качестве основного материала, содержащие антиген, усиливают антиген-специфический иммунитет.
Пример 10: In vivo тест 3 на мышах для модифицированного β-глюкана (противоопухолевые эффекты)
Методы
Используя ОВА-экспрессирующие мышиные клетки раковой опухоли E.G7-ОВА (ATCC) в качестве опухолеобразующих клеток, доводили их до состояния логарифмической фазы роста и культивировали в течение 1 недели в среде RPMI. Затем клетки промывали 3 раза стерилизованным PBS, подготавливая клетки к трансплантации.
Используемых в качестве животных-хозяев самцов мышей C57BL/6NCR в возрасте 5 недель, приобретенных у компании Japan SLC, Inc., содержали в условиях свободного кормления с 12-часовым циклом день/ночь в собственном помещении для содержания животных компании и акклиматизировали к местным условиям. Затем им вводили подкожно в живот 100 мкл PBS, содержащего 2×10⁶ клеток E.G7-ОВА, используя инъекционную иглу 25 G, чтобы вызвать образование опухоли.
В дни 0, 3, 7, 10 и 15 после развития опухоли выполняли введение мышам в соответствии со схемами, приведенными в таблице 8. В схемах (13) и (14) частицы, полученные в примере 4 (частицы курдлана, содержащие ОВА (10), частицы курдлана (11)), диспергировали в 100 мкл 4% (масс/об) водного раствора маннита, и раствор вводили вблизи участка образования опухоли, используя инъекционную иглу 25 G (Terumo Myjector). В сравнительной схеме (15) аналогичным образом вводили ОВА (Sigma-Aldrich Co. LLC.) и поли I:C (Sigma-Aldrich Co. LLC.). В сравнительной схеме (16) аналогичным образом вводили раствор, не содержащий ни антигены, ни частицы.
Мышей после введения содержали в условиях свободного кормления с доступом к источнику воды и измеряли объем опухолевой ткани.
Результаты
Средний объем опухолевой ткани после развития опухоли у 5 мышей из каждой группы введения представлен на фигуре 14. В схеме с введением частиц, не содержащих антигены (схема (14)), рост объема опухоли был более подавлен, чем в случае схемы без введения антигенов и введения частиц (сравнительная схема (16)), это свидетельствовало о том, что частицы с модифицированным β-глюканом в качестве основного материала имеют противоопухолевые эффекты. В схеме с введением частиц, содержащих антиген (13), рост объема опухоли был более подавлен, чем в случае схемы с введением частиц, не содержащих антигены (схема (14)), и схемы с введением ОВА и поли I:C (сравнительная схема (15)), это свидетельствовало о том, что частицы с модифицированным β-глюканом в качестве основного материала, содержащие антиген, имеют более сильные противоопухолевые эффекты.
Пример 11: Синтез β-глюкана с модификацией сополимером молочной-гликолевой кислот (модифицированный пачиман (16), модифицированный сизофиран (17), модифицированный глюкан Aureobasidium pullulans (18), модифицированный склероглюкан (19), модифицированные курдланы (20) и (21))
(1) Реакция гидролиза β-глюкана (синтез гидролизата пачимана (7), гидролизата сизофирана (8), гидролизата глюкана Aureobasidium pullulans (9), гидролизата склероглюкана (10), гидролизатов курдлана (11) и (12))
320 мг пачимана (Bio Supply) растворяли в 27 мл диметилсульфоксида, добавляли 1,2 мл 1 Н раствора соляной кислоты, с последующим перемешиванием при температуре 110°C в течение 0,5 часа. Реакционный раствор переносили в диализную мембрану и диализовали в воде, затем лиофилизировали, с получением гидролизата пачимана (7) (среднечисленная молекулярная масса 1900) в виде порошка.
В таких же условиях гидролизат сизофирана (8) (среднечисленная молекулярная масса 4400) получали путем реакции сизофирана (InvivoGen) в течение 1,3 часа, гидролизат глюкана Aureobasidium pullulans (9) (среднечисленная молекулярная масса 2700) получали путем реакции глюкана Aureobasidium pullulans (DAISO Co., Ltd.) в течение 0,15 часа, гидролизат склероглюкана (10) (среднечисленная молекулярная масса 3000) получали путем реакции склероглюкана (Ethycythyl) в течение 1,15 часа и гидролизат курдлана (11) (среднечисленная молекулярная масса 18700) и гидролизат курдлана (12) (среднечисленная молекулярная масса 1900) получали путем реакции курдлана (Wako Pure Chemical Industries, Ltd.) в течение 0,1 часа и 0,75 часа, соответственно.
Среднечисленную молекулярную массу β-глюкана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel G3000PWXL-CP×2, растворитель уксуснокислый буфер [10 мМ, pH=5]; детектор RI; эталонный образец пуллулан).
(2) Реакция триметилсилилирования (TMS) β-глюкана (синтез триметилсилилированного пачимана (9), триметилсилилированного сизофирана (10), триметилсилилированного глюкана Aureobasidium pullulans (11), триметилсилилированного склероглюкана (12), триметилсилилированного курдлана (13) и (14))
180 мг гидролизата пачимана (7) добавляли к 25 мл диметилсульфоксида, раствор нагревали до температуры 80°C. В этот раствор добавляли по каплям в течение 20 минут 20 мл 1,1,1,3,3,3-гексаметилдисилазана, с последующим перемешиванием при температуре 80°C в течение 16 часов. Реакционный раствор переносили в разделительную воронку и оставляли до разделения его на два слоя. Верхний слой собирали и концентрировали при пониженном давлении, добавляли 5 мл метанола и затем полученное твердое вещество отфильтровывали и высушивали, с получением 250 мг триметилсилилированного пачимана (9) в виде белого твердого вещества.
Таким же образом триметилсилилированный сизофиран (10) синтезировали из гидролизата сизофирана (8), триметилсилилированный глюкан Aureobasidium pullulans (11) синтезировали из гидролизата глюкана Aureobasidium pullulans (9), триметилсилилированный склероглюкан (12) синтезировали из гидролизата склероглюкана (10), триметилсилилированный курдлан (13) синтезировали из гидролизата курдлана (11) и триметилсилилированный курдлан (14) синтезировали из гидролизата курдлана (12).
Протекание реакции триметилсилилирования подтверждали путем измерений методом 1H-ЯМР.
(3) Реакция модификации β-глюкана сополимером молочной-гликолевой кислот (синтез модифицированного пачимана (16), модифицированного сизофирана (17), модифицированного глюкана Aureobasidium pullulans (18), модифицированного склероглюкана (19), модифицированногой курдлана (20) и (21))
230 мг триметилсилилированного пачимана (9) и 22 мг трет-бутоксикалия (tBuOK) высушивали с нагреванием при пониженном давлении в течение 2 часов и добавляли 10 мл тетрагидрофурана, с последующим перемешиванием при комнатной температуре в течение 1,5 часов, с получением активированного раствора. Мономер (смесь (DL)-лактида и гликолида с молярным соотношением 1:1) в 35-кратном молярном избытке по отношению к tBuOK, используемому для получения активированного раствора, растворяли в тетрагидрофуране, с получением раствора мономера. Раствор мономера добавляли по каплям к активированному раствору, с последующим перемешиванием в течение 30 минут, а затем добавляли 0,2 мл уксусной кислоты для остановки реакции. После завершения реакции раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-метанол (плохой растворитель) и системы хлороформ (хороший растворитель)-циклогексан (плохой растворитель), с получением белого твердого вещества. Полученное белое твердое вещество растворяли в 9 мл хлороформа и добавляли 1 мл трифторуксусной кислоты, с последующим перемешиванием при комнатной температуре в течение 30 минут. Реакционный раствор концентрировали при пониженном давлении, переосаждали и очищали с помощью системы хлороформ (хороший растворитель)-диэтиловый эфир (плохой растворитель), с получением 287 мг модифицированного пачимана (16) в виде белого твердого вещества.
Таким же образом модифицированный сизофиран (17) синтезировали из триметилсилилированного сизофирана (10), модифицированный глюкан Aureobasidium pullulans (18) синтезировали из триметилсилилированного глюкана Aureobasidium pullulans (11), модифицированный склероглюкан (19) синтезировали из триметилсилилированного склероглюкана (12), модифицированный курдлан (20) синтезировали из триметилсилилированного курдлана (13) и модифицированный курдлан (21) синтезировали из триметилсилилированного курдлана (14).
Результаты оценки модифицированного β-глюкана приведены в таблице 9. Среднечисленную молекулярную массу модифицированного β-глюкана определяли методом ГПХ (колонка, Tosoh Corporation TSK-gel α-5000×2, растворитель ДМФ; детектор RI; эталонный образец пуллулан). Долевое содержание (по массе) сегментов β-глюкана в модифицированном β-глюкане определяли из среднечисленной молекулярной массы β-глюкана, используемого для синтеза, и среднечисленной молекулярной массы модифицированного β-глюкана. Среднечисленную молекулярную массу каждой привитой цепи определяли методом 1H-ЯМР (фигура 15, модифицированный пачиман (16); фигура 16, модифицированный сизофиран (17); фигура 17, модифицированный глюкан Aureobasidium pullulans (18); фигура 18, модифицированный склероглюкан (19)). Среднее число привитых цепей определяли путем деления значения, полученного при вычитании среднечисленной молекулярной массы β-глюкана из среднечисленной молекулярной массы модифицированного β-глюкана, на среднечисленную молекулярную массу каждой привитой цепи.
Пример 12: Синтез пачимарана с модификацией сополимером молочной-гликолевой кислот (модифицированный пачимаран (22))
(1) Реакция окислительного расщепления пачимана (синтез пачимарана)
1 г пачимана (Bio Supply) смешивали с 120 мл воды и добавляли 40 мл 0,1 М раствора периодата натрия, с последующим перемешиванием при комнатной температуре в течение 40 часов, и затем реагент собирали центрифугированием. Реагент смешивали с 54 мл воды, добавляли 27 мл раствора, содержащего 216 мг борогидрида натрия, с последующим перемешиванием при комнатной температуре в течение 28 часов, и затем реагент собирали центрифугированием. Реагент смешивали с 70 мл 0,05 М раствора серной кислоты, раствор перемешивали при комнатной температуре в течение 24 часов и затем собирали 0,91 г пачимарана.
(2) Реакция гидролиза пачимарана (синтез гидролизата пачимарана (13))
Гидролиз проводили таким же образом, как в приведенном выше примере 11, и используя 360 мг пачимарана, получали 229 мг гидролизата пачимарана (13) (среднечисленная молекулярная масса 2100) в виде порошка.
(3) Реакция триметилсилилирования (TMS) пачимарана (синтез триметилсилилированного пачимарана (15))
Триметилсилилирование проводили таким же образом, как в примере 11, приведенном выше, и используя 200 мг гидролизата пачимарана (13), получали 325 мг триметилсилилированного пачимарана (15) в виде белого твердого вещества.
(4) Реакция модификации пачимарана сополимером молочной-гликолевой кислот (синтез модифицированного пачимарана (22))
Таким же образом, как в приведенном выше примере 11, проводили реакцию 300 мг триметилсилилированного пачимарана (15) с трет-бутоксикалием (tBuOK) и мономером (смесь (DL)-лактида и гликолида с молярным соотношением 1:1) в 35-кратном молярном избытке по отношению к tBuOK, с получением 353 мг модифицированного пачимарана (22) в виде белого твердого вещества.
Результаты оценки модифицированного пачимарана (22) приведены в таблице 10. Каждую величину определяли методом ГПХ и методом 1H-ЯМР таким же образом, как в примере 11, приведенном выше (фигура 19: измерение методом 1H-ЯМР модифицированного пачимарана (22)).
Пример 13: Получение частиц 2 (частицы пачимана (16), частицы сизофирана (17), частицы глюкана Aureobasidium pullulans (18), частицы склероглюкана (19), частицы курдлана (20), частицы пачимарана (21), сравнительные частицы декстрана (22)) методом с использованием эмульсии O/W
Получали раствор полимера, растворяя 10 мг модифицированного пачимана (16) в 1 мл этилацетата. Раствор полимера добавляли по каплям к 4 мл 1% (масс/об) водного раствора поливинилового спирта, с последующим перемешиванием с помощью миксера (Polytron, PT2100S) при 11000 об/мин в течение 5 минут, с получением эмульсионного раствора O/W. Этилацетат удаляли из эмульсионного раствора O/W методом выпаривания растворителя, и раствор использовали в качестве суспензии частиц. Суспензию переносили в 15-мл пробирку и центрифугировали при 8000 об/мин в течение 10 минут для осаждения частиц. После удаления супернатанта частицы ресуспендировали в 10 мл дистиллированной воды и затем частицы переосаждали центрифугированием в описанных выше условиях. Эту процедуру промывания повторяли еще раз, супернатант удаляли и затем частицы суспендировали в 1,8 мл водного раствора, содержащего 5% (масс/об) маннита и 0,1% (масс/об) полисорбата 80. Суспензию предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки (Tokyo Rikakikai Co., Ltd., FD-1000), с получением частиц пачимана (16).
Таким же образом получали частицы сизофирана (17) с модифицированным сизофираном (17) в качестве основного материала, частицы глюкана Aureobasidium pullulans (18) с модифицированным глюканом Aureobasidium pullulans (18) в качестве основного материала, частицы склероглюкана (19) с модифицированным склероглюканом (19) в качестве основного материала, частицы курдлана (20) с модифицированным курдланом (20) в качестве основного материала и частицы пачимарана (21) с модифицированным пачимараном (22) в качестве основного материала.
В качестве сравнительного примера, таким же образом получали сравнительные частицы декстрана (22) с модифицированным декстраном (15) в качестве основного материала.
Результаты расчета для частиц среднего размера частиц кумулянтным методом с использованием прибора для измерения динамического рассеяния света (Otsuka Electronics Co., Ltd., ELS-Z) приведены в таблице 11.
Пример 14: Получение частиц (частицы курдлана, содержащие ОВА (23) и (24), частицы склероглюкана, содержащие ОВА (25)) методом с использованием эмульсии S/O/W
Получали раствор полимера, растворяя 100 мг модифицированного курдлана (21) в 2,6 мл диметилкарбоната и 200 мкл трет-бутанола. К раствору полимера по каплям добавляли 1 мл 0,5% (масс/об) раствора ОВА (овальбумин, Sigma-Aldrich Co. LLC.), с последующим перемешиванием с помощью миксера (Polytron, PT2100S) при 11000 об/мин в течение 1 минуты, с получением эмульсионного раствора W/O. Эмульсионный раствор W/O предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки (Tokyo Rikakikai Co., Ltd., FD-1000). Полученное твердое вещество диспергировали в 10 мл этилацетата, с получением суспензионного раствора S/O. Суспензионный раствор S/O добавляли по каплям к 40 мл 1% (масс/об) водного раствора поливинилового спирта, с последующим перемешиванием с помощью миксера (Silverson Nippon Ltd, L5M-A) при 6000 об/мин в течение 5 минут, с получением эмульсионного раствора S/O/W. Этилацетат удаляли из эмульсионного раствора S/O/W методом выпаривания растворителя, и раствор использовали в качестве суспензии частиц. Суспензию переносили в 50-мл пробирку и центрифугировали при 8000 об/мин в течение 10 минут для осаждения частиц. После удаления супернатанта частицы ресуспендировали в 50 мл дистиллированной воды и затем частицы переосаждали центрифугированием в описанных выше условиях. Эту процедуру промывания повторяли еще раз, супернатант удаляли и затем частицы суспендировали в 8 мл водного раствора, содержащего 5% (масс/об) маннита и 0,1% (масс/об) полисорбата 80. Суспензию предварительно замораживали в жидком азоте и затем лиофилизировали при температуре охлаждения ловушки -45°C и в вакууме 20 Па в течение 12 часов с использованием прибора для сублимационной сушки, с получением частиц курдлана, содержащих ОВА (23).
Аналогичным образом, используя модифицированный курдлан (20), получали частицы курдлана, содержащие ОВА (24), и, используя модифицированный склероглюкан (19), получали частицы склероглюкана, содержащие ОВА (25).
Результаты оценки частиц приведены в таблице 12. Средний размер частиц у полученных частиц рассчитывали кумулянтным методом с использованием прибора для измерения динамического рассеяния света (Otsuka Electronics Co., Ltd., ELS-Z). Степень инкапсуляции (по массе) антигена определяли путем экстрагирования антигена из частиц с помощью органического растворителя, проведения электрофореза в геле для экстрагированного антигена на приборе для электрофореза в геле (TEFCO) и последующего окрашивания антигена с использованием набора для окрашивания коллоидным раствором Кумасси ярко-синего (TEFCO).
Пример 15: Тест 2 на in vitro стимуляцию дендритных клеток костного мозга (ДККМ) мышей для модифицированных β-глюканов (модифицированный пачиман (16), модифицированный сизофиран (17), модифицированный глюкан Aureobasidium pullulans (18), модифицированный пачимаран (22))
Методы
Взвешивали 10 мг модифицированных β-глюканов, полученных в примере 11 (модифицированный пачиман (16), модифицированный сизофиран (17), модифицированный глюкан Aureobasidium pullulans (18), модифицированный пачимаран (22)), растворяли их в 1 мл ацетонитрила, с получением раствора полимера. Раствор полимера (соответствующий 1 мг полимера) (100 мкл) вносили в лунки 12-луночного планшета и высушивали, получая покрытый полимером планшет. На покрытый полимером планшет высевали дендритные клетки, полученные в ссылочном примере 1, с культуральной средой таким образом, чтобы число клеток составляло 3×105 на лунку. Планшет с клетками инкубировали в течение 2 дней в CO2-инкубаторе, а затем клетки энергично суспендировали при помощи микропипетки, чтобы собирать только клетки, не прикрепившиеся к планшету. Собранные клетки центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, супернатант удаляли и клетки суспендировали в 100 мкл среды RPMI. К суспензии клеток добавляли FITC-меченые анти-CD86 антитела и PE-меченые анти-CD11c антитела, и суспензию оставляли при температуре 4°C на 15 минут для проведения реакции мечения антителом. После завершения реакции мечения антителом оценивали уровень экспрессии маркера активации (CD86) в дендритных клетках (CD11c-положительных клетках) на основании средней интенсивности флуоресценции (СИФ) методом проточной цитометрии.
В качестве сравнительного примера, используя планшет, аналогичным образом покрытый модифицированным декстраном (15), полученным в сравнительном примере 1, таким же образом определяли уровень экспрессии маркера активации для сравнения. В качестве другого сравнительного примера, 1 мг немодифицированных β-глюканов (гидролизат пачимана (7), гидролизат сизофирана (8), гидролизат глюкана Aureobasidium pullulans (9), гидролизат пачимарана (13)), полученных в примере 11, или 100 мкг поли I:C (Sigma-Aldrich Co. LLC.) с известной иммуностимулирующей активностью добавляли к культуральной среде и таким же образом определяли уровень экспрессии маркера активации для сравнения.
Результаты
Данные по средней интенсивности флуоресценции (СИФ), показателю уровня экспрессии CD86, маркера активации дендритных клеток, представлены на фигуре 20. При использовании модифицированного β-глюкана уровень экспрессии CD86 был выше, чем уровень в случае использования модифицированного декстрана (15), свидетельствуя о том, что модифицированный β-глюкан обладает сильной способностью к активации дендритных клеток. При использовании немодифицированного β-глюкана уровень экспрессии CD86 был ниже, чем уровень в случае использования модифицированного β-глюкана, это указывало на то, что модификация поли(гидроксикислотой) β-глюкана важна для иммуностимулирующей активности. Было обнаружено, что не только линейные модифицированные β-глюканы (пример 4, модифицированные курдланы (9)-(12); настоящий пример, модифицированный пачиман (16)), но также и разветвленные модифицированные β-глюканы (настоящий пример: модифицированный сизофиран (17), модифицированный глюкан Aureobasidium pullulans (18)) и дериватизированный модифицированный β-глюкан (настоящий пример: модифицированный пачимаран (22)) обладают иммуностимулирующей активностью.
Пример 16: Тест 2 на in vitro стимуляцию дендритных клеток костного мозга (ДККМ) мышей для частиц с модифицированным β-глюканом в качестве основного материала (частицы пачимана (16), частицы сизофирана (17), частицы глюкана Aureobasidium pullulans (18), частицы склероглюкана (19), частицы курдлана (20), частицы пачимарана (21))
Дендритные клетки, полученные в ссылочном примере 1, высевали в лунки 12-луночного планшета с культуральной средой таким образом, чтобы число клеток составляло 3×105 на лунку, и затем добавляли 0,05 мг частиц с модифицированным β-глюканом в качестве основного материала (частицы пачимана (16), частицы сизофирана (17), частицы глюкана Aureobasidium pullulans (18), частицы склероглюкана (19), частицы курдлана (20), частицы пачимарана (21)). Планшет с клетками инкубировали в течение 2 дней в CO2-инкубаторе, а затем клетки энергично суспендировали при помощи микропипетки, чтобы собирать только клетки, не прикрепившиеся к планшету. Собранные клетки центрифугировали при 1500 об/мин в течение 5 минут для осаждения клеток, супернатант удаляли и клетки суспендировали в 100 мкл среды RPMI. К суспензии клеток добавляли FITC-меченые анти-CD86 антитела и PE-меченые анти-CD11c антитела, и суспензию оставляли при температуре 4°C на 15 минут для проведения реакции мечения антителом. После завершения реакции мечения антителом оценивали уровень экспрессии маркера активации (CD86) в дендритных клетках (CD11c-положительных клетках) на основании средней интенсивности флуоресценции (СИФ) методом проточной цитометрии.
В качестве сравнительного примера, 0,05 мг частиц с декстраном в качестве основного материала (сравнительные частицы декстрана (22)) добавляли к культуральной среде и таким же образом определяли уровень экспрессии маркера активации для сравнения.
Результаты
Данные по средней интенсивности флуоресценции (СИФ), показателю уровня экспрессии CD86, для частиц каждого вида представлены на фигуре 21. При использовании частиц с модифицированным β-глюканом в качестве основного материала (частицы пачимана (16), частицы сизофирана (17), частицы глюкана Aureobasidium pullulans (18), частицы склероглюкана (19), частицы курдлана (20), частицы пачимарана (21)) уровень экспрессии CD86 был выше, чем в случае без добавления частиц и в случае использования частиц с модифицированным декстраном в качестве основного материала (сравнительные частицы декстрана (22)), это свидетельствовало о том, что частицы с модифицированным β-глюканом в качестве основного материала сильно активируют дендритные клетки.
Пример 17: In vivo тест 4 на мышах для модифицированного β-глюкана (оценка по IFN-γ-продуцирующей способности)
Методы
В эксперименте использовали самцов мышей C57BL/6NCR в возрасте 5 недель, приобретенных у компании Japan SLC, Inc. Мышей содержали в условиях свободного кормления с 12-часовым циклом день/ночь в собственном помещении для содержания животных компании в течение 1 недели и акклиматизировали к местным условиям.
Введение мышам выполняли в соответствии со схемами, приведенными в таблице 13. В случае схем (17)-(19) частицы, полученные в примере 14 (частицы курдлана, содержащие ОВА (23) и (24), частицы склероглюкана, содержащие ОВА (25)), диспергировали в 50 мкл 4% (масс/об) водного раствора маннита, и раствор вводили в подушечки обеих задних лап с использованием инъекционной иглы 29 G (Terumo Myjector). В случае сравнительной схемы (20) аналогичным образом вводили ОВА (Sigma-Aldrich Co. LLC.) и гидролизат курдлана (12).
Во всех схемах второе введение выполняли аналогичным образом через 3 дня после первого введения, третье введение выполняли аналогичным образом через 7 дней после первого введения и четвертое введение выполняли аналогичным образом через 10 дней после первого введения.
Мышей после введения содержали в условиях свободного кормления с доступом к источнику воды и подвергали эвтаназии двуокисью углерода через 16 дней после первого введения. Подколенные лимфатические узлы вблизи от места введения асептически удаляли, содержащиеся в них клетки диспергировали, а затем фильтровали через 200-мкм фильтр (AS ONE Corporation, FILCONS, 120-22S) для удаления детрита. Собранные клетки суспендировали в среде RPMI 1640 (далее в настоящем документе называемой средой RPMI), содержащей 10% ЭБС (Sigma-Aldrich Co. LLC.), 100 МЕ/мл пенициллина (Life Technologies, Inc.) и 100 МЕ/мл стрептомицина (Life Technologies, Inc.), высаживали на 96-луночный планшет (IWAKI & Co., Ltd., плоскодонный, из полистирола, для культивирования тканей) так, чтобы число клеток составляло 5×105 на лунку, и затем добавляли среду RPMI, содержащую 10 мкг ОВА и 0,75 мкг 2-меркаптоэтанола, для стимуляции клеток. Планшет с клетками инкубировали в CO2-инкубаторе в течение 48 часов, культуральный супернатант собирали, и концентрацию IFN-γ, продуцируемого каждой группой клеток, измеряли методом ELISA (Mabtech AB, Mouse IFN-gamma ELISA kit [HRP]).
Результаты
Количество IFN-γ, продуцируемого клетками лимфатических узлов, представлено на фигуре 22. IFN-γ является показателем активации клеточно-опосредованного иммунитета. В схеме с введением частиц, содержащих ОВА, с модифицированным курдланом в качестве основного материала (схема (17)) было обнаружено более сильное продуцирование IFN-γ, чем в схеме с введением ОВА и немодифицированного курдлана (сравнительная схема (20)), это свидетельствовало о том, что модифицированный β-глюкан in vivo также обладает более сильной иммуностимулирующей активностью, чем β-глюкан. В схеме с введением частиц, содержащих ОВА, с высокомолекулярным модифицированным курдланом в качестве основного материала (схема (18)) и схеме с введением частиц, содержащих ОВА, с разветвленным модифицированным склероглюканом в качестве основного материала (схема (19)) также было отмечено более сильное продуцирование IFN-γ, это указывало на то, что модифицированный β-глюкан обладает сильной иммуностимулирующей активностью независимо от молекулярной массы, а также от того, является ли он линейным или разветвленным.
ПРОМЫШЛЕННАЯ ПРИМЕНИМОСТЬ
Иммуностимулятор по настоящему изобретению можно применять в качестве лекарственного средства, в частности, в качестве иммуностимулятора в вакцине, предназначенной для лечения и/или предотвращения инфекции, рака и тому подобного.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ КОЛИЧЕСТВЕННОГО ОПРЕДЕЛЕНИЯ 1,3- β -ГЛЮКАНОВ | 1991 |
|
RU2017819C1 |
| ИММУНОГЕННАЯ КОМПОЗИЦИЯ | 2011 |
|
RU2593789C2 |
| ШТАММ ГРИБА AUREOBASIDIUM PULLULANS - ПРОДУЦЕНТ ЭКЗОПОЛИСАХАРИДА | 1989 |
|
SU1559718A1 |
| ШТАММ ГРИБА AUREOBASIDIUM PULLULANS - ПРОДУЦЕНТ ЭКЗОПОЛИСАХАРИДА | 1988 |
|
SU1559717A1 |
| КОМПОЗИЦИИ, СОДЕРЖАЩИЕ ГЛЮКАН | 2011 |
|
RU2596496C2 |
| КОМПЛЕКС, СОДЕРЖАЩИЙ ОЛИГОНУКЛЕОТИД, ОБЛАДАЮЩИЙ ИММУНОСТИМУЛИРУЮЩЕЙ АКТИВНОСТЬЮ, И ЕГО ПРИМЕНЕНИЕ | 2014 |
|
RU2723943C2 |
| ПРОЦЕСС ФЕРМЕНТАЦИИ АСКОМИЦЕТОВ | 2019 |
|
RU2754114C1 |
| ФЕРМЕНТ С АКТИВНОСТЬЮ ЭНДО-1,3(4)-β-ГЛЮКАНАЗЫ, КОДИРУЮЩАЯ ЕГО ДНК И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 1995 |
|
RU2215034C2 |
| СПОСОБ ПРОФИЛАКТИКИ ЗАБОЛЕВАНИЯ ИКРЫ И МОЛОДИ РЫБ САПРОЛЕГНИЕЙ | 1995 |
|
RU2081575C1 |
| МОЛЕКУЛА, СОДЕРЖАЩАЯ SPR0096 и SPR2021 | 2012 |
|
RU2636350C2 |
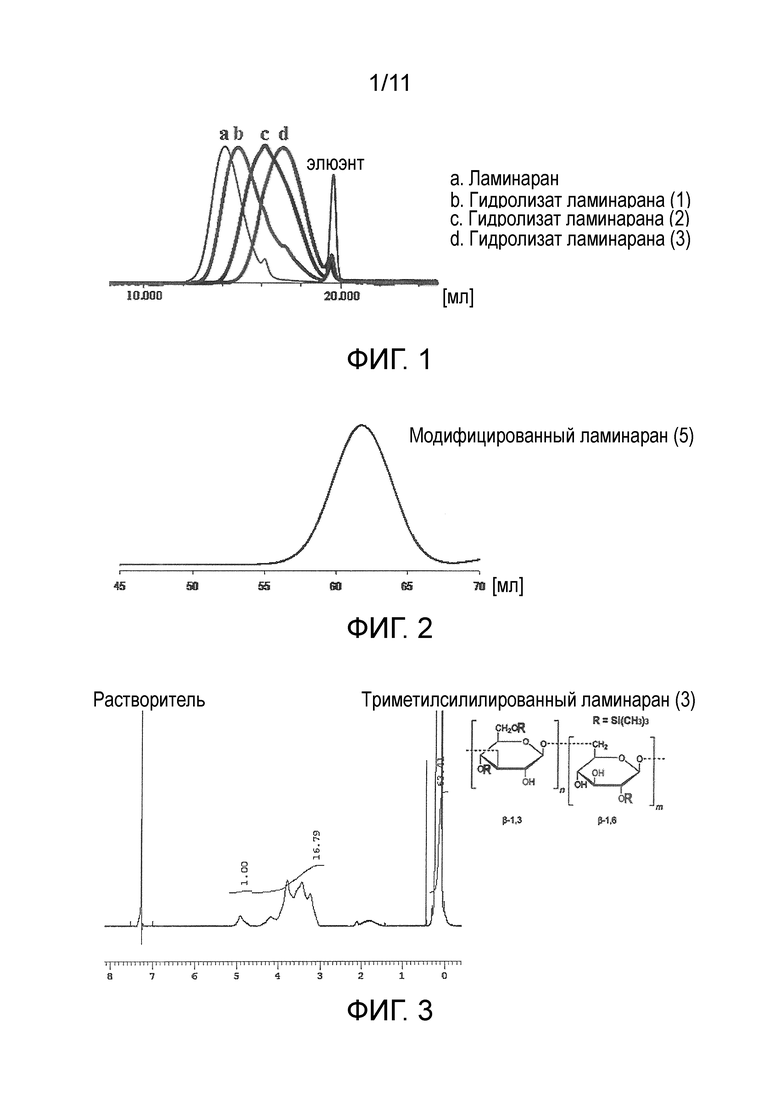
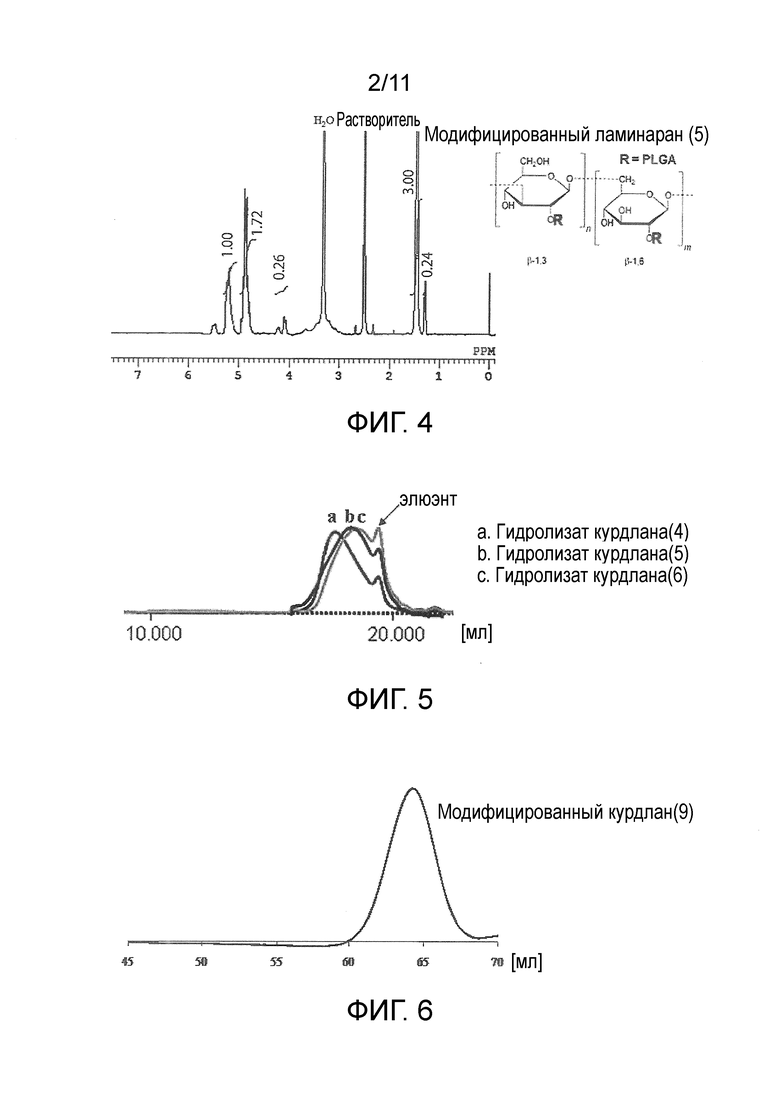
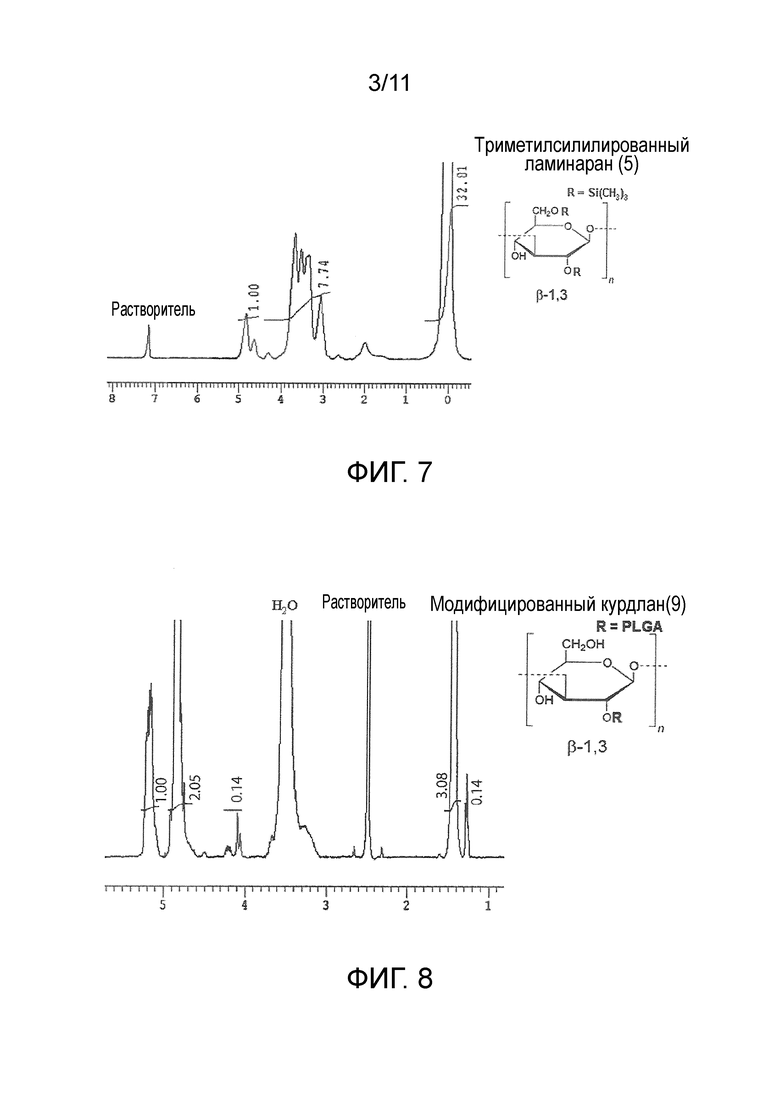
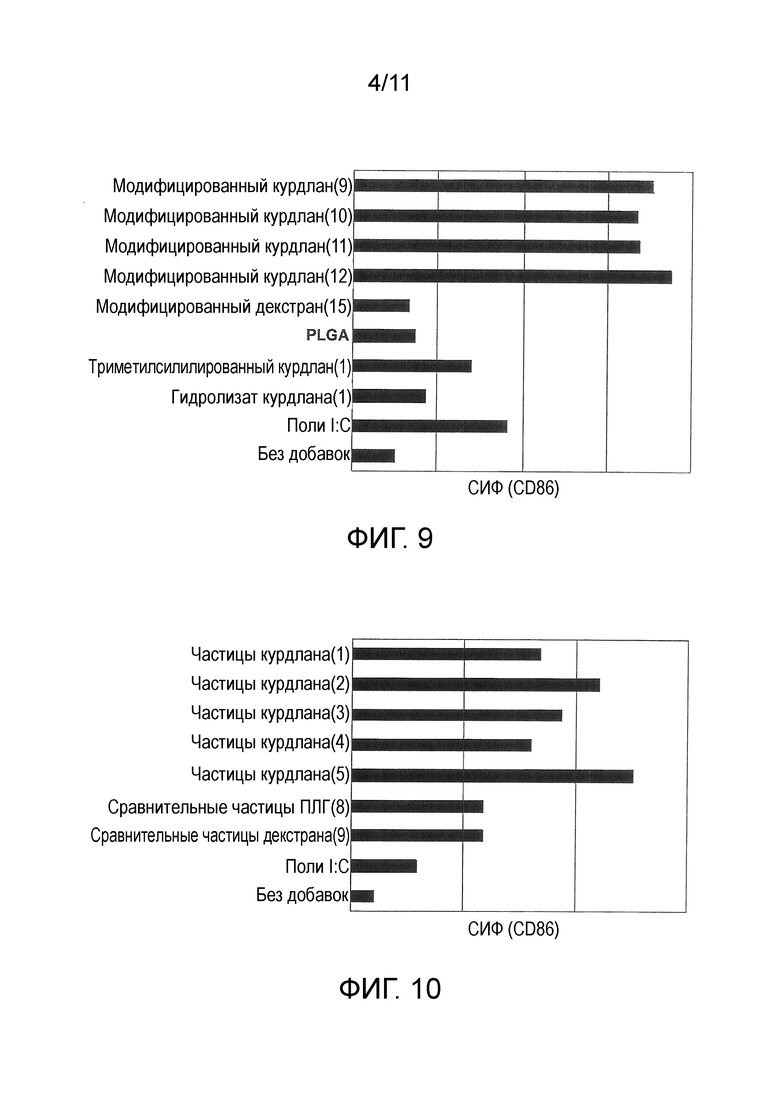
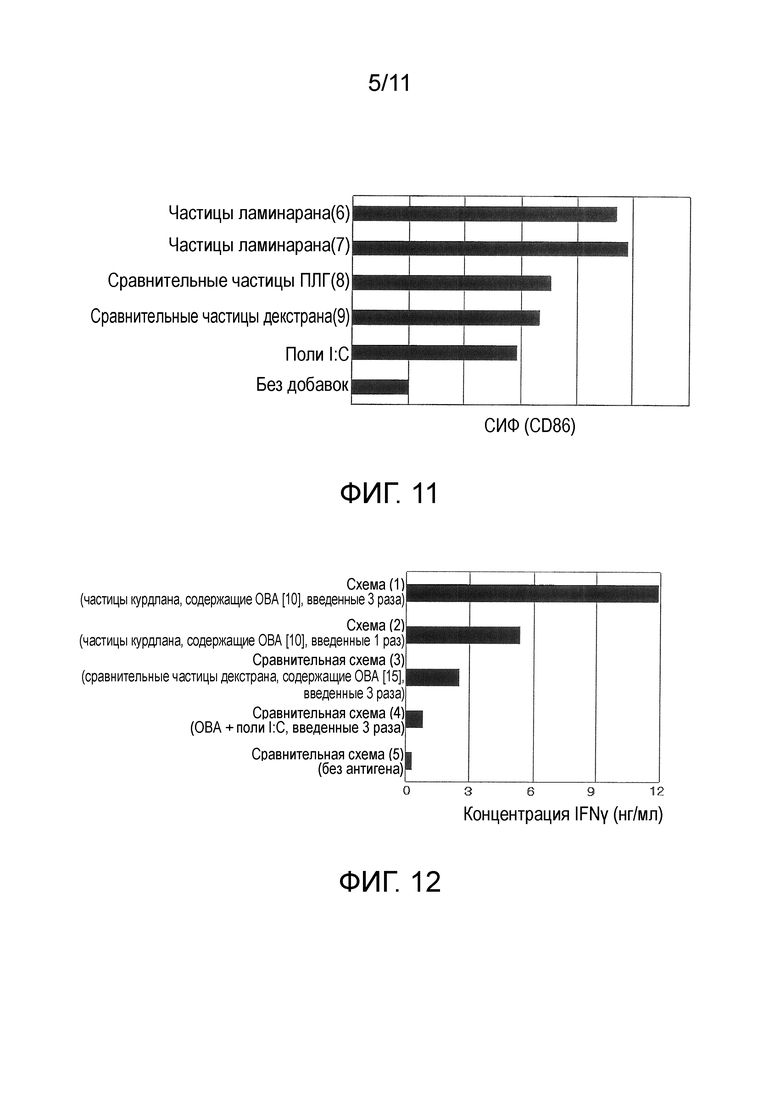
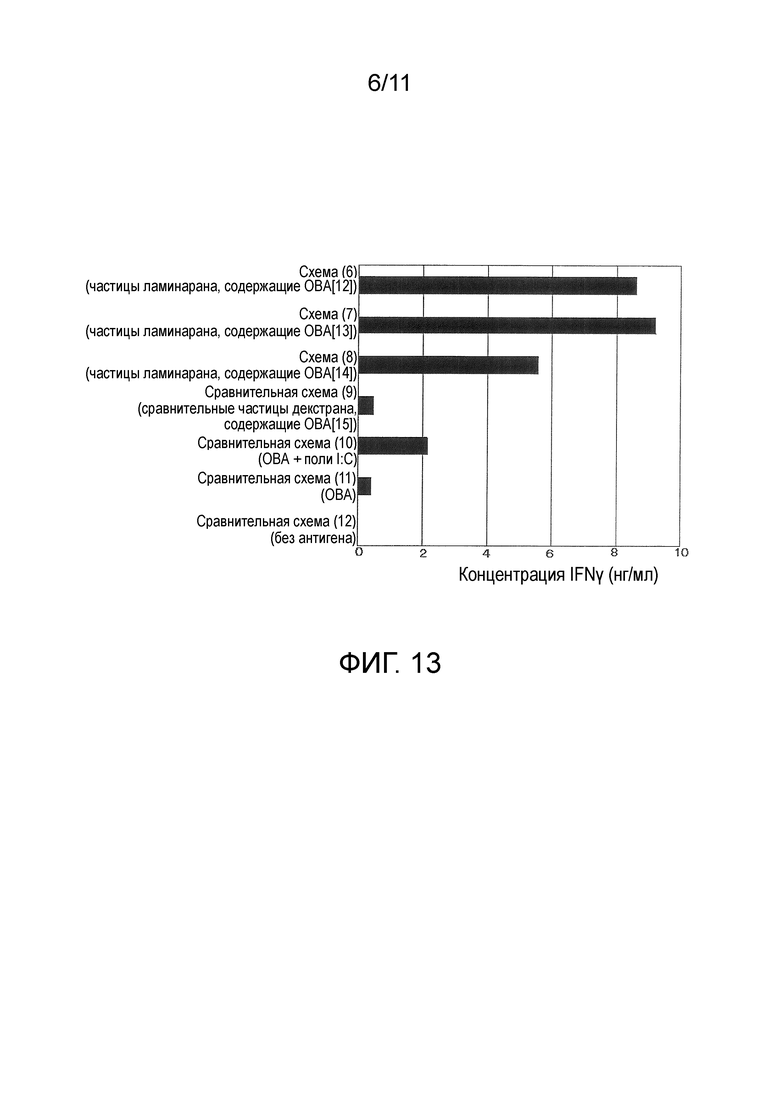
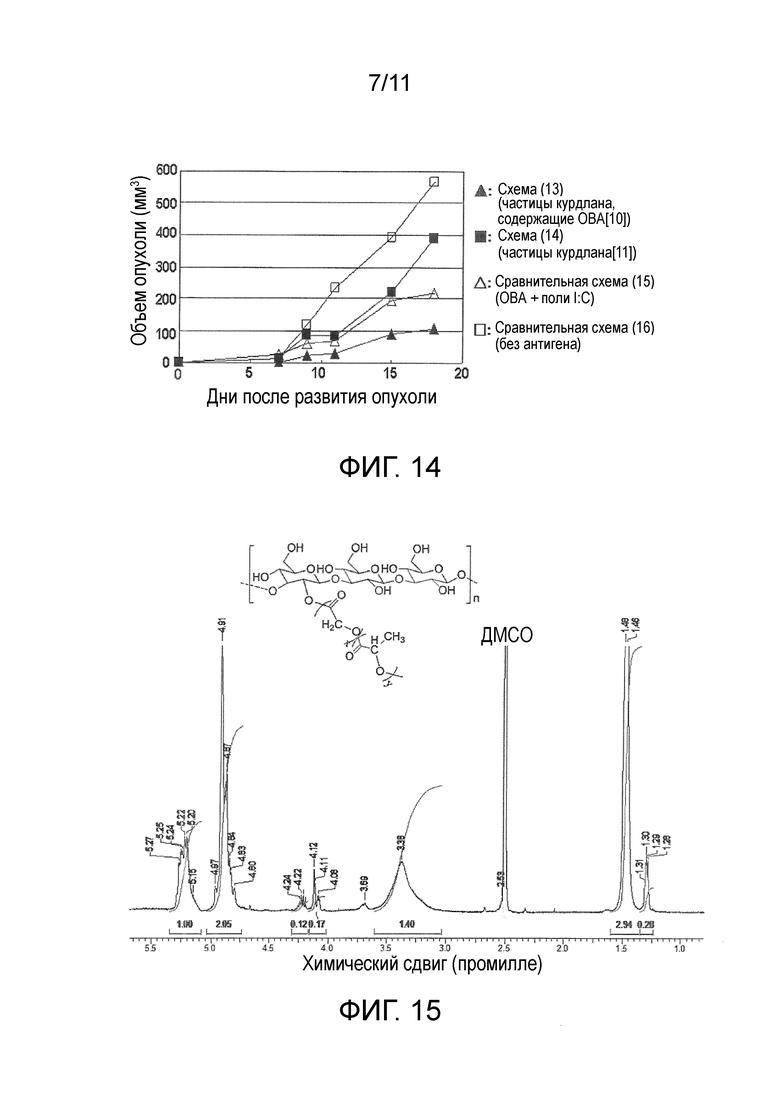
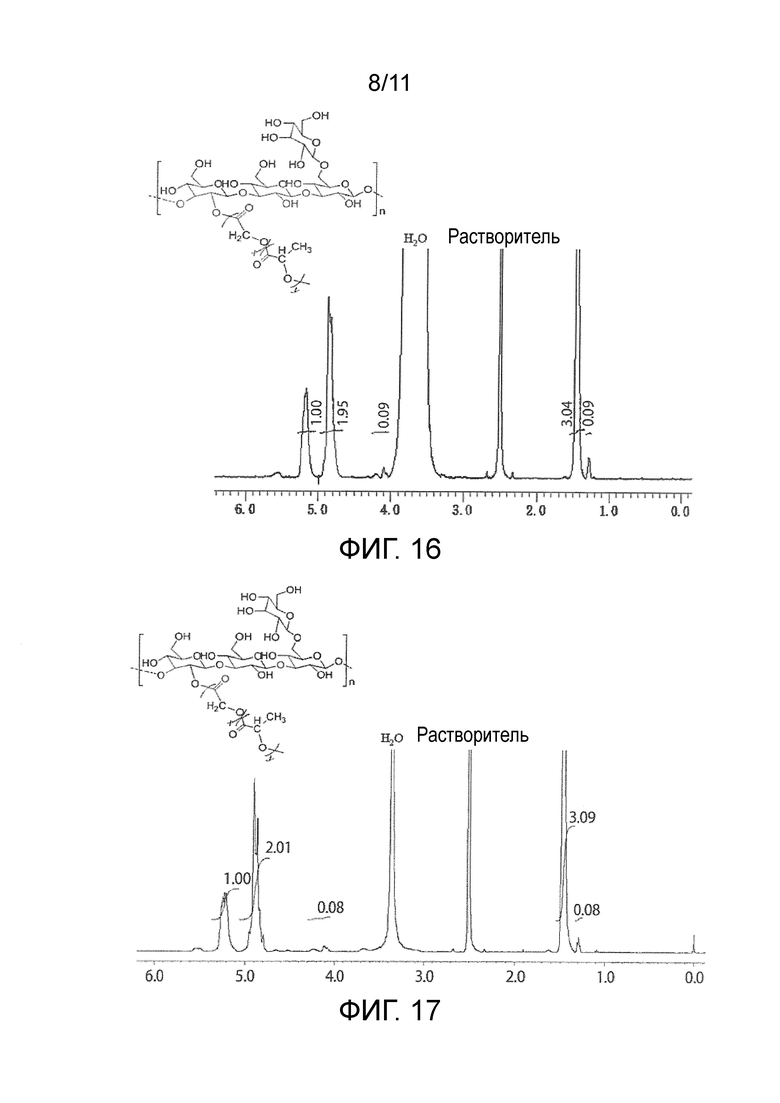
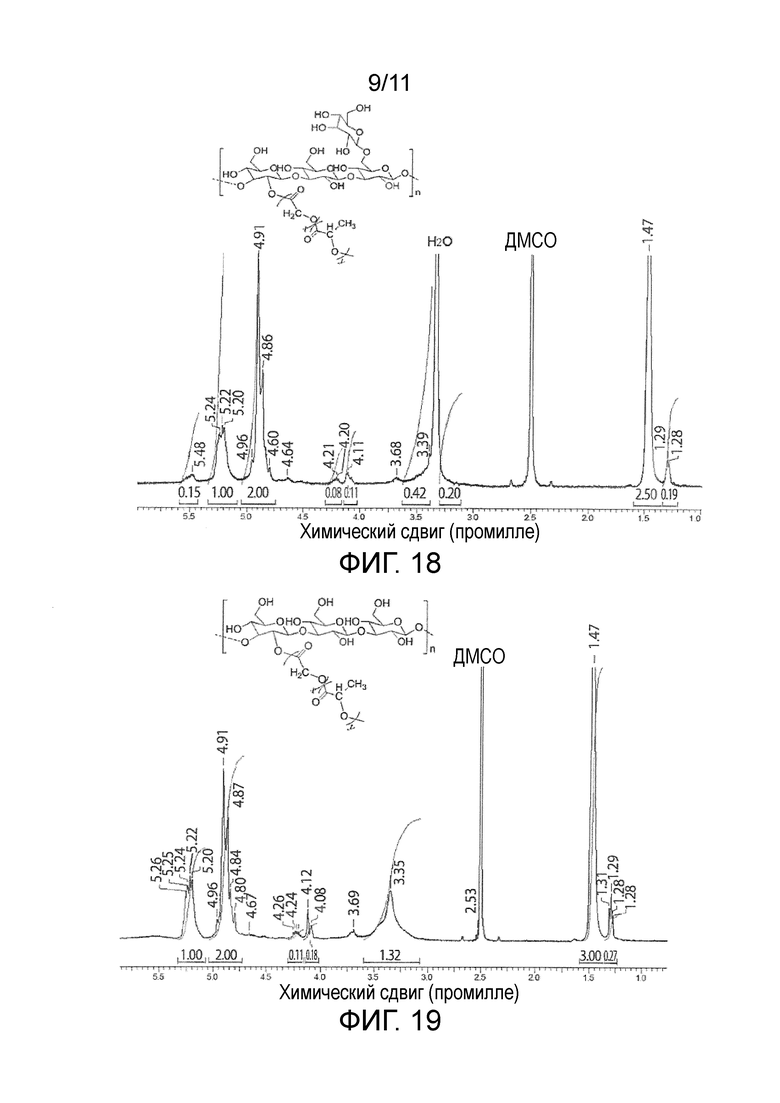
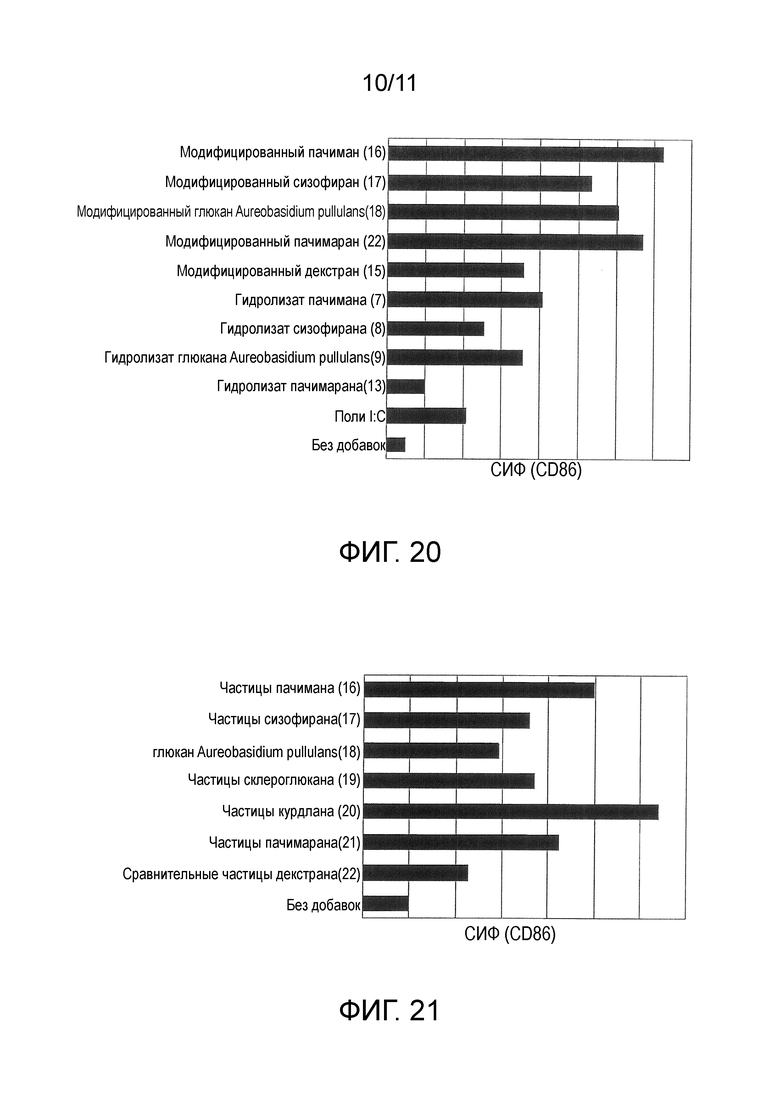
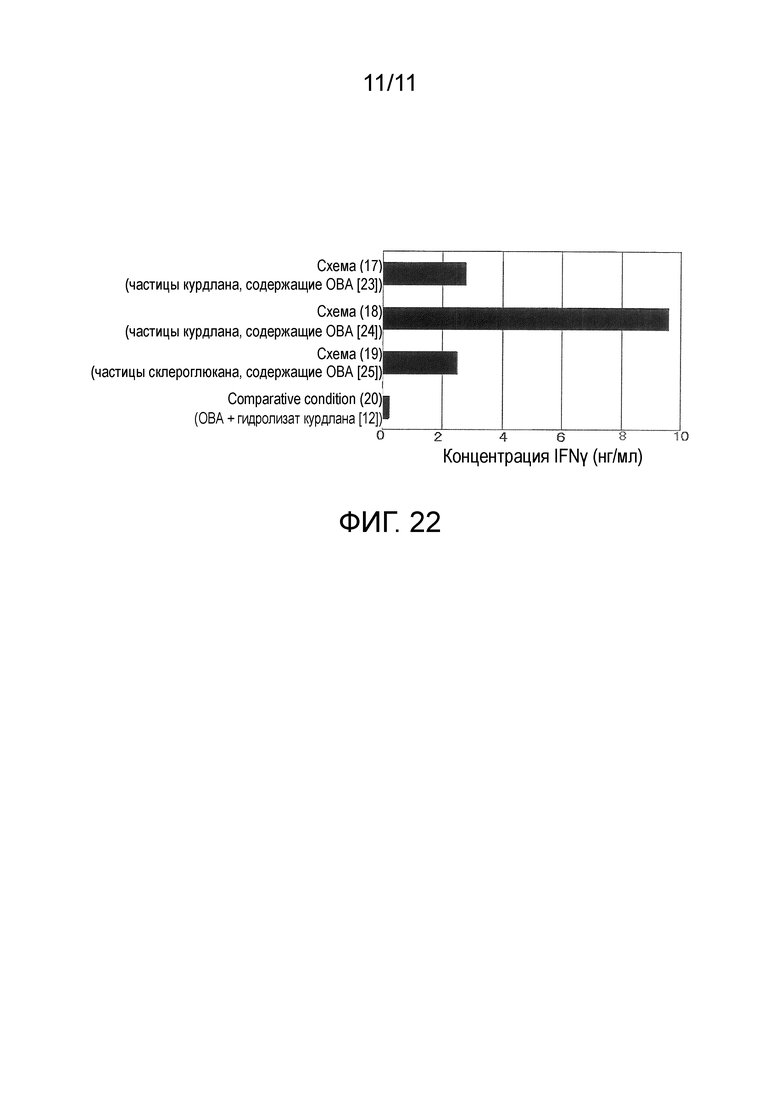
Изобретение относится к фармацевтической промышленности, а именно к иммуностимулятору для усиления иммунного ответа. Иммуностимулятор для усиления иммунного ответа, индуцированного антигеном, содержащий в качестве активного ингредиента модифицированный β-глюкан, обладающий иммуностимулирующим эффектом, причем β-глюкан ковалентно связан биосовместимой полигидроксикислотой. Лекарственное средство для лечения и/или предотвращения рака. Вакцина для лечения и/или предотвращения рака (варианты). Способ иммуностимуляции. Вышеописанный иммуностимулятор ускоряет иммунный ответ. 5 н. и 7 з.п. ф-лы, 22 ил., 13 табл., 17 пр.
1. Иммуностимулятор для усиления иммунного ответа, индуцированного антигеном, содержащий в качестве активного ингредиента модифицированный β-глюкан, обладающий иммуностимулирующим эффектом, отличающийся тем, что β-глюкан и биосовместимая полигидроксикислота ковалентно связаны.
2. Иммуностимулятор по п. 1, в котором β-глюкан представляет собой полимер глюкозы, связанный по меньшей мере одной β-1,3 связью и/или по меньшей мере одной β-1,6 связью.
3. Иммуностимулятор по п. 1 или 2, в котором модифицированный β-глюкан представляет собой привитый полимер, состоящий из основной цепи из β-глюкана и боковой цепи из полигидроксикислоты.
4. Иммуностимулятор по п.1, в котором доля сегментов β-глюкана составляет от 1% до 50% по массе.
5. Иммуностимулятор по п.1, в котором β-глюкан представляет собой курдлан, пачиман, ламинаран, лихенан, сизофиран, лентинан, склероглюкан, глюкан Aureobasidium pullulans или пачимаран.
6. Иммуностимулятор по п.1, в котором среднечисленная молекулярная масса β-глюкана составляет от 500 до 100000.
7. Иммуностимулятор по п.1, в котором полигидроксикислота представляет собой сополимер молочной-гликолевой кислот, полимолочную кислоту или полигликолевую кислоту.
8. Иммуностимулятор по п.1, содержащий частицы модифицированного β-глюкана в качестве активного ингредиента.
9. Лекарственное средство для лечения и/или предотвращения рака, содержащее иммуностимулятор по любому из пп. 1-8 в качестве активного ингредиента.
10. Вакцина для лечения и/или предотвращения рака, содержащая иммуностимулятор по любому из пп. 1-8 и антиген в качестве активных ингредиентов.
11. Вакцина для лечения и/или предотвращения рака, содержащая иммуностимулятор по любому из пп. 1-8 и раковый антиген в качестве активных ингредиентов.
12. Способ иммуностимуляции, включающий введение in vivo иммуностимулятора для усиления иммунного ответа, индуцированного антигеном по любому из пп. 1-8 или лекарственного средства по п. 9.
| BOHN J A et al | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| WO 2009068996 A3 (NOVARTIS AG) 23.12.2009 | |||
| WO 2012073020 А1 (BIOTEC PHARMACON ASA) 07.06.2012 | |||
| Установка для парафинирования сыров | 1978 |
|
SU753404A1 |
| Видоизменение прибора с двумя приемами для рассматривания проекционные увеличенных и удаленных от зрителя стереограмм | 1919 |
|
SU28A1 |
Авторы
Даты
2019-10-15—Публикация
2014-10-09—Подача