Предлагаемое изобретение относится к медицине, в частности к неврологии и офтальмологии, и предназначено для раннего прогнозирования и выявление групп риска развития нейродегенеративных заболеваний (НДЗ), в основе патогенеза которых лежит γ-синуклеинопатия.
Синуклеины участвуют в патогенезе ряда распространенных НДЗ, для которых характерно образование в тканях нервной системы больных специфического типа патогистологических включений, содержащих неправильно сформированные агрегаты синуклеинов. Синуклеины - это небольшие растворимые высоко гомологичные белки, гены которых в норме экспрессируются преимущественно в нервной ткани и описаны только у позвоночных. Семейство синуклеинов включает три белка: α-синуклеин, β-синуклеин и γ-синуклеин (Нинкина Н.Н., Бухман В.Л. Синуклеины: иметь или не иметь? // Генетика. - 2000. - V. 36. - №11. - Р. 1487-1491.; Brenz Verca M.S., Bahi A., Boyer F., Wagner G.C., Dreyer J.L. Distribution of alpha- and gamma-synucleins in the adult rat brain and 100 their modification by high-dose cocaine treatment // Eur J Neurosci. - 2003. - V. 18. - №7. - P. 1923-38.; Surguchov A. Molecular and cellular biology of synucleins // Int Rev Cell Mol Biol. - 2008. - V. 270. - P. 225-317).
Синуклеинопатии, в основе которых лежит патологическая агрегация синуклеинов, относятся к НДЗ - относительно медленно развивающихся болезней с преимущественным поражением нервной системы.
В норме γ-синуклеин обнаруживается в периферических отделах центральной нервной системы. Он был детектирован в нервных окончаниях первичных сенсорных и двигательных нейронов, в их телах, в нейронах симпатической нервной системы, в обонятельном эпителии. Получены многочисленные данные об участии γ-синуклеина в различных клеточных процессах, в том числе, в работе синапсов. Показано, что γ-синуклеин участвует в рециркуляции синаптических везикул и функционировании моноаминергической нейромедиаторной передачи, также получены данные, указывающие на его возможную шаперонную активность (О.А. Лыткина, Т.В. Тарасова, И.В. Хританкова, П.К. Анохин, М.С. Кухарский, А.А. Устюгов, член-корреспондент РАН С.О. Бачурин, Связывание гамма-синуклеина с синаптическими везикулами происходит без взаимодействия с белками SNAR-комплекса, Доклады академии наук, 2014, том 456, №5, с. 610-612). На модели мышей с генетической инактивацией γ-синуклеина выявлено развитие синаптической дисфункции, приводящее к нейродегенеративным процессам. Агрегированный γ-синуклеин является компонентом в составе атипических включений в дегенерирующих нейронах в аутопсийном материале головного мозга больных с нейродегенеративными расстройствами: деменции с тельцами Леви, болезнью Галлервордена-Шпатца, при болезни Паркинсона, в составе белковых включений клеточных депозитов у больных с боковым амиотрофическим склерозом, как разновидности болезни двигательного нейрона, а также при глаукоме у человека (Galvin J.E., Giasson В., Hurtig H.I., Lee V.M., Trojanowski J.Q. Neurodegeneration with brain iron accumulation, type 1 is characterized by alpha-, beta-, and gamma-synuclein neuropathology // Am J Pathol. - 2000. - V. 157. - №2. - P. 361-8.; Galvin J.E., Uryu K., Lee V.M., Trojanowski J.Q. Axon pathology in  disease and Lewy body dementia hippocampus contains alpha-, beta-, and gamma-synuclein // Proc Natl Acad Sci USA. - 1999. - V. 96. - №23. - P. 13450-5, Peters O., Millership S., Shelkovnikova T.A., Soto I., Keeling L., Hann A., Marsh-Armstrong N., Buchman V.L., Ninkina N. Selective pattern of motor system damage in gamma-synuclein transgenic mice mirrors the respective pathology in amyotrophic lateral sclerosis // Neurobiol Dis. - 2012. - V. 48. - P. 124-131). Имеются сведения о важной роли γ-синуклеина в различных патологиях сетчатки и зрительного нерва (Surguchov A, McMahan В, Masliah E, Irina Surgucheva. 2001a. Synucleins in ocular tissues. J Neurosci Res 65:68-77.). Есть мнение, что γ-синуклеин является объединяющим звеном патогенеза глаукомы и других НДЗ. Например, выявлено снижение иммунореактивности γ-синуклеина в слое нервных волокон сетчатки у пациентов с болезнью Альцгеймера (БА) (Surguchov A, McMahan В, Masliah Е, Irina Surgucheva. 2001а. Synucleins in ocular tissues. J Neurosci Res 65:68-77., Buchman V.L., Adu J., Pinon L.G., Ninkina N.N., Davies A.M. Persyn, a member of the synuclein family, influences neurofilament network integrity // Nat Neurosci. - 1998. - V. 1. - №2. - P. 101-3., Surguchov A., McMahan В., Masliah E., Surgucheva I. Synucleins in ocular tissues // J Neurosci Res. - 2001. - V. 65. - №1. - P. 68-77.). Известно, что глаукома имеет многообразную этиологию, но агрегированный γ-синуклеин является компонентом в составе атипических включений в дегенерирующих нейронах, расположенных в сетчатке в аутопсийном материале при разных видах глаукомы у человека и в зрительном нерве у мышей с глаукомой. (Surgucheva L, McMahan В., Ahmed F., Tomarev S., Wax M.B., Surguchov A. Synucleins in glaucoma: implication of gamma-synuclein in glaucomatous alterations in the optic nerve // J Neurosci Res. - 2002. - V. 68. - №1. - P. 97-106).
disease and Lewy body dementia hippocampus contains alpha-, beta-, and gamma-synuclein // Proc Natl Acad Sci USA. - 1999. - V. 96. - №23. - P. 13450-5, Peters O., Millership S., Shelkovnikova T.A., Soto I., Keeling L., Hann A., Marsh-Armstrong N., Buchman V.L., Ninkina N. Selective pattern of motor system damage in gamma-synuclein transgenic mice mirrors the respective pathology in amyotrophic lateral sclerosis // Neurobiol Dis. - 2012. - V. 48. - P. 124-131). Имеются сведения о важной роли γ-синуклеина в различных патологиях сетчатки и зрительного нерва (Surguchov A, McMahan В, Masliah E, Irina Surgucheva. 2001a. Synucleins in ocular tissues. J Neurosci Res 65:68-77.). Есть мнение, что γ-синуклеин является объединяющим звеном патогенеза глаукомы и других НДЗ. Например, выявлено снижение иммунореактивности γ-синуклеина в слое нервных волокон сетчатки у пациентов с болезнью Альцгеймера (БА) (Surguchov A, McMahan В, Masliah Е, Irina Surgucheva. 2001а. Synucleins in ocular tissues. J Neurosci Res 65:68-77., Buchman V.L., Adu J., Pinon L.G., Ninkina N.N., Davies A.M. Persyn, a member of the synuclein family, influences neurofilament network integrity // Nat Neurosci. - 1998. - V. 1. - №2. - P. 101-3., Surguchov A., McMahan В., Masliah E., Surgucheva I. Synucleins in ocular tissues // J Neurosci Res. - 2001. - V. 65. - №1. - P. 68-77.). Известно, что глаукома имеет многообразную этиологию, но агрегированный γ-синуклеин является компонентом в составе атипических включений в дегенерирующих нейронах, расположенных в сетчатке в аутопсийном материале при разных видах глаукомы у человека и в зрительном нерве у мышей с глаукомой. (Surgucheva L, McMahan В., Ahmed F., Tomarev S., Wax M.B., Surguchov A. Synucleins in glaucoma: implication of gamma-synuclein in glaucomatous alterations in the optic nerve // J Neurosci Res. - 2002. - V. 68. - №1. - P. 97-106).
Таким образом, нарушение метаболизма γ-синуклеина обнаружено при таких НДЗ как: болезнь Альцгеймера, болезнь Галлервордена-Шпатца, деменция с тельцами Леви, болезнь Паркинсона, боковой амиотрофический склероз, а также глаукома.
НДЗ являются распространенными заболеваниями, и диагноз их ставится на стадиях, когда процесс становится необратимым. В последние годы наблюдается рост НДЗ в связи с увеличением продолжительности жизни, ухудшением экологии и т.д. Так, по данным Организации Здравоохранения, в 2009 г.только болезнью Паркинсона и болезнью Альцгеймера в мире страдало более 40 миллионов человек, а к 2040 г.их число может превысить 100 миллионов, а страдающих глаукомой в мире доходит до 80-100 миллионов человек, причем в ближайшие 10 лет этот показатель увеличится на 10 миллионов человек. (Overk C.R., Masliah Е. Pathogenesis of synaptic degeneration in  disease and Lewy body disease, Biochem. Pharmacol. 2014, Vol. 88, P. 508-516, "Нейродегенеративные заболевания: от генома до целостного организма", под ред. М.В. Угрюмова, Москва, 2014, том 1, с. 22-44, «Глаукома. Национальное руководство» (под ред. проф. Е.А. Егорова) // М.: ГЭОТАР-Медиа. - 2013. - 824 с.). От 16% до 20% всех случаев заболевания глаукомой заканчиваются слепотой (Либман Е.С. Инвалидность вследствие патологии органа зрения (в кн. Офтальмология. Национальное руководство) / Под ред. С.Э. Аветисова, Е.А. Егорова, Л.К. Мошетовой, В.В. Нероева, Х.П. Тахчиди // М.: «ГЭОТАР-Медиа». - 2008. - С. 19-25.). Большинство НДЗ на определенном этапе развития сопровождается появлением деменции (Яхно Н.Н., Преображенский И.С., Захаров В.В. и др., Распространенность когнитивных нарушений при неврологических заболеваниях, Неврология, нейропсихиатрия, психосоматика, 2012, №2, с. 30-35.). Проблема НДЗ является одной из наиболее актуальных и важных проблем в медицине, имеющей большое медико-социальное значение ввиду высокой распространенности и тяжести исходов заболеваний, нередко ведущих к инвалидности и потере трудоспособности. Эффективность лечения основывается на своевременном выявлении данных заболеваний. На данный момент не существует доступных диагностических методов, позволяющих выявлять группы риска развития НДЗ, связанных с нарушением функции γ-синуклеина. Поскольку диагноз НДЗ ставится при появлении клинических признаков заболевания, когда процесс становится практически необратимым, то изучение ранних доклинических стадий проводится на модели с инактивированным геном, кодирующим γ-синуклеин. Поэтому актуально оценить возможность развития данных заболеваний на ранних стадиях.
disease and Lewy body disease, Biochem. Pharmacol. 2014, Vol. 88, P. 508-516, "Нейродегенеративные заболевания: от генома до целостного организма", под ред. М.В. Угрюмова, Москва, 2014, том 1, с. 22-44, «Глаукома. Национальное руководство» (под ред. проф. Е.А. Егорова) // М.: ГЭОТАР-Медиа. - 2013. - 824 с.). От 16% до 20% всех случаев заболевания глаукомой заканчиваются слепотой (Либман Е.С. Инвалидность вследствие патологии органа зрения (в кн. Офтальмология. Национальное руководство) / Под ред. С.Э. Аветисова, Е.А. Егорова, Л.К. Мошетовой, В.В. Нероева, Х.П. Тахчиди // М.: «ГЭОТАР-Медиа». - 2008. - С. 19-25.). Большинство НДЗ на определенном этапе развития сопровождается появлением деменции (Яхно Н.Н., Преображенский И.С., Захаров В.В. и др., Распространенность когнитивных нарушений при неврологических заболеваниях, Неврология, нейропсихиатрия, психосоматика, 2012, №2, с. 30-35.). Проблема НДЗ является одной из наиболее актуальных и важных проблем в медицине, имеющей большое медико-социальное значение ввиду высокой распространенности и тяжести исходов заболеваний, нередко ведущих к инвалидности и потере трудоспособности. Эффективность лечения основывается на своевременном выявлении данных заболеваний. На данный момент не существует доступных диагностических методов, позволяющих выявлять группы риска развития НДЗ, связанных с нарушением функции γ-синуклеина. Поскольку диагноз НДЗ ставится при появлении клинических признаков заболевания, когда процесс становится практически необратимым, то изучение ранних доклинических стадий проводится на модели с инактивированным геном, кодирующим γ-синуклеин. Поэтому актуально оценить возможность развития данных заболеваний на ранних стадиях.
Модель с инактивированным геном, кодирующим γ-синуклеин (γ-KO) адекватна НДЗ у человека, связанных с нарушением метаболизма γ-синуклеина. Показано, что у мышей с γ-KO развивается нарушение нейромедиаторной передачи, в том числе дофаминергической. У животных с данным генотипом происходит нейродегенеративный процесс и в оптическом нерве, формирующийся с возрастом, возможно, связанный с синаптической дисфункцией (Surgucheva I., McMahan В., Ahmed F., Tomarev S., Wax M.B., Surguchov A. Synucleins in glaucoma: implication of gamma-synuclein in glaucomatous alterations in the optic nerve // J Neurosci Res. - 2002. - V. 68. - №1. - P. 97-106]. Нарушение нейротрансмиссии и синаптической дисфункции в дофаминергической системе, в частности может влиять на регуляцию ВГД (Pescosolido N., Parisi F., Russo P., Buomprisco G., Nebbioso M., Role of dopaminergic receptors in glaucomatous disease modulation. Biomed Res Int. 2013; 2013:193048. doi: 10.1155/2013/193048).
Уровень ВГД у животных с γ-KO, а также влияние различных препаратов на изменение ВГД на данной модели и при γ-синуклеинопатиях у людей ранее не исследовали.
Задачей предлагаемого изобретения является разработка способа прогнозирования развития нейродегенеративных заболеваний при γ-синуклеинопатии.
Техническим результатом предлагаемого изобретения является формирование групп риска развития НДЗ и определение возможной тактики превентивных мероприятий.
Технический результат достигается за счет определения ВГД у мышей до и после однократной инсталляции одного из регуляторов дофаминергической системы: Дофамина, Галоперидола, Мелатонина.
Предлагаемые нами регуляторы дофаминергической системы вызывают кратковременное снижение ВГД в группе риска. Использование нескольких препаратов, которые применяются в клинической практике для терапии НДЗ, позволяет более надежно определить риск возникновения НДЗ, а также выработать тактику дальнейшего лечения. Нами был проведен поиск препаратов - регуляторов не только дофаминергической системы, но и других регуляторов вегетативной нервной системы, влияющих на продукцию или отток внутриглазной жидкости, воздействие которых может по-разному влиять на ВГД в норме и при γ-синуклеинопатии. Были исследованы: Мезатон, Атропин, Ирифрин, Мелатонин, Дофамин, Галоперидол. Из них были отобрали препараты, в ответ на введение которых ВГД у мышей с γ-KO и у здоровых мышей ВГД менялось по-разному.
В работе использованы линии генетически модифицированных мышей с γ-KO на генетическом фоне C57B16J (Charles River Laboratories, США). Контрольные животные, не содержащие модификаций генома (WT), были на том же генетическом фоне.
Исследование проводили у 15 мышей (30 глаз) с γ-KO, и у 20 контрольных мышей (40 глаз) того же возраста. Предварительно мы определили, что возраст мышей влияет на ВГД, поэтому все исследования мы проводили на молодых животных (3-4 мес.).
Мышам в оба глаза проводили инсталляции с помощью дозатора по 10 мкл препарата (Мелатонина 0,1%, Дофамин 10%, Галоперидол 0,2%). Применение каждого препарата воспроизводили трижды после двухнедельного перерыва. В группе с γ-KO и контрольной группе мышей проводили сравнение эффекта препарата. Измерение ВГД с помощью автоматического электронного тонометра Tonovet (Icare, Финляндия) у животных проводили утром до и после инсталляций препаратов через каждые 30 минут в течение 2 часов, предварительно анестезировали животных (Авертин 1%, 0,3 мл). Предварительно мы выявили, что анестезия не влияет на уровень ВГД у здоровых и у мышей с γ-KO.
Сравнение реакции ВГД на инстилляции регуляторов дофаминергической системы у мышей с γ-KO и у здоровых мышей.
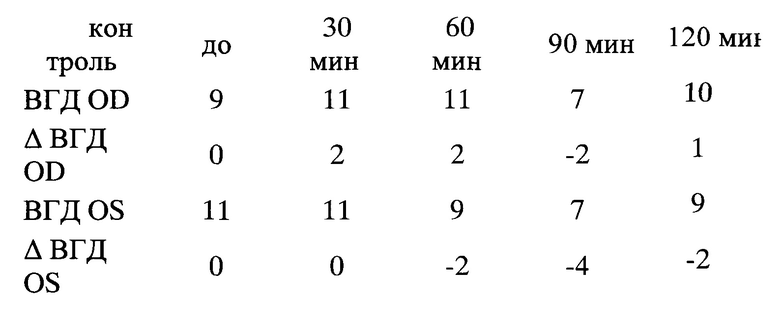
После инстилляции Мелатонина 0,1% у мышей с γ-KO через 60 мин отмечалось достоверное снижение ВГД на 5-6 мм рт.ст. (р<0,02) и в течение, по крайней мере, 2-х часов снижение ВГД составляло 5 мм рт.ст. (90 мин р<0,002, 120 мин р<0,001). В группе контроля ВГД снизилось незначительно на 2 мм рт.ст. через 30 мин, через 2 часа вернулось к исходному значению (фиг. 1).
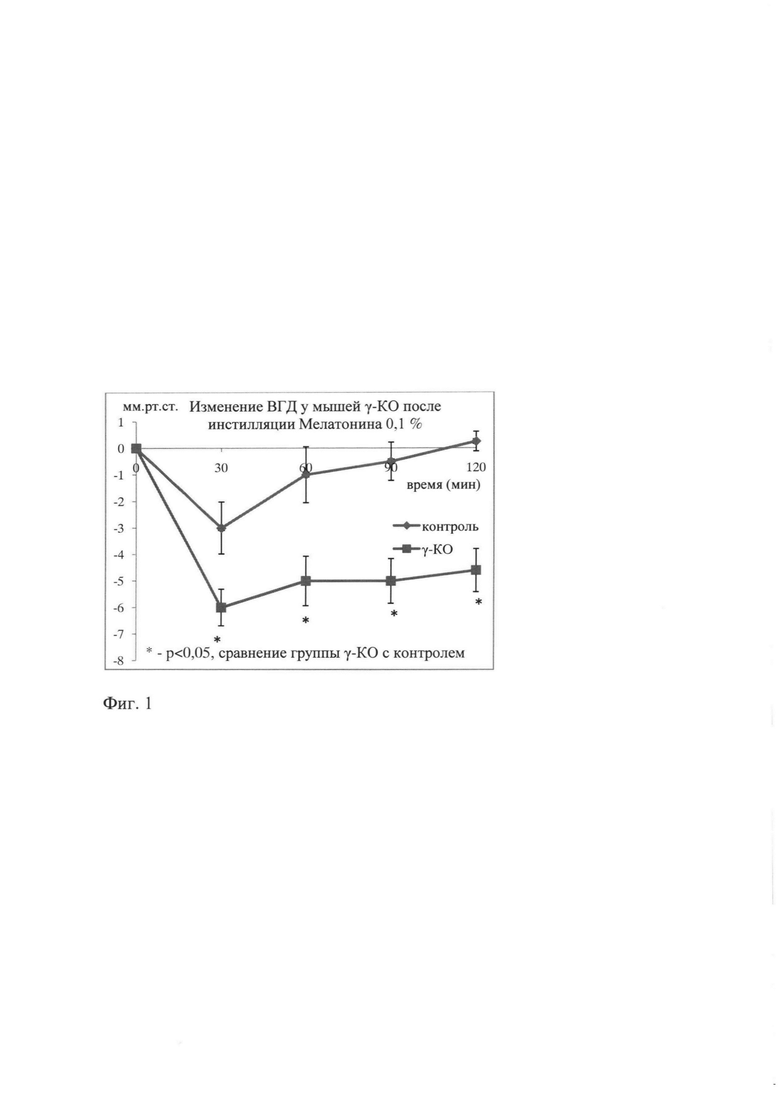
После инстилляции Галоперидола 0,2% в группе с γ-KO наблюдалось достоверное снижение ВГД через 30 мин, равнялось 5 мм рт.ст. (р<0,02) и в течение 2-х часов снижение ВГД составляло 5-6 мм рт.ст. При этом в группе контроля ВГД снижалось незначительно на 3 мм рт.ст. и через 2 часа вернулось к исходному (фиг. 2).
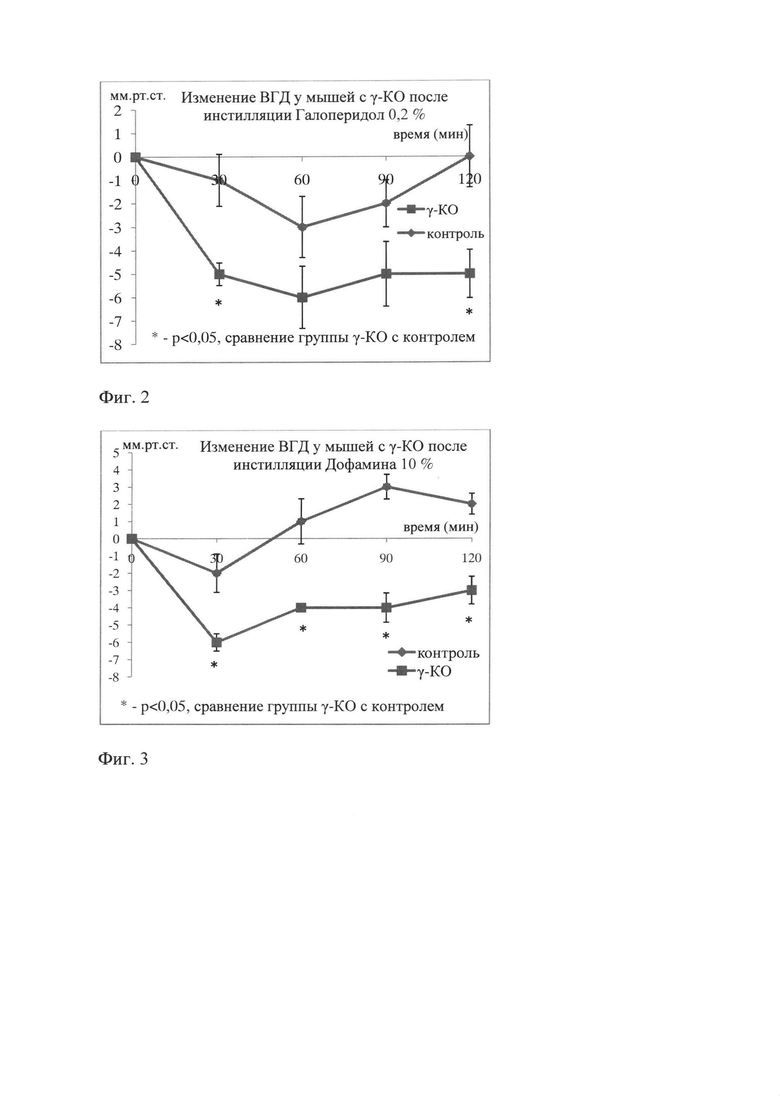
После инстилляции Дофамина 10% у мышей с γ-KO отмечалось достоверное снижение ВГД через 30 мин - 6 мм рт.ст. (р<0,000002), через 60 и 90 минут ВГД - 5 мм рт.ст. (р<0,03, р<0,002), напротив небольшого снижения ВГД в группе контроля на 1 мм рт.ст. через 30 мин, при этом возврат к исходным значениям ВГД в этой группе наблюдался уже через 1 час (фиг. 3).
Таким образом, результаты исследования показали, что у мышей с γ-KO реакция на инсталляцию регуляторов дофаминергической системы отличается от здоровых мышей. При наличии нарушенного метаболизма γ-синуклеина после инсталляций Мелатонина, Галоперидола и Дофамина ВГД длительно и существенно снижается (более чем на 4-5 мм рт.ст.) по сравнению с контрольными животными.
Способ осуществляют следующим образом. Определяют внутриглазное давление (ВГД) до и после инстилляции в конъюнктивальную полость Мелатонина 0,1% или Галоперидола 0,2%, или Дофамина 10%. При снижении ВГД более чем на 4 мм рт.ст. продолжительностью более 1 часа прогнозируют развитие нейродегенеративных заболеваний, в основе патогенеза которых лежит γ-синуклеинопатия.
Пример №1. Мышь №4546 с γ-KO, №4402 контроль. Инсталляция мелатонина 0,1% раствор в 0,05 М фосфатном буфере рН 7,4, содержащем 10% диметилсульфаксид (ДМСО).
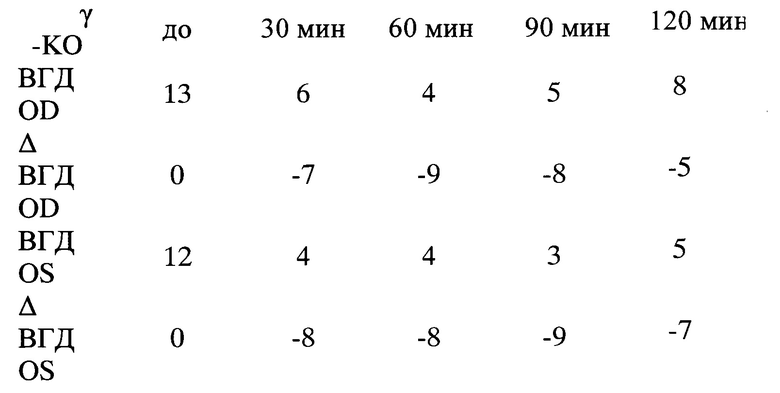
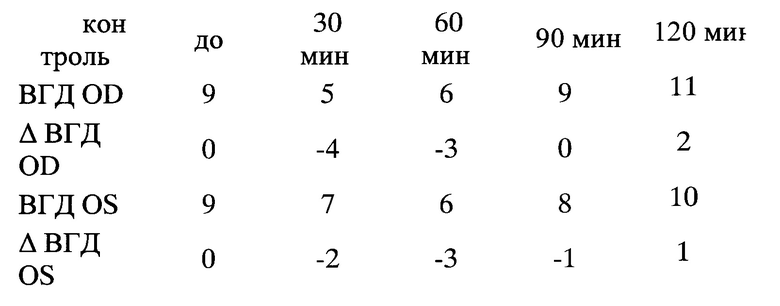
После инстилляции мелатонина 0,1% ВГД у мыши №4546 с γ-KO было снижено в течение 2 часов на 5-9 мм рт.ст., не достигая исходного уровня. При этом пик снижения ВГД был через 60-90 мин на 8-9 мм рт.ст. ВГД у контрольной мыши №4402 снижалось через 30-60 мин на 2-4 мм рт.ст., через 2 часа наблюдалось небольшое повышение ВГД на 1 -2 мм рт.ст.
Пример №2. Мышь №5116 с γ-KO, №4388 контроль. Инсталляция препарата Галоперидола 0,2%.


После инстилляции Галоперидола 0,2% ВГД у мыши №5116 с γ-KO было снижено в течение 30-90 мин на 4-7 мм рт.ст. Наблюдались ассиметричные изменения уровня ВГД через 2 часа: в OD осталось на низком уровне, в OS вернулось практически к исходному уровню. У контрольной мыши №4388 понижение ВГД оказалось менее значительным на 2-4 мм рт.ст., чем у мыши с γ-KO, при этом в начале наблюдения в OD наблюдалось повышение ВГД на 2 мм рт.ст.
Пример №3. Мышь №4546 с γ-KO, №4388 контроль. Инсталляция раствора дофамина 10% в 0,05 М фосфатном буфере рН 7,4.



После инстилляции дофамина 10% ВГД у мыши №4546 с γ-KO было снижено в течение 30-60 мин на 4-6 мм рт.ст. Через 2 часа уровень ВГД не вернулся к исходному уровню, снижен на 1-2 мм рт.ст. У контрольной мыши №4388 ВГД повысилось через 60-90 мин на 4-5 мм рт.ст. При этом через 120 мин ВГД осталось повышенное на 2-3 мм рт.ст.
Учитывая, что модель с γ-KO у мышей адекватна γ-синуклеинопатиям у людей, данный способ предлагается использовать в качестве прогностического теста для выявления γ-синуклеинопатий, что важно для раннего прогноза развития НДЗ.
Таким образом, предложенный способ позволяет прогнозировать развитие НДЗ при γ-синуклеинопатии, а, следовательно, формировать группы риска для динамического наблюдения и выбора превентивных лечебных мероприятий.
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ РАННЕЙ ДИАГНОСТИКИ БОЛЕЗНИ ПАРКИНСОНА | 2019 |
|
RU2722666C1 |
| Способ лечения нейродегенеративного процесса в глазу в эксперименте | 2023 |
|
RU2794835C1 |
| МОДУЛЯТОРЫ АЛЬФА-СИНУКЛЕИНА | 2018 |
|
RU2797677C2 |
| Способ моделирования нейродегенеративного процесса в глазу | 2022 |
|
RU2787515C1 |
| АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С ПРОТОФИБРИЛЛАМИ, И ИХ ПРИМЕНЕНИЕ В МЕТОДАХ ТЕРАПИИ И ДИАГНОСТИКИ БОЛЕЗНИ ПАРКИНСОНА, ДЕМЕНЦИИ, АССОЦИИРОВАННОЙ С ОБРАЗОВАНИЕМ ДИФФУЗНЫХ ТЕЛЕЦ ЛЕВИ, И ДРУГИХ АЛЬФА-СИНУКЛЕИНОПАТИЙ | 2011 |
|
RU2555526C2 |
| СПОСОБ СНИЖЕНИЯ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ | 2011 |
|
RU2472471C1 |
| СРЕДСТВО ДЛЯ СНИЖЕНИЯ ВНУТРИГЛАЗНОГО ДАВЛЕНИЯ И СПОСОБ ЕГО ПРИМЕНЕНИЯ | 2022 |
|
RU2815996C1 |
| СПОСОБ МОДЕЛИРОВАНИЯ ПСИХОТИЧЕСКОГО РАССТРОЙСТВА | 2004 |
|
RU2366464C2 |
| МЕТИЛТИОНИНИЙ, ПРЕДНАЗНАЧЕННЫЙ ДЛЯ ЛЕЧЕНИЯ СИНАПТОПАТИЙ | 2020 |
|
RU2835868C2 |
| Способ лечения первичной открытоугольной глаукомы | 1987 |
|
SU1648452A1 |
Изобретение относится к медицине, а именно к неврологии и офтальмологии, и может быть использовано для прогнозирования развития нейродегенеративных заболеваний у мышей, в основе патогенеза которых лежит γ-синуклеинопатия. Определяют внутриглазное давление (ВГД) до и после инсталляции в конъюнктивальную полость мелатонина 0,1%, или галоперидола 0,2%, или дофамина 10%. При снижении ВГД более чем на 4 мм рт.ст. продолжительностью более 1 часа прогнозируют развитие нейродегенеративных заболеваний при γ-синуклеинопатии. Способ обеспечивает формирование групп риска развития нейродегенеративных заболеваний и определение возможной тактики превентивных мероприятий за счет определения ВГД у мышей до и после однократной инстилляции одного из регуляторов дофаминергической системы: дофамина, галоперидола, мелатонина. 3 ил., 3 пр.
Способ прогнозирования развития нейродегенеративных заболеваний у мышей, в основе патогенеза которых лежит γ-синуклеинопатия, включающий определение внутриглазного давления (ВГД) до и после инсталляции в конъюнктивальную полость мелатонина 0,1%, или галоперидола 0,2%, или дофамина 10%, и при снижении ВГД более чем на 4 мм рт.ст. продолжительностью более 1 часа прогнозируют развитие нейродегенеративных заболеваний при γ-синуклеинопатии.
| SURGUCHEVA I | |||
| et al | |||
| Synucleins in glaucoma: implication of gamma-synuclein in glaucomatous alterations in the optic nerve | |||
| J Neurosci Res | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| WO 2003069332 A2, 21.08.2003 | |||
| AU 2011219414 B2, 20.11.2014 | |||
| НИНКИНА Н.Н | |||
| Молекулярно-клеточные механизмы патогенеза болезни двигательного нейрона: роль гамма-синуклеина | |||
| М., 2012, Автореф | |||
| диссер., стр.49 | |||
| КОХАН В.С | |||
| и др | |||
| Направленная инактивация гена, кодирующего гамма-синуклеин, влияет на уровень тревожности и исследовательской активности мышей | |||
| Журнал высшей нервной деятельности, 2011, том 61, N1, стр.85-93 | |||
| WILDING C | |||
| et al | |||
| γ-Synuclein Antibodies Have Neuroprotective Potential on Neuroretinal Cells via Proteins of theMitochondrial Apoptosis Pathway | |||
| PLoS ONE | |||
| Способ защиты переносных электрических установок от опасностей, связанных с заземлением одной из фаз | 1924 |
|
SU2014A1 |
| SURGUCHEVA I | |||
| et al | |||
| Gamma-synuclein as a marker of retinal ganglion cells | |||
| Mol Vis | |||
| Станок для изготовления деревянных ниточных катушек из цилиндрических, снабженных осевым отверстием, заготовок | 1923 |
|
SU2008A1 |
Авторы
Даты
2019-10-16—Публикация
2018-12-13—Подача