Предлагаемое изобретение относится к медицине, а именно к эндокринной хирургии и может быть использовано в диагностике узловых образований щитовидной железы.
Возрастающий интерес к проблеме определения злокачественности опухолей щитовидной железы (ОЩЖ) в значительной степени связан с ростом заболеваемости раком щитовидной железы. Рак щитовидной железы (ЩЖ) является самым распространенным заболеванием эндокринной системы и имеет тенденцию к увеличению во всех странах мира. По оценкам зарубежных экспертов, при сохранении текущих темпов прироста заболеваемости, рак ЩЖ (РЩЖ) уже к 2020 г. станет самой распространенной опухолью у женщин. В России, по данным Московского научно-исследовательского онкологического института имени П.А. Герцена, прирост абсолютного числа заболевших РЩЖ в период с 2004 по 2014 гг составил 36,5% у женщин и 15,5% у мужчин, оба пола (грубые показатели на 100000 населения) - 18,5%. От всех злокачественных опухолей на долю РЩЖ приходится около 0,5-1% среди мужского населения и 1-4,4% женского. РЩЖ встречается в 3 раза чаще у женщин, чем у мужчин, и обычно представлен в виде узловых образований, которые выявляются (по различным данным) у от 4 до 40% населения. По данным ВОЗ, за последние 20 лет заболеваемость РЩЖ в странах Европы и США удвоилась главным образом за счет лиц молодого и среднего возраста.
Основным неинвазивным способом диагностики узловых образований является ультразвуковое исследование (УЗИ) щитовидной железы. С помощью УЗИ определят подозрительные эхографические признаки опухолевого поражения щитовидной железы. Подозрительными признаками являются (оценивают только в солидных узлах или в солидных участках узлов): гипоэхогенная солидная структура, неровный, нечеткий или полициклический контур, точечные гиперэхогенные включения (микрокальцинаты), преобладание высоты узла над шириной ("выше, чем шире"), увеличенные лимфоузлы шеи. (Российские клинические рекомендации по диагностике и лечению высокодифференцированного рака щитовидной железы у взрослых, 2017 год. // Эндокринная хирургия. - 2017. - Т. 11. - №1. - C. 6-27.doi: 10.14341/serg201716-27).
В зависимости от количества подозрительных эхографических признаков, позволяющих предположить злокачественность или доброкачественность узла щитовидной железы используют систему TI-RADS (от англ. Thyroid Imaging Reporting and Data System), предложенную в 2009 г. E. Horvath и соавт. и модифицированную в 2011 г. J.Y. Kwak, которая определяет риск рака щитовидной железы. (Horvath Е., Majlis S., Rossi R. et al. An ultrasonogram reporting system for thyroid nodules stratifying cancer risk for clinical management. J. Clin. Endocrinol. Metab. 2009; 94 (5): 1748-1751. DOI: 10.1210/jc. 2008-1724).
Пациенты с неизмененной паренхимой ЩЖ были отнесены к TIRADS1. При категории TIRADS 2 отсутствуют признаки злокачественности (это коллоидные кисты ЩЖ, губчатые кисты, кисты с пристеночным компонентом) - риск рака щитовидной железы 0-4% при TIRADS 3 - отсутствие признаков злокачественности, но с наличием изо- или гиперэхогенных узлов с эксцентрично расположенными анэхогенными включениями) - риск рака щитовидной железы менее 5%; TIRADS 4а - наличие одного признака злокачественности - риск рака щитовидной железы 5-10%; TIRADS 4b - двух признаков и более, но при отсутствии регионарной лимфаденопатии - риск рака щитовидной железы 10-80%; TIRADS 5 - наличием трех-пяти признаков или выявленным метастатическим поражением зон регионарного лимфооттока - риск рака щитовидной железы более 80%. Однако, данная методика носит субъективный характер и очень зависит от квалификации врача ультразвуковой диагностики и разрешающей способности У3-аппарата.
Основным способом дооперационной диагностики узлов ЩЖ, принятым за ближайший аналог, определяющим необходимость хирургического лечения, является тонкоигольная аспирационная пункционная биопсия (ТАПБ) с последующим цитологическим исследованием полученных препаратов. Специалисты цитологической диагностики во всем мире в настоящее время используют классификацию поражений ЩЖ по системе Bethesda (Cibas and Ali, 2009).
При этом специалисты присваивают каждой категории так называемый риск злокачественности, т.е. в каком проценте случаев при постановке того или иного цитологического диагноза гистологически выявляется злокачественная опухоль.
Bethesda I - Недиагностический материал (кровь, артефакты, клеточный состав скудный или отсутствует, содержимое кисты). В данной категории показана повторная пункция.
Bethesda II - Доброкачественные изменения (коллоидный узел, аутоиммунный тиреоидит, токсический зоб) Риск злокачественного процесса 0-3%. В данной категории показаний к хирургическому лечению нет. Показано наблюдение в динамике.
Bethesda III - Атипия неясного значения. Риск злокачественного процесса 5-15%. Показана повторная ТАПБ через 1-3 мес.
Bethesda IV - Фолликулярная неоплазия или подозрение на фолликулярную неоплазию (в том числе из клеток Гюртля) Риск злокачественного процесса 15-30%. Показано хирургическое лечение.
Bethesda V - Подозрение на рак (папиллярный, медуллярный, низкодифференцированный) Риск злокачественного процесса 60-75%. Показано хирургическое лечение.
Bethesda VI - Рак (папиллярный, медуллярный, низкодифференцированный, лимфома и т.д.). Риск злокачественного процесса 97-99%. Показано хирургическое лечение.
ТАПБ с последующим цитологическим заключением требует большого опыта от исполнителя и относительно часто приводит к ошибкам (Stevens et al., 2009). По различным оценкам, ТАПБ в 15-30% случаев не может дифференцировать доброкачественные и злокачественные опухоли ЩЖ. В этих случаях заключения по цитологическому исследованию формулируются как «фолликулярная неоплазия», «фолликулярная опухоль» или «новообразование ЩЖ», которые представляют собой гетерогенную группу так называемых «неопределенных» изменений - как злокачественных, так и доброкачественных заболеваний, имеющих сходную цитоморфологическую картину. Только 10-15% из них при гистологическом исследовании действительно оказываются злокачественными (И.И., Кузнецов Н.С., Мельниченко Г.А. Руководство для врачей: Эндокринная хирургия. - М.: ГЭОТАР-Медиа, 2014) Единственным доказательством высокодифференцированного фолликулярного рака является обнаружение инвазии опухоли в сосуды и капсулу, что невозможно обнаружить при цитологическом исследовании Принадлежность образца к первой категории вообще не позволяет выставить диагноз при цитологическом исследовании. Эпителиальные клетки ЩЖ тесно спаяны между собой, клеточные связи рвутся с трудом, поэтому получение информативного материала при проведении ТАПБ представляет непростую задачу. Доля неинформативных пункций составляет в разных медицинских учреждениях 5-12%. Метаанализ, проведенный М. Bongiovanni и соавт. (2012), показал, что частота "неопределенного" цитологического заключения может достигать 20-30%.
Между тем, в России ежегодно производят несколько десятков тысяч операций у пациентов с заболеваниями щитовидной железы и количество операций продолжает неуклонно расти. Проблема в том, что оперативный путь чаще всего выбирается для лечения болезней щитовидной железы, не угрожающих жизни. Назначенная подобным образом операция не приносит улучшения состояния и не повышает качество жизни. По некоторым оценкам, до 70% операции на щитовидной железе проводятся без наличия показаний к хирургическому лечению. Избыточная оперативная активность, с одной стороны, связана с использованием врачами устаревших принципов определения тактики лечения пациентов, с другой - отсутствием достоверных способов, исключающих рак щитовидной железы.
Задачи: повышение достоверности верификации опухолевых поражений щитовидной железы, определение адекватного объема операции.
Технический результат: сокращение количества необоснованных хирургических вмешательств, которые могут привести к значительному снижению качества жизни за счет наличия специфических послеоперационных осложнений (парез гортани около 4-6% в специализированных учреждениях, до 20% в хирургических учреждениях общего профиля, послеоперационный гипопаратиреоз 4-30%, который может привести к стойким необратимым изменениям костной ткани).
Сущностью изобретения является молекулярно-генетический способ: при неопределенных цитологических заключениях выполняют молекулярно-генетическую диагностику, при котором предварительно высушенный цитологический препарат с цитологических стекол смывают 200 мкл лизирующего буфера, далее производят выделение ДНК и микроРНК из цитологических препаратов тонкоигольной аспирационной пункционной биопсии (ТАПБ) новообразований ЩЖ с помощью наборов для выделения, производят детекцию и количественную оценку диагностически значимых микроРНК, основанный на методе ПЦР (полимеразной цепной реакции) с флуоресцентной регистрацией результата анализов в реальной времени с помощью термоциклера CFX96(Bio-Rad Laboratories, США) и при условии показателей HMGA2 более 0.09, микроРНК 221 более 0,0105 и микроРНК 375 более -12,1213 определяют фолликулярную опухоль с признаками злокачественности, при показателях микроРНК-146b более 0.1721 определяют папиллярный рак, при показателях миРНК-375 более 5.2514 определяют медуллярный рак, а показатель соотношения митохондриальной ДНК/ядерной ДНК равно или более 5716,3013 - В-клеточный рак, наличие мутации V600 в гене BRAF-папиллярный рак и является риском наличия высокой биологической агрессивности данного папиллярного рака и наличия у данного пациента распространенного процесса.
В молекулярно-генетический анализ было вовлечено несколько диагностически значимых типов онкомаркеров, наиболее часто встречающиеся при раке ЩЖ: изменение уровня экспрессии гена HMGA2, соматические точечные замены в генах BRAF, изменение уровня экспрессии ряда микроРНК, а также соотношение митохондриальной и ядерной ДНК.
Поскольку молекулярно-генетическая диагностика позволяет не только выявлять злокачественный процесс, но и определять тип опухоли, образцы разделялись на следующие группы: доброкачественные образования (ДО), фолликулярные опухоли без маркеров злокачественности (ФОБМЗ), фолликулярные опухоли с маркерами злокачественности (ФОМЗ), В-клеточные фолликулярные опухоли с маркерами злокачественности (В-ФОМЗ), папиллярный и медуллярный раки. Если проводить параллели с гистологической классификацией, то группа ФОБМЗ состоит в основном из фолликулярных аденом с некоторым количеством фолликулярных раков, для которых не было обнаружено молекулярных маркеров злокачественности. Группа ФОМЗ состоит из фолликулярных раков, части фолликулярных вариантов папиллярного рака и небольшого количества фолликулярных аденом для которых были выявлены молекулярные маркеры злокачественности. В группу включены пациенты с показателями HMGA2 более 0,0918, микроРНК-375 более -12,1213, микроРНК-221 более 0,0105. А при показателях микроРНК-375 более 5.2514 определяют медуллярный рак. Группа В-ФОМЗ соответствует В-клеточным фолликулярным ракам. Способ позволяет таким образом не только повысить достоверность верификации опухолей щитовидной железы, но и сократить количество необоснованных хирургических вмешательств и таким образом снизить количество послеоперационных осложнений, улучшить качество жизни. Средняя диагностическая точность молекулярно-генетического исследования - 90.1%, а цитологического исследования - 58.2%.
Способ осуществляют следующим образом: первичным диагностическим звеном является УЗИ щитовидной железы. При наличии узлового образования более 1 см или наличии подозрительных признаков на рак щитовидной железы в узловых образованиях менее 1 см, выполняют тонкоигольную пункционная аспирационную биопсию (ТАПБ) с последующим цитологическим исследованием. При подозрении на рак щитовидной железы показано оперативное лечение. При получении неопределенных результатов цитологического исследования: III и IV класс по Bethesda, противоречивых результатах цитологического, ультразвукового и гистологического исследований, при множественных неинформативных заключениях пункционной биопсии проводят молекулярно-генетическое исследование: предварительно высушенный цитологический препарат с цитологических стекол смывают 200 мкл лизирующего буфера, далее производят выделение ДНК и микроРНК из цитологических препаратов тонкоигольной аспирационной пункционной биопсии (ТАПБ) новообразований ЩЖ с помощью наборов для выделения, производят детекцию и количественную оценку диагностически значимых микроРНК, основанный на методе ПЦР (полимеразной цепной реакции) с флуоресцентной регистрацией результата анализов в реальной времени с помощью термоциклера CFX96 (Bio-Rad Laboratories, США) и при условии показателей микроРНК-146b более 0.1721 определяют папиллярный рак, при показателях миРНК-375 более 5.2514 определяют медуллярный рак, а показатель соотношения митохондриальной ДНК/ядерной ДНК более 5716,3013 - В-клеточный рак, наличие мутации V600 в гене BRAF-папиллярный рак и является риском наличия высокой биологической агрессивности данного папиллярного рака и наличия у данного пациента распространенного процесса. На основании заключения определяют окончательную тактику и необходимость хирургического лечения.
Для доказательства достижения решаемых задач анализу подвергнуты результаты обследования и лечения 61 пациента отделения эндокринной хирургии ГБУЗ ККБ №2, оперированных по поводу мононодозного нетоксического зоба в 2016 г - 2017 г. Цитологические препараты, полученные при проведении стандартной тонкоигольной аспирационной пункционной биопсии, подвергнуты молекулярно-генетическому анализу, в Институте молекулярной и клеточной биологии Сибирского отделения Российской академии наук, г. Новосибирск.
Среди пациентов было 50 (82%) женщин и 11 (18%) мужчин в возрасте от 19 до 64 лет. Проведен анализ только пациентов с мононодозным поражением щитовидной железы, что исключало ошибки сравнения результатов УЗИ, гистологического и молекулярно-генетического метода исследования.
1. Оценка У3-диагностики:
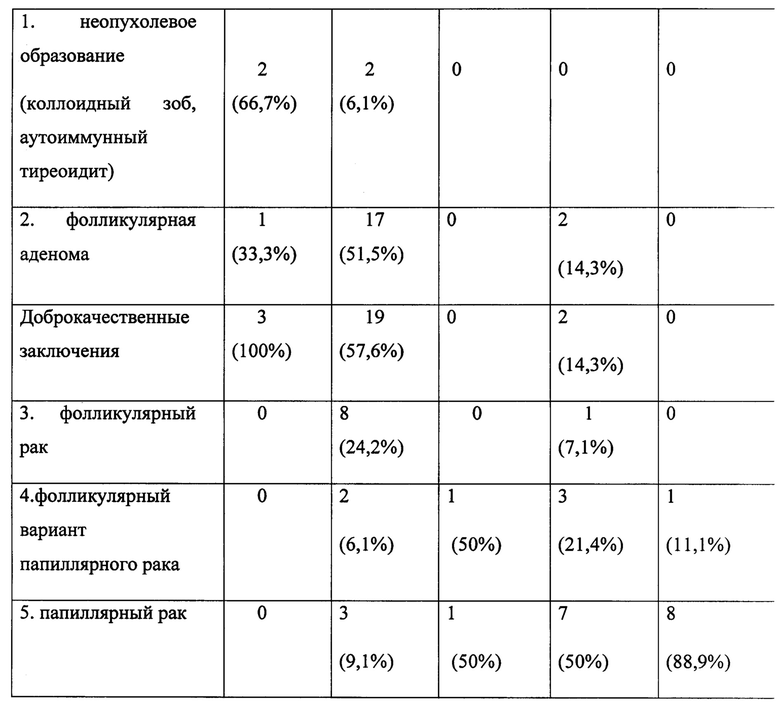
В данном обследовании, в группу TIRADS 2 (доброкачественные изменения щитовидной железы.) попало 3 пациента, в 2 случаях был диагностирован коллоидный зоб, у одного пациента - фолликулярная аденома. В группе TIRADS 3 (вероятно доброкачественные изменения щитовидной железы) - 33 пациента: в 2 случаях (6,1%) при гистологическом исследовании выявлены доброкачественные образования, в 17 случаях (51,5%) выявлена фолликулярная аденома и в 14 случаях (42,4%) выявлена злокачественная опухоль, что иллюстрирует недостоверность УЗИ-диагностики опухолей в этой группе.
В группе TIRADS IVa (риск малигнизации 5-10%) - у всех 2 пациентов (100%) выявлен папиллярный рак. В группу TIRADS IVb (риск малигнизации 10-80%) попало 14 пациентов: в 2 случаях (14,3%) диагностирована фолликулярная аденома, у 12 (85,7%) выявлены злокачественные опухоли. При TIRADS V у всех 9 пациентов выявлен злокачественный процесс. Все данные суммированы в таблице 1. 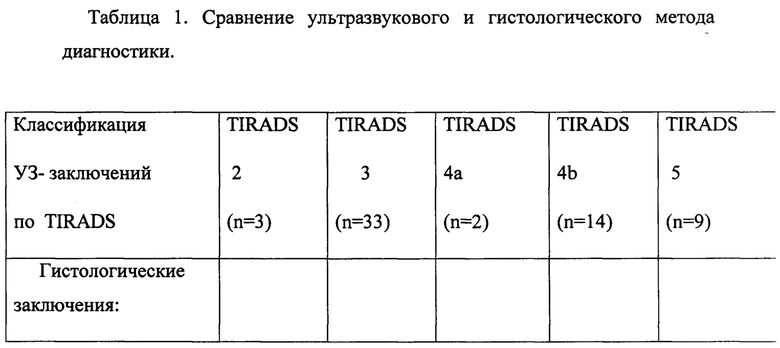
2. Оценка цитологической диагностики
В группе Bethesda II (18 пациентов) у 12 (61,1%) пациентов по ПГИ выявлен доброкачественный процесс, а вот у 6 (38,9%) - злокачественный.
В группе Bethesda IV (27 пациентов) у 15 (55,6%) выявлена злокачественная опухоль. У 12 (44,4%) выявлена фолликулярная аденома. В данной группе у двух пациентов были признаки злокачественного процесса (наличие дооперационного пареза гортани, подтвержденного осмотром ЛОР-врача), однако по ТАПБ диагностирована фолликулярная опухоль.
В группе Bethesda VI у всех 15 пациентов подтверждена злокачественная опухоль. Все данные суммированы в таблице 2.
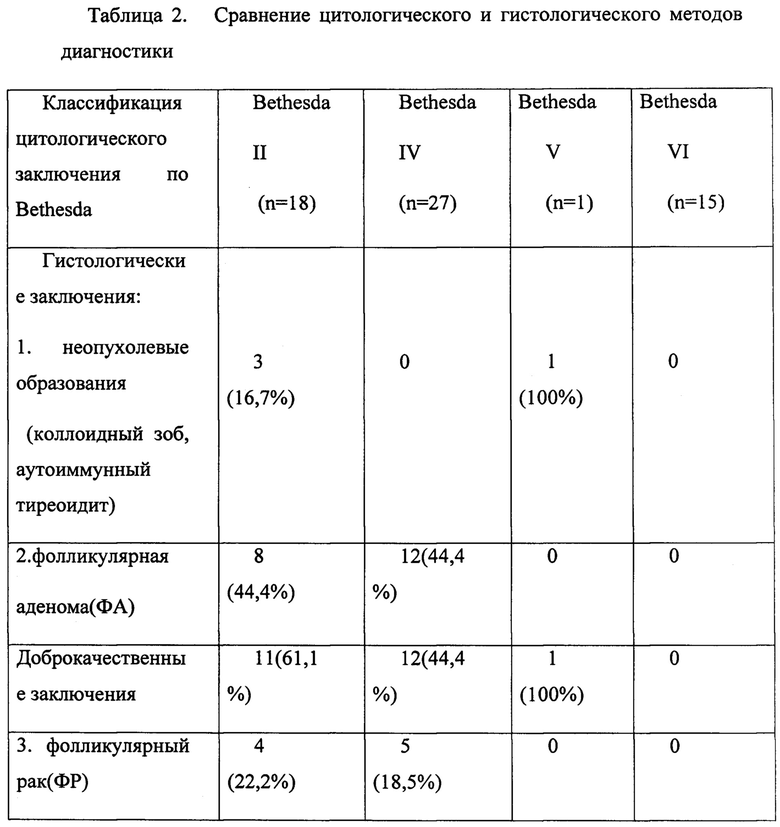
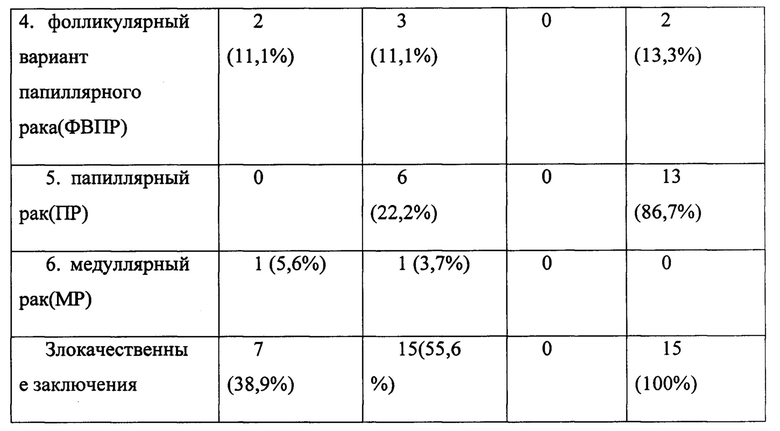
3. Оценка молекулярно-генетического метода диагностики
Во всех исследованиях из группы Beshesda II (6 человек), у которых по ПГИ (патогистологическое исследование) диагностирован злокачественный процесс, по молекулярно-генетическому исследованию так же был диагностирован злокачественный процесс.
Для 6 случаев расхождения результатов молекулярного анализа и ПГИ, было проведено экспертное гистологическое исследование, в результате которого в 3 случаях гистологический диагноз «фолликулярная аденома» был изменен на злокачественный (2 ФВПР и 1 ФР), и 3 случаях патогистологический диагноз не претерпел изменений.
Результаты сравнения молекулярного анализа и ПГИ приведены в таблице 3.
Таблица 3. Сравнение молекулярного анализа и патогистологического исследования.
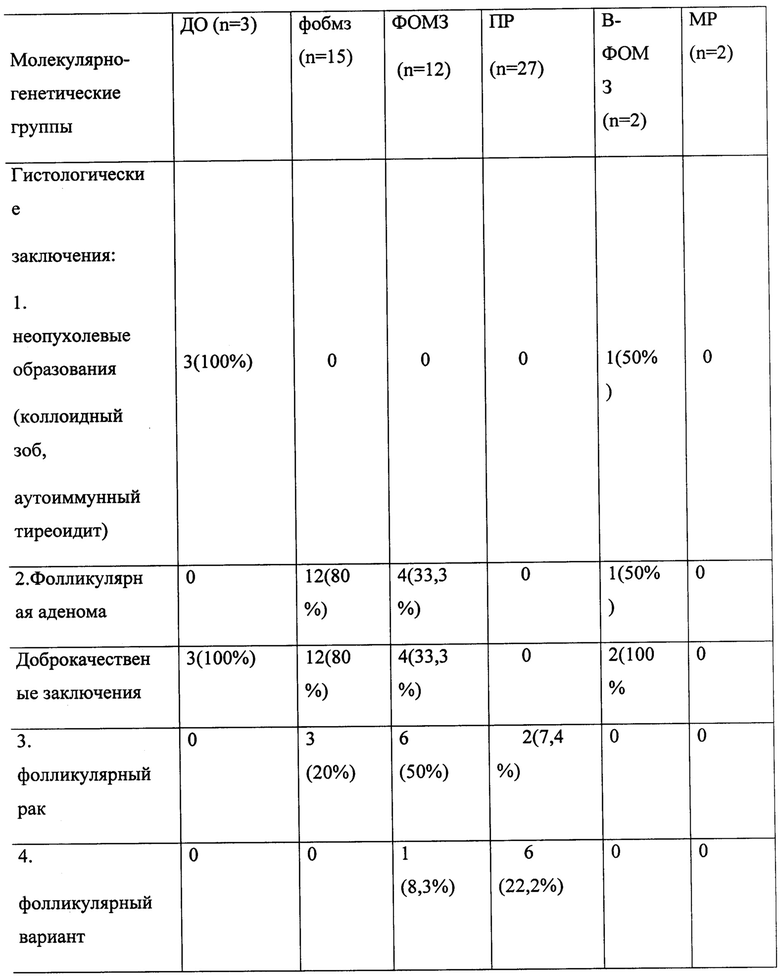

ДО - доброкачественные образования
ФОБМЗ - фолликулярная опухоль без маркеров злокачественности
ФОМЗ - фолликулярная опухоль с маркерами злокачественности.
ПР - папиллярный рак
В-ФОМЗ - В-клеточная опухоль с маркерами злокачественности.
MP - медуллярный рак.
Диагностические характеристики
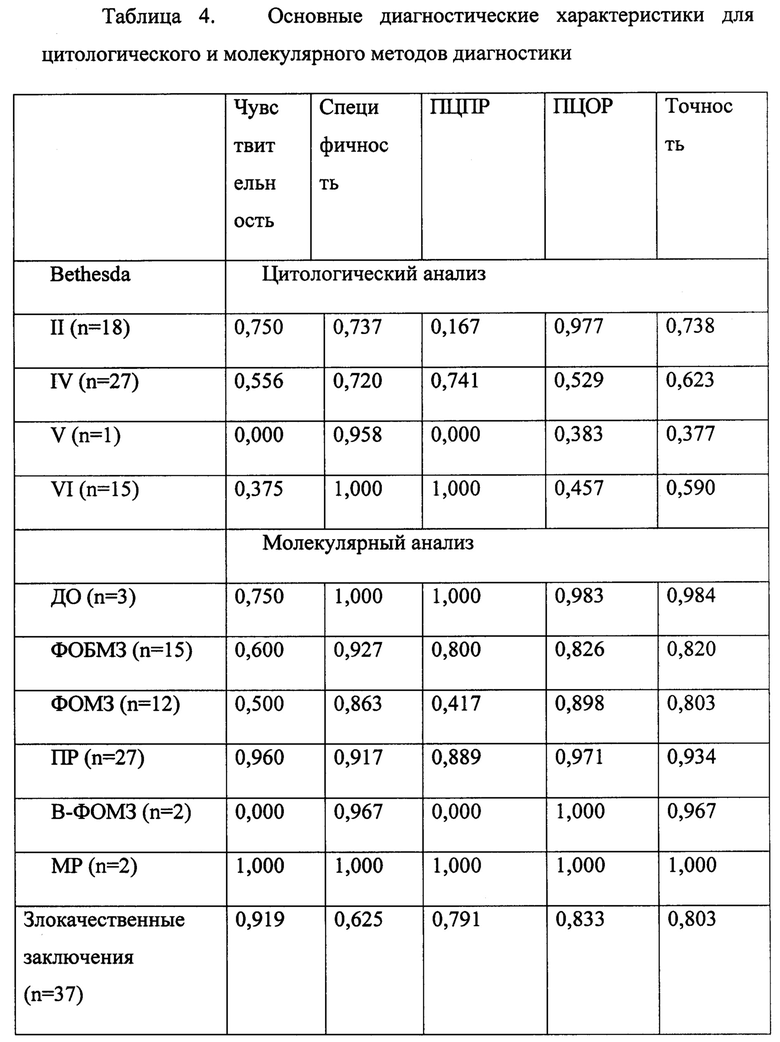
Полученные в ходе исследования данные позволили определить основные диагностические характеристики разных методов: чувствительность, специфичность, предсказательную ценность положительного результата (ПЦПР), предсказательную ценность отрицательного результата (ПЦОР), диагностическую точность. Эти данные для цитологического и молекулярного анализа (с учетом пересмотра 3 результатов ПГИ) приведены в таблице 4.
Так же был проведен молекулярно-генетический анализ материала с цитологических стекол 16 пациентов с лимфаденопатией шеи с цитологически выявленным раком щитовидной железы. Диагностическим критерием для подтверждения метастазирования в лимфоузлы шеи является уровень экспрессии HMGA2. При показателях HMGA2 в лимфоузле более 0,0255, то речь идет о метастазировании папиллярного рака в лимфоузлы шеи, если показатель меньше 0,0255 - нет патологии.
У 6 пациентов, которым была выполнена одномоментная тиреоидэктомия с фасциально-футлярной лимфодиссекцией, молекулярно-генетический анализ подтвердил метастазирование в паравазальные лимфоузлы шеи, диагностированное при цитологическом исследовании. У 1 пациента была обнаружена мутация RET-PTC. У 5 пациентов была выявлена мутация BRAF V600E, что подтверждает более агрессивную форму течения заболевания папиллярного рака с мутацией в гене BRAF. У 5 пациентов подтверждено отсутствие поражения лимфотических узлов.
У 1 пациентки при УЗИ лимфоузлов шеи по поводу рака щитовидной железы были выявлены подозрительные лимфоузлы. При ТАБ подозрительных лимфоузлов шеи исключено поражение паравазальных лимфоузлов. Интраоперационно тиреоидэктомия была расширена до удаления лимфоузлов шеи III группы. Патогистологическое исследование подтвердило метастатическое поражение удаленных лимфоузлов. Молекулярно-генетический анализ подтвердил в лимфоузлах метастазирование с BRAF мутацией.
У 5 пациентов, у которых исключено поражение лимфоузлов шеи по данным ТАБ при молекулярно-генетическом анализе выявлены метастазы в лимфоузлы. Все пациенты были повторно пересмотрены, у 3 пациентов выполнена повторная пункция лимфоузлов, у 2 не выявлена лимфаденопатия. У 1 пациентки подтверждено метастазирование в лимфоузел шеи. Пациентка записана на повторное оперативное лечение. И после оперативного лечения метастазирование в паравазальные лимфоузлы подтвердилось. У остальных поражение лимфоузлов шеи не подтвердилось, так как они все были после радиойодтерапии и вероятнее всего произошла аблация лимфоузлов.
Пациент М., 79 лет, поступил в отделение хирургии с жалобами на осиплость голоса. Ранее пациенту в краевом онкодиспансере выполнили тонкоигольную аспирационную пункционную биопсию (ТАПБ), по результатам которой имеется фолликулярная опухоль. Bethesda IV. Рекомендовано оперативное лечение в общелечебной сети. В клинике при дообследовании (консультация ЛОР-врача) у пациента выявлен парез гортани (что является признаком рака щитовидной железы с инвазией в возвратный гортанный нерв). В клинике так же была выполнена повторная ТАПБ. Результат: фолликулярная опухоль. При выполнении молекулярно-генетического анализа подтверждены признаки папиллярного рака(HMGA 2,7. микроРНК 146b - 9,18). Выполнена тиреоидэктомия. При гистологическом исследовании выявлен папиллярный рак.
Пациентка А, 24 лет, поступила в отделение хирургии с диагнозом многоузловой зоб 2 ст. Шейная лимфаденопатия. По месту жительства выполнена пункционная биопсия узлового образования правой доли щитовидной железы и параваазального лимфоузла справа. Результат: в узле ЩЖ: зоб коллоидный на фоне тиреоидита. Bethesda II. ТАБ лимфоузлов шеи: признаки гиперплазии. В клинике выполнена повторная пункционная биопсия. Результат: узлового образования щитовидной железы: клеточно-коллоидный зоб с лимфоидной инфильтрацией. Besthesda II. ТАБ л/у: элементы лимфоузла. При выполнении молекулярно-генетического исследования: в материале из узла щитовидной железы: папиллярная карцинома (HMGA 1.61, микроРНК 146b - 15,00). В лимфоузле: метастаз папиллярной карциномы(HMGA-1,5052, микроРНК 146b - 7.34). Пациентке выполнено оперативное лечение: тиреоидэктомия, центральная лимфаденэктомия, фасциально-футлярная лимфодиссекция. По данным патогистологического исследования подтвержден папиллярный рак в правой доли щитовидной железы с метастазированием в центральные и паравазальные лимфоузлы шеи справа.
Пациентка К, 24 лет, поступила в отделение хирургии с диагнозом узловой зоб 1 ст. Узел правой доли. Выполнена пункционная биопсия узлового образования правой доли щитовидной железы. Результат: клеточно-коллоидный зоб. Bethesda II. По данным УЗИ щитовидной железы узловое образование 9 мм, подозрительные признаки опухолевого поражения. При выполнении молекулярно-генетического исследования: в материале из узла щитовидной железы: папиллярная карцинома, фолликулярный вариант (HMGA 0.62, микроРНК 146b - 3.42). С учетом отсутствия BRAF мутации, размеров опухоли, фолликулярного варианта степень биологической агрессивности опухоли минимален, выполнена гемитиреоидэктомия. По данным патогистологического исследования подтвержден фолликулярный вариант папиллярного рака.
Пациент Д, 47 лет, поступил в отделение хирургии с диагнозом узловой зоб 1 ст. Узел правой доли. Выполнена пункционная биопсия узлового образования правой доли щитовидной железы. Результат: коллоидный зоб с лимфоидной инфильтрацией. Bethesda II. По данным УЗИ щитовидной железы узловое образование 6*5*5 мм, подозрительные признаки опухолевого поражения. При выполнении молекулярно-генетического исследования: фолликулярная опухоль с признаками злокачественности: (микроРНК221: 1.92, микроРНК375: -4.59). С учетом отсутствия BRAF мутации, размеров опухоли выполнена гемитиреоидэктомия. По данным патогистологического исследования: фолликулярный вариант папиллярного рака.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ дифференциальной диагностики узловых образований щитовидной железы человека | 2021 |
|
RU2757347C1 |
| Способ оценки риска наличия рака щитовидной железы у пациентов с синдромом узлового зоба | 2023 |
|
RU2814933C1 |
| Способ дооперационной диагностики медуллярного рака щитовидной железы | 2023 |
|
RU2819521C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2014 |
|
RU2569154C1 |
| Способ комплексной дооперационной дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы | 2022 |
|
RU2805941C1 |
| Способ дооперационной дифференциальной диагностики анапластического рака щитовидной железы | 2021 |
|
RU2759128C1 |
| Способ дооперационной дифференциальной диагностики доброкачественных и злокачественных узловых образований щитовидной железы | 2021 |
|
RU2783304C1 |
| Способ определения риска развития папиллярного рака щитовидной железы | 2023 |
|
RU2807880C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2014 |
|
RU2548773C1 |
| СПОСОБ ДИАГНОСТИКИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2023 |
|
RU2820815C1 |
Изобретение относится к медицине, а именно к эндокринной хирургии, и может быть использовано для дифференциальной диагностики новообразований щитовидной железы (ЩЖ). Выполняют УЗИ щитовидной железы, выявляют узловые образования щитовидной железы. Проводят пункционную биопсию, последующее цитологическое исследование пунктата. При неопределенных цитологических заключениях выполняют молекулярно-генетическое исследование, при котором предварительно высушенный цитологический препарат с цитологических стекол смывают 200 мкл лизирующего буфера. Далее производят выделение ДНК и микроРНК из цитологических препаратов тонкоигольной аспирационной пункционной биопсии (ТАПБ) новообразований ЩЖ с помощью наборов для выделения. Производят детекцию и количественную оценку диагностически значимых микроРНК, основанную на методе полимеразной цепной реакции (ПЦР) с флуоресцентной регистрацией результата анализов в реальном времени с помощью термоциклера CFX96(Bio-Rad Laboratories, США). При условии показателей HMGA2 более 0,09, микроРНК 221 более 0,0105 и микроРНК 375 более -12,1213, определяют фолликулярную опухоль с признаками злокачественности. При условии показателей микроРНК-146b более 0,1721, определяют папиллярный рак. При показателях миРНК-375 более 5,2514, определяют медуллярный рак. Показатель соотношения митохондриальной ДНК/ядерной ДНК более 5716,3013 определяет В-клеточный рак. Наличие мутации V600 в гене BRAF определяет папиллярный рак и является риском наличия высокой биологической агрессивности данного папиллярного рака и распространенного процесса. Способ обеспечивает сокращение количества необоснованных хирургических вмешательств, которые могут привести к значительному снижению качества жизни за счет наличия специфических послеоперационных осложнений (парез гортани около 4-6% в специализированных учреждениях, до 20% в хирургических учреждениях общего профиля, послеоперационный гипопаратиреоз 4-30%, который может привести к стойким необратимым изменениям костной ткани) за счет повышения достоверности верификации опухолевых поражений щитовидной железы методами молекулярно-генетической диагностики. 4 табл., 4 пр.
Способ дифференциальной диагностики новообразований щитовидной железы (ЩЖ), включающий выполнение УЗИ щитовидной железы, выявление узловых образований щитовидной железы, пункционную биопсию, последующее цитологическое исследование пунктата, отличающийся тем, что при неопределенных цитологических заключениях выполняют молекулярно-генетическое исследование, при котором предварительно высушенный цитологический препарат с цитологических стекол смывают 200 мкл лизирующего буфера, далее производят выделение ДНК и микроРНК из цитологических препаратов тонкоигольной аспирационной пункционной биопсии (ТАПБ) новообразований ЩЖ с помощью наборов для выделения, производят детекцию и количественную оценку диагностически значимых микроРНК, основанную на методе полимеразной цепной реакции (ПЦР) с флуоресцентной регистрацией результата анализов в реальном времени с помощью термоциклера CFX96 (Bio-Rad Laboratories, США) и при условии показателей HMGA2 более 0.09, микроРНК 221 более 0,0105 и микроРНК 375 более -12,1213, определяют фолликулярную опухоль с признаками злокачественности, при условии показателей микроРНК-146b более 0.1721, определяют папиллярный рак, при показателях миРНК-375 более 5.2514, определяют медуллярный рак, а показатель соотношения митохондриальной ДНК/ядерной ДНК более 5716,3013 - В-клеточный рак, наличие мутации V600 в гене BRAF папиллярный рак и является риском наличия высокой биологической агрессивности данного папиллярного рака и распространенного процесса.
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2014 |
|
RU2569154C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ ДОБРОКАЧЕСТВЕННЫХ И ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ ЩИТОВИДНОЙ ЖЕЛЕЗЫ ЧЕЛОВЕКА | 2014 |
|
RU2548773C1 |
| Фонарь для кинопроекционного аппарата | 1930 |
|
SU23086A1 |
| WO 2015071876 A2, 21.05.2015 | |||
| CN 105950730 A, 21.09.2016 | |||
| WO 2013066678 A1, 10.05.2013 | |||
| SURESH R | |||
| et al | |||
| Differential Expression of MicroRNAs in Papillary Thyroid Carcinoma and Their Role in Racial Disparity | |||
| J Cancer Sci Ther | |||
| Устройство для закрепления лыж на раме мотоциклов и велосипедов взамен переднего колеса | 1924 |
|
SU2015A1 |
Авторы
Даты
2019-11-06—Публикация
2019-04-10—Подача