Изобретение относится к области молекулярной биотехнологии и касается Т-лимфоцитов, имеющих новый рецептор.
В процессе иммунного ответа на антигены бактерий, вирусов и опухолей в организме формируется популяция клеток памяти - лимфоцитов, способных к ускоренному и усиленному ответу на тот же антиген, введенный повторно. Встреча организма с антигеном ведет к дифференцировке наивных Т-лимфоцитов в эффекторные клетки, а затем в клетки памяти. Это пул клеток, составляющий около 5% от общего количества лимфоцитов, способных длительно персистировать и осуществлять эффективный иммунный ответ при повторной встрече организма с антигеном (Rocha В., 1997; Jacob J. et al., 1997, Rocha В., 1999, Murali K. K. et al., 1998). Все известные методы вакцинации основаны на возникновении клеток памяти.
Специфическое узнавание антигена Т-лимфоцитами происходит благодаря наличию Т-клеточного рецептора (ТКР). ТКР состоит из альфа и бета цепей, которые являются уникальными для каждого клона Т-лимфоцитов. Пул Т-лимфоцитов организма представляет собой смесь клеток, на поверхности каждой из которых присутствует своя уникальная комбинация альфа и бета цепей ТКР, которая передается ее потомкам, образующимся в результате деления (клонам).
Получение Т-лимфоцитов в лабораторных условиях с ТКР нужной специфичности происходит в несколько этапов:
1. Проведение Т-клеточного клонирования. В пуле Т-лимфоцитов индуцируют размножение отдельных клеток с нужной специфичностью ТКР путем добавления к ним специфического антигена. Чтобы получить достаточное количество таких клеток, проводят несколько раундов рестимуляции их пролиферации специфическим антигеном. В результате получают необходимое количество Т-лимфоцитов, несущих ту же комбинацию альфа и бета цепей ТКР, что и исходная клетка (клон). Данная процедура требует значительных временных и технических затрат, связанных с длительностью роста индивидуальных клонов и необходимостью подбора и обеспечения достаточно сложных (иногда индивидуальных) условий их поддержания и дальнейшего тестирования.
2. Проведение генного клонирования, идентификация и определение нуклеотидных последовательностей альфа и бета цепей каждого клона Т-лимфоцитов. Полученные генетические последовательности при помощи экспрессионных векторов вводят в активированные Т-лимфоциты, в результате чего их потомки приобретают способность к экспрессии ТКР с новой заданной специфичностью. (Robbins PF, Morgan RA, Feldman SA, Yang JC, Sherry RM, Dudley ME, Wunderlich JR, Nahvi AV, Helman LJ, Mackall CL, Kammula US, Hughes MS, Restifo NP, Raffeld M, Lee CC, Levy CL, Li YF, El-Gamil M, Schwarz SL, Laurencot C, Rosenberg SA. Tumor regression in patients with metastatic synovial cell sarcoma and melanoma using genetically engineered lymphocytes reactive with NY-ESO-l.J Clin Oncol. 2011 Mar 1;29(7):917-24.; Blankenstein T, Leisegang M, Uckert W, Schreiber H. Targeting cancer-specific mutations by T cell receptor gene therapy. Curr Opin Immunol. 2015;33:112-9).
Ранее мы обнаружили, что среди пула Т-лимфоцитов присутствуют Т-лимфоциты, специфичность которых к нужному антигену определяет только альфа цепь ТКР [Казанский Д.Б. Трансгенные технологии создания иммунологической защиты организма. В сборнике докладов семинара Фонда перспективных исследований «Проблемные вопросы иммунологии», 03 октября 2014 г., Москва, ООО «Б-принт», 2015, С. 17-25.]. Такие ТКР распознают антиген вне зависимости от того, в комбинации с какой бета цепью они присутствуют на мембране Т-лимфоцита. Таким образом, трансгенез альфа цепи ТКР позволяет избежать процедуры клеточного клонирования и отказаться от трансгенного переноса бета цепей при получении ТКР с нужной специфичностью.
В данном способе технология идентификации нужного ТКР сводится к получению библиотек комплементарной ДНК (кДНК) из поликлональных клеток памяти иммунных животных, определению и секвенированию генов биологически активных альфа цепей методом секвенирования нового поколения (NGS-секвенирование). Данный подход позволяет значительно сократить продолжительность поиска и идентификации нужных рецепторов и облегчает техническое выполнение переноса в клеточный геном генетических конструкций благодаря уменьшению их размеров. В качестве одного из подходов для защиты от инфекционных заболеваний были получены трансгенные мыши, все Т-лимфоциты которых экспрессировали только один тип α-цепи ТКР, специфичной к вирусу лимфоцитарного хориоменингита (LCMV) (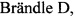 Brduscha-Riem К, Hayday AC, Owen MJ, Hengartner H, Pircher H. T cell development and repertoire of mice expressing a single T cell receptor alpha chain. Eur J Immunol. 1995 Sep;25(9):2650-5).
Brduscha-Riem К, Hayday AC, Owen MJ, Hengartner H, Pircher H. T cell development and repertoire of mice expressing a single T cell receptor alpha chain. Eur J Immunol. 1995 Sep;25(9):2650-5).
Недостаток данного подхода: полученные животные характеризовались резко ограниченным репертуаром ТКР по сравнению с мышами дикого типа, что не позволяло им успешно бороться с вирусом.
Известен подход, направленный на клиническое использование Т-лимфоцитов, трансдуцированных Т-клеточным рецептором (Jin J, Gkitsas N, Fellowes VS, Ren J, Feldman SA, Hinrichs CS, Stroncek DF, Highfill SL. Enhanced clinical-scale manufacturing of TCR transduced T-cells using closed culture system modules. J Transl Med. 2018 24; 16(1): 13).
Недостаток данного подхода: специфичность трансдуцированного Т-клеточного рецептора направлена на противоопухолевые антигены.
Еще один способ терапии трансгенными ТКР - ретровирусная трансдукция Т-лимфоцитов в культуре in vitro с их последующей активацией и получением лимфокинактивированных киллеров (Schendel DJ. Expression of transgenic t cell receptors in lak-T cells. Patent US 20110020308 Al. Priority date: 2006-12-12).
Отличие данного подхода от предлагаемого в использовании полной конфигурации ТКР, состоящей из альфа и бета цепей, и клиническая направленность подхода на лечение опухолей.
В качестве одного из подходов для лечения некоторых раковых заболеваний (меланомы, лейкозов) используют лимфоциты с генетически модифицированным химерным рецептором (CAR) (С.Slaney, B.Scheidt, А. Davenport, P.Beavis, J.Westwood, S.Mardiana, D.Tscharke, S.Ellis, H. M. Prince, J.Trapani, R. Johnstone, M. Smyth, M.Teng, A. Ali, Z.Yu, S. Rosenberg, N. Restifo, P. Neeson, P. Darcy, M.Kershaw. Dual-specific Chimeric Antigen Receptor T Cells and an Indirect Vaccine Eradicate a Variety of Large Solid Tumors in an Immunocompetent, Self-antigen Setting. Clin Cancer Res; 23(10) May 15, 2017; Kershaw MH, Westwood JA, Darcy PK. Gene-engineered T cells for cancertherapy. Nat Rev Cancer 2013;13:525-41.).
Недостаток данного подхода: CAR - это полностью искусственный рецептор, сочетающий элементы Т- и В-клеточных рецепторов. Для изготовления химерного рецептора приходится использовать фрагменты нескольких различных молекул и результирующий белок часто становится иммуногенным [Maus MV, Haas AR, Beatty GL, Albelda SM, Levine BL, Liu X, Zhao Y, Kalos M, June CH. T cells expressing chimeric antigen receptors can cause anaphylaxis in humans. Cancer Immunol Res. 2013 Jul;l(l):26-31. doi: 10.115 8/2326-6066.CIR-13-0006.].
Задачей заявляемого изобретения является: разработка нового способа создания противоинфекционной иммунологической защиты с помощью трансгенеза Т-лимфоцитов.
Задача решается получением Т-лимфоцитов с экспрессией α-цепи ТКР. Трансдукцию Т-лимфоцитов мыши проводили ретровирусными частицами, содержащими ген α-цепи ТКР, специфичного к Salmonella typhimurium (S.typhimurium штамм IV147) или Listeria monocytogenes (L.monocytogenes штамм EGD), с последующим адоптивным переносом модифицированных клеток инфицированным мышам - реципиентам с целью оценки функциональной активности трансдуцированных клеток в системах in vitro и in vivo.
Техническим результатом изобретения является получение индивидуальных трансгенных альфа цепей ТКР, специфичных к патогену S.thyphimurium, L.monocytogenes (представленные последовательностью SEQ ID NO 35-39 и SEQ ID NO 40-41), которые формируют полноценный функциональный ТКР для защиты и лечения инфекционных заболеваний, вызываемых этими патогенами.
Краткое описание чертежей.
На фиг. 1 представлена схема амплификации альфа-цепей. Среди ДНК, выделенной из селезенки иммунизированных мышей, присутствует набор из большого количества разных α-цепей. Используя нуклеотидную последовательность гипервариабельного CDR3 и 5'-конца для каждой альфа-цепи был получен набор праймеров, позволяющих амплифицировать по отдельности три участка гена, а потом их объединить.
На фиг. 2 представлена схема вектора для экспрессии альфа-цепей.
На фиг. 3 представлены результаты проверки корректности собранных конструкций путем аналитической рестрикции альфа-цепей ТКР в MigRl-PGK векторе (на примере α-цепей SM#1 и SM#2).
Сайт AgeI расположен на 5'-конце рамки считывания гена, SalI - на 3'-конце. Кроме того, рамка считывания SM#2 содержит дополнительный сайт SalI в 367-й позиции. Два сайта BamHI расположены на 5' и 3' концах PGK промотора. Рамки считывания обеих цепей SM#1 и SM#2 содержат по два сайта Ncol в 184й позиции и 530й (536й) позиции.
Таким образом, рестрикция по AgeI и SalI должна была дать один фрагмент длиной ~830 п. о. для SM#1 и два фрагмента для SM#2: ~370 и -480 п. о. Кроме того, в обоих случаях должна наблюдаться полоса, соответствующая оставшемуся вектору, длиной 5358 п.о.
Рестрикция по BamHI и NcoI должна давать три относительно коротких фрагмента: ~550 п. о., соответствующую PGK промотору, ~350 п.о., соответствующую средней части рамки считывания, и ~180 п.о. Кроме того, в обоих случаях должна наблюдаться полоса, соответствующая оставшемуся вектору, длиной ~4800 п.о.
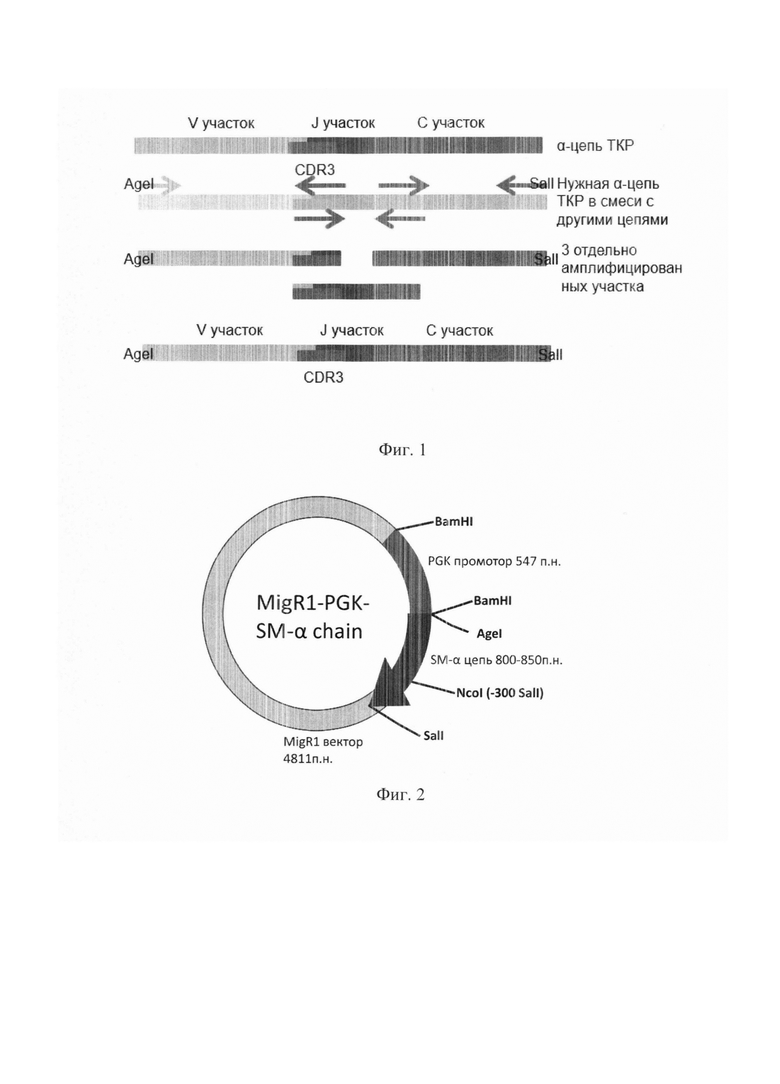
На фиг. 4 представлены результаты оценки функциональной активности in vitro Т-лимфоцитов, трансдуцированных альфа-цепями SM-1, SM14, SM16, SM20, SM21 ТКР, специфичных к S.typhimurium.
Фоновая пролиферация Т-лимфоцитов, трансдуцированных генетической конструкцией, несущей GFP или альфа-цепь ТКР (незакрашенные столбики). Пролиферация Т-лимфоцитов, трансдуцированных генетической конструкцией, несущей GFP или альфа-цепь ТКР, при их культивировании с антигенпрезентирующими клетками в присутствии специфического антигена (закрашенные столбики). По оси ординат показано количество импульсов в минуту (СРМ).
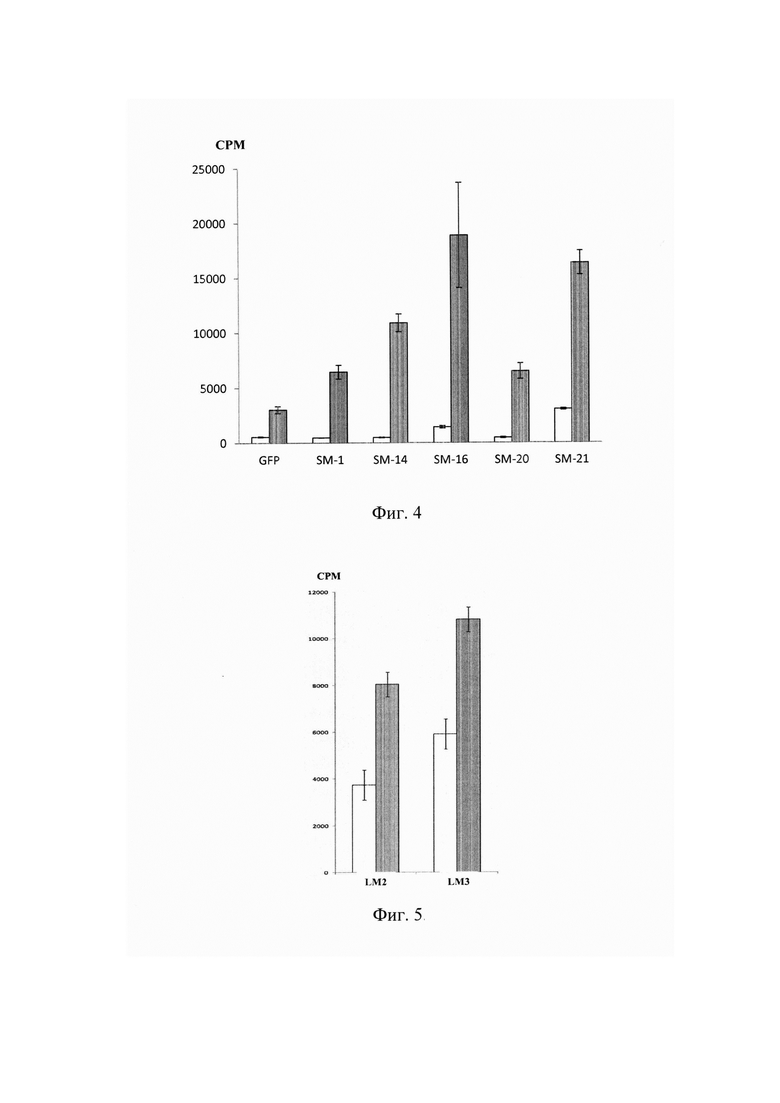
На фиг. 5 представлена оценка функциональной активности in vitro Т-лимфоцитов, трансдуцированных альфа-цепями ТКР LM2 и LM3, специфичными к L.monocytogenes.
Пролиферация Т-лимфоцитов, трансдуцированных генетической конструкцией альфа цепей ТКР LM2 или LM3, при их культивировании со спленоцитами интактных мышей в отсутствии (незакрашенные столбики) или в присутствии (закрашенные столбики) специфического антигена. По оси ординат показано количество импульсов в минуту (СРМ).
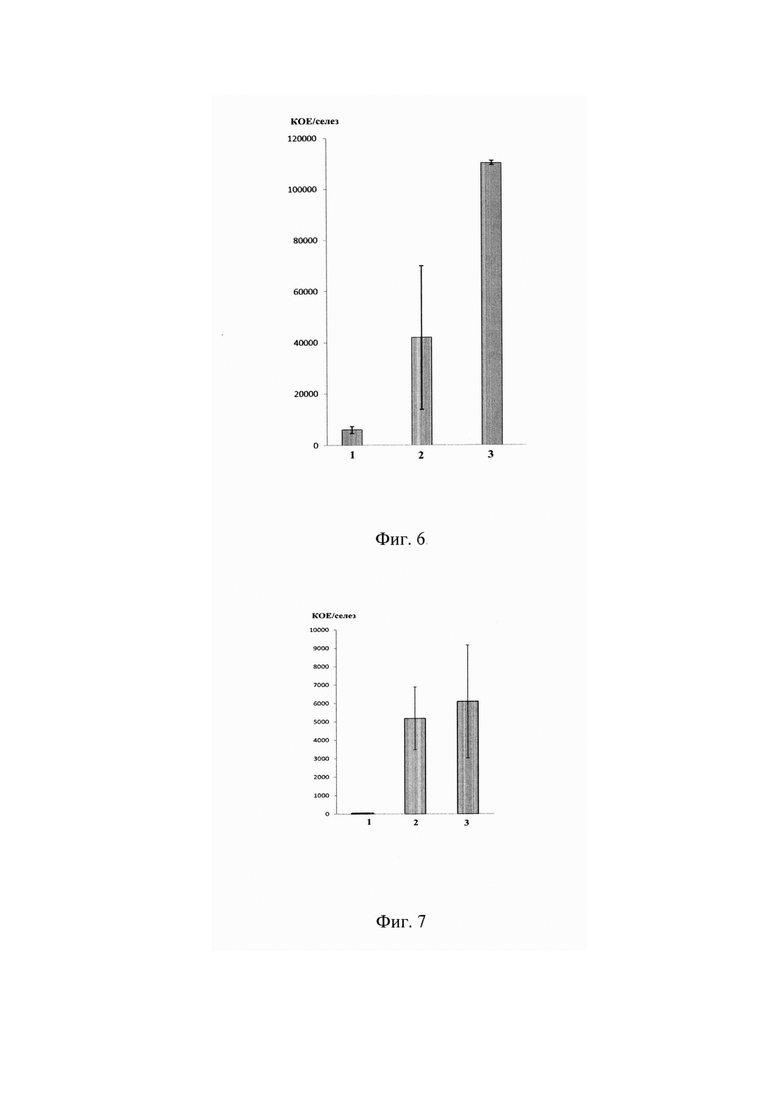
На фиг. 6 представлена оценка функциональной активности in vivo Т-лимфоцитов, трансдуцированных альфа-цепями SM-1, SM14, SM20 ТКР, специфичных к S.typhimurium (профилактический эффект, при котором Т-лимфоциты вводили в мышь до заражения бактериями).
По оси абсцисс показано: 1 - мыши с адоптивно перенесенными трансдуцированными Т-лимфоцитами и зараженные S.typhimurium.
2 - мыши с адоптивно перенесенными нетрансдуцированными (активированными) Т-лимфоцитами и зараженные S.typhimurium, 3 - мыши без адоптивно перенесенных Т-лимфоцитов, зараженные S.typhimurium.
По оси ординат показано количество бактериальных колоний, высеянных из селезенки мыши.
На фиг. 7 представлена оценка функциональной активности in vivo Т-лимфоцитов, трансдуцированных альфа-цепями SM-16, SM21 ТКР, специфичных к S.typhimurium (терапевтический эффект, при котором Т-лимфоциты вводили в мышь после заражения бактериями). По оси абсцисс показано: 1 - мыши, зараженные S.typhimurium и обработанные трансдуцированными Т-лимфоцитами. 2 - мыши, зараженные S.typhimurium и обработанные нетрансдуцированными (активированными) Т-лимфоцитами.
3 - мыши, зараженные S.typhimurium и не обработанные Т-лимфоцитами. По оси ординат показано количество бактериальных колоний, высеянных из селезенки мыши.
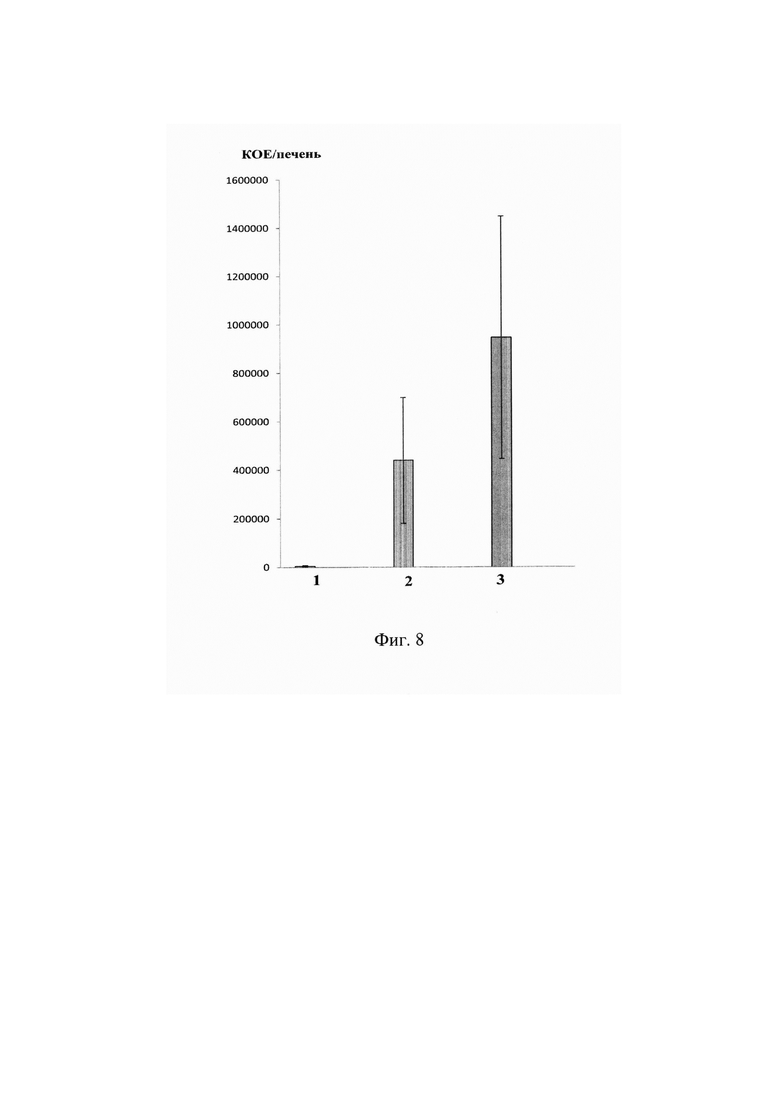
На фиг. 8 представлено количество L. monocytogenes в селезенках мышей R101 с адоптивно перенесенными Т-клетками, трансдуцированными смесью альфа-цепей ТКР (LM2 и LM3, профилактический эффект).
По оси абсцисс показано: 1- мыши, зараженные L. monocytogenes и обработанные трансдуцированными Т-лимфоцитами. 2 - мыши, зараженные L.monocytogenes и обработанные нетрансдуцированными (активированными) Т-лимфоцитами. 3 - мыши, зараженные L.monocytogenes и не обработанные Т-лимфоцитами.
По оси ординат показано количество бактериальных колоний, высеянных из печени зараженных мышей.
Способ осуществляется следующим образом. Клетки памяти, специфичные к патогену S.typhimurium или L.monocytogenes, обогащали путем рестимуляции in vitro в культуре с соответствующей убитой прогреванием бактерией. Все использованные штаммы бактерий были получены из коллекции Национального исследовательского центра эпидемиологии и микробиологии имени почетного академика Н. Ф. Гамалеи. По окончании рестимуляции клетки помещали в реагент, например, TRIzol (ThermoFisher Scientific, США) для выделения тотальной матричной РНК (мРНК). Далее методом полимеразной цепной реакции с обратной транскрипцией (ОТ ПЦР) проводили синтез комплементарной ДНК (кДНК). Полученную кДНК секвенировали и формировали библиотеки, которые содержали последовательности V- и J-сегментов альфа-цепей ТКР, специфичных к патогенам (Фиг. 1). Затем методом ПЦР амплифицировали полноразмерную кДНК α-цепи ТКР, специфичного к патогену, которую затем клонировали в ретровирусный вектор MigR1, содержащий промотор PGK (Фиг. 2). Данной генетической конструкцией вместе со вспомогательной плазмидой pCLeco проводили трансфекцию клеток пакующей линии НЕК293Т и получали ретровирусные частицы, содержащие ген α-цепи ТКР. Полученные ретровирусные частицы использовали для трансдукции активированных лимфоцитов мыши путем спинокуляции при 2000×g в течение 90 мин. Функциональную активность Т-лимфоцитов, трансдуцированных α-цепью ТКР, тестировали в системах in vitro по усилению пролиферативного ответа в присутствии специфического патогена и in vivo по динамике элиминации соответствующего возбудителя из организма зараженных мышей.
1. Получение и обогащение клеток памяти мышей B10.D2(R101) к S.typhimurium. Мышей B10D2(R101) иммунизировали клетками S.typhimurium (авирулентный штамм «274» - в дозе 1×106 КОЕ/мышь. Через 21 день у животных развивалась иммунологическая память к антигенам данной бактерии. Для обогащения пула специфичных Т-клеток памяти проводили стимуляцию in vitro тотальной популяции спленоцитов иммунных мышей инактивированными (прогретыми при 60°С в течение 60 мин) бактериями вирулентного штамма S.typhimurium (штамм IV 147).
Для этого к клеткам селезенки добавляли инактивированные клетки культуры S.typhimurium в количестве 2,0×106 КОЕ и инкубировали при 37°С в атмосфере с 5% СО2 и абсолютной влажностью в течение 72 часов. Затем в культуру дополнительно вносили 2,0×105 КОЕ инактивированных клеток культуры S.typhimurium и инкубировали в течение еще 72 часов. Общая продолжительность рестимуляции in vitro составила 144 часа. В качестве контроля использовали клетки селезенки иммунизированных мышей, которые культивировали в отсутствии бактерий. По окончании времени культивирования отбирали 0,5-1×106 клеток и помещали в 1 мл реагента, например, TRIzol (ThermoFisher Scientific, США) для выделения РНК.
2. Получение и обогащение клеток памяти у мышей B10.D2(R101) к L.monocytogenes. Самок мышей линии B10D2(R101) массой 16-18 грамм внутрибрюшинно иммунизировали клетками L.monocytogenes (штамм EGD). Формирование клеток памяти происходило через 45 дней после введения патогена. Для обогащения пула специфичных Т-клеток памяти проводили стимуляцию in vitro спленоцитов иммунных мышей инактивированными (прогретыми при 74°С в течение 90 мин) клетками L.monocytogenes. Для этого к клеткам селезенки добавляли инактивированные клетки L.monocytogenes в количестве 3,0×107 КОЕ и инкубировали в питательной среде RPMI 1640, например, фирмы ПанЭко, Россия, с добавлением 10% сыворотки эмбрионов крупного рогатого скота, например, ПанЭко, Россия, 5×10-5М 2-меркаптоэтанола, например, фирмы Merck, США, 2 мМ L-глютамина, например, фирмы Sigma, США, 20 мМ HEPES, например, фирмы ПанЭко, Россия и 10 мкг/мл ципрофлоксацина, например, фирмы (KRK, Словения) (ПС) при 37°С в течение 72 часов в атмосфере с 5% CO2 и абсолютной влажности. В качестве контроля использовали клетки селезенки иммунизированных мышей, которые культивировали в отсутствии бактерий. По окончании стимуляции in vitro отбирали 0,5-1×106 клеток для выделения РНК.
3. Создание библиотек кДНК альфа-цепей ТКР, специфичных к патогенам.
1) Получение тотальной РНК клеток памяти мышей, иммунных к патогенам.
Выделение РНК проводили при помощи реагента, например, TRIzol (ThermoFisher Scientific, США) по стандартному протоколу производителя. Полученную РНК растворяли в стерильной воде и определяли концентрацию на спектрофотометре, например, NanoDrop 2000 (Thermo Scientific, США). Образцы выделенной РЕПС хранили при -70°С.
2) Получение кДНК клеток памяти мышей, иммунных к патогенам. Синтез кДНК проводили с использованием праймеров для синтеза кДНК α- и β-цепей ТКР и SMARTNNNa-адаптера, который содержал уникальную последовательность из 12 вырожденных нуклеотидов (SEQ ID NO: 4-6; Е. Egorov, Е. Merzlyak, A. Shelenkov, О. Britanova, G. Sharonov, D. Staroverov, D. Bolotin, A. Davydov, E. Barsova, Y.Lebedev, M. Shugay, D. Chudakov. Quantitative Profiling of Immune Repertoires for Minor Lymphocyte Counts Using Unique Molecular Identifiers. - The Journal of Immunology, 2015).
3) Амплификация кДНК альфа- и бета-цепей ТКР, специфичных к патогенам.
ПЦР проводили в два последовательных этапа (Е. Egorov, Е. Merzlyak, A. Shelenkov, О. Britanova, G. Sharonov, D. Staroverov, D. Bolotin, A. Davydov, E. Barsova, Y.Lebedev, M. Shugay, D. Chudakov. Quantitative Profiling of Immune Repertoires for Minor Lymphocyte Counts Using Unique Molecular Identifiers. - The Journal of Immunology, 2015).
Для первого этапа ПЦР использовали продукт реакции обратной транскрипции в качестве матрицы и смесь прямых адаптерных праймеров (SEQ ID NO: 7-8) для быстрой амплификации концевых фрагментов с целевых транскриптов и обратных праймеров для амплификации α- и β-цепей ТКР (SEQ ID NO: 9-10). ПЦР проводили в течение 18 циклов при температурном режиме: 95°С - 10 секунд; 60°С - 20 секунд; 72°С - 40 секунд. Продукты первого этапа ПЦР очищали и использовали в качестве матрицы для второго этапа ПЦР.
Второй этап ПЦР проводили при помощи праймеров с уникальной нуклеотидной последовательностью на 5'-конце («штрих-код»). В результате каждый продукт второго раунда амплификации содержал известную нуклеотидную последовательность на 5'- и 3'-концах. ПЦР проводили в течение 10-12 циклов при температурном режиме: 95°С - 10 секунд; 60°С - 20 секунд; 72°С - 40 секунд.
4) Очистка продуктов ПЦР.
Продукты первого и второго этапов ПЦР очищали при помощи набора, например, QIAquick PCR purification kit (Qiagen, Германия) по стандартному протоколу производителя.
5) Секвенирование полученных образцов кДНК проводили методом NGS-секвенирования на базе Центрально-Европейского технологического института (Масариков университет, Брно, Чехия). Перед секвенированием к продуктам второй амплификации присоединяли путем лигирования TrueSeq-адаптеры (Illumina, США) с помощью набора реактивов, например, DNA sample prep kit (Illumina, США) по стандартному протоколу производителя. Секвенирование проводили на секвенаторе, например, MiSeq (Illumina, США). Для выполнения цикла секвенирования использовали одноразовый комплект реактивов, например, MiSeq Reagent Kit v2 (Illumina, США), позволяющий провести прочтение фрагментов кДНК длиной 150 п.н., с 5' и 3'-концов одной молекулы ДНК.
6) Биоинформатическую обработку данных, полученных в результате секвенирования, выполняли при помощи программных обеспечений MiGEC (http://milaboratory.com), MiXCR (http://milaboratory.com), MiTCR (D.Bolotin, M. Shugay, I.Mamedov, E.Putintseva, M.Turchaninova, I.Zvyagin, O. Britanova, D. Chudakov. MiTCR: software for T-cell receptor sequencing data analysis. - Nature Methods 10, 813-814 (2013)).
На первом этапе с помощью программного обеспечения MiGEC (http://milaboratory.com) выделяли данные, относящиеся к отдельным библиотекам. Для этого в сиквенсе каждой молекулы ДНК анализировали пары штрих-кодов, которые входили в состав праймеров и были уникальны для каждого отдельного образца кДНК. Далее с помощью молекулярного штрихкодирования индивидуальных молекул кДНК проводили первичную коррекцию ошибок, которые могли появиться в процессе прохождения ПЦР и/или секвенирования. Для этого в качестве штрих-кода использовали последовательность, состоящую из 12 вырожденных нуклеотидов, встроенных в SmartNNNa-адаптер. Таким образом, участок 5'-конца каждой полученной молекулы кДНК был представлен уникальной последовательностью. Использование такого молекулярного штрих-кода дает возможность нормировать данные для полученных образцов, то есть произвольно выбирать и проводить количественный анализ молекулярных событий.
Для последующих процедур обработки данных использовали программу MiXCR (http://milaboratory.com). После разделения данных по библиотекам в каждой последовательности устанавливали гипервариабельный участок CDR3, определяемый как участок от последнего консервативного цистеина в V-сегменте до первого консервативного фенилаланина в мотиве FGXG J-сегмента. Кроме того, определяли границы V, J и D-сегментов для β-цепей и V- и J-сегментов для α-цепей путем выравнивания с геномными последовательностями при помощи программного обеспечения MiTCR (D.Bolotin, М. Shugay, I. Mamedov, E. Putintseva, M. Turchaninova, I. Zvyagin, O. Britanova, D. Chudakov. MiTCR: software for T-cell receptor sequencing data analysis. - Nature Methods 10, 813- 814(2013)).
Далее одинаковые нуклеотидные последовательности с высоким качеством секвенирования, т.е. с частотой ошибок не более 1:10000 прочтенных нуклеотидов, объединяли в один клон, при этом сохраняли информацию о числе объединенных последовательностей. Последовательности с низким качеством прочтения присоединяли к последовательностям с высоким, при этом допускалось несколько несовпадений по нуклеотидам. Прочтения низкого качества удаляли, если не находили сходных с ними последовательностей высокого качества.
После формирования клонов осуществляли коррекцию ошибок, так как обратная транскрипция и амплификация кДНК в процессе ПЦР могли привести к нуклеотидным заменам и возникновению очень схожих вариантов одной и той же последовательности. Для того чтобы снизить искусственное разнообразие ТКР, объединяли клоны, которые отличались друг от друга на одну нуклеотидную замену в районе CDR3, при этом предполагалось, что число молекул клонов с ошибками в библиотеке как минимум в три раза меньше количества молекул клона, от которого они произошли (D. Bolotin, S. Poslavsky, I.Mitrophanov, M. Shugay, I. Mamedov, E. Putintseva, D. Chudakov. MiXCR: software for comprehensive adaptive immunity profiling. - Nature Methods, 12, 380-381(2015)).
В итоге были сформированы базы данных с полноразмерными последовательностями кДНК α- и β-цепей ТКР клонов клеток памяти, специфичных к патогенам S.typhimurium и L.monocytogenes.
Анализ α-цепей ТКР клонов клеток памяти, специфичных к S.typhimurium или L.monocytogenes, проводили в программе Exel (Microsoft Office, США). Для этого сравнивали пул клеток памяти, сформированный при иммунизации животных патогеном, с клонами, образованными при стимуляции клеток памяти in vitro. В результате анализа последовательностей самых распространенных клонов было установлено, что реактивация клеток памяти in vitro специфичным патогеном привела к их обогащению. Было выявлено два типа клонов обогащенных клеток памяти: 1) клоны, частота которых увеличилась по сравнению с неактивированным пулом клеток памяти; 2) клоны, уникальные для обогащенного пула клеток памяти и отсутствующие в неактивированном пуле клеток памяти.
Были установлены последовательности гипервариабельных участков (CDR3 регион) α-цепей обоих типов клонов. Последовательности α-цепей ТКР клеток памяти с установленными CDR3 регионами были вставлены в экспрессионные векторы, которые затем использовали для последующей модификации (трансдукции) Т-лимфоцитов мыши.
7. Создание генетических конструкций альфа-цепей ТКР, специфичных к патогенам.
1) Генетическое клонирование альфа-цепей ТКР. Для клонирования α-цепей Т-клеточных рецепторов клеток памяти, специфичных к антигенам бактерии S.typhimurium или L.monocytogenes, были синтезированы праймеры к константному региону α-цепи, общие для всех вариантов клонируемых α-цепей (SEQ ID NO: 1-3). Кроме того, были синтезированы праймеры, уникальные для каждого варианта клонируемой α-цепи (SEQ ID NO: 11-31).
При постановке ПЦР условия для амплификации отдельных V- и J-фрагментов подбирали так, чтобы ПЦР-продукт появлялся, если в качестве исходного материала использовалась мРНК из Т-лимфоцитов иммунизированной патогеном мыши, но не появлялся, если в качестве исходного материала использовалась мРНК из Т-лимфоцитов неиммунизированной мыши. Для синтеза V-фрагментов использовали прямой праймер с сайтом рестрикции AgeI (SEQ ID NO: 11, 14,17, 20, 23, 26, 29) и уникальный обратный праймер (SEQ ID NO: 13, 16, 19, 22, 25, 28, 31). Для синтеза J-фрагмента использовали уникальный прямой праймер (SEQ ID NO: 12,15,18,21,24,27, 30) и обратный праймер к константному региону а-цепи (SEQ ID NO:2). Для всех цепей синтезировали константный С-фрагмент с использованием праймеров C-forw (SEQ ID NO: 1) и C-Sall (SEQ ID NO: 3). В качестве матрицы для синтеза С-фрагмента использовали уже имеющуюся кДНК альфа-цепи ТКР клеток памяти (1D1), специфичных к молекуле гистосовместимости мыши H-2b (SEQ ID NO: 34).
Все фрагменты амплифицировали, анализировали в агарозном геле и выделяли из геля с помощью набора QIAEX II Gel Extraction Kit (Qiagen) в соответствии с инструкциями производителя. Затем в одной ГЩР-смеси объединяли V, J и С сегменты одной цепи и проводили реакцию с прямым праймером с сайтом рестрикции AgeI (SEQ ID NO: 11, 14, 17, 20, 23, 26, 29) для данной цепи и обратным праймером C-Sall (SEQ ID NO:3), (Фиг. 1). Результаты реакции анализировали с помощью гель-электрофореза, фрагмент нужной молекулярной массы вырезали и выделяли с помощью набора QIAEX II Gel Extraction Kit (Qiagen) в соответствии с инструкциями производителя. Затем с помощью Taq-полимеразы производили добавление А-нуклеотидов на 3-штрих концах обеих цепей ДНК к выделенному фрагменту, фрагмент очищали с помощью набора QIA quick PCR Purification Kit (Qiagen) в соответствии с инструкциями производителя и лигировали с pTZ57 вектором (InsTAclone PCR Cloning Kit, ThermoScientific). Лигазную смесь трансформировали в E.coli, трансформированные бактерии высевали на чашку Петри и выращивали при 37°С в течение 16-18 часов. Колонии проверяли на наличие вставки с помощью ПЦР. Колонию, несущую вставку, выращивали в 5 мл среды LB в течение 16-18 часов, после чего выделяли плазмидную ДНК с помощью набора QI Aprep Spin Miniprep Kit (Qiagen) в соответствии с инструкциями производителя. Полученную плазмидную ДНК секвенировали (ООО «Евроген») с использованием праймеров (SEQ ID NO: 32 и 33). Кроме того, для контроля корректности сборки генетической конструкции проводили аналитическую рестрикцию плазмидной ДНК по сайтам рестрикции BamHI и NcoI, а также SalI и AgeI и анализировали ее продукты с помощью гель-электрофореза. При этом получали две полосы: одну, соответствующую последовательности альфа-цепи, и другую, соответствующую последовательности PGK промотора (Фиг. 2). Для каждого варианта альфа-цепи один полностью корректный клон переносили на следующий этап работы. Сиквенсы используемых цепей представлены SEQ ID N0:35-41.
8. Перенос альфа-цепей в экспрессионный вектор.
В качестве экспрессионного вектора был использован созданный нами ретровирусный вектор MigRl-PGK на основе плазмид MigRl (AddgenePlasmid #27490) и pLenti PGK GFP Blast (AddgenePlasmid #19069), в котором экспрессия трансгена находилась под контролем фосфоглицераткиназного (PGK) промотора. Для клонирования рамки считывания трансгена в нем присутствуют сайты AgeI на 5'-конце предполагаемого трансгена и SalI на 3'-конце предполагаемого трансгена. По сайтам SalI и AgeI в ходе препаративной рестрикции вырезали рамку считывания альфа-цепи из корректного клона и соединяли ее с MIGR1-PGK-вектором, приготовленным рестрикцией по тем же сайтам (Фиг. 3).
9. Наработка плазмид для проведения трансфекции и трансдукции. Для наработки плазмид и генетических конструкций использовали компетентные клетки бактерии E.coli (XL 1 blue). ДНК трансформируемой плазмиды в количестве 10 нг смешивали с клетками E.coli, инкубировали на льду 20 мин, затем смесь подвергали тепловому шоку при 42°С в течение 30 сек и снова инкубировали 5 мин во льду. Затем к смеси добавляли 0,5 мл среды LB (AppliChem GmbH, Германия) и инкубировали 30 мин при 37°С.
Далее клетки бактерии наносили в чашку с LB-агаром (AppliChem GmbH, Германия, агар-агар Sigma, США) и инкубировали в термостате при температуре 37°С. Выросшие одиночные колонии переносили в среду LB и культивировали в течение 16-18 ч на термошейкере (150-200 об/мин) при температуре 37°С. Выделение плазмидной ДНК при помощи коммерческих наборов реактивов проводили согласно протоколам производителей -HiSpeed Plasmid MaxiKit (Qiagen, США).
10. Получение трансдуцированных Т-лимфоцитов.
1) Трансфекция клеток линии НЕК293Т и получение среды, содержащей вирусные частицы.
Клетки пакующей линии НЕК293Т выращивали в культуре до достижения конфлюэнтности 60-80% и проводили трансфекцию плазмидами MigRl-PGK-a, содержащей ген исследуемой α-цепи ТКР, и pCl-Есо (в соотношении 1:1) кальций-фосфатным методом в течение 24 часов.
Контроль эффективности трансфекции осуществляли при помощи белка GFP. Для этого параллельно при указанных выше условиях роводили трансфекцию клеток НЕК293Т плазмидами MigRl-PGK-GFP, содержащей ген GFP, и pCL-Eco. Наличие экспрессии белка GFP в клетках НЕК293Т оценивали при помощи флюоресцентного микроскопа (Nikon, Япония). Полученный уровень эффективности трансфекции геном GFP принимали аналогичным и для клеток НЕК293Т, трансфецированных геном с исследуемой α-цепью. Трансфекцию считали успешной, если не менее, чем у 60% клеток пакующей линии наблюдали флюоресценцию белка GFP.
Сбор ростовой среды клеток НЕК293Т проводили через 48 и 72 часа после трансфекции клеток НЕК293Т плазмидами MigR1-PGK-a и рС1-Есо. Полученную таким образом вирус-содержащую среду в свежем виде использовали для трансдукции Т-клеток мыши.
2) Получение лимфоцитов из селезенки и лимфатических узлов мыши. Работу проводили с использованием самцов и самок мышей линии B10.D2(R101) весом 18-20 гр, полученных из разведения ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России. Животных умерщвляли путем цервикальной дислокации и извлекали селезенку и лимфоузлы (мезентериальный, 2 подмышечных и 2 паховых). Селезенку гомогенизировали в гомогенизаторе Поттера и проводили гипотонический лизис эритроцитов. Затем клетки осаждали центрифугированием при 1500 об/мин в течение 5 мин при 4°С, удаляли надосадочную жидкость и ресуспендировали осадок в 3 мл питательной среды RPMI-1640, например, ПанЭко, Россия, содержащей 10 мкг/мл ципрофлоксацина (КRК, Словения).
Лимфатические узлы гомогенизировали описанным выше образом и вносили в суспензию спленоцитов. Полученную смесь клеток осаждали центрифугированием при 1500 об/мин в течение 5 мин при 4°С, удаляли надосадочную жидкость и ресуспендировали в 3 мл ПС. Количество лимфоцитов в суспензии подсчитывали в камере Горяева в присутствии смеси красителей 1% трипанового синего и 1% эозина в соотношении 1:1 и доводили до концентрации 107 кл/мл.
3) Активация Т-лимфоцитов мыши.
Смесь клеток селезенки и лимфатических узлов мыши в количестве 5×107 клеток помещали в 5 мл ПС в культуральные флаконы с площадью роста 25 см2, например, фирмы Costar, США. В ПС дополнительно вносили митоген Т-лимфоцитов конканавалин А (КонА), например, фирмы Sigma, США, до конечной концентрации 1,5-3 мкг/мл и интерлейкин-2 (ИЛ-2) до конечной концентрации 10 МЕ/мл (Neto Е.Н., Coelho A.L., Sampaio A.L. и др. Activation of human T lymphocytes via integrin signaling induced by RGD-disintegrins. Biochim.Biophys. Acta. 2007, 1773(2): 176-84). Лимфоциты культивировали в СО2-инкубаторе при 37°С, 5% СО2 в течение 24 ч. (Neveu P.J., Perdoux D. Polyclonal activation of guinea pig spleen lymphocytes. Int. Arch. Allergy. Appl. Immunol.l985; 78(4):401-405).
4) Трансдукция Т-лимфоцитов мыши вирусными частицами.
Трансдукцию активированных Т-лимфоцитов мыши вирусными частицами, содержащими ген исследуемой α-цепи ТКР, проводили в два этапа.
A) После активации концентрацию лимфоцитов подсчитывали с помощью камеры Горяева в смеси красителей трипанового синего и эозина и переносили в 6-луночный планшет (Costar, США) из расчета 12×106 клеток на лунку в объеме среды 9 мл, из которых 6 мл составляла вирус-содержащая среда роста клеток НЕК293Т и 3 мл ПС. В лунки планшета также вносили КонА (1,5 мкг/мл), ИЛ-2 (10 МЕ/мл) и полибрен до конечной концентрации 8 мкг/мл. Клетки трансдуцировали с помощью спинокуляции, которую проводили путем центрифугирования при 2000 g в течение 90 мин при комнатной температуре. Затем лимфоциты помещали в СО2-инкубатор.
Б) Через 16-20 часов культивирования проводили смену среды роста лимфоцитов на аналогичную и повторно выполняли трансдукцию при тех же параметрах спинокуляции. По окончании второй спинокуляции лимфоциты культивировали в СО2-инкубаторе при 37°С, 5% СО2 в течение 2 часов, после чего проводили замену вирус- содержащей среды на свежую ПС, содержащую ИЛ-2 в указанной выше концентрации, и продолжали культивирование в течение 48 часов при тех же условиях.
B) Оценку уровня трансдукции Т-лимфоцитов проводили методом проточной цитометрии, например, с помощью FacsCantoII, Beckton Dickenson, США, с использованием флуоресцентно меченных антител к молекуле CD3, которая является специфическим маркером Т-лимфоцитов. Уровень трансдукции определяли по экспрессии белка GFP.
Анализ клеток на проточном цитофлуориметре. При анализе на проточном цитофлуориметре исключали слипшиеся и мертвые клетки, окрашенные пропидий йодидом. Среди одиночных живых лимфоцитов определяли Т-лимфоциты по наличию маркера CD3, для которых оценивали уровень экспрессии белка GFP по флуоресценции в области спектра 520 нм. Результаты анализа клеток на проточном цитофлуориметре обрабатывали при помощи программного обеспечения FlowJo (Beckton Dickenson, США). В качестве контроля использовали Т-лимфоциты, активированные аналогичным образом (КонА и Ил-2), но не подвергнутые трансдукции (активированные Т-лимфоциты).
12. Функциональная оценка трансдуцированных Т-лимфоцитов была проведена в системах in vitro и in vivo. Оценку в системе in vitro проводили по усилению пролиферативного ответа трансдуцированных Т-лимфоцитов в ответ на специфический антиген в реакции смешанной культуры лимфоцитов (СКЛ). Уровень трансдукции Т-лимфоцитов составлял 50-80%.
1) Оценка функциональной активности in vitro Т-лимфоцитов, трансдуцированных альфа цепями ТКР, специфичных к S.typhimurium.
В качестве антигенпрезентирующих клеток были использованы макрофаги, предварительно инкубированные с S.typhimurium, и сингенные спленоциты интактных мышей, обработанные цитостатиком.
Подготовка слоя макрофагов. Мышам вводили внутрибрюшинно 3 мл 3% пептона. Через 3 дня животных умерщвляли методом цервикальной дислокации и извлекали клетки из брюшной полости. Для этого в перитонеальную полость мыши вводили 5 мл ледяной среды RPMI-1640 и отбирали 2 мл смыва. Полученный лаваж переносили в пробирку, предварительно помещенную на лед. В полученной суспензии подсчитывали количество клеток так, как описано выше. Клетки разводили ПС до концентрации 1,0×105 клеток/мл и переносили в лунки 96-луночного планшета, например, фирмы Costar, США, из расчета 1,0×104 клеток на 1 лунку. Затем к макрофагам добавляли клетки инактивированной бактерии S.typhimurium (штамм IV 147) из расчета 1,0×105 клеток бактерии на 1 лунку.
Конечный объем среды роста составлял 200 мкл на 1 лунку. Макрофаги с клетками бактерий культивировали в течение 72 часов в CO2-инкубаторе при 37°С, 5% CO2.
Обработка спленоцитов интактных мышей цитостатиком. Клетки селезенки мышей получали и подсчитывали так, как описано выше. Отбирали 30,0×106 клеток селезенки и переносили в 4,5 мл ПС. К полученной суспензии добавляли митомицин С, например, фирмы Kyowa, Япония, в концентрации 25 мкг/мл, тщательно перемешивали и инкубировали на водяной бане при 37°С в течение 30 мин. По окончанию инкубации клетки три раза отмывали в 4 мл ростовой среды RPMI-1640 путем осаждения на центрифуге, например, фирмы Hettich, Германия, при 1500 об/мин в течение 5 мин при 4°С. Надосадочную жидкость удаляли, осадок клеток ресуспендировали в 3 мл ПС, подсчитывали количество клеток так, как описано выше, и доводили концентрацию до 5,0×106 клеток/мл.
Постановка СКЛ. Через 72 ч культивирования макрофагов с клетками S.typhimurium из 96-луночного планшета, например, фирмы Costar, США, удаляли среду роста и в часть лунок, содержащих слой макрофагов, добавляли обработанные цитостатиком спленоциты из расчета 5,0×105 клеток на 1 лунку. Затем в культуру вносили Т-лимфоциты, трансдуцированные конструкциями α-цепей ТКР, белком GFP или контрольные (активированные) Т-лимфоциты из расчета 3,0×105 клеток на 1 лунку. Клетки инкубировали в 200 мкл ПС при 37°С, 5% СО2 в течение 72 ч. За 18 часов до окончания срока культивирования в лунки вносили раствор 3Н-тимидина в количестве 1 мкКи на лунку. Уровень включения метки оценивали на сцинтилляционном счетчике, например, фирмы LKB, Швеция, по количеству регистрируемых импульсов в минуту (СРМ). В процессе тестирования было продемонстрировано специфическое усиление пролиферации лимфоцитов, трансдуцированных а-цепями ТКР SMI, SM14, SM16, SM20, SM21 (Фиг. 4).
2) Оценка функциональной активности in vitro Т-лимфоцитов, трансдуцированных альфа цепями ТКР, специфичных к L.monocytogenes. Функциональную оценку in vitro Т-лимфоцитов, трансдуцированных альфа цепями ТКР, специфичных к L.monocytogenes (LM2 и LM3), проводили при помощи реакции СКЛ.
Постановка СКЛ. В культуру вносили трансдуцированные генами LM2, LM3, GFP или нетрансдуцированные контрольные (активированные) Т-лимфоциты из расчета 7,0×104 клеток/лунку. В качестве антигенпрезентирующих клеток были использованы сингенные спленоциты интактных мышей, обработанные цитостатиком (12×104/лунку), к которым добавляли инактивированные бактерии L.monocytogenes (103-104/лунку). В контрольные лунки бактерии не добавляли. Культивирование клеток проводили в 96-луночном планшете (Costar, США) в ПС с добавлением ИЛ-2 (10 МЕ/мл) при 37°С, 5% СО2 в течение 72 ч. За 8 часов до окончания срока культивирования в лунки вносили раствор 3Н-тимидина в количестве 1 мкКи на лунку. Уровень включения метки оценивали на сцинтилляционном счетчике (LKB, Швеция) по количеству регистрируемых импульсов в минуту (СРМ). В процессе тестирования in vitro было продемонстрировано специфическое усиление пролиферации лимфоцитами, трансдуцированными цепями LM2 и LM3 (Фиг. 5).
3) Функциональная оценка in vivo Т-лимфоцитов, трансдуцированных α-цепями ТКР, специфичными к S.typhimurium.
А) Оценка защитного (профилактического) действия трансдуцированных Т-лимфоцитов.
Мышам линии B10D2(R101) путем внутривенного введения адоптивно переносили смесь Т-лимфоцитов, трансдуцированных альфа-цепями SM1, SM14, SM20, в равных соотношениях по 100×103 каждого типа трансдуцированных клеток при уровне трансдукции 68,5%. Через 3 дня после переноса лимфоцитов энтерогастрально с помощью гаважной иглы проводили заражение животных S.typhimurium в дозе 3,0-5,0×106 КОЕ/мышь. Каждая группа состояла из 3 животных. На 7 сутки после заражения (10 сутки после переноса лимфоцитов) мышей умерщвляли путем цервикальной дислокации, в стерильных условиях проводили вскрытие, извлекали селезенку. Органы гомогенизировали в фосфатно-солевом буфере, готовили серию 10-кратных разведений в фосфатно-солевом буфере и высевали на чашки Петри, покрытые 6,0% SS-агаром (BD, США). Визуальный подсчет колоний производили через 18-24 часа после инкубации чашек Петри при температуре 37°С.
Было показано, что количество сальмонелл снижено в селезенках зараженных мышей, которым предварительно вводили трансдуцированные Т-лимфоциты, по сравнению с контрольными интактными мышами и мышами, которым предварительно вводили нетрансдуцировнные активированные Т-лимфоциты (Фиг. 6).
Б) Оценка терапевтического действия Т-лимфоцитов, трансдуцированных альфа- цепями SM16 и SM21 ТКР, специфичных к S.typhimurium.
Мышей энтерогастрально с помощью гаважной иглы заражали клетками вирулентного штамма S.typhimurium в дозе 6,0×106 КОЕ/мышь. Каждая группа состояла из 5 животных. На 4 сутки после заражения мышам путем внутривенного введения адоптивно переносили смесь Т-лимфоцитов, трансдуцированных альфа-цепями SM16, SM21, в равных соотношениях по 150×103 трансдуцированных клеток каждого типа при уровне трансдукции 63,5% и общем количестве введенных клеток 470×103 клеток/мышь. Через 3 дня после переноса лимфоцитов и на 7 сутки после заражения мышей умерщвляли путем цервикальной дислокации, извлекали селезенку и готовили бактериальные высевы на чашки Петри так, как описано выше. Был показан четкий терапевтический потенциал Т-лимфоцитов, трансдуцированных а-цепями SMI6 и SM21, выраженный в полной эрадикации возбудителя (Фиг. 7).
4) Функциональная оценка in vivo Т-лимфоцитов, трансдуцированных альфа цепью ТКР LM2 и LM3, специфичными к L.monocytogenes.
Оценка профилактического действия трансдуцированных Т-лимфоцитов.
Мышам путем внутривенного введения адоптивно переносили смесь Т-лимфоцитов, трансдуцированных альфа-цепями ТКР LM2 и LM3 (уровень трансдукции 60%) в равных соотношениях по 360×103 клеток при общем количестве введенных клеток 1,2×106/мышь. Через 3 часа после переноса лимфоцитов энтерогастрально с помощью гаважной иглы проводили заражение животных L.monocytogenes в дозе 4,5×106 КОЕ/мышь. Каждая группа состояла из 5 животных. На 5-е сутки после заражения мышей умерщвляли путем цервикальной дислокации, в стерильных условиях проводили вскрытие, извлекали печень и селезенку. Органы гомогенизировали в фосфатно-солевом буфере с помощью гомогенизатора IKA 10Т, готовили серию 10-кратных разведений в фосфатно-солевом буфере и высевали на чашки Петри, содержащие PALCAM-агар (HiMedia). Визуальный подсчет колоний производили через 48 часов после инкубации чашек Петри при температуре 37°С.
Было показано, что количество L.monocytogenes снижено в печени и селезенке мышей, которым предварительно вводили трансгенные Т-лимфоциты по сравнению с контрольными интактными мышами и мышами, которым предварительно вводили нетрансдуцированные активированные Т-лимфоциты (Фиг. 8).
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ создания противоопухолевой иммунологической защиты к клеткам лимфомы EL-4 | 2018 |
|
RU2708558C1 |
| Линия мышей, трансгенных по альфа-цепи Т-клеточного рецептора клеток памяти, для изучения их функциональной активности | 2017 |
|
RU2691484C2 |
| ГЕНЫ РЕЦЕПТОРОВ АНТИГЕНСПЕЦИФИЧНЫХ ХЕЛПЕРНЫХ Т-КЛЕТОК | 2013 |
|
RU2680588C2 |
| СПОСОБ ПОЛУЧЕНИЯ КЛЕТОК, ЭКСПРЕССИРУЮЩИХ Т-КЛЕТОЧНЫЙ РЕЦЕПТОР | 2013 |
|
RU2665548C2 |
| Однодоменное антитело ламы Н5 и его производное H5-Fc, специфически связывающие RBD-домен S-белка вируса SARS-CoV-2, обладающие вируснейтрализующей активностью | 2022 |
|
RU2793967C1 |
| СПОСОБ И КОМПОЗИЦИИ ДЛЯ КЛЕТОЧНОЙ ИММУНОТЕРАПИИ | 2013 |
|
RU2700765C2 |
| КОМПОЗИЦИИ И СПОСОБЫ ДЛЯ ЛЕЧЕНИЯ ГЕМОГЛОБИНОПАТИЙ | 2015 |
|
RU2707540C2 |
| ЛЕНТИВИРУСНЫЕ ВЕКТОРЫ ДЛЯ ДОСТАВКИ PKLR ДЛЯ ЛЕЧЕНИЯ ДЕФИЦИТА ПИРУВАТКИНАЗЫ | 2018 |
|
RU2777934C2 |
| КОМПОЗИЦИИ И СПОСОБЫ УСИЛЕНИЯ ЭКСПРЕССИИ ГЕНА PKLR | 2017 |
|
RU2773358C2 |
| КОМПОЗИЦИИ Т-КЛЕТОК С НЕДОСТАТОЧНОСТЬЮ РЕЦЕПТОРОВ Т-КЛЕТОК | 2013 |
|
RU2653761C2 |





















Изобретение относится к области биохимии, в частности к способу адоптиной клеточной терапии для профилактики или лечения инфекционных заболеваний, вызванных S.thyphimurium, L.monocytogenes. Изобретение позволяет эффективно лечить заболевания, вызванные S.thyphimurium, L.monocytogenes. 8 ил., 1 пр.
Способ адоптивной клеточной терапии для профилактики или лечения инфекционных заболеваний, вызванных S.thyphimurium, L.monocytogenes, путем введения Т-лимфоцитов, трансдуцированных альфа-цепью ТКР, специфичного к патогену S.thyphimurium, L.monocytogenes, характеризующийся тем, что трансгенез Т-лимфоцитов проводили ретровирусными частицами, содержащими ген α-цепи ТКР, представленного последовательностью SEQ ID NO 35-39 и SEQ ID NO: 40-41, соответственно.
| ПЕПТИДЫ ТЕМ8 И СОДЕРЖАЩИЕ ИХ ВАКЦИНЫ | 2008 |
|
RU2498993C2 |
| Способ получения селена из его смесей | 1930 |
|
SU23378A1 |
| WO 2018170026 A2, 20.09.2018 | |||
| US 9585957 B2, 07.03.2017. | |||
Авторы
Даты
2019-11-19—Публикация
2018-12-13—Подача