ОБЛАСТЬ ТЕХНИКИ, К КОТОРОЙ ОТНОСИТСЯ ИЗОБРЕТЕНИЕ
Настоящее изобретение относится к области производства рекомбинантных белков, в частности антител. Более конкретно, оно относится к способам культивирования клеток в промышленном масштабе для экспрессии белков с пониженной гетерогенностью.
УРОВЕНЬ ТЕХНИКИ
Разработка рекомбинантных белков в качестве терапевтических белков, таких как терапевтические антитела, требует производства рекомбинантных белков в промышленном масштабе. Для достижения этого могут быть использованы разные системы экспрессии, как прокариотические, так и эукариотические. Однако в течение последних двух десятилетий большинство терапевтических белков, одобренных в качестве терапевтических средств, производится с помощью клеточных культур млекопитающих, и такая система остается предпочтительной системой экспрессии для получения больших количеств рекомбинантных полипептидов, используемых человеком.
Однако клеточные культуры млекопитающих сопряжены с серьезными проблемами. Титр продуцируемого рекомбинантного белка, как правило, очень низок по сравнению с другими эукариотическими системами продуцирования, такими как системы, основанные на клетках дрожжей и насекомых.
В последние 30 лет много усилий было потрачено на установление основных параметров клеточной культуры и экспрессии рекомбинантных полипептидов, при этом большое внимание уделялось исследованиям, направленным на достижение оптимального роста клеток за счет изменения состава среды для культивирования клеток (см., например, Hecklau C. et al. J Biotech 218 (2016) 53-63; Zang Li. et al. Anal. Chem 83 (2011) 5422-5430) и рабочих условий, и на разработку крупных биореакторов.
Хотя продуктивность все еще является очень важным аспектом культуры клеток млекопитающих, в последние годы акцент сместился в сторону контроля качества продукта и стабильности процесса на всех этапах разработки и производства. Терапевтические белки, продуцируемые культурой клеток млекопитающих, отличаются различными уровнями гетерогенности. Такая гетерогенность включает, без ограничения, разные профили гликозилирования, различия, возникающие в результате дезамидирования или окисления, варианты, отличающиеся зарядами или размерами. Гетерогенность рекомбинантных белков также может привести к различиям в цвете продукта, например, между разными партиями одного и того же белка, произведенного в одном и том же производственном процессе. Такая гетерогенность и, в частности, различия в цвете представляющего интерес рекомбинантного белка становится более очевидной, когда терапевтические белки получают в высоких концентрациях. В последние годы наблюдается устойчивая тенденция к использованию подкожной доставки терапевтических белков, что требует производства лекарственных форм с высокой концентрацией терапевтических белков. Высокие концентрации связаны с повышенными уровнями агрегатов (Purdie J., et al. Biotechnology Progress, 2016, 32, 998-1008). Увеличенный уровень вариантов, отличающихся зарядом, например увеличенный уровень кислых видов, может влиять на стабильность белка (Banks D. D., et al. Journal of pharma Sciences, 2009, 98, 4501-10), при этом цвет концентрированного терапевтического белка может стать более интенсивным.
Условия культивирования клеток, такие как состав среды (Kshirsagar R., et al. Biotechnology and Bioengineering, 109:10, 2523-2532 (2012); US 2013/0281355; WO 2013/158275) и условия выращивания, включая pH и температуру (US 8,765,413), влияют на качественные характеристики терапевтических белков. Тем не менее, остается необходимость в создании еще более улучшенных способов культивирования клеток для получения терапевтических белков и, в частности, терапевтических антител с минимальной гетерогенностью.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
Настоящее изобретение направлено на реализацию указанной выше потребности путем уменьшения общего количества цистеина или цистина и триптофана в среде для культивирования клеток во время фазы продуцирования рекомбинантных белков.
Ниже описаны конкретные варианты осуществления, которые пронумерованы:
Вариант осуществления 1: Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют рекомбинантный белок, причем во время указанной фазы продуцирования культуру подпитывают:
• цистеином или цистином до общего количества от 10 мас.% до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка; и/или
• триптофаном до общего количества от 8 мас.% до 35 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
Вариант осуществления 2. Способ по варианту осуществления 1, в котором культуру подпитывают цистеином или цистином до общего количества от 12 мас.% до 28 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 12 мас.% до 25 мас.%, например от 12 мас.% до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
Вариант осуществления 3. Способ по варианту осуществления 1 или 2, в котором культуру подпитывают триптофаном до общего количества от 8 мас.% до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 8 мас.% до 25 мас.%, например от 8 мас.% до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка
Вариант осуществления 4. Способ по любому из предшествующих вариантов осуществления, в котором общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 5. Способ по любому из предшествующих вариантов осуществления, в котором общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток/л), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 1а: Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют рекомбинантный белок, причем во время указанной фазы продуцирования культуру подпитывают:
• цистеином или цистином до общего количества от 10 мас.% до 30 мас.% от общего количества продуцируемого рекомбинантного белка; и/или
• триптофаном до общего количества от 8 мас.% до 35 мас.% от общего количества продуцируемого рекомбинантного белка,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
Вариант осуществления 2а. Способ по варианту осуществления 1, в котором культуру подпитывают цистеином или цистином до общего количества от 12 мас.% до 28 мас.% от общего количества продуцируемого рекомбинантного белка, например общего количества от 12 мас.% до 25 мас.%, например от 12 мас.% до 20 мас.%, от общего количества продуцируемого рекомбинантного белка.
Вариант осуществления 3а. Способ по варианту осуществления 1 или 2, в котором культуру подпитывают триптофаном до общего количества от 8 мас.% до 30 мас.% от общего количества продуцируемого рекомбинантного белка, например общего количества от 8 мас.% до 25 мас.%, например от 8 мас.% до 20 мас.%, от общего количества продуцируемого рекомбинантного белка.
Вариант осуществления 4а. Способ по любому из предшествующих вариантов осуществления, в котором общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), причем клетки относятся к суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 5а. Способ по любому из предшествующих вариантов осуществления, в котором общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток/л), причем клетки относятся к суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 6. Способ по любому из предшествующих вариантов осуществления, в котором общее количество цистеина или цистина и/или триптофана в культуре достигается путем добавления цистеина или цистина и/или триптофана в среду для культивирования клеток:
а. в начале фазы продуцирования,
b. один или несколько раз в любой момент времени во время фазы продуцирования,
с. путем непрерывного добавления во время фазы продуцирования или
d. в любой комбинации а., b. и с.
Вариант осуществления 7. Способ по любому из предшествующих вариантов осуществления, представляющий собой периодический процесс, такой как процесс с периодической подпиткой.
Вариант осуществления 8. Способ по любому из предшествующих вариантов осуществления, причем цистеин или цистин и/или триптофан обеспечивают путем ежедневного добавления во время фазы продуцирования.
Вариант осуществления 9. Способ по варианту осуществления 8, в котором перед добавлением цистеина или цистина на следующий день культуру истощают по цистеину или цистину, например, путем уменьшения количества добавляемого цистеина или цистина до уровня от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 9а. Способ по варианту осуществления 8, в котором перед добавлением цистеина или цистина на следующий день культуру истощают по цистеину или цистину, например, путем уменьшения количества добавляемого цистеина или цистина до уровня от 5,6 до 7 г/(1012 клеток), причем клетки относятся к суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Вариант осуществления 10. Способ по варианту осуществления 8 или 9, в котором на поздней стадии продуцирования, т.е. когда клетки уже достигли максимальной жизнеспособной плотности клеток, культуру истощают по триптофану перед добавлением триптофана на следующий день.
Вариант осуществления 11. Способ по любому из предшествующих вариантов осуществления, в котором концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени во время фазы продуцирования, предпочтительно, в котором концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время фазы продуцирования
Вариант осуществления 12. Способ по любому из предшествующих вариантов осуществления, в котором концентрация триптофана в среде для культивирования клеток не превышает 0,6 г/л в любой момент времени во время фазы продуцирования, предпочтительно, в котором концентрация триптофана в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время фазы продуцирования.
Вариант осуществления 13. Способ, в котором фазу продуцирования осуществляют в течение по меньшей мере 7 дней, предпочтительно по меньшей мере 14 дней.
Вариант осуществления 14. Способ по любому из предшествующих вариантов осуществления, в котором в любой момент времени во время 2-й половины фазы продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
Вариант осуществления 15. Способ по любому из предшествующих вариантов осуществления, в котором в любой момент времени во время фазы продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
Вариант осуществления 14а. Способ по любому из предшествующих вариантов осуществления, в котором в любой момент времени во время 2-й половины фазы продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от количества продуцируемого рекомбинантного белка.
Вариант осуществления 15а. Способ по любому из предшествующих вариантов осуществления, в котором в любой момент времени во время фазы продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от количества продуцируемого рекомбинантного белка.
Вариант осуществления 16. Способ по любому из предшествующих вариантов осуществления, в котором клетки-хозяева представляют собой клетки млекопитающих, предпочтительно клетки СНО.
Вариант осуществления 17. Способ по любому из предшествующих вариантов осуществления, в котором рекомбинантный белок представляет собой антитело или его антигенсвязывающий фрагмент.
Вариант осуществления 18. Способ по варианту осуществления 17, в котором антитело или его антигенсвязывающий фрагмент представляет собой:
1) антитело или его антигенсвязывающий фрагмент, который:
а. содержит CDR-H1, имеющую последовательность, определенную в SEQ ID NO: 1; CDR-H2, имеющую последовательность, определенную в SEQ ID NO: 2; CDR-H3, имеющую последовательность, определенную в SEQ ID NO: 3; CDR-L1, имеющую последовательность, определенную в SEQ ID NO: 4; CDR-L2, имеющую последовательность, определенную в SEQ ID NO: 5, и CDR-L3, имеющую последовательность, определенную в SEQ ID NO: 6; или
b. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую последовательность, определенную в SEQ ID NO: 8; или
с. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 8;
d. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 11; или
е. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 11; или
2) антитело, которое содержит легкую цепь, имеющую последовательность, определенную в SEQ ID NO: 9, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 10; или
3) антитело, которое содержит легкую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 9, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 10.
Вариант осуществления 19. Способ по любому из предшествующих вариантов осуществления, в котором фазу продуцирования осуществляют в биореакторе, предпочтительно имеющем объем 50 л или более, 100 л или более, 500 л или более, 1000 л или более, 2000 л или более, 5000 л или более, 10000 л или более или 20000 л или более.
Вариант осуществления 20. Способ по любому из предшествующих вариантов осуществления, включающий этап выделения рекомбинантного белка из среды для культивирования клеток и дополнительный этап очистки рекомбинантного белка.
Вариант осуществления 21. Способ по варианту осуществления 20, в котором очистка включает хроматографию с белком А.
Вариант осуществления 22. Способ по варианту осуществления 20 или 21, дополнительно включающий этап приготовления состава очищенного рекомбинантного белка.
Вариант осуществления 23. Способ по варианту осуществления 22, в котором состав рекомбинантного белка готовят в виде жидкого состава, содержащего одну или более аминокислот и поверхностно-активное вещество.
Вариант осуществления 24. Способ по варианту осуществления 23, в котором состав содержит гистидин и/или пролин.
Вариант осуществления 25. Способ по варианту осуществления 24, в котором состав содержит гистидин в концентрации от 5 мМ до 100 мМ, например в концентрации от 10 до 50 мМ, и/или пролин в концентрации от 100 до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например, от 5 до 6.
Вариант осуществления 26. Способ по варианту осуществления 25, в котором состав содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5,2 до 6,0, предпочтительно при примерно 5,6.
Вариант осуществления 27. Способ по любому из вариантов осуществления 23-26, в котором поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно в концентрации от 0,001% до 0,1% (мас./об.), например, от 0,005% до 0,1%, например от 0,01% до 0,1%, например, от 0,01% до 0,05%, например 0,03%.
Вариант осуществления 28. Способ по любому из вариантов осуществления 23-27, в котором рекомбинантный белок представляет собой антитело, при этом антитело находится в составе в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например примерно 140 мг/мл.
Вариант осуществления 29. Способ по любому из предшествующих вариантов осуществления, обеспечивающий уменьшение гетерогенности полученных рекомбинантных белков, причем указанное уменьшение гетерогенности включает уменьшение:
а. гетерогенности заряда, предпочтительно группы кислых пиков (пиков кислых изоформ) (APG); и/или
b. окисления аминокислот, изомеризации, фрагментации, гликирования других ковалентных аддуктов, дезамидирования, цистеинилирования; и/или
с. цвета или интенсивности цвета, например между разными партиями рекомбинантного белка; и/или
d. высокомолекулярных видов (HMWS); и/или
е. нестабильности рекомбинантного белка.
Вариант осуществления 30. Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, в которой клетки продуцируют рекомбинантный белок и среду для культивирования клеток подпитывают цистеином или цистином и/или триптофаном, причем
• общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 7 г/(1012 клеток), например, от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и/или
• общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 3,5 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
Вариант осуществления 30а. Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, в которой клетки продуцируют рекомбинантный белок и среду для культивирования клеток подпитывают цистеином или цистином и/или триптофаном, причем
• общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 7 г/(1012 клеток), например, от 5,6 до 7 г/(1012 клеток), причем клетки относятся к суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и/или
• общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 3,5 г/(1012 клеток), причем клетки относятся к суммарному количеству жизнеспособных клеток в конце фазы продуцирования,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
Вариант осуществления 31. Способ по варианту осуществления 30, имеющий один или более дополнительных признаков, перечисленных в любом из вариантов осуществления 2-29.
Вариант осуществления 32. Способ уменьшения гетерогенности популяции рекомбинантных белков в партии, полученной на фазе продуцирования рекомбинантными клетками-хозяевами, включающий ограничение общего количества
а. цистеина или цистина и/или
b. триптофана,
присутствующих в среде для культивирования клеток во время фазы продуцирования рекомбинантного белка.
Вариант осуществления 33. Способ по варианту осуществления 32, имеющий один или более дополнительных признаков, перечисленных в любом из вариантов осуществления 2-29.
Вариант осуществления 34. Препарат рекомбинантного белка, который можно получить или получают способом по любому из предшествующих вариантов осуществления.
Вариант осуществления 35. Фармацевтическая композиция, содержащая антитело, причем композиция имеет один или более дополнительных признаков, перечисленных в любом из вариантов осуществления 23-28, при этом антитело предпочтительно представляет собой антитело, указанное в варианте осуществления 18.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ
Фиг.1: Описание проведения расчетов по измерению общего количества аминокислот, цистеина или цистина и триптофана, добавляемых во время фазы продуцирования, осуществляемой в биореакторе, в расчете на весовой процент продуцированного рекомбинантного белка.
Фиг.2: Влияние общего добавленного количества триптофана и цистеина или цистина в мас.% (г/г) от общего количества продуцированного mAb1, на b* значение, нормированное на 40 мг/мл (а), и вариант группы кислых пиков (APG) (b), соответственно. Максимальные концентрации триптофана и цистеина или цистина не влияют на b* значение (c) или APG% (d).
Фиг.3: Влияние общего количества добавленного триптофана и цистеина или цистина в мас.% от общей массы продуцированного mAb1 (г/г) на b* значение, нормированное на 40 мг/мл (а), и на вариант группы кислых пиков (APG) (b), соответственно, и отсутствие корреляции между максимальными концентрациями цистеина или цистина (с) и триптофана (d) на APG.
Фиг.4: Модель множественной линейной регрессии зависимости варианта группы кислых пиков (APG) рекомбинантного моноклонального антитела mAb1 от добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества продуцированного mAb1 (г/г).
Фиг.5: Модель множественной линейной регрессии зависимости варианта группы главных пиков рекомбинантного моноклонального антитела mAb1 от общего количества добавленного цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного mAb1 (г/г).
Фиг.6: Модель множественной линейной регрессии зависимости варианта высокомолекулярных видов (HMWS) рекомбинантного моноклонального антитела mAb1 от общего количества добавленного цистеина или цистина в мас.% от общего количества продуцированного рекомбинантного mAb1 (г/г).
Фиг.7: Модель множественной линейной регрессии зависимости варианта нормированного на 40 мг/мл b* значения рекомбинантного моноклонального антитела mAb1 от общего количества добавленного цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного mAb1 (г/г).
Фиг.8: Контурные графики, демонстрирующие влияние добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного mAb1, (г/г), на варианты (а) высокомолекулярных видов (HMWS), (b) b* значения, нормированного на 40 мг/мл, (с) группы кислых пиков (APG) и (d) группы главных пиков. Квадрат, обозначенный черной пунктирной линией, соответствует идеальному добавленному общему количеству цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного mAb1 (г/г) с точки зрения уменьшения APG, HMWS, нормированного на 40 мг/мл b* значения и увеличения варианта группы главных пиков, где добавленное количество цистеина или цистина соответствует 12,06 и 28,03 мас.%, соответственно, от общего количества продуцированного mAb1 (г/г), и добавленное количество триптофана находится в диапазоне от 8,84 до 32,06 мас.% от общего количества продуцированного mAb1 (г/г).
Фиг.9: Влияние добавленного общего количества цистеина или цистина и триптофана в мас.% от массы объемной клеточной культуры (CSV) на суммарное количество жизнеспособных клеток (IVCC), нормированное на CSV. Модель множественной линейной регрессии зависимости кумулятивного IVCC, нормированного на CSV, от добавленного общего количества цистеина или цистина и триптофана в мас.% от массы CSV, показана на (a). Контурная диаграмма влияния добавленного общего количества цистеина или цистина и триптофана в мас.% от массы CSV на кумулятивное IVCC, нормированное на CSV, показана на (b).
Фиг.10: Влияние общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток во время фазы продуцирования в мас.% от массы CSV, на конечный титр mAb1, измеренный методом ВЭЖХ (mAb ВЭЖХ). Модель множественной линейной регрессии зависимости конечного титра mAb1, определенного методом ВЭЖХ, от добавленного общего количества цистеина или цистина и триптофана в мас.% от массы CSV, показана на (а). Контурная диаграмма влияния добавленного общего количества цистеина или цистина и триптофана в мас.% от массы CSV на конечный титр mAb, определенный методом ВЭЖХ, показана на (b).
Фиг.11: Контурный график влияния общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток во время фазы продуцирования, в расчете на IVCC*10-12 в конце фазы продуцирования на IVCC в течение 14 дней показан на (a). Контурный график, демонстрирующий влияние общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток во время фазы продуцирования, в расчете на IVCC*10-12 в конце фазы продуцирования на конечный титр mAb, определенный методом ВЭЖХ, показан на (b). Описание проведения расчетов для измерения количества аминокислот, цистеина или цистина и триптофана, добавленного во время фазы продуцирования, осуществляемой в биореакторе, в расчете на IVCC*10-12 в конце фазы продуцирования, показано на (с).
Фиг.12: Контурный график влияния максимальных концентраций цистеина или цистина и триптофана, достигаемых в среде для культивирования клеток во время фазы продуцирования, на IVCC, нормированное на CSV.
Фиг.13: Общее количество цистеина или добавленного цистеина и Общее количество цистеина или добавленного цистеина на IVCC для условий, описанных в таблице 6.
Фиг.14: Влияние истощения цистеина или цистина на рост клеток и титр mAb. Профиль концентрации жизнеспособных клеток (VCC) (a), титры mAb (b) и концентрации Cys перед добавлением подпитки (c) показаны в виде функции трех экспериментальных условий: без истощения цистеина или цистина в течение всей фазы продуцирования [Без истощения - (34,35 г/л Cys в подпитке)] и два условия с ежедневным истощением цистеина или истощением цистина, начиная с дня 6 до конца продуцирования в режиме с периодической подпиткой и концентрацией Cys в подпитке 17,17 г/л и 6,87 г/л.
Фиг.15: Влияние добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного антитела, по массе, на (а) вариант APG и b* значение, нормированное на 40 мг/мл, для mAb2; (b) вариант APG для mAb3 и (c) варианты APG, BPG (группа щелочных пиков (пиков изоморф со свойствами основания) и варианты главной группы для mAb4.
Фиг.16: Влияние добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества рекомбинантных mAb1, mAb2, mAb3 и mAb4 на APG. На (а) представлен график зависимости варианта APG для mAb1, mAb2, mAb3 и mAb4 от добавленного общего количества цистеина или цистина в мас.% от общего количества продуцированных рекомбинантных mAb1, mAb2, mAb3 и mAb4, по массе. На (b) представлена модель множественной линейной регрессии зависимости варианта APG рекомбинантных моноклональных антител mAb1, mAb2 и mAb3 и рекомбинантного полиспецифического антитела mAb4 от добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества (по массе) продуцированного рекомбинантного mAb.
Фиг.17: Получено уравнение для прогнозирования уровня группы кислых пиков (APG) на основе данных, полученных для клеточной линии CHO DG44, экспрессирующей антитело mAb1 (Таблица 3).
Фиг.18: Сравнение экспериментального уровня группы кислых пиков (APG) (APG эксп.) с прогнозируемым уровнем APG (APG прогн.) для клеточной линии CHO DG44, экспрессирующей антитела mAb1. Данные получены в способе продуцирования (культивирования) в непрерывном режиме по технологии переменного тангенциального потока (Alternating Tangential Flow (ATF)) в биореакторах объемом 2 л. Прогнозирование APG основано на уравнении, приведенном на фиг. 17.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
Изобретение основано на открытии того факта, что ограничение общего количества цистеина или цистина и/или триптофана, используемых в среде для культивирования клеток на фазе продуцирования в способе получения рекомбинантного белка, позволяет уменьшить гетерогенность получаемых рекомбинантных белков. Следовательно, настоящее изобретение предусматривает использование ограниченного количества цистеина или цистина и/или триптофана в среде для культивирования клеток для уменьшения гетерогенности антитела или его антигенсвязывающего фрагмента, экспрессируемого в эту среду.
Уменьшение гетерогенности является предпочтительным в отношении:
а. заряда, предпочтительно, гетерогенности группы кислых пиков (APG); и/или
b. окисления аминокислот, изомеризации, фрагментации, гликирования других ковалентных аддуктов, дезамидирования, цистеинилирования; и/или
с. цвета или интенсивности цвета (b* значение, нормированное на 40 мг/мл); и/или
d. образования высокомолекулярных видов (HMWS); и/или
е. нестабильности рекомбинантного белка и/или
f. их комбинаций.
Используемый в настоящем описании термин «гетерогенность» относится к различиям между отдельными молекулами, например, рекомбинантными белками в популяции молекул, полученных одним и тем же способом получения или в одной и той же производственной партии. Гетерогенность может быть результатом неполных или неоднородных модификаций рекомбинантных белков, например, вследствие посттрансляционных модификаций экспрессируемого белка. Такие модификации могут быть результатом реакций дезаминирования и/или реакций окисления и/или ковалентного присоединения малых молекул, таких как реакции гликирования и/или реакции изомеризации, и/или реакции фрагментации, и/или других реакций, а также могут включать изменение характера гликирования. Химико-физическое проявление такой гетерогенности приводит к различным характеристикам полученных препаратов рекомбинантного белка, которые включают, без ограничения, профиль заряженных вариантов, цвета или интенсивности цвета и молекулярной массы.
Термин «фаза продуцирования» по настоящему изобретению содержит такой этап культивирования клеток в способе получения рекомбинантного белка, на котором клетки экспрессируют (т.е. продуцируют) рекомбинантный белок(белки). Фаза продуцирования начинается с увеличения титра нужного продукта и заканчивается сбором клеток, жидкости или супернатанта клеточной культуры. Как правило, в начале фазы продуцирования клеточную культуру переносят в биореактор. Сбор представляет собой этап, на котором жидкость для культивирования клеток удаляют, например из сосуда для продуцирования рекомбинантного белка, например рекомбинантного антитела, которое должно быть выделено и очищено на последующих этапах. Термин «начальная масса культуры клеток», используемый в настоящем описании, относится к массе культуры в начале фазы продуцирования, обычно к массе при ведении в биореактор.
В первом аспекте изобретение относится к способу получения рекомбинантного белка, включающему:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют рекомбинантный белок, причем во время указанной фазы продуцирования культуру подпитывают:
а. цистеином или цистином до общего количества от 10 до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка; и/или
b. триптофаном до общего количества от 8 до 35 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
Как станет очевидно далее из описания изобретения, культуру подпитывают цистеином или цистином и/или триптофаном; такая подпитка может быть выполнена с использованием:
1. цистеина; или
2. цистина; или
3. цистеина и цистина; или
4. цистеина и триптофана; или
5. цистина и триптофана; или
6. цистеина, цистина и триптофана; или
7. триптофана.
При использовании в настоящем описании выражения «общее количество цистеина или цистина» или «цистеин или цистин до общего количества…» относятся к а) общему количеству только цистеина, если в способе не используется цистин, b) к общему количеству только цистина, если в способе не используется цистеин, или c) к общему количеству цистеина+цистина, если в способе используются оба соединения. Цистеин и цистин в среде для культивирования клеток находятся в постоянном равновесии, при котором две молекулы цистеина окисляются в молекулу цистина и снова восстанавливаются до двух молекул цистеина.
Общее количество цистеина или цистина и/или триптофана может быть выражено в настоящем описании в виде процента от общего количества продуцированного рекомбинантного белка. Используемый в настоящем описании термин «мас.%» относится к проценту по массе. «Общее» относится к общему количеству, определенному в конце фазы продуцирования, т.е. к общему количеству цистеина или цистина и/или триптофана, добавляемых во время фазы продуцирования, и к общему количеству рекомбинантного белка, продуцированного во время фазы продуцирования, причем общее количество продуцированного рекомбинантного белка измеряют в конце фазы продуцирования.
На фиг. 1 показано, каким образом вычисляют общее количество цистеина или цистина и/или триптофана в расчете на мас.% продуцированного рекомбинантного белка. Общее количество добавленного цистеина, цистина или триптофана вычисляют в виде функции скорости подпитки (или объема подпитки) и концентрации цистеина, цистина или триптофана в этой подпитке, а также концентрации цистеина, цистина или триптофана в среде, в которую добавляют подпитку, в расчете на объем добавленной подпитки (фиг. 1, А). Количество продуцированного рекомбинантного белка вычисляют в виде функции конечного объема среды для культивирования клеток и конечного титра рекомбинантного белка (фиг. 1, В). Отношение этих двух вычисленных параметров представляет собой общее количество цистеина или цистина и/или триптофана, добавленных в расчете на количество продуцированного рекомбинантного белка (фиг. 1, С).
Клетки-хозяева сначала (на этапе а.) можно выращивать в среде для культивирования клеток, которая может включать или не включать цистеин или цистин и триптофан. Если среда для культивирования клеток уже содержит начальное количество цистеина или цистина и/или триптофана, тогда общее количество будет включать указанное начальное количество.
В одном из вариантов осуществления способа по изобретению культуру подпитывают цистеином или цистином до общего количества от 12,06 мас.% до 28,03 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 12 мас.% до 28 мас.%, например от 12 до 25 мас.%, например от 12 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
В другом варианте осуществления способа по изобретению культуру подпитывают триптофаном до общего количества от 8,84 до 32,06 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 8 мас. % до 30 мас.%, например от 8 до 25 мас.%, например от 8 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
Альтернативно, общее количество цистеина или цистина и/или триптофана может быть выражено в виде общего количества, добавленного в способе, относительно суммарного количества жизнеспособных клеток в конце фазы продуцирования. В одном из вариантов осуществления общее количество цистеина и/или цистина, обеспечиваемое в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например, от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования. В другом варианте осуществления общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток/л), причем количество клеток относится к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
Следует понимать, что специалист в данной области осведомлен о способах измерения количества цистеина или цистина и/или триптофана, добавленного и/или присутствующего в клеточной культуре на определенной фазе, такой как фаза продуцирования. Например, это можно сделать, как описано в приведенных в настоящем описании примерах. Аналогично, специалист в данной области техники осведомлен о методах измерения общего количества рекомбинантного белка, продуцированного культурой клеток, и, следовательно, способен применить раскрытие настоящего изобретения для достижения требуемого технического эффекта. Например, это можно сделать, как раскрыто в приведенных в настоящем описании примерах, например, с помощью анализатора модели ForteBio Octet (ForteBio, Inc., Menlo Park, CA) или методом жидкостной хроматографии высокого давления (ВЭЖХ), используя образцы супернатанта культуры клеток, которые до проведения анализа хранятся при -80°С.
Для разработки способа по изобретению, в котором количество цистеина или цистина и/или триптофана в расчете на ожидаемое общее количество продуцированного рекомбинантного белка поддерживают в определенных пределах, может потребоваться выполнение одного или более первоначальных экспериментов для определения приблизительных уровней рекомбинантного белка, продуцируемого конкретными клетками-хозяевами в определенных условиях культивирования. Когда приблизительные общие уровни продуцируемого рекомбинантного белка известны, может быть разработан способ согласно изобретению, в котором количество цистеина или цистина и/или триптофана в расчете на ожидаемое общее количество продуцированного рекомбинантного белка будет поддерживаться в указанных пределах.
Для достижения такого общего количества цистеина или цистина и/или триптофана в среде для культивирования клеток во время фазы продуцирования можно использовать различные стратегии. В одном из вариантов осуществления общее количество может быть достигнуто путем добавления цистеина или цистина и/или триптофана непосредственно в начале фазы продуцирования, например только один раз, или указанное общее количество может быть уже включено в среду для культивирования клеток, используемую для продуцирования. В другом варианте осуществления общее количество может быть достигнуто путем суммирования добавок, например ежедневных добавок или в виде непрерывного добавления, во время фазы продуцирования. В другом варианте осуществления общее количество может быть достигнуто путем комбинации начальной концентрации цистеина/цистеина и/или триптофана в жидкости для культивирования клеток в начале фазы продуцирования и добавок.
Соответственно, в одном из вариантов осуществления способа по изобретению общее количество цистеина или цистина и/или триптофана в среде для культивирования клеток достигается путем добавления цистеина или цистина и/или триптофана в среду для культивирования клеток:
а. в начале фазы продуцирования,
b. один или несколько раз в любой момент времени во время фазы продуцирования,
с. путем непрерывного добавления во время фазы продуцирования или
d. в любой комбинации а., b. и с.
В предпочтительном варианте осуществления цистеин или цистин и/или триптофан добавляют в начале фазы продуцирования и добавляют в виде ежедневных болюсных добавок во время фазы продуцирования. Предпочтительно фаза продуцирования длится по меньшей мере 7 дней, более предпочтительно более 7 дней, например, 10 дней, более предпочтительно 14 или более дней.
В предпочтительном варианте концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени во время фазы продуцирования, предпочтительно концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время фазы продуцирования.
Кроме того, в предпочтительном варианте концентрация триптофана в среде для культивирования клеток не превышает 0,6 г/л в любой момент времени во время фазы продуцирования, предпочтительно концентрация триптофана в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время фазы продуцирования.
В одном из вариантов осуществления цистеин или цистин ежедневно добавляют в среду для культивирования клеток, и ко дню 6 максимальную концентрацию цистеина или цистина в среде для культивирования клеток увеличивают до 0,3 г/л, а со дня 7 до дня 14 максимальную концентрацию цистеина или цистина в среде для культивирования клеток увеличивают до 0,9 г/л.
В некоторых вариантах осуществления количество цистеина или цистина и/или триптофана находится в указанных диапазонах, рассчитанных для всей фазы продуцирования, не только в конце фазы продуцирования, но также в любой момент времени любого отрезка во время фазы продуцирования или даже в любой момент времени в течение всей фазы продуцирования. Таким образом, в одном из вариантов осуществления в любой момент времени во 2-й половине фазы продуцирования (например, с дня 7 по день 14 14-дневной фазы продуцирования):
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
В другом варианте осуществления в любой момент времени на фазе продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
Когда цистеин или цистин доставляют клеткам путем ежедневных добавок, может быть обеспечено истощение культуры по цистеину или цистину до добавления следующей ежедневной добавки. В одном из вариантов осуществления культуру истощают по цистеину или цистину перед добавлением цистеина или цистина на следующий день, например путем уменьшения добавки цистеина или цистина до уровня от 5,6 до 7 г/[1012 клеток]. Во втором варианте осуществления во время культивирования клеток культуру истощают по триптофану на поздней стадии продуцирования, т.е. когда клетки уже достигли максимальной жизнеспособной плотности клеток, например истощение начинают в день 8 или позже во время 14-дневной фазе продуцирования.
Не ограничиваясь какой-либо теорией, предполагается, что, несмотря на истощение цистеина или цистина, клетки на фазе продуцирования не становятся лишенными цистеина или цистина, и предположительно имеют внутренний механизм, позволяющий хранить цистеин или цистин, полученный во время добавок, в виде неактивного метаболита, который в условиях истощения способен превращаться в цистеин или цистин, поступающий в среду для культивирования клеток.
В дополнительном независимом аспекте изобретение относится к способу получения рекомбинантного белка, включающему:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, в которой клетки продуцируют рекомбинантный белок и среду для культивирования клеток подпитывают цистеином или цистином и/или триптофаном, причем
• общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 7 г/(1012 клеток), например, от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и/или
• общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 3,5 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
В одном из вариантов осуществления этого способа среду для культивирования клеток подпитывают цистеином или цистином до общего количества от 12 до 28 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 12 мас.% до 25 мас.%, например от 12 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
В другом варианте осуществления этого способа среду для культивирования клеток подпитывают триптофаном до общего количества от 8 до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 8 мас.% до 25 мас.%, например от 8 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
В другом варианте осуществления этого способа общее количество цистеина или цистина и/или триптофана в среде для культивирования клеток достигается путем добавления цистеина или цистина и/или триптофана в среду для культивирования клеток:
а. в начале фазы продуцирования,
b. один или несколько раз в любой момент времени во время фазы продуцирования,
с. путем непрерывного добавления во время фазы продуцирования или
d. в любой комбинации а., b. и с.
В другом варианте осуществления способ представляет собой периодический процесс, такой как процесс с периодической подпиткой. В другом варианте осуществления этого способа цистеин или цистин и/или триптофан обеспечивают путем ежедневного добавления во время фазы продуцирования.
В другом варианте этого способа среду для культивирования клеток истощают по цистеину или цистину перед добавлением цистеина или цистина на следующий день, например путем уменьшения добавки цистеина или цистина до уровня от 5,6 и 7 г/[1012 клеток].
В другом варианте осуществления этого способа, среду для культивирования клеток истощают по триптофану перед его добавлением на следующий день на позднем этапе продуцирования, т.е. когда клетки уже достигли максимальной жизнеспособной плотности клеток.
В другом варианте осуществления этого способа концентрация цистеина или цистина в клеточной культуре не превышает 0,9 г/л в любой момент времени на фазе продуцирования; предпочтительно, когда концентрация цистеина или цистина в клеточной культуре в любой момент на фазе продуцирования не превышает 0,3 г/л.
В другом варианте осуществления этого способа концентрация триптофана в клеточной культуре не превышает 0,6 г/л в любой момент времени на фазе продуцирования; предпочтительно, когда концентрация триптофана в культуре клеток в любой момент времени на фазе продуцирования не превышает 0,3 г/л.
В другом варианте осуществления этого способа фазу продуцирования осуществляют в течение по меньшей мере 7 дней, предпочтительно по меньшей мере 14 дней.
В одном из вариантов осуществления этого способа в любой момент времени во 2-й половине фазы продуцирования:
а. количество цистеина или цистина в среде для культивирования клеток составляет от 10 до 30 мас.% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
b. количество триптофана в среде для культивирования клеток составляет от 8 до 35 мас.% от ожидаемого количества продуцируемого рекомбинантного белка.
В другом варианте осуществления этого способа в любой момент времени на фазе продуцирования:
а. количество цистеина или цистина составляет от 10 до 30 мас.% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
b. количество триптофана составляет от 8 до 35 мас.% от ожидаемого количества продуцируемого рекомбинантного белка.
В другом варианте осуществления этого способа клетки-хозяева представляют собой клетки млекопитающих, предпочтительно клетки СНО.
В другом варианте осуществления этого способа рекомбинантный белок представляет собой антитело или его антигенсвязывающий фрагмент.
В другом варианте осуществления этого способа фазу продуцирования осуществляют в биореакторе, предпочтительно имеющем объем 50 л или более, 100 л или более, 500 л или более, 1000 л или более, 2000 л или более, 5000 л или более, 10000 л или более или 20000 л или более.
В одном из вариантов осуществления способ включает этап выделения рекомбинантного белка из среды для культивирования клеток и дополнительный этап очистки рекомбинантного белка.
В дополнительном варианте осуществления этого способа очистка включает хроматографию с белком А.
В дополнительном варианте осуществления способ включает дополнительный этап получения состава очищенного рекомбинантного белка.
В одном из вариантов осуществления этого способа состав рекомбинантного белка готовят в виде жидкого состава, содержащего одну или более аминокислот и поверхностно-активное вещество.
В дополнительном варианте осуществления этого способа состав содержит гистидин и/или пролин.
В другом варианте осуществления этого способа состав содержит гистидин в концентрации от 5 мМ до 100 мМ, например в концентрации от 10 до 50 мМ, и/или пролин в концентрации от 100 до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например, от 5 до 6, например от 5,5 до 6.
В другом дополнительном варианте осуществления этого способа состав содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5,2 до 6,0, например примерно 5,6.
В дополнительном варианте осуществления этого способа поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно, в концентрации от 0,001% до 0,1% (мас./об.), например от 0,005% до 0,1%, например от 0,01% до 0,1%, например от 0,01% до 0,05%, например 0,03%.
В другом дополнительном варианте осуществления этого способа рекомбинантный белок представляет собой антитело, причем антитело находится в составе в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например примерно 140 мг/мл.
В другом варианте осуществления способ уменьшает гетерогенность продуцируемых рекомбинантных белков, причем указанное уменьшение гетерогенности включает уменьшение:
а. гетерогенности заряда, предпочтительно группы кислых пиков (APG); и/или
b. окисления аминокислот, изомеризации, фрагментации, гликирования других ковалентных аддуктов, дезамидирования, цистеинилирования; и/или
с. цвета или интенсивности цвета, например между разными партиями рекомбинантного белка; и/или
d. высокомолекулярных видов (HMWS); и/или
е. нестабильности рекомбинантного белка.
В дополнительном независимом аспекте изобретение относится к способу уменьшения гетерогенности популяции рекомбинантных белков в партии, полученной на фазе продуцирования рекомбинантными клетками-хозяевами, включающему ограничение общего количества:
а. цистеина или цистина и/или
b. триптофана,
присутствующих в среде для культивирования клеток во время фазы продуцирования рекомбинантного белка.
В одном из вариантов осуществления способ включает:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют рекомбинантный белок, причем во время указанной фазы продуцирования культуру подпитывают:
• цистеином или цистином до общего количества от 10 мас.% до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка; и/или
• триптофаном до общего количества от 8 мас.% до 35 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток.
В одном из вариантов осуществления способа культуру подпитывают цистеином или цистином до общего количества от 12 до 28 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 12 мас.% до 25 мас.%, например от 12 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
В другом варианте осуществления способа культуру подпитывают триптофаном до общего количества от 8 до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 8 до 25 мас.%, например от 8 до 20 мас.%, от ожидаемого общего количества продуцируемого рекомбинантного белка.
В другом варианте осуществления способа общее количество цистеина или цистина, обеспечиваемого в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
В другом варианте осуществления способа общее количество триптофана, обеспечиваемого в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток/л), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования.
В другом варианте осуществления способа общее количество цистеина или цистина и/или триптофана в среде для культивирования клеток обеспечивают путем добавления цистеина или цистина и/или триптофана в среду для культивирования клеток:
а. в начале фазы продуцирования,
b. один или несколько раз в любой момент времени во время фазы продуцирования,
с. путем непрерывного добавления во время фазы продуцирования или
d. в любой комбинации а., b. и с.
В другом варианте осуществления способ представляет собой периодический процесс, такой как процесс с периодической подпиткой.
В другом варианте осуществления способа цистеин или цистин и/или триптофан обеспечивают путем ежедневного добавления на фазе продуцирования.
В другом варианте осуществления способа среду для культивирования клеток истощают по цистеину или цистину перед добавлением цистеина или цистина на следующий день, например путем уменьшения добавления цистеина или цистина до уровня от 5,6 до 7 г/[1012 клеток].
В другом варианте осуществления способа среду для культивирования клеток истощают по триптофану перед его добавлением на следующий день на позднем этапе продуцирования, т.е. когда клетки уже достигли максимальной жизнеспособной плотности клеток.
В другом варианте осуществления способа концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени на фазе продуцирования, предпочтительно, когда концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени на фазе продуцирования.
В другом варианте осуществления способа концентрация триптофана в среде для культивирования клеток не превышает 0,6 г/л в любой момент времени на фазе продуцирования, предпочтительно, когда концентрация триптофана в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени на фазе продуцирования.
В другом варианте осуществления способа фазу продуцирования осуществляют в течение по меньшей мере 7 дней, предпочтительно, по меньшей мере 14 дней.
В другом варианте осуществления способа в любой момент времени во 2-й половине фазы продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
В другом варианте осуществления способа в любой момент времени на фазе продуцирования:
• количество цистеина или цистина в культуре составляет от 10 мас.% до 30% от ожидаемого количества продуцируемого рекомбинантного белка; и/или
• количество триптофана в культуре составляет от 8 мас.% до 35% от ожидаемого количества продуцируемого рекомбинантного белка.
В другом варианте осуществления способа клетки-хозяева представляют собой клетки млекопитающих, предпочтительно клетки СНО.
В другом варианте осуществления способа рекомбинантный белок представляет собой антитело или его антигенсвязывающий фрагмент.
В другом варианте осуществления способа фазу продуцирования осуществляют в биореакторе, предпочтительно имеющем объем 50 л или более, 100 л или более, 500 л или более, 1000 л или более, 2000 л или более, 5000 л или более, 10000 л или более или 20000 л или более.
В одном из вариантов осуществления способ включает этап выделения рекомбинантного белка из среды для культивирования клеток и дополнительный этап очистки рекомбинантного белка.
В следующем варианте осуществления способа очистка включает хроматографию с белком А.
В дополнительном варианте осуществления способ включает дополнительный этап получения состава очищенного рекомбинантного белка.
В одном из вариантов осуществления этого способа состав рекомбинантного белка готовят в виде жидкого состава, содержащего одну или более аминокислот и поверхностно-активное вещество.
В дополнительном варианте осуществления этого способа состав содержит гистидин и/или пролин.
В другом дополнительном варианте осуществления этого способа состав содержит гистидин в концентрации от 5 мМ до 100 мМ, например в концентрации от 10 до 50 мМ, и/или пролин в концентрации от 100 до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например от 5 до 6, например от 5,5 до 6.
В другом дополнительном варианте осуществления этого способа состав содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5,2 до 6,0, например примерно 5,6.
В дополнительном варианте осуществления этого способа поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно в концентрации от 0,001% до 0,1% (мас./об.), например от 0,005% до 0,1%, например от 0,01% до 0,1%, например от 0,01% до 0,05%, например 0,03%.
В еще одном дополнительном варианте осуществления этого способа рекомбинантный белок представляет собой антитело, причем антитело находится в составе в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например примерно 140 мг/мл.
В другом варианте осуществления способ уменьшает гетерогенность продуцируемых рекомбинантных белков, причем указанное уменьшение гетерогенности включает уменьшение:
а. гетерогенности заряда, предпочтительно группы кислых пиков (APG); и/или
b. окисления аминокислот, изомеризации, фрагментации, гликирования других ковалентных аддуктов, дезамидирования, цистеинилирования; и/или
с. цвета или интенсивности цвета, например между разными партиями рекомбинантного белка; и/или
d. высокомолекулярных видов (HMWS); и/или
е. нестабильности рекомбинантного белка.
В дополнительном аспекте изобретение относится к препарату рекомбинантного белка, который можно получить или получают способом по изобретению. В одном из вариантов осуществления препарат представляет собой нерасфасованный препарат. В других вариантах осуществления, например, когда способ включает дополнительные этапы получения продукта в виде лекарственного состава белка, полученный препарат представляет собой препарат белка, например, препарат, подходящий для введения пациенту.
Рекомбинантные белки, предпочтительно антитела или их антигенсвязывающие фрагменты в указанном препарате, полученном таким образом, имеют пониженную гетерогенность относительно таких же рекомбинантных белков, полученных таким же способом, но в котором во время фазы продуцирования общее количество цистеина или цистина и/или триптофана не ограничивают, как описано в настоящем изобретении.
В другом дополнительном аспекте изобретение относится к фармацевтической композиции, содержащей антитело, причем композиция представляет собой композицию жидкого состава с одной или более аминокислотами и поверхностно-активным веществом.
В одном из вариантов осуществления фармацевтическая композиция содержит гистидин и/или пролин.
В дополнительном варианте осуществления фармацевтическая композиция содержит гистидин и/или пролин.
В дополнительном варианте осуществления фармацевтическая композиция содержит гистидин в концентрации от 5 мМ до 100 мМ, например в концентрации от 10 до 50 мМ, и/или пролин в концентрации от 100 до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например, от 5 до 6, например от 5,5 до 6.
В дополнительном варианте осуществления фармацевтическая композиция содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5,2 до 6,0, например примерно 5,6.
В дополнительном варианте осуществления фармацевтической композиции поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно, в концентрации от 0,001% до 0,1% (мас./об.), например от 0,005% до 0,1%, например от 0,01% до 0,1%, например от 0,01% до 0,05%, например 0,03%.
В дополнительном варианте осуществления фармацевтической композиции антитело находится в композиции в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например примерно 140 мг/мл.
В дополнительном варианте осуществления фармацевтической композиции антитело представляет собой:
1) антитело или его антигенсвязывающий фрагмент, который:
а. содержит CDR-H1, имеющую последовательность, определенную в SEQ ID NO: 1; CDR-H2, имеющую последовательность, определенную в SEQ ID NO: 2; CDR-H3, имеющую последовательность, определенную в SEQ ID NO: 3; CDR-L1, имеющую последовательность, определенную в SEQ ID NO: 4; CDR-L2, имеющую последовательность, определенную в SEQ ID NO: 5, и CDR-L3, имеющую последовательность, определенную в SEQ ID NO: 6; или
b. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую последовательность, определенную в SEQ ID NO: 8; или
с. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 8;
d. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 11; или
е. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 11; или
2) антитело, которое содержит легкую цепь, имеющую последовательность, определенную в SEQ ID NO: 9, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 10; или
3) антитело, которое содержит легкую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 9, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 10.
Клетки-хозяева и условия культивирования
Рекомбинантный белок, антитело или его антигенсвязывающий фрагмент предпочтительно могут быть получены путем культивирования клеток-хозяев млекопитающих, наиболее предпочтительно клеток яичника китайского хомячка (СНО).
Термин «культура клеток» или его грамматические варианты включают, без ограничения, множество клеток-хозяев, предпочтительно клеток-хозяев млекопитающих, соответствующим образом сконструированных и/или подвергнутых манипуляциям с целью экспрессии (т.е. продуцирования) одного или более рекомбинантных белков, которые поддерживают или выращивают в среде для культивирования клеток в течение определенного периода времени, например фазы продуцирования.
Клетки млекопитающих и, в частности, клетки СНО, могут быть культивированы в любой среде, которая способна поддерживать их рост и экспрессию рекомбинантного белка; предпочтительно среда представляет собой среду, которая не содержит продуктов животного происхождения, таких как сыворотка животных и пептон. Специалисту в данной области доступны различные среды для культивирования клеток, причем каждая среда содержит различные комбинации витаминов, аминокислот, гормонов, факторов роста, ионов, буферов, нуклеозидов, глюкозы или эквивалентного источника энергии, которые присутствуют в соответствующих концентрациях, необходимых для роста клеток и продуцирования белка. Подходящие среды описаны, например, в WO 98/08934 и US 2006/0148074 (оба документа включены в настоящее описание во всей своей полноте). Другие подходящие коммерчески доступные среды, которые можно использовать в настоящем изобретении или которые могут быть модифицированы для удовлетворения требований по цистеину/цистеину и/или триптофану, включают среду AmpliCHO CD, среду Dynamis™, систему с периодической подпиткой EX-CELL® Advanced™ CHO, среду CD FortiCHO™, среду CP OptiCHO™, минимальную необходимую среду (MEM), среду BalanCD® CHO Growth A, среду ActiPro™, среду DMEM (модифицированную по способу Дульбекко среду Игла) и среду RPMI-1640.
Культура клеток может находиться в любом подходящем контейнере, таком как встряхиваемая колба или биореактор, который может работать в режиме с подпиткой или без подпитки в зависимости от требуемого масштаба производства. Эти биореакторы могут представлять собой реакторы с мешалкой или аэролифтные реакторы. Доступны различные крупномасштабные биореакторы с вместимостью от 1000 до 50000 л, предпочтительно от 5000 до 20000 л или до 100000 л. В качестве альтернативы, для производства антитела или фрагмента антитела также можно использовать биореакторы меньшего объема, например от 2 до 100 л.
В предпочтительном варианте осуществления настоящего изобретения, независимо от того, где осуществляется любая предыдущая фаза (т.е. фаза роста), фазу продуцирования проводят в биореакторе или любом другом контейнере для суспензионной культуры, таком как встряхиваемая колба или центрифужная пробирка. Фазу продуцирования предпочтительно осуществляют в режиме с периодической подпиткой, но в качестве альтернативы можно использовать любой другой режим, такой как периодический, непрерывный или хемостатный режим. В случае непрерывного или хемостатного режима соотношения общего количества использованного цистеина или цистеина и/или триптофана рассчитывают в соответствии со скоростью непрерывного потока в зависимости от скорости выведения продуцированного рекомбинантного белка из сосуда для продуцирования.
В одном из вариантов осуществления способ включает этап выделения рекомбинантного белка из среды для культивирования клеток и дополнительный этап очистки рекомбинантного белка.
В дополнительном варианте осуществления очистка включает хроматографию с белком А.
В дополнительном варианте осуществления способ включает дополнительный этап приготовления состава очищенного рекомбинантного белка.
В одном из вариантов осуществления состав рекомбинантного белка готовят в виде жидкого состава, содержащего одну или более аминокислот и поверхностно-активное вещество.
В дополнительном варианте осуществления состав содержит гистидин и/или пролин.
В другом дополнительном варианте осуществления состав содержит гистидин в концентрации от 5 мМ до 100 мМ, например в концентрации от 10 до 50 мМ, и/или пролин в концентрации от 100 до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например от 5 до 6, например от 5,5 до 6.
В другом дополнительном варианте осуществления состав содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5,2 до 6,0, например примерно 5,6.
В дополнительном варианте осуществления поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно в концентрации от 0,001% до 0,1% (мас./об.), например от 0,005% до 0,1%, например от 0,01% до 0,1%, например от 0,01% до 0,05%, например 0,03%.
В другом дополнительном варианте осуществления рекомбинантный белок представляет собой антитело, причем антитело находится в составе в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например примерно 140 мг/мл.
Рекомбинантный белок, например антитело или его антигенсвязывающий фрагмент, обычно находится в супернатанте клеточной культуры млекопитающих, обычно в культуре клеток СНО. В случае клеток-хозяев СНО, антитело или его антигенсвязывающий фрагмент секретируется в супернатант, и указанный супернатант можно собирать способами, известными в данной области, обычно центрифугированием.
Рекомбинантные белки, которые могут быть получены способом по изобретению
Способ по изобретению можно использовать для получения рекомбинантного полипептида или белка любого типа, включая, например, пептиды или более крупные белки, третичная структура которых является значимой, а также, например, гликопротеины и мультимерные белки. Однако предпочтительно рекомбинантный белок, полученный способом по изобретению, представляет собой антитело или его антигенсвязывающий фрагмент. Используемый в настоящем описании термин «антитело» или «антитела» включает, например, как моноклональные, так и поликлональные антитела, а также как моноспецифические, так и полиспецифические антитела, такие как биспецифические антитела.
Термин «антитело» или «антитела» включает антитела любого вида, в частности видов млекопитающих, обычно содержащие две тяжелые цепи и две легкие цепи, человеческие антитела любого изотипа, включая IgA1, IgA2, IgD, IgG1, IgG2a, IgG2b, IgG3 IgG4 IgE и IgM и их модифицированные варианты, и антитела приматов, которые не являются человеком, например шимпанзе, бабуина, макаки-резус или яванского макака, антитела грызунов, например мыши, крысы или кролика; антитела козы или лошади и их производные, или антитела птиц, таких видов как курицы, или рыб, таких видов как акулы. Термин «антитело» или «антитела» также относится к «химерным» антителам, в которых первая часть по меньшей мере одной последовательности тяжелой и/или легкой цепи антитела принадлежит первому виду, а вторая часть последовательности тяжелой и/или легкой цепи антитела принадлежит второму виду. Химерные антитела, представляющие интерес в настоящем описании, включают «приматизированные» антитела, содержащие антигенсвязывающие последовательности вариабельного домена, полученные от примата, не являющегося человеком (например, обезьяны Старого Света, такой как бабуин, макака-резус или яванский макак), и последовательности человеческой константной области. «Гуманизированные» антитела представляют собой химерные антитела, которые содержат последовательность, полученную от нечеловеческих антител. По большей части гуманизированные антитела представляют собой человеческие антитела (реципиентное антитело), в которых остатки из гипервариабельной области реципиента заменены остатками из гипервариабельной области или определяющей комплементарность области (CDR) вида, не являющегося человеком (донорское антитело), такого как как мышь, крыса, кролик, цыпленок или примат, не являющийся человеком, обладающими требуемой специфичностью, сродством и активностью. В большинстве случаев остатки человеческого (реципиентного) антитела вне CDR; т.е. в каркасной области (FR), дополнительно заменены соответствующими нечеловеческими остатками. Кроме того, гуманизированные антитела могут содержать остатки, которые отсутствуют в реципиентном антителе или в донорском антителе. Эти модификации выполняют для дальнейшего улучшения характеристик антител. Гуманизация уменьшает иммуногенность нечеловеческих антител у людей, тем самым облегчая применение антител для лечения заболеваний человека. Гуманизированные антитела и несколько различных технологий их получения хорошо известны в данной области. Термин «антитело» или «антитела» также относится к человеческим антителам, которые можно создавать в качестве альтернативы гуманизации. Например, можно получить трансгенных животных (например, мышей), которые способны после иммунизации продуцировать полный репертуар человеческих антител, не производя при этом эндогенные мышиные антитела. Например, имеется публикация о том, что гомозиготная делеция гена области соединения (JH) тяжелой цепи антитела у химерных и мутантных мышей зародышевой линии приводит к полному ингибированию продуцирования эндогенных антител. Перенос пула генов иммуноглобулинов зародышевой линии человека в такие мутантные мышиные зародышевые линии приведет к продуцированию человеческих антител со специфичностью в отношении конкретного антигена при иммунизации указанным антигеном трансгенного животного, несущего гены иммуноглобулинов зародышевой линии человека. Технологии получения таких трансгенных животных и технологии выделения и получения человеческих антител от таких трансгенных животных известны в данной области техники. Альтернативно, у трансгенного животного, например мыши, заменяют только гены иммуноглобулинов, кодирующие вариабельные области мышиного антитела, соответствующими последовательностями генов вариабельных областей человеческих иммуноглобулинов. Гены иммуноглобулинов мышиной зародышевой линии, кодирующие константные области антитела, остаются неизменными. Таким образом, эффекторные функции антител в иммунной системе трансгенной мыши и, следовательно, развитие В-клеток практически не изменяются, что может привести к улучшенному ответу антител на провокацию антигеном in vivo. После выделения генов, кодирующих конкретное представляющее интерес антитело, из таких трансгенных животных гены, кодирующие константные области, могут быть заменены генами константных областей человека с получением, таким образом, полностью человеческого антитела. Используемый в настоящей заявке термин «антитело» или «антитела» также относится к агликозилированному антителу.
Используемый в настоящей заявке термин «его антигенсвязывающий фрагмент» или его грамматические варианты относятся к фрагменту антитела. Фрагмент антитела содержит по меньшей мере один домен тяжелой или легкой цепи иммуноглобулина, как известно в данной области, и связывается с одним или более антигенами. Примеры фрагментов антител по изобретению включают фрагменты Fab, Fab', F(ab')2 и Fv и scFv; а также диатела, триантела, тетратела, мини-тела, доменные антитела (dAb), такие как sdAb, VHH или антитела верблюда (например, полученные из верблюдов или лам, такие как Nanobodies™) и фрагменты VNAR, одноцепочечные антитела, биспецифические, триспецифические, тетраспецифические или полиспецифические антитела, образованные из фрагментов антител или антител, включая, без ограничения, конструкции Fab-Fv или Fab-Fv-Fv. Определенные выше фрагменты антител известны в данной области техники.
В особенно предпочтительном варианте осуществления антитело или его антигенсвязывающий фрагмент, полученный способами по изобретению, представляет собой (таблица 1):
1) антитело или его антигенсвязывающий фрагмент, который:
а. содержит CDR-H1, имеющую последовательность, определенную в SEQ ID NO: 1; CDR-H2, имеющую последовательность, определенную в SEQ ID NO: 2; CDR-H3, имеющую последовательность, определенную в SEQ ID NO: 3; CDR-L1, имеющую последовательность, определенную в SEQ ID NO: 4; CDR-L2, имеющую последовательность, определенную в SEQ ID NO: 5, и CDR-L3, имеющую последовательность, определенную в SEQ ID NO: 6; или
b. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую последовательность, определенную в SEQ ID NO: 8; или
с. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 8;d. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 11; или
е. содержит вариабельную область легкой цепи, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 7, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 11; или
2) антитело, которое содержит легкую цепь, имеющую последовательность, определенную в SEQ ID NO: 9, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 10; или
3) антитело, которое содержит легкую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 9, и тяжелую цепь, имеющую по меньшей мере 80% идентичности или сходства, предпочтительно, 90% идентичности или сходства с последовательностью, определенной в SEQ ID NO: 10.
В настоящем описании определяющие комплементарность области («CDR») определены в соответствии с определением по Кабат. Определение по Кабат является стандартом для нумерации остатков в антителе и обычно используется для идентификации областей CDR (Kabat et al., (1991), 5-е издание, публикация NIH № 91-3242).
SEQ ID NO:1
SEQ ID NO:2
SEQ ID NO:3
SEQ ID NO:4
SEQ ID NO:5
SEQ ID NO:6
SEQ ID NO:7
SEQ ID NO:8
SEQ ID NO:9
SEQ ID NO:10
SEQ ID NO: 11
Рекомбинантный белок или предпочтительное антитело или его антигенсвязывающий фрагмент обычно могут быть продуцированы клетками-хозяевами, содержащими вектор, кодирующий нуклеотидную последовательность белка или антитела.
Антитела или их антигенсвязывающий фрагмент могут содержать только белок тяжелой или легкой цепи, и в этом случае для трансфекции клеток используют только последовательность, кодирующую белок тяжелой цепи или легкой цепи. Для получения продуктов, содержащих как тяжелые, так и легкие цепи, клетки могут быть трансфицированы двумя векторами: первым вектором, кодирующим белок легкой цепи, и второй вектор, кодирующий белок тяжелой цепи. Альтернативно, можно использовать один вектор, который включает последовательности, кодирующие белки легкой цепи и тяжелой цепи.
В предпочтительном варианте осуществления изобретение относится к способу получения антитела или его антигенсвязывающего фрагмента, включающему:
а. культивирование клеток СНО, способных продуцировать в среду антитело или его антигенсвязывающий фрагмент;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют антитело или его антигенсвязывающий фрагмент, причем во время указанной фазы продуцирования культуру подпитывают цистеином или цистином до общего количества от 10 до 30 мас.% от ожидаемого общего количества продуцируемого антитела или его антигенсвязывающего фрагмента;
с. и, необязательно, выделение антитела или его антигенсвязывающего фрагмента из среды для культивирования клеток,
при этом общее количество цистеина или цистина, обеспечиваемого в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и
причем цистеин или цистин обеспечивают путем ежедневного добавления во время фазы продуцирования, и
при этом концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени на фазе продуцирования, предпочтительно, когда концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени на фазе продуцирования, и
при этом указанное антитело или его антигенсвязывающий фрагмент предпочтительно:
а. содержит CDR-H1, имеющую последовательность, определенную в SEQ ID NO: 1; CDR-H2, имеющую последовательность, определенную в SEQ ID NO: 2; CDR-H3, имеющую последовательность, определенную в SEQ ID NO: 3; CDR-L1, имеющую последовательность, определенную в SEQ ID NO: 4; CDR-L2, имеющую последовательность, определенную в SEQ ID NO: 5, и CDR-L3, имеющую последовательность, определенную в SEQ ID NO: 6; или
b. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую последовательность, определенную в SEQ ID NO: 8.
В дополнительном предпочтительном варианте осуществления изобретение относится к способу получения антитела или его антигенсвязывающего фрагмента, включающему:
а. культивирование клеток СНО, способных продуцировать в среду антитело или его антигенсвязывающий фрагмент;
b. проведение культуры через фазу продуцирования, на которой клетки продуцируют антитело или его антигенсвязывающий фрагмент, причем во время указанной фазы продуцирования среду для культивирования клеток подпитывают:
• цистеином или цистином до общего количества от 10 до 30 мас.% от ожидаемого общего количества продуцируемого антитела или его антигенсвязывающего фрагмента; и/или
• триптофаном до общего количества от 8 до 35 мас.% от ожидаемого общего количества продуцируемого антитела или его антигенсвязывающего фрагмента,
с. и, необязательно, выделение антитела или его антигенсвязывающего фрагмента из среды для культивирования клеток,
при этом общее количество цистеина или цистина, обеспечиваемого в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и
причем общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток/л), при этом количество клеток относится к ожидаемому суммарному количеству жизнеспособных клеток в конце фазы продуцирования, и
причем цистеин или цистин и/или триптофан обеспечивают путем ежедневного добавления во время фазы продуцирования, и
при этом концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени на фазе продуцирования, предпочтительно, когда концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени на фазе продуцирования, и
при этом концентрация триптофана в культуре клеток не превышает 0,6 г/л среды в любой момент времени на фазе продуцирования, предпочтительно, когда концентрация триптофана в среде для культуры клеток не превышает 0,3 г/л в любой момент времени на фазе продуцирования, и
при этом указанное антитело или его антигенсвязывающий фрагмент предпочтительно:
а. содержит CDR-H1, имеющую последовательность, определенную в SEQ ID NO: 1; CDR-H2, имеющую последовательность, определенную в SEQ ID NO: 2; CDR-H3, имеющую последовательность, определенную в SEQ ID NO: 3; CDR-L1, имеющую последовательность, определенную в SEQ ID NO: 4; CDR-L2, имеющую последовательность, определенную в SEQ ID NO: 5, и CDR-L3, имеющую последовательность, определенную в SEQ ID NO: 6; или
b. содержит вариабельную область легкой цепи, имеющую последовательность, определенную в SEQ ID NO: 7, и вариабельную область тяжелой цепи, имеющую последовательность, определенную в SEQ ID NO: 8.
Ниже изобретение дополнительно описано с помощью примеров со ссылками на варианты осуществления, показанные на прилагаемых чертежах.
ПРИМЕРЫ
Сокращения
mAb: моноклональное антитело; MFCS: система управления мультиферментацией; Cys: цистеин или цистин; Trp: триптофан
Материалы и методы
Клеточная линия, культура клеток и процедура проведения эксперимента
Использовали клеточную линию CHO-DG44. Клетки культивировали в среде для инокуляции с определенными химическими веществами без компонентов животного происхождения, содержащей цистин (0,05 г/л) и триптофан (0,2 г/л), в стандартных рабочих условиях (рН 7, температура 36,8°С) в стеклянном 2 л биореакторе с мешалкой с башнями подачи (C-DCUII, Sartorius Stedim Biotech), управляемой системой управления мультиферментацией (Sartorius Stedim Biotech). Использовали четыре разные линии клеток-продуцентов, каждая из которых продуцировала моноклональное антитело (mAb), обозначенное mAb1, mAb2, mAb3 и mAb4, соответственно. mAb1 представляет собой анти-FcRn антитело, содержащее легкую цепь, имеющую последовательность, определенную в SEQ ID NO: 9, и тяжелую цепь, имеющую последовательность, определенную в SEQ ID NO: 10.
Процесс продуцирования выполняли в экспериментальном режиме с периодической подпиткой в течение 14 дней. Во время этой фазы моноклональные антитела секретировались в среду. Образцы отбирали ежедневно для определения плотности жизнеспособных клеток (VCD), жизнеспособности, pH в автономном режиме, pCO2, осмоляльности, концентрации глюкозы-лактата, концентрации аминокислот и концентрации mAb (которые хранили при -80°C). При необходимости каждый день вручную добавляли антивспениватель, чтобы предотвратить образования пены. Через 72 часа после инокуляции начинали процесс непрерывной подпитки питательными веществами с заданной скоростью. Среда для непрерывной подпитки питательными веществами не содержала цистеин/цистин или триптофан. В это время цистеин/цистин и триптофан добавляли ежедневно в течение 10 дней в виде болюсной подпитки в количестве, указанном в примерах ниже. Количество цистеина/цистина и триптофана, указанное в примерах, представляет собой общее количество болюсных добавок, которые начинали вводить через 72 часа после инокуляции, с учетом начального количества этих аминокислот, уже присутствующих в среде для инокуляции. Культуру подпитывали глюкозой в виде болюса, когда концентрация глюкозы падала ниже 6 г/л (начиная с дня 6), и концентрацию глюкозы измеряли ежедневно. Перед добавлением подпитки отбирали образцы для аминокислотного анализа. Концентрации после подпитки вычисляли с учетом состава подпитки и измеренной концентрации питательных веществ перед добавлением подпитки.
Аналитические методы
Подсчет клеток выполняли с помощью устройства автоматического подсчета клеток VI-CELL® XR (Beckman-Coulter, Inc., Brea, CA), которое работало на основе исключения трипанового синего.
Уровни глюкозы и лактата в культуральной среде определяли с помощью автоматического анализатора NOVA 400 BioProfile (Nova Biomedical, Waltham, MA).
Для определения осмоляльности использовали осмометр точки замерзания модели 2020 (Advanced Instruments, Inc., Norwood, MA). Измерение содержания газов и значений pH в автономном режиме выполняли с помощью анализатора газов в крови модели BioProfile pHOx® (Nova Biomedical Corporation, Waltham, MA).
Концентрации метаболитов определяли ежедневно с помощью системы CedexBioHT (Roche).
Анализ титра продукта осуществляли с помощью анализатора модели ForteBio Octet (ForteBio, Inc., Menlo Park, CA) или с помощью жидкостной хроматографии высокого давления (ВЭЖХ), используя образцы супернатанта клеточной культуры, которые до анализа хранили при -80°C.
Аминокислоты анализировали с помощью обращенно-фазовой ультраэффективной жидкостной хроматографии (УЭЖХ, UPLC) (метод Waters AccQ⋅Tagultra) после ультрафильтрации с использованием центробежных фильтров Amicon Ultra-0.5 мл (Merck Millipore, Billerica, MA).
Для очистки mAb в образцах супернатанта клеточной культуры использовали очистку с белком A (система ÄKTA Xpress). Относительное процентное содержание главной, кислых (APG для группы кислых пиков) и щелочных (BPG для группы щелочных пиков) изоформ очищенного mAb определяли методом капиллярного электрофореза с визуализацией результатов (ProteinSimple iCE3). Уровни высокомолекулярных видов (HMWS), мономерных и низкомолекулярных видов (LMWS) очищенного mAb определяли методом эксклюзионной хроматографии (SE-UPLC).
Интенсивность окраски составов концентрированных mAb1 и mAb2 измеряли в концентрированных элюатах с белком A с помощью спектрофотометра в режиме пропускания (UltrascanPro) и сравнивали по шкале Internationale de L’éclairage (CIL). Численные результаты нормировали на концентрацию 40 мг/мл.
Очищенные mAb1 анализировали методом масс-спектрометрии с электрораспылительной ионизацией (ESI-MS). Выполняли картирование пептидов для идентификации посттрансляционных модификаций антител. Статистический анализ выполняли с помощью программного обеспечения SAS JMP 11.
Пример 1
В двухлитровые биореакторы инокулировали клетки СНО, продуцирующие mAb1, с плотностью посева 0,35×106 клеток/мл. В процессе с периодической подпиткой тестировали восемь экспериментальных условий так, как описано в разделе «Материалы и методы», с различными максимальными концентрациями цистеина или цистина и триптофана, достигаемыми в процессе культивирования клеток, и различными общими количествами цистеина или цистина (Cys) и триптофана (Trp), выраженными в мас.% от общей массы продуцированного mAb1 (таблица 2а). Первой целью была оценка влияния цистеина или цистина и триптофана на гетерогенность рекомбинантного mAb1. Вторая цель состояла в определении, обусловлено ли это влияние высокими концентрациями цистеина или цистина и/или триптофана, достигаемыми в процессе культивирования клеток, и/или общим добавленным количеством, выраженным в мас.% от общей массы продуцированного mAb.
Таблица 2a
Заряженные варианты рекомбинантного белка и интенсивность окраски измеряли, как описано в разделе «Материалы и методы». Данные анализировали однофакторным статистическим анализом Anova для линейной модели, и в качестве статистически значимых принимали значения p <0,05.
Как следует из фиг. 2b, наблюдается корреляция между увеличенным уровнем заряженного варианта группы кислых пиков у mAb1 (APG%) и увеличением общего количества добавленного цистеина или цистина в расчете на общий весовой процент (г/г) продуцированного mAb1.
Что касается интенсивности цвета mAb1, существует корреляция между увеличенной интенсивностью цвета mAb1 (b* значение, нормированное на 40 мг/мл) и увеличенным общим количеством добавленного триптофана в расчете на общий весовой процент (г/г) продуцированного mAb1 (фиг. 2а).
Однако, когда данные были проанализированы относительно максимальной концентрации триптофана, цистеина или цистина, оказалось, что она не влияет на цвет или APG (фиг. 2c и 2d).
Для подтверждения того, что именно общее количество цистеина или цистина и триптофана в расчете на общую массу продуцированного mAb1 оказывает влияние на гетерогенность mAb1, а не максимальная концентрация цистеина или цистина и/или триптофана, достигаемая во время фазы продуцирования в режиме с подпиткой, были протестированы 8 экспериментальных условий с различными болюсными добавками цистеина или цистина и триптофана в день 3 для достижения высоких концентраций этих 2-х аминокислот (таблица 2b). Стратегию подпитки адаптировали для получения такого же количества добавленных цистеина или цистина и триптофана в мас.% (г/г) от общей массы продуцированного mAb1. Как видно из условий с подпиткой, существует корреляция между увеличенным уровнем заряженного варианта группы кислых пиков у mAb1 (APG%) и увеличением добавленного общего количества цистеина или цистина в расчете на общее количество продуцированного mAb1 в мас.% (г/г) (фиг. 3b) и между увеличенной интенсивностью цвета mAb1 (b* значение, нормированное на 40 мг/мл) и увеличенным добавленным общим количеством триптофана в расчете на общее количество продуцированного mAb1 в мас.% (г/г) (фиг. 3a). Однако отсутствует корреляция между заряженным вариантом APG и максимальными концентрациями (г/л) цистеина или цистина и триптофана (фиг. 3c и 3d, соответственно). Эти результаты подтверждают, что на заряженный вариант APG и интенсивность цвета влияет общее количество цистеина и триптофана, добавленное во время культивирования клеток в расчете на мас.% (г/г) от общей массы продуцированного mAb1. При этом, максимальная концентрация цистеина или цистина и триптофана не оказывает никакого влияния на заряженный вариант APG и интенсивность цвета.
Таблица 2b
Выводы
Общее количество добавленных Cys и Trp в мас.% от общего количества продуцированного рекомбинантного mAb1 (г/г) оказывает влияние на заряженный вариант mAb1 и интенсивность цвета. Напротив, максимальная концентрация цистеина или цистина и триптофана в среде для культивирования клеток не влияла на качество mAb1.
Пример 2
Для дальнейшего изучения влияния добавленного общего количества цистеина или цистина и триптофана в мас.% от общего количества продуцированного mAb (г/г) во время культивирования клеток использовали 48 экспериментальных условий (таблица 3) в 2л биореакторах, как описано в разделе «Материалы и методы». Анализировали заряженный вариант mAb1, агрегаты (HMWS), интенсивность цвета, титр и рост жизнеспособных клеток.
Таблица 3
Как показано на фиг. 4, общее количество цистеина или цистина и триптофана, добавленное во время фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г), влияет на заряженный вариант кислой группы (APG%). Эффект насыщения составляет примерно 50 мас.% от общего количества цистеина или цистина, добавленного на 14-дневной фазе продуцирования, в расчете на общее количество продуцированного mAb1 (г/г). Влияние цистеина или цистина и триптофана является кумулятивным без какого-либо взаимодействия. Уменьшение выраженного в процентах общего количества цистеина или цистина и триптофана, добавленных во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г), приводит к уменьшению процента кислого пика продуцируемого mAb1.
На фиг. 5 показано влияние общего количества цистеина или цистина и триптофана (добавленного в течение 14 дней культивирования клеток) в мас.% от общей массы продуцированного mAb1 на группу главных пиков. Как видно из APG%, влияние цистеина или цистина и триптофана является кумулятивным без какого-либо взаимодействия. Уменьшение общего количества цистеина или цистина и триптофана, добавленного в течение 14-дневной фазы продуцирования в мас.% от общей массы продуцированного mAb1, приводит к увеличению процента главного пика продуцированного рекомбинантного mAb.
На фиг. 6 показано влияние общего количества цистеина или цистина, добавленного во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г), на высокомолекулярные виды (HMWS). Эффект насыщения составляет примерно 50% от общего количества цистеина или цистина, добавленного во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г). Уменьшение общего количества цистеина или цистина приводит к уменьшению процентного содержания HMWS в продуцируемом рекомбинантном mAb. Влияние общего количества добавленного Trp на HMWS не наблюдается.
Результаты, показанные на фиг. 7, демонстрируют влияние общего количества цистеина или цистина и триптофана, добавленного во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г), на интенсивность цвета (b* значение, нормированное на 40 мг/мл) рекомбинантного mAb1. Уменьшение общего количества цистеина или цистина и триптофана, добавленного во время 14-дневной фазы продуцирования, приводит к уменьшению интенсивности цвета полученного рекомбинантного mAb1. Наблюдается влияние общего количества цистеина или цистина и триптофана, добавленного во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г).
На фиг. 8 показаны контурные графики, демонстрирующие оптимальные диапазоны выраженного в процентах общего количества цистеина или цистина и триптофана, добавленного во время 14-дневной фазы продуцирования в мас.% от общего количества продуцированного mAb1 (г/г), для достижения самых низких значений APG, HMWS, интенсивности цвета и самых высоких значений для группы главных пиков; добавленное общее количество цистеина или цистина и триптофана составляет для цистеина или цистина от 12,06 до 28,03 мас.% от общего количества продуцированного mAb-1 (г/г), и для триптофана от 8,84 до 32,06 мас.% от общего количества mAb1 (г/г).
Вычисляли кумулятивное суммарное количество жизнеспособных клеток (IVCC) на протяжении 14-дневной фазы продуцирования, которое нормировали на объем культуры клеток (CSV). Результаты, приведенные на фиг. 9, показывают влияние на IVCC выраженного в процентах общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток из расчета на начальную массу CSV. Существуют оптимальные диапазоны выраженного в процентах общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток в расчете на начальную массу CSV, которые для цистеина или цистина составляют от 0,08% до 0,24% и для триптофана составляют от 0,07% до 0,15%. Синергетический эффект отсутствовал, и наблюдали только кумулятивный эффект (фиг. 9a и 9b).
На фиг. 10a и 10b показано влияние на титр mAb1 выраженного в процентах общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток в расчете на начальную массу CSV. Существует оптимальный диапазон выраженного в процентах общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток в расчете на массу CSV, который составляет для цистеина или цистина от 0,08% до 0,24% и для триптофана от 0,07% до 0,15% в мас.% от массы CSV. Эффект взаимодействия отсутствует.
Контурные графики, приведенные на фиг. 11a и 11b, показывают оптимальные диапазоны общего количества цистеина или цистина и триптофана, добавленного в среду для культивирования клеток в расчете на IVCC*10-12 в конце фазы продуцирования, которые составляют для Cys от 2,9 до 12 г и для Trp от 2,5 до 7 г.
Пример 3
Получали характеристики рекомбинантного моноклонального антитела, используя 3 экспериментальных условия в режиме с подпиткой, как описано в разделе «Материалы и методы», с добавлением различного общего количества цистеина или цистина и триптофана в мас.% от общего количества продуцированного рекомбинантного mAb1 (таблица 4).
Таблица 4
мас.% (г/г)
мас.% (г/г)
Масс-спектроскопический анализ показал сдвиг массы наиболее интенсивного пика, наблюдаемого в масс-спектре в неденатурирующих и денатурирующих условиях и для гликозилированного mAb1 в результате увеличения концентрации цистеина или цистина и триптофана. Эти наблюдения приводят к заключению, что модификации не связаны с изменениями характера гликозилирования. Анализ масс-спектров легкой цепи, тяжелой цепи и полумера (одна тяжелая цепь плюс одна легкая цепь) после ручной деконволюции позволяет предположить возможность гликирования mAb1 при высоком общем количестве цистеина или цистина и триптофана, добавляемых во время 14-дневной фазы продуцирования в мас.% от общей массы продуцированного mAb. Вероятно, можно наблюдать более высокое содержание аддуктов, т.е. присоединения малых молекул к mAb1. Аддукция цистеина к легкой цепи увеличивается при увеличении добавляемого общего количества цистеина или цистина и триптофана. В таблице 5 суммированы характеристики mAb1, полученные с помощью картирования пептидов, для трех протестированных условий проведения эксперимента. Результаты показывают, что увеличение общего количества цистеина или цистина и триптофана, добавляемого во время 14-дневной фазы продуцирования в мас.% от общей массы продуцированного mAb, приводит к увеличению окисления метионина в треонине 19 тяжелой цепи и дезамидированию треонина 33 тяжелой цепи. Кроме того, варианты APG% и BPG% mAb1 резко возрастают с увеличением общего количества цистеина или цистина и триптофана, добавляемого в мас.% от общей массы продуцированного mAb во время 14-дневной фазы продуцирования, тогда как главный пик увеличивается с уменьшением общего количества цистеина или цистина и триптофана, добавляемого в мас.% от общей массы продуцированного mAb во время 14-дневной фазы продуцирования.
Таблица 5
HC T023
HC T033
Пример 4
Для определения концентрации цистеина или цистина и триптофана, ингибирующей рост клеточной линии CHO DG44, экспрессирующей mAb1, были протестированы различные болюсные добавки цистеина или цистина и триптофана в день 3, которые вводили с целью достижения высоких концентраций этих аминокислот (Таблица 2b). Для получения такого же количества добавленного цистеина или цистина и триптофана в мас.% от общей массы продуцированного mAb1 была адаптирована стратегия подпитки. На фиг. 12 показано, что высокие концентрации цистеина или цистина и триптофана от 0,3 г/л до 0,9 г/л и 0,6 г/л, соответственно, значительно снижают рост клеток (кумулятивное IVCC во время 14-дневной фазы продуцирования, нормированный на CSV).
Пример 5
Было выдвинуто предположение, что истощение цистеина или цистина может оказывать влияние на рост и продуктивность клеточной линии СНО, экспрессирующей mAb1. Были проанализированы девять экспериментальных условий в 2 литровых биореакторах (Таблица 6a): три контрольных условия без истощения цистеина или цистина на протяжении всей фазы продуцирования, два экспериментальных условия с ежедневным истощением, начиная с дня 6 и до завершения процесса продуцирования с подпиткой, в которой концентрация цистеина или цистина составляла 6,87 г/л, и четыре экспериментальных условия с истощением цистеина или цистина в день 6 и с концентрацией цистеина или цистина в подпитке 17,17 г/л. Истощение было циклическим из-за ежедневного добавления цистеина или цистина. Стратегия подпитки описана в таблице 6b. Общее количество добавленного цистеина или цистеина и общее количество цистеина или цистеина, добавленного в расчете на IVCC, показано на фиг. 13. Концентрации Cys перед добавлением подпитки показаны на фиг. 14c. Как показано на фиг. 14а, истощение цистеина или цистина в день 6 не влияет на рост клеток, если концентрация цистеина или цистина в подпитке составляет примерно 17,17 г/л. Не ограничиваясь какой-либо теорией, было выдвинуто предположение, что связанные с цистеином или цистином метаболиты накапливаются и хранятся в клетках, и становятся доступными при истощении цистеина или цистина. Однако истощение цистеина или цистеина влияет на эффективность продуцирования mAb1 клеточной линией (фиг. 14b).
Таблица 6а
Таблица 6b
Пример 6
Влияние уменьшения гетерогенности, обусловленного контролем общего количества цистеина или цистина и триптофана, добавленного в мас.% от общего количества рекомбинантного mAb во время фазы продуцирования, не является исключительным только для mAb1; в экспериментах с добавленным общим количеством цистеина или цистина и триптофана были протестированы три другие клеточные линии СНО, также продуцирующие рекомбинантные антитела (таблица 7). Как показано на фиг. 15а, увеличение уровня заряженного варианта APG и интенсивности цвета коррелируют с увеличением общего количества добавленного цистеина или цистина и триптофана в мас.% от общего количества mAb2. Аналогичные результаты были получены при анализе заряженного варианта APG для mAb3 (15b). Наконец, увеличение уровня заряженных вариантов APG и BPG и уменьшение главного пика коррелировали с увеличением общего количества добавленных цистеина или цистина и триптофана в мас.% от общего количества mAb4 (15c). Эти результаты подтверждают результаты, полученные для mAb1.
Таблица 7
Пример 7
Влияние общего количества цистеина или цистина и триптофана, добавленного в мас.% от общей массы продуцированного рекомбинантного mAb во время 14-дневного продуцирования, анализировали по данным, полученным для четырех различных моноклональных антител, протестированных в настоящей заявке (таблицы 3 и 7). Как показано на фиг.16 (а и b), для всех четырех проанализированных антител увеличение уровня заряженного варианта APG коррелирует с увеличением общего количества добавленного цистеина или цистина и триптофана в мас.% от общей массы продуцированных рекомбинантных антител. Результаты подтверждают, что взаимосвязь между добавленным общим количеством цистеина или цистина и триптофана в мас.% от общей массы продуцированного рекомбинантного антитела и гетерогенностью антитела не ограничивается конкретным антителом, а относится к любому антителу.
Пример 8
Жидкие фармацевтические составы
Фармацевтические составы моноклонального антитела mAb1 получали в режиме с периодической подпиткой, т.е. в 2000 л биореакторе из нержавеющей стали в стандартных рабочих условиях, описанных в разделе «Материалы и методы», с добавлением различных общих количеств цистеина или цистина и триптофана, как указано в таблице 9. Буфер для образца антитела заменяли буфером для диафильтрации (33 мМ His и 250 мМ Pro, pH 5,6) по меньшей мере 7 раз (7 диализных объемов) с последующей ультрафильтрацией через мембрану с отсечкой по молекулярной массе (MWCO) 30 кДа. После достижения концентрации антитела (140 мг/мл +/- 14 мг/мл) добавляли полисорбат 80 в требуемой концентрации (0,03% мас./об. в расчете на конечную концентрацию). Концентрацию антитела измеряли с помощью УФ А280.
В таблице 8 представлены заряженные варианты mAb1 в составе. В двух процессах продуцирования, определенных в таблицах 8 и 9 как «более высокое добавление Cys», общее количество добавленного цистеина или цистина в мас.% от общего количества продуцированного рекомбинантного mAb1 было больше по сравнению с тремя другими процессами продуцирования, определенными в таблицах 8 и 9 как «более низкое добавление Cys». Увеличение уровня заряженных вариантов APG коррелирует с увеличением общего количества добавленного цистеина или цистина в мас.% от общего количества продуцированного рекомбинантного mAb1.
Таблица 8
(опыт #1)
(опыт #2)
(опыт #1)
(опыт #1)
(опыт #2)
(опыт #1)
Пример 9
Модель для прогнозирования уровня группы пиков кислых видов (APG) разрабатывали на основе данных (таблицы 3), полученных для клеточной линии CHO DG44, экспрессирующей антитела mAb1 (фиг. 17). APG выражали в виде функции общего количества цистеина или цистина и триптофана, добавляемого в мас.% от общей массы продуцированного рекомбинантного mAb во время продуцирования в течение 14 дней, с помощью кинетической модели Михаэлиса-Ментен (Michealis Menten).
Для применения этой модели к непрерывному процессу продуцирования, каждый день во время непрерывного процесса продуцирования определяли как новую производственную партию. Поэтому соотношения общего количества использованного цистеина или цистеина и/или триптофана рассчитывали в соответствии со скоростью непрерывного потока в зависимости от скорости выведения продуцированного рекомбинантного белка из сосуда для продуцирования. Непрерывный процесс продуцирования осуществляли в 2-литровых биореакторах по технологии переменного тангенциального потока (Alternating Tangential Flow, ATF). Как показано на фиг. 18, предсказание заряженного варианта APG хорошо согласуется с экспериментальными данными. Результаты подтверждают возможность аппроксимации взаимосвязи между добавляемым общим количеством цистеина или цистина и триптофана в мас.% от общей массы продуцированного рекомбинантного антитела и гетерогенностью антитела на другие режимы продуцирования, такие как продуцирование в непрерывном, периодическом или хемостатном режиме.
--->
СПИСКИ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> UCB Biopharma SPRL
<120> СПОСОБЫ КУЛЬТИВИРОВАНИЯ КЛЕТОК
<130> PF0104-WO
<160> 11
<170> BiSSAP 1.3.6
<210> 1
<211> 10
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 1
Gly Phe Thr Phe Ser Asn Tyr Gly Met Val
1 5 10
<210> 2
<211> 17
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 2
Tyr Ile Asp Ser Asp Gly Asp Asn Thr Tyr Tyr Arg Asp Ser Val Lys
1 5 10 15
Gly
<210> 3
<211> 8
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 3
Gly Ile Val Arg Pro Phe Leu Tyr
1 5
<210> 4
<211> 16
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 4
Lys Ser Ser Gln Ser Leu Val Gly Ala Ser Gly Lys Thr Tyr Leu Tyr
1 5 10 15
<210> 5
<211> 7
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 5
Leu Val Ser Thr Leu Asp Ser
1 5
<210> 6
<211> 9
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 6
Leu Gln Gly Thr His Phe Pro His Thr
1 5
<210> 7
<211> 112
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 7
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Val Gly Ala
20 25 30
Ser Gly Lys Thr Tyr Leu Tyr Trp Leu Phe Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Thr Leu Asp Ser Gly Ile Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly
85 90 95
Thr His Phe Pro His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
<210> 8
<211> 116
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 8
Glu Val Pro Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asp Ser Asp Gly Asp Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Gly Ile Val Arg Pro Phe Leu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser
115
<210> 9
<211> 219
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 9
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
1 5 10 15
Asp Arg Val Thr Ile Thr Cys Lys Ser Ser Gln Ser Leu Val Gly Ala
20 25 30
Ser Gly Lys Thr Tyr Leu Tyr Trp Leu Phe Gln Lys Pro Gly Lys Ala
35 40 45
Pro Lys Arg Leu Ile Tyr Leu Val Ser Thr Leu Asp Ser Gly Ile Pro
50 55 60
Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Glu Phe Thr Leu Thr Ile
65 70 75 80
Ser Ser Leu Gln Pro Glu Asp Phe Ala Thr Tyr Tyr Cys Leu Gln Gly
85 90 95
Thr His Phe Pro His Thr Phe Gly Gln Gly Thr Lys Leu Glu Ile Lys
100 105 110
Arg Thr Val Ala Ala Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu
115 120 125
Gln Leu Lys Ser Gly Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe
130 135 140
Tyr Pro Arg Glu Ala Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln
145 150 155 160
Ser Gly Asn Ser Gln Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser
165 170 175
Thr Tyr Ser Leu Ser Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu
180 185 190
Lys His Lys Val Tyr Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser
195 200 205
Pro Val Thr Lys Ser Phe Asn Arg Gly Glu Cys
210 215
<210> 10
<211> 444
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 10
Glu Val Pro Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asp Ser Asp Gly Asp Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Gly Ile Val Arg Pro Phe Leu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Cys Ser Arg Ser Thr Ser Glu Ser Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Lys Thr Tyr Thr Cys Asn Val Asp His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Arg Val Glu Ser Lys Tyr Gly Pro Pro Cys Pro
210 215 220
Pro Cys Pro Ala Pro Glu Phe Leu Gly Gly Pro Ser Val Phe Leu Phe
225 230 235 240
Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro Glu Val
245 250 255
Thr Cys Val Val Val Asp Val Ser Gln Glu Asp Pro Glu Val Gln Phe
260 265 270
Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr Lys Pro
275 280 285
Arg Glu Glu Gln Phe Asn Ser Thr Tyr Arg Val Val Ser Val Leu Thr
290 295 300
Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys Lys Val
305 310 315 320
Ser Asn Lys Gly Leu Pro Ser Ser Ile Glu Lys Thr Ile Ser Lys Ala
325 330 335
Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro Ser Gln
340 345 350
Glu Glu Met Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val Lys Gly
355 360 365
Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly Gln Pro
370 375 380
Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp Gly Ser
385 390 395 400
Phe Phe Leu Tyr Ser Arg Leu Thr Val Asp Lys Ser Arg Trp Gln Glu
405 410 415
Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His Asn His
420 425 430
Tyr Thr Gln Lys Ser Leu Ser Leu Ser Leu Gly Lys
435 440
<210> 11
<211> 220
<212> Протеин
<213> Искусственная последовательность
<220>
<223> Гуманизированная
<400> 11
Glu Val Pro Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Gly
1 5 10 15
Ser Leu Arg Leu Ser Cys Ala Val Ser Gly Phe Thr Phe Ser Asn Tyr
20 25 30
Gly Met Val Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val
35 40 45
Ala Tyr Ile Asp Ser Asp Gly Asp Asn Thr Tyr Tyr Arg Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Ser Ser Leu Tyr
65 70 75 80
Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys
85 90 95
Thr Thr Gly Ile Val Arg Pro Phe Leu Tyr Trp Gly Gln Gly Thr Leu
100 105 110
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu
115 120 125
Ala Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys
130 135 140
Leu Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser
145 150 155 160
Gly Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser
165 170 175
Ser Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser
180 185 190
Leu Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn
195 200 205
Thr Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys
210 215 220
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБ ПОЛУЧЕНИЯ БИСПЕЦИФИЧЕСКИХ АНТИТЕЛ, БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И ТЕРАПЕВТИЧЕСКОЕ ПРИМЕНЕНИЕ ТАКИХ АНТИТЕЛ | 2018 |
|
RU2795240C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2795973C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2778325C1 |
| АНТИТЕЛА ПРОТИВ TFR И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ ПРОЛИФЕРАТИВНЫХ И ВОСПАЛИТЕЛЬНЫХ РАССТРОЙСТВ | 2016 |
|
RU2737637C2 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2788949C1 |
| БЕЛКОВЫЕ КОМПОЗИЦИИ ПРОТИВ VEGF И СПОСОБЫ ИХ ПОЛУЧЕНИЯ | 2020 |
|
RU2785994C1 |
| АНТИТЕЛА ПРОТИВ BTN3A И ИХ ПРИМЕНЕНИЕ ПРИ ЛЕЧЕНИИ РАКА ИЛИ ИНФЕКЦИОННЫХ ЗАБОЛЕВАНИЙ | 2019 |
|
RU2800726C2 |
| АНТИТЕЛА, НАЦЕЛИВАЮЩИЕСЯ НА КОСТНУЮ ТКАНЬ | 2018 |
|
RU2801206C2 |
| Новый O-фосфосерин-экспортирующий белок и способы получения О-фосфосерина, цистеина и производного цистеина с его применением | 2021 |
|
RU2831309C1 |
| Вариант белка рецептора цАМФ и способ получения L-аминокислоты с его применением | 2019 |
|
RU2743745C1 |

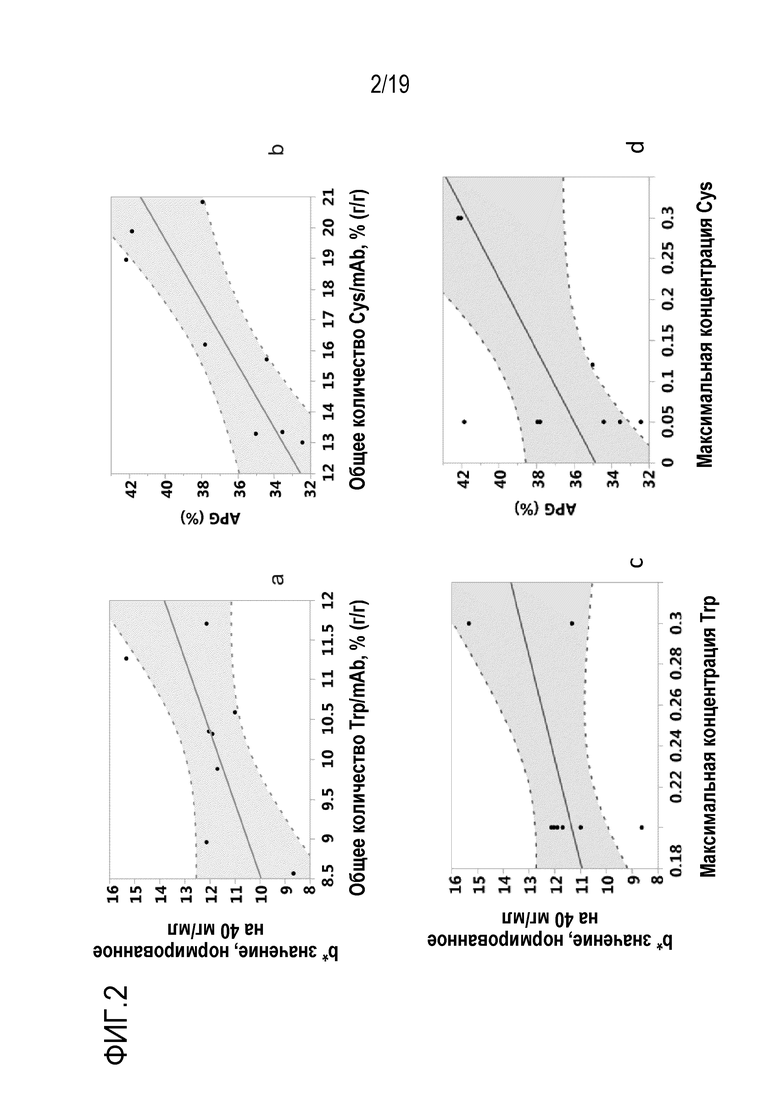
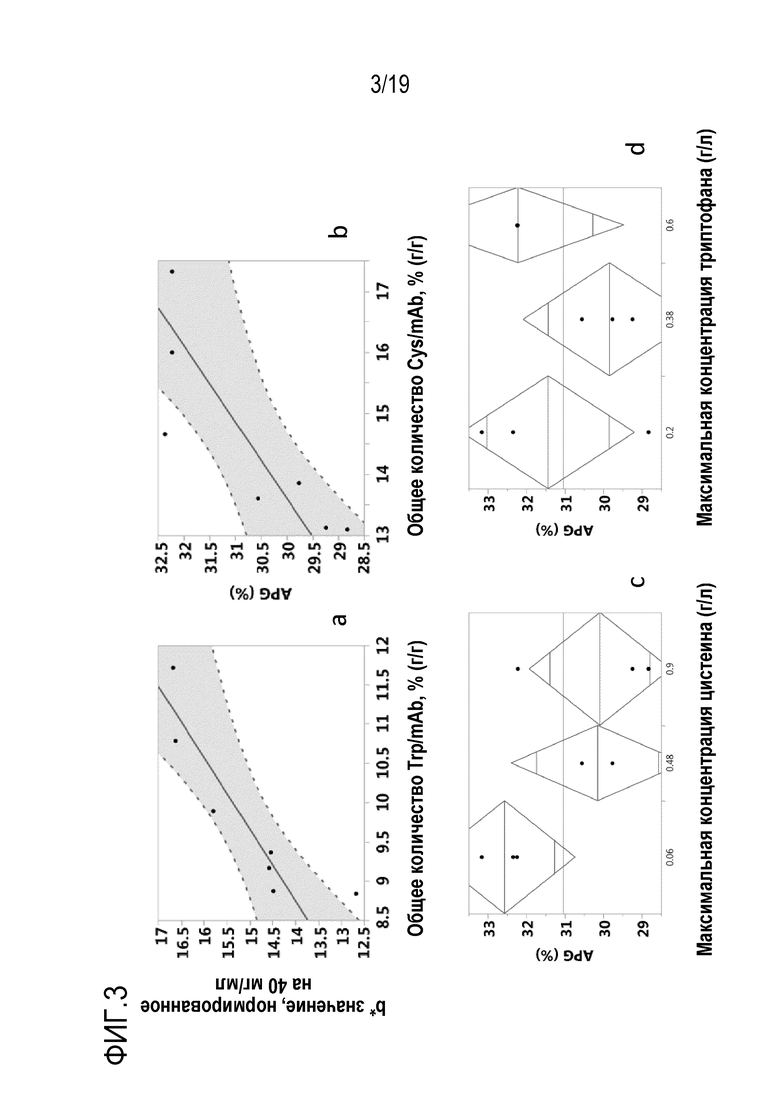
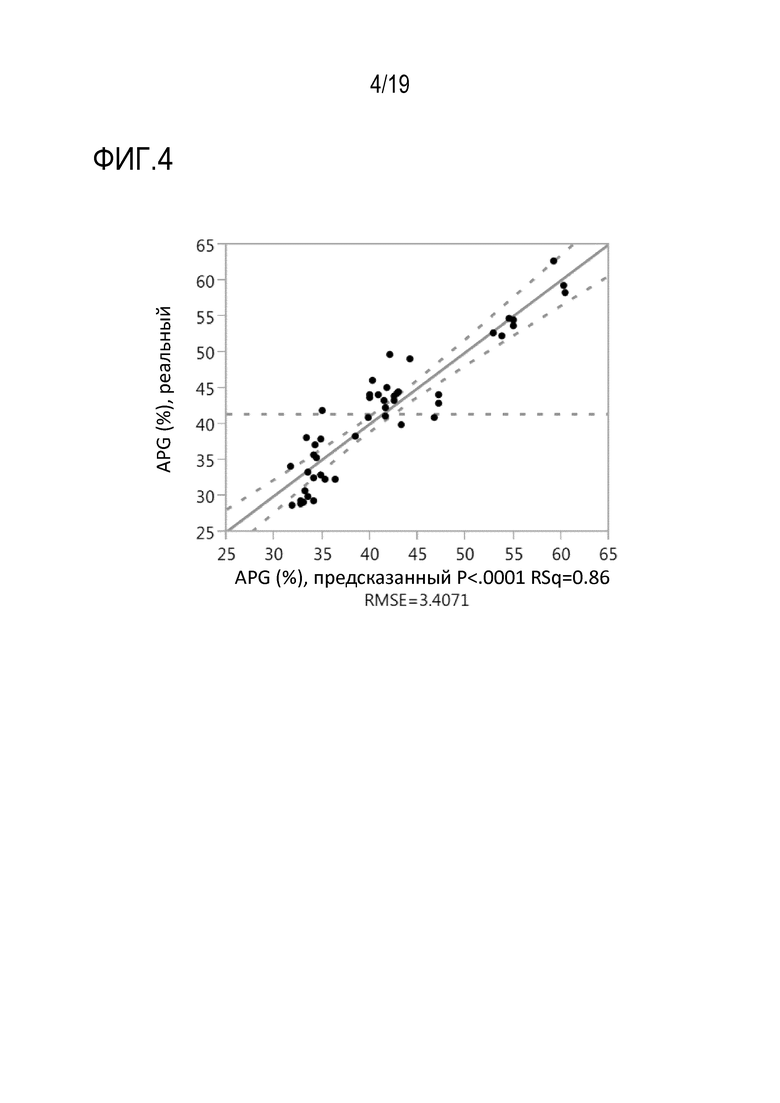
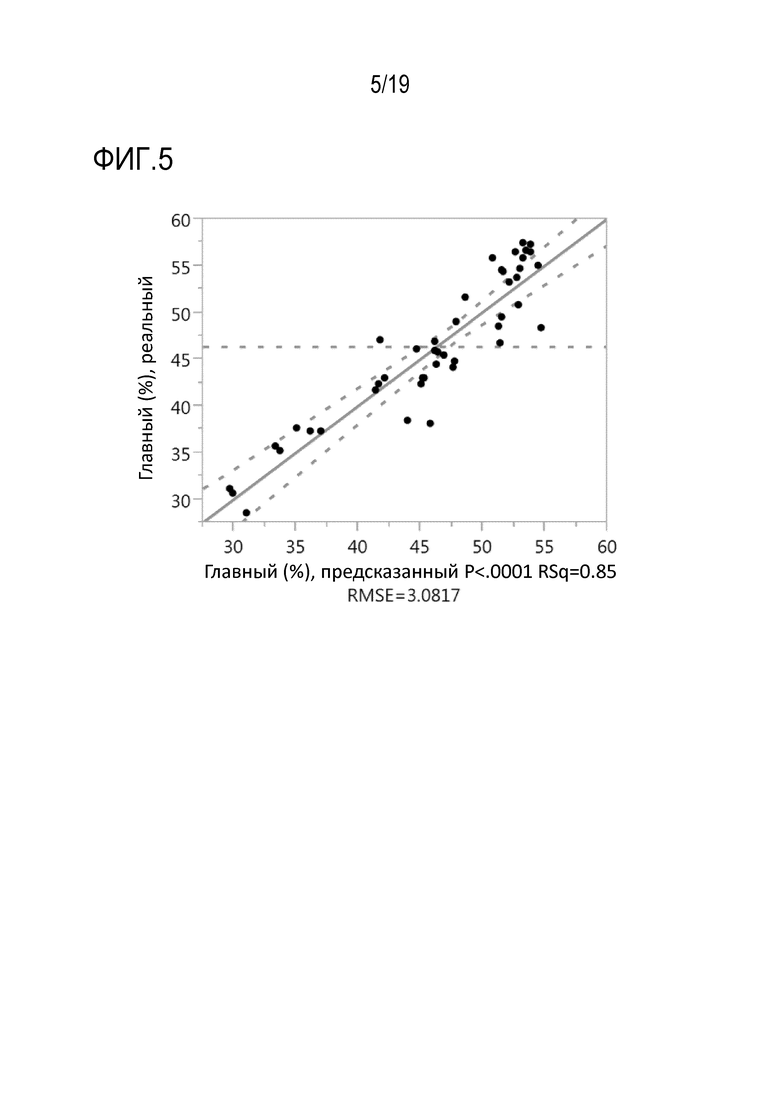
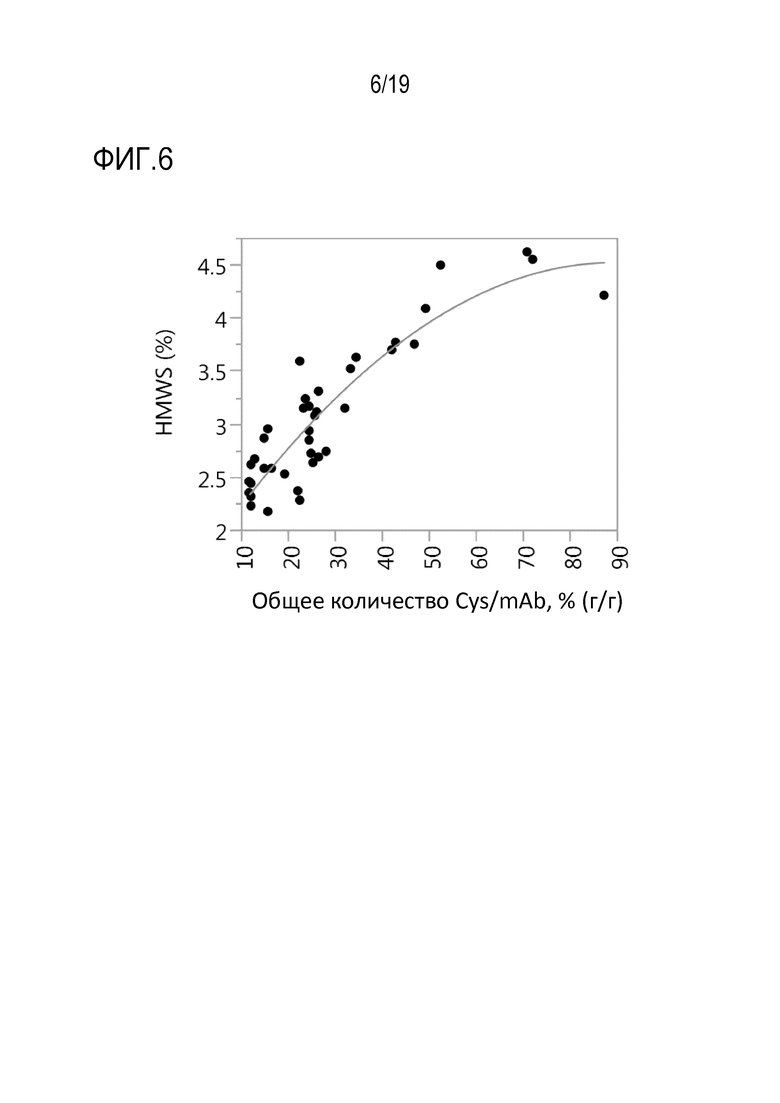
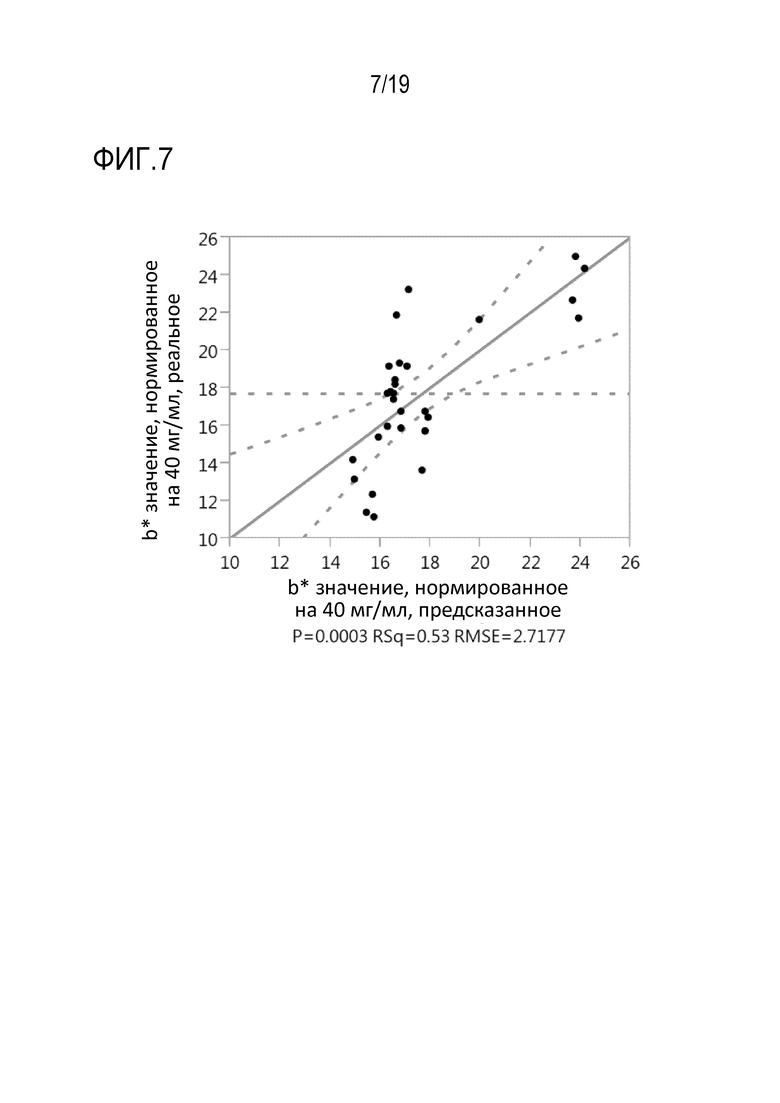
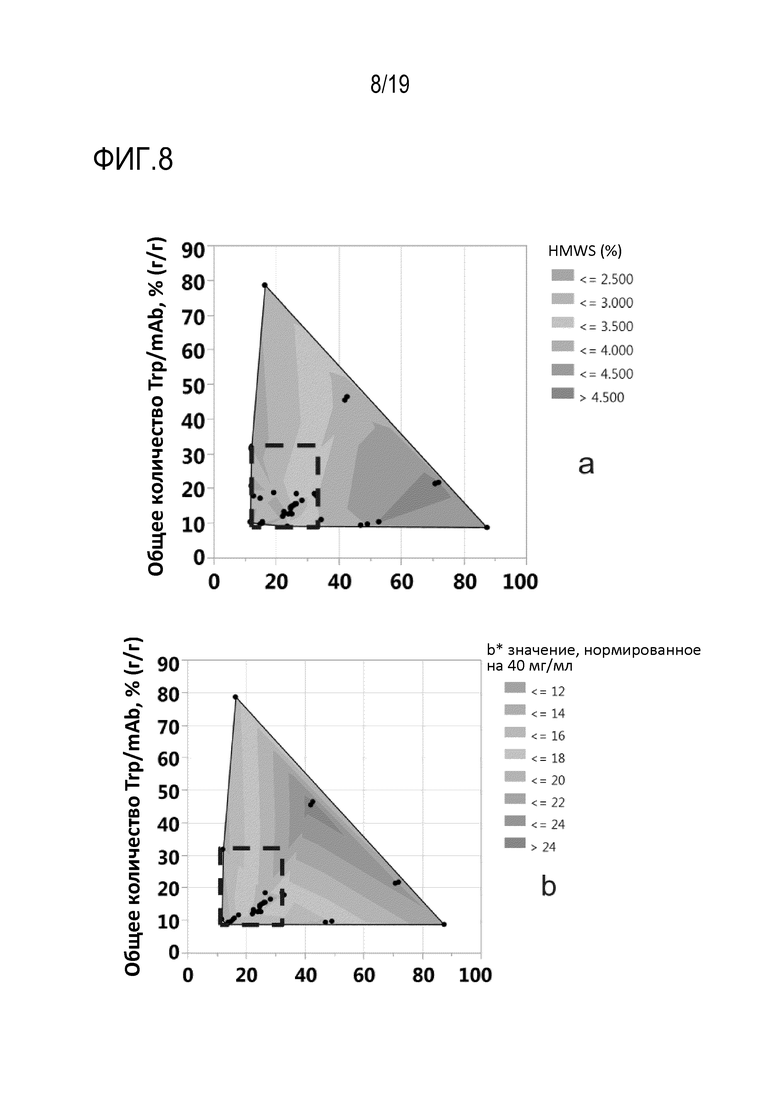
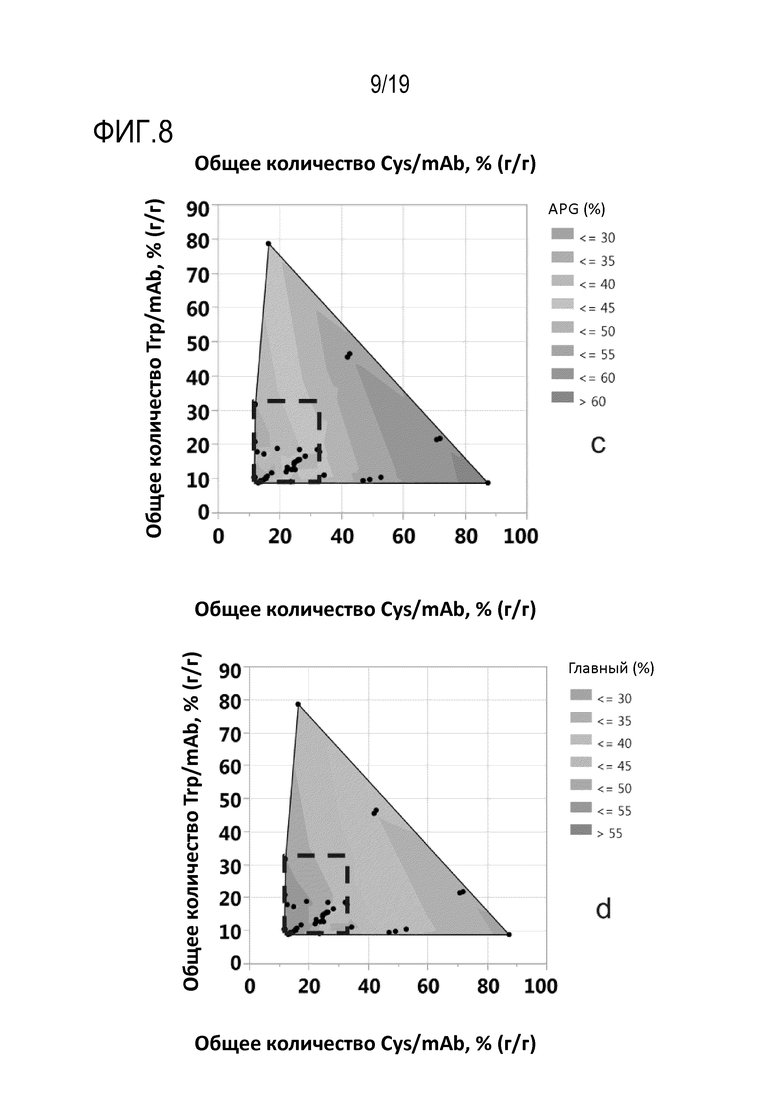
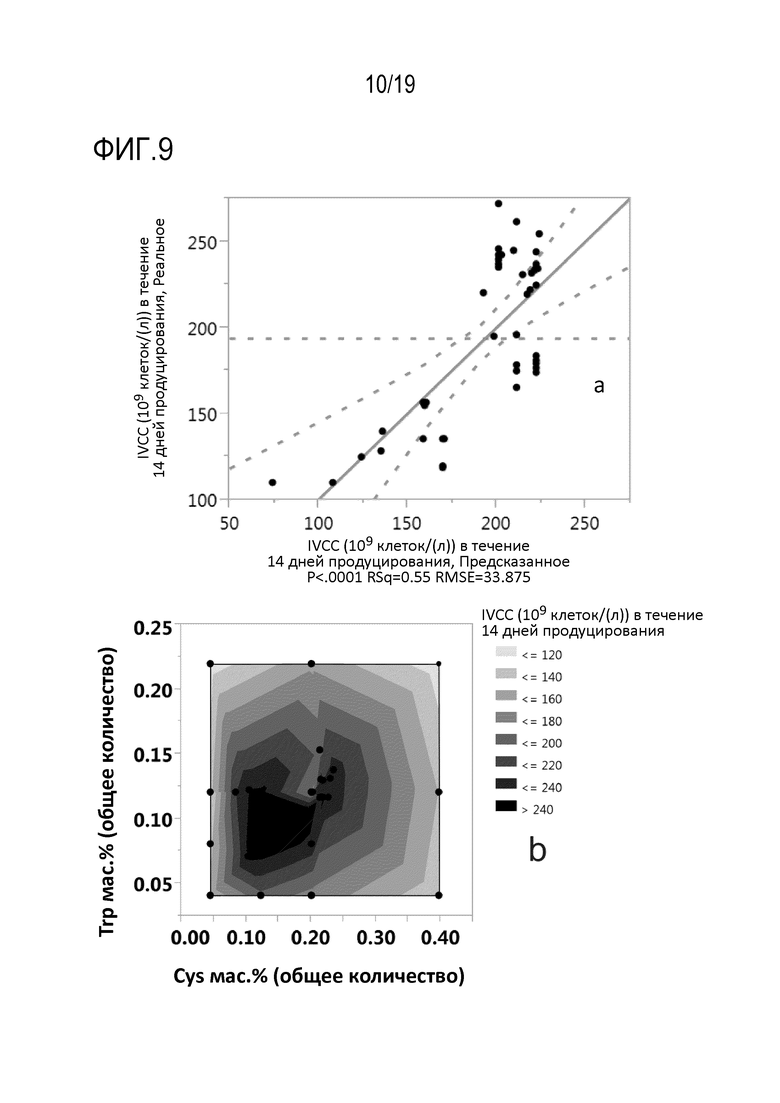
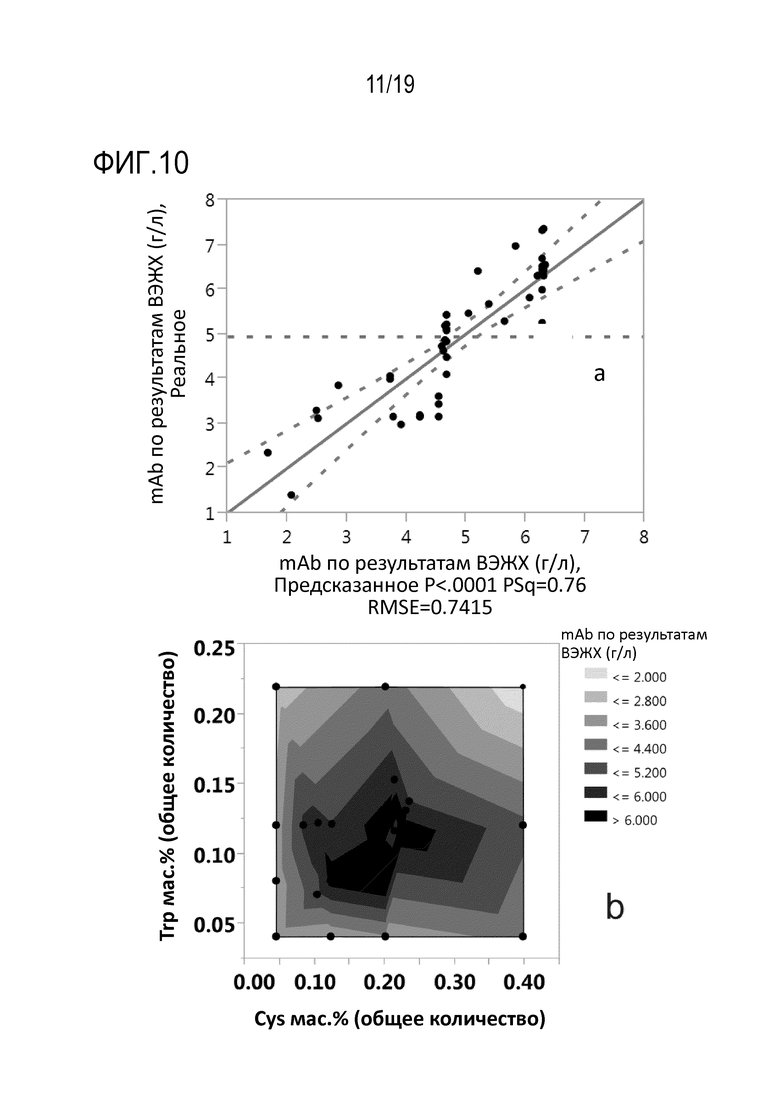
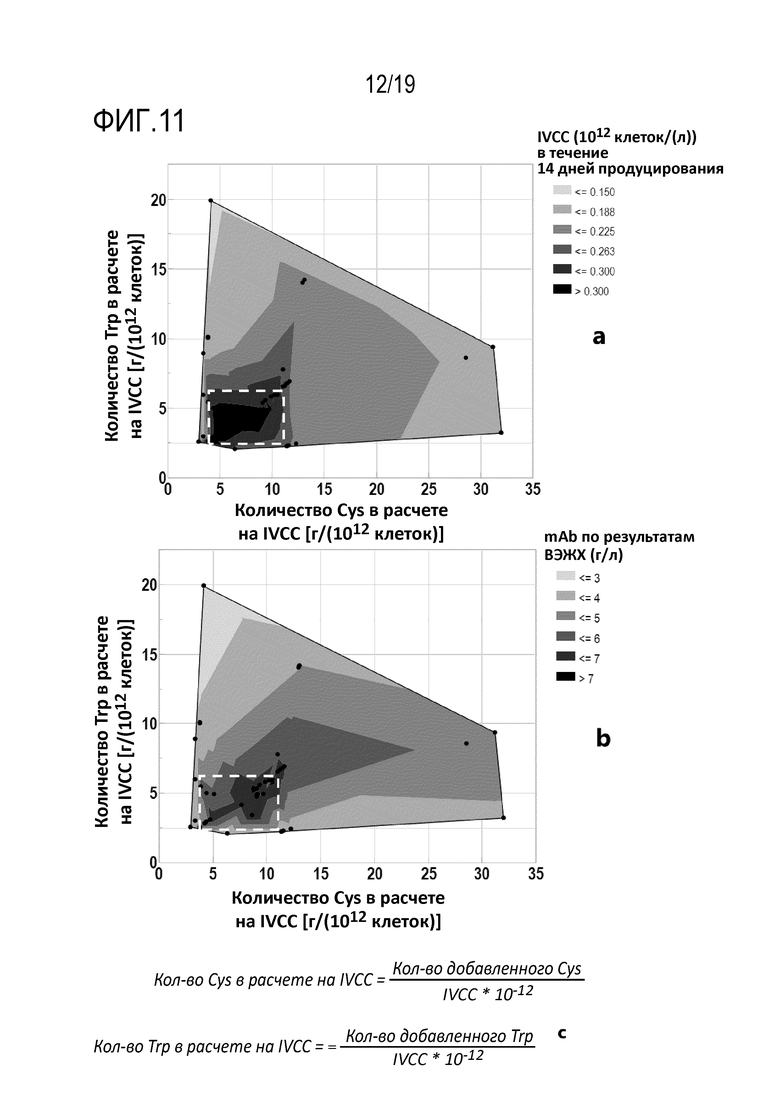
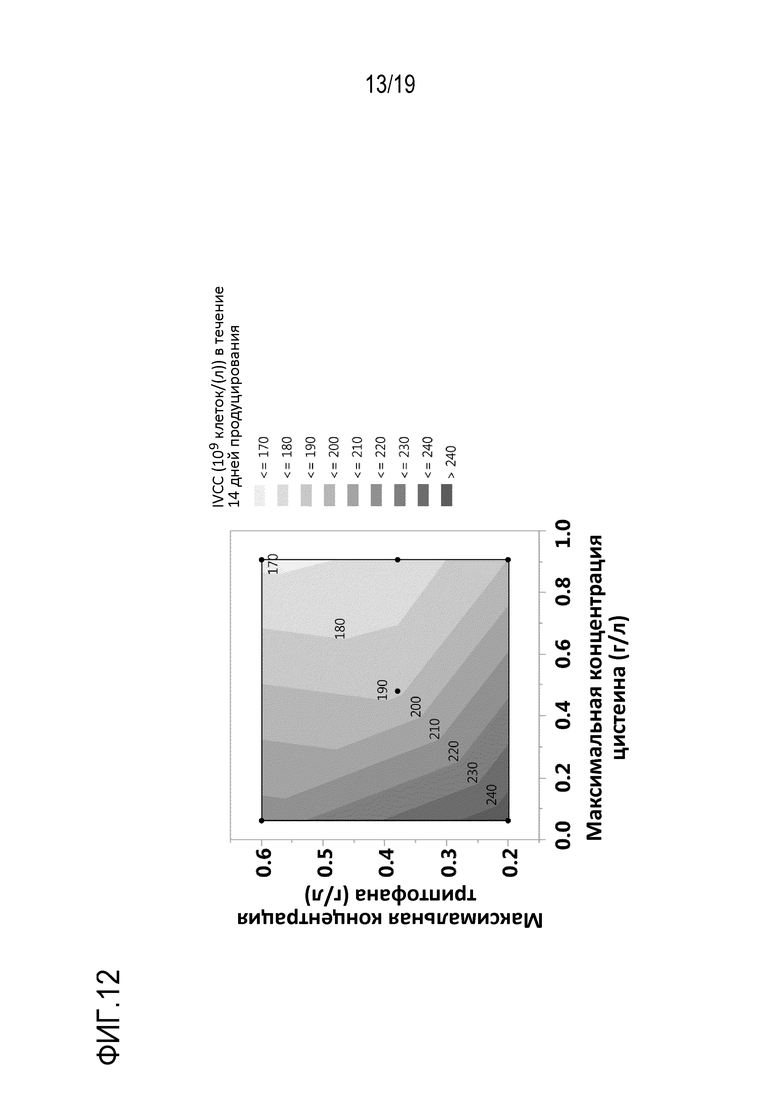
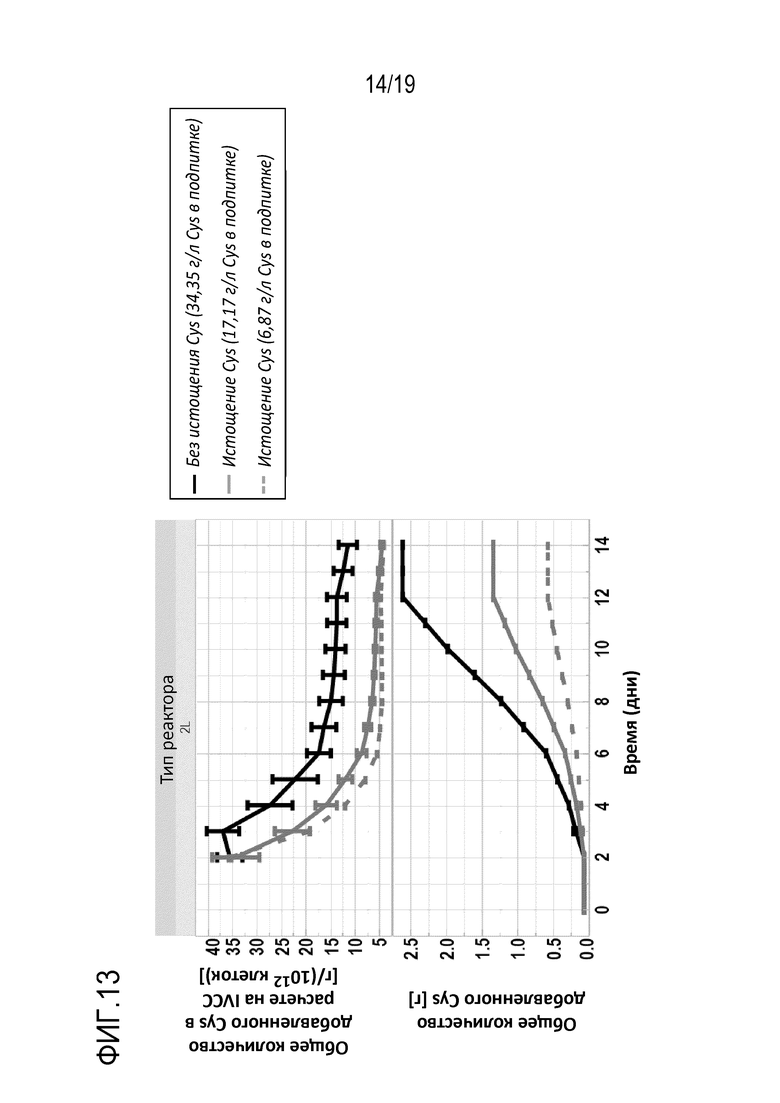
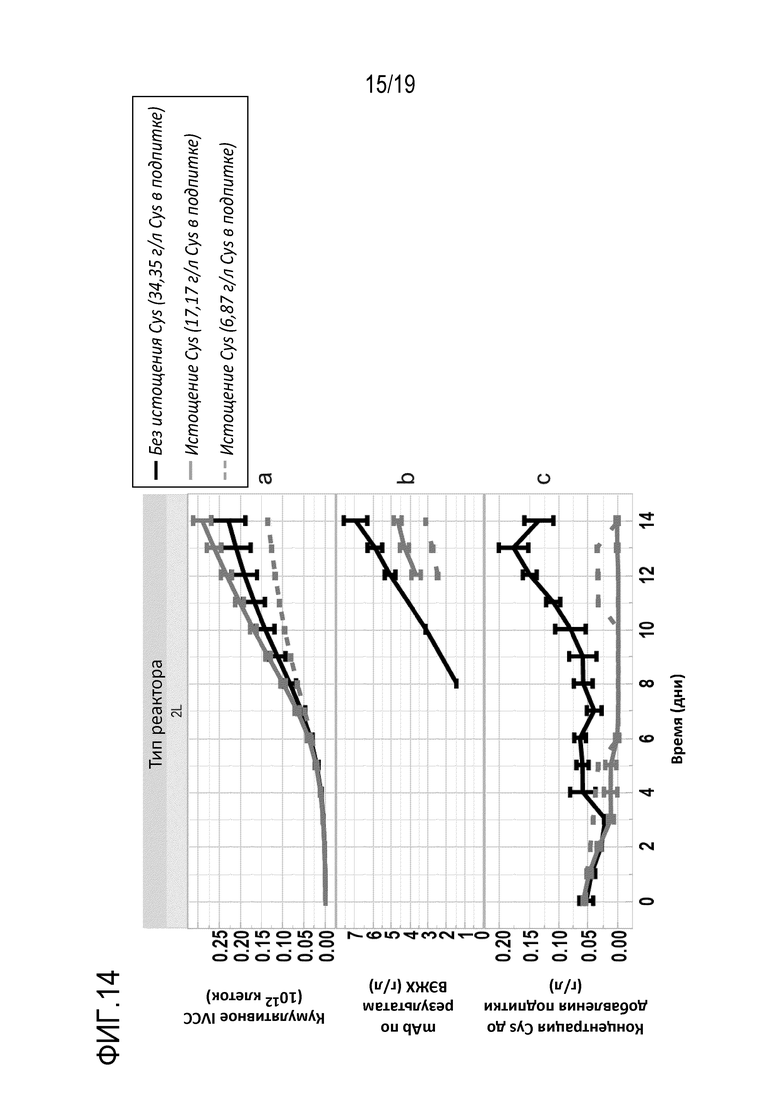
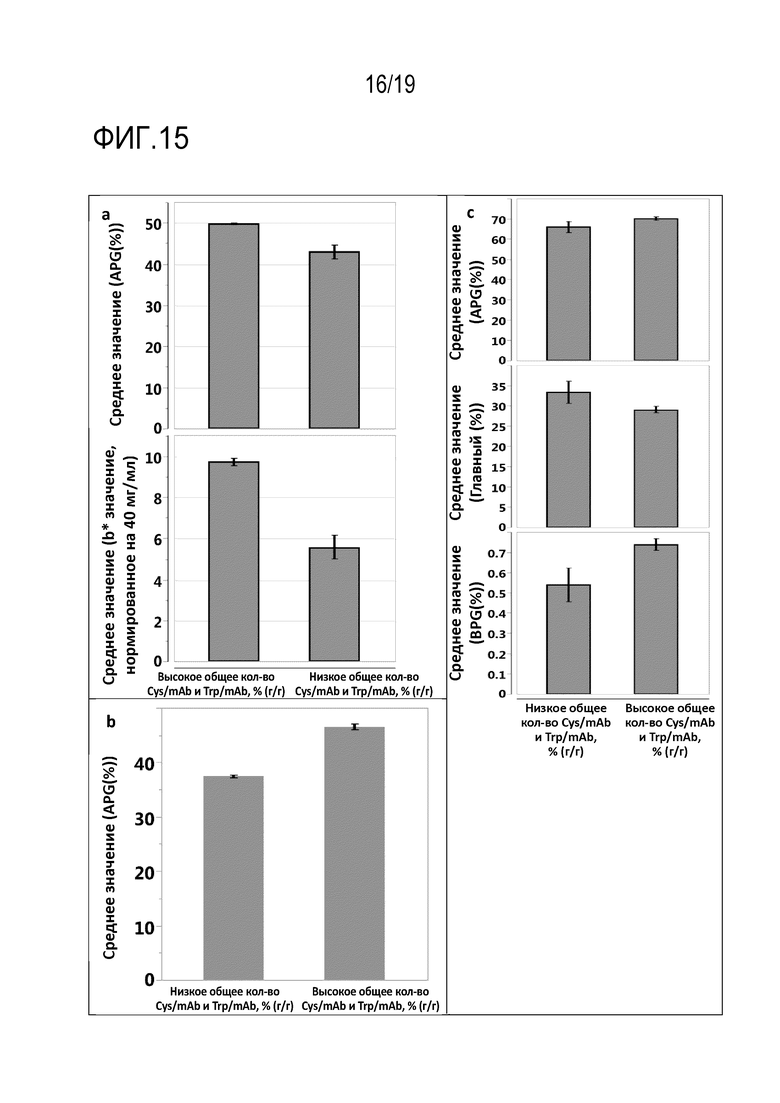
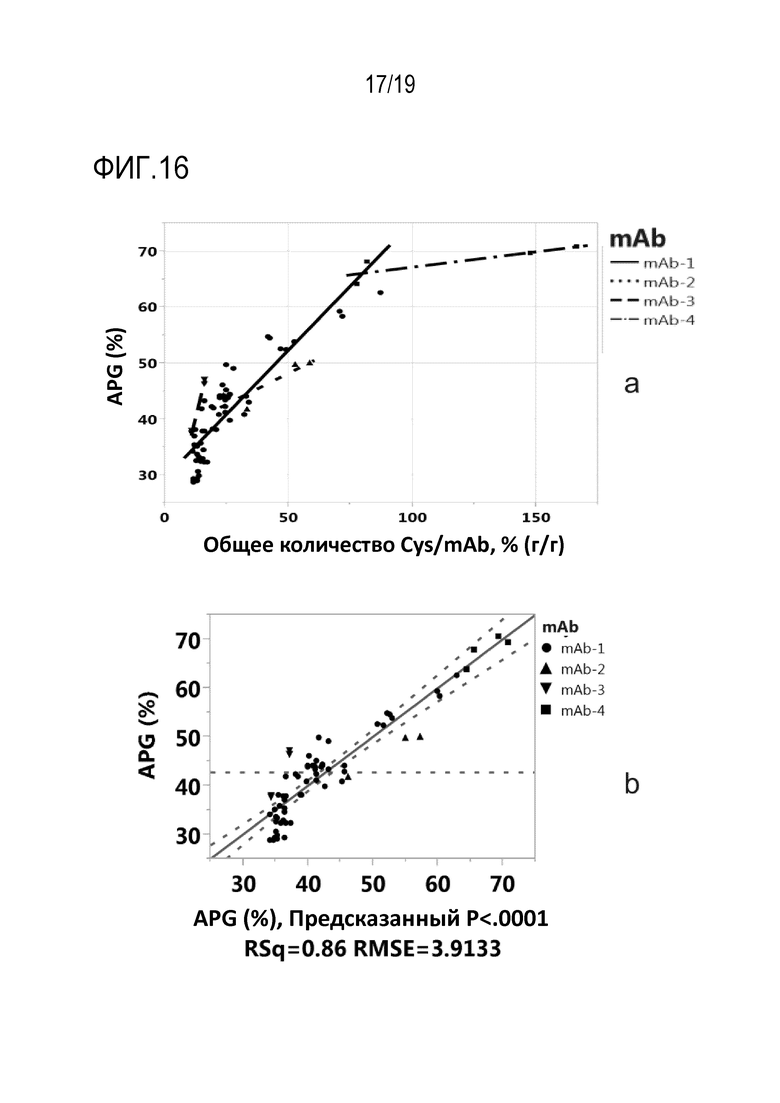

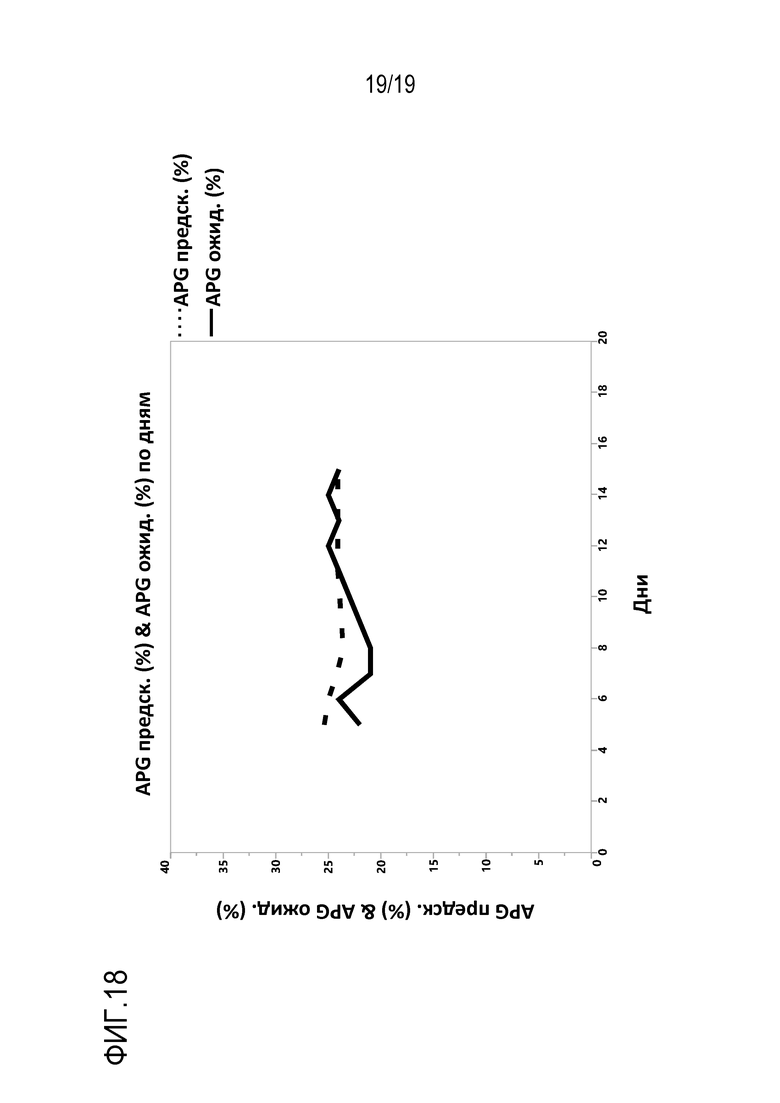
Настоящее изобретение относится к области биотехнологии, конкретно к применению ограниченного количества цистеина и триптофана в качестве добавки к среде для культивирования клеток во время продуцирования рекомбинантных белков и, в частности, антител. Белки и антитела, получаемые в таких контролируемых условиях, имеют пониженную гетерогенность, в частности пониженную гетерогенность заряженных вариантов. 3 н. и 27 з.п. ф-лы. 18 ил., 8 табл., 9 пр.
1. Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через стадию получения, на которой клетки продуцируют рекомбинантный белок, причем во время указанной стадии получения культуру подпитывают:
• цистеином или цистином до общего количества от 12 мас.% до 28 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка; и
• триптофаном до общего количества от 8 мас.% до 32 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток,
где рекомбинантный белок представляет собой антитело или его антиген-связывающий фрагмент и
где клетка-хозяин представляет собой клетку CHO.
2. Способ по п. 1, где культуру подпитывают цистеином или цистином до общего количества от 12 мас.% до 25 мас.%, например от 12 мас.% до 20 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка.
3. Способ по п. 1 или 2, где культуру подпитывают триптофаном до общего количества от 8 мас.% до 30 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка, например общего количества от 8 мас.% до 25 мас.%, например от 8 мас.% до 20 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка.
4. Способ по любому из предшествующих пунктов, где общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 12 г/(1012 клеток), например от 2,9 до 7 г/(1012 клеток), например от 5,6 до 7 г/(1012 клеток), где клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце стадии получения.
5. Способ по любому из предшествующих пунктов, где общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 7 г/(1012 клеток), например от 2,5 до 3,5 г/(1012 клеток), причем клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце стадии получения.
6. Способ по любому из предшествующих пунктов, где общее количество цистеина или цистина и триптофана в культуре достигается путем добавления цистеина или цистина и триптофана в среду для культивирования клеток:
а. в начале стадии получения,
b. один или несколько раз в любой момент времени во время стадии получения,
с. путем непрерывного добавления во время стадии получения или
d. в любой комбинации а., b. и с.
7. Способ по любому из предшествующих пунктов, представляющий собой периодический процесс, такой как процесс с периодической подпиткой.
8. Способ по любому из предшествующих пунктов, где цистеин или цистин и триптофан обеспечивают путем ежедневного добавления во время стадии получения.
9. Способ по п. 8, где перед добавлением цистеина или цистина на следующий день культуру истощают по цистеину или цистину, например, путем уменьшения добавления цистеина или цистина до уровня от 5,6 до 7 г/(1012 клеток), где клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце стадии получения.
10. Способ по п. 8 или 9, где на поздней стадии получения, то есть когда клетки уже достигли максимальной жизнеспособной плотности клеток, культуру истощают по триптофану перед добавлением триптофана на следующий день.
11. Способ по любому из предшествующих пунктов, где концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,9 г/л в любой момент времени во время стадии получения, предпочтительно, где концентрация цистеина или цистина в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время стадии получения.
12. Способ по любому из предшествующих пунктов, где концентрация триптофана в среде для культивирования клеток не превышает 0,6 г/л в любой момент времени во время стадии получения, предпочтительно, где концентрация триптофана в среде для культивирования клеток не превышает 0,3 г/л в любой момент времени во время стадии получения.
13. Способ по любому из предшествующих пунктов, где стадию получения осуществляют в течение по меньшей мере 7 дней, предпочтительно по меньшей мере 14 дней.
14. Способ по любому из предшествующих пунктов, где в любой момент времени во время второй половины стадии получения:
• количество цистеина или цистина в культуре составляет от 12 мас.% до 28% от ожидаемого количества продуцируемого рекомбинантного белка; и
• количество триптофана в культуре составляет от 8 мас.% до 32% от ожидаемого количества продуцируемого рекомбинантного белка.
15. Способ по любому из предшествующих пунктов, где в любой момент времени во время стадии получения:
• количество цистеина или цистина в культуре составляет от 12 мас.% до 28% от ожидаемого количества продуцируемого рекомбинантного белка; и
• количество триптофана в культуре составляет от 8 мас.% до 32% от ожидаемого количества продуцируемого рекомбинантного белка.
16. Способ по п. 1, где антитело или его антигенсвязывающий фрагмент представляет собой:
1) антитело или его антигенсвязывающий фрагмент, который:
а. содержит CDR-H1 с последовательностью SEQ ID NO:1; CDR-H2 с последовательностью SEQ ID NO:2; CDR-H3 с последовательностью SEQ ID NO:3; CDR-L1 с последовательностью SEQ ID NO:4; CDR-L2 с последовательностью SEQ ID NO:5, и CDR-L3 с последовательностью SEQ ID NO:6; или
b. содержит вариабельную область легкой цепи с последовательностью SEQ ID NO:7, и вариабельную область тяжелой цепи с последовательностью SEQ ID NO:8; или
с. содержит вариабельную область легкой цепи, которая по меньшей мере на 80% идентична или сходна, предпочтительно на 90% идентична или сходна последовательности SEQ ID NO:7, и вариабельную область тяжелой цепи, которая по меньшей мере на 80% идентична или сходна, предпочтительно на 90% идентична или сходна последовательности SEQ ID NO:8;
d. содержит вариабельную область легкой цепи с последовательностью SEQ ID NO:7, и тяжелую цепь с последовательностью SEQ ID NO:11; или
е. содержит вариабельную область легкой цепи, которая по меньшей мере на 80% идентична или сходна, предпочтительно, на 90% идентична или сходна последовательности SEQ ID NO:7, и тяжелую цепь, которая по меньшей мере на 80% идентична или сходна, предпочтительно, на 90% идентична или сходна последовательности SEQ ID NO:11; или
2) антитело, которое содержит легкую цепь с последовательностью SEQ ID NO:9, и тяжелую цепь с последовательностью SEQ ID NO:10; или
3) антитело, которое содержит легкую цепь, которая по меньшей мере на 80% идентична или сходна, предпочтительно, на 90% идентична или сходна последовательности SEQ ID NO:9, и тяжелую цепь, которая по меньшей мере на 80% идентична или сходна, предпочтительно, на 90% идентична или сходна последовательности SEQ ID NO:10.
17. Способ по любому из предшествующих пунктов, где стадию получения осуществляют в биореакторе, предпочтительно имеющем объем 50 л или более, 100 л или более, 500 л или более, 1000 л или более, 2000 л или более, 5000 л или более, 10000 л или более или 20000 л или более.
18. Способ по любому из предшествующих пунктов, включающий стадию выделения рекомбинантного белка из среды для культивирования клеток и дополнительную стадию очистки рекомбинантного белка.
19. Способ по п. 18, где очистка включает хроматографию с белком А.
20. Способ по любому из предшествующих пунктов, где способ дополнительно включает стадию получения состава рекомбинантного белка.
21. Способ по п. 20, где состав рекомбинантного белка получают в виде жидкого состава, содержащего одну или более аминокислот и поверхностно-активное вещество.
22. Способ по п. 21, где состав содержит гистидин и/или пролин.
23. Способ по п. 22, где состав содержит гистидин в концентрации от 5 мМ до 100 мМ, например, в концентрации от 10 мМ до 50 мМ, и/или пролин в концентрации от 100 мМ до 500 мМ при рН от 5 до 7,4, например от 5 до 6,5, например, от 5 до 6.
24. Способ по п. 23, где состав содержит гистидин в концентрации 30 мМ и пролин в концентрации 250 мМ при рН от 5.2 до 6,0.
25. Способ по любому из пп. 21-24, где поверхностно-активное вещество представляет собой полисорбат 80, предпочтительно в концентрации от 0,001% до 0,1% (мас./об.), например, от 0,005% до 0,1%, например от 0,01% до 0,1%, например от 0,01% до 0,05%, например 0,03%.
26. Способ по любому из пп. 21-25, где рекомбинантный белок представляет собой антитело, где антитело находится в составе в концентрации от 10 до 250 мг/мл, например от 20 до 250 мг/мл, например от 50 до 250 мг/мл, например от 120 до 160 мг/мл, например 140 мг/мл.
27. Способ получения рекомбинантного белка, включающий:
а. культивирование клеток-хозяев, способных продуцировать рекомбинантный белок в среду;
b. проведение культуры через стадию продуцирования, где клетки продуцируют рекомбинантный белок и среду для культивирования клеток подпитывают цистеином или цистином и триптофаном, причем
• общее количество цистеина или цистина, обеспечиваемое в способе, составляет от 2,9 до 7 г/(1012 клеток), например, от 5,6 до 7 г/(1012 клеток), где клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце стадии получения, и
• общее количество триптофана, обеспечиваемое в способе, составляет от 2,5 до 3,5 г/(1012 клеток), где клетки относятся к ожидаемому суммарному количеству жизнеспособных клеток в конце стадии получения,
с. и, необязательно, выделение рекомбинантного белка из среды для культивирования клеток,
где рекомбинантный белок представляет собой антитело или его антиген-связывающий фрагмент и где клетка-хозяин представляет собой клетку CHO.
28. Способ по п. 18, имеющий один или более дополнительных признаков, перечисленных в любом из пп. 2-26.
29. Способ уменьшения гетерогенности рекомбинантных белков в партии, полученной на стадии получения рекомбинантными клетками-хозяевами, включающий ограничение общего количества
а. цистеина или цистина и
b. триптофана,
присутствующих в среде для культивирования клеток во время стадии получения рекомбинантного белка,
где общее количестве цистеина или цистина составляет от 12 мас.% до 28 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка; и общее количество триптофана составляет от 8 мас.% до 32 мас.% от ожидаемого общего количества продуцируемого рекомбинантного белка,
где рекомбинантный белок представляет собой антитело или его антиген-связывающий фрагмент и
где клетки-хозяева представляют собой клетки CHO.
30. Способ по п. 29, где способ дополнительно содержит один или более дополнительных признаков, перечисленных в любом из пп. 2-26.
| WO 2008063892 A2, 29.08.2008 | |||
| PATRONE M | |||
| et al.: Enhanced Expression of Full-Length Human Cytomegalovirus Fusion Protein in Non-Swelling Baculovirus-Infected Cells with a Minimal Fed-Batch Strategy, PLOS ONE, 2014, v | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Сопло для установок пневматического транспорта | 1950 |
|
SU90753A1 |
| WO 2014145091 A1, 18.09.2014 | |||
| WO 2012145682 A1, 26.10.2012 | |||
| WO 2013158275 A1, 24.10.2013 | |||
| HONGCHENG LIU eta | |||
Авторы
Даты
2021-11-01—Публикация
2018-05-29—Подача