Изобретение относится к области химии природных и физиологически активных веществ, а именно к области стероидных гормонов - к новым, неописанным в литературе, фосфорил замещенным 3-кето-андрост-4-ен-[16,17-d]пиридазинам общей формулы:

где R=Ph, NHPh или NHtBu, и к способу их получения. Предлагаемые соединения обладают антипролиферативной активностью в отношении клеток гормонозависимого и трижды негативного (гормононезависимого) рака молочной железы, регулируют экспрессию рецепторов эстрогенов α (ERα) и белков клеточного цикла, индуцируют апоптоз и могут найти применение в медицине для создания противоопухолевых средств.
Ранее в литературе были описаны соединения, изомерные по структуре к заявляемым (Y.A. Volkova, Y.C. Antonov, A.V. Komkov, A.M. Scherbakov, A.C. Chashkov, L.G. Menchikov, E.I. Chernoburova, I.V. Zavarzin. Access to steroidal pyridazines via Modified thiohydrazides // RSC Advances. - 2016. - T. 6. - C. 42863-42868) общей формулы:

где R1=С6Н4-n-F или C6H4-n-ОМе. Однако эти изомерные соединения при испытании не проявили значимую антипролиферативную активность в отношении клеток рака молочной железы.
Предлагаемые соединения являются новыми, неописанными и отличаются от известных соединений наличием фосфорильных заместителей в пиридазиновом цикле вместо карбоксамидных.
Рак молочной железы является самым распространенным онкологическим заболеванием у женщин в мировом масштабе. Подтипы рака молочной железы классифицируются в зависимости от наличия на поверхности клеток определенных белков-рецепторов, и среди них положительный по гормональным рецепторам подтип наиболее часто диагностируется у пациентов (Radecka В.; Litwiniuk М., Breast cancer in young women. Ginekol Pol. 2016, 87(9), 659-663). Рак молочной железы считается положительный по гормональным рецепторам (гормонозависимым), если клетки злокачественной опухоли имеют на своей поверхности большое количество рецепторов эстрогенов и/или прогестерона. Поскольку эстрогены передают через свои рецепторы сигналы для роста и деления клеток, начинается неконтролируемый рост опухолевых клеток, который в итоге приводит к прогрессии заболевания (Brufsky A.M.; Dickler M.N., Estrogen Receptor-Positive Breast Cancer: Exploiting Signaling Pathways Implicated in Endocrine Resistance. Oncologist 2018, 23(5), 528-539; Yip C.H.; Rhodes A., Estrogen and progesterone receptors in breast cancer. Future Oncol. 2014, 10(14), 2293-301). При лечении положительного по гормональным рецепторам рака молочной железы обычно используют гормональную терапию - препараты, которые подавляют функцию эстрогеновых рецепторов, либо снижают содержание эстрогенов в крови (Burstein H.J., Systemic Therapy for Estrogen Receptor-Positive, HER2-Negative Breast Cancer. N Engl. J. Med. 2020, 24, 383(26), 2557-2570; Reinert Т.; de Paula В.; Shafaee M.N.; Souza P.H.; Ellis M.J.; Bines J., Endocrine therapy for ER-positive/HER2-negative metastatic breast cancer. Chin Clin Oncol. 2018, 7(3):25; Yu K.D.; Cai Y.W.; Wu S.Y.; Shui R.H.; Shao Z.M., Estrogen receptor-low breast cancer: Biology chaos and treatment paradox. Cancer Commun. 2021, 41(10), 968-980).
Улучшение итоговых показателей у вовремя диагностированных пациентов с опухолями молочной железы возможно в случае сочетания раннего выявления и последующего эффективного лечения с использованием трех методов -хирургического вмешательства, лучевой терапии и терапевтического лечения. В связи с увеличением доли резистентных опухолевых заболеваний, плохо поддающихся лечению в рамках стандартной химиотерапии существует острая необходимость в разработке новых эффективных лекарств для лечения рака молочной железы, влияющих на функцию эстрогеновых рецепторов и индуцирующих клеточную гибель.
Значительным потенциалом в этой области обладают производные стероидных гормонов, содержащие гетероатомные фрагменты (Tantawy М.А.; Nafie M.S.; Elmegeed G.A.; AH IA.L, Auspicious role of the steroidal heterocyclic derivatives as a platform for anti-cancer drugs. Bioorg Chem. 2017, 73, 128-146; Singh H.; Jindal D.P.; Yadav M.R.; Kumar M., Heterosteroids and drug research. Prog Med Chem. 1991, 28, 233-300). Они являются биологически активными веществами, проявляющими избирательное биологическое действие в отношении клеток гормонозависимого рака молочной железы. Наиболее близким к заявленным соединениям по свойствам в ряду стероидных структур является стероидный препарат андростанового ряда - форместан структурной формулы:

Форместан (4-гидроксиандрост-4-ен-3,17-дион) был разработан для лечения положительного по гормональным рецепторам рака молочной железы у женщин в постменопаузе (Wiseman L.R.; Goa K.L., Formestane. A review of its pharmacological properties and clinical efficacy in the treatment of postmenopausal breast cancer. Drugs Aging. 1996, 9(4), 292-306). Форместан характеризуется низкой антипролиферативной активностью (IC50 более 100 μМ) в отношении клеток гормонозависимого рака молочной железы человека MCF7  R.; Petri, Е. Т.;
R.; Petri, Е. Т.;  Jakimov, D. S.;
Jakimov, D. S.;  Penov
Penov  Synthesis and anticancer cell potential of steroidal 16,17-seco-16,17a-dinitriles: Identification of a selective inhibitor of hormone-independent breast cancer cells. Bioorg. Med. Chem. 2015, 23 (4), 703-711). Преодолеть этот недостаток возможно только путем создания новых антипролиферативных агентов в ряду стероидов, обладающих свойствами модуляторов эстрогеновых рецепторов.
Synthesis and anticancer cell potential of steroidal 16,17-seco-16,17a-dinitriles: Identification of a selective inhibitor of hormone-independent breast cancer cells. Bioorg. Med. Chem. 2015, 23 (4), 703-711). Преодолеть этот недостаток возможно только путем создания новых антипролиферативных агентов в ряду стероидов, обладающих свойствами модуляторов эстрогеновых рецепторов.
Технической задачей настоящего изобретения является расширение ассортимента стероидных соединений, обладающих улучшенной антипролиферативной активностью в отношении клеток рака, способных индуцировать их гибель (апоптоз), а также разработка способа их получения с целью дальнейшего создания лекарственных препаратов на их основе. Поставленная техническая задача достигается новыми фосфорил замещенными 3-кето-андрост-4-ен-[16,17-d]пиридазинами общей формулы:
 где R=Ph, NHPh или NHtBu.
где R=Ph, NHPh или NHtBu.
Соединения общей формулы I обладают антипролиферативной активностью в отношении клеток гормонозависимого рака молочной железы MCF7 и клеток трижды негативного рака молочной железы MDA-MB-231. Предложен также способ получения соединений общей формулы I, где R=Ph, NHPh или NHtBu, заключающийся в том, что 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диен подвергают взаимодействию с тиогидразидами фосфорилмуравьиной кислоты общей формулы:
 где R имеет вышеуказанные значения, в присутствии в качестве катализатора пара-толуолсульфоновой кислоты, образующиеся при этом соответствующие 3β-гадрокси-5-андростено[16,17-d]пиридазины общей формулы:
где R имеет вышеуказанные значения, в присутствии в качестве катализатора пара-толуолсульфоновой кислоты, образующиеся при этом соответствующие 3β-гадрокси-5-андростено[16,17-d]пиридазины общей формулы:
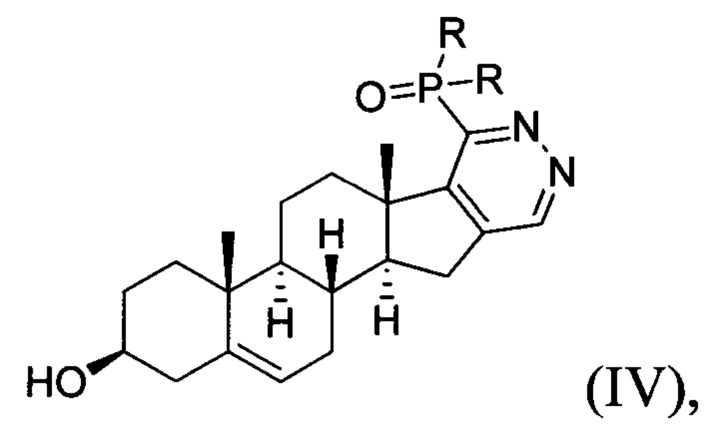 где R имеет вышеуказанные значения, подвергают обработке циклогексаноном и алюминий изопропоксидом с последующим выделением целевого продукта.
где R имеет вышеуказанные значения, подвергают обработке циклогексаноном и алюминий изопропоксидом с последующим выделением целевого продукта.
Предлагаемые соединения общей формулы I получают с использованием следующей синтетической последовательности: 1) гетероциклизация 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диена с тиогидразидами фосфорилмуравьиной кислоты с in situ омылением 3-ОАс остатка до 3-ОН, 2) окисление 3-гидрокси-5-ен фрагмента до 3-кето-4-ен фрагмента циклогексаноном и алюминий изопропоксидом.
Процесс протекает по следующей схеме:
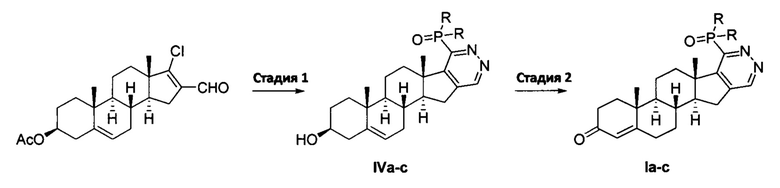
где R=Ph, NHPh или NHtBu.
Стадию 1 гетероциклизации проводят в среде органического растворителя -1,4-диоксана, а стадию 2 окисления проводят в среде толуола. Процесс проводят при кипячении.
Изобретение иллюстрируется следующими примерами, не ограничивающими его объем.
Исходные тиогидразиды фосфорилмуравьиной кислоты были получены в соответствии с известным способом, включающим обработку морфолидов фосфорилтиомуравьиной кислоты гидразин гидратом в среде диметилформамида или 1,4-диоксана при комнатной температуре, описанным в работе «Козлов М.А.; Волкова Ю.А.; Заварзин И.В., Синтез 5-фосфорилзамещенных 1,3,4(3H)-тиадиазолонов. Russ. Chem. Bull, 2019, 68 (11), 2105-2107».
Исходный 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диен был получен в соответствии с известным способом, включающим обработку 3β-ацетокси-17-кетоандростан-5,16-диена оксихлоридом фосфора в диметилформамиде при нагревании до 65°С, описанным в работе «Volkova Y.A.; Antonov Y.S.; Komkov А.V.; Scherbakov A.M.; Shashkov A.S.; Menchikov L.G.; Chernoburova E.I.; Zavarzin I.V., Access to Steroidal Pyridazines via Modified Thiohydrazides RSCAdv., 2016, 6, 42863-42868».
Пример 1. Получение 3-оксо-1'-(дифенилфосфиноксид)-4-андростено[16,17-d]пиридазина (Ia)
Стадия 1. Получение (3гидрокси-5-андростено[16,17-d]пиридазин-1'-ил)дифенилфосфин оксида (IVa).
(Дифенилфосфорил)метантиогидразид (0.35 ммоль, 97 мг) добавили к раствору 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диена (0.35 ммоль, 132 мг) и пара-толуолсульфоновой кислоты (0.035 ммоль, 6.7 мг, 0.1 экв.) в 1,4-диоксане (9 мл). Реакционную смесь перемешивали при кипячении в течение 10 мин, затем остудили до комнатной температуры. Растворитель отогнали при пониженном давлении и остаток перерастворили в метаноле (10 мл). К полученному раствору добавили K2CO3 (0.35 ммоль, 48 мг, 1.0 экв) и кипятили смесь дополнительно 30 минут. Растворитель отогнали при пониженном давлении, продукт выделяли методом колоночной хроматографии (элюент CHCl3 - МеОН, 1:0 → 60:1). В результате получили указанное соединение IVa (59 мг, выход 32%) в виде бледно-желтого твердого вещества с Тпл=163-164°С и чистотой 98% (по ЯМР).
1Н ЯМР (400 МГц, 101 МГц, 1Н-13С HSQC, ДМСО-d6): δ 0.82 - 0.97 (м, 3Н, 1-СН2, 9-СН, 12-СН2), 0.98 (с, 3Н, 19-СН3), 1.18 (с, 3Н, 18-СН3), 1.28-1.39 (м, 1Н, 2-СН2), 1.39-1.60 (м, 4Н, 2-СН2, 11-СН2,14-СН), 1.60-1.80 (м, 3Н, 2-СН2, 1-СН2,8-СН), 1.97-2.07 (м, 1Н, 7-СН2), 2.07-2.20 (м, 2Н, 4-СН2), 2.65 (дд, J=12.8, 16.1 Гц, 1Н, 15-СН2), 2.83 (дд, J=6.5, 16.1 Гц, 1H, 15-СН2), 2.91-3.00 (м, 1Н, 12-СН2), 3.23 (тт, J=10.8, 4.6 Гц, 1Н, 3-СН), 5.26-5.30 (м, 1Н, 6-СН), 7.47-7.67 (м, 10Н, o-CHPh, м-CHPh, п-CHPh), 9.30 (д, JH-Р=3.9 Гц, 1H, 4'-СН).
13С ЯМР (101 МГц, ДМСО-d6): δ 16.4 (18-СН3), 19.0 (19-СН3), 20.2 (11-СН2), 29.9 (15-СН2), 30.3 (8-СН), 30.8 (7-СН2), 31.4 (2-СН2), 33.7 (12-СН2), 36.2 (10-С), 36.6 (1-СН2), 42.2 (4-СН2), 47.6 (13-С), 49.3 (9-СН), 55.5 (14-СН), 69.9 (3-СН), 119.9 (6-СН), 128.2 (д, 3JC-Р=12.1 Гц, м-CHPh), 128.9 (д, 3JC-P=11.9 Гц, м-CHPh), 131.3 (д, 2JC-P=9.5 Гц, o-CHph), 131.7 (д, 4JC-P=2.4 Гц, n-CHPh), 132.1 (д, 2JC-P=9.4 Гц, o-CHPh), 132.3 (д, 4JC-P=2.0 Гц, п-CHPh), 132.5 (д, 1JC-Р=110.1 Гц, ipso-CPh), 133.3 (д, 1JC-Р=110.0 Гц, ipso-CPh), 141.6 (5-С), 144.5 (д, 3JC-Р=6.0 Гц, 16-С), 150.1 (д, 4JC-Р=1.7 Гц, 4'-СН), 155.1 (д, 1JC-Р=126.3 Гц, 1'-С), 157.3 (д, 2JC-Р=17.5 Гц, 17-С). 31Р ЯМР (162 МГц, ДМСО-d6): δ 26.43. Спектр HRMS (ESI) для C33H38N2O2P ([М+Н]+): вычислено 525.2665, найдено 525.2658. ИК (KBr): 3417, 2929, 2902, 2858, 1596, 1438, 1190, 1120, 1065, 750, 725, 695, 551 см-1.
Стадия 2. Получение 3-оксо-1'-(дифенилфосфиноксид)-4-андростено[16,17-d]пиридазина (Ia).
К раствору (3β-гидрокси-5-андростено[16,17-d]пиридазин-1'-ил)дифенилфосфин оксида (0.10 ммоль, 52 мг) в сухом толуоле (2 мл) добавили циклогексанон (0.72 мл, 0.70 ммоль) и 0.15 М раствор Al(i-PrO)3 в толуоле (1.5 мл). Реакционную смесь перемешивали при кипячении в течение 3 часов, затем остудили до комнатной температуры и разбавили 30% водным раствором уксусной кислоты (15 мл). Полученный раствор экстрагировали хлороформом (3×5 мл). Объединенные органические слои промыли насыщенным водным раствором NaHCO3 (3×5 мл), водой до рН=7 и сушили над безводным Na2SO4. Растворитель отогнали при пониженном давлении, продукт выделяли методом колоночной хроматографии (элюент CHCl3 -МеОН, 1:0 → 150:1). В результате получили указанное соединение Iа (35 мг, выход 67%) в виде бледно-желтого твердого вещества с Тпл=250-251°С и чистотой 98% (по ЯМР).
1Н ЯМР (400 МГц, 101 МГц, 1Н-13С HSQC, CDCl3): δ 0.95 (тд, J=4.9, 11.7 Гц, 1Н, 9-СН), 1.01-1.20 (м, 2Н, 1-СН2, 12-СН2), 1.23 (с, 3Н, 19-СН3) 1.32 (с, 3Н, 18-СН3), 1.51-1.71 (м, 4Н, 7-СН2, 11-СН2, 14-СН), 1.85-2.09 (м, 3Н, 1-СН2, 7-СН2, 8-СН), 2.27-2.54 (м, 4Н, 2-СН2, 6-СН2), 2.65 (дд, J=15.6, 12.9 Гц, 1Н, 15-СН2), 2.85 (дд, J=15.6, 6.6 Гц, 1Н, 15-СН2), 3.22 (тд, J=12.7, 3.6 Гц, 1Н, 12-СН2), 5.73 (с, 1H, 4-СН), 7.39-7.58 (м, 6Н, м-CHPh, п-CHPh), 7.76-7.84 (м, 4Н, o-CHPh), 9.13 (д, JH-Р=3.9 Гц, 1Н, 4'-СН). 13С ЯМР (101 МГц, CDCl3): δ 16.9 (I8-CH3), 17.2 (19-СН3), 20.7 (11-СН2), 30.4 (15-СН2), 31.8 (1-СН2), 32.5 (2-СН2), 33.9 (6-СН2), 34.1 (12-СН2), 34.4 (8-СН), 35.5 (7-СН2), 38.6 (10-С), 48.3 (13-С), 53.4 (9-СН), 55.7 (14-СН), 124.1 (4-СН), 128.0 (д, 3JC-P=12.6 Гц, м-CHPh), 128.5 (д, 3JC-P=12.2 Гц, м-CHPh), 131.6 (д, 4JC-Р=2.4 Гц, п-CHPh), 131.7 (д, 2JC-Р=9.8 Гц, o-CHPh), 132.0 (д, 4JC-Р=2.2 Гц, п-CHPh), 132.6 (д, 2JC-Р=9.5 Гц, o-CHPh), 132.7 (д, 1JC-P=103.4 Гц, ipso-CPh), 132.9 (д, 1JC-P=112.0 Гц, ipso-CPh), 143.7 (д, 3JC-P=6.4 Гц, 16-С), 149.4 (д, 4JC-P=2.3 Гц, 4'-СН), 155.8 (д, 1JC-P=125.6 Гц, 1'-С), 157.8 (д, 2JC-P=17.1 Гц, 17-С), 170.0 (5-С), 199.2 (3-С). 31Р ЯМР (162 МГц, CDCl3): δ 26.19. Спектр HRMS (ESI) для C33H36N2O2P ([М+Н]+): вычислено 523.2509, найдено 523.2497. ИК (KBr): 2941,2859,1667,1438,1332,1231,1199, 1112, 721, 699, 550, 50, 490 см-1.
Пример 2. Получение 3-оксо-1'-(N,N'-дифенилфосфориламидо)-4-андростено[16,17-d]пиридазина (Ib)
Стадия 1. Получение 3β-гидрокси-1'-(N,N'-дифенилфосфориламидо)-5-андростено[16,17-d]пиридазина (IVb).
Аналогично примеру 1 стадии 1 из 132 мг 3β-ацетокси-17-хлор- 16-формил-андроста-5,16-диена и 120 мг Р-(гидразинокаботиоил)-N,N'-фосфодиамида получено 100 мг (выход 51%) 3β-гидрокси-1'-(N,N'-дифенилфосфориламидо)-5-андростено[16,17-d]пиридазина (IVb) в виде светло-желтого твердого вещества с Тпл=172-173°С и чистотой 98% (по ЯМР).
1Н ЯМР (400 МГц, 101 МГц, 1Н-13С НМВС, 1H-13C HSQC, ДМСО-d6): δ 0.97-1.05 (м, 2Н, 9-СН, 1-СН2), 1.01 (с, 3Н, 19-СН3), 1.14 (с, 3Н, 18-СН3), 1.29-1.45 (м, 1H, 2-СН2), 1.52-1.70 (м, 6Н, 11-СН2, 14-СН, 12-СН2, 7-СН2), 1.72-1.86 (м, 2Н, 1-СН2, 8-СН), 2.01-2.24 (м, 3Н, 4-СН2, 7-СН2), 2.63 (дд, J=16.0, 12.6 Гц, 1Н, 15-СН2), 2.83 (дд, J=6.5, 16.0 Гц, 1Н, 15-СН2), 3.02-3.08 (м, 1Н, 12-СН2), 3.19-3.30 (м, 1H, 3-СН), 4.62 (с, 1Н, ОН), 5.28-5.34 (м, 1Н, 6-СН), 6.75-6.85 (м, 2Н, п-CHPh), 7.04-7.21 (м, 8Н, м-CHPh, o-CHPh), 8.14 (д, JH-P=14.0 Гц, 1H, NH), 8.24 (д, JH-P=9.0 Гц, 1Н, NH), 9.30 (д, JH-P=3.6 Гц, 1Н, 4'-СН). 13С ЯМР (101 МГц, ДМСО-d6): δ 16.1 (18-СН3), 19.1 (19-СН3), 20.4 (11-СН2), 29.7 (15-СН2), 30.3 (8-СН), 31.0 (7-СН2), 31.4 (2-СН2), 33.4 (12-СН2), 36.2 (10-С), 36.7 (1-СН2), 42.2 (4-СН2), 47.5 (13-С), 49.5 (9-СН), 55.8 (14-СН), 70.0 (3-СН), 117.7 (д, 3JC-P=7.0 Гц, o-CHPh), 118.1 (д, 3JC-P=7.0 Гц, o-CHPh), 120.0 (6-СН), 120.4 (п-CHPh), 120.5 (n-CHPh), 128.6 (м-CHPh), 128.8 (м-CHPh), 141.2 (5-С), 141.7 (ipso-CPh), 142.0 (ipso-CPh), 144.1 (д, 3JC-P=7.0 Гц, 16-С), 150.4 (4'-СН), 153.1 (д,1JC-P=182.1 Гц, 1'-С), 156.6(д,2JC-P=21.1 Гц, 17-С). 31Р ЯМР(162МГц, ДМСО-d6): δ 4.30. Спектр HRMS (ESI) для C33H40N4O2P ([М+Н]+): вычислено 555.2883, найдено 555.2881. ИК (KBr): 3406,2929, 2903, 2584, 1603, 1499, 1376, 1294, 1209, 1058, 1243, 1001, 954, 936, 752, 693, 622, 499 см-1.
Стадия 2. Получение 3-оксо-1'-(N,N'-дифенилфосфориламидо)-4-андростено[16,17-d]пиридазина (Ib).
Аналогично примеру 1 стадии 2 из 55 мг 3β-гидрокси-1'-(N,N'-дифенилфосфориламидо)-5-андростено[16,17-d]пиридазина получено 35 мг (выход 63%) 3-оксо-1'-(N,N'-дифенилфосфориламидо)-4-андростено[16,17-d]пиридазина (Ib) в виде светло-желтого твердого вещества с Тпл=193-195°С и чистотой 98% (по ЯМР).
1Н ЯМР (400 МГц, 101 МГц, 1Н-13С HSQC, CDCl3): δ 0.97 - 1.08 (м, 1Н, 9-СН), 1.11-1.21 (м, 1Н, 1-СН2), 1.20-1.25 (м, 6Н, 18-СН3, 19-СН3), 1.56-1.78 (м, 5Н, 7-СН2, 11-СН2, 12-СН2, 14-СН), 1.85-2.07 (м, 3Н, 1-СН2, 7-СН2, 8-СН), 2.29-2.54 (м, 4Н, 2-СН2, 6-СН2), 2.65 (дд, J=16.0, 12.6 Гц, 1H, 15-СН2), 2.82-2.92 (м, 1Н, 15-СН2), 3.09-3.18 (м, 1Н, 12-СН2), 5.75 (с, 1Н, 4-СН), 5.93-6.02 (м, 1Н, NH), 6.85 (t, J=7.3 Гц, 1H, п-CHPh), 6.89-6.98 (м, 3Н, o-CHPh, м-CHPh), 7.06-7.12 (м, 2Н, м-CHPh), 7.15-7.19 (м, 4Н, м-CHPh, o-CHPh), 7.69 (д, JH-Р=12.3 Гц, 1Н, NH), 9.21 (д, JH-P=3.8 Гц, 1Н, 4'-СН). 13С ЯМР (101 МГц, CDCl3): 8 16.5 (18-СН3), 17.2 (19-СН3), 20.7 (11-СН2), 30.3 (15-СН2), 31.7 (1-СН2), 32.4 (2-СН2), 33.9 (6-СН2), 34.0 (12-СН2), 34.3 (8-СН), 35.5 (7-СН2), 38.5 (10-С), 48.1 (13-С), 53.3 (9-СН), 55.5 (14-СН), 118.1 (д, 3JC-P=6.2 Гц, o-CHPh), 118.8 (д, 3JC-P=6.3 Гц, o-CHPh), 122.2 (п-CHPh), 122.3 (п-CHPh), 124.3 (4-СН), 129.2 (M-CHPh), 138.5 (ipso-CPh), 138.8 (ipso-CPh), 144.6 (д, 3JC-P=8.4 Гц, 16-С), 150.4 (д, 4JC-P=3.3 Гц, 4'-СН), 152.2 (д, lJC-P=181.3 Гц, 1'-С), 156.8 (д, 2JC-P=20.0 Гц, 17-С), 169.6 (5-С), 199.1 (3-С). 31Р ЯМР (162 МГц, CDC13): δ 0.73. Спектр HRMS (ESI) для C33H38N4O2P ([М+Н]+): вычислено 553.2727, найдено 553.2727. ИК (KBr): 3235,3046, 2943,2857,1669,1602,1499, 1377,1286,.1230, 1204, 1077, 1032, 1000, 949, 953, 751, 693, 621, 495, 452 см-1.
Пример 3. Получение 3-оксо-1'-(N,N'-ди(трет-бутил)фосфориламидо)-4-андростено[16,17-d]пиридазина (Ic)
Стадия 1. Получение 3β-гидрокси-1'-(N,N'-ди(трет-бутил)фосфориламидо)-5-андростено[16,17-d]пиридазина (IVc).
Аналогично примеру 1 стадии 1 из 132 мг 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диена и 93 мг (ди(трет-бутиламино)фосфорил)метантиогидразида получено 94 мг (выход 52%) 3β-гидрокси-1'-(N,N'-ди(трет-бутил)фосфориламидо)-5-андростено[16,17-в]пиридазина (IVc) в виде светло-желтого твердого вещества с Тпл=174-176°С и чистотой 98% (по ЯМР).
1Н ЯМР (600МГц, 150 МГц, 1H-13С HSQC, ДМСО-d6): 5 0.98-1.02 (м, 2Н, 9-СН, 1-СН2), 1.03 (с, 3Н, 19-СН3), 1.13 (с, 3Н, 18-СН3), 1.14 (с, 9Н, С(СН3)3), 1.27 (с, 9Н, С(СН3)3), 1.35-1.42 (м, 1H, 2-СН2), 1.50-1.58 (м, 1H, 14-СН), 1.60-1.65 (м, 3Н, 11-СН2,12-СН2), 1.66-1.72(м, 2Н, 2-СН2, 7-СН2), 1.76 (тд, J=10.8 Гц, J=5.0 Гц, 1Н, 8-СН), 1.81 (dt, J=12.9 Гц, J=3.4 Гц, 1Н, 1-СН2), 2.03-2.23 (м, 3Н, 4-СН2, 7-СН2), 2.58 (дд, J=15.8 Гц, J=13.0 Гц, 1Н, 15-СН2), 2.77 (дд, J=6.5 Гц, J=15.8 Гц, 1Н, 15-СН2), 3.23-3.32 (м, 2Н, 12-СН2, 3-СН), 3.96 (д, JH-P=5.8 Гц, 1Н, NH), 4.10 (д, JH-P=13.6 Гц, 1Н, NH), 4.59 (д, J=4.6 Гц, 1Н, ОН), 5.27-5.35 (м, 1Н, 6-СН), 9.16 (д, JH-P=3.3 Гц, 1Н, 4'-СН). 13С ЯМР (150МГц, ДМСО-d6): δ 15.7 (18-СН3), 19.1 (19-СН3), 20.2 (11-СН2), 29.7 (15-СН2), 30.4 (8-СН), 31.1 (7-СН2, 2-СН2), 31.4 (д, 3JC-P=3.4 Гц, С(СН3)3), 31.7 (д, 3JC-P=3.5 Гц, С(СН3)3), 33.4 (12-СН2), 36.3 (10-С), 36.7 (1-СН2), 42.2 (4-СН2), 47.4 (13-С), 49.7 (9-СН), 50.5 (С(СН3)3), 51.4 (С(СН3)3), 55.9 (14-СН), 70.0 (3-СН), 119.9 (6-СН), 141.7 (5-С), 143.0 (д,3JC-P=8.0 Гц, 16-С), 149.1 (4'-СН), 155.0 (д, 2JC-P=20.0 Гц, 17-С), 157.3 (д, lJC-P=168.1 Гц, Г-С). 31Р ЯМР (243 МГц, ДМСО-d6): 5 10.95. Спектр HRMS (ESI) для C29H48N4O2P ([M+H]+): вычислено 515.3509, найдено 515.3503. ИК (KBr): 3396, 2968, 2934, 2905,2869, 1384, 1235, 1064, 1043, 1021, 750, 586 см-1.
Стадия 2. Получение 3-оксо-1'-(N,N'-ди(трет-бутил)фосфориламидо)-4-андростено[16,17-d]пиридазина (Ic).
Аналогично примеру 1 стадии 2 из 51 мг 3β-гидрокси-1'-(N,N'-ди(трет-бутил)фосфориламидо)-5-андростено[16,17-d]пиридазина получено 28 мг (выход 54%) 3-оксо-1'-(N,N'-ди(трет-бутил)фосфориламидо)-4-андростено[16,17-d]пиридазина (Ic) в виде светло-желтого твердого вещества с Тпл=272-274°С и чистотой 98% (по ЯМР).
1Н ЯМР (400 МГц, 101 МГц, 1Н-13С НМВС, 1H-13С HSQC, CDCl3): δ 1.02-1.12 (м, 1H, 9-СН), 1.12-1.23 (м, 1Н, 1-СН2), 1.24 (с, 3Н, 19-СН3), 1.25 (с, 3Н, 18-СН3), 1.27 (с, 9Н, С(СН3)3), 1.30 (с, 9Н, С(СН3)3), 1.48-1.66 (м, 2Н, 12-СН2, 14-СН), 1.66-1.78 (м, 3Н, 7-СН2, 11-СН2), 1.86-2.01 (м, 2Н, 1-СН2, 8-СН), 2.03-2.12 (м, 1Н, 7-СН2), 2.30-2.54 (м, 5Н, 2-СН2, 6-СН2, NH), 2.59 (дд, J=15.6, 12.9 Гц, 1Н, 15-СН2), 2.82 (дд, J=6.6, 15.6 Гц, 1Н, 15-СН2), 3.41-3.53 (м, 1Н, 12-СН2), 3.77 (д, JH-P=73 Гц, 1Н, NH), 5.74 (с, 1H, 4-СН), 9.08 (д, JH-P=3.5 Гц, 1Н, 4'-СН). 13С ЯМР (101 МГц, CDCl3): δ 16.2 (18-СН 3), 17.2 (19-СН3), 20.7 (11-СН2), 30.3 (15-СН2), 31.7 (д, 3JC-P=4.5 Гц, С(СН3)3), 31.9 (1-СН2), 32.1 (д, 3JC-P=4.1 Гц, С(СН3)3), 32.5 (2-СН2), 33.9 (6-СН2), 34.4 (8-СН, 12-СН2), 35.5 (7-СН2), 38.6 (10-С), 48.0 (13-С), 51.8 (С(СН3)3), 52.2 (д, 2JC-P=2.5 Гц, С(СН3)3), 53.6 (9-СН), 55.9 (14-СН), 124.1 (4-СН), 143.4 (д, 3JC-P=7.5 Гц, 16-С), 149.3 (4'-СН), 155.2 (д, 2JC-P=19.3 Гц, 17-С), 157.4 (д, JC-P=169.2 Гц, 1'-С), 170.2 (5-С), 199.3 (3-С). 31Р ЯМР (162 МГц, CDCl3): δ 9.58. Спектр HRMS (ESI) для C29H46N4O2P ([М+Н]+): вычислено 513.3353, найдено 513.3352.
Пример 4. Определение антипролиферативной активности заявляемых соединений общей формулы I
Антипролиферативная активность заявляемых соединений общей формулы I оценивалась на культурах клеток рака молочной железы человека MCF7 и MDA-MB-231 с помощью теста МТТ. МТТ тест основан на восстановлении живыми клетками МТТ-реагента 3-[4,5-диметилтиазол-2]-2,5-дифенилтетразол бромида с образованием фиолетовых кристаллов формазана, нерастворимых в культуральной среде. Клеточные линии MCF7 и MDA-MB-231 получены из коллекции АТСС (США) и до проведения анализов хранились в криобанке НМИЦ онкологии им. Н.Н. Блохина. In vitro культивирование клеток проводили в стандартной среде DMEM (ПанЭко, Россия) с добавлением 10% эмбриональной сыворотки телят (HyClone, США), пенициллина (50 ед/мл) и стрептомицина (50 мкг/мл) (ПанЭко, Россия); инкубацию проводили при 37°С, 5%-ном СО2 и относительной влажности 80-90%. В работе с опухолевыми клетками использовали клеточный инкубатор NU-5840E (NuAire, США). Для проведения биологических испытаний соединения общей формулы I растворяли в ДМСО (диметилсульфоксид) в концентрации 10 мМ и хранили при +4°С до проведения исследования. Клетки MCF7 и MDA-MB-231 рассевали на плато (Corning, США) и через 24 ч вносили соединения формулы I в интервале доз от 1.6 до 50 мкМ. В качестве препарата сравнения использовали цисплатин - один из наиболее широко применяемых и хорошо изученных препаратов в современной онкологической практике (Ghosh S., Cisplatin: The first metal based anticancer drug. Bioorg Chem. 2019, 88, 102925). К контрольным клеткам добавляли соответствующий объем растворителя, при этом его конечная концентрация в среде не превышала 0,1%. Через 72 часа роста с соединениями среду удаляли и вносили к клеткам МТТ реагент (AppliChem, США) на 2 ч. После окончания инкубации клетки лизировали в 100% ДМСО (AppliChem, США); встряхивали плато для растворение образовавшихся кристаллов формазана и оптическую плотность (ОП) полученных растворов анализировали на спектрофотометре MultiScan FC (ThermoFisher, США) при 571 нм. Далее из значений ОП вычитали ОП в лунках, не содержащих клеток; за 100% принимали ОП растворов, полученных в контрольных образцах. Значение IC50 рассчитывали как концентрацию соединения, при которой ОП раствора составляла 50% от контрольного образца. Эксперимент повторяли три раза. Данные антипролиферативной активности соединений общей формулы I представлены в Таблице.

Данные, представленные в таблице, свидетельствуют, что соединения формулы I (Ia, Ib и Ic) оказывают антипролиферативное действие на клетки рака молочной железы MCF7 и MDA-MB-231. Эффекты соединений Ia и Ib более выражены в отношении гормонозависимых клеток MCF7, чем в отношении клеток трижды негативного (гормононезависимого) рака MDA-MB-231. Индекс селективности для Ia и Ib составляет 2.8 и 3.7, соответственно. Соединение 1 с проявляет схожую активность на обеих линиях клеток рака молочной железы, то есть не демонстрирует селективность по отношению к гормонозависимым клеткам рака молочной железы.
Антипролиферативные эффекты соединений Ia-с в клетках MCF7 и MDA-MB-231 были существенно выше, чем эффекты ближайшего аналога -лекарственного препарата форместана (III). Кроме того, соединения Ia и Ib в клетках MCF7 демонстрировали эффекты близкие к эффектам, вызванным препаратом цисплатин; установленные значения IC50 не превышают 7 мкМ. Пример 5. Определение влияния заявляемых соединений общей формулы I (Ia и Ib) на экспрессию белков в клетках гормонозависимого рака молочной железы MCF7.
Анализ экспрессии белков в опухолевых клетках проводят с помощью иммуноблоттинга. Клетки линии MCF7 на стадии формирования 50-60% монослоя дважды промывают физиологическим раствором (10 мМ Tris-HCl рН 7,5; 0,14 М NaCl) и снимают с чашек Петри в 50 мМ Tris-HCl буфере (рН 7,5), содержащем 0,5% Игепал СА-630, 150 мМ NaCl, 1 mMEDTA, 1 mMDTT, 1 мМ фенилметилсульфонилфлорид, 0,1 мМ ортованадат натрия и апротинин, леупептин, пепстатин (1 мкг/мл каждого) (Scherbakov, А. М.; Lobanova, Y. S.; Shatskaya, V. A.; Onopchenko, О. V.; Gershtein, Е. S.; Krasil'nikov, М. А., Activation of mitogenic pathways and sensitization to estrogen-induced apoptosis: two independent characteristics of tamoxifen-resistant breast cancer cells? Breast Cancer Res Treat 2006, 100 (I), 1-11). Пробирки с полученными образцами оставляют на 10 минут на льду при +4°С.Затем образцы центрифугируют в течение 10 минут при 7 тыс.об/мин. и +4°С в центрифуге Eppendorf 5417R. Надосадочную жидкость (клеточные экстракты) переносят в новые пробирки. В полученных клеточных экстрактах измеряют концентрацию белка методом Брэдфорда (Bollag, D. М.; Edelstein, S. J., Protein methods. Wiley-Liss: New York; Chichester, 1991; p xii, 230). Оптическую плотность определяют на спектрофотометре Biosciences Ultrospec 2100 pro (GE HealthCare) при длине волны 595 нм. Клеточные экстракты хранят при -70°С до проведения дальнейших анализов.
Электрофорез образцов, содержавших по 50 мкг белка, проводят в 10%-ном SDS-полиакриламидном геле (Sigma) в течение 4 часов (Westermeier, R.; Barnes, N., Electrophoresis in practice: a guide to methods and applications of DNA and protein separations. 3rd ed.; Wiley-VCH: Weinheim; Chichester, 2001; p xviii, 349) при стабилизации по напряжению 90 В. Затем белки переносят из геля на нитроцеллюлозные фильтры Protran (Amersham) в системе ТЕ22 Mighty Small Transfer Tank методом электропереноса (Westermeier, R.; Barnes, N., Electrophoresis in practice: a guide to methods and applications of DNA and protein separations. 3rd ed.; Wiley-VCH: Weinheim; Chichester, 2001; p xviii, 349).
Для оценки эффективности нанесения экстрактов на нитроцеллюлозные мембраны используют метод окрашивания раствором Понсо (Bollag, D. М.; Edelstein, S. J., Protein methods. Wiley-Liss: New York; Chichester, 1991; p xii, 230). После окрашивания по методу Понса мембраны отмывают. Для предотвращения неспецифической сорбции фильтры обрабатывают 5% раствором обезжиренного молока (Applichem), и затем инкубируют с первичными антителами в течение 16 ч в холодильнике при +4°С. Антитела для анализа сигнальных белков произведены Cell Signaling Technology (США). Антитела к GAPDH используют для контроля эффективности переноса проб на нитроцеллюлозную мембрану и нормирования. Мембраны отмывают, инкубируют 1.5 ч с соответствующими вторичными антителами к антителам кролика или мыши (Jackson ImmunoResearch Lab., США), конъюгированными с пероксидазой. Детекция сигнала производится на станции Image Quant LAS 4000 (GE HealthCare, США), стандартное время экспозиции не превышает 200 с. Рецепторы эстрогенов α (ERα) также функционирует как ключевой регулятор нормального развития и дифференцировки молочной железы (Santandrea, G.; Bellarosa, С; Gibertoni, D.; Cucchi, M. С; Sanchez, А. М.; Franceschini, G.; Masetti, R.; Foschini, M. P., Hormone Receptor Expression Variations in Normal Breast Tissue: Preliminary Results of a Prospective Observational Study. Journal of personalized medicine 2021, 11 (5), 387; Shoker, B. S.; Jarvis, C; Clarke, R. В.; Anderson, E.; Hewlett, J.; Davies, M. P.; Sibson, D. R.; Sloane, J. P., Estrogen receptor-positive proliferating cells in the normal and precancerous breast. The American journal of pathology 1999,155 (6), 1811-1815). Клетки линии MCF7 являются гормонозависимыми, их рассматривают как модель люминального рака молочной железы. Соединения Ia и Ib снижают экспрессию ERα, это относит их к антиэстрогенам. Активный ERα проникает в ядра клеток и запускает транскрипцию ряда генов, участвующих в регуляции пролиферации (Fuentes, N.; Silveyra, P., Estrogen receptor signaling mechanisms. Advances in protein chemistry and structural biology 2019,116, 135-170). Growth regulation by estrogen in breast cancer 1 (GREB1, mediator of steroid hormone action) относится к таким генам - экспрессия этого белка увеличивается при воздействиях эстрогенов на клетки (Cheng, М.; Michalski, S.; Kommagani, R., Role for Growth Regulation by Estrogen in Breast Cancer 1 (GREB1) in Hormone-Dependent Cancers. Internationaljournal of molecular sciences 2018,19 (9), 2543). Соединения, одновременно снижающие экспрессию ERα и GREB1, можно отнести к сильным антиэстрогенам. Не выявлено значительного падения GREB1 при обработке клеток MCF7 соединением Ia, тогда как соединение Ib эффективно блокирует экспрессию этого белка.
PCNA, CDK4 и cyclin D1 относятся к белкам, регулирующим пролиферацию и клеточный цикл (Huber, K.; Mestres-Arenas, A.; Fajas, L.; Leal-Esteban, L. С, The multifaceted role of cell cycle regulators in the coordination of growth and metabolism. TheFEBSjournal 2021,288 (12), 3813-3833; Baker, S. J.; Poulikakos, P. I.; Irie, H. Y.; Parekh, S.; Reddy, E. P., CDK4: a master regulator of the cell cycle and its role in cancer. Genes & cancer 2022,13, 21-45; Cornwell, J. A.; Crncec, A.; Afifi, M. M.; Tang, K.; Amin, R.; Cappell, S. D., Loss of CDK4/6 activity in S/G2 phase leads to cell cycle reversal. Nature 2023, 619, 363-370). Оба соединения Ia и Ib снижают экспрессию cyclin D1, эффекты Ib более значительные, чем у соединения Ia. Схожая тенденция выявлена при оценке экспрессии CDK4 в клетках MCF7: соединение Ib сильнее, чем соединение Iа подавляет CDK4. Обработка клеток MCF7 стероидом Ib в концентрации 15 мкМ приводит к снижению PCNA в клетках.
Таким образом, оба выбранные соединения общей формулы I оказывают влияние на белки-регуляторы клеточного цикла, эффекты, индуцированные Ib, более выражены, значительнее других была подавлена экспрессия cyclin D1. Апоптоз является основным типом гибели, индуцированной химиотерапевтическими средствами в опухолевых клетках (Pfeffer, СМ.; Singh, А. Т. K., Apoptosis: A Target for Anticancer Therapy. International journal of molecular sciences 2018, 19 (2), 448). Химиотерапия блокирует важные сигнальные пути клеток и вызывает разрывы ДНК, все это приводит к инициации клеточной гибели, активации ряда ферментов апоптоза и смещению баланса между проапопточескими и антиапоптотическими белками. Финальным этапом апоптоза является расщепление PARP (Poly (ADP-ribose) polymerase), накопление расщепленной PARP говорит о гибели клеток (Ward, Т. Н.; Cummings, J.; Dean, Е.; Greystoke, A.; Hou, J. M.; Backen, A.; Ranson, M.; Dive, C., Biomarkers of apoptosis. British Journal of Cancer 2008, 99 (6), 841-846.). Соединения Ia и Ib вызывали накопление расщепленной PARP, 15 мкМ соединение Ib вызывало более значительное расщепление PAPR, чем 15 мкМ соединение Ia. Выбранные соединения вызывали доз-зависимое снижение экспрессии антиапоптотического белка Bcl-2. В клетках, обработанных соединением lb в концентрации 15 мкМ, Bcl-2 практически не определяется, что говорит о высоком потенциале этого соединения как индуктора гибели.
Выполненное исследование демонстрирует, что заявленные соединения формулы I обладают высокой антипролиферативной активностью в отношении положительных по гормональным рецепторам клеткам рака молочной железы. Соединения формулы I (Ia,b) проявляют свойства антиэстрогенов, подавляют экспрессию белков-регуляторов клеточного цикла и индуцируют апоптоз. В отличие от известных соединений общей формулы II соединение формулы I оказывают антипролиферативное действие на клетки рака молочной железы. В связи с большой социально-экономической значимостью проблемы лечения злокачественных образований создание новых соединений представляет собой актуальную проблему как экспериментальной, так и клинической медицины. Заявленное соединение I показало высокую активность в тестах in vitro и рекомендовано для дальнейшего исследования на моделях опухолей у животных. Высокий уровень ответа ожидается получить в терапии гормонозависимого рака молочной железы.
Техническим результатом настоящего изобретения являются новые вещества - фосфорил замещенные 3-кето-андрост-4-ен-[16,17-d]пиридазины общей формулы I, проявляющие высокую антипролиферативную активность в отношении клеток гормонозависимого и трижды негативного рака молочной железы. По результатам биологических исследований in vitro показано, что соединения формулы I (Ia, Ib и Ic) существенно превосходят по активности в отношении клеток гормонозависимого рака молочной железы MCF7 и клеток трижды негативного рака молочной железы MDA-MB-231 ближайший аналог - лекарственный препарат форместан (III). Кроме того соединение 1а сопоставимо по активности, а соединение Ib превосходит применяемый в клиническом практике лекарственный препарат цисплатин. Оба соединения Ia и Ib демонстрируют селективность в отношении гормонозависимого типа раковых клеток, проявляют свойства антиэстрогенов, подавляют экспрессию белков-регуляторов клеточного цикла и индуцируют апоптоз.
| название | год | авторы | номер документа |
|---|---|---|---|
| ФОСФОРОАМИДАТНЫЕ ПРОИЗВОДНЫЕ 5-ФТОР-2'-ДЕЗОКСИУРИДИНА ДЛЯ ПРИМЕНЕНИЯ ДЛЯ ЛЕЧЕНИЯ РАКА | 2012 |
|
RU2614406C2 |
| N-ПИПЕРОНИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2017 |
|
RU2642068C1 |
| 2β,3α,5α-ТРИГИДРОКСИ-АНДРОСТ-6-ОН, СПОСОБЫ ЕГО ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2014 |
|
RU2629929C2 |
| Замещенные спироандростен-17, 6'[1,3,4]тиадиазины, обладающие противовирусной активностью | 2021 |
|
RU2750639C1 |
| Фторхинолоны на основе 4-дезоксипиридоксина | 2016 |
|
RU2634122C1 |
| Производные пиридоксина и ацетона с противоопухолевой активностью | 2017 |
|
RU2639879C1 |
| (17S)-N-БЕНЗИЛ-5-((3β-АЦЕТОКСИ-28-НОР-УРС-12-ЕН)-17-ИЛ)-1,3,4-ОКСАДИАЗОЛ-2-АМИН, ОБЛАДАЮЩИЙ СЕЛЕКТИВНОЙ ЦИТОТОКСИЧНОСТЬЮ В ОТНОШЕНИИ КЛЕТОК РАКА МОЛОЧНОЙ ЖЕЛЕЗЫ MCF-7 | 2019 |
|
RU2708400C1 |
| N-МЕТОКСИБЕНЗИЛЬНЫЕ ПРОИЗВОДНЫЕ ДАУНОРУБИЦИНА, ОБЛАДАЮЩИЕ АНТИПРОЛИФЕРАТИВНЫМИ СВОЙСТВАМИ | 2019 |
|
RU2704326C1 |
| КОНЪЮГАТЫ ТРИТЕРПЕНОВЫХ КИСЛОТ И (Е)-4-(1Н-ИНДОЛ-3-ИЛВИНИЛ)-ПИРИДИНИЙ БРОМИДА С ПРОТИВООПУХОЛЕВОЙ АКТИВНОСТЬЮ | 2020 |
|
RU2786134C2 |
| Соединения фторхинолонового ряда на основе производных пиридоксина, обладающие антибактериальными свойствами | 2019 |
|
RU2713932C1 |
Изобретение относится к фосфорил замещенным 3-кето-андрост-4-ен-[16,17-d]пиридазинам общей формулы I, где R=Ph, NHPh или NHtBu. Технический результат: создание новых стероидных соединений, обладающих высокой антипролиферативной активностью в отношении клеток гормонозависимого рака молочной железы MCF7 и клеток трижды негативного рака молочной железы MDA-MB-231, которые могут найти применение в медицине для создания противоопухолевых средств. 2 н. и 1 з.п. ф-лы, 4 пр., 1 табл.
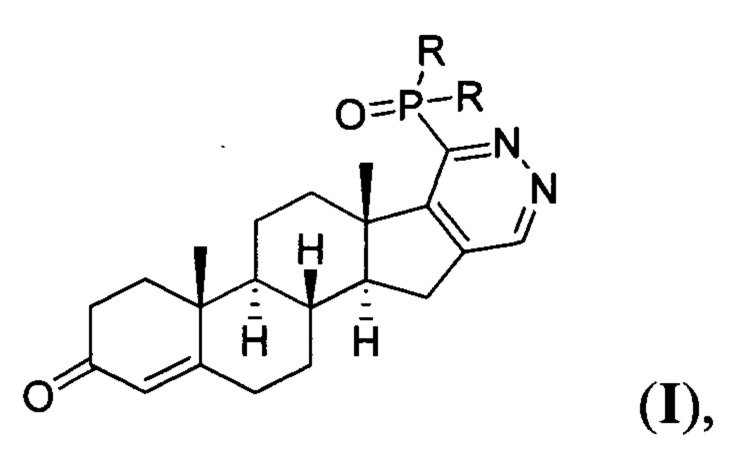
1. Фосфорил замещенные 3-кето-андрост-4-ен-[16,17-d]пиридазины общей формулы:

где R=Ph, NHPh или NHtBu.
2. Соединения по п. 1, обладающие антипролиферативной активностью в отношении клеток гормонозависимого рака молочной железы MCF7 и клеток трижды негативного рака молочной железы MDA-MB-231.
3. Способ получения фосфорил замещенных 3-кето-андрост-4-ен-[16,17-d]пиридазинов общей формулы I по п. 1, где R=Ph, NHPh или NHtBu, заключающийся в том, что 3β-ацетокси-17-хлор-16-формил-андроста-5,16-диен подвергают взаимодействию с тиогидразидами фосфорилмуравьиной кислоты общей формулы:
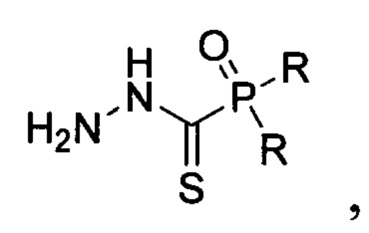 где R имеет вышеуказанные значения, в присутствии в качестве катализатора пара-толуолсульфоновой кислоты в среде 1,4-диоксана при кипячении, образующиеся при этом соответствующие 3β-гидрокси-5-андростено[16,17-d]пиридазины общей формулы:
где R имеет вышеуказанные значения, в присутствии в качестве катализатора пара-толуолсульфоновой кислоты в среде 1,4-диоксана при кипячении, образующиеся при этом соответствующие 3β-гидрокси-5-андростено[16,17-d]пиридазины общей формулы:
 где R имеет вышеуказанные значения, подвергают обработке циклогексаноном и алюминий изопропоксидом в среде толуола при кипячении с последующим выделением целевого продукта.
где R имеет вышеуказанные значения, подвергают обработке циклогексаноном и алюминий изопропоксидом в среде толуола при кипячении с последующим выделением целевого продукта.
| VOLKOVA Y | |||
| A | |||
| ET AL | |||
| Access to steroidal pyridazines via modified thiohydrazides | |||
| RSC advances, 2016, vol | |||
| Приспособление для точного наложения листов бумаги при снятии оттисков | 1922 |
|
SU6A1 |
| Способ смешанной растительной и животной проклейки бумаги | 1922 |
|
SU49A1 |
| ОПРОКИДНАЯ ВАГОНЕТКА | 1934 |
|
SU42863A1 |
| WISEMAN L | |||
| R., GOA K | |||
| L | |||
| Formestane: a review of its pharmacological properties and clinical efficacy in the treatment of postmenopausal breast cancer | |||
| Drugs & aging, 1996, vol | |||
| Разборный с внутренней печью кипятильник | 1922 |
|
SU9A1 |
| ПРИСПОСОБЛЕНИЕ ДЛЯ УСТРАНЕНИЯ СКОЛЬЖЕНИЯ КОЛЕС АВТОМОБИЛЕЙ | 1920 |
|
SU292A1 |
| TANTAWY M | |||
| A | |||
| ET | |||
Авторы
Даты
2023-11-21—Публикация
2023-10-05—Подача