Изобретение относится к медицине, а именно к клеточной биологии, цитологии, гистологии. В изобретении представлен способ определения воздействия бихромата калия на флуоресценцию ализарина красного С, что необходимо для определения локализации катехоламинов в эритроцитах.
Хромаффинная реакция эритроцитов и мозгового вещества надпочечников является одним из классическим способов оценки метаболизма биогенных аминов в организме (1. Zak F.G., Lawson W. The Paraganglionic Chemoreceptor System: Physiology, Pathology, and Clinical Medicine. New York: Springer-Verlag, 1982. P. 583). Существуют способы стандартной клинической и экспериментальной цитохимической оценки депонирования биогенных аминов эритроцитами, в котором мазки периферической крови окрашиваются в р-ре бихромата и нитрата серебра или ализарина красного С (2. Мардарь А.И., Кладиенко Д.П. Цитохимический способ выявления катехоламинов в эритроцитах // Лаб. дело. 1986. №10. С. 586-588; 3. Зиновьев С.В. Локализация ионов кальция на мембране эритроцитов кролика при общем охлаждении организма // Диагностика состояния дыхательной системы (Материалы XVII сессии СО АМН СССР). - Благовещенск, 1988. - С. 5-8; 4. Зиновьев С.В., Целуйко С.С. Цитохимическая характеристика эритроцитов при экспериментальном антиортостатическом вывешивании крыс // Амурский медицинский журнал. 2017. №2 (18). С. 54-57). Недостатком известных способов, является то, что отсутствует надежный контроль специфического выявления бихроматом калия биогенных аминов.
Наиболее близким к заявляемому нами техническому решению является способ, в котором мазки периферической крови окрашиваются в растворе бихромата и ализарина красного С в целях выявления содержания и количественной оценки окрашенных гранул, отражающих локализацию катионов кальция и биогенных аминов в цитоплазме эритроцитов (5. Патент RU 2617201 С1 от 21.04.2017 «Способ количественной цитохимической оценки хромафинной реакции эритроцитов крыс при общем охлаждении организма»). Этот способ исполняет функцию контроля специфичности светооптического обнаружения окрашенных ализарином катионов кальция и биогенных аминов в цитоплазме эритроцитов. Недостатком способа, описанного в прототипе (5), является то, что он осуществляется без флуоресцентной микроскопии.
Цель заявленного способа заключается в количественной оценке цитохимического выявления биогенных аминов, которые содержатся в цитоплазме части эритроцитов. В отличие от известного способа, описанного в прототипе (5), в заявленном способе с помощью флуоресцентной микроскопии уточняется механизм цитохимического выявления биогенных аминов на мазках периферической крови окрашенных ализарином красным С. Во время осуществления способа выявляется то, что амидные группы биогенных аминов взаимодействуют с бихроматом калия с образованием гидроксид хрома 2 (Cr(ОН)2), который затем специфически вступают в химическую реакцию с ализарином красным С и формируют лак. Сущность заявленного способа заключается в том, что хромаффинная реакция эритроцитов оценивается с помощью флуоресцентной микроскопии.
Техническая проблема, ранее препятствующая решению задачи заявленного способа, заключается в выборе способа микроскопии окрашенных мазков крови, увеличении арсенала средств, позволяющих выявить наличие специфических гранул в эритроцитах, маркирующих биогенные амины.
Технический результат изобретения заключается в повышении точности оценки хромаффинной реакции в эритроцитах в результате того, что с помощью флуоресцентной микроскопии прогнозируются количественные особенности содержания и метаболизма биогенных аминов в эритроцитах.
Технический результат от реализации заявленного изобретения достигается с помощью совокупности существенных признаков, описанной ниже:
«Способ флуоресцентной цитохимической оценки содержания биогенных аминов в эритроцитах, осуществляемый во время поэтапной обработки мазков периферической крови аутбредных крыс альбиносов через 48 часов после травмы, включающий одновременную фиксацию и окраску в насыщенном 5% спиртовом растворе ализарина красного С, двойное отмывание препаратов в дистиллированной воде с последующим высушиванием, дополнительное окрашивание в 5% водном растворе бихромата калия при необходимости, повторное отмывание в дистиллированной воде, а также осуществляемый во время обработки мазков крови, дополнительно фиксированных в парах формалина, после чего проводят микроскопию окрашенных или не окрашенных мазков крови, отличающийся тем, что с целью оценки флуоресценции эритроцитов, мазки крови исследуют под флуоресцентным микроскопом при условии освещения препаратов сверху в диапазоне спектра поглощения от 600-615 нм, всего в мазке изучают 300 клеток, после чего рассчитывают средний цитохимический коэффициент - СЦК по формуле:
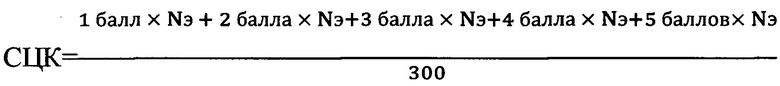 ,
,
где:
Nэ - количество эритроцитов,
1 балл - эритроциты не флуоресцируют,
2 балла - выявляется разрозненная (1-5 гранул) гранулярная флуоресценция цитоплазмы эритроцита,
3 балла - выявляется флуоресцирующая разрозненная гранулярная окраска части периферии (тора) эритроцита, центральная часть клетки не окрашена,
4 балла - периферия цитоплазмы (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная менее 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом,
5 баллов - цитоплазма (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная более 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом,
при значении СЦК<1,2 делают вывод о снижении адренореактивности эритроцитов, приводящей к гемореологическим нарушениям периферической крови у крыс».
Таким образом, способ осуществляется в несколько этапов.
1. Этап. Изготавливается тонкий мазок периферической крови аутбредных крыс альбиносов на предметном стекле.
2. Этап. Производится окраска флуорохромом-ализарином красным С мазка периферической крови аутбредных крыс альбиносов на предметном стекле. В отличие от известных способов (5) в заявленном способе мазок периферической крови, после высушивания на открытом воздухе, затем одновременно фиксируется и окрашивается в 5% р-ре ализарина красного С в 96% этаноле на протяжении 90 секунд. В целях избавления от этанола уже окрашенный мазок периферической крови промокается по краям с помощью фильтровальной бумаги, а затем полностью высушивается на открытом воздухе в течение 3 часов. Окрашенный мазок крови (5-10 секунд) прополаскиваются в дистиллированной воде, затем помещается в 5% р-р бихромата калия на 5-10 секунд, потом отмываются в дистиллированной воде (от 5 до 30 секунд), мазки крови сушатся на открытом воздухе.
3. Этап. Флуоресцентная микроскопия мазка периферической крови аутбредных крыс альбиносов на предметном стекле. С помощью способа флуоресцентной микроскопии изучаются неокрашенные препарат и окрашенные цитологические препараты. В момент флуоресцентной микроскопии неокрашенные препараты и окрашенные препараты освещались сверху при увеличении объектива×40, окуляр×10.
Возбуждение флуоресценции осуществлялось в диапазоне спектра поглощения, характерного для ализарина от 600-615 нм. Выход флуоресценции оценивается в целях выявления максимума флуоресценции в диапазоне 600-680 нм.
Этот этап включает цитохимическую оценку изучаемой реакции на мазках крови. В целях, оценки механизма тушения флуоресценции ализарина красного С в клетках крови изучаются окрашенные или не окрашенные препараты:
А - с обработкой мазков бихроматом калия,
Б - без обработки мазков бихроматом калия,
В - фиксированные в парах формалина,
Г - фиксированные в парах формалина и окрашенных ализарином красным С и бихроматом калия.
В отличие от известного способа (5) количественная оценка цитохимической реакции происходит по пятибалльной системе:
1 балл - эритроциты не флуоресцируют;
2 балла выявляется разрозненная (1-5 гранул) гранулярная флуоресценция цитоплазмы эритроцита;
3 балла - выявляется флуоресцирующая разрозненная гранулярная окраска части периферии (тора) эритроцита, центральная часть клетки не окрашена;
4 балла - Периферия цитоплазмы (тор) эритроцитов целиком гранулярно флуоресцирует. Гранулярная зернистость крупная менее 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом.
5 баллов - Цитоплазма (тор) эритроцитов целиком гранулярно флуоресцирует. Гранулярная зернистость крупная более 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом.
Подсчет цитохимической реакции ведется на 300 эритроцитов. Во время исследования подсчитывается количество эритроцитарных клеток с различной выраженностью флуоресценции. В окрашенных мазках крови собственная флуоресценция (при возбуждении в области спектра 600-615 нм) отсутствует. Поэтому введения ее оценочного значения в СЦК мы пренебрегали.
После чего по формулам рассчитывают средний цитохимический коэффициент флуоресценции биогенный аминов СЦК:
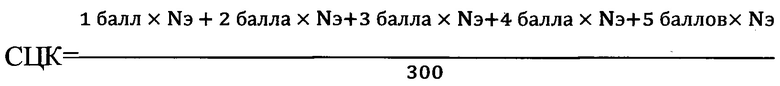 ,
,
где:
Nэ - количество эритроцитов,
1 балл - эритроциты не флуоресцируют,
2 балла - выявляется разрозненная (1-5 гранул) гранулярная флуоресценция цитоплазмы эритроцита,
3 балла - выявляется флуоресцирующая разрозненная гранулярная окраска части периферии (тора) эритроцита, центральная часть клетки не окрашена,
4 балла - периферия цитоплазмы (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная менее 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом,
5 баллов - цитоплазма (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная более 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом,
где при значении СЦК<1,2 делают вывод о снижении адренореактивности эритроцитов, приводящей к гемореологическим нарушениям периферической крови у крыс.
Это делается с целью микроскопического анализа механизма сенсибилизации флуоресценции ализарина красного С на мазках крови, что в свою очередь позволяет уточнить изобретательский уровень и новизну заявленного способа.
Как указывалось выше, недостатком известных способов исследования (5) является то, что в них не изучалась флуоресценция ализарина красного С в присутствии бихромата калия и других веществ. Ализарин красный С (Na-соль 9,10-дигидро-3,4-дигидрокси-9,10-диоксо-2-антраценсульфо-кислоты) будучи простым фенолом, является специфическим и сильным флуорохромом. С помощью флуоресценции ализарина красного С выявляется наличие катионов - оксида титана, алюминия, цинка, меди, кальция, которые сопровождают биохимические процессы с участием тиоловых групп белков (6. Карнаухов В.Н. Люминесцентный анализ клеток: учебное пособие - Пущине Электронное из-во «Аналитическая микроскопия». - 2002. http:cam.psn. ru; Гуркин Р.В., свободный. - Загл. с экрана. - № гос. регистрации 6072 от 4 февраля 2002 г.; 7. Dworak L., Matylitsky V., Wachtveitl J. Ultrafast Photoinduced Processes in Alizarin-Sensitized Metal Oxide Mesoporous Films. ChemPhysChem. Vol. 10. Is. 2. P. 384-91; 8. Chena Z., Wanga Z., Chenb J., Chenc X. Alizarin red S/copper ion-based ensemble for fluorescence turn on detection of glutathione with tunable dynamic range // Biosensors and Bioelectronics. 2012, Vol. 38. Is. 1, P. 202-208; 9. Kaushik R., Kumar P., Ghosh A. et all. Alizarin red S-zinc(II) fluorescent ensemble for selective detection of hydrogen sulphide and assay with an H2S donor // RSC Adv. 2015. Vol. 5. P. 79309-79316). Известно, что атомы хрома в качестве донора сенсибилизирует люминесценцию в атомах акцептора - Nd3+. Характерной чертой данного процесса является тушение флуоресценции донора и возникновение более длинноволновой флуоресценции акцептора (10. Константинова-Шлезингер М.А., Химия ламповых гетеродесмических люминофоров, М., 1970). Поэтому новизной заявленного способа является то, что окрашивание мазков крови спиртовым раствором ализарина красного С и бихроматом калия усиливает флуоресценцию эритроцитов крыс.
Другим доказательством новизны заявленного способа является то, что фиксации цитологических препаратов в парах формалина подавляет флуоресценцию эритроцитов крыс после окрашивание мазков крови спиртовым раствором ализарина красного С и бихроматом калия.
При этом известны способы оценки усиления флуоресценции биогенных аминов в срезах надпочечников, которые производятся после обработки формалином по методу Фалька (11. Луппа X. Основы гистохимии. М.: Мир, 1980. 343 с.). В этих способах возбуждение флуоресценции происходит в области электромагнитного излучения с длиной волны от 380 нм, до 410 нм, а спектр флуоресценции в области от 480 до 540 нм (11). Недостатком известных способов является сильная собственная флуоресценция тканей органов и клеток живых организмов /6/. Автофлуоресценция тканей органов и клеток живых организмов появляется при возбуждении электромагнитным излучением с длиной волны от 380 нм до 700 нм. Спектр собственно флуоресценции находится в области от 510 нм до 700 нм (6).
Фундаментальное значение новизны заявленного способа подтверждается при анализе участия антрахинонов в окислительно-восстановительных реакциях. Производные антрахинонов используются в производстве концентрированной перекиси водорода (12. Патент RU 736535 А1). При этом известно, что пероксидазы специфически окисляют молекулу ализарина, обесцвечивают его молекулу (13. Huiran Pan, Xiaolin Xu, Zhu Wen, et all. Decolorization pathways of anthraquinone dye Disperse Blue 2BLN by Aspergillus // Bioengineered. 2017, Vol. 8, №5. P. 630-641; 14. Pirillo S., Einschlag F. S. G., Rueda E. H. et all. Horseradish Peroxidase and Hematin as Biocatalysts for Alizarin Degradation Using Hydrogen Peroxide // Ind. Eng. Chem. Res., 2010, 49 (15). P. 6745-6752; 15. Pozdnyakova N. N., Wilkolazka A.J., Polak J., et all. Decolourisation of anthraquinone- and anthracene-type dyes by versatile peroxidases from bjerkandera fumosa and pleurotus ostreatus // Journal Biocatalysis and Biotransformation. 2015..Volume 33, Issue 2. P. 69-80). Окисление пероксидазой молекулы ализарина красного С приводит к обесцвечиванию его молекулы, что должно изменять спектр поглощения ализарином электромагнитных волн в красном диапазоне возбуждения флуоресценции. Это влияет на квантовый выход молекулой ализарина красного С в момент флуоресценции.
В отличие от известных способов (5) в заявленном способе с помощью флуоресцентного микроскопа изучается реакция продуктов окисления бихроматом биогенных аминов, которые, при участии пероксидазной активности эритроцитов образуют восстановленную- ярко окрашенную форму лака ализарина красного С.Гемоглобин обладает псевдопероксидазной активностью, что важно учитывать, так как ализарин красный С является простым фенолом, а следовательно, субстратом пероксидазной активности (16. Микроскопическая техника: руководство для врачей и лаборантов / ред. Саркисов Д.С., Перов Ю.Л.; РАМН. М.: Медицина, 1996. 544 с.). В эритроцитах содержится высокое количество гемоглобина, и других ферментов, которые обладают псевдопероксидазной активностью. При этом выяснено, то, что пероксидазы специфически окисляют ароматические аминокислоты и биогенные амины с образованием окисленных пигментов (17. Новиков Н.Н. Новый метод определения активности пероксидаз в растениях // Известия Тимирязевской сельскохозяйственной академии. 2016. Вып. 3. С. 36-46). Поэтому новизной изобретения является то, что с помощью флуоресцентной микроскопии производиться оценка - специфических для дифферона эритроидного ряда гемопоэза окислительно-восстановительных свойств, на основе восстановления окрашенной молекулы ализарин красного С.
Ранее эта функция была описана только в случае развития мегалобластных анемий при дефиците фолиевой кислоты и витамина B12-цианкобаломина. Окрашивание эритроидных клеток ализарином красным С по Кассу рекомендовано для дифференциальной диагностики мегал областной анемии при недостаточности витамина В12-цианкобаломина (18. Маколкин В.И., Овчаренко СИ. Внутренние болезни. М.: Медицина, 1999. 592 с; 19 Kass L. Pink Staining of Pernicious Anemia Megaloblasts by Alizarin Red S // American Journal of Clinical Pathology. Vol. 62, I. 4. 1974, p. 511-514).
Сенсибилизация люминесценции атомами хрома имеет фундаментальное значение для исследования резонансно-индукционного переноса энергии между донором и акцептором. Новизна предлагаемого способа заключается в том, что во время решения задач изобретения появляется необходимость объяснения механизма флуоресценции ализарина красного С в присутствии ионов хрома. Нами установлено влияние добавления бихромата калия на сенсибилизацию флуоресценции ализарина красного С после окрашивания эритроцитов, что доказывает тушение флуоресценции доноров электронов. Это указывает на существенные недостатки известных прототипов заявленного изобретения и на его фундаментальное значение в изучении синглетного энергетического перехода электронов атомов аминогрупп биогенных аминов.
Пример осуществления предлагаемого способа.
Объектом исследования являлись белые крысы (Вистар) - самцы, в возрасте 4 месяца, весом 300-350 грамм. Животные находились в помещении при температуре +25°С и 30% влажности воздуха. Были созданы 3 группы экспериментальных животных. В каждой группе было по 20 животных. 1 гр. - интактные животные. 2 и 3 группы. Животных подвергали экспериментальному воздействию закрытой черепно-мозговой травмы. В качестве модели механической травмы головного мозга использовали стандартная модель «падающего груза». Ее осуществляли с помощью груза весом 115 гр., падающего с высоты 120 см (20. Дмитриенко Е.В., Филатенкова Т.А., Рыбакина Е.Г., Корнева Е.А. Поведенческие реакции животных после экспериментальной черепно-мозговой травмы: влияние препарата нуклеотидной природы // Вестник Санкт-Петербургского университета. Медицина. 2014. №3. С. 180-191). После нанесения травмы животные переносились в специальную пластиковую клетку, и за ними велось наблюдение. В течение времени восстановления у крыс наблюдались асфиксия, судороги, потеря двигательной активности, и т.д. Через 120 минут после нанесения травмы у части животных - группа 2 производилось цитохимическое исследование хромаффинной реакции эритроцитов в артериальной крови, полученной из легочной вены левого легкого. Другая часть животных - группа-3 возвращались в клетку. В этой группе крыс цитохимическое исследование хромаффинной реакции эритроцитов производилось через 48 часов после ЧМТ. После анестезии животных осуществлялась вскрытие грудной клетки крыс. Для получения крови делалась флеботомия (венесекция) левой каудальной легочной вены по известному способу /4/. Для этого с помощью зажима нейрохирургического типа «Москит» пережимался просвет легочной вены. Левое легкое приподымалось и укладывалось на предметное стекло, которое вводят в грудную клетку. Затем скальпелем рассекался просвет левой каудальной легочной вены, который расположен ближе к воротам левого легкого. Капля крови, поступившая из вен легкого, наносилась на предметное стекло, после чего изготавливался цитологический мазок. Затем производилось цитохимическое окрашивание мазков крови изложенным в изобретении способом. Для оценки флуоресценции эритроцитов на мазках крови окрашенных предложенным нами способом использовали микроскоп фирм Карл Цейс - Axio Scope. A1. Сначала оценивалась флуоресценция мазков окрашенных ализарином красным С (Sigma-Aldrich), не обработанных р-ром бихромата калия. Потом оценивалась флуоресценция мазков окрашенных ализарином красным С обработанных р-ром бихромата калия.
Парциальный вес флуоресцирующих и не флуоресцирующих эритроцитов оценивался с помощью СЦК. Это было обусловлено тем, что выраженность флуоресценции эритроцитов отражает различную степень окраски клеток в каждом случае наблюдения микропрепарата.
Парциальный вес флуоресцирующих и не флуоресцирующих эритроцитов оценивался с помощью СЦК. Это было обусловлено тем, что выраженность флуоресценции эритроцитов отражает различную степень окраски клеток в каждом случае наблюдения микропрепарата. Результаты цитохимического исследования мазков периферической крови крыс, которые отражают механизм экспериментального воздействия на организм, отражены в таблицах (1, 2). При исследовании неокрашенных мазков крови отмечается выраженная флуоресценция цитологических препаратов таблица (1). Мы изучали нефиксированные и фиксированные в парах формалина мазки крови крыс. Флуоресценция крови крыс на неокрашенных мазках цитологических мазках изучалась при возбуждении флуоресценции в области от 380 нм до 410 нм. Спектр собственной флуоресценции крови находиться в области от 410 нм до 540 нм. При флуоресцентной микроскопии при освещении препаратов при длине волны 615 нм отмечается отсутствие собственной флуоресценция эритроцитов и лейкоцитов, с которыми контактируют флуоресцирующие частицы размером от 0,2 до 1 мкм. При окрашивании предложенным способом мазков крови, но без бихромата калия, отмечается существенное тушение флуоресценции ализарина красного С и собственной флуоресценции цитологических препаратов. При длительном окрашивании мазков крови (более 5 минут) рядом с эритроцитами обнаруживаются единичные крупные гранулы лака ализарина размером от 0,3 - до 1 мкм. Эти гранулы не флуоресцируют во всех диапазонах спектра. При исследовании микропрепаратов отмечается флуоресценция незначительной части эритроцитов, которая возникает при освещении препаратов при длине волны 615 нм. Эта флуоресценции увеличивается при экспериментальной травме (табл. 2).
При окрашивании мазков крови ализарином и бихроматом обнаруживается выраженная флуоресценция части эритроцитов, в другой части эритроцитарных клеток продукт гистохимической реакции отсутствует. Парциальный вес флуоресцирующих эритроцитов повышается в первые часы (120 минут) после экспериментальной травмы. Это приводит к достоверному увеличению СЦК хромаффинной реакции эритроцитов (табл. 2). В период после 48 часов после начала травматической болезни, в мазках крови существенной уменьшается количество флуоресцирующих эритроцитов, следовательно, повышается количество не флуоресцирующих клеток. СЦК хромаффинной реакции эритроцитов в этой группе животных снижается. Установлено, то, что фиксация в парах формалина мазков крови окрашенным предложенным способом с последующей окраской бихроматом калия блокирует флуоресценцию эритроцитов при освещении препаратов при длине волны 615 нм (табл. 2). Это говорит об участии амидных групп тирозина в этой реакции.
Аутбредные крысы альбиносы (Rattus norvegic) имеют видовые особенности обмена ароматических аминокислот, в ввиду низкой активности тирозиназы (21. Blaszczyk W.M., Arning L., Hoffmann K.P., et all. A Tyrosinase missense mutation causes albinism in the Wistar rat // Pigment Cell Res. 2005. 18(2). 144-145). Это уточняет и облегчает исследование обмена ароматических аминокислот в эритроцитах периферической крови во время эксперимента. В свою очередь это необходимо для создания экспериментальных моделей, в которых исследуется молекулярный механизм адренореактивности эритроцитов периферической крови.
С помощью заявленного способа оценки выявляется то, что снижение СЦК<1,2 указывает на участие адренореактивности эритроцитов в гемореологических нарушениях периферической крови через 48 часов после начала экспериментальной черепно-мозговой травмы аутбредных крыс альбиносов.
Сведения об авторах:
1) Зиновьев Сергей Викторович, старший научный сотрудник ЦНИЛ, ФГБОУ ВО ТГМУ Минздрава России, г. Владивосток.
2) Плехова Наталья Геннадьевна, заведующая ЦНИЛ ФГБОУ ВО ТГМУ Минздрава России, г. Владивосток.
3) Радьков Иван Валерьевич, аспирант ФГБОУ ВО ТГМУ Минздрава России г. Владивосток, г. Владивосток.
4) Лаптев Виктор Викторович лаборант ФГБОУ ВО Тихоокеанский государственный медицинский университет Минздрава России, г. Владивосток.
СПОСОБ ФЛУОРЕСЦЕНТНОЙ ЦИТОХИМИЧЕСКОЙ ОЦЕНКИ СОДЕРЖАНИЯ БИОГЕННЫХ АМИНОВ В ЭРИТРОЦИТАХ
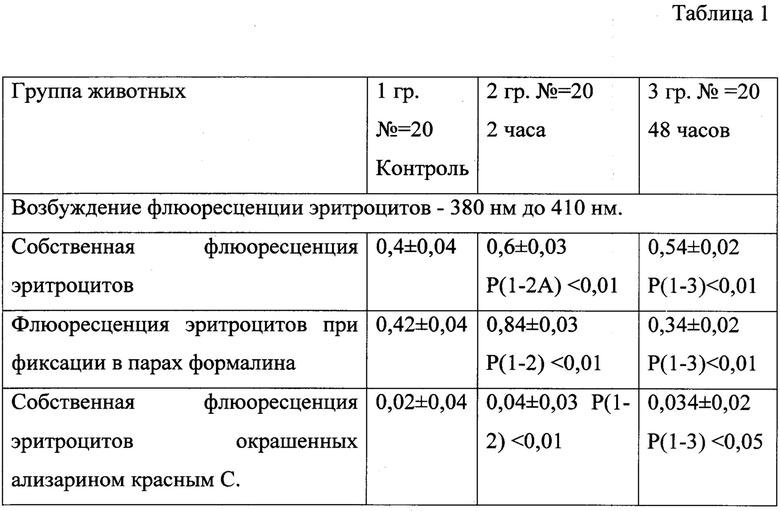
Р - статистическая достоверность количественных значений СЦК эритроцитов в 1, 2, 3 групп животных.
СПОСОБ ФЛУОРЕСЦЕНТНОЙ ЦИТОХИМИЧЕСКОЙ ОЦЕНКИ СОДЕРЖАНИЯ БИОГЕННЫХ АМИНОВ В ЭРИТРОЦИТАХ
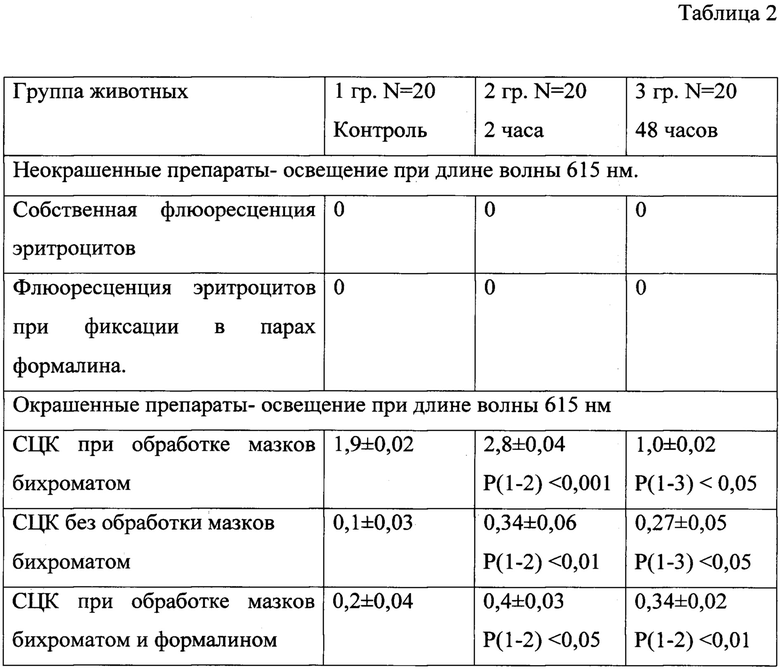
Р - статистическая достоверность количественных значений СЦК эритроцитов в 1, 2, 3 групп животных.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма | 2016 |
|
RU2617201C1 |
| Способ определения окислительного потенциала клеток с применением бихроматометрии | 2022 |
|
RU2798290C1 |
| Способ донозологической неинвазивной диагностики состояния здоровья работников | 2019 |
|
RU2725291C1 |
| СПОСОБ ОЦЕНКИ ЭФФЕКТИВНОСТИ ИММУНИЗАЦИИ ПРИ КУ-РИККЕТСИОЗЕ | 1991 |
|
RU2039982C1 |
| Способ определения иммунодефицитного состояния у лиц, подвергающихся воздействию малых доз ионизирующей радиации | 1990 |
|
SU1807401A1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ ОСТРЫХ РЕСПИРАТОРНЫХ ЗАБОЛЕВАНИЙ И БАКТЕРИАЛЬНЫХ КАТАРАЛЬНЫХ АНГИН | 1989 |
|
RU2028600C1 |
| СПОСОБ ВЫЯВЛЕНИЯ ЦИРКУЛИРУЮЩИХ ОПУХОЛЕВЫХ КЛЕТОК, МИКРОЭМБОЛ И АПОПТОТИЧЕСКИХ ТЕЛЕЦ В КРОВИ БОЛЬНЫХ РАКОМ ЛЕГКОГО ЧЕЛОВЕКА | 2013 |
|
RU2571821C2 |
| СПОСОБ ВЫЯВЛЕНИЯ НАРУШЕНИЯ ФУНКЦИИ ФАГОЦИТОВ ПРИ РАЗВИТИИ РЕЦИДИВИРУЮЩИХ ИНФЕКЦИОННЫХ ПРОЦЕССОВ | 2007 |
|
RU2362997C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СПОСОБНОСТИ АДАПТАЦИИ ЧЕЛОВЕКА К УКАЧИВАНИЮ | 1986 |
|
RU1438033C |
| Способ определения активности миелопероксидазы нейтрофилов в мазках крови животных | 2015 |
|
RU2612149C1 |
Изобретение относится к медицине, а именно к цитологии, гистологии, и может быть использовано для флуоресцентной цитохимической оценки адренореактивности в эритроцитах. Для этого осуществляют поэтапную обработку мазков периферической крови аутбредных крыс. При этом проводят одновременную фиксацию и окраску мазка в насыщенном 5% спиртовом растворе ализарина красного С. Затем осуществляют двойное отмывание препаратов в дистиллированной воде с последующим высушиванием. Дополнительно окрашивают в 5% водном растворе бихромата калия при необходимости, повторно отмывают в дистиллированной воде. Во время обработки проводят дополнительную фиксацию мазков крови в парах формалина. Затем проводят микроскопию окрашенных или неокрашенных мазков крови. Мазки крови исследуют под флуоресцентным микроскопом при условии освещения препаратов сверху в диапазоне спектра поглощения от 600-615 нм. В мазке изучают 300 клеток. Рассчитывают средний цитохимический коэффициент (СЦК) в баллах. При значении СЦК<1,2 делают вывод о снижении адренореактивности эритроцитов. Изобретение позволяет оценить адренореактивность эритроцитов в периферической крови животных. 2 табл., 1 пр.
Способ флуоресцентной цитохимической оценки адренореактивности в эритроцитах, осуществляемый во время поэтапной обработки мазков периферической крови аутбредных крыс альбиносов, включающий одновременную фиксацию и окраску в насыщенном 5% спиртовом растворе ализарина красного С, двойное отмывание препаратов в дистиллированной воде с последующим высушиванием, дополнительное окрашивание в 5% водном растворе бихромата калия при необходимости, повторное отмывание в дистиллированной воде, а также осуществляемый во время обработки мазков крови, дополнительно фиксированных в парах формалина, после чего проводят микроскопию окрашенных или неокрашенных мазков крови, отличающийся тем, что с целью оценки флуоресценции эритроцитов мазки крови исследуют под флуоресцентным микроскопом при условии освещения препаратов сверху в диапазоне спектра поглощения от 600-615 нм, всего в мазке изучают 300 клеток, после чего рассчитывают средний цитохимический коэффициент - СЦК по формуле:
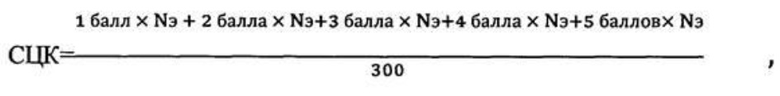
где:
NЭ - количество эритроцитов,
1 балл - эритроциты не флуоресцируют,
2 балла - выявляется разрозненная (1-5 гранул) гранулярная флуоресценция цитоплазмы эритроцита,
3 балла - выявляется флуоресцирующая разрозненная гранулярная окраска части периферии (тора) эритроцита, центральная часть клетки не окрашена,
4 балла - периферия цитоплазмы (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная, менее 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом,
5 баллов - цитоплазма (тор) эритроцитов целиком гранулярно флуоресцирует, гранулярная зернистость крупная, более 0,5 мкм в диаметре, в результате чего флуоресценция гранул сливается друг с другом, где при значении СЦК<1,2 делают вывод о снижении адренореактивности эритроцитов
| Способ количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма | 2016 |
|
RU2617201C1 |
| CN 102411013 A, 11.04.2012 | |||
| МАРДАРЬ А.И | |||
| и др | |||
| Цитохимический способ выявления катехоламинов в эритроцитах, Лаб | |||
| дело | |||
| Пневматический водоподъемный аппарат-двигатель | 1917 |
|
SU1986A1 |
| KASS L., Pink staining of pernicious anemia megaloblasts by alizarin red s | |||
| American Journal of Clinical Pathology, 1974, 62(4), P | |||
| СПОСОБ ПОЛУЧЕНИЯ ТВЕРДЫХ ПРОДУКТОВ УПЛОТНЕНИЯ ФОРМАЛЬДЕГИДА С ФЕНОЛАМИ И ДРУГИМИ ВЕЩЕСТВАМИ | 1925 |
|
SU511A1 |
Авторы
Даты
2019-12-17—Публикация
2018-07-10—Подача