Изобретение относится к медицине, а именно к гигиене, клинико-лабораторной диагностике, цитологии, и, являясь способом диагностики состояния здоровья работников, обеспечивает выявление донозологических признаков нарушений здоровья при воздействии вредных производственный факторов.
Методы диагностики преморбидных состояний человека весьма разнообразны и включают психодиагностическое тестирование, изучение иммунного статуса, функций сердечно-сосудистой системы, определение биохимических параметров крови, а именно, показателей свободнорадикального и перекисного окисления (состояние антиоксидантных систем и перекисного окисления липидов), состояние ферментных систем клеток и другие. В настоящий момент актуальным направлением в современной клинико-лабораторной диагностике являются неинвазивные методы обследования. Особенное значение имеют подобные методы с целью донозологической диагностики нарушений состояния здоровья, обусловленных влиянием неблагоприятных факторов окружающей среды, включая факторы рабочей среды. К неинвазивному методу гигиенической донозологической диагностики относят цитологическое исследование буккального эпителия слизистой оболочки ротовой полости.
Известны способы цитологического исследования мазков слизистой оболочки ротовой полости [1. Быков В.Л., Гистология и эмбриология органов полости рта человека. Учебное пособие. Издание второе, исправленное, 1998. 2-е изд. СПб.: Специальная литература, 1998. 248 с.]. При этом методе, материал, получаемый путем соскоба с внутренней поверхности ротовой полости с помощью шпателя или тампона, переносят на покровное стекло, фиксируют и окрашивают одним из принятых полихромных методов: по Папаниколау, Романовскому-Гимзе и др. Подобное диагностическое цитологическое исследование используют для выявления нарушений процесса дифференцировки эпителия при развитии воспалительных, дистрофических, предопухолевых или опухолевых процессов. В эпителии полости рта определяются базальные, парабазальные, промежуточные и поверхностные клетки, а в участках, подвергающихся ороговению, также и роговые чешуйки. При травме и наличии воспалительных процессов эпителия в мазке отмечаются базальные клетки, а парабазальные обнаруживаются при атрофии. Преобладание в мазке промежуточных клеток указывает на созревание эпителия и его максимальный уровень обнаруживается наличием поверхностных клеток, в случае ороговевания эпителия - роговых чешуек. При гиперкератозах содержание последних резко увеличивается. Путем подсчета индекса созревания, который является количественным соотношением клеток в различной стадии дифференцировки: парабазальных, промежуточных, поверхностных и роговых чешуек, и выражен в процентах, оценивается степень созревания эпителия. С этой целью используют и другие количественные показатели, а именно, кариопикнотический индекс (относительное содержание клеток с пикнотическим ядром) и эозинофильный индекс (доля клеток с эозинофильной цитоплазмой) [1].
Недостатками известных способов является то обстоятельство, что с их помощью не осуществляется цитохимическая оценка молекулярных механизмов регуляции дифференцировки многослойного плоского неороговевающего эпителия слизистой оболочки ротовой полости, что не позволяет в должной мере соотнести влияние неблагоприятных факторов окружающей среды, в том числе вредных факторов рабочей среды, на состояние здоровья человека.
Наиболее близким, к заявляемому техническому решению является метод цитохимического исследования буккального эпителия слизистой оболочки ротовой полости, путем окраски клеток спиртовым раствором ализарина красного С [2. Зиновьев С.В., Романцова Е.Б., Целуйко С.С. Цитохимическая характеристика орального секрета у школьниц // Российский вестник перинатологии и педиатрии. 2016. Т. 61. №4. С. 266-267]. Задачей известного способа [2], является морфологическая оценка ядра клеток буккального эпителия по включению красителя и его оптической плотности, которая определяется с помощью оптической микроскопии в проходящем свете.
Недостатком данного метода является [2] субьективность и ограничение информации о клеточном метаболизме, сопровождающих процесс дифференцировки, что не позволяет в полной мере оценить состояние эпителия и использовать его в качестве гигиенической донозологической диагностики нарушений в состоянии здоровья человека.
Техническая проблема, ранее препятствующая решению задачи заявленного способа, невозможность объективной оценки состояния клеток при просмотре под оптическим микроскопом окрашенных мазков, тогда как в заявляемом способе, используется явление флуоресценции окрашенных ализарином красным С клеток буккального эпителия. Недостатком известных способов [2], наиболее близких к заявляемому нами техническому решению является то, что они осуществляются без флуоресцентной микроскопии.
1. Технический результат заявленного способа заключается в том, что с его помощью выявляются цитохимические особенности кальций-зависимого механизма регулирования дифференцировки буккального эпителия.
2. Техническим результатом заявленного способа является то, что с помощью флуоресцентной микроскопии можно сделать оценку ДНК-интеркалирующих свойств ализарина красного С, который окрашивает ядра клеток буккального эпителия. Это позволяет оценить особенности строения ДНК изучаемых клеточных элементов. Фрагменты хинонов являются общими для многих природных и синтетических соединений, включая ализарин, которые являются ДНК-интеркалирующими агентами, благодаря их структурам, способным образовывать водородные связи с азотистыми основаниями. Указанные соединения имеют боковые цепи, углеводные остатки и основные атомы азота, которые прочно связываются с ДНК [3. Горностаев Л.М., Арнольд Е.В., Лаврикова Т.И., Руковец Т.А., Талдыкина Д.С., Халявина Ю.Г., Штиль А.А. Полициклические хиноидные соединения в качестве противоопухолевых препаратов // Сибирское медицинское обозрение. 2017. Т. 6. С. 21-31.] Примерами производных хинонов с противоопухолевой активностью доксорубицин, митомицин [3]. Все известные хиноновые ДНК-интеркаляторы способны нарушать функции ДНК, что приводит к гибели клеток. Ализарин - самый известный хинон, на основе которого синтезированы другие антрахиноны, так же обладает противоопухолевой активностью [4. Mishra S.R., P. Nandhakumar, Yadav К.Р., et all. In vitro analysis of alizarin as novel therapeutic agent for murine breast cancer // The Pharma Innovation Journal 2017; 6(10): 345-350; 5. Ye M.Y., Yao G.Y., Pan Y.M., Liao Z.X., Zhang Y., Wang H.S. Synthesis and antitumor activities of novel α-aminophosphonate derivatives containing an alizarin moiety // Guiyang Yao, Weilong Dai, Synthesis and antitumor properties of novel alizarin analogs // Eur. J. Med. Chem. 2014. 23. 12. P. 5031-5042].
3. Учитывая то, что с помощью ализарина красного С выявляются микроядра [2], техническим результатом заявленного способа является цитохимическая характеристика механизма развития ядерной патологии в клетках буккального эпителия.
Поэтому, новизной и изобретательским уровнем заявленного способа является оценка клеток с привлечением флуоресцентной микроскопии в мазках буккального эпителия, окрашенных ализарином красным С, после чего вычисляется цитохимический коэффициент, который характеризует степень дифференцировки клеток.
Цель способа: выявить и количественно охарактеризовать особенности строения ядра и цитоплазмы клеток многослойного плоского неороговевающего эпителия полости рта.
Суть способа заключается в том, что с помощью флуоресцентной микроскопии оценивается степень включения ализаринового красного С в ядро и цитоплазму клеток буккального эпителия.
Способ осуществляется в 6 этапов:
1. Полоскание рта исследуемого лица дистиллированной водой. После чего исследуемый выплевывает воду.
2. С помощью медицинского шпателя делается соскоб со слизистой оболочки ротовой полости, после чего изготавливают два мазка буккального эпителия на предметном стекле.
3. Фиксация высушенного мазка буккального эпителия производится 96%-ным этиловым спиртом в течение 10 минут. Мазки после фиксации делятся на две части: А. Мазки без обработки и Б. мазки с обработкой нейтральным 5% раствором ЭДТА (этилендиаминтетрауксусная кислота).
4. Окрашивание мазка производят в 5%-ном спиртовом р-ре ализарина красного С в течение 10 минут. Для удаления воды производится промокание краев мазка фильтровальной бумагой. Последующее отмывание мазка осуществляется в дистиллированной воде на протяжении 30 секунд в нескольких сменах. Высушивание мазков производится на открытом воздухе в темном помещении.
5. Флуоресцентная микроскопия окрашенных мазков производится под иммерсионном объективом ×100, окулярами ×10 в отраженном свете. Неокрашенные клетки просматриваются при возбуждении флуоресценции длиной волны от 340-400 нм с эмиссией флуоресценции в диапазоне 400-580 нм. Окрашенные ализарином мазки просматриваются при возбуждении флуоресценции при длине волны от 430-520 нм с эмиссией флуоресценции в диапазоне 580-680 нм.
6. Количественную оценку проводят путем подсчета клеток с распределением соответственно содержанию в них красителя и распределением баллов. Всего изучается 100 клеток. Рассчитывают средний цитохимический коэффициент - СЦК по формуле:
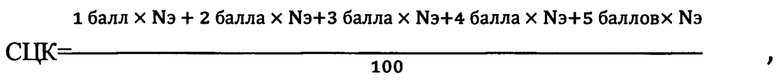
где:
Nэ - количество эпителиоцитов;
1 балл - не флуоресцирующие в диапазоне 580-680 нм, не окрашенные ализарином клетки.
2 балла - слабо флуоресцирующие по периферии цитоплазмы клетки в диапазоне 580-680 нм, 90% площади ядра и перинуклеарная зоны, флуоресцирует в диапазоне 400-580 нм.
3 балла - ядро флуоресцирует в диапазоне 400-580 нм, окрашенные ализарином цитоплазматические структуры, флуоресцируют в диапазоне 580-680 нм.
4 балла - ядро и внутриклеточные цитоплазматические структуры окрашенные ализарином, флуоресцируют в диапазоне 580-680 нм.
5 баллов - ядро и цитоплазма интенсивно флуоресцируют, в диапазоне 580-680 нм.
Пример исследования.
Объектом исследования служили 43 работника испытательного лабораторного центра учреждения Роспотребнадзора, осуществляющих профессиональную деятельность во вредных условиях труда 3 класса 1-3 степени (в соответствии с Р 2.2.2006-05 «Руководство по гигиенической оценке факторов рабочей среды и трудового процесса. Критерии и классификация условий труда»). Возраст обследуемых - 22-65 лет. Мы дважды исследовали слизистую оболочку полости рта у 43 обследуемых: 1 этап - до приема продукта переработки бурых морских водорослей, 2 этап - после приема продукта переработки бурых морских водорослей. В качестве продукта переработки применялся специализированный продукт «Ламиналь (биогель из морской капусты)» [6. Аминина Н.М. Лечебно-профилактический продукт «Ламиналь - биогель из морских водорослей». Владивосток: Тинро-Центр, 2006. 34 с.] (Свидетельство о государственной регистрации №RU. 77.99.88.004.E.005810.04.15). Прием биогеля по 30 грамм осуществлялся в профилактических целях до начала трудовой смены за 30 минут до приема пищи. Продолжительность эксперимента составила четыре рабочих недели. Буккальный эпителий забирался шпателем с последующим переносом на предметное стекло и высушиванием на открытом воздухе в течение 10 минут с последующей фиксацией 96%-ным этиловым спиртом. В цитологических мазках исследовалось по 100 клеток до и после приема биогеля. Клеточный профиль буккального эпителия изучали с помощью заявленного способа. Для флуоресцентной микроскопии использовали микроскоп фирмы Карл Цейс - Axio Scope.А1. Результаты исследования представлены в таблице №1.
После флуоресцентного изучения состояния клеток производится отмывание мазка от ализарина красного в растворе дистиллированной воды. Затем мазки окрашиваются по Романовскому-Гимза, после чего определяется индекс созревания клеток буккального эпителия, а именно, соотношение парабазальных /промежуточных/ поверхностных клеток/роговых чешуек, выраженное в процентах, также оценивается степень дифференцировки и полнота созревания эпителия (табл. 2).
4. Таким образом, заявленный способ существенно уточняет известные способы исследования буккального эпителия [1, 2]. Техническим результатом заявленного способа является оценка положительного воздействия продукта переработки бурых морских водорослей на ротовую полость человека.
Технический результат: с помощью заявленного способа можно установить максимальную эффективную продолжительность времени, необходимого для приема продукта переработки бурых морских водорослей. Прием продукта переработки бурых морских водорослей в дозе 30 грамм, в течение 4 рабочих недель, приводит к стабилизации клеточных маркеров структурного гомеостаза полости рта. Отмечается отсутствие цитотоксических эффекта специализированного продукта, применяемого в комплексе профилактических мер для снижения негативного влияния вредных производственных факторов на эпителий ротовой полости персонала испытательного лабораторного центра. 
Источники информации
1. Быков В.Л., Гистология и эмбриология органов полости рта человека. Учебное пособие. Издание второе, исправленное, 1998. 2-е изд. СПб.: Специальная литература, 1998. 248 с.
2. Зиновьев С.В., Романцова Е.Б., Целуйко С.С. Цитохимическая характеристика орального секрета у школьниц // Российский вестник перинатологии и педиатрии. 2016. Т. 61. №4. С. 266-267.
3. Горностаев Л.М., Арнольд Е.В., Лаврикова Т.И., Руковец Т.А., Талдыкина Д.С, Халявина Ю.Г., Штиль А.А. Полициклические хиноидные соединения в качестве противоопухолевых препаратов // Сибирское медицинское обозрение. 2017. Т. 6. С. 21-31.
4. Mishra S.R., P. Nandhakumar, Yadav К.Р., et all. In vitro analysis of alizarin as novel therapeutic agent for murine breast cancer // The Pharma Innovation Journal 2017; 6(10): 345-350.
5. Ye M.Y., Yao G.Y., Pan Y.M., Liao Z.X., Zhang Y., Wang H.S. Synthesis and antitumor activities of novel α-aminophosphonate derivatives containing an alizarin moiety // Guiyang Yao, Weilong Dai, Synthesis and antitumor properties of novel alizarin analogs // Eur. J. Med. Chem. 2014. 23. 12. P. 5031-504.
6. Аминина H.M. Лечебно-профилактический продукт «Ламиналь - биогель из морских водорослей». Владивосток: Тинро-Центр, 2006. 34 с.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ флуоресцентной цитохимической оценки содержания биогенных аминов в эритроцитах | 2018 |
|
RU2709212C1 |
| Способ количественной цитохимической оценки хромаффинной реакции эритроцитов крыс при общем охлаждении организма | 2016 |
|
RU2617201C1 |
| Способ определения окислительного потенциала клеток с применением бихроматометрии | 2022 |
|
RU2798290C1 |
| СПОСОБ ФОРМИРОВАНИЯ ГРУППЫ РИСКА НЕОПЛАСТИЧЕСКИХ НАРУШЕНИЙ В ЭПИТЕЛИИ ШЕЙКИ МАТКИ | 2010 |
|
RU2437096C1 |
| СПОСОБ ДИФФЕРЕНЦИАЛЬНОЙ ДИАГНОСТИКИ КРАСНОГО ПЛОСКОГО ЛИШАЯ СЛИЗИСТОЙ ОБОЛОЧКИ РТА | 2022 |
|
RU2789238C1 |
| Способ исследования препарата ротовой жидкости | 2023 |
|
RU2832060C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ АКТИВНОСТИ ЩЕЛОЧНОЙ ФОСФАТАЗЫ В МАЗКАХ КРОВИ КРУПНОГО РОГАТОГО СКОТА И ПТИЦ | 2000 |
|
RU2212843C2 |
| СПОСОБ ДИАГНОСТИКИ СТЕПЕНИ ЗЛОКАЧЕСТВЕННОГО РАКА ЩИТОВИДНОЙ ЖЕЛЕЗЫ | 2011 |
|
RU2485517C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ СОСТОЯНИЯ СЛИЗИСТОЙ ОБОЛОЧКИ ПОЛОСТИ РТА | 2001 |
|
RU2210770C2 |
| Способ определения полового сношения | 1990 |
|
SU1772750A1 |
Изобретение относится к медицине, а именно к гигиене, клинико-лабораторной диагностике, цитологии, и может быть использовано для исследования клеток эпителия полости рта у работников, подвергающихся воздействию вредных факторов рабочей среды и трудового процесса. Проводят изготовление мазков буккального эпителия, окрашивание мазков ализарином красным С, проведение флуоресцентной микроскопии мазков. Далее осуществляют количественную оценку строения клеток в мазках путем вычисления цитохимического коэффициента флуоресценции, количественно выражающего особенности строения ядра и цитоплазмы, а также степень дифференцировки клеток и вычисляемого путем подсчета клеток с распределением соответственно содержанию в них красителя ализарина красного С. Всего изучают 100 клеток. Рассчитывают средний цитохимический коэффициент - СЦК по формуле:
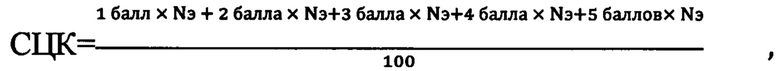
где Nэ - количество эпителиоцитов. 1 балл - не флуоресцирующие в диапазоне 580-680 нм, не окрашенные ализарином клетки; 2 балла - слабо флуоресцирующие по периферии цитоплазмы клетки в диапазоне 580-680 нм, 90% площади ядра и перинуклеарная зона, флуоресцирует в диапазоне 400-580 нм; 3 балла - ядро флуоресцирует в диапазоне 400-580 нм, окрашенные ализарином цитоплазматические структуры, флуоресцируют в диапазоне 580-680 нм; 4 балла - ядро и внутриклеточные цитоплазматические структуры, окрашенные ализарином, флуоресцируют в диапазоне 580-680 нм; 5 баллов - ядро и цитоплазма интенсивно флуоресцируют в диапазоне 580-680 нм. Способ обеспечивает возможность выявления цитохимических особенностей кальций-зависимого механизма регулирования дифференцировки буккального эпителия, за счет объективной оценки состояния клеток при просмотре под оптическим микроскопом окрашенных мазков, а также возможности с помощью флуоресцентной микроскопии сделать оценку ДНК-интеркалирующих свойств ализарина красного С, который окрашивает ядра клеток буккального эпителия, что обеспечивает обоснование мер профилактики, одним из элементов которого является применение специализированных пищевых продуктов, обладающих протекторными свойствами и повышающих общую сопротивляемость организма. 2 табл., 1 пр.
Способ исследования клеток эпителия полости рта у работников, подвергающихся воздействию вредных факторов рабочей среды и трудового процесса, включающий изготовление мазков буккального эпителия, окрашивание мазков ализарином красным С, проведение флуоресцентной микроскопии мазков; далее осуществляют количественную оценку строения клеток в мазках путем вычисления цитохимического коэффициента флуоресценции, количественно выражающего особенности строения ядра и цитоплазмы, а также степень дифференцировки клеток и вычисляемого путем подсчета клеток с распределением соответственно содержанию в них красителя ализарина красного С; всего изучают 100 клеток, рассчитывают средний цитохимический коэффициент - СЦК по формуле:
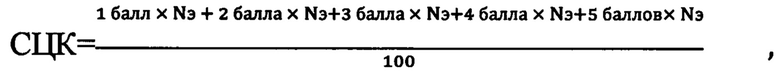
где:
Nэ - количество эпителиоцитов;
1 балл - не флуоресцирующие в диапазоне 580-680 нм, не окрашенные ализарином клетки;
2 балла - слабо флуоресцирующие по периферии цитоплазмы клетки в диапазоне 580-680 нм, 90% площади ядра и перинуклеарная зона, флуоресцирует в диапазоне 400-580 нм;
3 балла - ядро флуоресцирует в диапазоне 400-580 нм, окрашенные ализарином цитоплазматические структуры флуоресцируют в диапазоне 580-680 нм;
4 балла - ядро и внутриклеточные цитоплазматические структуры, окрашенные ализарином, флуоресцируют в диапазоне 580-680 нм;
5 баллов - ядро и цитоплазма интенсивно флуоресцируют в диапазоне 580-680 нм.
| CN 109342381 A, 15.02.2019 | |||
| Антибуксовочное устройство В.Г. Вохмянина для транспортных средств и самоходных машин колёсного типа | 2017 |
|
RU2641954C1 |
| WO 2016064353 A1, 28.04.2016 | |||
| JP 2012500860 A, 12.01.2012 | |||
| ЗИНОВЬЕВ С.В | |||
| и др | |||
| Цитохимическая характеристика орального секрета у школьниц | |||
| Российский вестник перинатологии и педиатрии | |||
| Токарный резец | 1924 |
|
SU2016A1 |
| КАРНАУХОВ В.Н | |||
| Люминесцентный анализ клеток | |||
| Изд-во "Аналитическая микроскопия" | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
Авторы
Даты
2020-06-30—Публикация
2019-05-27—Подача