Область техники
Изобретение относится к биотехнологии, иммунологии и вирусологии. Предложенное средство может применяться для профилактики ближневосточного респираторного синдрома.
Предшествующий уровень техники.
Ближневосточный респираторный синдром (БВРС) - острое воспалительное заболевание дыхательной системы, возбудителем которого является коронавирус ближневосточного респираторного синдрома (БВРС-КоВ). Основным источником заражения людей БВРС-КоВ (а также природным резервуаром) являются верблюды. Нейтрализующие антитела к БВРС-КоВ были найдены у верблюдов в Омане, на Канарских островах и в Египте. Несмотря на то, что верблюды играют важную роль в передаче вируса от животных к человеку, механизм передачи изучен неполностью. Помимо верблюдов, были обнаружены ежи и летучие мыши, инфицированные коронавирусами, филогенетически-близкими к БВРС-КоВ в Европе, Тайланде, Южной Африке и Китае. Анализ 144 лабораторно-подтвержденных случаев (из 9 разных стран мира) и 17 возможных случаев инфицирования (Иордан, Италия и др.) вирусом БВРС-КоВ показал, что большая часть (59%) была вызвана передачей вируса от человека к человеку. При этом чаще всего заражение происходило при тесном контакте между людьми в медицинских центрах (63.2%) и среди членов семьи (13.7%) (The WHO MERS-CoV Research Group, State of Knowledge and Data Gaps of Middle East Respiratory Syndrome Coronavirus (MERS-CoV) in Humans, PLOS Currents Outbreaks, 2013, №12-1).
Первый случай заболевания человека БВРС-КоВ был диагностирован в Саудовской Аравии в 2012 году. Согласно информации, предоставляемой ВОЗ, в настоящее время случаи заболевания зафиксированы в 27 странах (Алжир, Австрия, Бахрейн, Китай, Египет, Франция, Германия и др.), из них большинство (82%) - в Саудовской Аравии. Последняя крупная вспышка за пределами Саудовской Аравии произошла в Южной Корее с мая по июль 2015 года, когда из 186 случаев инфицирования БВРС-КоВ погибло 36 человек (Lee S.S., Wong N.S., Probable transmission chains of Middle East respiratory syndrome coronavirus and the multiple generations of secondary infection in South Korea. International Journal of Infectious Diseases, 2015, №38, 65-67). Распространение инфекции БВРС-КоВ вызывает особую обеспокоенность во всем мире не только из-за сходства с тяжелым острым респираторным синдромом (ТОРС), который охватил Китай и быстро распространился почти на 30 стран в 2002-2003 гг., став причиной смерти около 800 человек (V. Kumar, Y.S. Jung, Р.Н. Liang, Anti-SARS coronavirus agents: a patent review (2008 - present), Expert Opinion on Therapeutic Patents, 2013, №23, 1337-1348). Подобно ТОРС, в большинстве случаев БВРС проявляется как заболевание нижних дыхательных путей с лихорадкой, кашлем, затруднениями дыхания и пневмонией, которые могут прогрессировать до острого респираторного синдрома и полиорганной недостаточности. С меньшей вероятностью болезнь может протекать с легкими гриппоподобными заболеваниями, а в еще более редких случаях - бессимптомно. На сегодняшний день по данным ВОЗ зарегистрировано 2229 клинически подтвержденных случаев инфекции БВРС-КоВ и 791 случай летального исхода, связанных с заражением БВРС-КоВ, таким образом, летальность составляет около 35,5%.
Высокий процент смертности, быстрое географическое распространение БВРС-КоВ и нечетко определенная этиология заболевания создали острую необходимость в создании эффективных средств профилактики и лечения БВРС. Относительно средств терапии, комбинация рибавирина и интерферона-α2b показала хорошие результаты при лечении инфицированных БВРС-КоВ макак-резус. У макак-резус, лечение которых начиналось через 8 часов после инфицирования не наблюдалось дыхательных аномалий и признаков пневмонии. Более того, у опытной группы макак-резус детектировали более низкий уровень системных и местных воспалительных маркеров, а также меньшее число копий генома БВРС-КоВ и менее тяжелыми гистопатологическими изменениями в легких. Однако данное лечение начинали спустя совсем небольшой промежуток времени после инфицирования БВРС-КоВ, а также предложенная комбинация оказалась непригодной для человека (D. Falzarano, Е. de Wit, A.L. Rasmussen, F. Feldmann, A. Okumura, D.P. Scott, D. Brining, T. Bushmaker, C. Martellaro, L. Baseler, A.G Benecke, M.G. Katze, V.J. Munster, H. Feldmann, Treatment with interferon-α2b and ribavirin improves outcome in MERS-CoV-infected rhesus macaques, Nature Medicine, 2013, №19(10), 1313-1317).
На данный момент не существует ни одной зарегистрированной вакцины против БВРС. В отличие от эпидемии, вызванной коронавирусом тяжелого острого респираторного синдрома (ТОРС-КоВ), прекратившейся относительно быстро, поскольку резервуар инфекции был определен и изолирован, БВРС-КоВ персистирует в популяции уже на протяжении 5 лет. На сегодняшний день ВОЗ ожидает поступления новых сообщений о случаях БВРС-КоВ из стран Ближнего Востока. Также ожидается завоз БВРС-КоВ в другие страны лицами, зараженными в результате контакта с животными (например, верблюдами) или продуктами животного происхождения.
Тем не менее, за прошедшие годы было предпринято немало усилий по созданию различных вакцин и средств терапии от коронавирусных инфекций, поскольку симптомы заболевания БВРС-КоВ сходны с симптомами при атипичной пневмонии, вызванной ТОРС-КоВ. Более того, поскольку оба коронавируса преодолели межвидовой барьер и инфицируют людей, БВРС-КоВ считается потенциальной угрозой, способной, как и ТОРС-КоВ, вызвать пандемию. В разработке вакцин от ТОРС-КоВ использовали несколько подходов: была создана живая бактериальная вакцина (решение по патенту RU 2332457), в составе которой есть антиген ТОРС-КоВ, заякоренный на поверхности клетки с помощью синтетазы поли-гамма-глутаминовой кислоты. В другом случае для лечения ТОРС используют фармацевтическую композицию (патент RU 2411042), включающую в себя терапевтически эффективное количество рекомбинатного рецептора фактора некроза опухолей-α (TNF-α) или талидомида в фармацевтически пригодном носителе. И существует также решение согласно патенту RU 2263144, включающее в себя специальный штамм СоД вируса ТОРС, предназначенный для разработки средств и методов биологической защиты.
Известно техническое решение по патенту US 9555094 В2 от 31.01.2017, в котором предложены два варианта аминокислотных последовательностей полного белка S БВРС-КоВ. В связи с тем, что авторы патента US 9555094 В2 подали заявку 23.07.2013, они не могли использовать современные штаммы БВРС-КоВ.
Известно решение, где в качестве кандидатной вакцины использовали рекомбинантный модифицированный вирус осповакцины Анкара, способный экспрессировать полноразмерный поверхностный белок S БВРС-КоВ. Было показано присутствие специфичных антител в сыворотке крови проиммунизированных животных (1:8000-1:16000 для введенных доз 107 и 108 БОЕ (бляшкообразующая единица)), однако бустирование в дозе 106 БОЕ показало значительно более высокие титры (1:64000-1:128000). Так же было показано формирование клеточного иммунного ответа на эпитопы S291 и S823 целевого антигена S БВРС-КоВ. У животных, иммунизированных дозой 108 БОЕ, был показан уровень CD8+ в 3 раза выше, чем у животных, иммунизированных дозами 106 и 107 БОЕ (A. Volz et al., Protective efficacy of recombinant Modified Vaccinia virus Ankara (MVA) delivering 2 Middle East Respiratory Syndrome coronavirus spike glycoprotein, Virology, 2015, №89(16), 8651-8656).
Известно техническое решение, в котором предложена кандидатная вакцина на основе химерного вируса везикулярного стоматита, в котором ген G белка заменен на ген полноразмерного S БВРС-КоВ. Было показано присутствие специфичных IgG в сыворотке крови мышей Balb/c после однократной внутримышечной или интраназальной иммунизации (на 14-й день, 13 мкг/мл) и после бустирования (через 21 день, 20 мкг/мл). Также было показано наличие специфических антител в сыворотке крови макак-резус после однократной внутримышечной или интраназальной иммунизации. Кроме этого, были детектированы вирус-нейтрализующие антитела в сыворотке крови макак-резус, причем титр антител был достоверно выше в группе с внутримышечной иммунизацией (R. Liu et. al., A recombinant VSV-vectored MERS-CoV vaccine induces neutralizing antibody and T cell responses in rhesus monkeys after single dose immunization, Antiviral Research, 2018, №150, 30-38).
Известно техническое решение, в котором предложены два варианта кандидатной вакцины против ближневосточного респираторного синдрома, основанных на рекомбинантных аденовирусных векторах 5 и 41 серотипов, экспрессирующих полноразмерный поверхностный белок S БВРС-КоВ. Полученные препараты способны индуцировать формирование гуморального и клеточного иммунного ответа на целевой антиген S БВРС-КоВ у мышей линии BALB/c при введении препарата как внутримышечно (i.m.), так и внутрибрюшинно (i.g.). При этом, при исследовании гуморального иммунного ответа наиболее высокие титры антител в сыворотке крови испытуемых животных был в ответ на препарат Ad5-S при введении i.m. (~1:10000). Аналогично, наиболее сильный клеточный иммунный ответ был на препарат Ad5-S (i.m.), для этого был проведен цитометрический анализ для определения in vitro выработки цитокинов (интерферона гамма, TNF-α, интерлейкина-2 и интерлейкина-10) в предварительно полученных спленоцитах испытуемых животных. Опытные значения для препарата Ad5-S (i.m.) составили: С(интерферона гамма)~90 пкг/мл, C(TNF-α)~37 пкг/мл, С(IL-2)~23 пкг/мл, С(IL-10)~4 пк/мл; в то время, как значения для Ad41-S i.m оказались в 2-3 раза меньше, а в группах с i.g. введением были примерно равны нулю (X. Guo et al., Systemic and mucosal immunity in mice elicited by a single immunization with human adenovirus type 5 or 41 vector-based vaccines carrying the spike protein of Middle East respiratory syndrome coronavirus, Immunology, 2015, №145(4), 476-484).
Существует также техническое решение, согласно которому в качестве вариантов кандидатной вакцины были предложены рекомбинантные аденовирусные векторы 5 серотипа, экспрессирующие полноразмерный поверхностный белок S БВРС-КоВ (вариант 1) или экспрессирующие субъединицу S1 поверхностного белка S БВРС-КоВ (вариант 2). После двукратной иммунизации (праймирование - внутримышечно; бустирование - интраназально), было показано наличие вирус-нейтрализующих антител к БВРС-КоВ в сыворотке испытуемых животных после введения как варианта 1 (титр составил ~1:1024), так и варианта 2 (титр составил ~1:2048). Также была показана их нейтрализующая активность в условиях in vitro, при этом наиболее сильная нейтрализующая активность была показана для Ad5-MERS-S1, экспрессирующим секретируемый белок S1 (Е. Kima et al., Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice, Vaccine, 2014, №32, 5975-5982).
Техническое решение согласно статье (Е. Kima et al., Immunogenicity of an adenoviral-based Middle East Respiratory Syndrome coronavirus vaccine in BALB/c mice, Vaccine, 2014, №32, 5975-5982) как наиболее близкое к заявляемому по составу действующего вещества и способу его использования выбраны авторами заявляемого изобретения за прототип. Существенным недостатком данного технического решения является использование белков с консенсусной последовательностью со сходимостью со штаммами не позднее 2014 года. Также, в данном техническом решении не представлены данные о формировании клеточного иммунного ответа при введении антигена, что является существенной характеристикой кандидатной вакцины.
Раскрытие настоящего изобретения.
Задачей каждого из вариантов изобретения является создание иммунобиологического средства для эффективной индукции иммунного ответа к БВРС-КоВ.
Разработано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S вируса БВРС на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с последовательностью SEQ ID NO: 1 (вариант 1). Также разработано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S вируса БВРС на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с трансмембранным доменом гликопротеина вируса везикулярного стоматита с последовательностью SEQ ID NO: 2 (вариант 2). Также разработано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с последовательностью лидерного пептида с последовательностью SEQ ID NO: 3 (вариант 3). Также разработано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с трансмембранным доменом гликопротеина вируса везикулярного стоматита с последовательностью SEQ ID NO: 4 (вариант 4). Также разработано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 с последовательностью SEQ ID NO: 5 (вариант 5).
Способ использования иммунобиологического средства по вариантам 1, или 2, или 3, или 4, или 5 заключается во введении в организм млекопитающих этого средства в эффективном количестве для индукции специфического иммунитета к БВРС-КоВ.
При этом способ использования иммунобиологического средства заключается в последовательном введении в организм млекопитающих двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа или двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ. Также разработан способ использования иммунобиологического средства, заключающийся в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ, или в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ. Также разработан способ использования иммунобиологического средства, заключающийся в одновременном введении в организм млекопитающих любых двух иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа для индукции специфического иммунитета к БВРС-КоВ.
Краткое описание чертежей
На фиг. 1 представлены результаты изучения экспрессии различных вариантов гена гликопротеина S вируса БВРС-КоВ в клетках линии HEK293 в составе рекомбинантных аденовирусов Ad5-S, Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc методом иммуноблоттинга.
1 - лизат клеток, к которым добавляли Ad5-S;
2 - лизат клеток, к которым добавляли Ad5-S-G;
3 - среда от клеток, к которым добавляли Ad5-RBD;
4 - среда от клеток, к которым добавляли Ad5-RBD-Fc;
5 - лизат клеток, к которым добавляли Ad5-RBD-G;
6 - лизат клеток, к которым добавляли Ad-null;
7 - лизат клеток, к которым добавляли фосфатно-солевой буфер.
На фиг. 2 представлены результаты изучения экспрессии различных вариантов гена гликопротеина S вируса БВРС-КоВ в клетках линии HEK293 в составе рекомбинантных аденовирусов pAd26-S, pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc методом иммуноблоттинга.
1 - лизат клеток, к которым добавляли Ad26-S;
2 - лизат клеток, к которым добавляли Ad26-S-G;
3 - среда от клеток, к которым добавляли Ad26-RBD;
4 - среда от клеток, к которым добавляли Ad26-RBD-Fc;
5 - лизат клеток, к которым добавляли Ad26-RBD-G;
6 - лизат клеток, к которым добавляли Ad-null;
7 - лизат клеток, к которым добавляли фосфатно-солевой буфер.
На фиг. 3 представлены результаты оценки эффективности иммунизации разработанным иммунологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, RBD, S-G, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 по оценке доли пролиферирующих CD4+ лимфоцитов, рестимулированных гликопротеином S БВРС-КоВ, на 8 день после иммунизации испытуемых животных.
Ось ординат - количество пролиферирующих клеток, %
Ось абсцисс - различные группы животных:
1) фосфатный буфер (100 мкл) - интактные животные
2) Ad5-S 108БОЕ/мышь
3) Ad5-RBD 108БОЕ/мышь
4) Ad5-S-G 108БОЕ/мышь
5) Ad5-RBD-G 108БОЕ/мышь
6) Ad5-RBD-Fc 108БОЕ/мышь.
На фиг. 4 представлены результаты оценки эффективности иммунизации разработанным иммунологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, RBD, S-G, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 по оценке доли пролиферирующих CD4+ лимфоцитов, рестимулированных гликопротеином S БВРС-КоВ, на 15 день после иммунизации испытуемых животных.
Ось ординат - количество пролиферирующих клеток, %
Ось абсцисс - различные группы животных:
1) фосфатный буфер (100 мкл) - интактные животные
3) Ad5-S 108БОЕ/мышь
4) Ad5-RBD 108БОЕ/мышь
5) Ad5-S-G 108БОЕ/мышь
6) Ad5-RBD-G 108БОЕ/мышь
7) Ad5-RBD-Fc 108БОЕ/мышь.
На фиг. 5 представлены результаты оценки эффективности иммунизации разработанным иммунологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, RBD, S-G, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 по оценке доли пролиферирующих CD8+ лимфоцитов, рестимулированных гликопротеином S БВРС-КоВ, на 8 день после иммунизации испытуемых животных.
Ось ординат - количество пролиферирующих клеток, %
Ось абсцисс - различные группы животных:
1) фосфатный буфер (100 мкл) - интактные животные
3) Ad5-S 108БОЕ/мышь
4) Ad5-RBD 108БОЕ/мышь
5) Ad5-S-G 108БОЕ/мышь
6) Ad5-RBD-G 108БОЕ/мышь
7) Ad5-RBD-Fc 108БОЕ/мышь.
На фиг. 6 представлены результаты оценки эффективности иммунизации разработанным иммунологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, RBD, S-G, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 по оценке доли пролиферирующих CD8+ лимфоцитов, рестимулированных гликопротеином S БВРС-КоВ, на 15 день после иммунизации испытуемых животных.
Ось ординат - количество пролиферирующих клеток, %
Ось абсцисс - различные группы животных:
1) фосфатный буфер (100 мкл) - интактные животные
3) Ad5-S 108БОЕ/мышь
4) Ad5-RBD 108БОЕ/мышь
5) Ad5-S-G 108БОЕ/мышь
6) Ad5-RBD-G 108БОЕ/мышь
7) Ad5-RBD-Fc 108БОЕ/мышь.
На фиг. 7 представлены результаты оценки эффективности разработанного иммунобиологического средства на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) вируса БВРС с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 по оценке прироста концентрации ИФН-гамма в среде после стимуляции спленоцитов иммунизированных аденовирусными конструкциями мышей линии C57/BL6 рекомбинантным полноразмерным белком S вируса БВРС-КоВ.
Ось ординат - значения прироста концентрации ИФН-гамма в среде стимулированных клеток при сравнении с интактными клетками (разы).
Ось абсцисс - исследуемые группы животных: интактные животные и животные, которым вводили по 108БОЕ/мышь Ad5-RBD, Ad5-S, Ad5-RBD-G, Ad5-S-G или Ad5-RBD-Fc.
Реализация изобретения.
Одной из самых перспективных конструкций для создания кандидатной вакцины для профилактики БВРС является рецептор-связывающий домен (RBD) белка S с Fc-фрагментом от человеческого IgG1 (Fc). Неоднократно была показана высокая иммуногенность рекомбинантного белка RBD-Fc посредством изучения индукции клеточного и гуморального иммунных ответов на лабораторных животных (L. Du et al., Identification of a Receptor-Binding Domain in the S Protein of the Novel Human Coronavirus Middle East Respiratory Syndrome Coronavirus as an Essential Target for Vaccine Development,Virology, 2013, №87(17), 9939-9942.; (L. Du et al., A Truncated Receptor-Binding Domain of MERS-CoV Spike Protein Potently Inhibits MERS-CoV Infection and Induces Strong Neutralizing Antibody Responses: Implication for Developing Therapeutics and Vaccines, PLoS One, 2013, №8(12), e81587; C. Ma et al., Intranasal vaccination with recombinant receptor-binding domain of MERS-CoV spike protein induces much stronger local mucosal immune responses than subcutaneous immunization: Implication for designing novel mucosal MERS vaccines, Vaccine, 2014, №32(18), 2100-2108; C. Ma et al., Searching for an ideal vaccine candidate among different MERS coronavirus receptor-binding fragments - the importance of immunofocusing in subunit vaccine design, Vaccine, 2014, №32(46), 6170-6176). Однако у данной конструкции есть ряд недостатков, главным из которых является недостаточное число эпитопов, что может послужить причиной слабой протективности данной конструкции в отношении БВРС-КоВ. Вследствие вышесказанного, рационально также использовать полноразмерный белок S БВРС-КоВ для наибольшей протективности антигена, входящего в состав кандидатной вакцины (K. Modjarrad, MERS-CoV vaccine candidates in development: The current landscape, Vaccine, 2016, №34(26), 2982-2987). Для достижения максимально эффективной индукции иммунных реакций, авторы предложили различные варианты модификаций данного антигена, а также возможность его комбинации с трансмембранным доменом гликопротеина вируса везикулярного стоматита для повышения уровня экспрессии целевого белка.
Было получено 5 различных вариантов нуклеотидных последовательностей (модифицированного гена S БВРС-КоВ либо рецептор-связывающего домена белка S) путем оптимизации данных последовательностей под экспрессию в клетках млекопитающих.
Далее было разработано несколько конструкций на основе рекомбинантных аденовирусов человека 5-го и 26-го серотипов для эффективной доставки модифицированных генов в клетки млекопитающих. Среди генетических вакцин, проходящих клинические испытания по данным на ноябрь 2017 года на долю вакцин и терапевтических препаратов на основе рекомбинантных аденовирусов приходится большая часть используемых векторов - около 21% (The Journal pf Gene Medicine, Gene Therapy Clinical Trials Worldwide, 2017). Такой перевес генетических вакцин на основе аденовирусов связан с тем, что рекомбинантные аденовирусные векторы являются одними из наиболее безопасных для человека и вместе с тем эффективных векторов (K.R. Van Kampen et. al., Safety and immunogenicity of adenovirus-vectored nasal and epicutaneous influenza vaccines in humans. Vaccine, 2005, №23(8), 1029-1036).
Рекомбинантные аденовирусы обладают следующими преимуществами: не способны размножаться в клетках человека, способны проникать как в делящиеся, так и неделящиеся клетки, индуцируют как клеточный, так и гуморальный иммунный ответ, обеспечивают высокий уровень экспрессии целевого антигена. Введение аденовирусных векторов в организм возможно различными способами: интраназально, перорально, внутрибрюшинно, внутривенно, внутримышечно, подкожно. В подавляющем большинстве исследований, проведенных на животных моделях, рекомбинантные аденовирусы вводились в виде суспензии в физиологическом растворе (A.P.D. Souza et. al., Recombinant viruses as vaccines against viral diseases, Brazilian Journal of Medical and Biological Research, 2005, №38, 509-522).
Рекомбинантные аденовирусные векторы достаточно стабильны в суспензии, также, они могут быть лиофилизированы, и в таком состоянии не требуют заморозки, что облегчает транспортировку и хранение препаратов, особенно в развивающихся странах (A.P.D. Souza et. al., Recombinant viruses as vaccines against viral diseases, Brazilian Journal of Medical and Biological Research, 2005, №38, 509-522). Из ряда известных аденовирусов, наиболее исследованными являются аденовирусы человека 5-го серотипа, поэтому они стали основой для создания векторов для генотерапии. Были разработаны технологии получения векторов первого и второго поколений, химерных векторов (содержащих белки вирусов других серотипов) (J.N. Glasgow et. al., An adenovirus vector with a chimeric fiber derived from canine adenovirus type 2 displays novel tropism, Virology, 2004, №324, 103-116) и ряда других векторов. Также, были созданы векторы, производные от других серотипов, например, 26-го (Н. Chen et. al., Adenovirus-Based Vaccines: Comparison of Vectors from Three Species of Adenoviridae, Virology, 2010, №84(20), 10522-10532).
Векторы на основе аденовируса человека 26-го серотипа показывают высокий уровень иммуногенности у приматов, где они способны индуцировать мощный CD8+ Т-клеточный ответ, качественно превосходящий Т-клеточный ответ при введении в организм векторов на основе аденовируса человека 5-го серотипа (J. Liu et. al., Magnitude and phenotype of cellular immune responses elicited by recombinant adenovirus vectors and heterologous prime-boost regimens in rhesus monkeys, Virology, 2008, №82, 4844-4852). При этом происходит распознавание большего числа эпитопов и индукция выработки более широкого спектра факторов, а не преимущественно интерферона гамма (J. Liu et. al., Magnitude and phenotype of cellular immune responses elicited by recombinant adenovirus vectors and heterologous prime-boost regimens in rhesus monkeys, Virology, 2008, №82, 4844-4852). Эти данные позволяют предполагать, что векторы на основе аденовируса человека 26-го серотипа обладают фундаментальными отличиями в способности индуцировать формирование иммунного ответа на целевой антиген относительно других аденовирусных векторов.
Для создания консенсусной аминокислотной последовательности белка S в настоящем патенте были использованы современные штаммы вируса БВРС 2015-2017, актуальные на настоящее время.
Изобретение по варианту 1 представляет собой рекомбинантный аденовирус человека 5-го серотипа, или рекомбинантный аденовирус человека 26-го серотипа, содержащий оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S БВРС-КоВ на основании последовательностей генов белка S современных штаммов БВРС-КоВ (2015-2017 гг.) (SEQ ID NO: 1).
Изобретение по варианту 2 представляет собой рекомбинантный аденовирус человека 5-го серотипа, или рекомбинантный аденовирус человека 26-го серотипа, содержащий оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S БВРС-КоВ на основании последовательностей генов белка S современных штаммов БВРС-КоВ (2015-2017 гг.) с трансмембранным доменом гликопротеина вируса везикулярного стоматита (SEQ ID NO: 2).
Изобретение по варианту 3 представляет собой рекомбинантный аденовирус человека 5-го серотипа, или рекомбинантный аденовирус человека 5-го серотипа, содержащий оптимизированную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов БВРС-КоВ (2015-2017 гг.) с последовательностью лидерного пептида (SEQ ID NO: 3).
Изобретение по варианту 4 представляет собой рекомбинантный аденовирус человека 5-го серотипа, или рекомбинантный аденовирус человека 26-го серотипа содержащий оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов БВРС-КоВ (2015-2017 гг.) с трансмембранным доменом гликопротеина вируса везикулярного стоматита (SEQ ID NO: 4).
Изобретение по варианту 5 представляет собой рекомбинантный аденовирус человека 5-го серотипа, или рекомбинантный аденовирус человека 26-го серотипа, содержащий оптимизированную последовательность рецептор-связывающего домена белка S на основании последовательностей генов белка S современных штаммов БВРС-КоВ (2015-2017 гг.) с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 (SEQ ID NO: 5).
Разработано несколько способов использования данных иммунобиологических средств. Способы использования, представленные далее в формуле изобретения по вариантам 1-5, предусматривают введение вышеописанных иммунобиологических средств по каждому из 5-ти вариантов в организм млекопитающих по отдельности в эффективном количестве для индукции специфического иммунитета к БВРС-КоВ.
Способ использования иммунобиологического средства по варианту 1, или варианту 2, или варианту 3, или варианту 4, или варианту 5, заключается во введении в организм млекопитающих этого средства в эффективном количестве для индукции специфического иммунитета к вирусу БВРС.
Способ использования иммунобиологического средства по вариантам 1-5 заключается в последовательном введении в организм млекопитающих любых двух иммунобиологических средств из вариантов 1-5 с интервалом более, чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
Особенностями способа использования созданных иммунобиологических средств является следующее:
Способ использования иммунобиологического средства по вариантам 1-5 заключается в последовательном введении в организм млекопитающих двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа или двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
Способ использования иммунобиологического средства по вариантам 1-5 заключается в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ, или в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа с интервалом более, чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ. Способ использования иммунобиологического средства по вариантам 1-5 заключается в одновременном введении в организм млекопитающих любых двух иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа для индукции специфического иммунитета к БВРС-КоВ.
Примеры.
Пример 1.
Создание консенсусной аминокислотной последовательности белка S, наиболее гомологичной для различных современных штаммов (2015-2017 гг.) БВРС-КоВ, выделенных от человека.
Наиболее иммуногенным и самым перспективным вакцинным антигеном среди всех белков БВРС-КоВ является белок S - тримерный, заякоривающийся гликопротеин типа I, взаимодействующий с родственным ему человеческим рецептором дипептидилпептидазой 4 (DPP4), опосредуя проникновение вируса. Белок S включает в себя две субьединицы: S1 (содержащую RBD и определяющую тропизм вируса) и S2 (отвечающую за слияние клеток).
В данном примере приведен способ создания консенсусной аминокислотной последовательности полноразмерного белка S, наиболее гомологичной для различных штаммов БВРС-КоВ, изолированных от человека за период с 2015 по 2017 гг.
Исходные аминокислотные последовательности полноразмерного белка S взяты из официального общедоступного источника NCBI, GenBank, США (www.ncbi.nlm.nih.gov). Был проведен анализ 179 последовательностей полноразмерного белка S от различных штаммов БВРС-КоВ, выделенных от человека. Работа с последовательностями осуществлялась с помощью компьютерных программ Geneious 10.0.9 и BLAST.
Сначала была выбрана консенсусная последовательность белка S. Данная последовательность была получена посредством выравнивания всех последовательностей полноразмерного белка S взятых из NCBI, GenBank относительно друг друга в программе Geneious 10.0.9. Всего было исследовано 179 последовательностей, 66 из них показали 100% гомологии, а остальные 113 имели 99% гомологии относительно выбранной консенсусной последовательности (SEQ ID N0:1), использована для варианта 1.
Поскольку верблюды являются резервуаром БВРС-КоВ и источником заражения людей, полученная консенсусная последовательность белка S SEQ ID NO: 1 была исследована на процент гомологии относительно консенсусной последовательности полноразмерного белка S штаммов БВРС-КоВ, выделенных от верблюдов и показала 100% гомологии с ней. Выравнивание проводилось в программе BLAST. Консенсусная последовательность полноразмерного белка S штаммов БВРС-КоВ, выделенных от верблюдов была выбрана посредством выравнивания всех последовательностей полноразмерного белка S штаммов БВРС-КоВ, изолированных от верблюдов. Последовательности были взяты из NCBI, GenBank и выровнены относительно друг друга в программе Geneious 10.0.9. Всего было исследовано 176 последовательностей белка штаммов БВРС-КоВ, изолированных от верблюдов, 64 из них показали 100% гомологии с консенсусной последовательностью, остальные 112 имели 99% гомологии относительно консенсусной последовательности белка S штаммов БВРС-КоВ, изолированных от верблюдов.
Пример 2.
Получение различных вариантов гликопротеина S БВРС-КоВ.
Для исследования иммуногенности различных форм белка S БВРС-КоВ - секретируемых и несекретируемых, последовательность SEQ ID NO: 1 была модифицирована несколькими способами:
1) Для заякоривания белка в мембране и таким образом получения несекретируемой формы полного белка S БВРС-КоВ, к последовательности SEQ ID NO: 1 была добавлена последовательность трансмембранного домена гликопротеина вируса везикулярного стоматита, таким образом, была создана последовательность SEQ ID NO: 2 использована для варианта 2.
2) Для исследования иммуногенности только рецептор-связывающего домена (RBD) белка S БВРС-КоВ в секретируемой форме, была создана последовательность SEQ ID NO: 3 (использована для варианта 3), содержащая последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида (добавлена для секреции белка). Согласно литературным данным, RBD связывается с рецептором дипептидилпептидаза 4 человека (hDPP4) и индуцирует выработку нейтрализующих антител в иммунизированных мышах (L. Du et al., Identification of a Receptor-Binding Domain in the S Protein of the Novel Human Coronavirus Middle East Respiratory Syndrome Coronavirus as an Essential Target for Vaccine Development,Virology, 2013, №87(17), 9939-9942). Последовательность RBD была выбрана из исследований Lanying Du et. al. (L. Du et al., A Truncated Receptor-Binding Domain of MERS-CoV Spike Protein Potently Inhibits MERS-CoV Infection and Induces Strong Neutralizing Antibody Responses: Implication for Developing Therapeutics and Vaccines, PLoS One, 2013, №8(12), e81587).
3) Для исследования RBD белка S БВРС-КоВ в несекретируемой форме, была выбрана последовательность SEQ ID NO: 4 (использована для варианта 4), состоящая из RBD белка S БВРС-КоВ, к которой была добавлена последовательность трансмембранного домена гликопротеина вируса везикулярного стоматита.
4) Для исследования секретируемой формы RBD белка S с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 была выбрана последовательность SEQ ID NO: 5 (использована для варианта 5). Добавление Fc-фрагмента от человеческого IgG1 усиливает иммуногенность за счет возможного связывания Fc фрагмента белка с Fc рецептором на антиген-презентирующих клетках (Z. Li et. al., Transfer of IgG in the female genital tract by MHC class I-related neonatal Fc receptor (FcRn) confers protective immunity to vaginal infection, Proceedings of the National Academy of Sciences USA, 2011, №108, 4388-4393), а также усилить стабильность белка и продлить период полужизни in vivo (M.Y. Zhang et. al., Crossreactive HIV-1-neutralizing activity of serum IgG from a rabbit immunized with gp41 fused to IgG1 Fc: Possible role of the prolonged half-life of the immunogen, Vaccine, 2008, №27, 857-63).
Пример 3.
Получение генетических конструкций, кодирующих ген белка S в различных вариантах.
В данном примере приведен способ создания генетических конструкций, кодирующих модифицированные варианты гена S.
Для создания конечных генетических конструкций, кодирующих полученные консенсусные последовательности белка S, указанные аминокислотные последовательности (SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5) были переведены в нуклеотидные. Далее была проведена оптимизация полученных последовательностей под экспрессию в клетках млекопитающих компанией ЗАО «Евроген» (Москва). Все нуклеотидные последовательности были получены методом синтеза компанией ЗАО «Евроген» (Москва). В итоге были получены следующие конструкции:
1) pVax-S, содержащая нуклеотидную последовательность полного гена S БВРС-КоВ;
2) pVax-S-G, содержащая нуклеотидную последовательность полного гена S БВРС-КоВ с геном G вируса везикулярного стоматита;
3) pAL2-T-RBD, содержащая нуклеотидную последовательность рецептор-связывающего домена белка S с последовательностью гена лидерного пептида;
4) pAL2-T-RBD-G, содержащая нуклеотидную последовательность рецептор-связывающего домена белка S с геном G вируса везикулярного стоматита;
5) pAL2-T-RBD-Fc, содержащая нуклеотидную последовательность рецептор-связывающего домена белка S с последовательностью гена лидерного пептида и нуклеотидной последовательностью Fc-фрагмента от человеческого IgG1.
После этого, при помощи стандартных методов генной инженерии последовательность гена белка S из конструкции pVax-S была клонирована с использованием эндонуклеазы рестрикции Xbal в челночную плазмиду pShuttle-CMV (StrataGen, США) и полученная плазмида была названа pShuttle-S. Таким образом, была создана челночная плазмида pShuttle-S, несущая оптимизированную под экспрессию в клетках млекопитающих нуклеотидную последовательность консенсусной аминокислотной последовательности S (SEQ ID NO: 1), полученной в примере 1.
Аналогично нуклеотидные последовательности модифицированных вариантов белка S БВРС-КоВ были клонированы в челночную плазмиду pShuttle-CMV (StrataGen, США) и были получены следующие челночные плазмиды:
- pShuttle-S-G (содержит оптимизированную нуклеотидную последовательность полного протективного антигена S БВРС-КоВ с трансмембранным доменом гликопротеина вируса везикулярного стоматита)
- pShuttle-RBD (содержит оптимизированную нуклеотидную последовательность рецептор-связывающего домена S БВРС-КоВ)
- pShuttle-RBD-G (содержит оптимизированную нуклеотидную последовательность рецептор-связывающего домена S БВРС-КоВ с трансмембранным доменом гликопротеина вируса везикулярного стоматита)
- pShuttle-RBD-Fc (содержит оптимизированную нуклеотидную последовательность рецептор-связывающего домена S БВРС-КоВ с оптимизированной последовательностью Fc-фрагмента от человеческого IgG1).
Пример 4.
Получение иммунобиологического средства на основе рекомбинантного аденовируса человека 5-го серотипа, содержащего:
1) оптимизированную нуклеотидную последовательность рецептор-связывающего домена S БВРС-КоВ (вариант 1);
2) оптимизированную нуклеотидную последовательность полного протективного антигена S БВРС-КоВ с трансмембранным доменом гликопротеина вируса везикулярного стоматита (вариант 2);
3) оптимизированную нуклеотидную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида (вариант 3),
4) оптимизированную нуклеотидную последовательность рецептор-связывающего домена белка S с трансмембранным доменом гликопротеина вируса везикулярного стоматита (вариант 4),
5) оптимизированную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 (вариант 5).
Получение рекомбинантной аденовирусной плазмиды pAd5-S, содержащей оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S БВРС-КоВ (SEQ ID NO: 1) (вариант 1) проходило методом гомологичной рекомбинации между плазмидой pAd-Easy (AdEasy™ Adenoviral Vector System, StrataGen, США), содержащей геномную часть аденовируса человека 5 серотипа с удаленной Е1 и Е3 областями, и челночной плазмидой pShuttle-S (полученной в примере 3), несущей гомологичные участки генома аденовируса и экспрессионную кассету с целевым геном (белка S). Для этого, полученная в примере 3 челночная плазмида pShuttle-S была линеаризована эндонуклеазой рестрикции Pmel.
Гомологичную рекомбинацию проводили в клетках Е. coli штамма BJ5183. Плазмиду Ad-Easy смешивали с плазмидой pShuttle-S, а затем полученной смесью трансформировали клетки E. coli методом электропорации согласно руководству «MicroPulser™ Electroporation Apparatus Operating Instructions and Applications Guide» (Bio-Rad, США). После трансформации клетки E. coli штамма BJ5183 высевали на чашки с LB-агаром, содержащим селективный антибиотик и подращивали в течение 18 часов при температуре +37°С. Эффективность трансформации составляла 1010-1011 трансформированных клонов на 1 мкг плазмиды pBluescript II SK(-).
В результате гомологичной рекомбинации в плазмиде pAd-Easy появлялась кассета с целевым трансгеном (белка S), и менялся ген устойчивости к антибиотику.
Таким образом, была сконструирована рекомбинантная аденовирусная плазмида pAd5-S, содержащая полноразмерный геном рекомбинантного аденовируса человека 5-го серотипа (с делетированными Е1 и Е3 областями генома) со встроенной генетической конструкцией, полученной в примере 3. Далее плазмиду pAd5-S гидролизовали эндонуклеазой рестрикции Рас I и трансфецировали ею пермессивную культуру клеток эмбриональной почки человека линии НЕК 293. Клетки линии НЕК 293 содержат в своем геноме встроенную область Е1 генома аденовируса человека 5-го серотипа, благодаря чему в них может происходить размножение рекомбинантных репликативно-дефектных аденовирусов человека 5-го серотипа. На шестой день после трансфекции проводили первые слепые пассажи для более эффективного получения рекомбинантного аденовируса. После наступления цитопатического действия вируса (данные микроскопирования), клетки с культуральной средой трехкратно перемораживали для разрушения клеток и выхода вируса. В результате был получен материал, который затем был использован для накопления препаративных количеств рекомбинантных аденовирусов.
Активность препарата pAd5-S здесь и далее оценивали стандартным методом титрования на культуре чувствительных клеток 293 HEK в реакциях бляшкообразования.
Для подтверждения создания конструкции предлагаемой рекомбинантной псевдоаденовирусной частицы на основе аденовируса человека 5 серотипа, экспрессирующей ген S БВРС-КоВ, проводили полимеразную цепную реакцию (ПЦР) по известной стандартной методике.
Аналогичным образом были получены еще четыре рекомбинантных аденовируса: Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc.
Пример 5.
Получение иммунобиологического средства на основе рекомбинантного аденовируса человека 26-го серотипа, содержащего:
1. оптимизированную нуклеотидную последовательность рецептор-связывающего домена S БВРС-КоВ (вариант 1);
2. оптимизированную нуклеотидную последовательность полного протективного антигена S БВРС-КоВ с трансмембранным доменом гликопротеина вируса везикулярного стоматита (вариант 2);
3. оптимизированную нуклеотидную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида (вариант 3),
4. оптимизированную нуклеотидную последовательность рецептор-связывающего домена белка S с трансмембранным доменом гликопротеина вируса везикулярного стоматита (вариант 4),
5. оптимизированную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 (вариант 5).
В рекомбинантный вектор pAd26-ORF6-Ad5 была помещена экспрессионная кассета с геном S БВРС-КоВ. Для этого вектор pAd26-ORF6-Ad5 был линеаризован с помощью эндонуклеазы рестрикции Pmel, а плазмидная конструкция pShuttle-S, полученная в примере 3 была обработана эндонуклеазами рестрикции Pmel. Продукты гидролиза лигировали, после чего при помощи стандартных методов была получена плазмида pAd26-S.
На следующем этапе, плазмиду pAd26-S гидролизовали эндонуклеазами рестрикции Pacl и Swal и трансфецировали ею пермессивную культуру клеток линии НЕК 293. На третий день после трансфекции проводили первые слепые пассажи для более эффективного получения рекомбинантного аденовируса. После наступления цитопатического действия вируса (данные микроскопирования), клетки с культуральной средой трехкратно перемораживали для разрушения клеток и выхода вируса. В результате был получен материал, который затем был использован для накопления препаративных количеств рекомбинантных аденовирусов. Активность препарата pAd26-S здесь и далее оценивали стандартным методом титрования на культуре клеток 293 HEK в реакции бляшкообразования.
Для подтверждения создания конструкции предлагаемой рекомбинантной псевдоаденовирусной частицы на основе рекомбинантного аденовируса человека 26-го серотипа, экспрессирующей ген S БВРС-КоВ, проводили полимеразную цепную реакцию (ПЦР) по известной стандартной методике.
Аналогичным образом были получены еще четыре рекомбинантных аденовируса: pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc.
Далее была показана способность сконструированных рекомбинантных аденовирусов экспрессировать различные варианты гена белка S в клетках.
Пример 6.
Проверка экспрессии различных вариантов гена гликопротеина S БВРС-КоВ в клетках линии HEK293 в составе рекомбинантных аденовирусов Ad5-S, Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc методом иммуноблоттинга.
Клетки НЕK293 культивировали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки в инкубаторе при температуре 37°С и 5% CO2. Клетки помещали на 35 мм2 культуральные чашки Петри и инкубировали в течение суток до достижения 70% конфлюэнтности. Далее к клеткам добавляли исследуемые препараты рекомбинантных аденовирусов (Ad5-S, Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc), контрольный препарат (Ad-null - рекомбинантый аденовирус, не содержащий вставок) из расчета 100 БОЕ/клетку и фосфатно-солевой буфер в качестве отрицательного контроля. Через сутки проверяли экспрессию антигенов БВРС-КоВ методом иммуноблотинга. Для этого среды с клеток были отобраны в отдельные пробирки для анализа секретируемых форм белка, а клетки были промыты стерильным фосфатно-солевым буфером, а затем лизированы с помощью лизирующего буфера «Cell Culture Lysis Reagent» (Promega, США), содержащего 25 мМ Tris-фосфат (рН 7.8), 2 мМ ДТТ, 2 мМ транс-1,2-диаминоциклогексан, 10% глицерин и 1% Triton® Х-100 для анализа трансмембранных белков.
После отбора сред и лизиса клеток производили измерение концентрации тотального белка в пробах с помощью реактива Bradford (Sigma) согласно инструкции производителя. Аликвоту выровненных по содержанию белка образцов смешивали буфером для внесения (по Лэммли) (Sample Buffer, Laemmli, Sigma, США) и инкубировали в течение 10 минут при 98°С.
Далее проводили электрофорез в денатурирующих условиях в полиакриламидном геле Mini-PROTEAN ® TGX™ Precast Protein Gels (Bio-Rad, США) в Tris/glycine/SDS Running Buffer 10X (Bio-Rad, США) с помощью системы Mini-PROTEAN® Tetra Cell (Bio-Rad, США) в течение 20 минут при 250V. После электрофореза белки переносили на нитроцеллюлозную мембрану Trans-Blot® Turbo™ Mini Nitrocellulose Transfer Packs (Bio-Rad) в буфере Tris-CAPS (Bio-Rad, США) с помощью системы для переноса Trans-Blot® SD Semi-Dry Transfer Cell (Bio-Rad, США) в течение 10 минут при 25V. Затем проводили блокирование неспецифического сигнала. Для этого мембрану инкубировали в растворе 5% обезжиренного молока в фосфатно-солевом буфере с 0,05% Твин20 (ТФСБ) в течение часа при комнатной температуре. После этого мембрану инкубировали 1 час при 37°С с антителами к белку S (40069-RP02) в растворе 5% обезжиренного молока в ТФСБ. Далее проводили отмывку мембраны раствором ТФСБ и обрабатывали мембрану раствором вторичных антител, конъюгированных с пероксидазой хрена, в растворе 5% обезжиренного молока в ТФСБ при 37°С на шейкере в течение 1 часа. Затем мембрану тщательно отмывали раствором ТФСБ. Дальнейшую детекцию проводили с помощью набора Clarity™ Western ECL Substrate (Bio-Rad, США) и проявляли на пленку Amersham Hyperfilm® ECL™ (GE Healthcare, США).
Результаты представлены на Фиг. 1. Как видно из полученных данных, во всех клетках, трансдуцированных рекомбинантными аденовирусами Ad5-S, Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc наблюдалась экспрессия различных вариантов гена целевого белка S, при этом белки S, S-G, RBD-G были обнаружены в лизатах (трансмембранная форма), а белки RBD и RBD-Fc были обнаружены в средах (секретируемая форма). Все детектируемые фрагменты совпадают по молекулярной массе с теоретическими значениями. В контрольных образцах экспрессии не наблюдалось.
Пример 7.
Проверка экспрессии различных вариантов гена гликопротеина S БВРС-КоВ в клетках линии НЕK293 в составе рекомбинантных аденовирусов pAd26-S, pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc методом иммуноблоттинга.
Клетки НЕK293 культивировали в среде DMEM с добавлением 10% эмбриональной телячьей сыворотки в инкубаторе при температуре 37°С и 5% CO2. Клетки помещали на 35 мм2 культуральные чашки Петри и инкубировали в течение суток до достижения 70% конфлюэнтности. Далее к клеткам добавляли исследуемые препараты рекомбинантных аденовирусов (pAd26-S, pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc), контрольный препарат (Ad26-null - рекомбинантный аденовирус, не содержащий вставок) из расчета 100 БОЕ/клетку и фосфатно-солевой буфер в качестве отрицательного контроля. Через сутки проверяли экспрессию антигенов БВРС-КоВ методом иммуноблоттинга. Для этого среды с клеток были отобраны в отдельные пробирки для анализа секретируемых форм белка, а клетки были промыты стерильным фосфатно-солевым буфером, а затем лизированы с помощью лизирующего буфера «Cell Culture Lysis Reagenb (Promega, США), содержащего 25 мМ Tris-фосфат (рН 7.8), 2 мМ ДТТ, 2 мМ транс-1,2-диаминоциклогексан, 10% глицерин и 1% Triton® Х-100 для анализа трансмембранных белков.
После отбора сред и лизиса клеток производили измерение концентрации тотального белка в пробах с помощью реактива Bradford (Sigma) согласно инструкции производителя. Аликвоту выровненных по содержанию белка образцов смешивали буфером для внесения (по Лэммли) (Sample Buffer, Laemmli, Sigma, США) и инкубировали в течение 10 минут при 98°С.
Далее проводили электрофорез в денатурирующих условиях в полиакриламидном геле Mini-PROTEAN ® TGX™ Precast Protein Gels (Bio-Rad, США) в Tris/glycine/SDS Running Buffer 10X (Bio-Rad, США) с помощью системы Mini-PROTEAN® Tetra Cell (Bio-Rad, США) в течение 20 минут при 250V. После электрофореза белки переносили на нитроцеллюлозную мембрану Trans-Blot® Turbo™ Mini Nitrocellulose Transfer Packs (Bio-Rad, США) в буфере Tris-CAPS (Bio-Rad, США) с помощью системы для переноса Trans-Blot® SD Semi-Dry Transfer Cell (Bio-Rad, США) в течение 10 минут при 25V. Затем проводили блокирование неспецифического сигнала. Для этого мембрану инкубировали в растворе 5% обезжиренного молока в фосфатно-солевом буфере с 0,05% Твин20 (ТФСБ) в течение часа при комнатной температуре. После этого мембрану инкубировали 1 час при 37°С с антителами к белку S (40069-RP02) в растворе 5% обезжиренного молока в ТФСБ. Далее проводили отмывку мембраны раствором ТФСБ и обрабатывали мембрану раствором вторичных антител, конъюгированных с пероксидазой хрена, в растворе 5% обезжиренного молока в ТФСБ при 37°С на шейкере в течение 1 часа. Затем мембрану тщательно отмывали раствором ТФСБ. Дальнейшую детекцию проводили с помощью набора Clarity™ Western ECL Substrate (Bio-Rad, США) и проявляли на пленку Amersham Hyperfilm® ECL™ (GE Healthcare, США).
Результаты представлены на Фиг. 2. Как видно из полученных данных, во всех клетках, трансдуцированных рекомбинантными аденовирусами pAd26-S, pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc наблюдалась экспрессия различных вариантов гена целевого белка S, при этом белки S, S-G, RBD-G были обнаружены в лизатах (трансмембранная форма), а белки RBD и RBD-Fc были обнаружены в средах (секретируемая форма). Все детектируемые фрагменты совпадают по молекулярной массе с теоретическими значениями. В контрольных образцах экспрессии не наблюдалось.
Пример 8.
Способ использования иммунобиологического средства на основе рекомбинантных аденовирусов человека 5-го и 26-го серотипов (Ad5-S, Ad5-S-G, Ad5-RBD, Ad5-RBD-G, Ad5-RBD-Fc, pAd26-S, pAd26-S-G, pAd26-RBD, pAd26-RBD-G, pAd26-RBD-Fc) путем введения в организм млекопитающих в эффективном количестве для индукции специфического иммунитета к БВРС-КоВ.
Разработанное иммунобиологическое средство на основе рекомбинантных аденовирусов человека 5-го и 26-го серотипов, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5 используется путем введения в организм млекопитающих любым из известных для данного вирусного вектора способов введения (подкожно, внутримышечно, внутривенно, интраназально). При этом в организме млекопитающих развивается иммунный ответ к целевому белку гликопротеина БВРС-КоВ.
Одной из основных характеристик эффективности иммунизации является титр антител. В примере представлены данные, касающиеся изменения титра антител против гликопротеина БВРС-КоВ через 21 день после однократной внутримышечной иммунизации животных иммунобиологическим средством, включающим рекомбинантный аденовирус человека 5-го или 26-го серотипа, содержащий оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5.
В эксперименте использовались млекопитающие - мыши линии C57BL/6, самки 18 г. Все животные были разделены на 37 групп по 5 животных, которым внутримышечно вводили:
1) Ad5-S 107БОЕ/мышь
2) Ad5-RBD 107БОЕ/мышь
3) Ad5-S-G 107БОЕ/мышь
4) Ad5-RBD-G 107БОЕ/мышь
5) Ad5-RBD-Fc 107БОЕ/мышь
6) Ad5-null 107БОЕ/мышь
7) Ad5-S 108БОЕ/мышь
8) Ad5-RBD 108БОЕ/мышь
9) Ad5-S-G 108БОЕ/мышь
10) Ad5-RBD-G 108БОЕ/мышь
11) Ad5-RBD-Fc 108БОЕ/мышь
12) Ad5-null 108БОЕ/мышь
13) Ad5-S 109БОЕ/мышь
14) Ad5-RBD 109БОЕ/мышь
15) Ad5-S-G 109БОЕ/мышь
16) Ad5-RBD-G 109БОЕ/мышь
17) Ad5-RBD-Fc 109БОЕ/мышь
18) Ad5-null 109БОЕ/мышь
19) Ad26-S 107БОЕ/мышь
20) Ad26-RBD 107БОЕ/мышь
21) Ad26-S-G 107БОЕ/мышь
22) Ad26-RBD-G 107БОЕ/мышь
23) Ad26-RBD-Fc 107БОЕ/мышь
24) Ad26-null 107БОЕ/мышь
25) Ad26-S 108БОЕ/мышь
26) Ad26-RBD 108БОЕ/мышь
27) Ad26-S-G 108БОЕ/мышь
28) Ad26-RBD-G 108БОЕ/мышь
29) Ad26-RBD-Fc 108БОЕ/мышь
30) Ad26-null 108БОЕ/мышь
31) Ad26-S 109БОЕ/мышь
32) Ad26-RBD 109БОЕ/мышь
33) Ad26-S-G 109БОЕ/мышь
34) Ad26-RBD-G 109БОЕ/мышь
35) Ad26-RBD-Fc 109БОЕ/мышь
36) Ad26-null 109БОЕ/мышь
37) фосфатно-солевой буфер
Через три недели у животных отбирали кровь из хвостовой вены и выделяли сыворотку крови. Титр антител определяли методом иммуноферментного анализа (ИФА) по следующему протоколу:
1) Белок (S) адсорбировали на лунках 96-луночного планшета для ИФА в течение 16 часов при температуре +4°С.
2) Далее для избавления от неспецифического связывания осуществилась "забивка" планшета 5% молоком, растворенном в TPBS в объеме 100 мкл на лунку. Инкубировали на шейкере при температуре 37°С на протяжении часа.
3) Методом 2-х кратных разведений разводили образцы сыворотки иммунизированных мышей. Всего было приготовлено 12 разведений каждого образца.
4) Добавляли по 50 мкл каждого разведенного образца сыворотки в лунки планшета.
5) Далее проводили инкубацию в течение 1 часа при 37°С.
6) После инкубации проводилась трехкратная промывка лунок фосфатным буфером.
7) Затем добавляли вторичные антитела против иммуноглобулинов мыши, конъюгированные с пероксидазой хрена.
8) Далее проводили инкубацию в течение 1 часа при 37°С.
9) После инкубации проводилась трехкратная промывка лунок фосфатным буфером
10) Затем добавили раствор тетраметилбензидина (ТМВ), который является субстратом пероксидазы хрена и в результате реакции превращается в окрашенное соединение. Реакцию останавливали через 15 минут добавлением серной кислоты. Далее с помощью спектрофотометра измеряли оптическую плотность раствора (OD) в каждой лунке при длине волны 450 нм.
Титр антител определяли, как последнее разведение, в котором оптическая плотность раствора была достоверно выше, чем в группе отрицательного контроля. Полученные результаты (среднее геометрическое значение) представлены в таблице 1.
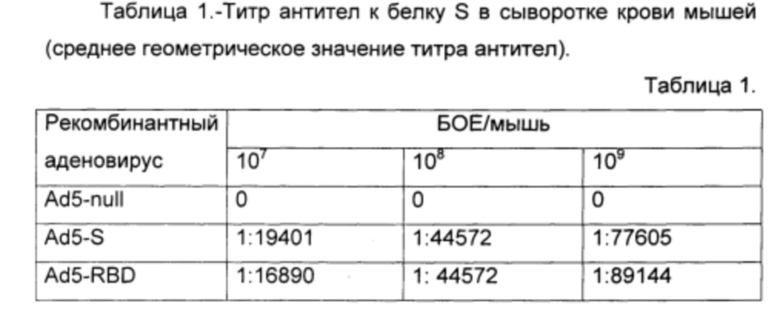
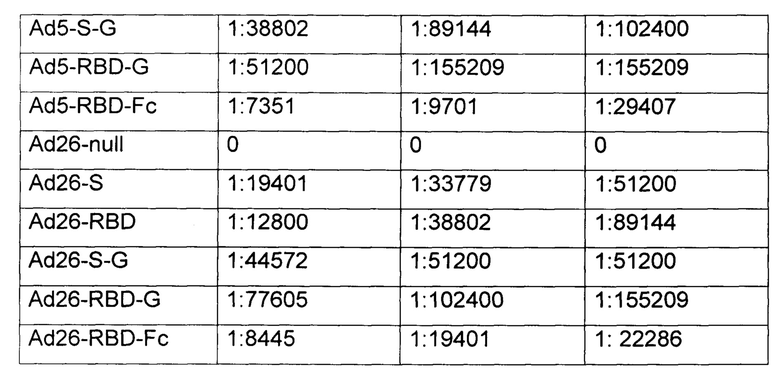
Результаты эксперимента показали, что разработанное иммунобиологическое средство по п. 1-10, введенное в организм млекопитающего, индуцирует гуморальный иммунный ответ к гликопротеину БВРС-КоВ во всем диапазоне выбранных доз. При этом, очевидно, что увеличение доз будет приводить к увеличению титра антител в крови млекопитающих до наступления токсического эффекта.
Пример 9.
Способ использования разработанного иммунобиологического средства основе рекомбинантного аденовируса человека 5-го серотипа, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, путем их последовательного введения в организм млекопитающих с интервалом в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
Эксперимент был выполнен согласно протоколу, описанному в примере 7.
Все животные были разделены на 29 групп (по 3 животных), которым внутримышечно вводили:
1. фосфатный буфер (100 мкл), а через неделю фосфатный буфер (100 мкл)
2. фосфатный буфер (100 мкл), а через неделю Ad5-null 108БОЕ/мышь
3. Ad5-null 108БОЕ/мышь, а через неделю фосфатный буфер (100 мкл)
4. Ad5-null 108БОЕ/мышь, а через неделю Ad5-null 108БОЕ/мышь
5. Ad5-S 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
6. Ad5-S 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
7. Ad5-S 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
8. Ad5-S 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
9. Ad5-S 108БОЕ/мышь, а через неделю Ad5-RBD-Fc 108БОЕ/мышь
10. Ad5-RBD 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
11. Ad5-RBD 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
12. Ad5-RBD 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
13. Ad5-RBD 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
14. Ad5-RBD 108БОЕ/мышь, а через неделю Ad5-RBD-Fc 108БОЕ/мышь
15. Ad5-S-G 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
16. Ad5-S-G 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
17. Ad5-S-G 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
18. Ad5-S-G 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
19. Ad5-S-G 108БОЕ/мышь, а через неделю Ad5-RBD-Fc 108БОЕ/мышь
20. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
21. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
22. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
23. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
24. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad5- RBD-Fc 108БОЕ/мышь
25. Ad5-RBD-Fc 108БОЕ/мышь, а через неделю Ad5-RBD-Fc 108БОЕ/мышь
26. Ad5-RBD-Fc 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
27. Ad5-RBD-Fc 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
28. Ad5-RBD-Fc 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
29. Ad5-RBD-Fc 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
Результаты представлены в таблицах 2 и 3.


Таким образом, результаты эксперимента полностью подтвердили, что последовательная иммунизация разработанными иммунобиологическими средствами в различных комбинациях включающими различные формы белка S БВРС-КоВ вызовет более мощную индукцию иммунного ответа, чем иммунизация по аналогичной схеме одним и тем же антигеном.
Пример 10.
Определение эффективности иммунизации разработанным иммунобиологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, по оценке доли пролиферирующих лимфоцитов.
Пролиферативный анализ позволяет оценивать способность лимфоцитов усиленно делиться после встречи с антигеном. Для того, чтобы оценить пролиферацию авторы использовали окраску лимфоцитов флуоресцентным красителем CFSE. Данный краситель связывается с клеточными белками, и сохраняется долгое время и при этом никогда не передается соседним клеткам в популяции. Однако, флуоресцентная метка передается дочерним клеткам. Концентрация метки, а, следовательно, и интенсивность флуоресценции, снижаются ровно в два раза. Поэтому делящиеся клетки легко отслеживать по уменьшению их флуоресценции.
В эксперименте использовались мыши линии C57BL/6. Все животные были разделены на 7 групп (по 3 животных), которым внутримышечно вводили:
1) фосфатный буфер (100 мкл)
2) Ad5-null 108БОЕ/мышь
3) Ad5-S 108БОЕ/мышь
4) Ad5-RBD 108БОЕ/мышь
5) Ad5-S-G 108БОЕ/мышь
6) Ad5-RBD-G 108БОЕ/мышь
7) Ad5-RBD-Fc 108БОЕ/мышь
Дозы рекомбинантных аденовирусов были выбраны на основании данных, полученных при определении титра антител. Через две недели животных усыпляли. Из селезенки выделяли лимфоциты методом центрифугирования в градиенте фиколла-урографина. Затем выделенные клетки окрашивали CFSE по методике (B.J. Quah et. al., Monitoring lymphocyte proliferation in vitro and in vivo with the intracellular fluorescent dye carboxyfluorescein diacetate succinimidyl ester, Nature Protocols, 2007, №2(9), 2049-2056) и культивировали в присутствие антигена. Далее клетки анализировали методом проточной цитофлуориметрии. Полученные результаты представлены на Фиг. 3, 4, 5, 6. Таким образом, можно заключить, что полученные аденовирусные конструкции индуцируют формирование антиген-специфического иммунного ответа (как CD4+, так и CD8+).
Как видно из результатов эксперимента (Фиг. 3, 4, 5, 6), разработанное иммунобиологическое средство по п. 1, п. 2, п. 3, п. 4, п. 5 в данной дозе эффективно стимулируют пролиферацию лимфоцитов.
Пример 11.
Способ использования разработанных иммунобиологических средств на основе рекомбинантных аденовирусов человека 5-го и 26-го серотипов, содержащих оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, путем их последовательного введения в организм млекопитающих с интервалом в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
Эксперимент был выполнен согласно протоколу, описанному в примере 7. Комбинации иммунобиологических средств были выбраны исходя из примеров 7 и 8.
Все животные были разделены на 31 группу (по 3 животных), которым внутримышечно вводили:
1. фосфатный буфер (100 мкл), а через неделю фосфатный буфер (100 мкл)
2. Ad26-null 108БОЕ/мышь, а через неделю фосфатный буфер (100 мкл)
3. фосфатный буфер (100 мкл), а через неделю Ad26-null 108БОЕ/мышь
4. Ad26-null 108БОЕ/мышь, а через неделю Ad26-null 108БОЕ/мышь
5. Ad5-null 108БОЕ/мышь, а через неделю фосфатный буфер (100 мкл)
6. фосфатный буфер (100 мкл), а через неделю Ad5-null 108БОЕ/мышь
7. Ad5-null 108БОЕ/мышь, а через неделю Ad5-null 108БОЕ/мышь
8. Ad5-null 108БОЕ/мышь, а через неделю Ad26-null 108БОЕ/мышь
9. Ad26-null 108БОЕ/мышь, а через неделю Ad5-null 108БОЕ/мышь
10. Ad5-S 108БОЕ/мышь, а через неделю Ad26-RBD-G 108БОЕ/мышь
11. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad26-S 108БОЕ/мышь
12. Ad26-S 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
13. Ad26-RBD-G 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
14. Ad5-S-G 108БОЕ/мышь, а через неделю Ad26-RBD 108БОЕ/мышь
15. Ad26-S-G 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
16. Ad5-RBD 108БОЕ/мышь, а через неделю Ad26-S-G 108БОЕ/мышь
17. Ad26-S-G 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
18. Ad26-RBD 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
19. Ad5-RBD 108БОЕ/мышь, а через неделю Ad26-S-G 108БОЕ/мышь
20. Ad5-S-G 108БОЕ/мышь, а через неделю Ad26-RBD-G 108БОЕ/мышь
21. Ad5-RBD-G 108БОЕ/мышь, а через неделю Ad26-S-G 108БОЕ/мышь
22. Ad26-S-G 108БОЕ/мышь, а через неделю Ad5-RBD-G 108БОЕ/мышь
23. Ad26-RBD-G 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
24. Ad5-S 108БОЕ/мышь, а через неделю Ad26-RBD 108БОЕ/мышь
25. Ad26-S 108БОЕ/мышь, а через неделю Ad5-RBD 108БОЕ/мышь
26. Ad5-RBD 108БОЕ/мышь, а через неделю Ad26-S 108БОЕ/мышь
27. Ad26-RBD 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
28. Ad5-S-G 108БОЕ/мышь, а через неделю Ad26-S 108БОЕ/мышь
29. Ad26-S-G 108БОЕ/мышь, а через неделю Ad5-S 108БОЕ/мышь
30. Ad5-S 108БОЕ/мышь, а через неделю Ad26-S-G 108БОЕ/мышь
31. Ad26-S 108БОЕ/мышь, а через неделю Ad5-S-G 108БОЕ/мышь
Результаты представлены в таблицах 4 и 5.
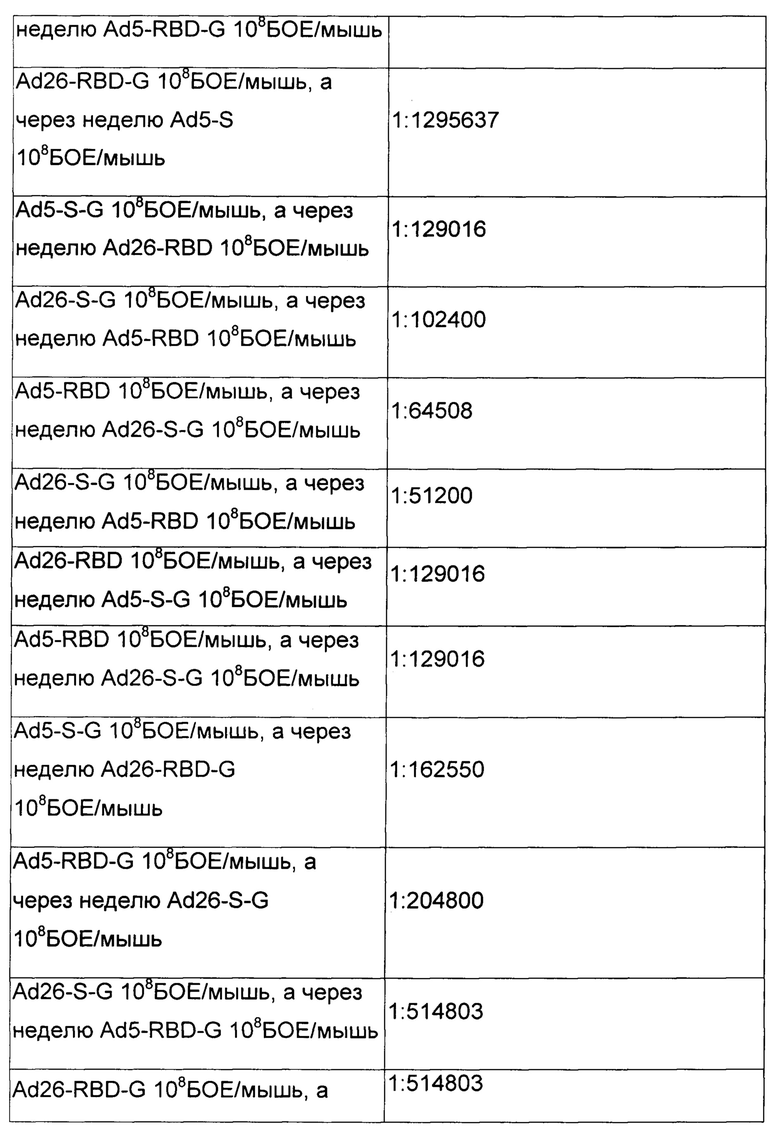
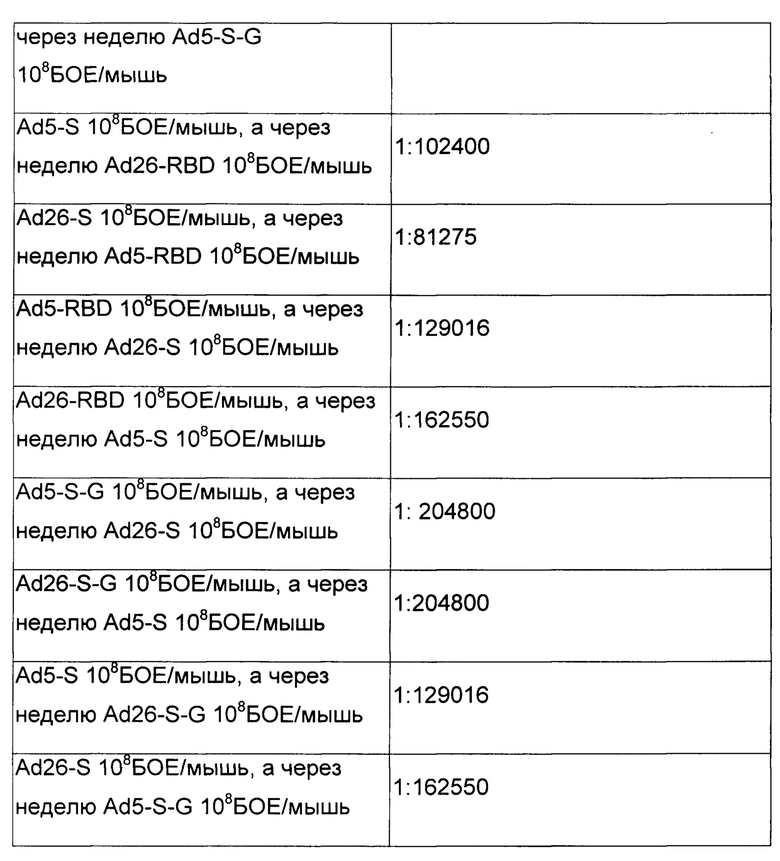
Таким образом, результаты эксперимента полностью подтвердили, что последовательная иммунизация разработанными иммунобиологическими средствами по п. 1, 2, 3, 4 и п. 6, 7, 8, 9, включающими различные аденовирусные векторы (на основе аденовирусов человека 5-го и 26-го серотипов) вызовет более мощную индукцию иммунного ответа, чем иммунизация по аналогичной схеме одним и тем же вектором.
Пример 12.
Определение эффективности иммунизации разработанным иммунобиологическим средством на основе рекомбинантного аденовируса, содержащего оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белков S, S-G, RBD, RBD-G, RBD-Fc) вируса БВРС с последовательностью, выбранной из SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4, SEQ ID NO: 5, по оценке прироста концентрации ИФН-гамма в среде после стимуляции спленоцитов иммунизированных аденовирусными конструкциями мышей линии C57/BL6 рекомбинантным полноразмерным белком S вируса БВРС-КоВ.
Для определения уровня ИФН-гамма был использован набор Mouse IFN gamma Platinum ELISA (Affymetrix eBioscience, USA).
Порядок проведения ИФА. Промыли лунки планшета однократным буфером для промывки дважды объемом 200 мкл на лунку, а затем внесли по 100 мкл стандартов и 100 мкл раствора для разведения образцов в качестве отрицательного контроля. В лунки образцов внесли по 50 мкл раствора для разведения образцов, а затем по 50 мкл самих образцов (среда от стимулированных спленоцитов). Приготовили раствор антител, конъюгированных с биотином. Для этого развели конъюгат объемом 60 мкл в 5,94 мл буфера для анализа. Затем во все лунки внесли по 50 мкл раствора антител, конъюгированных с биотином, накрыли планшет крышкой и инкубировали при комнатной температуре на шейкере при 400 об/мин в течение 2 часов. Далее приготовили раствор стрептавидина, конъюгированного с пероксидазой хрена. Для этого развели конъюгат объемом 60 мкл в 5,94 мл буфера для анализа. Промыли лунки планшета дважды однократным буфером для промывки объемом 200 мкл на лунку и во все лунки планшета внесли по 100 мкл раствора стрептавидина, конъюгированного с пероксидазой хрена. Планшет инкубировали при комнатной температуре на шейкере при 400 оборотов в минуту в течение 1 часа. Затем лунки планшета промыли дважды однократным буфером для промывки объемом 200 мкл на лунку и во все лунки планшета внесли по 100 мкл ТМБ субстрата и инкубировали в темноте при комнатной температуре 10 минут, а затем добавили во все лунки по 100 мкл останавливающего раствора. Значение оптической плотности определяли измерением на планшетном спектрофотометре (Multiskan FC, Thermo) при длине волны 450 нм.
Результаты измерения продукции ИФН-гамма на 15-й день после иммунизации испытуемых животных аденовирусными конструкциями представлены графически на Фиг. 8 и в таблице 6 в виде прироста концентрации ИФН-гамма (разы) при сравнении клеток, стимулированных рекомбинантным полноразмерным белком S БВРС-КоВ, с интактными клетками.

По результатам исследования было показано, что введение полученных конструкций животным приводит высокому уровню индукции экспрессии ИФН-гамма спленоцитами при стимуляции рекомбинантным белком S вируса БВРС-КоВ, что свидетельствует о формировании специфического Т-клеточного иммунитета.
Пример 13.
Способ использования разработанных иммунобиологических средств на основе рекомбинантных аденовирусов человека 5-го серотипа, содержащих оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность протективного антигена (белка RBD-G и S) БВРС-КоВ с последовательностью, выбранной из SEQ ID NO: 1 и SEQ ID NO:4 путем их одновременного введения в организм млекопитающих, для индукции специфического иммунитета к БВРС-КоВ.
Эксперимент был выполнен согласно протоколу, описанному в примере 7. Комбинация иммунобиологических средств была выбрана исходя из примеров 8 и 11.
Все животные были разделены на 17 групп (по 5 животных), которым внутримышечно вводили:
1. фосфатный буфер (100 мкл)
2. Ad5-null 105 вирусных частиц/мышь
3. Ad5-null 106 вирусных частиц/мышь
4. Ad5-null 107 вирусных частиц/мышь
5. Ad5-null 108 вирусных частиц/мышь
6. Ad5-null 109 вирусных частиц/мышь
7. Ad5-null 1010 вирусных частиц/мышь
8. Ad5-null 5*1010 вирусных частиц/мышь
9. Ad5-null 1011 вирусных частиц/мышь
10. Ad5-S+ Ad5-RBD-G 105 вирусных частиц/мышь
11. Ad5-S+ Ad5-RBD-G 106 вирусных частиц/мышь
12. Ad5-S+ Ad5-RBD-G 107 вирусных частиц/мышь
13. Ad5-S+ Ad5-RBD-G 108 вирусных частиц/мышь
14. Ad5-S+ Ad5-RBD-G 109 вирусных частиц/мышь
15. Ad5-S+ Ad5-RBD-G 1010 вирусных частиц/мышь
16. Ad5-S+ Ad5-RBD-G 5*1010 вирусных частиц/мышь
17. Ad5-S+ Ad5-RBD-G 1011 вирусных частиц/мышь
Результаты представлены в таблицах 7 и 8.
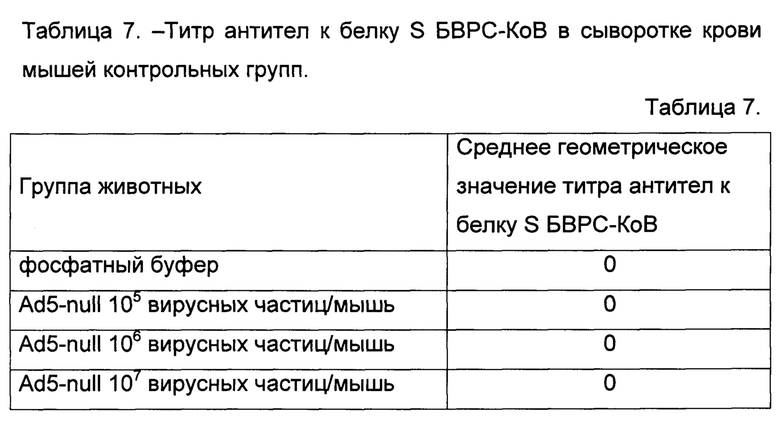

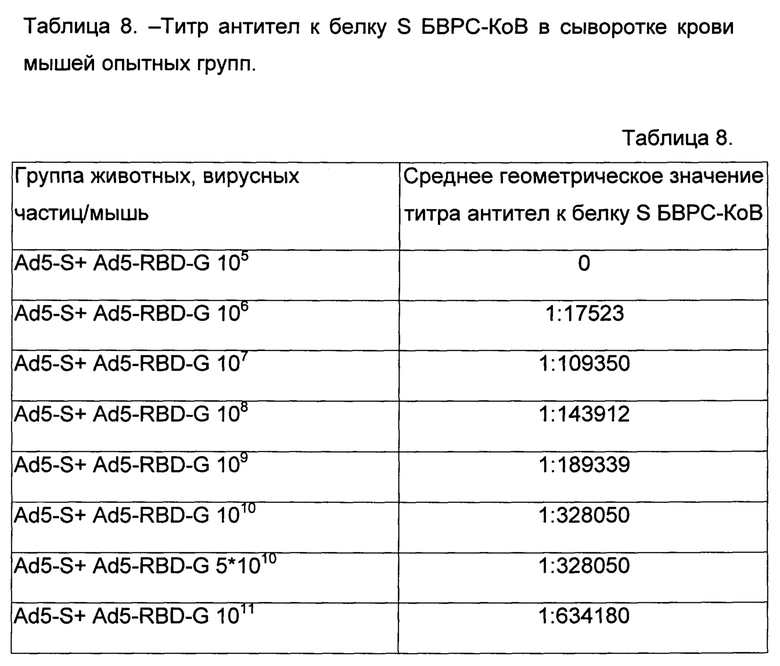
Таким образом, результаты эксперимента полностью подтвердили, что одновременная иммунизация разработанными иммунобиологическими средствами по п. 1 и 4 индуцирует гуморальный иммунный ответ к гликопротеину БВРС-КоВ в диапазоне доз от 106 вирусных частиц/мышь до 1011 вирусных частиц/мышь. При этом, очевидно, что увеличение доз будет приводить к увеличению титра антител в крови млекопитающих до наступления токсического эффекта.
Промышленная применимость
Преимуществом заявленного технического решения является использование таких доз рекомбинантных аденовирусов, экспрессирующих ген полноразмерного белка, которые позволяют повысить иммуногенность, но при которых еще не наблюдаются токсические эффекты на животных. Также к преимуществам можно отнести дополнительное возрастание иммуногенности рецептор-связывающего домена гена S БВРС-КоВ за счет присоединения лидерной последовательности для секреции белка из клетки во внешнюю среду. Одним из преимуществ заявленного технического решения является наличие адекватного Т-клеточного ответа (как CD4+, так и CD8+) на введение антигена.
Таким образом, создано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа, содержащее аденовирус человека 5-го серотипа с делетированными Е1/Е3 областями и встроенную генетическую конструкцию, кодирующую разработанные оптимальные консенсусные аминокислотные последовательности протективного антигена S, наиболее гомологичные для различных штаммов БВРС-КоВ (с 2015-2017 гг.). Также, создано иммунобиологическое средство на основе рекомбинантного аденовируса человека 26-го серотипа, содержащее аденовирус человека 26-го серотипа с делетированной Е1 областью, замененной открытой рамкой считывания 6 на открытую рамку считывания аденовируса человека 5-го серотипа и с встроенной генетической конструкцией, кодирующей разработанные оптимальные консенсусные аминокислотные последовательности протективного антигена S, наиболее гомологичные для различных штаммов БВРС-КоВ (с 2015-2017 гг.). При этом кодирующие последовательности различных форм белка S БВРС-КоВ экспрессируются рекомбинантными псевдоаденовирусными частицами непосредственно в организме субъекта. Разработанное иммунобиологическое средство может рассматриваться в качестве кандидатного препарата для доклинических исследований, как противовирусная вакцина широкого спектра действия, которая способна одновременно эффективно защищать человека от заражения различными штаммами БВРС-КоВ. Предложена технология производства такой вакцины.
| название | год | авторы | номер документа |
|---|---|---|---|
| Иммунобиологическое средство и способ его использования для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 (варианты) | 2020 |
|
RU2720614C1 |
| Применение средства для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 у детей | 2021 |
|
RU2761904C1 |
| Иммунобиологическое средство для индукции иммунного ответа против вируса Ласса и способ его применения | 2024 |
|
RU2823965C1 |
| Иммунобиологическое средство и способ его использования для индукции специфического иммунитета против вирусов SARS-CoV-2 вариант B.1.617.2 (Delta) и SARS-CoV-2 вариант B.1.1.529 (Omicron) (варианты) | 2022 |
|
RU2779634C1 |
| Фармацевтическое средство и способ его использования для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 (варианты) | 2020 |
|
RU2731342C1 |
| Иммунобиологическое средство для индукции иммунного ответа к филовирусам: Ebolavirus и/или Marburgvirus, способ использования иммунобиологического средства | 2021 |
|
RU2760439C1 |
| Средство для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 в жидкой форме (варианты) | 2021 |
|
RU2743963C1 |
| Средство для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 в лиофилизированной форме (варианты) | 2021 |
|
RU2743962C1 |
| Применение средства для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 у лиц старше 60 лет и/или имеющих хронические заболевания (варианты) | 2021 |
|
RU2744442C1 |
| Применение средства для индукции специфического иммунитета против вируса тяжелого острого респираторного синдрома SARS-CoV-2 для ревакцинации населения (варианты) | 2021 |
|
RU2744444C1 |











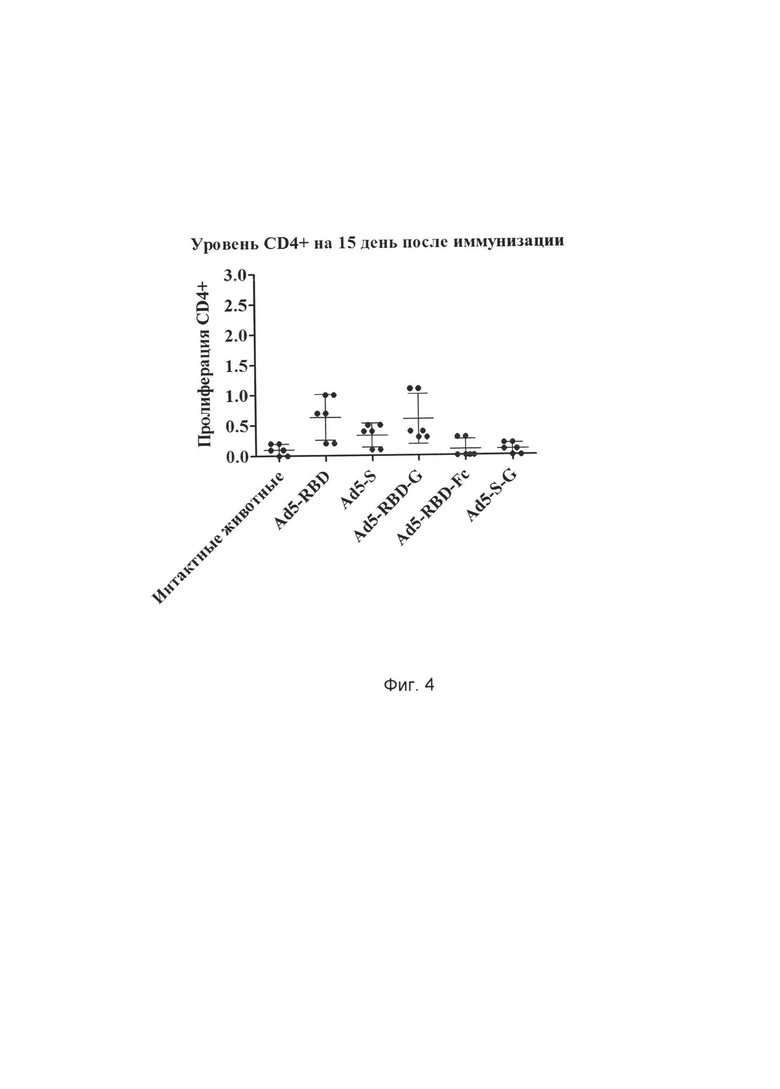
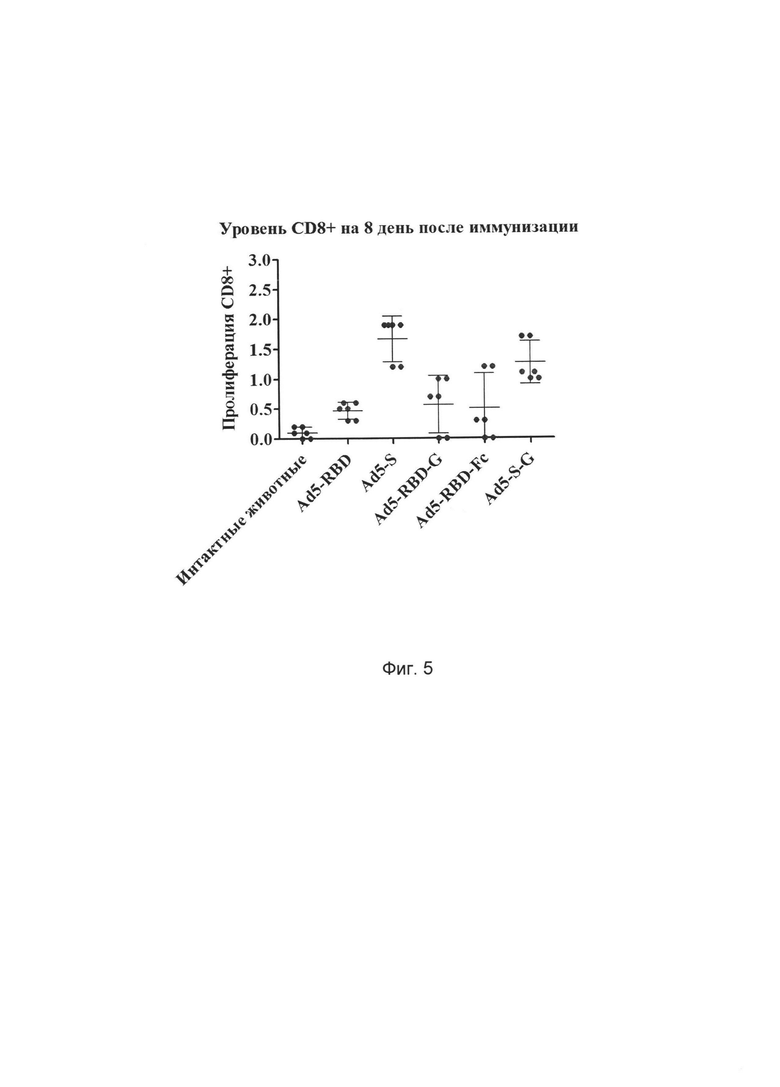
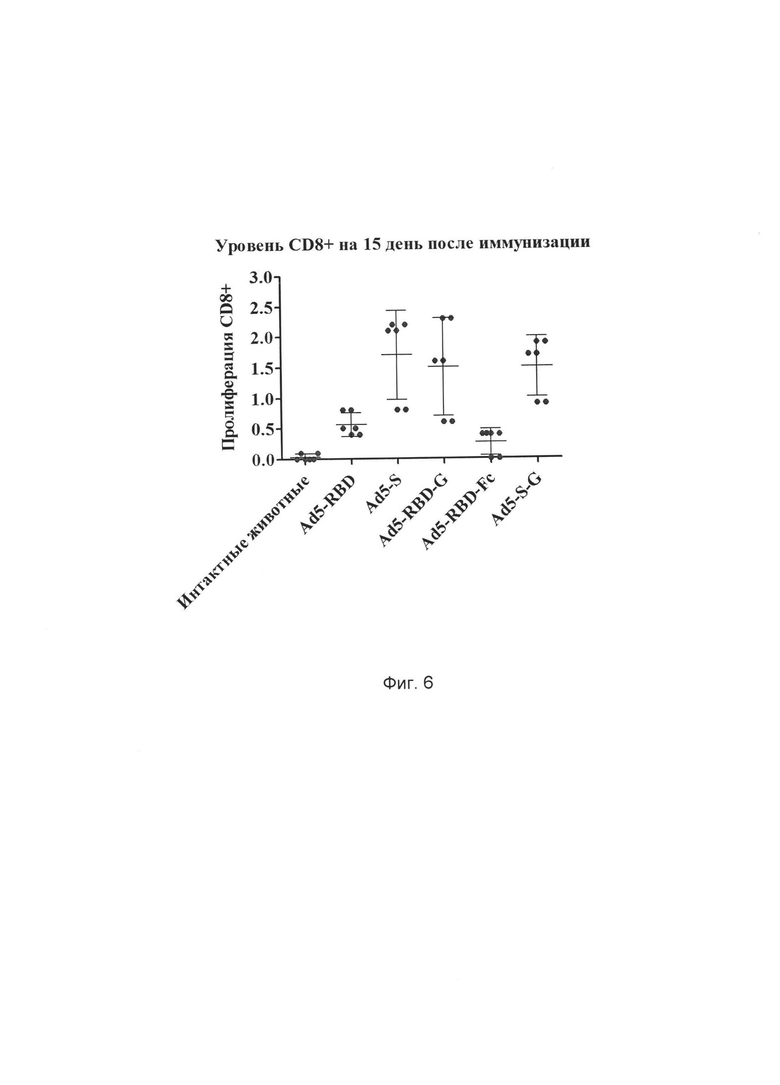
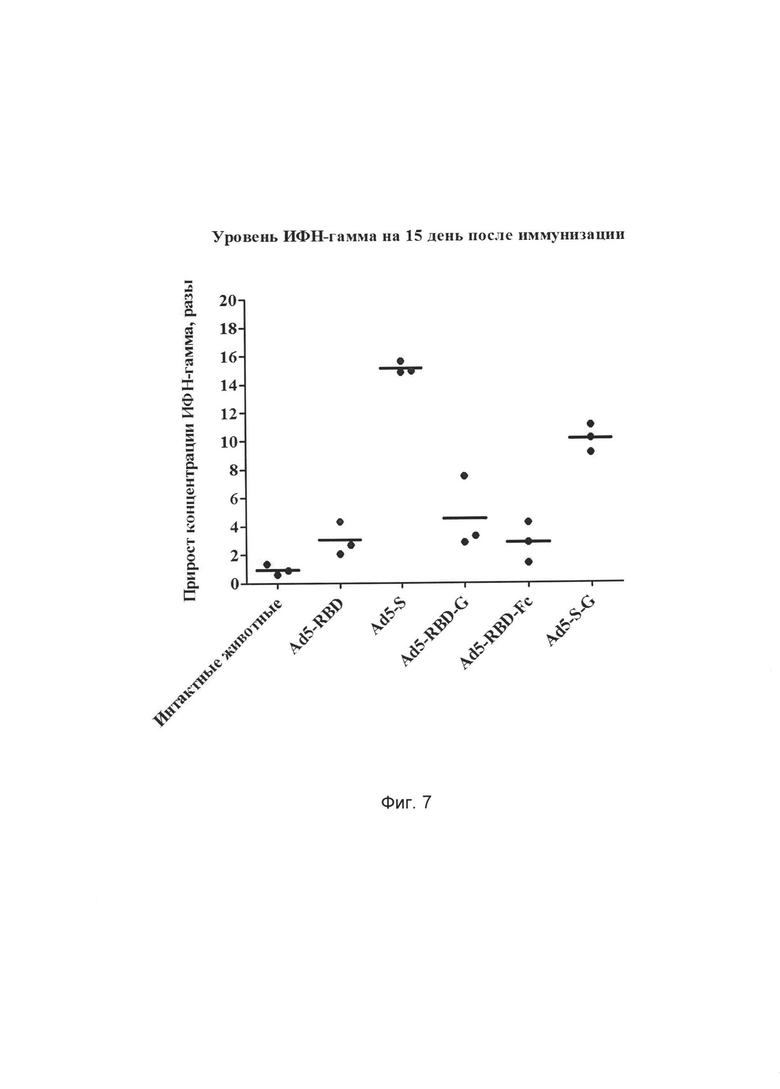
Изобретение относится к биотехнологии, иммунологии и вирусологии. Описано иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S вируса БВРС на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг. с последовательностью SEQ ID NO: 1, SEQ ID NO: 2, SEQ ID NO: 3, SEQ ID NO: 4 или SEQ ID NO: 5. Способ использования иммунобиологического средства для индукции специфического иммунитета к БВРС-КоВ. При этом способ использования иммунобиологического средства заключается в последовательном введении в организм млекопитающих двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа или двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ. Также разработан способ использования иммунобиологического средства, заключающийся в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ, или в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ. Также разработан способ использования иммунобиологического средства, заключающийся в одновременном введении в организм млекопитающих любых двух иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа для индукции специфического иммунитета к БВРС-КоВ. Представленное средство может применяться для профилактики ближневосточного респираторного синдрома. 9 н.п. ф-лы, 7 ил., 8 табл., 13 пр.
1. Иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S вируса БВРС на основании последовательностей генов белка S современных штаммов вируса БВРС 2015-2017 гг.с последовательностью SEQ ID NO:1 (вариант 1).
2. Иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность полного протективного антигена S вируса БВРС с трансмембранным доменом гликопротеина вируса везикулярного стоматита с последовательностью SEQ ID NO:2 (вариант 2).
3. Иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида с последовательностью SEQ ID NO:3 (вариант 3).
4. Иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную под экспрессию в клетках млекопитающих консенсусную последовательность рецептор-связывающего домена белка S с трансмембранным доменом гликопротеина вируса везикулярного стоматита с последовательностью SEQ ID NO:4 (вариант 4).
5. Иммунобиологическое средство на основе рекомбинантного аденовируса человека 5-го серотипа или рекомбинантного аденовируса человека 26-го серотипа, содержащее оптимизированную последовательность рецептор-связывающего домена белка S с последовательностью лидерного пептида и последовательностью Fc-фрагмента от человеческого IgG1 с последовательностью SEQ ID NO:5 (вариант 5).
6. Способ использования иммунобиологического средства по п. 1, или п. 2, или п. 3, или п. 4, или п. 5, заключающийся во введении в организм млекопитающих этого средства в эффективном количестве для индукции специфического иммунитета к вирусу БВРС.
7. Способ использования иммунобиологического средства в эффективном количестве для индукции специфического иммунитета к вирусу БВРС по пп. и/или 1, и/или 2, и/или 3, и/или 4, и/или 5, заключающийся в последовательном введении в организм млекопитающих двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа или двух различных иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
8. Способ использования иммунобиологического средства в эффективном количестве для индукции специфического иммунитета к вирусу БВРС по пп. и/или 1, и/или 2, и/или 3, и/или 4, и/или 5, заключающийся в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа с интервалом более чем в 1 неделю для индукции специфического иммунитета к БВРС-КоВ, или в последовательном введении в организм млекопитающих любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 26-го серотипа и любого из иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го серотипа с интервалом более чем в 1 неделю, для индукции специфического иммунитета к БВРС-КоВ.
9. Способ использования иммунобиологического средства в эффективном количестве для индукции специфического иммунитета к вирусу БВРС по пп. и/или 1, и/или 2, и/или 3, и/или 4, и/или 5, заключающийся в одновременном введении в организм млекопитающих любых двух иммунобиологических средств на основе рекомбинантного аденовируса человека 5-го или 26-го серотипа для индукции специфического иммунитета к БВРС-КоВ.
| US 9718872 B2, 01.08.2017 | |||
| US 9889194 B2, 13.02.2018 | |||
| RU 2015136683 A, 06.03.2017. |
Авторы
Даты
2019-12-19—Публикация
2018-09-06—Подача