Область техники
Настоящее изобретение относится к микробиологической промышленности, а именно к получению продуцента изолимонной кислоты на основе дрожжей вида Yarrowia lipolytica, модифицированных методами генной инженерии.
Предшествующий уровень техники
Возрастающий интерес к продукции природного изомера изолимонной кислоты (трео-Ds(+)-изолимонная кислота) связан с использованием ее в фармацевтической и пищевой промышленностях [1].
Перспективной является разработка технологии получения изолимонной кислоты с использованием микроорганизмов. Микробиологический синтез позволяет получить природный изомер и является сравнительно быстрым и простым способом, что делает продукт доступным и рентабельным для дальнейшего использования. Способность продуцировать изолимонную кислоту обнаружена у мицелиального гриба вида Penicillium purpurogenum, представителей дрожжей Candida ravautii, Candida catenulate, а также Yarrowia lipolytica [2]. Среди указанных микроорганизмов дрожжи Y. lipolytica являются наиболее физиологически и генетически изученными, для них разработаны технологии промышленной ферментации, системы генетической трансформации, подходы для экспрессии и инактивации генов, секвенирован геном [3].
Известно, что изоцитрат (изолимонная кислота) синтезируется в митохондриях в процессе осуществления цикла Кребса посредством реакции изомеризации цитрата в изоцитрат, катализируемой ферментом аконитазой. В условиях избытка источника углерода и лимита источника азота происходит частичное торможение следующего этапа цикла Кребса - окислительного декарбоксилирования изоцитрата, катализируемого ферментом изоцитратдегидрогеназой (Idh), что приводит к накоплению интермедиантов цикла Кребса изоцитрата и цитрата в митохондриях [4]. Причина торможения декарбоксилирования изоцитрата заключается в том, что клетки начинают синтезировать ионы аммония из аденозинмонофосфата (АМФ) за счет повышения активности фермента аденозинмонофосфатдеаминазы (АМФД), при этом снижение АМФ, являющегося кофактором митохондриальной изоцитратдегидрогеназы, приводит к ингибированию этого фермента и, как следствие, к накоплению цитрата и изоцитрата [4].
В условиях избытка источника углерода и лимита источника азота повышение экспрессии гена YlAMPD, ответственного за синтез аденозинмонофосфатдеаминазы в дрожжах Y. lipolytica, приводит к увеличению пула синтезируемого изоцитрата и цитрата. Так, природный штамм Y. lipolytica W29 за 5 дней культивирования в условиях избытка источника углерода и лимита по азоту продуцирует 38.5 г/л смеси цитрата и изоцитрата, а штамм Yarrowia lipolytica W29 YlAMPD, обладающий увеличенной экспрессией гена YlAMPD, в тех же условиях производит 47.5 г/л смеси цитрата и изоцитрата [5].
Внутренняя мембрана митохондрии непроницаема для крупных молекул, таких как органические кислоты, аминокислоты, нуклеотиды, коферменты и кофакторы. Транспортную функцию таких молекул через мембрану осуществляет особая группа белков - митохондриальные транспортеры [6].
Известно, что в дрожжах Y. lipolytica за транспорт цитрата в митохондрию и из нее отвечает белок YlYhm2p [5], а за транспортировку изоцитрата между митохондриями и цитоплазмой отвечает белок YlSfc1p [7].
Инактивация гена YlYHM2 приводит к неспособности митохондрий клетки транспортировать цитрат из митохондрий в цитоплазму, тем самым позволяя полностью использовать цитрат внутри митохондрий для дальнейших биохимических превращений. Штамм Y. lipolytica W29 dYlyhm2, полученный из природного штамма Y. lipolytica W29 в результате делеции гена YlYHM2, в условиях избытка источника углерода и лимита по азоту накапливает в среде культивирования только 0.05 г/л цитрата за 5 дней культивирования, а исходный штамм - 30.1 г/л цитрата [5].
В условиях избытка источника углерода и лимита источника азота повышение уровня экспрессии гена YlSFC1 приводит к увеличению продукции изолимонной кислоты и изменению соотношения изолимонная кислота / лимонная кислота. Штамм Υ. lipolytica W29 YlSFC1 за 144 ч культивирования в 1 л ферментере накапливает 69.4 г/л изолимонной кислоты, при этом соотношение концентраций изолимонной кислоты к лимонной кислоте составляет 2.3:1, для исходного штамма те же показатели составляют 7.5 г/л и 0.1:1, соответственно [7].
Краткое описание изобретения
Технической проблемой, на решение которой направлено настоящее изобретение является расширение арсенала микроорганизмов, способных продуцировать изолимонную кислоту.
Техническим результатом заявляемого изобретения является рекомбинантный штамм дрожжей Yarrowia lipolytica 583 ВКПМ Y-4657 с инактивированным геном YlYHM2 и усиленной экспрессией генов YlAMPD и YlSFC1, продуцирующий изолимонную кислоту в условиях избытка источника углерода и лимита источника азота.
Заявляемый штамм получен из родительского штамма Y. lipolytica W29 YlAMPD, обладающего усиленной экспрессией гена YlAMPD, путем следующих модификаций:
- инактивация гена YlYHM2
- усиление экспрессии гена YlSFC1
Краткое описание рисунков
Изобретение проиллюстрировано следующими фигурами графического изображения:
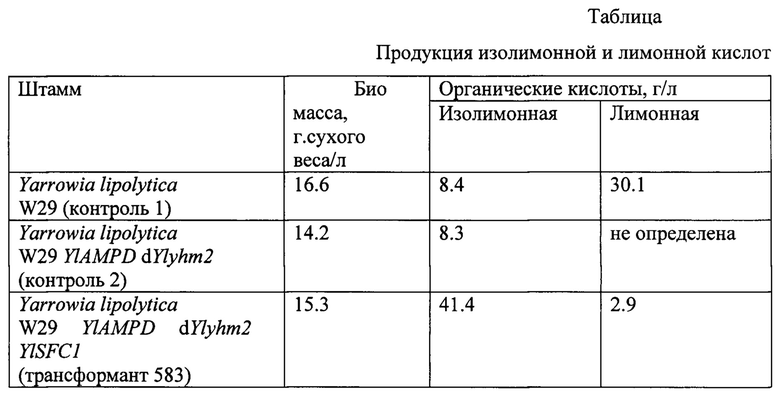
Фиг. 1. Схема генетической конструкции pUC-f1YlYHM2-URA3
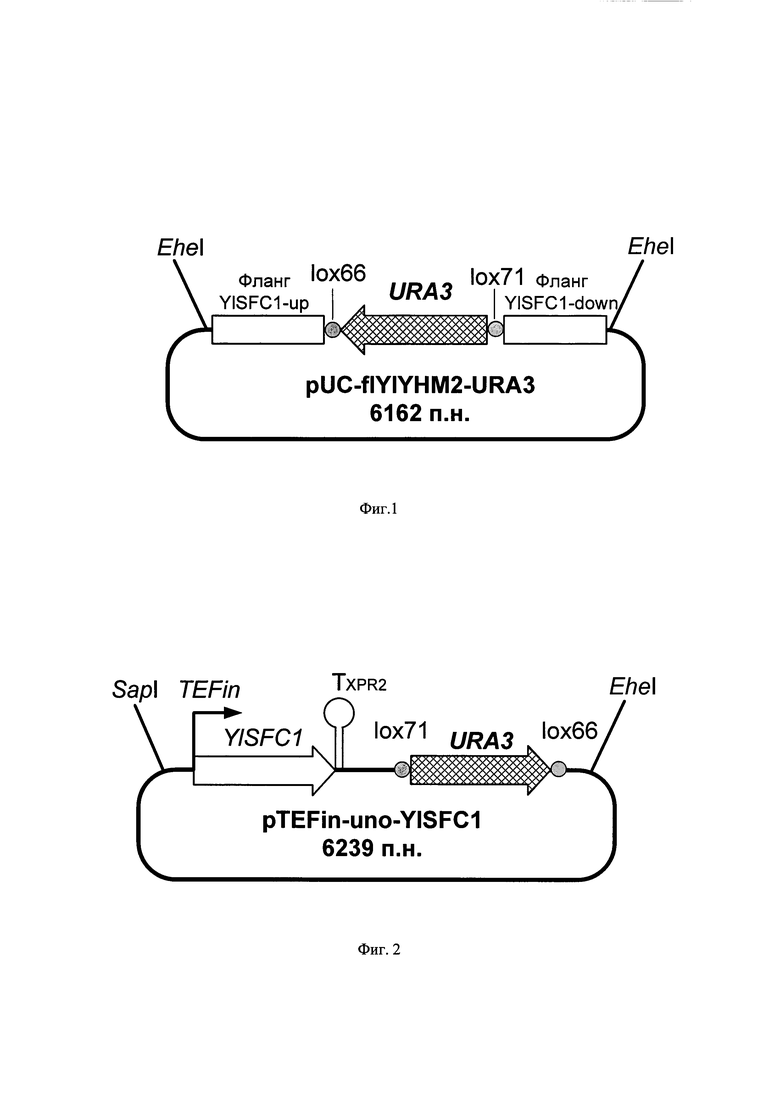
Фиг. 2. Схема генетической конструкции pTEFin-uno-YlSFC1
Пример 1. Конструирование заявляемого штамма
Для проведения экспериментов используют штамм Yarrowia lipolytica W29 YlAMPD, который получен из штамма Yarrowia lipolytica W29 URA3- (ВКПМ Y-3372) путем трансформации экспрессионной кассетой, содержащей селективный маркер URA3, ограниченный с двух сторон сайтами lox66 и lox71, узнаваемыми рекомбиназой Cre, а также ген YlAMPD под контролем промотора hp4d и терминатора гена YlXPR2.
1.1 Инактивация гена ΥlΥΗΜ2
Известным методом [8] на базе штамма Y. lipolytica W29 YlAMPD получают ауксотрофный по урацилу штамм Y. lipolytica W29 YlAMPD URA3-.
Генетическую конструкцию pUC-f1YlYHM2-URA3 [5], изображенную на фиг. 1 и содержащую следующие элементы, клонированные на векторе pUC19:
- фланги YlSFC1up и YlSFC1down - участки, гомологичные к областям хромосомы штамма Yarrowia lipolytica W29 YlAMPD выше и ниже, относительно рамки гена YlSFC1,
- селективный маркер URA3, ограниченный с двух сторон сайтами lox66 и lox71, узнаваемыми рекомбиназой Cre,
обрабатывают эндонуклеазой рестрикции EheI, и 1 мкг полученной делеционной кассеты f1YlYHM2-URA3 используют для трансформации штамма Yarrowia lipolytica W29 YlAMPD URA3- методом электропорации [9]. Трансформанты селектируют на минимальной среде YNBD (Himedia Μ139 с добавлением глюкозы 20 г/л) по прототрофности к урацилу и далее, методом ПЦР отбирают клоны, которые содержат делецию гена ΥlΥΗΜ2, используя праймеры:
CCCAGAACCTTCTTGCATTCCA (YlYhm2-conf-F)
CCTCCCACATGAGTCATGCTTCC (YlYhm2-conf-R)
В результате ПЦР с хромосомной ДНК клонов, содержащих делецию гена YlYHM2, получают продукт размером 3555 п. о. Один из отобранных клонов Y. lipolytica W29 YlAMPD dYlyhm2, содержащий делецию гена ΥlΥΗΜ2, используют в дальнейшей работе.
1.2 Усиление экспрессии гена YlSFC1
На базе штамма Y. lipolytica W29 YlAMPD dYlyhm2, аналогично примеру 1.1, получают ауксотрофный штамм Y. lipolytica YlAMPD dYlyhm2 URA3-.
Генетическую конструкцию pTEFin-uno-YlSFC1 [7], изображенную на фиг .2 и содержащую следующие элементы, клонированные на векторе pUC19:
- ген YlSFC1 под контролем промотора TEF1 и терминатора гена XPR2,
- селективный маркер URA3, ограниченный с двух сторон сайтами lox66 и lox71, узнаваемыми рекомбиназой Cre,
обрабатывают эндонуклеазами рестрикции SapI и EheI, и 2 мкг полученной экспрессионной кассеты TEFin-uno-YlSFC1 используют для трансформации штамма Y. lipolytica YlAMPD dYlyhm2 URA3- методом электропорации. Трансформанты отбирают на минимальной среде YNBD (Himedia M139 с добавлением глюкозы 20 г/л) по прототрофности к урацилу.
Культивирование отобранных трансформантов проводят в трех независимых повторностях в пробирках (50 мл) с рабочим объемом 10 мл при 30°С и постоянном перемешивании (250 об/мин) в течение 5 суток в среде YNBD9N0.2 (среда Himedia M151 с добавлением глюкозы 90 г/л, (NH4)2SO4 2 г/л, 100 мМ калий-фосфатного буфера рН=6.8). В качестве контролей используют штамм Y. lipolytica W29 YlAMPD dYlyhm2 и природный штамм Y. lipolytica. На вторые сутки культивирования для поддержания рН добавляют мел 200 мг.Пробы отбирают на пятые сутки культивирования. К культуральной жидкости добавляют равный объем 1М HCl, центрифугируют 1 мин (14500 об/мин), супернатант переносят в новую микропробирку и делают необходимые разведения. Количество продуцируемых изолимонной и лимонной кислот в супернатанте определяют с помощью метода высокоэффективной жидкостной хроматографии.
Лучший из отобранных трансформантов 583 имеет продукцию изолимонной кислоты 41.4 г/л. (табл.).
Этот трансформант депонирован в БРЦ ВКПМ НИЦ «Курчатовский институт» - ГосНИИгенетика (117545 Москва, 1-ый Дорожный пр-д, д.1) как штамм Yarrowia lipolytica 583 ВКПМ Y-4657.
Заявляемый штамм Yarrowia lipolytica 583 ВКПМ Y-4657 характеризуется следующими признаками:
Культурально-морфологические признаки
Суточная культура в жидкой среде YPD (мас. %: дрожжевой экстракт - 1, пептон - 2, глюкоза - 2, вода - остальное) представлена овальными, удлиненно-овальными, округлыми клетками размером 4.6-6.0×4.5-12.5 мкм. Почкование полярное или латеральное, на узком основании. К третьим суткам большинство клеток почкуются и образуют псевдомицелий. Колонии на агаризованной среде YPD кремового цвета, пастообразные, слегка приподнятые в центре, морщинистые, с фестончатым краем. Штрих на агаризованной среде YPD непрерывный, плоский, блестящий, кремово-белого цвета, пастообразный, края ровные, со временем становится складчатым. Спор не образует.
Физиолого-биохимические признаки
Облигатный аэроб. Сахара не сбраживает. Ассимилирует глюкозу, глицерин, этанол, ацетат, гидрофобные субстраты. Не ассимилирует: мальтозу, лактозу, целлобиозу, трегалозу, мелибиозу, раффинозу, мелицитозу, инулин, крахмал, D-ксилозу, L- и D-арабинозу, раммозу, дульцит, инозит, D-глюкозамин и глюкуроновую, 2-кетоглюконовую, 5-кетоглюконовую кислоты. Не ассимилирует нитраты. Не растет в безвитаминной среде, требует тиамин, не требует биотин. Оптимальное значение рН для роста 5,5-7,0. Не растет при 37°С. Максимальная температура роста 35°С.
Пример 2. Получение изолимонной кислоты путем культивирования заявляемого штамма Y. lipolytica 583 ВКПМ Y-4657
Культивирование штамма Y. lipolytica 583 ВКПМ Y-4657 проводят в 1-л ферментере Applikon BioBundle 1L с рабочим объемом 500 мл при температуре 29°С в минеральной среде следующего состава (мас. %): глюкоза - 4, (NH4)2SO4 - 0.3, MgSO4⋅7H2O - 0.14, NaCl - 0.05, Ca(NO3)2 - 0.08, KH2PO4 - 0.2, K2HPO4 - 0.02, биотин - 0.00005, тиамин - 0.001, вода - остальное. Концентрированный раствор микроэлементов следующего состава (мас. %): CuSO4⋅5H2O - 0,6, ΚΙ - 0.0088, MnSO4⋅5H2O - 0.3, Н3 ВО3 - 0.02, CoCl2⋅6H2O - 0.0955, ZnSO4⋅7H2O - 4.2, FeSO4⋅7H2O - 6.5, H2SO4 - 0.5, вода - остальное готовят отдельно и вносят в количестве 4.6 мл на 1 л рабочего объема. В качестве пеногасителя используют адеканоль (0.1% об./об.). Каждые 24 ч в ферментер вносят подпитку глюкозы (30 г/л). Раствор 5М NaOH используют для поддержания значения рН среды равного 5 на протяжении первых суток культивирования, затем значение рН=6 до конца культивирования. Уровень растворенного в среде кислорода составляет не менее 50%.
Подготовку посевной культуры проводят в два этапа:
- пересев штамма на агаризованную среду YPD;
- посев в жидкую среду YNBDbuf (среда Himedia Μ139 с добавлением глюкозы 20 г/л и 100 мМ калий-фосфатного буфера) в колбы с общим объемом 750 мл и рабочим объемом 70 мл и инкубация в течение 24 ч при 30°С и постоянном перемешивании (250 об/мин).
Посевную культуру вносят в ферментер в количестве 10% от рабочего объема. Отбор проб осуществляют каждые 24 ч.
Заявляемый штамм накапливает 136.7 г/л изолимонной кислоты за 166 ч культивирования, при этом соотношение изолимонная кислота / лимонная кислота достигает значения 7.4.
Таким образом, заявляемый штамм Y. lipolytica 583 ВКПМ Y-4657 с инактивированным геном YlYHM2 и усиленной экспрессией генов YlAMPD и YlSFC1, в условиях избытка источника углерода и лимита источника азота продуцирует в значительном количестве целевой продукт изолимонную кислоту при пониженном содержании примеси лимонной кислоты.
Список литературы
1. Aurich, Α., et al., Microbiologically produced carboxylic acids used as building blocks in organic synthesis. Subcell Biochem, 2012. 64: p. 391 - 423.
2. Kamzolova, S.V., et al., Isocitric acid production from rapeseed oil by Yarrowia lipolytica yeast. Appl Microbiol Biotechnol, 2013. 97(20): p. 9133-9144.
3. Nicaud, J.M., Yarrowia lipolytica. Yeast, 2012. 29(10): p. 409-418.
4. Beopoulos, Α., J.M. Nicaud, and C. Gaillardin, An overview of lipid metabolism in yeasts and its impact on biotechnological processes. Appl Microbiol Biotechnol, 2011. 90(4): p. 1193-1206.
5. Yuzbasheva, E.Y., et al., The mitochondrial citrate carrier in Yarrowia lipolytica: Its identification, characterization and functional significance for the production of citric acid. Metabolic Engineering, 2019. 54: p. 264-274.
6. Palmieri, F., et al., Identification of mitochondrial carriers in Saccharomyces cerevisiae by transport assay of reconstituted recombinant proteins. Biochim Biophys Acta, 2006. 1757(9-10): p. 1249-1262.
7. RU 2713124.
8. Yuzbasheva, E.Y., et al., Co-expression of glucose-6-phosphate dehydrogenase and acyl-CoA binding protein enhances lipid accumulation in the yeast Yarrowia lipolytica. N Biotechnol, 2017. 39: p. 18-21
9. Wang, J.-H., W. Hung, and S.-H. Tsai, High efficiency transformation by electroporation of Yarrowia lipolytica. The Journal of Microbiology, 2011. 49(3): p. 469-472.
| название | год | авторы | номер документа |
|---|---|---|---|
| Способ повышения продукции изолимонной кислоты у дрожжей Yarrowia lipolytica, дрожжи вида Yarrowia lipolytica, обладающие способностью к продукции изолимонной кислоты | 2018 |
|
RU2713124C2 |
| ДРОЖЖИ РОДА YARROWIA, ОБЛАДАЮЩИЕ СПОСОБНОСТЬЮ ВНУТРИКЛЕТОЧНО НАКАПЛИВАТЬ СЛОЖНЫЕ ЭФИРЫ ЖИРНЫХ КИСЛОТ, И СПОСОБ МИКРОБИОЛОГИЧЕСКОГО СИНТЕЗА ТАКИХ ЭФИРОВ | 2013 |
|
RU2539744C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ YARROWIA-LIPOLYTICA - ПРОДУЦЕНТ ЛИПАЗЫ | 2011 |
|
RU2451075C1 |
| ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ЛИПАЗЫ | 2007 |
|
RU2355754C1 |
| СПОСОБ ПОЛУЧЕНИЯ ЯНТАРНОЙ КИСЛОТЫ С ИСПОЛЬЗОВАНИЕМ ДРОЖЖЕЙ, ПРИНАДЛЕЖАЩИХ К РОДУ Yarrowia | 2009 |
|
RU2422526C2 |
| Штамм дрожжей Yarrowia lipolytica - продуцент линалоола | 2023 |
|
RU2819537C1 |
| Модифицированная нуклеотидная последовательность, кодирующая полипептид, обладающий активностью фитоен синтазы и геранилгеранилпирофосфат синтазы (варианты), ее использование при конструировании трансформантов дрожжей Yarrowia lipolytica, продуцирующих каротиноиды | 2021 |
|
RU2794980C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ФИТАЗЫ | 2012 |
|
RU2504579C2 |
| Штамм дрожжей Yarrowia lipolytica - продуцент янтарной кислоты (варианты) | 2016 |
|
RU2631922C1 |
| Промотор для экспрессии генов и его использование при конструировании трансформанта дрожжей Yarrowia lipolytica, продуцирующего β-каротин | 2022 |
|
RU2819535C1 |
Изобретение относится к микробиологии и представляет собой штамм дрожжей Yarrowia lipolytica 583 ВКПМ Y-4657 с инактивированным геном YlYHM2 и усиленной экспрессией генов YlAMPD и YlSFC1, продуцирующий изолимонную кислоту в условиях избытка источника углерода и лимита источника азота. Изобретение позволяет получать изолимонную кислоту с высокой степенью эффективности. 2 ил., 1 табл., 2 пр.
Штамм дрожжей Yarrowia lipolytica 583 ВКПМ Y-4657 с инактивированным геном ΥlΥΗΜ2 и усиленной экспрессией генов YlAMPD и YlSFC1, продуцирующий изолимонную кислоту в условиях избытка источника углерода и лимита источника азота.
| RU 2018126504 A, 20.01.2020 | |||
| Штамм дрожжей Yarrowia lipolytica - продуцент янтарной кислоты (варианты) | 2016 |
|
RU2631922C1 |
| РЕКОМБИНАНТНЫЙ ШТАММ ДРОЖЖЕЙ Yarrowia lipolytica - ПРОДУЦЕНТ ФИТАЗЫ | 2012 |
|
RU2504579C2 |
| Yuzbasheva E.Y | |||
| et al | |||
| The mitochondrial citrate carrier in Yarrowia lipolytica: Its identification, characterization and functional significance for the production of citric acid | |||
| Metabolic Engineering, 2019 | |||
| Видоизменение прибора для получения стереоскопических впечатлений от двух изображений различного масштаба | 1919 |
|
SU54A1 |
| Железнодорожный снегоочиститель | 1920 |
|
SU264A1 |
Авторы
Даты
2021-10-19—Публикация
2021-02-26—Подача