ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] По данной заявке испрашивается приоритет согласно 35 U.S.C. § 1 19(e) в соответствии с предварительной патентной заявкой США с Серийным № 61/791,600, поданной 15 марта 2013 г., содержание которой полностью включено в настоящее описание посредством ссылки.
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
[0002] В настоящем описании производится ссылка на список последовательностей, представленный в электронной Форме как файл ascii.txt под наименованием "2003080-0636_ST25" от 14 марта 2014 г. Файл с расширением.txt был создан 7 марта 2014 г. и имеет размер 100 кб.
ПРЕДШЕСТВУЮЩИЙ УРОВЕНЬ ТЕХНИКИ
[0003] Би- и мульти-специфические связующие средства разрабатываются в настоящее время для различных терапевтических, диагностических и исследовательских применений. Многие такие средства генерируют посредством ассоциации компонентов антител, которые нацеливают различные антигены друг на друга, например, в виде гибридных белков или посредством сшивки компонентов антител. Такие подходы, среди прочего, включали генерирование мультиспецифических антител посредством слияния клеток (например, гибридом), каждая из которых экспрессирует моноспецифическое антитело, химического конъюгирования двух или более моноспецифических антител и/или технологии рекомбинантных ДНК. Однако такие методы не лишены ограничений.
[0004] В частности, технология рекомбинантных ДНК позволила получить некоторые сконструированные антитела, которые являются мультиспецифическими и полифункциональными. С появлением молекул одноцепочечных Fv, было достигнуто много успехов в области сконструированных антител. Такие сконструированные антитела проявляли улучшенные свойства в сравнении с традиционными антителами, благодаря, по меньшей мере частично, полученным в результате уникальным форматам. Несмотря на то, что существуют несколько стратегий для конструирования средств из мультиспецифических антител, наибольшие усилия были сконцентрированы на улучшении лишь некоторых функциональных аспектов. В результате, большинство сконструированных белков, полученных из компонентов антител, не обладают всеми желательными функциональными свойствами, которые могли бы придавать им наибольшую фармакологическую значимость.
СУЩНОСТЬ ИЗОБРЕТЕНИЯ
[0005] Настоящее изобретение предоставляет, помимо прочего, улучшенные мульти-специфические связующие средства, которые включают компонент мультимеризации. Такие предоставленные средства имеют улучшенные функциональные характеристики по сравнению с родительскими связующими средствами, которые лишены таких компонентов мультимеризации.
[0006] В некоторых вариантах осуществления, предоставляемые средства состоят из индивидуальных полипептидов, каждый из которых включает по меньшей мере один, и, более обычно, по меньшей мере два или более связующих фрагментов, которые специфически взаимодействуют с конкретной мишенью. Во многих вариантах осуществления, такие связующие фрагменты представляют собой или содержат компоненты антител. Помимо прочего, в некоторых вариантах осуществления, настоящее изобретение предоставляет полипептиды, содержащие компонент антитела, имеющий аминокислотную последовательность, содержащую по меньшей мере связующие элементы антитела 5F11. В соответствии с настоящим изобретением, такие индивидуальные полипептиды в ряду предоставляемых средств конструируют для включения компонента мультимеризации. Во многих вариантах осуществления, такие полипептиды включают компонент димеризации. Во многих вариантах осуществления, компонент димеризации представляет собой элемент человеческого гепатоцитарного ядерного фактора-1 альфа.
[0007] В некоторых конкретных вариантах осуществления, описанных в данном документе, предоставляемые средства состоят из биспецифических полипептидов антител, сконструированных, чтобы содержать компонент мультимеризации.
[0008] В некоторых вариантах осуществления, настоящее изобретение предоставляет биспецифические связующие средства, состоящие из двух гибридных белков, каждый из которых содержит первый компонент антитела, который связывает первый антиген; второй компонент антитела, который связывает второй антиген, и компонент димеризации, содержащий элемент человеческого гепатоцитарного ядерного фактора-1 альфа (HNF-1α).
[0009] В некоторых вариантах осуществления, первый и второй антигены настоящего изобретения не являются идентичными. В некоторых вариантах осуществления, первый антиген настоящего изобретения представляет собой опухолевый антиген. В некоторых вариантах осуществления, опухолевый антиген ассоциируется с B-клеткой или T-клеткой. В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD2. В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD3.
[0010] В некоторых вариантах осуществления, второй антиген настоящего изобретения присутствует на Т-клетках. В некоторых вариантах осуществления, второй антиген настоящего изобретения представляет собой CD3.
[0011] В некоторых вариантах осуществления, компонент димеризации настоящего изобретения имеет последовательность, по меньшей мере приблизительно на 50% (например, по меньшей мере приблизительно на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентичную аминокислотным остаткам 1-32 человеческого HNF-1α (SEQ ID NO:1). В некоторых вариантах осуществления, домен димеризации настоящего изобретения имеет последовательность, которая является по существу идентичной аминокислотным остаткам 1-32 человеческого HNF-1α (SEQ ID NO:1). В некоторых вариантах осуществления, домен димеризации настоящего изобретения содержит аминокислотные остатки 1-32 человеческого HNF-1α (SEQ ID NO:1). В некоторых вариантах осуществления, домен димеризации настоящего изобретения представляет собой аминокислотные остатки 1-32 человеческого HNF-1α (SEQ ID NO:1).
[0012] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, по меньшей мере приблизительно на 50% (например, по меньшей мере приблизительно на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентичную SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 или SEQ ID NO:23.
[0013] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая является по существу идентичной SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 или SEQ ID NO:23.
[0014] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая является идентичной SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 или SEQ ID NO:23.
[0015] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения содержит последовательность, которую выбирают из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 и SEQ ID NO:23.
[0016] В некоторых вариантах осуществления, предоставлена фармацевтическая композиция, содержащая биспецифическое связующее средство настоящего изобретения и фармацевтически приемлемый носитель.
[0017] В некоторых вариантах осуществления, предоставлен гибридный белок, содержащий в направлении 5'-3', первый компонент антитела, второй компонент антитела и компонент димеризации, содержащий элемент человеческого гепатоцитарного ядерного фактора-1 альфа (HNF-1α). В некоторых вариантах осуществления, элемент человеческого HNF-1α содержит аминокислотные остатки 1-32 человеческого HNF-1α.
[0018] В некоторых вариантах осуществления, первый и второй компоненты антител гибридного белка настоящего изобретения представляют собой одноцепочечные вариабельные фрагменты (scFv).
[0019] В некоторых вариантах осуществления, первый scFv гибридного белка настоящего изобретения связывается с опухолевым антигеном. В некоторых вариантах осуществления, первый scFv гибридного белка настоящего изобретения связывается с опухолевым антигеном, который представляет собой GD2. В некоторых вариантах осуществления, первый scFv гибридного белка настоящего изобретения связывается с опухолевым антигеном, который представляет собой GD3.
[0020] В некоторых вариантах осуществления, второй scFv гибридного белка настоящего изобретения связывается с антигеном, присутствующим на Т-клетках. В некоторых вариантах осуществления, второй scFv гибридного белка настоящего изобретения связывается с антигеном, присутствующим на Т-клетках, который представляет собой CD3.
[0021] В некоторых вариантах осуществления, гибридный белок настоящего изобретения имеет последовательность по меньшей мере приблизительно на 50% (например, по меньшей мере приблизительно на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98%, или 99%) идентичную SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, или SEQ ID NO:23.
[0022] В некоторых вариантах осуществления, гибридный белок настоящего изобретения имеет последовательность, которая является по существу идентичной SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, или SEQ ID NO:23.
[0023] В некоторых вариантах осуществления, гибридный белок настоящего изобретения имеет последовательность, которая является идентичной SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22 или SEQ ID NO:23.
[0024] В некоторых вариантах осуществления, гибридный белок настоящего изобретения содержит последовательность, которую выбирают из SEQ ID NO:2, SEQ ID NO:3, SEQ ID NO:4, SEQ ID NO:5, SEQ ID NO:6, SEQ ID NO:7, SEQ ID NO:8, SEQ ID NO:9, SEQ ID NO:10, SEQ ID NO:11, SEQ ID NO:12, SEQ ID NO:13, SEQ ID NO:14, SEQ ID NO:15, SEQ ID NO:16, SEQ ID NO:17, SEQ ID NO:18, SEQ ID NO:19, SEQ ID NO:20, SEQ ID NO:21, SEQ ID NO:22, и SEQ ID NO:23.
[0025] В некоторых вариантах осуществления, предоставлено димерное биспецифическое связующее средство, состоящее из двух гибридных белков настоящего изобретения.
[0026] В некоторых вариантах осуществления, предоставлена фармацевтическая композиция, содержащая димерное биспецифическое связующее средство, которое состоит из двух гибридных белков настоящего изобретения и фармацевтически приемлемого носителя.
[0027] В некоторых вариантах осуществления, предоставлена последовательность нуклеиновой кислоты, кодирующая гибридный белок настоящего изобретения.
[0028] В некоторых вариантах осуществления, предоставлен вектор, содержащий последовательность нуклеиновой кислоты настоящего изобретения.
[0029] В некоторых вариантах осуществления, предоставлена клетка-хозяин, содержащая вектор настоящего изобретения. В некоторых вариантах осуществления, клетку-хозяина настоящего изобретения выбирают из группы, состоящей из бактериальной, дрожжевой клетки, клетки насекомых или клетки млекопитающих. В некоторых вариантах осуществления, клетку-хозяина настоящего изобретения выбирают из группы, состоящей из клеток E. coli, Pichia pastoris, Sf9, COS, HEK293 и CHO.
[0030] В некоторых вариантах осуществления, предоставлен способ продуцирования димерного биспецифического связующего средства настоящего изобретения, способ, включающий культивирование клеток-хозяев, содержащих вектор, содержащий последовательность нуклеиновой кислоты, которая кодирует гибридный белок настоящего изобретения при условиях, подходящих для экспрессии димерного биспецифического связующего средства, и извлечение димерного биспецифического связующего средства.
[0031] В некоторых вариантах осуществления, в способе предоставления высокоаффинной композиции биспецифического антитела, содержащей биспецифическое средство из антитела, которое включает первый и второй компоненты антител, предоставлено усовершенствование, указанное усовершенствование включает в себя предоставление по меньшей мере одного из таких первого и второго компонентов антител в виде гибрида с компонентом димеризации, состоящим из элемента димеризации человеческого HNF-1α, таким образом, что гибрид компонент антитела - компонент димеризации обладает способностью к образованию гомодимера. В некоторых вариантах осуществления, компонент димеризации настоящего изобретения содержит аминокислотные остатки 1-32 человеческого HNF-1α.
[0032] В некоторых вариантах осуществления, предоставлен способ уничтожения опухолевых клеток, способ, включающий стадии контактирования опухолевых клеток с биспецифическим связующим средством, состоящим из двух гибридных белков, каждый из которых содержит, в направлении 5'-3', первый компонент антитела, который связывается с опухолевым антигеном, второй компонент антитела который связывается с CD3 на Т-клетках, и компонент димеризации, содержащий элемент человеческого HNF-1α, таким образом, что биспецифическое связующее средство способно к димеризации с образованием гомодимера, причем контактирование выполняют при условиях и в течение времени, достаточных, чтобы Т-клетки, с которыми связался гомодимер, опосредовали уничтожение опухолевых клеток. В некоторых вариантах осуществления, компонент димеризации настоящего изобретения содержит аминокислотные остатки 1-32 человеческого HNF-1α. В некоторых вариантах осуществления, первый и второй компоненты антитела биспецифического связующего средства настоящего изобретения представляют собой одноцепочечные вариабельные фрагменты (scFv). В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD2. В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD3.
[0033] В некоторых вариантах осуществления, предоставлен способ ингибирования роста опухоли, способ, включающий стадии контактирования опухоли с биспецифическим связующим средством, состоящим из двух гибридных белков, каждый из которых содержит, в направлении 5'-3', первый компонент антитела, который связывается с опухолевым антигеном, второй компонент антитела, который связывается с CD3 на Т-клетках, и компонент димеризации, содержащий элемент человеческого HNF-1α, таким образом, что биспецифическое антитело способно к димеризации с образованием гомодимера, причем контактирование выполняется при условиях и в течение времени, достаточных, чтобы Т-клетки, с которыми связался гомодимер, ингибировали рост опухоли. В некоторых вариантах осуществления, домен димеризации настоящего изобретения содержит аминокислотные остатки 1-32 человеческого HNF-1α. В некоторых вариантах осуществления, первый и второй компоненты антитела биспецифического связующего средства настоящего изобретения представляют собой одноцепочечные вариабельные фрагменты (scFvs). В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD2. В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD3.
[0034] В некоторых вариантах осуществления, предоставлено биспецифическое связующее средство, состоящее из двух гибридных белков, каждый из которых содержит, в направлении 5'-3', первый компонент антитела, который связывается с опухолевым антигеном, второй компонент антитела, который связывается с CD3 на Т-клетках, и компонент димеризации, содержащий элемент человеческого HNF-1α, таким образом, что биспецифическое связующее средство способно к димеризации с образованием гомодимера; где гомодимер характеризуется более длительным временем полужизни в сравнении с иным сравниваемым биспецифическим связующим средством, которое не содержит компонента димеризации. В некоторых вариантах осуществления, компонент димеризации настоящего изобретения содержит аминокислотные остатки 1-32 человеческого HNF-1α. В некоторых вариантах осуществления, первый и второй компоненты антитела биспецифического связующего средства настоящего изобретения представляют собой одноцепочечные вариабельные фрагменты (scFv). В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD2. В некоторых вариантах осуществления, опухолевый антиген настоящего изобретения представляет собой GD3.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖА
[0035] Чертеж, включенный в данное описание, который состоит из следующих фигур, представлен только с целью иллюстрации, но не для ограничения.
[0036] ФИГ.1 показывает схематичекие иллюстрации, без соблюдения масштаба, scFv5F11-scFvOKT3 (GD2xCD3) и димерного scFv5F11-scFvOKT3-HDD биспецифических связующих средств.
[0037] ФИГ.2A показывает кривые связывания при ELISA связывания GD2 (верх) и связывания CD3 на клетках Jurkat (низ) для GD2×CD3 и GD2×CD3-HDD биспецифических связующих средств.
[0038] ФИГ.2B показывает связывание CD3 на клетках Jurkat для GD2×CD3 и GD2×CD3-HDD биспецифических связующих средств.
[0039] ФИГ.3A и 3B показывает сенсограммы Biacore связывания GD2 для GD2×CD3 и GD2×CD3-HDD биспецифических связующих средств. Кривые показаны при следующих концентрациях биспецифического антитела: 62,5, 125, 250, 500, 1000, 2000 нМ.
[0040] ФИГ.4 показывает процент опосредованного Т-клетками уничтожения клеточных линий меланомы и нейробластомы in vitro для GD2×CD3 и GD2×CD3-HDD биспецифических связующих средств.
[0041] ФИГ.5 показывает объем опухоли (мм3) подкожных опухолей SKNLD, имплантированных мышам BALB/cA-Rag2KO/IL-2RγKO (DKO), при контроле (без обработки), обработанных GD2×CD3, и GD2×CD3-HDD групп ксенотрансплантатной исследовательской модели опухоли.
[0042] ФИГ.6 показывает объем опухоли (мм3) подкожных M14 опухолей, имплантированным мышам BALB/cA-Rag2KO/IL-2RγKO (DKO) при контроле (без обработки), обработанных GD2×CD3, и GD2×CD3-HDD групп ксенотрансплантатной исследовательской модели опухоли.
[0043] ФИГ.7 показывает кривые связывания при ELISA при связывании GD2 для 3LHBT и 3LHBT-HDD биспецифических связующих средств.
[0044] ФИГ.8 показывает кривые связывания при ELISA при связывании GD2 для GD2×CD3 биспецифических связующих средств с различными доменами димеризации.
[0045] ФИГ.9 показывает процент опосредованного Т-клетками уничтожения клеточных линий меланомы и нейробластомы in vitro для GD2×CD3 биспецифических связующих средств с различными доменами димеризации.
ПОДРОБНОЕ ОПИСАНИЕ НЕКОТОРЫХ ВАРИАНТОВ ОСУЩЕСТВЛЕНИЯ
[0046] Настоящее изобретение не ограничено конкретными способами, и описанными условиями экспериментов, так как такие способы и условия могут видоизменяться. Также следует понимать, что терминология, используемая в данном документе, служит цели описания только конкретных вариантов осуществления, и не подразумевается как ограничивающая, если не указано, поскольку объем настоящего изобретения будет ограничен только прилагаемой формулой изобретения.
[0047] Если не утверждается иначе, все технические и научные термины и фразы, используемые в данном документе, имеют такое же значение, какое обычно является понятным рядовому специалисту в области. Хотя любые методы и материалы, аналогичные или эквивалентные описанным в данном документе, могут применяться при практической реализации или тестировании настоящего изобретения, ниже будут описаны предпочтительные способы и материалы. Все публикации, указанные в данном документе, включены в настоящее описание посредством ссылки.
ОПРЕДЕЛЕНИЯ
[0048] Чтобы упростить понимание настоящего изобретения, сначала ниже определяют некоторые термины. Дополнительные определения следующих терминов и других терминов приведены по всему объему описания.
[0049] Как применяют в данном описании и прилагаемой формуле изобретения, формы единственного числа "a", "an" и "the" включают ссылки на форму множественного числа, если по контексту явным образом не следует иное. Таким образом, например, ссылка на "способ" включает один или более способов, и/или стадий типа, описанного в данном документе, и/или который станет очевидным специалистам в данной области при прочтении данного раскрытия и т.д.
[0050] "Созревшая аффинность" (или “антитело с созревшей аффинностью”), как используют в данном документе, относится к антителу с одним или более изменениями в одной или более из его CDR, которые приводят к улучшению аффинности антитела к антигену, в сравнении с родительским антителом, которое не обладает этими изменением(изменениями). В некоторых вариантах осуществления, антитела с созревшей аффинностью будут иметь наномолярные или даже пикомолярные значения аффинности к целевому антигену. Антитела с созревшей аффинностью могут быть получены посредством любой из разнообразных методик, известных к области. Marks et al. BioTechnology 10: 779-783 (1992) описывает созревание аффинности посредством перетасовки VН и VL доменов. Случайный мутагенез CDR и/или остатков каркаса описан в: Barbas et al. Proc Nat. Acad. Sci, USA 91: 3809-3813 (1994); Schier et al. Gene 169: 147-155 (1995); Yelton et al. J. Immunol. 155: 1994-2004 (1995); Jackson et al., J. Immunol. 154(7):3310-9 (1995); и Hawkins et al, J. Mol. Biol. 226: 889-896 (1992).
[0051] "Антитело", как используют в данном документе, имеет свое значение, понимаемое в данной области, и относится к иммуноглобулину (Ig), который связывается специфически с конкретным антигеном. Как известно рядовым специалистам в данной области, антитела, продуцируемые в природе, типовым образом состоят из четырех полипептидных цепей, двух тяжелых (H) цепей и двух легких (L) цепей. Каждая тяжелая и легкая цепь состоит из вариабельной области (сокращенно обозначенной в данном документе как HCVR или VH и LCVR или VL, соответственно) и константной области. Константная область тяжелой цепи содержит CH1, CH2 и CH3 домен (и необязательно CH4 домен в случае IgM и IgE). Константная область легкой цепи состоит из одного домена, CL. VH и VL области дополнительно содержат области гипервариабельности, под названием области, определяющие комплементарность (CDR), вперемежку с областями, которые являются более консервативными, называемыми каркасными областями (FR). Каждая VH и VL составлена из трех CDR и четырех FR, расположенных от амино-конца к карбокси-концу в следующем порядке: FR1, CDR1, FR2, CDR2, FR3, CDR3, FR4.
Иммуноглобулиновые молекулы могут принадлежать к любому типу (например, IgM, IgD, IgG, IgA и IgE), классу (например, IgG1, IgG2, IgG3, IgG4, IgA1 и IgA2) или подклассу.
[0052] "Компонент антитела", как используют в данном документе, относится к полипептидному элементу (который может быть полным полипептидом, или частью более крупного полипептида, такого как, например, гибридный полипептид, описанный в данном документе), который специфически связывается с эпитопом или антигеном и включает один или более структурных признаков иммуноглобулина. В целом, компонент антитела представляет собой любой полипептид, чья аминокислотная последовательность включает элементы, характеристические для области связывания антитела (например, легкую цепь или вариабельную область антитела или одну или более его областей, определяющих комплементарность ("CDR"), или тяжелую цепь или вариабельную область антитела или одну или более его CDR, необязательно в присутствии одной или более каркасных областей). В некоторых вариантах осуществления, компонент антитела представляет собой или содержит непроцессированное антитело. В некоторых вариантах осуществления, компонент антитела является меньшим, чем непроцессированное антитело, но включает по меньшей мере один участок связывания (содержащий по меньшей мере одну, и предпочтительно по меньшей мере две последовательности со структурой известных "вариабельных областей") антитела. В некоторых вариантах осуществления, термин “компонент антитела” охватывает любой белок, имеющий домен связывания, который является гомологичным или в значительной степени гомологичным иммуноглобулин-связывающему домену. В конкретных вариантах осуществления, включенный "компонент антитела" охватывает полипептиды, имеющие домен связывания, который показывает по меньшей мере 99% идентичность с доменом связывания иммуноглобулина. В некоторых вариантах осуществления, включенный "компонент антитела" представляет собой любой полипептид, имеющий домен связывания, который показывает по меньшей мере 70%, 75%, 80%, 85%, 90%, 95% или 98% идентичности с доменом связывания иммуноглобулина, например, ссылочный домен связывания иммуноглобулина. Включенный "компонент антитела" может иметь аминокислотную последовательность, идентичную аминокислотной последовательности антитела (или его части, например, его антиген-связывающей части), которая обнаруживается в природном источнике. Компонент антитела может быть моноспецифическим, би-специфическим или мульти-специфическим. Компонент антитела может включать структурные элементы, характеристические для любого класса иммуноглобулинов, включая любой из человеческих классов: IgG, IgM, IgA, IgD и IgE. Было показано, что антиген-связывающая функция антитела может выполняться фрагментами непроцессированного антитела. Такие варианты осуществления антитела могут также быть биспецифическими, иметь форматы двойной специфичности или мульти-специфичности; специфически связываясь с двумя или более различными антигенами. Примеры фрагментов связывания, охватываемых термином “антиген-связывающая часть” антитела, включают (i) Fab фрагмент, моновалентный фрагмент, состоящий из VH, VL, CH1 и CL доменов; (ii) F(ab')2 фрагмент, бивалентный фрагмент, содержащий два Fab фрагмента, связанные посредством дисульфидного мостика в шарнирной области; (iii) Fd фрагмент, состоящий из VH и CH1 доменов; (iv) Fv фрагмент, состоящий из VH и VL доменов единственного плеча антитела, (v) dAb фрагмент (Ward et al, (1989) Nature 341: 544-546), который содержит единственный вариабельный домен; и (vi) изолированную область, определяющую комплементарность (CDR). Кроме того, несмотря на то, что два домена Fv фрагмента, VH и VL, кодируются отдельными генами, они могут быть соединены, с использованием рекомбинантных методов, посредством синтетического линкера, который позволяет им быть полученными в виде единственной белковой цепи, в которой VH и VL области спариваются с образованием моновалентных молекул (известных как одноцепочечные Fv (scFv); см., например, Bird et al. (1988) Science 242: 423-426; и Huston et al. (1988) Proc. Natl. Acad. Sci. USA 85: 5879-5883). В некоторых вариантах осуществления, "компонент антитела", описанный в данном документе, представляет собой такое одноцепочечное антитело или содержит его. В некоторых вариантах осуществления, "компонент антитела" представляет собой диатело или содержит его. Диатела представляют собой бивалентные, биспецифические антитела, в которых VH и VL домены экспрессируются на единственной полипептидной цепи, но с использованием линкера, который является слишком коротким, чтобы обеспечить спаривание между двумя доменами на одной и той же цепи, таким образом, принуждая домены спариваться с комплементарными доменами еще одной другой цепи и создавая два антигенсвязывающих участка (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R. J., et al. (1994) Structure 2: 1121-1123). Такие части связывания антитела известны в данной области (Kontermann and Dubel eds., Antibody Engineering (2001) Springer-Verlag. New York. 790 pp. (ISBN 3-540-41354-5). В некоторых вариантах осуществления, компонент антитела представляет собой или содержит одноцепочечное "линейное антитело", содержащее пару тандемных Fv сегментов (VH-CH1-VH-CH1), которые, вместе с комплементарными полипептидами легкой цепи, образуют пару антиген-связывающих областей (Zapata et al. Protein Eng. 8(10): 1057-1062 (1995); и Патент США № 5,641,870). В некоторых вариантах осуществления, компонент антитела может иметь структурные элементы, характеристические для химерных или гуманизированных антител. В целом, гуманизированные антитела представляют собой человеческие иммуноглобулины (реципиентное антитело), в которых остатки из области, определяющей комплементарность (CDR) реципиента, заменяют на остатки из CDR нечеловеческого вида (донорного антитела), такого как мышь, крыса или кролик, имеющей желательную специфичность, аффинность и активность. В некоторых вариантах осуществления, компонент антитела может иметь структурные элементы, характеристические для человеческого антитела.
[0053] "Биологическая активность", как используют в данном документе, относится к наблюдаемому биологическому эффекту или результату, достигаемому средством или объектом, представляющим интерес. Например, в некоторых вариантах осуществления, взаимодействие специфического связывания является биологической активностью. В некоторых вариантах осуществления, модуляция (например, индукция, усиление или ингибирование) биологического пути или события представляет собой биологическую активность. В некоторых вариантах осуществления, наличие или степень биологической активности оценивают посредством обнаружения непосредственного или косвенного продукта, производимого посредством биологического пути или события, представляющих интерес.
[0054] "Биспецифическое антитело", как используют в данном документе, относится к биспецифическому связующему средству, в котором по меньшей мере один, и типично оба из связующих фрагментов являются компонентом антитела или содержат его. Разнообразные различные структуры биспецифических антител являются известными в данной области. В некоторых вариантах осуществления, каждый фрагмент связывания в биспецифическом антителе, который представляет собой компонент антитела или содержит его, включает VH и/или VL области; в некоторых таких вариантах осуществления, VH и/или VL области являются такими областями, обнаруживаемыми в конкретном моноклональном антителе. В некоторых вариантах осуществления, где биспецифическое антитело содержит два связующих фрагмента компонента антитела, каждый из них включает VH и/или VL области из различных моноклональных антител.
[0055] "Биспецифическое связующее средство", как используют в данном документе, относится к полипептидному средству с двумя дискретными связующими фрагментами, каждый из которых связывается с раздельной мишенью. В некоторых вариантах осуществления, биспецифическое связующее средство представляет собой одиночный полипептид; в некоторых вариантах осуществления, биспецифическое связующее средство представляет собой множество пептидов или содержит его, которые, в некоторых таких вариантах осуществления могут быть ковалентно ассоциированы друг с другом, например, посредством сшивки. В некоторых вариантах осуществления, два связующих фрагмента биспецифического связующего средства распознают различные участки (например, эпитопы) одной и той же мишени (например, антигена); в некоторых вариантах осуществления, они распознают различные мишени. В некоторых вариантах осуществления, биспецифическое связующее средство способно к связыванию одновременно с двумя мишенями, которые имеют различную структуру.
[0056] "Носитель", как используют в данном документе, относится к разбавителю, адъюванту, эксципиенту или среде, вместе с которыми композицию вводят. В некоторых примерных вариантах осуществления, носители могут включать стерильные жидкости, такие как, например, воду и масла, включая масла нефтяного, животного, растительного или синтетического происхождения, такие как, например, арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. В некоторых вариантах осуществления, носители представляют собой один или более твердых компонентов или включают их.
[0057] "CDR", как используют в данном документе, относится к области, определяющей комплементарность внутри вариабельной области антитела. Существуют три CDR в каждой из вариабельных областей тяжелой цепи и легкой цепи, которые обозначают CDR1, CDR2 и CDR3, для каждой из вариабельных областей. "Набор CDR" или "CDR набор" относится к группе из трех или шести CDR, которые находятся либо в единственной вариабельной области, способной к связыванию антигена или CDR вариабельных областей когнатных тяжелой и легкой цепи, способных к связыванию антигена. Границы CDR были определены различно, в зависимости от систем, несколько из которых известны в данной области (например, Кабат, Чотиа и т.д.).
[0058] "CDR-привитое антитело", как используют в данном документе, относится к антителу, чья аминокислотная последовательность содержит последовательности вариабельной области тяжелой и легкой цепи от одного вида, но в котором последовательности одной или более CDR областей VH и/или VL заменяют на CDR последовательности еще одного вида, такие как антитела, имеющие мышиные VH и VL области, в которых одну или более мышиных CDR (например, CDR3) заменяют на человеческие CDR последовательности. Аналогично, "CDR-привитое антитело" может также относиться к антителам, имеющим человеческие VH и VL области, в которых одна или более из человеческих CDR (например, CDR3) были заменены на последовательности мышиных CDR.
[0059] "Химерное антитело", как используют в данном документе, относится к антителу, чья аминокислотная последовательность включает последовательности VH и VL областей, которые обнаруживаются в первом виде, и последовательности константных областей, которые обнаруживаются во втором виде, отличающемся от первого вида. Во многих вариантах осуществления, химерное антитело имеет мышиные VH и VL области, связанные с человеческими константными областями. В некоторых вариантах осуществления, антитело с человеческими VH и VL областями, связанными с нечеловеческими константными областями (например, мышиной константной областью), называют "обратным химерным антителом".
[0060] "Сравнимые", как используют в данном документе, относится к двум или более средствам, объектам, ситуациям, наборам условий и т.д., которые могут не являться идентичными друг другу, но которые являются достаточно сходными, чтобы обеспечить сравнение между ними таким образом, что могут обоснованно быть сделаны выводы на основании наблюдаемых различий или сходных признаков. Рядовые специалисты в области смогут понять, по контексту, какая степень идентичности требуется при любом данном обстоятельстве для двух или более таких средств, объектов, ситуаций, наборов условий и т.д., чтобы их считать сравнимыми.
[0061] "Компонент димеризации", как используют в данном документе, относится к полипептидному элементу который, при включении в полипептидную цепь, опосредует нековалентную ассоциацию этой цепи с одним или более другими полипептидами, также содержащими компонент димеризации, в комплекс более высокого порядка. Там, где взаимодействующие полипептидные цепи имеют идентичные последовательности, полученный в результате ассоциированный комплекс более высокого порядка называют "гомодимером" (или "гомомультимером", если включены более двух цепей; там, где взаимодействующие полипептидные цепи имеют различные последовательности, полученный в результате ассоциированный комплекс называют "гетеродимером" (или "гетеромультимером"). В некоторых вариантах осуществления, компонент димеризации имеет по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более аминокислот по длине. Описанное в данном документе, число потенциальных компонентов димеризации известно в данной области. В некоторых вариантах осуществления, компонент димеризации может включать участок для ковалентной ассоциации, например, посредством образования дисульфидной связи. В некоторых вариантах осуществления, компонент димеризации для применения в соответствии с настоящим изобретением представляет собой или содержит элемент, обнаруженный в человеческом HNF-1α, который опосредует димеризацию, когда его вводят в полипептид, отличающийся от HNF-1α.
[0062] "Эпитоп", как используют в данном документе, включает любой фрагмент, который специфически распознается иммуноглобулиновым (например, антителом или рецептором) связующим компонентом. В некоторых вариантах осуществления, эпитоп состоит из множества химических атомов или групп на антигене. В некоторых вариантах осуществления, такие химические атомы или группы являются экспонированными на поверхности, когда антиген принимает соответствующую трехмерную конформацию. В некоторых вариантах осуществления, такие химические атомы или группы являются физически близкими друг к другу в пространстве, когда антиген принимает такую конформацию. В некоторых вариантах осуществления, по меньшей мере некоторые такие химические атомы или группы являются физически отделенными друг от друга, когда антиген принимает альтернативную конформацию (например, является линеаризованным).
[0063] "Эксципиент", как используют в данном документе, относится к нетерапевтическому средству, которое может быть включено в фармацевтическую композицию, например, чтобы обеспечить желательную консистенцию или стабилизирующий эффект или способствовать им. Подходящие фармацевтические эксципиенты включают, например, крахмал, глюкозу, лактозу, сахарозу, желатин, солод, рис, муку, мел, силикагель, стеарат натрия, моностеарат глицерина, тальк, хлорид натрия, сухое обезжиренное молоко, глицерин, пропиленгликоль, воду, этанол и т.п.
[0064] "Каркас" или "каркасная область", как используют в данном документе, относится к последовательностям вариабельной области минус CDR. Так как последовательность CDR может быть определена посредством различных систем, аналогично, каркасная последовательность является субъектом соответственно различных интерпретаций. Шесть CDR делят каркасные области в тяжелых и легких цепях на четыре подобласти (FR1, FR2, FR3 и FR4) в каждой цепи, в которой CDR1 расположена между FRl и FR2, CDR2 между FR2 и FR3, и CDR3 между FR3 и FR4. Без установления конкретной подобласти, как FR1, FR2, FR3 или FR4, каркасная область, как называют иначе, представляет комбинированную FR в вариабельной области единственной, природной иммуноглобулиновой цепи. Как используют в данном документе, FR представляет одну из четырех подобластей, FR1, например, представляет первую каркасную область, наиболее близкую к аминотерминальному концу вариабельной области и 5' по отношению к CDR1, а FR представляет две или более подобластей, составляющих каркасную область.
[0065] "Клетка-хозяин", как используют в данном документе, относится к клетке, в которую была введена экзогенная ДНК (рекомбинантная или иная). Квалифицированные специалисты при прочтении данного раскрытия смогут понять, что такие термины относятся не только к конкретной субъектной клетке, но, потомству таких клеток. Поскольку в последующих поколениях могут происходить некоторые модификации вследствие либо мутаций или воздействия факторов окружающей среды, такое потомство может, фактически, не являться идентичным родительской клетке, но все еще является включенным в пределы охвата термина “клетка-хозяин”, используемого в данном документе. В некоторых вариантах осуществления, клетки-хозяева включают прокариотные и эукариотные клетки, выбранные из любых царств жизненных форм, которые являются подходящими для экспрессирования экзогенной ДНК (например, последовательности рекомбинантной нуклеиновой кислоты). Иллюстративные клетки включают клетки прокариотов и эукариотов (одноклеточных или многоклеточных), бактериальные клетки (например, штаммы E. coli, Bacillus spp., Streptomyces spp., и т.д.), микобактериальные клетки, грибковые клетки, дрожжевые клетки (например, S. cerevisiae, S. pombe, P. pastoris, P. methanolica и т.д.), растительные клетки, клетки насекомых (например, SF-9, SF-21, клетки насекомых, инфицированные бакуловирусом, Trichoplusia ni и т.д.), нечеловеческие животные клетки, человеческие клетки, или клеточные гибриды, такие как, например, гибридомы или квадромы. В некоторых вариантах осуществления, клетка представляет собой клетку человека, обезьяны, человекообразной обезьяны, хомяка, крысы, или мышиную клетку. В некоторых вариантах осуществления, клетка является эукариотной, и ее выбирают из следующих клеток: CHO (например, CHO K1, DXB-11 CHO, Veggie-CHO), COS (например, COS-7), клетки сетчатки, Vero, CV1, почки (например, HEK293, 293 EBNA, MSR 293, MDCK, HaK, BHK), He1α, HepG2, WI38, MRC 5, Colo205, HB 8065, HL-60 (например, BHK21), Jurkat, Daudi, A431 (эпидермальной), CV-1, U937, 3T3, L-клетки, клетки C127, SP2/0, NS-0, MMT 060562, клетки Сертоли, клетки BRL 3, клетки HT1080, клетки миеломы, опухолевой клетки, и клеточной линии, производной от вышеуказанной клетки. В некоторых вариантах осуществления, клетка содержит один или более вирусных генов, например, клетка сетчатки, которая экспрессирует вирусный ген (например, клетка PER.C6™).
[0066] "Человеческое антитело", как используют в данном документе, предназначено для включения антител, имеющих вариабельные и константные области, генерируемые (или собранные) из последовательностей человеческих иммуноглобулинов. В некоторых вариантах осуществления, антитела (или компоненты антител) могут считаться "человеческими", даже, несмотря на то, что их аминокислотные последовательности включают остатки или элементы, не кодируемые иммуноглобулиновыми последовательностями человеческих зародышевых линий (например, включают вариации последовательности, например, которые могут (исходно) быть включены посредством случайного или сайт-специфического мутагенеза in vitro или посредством соматической мутации in vivo), например в одну или более CDR и, в частности, CDR3.
[0067] "Гуманизированные", как известно в данной области, термин “гуманизированные” обычно применяют для наименования антител (или компонентов антител), чья аминокислотная последовательность включает последовательности VH и VL области из референтного антитела, появляющегося у нечеловеческого вида (например, мыши), но также включает модификации в этих последовательностях относительно референтного антитела, предназначенного для придания им больше "человекоподобия", т.е., большего сходства с вариабельными последовательностями человеческой зародышевой линии. В некоторых вариантах осуществления, "гуманизированное" антитело (или компонент антитела) представляет собой антитело, которое иммуноспецифически связывается с антигеном, представляющим интерес, и, которое имеет каркасную (FR) область, имеющую по существу аминокислотную последовательность такую же, как у человеческого антитела, и область, определяющую комплементарность (CDR), имеющую по существу аминокислотную последовательность, такую же, как у нечеловеческого антитела. Гуманизированное антитело содержит по существу все из по меньшей мере одного, и типично двух, вариабельных доменов (Fab, Fab', F(ab')2, FabC, Fv) в которых все или по существу все из CDR областей соответствуют таким областям нечеловеческого иммуноглобулина (т.е., донорного иммуноглобулина) и все или по существу все из каркасных областей являются каркасными областями консенсусной области человеческого иммуноглобулина. В некоторых вариантах осуществления, гуманизированное антитело также содержит по меньшей мере часть константной области иммуноглобулина (Fc), обычно такую часть константной области человеческого иммуноглобулина. В некоторых вариантах осуществления, гуманизированное антитело содержит легкую цепь, а также по меньшей мере вариабельный домен тяжелой цепи. Антитело может включать CH1, шарнирную, CH2, CH3, и, необязательно, CH4 область константной области тяжелой цепи. В некоторых вариантах осуществления, гуманизированное антитело содержит только гуманизированную VL область. В некоторых вариантах осуществления, гуманизированное антитело содержит только гуманизированную VH область. В некоторых нескольких вариантах осуществления, гуманизированное антитело содержит гуманизированные VH и VL области.
[0068] "Изолированное", как используют в данном документе, относится к веществу и/или объекту, которые были (1) отделены от по меньшей мере нескольких компонентов, с которыми они были ассоциированы при первоначальном получении (либо в природе и/или в экспериментальной установке), и/или (2) сконструированы, продуцированы, получены и/или изготовлены посредством человеческих рук. Изолированные вещества и/или объекты могут быть отделены от приблизительно 10%, приблизительно 20%, приблизительно 30%, приблизительно 40%, приблизительно 50%, приблизительно 60%, приблизительно 70%, приблизительно 80%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99% или более чем приблизительно 99% других компонентов, с которыми они были первоначально ассоциированы. В некоторых вариантах осуществления, изолированные средства являются на приблизительно 80%, приблизительно 85%, приблизительно 90%, приблизительно 91%, приблизительно 92%, приблизительно 93%, приблизительно 94%, приблизительно 95%, приблизительно 96%, приблизительно 97%, приблизительно 98%, приблизительно 99%, или более чем приблизительно 99% чистыми. Как используют в данном документе, вещество является "чистым", если оно по существу не содержит других компонентов. В некоторых вариантах осуществления, как будет понятно квалифицированным специалистам в данной области, вещество может все еще считаться "изолированным" или даже "чистым", после объединения с некоторыми другими компонентами, такими как, например, один или более носители или эксципиенты (например, буфером, растворителем, водой и т.д.); в таких вариантах осуществления, процент выделения или чистоту вещества рассчитывают без включения таких носителей или эксципиентов. Чтобы привести лишь один пример, в некоторых вариантах осуществления, биологический полимер, такой как полипептид или полинуклеотид, который встречается в природе, считается "изолированным" когда, a) по причине своего происхождения или источника деривации не является ассоциированным с некоторыми или всеми компонентами, которые сопровождают его в нативном состоянии в природе; b) он по существу не содержит других полипептидов или нуклеиновых кислот того же самого вида, отличного от вида, который продуцирует его в природе; c) экспрессируется или иным образом находится в ассоциации с компонентами из клетки или другой системой экспрессии, которая не принадлежит к виду, который продуцирует его в природе. Таким образом, например, в некоторых вариантах осуществления, полипептид, который синтезирован химически или синтезируется в клеточной системе, отличающейся от клеточной системы, которая продуцирует его в природе, считается "изолированным" полипептидом. Альтернативно или дополнительно, в некоторых вариантах осуществления, полипептид, который был подвергнут одному или более методам очистки, может считаться "изолированным" полипептидом в той степени, в которой он был отделен от других компонентов a) с которыми он ассоциирован в природе; и/или b) с которыми он был ассоциирован при первоначальном получении.
[0069] "KD", как используют в данном документе, относится к константе диссоциации связующего средства (например, антитела или его компонента связывания) из комплекса с его партнером (например, эпитопом с которым связываются антитело или его компонент связывания).
[0070] "Koff, как используют в данном документе, относится к константе скорости диссоциации для диссоциации связующего средства (например, антитела или его компонента связывания) из комплекса с его партнером (например, эпитопом с которым связывается антитело или его компонент связывания).
[0071] "Kon", как используют в данном документе, относится к константе скорости ассоциации для ассоциации связующего средства (например, антитела или его компонента связывания) с его партнером (например, эпитопом, с которым связывается антитело или его компонент связывания).
[0072] "Линкер", как используют в данном документе, применяют для обозначения той части мультиэлементного полипептида, которая связывает различные элементы друг с другом. Например, рядовые специалисты в данной области смогут оценить, что полипептид, чья структура включает два или более функциональных или организационных домена, часто включает растяжку из аминокислот между такими доменами, которая связывает их друг с другом. В некоторых вариантах осуществления, полипептид, содержащий линкерный элемент, имеет суммарную структуру общей формы S1 - L - S2, где S1 и S2 могут быть одинаковыми или различными и представляют два домена, ассоциированные друг с другом посредством линкера. В некоторых вариантах осуществления, линкер имеет по меньшей мере 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100 или более аминокислот по длине. В некоторых вариантах осуществления, линкер отличается тем, что он стремится не принимать жесткую трехмерную структуру, но скорее обеспечивает полипептиду эластичность. Разнообразные различные линкерные элементы, которые могут соответствующим образом применяться при конструировании полипептидов (например, гибридных полипептидов), известны в данной области (см., например, Holliger, P., et al. (1993) Proc. Natl. Acad. Sci. USA 90: 6444-6448; Poljak, R. J., et al. (1994) Structure 2: 1121-1123).
[0073] "Мультивалентное связующее средство", как используют в данном документе, относится к связующему средству, способному к связыванию с двумя или более антигенами, которые могут находиться на одной и той же молекуле или на различных молекулах. Мультивалентные связующие средства, описанные в данном документе, в некоторых вариантах осуществления, конструируют, чтобы они имели три или более участка связывания антигена, и они обычно не является природными белками. Мультивалентные связующие средства, описанные в данном документе, относятся к связующим средствам, способным к связыванию двух или более родственных или неродственных мишеней. Мультивалентные связующие средства могут быть составлены из множественных копий единственного компонента антитела или множественных копий различных компонентов антител. Такие связующие средства являются способными к связыванию с двумя или более антигенами и представляют собой тетравалентные или мультивалентные связующие средства. Мультивалентные связующие средства могут дополнительно содержать терапевтическое средство, такое, как, например, иммуномодулятор, токсин или РНКаза. Мультивалентные связующие средства, описанные в данном документе, являются, в некоторых вариантах осуществления, способными к связыванию одновременно с по меньшей мере двумя мишенями, которые имеют различную структуру, например, двумя различными антигенами, двумя различными эпитопами на одном и том же антигене или гаптеном и/или антигеном или эпитопом. Во многих вариантах осуществления, мультивалентные связующие средства настоящего изобретения представляют собой белки, сконструированные, чтобы иметь характеристики мультивалентных связующих средств, описанных в данном документе. Мультивалентные связующие средства настоящего изобретения могут быть моноспецифическими (способными к связыванию одного антигена) или мультиспецифическими (способными к связыванию двух или более антигенов), и могут состоять из двух полипептидов тяжелой цепи и двух полипептидов легкой цепи. Каждый участок связывания, в некоторых вариантах осуществления, состоит из вариабельного домена тяжелой цепи и вариабельного домена легкой цепи всего с шестью CDR, вовлеченными в связывание антигена на участок связывания антигена.
[0074] "Нуклеиновая кислота", как используют в данном документе, в самом широком смысле, относится к любому соединению и/или веществу, которое представляет собой олигонуклеотидную цепь или может быть в нее включено. В некоторых вариантах осуществления, нуклеиновая кислота является соединением и/или веществом, которое представляет собой олигонуклеотидную цепь или может быть включено в нее посредством фосфодиэфирной связи. Как будет ясно из контекста, в некоторых вариантах осуществления, "нуклеиновая кислота" относится к индивидуальным остаткам нуклеиновой кислоты (например, нуклеотидам и/или нуклеозидам); в некоторых вариантах осуществления, "нуклеиновая кислота" относится к олигонуклеотидной цепи, содержащей индивидуальные остатки нуклеиновой кислоты. В некоторых вариантах осуществления, "нуклеиновая кислота" представляет собой или содержит РНК; в некоторых вариантах осуществления, "нуклеиновая кислота" представляет собой или содержит ДНК. В некоторых вариантах осуществления, нуклеиновая кислота представляет собой, содержит или состоит из одного или более остатков природной нуклеиновой кислоты. В некоторых вариантах осуществления, нуклеиновая кислота представляет собой, содержит или состоит из одного или более аналогов нуклеиновой кислоты. В некоторых вариантах осуществления, аналог нуклеиновой кислоты отличается от нуклеиновой кислоты тем, что в нем не используется фосфодиэфирный скелет. Например, в некоторых вариантах осуществления, нуклеиновая кислота представляет собой, содержит или состоит из одной или более "пептид-нуклеиновых кислот", которые известны в данной области, и имеют пептидные связи вместо фосфодиэфирных связей в скелете, и они считаются включенными в пределы объема настоящего изобретения. Альтернативно или дополнительно, в некоторых вариантах осуществления, нуклеиновая кислота имеет одну или более фосфотиоатных и/или 5'-N-фосфорамидитных связей в большей степени, чем фосфодиэфирных связей. В некоторых вариантах осуществления, нуклеиновая кислота представляет собой, содержит или состоит из одного или более природных нуклеозидов (например, аденозина, тимидина, гуанозина, цитидина, уридина, дезоксиаденозина, дезокситимидина, дезоксигуанозина и дезоксицитидина). В некоторых вариантах осуществления, нуклеиновая кислота представляет собой, содержит или состоит из одного или более нуклеозидных аналогов (например, 2-аминоаденозина, 2-тиотимидина, инозина, пирроло-пиримидина, 3-метиладенозина, 5-метилцитидина, C-5-пропинил-цитидина, C-5-пропинил-уридина, 2-аминоаденозина, C5-бромуридина, C5-фторуридина, C5-иодуридина, C5-пропинил-уридина, C5-пропинил-цитидина, C5-метилцитидина, 2-аминоаденозина, 7-деазааденозина, 7-деазагуанозина, 8-оксоаденозина, 8-оксогуанозина, О(6)-метилгуанина, 2-тиоцитидина, метилированных оснований, интеркалированных оснований, и их комбинаций). В некоторых вариантах осуществления, нуклеиновая кислота содержит один или более модифицированных сахаров (например, 2'-фторрибозу, рибозу, 2'-дезоксирибозу, арабинозу и гексозу) в сравнении с сахарами в природных нуклеиновых кислотах. В некоторых вариантах осуществления, нуклеиновая кислота имеет нуклеотидную последовательность, которая кодирует функциональный генный продукт, такой как РНК или белок. В некоторых вариантах осуществления, нуклеиновая кислота включает один или более интронов. В некоторых вариантах осуществления, нуклеиновые кислоты получают посредством одного или более выделения из природного источника, ферментативного синтеза посредством полимеризации, основанной на комплементарной матрице (in vivo или in vitro), воспроизводства в рекомбинантной клетке или системе, и химического синтеза. В некоторых вариантах осуществления, нуклеиновая кислота имеет по меньшей мере 3, 4, 5, 6, 7, 8, 9, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 110, 120, 130, 140, 150, 160, 170, 180, 190, 20, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500, 600, 700, 800, 900, 1000, 1500, 2000, 2500, 3000, 3500, 4000, 4500, 5000 или более остатков по длине. В некоторых вариантах осуществления, нуклеиновая кислота является одноцепочечной; в некоторых вариантах осуществления, нуклеиновая кислота является двухцепочечной. В некоторых вариантах осуществления нуклеиновая кислота имеет нуклеотидную последовательность, содержащую по меньшей мере один элемент, который кодирует, или является комплементом последовательности, которая кодирует полипептид. В некоторых вариантах осуществления, нуклеиновая кислота имеет ферментативную активность.
[0075] "Функционально связанные", как используют в данном документе, относится к совмещению, где описанные компоненты находятся во взаимосвязи, позволяющей им функционировать предназначенным им образом. Контрольная последовательность, "функционально связанная" с кодирующей последовательностью, лигирована таким образом, что экспрессия кодирующей последовательности достигается при условиях, совместимых с контрольными последовательностями. "Функционально связанные" последовательности включают как последовательности контроля экспрессии, которые являются смежными с геном, представляющим интерес, так и последовательности контроля экспрессии, которые действуют при перемещении или на расстоянии от контрольного гена, представляющего интерес. Термин «последовательность контроля экспрессии", как используют в данном документе, относится к полинуклеотидным последовательностям, которые являются необходимыми для воздействия на экспрессию и процессинга кодирующих последовательностей, с которыми они лигированы. Последовательности контроля экспрессии включают соответствующие последовательности инициации и терминации транскрипции, промоторные и энхансерные последовательности; сигналы эффективного процессинга РНК, такие как сигналы сплайсинга и полиаденилирования; последовательности, которые стабилизируют цитоплазматическую мРНК; последовательности, которые увеличивают эффективность трансляции (т.е., консенсусную последовательность Козака); последовательности, которые увеличивают стабильность белка; и, когда это желательно, последовательности, которые увеличивают секрецию белка. Природа таких контрольных последовательностей различается в зависимости от организма-хозяина. Например, у прокариотов, такие контрольные последовательности обычно включают промотор, рибосомальный участок связывания и последовательность терминации транскрипции, в то время как у эукариотов, обычно, такие контрольные последовательности включают промоторы и последовательность терминации транскрипции. Подразумевают, что термин “контрольные последовательности” включает компоненты, наличие которых является незаменимым для экспрессии и процессинга, и, они могут также включать дополнительные компоненты, наличие которых является преимущественным, например, лидерные последовательности и последовательности партнеров гибридизации.
[0076] "Физиологические условия", как используют в данном документе, имеют их понимаемое в данной области значение, относящееся к условиям, при которых клетки или организмы живут и/или размножаются. В некоторых вариантах осуществления, термин относится к условиям внешней или внутренней окружающей среды, которые могут иметь место в природе для организма или клеточной системы. В некоторых вариантах осуществления, физиологические условия представляют собой условия, присутствующие внутри организма человека или животного, не являющегося человеком, особенно, те условия, которые имеют место в и/или в пределах операционного поля. Физиологические условия обычно включают, например, температурный интервал 20-40°C, атмосферное давление, равное 1, pH 6-8, концентрацию глюкозы 1-20 мМ, концентрацию кислорода при атмосферных уровнях, и силу тяжести, существующую на Земле. В некоторых вариантах осуществления, условия в лаборатории создаются и/или поддерживаются при физиологических условиях. В некоторых вариантах осуществления, физиологические условия встречаются в организме.
[0077] "Полипептид", как используют в данном документе, относится к любой полимерной цепи из аминокислот. В некоторых вариантах осуществления, полипептид имеет аминокислотную последовательность, которая встречается в природе. В некоторых вариантах осуществления, полипептид имеет аминокислотную последовательность, которая не встречается в природе. В некоторых вариантах осуществления, полипептид имеет аминокислотную последовательность, которую конструируют таким образом, что ее разрабатывают и/или получают посредством действия рук человека.
[0078] "Рекомбинантные", как используют в данном документе, предназначено для обозначения полипептидов (например, антител или компонентов антител или мультиспецифических связующих средств, описанных в данном документе), которые разрабатывают, конструируют, получают, экспрессируют, создают или выделяют посредством рекомбинантных средств, таких как полипептиды, экспрессируемые с использованием рекомбинантного вектора экспрессии, трансфицированного в клетку-хозяина, полипептиды, выделенные из рекомбинантной, комбинаторной библиотеки полипептидов человека (Hoogenboom H.R., (1997) TIB Tech. 15: 62-70; Azzazy H., and Highsmith W.E., (2002) Clin. Biochem. 35: 425-445; Gavilondo J.V., and Larrick J.W. (2002) BioTechniques 29: 128-145; Hoogenboom H., and Chames P. (2000) Immunology Today 21: 371-378), антитела, выделенные из животного (например, мыши), которое является трансгенным для генов человеческого иммуноглобулина (см., например, Taylor, L.D., et al. (1992) Nucl. Acids Res. 20: 6287-6295; Kellermann S-A., и Green L.L. (2002) Current Opinion in Biotechnology 13: 593-597; Little M. et al (2000) Immunology Today 21: 364-370), или полипептиды, полученные, экспрессированные, созданные или выделенные посредством любого другого средства, которое включает в себя сплайсинг выбранных элементов последовательности друг с другом. В некоторых вариантах осуществления, один или более из таких выбранных элементов последовательности обнаруживают в природе. В некоторых вариантах осуществления, один или более из таких выбранных элементов последовательности разрабатывают in silico (виртуально). В некоторых вариантах осуществления, один или более таких выбранных элементов последовательности являются результатом мутагенеза (например, in vivo или in vitro) известного элемента последовательности, например, из природного или синтетического источника. Например, в некоторых вариантах осуществления, полипептид рекомбинантного антитела состоит из последовательностей, обнаруженных в зародышевой линии организма-источника, представляющего интерес (например, человека, мыши и т.д.). В некоторых вариантах осуществления, рекомбинантное антитело имеет аминокислотную последовательность, которая являлась результатом мутагенеза (например, in vitro или in vivo, например, в трансгенном животном), таким образом, что аминокислотные последовательности VH и VL областей рекомбинантных антител представляют собой последовательности, которые, происходя от и являясь родственными VH и VL последовательностям зародышевой линии, в то же время, могут не существовать в природе в наборе антител зародышевой линии in vivo.
[0079] "Извлечение", как используют в данном документе, относится к процессу придания средству или объекту, состояния, при котором они по существу не содержат других ранее ассоциированных компонентов, например, посредством выделения, например, с использованием методов очистки, известных в данной области. В некоторых вариантах осуществления, средство или объект извлекают из природного источника и/или источника, содержащего клетки.
[0080] "Специфическое связывание", как используют в данном документе, относится к способности связующего средства распознавать возможные партнеры в окружении, в котором связывание будет происходить. Считают, что связующее средство, которое взаимодействует с одной конкретной мишенью, когда присутствуют другие потенциальные мишени, "связывается специфически" с мишенью, с которой оно взаимодействует. В некоторых вариантах осуществления, специфическое связывание оценивают посредством обнаружения или определения степени ассоциации между связующим средством и его партнером; в некоторых вариантах осуществления, специфическое связывание оценивают посредством обнаружения или определения степени диссоциации комплекса связующее средство-партнер; в некоторых вариантах осуществления, специфическое связывание оценивают посредством обнаружения или определения способности связующего средства конкурировать за альтернативное взаимодействие между его партнером и еще одним объектом. В некоторых вариантах осуществления, специфическое связывание оценивают посредством выполнения таких обнаружений или определений на протяжении интервала концентраций.
[0081] "Субъект", как используют в данном документе, означает любое млекопитающее, включая людей. В некоторых вариантах осуществления настоящего изобретения субъект является взрослым, подростком или ребенком. В некоторых вариантах осуществления, термин "индивидуум" или "пациент" используют и подразумевают взаимозаменяемо с термином "субъект". Настоящее изобретение также предусматривает введение фармацевтических композиций и/или осуществление способов лечения внутриутробно.
[0082] "По существу": Как используют в данном документе, термин "по существу" относится к качественному состоянию проявления полной или почти полной границы или степени характеристики или свойства, представляющего интерес. Рядовой специалист в областях, связанных с биологией, поймет, что биологические и химические явления редко, если вообще, проходят до завершения и/или протекают полностью или достигают или отменяют абсолютный результат. Термин "по существу", следовательно, применяют в данном документе, чтобы передать потенциальное отсутствие завершения, присущее многим биологическим и химическим явлениям.
[0083] "Существенная гомология последовательности": фраза "существенная гомология" применяется в данном документе, как обозначающая сравнение между аминокислотными последовательностями или последовательностями нуклеиновых кислот. Как смогут оценить рядовые специалисты в данной области, две последовательности обычно считаются "гомологичными по существу", если они содержат гомологичные остатки в соответствующих положениях. Гомологичные остатки могут быть идентичными остатками. Альтернативно, гомологичные остатки могут быть неидентичными остатками с соответственно сходными структурными и/или функциональными характеристиками. Например, как хорошо известно рядовым специалистам в данной области, некоторые аминокислоты обычно классифицируют как "гидрофобные" или "гидрофильные" аминокислоты и/или как имеющие "полярные" или "неполярные" боковые цепи. Замена одной аминокислоты на другую того же самого типа часто может считаться "гомологичной" заменой. Типовые категоризации аминокислот обобщены в Таблицах 1 и 2.
[0084] Как хорошо известно в данной области, аминокислотные последовательности или последовательности нуклеиновых кислот могут сравниваться с использованием любого из различных алгоритмов, включающих алгоритмы, доступные в продаваемых компьютерных программах, такие как BLΑSTN для нуклеотидных последовательностей и BLΑSTP, BLΑST с разрывами, и PSI-BLΑST для аминокислотных последовательностей. Примерные такие программы описаны в Altschul, et al, Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al, Methods in Enzymology; Altschul, et al, "Gapped BLΑST и PSI-BLΑST: a new generation of protein database search programs", Nucleic Acids Res. 25: 3389-3402, 1997; Baxevanis, et al, Bioinformatics : A Practical Guide to Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999; из которых все вышеуказанные включены в данный документ посредством ссылки. В дополнение к идентифицированию гомологичных последовательностей, программы, указанные выше, обычно обеспечивают указание на степень гомологии. В некоторых вариантах осуществления, две последовательности считаются по существу гомологичными, если по меньшей мере 50%, по меньшей мере 55%, по меньшей мере 60%, по меньшей мере 65%, по меньшей мере 70%, по меньшей мере 75%, по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 91%, по меньшей мере 92%, по меньшей мере 93%, по меньшей мере 94%, по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или более из их соответствующих остатков являются гомологичными на релевантном протяжении остатков. В некоторых вариантах осуществления, релевантное протяжение представляет собой полную последовательность. В некоторых вариантах осуществления, релевантное протяжение составляет по меньшей мере 10, по меньшей мере 15, по меньшей мере 20, по меньшей мере 25, по меньшей мере 30, по меньшей мере 35, по меньшей мере 40, по меньшей мере 45, по меньшей мере 50, по меньшей мере 55, по меньшей мере 60, по меньшей мере 65, по меньшей мере 70, по меньшей мере 75, по меньшей мере 80, по меньшей мере 85, по меньшей мере 90, по меньшей мере 95, по меньшей мере 100, по меньшей мере 125, по меньшей мере 150, по меньшей мере 175, по меньшей мере 200, по меньшей мере 225, по меньшей мере 250, по меньшей мере 275, по меньшей мере 300, по меньшей мере 325, по меньшей мере 350, по меньшей мере 375, по меньшей мере 400, по меньшей мере 425, по меньшей мере 450, по меньшей мере 475, по меньшей мере 500 или более остатков.
[0085] "Существенная идентичность": фраза "существенная идентичность" применяется в данном документе для обозначения сравнения между аминокислотными последовательностями или последовательностями нуклеиновых кислот. Как смогут оценить рядовые специалисты в данной области, две последовательности обычно считаются "идентичными по существу", если они содержат идентичные остатки в соответствующих положениях. Как хорошо известно в данной области, аминокислотные последовательности или последовательности нуклеиновых кислот могут сравниваться с использованием любого из различных алгоритмов, включающих алгоритмы, доступные в продаваемых компьютерных программах, такие как BLΑSTN для нуклеотидных последовательностей и BLΑSTP, BLΑST с разрывами, и PSI-BLΑST для аминокислотных последовательностей. Примерные такие программы описаны в Altschul, et al, Basic local alignment search tool, J. Mol. Biol, 215(3): 403-410, 1990; Altschul, et al, Methods in Enzymology; Altschul, et al, Nucleic Acids Res. 25: 3389-3402, 1997; Baxevanis, et al, Bioinformatics : A Practical Guide to Analysis of Genes and Proteins, Wiley, 1998; and Misener, et al, (eds.), Bioinformatics Methods and Protocols (Methods in Molecular Biology, Vol. 132), Humana Press, 1999. В дополнение к идентифицированию идентичных последовательностей, программы, указанные выше, обычно обеспечивают указание на степень идентичности. В некоторых вариантах осуществления, две последовательности считаются по существу идентичными, если по меньшей мере 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более из их соответствующих остатков являются идентичными на релевантном протяжении остатков. В некоторых вариантах осуществления, релевантное протяжение представляет собой полную последовательность. В некоторых вариантах осуществления, релевантное протяжение составляет по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 95, 100, 125, 150, 175, 200, 225, 250, 275, 300, 325, 350, 375, 400, 425, 450, 475, 500 или более остатков. В контексте CDR, ссылка на "существенную идентичность" обычно относится к CDR, имеющей аминокислотную последовательность по меньшей мере 80%, предпочтительно по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 98% или по меньшей мере 99% идентичную аминокислотной последовательности ссылочной CDR.
[0086] "Поверхностный плазмонный резонанс", как используют в данном документе, относится к оптическому явлению, которое позволяет проводить анализ взаимодействий специфического связывания в режиме реального времени, например, посредством обнаружения изменений концентраций белка в биосенсорной матрице, таким образом, как посредством использования системы BIAcore (Pharmacia Biosensor AB, Uppsala, Sweden and Piscataway, N.J.). Для дополнительных описаний, см. Jonsson, U., et al. (1993) Ann. Biol. Clin. 51: 19-26; Jonsson, U., et al. (1991) Biotechniques 11: 620-627; Johnsson, B., et al. (1995) J. Mol. Recognit. 8: 125-131; и Johnnson, B., et al. (1991) Anal. Biochem. 198: 268-277.
[0087] "Терапевтически эффективное количество", как используют в данном документе, означает количество, которое производит желательный эффект, для которого его вводят. В некоторых вариантах осуществления, термин относится к количеству, которое является достаточным, при введении населению, страдающего от или подверженного воздействию заболевания, нарушения и/или состояния в соответствии с терапевтическим режимом дозирования, для лечения заболевания, нарушения и/или состояния. В некоторых вариантах осуществления, терапевтически эффективное количество представляет собой количество, которое снижает частоту возникновения и/или тяжесть и/или замедляет наступление одного или более симптомов заболевания, нарушения и/или состояния. Рядовые специалисты в данной области смогут оценить, что термин "терапевтически эффективное количество" не требует в действительности достижения успешного лечения у конкретного индивидуума. В большей степени, терапевтически эффективное количество может являться таким количеством, которое обеспечивает конкретный желательный фармакологический ответ у значительного числа субъектов при введении пациентам, нуждающимся в таком лечении. В некоторых вариантах осуществления, ссылка на терапевтически эффективное количество может быть ссылкой на количество, измеренное в одной или более специфических тканях (например, ткани, подвергнутой воздействию заболевания, нарушения или состояния) или жидких средах (например, крови, слюне, сыворотке, поту, слезах, моче и т.д.). Рядовые специалисты в данной области смогут оценить, что, в некоторых вариантах осуществления, терапевтически эффективное количество конкретных средства или терапии может быть составлено и/или вводиться в однократной дозе. В некоторых вариантах осуществления, терапевтически эффективное средство может быть составлено и/или вводиться в множестве доз, например, как часть режима дозирования.
[0088] "Трансформация", как используют в данном документе, относится к любому процессу, посредством которого экзогенную ДНК вводят в клетку-хозяина. Трансформация может происходить в природных или искусственных условиях, с использованием различных методов, хорошо известных в данной области. Трансформация может быть основана на любом известном методе для введения чужеродных последовательностей нуклеиновых кислот в прокариотную или эукариотную клетку-хозяина. В некоторых вариантах осуществления, конкретную методологию трансформации выбирают на основе трансформируемой клетки-хозяина, и она может включать, но не ограничена перечисленным, вирусную инфекцию, электропорацию, спаривание, липофекцию. В некоторых вариантах осуществления, "трансформированная" клетка является стабильно трансформированной в том смысле, что введенная ДНК является способной к репликации либо как автономно реплицирующаяся плазмида или как часть хозяйской хромосомы. В некоторых вариантах осуществления, трансформированная клетка временно экспрессирует введенную нуклеиновую кислоту в течение ограниченных периодов времени.
[0089] "Вектор", как используют в данном документе, относится к молекуле нуклеиновой кислоты, способной к транспортировке еще одной нуклеиновой кислоты, с которой она была связана. Один тип вектора представляет собой "плазмиду", которая относится к петле круговой двухцепочечной ДНК, в которую могут быть лигированы дополнительные сегменты ДНК. Еще один тип вектора представляет собой вирусный вектор, где дополнительные сегменты ДНК могут быть лигированы в вирусный геном. Некоторые векторы являются способными к автономной репликации в клетке-хозяине, в которую они вводятся (например, бактериальные векторы, имеющие бактериальное происхождение репликации и эписомальные векторы млекопитающих). Другие векторы (например, неэписомальные векторы млекопитающих) могут быть интегрированы в геном клетки-хозяина при введении в клетку-хозяина, и посредством этого реплицируются наряду с геномом хозяина. Кроме того, некоторые векторы способны к направлению экспрессии генов, с которыми они функционально связаны. Такие векторы называют в данном документе "векторами экспрессии".
[0090] Стандартные методы могут применяться для рекомбинантных ДНК, олигонуклеотидного синтеза, и культивирования и трансформации тканей (например, электропорация, липофекция). Ферментативные реакции и методы очистки могут выполняться в соответствии со спецификациями производителя или, как обычно, осуществляться в данной области или как описано в данном документе. Вышеуказанные методы и методики могут, как правило, выполняться в соответствии с общепринятыми методами, хорошо известными в данной области и описанными в различных общих и более конкретных ссылках, которые цитируются и обсуждаются по всему объему настоящего описания. См., например, Sambrook et al. Molecular Cloning: A Laboratory Manual (2d ed., Cold Spring Harbor Laboratory Press, Cold Spring Harbor, N.Y. (1989)), которая включена в данный документ посредством ссылки для любых целей.
Мультивалентные связующие средства
[0091] Как осведомлены специалисты в данной области, мультивалентное связующее средство представляет собой молекулярный объект или комплекс, который включает компоненты связывания, которые связываются специфически с двумя или более мишенями (например, эпитопами). Такие мультивалентные связующие средства находят разнообразные применения в данной области, включая терапевтические применения. Чтобы привести всего один пример, как осведомлены специалисты в данной области, мультивалентные связующие средства были сконструированы, чтобы способствовать уничтожению опухолевых клеток посредством направления (или мобилизации) цитотоксичных Т-клеток к участку опухоли. Примеры опухолевых антигенов включают, но не ограничены перечисленным, альфафетопротеин (AFP), CA15-3, CA27-29, CA19-9, CA-125, кальретинин, онкоэмбриональный антиген, CD34, CD99, CD1 17, хромогранин, цитокератин, десмин, эпителиальный мембранный белок (EMA), Фактор VIII, CD31 FL1, глиофибриллярный кислый белок (GFAP), жидкостный белок макроскопического поликистоза (GCDFP-15), HMB-45, хорионический гонадотропин человека (hCG), ингибин, кератин, CD45, лимфоцитарный маркер, MART-1 (Мелан-A), Мио Dl, мышечно-специфический актин (MSA), нейрофиламент, нейрон-специфическую енолазу (NSE), плацентарную щелочную фосфатазу (PLΑP), специфический антиген простаты, белок S100, актин гладких мышц (SMA), синаптофизин, тиреоглобулин, тиреоидный фактор транскрипции-1, опухолевый M2-PK и виментин.
[0092] Потенциальная эффективность действия мультиспецифических связующих средств, которые мобилизуют Т-клетки, основана на способности этих средств направлять Т-клетки к участкам локализации опухоли для опосредованного T-клетками уничтожения. Т-клетки являются наиболее активными эффекторными клетками в иммунной системе при уничтожении аберрантных клеток и неспособны к Fc-опосредованной антителозависимой клеточной цитотоксичности (ADCC). Механизм, посредством которого такие мультивалентные связующие средства направляют Т-клетки к участкам локализации опухоли, осуществляется через связывание опухолевого антигена на поверхности опухоли и со-рецептора на поверхности Т-клеток, CD3. CD3 представляет собой комплекс из трех цепей (γ, δ и ε), экспрессируемых на поверхности всех зрелых Т-клеток. Экспрессия CD3 почти исключительно ограничена Т-клетками. Анти-CD3 компонент биспецифического связующего средства может превращать ранее нестимулированную и незадействованную неклональную T-клетку, чтобы она стала высокоактивным серийным киллером опухолевых клеток (Wolf et al, 2005, Drug Discov Today 10: 1237-1244). Связующие средства этого типа продемонстрировали эффективность действия на исследованиях животных моделей с ксенотрансплантатными солидными опухолями, экспрессирующими антигены адгезивной молекулы эпителиальных клеток (EpCAM) в дополнение к другим мишеням (Bargou et al, выше; Brischwein et al, 2006, Mol Immunol 43: 1129-1143; Baeuerle and Reinhardt, 2009, Cancer Res 69: 4941-4944).
[0093] В некоторых вариантах осуществления, мультивалентные связующие средства для применения в соответствии с настоящим изобретением представляют собой биспецифические связующие средства. Во многих вариантах осуществления, такие биспецифические связующие средства являются способными к связыванию с Т-клетками. Во многих вариантах осуществления, такие биспецифические связующие средства являются способными к связыванию с CD3 на Т-клетках.
[0094] В некоторых вариантах осуществления, мультивалентные или биспецифические связующие средства для применения в соответствии с настоящим изобретением представляют собой или содержат компоненты антител. Различные технологии известны в данной области для разработки, построения и/или получения мультиспецифических или биспецифических связующих средств, содержащих компоненты антител.
[0095] Например, были построены биспецифические связующие средства, которые либо используют полный каркас иммуноглобулина (например, IgG), одноцепочечный вариабельный фрагмент (scFv), или их комбинации. Было показано, что биспецифические связующие средства, составленные из двух блоков scFv в тандеме, представляют собой один из наиболее клинически успешных форматов биспецифического антитела. В случае противоопухолевой иммунотерапии, биспецифические связующие средства, которые содержат два одноцепочечных вариабельных фрагмента (scFv) в тандеме, были разработаны таким образом, что scFv, который связывает опухолевый антиген, связан с scFv, который задействует Т-клетки посредством связывания CD3. Таким способом, Т-клетки мобилизуются к участку локализации опухоли с надеждой, что они могут опосредовать уничтожение опухолевых клеток, наделяя опухоль цитотоксическими свойствами, которые имеют некоторые Т-клетки. Был получен пример такого биспецифического связующего средства, которое целенаправленно действует на CD19 и CD3 для лимфомы (называемого Биспецифическое привлечение T-клеток или BiTE; например, см. Dreier et al, 2003, J Immunol 170: 4397-4402; Bargou et al, 2008, Science 321: 974-977), которое успешно предотвращало рост опухоли в исследованиях на животных моделях с ксенотрансплантатами. В исследованиях на людях, это биспецифическое связующее средство продемонстрировало целевую реакцию опухоли, включая пять частичных и две полных ремиссии.
[0096] Иллюстративные биспецифические связующие средства включают такие средства с первым компонентом антитела, специфичным для опухолевого антигена и вторым компонентом антитела, специфичным для цитотоксичного маркера, например, Fc-рецептора (например, FcγRI, FcγRII, FcγRIII и т.д.) или T-клеточного маркера (например, CD3, CD28 и т.д.). Дополнительно, второй компонент антитела может быть заменен на компонент антитела, имеющий отличающуюся желательную специфичность. Например, биспецифическое связующее средство с первым компонентом антитела, специфичным для опухолевого антигена, и вторым компонентом антитела, специфичным для токсина, может образовывать пару, для того, чтобы доставлять токсин (например, сапорин, алкалоид барвинка и т.д.) к опухолевой клетке. Другие иллюстративные биспецифические связующие средства включают такие средства с первым компонентом антитела, специфичным для активации рецептора (например, рецептора B-клеток, FcγRI, FcγRIIA, FcγRIIIA, FcγRI, рецептора T-клеток и т.д.), и вторым компонентом антитела, специфичным для ингибирования рецептора (например, FcγRIIB, CD5, CD22, CD72, CD300a и т.д.). Еще один другой пример включает второй компонент антитела, специфичный к отличающемуся антигену на том же самом клеточном типе, для которого первый компонент антитела является специфичным, например, CD20, CD19, CD21, CD23, CD46, CD80, HLΑ-DR, CD74, MUC1 и CD22 на B-клетках. Такие биспецифические связующие средства могут быть построены для терапевтических состояний, ассоциированных с активацией клеток (например, аллергии и астмы). Биспецифические связующие средства могут быть получены, например, посредством комбинирования тяжелых цепей и/или легких цепей, которые распознают различные эпитопы одного и того же или отличающихся антигенов. В некоторых вариантах осуществления, посредством молекулярной функции, биспецифическое связующее средство связывает один антиген (или эпитоп) на одном из его двух плечей связывания (одна пара VH/VL), и связывает отличающийся антиген (или эпитоп) на его втором плече (отличающаяся пара VH/VL). По этому определению, биспецифическое связующее средство имеет два различающихся антигенсвязывющих плеча (как по специфичности, так и последовательностям CDR), и является моновалентным для каждого антигена, с которым оно связывается.
[0097] В некоторых вариантах осуществления, биспецифические связующие средства настоящего изобретения характеризуются по способности связываться одновременно с двумя мишенями, которые имеют различную структуру. В некоторых вариантах осуществления, биспецифические связующие средства настоящего изобретения имеют по меньшей мере один компонент, который специфически связывается с, например, антигеном или эпитопом B-клеток, T-клеток, миелоидных клеток, плазмы или тучных клеток, и по меньшей мере одним другим компонентом, который специфически связывается с нацеливаемым конъюгатом, который несет терапевтическое или диагностическое средство.
[0098] Как правило, антитела, которые связываются с углеводными антигенами, такими как GD2, обычно имеют низкую аффинность. Таким образом, применение стабильных неиммуногенных пептидных последовательностей, описанных в данном документе, чтобы индуцировать гомодимеризацию, представляет уникальный подход для увеличения целенаправленности T-клеток для иммунотерапии злокачественных новообразований. Дополнительно, димеризация биспецифических связующих белков настоящего изобретения, которые составлены из тандемных компонентов антител (например, scFv), которые имеют массу приблизительно 50-55 кДа в мономерной форме, существенно увеличивает время полужизни в сыворотке и потенциальную терапевтическую эффективность действия независимо от аффинности к опухоли.
[0099] Опухолевый антиген GD2 в высокой степени экспессируется у нескольких типов метастатического рака, и для них в настоящее время не существует эффективных способов лечения. Безопасность и эффективность анти-GD2 антител были подтверждены при рандомизированных испытаниях, однако, как об основном недостатке, сообщалось о комплемент-опосредованной острой боли во время инфузии антитела (Yang et al, 2010, Drugs Future 35(8):665). Биспецифические связующие белки, описанные в данном документе, обладают способностью к бивалентному связыванию без присутствия Fc, компонента традиционных антител. Такая бивалентность является результатом применения компонента димеризации, который не индуцирует активацию комплемента. Сама по себе, описанная стратегия димеризации биспецифических связующих белков, представляет уникальный подход для повышенного уничтожения опухоли, пониженных неблагоприятных эффектов, и демонстрирует высокоактивное терапевтическое средство для лечения нескольких GD2-положительных злокачественных новообразований.
Компоненты димеризации
[0100] Настоящее изобретение дает представление о том, что иллюстративные свойства мультиспецифических связующих средств (и, в частности, биспецифических связующих средств, таких как биспецифические антитела), описанных в данном документе, являются особенно применимыми, и/или предоставляют конкретные преимущества в некоторых областях применения in vivo, при сочетании с компонентом димеризации. Например, среди прочего, настоящее изобретение охватывает признание того, что мультиспецифические связующие средства, которые конструируют способными к димеризации, описанные в данном документе, обеспечивают увеличение функциональной аффинности мультиспецифических связующих средств к их мишени(мишеням). В частности, различные Примеры, представленные в настоящем описании, демонстрируют улучшенные свойства димера биспецифического антитела (состоящего из двух гибридных полипептидов, каждый из которых включает первый и второй компоненты антител и компонент димеризации) в сравнении с его соответствующими мономерными полипептидами, в которых отсутствует компонент димеризации. Конкретный демонстрируемый примером димер биспецифического антитела нацелен на дисиалоганглиозид GD2 и CD3; в некоторых вариантах осуществления, как показано, димер характеризуется увеличенной активности вызывать деструкцию опухолевых клеток под действием Т-клетлк.
[0101] В некоторых вариантах осуществления, настоящее изобретение охватывает признание того факта, что, среди прочего, применение компонента димеризации в контексте биспецифического связующего средства может индуцировать бивалентное связывание биспецифического связующего средства с по меньшей мере одной из ее мишеней. Для непроцессированных IgG антител используют бивалентное связывание, которое может повысить авидность для антигенов на порядки величины по сравнению с характеристикой моновалентного связывания для scFv фрагментов (Pluckthun and Pack, 1997, Immunotechnol. 3: 83-105). Настоящее изобретение охватывает признание того факта, что сходные, или даже более высокие, улучшения авидности могут достигаться посредством введения компонента димеризации в полипептид бивалентного связующего средства.
[0102] В некоторых вариантах осуществления, настоящее изобретение охватывает признание того, что среди прочего, компонент димеризации, описанный в данном документе, является подходящим для димеризации любого сконструированного белка, к которому он присоединен. В некоторых определенных вариантах осуществления, сконструированный белок включает компоненты антител, биспецифические связующие средства или мультивалентные связующие средства. В некоторых вариантах осуществления, настоящее изобретение предоставляет, среди прочего, биспецифическое связующее средство, функционально связанное с компонентом димеризации, где такое димерное биспецифическое связующее средство характеризуется более высокой авидностью для по меньшей мере одной мишени в сравнении с биспецифическим связующим средством, в котором отсутствует компонент димеризации. В некоторых вариантах осуществления, достигается более высокая авидность для терапевтической мишени, например, опухолевого антигена. В некоторых вариантах осуществления, более высокая авидность достигается для компонента антитела биспецифического связующего средства, описанного в данном документе. В некоторых вариантах осуществления, компонент димеризации описанный в данном документе, является применимым конкретно и/или предоставляет конкретные преимущества при улучшении связывания у биспецифических связующих средств, содержащих компонент антитела, который связывает дисиалоганглиозид GD2. Иллюстративные компоненты антител включают такие компоненты, собранные из прежде характеризованных антител, таких как, например, 5F11 и 3F8.
[0103] Разнообразные последовательности компонентов димеризации, которые могут применяться в соответствии с настоящим изобретением, известны в данной области (см., например, Pluckthun and Pack, выше; Cuesta et al, 2010, Trends Biotechnol. 28: 355-362). Некоторые конкретные примеры таких компонентов включаюют синтетические или дрожжевые пептиды, которые представляют собой спиральные пучки или суперспирали (Таблица 3).
[0104] Настоящее изобретение особым образом охватывает открытие того, что конкретно применимый компонент димеризации для введения в мультивалентные связующие средства, и, конкретно, в бивалентные антитела, представляет собой или содержит элемент димеризации человеческого гепатоцитарного ядерного фактора-1 альфа (HNF-1α).
[0105] HNF-1α состоит из четырех областей: амино-концевого компонента димеризации, гибкого линкера, состоящего из двух частей ДНК-связывающего мотива, и карбокси-концевого компонента трансактивации. Гибкий линкер соединяет ДНК-связывающий мотив и компонент димеризации. HNF-1α является важным регулятором как почечной, так и печеночной экспрессии генов. Иллюстративная аминокислотная последовательность остатков 1-32 человеческого HNF-1α показана в SEQ ID NO:1 ниже.
Человеческий HNF- 1α1-32 MVSKLSQLQTEL1ΑALLESGLSKEALIQALGE (SEQ ID NO:1)
[0106] Обычно, компонент димеризации может быть разработан или выбран с учетом аминокислотных последовательностей белков, которые известны как самоассоциирующиеся. Примеры таких компонентов димеризации, известных в данной области, включают спиральные пучки, суперспирали (например, лейциновые молнии), синтетические пептиды, и дрожжевые белки. Настоящее изобретение предоставляет специализированную оценку биспецифических связующих средств, в которых используется компонент димеризации, содержащий элемент человеческого гепатоцитарного ядерного фактора-1α, который, как сообщалось, образует туго скрученный четырехспиральный пучок (Narayana et al, 2001, J. Mol. Biol. 310: 635-658). Например, компонент димеризации, содержащий элемент человеческого HNF-1α, может иметь последовательность, которая является по существу идентичной аминокислотным остаткам 1-32 человеческого HNF-1α (SEQ ID NO:1). В некоторых вариантах осуществления, компонент димеризации в соответствии с настоящим изобретением имеет последовательность по меньшей мере приблизительно на 50% (например, по меньшей мере приблизительно на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентичной аминокислотным остаткам 1-32 человеческого HNF-1α (SEQ ID NO:1).
[0107] Иллюстративные биспецифические связующие средства настоящего изобретения показаны в Таблице 4. Иллюстративные вариабельные области антител настоящего изобретения подчеркнуты. Иллюстративный компонент димеризации настоящего изобретения показан курсивом.
(SEQ ID NO:2)
(SEQ ID NO:3)
(SEQ ID NO:4)
(SEQ ID NO:5)
(SEQ ID NO:6)
(SEQ ID NO:7)
(SEQ ID NO:8)
(SEQ ID NO:9)
(SEQ ID NO:10)
(SEQ ID NO:11)
(SEQ ID NO:12)
(SEQ ID NO:13)
(SEQ ID NO:14)
(SEQ ID NO:15)
(SEQ ID NO:16)
(SEQ ID NO:17)
(SEQ ID NO:18)
(SEQ ID NO:19)
(SEQ ID NO:20)
(SEQ ID NO:21)
(SEQ ID NO:22)
(SEQ ID NO:23)
[0108] В различных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением состоят из первого связующего компонента и второго связующего компонента и компонента димеризации. Во многих вариантах осуществления, каждый из первого и второго связующих компонентов биспецифического связующего средства, описанного в данном документе, состоит из компонентов антител, характеризуемых различными специфичностями. Во многих вариантах осуществления, компоненты антител выбирают из Таблицы 4.
[0109] В различных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат первый связующий компонент, второй связующий компонент и компонент димеризации, который соединен со вторым связующим компонентом. В различных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат первый связующий компонент, второй связующий компонент и компонент димеризации, который соединен с первым связующим компонентом. В различных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат первый связующий компонент, второй связующий компонент и компонент димеризации, который соединен как с первым, так и вторым связующим компонентом (например, расположен между первым и вторым связующими компонентами).
[0110] В некоторых определенных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат, от 5’ к 3', первый связующий компонент, второй связующий компонент и компонент димеризации. В некоторых определенных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат, в направлении от 5’ к 3 ', компонент димеризации, первый связующий компонент и второй связующий компонент. В некоторых определенных вариантах осуществления, биспецифические связующие средства в соответствии с настоящим изобретением содержат, от 5’ к 3', первый связующий компонент, компонент димеризации и второй связующий компонент.
[0111] В различных вариантах осуществления, первый и/или второй связующие компоненты, описанные в данном документе, содержат или представляют собой компоненты антител. В различных вариантах осуществления, первый и/или второй связующий компоненты, описанные в данном документе, содержат линкерную последовательность.
[0112] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность по меньшей мере приблизительно на 50% (например, по меньшей мере приблизительно на 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 96%, 97%, 98% или 99%) идентичную последовательности, которая появляется в Таблице 4.
[0113] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая является по существу идентичной последовательности, которая появляется в Таблице 4.
[0114] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая является идентичной последовательности, которая появляется в Таблице 4.
[0115] В некоторых вариантах осуществления, биспецифическое связующее средство настоящего изобретения выбирают из последовательности, которая появляется в Таблице 4.
[0116] В различных вариантах осуществления, первый связующий компонент биспецифического связующего средства, описанного в данном документе, содержит компонент антитела, имеющий последовательность по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентичную последовательности компонента антитела, которая появляется в Таблице 4.
[0117] В различных вариантах осуществления, первый связующий компонент биспецифического связующего средства, описанного в данном документе, содержит компонент антитела, имеющую последовательность, которая является идентичной последовательности компонента антитела, которая появляется в Таблице 4.
[0118] В различных вариантах осуществления, второй связующий компонент биспецифического связующего средства, описанного в данном документе, содержит компонент антитела, имеющий последовательность по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99% или более) идентичную последовательности компонента антитела, которая появляется в Таблице 4.
[0119] В различных вариантах осуществления, второй связующий компонент биспецифического связующего средства, описанного в данном документе, содержит компонент антитела, имеющий последовательность, которая является идентичной последовательности компонента антитела, которая появляется в Таблице 4.
[0120] В различных вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая по меньшей мере на 50% (например, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98% 99% или более) является идентичной последовательности биспецифического связующего средства, которая появляется в Таблице 4.
[0121] В различных вариантах осуществления, биспецифическое связующее средство настоящего изобретения имеет последовательность, которая является идентичной последовательности биспецифического связующего средства, которая появляется в Таблице 4.
Мишени
[0122] Среди прочего, настоящее изобретение охватывает признание того, что димеризация мультиспецифических связующих средств, и, конкретно, биспецифических связующих средств, таких как биспецифические антитела, является особенно применимой и/или эффективной для облегчения уничтожения клеток. В частности, настоящее описание демонстрирует, что активность мультивалентных связующих средств, которые связываются специфически как с ассоциированным с клеткой-мишенью эпитопом, так и ассоциированным с лимфоцитом эпитопом, может быть резко увеличена посредством введения домена димеризации.
[0123] Например, в некоторых вариантах осуществления настоящего изобретения, мультивалентное связующее средство связывается специфически с эпитопом, ассоциированным с опухолевой клеткой и T-клеточным эпитопом. В соответствии с такими вариантами осуществления, включение домена димеризации в мультивалентное связующее средство может способствовать связыванию средства с одним или обоими из его целевых эпитопов и/или может усилить уничтожение целевых опухолевых клеток при опосредовании целевыми T-клетками.
[0124] В некоторых вариантах осуществления, клетки-мишени, подлежащие уничтожению, включают, например, инфицированные вирусом клетки (например, ВГЦ-инфицированные клетки, ВИЧ-инфицированные CD4+ Т-клетки, ВПЧ-инфицированные кератиноциты), клетки, инфицированные внутриклеточными бактериями или простейшими, и раковые клетки. Рядовые специалисты в данной области хорошо осведомлены о соответствующих целевых эпитопах на таких клетках, с которыми желательно связываются мультивалентные связующие средства, описанные в данном документе. Такие представительные эпитопы могут быть обнаружены на антигенах, таких как, например, оболочечные белки, протеазы, белки обратной транскриптазы, белки интегразы и т.д.
[0125] В некоторых вариантах осуществления, лимфоцитарные клетки, которые могут опосредовать уничтожение клеток-мишеней, описанных в данном документе, включают Т-клетки (например, CD8+ Т-клетки), клетки естественных киллеров (NK), макрофаги, гранулоциты и антитело-зависимые цитотоксичные клетки. Рядовые специалисты в данной области осведомлены о соответствующих целевых эпитопах на таких лимфоцитах, с которыми желательно связываются мультивалентные связующие средства, описанные в данном документе. Такие представительные эпитопы могут быть обнаружены на антигенах, таких как, например, Fc рецептор IgG (например, FcγRIIB), CD1d, CD3, CD4, CD7, CD8, CD13, CD14, CD16, CD31, CD38, CD56, CD68, MAC-1/MAC-3, IL-2Rα, OX40, Ly49 и CD94.
Конструирование и экспрессия нуклеиновых кислот
[0126] Мультиспецифические связующие средства, включающие компоненты димеризации, описанные в данном документе, могут быть получены из молекул нуклеиновых кислот с использованием методов молекулярной биологии, известных в данной области. Молекулы нуклеиновых кислот внедряют в вектор, который способен экспрессировать гибридные белки при введении в соответствующую клетку-хозяина. Соответствующие клетки-хозяева включают, но не ограничены перечисленным, клетки бактерий, дрожжей, насекомых и млекопитающих. Любые методы, известные специалистам в области для внедрения фрагментов ДНК в вектор, могут применяться для построения векторов экспрессии, кодирующих гибридные белки настоящего изобретения под контролем транскрипционных/трансляционных контрольных сигналов. Эти методы могут включать рекомбинантную ДНК in vitro и технологии синтеза и рекомбинацию in vivo (См. Sambrook et al. Molecular Cloning, A Laboratory Manual, Cold Spring Harbor Laboratory; Current Protocols in Molecular Biology, Eds. Ausubel, et al, Greene Publ. Assoc., Wiley-Interscience, NY).
[0127] Экспрессия молекул нуклеиновых кислот в соответствии с настоящим изобретением может регулироваться второй последовательностью нуклеиновой кислоты, таким образом, что молекула экспрессируется в хозяине, трансформированном с использованием молекулы рекомбинантной ДНК. Например, экспрессия молекул нуклеиновых кислот изобретения может контролироваться элементом промотора и/или энхансера, которые известны в данной области.
[0128] Конструкции нуклеиновых кислот включают области, которые кодируют мультиспецифические связующие белки, генерируемые из антител и/или компонентов антител. Обычно, такие мультиспецифические связующие белки будут генерироваться из VH и/или VL областей. После идентификации и селекции антител, проявляющих желательные связывающие и/или функциональные свойства, вариабельные области каждого антитела выделяют, амплифицируют, клонируют и секвенируют. Могут быть проведены модификации VH и VL нуклеотидных последовательностей, включающие присоединения нуклеотидных последовательностей, кодирующих аминокислоты и/или несущих сайты рестрикции, делеции нуклеотидных последовательностей, кодирующих аминокислоты или замены нуклеотидных последовательностей, кодирующих аминокислоты. Антитела и/или компоненты антител могут генерироваться из человеческих, гуманизированных или химерных антител.
[0129] Конструкции нуклеиновых кислот настоящего изобретения внедряют в вектор экспрессии или вирусный вектор методами, известными в области, и молекулы нуклеиновых кислот являются функционально связанными с последовательностью контроля экспрессии.
[0130] Вектор экспрессии, содержащий молекулу нуклеиновой кислоты, трансформируется в подходящей клетке-хозяине, чтобы обеспечить продуцирование белка, кодируемого конструкциями нуклеиновой кислоты. Иллюстративные клетки-хозяева включают прокариоты (например, E. coli) и эукариоты (например, клетки COS или CHO). Клетки-хозяева, трансформированные с помощью вектора экспрессии, выращивают при условиях, позволяющих проводить продуцирование гибридного белка настоящего изобретения с последующим извлечением мультиспецифического связующего средства, образованного из гибридных белков.
[0131] Мультиспецифические связующие средства настоящего изобретения могут быть очищены любым методом, который обеспечивает последующее образование стабильного димера. Например, не ограничиваясь какой-либо теорией, мультиспецифические связующие средства могут быть извлечены из клеток либо в виде растворимых полипептидов или в виде тел включения, из которых они могут экстрагироваться количественно посредством 8M гидрохлорида гуанидиния и диализа. Чтобы дополнительно очистить мультиспецифические связующие средства настоящего изобретения, могут применяться общепринятые ионо-обменная хроматография, хроматография гидрофобного взаимодействия, обращенно-фазовая хроматография или гель-фильтрация. Мультиспецифические связующие средства настоящего изобретения могут также быть извлечены из кондиционных сред после секреции из эукариотных или прокариотных клеток.
Методы скрининга и обнаружения
[0132] Мультиспецифические связующие средства настоящего изобретения могут также применяться в методах скрининга in vitro или in vivo, где желательным является обнаружить и/или измерить одну или более активностей клетки или клеток (например, апоптоз или рост клеток). Методы скрининга являются хорошо известными в данной области и включают бесклеточные, аналитические тесты на клеточной основе и на животных. В аналитических тестах in vitro, обнаружение целевой молекулы либо в твердом состоянии или в растворимом виде может достигаться несколькими путями, известными в области, включающими применение метки или обнаруживаемой группы, способной к идентификации мультиспецифического связующего средства, которое связано с целевой молекулой (например, антигеном клеточной поверхности). Обнаруживаемые метки могут применяться в сочетании с аналитическими тестами с использованием мультиспецифических связующих средств настоящего изобретения.
Терапевтические методы
[0133] Способность мультиспецифических связующих средств настоящего изобретения проявлять высокую аффинность связывания для одного из целевых антигенов делает их терапевтически применимыми для эффективного нацеливания на клетки, экспрессирующие целевой антиген. Таким образом, в некоторых вариантах осуществления, может быть желательным увеличить аффинность мультиспецифического связующего средства для одного целевого антигена, а не другого целевого антигена, который также связывается мультиспецифическим связующим средством. Например, в контексте уничтожения опухоли, при некоторых состояниях благоприятным может быть увеличение аффинности к опухолевому антигену, но не к антигену на поверхности клетки, способной к опосредованию уничтожения опухоли (например, T-клетки). Таким образом, благоприятный эффект может быть получен от увеличения аффинности связывания мультиспецифического связующего средства к опухолевому антигену у пациента, имеющего опухоль, которая экспрессирует опухолевый антиген, посредством применения мультиспецифического связующего средства, описанного в данном документе.
[0134] Настоящее изобретение предоставляет мультиспецифическое связующее средство, описанное в данном документе, в виде терапевтического средства для лечения пациентов, имеющих опухоль, которая экспрессирует антиген, способный быть связанным таким мультиспецифическим связующим средством. Такие мультиспецифические связующие средства могут применяться в способе лечения организма человека или животного или в способе диагностики.
Введение
[0135] Настоящее изобретение предоставляет способы введения эффективного количества терапевтического активного вещества, описанного в данном документе (например, мультиспецифического связующего средства), субъекту, нуждающемуся в лечении.
[0136] Мультиспецифические связующие средства, описанные в данном документе, могут вводиться посредством различных методов, известных в данной области для терапевтической доставки средств, таким образом, белки или нуклеиновые кислоты могут применяться для терапевтической доставки мультиспецифического связующего средства или нуклеиновой кислоты, кодирующей мультиспецифическое связующее средство настоящего изобретения, для уничтожения или ингибирования роста целевых клеток у субъекта, например, посредством клеточной трансфекции, генной терапии, прямого введения со средой доставки или с фармацевтически приемлемым носителем, опосредованной доставки с обеспечением рекомбинантных клеток, содержащих нуклеиновую кислоту, кодирующую мультиспецифическое связующее средство настоящего изобретения.
[0137] Различные системы доставки являются известными и могут применяться для введения мультиспецифического связующего средства настоящего изобретения, например, инкапсулирование в липосомах, микрочастицы, микрокапсулы, рекомбинантные клетки, способные к экспрессии соединения, опосредованный рецептором эндоцитоз (см., например, Wu and Wu, 1987, J. Biol. Chem. 262: 4429-4432), конструкция нуклеиновой кислоты как части ретровирусного или другого вектора и т.д. Пути введения могут быть энтеральными или парентеральными и включают, но не ограничены лишь ими, внутривенный, подкожный, внутримышечный, парентеральный, трансдермальный или трансмукозальный (например, пероральный или назальный). В некоторых вариантах осуществления, мультиспецифическое связующее средство настоящего изобретения вводят внутривенно. В некоторых вариантах осуществления, мультиспецифические связующие средства настоящего изобретения вводят подкожно. В некоторых вариантах осуществления, мультиспецифические связующие средства вводят вместе с другими биологически активными средствами.
Фармацевтические композиции
[0138] Настоящее изобретение дополнительно предоставляет фармацевтические композиции, содержащие мультиспецифические связующие средства настоящего изобретения и фармацевтически приемлемый носитель или эксципиент. Композиция, если желательно, может также содержать одно или более дополнительных терапевтически активных веществ.
[0139] Несмотря на то, что описания фармацевтических композиций, предоставленных в данном документе, в основном, направлены на фармацевтические композиции, которые являются пригодными для рецептурного введения людям, квалифицированный специалист в области поймет, что такие композиции в общем случае подходят для введения животным всех видов. Модификация фармацевтических композиций, подходящих для введения людям, чтобы придать им свойства композиций, подходящих для введения различных животных, является широко распространенной, и рядовой ветеринар-фармаколог может разработать и/или провести такую модификацию, проводя обычные, если потребуется эксперименты.
[0140] Лекарственные формы фармацевтических композиций, описанных в данном документе, могут быть получены любым методом, известным или в дальнейшем разработанным в области фармакологии. Как правило, такие подготовительные методы включают стадию приведения активного ингредиента в ассоциацию с разбавителем или еще одним эксципиентом и/или одним или более других вспомогательных ингредиентов, и затем, если необходимо и/или желательно, формования и/или упаковки продукта в желательную одно- или многодозовую единицу.
[0141] Фармацевтическая композиция в соответствии с настоящим изобретением может быть получена, упакована и/или поставлена в нерасфасованном виде, в виде единичной стандартной дозы и/или в виде множества единичных стандартных доз. Как используют в данном документе, "стандартная доза" представляет собой дискретное количество фармацевтической композиции, содержащей заданное количество активного ингредиента. Количество активного ингредиента обычно равно дозировке активного ингредиента, которая могла бы вводиться субъекту, и/или удобной фракции такой дозировки, такой как, например, одна вторая или одна третья части такой дозировки.
[0142] Относительные количества активного ингредиента, фармацевтически приемлемого эксципиента и/или любых дополнительных ингредиентов в фармацевтической композиции в соответствии с изобретением будут варьировать в зависимости от идентичности, размера и/или состояния субъекта, подвергаемого лечению, и, дополнительно, в зависимости от пути, посредством которого композиция будет вводиться. В качестве примера, композиция может содержать между 0,1% и 100% (м/м) активного ингредиента.
[0143] Фармацевтические лекарственные формы могут дополнительно содержать фармацевтически приемлемый эксципиент, который, как используют в данном документе, включает любые и все растворители, дисперсионные среды, разбавители или другие жидкие среды, дисперсионные или суспензионные добавки, поверхностно-активные вещества, изотонические средства, загущающие или эмульгирующие средства, консерванты, твердые связующие, смазки и т.п., как подходит для конкретной желательной дозированной формы. Remington's Science and Practice of Pharmacy, 21st Edition, A.R. Gennaro (Lippincott, Williams & Wilkins, Baltimore, MD, 2006; включенная в данное описание посредством ссылки) раскрывает различные эксципиенты, применяемые при составлении фармацевтических композиций, и известные методы для их получения. За исключением случаев, когда какая-либо общепринятая эксципиентная среда является несовместимой с веществом или его производными, таким образом, как производя любой нежелательный биологический эффект, или иным образом взаимодействуя вредоносным образом с любыми другими компонентом(компонентами) фармацевтической композиции, ее применение рассматривают, как включенное в объем данного изобретения.
[0144] В некоторых вариантах осуществления, фармацевтически приемлемый эксципиент имеет по меньшей мере 95%, по меньшей мере 96%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или 100% чистоту. В некоторых вариантах осуществления, эксципиент разрешен для применения на людях и применения в ветеринарии. В некоторых вариантах осуществления, эксципиент имеет разрешение Управления по контролю за продуктами питания и лекарствами США. В некоторых вариантах осуществления, эксципиент имеет фармацевтическую степень чистоты. В некоторых вариантах осуществления, эксципиент удовлетворяет стандартным требованиям Фармакопеи США (USP), Европейской Фармакопеи (EP), Фармакопеи Великобритании, и/или Международной Фармакопеи.
[0145] Фармацевтически приемлемые эксципиенты, используемые в производстве фармацевтических композиций, включают, но не ограничены перечисленным, инертные разбавители, диспергирующие и/или гранулирующие средства, поверхностно-активные средства и/или эмульгаторы, разрыхлители, связующие средства, консерванты, буферные средства, смазывающие средства и/или масла. Такие эксципиенты необязательно могут быть включены в фармацевтические лекарственные формы. Эксципиенты, такие как масло какао и суппозиторные воска, красящие средства, покрывающие средства, послащивающие, вкусовые и/или ароматизирующие средства, могут присутствовать в композиции, в соответствии с решением разработчика.
[0146] Общие подходы к составлению и/или изготовлению фармацевтических средств можно найти, например, в Remington: Science and Practice of Pharmacy 21st ed., Lippincott Williams & Wilkins, 2005 (включенной в данный документ посредством ссылки).
Наборы
[0147] Настоящее изобретение дополнительно предоставляет упаковку лекарственного средства или набор, содержащие один или более контейнеров, заполненных по меньшей мере одним мультиспецифическим связующим средством, описанным в данном документе. Наборы могут применяться в любом применимом способе, включающем, например, диагностику. Необязательно ассоциированной с такими контейнером(контейнерами) может быть памятка в форме, предписанной правительственным органом, регулирующим производство, применение или продажу фармацевтических средств или биологических продуктов, которая отражает (a) разрешение от органа на производство, применение или продажу для введения человеку, (b) указания для применения или и то, и другое.
ПРИМЕРЫ
[0148] Изобретение будет дополнительно иллюстрировано следующими неограничивающими примерами. Эти Примеры приводятся, чтобы способствовать пониманию изобретения, но не предназначены и не должны рассматриваться для ограничения его объема никаким образом. Примеры не включают подробных описаний общепринятых способов, которые могут быть хорошо известны рядовым специалистам в данной области (Способы молекулярного клонирования и т.д.). Если не указано иначе, части представляют собой массовые части, молекулярная масса является средней молекулярной массой, температура указана в градусах Цельсия, и давление является атмосферным или близким к атмосферному.
Пример 1. Разработка и построение биспецифических гибридных белков с компонентом димеризации
[0149] Настоящий Пример описывает получение мультиспецифического связующего средства, которое специфически конструируют, чтобы оно было способно к димеризации, в качестве стратегии для усиления его активности уничтожения опухоли. Данную стратегию тестировали на биспецифическом связующем белке, который может опосредовать уничтожение T-клетками GD2-положительных опухолевых клеток. Дисиалоганглиозид GD2 в высокой степени экспрессируется на опухолях при злокачественных новообразованиях, как у детей, так и у взрослых, включающих нейробластому, ретинобластому, меланому, опухоли мозга, саркомы и мелкоклеточный рак легкого (Modak et al, 2007, Cancer Invest. 25: 67-77). Настоящий Пример специфически иллюстрирует построение способного к димеризации гибридного белка, именуемого GD2xCD3-HDD, который состоит из из scFv полипептидов из антител анти-GD2 и анти-GD3, связанных друг с другом посредством компонента димеризации из HNF-1α, и который нацелен на GD2 и CD3. Несмотря на то, что самостоятельная димеризация HNF-1α является известной, было неясно, может ли компонент димеризации из HNF-1α использоваться для димеризации других белков, к которым он может быть присоединен, в частности, антител или их компонентов. Например, авторы изобретения определили, проводя присоединение к компонентам антител, что человеческий пептидный гормон эндотелин-1 (ET1), димеризация которого сама по себе является известной, был неспособен к димеризации.
[0150] Дополнительные Примеры, представленные в данном документе, демонстрируют, что успешная димеризация этого гибридного белка, по результатам тестирования посредством динамического светорассеяния, увеличивала функциональную аффинность к GD2, усиливало опосредованное T-клетками уничтожение опухолевых клеток in vitro, и ингибирование опухолевого роста у мышей с имплантированными опухолями. Эти Примеры демонстрируют потенциал настоящей стратегии для увеличения активности антител, мобилизующих T-клетки, для иммунотерапии злокачественных новообразований.
Молекулярное клонирование
[0151] Анти-GD2 x анти-CD3 тандемные scFv (GD2xCD3) биспецифические связующие белки были построены из одиночных полипептидных цепей, содержащих scFv анти-GD2 моноклонального антитела 5F11 (Hu et al, 2009, J. Immunol. 183: 5748-5755; Cheung et al, 2004, J. Nucl. Med. 45: 867-877) и гуманизированный scFv анти-CD3 OKT3 (Woodle et al, 1992, J. Immunol. 148: 2756-2763) с компонентом димеризации HNF-1α (называемым GD2×CD3 и GD2×CD3-HDD) и без него. HDD компонент помещали дистально по отношению к анти-GD2 scFv, и проксимально по отношению к анти-CD3 ScFv. Не желая быть связанными соответствием какой-либо конкретной теории, авторы считают, что, данное размещение было выбрано для максимизации потенциального увеличения функциональной аффинности к дистальному антигену (GD2), а не к проксимальному антигену (CD3), который мог бы быть геометрически ограниченным. Усиление связывания с GD2 могло бы предположительно увеличить уничтожение опухоли, в то время как усиление связывания с CD3 связывания могло бы приводить к увеличенной цитокиновой буре, известному побочному эффекту мобилизующих T-клетки биспецифических антител (Choi et al, 2011, Expert Opin. Biol. Ther. 11: 843-853). Дополнительно, димеризация тандемных scFv биспецифических связующих белков (ММ ~55-60 кДа) имеет потенциал увеличения периода полужизни в сыворотке, так как гомодимерный тандем scFv биспецифических связующих белков смог бы избежать пути почечного выведения, для которого субъектом являются белки меньше чем 60 кДа.
[0152] Вкратце, вариабельные области анти-GD2 антитела 5F11 и гуманизированного анти-CD3 OKT3 (полученного из мышиного антитела OKT3) антитела были описаны ранее. Одноцепочечные вариабельные фрагменты (scFv) 5F11 и гуманизированного антитела OKT3 (hOKT3) были генетически собраны в различных ориентациях, с использованием линкера из 15 аминокислот ((G4S)3) и синтезированы раздельно (Genescript, Piscataway, NJ). Ориентации VHVL или VLVH были построены с использованием вариабельных областей антитела 5F11, и ориентация VHVL была построена с использованием вариабельных областей анти-CD3 антитела hOKT3. Специфическая идентичность компонентов антител, используемых в настоящем изобретении, не является критической для предоставленной аналитической оценки того, что добавление компонента димеризации улучшает активность мультиспецифического связующего средства, состоящего из компонентов антител, нацеленных на два антигена.
[0153] Одноцепочечные вариабельные фрагменты, построенные из антитела 5F11, обрабатывали NheI и ApaI, и scFv, построенный из антитела hOKT3, обрабатывали ApaI и BamHI. Обработанные фрагменты последовательно лигировали в вектор Глутатионового синтеза (GS) (Invitrogen), чтобы получить биспецифические связующие белки 5HLBT и 5LHBT.
[0154] Стабилизирующие мутации были проделаны по двум цистеиновым остаткам scFv 5F11 (тяжелая цепь S44C, легкая цепь A100C) посредством мутагенеза в соответствии со спецификациями производителя (Stratagene, CA), чтобы на выходе получить 5HLDSBT и 5LHDSBT. Линкерную последовательность либо из 15 ((G4S)3) или пяти (G4S) аминокислот по длине клонировали между 5F11 scFv и hOKT3 scFv, также как 5HLDSBT и 5LHDSBT для сравнения. Сходным образом, стабилизирующие цистеиновые мутации также вводили в OKT3 scFv с получением 5HLDS-DSBT. Дополнительно, две мутации созревания аффинности (P104Y и E31Q; Hu et al, 2009, J Immunol 183: 5748-5755) раздельно вводили в 5HLDSBT с получением Y-BT и Q-BT, соответственно.
[0155] С использованием методов, описанных выше, другие биспецифические связующие белки с анти-GD2 × анти-CD3 тандемным scFv (GD2×CD3) были построены на основе гуманизированного анти-GD2 антитела 3F8 (Cheung et al, 2012, Oncolmmunol. 1:4, 477-486) и гуманизированного анти-CD3 OKT3 (Woodle et al., выше) с компонентом димеризации НNF-1α; и биспецифические связующие белки с анти-GD3 × анти-CD3 тандемным scFv (GD3×CD3) на основе моноклонального анти-GD3 антитела KM641 (Ohta et al., 1993, Cancer Immunol. Immunother. 36(4): 260-266) и гуманизированного анти-CD3 OKT3 (Woodle et al, выше) с компонентом димеризации HNF-1α. Компонент димеризации гибридизировали с C-концом компонента анти-CD3 антитела, используя часть шарнира человеческого IgG3 (TPLGDTTHTSG). Иллюстративные гибридные белки, описанные выше, показаны в Таблице 5.
Получение и очистка
[0156] Экспрессирующие конструкции были получены с использованием ДНК из гибридного белка scFv5F11-(G4S)3-scFvhОКT3 (Y-BT, SEQ ID NO:10) как с компонентом димеризации (GD2xCD3-HDD), так и без него (GD2×CD3), содержащим элемент (аминокислоты 1-32) из HNF-1α с последующей 6X гистидиновой меткой. ДНК трансфицировали в клетки DG44 CHO-S (Invitrogen) посредством электропорации с использованием нуклеофектора II-машины для электропорации (Amaxa) и раствора для нуклеофекции V. Трансфицированные клетки подвергали отбору по чувствительности к лекарственному препарату с 500 мкг/мл G418. Через приблизительно две недели, одиночные клетки помещали в 96-луночные планшеты посредством серийного разведения. Облученные клетки CHO-S применяли в качестве питающих клеток при концентрации, равной 5000 клеток/на лунку. Супернатант от каждого клона собирали через три недели и подвергали анализу на связывание GD2. Клоны, которые демонстрировали наивысшее связывание с GD2, отбирали для масштабирования до объемного культивирования с ротационным втряхиванием при 125 об/мин при 37°C и 8% CO2, когда клетки достигают 2 миллиона/мл и находятся в фазе логарифмического роста. Супернатанты культур собирали, когда достигался выход желательного антитела, или, когда жизнеспособность падала до <40%. Биспецифические гибридные белки (GD2×CD3 и GD2×CD3-HDD), секретируемые в супернатант культуры очищали на Ni2+ сефарозе (GE Healthcare Bio-Sciences, Sweden) и элюировали с 300 мМ имидазолом.
Пример 2. Скрининг in vitro и аффинность биспецифических гибридных белков
[0157] Данный Пример иллюстрирует эффект димеризации одноцепочечных биспецифических гибридных белков, полученных в соответствии с Примером 1, на функциональную аффинность к их мишеням. В некоторых случаях, биспецифические мономеры могут связываться с их мишенями в течение коротких периодов времени (например, слабое удерживание вследствие размера). В данном примере, биспецифические гибридные белки, которые конструируют для образования гомодимеров, демонстрируют увеличенную аффинность для антигена.
Динамическое светорассеяние
[0158] Способность компонента димеризации из HNF-1α индуцировать димеризацию в биспецифических гибридных белках тестировали посредством динамического светорассеяния. Гидродинамический радиус очищенных биспецифических гибридных белков измеряли, используя динамическое светорассеяние, на Zetasizer Nano (Malvern Instruments, Ltd.). В Таблице 6 приведены иллюстративные измерения с использованием биспецифических гибридных белков, описанных в Примере 1. Гидродинамический радиус дополнительных образцов очищенных биспецифических гибридных белков также измеряли, используя динамическое светорассеяние, как описано выше. Результаты показаны в Таблице 7.
[0159] Как показано в Таблицах 6 и 7, GD2×CD3 (ММ 55 кДа) имел гидродинамический радиус, равный 7,2±1,7 нм, в то время как GD2xCD3-HDD (ММ 59 кДа для мономера, 118 кДа для димера) имел гидродинамический радиус, равный 13,6±0,7 нм (или 11,1±0,5). Увеличение в размере, как продемонстрировано посредством светорассеяния указывают на димерную конформацию для GD2×CD3-HDD.
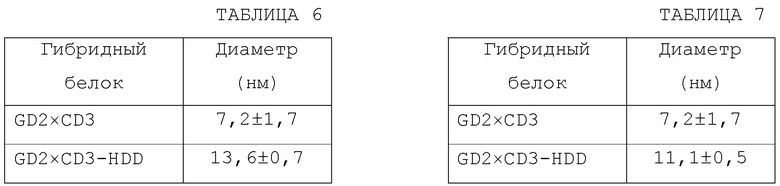
Аналитические тесты ELISA
[0160] Чтобы определить, усиливает ли HDD функциональную аффинность к GD2 или CD3, аналитические тесты ELISA выполняли, испольуя очищенный GD2 и цельные клетки Jurkat (культивированные Т-клетки, содержащие CD3). Вкратце, 96-луночные планшеты покрывали в течение ночи GD2 при 1 мкг/мл на лунку в 90% этаноле, при комнатной температуре. Через сутки планшеты блокировали 150 мкл/лунку 0,5% БСА при комнатной температуре в течение одного часа. После промывки, серию разбавлений биспецифических антител добавляли в планшеты и инкубировали при комнатной температуре в течение двух часов. Планшет последовательно промывали четыре раза PBS и затем инкубировали при комнатной температуре в течение одного часа с 100 мкл/лунку мышиного-анти-His-метки антитела (AbD Serotec) при разбавлении 1:1000 в 0,5% БСА. Планшет промывали снова четыре раза PBS и затем инкубировали при комнатной температуре в течение одного часа с 100 мкл/лунку козьего-анти-мышиного-HRP антитела (Jackson ImmunoResearch) при разбавлении 1:3000 в 0,5% БСА. Планшет промывали снова четыре раза PBS и проявляли, используя 150 мкл/лунку буфера OPD (Sigma). Реакцию останавливали 30 мкл/лунку 5н H2SO4. Планшеты затем считывали при 490 нм на спектрофотометре. В Таблице 8 и на ФИГ.2A (верхняя часть) приведены результаты иллюстративного связывания GD2 биспецифическими гибридными белками, полученными согласно Примеру 1. На ФИГ.2A (низ) приведены результаты связывания CD3/клетки Jurkat биспецифическими гибридными белками, полученными согласно Примеру 1. Дополнительные образцы очищенных биспецифических гибридных белков также измеряли на предмет связывания CD3/клетки Jurkat. Результаты показаны на ФИГ.2B.
[0161] Кинетику связывания in vitro определяли, используя Биосенсор Biacore T-100 (GE Healthcare). Сенсорный чип CM5 и относящиеся к нему реагенты приобретали у Biacore USA. Ганглиозиды GM1 приобретали от ALEXIS Biochemicals (AXXORA L.L.C.), и GD2 от Advanced Immunochemical. Вкратце, ганглиозиды непосредственно иммобилизовали на сенсорном чипе CM5 посредством гидрофобного взаимодействия. Поверхность сравнения была иммобилизована с помощью GM1. Активную поверхность иммобилизовали с использованием GD2 и GM1 при соотношении 1:1. Разбавленную смесь GD2 и GM1 (50 мкг/мл) инжектировали (300 мкл) при объемной скорости потока, равной 15 мкл/мин в течение 20 минут. Обширная промывка сопровождалась 10 мМ NaOH (обычно пять промывок по 20 мкл при объемной скорости потока, равной 5 мкл/мин) до получения устойчивой базовой линии.
[0162] Очищенное анти-GD2 моноклональное антитело (5F11) разбавляли в буфере HBS-E, содержащем 250 мМ NaCl при переменных концентрациях (50-1600 нМ) перед анализом. Образцы (60 мкл) инжектировали над поверхностью сенсора при объемной скорости потока, равной 30 мкл/мин в течение 2 минут. После завершения фазы ассоциации, мониторинг диссоциации проводили в буфере HBS-E, содержащем 250 мМ NaCl в течение 300 секунд при той же скорости потока. В конце каждого цикла, поверхность регенерировали, используя 50 мкл 20 мМ NaOH при объемной скорости потока, равной 50 мкл/мин в течение одной минуты, и 100 мкл 4M MgCl2 при объемной скорости потока, равной 50 мкл/мин в течение двух минут. Биосенсорные кривые, полученные после инжекции образцов над иммобилизованным GD2, вычитали с учетом контрольных кривых, полученных с образцами, инжектированными над иммобилизованным GM1 перед анализом кинетики. Данные анализировали посредством модели бивалентного анализируемого вещества и установки параметра по умолчанию для констант скорости с использованием программного обеспечения для оценки Biacore T-100. Рассчитывали константу скорости ассоциации (kon), константу скорости диссоциации (koff) и равновесную константу диссоциации (KD=koff/kon). В Таблице 9 и ФИГ.3A приведены иллюстративные сенсограммы значений KD для биспецифических гибридных белков, полученных согласно Примеру 1. Дополнительные образцы очищенных биспецифических гибридных белков также тестировали посредством Biacore. Иллюстративные результаты показаны в Таблице 10 и ФИГ.3B.
EC50 (мкг/мл)
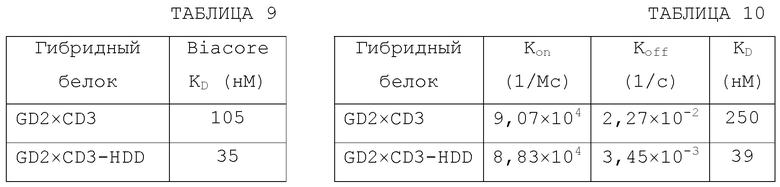
[0163] Как показано в Таблице 8, аналитические тесты связывания ELISA показали 6-кратное увеличение связывания GD2 для GD2×CD3-HDD относительно GD2×CD3 биспецифических связующих белков (также см. верхнюю часть ФИГ.2A и 2B). Связывание с клетками Jurkat не отличалось значительно (см. нижнюю часть ФИГ.2A и 2B). Анализ на Biacore связывания GD2 (ФИГ.3A и 3B; и Таблицы 9 и 10) подтверждает увеличение аффинности к опухолевой мишени GD2 в 3-6 раз.
[0164] В аналогичном эксперименте, 3LHBT-HDD (SEQ ID NO:11) тестировали на связывание GD2, как описано выше. Результаты показаны в Таблице 11 и на ФИГ.7. Результаты подтверждают, что, как описано в данном документе, 3LHBT-HDD показывает лучшую активность на основе связывания GD2. Конкретно, 3LHBT-HDD демонстрировал приблизительно в 2,5 раза более низкое EC50, чем 3LHBT.
EC50 (мкг/мл)
[0165] Взятые вместе, эти данные демонстрируют, что компонент димеризации человеческого HNF-1α эффективно индуцирует димеризацию одноцепочечного биспецифического антитела с образованием гомодимера, который усиливает функциональную аффинность к одному из антигенов биспецифического антитела (например опухолевому антигену).
Пример 3. Опосредованное T-клетками уничтожение опухолевых клеток in vitro
[0166] Данный Пример демонстрирует увеличенную способность биспецифических гомодимеров инициировать уничтожение опухолевых клеток, опосредованное через Т-клетки. Типовым образом, биспецифические связующие белки, которые мобилизуют Т-клетки, обладают способностью направлять T-клетки к участку локализации опухоли для опосредованного Т-клетками уничтожения опухоли. В данном примере показано, что иллюстративные биспецифические гомодимеры эффективно опосредуют уничтожение Т-клетками опухолевых клеток, более эффективно в сравнении с биспецифическими одноцепочечными белками.
Аналитический тест на высвобождение Хрома-51 (51Cr)
[0167] Клетки меланомы и нейробластомы (SKMEL1, NMB-7, M14, BE (1)N, HTB63, H524, SKNJC2, SKMEL28, H69, H196 и H345) культивировали в RPMI1640 (Cellgro), дополненной 10% FBS (Life Technologies) при 37°C в увлажняемом инкубаторе с 5% CO2. Клеточные линии нейробластомы LAN1 и меланомы M14 были получены из Калифорнийского Университета, Лос-Анжелес. SKNLD был разработан в Мемориальном онкологическом центре Слоана-Кеттеринга. Клеточная линия SKLND была производной от ATCC IMR-32. Верификацию проводили посредством секвенирования ДНК с коротким концевым повтором (STR).
[0168] Прилипающие клетки собирали с помощью 1× ЭДТУ. Т-клетки очищали от человеческого PBMC, используя набор Pan для выделения T-клеток в соответствии со спецификациями производителя (Miltenyi Biotec). Парамагнитные микрочастицы Dynabeads с CD3/CD28 (Invitrogen) применяли для стимуляции и распространения Т-клеток в соответствии со спецификациями производителя. Распространенные Т-клетки культивировали и поддерживали в RPMI, дополненной FBS и 30 Ед/мл интерлейкина-2 (IL-2). Популяции T-клеток идентифицировали и анализировали с помощью антител анти-CD3-перцеп cy5.5, анти-CD4-FITC, анти-CD8-APC и анти-CD56-PE (BD Biosciences) посредством проточной цитометрии, используя FACSARIA™.
[0169] Целевые опухолевые клетки метили хроматом натрия с 51Cr (Amersham, Arlington Height, IL) при 100 мкКи/106 клеток при 37°C в течение одного часа. Клетки промывали дважды. Целевые клетки (5000 клеток/лунку) предварительно смешивали с эффекторными клетками и биспецифическими гибридными белками в 96-луночных полистирольных круглодонных планшетах (BD Biosciences) до конечного объема, равного 250 мкл/лунку. Планшеты инкубировали при 37°C в течение четырех часов и затем центрифугировали при 400 g в течение пяти минут. Высвобождение 51Cr в супернатант подсчитывали в гамма-счетчике (Packed Instrument, Downers Grove, IL). Процентную долю специфического высвобождения рассчитывали, используя формулу 100% (экспериментальное число импульсов в минуту - фоновое число импульсов в минуту)/(число импульсов в минуту для 5% додецилсульфата натрия [SDS] - фоновое число импульсов в минуту), где число импульсов в минуту соответствует числу импульсов в минуту высвобожденного 51Cr. Полное высвобождение оценивали при лизисе с помощью 5% SDS (Sigma, St Louis, Mo), и фоновое высвобождение измеряли в отсутствие эффекторных клеток. Иллюстративные результаты опосредованного Т-клетками уничтожения опухолевых клеток для биспецифических гибридных белков, полученных согласно Примеру 1, приведены в Таблице 12 и на ФИГ.4.
GD2×CD3
GD2×CD3-HDD
[0170] Как показано в Таблице 12 и на ФИГ.4, GD2×CD3 и GD2×CD3-HDD биспецифические гибридные белки были способны к опосредованному уничтожению T-клетками выбранных GD2-положительных опухолевых клеточных линий. В частности, GD2×CD3-HDD показал значительное увеличение способности направлять опосредованное Т-клетками уничтожение опухолевых клеток по сравнению с GD2×CD3 (12-27-кратное увеличение, p<0,001).
[0171] Представленные Примеры как раз демонстрируют, среди прочего, что димеризация биспецифических гибридных белков, которые связываются с опухолевым антигеном и CD3, может эффективно увеличивать способность биспецифического гибридного белка опосредовать уничтожение T-клетками опухолевых клеток, которые экспрессируют опухолевый антиген.
Пример 4. Эффективность действия in vivo гомодимеров биспецифического гибридного белка
[0172] Мультиспецифические гибридные белки, описанные в предыдущих Примерах, тестировали на их эффективность действия in vivo.
Мышиная модель ксенотрансплантата
[0173] Штамм маточных мышей BALB/cA-Rag2KO/IL-2RγKO (DKO) был любезно предоставлен Др. Mamoru Ito (Центральный Институт Экспериментальных Животных [CIEA], Miyamae, Kawasaki, Japan) и его размножали в Мемориальном онкологическом центре Слоана-Кеттеринга. Животных обеспечивали питанием Сульфатрим. Уход за всеми животными соответствовал положениям Канадского Совета по Уходу за Животными. Эксперименты in vivo проводили, когда мыши достигали возраста от 6 недель до 12 недель.
[0174] Мононуклеарные клетки периферической крови (PBMC) от здоровых доноров выделяли из отходных лейкоцитарных пленок от здоровых доноров (New York Blood Center, NY). PBMC отделяли, используя разделение Фиколл-пак (GE Healthcare Life Sciences) и промывали PBS. Эритроциты истощали посредством инкубации в течение 30-60 секунд с использованием Лизирующего буфера ACK (GIBCO, Life Technologies Corp).
[0175] Очищенные PBMC смешивали с клетками SKNLD (быстро растущей подкожной нейробластомы) при соотношении 1:1 (50000 PBMC: 50,000 клетки SKNLD) в Матригеле (BD Biosciences). Мышам DKO имплантировали смешанные клетки PMBC/SKNLD. Через 4 дня после имплантации, пять мышей на группу не получали лечения, получали внутривенные инъекции GD2×CD3 (пять раз в неделю в течение двух недель) или внутривенные инъекции GD2×CD3-HDD (пять раз в неделю в течение двух недель). Размер опухоли измеряли кронциркулями дважды в неделю от дня 14 до дня 44. Кровь получали из хвостовой вены мышей DKO в течение восьми часов после болюсной инъекции 50 мкг биспецифического гибридного белка. Сывороточные уровни биспецифического гибридного белка измеряли посредством двойного сэндвич-ELISA, где биспецифический гибридный белок захватывается с использованием крысиного анти-5F11-идиотипического антитела в твердой фазе, и связанный биспецифический гибридный белок обнаруживают с использованием биотинилированного мышиного-анти-His-метки антитела (AbD Serotec) с последующей стрептавидин-HRP (Life Technologies, Invitrogen). Иллюстративные измерения объема опухоли для каждой группы показаны на ФИГ.5. Площадь под кривой рассчитывали для каждой мыши, и средние значения показаны в Таблице 15.
[0176] Иллюстративный фармакокинетический анализ GD2xCD3 и GD2xCD3-HDD показан в Таблице 16. Дополнительные образцы очищенных биспецифических гибридных белков тестировали на предмет фармакокинетического анализа (Таблица 17).
[0177] Как показано в Таблице 15, GD2xCD3 показал умеренное снижение роста опухоли (приблизительно на 18% более низкая AUC), которое не было статистически значимым (p=0,59). Однако GD2×CD3-HDD показал значительное снижение роста опухоли (приблизительно на 69% более низкая AUC, p=0,02), и более высокое, чем GD2×CD3. Фармакокинетический анализ показал более, чем 3-кратное (или приблизительно 4-кратное) увеличение периода полужизни в сыворотке для GD2×CD3-HDD относительно GD2×CD3 (p=0,002, см. Таблицы 16 и 17).
[0178] В аналогичном эксперименте, мышам DKO имплантировали смешанные клетки PMBC/M14, как описано выше. Иллюстративные измерения объема опухоли для каждой группы показаны на ФИГ.6.
[0179] Взятые вместе, эти данные показывают, что введение димерных мультиспецифических связующих белков (в данном случае, гомодимерных биспецифических белков антитела), которые целенаправленно действуют на опухолевый антиген и Т-клетки через CD3, эффективно снижает рост опухоли in vivo. В частности, такое снижение роста опухоли является более высоким по сравнению с тем же самым биспецифическим связующим белком в одноцепочечной конформации. Дополнительно, гомодимерные биспецифические связующие белки демонстрируют более длительный период полужизни по сравнению с одноценочечными конформациями того же самого биспецифического связующего белка.
Пример 5. Аналитический тест на высвобождение цитокинов
[0180] Мультиспецифические гибридные белки, описанные в предыдущих Примерах, тестировали, чтобы подтвердить, что метка димеризации (HDD, SEQ ID NO:1) не могла бы усиливать высвобождение цитокинов, являющееся результатом увеличенного связывания с CD3.
[0181] Вкратце, PBMC выделяли из крови здоровых доноров посредством центрифугирования в среде для фракционирования лимфоцитов (Mediatech, Inc.). Человеческие Т-клетки очищали посредством набора Pan для выделения T-клеток в соответствии со спецификациями изготовителя (Miltenyi Biotec). Т-клетки (50000 клеток/на лунку) совместно культивировали с клетками SKNLD нейробластомы (10000 клеток/на лунку) в 96-луночном планшете с BsАb при 37°C. Супернатанты собирали через 24 часа. Концентрацию четырех различных цитокинов (IL-2, IL-10, IFN-γ и TNF-α) измеряли с использованием набора для анализа цитокинов на основе ELISA (набор человеческих цитокинов OptEIA™, BD Biosciences) в соответствии со спецификациями изготовителя. Уровень каждого цитокина количественно оценивали в соответствии со стандартом, поставляемым вместе с аналитическим набором. Образцы положительного контроля подвергали анализу с использованием T-клеток, активированных иммуномикроносителями с CD3/CD8, чтобы подтвердить адекватное обнаружение цитокинов. В Таблице 18 приведены иллюстративные данные высвобождения цитокинов из человеческих Т-клеток в присутствии BsАb или родительского гуманизированного антитела OKT3 (единицы даны в пг/мл). В Таблице 19 приведены данные высвобождения цитокинов из человеческих Т-клеток в присутствии BsАb и клеток SKNLD нейробластомы или родительского гуманизированного антитела OKT3 (единицы даны в пг/мл).
[0182] Как показано в Таблицах 18 и 19, не наблюдали никакого значительного увеличения высвобождения цитокинов для GD2×CD3-HDD BsАb относительно GD2×CD3 у Т-клеток с добавленными опухолевыми клеткам (p=0,7) или без них (p=0,5). Взятые вместе, данные результаты подтверждают, что, как описано в данном документе, биспецифические гибридные белки, описанные в Примере 1, максимизируют увеличение функциональной аффинности к дистальному антигену (GD2), а не проксимальному антигену (CD3), что, таким образом, приводит к увеличенному уничтожению опухоли без увеличения высвобождения цитокинов, которое является известным побочным эффектом мобилизующих T-клетки биспецифических антител.
Пример 6. Характеризация мультиспецифических гибридных белков с компонентами димеризации
[0183] Настоящий Пример описывает дополнительное получение мультиспецифических связующих средств, которые специфически конструируют для придания способности к димеризации посредством использования различных компонентов димеризации, например, синтетического домена типа спираль-поворот-спираль ("dHLX", GELEELLKHLKELLKG-PRK-GELEELLKHLKELLK, SEQ ID NO:24; Pluckthun et al., 1997, Immunotechnology 3(2):83) и человеческого IgGl Fc. dHLX, подобно HDD, составлен из домена типа спираль-петля-спираль, который образует нековалентные димеры. Напротив, dHLX является синтетическим и может быть иммуногенным, если его инъекционно вводят людям.
[0184] Биспецифические связующие средства GD2×CD3 получали либо с HDD, доменом dHLX или человеческим IgGl Fc по их соответствующим C-концам (как описано в Примере 1) и тестировали на GD2 связывание (как описано в Примере 2) и in vitro на опосредованное Т-клетками уничтожение опухолевых клеточных линий меланомы M14 и нейробластомы LΑN-1 (как описано в Примере 3). В Таблице 20 и ФИГ.8 приведены результаты иллюстративного связывания GD2 для биспецифических связующих средств GD2×CD3 с различными доменами димеризации. В Таблице 21 и ФИГ.9 приведены результаты иллюстративного in vitro опосредованного Т-клетками уничтожения опухолевых клеточных линий меланомы M14 и нейробластомы LΑN-1 под действием биспецифических связующих средств GD2×CD3 с различными доменами димеризации.
EC50 (нМ)
(%)
(%)
[0185] Как показано в Таблице 20 и на ФИГ.8, аналогичное связывание с GD2 наблюдали для димерных биспецифических гибридных белков GD2×CD3-HDD и GD2×CD3-Fc (0,6 нМ по сравнению с 0,3 нМ), димеров, которые являлись результатом нековалентных и ковалентных взаимодействий, соответственно. Напротив, димерный GD2×CD3-dHLX, также как мономерный GD2xCD3, демонстрировал в несколько раз более низкую авидность связывания с GD2 (т.е., 2,9 нМ и 5,0 нМ, соответственно). Дополнительно, в отличие от других димерных гибридных белков, GD2×CD3-dHLX демонстрировал существенную агрегацию (данные не показаны).
[0186] Как показано в Таблице 21 и на ФИГ.9, GD2×CD3-HDD демонстрировал in vitro наиболее эффективное опосредованное Т-клетками уничтожение опухолевых клеточных линий меланомы M14 и нейробластомы LΑN-1. Кроме того, несмотря на обладание немного более высокой авидности к GD2, GD2×CD3-Fc демонстрировал in vitro более низкое уничтожение опухолевых клеток, измеренное посредством как EC50, так и по максимальному процентному уничтожению опухоли, чем GD2×CD3-HDD. Напротив, GD2×CD3-dHLX демонстрировал самое низкое уничтожение опухолевых клеток, которое заметно было ниже, чем для мономерного GD2xCD3.
[0187] Взятые вместе, эти дополнительные данные демонстрируют, что, как описано в данном документе, HDD может обеспечить димерные биспецифические средства с увеличенной авидностью связывания опухолевого антигена и сходной с авидностью связывания, достигаемой с ковалентными доменами димеризации (например, человеческим IgGl Fc). HDD обеспечивал улучшенное опосредованное Т-клетками уничтожение по сравнению с уничтожением, наблюдаемым с другими доменами димеризации, подтверждая то, что настоящее изобретение предоставляет уникально полезный компонент димеризации, особенно, для применения в мобилизующих Т-клетки биспецифических связующих средствах.
[0188] Как показано в предшествующих Примерах, гибридизация компонента димеризации из человеческого HNF-1α с карбокси-концом тандемного scFv GD2×CD3 инициирует образование стабильных димеров и увеличивает функциональную аффинность дистального противоопухолевого компонента антитела биспецифического димера. Обычно, опухоли избегают Т-клетки посредством регуляции с понижением H1Α и регуляции с повышением регуляторных Т-клеток, препятствуя хомингу цитолитических Т-клеток (CTL) в целом, низкой клональной частоты. Биспецифические антитела, задействующие CD3 на Т-клетках, могут активировать и перенаправлять поликлональные Т-клетки к опухолям. Биспецифические димеры настоящего изобретения обладают увеличенной функциональной аффинностью для опухолевых клеток, экспрессирующих GD2, и приводят к значительному увеличению уничтожения опухолевых клеток в аналитических тестах in vitro с GD2-положительными опухолевыми клеточными линиями, используя активированные Т-клетки в качестве эффекторов. Компонент димеризации настоящего изобретения не увеличивает значительно связывание T-клеток или высвобождение цитокина, которое известно в качестве неблагоприятного побочного эффекта задействующей Т-клетки иммунотерапии биспецифическими антителами.
[0189] Кроме того, Примеры демонстрируют, что метка HDD является особенно полезной, когда ее присоединяют к компонентам антител, как продемонстрировано в биспецифическом антителе GD2xCD3 (BsAb). Авторы изобретения продемонстрировали уникальную конструкцию для BsАb (см. ФИГ.1), которое может увеличивать авидность для конкретного эпитопа одного плеча связывания BsАb (т.е., дистального анти-GD2 конца, а не проксимального анти-CD3 конца). Основным недостатком при разработке задействующих T-клетки биспецифических антител являлась сверхстимуляция Т-клеток, являющаяся результатом мобилизации CD3. Такая мобилизация может приводить к избыточному высвобождению цитокинов (известному как цитокиновая буря), которое приводит к серьезным неблагоприятным эффектам у пациентов. Как показано в Примерах, использование метки HDD tag в GD2×CD3 BsАb увеличивает связывание с GD2, а не с CD3 (см. ФИГ.2), не вызывая какого-либо существенного отличия по высвобождению цитокинов (см. Таблицы 18 и 19, сравнивающие мономерный GD2xCD3 и димерный GD2×CD3-HDD). Как GD2×CD3, так и GD2×CD3-HDD антитела демонстрировали в несколько раз меньшее высвобождение цитокинов, чем бивалентное анти-CD3 IgG huOKT3.
[0190] Взятые вместе, биспецифические димерные объекты настоящего изобретения увеличивали аффинность и эффективность уничтожения в сравнении с их недимеризованными аналогами, и, в сочетании с увеличенным периодом полужизни в сыворотке, приводили к значительному уменьшению опухоли на мышиной модели ксенотрансплантата нейробластомы.
[0191] Имея, таким образом, описанные несколько аспектов по меньшей мере одного варианта осуществления данного изобретения, следует учитывать, что различные изменения, модификации и усовершенствования будут полностью очевидными для квалифицированных специалистов в области. Такие изменения, модификации и усовершенствования предназначены, чтобы быть частью данного раскрытия, и подразумеваются охватываемыми сущностью и объемом изобретения. Соответственно, приведенное выше описание и чертежи приведены только путем примера, и изобретение описано подробно посредством формулы изобретения, которая следует ниже.
Эквиваленты
[0192] Применение терминов порядковых числительных, таких как "первый", "второй", "третий" и т.д. в формуле изобретения для модификации элемента пункта формулы изобретения само по себе не означает какого-либо приоритета, старшинства или порядка одного элемента пункта формулы изобретения по отношению к другому или временного порядка, в котором выполняются действия способа, но их используют просто в качестве меток для различения одного элемента пункта формулы изобретения, имеющего некоторое наименование, от другого элемента, имеющего то же самое наименование (но для применения термина порядкового числительного), чтобы различать элементы пункта формулы изобретения.
[0193] Артикли "a" и "an", как используют в данном документе в описании и в формуле изобретения, если явным образом не указано противоположное, должны быть поняты, как включающие множественные объекты. Формула изобретения или описания, которые включают "или" между одним или более членами группы, считаются оправданными, если один, более одного, или все из членов группы присутствуют и используются в данном продукте или процессе, или иным образом относятся к данному продукту или процессу, если не указано противоположное, или иным образом не является очевидным из контекста. Изобретение включает варианты осуществления, в которых точно один член группы присутствует в данном продукте или процессе, используется в данном продукте или процессе или иным образом относится к данному продукту или процессу. Изобретение также включает варианты осуществления, в которых более одного или все члены группы присутствуют в данном продукте или процессе, используются в данном продукте или процессе или иным образом относятся к данному продукту или процессу. Кроме того, следует понимать, что изобретение охватывает все вариации, комбинации и перестановки, в которых одно или более ограничений, элементов, статей, описательных терминов и т.д., из одного или нескольких перечисленных пунктов вводят в еще один другой пункт, зависимый от того же самого основного пункта (или, соответственно, любого другого пункта), если не указано иначе или иным образом не является очевидным для рядового специалиста в области, что будет возникать противоречие или несоответствие. Там, где элементы представлены в виде списков (например, в группе Маркуша или аналогичном формате), следует понимать, что каждая подгруппа элементов также является раскрытой, и любые элемент(ы) могут быть удалены из группы. Следует понимать, что, в целом, там, где изобретение или аспекты изобретения, упоминаются как содержащие конкретные элементы, признаки и т.д., некоторые варианты осуществления изобретения или аспекты изобретения состоят, или состоят по существу из, таких элементов, признаков и т.д. С целью упрощения эти варианты осуществления в каждом случае конкретно не приведены определенно в данном документе. Следует также понимать, что любой вариант осуществления или аспект изобретения могут явным образом быть исключены из формулы изобретения, независимо от того, изложено ли конкретное исключение в описании. Публикации, веб-сайты и другие ссылочные материалы, указанные в данном документе для описания уровня техники изобретения и для предоставления дополнительных подробностей, касающихся его практического осуществления, включены в данный документ посредством ссылки.
--->
СПИСОК ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> Мемориальный онкологический центр Слоана-Кеттеринга
<120> ТЕХНОЛОГИИ МУЛЬТИМЕРИЗАЦИИ
<130> 2003080-0636
<150> 61/791,600
<151> 2013-03-15
<160> 24
<170> PatentIn version 3.5
<210> 1
<211> 32
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 1
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
1 5 10 15
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
20 25 30
<210> 2
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 2
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser
130 135 140
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser
195 200 205
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser
210 215 220
Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 3
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 3
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Ile Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys
130 135 140
Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr Thr Met His Trp Val Lys
145 150 155 160
Gln Ser His Gly Lys Ser Leu Glu Trp Ile Gly Gly Ile Asn Pro Asn
165 170 175
Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu
180 185 190
Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Asp Thr Thr Val
210 215 220
Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 4
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 4
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Cys Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser
130 135 140
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser
195 200 205
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser
210 215 220
Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Arg Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 5
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 5
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Ile Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser
100 105 110
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Gln Gln
115 120 125
Ser Gly Pro Glu Leu Val Lys Pro Gly Ala Ser Val Lys Ile Ser Cys
130 135 140
Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr Thr Met His Trp Val Lys
145 150 155 160
Gln Ser His Gly Lys Cys Leu Glu Trp Ile Gly Gly Ile Asn Pro Asn
165 170 175
Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe Lys Gly Lys Ala Thr Leu
180 185 190
Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr Met Glu Leu Arg Ser Leu
195 200 205
Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys Ala Arg Asp Thr Thr Val
210 215 220
Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 6
<211> 491
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 6
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Cys Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln
115 120 125
Ser Pro Ala Ile Met Ser Ala Ser Pro Gly Glu Lys Val Thr Met Thr
130 135 140
Cys Ser Ala Ser Ser Ser Ile Ser Tyr Met His Trp Tyr Gln Gln Lys
145 150 155 160
Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
165 170 175
Ser Gly Val Pro Ala Arg Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr
180 185 190
Ser Leu Thr Ile Ser Ser Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr
195 200 205
Cys His Gln Arg Ser Ser Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys
210 215 220
Leu Glu Ile Lys Arg Ala Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln
245 250 255
Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys
260 265 270
Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr Thr Met His Trp Val Arg
275 280 285
Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser
290 295 300
Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile
305 310 315 320
Ser Arg Asp Asn Ser Lys Asn Thr Ala Phe Leu Gln Met Asp Ser Leu
325 330 335
Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp
340 345 350
His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly Thr Pro Val Thr Val Ser
355 360 365
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
370 375 380
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
385 390 395 400
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
405 410 415
Asn Trp Tyr Gln Gln Thr Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
420 425 430
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
435 440 445
Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu
450 455 460
Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
465 470 475 480
Phe Gly Gln Gly Thr Lys Leu Gln Ile Thr Arg
485 490
<210> 7
<211> 491
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 7
Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser Ala Ser Pro Gly
1 5 10 15
Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser Ile Ser Tyr Met
20 25 30
His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys Arg Trp Ile Tyr
35 40 45
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg Phe Ser Gly Ser
50 55 60
Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser Met Glu Ala Glu
65 70 75 80
Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser Tyr Pro Leu Thr
85 90 95
Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser
100 105 110
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
115 120 125
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
130 135 140
Thr Met His Trp Val Lys Gln Ser His Gly Lys Cys Leu Glu Trp Ile
145 150 155 160
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
165 170 175
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
180 185 190
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
195 200 205
Ala Arg Asp Thr Thr Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr
210 215 220
Val Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser
225 230 235 240
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln
245 250 255
Ser Gly Gly Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys
260 265 270
Lys Ala Ser Gly Tyr Thr Phe Thr Arg Tyr Thr Met His Trp Val Arg
275 280 285
Gln Ala Pro Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser
290 295 300
Arg Gly Tyr Thr Asn Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile
305 310 315 320
Ser Arg Asp Asn Ser Lys Asn Thr Ala Phe Leu Gln Met Asp Ser Leu
325 330 335
Arg Pro Glu Asp Thr Gly Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp
340 345 350
His Tyr Cys Leu Asp Tyr Trp Gly Gln Gly Thr Pro Val Thr Val Ser
355 360 365
Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser
370 375 380
Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly
385 390 395 400
Asp Arg Val Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met
405 410 415
Asn Trp Tyr Gln Gln Thr Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr
420 425 430
Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser
435 440 445
Gly Ser Gly Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu
450 455 460
Asp Ile Ala Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr
465 470 475 480
Phe Gly Gln Gly Thr Lys Leu Gln Ile Thr Arg
485 490
<210> 8
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 8
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Cys Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Tyr Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser
130 135 140
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser
195 200 205
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser
210 215 220
Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Arg Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 9
<211> 501
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 9
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Gln Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Ser Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Phe Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser
130 135 140
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser
195 200 205
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser
210 215 220
Tyr Pro Leu Thr Phe Gly Ala Gly Thr Lys Leu Glu Ile Lys Arg Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg
500
<210> 10
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 10
Gln Val Gln Leu Gln Gln Ser Gly Pro Glu Leu Val Lys Pro Gly Ala
1 5 10 15
Ser Val Lys Ile Ser Cys Lys Thr Ser Gly Tyr Lys Phe Thr Glu Tyr
20 25 30
Thr Met His Trp Val Lys Gln Ser His Gly Lys Cys Leu Glu Trp Ile
35 40 45
Gly Gly Ile Asn Pro Asn Asn Gly Gly Thr Asn Tyr Asn Gln Lys Phe
50 55 60
Lys Gly Lys Ala Thr Leu Thr Val Asp Lys Ser Ser Ser Thr Ala Tyr
65 70 75 80
Met Glu Leu Arg Ser Leu Thr Ser Glu Asp Ser Ala Val Tyr Tyr Cys
85 90 95
Ala Arg Asp Thr Thr Val Pro Tyr Ala Tyr Trp Gly Gln Gly Thr Thr
100 105 110
Val Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
115 120 125
Gly Gly Gly Ser Asp Ile Glu Leu Thr Gln Ser Pro Ala Ile Met Ser
130 135 140
Ala Ser Pro Gly Glu Lys Val Thr Met Thr Cys Ser Ala Ser Ser Ser
145 150 155 160
Ile Ser Tyr Met His Trp Tyr Gln Gln Lys Pro Gly Thr Ser Pro Lys
165 170 175
Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala Ser Gly Val Pro Ala Arg
180 185 190
Phe Ser Gly Ser Gly Ser Gly Thr Ser Tyr Ser Leu Thr Ile Ser Ser
195 200 205
Met Glu Ala Glu Asp Ala Ala Thr Tyr Tyr Cys His Gln Arg Ser Ser
210 215 220
Tyr Pro Leu Thr Phe Gly Cys Gly Thr Lys Leu Glu Ile Lys Arg Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 11
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 11
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 12
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 12
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 13
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 13
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 14
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 14
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 15
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 15
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 16
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 16
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 17
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 17
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Gly Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 18
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 18
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 19
<211> 553
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 19
Glu Val Thr Leu Val Glu Ser Gly Gly Asp Phe Val Lys Pro Gly Gly
1 5 10 15
Ser Leu Lys Val Ser Cys Ala Ala Ser Gly Phe Ala Phe Ser His Tyr
20 25 30
Ala Met Ser Trp Val Arg Gln Thr Pro Ala Lys Arg Leu Glu Trp Val
35 40 45
Ala Tyr Ile Ser Ser Gly Gly Ser Gly Thr Tyr Tyr Ser Asp Ser Val
50 55 60
Lys Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Thr Leu Tyr
65 70 75 80
Leu Gln Met Arg Ser Leu Arg Ser Glu Asp Ser Ala Met Tyr Phe Cys
85 90 95
Thr Arg Val Lys Leu Gly Thr Tyr Tyr Phe Asp Ser Trp Gly Gln Gly
100 105 110
Thr Thr Leu Thr Val Ser Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly
115 120 125
Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln Thr Ala Ser Ser
130 135 140
Leu Pro Ala Ser Leu Gly Asp Arg Val Thr Ile Ser Cys Ser Ala Ser
145 150 155 160
Gln Asp Ile Ser Asn Tyr Leu Asn Trp Tyr Gln Gln Lys Pro Asp Gly
165 170 175
Thr Val Lys Leu Leu Ile Phe Tyr Ser Ser Asn Leu His Ser Gly Val
180 185 190
Pro Ser Arg Phe Ser Gly Gly Gly Ser Gly Thr Asp Tyr Ser Leu Thr
195 200 205
Ile Ser Asn Leu Glu Pro Glu Asp Ile Ala Thr Tyr Phe Cys His Gln
210 215 220
Tyr Ser Lys Leu Pro Trp Thr Phe Gly Gly Gly Thr Lys Leu Glu Ile
225 230 235 240
Lys Arg Ala Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly
245 250 255
Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly
260 265 270
Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser
275 280 285
Gly Tyr Thr Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro
290 295 300
Gly Lys Gly Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr
305 310 315 320
Thr Asn Tyr Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp
325 330 335
Asn Ser Lys Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu
340 345 350
Asp Thr Gly Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys
355 360 365
Leu Asp Tyr Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly
370 375 380
Gly Gly Ser Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln
385 390 395 400
Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val
405 410 415
Thr Ile Thr Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr
420 425 430
Gln Gln Thr Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser
435 440 445
Lys Leu Ala Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly
450 455 460
Thr Asp Tyr Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala
465 470 475 480
Thr Tyr Tyr Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln
485 490 495
Gly Thr Lys Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His
500 505 510
Thr Ser Gly Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu
515 520 525
Ala Ala Leu Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala
530 535 540
Leu Gly Glu Gly Ser Gly Gly Ala Pro
545 550
<210> 20
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 20
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 21
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 21
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Lys Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Ser Gly Val Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Ile Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ala Phe Met Ser Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Met Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 22
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 22
Glu Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn His
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 23
<211> 550
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 23
Lys Ile Val Met Thr Gln Thr Pro Ala Thr Leu Ser Val Ser Ala Gly
1 5 10 15
Glu Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Ser Val Ser Asn Asp
20 25 30
Val Thr Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Ala Ser Asn Arg Tyr Thr Gly Ile Pro Ala Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Glu Phe Thr Phe Thr Ile Ser Ser Val Gln Ser
65 70 75 80
Glu Asp Phe Ala Val Tyr Phe Cys Gln Gln Asp Tyr Ser Ser Phe Gly
85 90 95
Gln Gly Thr Lys Leu Glu Ile Lys Arg Gly Gly Gly Gly Ser Gly Gly
100 105 110
Gly Gly Ser Gly Gly Gly Gly Ser Gln Val Gln Leu Val Glu Ser Gly
115 120 125
Pro Gly Val Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Val
130 135 140
Ser Gly Phe Ser Val Thr Asn Tyr Gly Val His Trp Val Arg Gln Pro
145 150 155 160
Pro Gly Lys Gly Leu Glu Trp Leu Gly Val Ile Trp Ala Ile Gly Ile
165 170 175
Thr Asn Tyr Asn Ser Ser Val Lys Gly Arg Leu Thr Ile Ser Lys Asp
180 185 190
Asn Ser Lys Asn Thr Val Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu
195 200 205
Asp Thr Ala Val Tyr Tyr Cys Ala Ser Arg Gly Gly His Tyr Gly Tyr
210 215 220
Ala Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser Ala
225 230 235 240
Ser Thr Lys Gly Pro Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Gly
245 250 255
Gly Gly Gly Ser Gln Val Gln Leu Val Gln Ser Gly Gly Gly Val Val
260 265 270
Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Lys Ala Ser Gly Tyr Thr
275 280 285
Phe Thr Arg Tyr Thr Met His Trp Val Arg Gln Ala Pro Gly Lys Gly
290 295 300
Leu Glu Trp Ile Gly Tyr Ile Asn Pro Ser Arg Gly Tyr Thr Asn Tyr
305 310 315 320
Asn Gln Lys Phe Lys Asp Arg Phe Thr Ile Ser Arg Asp Asn Ser Lys
325 330 335
Asn Thr Ala Phe Leu Gln Met Asp Ser Leu Arg Pro Glu Asp Thr Gly
340 345 350
Val Tyr Phe Cys Ala Arg Tyr Tyr Asp Asp His Tyr Cys Leu Asp Tyr
355 360 365
Trp Gly Gln Gly Thr Pro Val Thr Val Ser Ser Gly Gly Gly Gly Ser
370 375 380
Gly Gly Gly Gly Ser Gly Gly Gly Gly Ser Asp Ile Gln Met Thr Gln
385 390 395 400
Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr
405 410 415
Cys Ser Ala Ser Ser Ser Val Ser Tyr Met Asn Trp Tyr Gln Gln Thr
420 425 430
Pro Gly Lys Ala Pro Lys Arg Trp Ile Tyr Asp Thr Ser Lys Leu Ala
435 440 445
Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Tyr
450 455 460
Thr Phe Thr Ile Ser Ser Leu Gln Pro Glu Asp Ile Ala Thr Tyr Tyr
465 470 475 480
Cys Gln Gln Trp Ser Ser Asn Pro Phe Thr Phe Gly Gln Gly Thr Lys
485 490 495
Leu Gln Ile Thr Arg Thr Pro Leu Gly Asp Thr Thr His Thr Ser Gly
500 505 510
Met Val Ser Lys Leu Ser Gln Leu Gln Thr Glu Leu Leu Ala Ala Leu
515 520 525
Leu Glu Ser Gly Leu Ser Lys Glu Ala Leu Ile Gln Ala Leu Gly Glu
530 535 540
Gly Ser Gly Gly Ala Pro
545 550
<210> 24
<211> 34
<212> PRT
<213> Искусственная последовательность
<220>
<223> синтетическая
<400> 24
Gly Glu Leu Glu Glu Leu Leu Lys His Leu Lys Glu Leu Leu Lys Gly
1 5 10 15
Pro Arg Lys Gly Glu Leu Glu Glu Leu Leu Lys His Leu Lys Glu Leu
20 25 30
Leu Lys
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| Биспецифическое антитело анти-HER2/анти-4-1BB и его применение | 2020 |
|
RU2831838C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО АНТИ-EGFR/АНТИ-4-1ВВ И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2831836C2 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО ПРОТИВ ВИРУСА БЕШЕНСТВА И ЕГО ПРИМЕНЕНИЕ | 2019 |
|
RU2764740C1 |
| БИСПЕЦИФИЧЕСКОЕ АНТИТЕЛО И ЕГО ПРИМЕНЕНИЕ | 2021 |
|
RU2839153C2 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2837821C1 |
| НАЦЕЛЕННЫЕ НА ОПУХОЛЬ АГОНИСТИЧЕСКИЕ CD28-АНТИГЕНСВЯЗЫВАЮЩИЕ МОЛЕКУЛЫ | 2019 |
|
RU2808030C2 |
| АНТИТЕЛО ПРОТИВ СТОЛБНЯЧНОГО ТОКСИНА И ЕГО ПРИМЕНЕНИЕ | 2020 |
|
RU2815280C1 |
| МОНОСПЕЦИФИЧЕСКИЕ И БИСПЕЦИФИЧЕСКИЕ БЕЛКИ С РЕГУЛИРОВАНИЕМ ИММУННОЙ КОНТРОЛЬНОЙ ТОЧКИ ДЛЯ ЛЕЧЕНИЯ РАКА | 2018 |
|
RU2793167C2 |
| БИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА, СВЯЗЫВАЮЩИЕСЯ С TFR | 2019 |
|
RU2810756C2 |
| АНТИТЕЛА ПРОТИВ GUCY2C И ИХ ПРИМЕНЕНИЕ | 2019 |
|
RU2812113C2 |

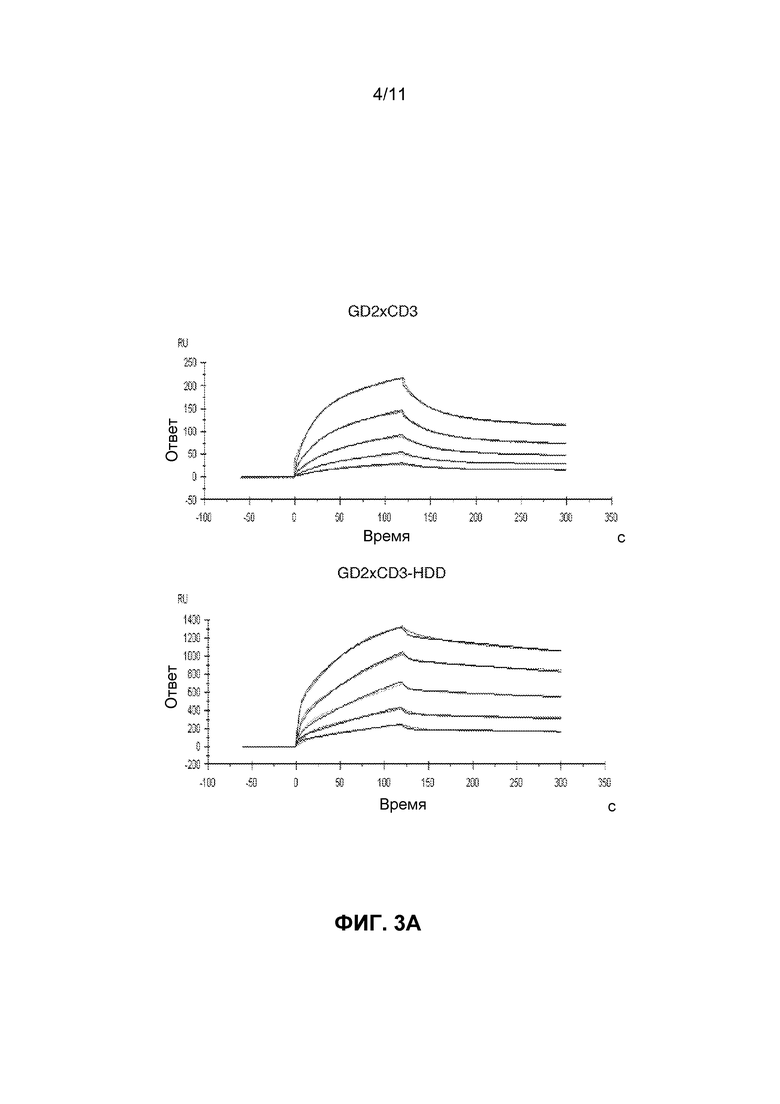
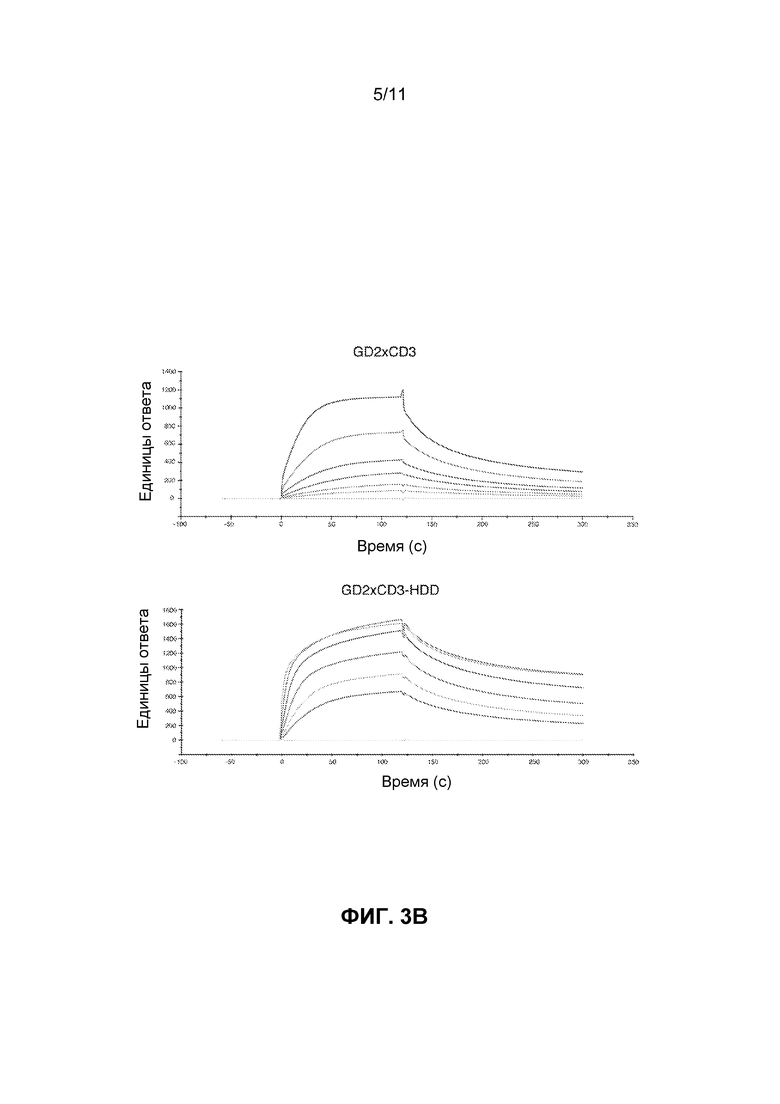
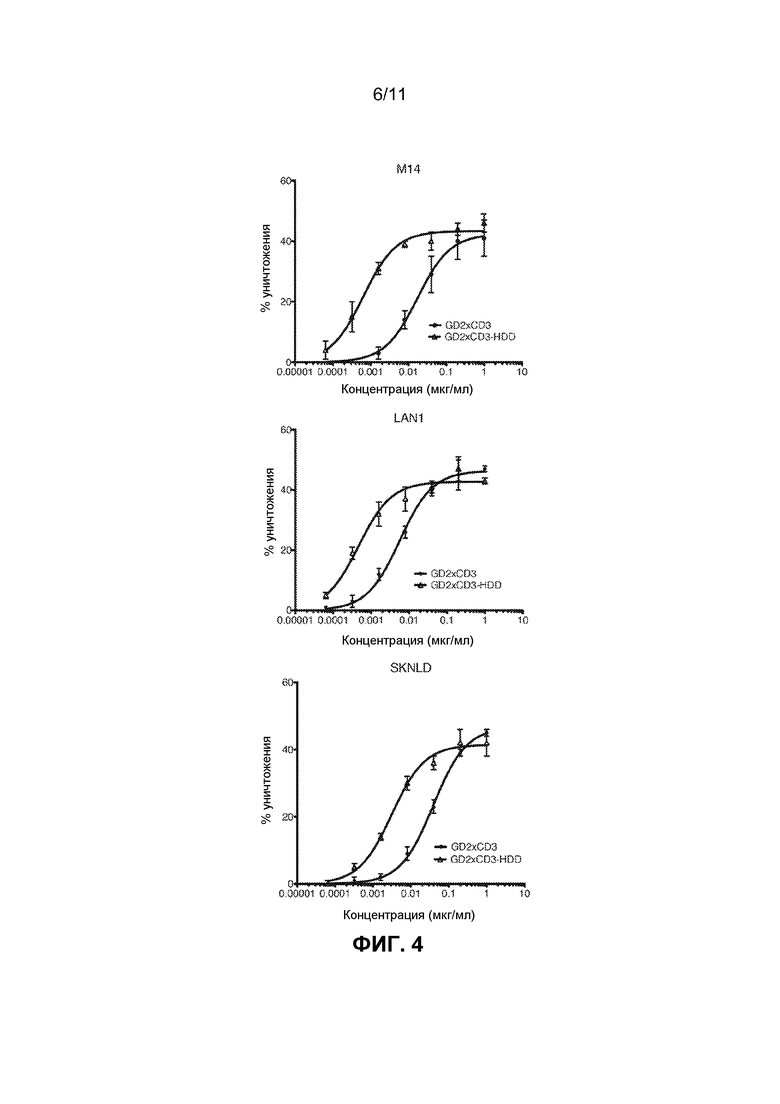
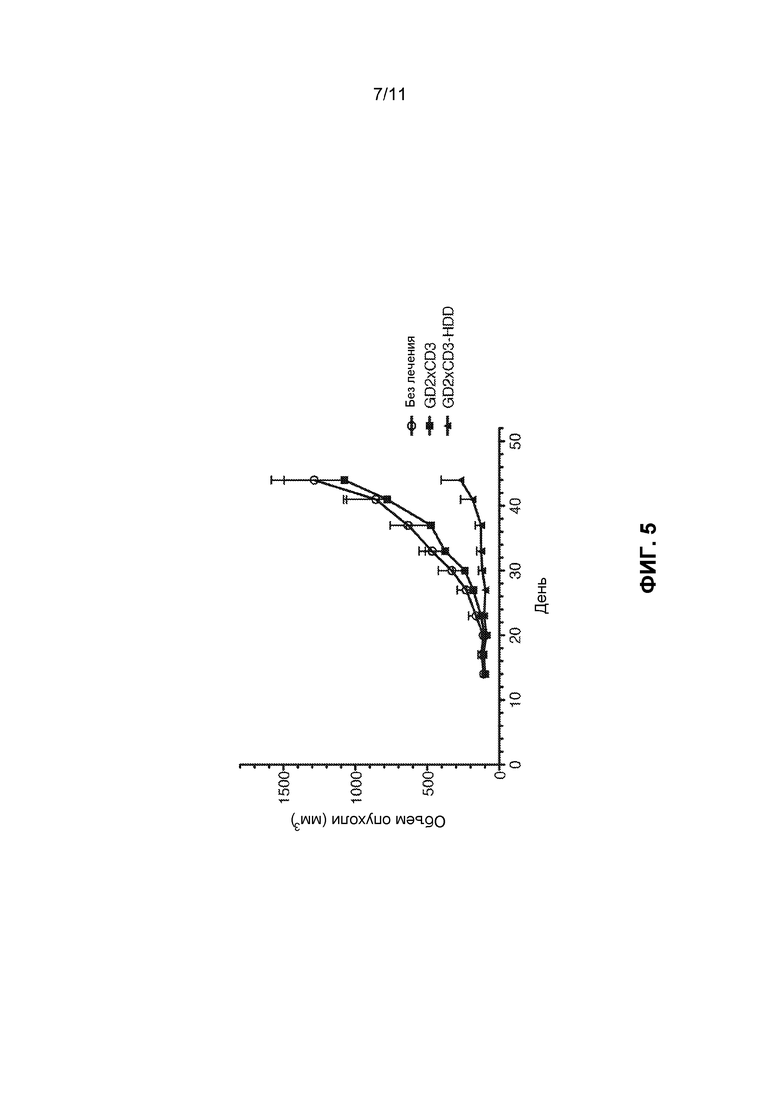
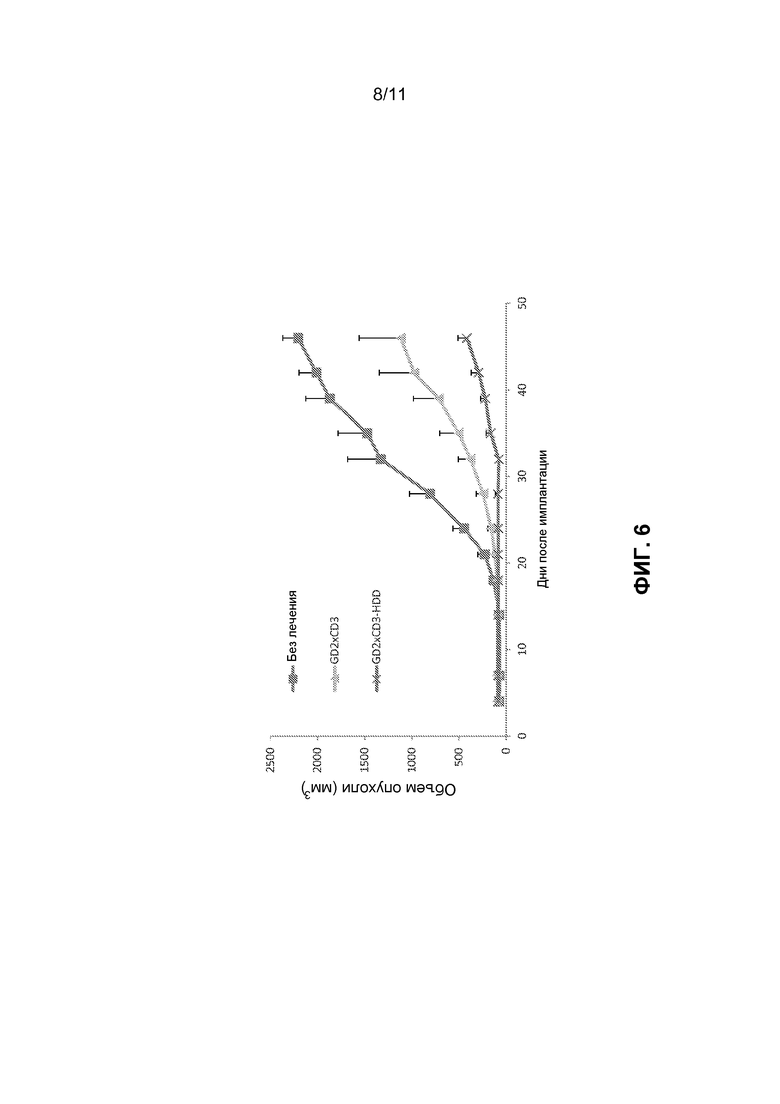

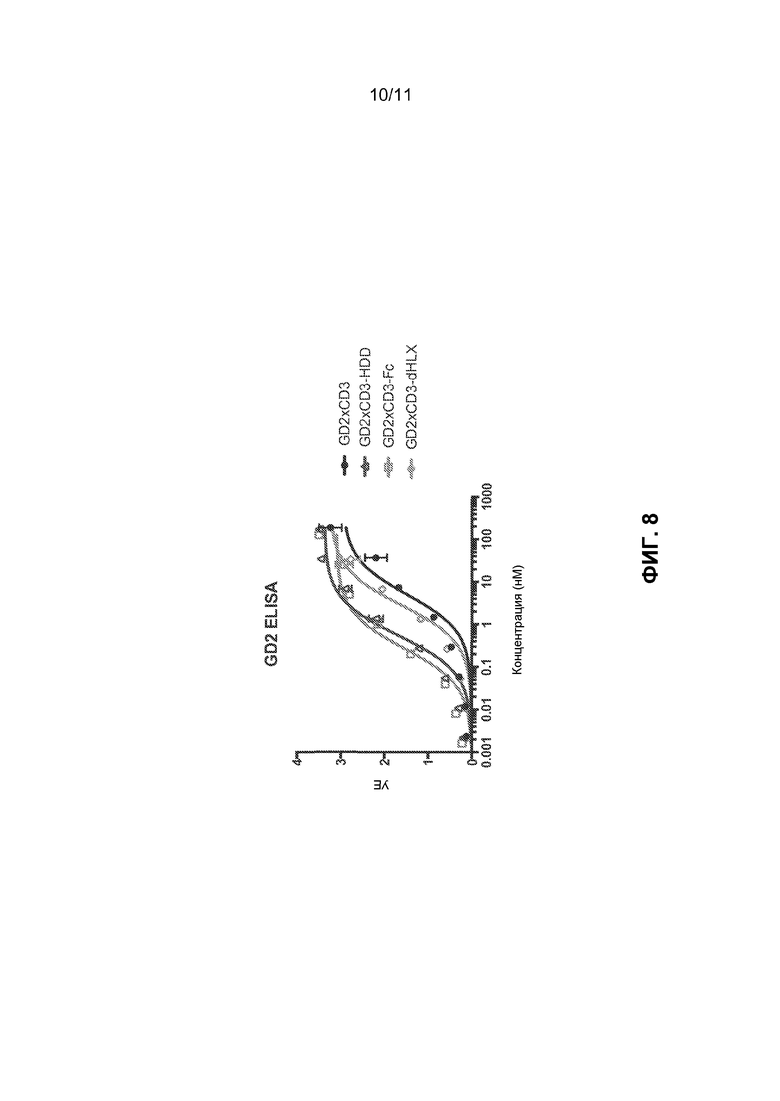

Настоящее изобретение относится к области иммунологии. Предложены биспецифическое антитело и слитый белок для специфического связывания с GD2 и CD3. Также рассмотрены фармацевтические композиции, нуклеиновая кислота, вектор экспрессии, клетка-хозяин и способ получения биспецифического антитела. Кроме того, описан способ уничтожения клеток нейробластомы, способ ингибирования роста нейробластомы и способ увеличения времени полужизни биспецифического антитела. Данное изобретение может найти дальнейшее применение в увеличении активности антител, мобилизующих Т-клетки, для иммунотерапии злокачественных образований, в частности нейробластомы. 11 н. и 7 з.п. ф-лы, 11 ил., 19 табл., 6 пр.
1. Биспецифическое антитело для специфического связывания с GD2 и CD3, где биспецифическое антитело состоит из двух слитых белков, причем каждый из слитых белков содержит, в направлении от N-конца к C-концу:
(i) первый фрагмент scFv, который связывает GD2, как он представлен в любой из SEQ ID NO: 2-18 и 20-23;
(ii) второй фрагмент scFv, который связывает CD3, как он представлен в любой из SEQ ID NO: 2-18 и 20-23; и
(iii) компонент димеризации, содержащий элемент человеческого гепатоцитарного ядерного фактора-1 альфа (HNF-1α), содержащий аминокислотные остатки 1-32 последовательности SEQ ID NO: 1,
где слитые белки димеризуются через компонент димеризации HNF-1α с образованием гомодимера.
2. Антитело по п.1, где каждый из слитых белков содержит последовательность, которая выбрана из любой из SEQ ID NO: 11-18 и 20-23.
3. Фармацевтическая композиция для лечения заболеваний, связанных с GD2, содержащая в эффективном количестве биспецифическое антитело по п.1 или 2 и фармацевтически приемлемый носитель.
4. Слитый белок для специфического связывания с GD2 и CD3, содержащий, в направлении от N к C:
(i) первый фрагмент scFv, который связывает GD2, как он представлен в любой из SEQ ID NO: 2-18 и 20-23,
(ii) второй фрагмент scFv, который связывает CD3, как он представлен в любой из SEQ ID NO: 2-18 и 20-23, и
(iii) компонент димеризации, содержащий элемент человеческого гепатоцитарного ядерного фактора-1 альфа (HNF-1α), содержащий аминокислотные остатки 1-32 последовательности SEQ ID NO: 1,
где слитый белок способен димеризоваться через компонент димеризации HNF-1α с образованием гомодимера.
5. Слитый белок по п.4, где слитый белок содержит последовательность, которая выбрана из любой из SEQ ID NO: 11-18 и 20-23.
6. Фармацевтическая композиция для лечения заболеваний, связанных с GD2, содержащая в эффективном количестве слитый белок по п. 4 или 5 и фармацевтически приемлемый носитель, где слитый белок димеризовался через компонент димеризации HNF-1α с образованием гомодимера.
7. Нуклеиновая кислота, кодирующая слитый белок по п.4 или 5.
8. Вектор экспрессии, содержащий нуклеиновую кислоту по п.7.
9. Клетка-хозяин для экспрессии слитого белка, который специфически связывается с GD2 и CD3, содержащая вектор по п.8.
10. Клетка-хозяин по п.9, где клетку выбирают из бактериальной клетки, дрожжевой клетки, клетки насекомого или клетки млекопитающего.
11. Клетка-хозяин по п.10, где клетку-хозяина выбирают из группы, состоящей из клеток E.coli, Pichia pastoris, Sf9, COS, HEK293 и CHO.
12. Способ получения димерного биспецифического антитела, включающий в себя культивирование клетки-хозяина по п.11 при условиях, подходящих для экспрессии слитого белка, где слитый белок димеризуется через компонент димеризации HNF-1α с образованием димерного биспецифического антитела, и извлечение димерного биспецифического антитела.
13. Способ уничтожения клеток нейробластомы, включающий в себя стадии контактирования клеток нейробластомы с биспецифическим антителом, состоящим из двух слитых белков, каждый из которых содержит, в направлении от N-конца к C-концу:
(i) первый фрагмент scFv, который связывается с GD2, как он представлен в любой из SEQ ID NO: 2-18 и 20-23,
(ii) второй фрагмент scFv, который связывается с CD3, как он представлен в любой из SEQ ID NO: 2-18 и 20-23, на Т-клетках, и
(iii) компонент димеризации, содержащий элемент человеческого HNF-1α, содержащий аминокислотные остатки 1-32 последовательности SEQ ID NO: 1, где слитые белки димеризуются через компонент димеризации HNF-1α с образованием гомодимера,
причем контактирование выполняют при условиях и в течение времени, достаточных, чтобы Т-клетки, с которыми связался гомодимер, опосредовали уничтожение клеток нейробластомы.
14. Способ по п.13, где каждый из слитых белков содержит последовательность, которая выбрана из любой из SEQ ID NO: 11-18 и 20-23.
15. Способ ингибирования роста нейробластомы, включающий стадии:
контактирования нейробластомы с биспецифическим антителом, состоящим из двух слитых белков, каждый из которых содержит, в направлении от N-конца к C-концу:
(i) первый фрагмент scFv, который связывается с GD2, как он представлен в любой из SEQ ID NO: 2-18 и 20-23,
(ii) второй фрагмент scFv, который связывается с CD3, как он представлен в любой из SEQ ID NO: 2-18 и 20-23, на Т-клетках, и
(iii) компонент димеризации, содержащий элемент человеческого HNF-1α, содержащий аминокислотные остатки 1-32 последовательности SEQ ID NO: 1, где слитые белки димеризуются через компонент димеризации HNF-1α с образованием гомодимера,
причем контактирование выполняют при условиях и в течение времени, достаточных, чтобы Т-клетки, с которыми связался гомодимер, ингибировали рост нейробластомы.
16. Способ по п.15, где каждый из слитых белков содержит последовательность, которая выбрана из любой из SEQ ID NO: 11-18 и 20-23.
17. Способ увеличения времени полужизни биспецифического антитела, включающий:
введение компонента димеризации HNF-1α, содержащего аминокислотные остатки 1-32 последовательности SEQ ID NO: 1, так чтобы биспецифическое антитело состояло из двух слитых белков, каждый из которых содержит, в направлении от N-конца к C-концу:
(i) первый фрагмент scFv, который связывается с GD2, как он представлен в любой из SEQ ID NO: 2-18 и 20-23,
(ii) второй фрагмент scFv, который связывается с CD3, как он представлен в любой из SEQ ID NO: 2-18 и 20-23, на Т-клетках, и
(iii) компонент димеризации HNF-1α,
где слитые белки способны к димеризации с образованием гомодимера.
18. Способ по п.17, где каждый из слитых белков содержит последовательность, которая выбрана из любой из SEQ ID NO: 11-18 и 20-23.
| US 20060228300 A1, 12.10.2006 | |||
| ВЫСЕВАЮЩИЙ АППАРАТ | 1992 |
|
RU2050764C1 |
| US 20070298041 A1, 27.12.2007 | |||
| YANKELEVICH M | |||
| et al | |||
| Переносная печь для варки пищи и отопления в окопах, походных помещениях и т.п. | 1921 |
|
SU3A1 |
| Устройство для охлаждения водою паров жидкостей, кипящих выше воды, в применении к разделению смесей жидкостей при перегонке с дефлегматором | 1915 |
|
SU59A1 |
| Способ восстановления хромовой кислоты, в частности для получения хромовых квасцов | 1921 |
|
SU7A1 |
| Приспособление для перемещения нижней крышки в загрузочной коробке генератора | 1923 |
|
SU1198A1 |
| CD19XCD3-СПЕЦИФИЧЕСКИЕ ПОЛИПЕПТИДЫ И ИХ ПРИМЕНЕНИЕ | 1999 |
|
RU2228202C2 |
Авторы
Даты
2020-02-19—Публикация
2014-03-14—Подача