Область техники, к которой относится изобретение
Настоящее изобретение относится к новому условно реплицирующему аденовирусу и содержащему его реактиву для обнаружения раковых клеток или диагностики рака.
Уровень техники
Применяемые современные методы диагностики рака в основном включают (i) методы с использованием оборудования большого размера (например, МРТ) и (ii) методы обнаружения маркеров рака и т.п. в крови, более простые и менее обременительные для пациентов, на которые в настоящее время возлагаются надежды. В частности, раковые клетки, циркулирующие в периферической крови раковых больных (т.е. циркулирующие опухолевые клетки (ЦОК)), тесно связаны с клиническими симптомами, поскольку эти клетки повышают риск системных метастазов, а прогноз для пациентов, у которых обнаружены ЦОК, является в значительной степени неблагоприятным. Таким образом, предполагается создание простого и высокочувствительного метода обнаружения ЦОК в качестве прогностического показателя или заменителя маркера для прогнозирования.
Методы, используемые для обнаружения ЦОК, включают обнаружение с помощью сопутствующего раку антигена, такого как ЕpСАМ (молекула адгезии эпителиальных клеток) или цитокератин-8 (например, с помощью системы CellSearch), обнаружение методом полимеразной цепной реакции с обратной транскрипцией (ПЦР с обратной транскрипцией) и т.д. Тем не менее, поскольку эти сопутствующие раку антигены также экспрессируют в нормальных эпителиальных клетках, высока вероятность ложноположительного обнаружения, и в то же время в случае обнаружения методом ПЦР невозможно наблюдать морфологические характеристики раковых клеток. По этим причинам существует потребность в новом методе в том, что касается чувствительности, простоты, точности и стоимости.
С другой стороны, авторами настоящего изобретения уже создан условно реплицирующий аденовирус, специфический для раковых клеток и экспрессирующий GFP (экспрессирующий GFP условно реплицирующий аденовирус: GFP-CRAd) (называемый TelomeScan®, ОВР-401 или Telomelysin-GFP) (патентный документ 1: WO 2006/036004). Кроме того, авторами настоящего изобретения также создан простой метод обнаружения ЦОК с использованием TelomeScan (непатентный документ 1: Kojima Т. и др., J. Clin. Invest., 119; 3172, 2009).
Тем не менее, поскольку TelomeScan содержит фибриллярный белок аденовируса серотипа 5 и инфицирует клетки-мишени посредством рецептора вируса Коксаки и аденовируса (CAR), TelomeScan не может инфицировать клетки, которые не экспрессируют CAR. В частности, известно, что экспрессия CAR уменьшается в высокозлокачественных раковых клетках, которые являются высокоинвазивными, метастатическими и пролиферативными (непатентный документ 2: Okegawa Т., и др., Cancer Res., 61: 6592-6600, 2001); следовательно, TelomeScan может не обнаруживать эти высокозлокачественные раковые клетки. Кроме того, хотя это и менее вероятно, TelomeScan может давать ложноположительные результаты вследствие инфицирования и роста в нормальных клетках крови (например, лейкоцитах), вызывающего экспрессию GFP.
По этим причинам существует потребность в реактиве для обнаружения раковых клеток и реактиве для диагностики рака, каждый из которых обнаруживает все раковые клетки, включая CAR-негативные клетки, и не дает ложноположительных результатов в нормальных клетках крови.
Документы известного уровня техники
Патентные документы
Патентный документ 1: WO 2006/036004
Непатентный документ 1: Kojima Т., и др., J. Clin. Invest., 119: 3172, 2009
Непатентный документ 2: Okegawa Т., и др., Cancer Res., 61: 6592-6600, 2001
Краткое изложение сущности изобретения
Задача, решаемая в изобретении
Настоящее изобретение создано с учетом перечисленных обстоятельств, и в его основу положена задача создания реактива для обнаружения раковых клеток и реактива для диагностики рака, каждый из которых обнаруживает все раковые клетки, включая CAR-негативные клетки, и не дает ложноположительных результатов в нормальных клетках крови, а также задача создания условно реплицирующего рекомбинантного аденовируса, применимого в качестве такого реактива.
Средства решения задачи
В результате обширных и интенсивных усилий, направленных на решение указанной задачи, авторы настоящего изобретения обнаружили, что при замене фибриллярного белка аденовируса серотипа 5 в TelomeScan связывающим CD46 фибриллярным белком другого аденовируса, который активно экспрессирует почти во всех клетках человека, в частности, в раковых клетках можно обнаруживать не только CAR-позитивные клетки, но также CAR-негативные клетки. Кроме того, авторам настоящего изобретения удалось исключить ложноположительные результаты в клетках крови путем встраивания в TelomeScan опосредованной микроРНК генно-регуляторной сети, что привело к созданию настоящего изобретения.
Более точно, в настоящем изобретении предложено следующее.
(1) Полинуклеотид, содержащий промотор обратной транскриптазы теломеразы человека (hTERT), ген E1А, последовательность 1RES и ген E1B в указанном порядке и содержащий последовательность-мишень первой микроРНК.
(2) Полинуклеотид по п. (1), в котором первая микроРНК экспрессирует в нераковых клетках.
(3) Полинуклеотид по п. (1) или (2), в котором первой микроРНК является по меньшей мере одна микроРНК, выбранная из группы, включающей miR-142, miR-15, miR-16, miR-21, miR-126, miR-181, miR-223, miR-296, miR-125, miR-143, miR-145, miR-199 и let-7.
(4) Рекомбинантный аденовирус, содержащий репликативную кассету, в которой содержится полинуклеотид по любому из п.п. (1)-(3), при этом репликативная кассета встроена в область E1 генома аденовируса.
(5) Рекомбинантный аденовирус по п. (4), дополнительно содержащий маркерную кассету, в которой содержится репортерный ген и промотор, способный регулировать экспрессию гена, при этом маркерная кассета встроена в область ЕЗ генома аденовируса.
(6) Рекомбинантный аденовирус по п. (5), в котором маркерная кассета дополнительно содержит последовательность-мишень второй микроРНК.
(7) Рекомбинантный аденовирус по п. (4), в котором в область ЕЗ генома аденовируса дополнительно встроена индуцирующая некроз клеток кассета, содержащая ген, который кодирует связанный с индуцированием некроза клеток белок и промотор, способный регулировать экспрессию гена.
(8) Рекомбинантный аденовирус по п. (7), в котором индуцирующая некроз клеток кассета дополнительно содержит последовательность-мишень второй микроРНК.
(9) Рекомбинантный аденовирус по п. (6) или (8), в котором вторая микроРНК экспрессирует в нераковых клетках.
(10) Рекомбинантный аденовирус по п. (9), в котором второй микроРНК является по меньшей мере одна микроРНК, выбранная из группы, включающей miR-142, miR-15, miR-16, miR-21, miR-126, miR-181, miR-223, miR-296, miR-125, miR-143, miR-145, miR-199 и let-7.
(11) Рекомбинантный аденовирус по п. (5) или (6), в котором репортерным геном является ген, который кодирует белок, испускающий флуоресцентное свечение, или ген, который кодирует ферментативный белок, выделяющий люминофор или хромофор в результате ферментативной реакции.
(12) Рекомбинантный аденовирус по любому из п.п. (5)-(10), в котором промотором является промотор обратной транскриптазы теломеразы человека или промотор цитомегаловируса.
(13) Рекомбинантный аденовирус по любому из п.п. (4)-(12), дополнительно содержащий ген, который кодирует связывающий CD46 фибриллярный белок.
(14) Рекомбинантный аденовирус по п. (13), в котором связывающий CD46 фибриллярный белок содержит по меньшей мере фибриллярную область утолщения в фибриллярном белке аденовируса серотипа 34 или 35.
(15) Реактив для обнаружения раковых клеток, содержащий рекомбинантный аденовирус по любому из п.п. (4)-(14).
(16) Реактив для диагностики рака, содержащий рекомбинантный аденовирус по любому из п.п. (4)-(14).
(17) Реактив по п. (15), в котором раковые клетки выделены из биологического образца, взятого у объекта.
(18) Реактив по п. (17), в котором биологическим образцом является кровь.
(19) Реактив по п. (15) или (18), в котором раковыми клетками являются циркулирующие опухолевые клетки.
(20) Реактив по любому из п.п. (15) и (17)-(19), в котором раковыми клетками являются резистентные к лекарственным средствам раковые клетки.
(21) Реактив по любому из п.п. (15) и (17)-(20), в котором раковыми клетками являются стволовые раковые клетки.
(22) Реактив по любому из п.п. (15) и (17)-(21), в котором раковыми клетками являются раковые клетки, в которых произошел эпителиально-мезенхимальный переход или мезенхимально-эпителиальный переход.
(23) Способ обнаружения раковых клеток, включающий введение раковых клеток в контакт с рекомбинантным аденовирусом по п. (11) и обнаружение флуоресцентного свечения или окрашивания, вызванного раковыми клетками.
(24) Способ по п. (23), в котором раковые клетки выделены из биологического образца, взятого у объекта.
(25) Способ по п. (24), в котором биологическим образцом является кровь.
(26) Способ по п. (25), в котором раковыми клетками являются циркулирующие опухолевые клетки.
Эффект изобретения
Настоящее изобретение обеспечивает простое и высокочувствительное обнаружение CAR-негативных раковых клеток без обнаружения нормальных клеток крови (например, лейкоцитов).
Краткое описание чертежей
На фиг. 1 схематически проиллюстрирован один из примеров структуры рекомбинантного аденовируса согласно настоящему изобретению.
На фиг. 2 показаны результаты измерения активности рекомбинантных аденовирусов методом проточной цитометрии.
На фиг. 3 показаны результаты, полученные для клеток H1299, содержащихся в образцах крови.
На фиг. 4 показаны результаты, полученные для клеток А549, содержащихся в образцах крови.
На фиг. 5 показаны результаты измерения активности рекомбинантного аденовируса согласно настоящему изобретению в раковых клетках различных типов.
На фиг. 6 показаны результаты, полученные для раковых клеток, в которых произошел эпителиально-мезенхимальный переход (ЕМТ).
На фиг. 7 показаны результаты, полученные для стволовых раковых клеток.
На фиг. 8 показаны результаты, полученные для клеток H1299 и Т24, взятых из образцов крови, с использованием красного флуоресцирующего белка.
Описание вариантов осуществления
Далее настоящее изобретение будет описано более подробно. Описанные варианты осуществления имеют целью проиллюстрировать настоящее изобретение, а не ограничить его только этими вариантами осуществления. Настоящее изобретение может быть реализовано в различных формах, не выходящих за пределы его существа. Кроме того, в настоящую заявку в порядке ссылки включено раскрытие и чертежи патентной заявки Японии 2011-181414 (поданной 23 августа 2011 г. ), на основании которой испрашивается приоритет настоящей заявки.
1. Краткое изложение
TelomeScan (т.е. условно реплицирующий аденовирус, содержащий промотор hTERT, ген E1А, последовательность 1RES и ген E1В, встроенные в указанном порядке в лишенную E1 область аденовируса серотипа 5, и содержащий промотор цитомегаловируса (CMV) и GFP, встроенные в указанном порядке в лишенную Е3 область аденовируса серотипа 5), ранее созданный авторами настоящего изобретения, имеет следующие недостатки: (i) TelomeScan может не обнаруживать высокозлокачественные раковые клетки в случае уменьшенной экспрессии CAR; и (ii) TelomeScan может обнаруживать нормальные клетки крови как ложноположительные. В результате обширных и интенсивных усилий, направленных на преодоление указанных недостатков, авторы настоящего изобретения обнаружили, что высокозлокачественные CAR-негативные раковые клетки можно обнаруживать в случае замены фибриллярного белка аденовируса серотипа 5 в TelomeScan связывающим CD46 фибриллярным белком другого аденовируса, который активно экспрессирует почти во всех клетках человека, в частности, в раковых клетках. Кроме того, авторами настоящего изобретения было обнаружено, что путем встраивания последовательности-мишени miR-142-3р, которой является микроРНК, в каждую из репликативных и маркерных кассет TelomeScan можно предотвращать рост вируса и экспрессию маркерного белка в нормальных клетках крови и тем самым исключать получение ложноположительных результатов в нормальных клетках крови.
В частности, в одном из предпочтительных вариантов осуществления настоящего изобретения рекомбинантным аденовирусом согласно настоящему изобретению является рекомбинантный аденовирус, у которого в область E1 генома аденовируса встроена репликативная кассета, содержащая промотор hTERT, ген E1А, последовательность 1RES, ген E1В и последовательность-мишень микроРНК, а в область Е3 генома аденовируса встроена маркерная кассета, содержащая репортерный ген, промотор, способный регулировать экспрессию гена, и последовательность-мишень микроРНК, и который содержит ген, который кодирует связывающий CD46 фибриллярный белок аденовируса (фиг. 1). Этот рекомбинантный аденовирус обладает следующими свойствами.
(i) За счет гена, кодирующего связывающий CD46 фибриллярный белок аденовируса, этот рекомбинантный аденовирус способен инфицировать почти все клетки, включая CAR-негативные клетки.
(ii) За счет промотора hTERT этот рекомбинантный аденовирус является специфическим для экспрессирующих hTERT раковых клеток, а также увеличивает экспрессию репортерного гена в процессе роста, в результате чего образование маркерного белка, хромофора и т.п. может быть увеличено до поддающихся обнаружению уровней.
(iii) За счет последовательности-мишени микроРНК этот рекомбинантный аденовирус способен предотвращать появление ложноположительных результатов, даже когда вирус инфицирует нормальные клетки с активным промотором hTERT, поскольку экспрессия этой микроРНК предотвращает не только рост вируса, но также экспрессию репортерного гена. В частности, за счет последовательности-мишени микроРНК, которая специфически экспрессирует в клетках крови, этот рекомбинантный аденовирус способен предотвращать появление ложноположительных результатов, даже когда вирус инфицирует нормальные клетки крови с активным промотором hTERT, поскольку экспрессия этой микроРНК предотвращает не только рост вируса, но также экспрессию репортерного гена.
Эти сведения были положены в основу создания настоящего изобретения.
2. Рекомбинантный аденовирус
(1) Репликативная кассета
В настоящем изобретении предложен полинуклеотид, содержащий промотор обратной транскриптазы теломеразы человека (hTERT), ген E1А, последовательность 1RES и ген E1B в указанном порядке и содержит последовательность-мишень микроРНК. Кроме того, в настоящем изобретении предложен рекомбинантный аденовирус, содержащий репликативную кассету, в которой содержится упомянутый полинуклеотид, при этом репликативная кассета встроена в область E1 генома аденовируса.
За счет действия упомянутого полинуклеотида (или содержащей его репликативной кассеты) может обеспечиваться специфический рост рекомбинантного аденовируса согласно настоящему изобретению в раковых клетках, а также может предотвращаться его рост в клетках, которые экспрессируют желаемую микроРНК. Например, если последовательностью-мишенью микроРНК, содержащейся в репликативной кассете согласно настоящему изобретению, является последовательность-мишень микроРНК, которая специфически экспрессирует в клетках крови, обеспечивается специфический рост рекомбинантного аденовируса согласно настоящему изобретению в экспрессирующих hTERT раковых клетках и предотвращается его рост в нормальных клетках крови.
Промотор обратной транскриптазы теломеразы человека (hTERT) является промотором обратной транскриптазы, которая является одним из элементов теломеразы человека. Хотя активность теломеразы человека увеличивается за счет сплайсинга мРНК hTERT, посттрансляционной модификации белка hTERT и других событий, предполагается, что наиболее важным молекулярным механизмом является усиленная экспрессия гена hTERT, т.е. повышенная активность промотора hTERT. Подтверждено, что активность теломеразы человека повышена в 85% или более случаев рака у людей, при этом она не проявляет активности в большинстве нормальных клетках. Соответственно, за счет применения промотора hTERT следующий за ним ген может специфически экспрессировать в раковых клетках. В настоящем изобретении промотор hTERT расположен до гена E1А, последовательности 1RES и гена E1В, за счет чего обеспечивается специфический рост вируса в экспрессирующих hTERT раковых клетках.
Подтверждено, что hTERT имеет множество связывающих транскрипционный фактор последовательностей в области 1,4 т.п.н. до ее конца 5', и эта область считается промотором hTERT. В частности, последовательность из 181 п. н. до сайта инициации трансляции является сердцевинной областью, важной для экспрессии ее последующих генов. Хотя в настоящем изобретении может использоваться любая последовательность при условии, что она содержит эту сердцевинную область, предпочтительно в качестве промотора hTERT используется предшествующая последовательность приблизительно из 378 п. н., которая полностью перекрывает эту сердцевинную область. Подтверждено, что эта последовательность приблизительно из 378 п. н. обладает такой же эффективностью с точки зрения экспрессии генов, как и сама сердцевинная область из 181 п. н. Нуклеотидная последовательность промотора hTERT из 455 п. н. представлена в SEQ ID NO: 1.
Помимо последовательности, представленной в SEQ ID NO: 1, нуклеотидная последовательность промотора hTERT содержит последовательности полинуклеотидов, которые поддаются гибридизации в строгих условиях с нуклеотидной последовательностью ДНК, комплементарной нуклеотидной последовательности ДНК, представленной в SEQ ID NO: 1, и содержит активный промотор hTERT. Такие полинуклеотиды могут быть получены из кДНК и библиотеки генов известными методами гибридизации (например, методом гибридизации колоний микроорганизмов, бляшкообразования, саузерн-блоттинга) с использованием полинуклеотида, который состоит из нуклеотидной последовательности, представленной в SEQ ID NO: 1, или ее фрагмента в качестве зонда.
Что касается создания библиотек кДНК, можно сослаться на "Molecular Cloning, А Laboratory Manual 2nd ed" (Cold Spring Harbor Press (1989)). В качестве альтернативы, в этих целях также могут использоваться предлагаемые на рынке к ДНК и библиотеки генов.
Строгие условия упомянутой гибридизации включают, например, условия от 1 × SSC до 2 × SSC, от 0,1% до 0,5% SDS и температуру от 42°С до 68°С, более точно, предварительную гибридизацию при температуре от 60°С до 68°С в течение 30 минут или более и затем от 4 до 6 циклов промывания в 2 × SSC, 0,1% SDS при комнатной температуре в течение 5-15 минут.
Что касается подробных процедур гибридизации, можно сослаться на "Molecular Cloning, A Laboratory Manual 2nd ed" (Cold Spring Harbor Press (1989); в частности, раздел 9.47-9.58) и т.д.
Гены Е1А и Е1В входят в ген E1 аденовирус. Этот ген E1 является одним из ранних генов из числа ранних (Е) и поздних (L) вирусных генов, имеющих отношение к репликации ДНК, и кодирует белок, имеющий отношение к регуляции транскрипции вирусного генома. Белок E1, кодированный геном E1 А аденовируса, активирует транскрипцию определенной группы генов (например, E1В, Е2, Е4), необходимых для образования инфекционного вируса. Белок E1В, кодированный геном E1В аденовируса, помогает позднему гену (L-гену) мРНК накапливаться в цитоплазме инфицированных клеток-хозяев и ингибирует синтез белка в клетках-хозяевах, способствуя тем самым репликации вируса. Нуклеотидные последовательности генов E1А и E1В представлены в SEQ ID NO: 2 и SEQ ID NO: 3, соответственно. Помимо последовательностей, представленных в SEQ ID NO: 2 и SEQ ID NO: 3, нуклеотидные последовательности генов E1А и E1В включают нуклеотидные последовательности, которые поддаются гибридизации в строгих условиях с нуклеотидной последовательностью ДНК, комплементарной нуклеотидной последовательности ДНК, представленной в SEQ ID NO: 2 или SEQ ID NO: 3, и кодируют белок, содержащий активный E1А или E1В. Процедуры и строгие условия гибридизация являются такими же, как описаны выше применительно к промотору hTERT.
Последовательность 1RES (внутреннего сайта посадки рибосомы) является сигналом инициации синтеза белка, специфическим для семейства пикорнавирусов, и предположительно служит сайтом связывания рибосомы, поскольку является комплементарной концу 3' рибосомной РНК 18S. Известно, что эта последовательность опосредует трансляцию мРНК, выделенных из вирусов семейства пикорнавирусов. Эффективность трансляции посредством последовательности IRES является высокой, и синтез белка происходит даже в мРНК независимо от структуры кэпа. Таким образом, в вирусе согласно настоящему изобретению ген E1А и ген E1В, следующий за последовательностью IRES, в обоих случаях независимо транслируются под действием промотора hTERT. При использовании последовательности IRES как в гене E1А, так и в гене E1В независимо происходит опосредованная промотором hTERT регуляция экспрессии, и, следовательно, рост вируса можно более строго ограничить клетками с активной теломеразой в отличие от случая, когда промотором hTERT регулируется какой-либо один из генов: E1А или E1В. Кроме того, последовательность IRES вставленная между генами E1А и генами E1В, может усиливать способность роста вируса в клетках-хозяевах. Нуклеотидная последовательность IRES представлена в SEQ ID NO: 4. Помимо последовательности, представленной в SEQ ID NO: 4, нуклеотидная последовательность IRES включает нуклеотидные последовательности, которые поддаются гибридизации в строгих условиях с нуклеотидной последовательностью ДНК, комплементарной нуклеотидной последовательности ДНК, представленной в SEQ ID NO: 4, и кодируют белок с активным IRES. Процедуры и строгие условия гибридизация являются такими же, как описаны выше применительно к промотору hTERT.
МикроРНК в целом представляют собой короткие однонитевые РНК приблизительно из 15-25 нуклеотидов и, как предполагаются, регулируют трансляцию различных генов при связывании их последовательности-мишени, присутствующей в мРНК. Так, например, когда экспрессирующие микроРНК клетки инфицируются рекомбинантным аденовирусом, содержащим желаемый ген и последовательность-мишень микроРНК, в этих клетках предотвращается экспрессия желаемого гена. Такая последовательность-мишень микроРНК может вставляться в любой сайт при условии, что предотвращается экспрессия желаемого гена, но предпочтительно вставляется в нетранслируемую область желаемого гена, более предпочтительно после желаемого гена.
Последовательность-мишень микроРНК, используемая в настоящем изобретении, включает последовательности-мишени микроРНК, которая экспрессируют в нераковых клетках. Подразумевается, что нераковые клетки означают клетки, не являющиеся клетками злокачественных опухолей, и их примеры включают нормальные клетки, клетки доброкачественных опухолей и т.п. Нормальные клетки включают, например, нормальные клетки крови, нормальные эндотелиальные клетки, нормальные фибробласты, нормальные стволовые клетки и т.п. С другой стороны, циркулирующие опухолевые клетки считаются клетками, порождаемыми злокачественными опухолями, и, следовательно, они относятся к клеткам злокачественных опухолей в соответствии с настоящим изобретением.
Последовательность-мишень микроРНК, используемая в настоящем изобретении, также включает последовательности-мишени микроРНК, которая специфически экспрессирует в клетках крови. В соответствии с настоящим изобретением "клетки крови" могут включать не только нормальные клетки крови, но также раковые клетки крови. В частности, в соответствии с настоящим изобретением "микроРНК, которая специфически экспрессирует в клетках крови", может специфически экспрессировать в нормальных клетках крови или может специфически экспрессировать как в нормальных клетках крови, так и раковых клетках крови. Даже в случае экспрессии как в нормальных, так и раковых клетках крови, микроРНК также может уменьшать число ложноположительных случаев обнаружения нормальных клеток крови во время обнаружения циркулирующих опухолевых клеток и тем самым обеспечивает точное обнаружение циркулирующих опухолевых клеток, которые высвобождаются из твердых опухолей. В соответствии с настоящим изобретением "микроРНК, которая специфически экспрессирует в клетках крови" более предпочтительно представляет собой микроРНК, которая экспрессирует в нормальных клетках крови, но не экспрессирует в раковых клетках крови.
В соответствии с настоящим изобретением клетки крови включают без ограничения лейкоциты (т.е. нейтрофилы, эозинофилы, базофилы, лимфоциты (Т-клетки и В-клетки), моноциты, дендритные клетки), СD34-позитивные клетки, кроветворные клетки, кроветворные стволовые клетки, кроветворные клетки-предшественники, одноядерные клетки периферической крови (РВМС) и т.п. Аналогичным образом, раковые клетки крови включают лейкозные клетки, клетки лимфомы и т.п. В соответствии с настоящим изобретением подразумевается, что "специфическая экспрессия" в определенных клетках означает не только то, что экспрессия ограничена только целевыми клетками, но также то, что уровни экспрессии являются более высокими в целевых клетках, чем в других клетках. Например, подразумевается, что "специфическая экспрессия в клетках крови" означает не только то, что экспрессия ограничена только клетками крови, но также то, что уровни экспрессии являются более высокими в клетках крови, чем в каких-либо других клетках.
МикроРНК, которая специфически экспрессирует в клетках крови включает, например, miR-142, miR-15, miR-16, miR-21, miR-126, miR-181, miR-223, miR-296 и т.п., при этом предпочтительными являются miR-142, miR-15 и miR-16.
Хотя микроРНК является однонитевой РНК, может использоваться последовательность-мишень любой нити двунитевой РНК с преждевременной терминацией синтеза при условии, что может предотвращаться экспрессия желаемого гена. Например, для miR-142 существуют miR-142-3р и miR-142-5p, и в настоящем изобретении может использоваться последовательность-мишень любой микроРНК. В частности, в соответствии с настоящим изобретением "miR-142" включает как miR-142-3р, так и miR-142-5p, при этом miR-142-3p является предпочтительной. Аналогичным образом, в соответствии с настоящим изобретением "miR-15" включает смысловую нить (именуемую "miR-15S") и антисмысловую нить (именуемую "miR-15AS") двунитевой РНК с преждевременной терминацией синтеза. То же самое касается других микроРНК.
Ген miR-142-3р находится в сайте транслокации в лейкозных В-клетках (агрессивных лейкозных В-клетках), и, как известно, экспрессирует в кроветворных тканях (например, костном мозге, селезенке, вилочковой железе), но не экспрессирует в других тканях. Кроме того, поскольку экспрессия miR-142-3р наблюдалась в фетальной печени мышей (фетальной кроветворной ткани), считается, что miR-142-3р участвует в дифференциации системы кроветворения (Chang-Zheng Chen, и др., Science, 2004).
В этом варианте осуществления экспрессия гена избирательно регулируется на двух стадиях, поскольку специфическая экспрессия в раковых клетках происходит под действием промотора hTERT, а экспрессия в клетках крови регулируется под действием микроРНК.
В другом варианте осуществления последовательность-мишень микроРНК, используемая в настоящем изобретении, включает последовательность-мишень микроРНК, экспрессия которой в раковых клетках подавлена. МикроРНК, экспрессия которой в раковых клетках подавлена, включает, например, miR-125, miR-143, miR-145, miR-199, let-7 и т.п. В этом варианте осуществления предусмотрена двойная специфическая экспрессия гена в раковых клетках под действием промотора hTERT и микроРНК.
Хотя молекулы микроРНК были первоначально обнаружены в нематодах, дрожжах и других организмах, в настоящее время они обнаружены в нескольких сотнях микроРНК человека и мышей. Последовательности этих микроРНК известны, а информация о последовательностях и т.п. может быть получена в общедоступных базах данных (например, в базе данных последовательностей miRBase (http://microrna.sanger.ac.uk/sequences/index.shtml, http://www.mirbase.org/)).
Далее представлены последовательности miR-142, микроРНК-15, микроРНК-16, miR-21, miR-126, miR-181, miR-223, miR-296, miR-125, miR-143, miR-145, miR-199 и let-7.

В соответствии с настоящим изобретением отдельное звено последовательности-мишени микроРНК образовано последовательностью, комплементарной всей микроРНК или ее части, и содержит от 7 до 30 нуклеотид, предпочтительно от 19 до 25 нуклеотид, более предпочтительно от 21 до 23 нуклеотид. В соответствии с настоящим изобретением подразумевается, что отдельное звено последовательности-мишени микроРНК означает нуклеотидную последовательность минимальной необходимой длины для того, чтобы служить мишенью определенных микроРНК. Более точно, подразумевается олигонуклеотид по меньшей мере из 7 нуклеотид, выбранных из комплементарных нуклеотидных последовательностей, представленных в SEQ ID NO: 5-26, и в таком олигонуклеотиде может содержаться замена, деления, присоединение или удаление одного или нескольких нуклеотидов в любом положении(-ях).
Последовательность-мишень в целом, встраиваемая в полинуклеотид или рекомбинантный аденовирус согласно настоящему изобретению, может содержать несколько копий отдельного звена последовательности-мишени для обеспечения эффективного взаимодействия между микроРНК и последовательностью-мишенью. Последовательность-мишень в целом, встраиваемая в рекомбинантный аденовирус, может иметь любую длину при условии, что она может быть встроена в вирусный геном. Например, она может содержать от 1 до 10 копий, предпочтительно от 2 до 6 копий, более предпочтительно от 2 до 4 копий отдельного звена последовательности-мишени (John G. Doench, и др., Genes Dev. 2003 17:438-442). Олигонуклеотид применимой длины может вставляться между отдельными звеньями последовательности-мишени, содержащимися в последовательности-мишени в целом. Применимая длина такого олигонуклеотида не ограничена каким-образом при условии, что последовательность-мишень в целом может быть встроена в геном рекомбинантного аденовируса. Например, длина такого олигонуклеотида может составлять от 0 до 8 нуклеотид. Кроме того, при наличии нескольких звеньев последовательности-мишени микроРНК, последовательностями-мишенями в соответствующих звенья могут являться последовательности, относящиеся к одной и той же микроРНК или к различным микроРНК. Помимо этого, при наличии последовательностей-мишеней, относящихся к одной и той же микроРНК, последовательности-мишени в соответствующих звенья могут иметь различную длину и/или содержать различные нуклеотидные последовательности.
Последовательность-мишень микроРНК, содержащаяся в полинуклеотиде согласно настоящему изобретению (или в содержащей его репликативной кассете), также может именоваться "последовательностью-мишенью первой микроРНК" с тем, чтобы полинуклеотид, встроенный в рекомбинантный аденовирус, отличался от других последовательностей мишеней микроРНК, присутствующих в рекомбинантном аденовирусе.
При использовании miR-142-3р в качестве микроРНК примерами ее последовательности-мишени в соответствии с настоящим изобретением могут являться следующие последовательности.
(i) Последовательность, содержащая два звена последовательностей-мишеней miR-142-3р:
5'-gcggcctccataaagtaggaaacactacacagctccataaagtaggaaacactacattataagcggtac
(SEQ ID NO: 27, каждым подчеркиванием обозначено отдельное звено последовательности-мишени miR-142-3p)
(ii) последовательность, содержащая четыре звена последовательности-мишени miR-142-3р:
5'-ggcctccataaagtaggaaacactacacagctccataaagtaggaaacactacattaattccataaagtaggaaacactacaccactccataaagtaggaaacactacagtac
(SEQ ID NO: 28, каждым подчеркиванием обозначено отдельное звено последовательности-мишени miR-142-3р).
В соответствии с настоящим изобретением последовательность-мишень микроРНК находится после структуры промотор hTERT-ген E1А-последовательность IRES-ген E1В, при этом образующийся полинуклеотид, содержащий промотор hTERT, ген E1А, последовательность IRES, ген E1В и последовательность-мишень микроРНК в указанном порядке (который именуется репликативной кассетой) встроен в геном аденовируса, за счет чего предотвращается экспрессия гена E1 и рост вируса в клетках, экспрессирующих микроРНК.
В соответствии с настоящим изобретением последовательность-мишень микроРНК встроена после гена E1В или описанного далее репортерного гена, за счет чего предотвращается экспрессия находящегося до нее гена. Хотя подробности этого механизма не ясны, далее описан один из возможных механизмов. Сначала, микроРНК-RISC (индуцированный РНК комплекс сайленсинга) расщепляет последовательность-мишень на мРНК, чтобы тем самым извлечь полиадениловую кислоту из мРНК. При этом снижается устойчивость мРНК, что вызывает ее распад и, следовательно, предотвращение экспрессии гена. В качестве альтернативы, микроРНК-RISC использует рибонуклеазу полиадениловой кислоты, как в случае нормальной микроРНК, чтобы вызвать распад полиадениловой кислоты, в результате чего снижается устойчивость мРНК и предотвращается экспрессия гена.
Следует отметить, что ранее сообщалось о том, что индуцированное микроРНК ингибирующее действие в отношении экспрессию генов не достигалось в случае экспрессии (трансляции) гена, вставленного после последовательности IRES (Ramesh S. Pillai и др., Science 309, 1573(2005); Geraldine Mathonnet, и др., Science 317, 1764 (2007)). Тем не менее, когда авторы настоящего изобретения подтвердили экспрессию гена рекомбинантного аденовируса согласно настоящему изобретению, содержащего промотор hTERT, ген Е1А, последовательность IRES, ген Е1В и последовательность-мишень микроРНК в указанном порядке, было установлено, что микроРНК в достаточной степени предотвращает экспрессию гена E1В, вставленного после последовательности IRES. Это является новым фактом, установленным в настоящем изобретении.
Гены, которые должны содержаться в репликативной кассете согласно настоящему изобретению, могут быть получены стандартными методами генной инженерии. Например, может использоваться синтез нуклеиновых кислот с помощью синтезатора ДНК, который широко применяется в качестве метода генной инженерии. В качестве альтернативы, также могут использоваться методы ПЦР, в которых выделяют или синтезируют последовательности генов, служащие матрицами, и затем создают специфические для каждого гена праймеры, чтобы амплифицировать последовательность генов посредством системы ПЦР (Current Protocols in Molecular Biology, John Wiley & Sons (1987), раздел 6.1-6.4), или методы амплификации генов с использованием клонирующего вектора. Перечисленные методы могут быть легко применены специалистами в данной области техники в соответствии с Molecular cloning 2nd Edt. Cold Spring Harbor Laboratory Press (1989) и т.д. Для очистки получаемого продукта ПЦР могут применяться известные методы. При необходимости могут использоваться традиционные методы секвенирования, чтобы определять, получен ли, как ожидалось, целевой ген. Например, в этих целях может использоваться секвенирование методом обрыва цепи с использованием дидезоксинуклеотида (Sanger и др. (1977) Proc. Natl. Acad. Sci. USA 74: 5463) или аналогичный метод. В качестве альтернативы, для анализа последовательностей также может использоваться применимый секвенатор ДНК (например, ABI PRISM (Applied Biosystems)).
В соответствии с настоящим изобретением последовательность-мишень микроРНК может быть получена путем конструирования и синтеза таким образом, чтобы каждое отдельное звено последовательности-мишени являлось комплементарным всей нуклеотидной последовательности микроРНК или ее части. Например, последовательность-мишень miR-142-Зр может быть получена путем синтеза ДНК таким образом, чтобы она являлась комплементарной нуклеотидной последовательности miR-142-3р.
Затем соответствующие гены, полученные, как описано выше, лигируют в заданном порядке. Сначала расщепляют каждый из упомянутых генов известными рестриктазами и т.п., вставляют фрагмент расщепленной ДНК каждого гена в известный вектор и лигируют с ним известными способами. В качестве известного вектора может использоваться, например, вектор pIRES. Вектор pIRES содержит последовательность IRES (внутреннего сайта посадки рибосомы) вируса энцефаломиокардита (ECMV) и способен транслировать две открытые рамки считывания (ORF) из одной мРНК. При использовании вектора pIRES путем последовательной вставки требуемых генов в полилинкер может быть получен "полинуклеотид, содержащий промотор hTERT, ген E1А, последовательность IRES и ген Е1B в указанном порядке и содержащий последовательность-мишень микроРНК". Такая последовательность-мишень микроРНК может вставляться в любом месте, но предпочтительно вставляется после структуры промотор hTERT-E1A-IRES-E1B. Для лигирования ДНК может использоваться лигаза ДНК. В качестве альтернативы, с помощью известных рестриктаз может удаляться промотор CMV, содержащийся в известном векторе (например, pShuttle), и затем при необходимости в этот сайт может вставляться последовательность, полученная путем расщепления соответствующими рестриктазами последовательности-мишени промотора hTERT-E1A-IRES-E1B-микроРНК. После того, как под контролем промотора hTERT обеспечивается экспрессия гена E1, необходимого для роста аденовируса, может происходить специфический рост вируса в раковых клетках.
(2) Маркерная кассета
В еще одном варианте осуществления настоящего изобретения предложен рекомбинантный аденовирус, у которого в область E1 генома аденовируса встроена упомянутая репликативная кассета, а в область Е2 генома аденовируса дополнительно встроена маркерная кассета. Такая маркерная кассета содержит репортерный ген и промотор, способный регулировать экспрессию гена, и может дополнительно содержать последовательность-мишень микроРНК.
Область Е3 аденовируса содержит 11,6 кДа ADP (аденовирусного белка смерти), которым обладает функцией промотора поражения клеток и диффузии вируса. Рекомбинантный аденовирус согласно настоящему изобретению рассчитан на элиминирование любой области вирусного генома, подобной содержащей ADP области Е3, которая кодирует белок с функцией промотора поражения клеток и диффузии вируса, в результате чего отсрочивается время гибели клеток и облегчается идентификация раковых тканей путем создания (испускания, экспрессии) флуоресцентного свечения (например, GFP). Это также полезно, поскольку в течение длительного времени могут обнаруживаться живые циркулирующие опухолевые клетки (ЦОК), которые описаны далее.
Репортерный ген, который должен содержаться в маркерной кассете в рекомбинантном аденовирусе согласно настоящему изобретению, не ограничен каким-либо образом, и его примеры включают ген, который кодирует белок, испускающий флуоресцентное свечение, ген, который кодирует ферментативный белок, выделяющий люминофор или хромофор в результате ферментативной реакции, ген, который кодирует антибиотик, ген, который кодирует слитый с меткой белок, ген, который кодирует белок, экспрессирующий на поверхности клеток и связывающий специфическое антитело, ген, который кодирует мембранный транспортный белок, и т.д. Примеры белка, который испускает флуоресцентное свечение (т.е. маркерного белка), включают зеленый флуоресцирующий белок (GFP), выделенный из светящихся медуз, таких как Aequorea victoria, его разновидности EGFP (усиленный гуманизированный GFP) и rsGFP (GFP со смещением спектра флуоресценции в красную область), желтый флуоресцирующий белок (YFP), голубой флуоресцирующий белок (CFP), синий флуоресцирующий белок (BFP), GFP, выделенный из Renilla reniformis, и т.д., а гены, кодирующие эти белки, могут использоваться в настоящем изобретении. Упомянутым белком, который испускает флуоресцентное свечение, предпочтительно является GFP или EGFP.
Аналогичным образом, примеры ферментативного белка, который выделяет люминофор или хромофор в результате ферментативной реакции, включают β-галактозидазу, люциферазу и т.д. В результате ферментативной реакции β-галактозидаза выделяет синий хромофор из 5-бром-4-хлор-3-индолил-β-D-галактопиранозида (X-gal). С другой стороны, люцифераза выделяет люминофор в результате ферментативной реакции с люциферином. Известны люцифераза светлячка, бактериальная люцифераза, люцифераза Renilla и т.п., и специалисты в данной области техники смогут выбрать применимый фермент из известных видов люциферазы.
Кроме того, промотор, способный регулировать экспрессию упомянутого гена, не ограничен каким-либо образом при условии, что он является применимым промотором, совместимым с вирусом, используемым для экспрессии упомянутого желаемого гена. Примеры включают без ограничения, промотор CMV, промотор hTERT, поздний промотор SV40, промотор MMTV LTR, промотор RSV LTR, промотор SRα, промотор β-актина, промотор PGK, промотор EF-1a и т.д. В этих целях предпочтительно может использоваться промотор CMV или промотор hTERT.
Последовательность-мишень микроРНК для встраивания в маркерную кассету может являться такой же, как и последовательность-мишень микроРНК для встраивания в репликативную кассету, или может отличаться от нее.
В соответствии с настоящим изобретением последовательность-мишень микроРНК находится в нетранслируемой области репортерного гена, предпочтительно после этого гена, и тем самым может предотвращаться экспрессия репортерного гена. В частности, в соответствии с настоящим изобретением маркерная кассета предпочтительно содержит промотор, способный регулировать репортерный ген, репортерный ген и последовательность-мишень микроРНК в указанном порядке. Последовательность-мишень микроРНК для встраивания в маркерную кассету именуется "последовательностью-мишенью второй микроРНК" с тем, чтобы она отличалась от последовательности-мишени микроРНК для включения в репликативную кассету. Остальные пояснения, касающиеся микроРНК, являются такими же, как описаны выше.
Подробности получения, очистки и секвенирования рекомбинантных генов для включения в маркерную кассету согласно настоящему изобретению являются такими же, как описаны выше применительно к репликативной кассете.
(3) Индуцирующая некроз клеток кассета
В еще одном варианте осуществления настоящего изобретения предложен рекомбинантный аденовирус, у которого в область E1 генома аденовируса встроена упомянутая репликативная кассета, а в область Е3 генома аденовируса индуцирующая некроз клеток встроена кассета. Такая индуцирующая некроз клеток кассета содержит ген, который кодирует связанный с индуцированием некроза клеток белок, и промотор, способный регулировать экспрессию гена, и может дополнительно содержать последовательность-мишень микроРНК.
Индуцирующая некроз клеток кассета, используемая в рекомбинантном аденовирусе согласно настоящему изобретению, содержит ген, который кодирует связанный с индуцированием некроза клеток белок, и промотор, способный регулировать экспрессию гена. Так, например, когда рекомбинантным аденовирусом согласно настоящему изобретению инфицированы раковые клетки, происходит специфический рост вируса в раковых клетках, и тем самым повышается уровень внутриклеточной экспрессии связанного с индуцированием некроза клеток белка и индуцируется некроз только раковых клеток без поражения нормальных клеток.
Подразумевается, что такой ген, который кодирует связанный с индуцированием некроза клеток белок, означает ген, который кодирует белок, связанный с индуцированием некроза специфических клеток. Примеры связанного с индуцированием некроза клеток белка включают иммунологические белки, такие как РА28. РА28 является белком, который активирует внутриклеточные протеасомы и выявляет иммунные реакции, а также индуцирует некроз клеток в случае сверхэкспрессии. Кроме того, в качестве одного из примеров белка, индуцирующего апоптоз клеток, также можно привести TRAIL. TRAIL является молекулой, которая индуцирует апоптоз клеток после связывания посредством своего рецептора со специфическим антителом.
Помимо этого, другим примером гена, кодирующего связанный с индуцированием некроза клеток белок, является ген-супрессор опухолей, функцией которого является подавление роста раковых клеток. Примеры такого гена-супрессора опухолей включают следующие гены, используемые в традиционной генной терапии. Далее приведена SEQ ID NO (нуклеотидная последовательность) и инвентарный номер в базе данных генетических последовательностей GenBank для каждого гена.
р53 (SEQ ID NO: 29; инвентарный номер М14694): рак множества типов
р15 (SEQ ID NO: 30; инвентарный номер L36844): рак множества типов
р16 (SEQ ID NO: 31; инвентарный номер L27211): рак множества типов
АРС (SEQ ID NO: 32; инвентарный номер М74088): рак толстой и прямой кишки, рак желудка, рак поджелудочной железы
BRCA-1 (SEQ ID NO: 33; инвентарный номер U14680): рак яичников, рак молочной железы
DPC-4 (SEQ ID NO: 34; инвентарный номер U44378): рак толстой и прямой кишки, рак поджелудочной железы
FHIT (SEQ ID NO: 35; инвентарный номер NM 112012): рак желудка, рак легкого, рак матки
р73 (SEQ ID NO: 36; инвентарный номер Y11416): нейробластома
PATCHED (SEQ ID NO: 37; инвентарный номер U59464): базально-клеточный рак
Rbp110 (SEQ ID NO: 38; инвентарный номер М15400): рак легкого, остеосаркома
DCC (SEQ ID NO: 39; инвентарный номер Х76132): рак толстой и прямой кишки
NF1 (SEQ ID NO: 40; инвентарный номер NM 000267): нейрофиброма типа 1
NF2 (SEQ ID NO: 41; инвентарный номер L11353): нейрофиброма типа 2
WT-1 (SEQ ID NO: 42; инвентарный номер NM 000378): опухоль Вильмса
Последовательность-мишень микроРНК для включения в индуцирующую некроз клеток кассету может являться такой же, как последовательность-мишень микроРНК для встраивания в репликативную кассету, или может отличаться от нее. В соответствии с настоящим изобретением последовательность-мишень микроРНК находится в нетранслируемой области гена, кодирующего связанный с индуцированием некроза клеток белок, предпочтительно после этого гена, и тем самым может предотвращаться экспрессия связанного с индуцированием некроза клеток белка. В частности, в соответствии с настоящим изобретением индуцирующая некроз клеток кассета предпочтительно содержит промотор, способный регулировать ген, который кодирует связанный с индуцированием некроза клеток белок, ген, который кодирует связанный с индуцированием некроза клеток белок, и последовательность-мишень микроРНК в указанном порядке. Остальные пояснения, касающиеся микроРНК, являются такими же, как описаны выше.
Подробности получения, очистки и секвенирования рекомбинантных генов для включения в индуцирующую некроз клеток кассету согласно настоящему изобретению являются такими же, как описаны выше применительно к репликативной кассете.
Чтобы определить, был ли индуцирован некроз клеток, могут проводиться описанные далее наблюдения морфологии. В частности, после того, как клетки на дне сосуда для культивирования инфицируют рекомбинантным вирусом согласно настоящему изобретению и инкубируют в течение заданного времени, их извлекают со дна и затем помещают в культуральный раствор для наблюдения в инвертированный микроскоп. Поскольку к этому моменту клетки утеряли жизнеспособность, может быть определено, что был индуцирован некроз клеток. В качестве альтернативы, некроз клеток также может подтверждаться с помощью предлагаемого на рынке комплекта для анализа живых клеток с использованием тетразолиевой соли (например, МТТ, ХТТ).
(4) Связывающий CD46 фибриллярный белок
В еще одном варианте осуществления рекомбинантный аденовирус согласно настоящему изобретению может содержать ген, который кодирует связывающий CD46 фибриллярный белок аденовируса.
Широко используемые в настоящее время векторы аденовируса получают на основе структуры аденовируса серотипа 5 (или серотипа 2), относящегося к подгруппе С аденовирусов человека 51 серотипа. Хотя аденовирус серотипа 5 широко применяется в силу его отличных свойств переноса генов, его недостатком является то, что он с трудом инфицирует клетки с низкой экспрессией рецепторов вируса Коксаки и аденовируса (CAR), поскольку его инфицирующее действие опосредовано путем связывания CAR в клетках-мишенях. В частности, поскольку экспрессия CAR уменьшена в высокозлокачественных раковых клетках, которые являются высокоинвазивными, метастатическими и пролиферативными, аденовирус, содержащий фибриллярный белок аденовируса серотипа 5, может не инфицировать такие высокозлокачественные раковые клетки.
В отличие от этого, CD46 экспрессирует почти во всех клетках за исключением эритроцитов человека, а также в высокозлокачественных раковых клетках. Таким образом, рекомбинантный аденовирус, содержащий ген, который кодирует связывающий CD46 фибриллярный белок аденовируса, также может инфицировать CAR-негативные высокозлокачественные раковые клетки. Например, аденовирус серотипов 34 и 35 связывает CD46 посредством своего рецептора и тем самым инфицирует клетки (Marko Marttila, и др., J. Virol. 2005, 79(22):14429-36). Как описано выше, поскольку CD46 экспрессирует почти во всех клетках за исключением эритроцитов человека, аденовирус серотипов 34 и 35 способен инфицировать разнообразные клетки, включая CAR-негативные клетки. Кроме того, фибриллярный белок аденовируса содержит область утолщения, стержневую область и хвостовую область, при этом аденовирус инфицирует клетки посредством связывания рецептора его фибриллярной областью утолщения. Таким образом, по меньшей мере в фибриллярной области утолщения фибриллярного белка аденовирус серотипа 5 заменен аденовирусом серотипа 34 или 35, за счет чего вирус способен инфицировать CAR-негативные клетки посредством CD46.
За счет гена, который кодирует связывающий CD46 фибриллярный белок аденовируса, рекомбинантный аденовирус согласно настоящему изобретению способен инфицировать почти все клетки за исключением эритроцитов и тем самым способен инфицировать высокозлокачественные CAR-негативные высокоинвазивными, метастатическими и пролиферативными. В соответствии с настоящим изобретением подразумевается, что "CAR-негативные" клетки означают клетки с низкой экспрессией CAR экспрессию или клетки с отсутствующей экспрессией CAR.
В настоящее время идентифицировано 57 серотипов аденовируса человека, которые делятся на шесть групп с А по F. По имеющимся данным CD46 связывают аденовирусы серотипов, относящихся к группе В. В группу В входят, например, аденовирусы серотипов 34 и 35, а также серотипов 3, 7, 11, 16, 21 и 50.
В соответствии с настоящим изобретением предпочтительным белком для использования в качестве связывающего CD46 фибриллярного белка аденовируса является фибриллярный белок аденовируса, относящегося к группе В, более предпочтительно фибриллярный белок аденовируса серотипа 3, 7, 34, 35, 11, 16, 21 или 50, еще более предпочтительно фибриллярный белок аденовируса серотипа 34 или 35.
Нуклеотидная последовательность гена, который кодирует фибриллярный белок аденовируса серотипа 34, 35, 3, 7, И, 16, 21 или 50, может быть получена в одной из известных баз данных генетических последовательностей, например, GenBank NCBI (Национального центра биотехнологической информации). Кроме того, в соответствии с настоящим изобретением нуклеотидная последовательность гена, который кодирует фибриллярный белок аденовируса серотипа 34, 35, 3, 7, 11, 16, 21 или 50, содержит не только нуклеотидную последовательность каждого гена из описанной выше базы данных, но также нуклеотидные последовательности, которые поддаются гибридизации в строгих условиях с нуклеотидной последовательностью ДНК, комплементарной каждой нуклеотидной последовательности ДНК из базы данных, и кодируют белок, обладающий способность связывать CD46.
Способность связывать CD46 может оцениваться при определении инфективности рекомбинантного аденовируса, содержащего нуклеотидную последовательность ДНК, в отношении клеток, экспрессирующих CD46. Инфективность рекомбинантного аденовируса может определяться известным способом, например, путем обнаружения GFP, экспрессируемого вирусом, которым инфицированы клетки, экспрессирующие CD46, путем флюоресцентной микроскопии или проточной цитометрии т.д. Процедуры и строгие условия гибридизация являются такими же, как описаны выше.
Рекомбинантный аденовирус согласно настоящему изобретению может содержать всю или частичную область связывающего CD46 фибриллярного белка аденовируса, в результате чего по меньшей мере фибриллярная область утолщения фибриллярного белка связывает CD46. В частности, в соответствии с настоящим изобретением связывающий CD46 фибриллярный белок аденовируса может содержать по меньшей мере фибриллярную область утолщения в фибриллярном белке аденовируса, относящегося к группе В, более предпочтительно по меньшей мере фибриллярную область утолщения в фибриллярном белке аденовируса любого типа, выбранного из группы, включающий серотип 34, серотип 35, серотип 3, серотип 7, серотип 11, серотип 16, серотип 21 и серотип 50, еще более предпочтительно по меньшей мере фибриллярную область утолщения в фибриллярном белке аденовируса серотипа 34 или 35. Кроме того, идеи настоящего изобретения не ограничены этими фибриллярными белками при условии, что соответствующий белок связывает СD46, и также охватывают белки, способные связывать CD46, а также белки, содержащие структурный мотив, способный связывать CD46.
В качестве альтернативы, в соответствии с настоящим изобретением связывающий CD46 фибриллярный белок может содержать область, состоящую из фибриллярной области утолщения и фибриллярной стержневой области в фибриллярном белке аденовируса, относящегося к группе В, более предпочтительно область, состоящую из фибриллярной области утолщения и фибриллярной стержневой области в фибриллярном белке аденовируса любого серотипа, выбранного из группы, включающей серотип 34, серотип 35, серотип 3, серотип 7, серотип 11, серотип 16, серотип 21 и серотип 50, еще более предпочтительно область, состоящую из фибриллярной области утолщения и фибриллярной стержневую область в фибриллярном белке аденовируса серотипа 34 или 35.
В соответствии с настоящим изобретением связывающий CD46 фибриллярный белок может содержать фибриллярную стержневую область или фибриллярную хвостовую область в фибриллярном белке аденовируса любого серотипа (например, серотипа 2, серотипа 5) помимо упомянутых выше серотипов при условии, что он содержит по меньшей мере фибриллярную область утолщения в фибриллярном белке аденовируса, относящегося к группе В.
Примеры такого фибриллярного белка включают без ограничения фибриллярные белки, которые содержат область, состоящую не только из фибриллярной области утолщения и фибриллярной стержневой области в фибриллярном белке аденовируса любого серотипа, выбранного из группы, включающей серотип 34, серотип 35, серотип 3, серотип 7, серотип 11, серотип 16, серотип 21 и серотип 50, но также фибриллярную хвостовую область в фибриллярном белке аденовируса серотипа 5.
Нуклеотидные последовательности гена, который кодирует фибриллярную область утолщения в фибриллярном белке аденовируса серотипа 34, гена, который кодирует фибриллярную стержневую область в фибриллярном белке аденовируса серотипа 34, и гена, который кодирует область, состоящую из фибриллярной области утолщения и фибриллярной стержневую область в фибриллярном белке аденовируса серотипа 34, представлены в SEQ ID NO: 47, 48 и 49, соответственно.
Аналогичным образом, нуклеотидная последовательность гена, который кодирует область, состоящую не только из фибриллярной области утолщения и фибриллярной стержневой области в фибриллярном белке аденовируса серотипа 34, но также фибриллярную хвостовую область в фибриллярном белке аденовируса серотипа 5, представлена в SEQ ID NO: 50. В соответствии с настоящим изобретением нуклеотидная последовательность такого гена включает не только нуклеотидную последовательность, представленную в SEQ ID NO: 50, но также нуклеотидные последовательности, которые поддаются гибридизации в строгих условиях с нуклеотидной последовательностью ДНК, комплементарной нуклеотидной последовательности ДНК, представленной в SEQ ID NO: 50, и кодируют белок, обладающий способностью связывать CD46. Процедуры оценки способности связывать CD46, процедуры и строгие условия гибридизация являются такими же, как описаны выше.
Для получения рекомбинантного аденовируса согласно настоящему изобретению с помощью соответствующих рестриктаз может быть вырезан полинуклеотид, содержащий репликативную кассету, маркерную кассету и/или индуцирующую некроз клеток кассету, и вставлен в соответствующий вектор экспрессии вируса. Одним из предпочтительных вирусов экспрессии вектор является вектор аденовируса, более предпочтительно вектор аденовируса серотип 5, особо предпочтительно вектор аденовируса серотип 5, содержащий ген, который кодирует связывающий CD46 фибриллярный белок аденовируса (например, фибриллярный белок аденовируса серотипа 34 или 35).
Как показано в описанном далее Примере 2, экспрессия GFP в клетках крови подавлялась в удовлетворительной степени в обоих случаях, когда последовательность-мишень микроРНК вставляли после репликативной кассеты и после маркерной кассеты, при этом экспрессия GFP в клетках крови неожиданно значительно подавлялась, когда последовательности-мишени микроРНК вставляли одновременно после репликативной кассеты и после маркерной кассеты, соответственно. Это является новым фактом, установленным в настоящем изобретении.
В соответствии с настоящим изобретением рекомбинантный аденовирус может быть получен, например, следующим образом.
Сначала обрабатывают рестриктазами pHMCMV5 (Mizuguchi H. и др., Human Gene Therapy, 10; 2013-2017, 1999) и вставляют последовательность-мишень микроРНК, чтобы получить вектор, содержащий последовательность-мишень микроРНК. Затем обрабатывают рестриктазами pSh-hAIB, содержащий структуру промотор hTERT-E1A-IRES-E1B (WO 2006/036004) и вставляют полученный фрагмент, содержащий структуру промотор hTERT-E1A-IRES-E1B, в упомянутый вектор, содержащий последовательность-мишень микроРНК, чтобы получить вектор, содержащий структуру промотор hTERT-E1A-IRES-E1B-последовательность-мишень микроРНК. С другой стороны, обрабатывают рестриктазами pHMCMVGFP-1 (pHMCMV5, содержащий ген EGFP), чтобы получить фрагмент, содержащий промотор CMV и ген EGFP, и вставляют этот фрагмент в упомянутый вектор, содержащий последовательность-мишень микроРНК, чтобы получить вектор, содержащий структуру промотор CMV-EGFP-последовательность-мишень микроРНК. Затем обрабатывают рестриктазами вектор, содержащий структуру промотор hTERT-E1A-IRES-E1B-последовательность-мишень микроРНК и вектор, содержащий структуру промотор CMV-EGFP-последовательность-мишень микроРНК, и лигируют друг с другом, чтобы получить вектор, в котором структура промотор hTERT-E1A-IRES-E1B-последовательность-мишень микроРНК встроена в лишенную E1 область генома аденовируса, а структура CMV-EGFP-последовательность-мишень микроРНК встроена в лишенную Е3 область генома аденовируса. В качестве альтернативы, при использовании вектора, содержащего ген, который кодирует связывающий CD46 фибриллярный белок аденовируса, в качестве вектора для вставки с фрагментами ДНК, содержащими соответствующие структуры, можно получить вектор, в котором структура промотор hTERT-E1A-IRES-E1B-последовательность-мишень микроРНК встроена в лишенную E1 область генома аденовируса, а структура CMV-EGFP-последовательность-мишень микроРНК встроена в лишенную ЕЗ область генома аденовируса, и который содержит ген, который кодирует связывающий CD46 фибриллярный белок аденовируса. Кроме того, этот вектор может быть линеаризован с помощью известной рестриктазы, а затем им могут быть инфицированы выращенные клетки (например, 293 клетки), чтобы получить тем самым инфекционный рекомбинантный аденовирус. Следует отметить, что специалисты в данной области техники смогли бы легко получить все вирусы, входящие в объем настоящего изобретения, путем незначительной модификации описанных процедур получения.
3. Реактив для обнаружения раковых клеток или реактив для диагностики рака
Как описано выше, рекомбинантный аденовирус согласно настоящему изобретению обладает следующими свойствами.
(i) Этот рекомбинантный аденовирус инфицирует почти все клетки за исключением эритроцитов, а также способен инфицировать высокозлокачественные CAR-негативные клетки.
(ii) Этот рекомбинантный аденовирус является специфическим для экспрессирующих hTERT раковых клеток, а также увеличивает экспрессию репортерного гена в процессе роста, в результате чего образование маркерного белка, хромофора и т.п. может быть увеличено до поддающихся обнаружению уровней.
(iii) Этот рекомбинантный аденовирус способен предотвращать появление ложноположительных результатов, даже когда вирус инфицирует нормальные клетки с активным промотором hTERT, поскольку экспрессия микроРНК предотвращает не только рост вируса, но также экспрессию репортерного гена. В частности, за счет последовательности-мишени микроРНК, которая специфически экспрессирует в клетках крови, этот рекомбинантный аденовирус способен предотвращать появление ложноположительных результатов, даже когда вирус инфицирует нормальные клетки крови с активным промотором hTERT, поскольку экспрессия этой микроРНК предотвращает не только рост вируса в клетках крови, но также экспрессию репортерного гена.
Таким образом, рекомбинантный аденовирус согласно настоящему изобретению может применяться в качестве реактива для обнаружения раковых клеток или реактива для диагностики рака. В частности, за счет перечисленных свойств рекомбинантный вирус согласно настоящему изобретению исключительно эффективен при обнаружении циркулирующих опухолевых клеток (ЦОК), присутствующих в крови.
С другой стороны, начиная с 2004 года, когда в New England Journal of Medicine (Cristofanilli M. и др., The New England Journal of Medicine, 2004, 781-791) было описано, что ЦОК, которые являются раковыми клетками, присутствующими в крови, использовались в качестве прогностического критерия применительно к пациентам, перенесшим операцию по поводу рака молочной железы, ЦОК используются в качестве биомаркера во множестве клинических исследований, проводящихся в Европе и Северной Америке. В частности, установлено, что ЦОК являются независимым фактором, определяющим прогноз для пациентов, страдающих раком молочной железы, раком предстательной железы и раком кожи. Кроме того, в проводимом в Европе клиническом исследовании вспомогательной терапии рака предстательной железы (SUCCESS), число подсчитанных ЦОК суммируется с критериями включения, и включаются только пациенты, у которых обнаружена одна или несколько клеток. Это исследование является крупномасштабным клиническим исследованием 2000 или более случаев с изучением, внимание в котором уделяется результатам. Кроме того, также проводится клиническое исследование, в котором одним из конечных клинических результатов является увеличение или уменьшение числа самих ЦОК (MDV3100).
За последние годы Управлением по контролю пищевых продуктов и медикаментов (FDA) США выпущены рекомендации по одобрению и разрешению к применению противораковых средств молекулярно-направленного действия, что делает контроль ЦОК более важным при диагностике рака. Рекомендациями FDA установлено, что до выбора противораковых средств молекулярно-направленного действия следует проверить наличие генетических изменений в опухолевых молекулах-мишенях. Если следовать этим рекомендациям, используя традиционные методы, возникает необходимость хирургической биопсии опухолевых тканей пациентов с целью проведения генетических исследований, что тяжелейшим бременем ложится на пациентов. С целью решения этой задачи в настоящее время предпринимаются шаги по проведению генетических исследований с использованием ЦОК, взятых из крови, и эта стратегия получила название "жидкостной биопсии" в отличие от традиционной "биопсии". Если эта стратегия будет иметь успех, генетические исследования опухолевых тканей можно будет проводить просто путем отбора крови, и будет значительно снижена нагрузка на пациентов. По этим причинам растет роль контроля ЦОК как высокоэффективного метода испытаний в клинических условиях.
Система CellSearch System компании Veridex LLC является единственным на данный момент прибором для обнаружения ЦОК, который одобрен FDA и используется в большинстве способов обнаружения ЦОК в ходе клинических исследований. В основу системы CellSearch положены методы обнаружения раковых клеток с использованием антитела ЕpСАМ и антитела цитокератин.
Тем не менее, поскольку методы обнаружения ЦОК рассчитаны на обнаружение от нескольких до десятков тысяч клеток на миллиард клеток крови, очень сложно чувствительность и точность обнаружения. Кроме того, способам обнаружения ЦОК на основе системы CellSearch также присущи некоторые недостатки. Например, отмечается, что раковые клетки, определяемые как негативные при исследовании на ЦОК в системе CellSearch, определяются как позитивные при другом исследовании, и что существуют значительные различия в чувствительности и точности в зависимости от типа рака (Allard W.J. и др., Clinical Cancer Research, 2004, 6897-6904). Кроме того, также отмечается, что недостатком системы CellSearch является низкая вероятность обнаружения ЦОК в случае рака легкого в условиях клинического исследования (там же).
Помимо этого, также отмечается, что недостатком системы CellSearch является сниженная вероятность обнаружения ЦОК, поскольку в раковых клетках, в которых произошел эпителиально-мезенхимальный переход (ЕМТ), снижена экспрессия антигенов, в том числе ЕpСАМ на поверхности клеток (Anieta M. et.al., J Natl Cancer Inst, 101, 2009, 61-66, Janice Lu et.al., Int J Cancer, 126(3), 2010, 669-683).
Кроме того, для проведения упомянутой "жидкостной биопсии" дополнительно необходимо концентрировать и фенотипировать или генотипировать ЦОК, для чего требуются более чувствительные и более точные методы обнаружения ЦОК, чем простой подсчет числа ЦОК.
В отличие от этого, обладающий упомянутыми свойствами (i)-(iii) рекомбинантный аденовирус согласно настоящему изобретению обеспечивает простое, высокочувствительное и высокоточное обнаружение ЦОК в крови без обнаружения лейкоцитов и других нормальных клеток крови. Кроме того, поскольку реактив согласно настоящему изобретению позволяет обнаруживать живые ЦОК, путем анализа поверхностных антигенов и т.п., присутствующих в специфическом антителе ЦОК, можно идентифицировать орган-источник обнаруженных ЦОК. Таким образом, рекомбинантный аденовирус согласно настоящему изобретению применим для обнаружения ЦОК и диагностики рака.
Помимо этого, рекомбинантный аденовирус или реактив для обнаружения раковых клеток согласно настоящему изобретению может применяться для обнаружения раковых клеток, в которых произошел ЕМТ или мезенхимально-эпителиальный переход (МЕТ). ЕМТ является феноменом потери раковыми клетками своих свойств эпителиальных клеток и приобретения ими свойств клеток мезенхимального происхождения, имеющих тенденцию мигрировать в окружающие ткани, при этом ЕМТ также вовлечен в инвазию и/или метастазирование раковых клеток. С другой стороны, мезенхимально-эпителиальный переход (МЕТ) является феноменом приобретения клетками мезенхимального происхождения свойств эпителиальных клеток. Как описано выше, раковые клетки, в которых произошел ЕМТ, сложно обнаруживать известными методами, включая систему CellSerch. В отличие от этого, настоящее изобретение позволяет обнаруживать раковые клетки, в которых произошел ЕМТ или МЕТ. Соответственно, рекомбинантный аденовирус согласно настоящему изобретению применим для обнаружения раковых клеток и диагностики рака.
Кроме того, рекомбинантный аденовирус согласно настоящему изобретению также может использоваться для обнаружения резистентных к лекарственным средствам раковых клеток. Лекарственными средствами, подразумеваемыми в настоящем изобретении, являются лекарственные средства, которые применяются для химиотерапии рака. Примеры таких лекарственных средств включают без ограничения адриамицин, карбоплатин, цисплатин, 5-фторурацил, митомицин, блеомицин, доксорубицин, даунорубицин, метотрексат, паклитаксел, доцетаксел актиномицин D и т.д. Кроме того, рекомбинантный вирус согласно настоящему изобретению также может применяться для обнаружения стволовых раковых клеток. В соответствии с настоящим изобретением стволовые раковые клетки означает клетки (стволовые клетки), являющиеся источником раковых клеток. Стволовые раковые клетки также могут включать резистентные к лекарственным средствам клетки.
В соответствии с настоящим изобретением тип обнаруживаемого или диагностируемого рака или опухоли не ограничен каким-либо образом, и могут использоваться клетки рака всех типов. Их примеры включают твердые опухоли или кровяные опухоли, более точно, опухоль головного мозга, цервикальный рак, рак пищевода, рак языка, рак легкого, рак молочной железы, рак поджелудочной железы, рак желудка, рак тонкой кишки, рак двенадцатиперстной кишки, рак толстой и прямой кишки, рак мочевого пузыря, рак почки, рак печени, рак предстательной железы, рак матки, рак шейки матки, рак яичников, рак щитовидной железы, рак желчного пузыря, фарингеальный рак, саркому, меланому, лейкемию, лимфому и множественную миелому (ММ). В большей части (85% или более) раковых клеток, выделенных из тканей человека, наблюдается повышенная активность теломеразы, и настоящее изобретение позволяет в целом обнаруживать такие экспрессирующие теломеразу раковые клетки.
Кроме того, в соответствии с настоящим изобретением ЦОК не ограничены каким-либо образом при условии, что они являются раковыми клетками, присутствующими в крови, при этом они включают не только раковые клетки, высвобождаемые твердыми опухолями, но также клетки кровяных опухолей, такие как упомянутые выше клетки лейкемии и клетки лимфомы. Тем не менее, в тех случаях, когда ЦОК представляют собой клетки кровяной опухоли, последовательностью-мишенью микроРНК, содержащейся в аденовирусе согласно настоящему изобретению, предпочтительно является последовательность-мишень микроРНК, которая специфически экспрессирует в нормальных клетках крови.
Для получения реактива согласно настоящему изобретению рекомбинантный аденовирус может быть обработан, например, путем замораживания для облегчения обращения и затем может использоваться непосредственно или в смеси с известными фармацевтическими приемлемыми носителями (например, формообразующими, наполнителями, связующими, смазками) и/или известными добавками (включая буферы, регуляторы изотоничности, хелаторы, красители, консерванты, ароматизаторы, отдушки, подсластители).
4. Способ обнаружения раковых клеток или способ диагностики рака
Кроме того, рекомбинантный аденовирус согласно настоящему изобретению может использоваться для обнаружения раковых клеток или диагностики рака путем его введения в контакт с раковыми клетками и обнаружения флуоресцентного свечения или окрашивания, вызываемого раковыми клетками.
В соответствии с настоящим изобретением подразумевается, что термин "(введение в) контакт" означает, что раковые клетки и рекомбинантный аденовирус согласно настоящему изобретению помещают в одну и ту же реакционную систему, например, путем добавления рекомбинантного аденовируса согласно настоящему изобретению к образцу, содержащему раковые клетки, путем смешивания раковых клеток с рекомбинантным аденовирусом, путем культивации раковых клеток в присутствии рекомбинантного аденовируса или путем инфицирования раковых клеток рекомбинантным аденовирусом. Помимо этого, в соответствии с настоящим изобретением "флуоресцентное свечение или окрашивание" не ограничено каким-либо образом при условии, что оно представляет собой свечение или окрашивание, которое вызвано белком, экспрессирующим из репортерного гена, а его примеры включают флуоресцентное свечение, испускаемое маркерным белком (например, GFP), свечение, испускаемое люминофором, который выделяется в результате опосредованной люциферазой ферментативной реакции, окрашивание в синий цвет, вызванное хромофором, который выделяется в результате ферментативной реакции между β-галактозидазой и X-gal, и т.д.
Раковые клетки для применения в способе обнаружения раковых клеток или в способе диагностики рака могут быть выделены из биологического образца, взятого у объекта. Такой биологический образец, взятый у объект, не ограничен каким-либо образом при условии, что он представляет собой ткань, предположительно содержащую раковые клетки, а его примеры включают кровь, опухолевую ткань, лимфоидную ткань и т.п. В качестве альтернативы, раковыми клетками могут являться циркулирующие в крови опухолевые клетки (ЦОК), при этом пояснения, касающиеся ЦОК, являются такими же, как приведены выше.
Обнаружение раковых клеток и диагностика рака с использованием реактива согласно настоящему изобретению могут осуществляться, например, следующим образом.
В тех случаях, когда биологическим образцом, взятым у объекта, является кровь, обрабатывают образец крови путем добавления вызывающего лизис эритроцитов реактива, чтобы удалить эритроциты, и смешивают в пробирке суспензию оставшихся клеток с реактивом согласно настоящему изобретению в заданном соотношении (от 0,01 до 1000 MOI (кратность инфицирования), предпочтительно от 0,1 до 100 MOI, более предпочтительно от 1 до 10 MOI). Выдерживают или вращают пробирку при комнатной температуре или температуре 37°С в течение заданного времени (например, 4-96 часов, предпочтительно 12-72 часов, более предпочтительно 18-36 часов), чтобы способствовать инфицированию раковых клеток вирусом и росту вируса. Осуществляют количественный анализ флуоресцентного свечения, образующегося в клеточной фракции, методом проточной цитометрии GFP. В качестве альтернативы, подвергают экспрессирующие GFP клетки морфологическому анализу путем наблюдения во флуоресцентный микроскоп. Эта система обеспечивает высокочувствительное обнаружение ЦОК, присутствующих в периферической крови. Этот способ может использоваться для обнаружения ЦОК, которые в ничтожных количествах присутствуют в периферической крови.
В тех случаях, когда для обнаружения ЦОК используется проточная цитометрия, ЦОК могут обнаруживаться путем определения того, является ли каждая клетка GFP-позитивной или GFP-негативной, например, в соответствии со следующими критериями.
Сначала анализируют группы клеток из образца, не инфицированных каким-либо вирусом, чтобы определить величину фонового флуоресцентного свечения. Устанавливают порог максимальной величины флуоресцентного свечения. Затем анализируют группы клеток из образца, инфицированных вирусом согласно настоящему изобретению, и определяют, что группы клеток из образца с величиной флуоресцентного свечения, равной или превышающей порог, являются GFP-позитивными. В случае использования образца крови, взятого у объекта, обнаруженные GFP-позитивные клетки могут идентифицироваться как ЦОК. Кроме того, эти GFP-позитивные клетки (ЦОК) могут концентрироваться для фенотипирования или генотипирования.
В соответствии с настоящим изобретением примеры объекта включают млекопитающих, таких как люди, кролики, морские свинки, крысы, мыши, хомяки, кошки, собаки, козы, свиньи, овцы, коровы, лошади, обезьяны и т.п.
Соответствующее количество используемого реактива согласно настоящему изобретению выбирают в зависимости от состояния и количества биологического образца, используемого для обнаружения, типа используемого способа обнаружения и т.д. Например, в случае образца крови реактив согласно настоящему изобретению может использоваться в количестве от около 0,01 до 1000 MOI, предпочтительно от 0,1 до 100 MOI, более предпочтительно от 1 до 10 MOI на 1-50 мл, предпочтительно 3-25 мл, более предпочтительно 5-15 мл образца крови. MOI означает соотношение между количеством вируса (инфекционных единиц) и числом клеток, когда заданное количество культивированных клеток инфицировано заданным количество частиц вируса, и используется в качестве показателя инфицирования клеток вирусами.
С целью инфицирования клеток рекомбинантным вирусом могут использоваться следующие процедуры. Сначала высевают клетки на культуральный планшет, содержащий соответствующую питательную среду, и выращивают при температуре 37°С в присутствии газообразной двуокиси углерода. Питательную среду выбирают из DMEM, MEM, RPMI-1640 и других сред, широко используемых для получения культур животных клеток, с возможным добавлением сыворотки, антибиотиков, витаминов и т.п. при необходимости. Инокулируют культуру клеток заданным количеством вируса, например, от 0,1 до 10 MOI.
Для подтверждения роста вируса собирают инфицированные вирусом клетки и обрабатывают их, чтобы извлечь из них ДНК, с последующей ПЦР в реальном времени с использованием праймеров, нацеленных на соответствующий ген, содержащийся в вирусе согласно настоящему изобретению, что позволяет осуществить количественный анализ роста вируса.
В случаях использования гена GFP в качестве репортерного гена меченые клетки могут обнаруживаться следующим образом: клетки, в которых происходит рост вируса, испускают заданное флуоресцентное свечение (например, зеленое флуоресцентное свечение в случае GFP) после их облучения возбуждающим излучением, в результате чего раковые клетки могут визуализироваться посредством флуоресцентного свечения. Например, вызванное GFP флуоресцентное свечение клеток можно видеть при наблюдении инфицированных вирусом клеток во флуоресцентный микроскоп. Кроме того, с целью наблюдения инфицированных вирусом клеток с течением времени вызванное GFP флуоресцентное свечение с течением времени можно контролировать с помощью ПЗС-камеры.
Кроме того, реактив согласно настоящему изобретению также позволяет обнаруживать in vivo в реальном времени присутствующие раковых клеток. Для мечения и обнаружения in vivo в реальном времени рекомбинантный аденовирус согласно настоящему изобретению может вводиться in vivo.
Реактив согласно настоящему изобретению может вводиться непосредственно be в пораженную область или вводиться in vivo (в клетки-мишени или органы-мишени) любым известным способом, например, путем инъекции в вену, мышцу, брюшинную полость или подкожную ткань, путем ингаляции через полость носа, полость рта или легкие, путем перорального введения, путем интраваскулярного введения посредством катетера и т.п., при этом предпочтительным примером является локальная инъекция в мышцу, брюшинную полость или куда-либо еще, инъекция в вену и т.д.
При введении реактива согласно настоящему изобретению объекту может выбираться соответствующая доза в зависимости от типа действующего ингредиента, способа введения, мишени, возраста, веса тела, пола и/или симптомов пациента и других условий. Обычно может устанавливаться суточная доза вируса согласно настоящему изобретению в качестве действующего ингредиента от около 106 до 1011 БОЕ (бляшкообразующих единиц), предпочтительно от около 109 до 1011 БОЕ, которая вводится раз в сутки или поделена на дозы.
Преимуществом мониторинга в реальном времени in vivo флуоресцентного свечения раковых клеток является его применение в средствах диагностики in vivo. Это полезно в случае так называемой навигационной хирургии и т.п. Подробности навигационной хирургии описаны в WO 2006/036004.
Кроме того, реактив согласно настоящему изобретению применим для обнаружения ЦОК в качестве биомаркера, и, следовательно, реактив согласно настоящему изобретению может использоваться для определения прогноза.
Например, при использовании GFP в качестве маркерного белка в вирусе согласно настоящему изобретению инфицируют вирусом согласно настоящему изобретению биологический образец, взятый у страдающего раком пациента до начала какой либо противораковой терапии (например, химиотерапии, лучевой терапии, оперативного вмешательства), и биологический образец, взятый в определенный момент по истечении определенного времени (например, 1-90 дней) после начала лечения. Затем в одинаковых условиях сравнивают число GFP-позитивных клеток в образце, взятом до начала лечения, и в образце, взятом в определенный момент после начала лечения. В результате, если число GFP-позитивных клеток после лечения становится меньшим, чем число GFP-позитивных клеток до лечения, может быть установлено, что прогноз улучшился.
Далее настоящее изобретение будет более подробно описано на следующих наглядных примерах, которые не имеют целью ограничить его объем.
Пример 1
Получение фибриллярного белка 142-3рТ рекомбинантного аденовируса Ad34
(1) Получение pHMCMV5-miR-142-3pT
Обработали pHMCMV5 (Mizuguchi H. и др., Human Gene Therapy, 10; 2013-2017, 1999) с помощью NotI/KpnI и лигировали полученный фрагмент с двунитевым олигонуклеотидом, который был получен путем ренатурации следующих синтетических олигоДНК, в результате чего получили pHMCMV5-miR-142-3pT(pre).
miR-142-3pT-S1: 5'-GGCCTCCATAAAGTAGGAAACACTACACAGCTCCATAAAGTAGGAAACACTACATTAATTAAGCGGTAC-3'
(SEQ ID NO: 43, каждым подчеркиванием обозначена последовательность-мишень miR-142-3р),
miR-142-3pT-AS1: 5'-CGCTTAATTAATGTAGTGTTTCCTACTTTATGGAGCTGTGTAGTGTTTCCTACTTTATGGA-3'
(SEQ ID NO: 44, каждым подчеркиванием обозначена последовательность-мишень miR-142-3р).
Затем обработали pHMCMV5-miR-142-3pT(pre) с помощью PacI/KpnI и лигировали полученный фрагмент с двунитевым олигонуклеотидом, который был получен путем ренатурации следующих синтетических олигоДНК, в результате чего получили pHMCMV5-miR-142-3pT с 4 повторами последовательности-мишени miR-142-3р.
miR-142-3pT-S2: 5'-TCCATAAAGTAGGAAACACTACAGGACTCCATAAAGTAGGAAACACTACAGTAC-3'
(SEQ ID NO: 45, каждым подчеркиванием обозначена последовательность-мишень miR-142-3р)
miR-142-3pT-AS2: 5'-TGTAGTGTTTCCTACTTTATGGAGTCCTGTAGTGTTTCCTACTTTATGGAAT-3'
(SEQ ID NO: 46, каждым подчеркиванием обозначена последовательность-мишень miR-142-3р)
(2) Получение челночной плазмиды E1 pHM5-hAIB-miR-142-3pT
Подвергли pSh-hAIB (WO 2006/036004) расщеплению с помощью I-CeuI/PmeI и подвергли продукт расщепления электрофорезу в агарозном геле. Вырезали из геля полосу приблизительно 4.5 т.п.н. (кассету hAIB) и обработали с помощью GENECLEAN II (Q-Biogene), чтобы очистить и собрать фрагмент ДНК. Лигировали очищенный фрагмент ДНК (кассету hAIB) с фрагментом, полученным из pHMCMV5-miR-142-3рТ, путем расщепления с помощью NheI, обработали с помощью фрагмента Кленова и подвергли дальнейшему расщеплению с помощью I-CeuI, в результате чего получили структуру pHM5-hAIB-miR-142-3pT, содержащую промотор hTERT, ген Е1А, последовательность IRES (внутреннего сайта посадки рибосомы), ген Е1В и последовательность-мишень miR-142-3рТ.
(3) Получение челночной плазмиды Е3 pHM13CMV-EGFP-miR-142-3pT
Подвергли pEGFP-N1 (Clontech) расщеплению с помощью ApaI и NotI, интегрировали полученный продукт расщепления в сайт ApaI/NotI в pHMCMV5 и получили pHMCMVGFP-1. Подвергли pHMCMVGFP-1 расщеплению с помощью PmeI/HindIII, и подвергли продукт расщепления электрофорезу в агарозном геле. Вырезали из геля полосу приблизительно 750 п. н. (EGFP) и обработали с помощью GENECLEAN II, чтобы очистить и собрать фрагмент ДНК. Лигировали очищенный фрагмент ДНК (EGFP) с фрагментом, полученным из pBIuescriptII KS+, путем расщепления с помощью HincII/HindIII, в результате чего получили pBSKS-EGFP. Подвергли pBSKS-EGFP расщеплению с помощью ApaI/XbaI, и подвергли продукт расщепления электрофорезу в агарозном геле. Вырезали из геля полосу приблизительно 750 п. н. (EGFP) и обработали с помощью GENECLEAN II, чтобы очистить и собрать фрагмент ДНК. Лигировали очищенный фрагмент ДНК (EGFP) с фрагментом, полученным из pHMCMV5-miR-142-3pT, путем расщепления с помощью ApaI/XbaI, в результате чего получили pHMCMV5-EGFP-miR-142-3pT. Подвергли pHMCMV5-EGFP-miR-142-3рТ расщеплению с помощью BglII, и подвергли продукт расщепления электрофорезу в агарозном геле. Вырезали из геля полосу приблизительно 2 т.п.н. (CMV-EGFP-miR-142-3рТ) и обработали с помощью GENECLEAN II, чтобы очистить и собрать фрагмент ДНК. Лигировали очищенный фрагмент ДНК (CMV-EGFP-miR-142-3рТ) с фрагментом, полученным из рНМ13 (Mizuguchi и др., Biotechniques, 30; 1112-1116, 2001), путем расщепления с помощью BamHI и обработали с помощью CIP (Alkaline Phosphatase, Calf Intest), в результате чего получили pHM13CMV-EGFP-miR-142-3рТ.
(4) Получение pAdHM49-hAIB142-3pT-CG142-3pT
Обработали pAdHM49 (Mizuguchi и др., J. Controlled Release 110; 202-211, 2005) с помощью I-CeuI/PI-SceI и лигировали полученный фрагмент со структурой рНМ5-hAIB-miR-142-3рТ, который также была обработана с помощью I-CeuI/PI-SceI, в результате чего получили структуру pAdHM49-hAIB142-3pT, в которой промотор hTERT, ген E1А, последовательность IRES, ген E1В и последовательность-мишень miR-142-3рТ встроены в лишенную E1 область вектора Ad. Поскольку pAdHM49 является рекомбинантным аденовирусом, у которого область, охватывающая гены, кодирующие фибриллярное утолщение и фибриллярный стержень в фибриллярном белке аденовируса серотипа 5, заменена областью, охватывающей гены, кодирующие фибриллярное утолщение и фибриллярный стержень в фибриллярном белке аденовируса серотипа 34, pAdHM49 содержит нуклеотидную последовательность (SEQ ID NO: 49) гена, который кодирует область, состоящую из фибриллярной области утолщения и фибриллярной стержневой области в фибриллярном белке аденовируса серотипа 34. Нуклеотидная последовательность гена, который кодирует фибриллярный белок pAdHM49 (т.е. фибриллярную область утолщения и фибриллярную стержневую область в фибриллярном белке аденовируса серотипа 34 и фибриллярную хвостовую область в фибриллярном белке аденовируса серотипа 5) представлена в SEQ ID NO: 50. В SEQ ID NO: 50 нуклеотидная последовательность гена, который кодирует фибриллярную хвостовую область в фибриллярном белке аденовируса серотипа 5, находится в нуклеотидах 1-132, нуклеотидная последовательность гена, который кодирует фибриллярную стержневую область в фибриллярном белке аденовируса серотипа 34, находится в нуклеотидах 133-402, а нуклеотидная последовательность гена, который кодирует фибриллярную область утолщения в фибриллярном белке аденовируса серотипа 34, находится в нуклеотидах 403-975. В частности, SEQ ID NO: 50 нуклеотидная последовательность области, выделенной из фибриллярного белка аденовируса серотипа 5, находится в нуклеотидах 1-132, а нуклеотидная последовательность области, выделенной из фибриллярного белка аденовируса серотипа 34, находится в нуклеотидах 133-975.
Затем подвергли pAdHM49-hAIB142-3pT расщеплению с помощью Csp45I и лигировали полученный фрагмент с фрагментом, полученным из pHM13CMV-EGFP-miR-142-3рТ путем расщепления с помощью ClaI, в результате чего получили структуру pAdHM49-hAIB142-3pT-CG142-3pT, в которой промотор hTERT, ген E1А, последовательность IRES, ген E1В и последовательность-мишень miR-142-3рТ встроены в лишенную E1 область вектора аденовирус, а промотор CMV, EGFP и последовательность-мишень miR-142-3рТ встроены в лишенную Е3 область вектора аденовирус, и которая дополнительно содержит ген, кодирующий фибриллярный белок аденовируса серотипа 34.
(5) Получение фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34
Линеаризовали pAdHM49-hAIB142-3pT-CG142-3pT путем расщепления с помощью рестриктазы PacI с сайтом узнавания на каждом конце генома аденовируса и инфицировали линеаризованным продуктом 293 клетки, высеянные на 60-мм чашку для культивирования, путем использования Lipofectamine 2000 (Invitrogen). Примерно через 2 недели получили фибриллярный белок 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 (фиг. 1).
Пример 2
Измерение активности фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34
(1) Клетки
Использовали HeLa (выделенные из клеток рака матки человека) и LN319 (выделенные из клеток глиомы человека) в качестве CAR-позитивных клеток, и использовали LNZ308 (выделенные из клеток глиомы человека), LN444 (выделенные из клеток глиомы человека) и К562 (выделенные из клеток миелогенной лейкемии человека) в качестве CAR-негативных клеток. Клетки K562 эспрессируют miR-142-3р. Использовали среду DMEM (10% фетальной телячьей сыворотки (ФТС) с добавлением антибиотиков) для культивирования клеток HeLa, LN319, LNZ308 и LN444, и использовали среду RPMI-1640 (10% ФТС, с добавлением антибиотиков) для культивирования клеток K562. Культивировали эти клетки при температуре 37°С под давлением насыщенного пара в присутствии 5% СО2.
(2) Измерение активности фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 методом проточной цитометрии
Высеяли клетки каждой линии на 24-луночный планшет в количестве 5×104 клеток/500 мкл на лунку и обработали с помощью фибриллярного белка 142-3рТ (Е1, Е3) Ad34 в количестве 10 MOI. В качестве контроля использовали TelomeScan (т.е. условно реплицирующий аденовирус, содержащий промотор hTERT, ген E1А, последовательность IRES и ген E1В, встроенные в указанном порядке в лишенный E1 сайт аденовируса серотипа 5, и содержащий промотор CMV и GFP, встроенные в указанном порядке в лишенный Е3-сайт аденовируса серотипа 5). После культивирования в течение 24 часов собрали клетки, и определили число GFP-позитивных клеток с использованием проточного цитометра MACSQuant (Miltenyi Biotec).
Полученные результаты проиллюстрированы на фиг. 2. В описании и на фиг. 2 "TelomeScan (фибриллярный белок Ad5)" означает TelomeScan, а "фибриллярный белок Ad34" означает рекомбинантный аденовирус, содержащий промотор hTERT, ген E1А, последовательность IRES и ген E1В, встроенные в указанном порядке в лишенный E1 сайт генома аденовируса, а также промотор CMV и GFP, встроенные в указанном порядке в лишенный Е3-сайт генома аденовируса, и содержит ген, который кодирует фибриллярный белок, выделенный из аденовируса серотипа 34. Аналогичным образом, "фибриллярный белок 142-3рТ(Е1) Ad34" означает рекомбинантный аденовирус, дополнительно содержащий последовательность-мишень miR-142-3р, встроенную в лишенную E1 область (после гена E1В) упомянутого фибриллярного белка Ad34, а "фибриллярный белок 142-3pT(E3) Ad34" означает рекомбинантный аденовирус, дополнительно содержащий последовательность-мишень miR-142-3p, встроенную в лишенную Е3 область (после гена GFP) упомянутого фибриллярного белка Ad34. Аналогичным образом, "фибриллярный белок 142-3рТ (Е1, Е3) Ad34" означает рекомбинантный аденовирус, дополнительно содержащий последовательность-мишень miR-142-3р, встроенную как в лишенную E1, так и лишенную Е3 области (после гена Е1В и после гена GFP, соответственно) упомянутого фибриллярного белка Ad34. Кроме того, на фиг. 2 и последующих фигурах "(содержащий GFP)" означает, что ген GFP вставлен в каждый вирусный геном.
В результате измерения активности, когда CAR-негативные клетки LNZ308, LN444 и K562 инфицировали TelomeScan (фибриллярным белком Ad5), не было обнаружено GFP-позитивных клеток (фиг. 2, гистограммы k, p и u). В отличие от этого, когда эти клетки инфицировали фибриллярным белком Ad34, были обнаружены GFP-позитивные клетки (85,5% позитивных клеток LNZ308, 58,4% позитивных клеток LN444 и 63,7% позитивных клеток K562) (гистограммы l, q и v).
Эти результаты показывают, что рекомбинантный аденовирус согласно настоящему изобретению, содержащий ген, который кодирует фибриллярный белок аденовируса серотипа 34, обеспечивает значимое обнаружение CAR-негативных клеток.
Кроме того, в случае клеток K562, которые являются CAR-негативными и экспрессируют miR-142-3р, количество GFP-позитивных клеток составляло 63,7% (гистограмма v) после инфицирования фибриллярным белком Ad34, а количество GFP-позитивных клеток составляло 12,2% после инфицирования фибриллярным белком 142-3рТ(Е1) Ad34 и 34,8% после инфицирования фибриллярным белком 142-3рТ (Е3) Ad34, при этом GFP-позитивные клетки не были обнаружены после инфицирования фибриллярным белком 142-3рТ (Е1, Е3) Ad34 (гистограммы w, x и y). В частности, вероятность обнаружения клеток K562 была значительно меньшей при использовании аденовируса, содержащего последовательность-мишень miR-142-3р, встроенную в лишенную E1 или лишенную Е3 область генома аденовируса, при этом клетки K562 больше не обнаруживались при использовании аденовируса, содержащего последовательность-мишень miR-142-3р, встроенную как в лишенную E1, так и лишенную Е3 области.
Эти результаты показывают, что при использовании рекомбинантного вируса согласно настоящему изобретению, содержащего последовательность-мишень miR-142-3р, не обнаруживались клетки с высоким уровнем экспрессии miR-142-3р, такие как нормальные клетки крови.
Пример 3
Обнаружение раковых клеток в образцах крови с использованием фибриллярного белка 142-3pT (E1, E3) Ad34
Суспендировали 5×104 клеток Η1299 (CAR-позитивных) в 5 мл крови, и подвергли лизису эритроциты, чтобы собрать РВМС. Добавили в РВМС вирус в количестве 1×109, 1×1010 или 1×1011 VP (частиц вируса) и инфицировали при температуре 37°С в течение 24 часов с одновременным вращением с помощью вращателя. Собрали клетки, окрасили с использованием антитела к CD45 в качестве иммунной метки, и наблюдали GFP-позитивные клетки с помощью флуоресцентного микроскопа. CD45 является поверхностным антигеном клеток крови за исключением эритроцитов и тромбоцитов. По вертикальной оси на фиг. 3 и 4 отложены "GFP-позитивные раковые клетки (%)", отображающие "число GFP-позитивных и CD45-негативных клеток (%) среди GFP-позитивных клеток".
В результате, после инфицирования TelomeScan (фибриллярным белком Ad5) наблюдалось множество ложноположительных клеток (GFP-позитивных и CD45-позитивных клеток), тогда как после инфицирования фибриллярным белком 142-3рТ (Е1, Е3) Ad34 число ложноположительных клеток было очень небольшим, что позволяло специфически обнаруживать раковые клетки.
Кроме того, в результате количественного анализа специфичности обнаружения клеток H1299 после инфицирования вирусом TelomeScan (фибриллярным белком Ad5) в количестве 1×109 VP были обнаружены ложноположительные клетки, тогда как при использовании фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 специфичность обнаружения составляла 90% или более, а в случае некоторых образцов 100%) даже при увеличении количества инфицирующего вируса (фиг. 3). Был осуществлен такой же количественный анализ клеток А549 (CAR-позитивных клеток), показавший, что после инфицирования вирусом в количестве 1×109 VP специфичность обнаружения составляла 100% (фиг. 4). Эти результаты показывают, что рекомбинантный вирус согласно настоящему изобретению позволяет специфически обнаруживать раковые клетки, содержащиеся во фракции РВМС.
Соответственно, было продемонстрировано, что реактив для обнаружения и реактив для диагностики согласно настоящему изобретению позволяют обнаруживать высокозлокачественные CAR-негативные раковые клетки и в то же время исключать ложноположительное обнаружение нормальных клеток крови с высокой экспрессией miR-142-3р (например, лейкоцитов) и т.д., и, следовательно, обладают высокой эффективностью при обнаружении циркулирующих опухолевых клеток (ЦОК) в крови.
Пример 4
Измерение активности фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 в различных линиях клеток рака человека
(1) Клетки
В этом примере использовали клетки, выделенные из клеток Η1299 немелкоклеточного рака легкого человека, клеток А549 рака легкого человека, клеток MCF7 рака молочной железы человека, клеток MDA-MB-231 рака молочной железы человека, клеток KK47 рака мочевого пузыря человека, клеток ΜΚΝ45 рака желудка человека, клеток SW620 рака толстой и прямой кишки человека, клеток Huh7 рака печени человека, клеток PaneI рака поджелудочной железы человека, клеток LN319 глиомы человека, клеток Т24 рака мочевого пузыря человека, клеток LNZ308 глиомы человека и клеток LN444 глиомы человека.
(2) Измерение активности фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 методом проточной цитометрии
Суспендировали 5×104 раковых клеток каждой линии в 500 мкл среды, в которую затем добавили 100 мкл суспензии условно реплицирующего Ad в количестве 5×105 или 5×106 БОЕ/мл. Высеяли полученную смесь клеток и условно реплицирующего Ad на 24-луночный планшет и культивировали при температуре 37°С в течение 24 часов. Собрали клетки и центрифугировали с частотой вращения 1500 об/мин в течение 5 минут. После удаления среды суспендировали клетки в 300 мкл фосфатно-солевого буфера (ФСБ), содержащего 2% ФТС, и определили вероятность обнаружения GFP позитивных клеток с использованием проточного цитометра (MACS Quant Analyzer; Miltenyi Biotec). Полученные данные подвергли анализу с помощью программного обеспечения Flowjo для анализа данных цитометрии.
В результате, было обнаружено, что фибриллярный белок 142-3рТ (Е1, Е3) Ad34 эффективно инфицировал почти все раковые клетки, и 60% или более раковых клеток были GFP-позитивными. В частности, в случае CAR-негативных клеток (Т24, LNZ308, LN444), значительно повысилась вероятность обнаружения их GFP-позитивных клеток по сравнению с традиционно применяемым TelomeScan (фиг. 5).
Эти результаты показывают, что рекомбинантный вирус согласно настоящему изобретению позволяет эффективно обнаруживать не только CAR-позитивные клетки, но также CAR-негативные клетки.
Пример 5
Обнаружение раковые клетки с произошедшим эпителиально-мезенхимальным переходом (ЕМТ)
Культивировали клетки PancI рака поджелудочной железы человека в течение 6 дней в присутствии 10 нг/мл рекомбинантного TGF-β1, чтобы тем самым индуцировать эпителиально-мезенхимальный переход (ЕМТ). После индуцирования ЕМТ определили относительную экспрессию мРНК, кодирующих E-кадгерин, ЕpСАМ, hTERT, N-кадгерин, Slug и Snail, путем ПЦР с обратной транскрипцией в реальном времени. Кроме того, осуществили анализ экспрессии CAR и CD46 в клетках Раnc I методом проточной цитометрии. Инфицировали клетки вирусом согласно настоящему изобретению таким же образом, как описано в Примере 4.
В результате, после культивирования в содержащей TGF-β среде экспрессия маркерных генов ЕМТ Slug, Snail и N-кадгерина увеличилась, а экспрессия эпителиальных маркеров E-кадгерина и ЕpСАМ уменьшилась, что является признаком индуцирования ЕМТ (фиг. 6А). Кроме того, после индуцирования ЕМТ экспрессия CAR уменьшилась, тогда как экспрессия CD46 не уменьшилась, (фиг. 6Б). К тому же, при использовании традиционного TelomeScan в клетках PancI с произошедшим переходом ЕМТ GFP-позитивными были всего около 35% этих клеток, тогда как в случае фибриллярного белка 142-3рТ (Е1, Е3) рекомбинантного аденовируса Ad34 (фиг. 6В) GFP-позитивными были почти 90% или более клеток.
Эти результаты показывают, что рекомбинантный вирус согласно настоящему изобретению позволяет с высокой чувствительностью обнаруживать раковые клетки с произошедшим переходом эпителиально-мезенхимальным переходом (ЕМТ).
Пример 6
Обнаружение стволовых раковых клеток
Высеяли клетки MCF7 и клетки MCF7-ADR (раковые клетки, резистентные к противораковому средству адриамицин) на 96-луночный планшет в количестве 1×103 клеток на лунку, и на следующий день добавили адриамицин в количестве 0,2, 1, 5, 25 или 125 мкг/мл. Через 24 часа после добавления адриамицина определили жизнеспособность клеток с использованием реактива alamarBlue® (значение: среднее ± стандартное отклонение (n=6)).
Клетки MCF7 и клетки MCF7-ADR также подвергли анализу методом проточной цитометрии с целью определения экспрессии CAR, CD46, Ρ- гликопротеина (MDR), CD24 и CD44. Суспендировали 5×105 MCF7-ADR клеток в 100 мкл ФСБ, содержащего 2% ФТС, и добавили по 1 мкл меченного FITC мышиного антитела к CD24 человека и меченного РЕ мышиного антитела к CD44 человека, с последующей реакцией в течение 1 часа на льду в защищенных от света условиях. После промывания 4 мл ФСБ, содержащего 2% ФТС, центрифугировали суспензию с частотой вращения 1500 об/мин в течение 5 минут, чтобы путем аспирации удалить надосадочную жидкость. Снова суспендировали клетки в 100 мкл ФСБ, содержащего 2% ФТС, и поместили в сортировщик клеток (FACS Aria II; BD Biosciences), чтобы рассортировать их на фракцию СD24-негативных клеток и фракцию СD44-позитивных клеток. Полученные данные подвергли анализу с помощью программного обеспечения Flowjo для анализа данных цитометрии. Известно, что фракция с характеристиками СD24-негативных клеток и СD44-позитивных клеток рака молочной железы человека, представляет собой стволовые раковые клетки (Al-Hajj M., и др., Proc Natl Acad Sci USA, 100; 3983-3988, (2003)). Инфицировали клетки вирусом согласно настоящему изобретению таким же образом, как описано в Примере 4.
В результате, клетки MCF7-ADR продемонстрировали значительно более высокую жизнеспособность даже в присутствии адриамицина по сравнению с клетками MCF7 и, соответственно, были признаны резистентными к лекарственным средствам (фиг. 7А). Клетки MCF7-ADR также продемонстрировали высокую экспрессию CAR и CD46, как и в случае клеток MCF7. Кроме того, клетки MCF7-ADR также продемонстрировали высокую экспрессию MDR, который является мембранным белком, отвечающим за способность элиминацию лекарственных средств (фиг. 7Б). Кроме того, когда фибриллярным белком 142-3рТ( Е1, Е3) Ad34 инфицировали CD24-негативные и СD44-позитивные клетки из числа клеток MCF-ADR, 80% или более клеток были GFP-позитивными. В отличие от этого, в случае традиционно используемого TelomeScan около 70% клеток были GFP-позитивными (фиг. 7В).
Эти результаты показывают, что рекомбинантный вирус согласно настоящему изобретению позволяет обнаруживать резистентные к лекарственным средствам раковые клетки. Кроме того, доказано, что рекомбинантный вирус согласно настоящему изобретению позволяет обнаруживать стволовые раковые клетки.
Пример 7
Обнаружение раковых клеток в образцах крови с использованием фибриллярного белка 142-3рТ (Е1, Е3) Ad34
Инфицировали клетки H1299 или клетки Т24 клетки вектором лентивируса, экспрессирующего красный флуоресцирующий белок (мономерный красный флуоресцирующий белок; RFP), в количестве 100 MOI и культивировали. Затем высеяли клетки на 96-луночный планшет в количестве 0,1 клетки на лунку, чтобы получить клоны клеток, и культивировали до образования колоний. С помощью флуоресцентного микроскопа отобрали экспрессирующие RFP клетки, которые продолжили культивировать, а затем подвергли проточной цитометрии, чтобы определить интенсивность экспрессии RFP. Затем идентифицировали клетки с высокой интенсивностью экспрессии RFP как экспрессирующие RFP клетки.
Суспендировали одноядерные клетки периферической крови человека (hPBMC), выделенные из 1,0 мл периферической крови человека, в 800 мкл среды RPMI-1640 (10% ФТС с добавлением антибиотиков). Добавили к суспензии hPBMC раковые клетки в количестве 1,0×105 или 5,0×105 клеток/мл в объеме 100 мкл (на фиг. 8 "пики раковых клеток" отображают число раковых клеток, добавленных к суспензии hPBMC). Кроме того, добавили суспензию условно реплицирующего Ad в количестве 2×108 БОЕ/мл в объеме 100 мкл, что дало общий объем 1 мл, и культивировали при температуре 37°С в течение 24 часов при медленном вращении с помощью вращателя.
Суспензию клеток, культивированную в течение 24 часов после инфицирования вирусом, центрифугировали с ускорением силы тяжести 300×g в течение 5 минут, чтобы удалить надосадочную жидкость. Добавили фиксатор клеток в объеме 200 мкл и ввели в реакцию при температуре 4°С в защищенных от света условиях в течение 15 минут. После добавления 1 мл ФСБ центрифугировали суспензию с ускорением силы тяжести 300×g в течение 5 минут, чтобы удалить надосадочную жидкость. Суспендировали клетки в ФСБ, содержащем 2% ФТС, и определили вероятность обнаружения GFP-позитивных клеток с помощью проточного цитометра (MACS Quant Analyzer; Miltenyi Biotec). Полученные данные подвергли анализу с помощью программного обеспечения Flowjo для анализа данных цитометрии.
В этом примере смешали раковые клетки, меченные RFP (красным флуоресцирующим белком), с hPBMC, чтобы определить, можно ли обнаружить раковые клетки hPBMC. В результате, в случае CAR-позитивных раковых клеток (Н1299), TelomeScan (фибриллярный белок Ad5) и фибриллярный белок 142-3рТ(Е1,Е3) Ad34 позволяли обнаруживать 80% или более раковых клеток. С другой стороны, в случае CAR-негативных раковых клеток (Т24) TelomeScan (фибриллярный белок Ad5) обеспечивал очень низкую эффективность обнаружения (около 10% обнаруженных GFP-позитивных клеток), тогда так фибриллярный белок 142-3рТ(Е1,Е3) Ad34 позволял обнаруживать 80% или более раковых клеток (фиг. 8).
Эти результаты показывают, что рекомбинантный аденовирус согласно настоящему изобретению позволяет эффективно обнаруживать не только CAR-позитивные раковые клетки, но также CAR-негативные раковые клетки.
Промышленная применимость
Реактивы, содержащие рекомбинантный аденовирус согласно настоящему изобретению, обеспечивают простое и высокочувствительное обнаружение CAR-негативных раковых клеток без обнаружения нормальных клеток крови (например, лейкоцитов).
Перечень последовательностей в свободной текстовой форме
SEQ ID NO: 4: синтетическая ДНК
SEQ ID NO: 5-26: синтетическая РНК
SEQ ID NO: 27-28: синтетическая ДНК
SEQ ID NO: 43-46: синтетическая ДНК
SEQ ID NO: 50: синтетическая ДНК
Перевод к фигурам
Фиг. 1
Последовательность-мишень микроРНК
Геном Ad
Связывающий CD46 фибриллярный белок Ad
Фиг. 2
TelomeScan (фибриллярный белок Ad5) (содержащий GFP)
Фибриллярный белок Ad34 (содержащий GFP)
Фибриллярный белок 142-3pТ (Е1) Ad34 (содержащий GFP)
Фибриллярный белок 142-3pT (E3) Ad34 (содержащий GFP)
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP)
Число клеток
Уровень экспрессии GFP
Фиг. 3
Клетки H1299
GFP-позитивные раковые клетки (%)
TelomeScan (фибриллярный белок Ad5) (содержащий GFP) 1×109 VP
Фибриллярный белок 142-3pТ (Е1, Е3) Ad34 (содержащий GFP) 1×109 VP
Фибриллярный белок 142-3pТ (Е1, Е3) Ad34 (содержащий GFP) 1×1010 VP
Фиг. 4
Клетки А549
GFP-позитивные раковые клетки (%)
TelomeScan (фибриллярный белок Ad5) (содержащий GFP) 1×109 VP
Фибриллярный белок 142-3pТ (Е1, Е3) Ad34 (содержащий GFP) 1×109 VP
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP) 1×1010 VP
Фиг. 5
GFP-позитивные клетки (%)
10 MOI
1 MOI
TelomeScan (фибриллярный белок Ad5) (содержащий GFP)
Фибриллярный белок Ad34 (содержащий GFP)
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP)
Фиг. 6
Число клеток
Относительный уровень экспрессии
GFP-позитивные клетки (%)
1 MOI
10 MOI
TelomeScan (фибриллярный белок Ad5) (содержащий GFP)
Фибриллярный белок Ad34 (содержащий GFP)
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP)
Фиг. 7
Жизнеспособность клеток (%)
Концентрация ADR (мкг/мл)
GFP-позитивные клетки (%)
10 MOI
1 MOI
TelomeScan (фибриллярный белок Ad5) (содержащий GFP)
Фибриллярный белок Ad34 (содержащий GFP)
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP)
Фиг. 8
GFP-позитивные клетки/RFP позитивные клетки (%)
TelomeScan (фибриллярный белок Ad) (содержащий GFP)
Фибриллярный белок Ad34 (содержащий GFP)
Фибриллярный белок 142-3рТ (Е1, Е3) Ad34 (содержащий GFP)
Пики раковых клеток



























































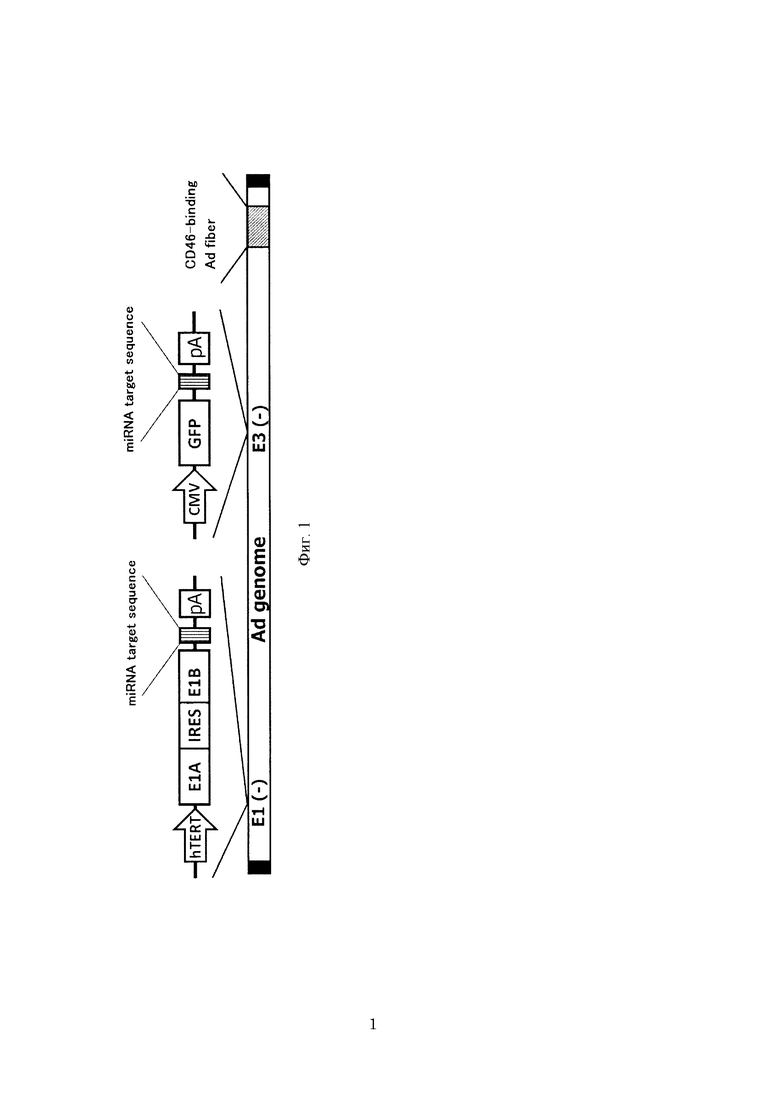
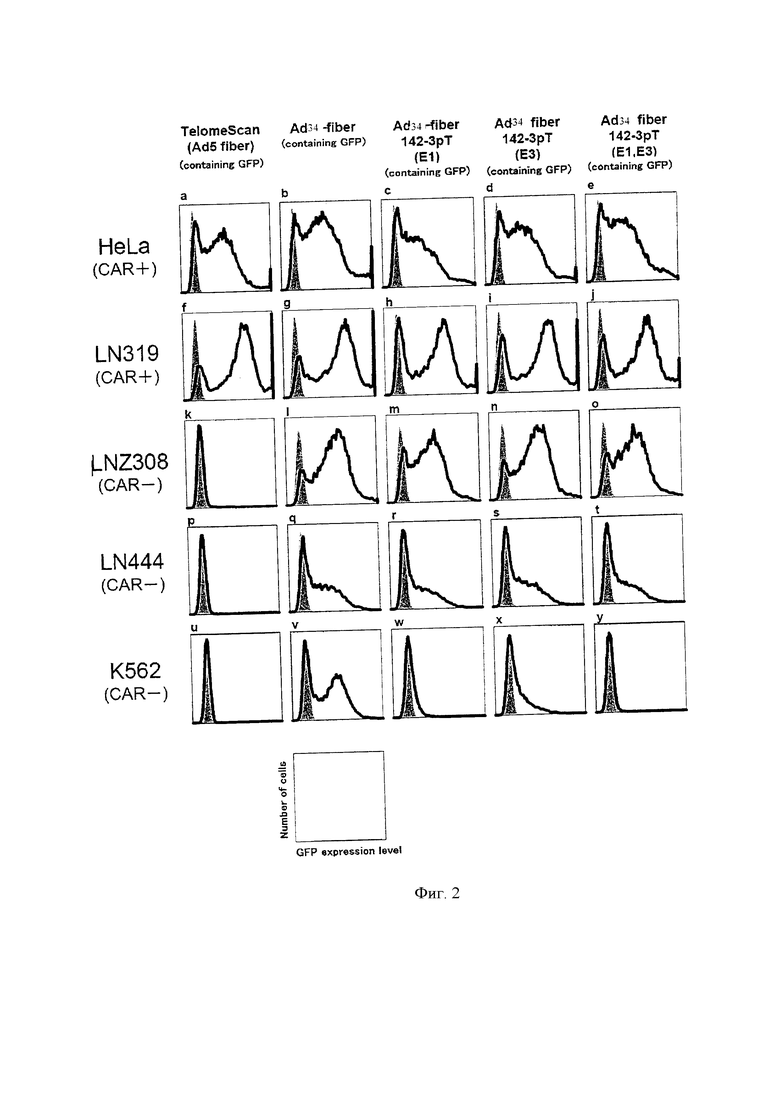
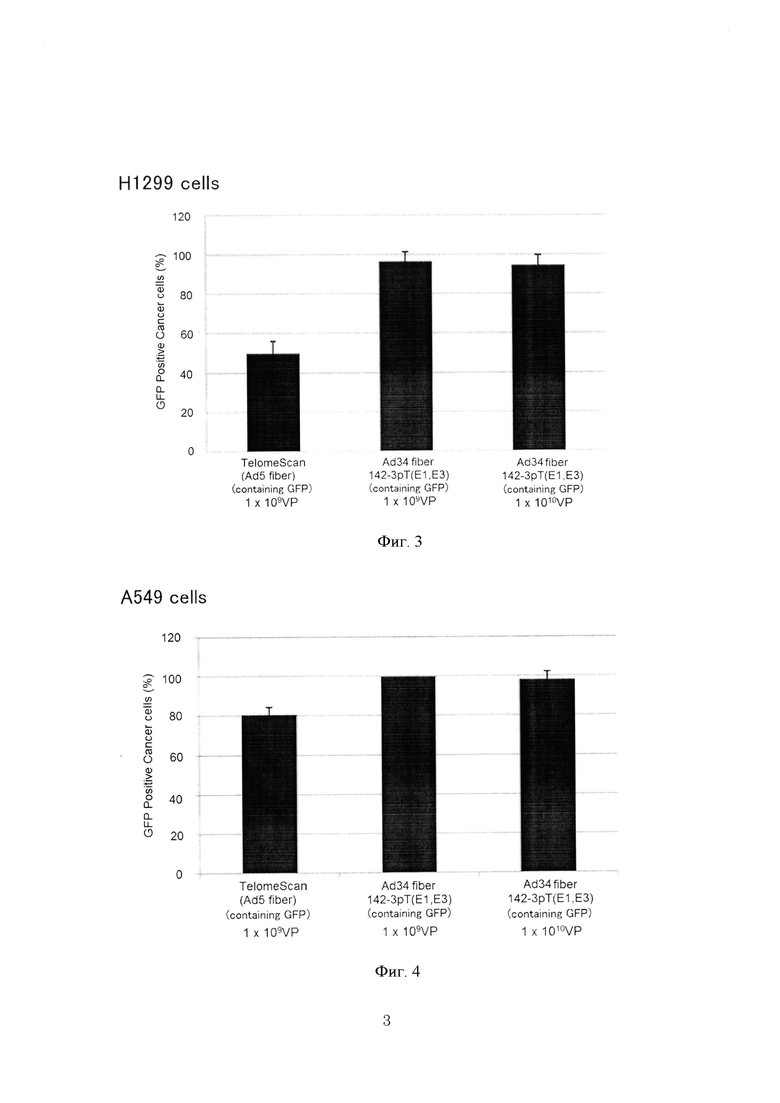
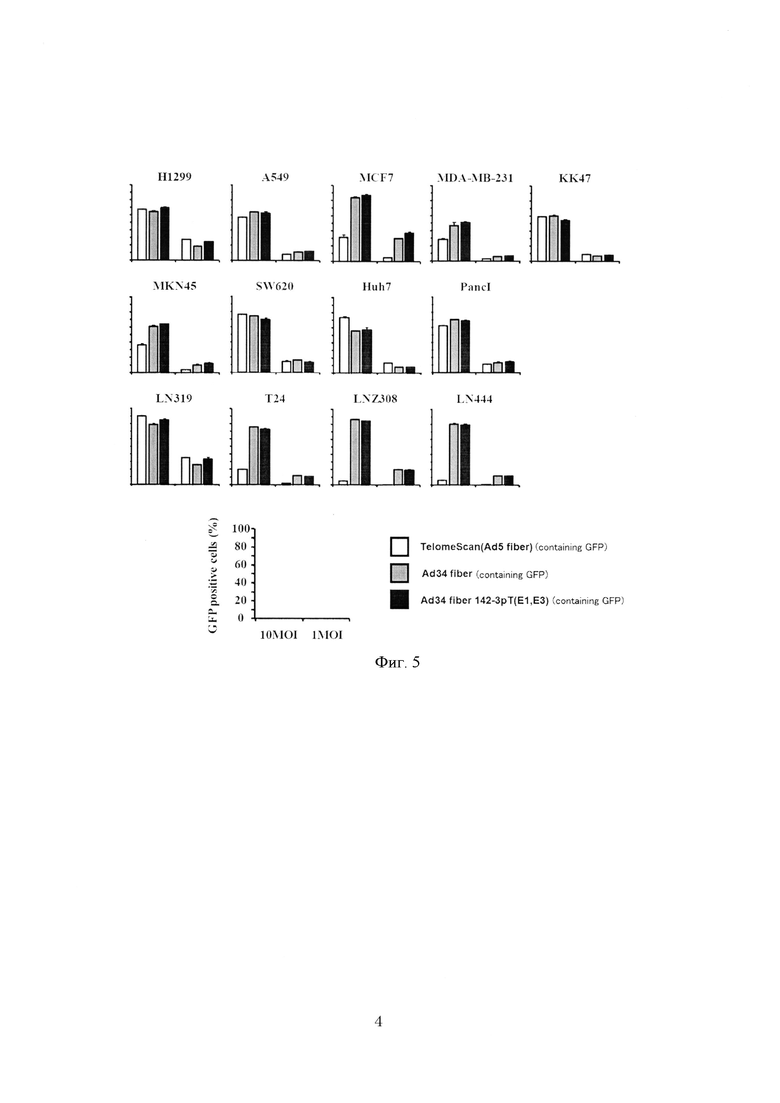

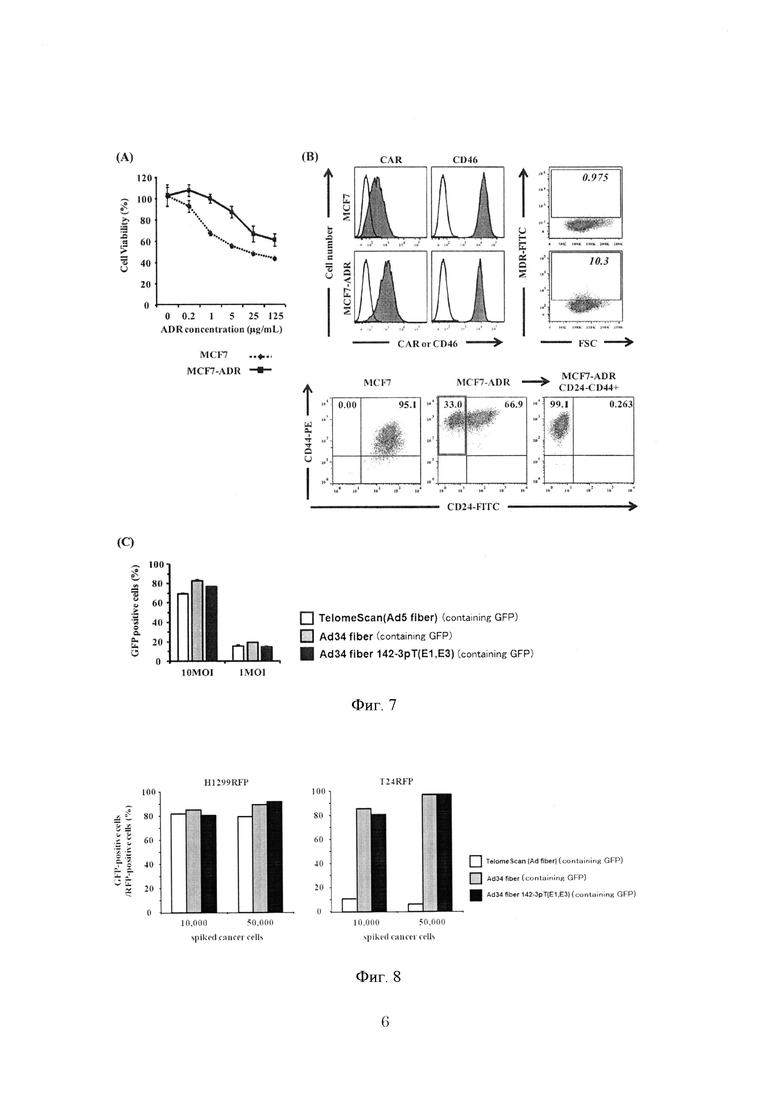
Предложенное изобретение относится к области биотехнологии. Предложен рекомбинантный аденовирус для обнаружения раковых клеток или диагностики рака, содержащий репликативную кассету, маркерную кассету, ген, который кодирует связывающий CD46 фибриллярный белок. Указанная репликативная кассета интегрирована в участок Е1 генома аденовируса и содержит промотор обратной транскриптазы теломеразы человека, ген Е1А, последовательность IRES и ген Е1В в указанном порядке и последовательность-мишень miR-142. Указанная маркерная кассета интегрирована в участок Е3 генома аденовируса и состоит из репортерного гена, промотора, способного регулировать экспрессию гена, и последовательности-мишени miR-142. Предложенный рекомбинантный аденовирус позволяет обнаруживать все раковые клетки, включая CAR-негативные клетки, и при этом не дает ложноположительных результатов в процессе обнаружения раковых клеток для нормальных клеток крови. Предложенный рекомбинантный аденовирус может быть использован в медицине при диагностике рака. 3 з.п. ф-лы, 8 ил., 7 пр.
1. Рекомбинантный аденовирус для обнаружения раковых клеток или диагностики рака, включающий следующее:
репликативная кассета, состоящая из полинуклеотида, содержащего промотор обратной транскриптазы теломеразы человека, ген Е1А, последовательность IRES и ген Е1В в указанном порядке и содержащего последовательность-мишень первой микроРНК, при этом репликативная кассета интегрирована в участок Е1 генома аденовируса и первая микроРНК является miR-142;
маркерная кассета, состоящая из репортерного гена, промотора, способного регулировать экспрессию гена, и последовательности-мишени второй микроРНК, при этом маркерная кассета интегрирована в участок Е3 генома аденовируса и вторая микроРНК является miR-142;
ген, который кодирует связывающий CD46 фибриллярный белок.
2. Рекомбинантный аденовирус по п. 1, в котором репортерным геном является ген, который кодирует белок, испускающий флуоресцентное свечение, или ген, который кодирует ферментативный белок, выделяющий люминофор или хромофор в результате ферментативной реакции.
3. Рекомбинантный аденовирус по п. 1, в котором промотором является промотор обратной транскриптазы теломеразы человека или промотор цитомегаловируса.
4. Рекомбинантный аденовирус по п. 1, в котором связывающий CD46 фибриллярный белок содержит, по меньшей мере, фибриллярную область утолщения в фибриллярном белке аденовируса серотипа 34 или 35.
Авторы
Даты
2018-01-24—Публикация
2012-02-17—Подача