Изобретение относится к аналитической химии, а именно к способам количественного определения токсичных компонентов в имплантатах на основе полилактид-гликолида (PLGA), в том числе скаффолдах для культивирования клеток из PLGA с включенными в структуру композита фосфатов кальция (ФК) методом газовой хроматографии с предварительным растворением PLGA имплантата. Изобретение заключается в способе одновременного и в одной пробе количественного определения токсичных компонентов: остаточных растворителей (ацетона, этилацетата) и остаточного лактида (мономеры лактида) в имплантате из PLGA, в том числе в скаффолде на основе PLGA с включенными ФК: гидроксиапатитом Ca10(PO4)6(OH)2 и β-трикальций фосфатом Са3(РО4)2.
Данные токсичные компоненты: остаточный лактид и органические растворители (ацетон, этилацетат) могут быть определены также заявленным способом в других изделиях медицинского назначения на основе PLGA, например, в полимерных капсулах из PLGA, шовном материале, пинах и других, в процессе изготовления которых в качестве растворителя PLGA были использованы ацетон и/или этилацетат.
Известно, что полимерная основа PLGA по завершения процесса полимеризации может содержать остаточный лактид, высокое содержание которого повышает риск проявлений токсических реакций со стороны клеток и организма, вызывать отторжение имплантата организмом человека [1].
Содержание остаточного лактида в PLGA и изделиях на основе PLGA для медицинского назначения нормируется и указывается в спецификации. Допускается его содержание не выше 3% [2].
Ацетон и этилацетат используют для растворения гранул PLGA с целью возможности формирования изделия, т.е. они являются технологическими растворителями, наиболее применимыми в процессе производства медицинских изделий из PLGA. Поскольку ацетон и этилацетат являются растворителями третьего класса токсичности необходимо определять их остаточное содержание в скаффолдах, полимерных капсулах, шовном материале на основе PLGA и других изделиях – имплантатах из PLGA. [3].
Количественное определение остаточных растворителей и остаточного лактида в полимерах, в том числе PLGA, проводят методами инфракрасной спектроскопии (ИК), высокоэффективной жидкостной хроматографии (ВЭЖХ) и газовой хроматографии (ГХ).
Определение массовой доли лактида в полилактиде методом ИК-спектроскопии описано в патенте WO2013/187758. Недостатком данного метода является сложность приготовления стандартных образцов близких по своему составу и структуре к конкретной матрице скаффолда.
Количественное определение остаточных мономеров (лактида и гликолида) в PLGA методом ВЭЖХ проводят в обращено-фазовом режиме. В ходе пробоподготовки проводят гидролиз образца полимера с применением гидроксида натрия, затем следует этап дериватизации некоторого количества молочной и гликолевой кислот, полученных на этапе гидролиза. В качестве дериватизируещего агента используют 2,4'-дибромацетофенон и триэтаноламин. Недостатком данного метода является сложность пробоподготовки, невозможность определять ацетон и этилацетат, и дороговизна аналитической процедуры [4].
Основным способом количественного определения остаточных растворителей (ацетон, этилацетат) и альтернативным способом определения остаточного лактида является метод газовой хроматографии. В данном методе разделение смеси реагентов проводят на капиллярных колонках, количественный анализ проводят по зависимости площади хроматографического пика от концентрации (метод абсолютной градуировки) либо по соотношению площадей пиков исследуемых компонентов с площадью пика вещества-стандарта в образце сравнения и исследуемом образце (метод внутреннего стандарта). Площадь пика – аналитический сигнал, получаемый при прохождении потока газа-носителя с разделенными компонентами смеси через детектор. В качестве детектора используют пламенно-ионизационный детектор (ПИД), в качестве газа-носителя гелий или азот.
В качестве способа количественного определения летучих органических примесей (ацетон, лактид) в упаковочных материалах на основе полилактида предложено использовать способ твердофазной микроэкстракции с дальнейшим анализом методом газовой хроматографии с ПИД на капиллярной колонке DB-5 (95% диметилполисилоксан, 5% фенил, Agilent Technologies). Навеску образца нагревают в закрытой виале, далее с помощью твердофазного экстрактора отбирают летучую часть пробы. Десорбцию проводят в испарителе хроматографа в течение 5-20 мин с дальнейшим анализом. Недостатком данного метода является сложный процесс пробоподготовки с применением различных моделей волокон-экстрагентов, в зависимости от молекулярной массы экстрагируемого вещества [5].
В ряде работ предложено использовать парафазную приставку к газовому хроматографу для количественного определения остаточных растворителей. Способ заключается в нагревании виалы с раствором образца до 110°С, далее поток газа-носителя нагнетается в виалу, после чего смесь подается в испаритель хроматографа. Далее проводится хроматографическое разделение на капиллярной колонке. Таким способом можно определять остаточные растворители, но невозможно определить остаточный лактид [6].
Остаточный дихлорметан предложено количественно определять методом газовой хроматографии в наночастицах PLGA без предварительной пробоподготовки. В качестве растворителя используют N,N-диметилацетамид, хроматографическое разделение проводят на капиллярной колонке HP-5ms (95% диметилполисилоксан, 5% дифенил, Agilent Technologies). Использование в качестве растворителя N,N-диметилацетамида с температурой кипения (165°С) близкой к лактиду (~ 175°С) может повлиять на хроматографическое разделение, однако, в данной работе это не было рассмотрено [7].
Методика количественного определения остаточного лактида в полилактиде с использованием газового хроматографа на детекторе ПИД основана на использовании метода внутреннего стандарта. Для хроматографического разделения использовали капиллярную колонку DB-17ms (30м×0,25мм, толщина фазы (50%фенил-метилполисилоксан) 0,25мкм, Agilent Technologies). Этапы анализа: приготовление раствора внутреннего стандарта (2,6-диметил-γ-пирон в дихлорметане); приготовление стандартного раствора лактида в дихлорментане; приготовление рабочего раствора (смесь стандартного раствора лактида и внутреннего стандарта). На этапе приготовления стандартного рабочего раствора описано добавление ацетона, что не подходит для количественного определения остаточного ацетона в скаффолдах. [8].
Предложен способ количественного определения остаточного лактида в полилактиде с применением внутреннего стандарта (дифениловый эфир) методом газовой хроматографии. Анализ проводится на капиллярной колонке SPB-5 (95% диметилполисилоксан, 5% фенил, Sigma Aldrich), при температурах испарителя и детектора 250°С, температура колонки 140°С, поток газа-носителя (азота) 2 мл/мин, деление потока 1:20. Пробу образца полимера растворяют в дихлорметане, затем к раствору прибавляют гексан (осадитель) для проведения экстракции лактида из раствора полилактида. К полученному раствору добавляют внутренний стандарт, затем проводят газохроматографический анализ [9]. На основе описанных условий коллектив авторов предложил способ количественного определения остаточного лактида в полилактиде. Суть способа заключается в том, что лактид вступает в реакцию с абсолютизированным спиртом с образованием этил лактата. После растворения навески образца полимера в хлороформе к раствору добавляют внутренний стандарт и абсолютизированный спирт, затем проводят количественное определение методом газовой хроматографии [10]. Недостатком является то, что колонка на основе диметилполисилоксана не позволяет провести эффективное разделение пиков ацетона и этилацетата с растворителем (хлороформ, дихлорметан).
Прототипом заявленного способа является способ хроматографического разделения изомеров лактида на капиллярной колонке HP-Innowax (100% полиэтиленгликоль, Agilent Technologies) методом газовой хроматографии. Поскольку целью данного исследования было получить условия разделения изомеров лактида (мезо-лактид, L-лактид), разработка способа количественного определения не была проведена. Применение такого типа капиллярных колонок позволяет провести разделение остаточных растворителей и, как показано в данной работе, провести разделение изомеров лактида [11].
Техническим результатом настоящего изобретения является возможность одновременного и в одной пробе количественного определения ацетона, этилацетата, лактида в имплатнатах и скаффолдах на основе полилактид-гликолида (PLGA), в том числе в скаффолдах с включением ФК, заменителей костных тканей: гидроксиапатита Ca10(PO4)6(OH)2 и β-трикальций фосфата Са3(РО4)2. Задача решается путем растворения композита PLGA в хлороформе (при этом минеральная составляющая не растворяется), далее следует очистка полученной суспензии от полимера PLGA и частиц гидроксиапатита и β-трикальций фосфата, других ФК (остаточные оксиды, переходные формы ФК) с последующим анализом очищенного раствора в специально подобранных оптимизированных хроматографических условиях на содержание остаточного ацетона, этилацетата, лактида в одной пробе одновременно.
Заявленное изобретение по одновременному в одной пробе определению ацетона, лактида, этилацетата в скаффолдах из PLGA с ФК и других имплантатах на основе PLGA состоит из следующих этапов:
1 Растворение: перевод PLGA из твердого состояния в жидкое (раствор) путем растворения образца композитной матрицы (скаффолда) из PLGA (иного имплантата на основе PLGA) в хлороформе. Образец имплантата взвешивают на аналитических весах, записывают навеску с точностью ~ 0,0001 г, к навеске прибавляют хлороформ и доводят массу до соотношения 1:30 (минимальная масса исследуемого раствора 0,7 г), фиксируя итоговую массу с точностью ~ 0,0001 г. Процесс растворения образца длится не менее 30 мин до образования гомогенного раствора.
В случае растворения скаффолда из PLGA с включенными фосфатами кальция (ФК) минеральные компоненты не растворяются в хлороформе и суспензия фильтруется.
2 Очистка фильтрацией и разделение раствора PLGA: проводят очистку суспензии от неорганической части гидроксиапатита Ca10(PO4)6(OH)2 и β-трикальций фосфатом Са3(РО4)2 и полимерной части (PLGA) с использованием шприцевых фильтров (размер пор не более 0,45 мкм). Фильтрация растворенной полимерной фракции исследуемого раствора происходит за счет разницы молекулярных масс токсичных компонентов, растворителя (хлороформа) и PLGA. От неорганической части (фосфаты кальция) очистка раствора образца происходит за счет подобранного размера пор (0,45 мкм).
Анализируется проба фильтрата с органическими компонентами и остаточным лактидом.
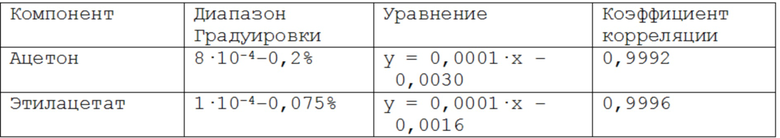
3 Построение градуировочных зависимостей в диапазонах: градуировочные кривые зависимости по площади пиков от концентрации компонента в следующих диапазонах: ацетон (8·10-4–0,2%), лактид (0,006–0,25%), этилацетат (1·10–4–0,075%) в хлороформе;
4 Анализ пробы: анализируют полученную пробу образца в следующих условиях:
Капиллярная колонка DB-WAX, 100% полиэтиленгликоль 30м × 0,25мм, толщина фазы 0,25мкм, производитель Agilent Technologies;
Газ-носитель: азот;
Детектор: пламенно-ионизационный;
Температура испарителя: 250°С;
Температура детектора: 250°С;
Давление: 60 кПа; деление потока: 1:20;
Температурный режим колонки: плато 80°С – 2 мин, нагрев 10°С/мин до 170°С – плато 1 мин, нагрев 20°С/мин до 220°С – плато 17,5 мин;
Объем вводимой пробы: 0,5 мкл.
Разработанные хроматографические условия позволяют разделить ацетон, лактид и этилацетат. Способ, на основе данных хроматографических условий с предварительной фильтрацией раствора образца, позволяет проводить одновременное количественное определение токсических компонентов: технологических растворителей (ацетон и этилацетат) и остаточного лактида в имплантате из PLGA, а именно, в скаффолде, в том числе с неорганической основой, фосфатами кальция (смесью гидроксиапатита Ca10(PO4)6(OH)2 и β-трикальций фосфата Са3(РО4)2), а также в иных имплантатах на основе PLGA: полимерных капсулах и шовном материале и др.
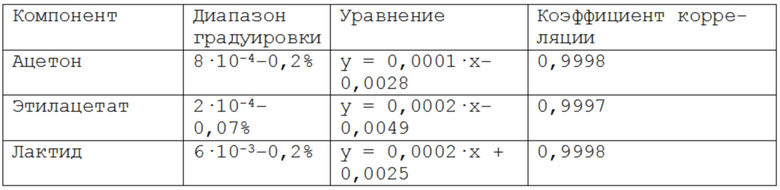
На фиг. 1 приведена хроматограмма разделения модельной смеси в хлороформе: ацетон 3,0 мин; этилацетат 3,2 мин; хлороформ (растворитель) 3,6 мин; лактид 17,7 мин.
В таблице 1 указаны хроматографические параметры разделения.
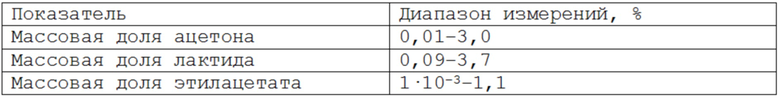
В таблице 2 указаны диапазоны количественного определения токсичных компонентов в пробах скаффолдов.
Таблица 1 – Хроматографические параметры разделения

Для каждого градуировочного образца определяют площади хроматографических пиков компонентов (ацетон, лактид, этилацетат). Каждый образец анализируют не менее трех раз. Полученную зависимость массовой доли компонентов от площади хроматографического пика методом линейного регрессионного анализа интерполируют уравнением прямой. Градуировочная зависимость считается пригодной при коэффициенте корреляции не менее 0,995.
Массовую долю токсичных компонентов (ацетона, лактида, этилацетата) в анализируемом растворе рассчитывают по формуле:
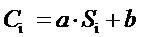
где Сi — массовая доля токсичных компонентов (ацетона, лактида, этилацетата) в растворе, %;
Si — площадь хроматографического пика токсичных компонентов, мВ·с;
a, b — коэффициенты градуировочной зависимости.
Массовую долю определяемых компонентов в пробе скаффолда рассчитывают по формуле:
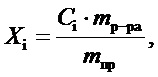
где Xi — массовая доля компонента в пробе, %;
Сi — массовая доля компонента в анализируемом растворе, %;
mр-ра — масса приготовленного раствора, г;
mпр — навеска пробы, г.
Таблица 2 – Диапазоны количественного определения токсичных компонентов в пробах скаффолдов
Ниже приведены примеры конкретного осуществления изобретения.
Пример 1. Количественное определение ацетона и этилацетата в образце скаффолда
Навеску образца скаффолда «PGLA 75/25 + ФК» 99,56 мг растворили в 1,5026 г хлороформа. Затем раствор отобрали шприцем на 5 мл и пропустили через PTFE фильтр (размер пор 0,45 мкм). Процедуру повторили 2 раза. Полученный раствор был гомогенным без видимых включений и опалесценции. Раствор хроматографировали по приведенным условиям. Были построены градуировочные зависимости на ацетон и этилацетат (табл. 3).
Таблица 3 – Диапазоны градуировочных зависимостей массовой доли от площади хроматографического пика
Результат расчета содержания ацетона, этилацетата в образце скаффолда приведен в табл. 4.
Таблица 4 –– Содержание ацетона и этилацетата в образце «PGLA 75/25 + GAP»

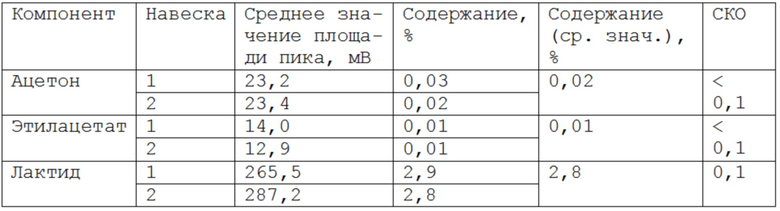
На фиг. 2 представлена хроматограмма образца «PGLA 75/25 + GAP» в хлороформе: ацетон 3,3 мин; этилацетат 3,4 мин; хлороформ (растворитель) 3,6 мин; (давление газа-носителя 40 кПа).
Пример 2. Количественное определение ацетона, этилацетата и лактида в образце скаффолда
Две параллельные навески образца скаффолда «Scaffold TSU» 0,0142 г (навеска 1) и 0,0174 г (навеска 2), массу раствора довели хлороформом до 0,7500 г (1) и 0,8015 г (2). Затем раствор отобрали шприцем на 5 мл и пропустили через PTFE фильтр (размер пор 0,45 мкм). Процедуру повторили 2 раза. Полученный раствор был гомогенным без видимых включений и опалесценции. Раствор хроматографировали по приведенным условиям.
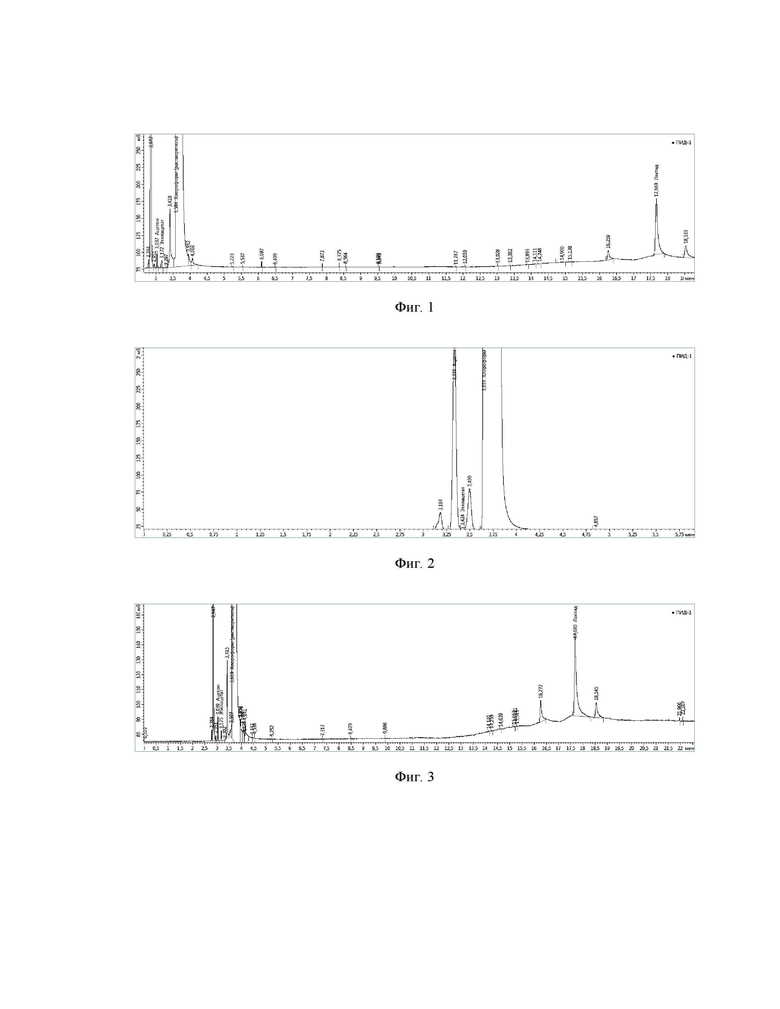
На фиг. 3 представлена хроматограмма разделения образца «Scaffold TSU» в хлороформе: ацетон 3,0 мин; этилацетат 3,2 мин; хлороформ (растворитель) 3,6 мин; лактид 17,7 мин; (давление газа-носителя 60 кПа).
Были построены градуировочные зависимости на ацетон, этилацетат и лактид (табл. 5).
Таблица 5 –– Диапазоны градуировочных зависимостей массовой доли от площади хроматографического пика
Результат расчета содержания ацетона, лактида и этилацетата в образце скаффолда приведен в табл. 6.
Таблица 6 – Содержание определяемых компонентов в образце «Scaffold TSU»
Литература:
1. J. H. Hamman et al. Poly (D,L-lactide-co-glycolide) nanoparticles: Uptake by epithelial cells and cytotoxicity // eXPRESS Polymer Letters Vol.8, No.3 (2014) 197–206 10.3144/expresspolymlett.2014.23; F. W. Cordewener et al. Cytotoxicity of poly (96l/4d-lactide): the influence of degradation and sterilization // Biomaterials doi.org/10.1016/S0142-9612(00)00111-3; J Singha et al. Preparation, characterization, cytotoxicity and transfection efficiency of poly(d,l-lactide-co-glycolide) and poly(d,l-lactic acid) cationic nanoparticles for controlled delivery of plasmid DNA // International Journal of Pharmaceutics V. 343, 2007, P. 247-254
2. ASTM F2313-18 Standard Specification for Poly(glycolide) and Poly(glycolide-co-lactide) Resins for Surgical Implants with Mole Fractions Greater Than or Equal to 70 % Glycolide; ASTM F2579-18 Standard Specification for Amorphous Poly(lactide) and Poly(lactide-co-glycolide) Resins for Surgical Implants
3. ОФС.1.4.1.0026.18 Имплантаты; ОФС.1.1.0008.15 Остаточные органические растворители
4. M. Schneider et al. Development of a fast and precise method for simultaneous quantification of the PLGA monomers lactic and glycolic acid by HPLC // Journal of Pharmaceutical Analysis. V. 9, P.100-107
5. Ducrueta V. et al Quantitative determination of volatile organic compounds formed during Polylactide processing by MHS-SPME // Polymer Degradation and Stability. V.136, P.80–88; X. Zhang et al. Determination of acetone in human breath by gas chromatography-mass spectrometry and solid-phase microextraction with on-fiber derivatization // Journal of chromatography B. V. 810, P. 269-275
6. X. Wang et al. Quantitative determination of residual 1,4-dioxane in three-dimensional printed bone scaffold // Journal of Orthopedic Translation // doi.org/10.1016/j.jot.2017.06.004; S. Zhao. An easy solution to monitor printing residual solvents in packaging material using an Agilent 7820 GC system an Agilent 7697A headspace sampler // Agilent technologies
7. I.-J. Oh, E.-J. Han. Analysis of residual solvents in polylactide-co-glycolide) nanoparticles // Journal of Pharmaceutical Investigation. V. 42, P. 251-256
8. Quantification of Residual Lactide in Polylactide (PLA) by Gas Chromatography (GC) Using a Flame Ionization Detector (FID)-External Release Version // Nature works LLC
9. L. Feng et al. Quantification of residual monomer in polylactide by gas chromatographic internal standard method // Polymer Testing. V. 50, P. 79-82
10. L. Feng et al. An analytical method for determining residual lactide in polylactide by gas chromatography // Analytical sciences. V. 33, P. 235-238
11. В.Н. Глотова и др. Оптимизация газохроматографического разделения изомеров лактида // XVI Международная научно-практическая конференция имени профессора Л.П. Кулёва, стр. 254-255
| название | год | авторы | номер документа |
|---|---|---|---|
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ С УЛУЧШЕННОЙ СТАБИЛЬНОСТЬЮ | 2015 |
|
RU2728786C2 |
| ЭМУЛЬСИИ ДЛЯ МИКРОКАПСУЛИРОВАНИЯ, СОДЕРЖАЩИЕ БИОРАЗЛАГАЕМЫЕ ПОВЕРХНОСТНО-АКТИВНЫЕ БЛОК-СОПОЛИМЕРЫ В КАЧЕСТВЕ СТАБИЛИЗАТОРОВ | 2011 |
|
RU2617057C2 |
| РАСТВОР МОКСИФЛОКСАЦИНА ДЛЯ ИНЪЕКЦИЙ И СПОСОБ ЕГО ПОЛУЧЕНИЯ | 2006 |
|
RU2314103C1 |
| ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ХИМИОТЕРАПИИ ОНКОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ И СПОСОБ ЕЕ ПОЛУЧЕНИЯ | 2016 |
|
RU2617511C1 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ НАНОЧАСТИЦ НИЗКОСИАЛИРОВАННОГО ЭРИТРОПОЭТИНА С ВЫСОКОЙ СТЕПЕНЬЮ СОРБЦИИ ДЛЯ ЛЕЧЕНИЯ НЕВРОЛОГИЧЕСКИХ ЗАБОЛЕВАНИЙ | 2014 |
|
RU2616258C2 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 2,4-ДИХЛОРФЕНОКСИУКСУСНОЙ КИСЛОТЫ В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2011 |
|
RU2453848C1 |
| СПОСОБ ПОЛУЧЕНИЯ БИОРАЗЛАГАЕМОГО КОМПОЗИТА НА ОСНОВЕ АЛИФАТИЧЕСКИХ СЛОЖНЫХ ПОЛИЭФИРОВ И ГИДРОКСИАПАТИТА | 2016 |
|
RU2664432C1 |
| СПОСОБ ОПРЕДЕЛЕНИЯ 2,6-ДИМЕТИЛГИДРОКСИБЕНЗОЛА В БИОЛОГИЧЕСКОМ МАТЕРИАЛЕ | 2024 |
|
RU2832324C1 |
| ИНЪЕКЦИОННЫЕ КОМПОЗИЦИИ МИКРОЧАСТИЦ НАЛТРЕКСОНА ДЛИТЕЛЬНОГО ДЕЙСТВИЯ | 2019 |
|
RU2817016C2 |
| СПОСОБ ПОЛУЧЕНИЯ ПОЛИМЕРНЫХ ПРОТИВООПУХОЛЕВЫХ ЧАСТИЦ В ПРОТОЧНОМ МИКРОРЕАКТОРЕ И ЛИОФИЛИЗАТА НА ИХ ОСНОВЕ | 2018 |
|
RU2681933C1 |
Изобретение относится к аналитической химии, а именно к способам количественного определения токсичных компонентов в имплантатах на основе полилактид-гликолида (PLGA) методом газовой хроматографии. Способ одновременного определения в одной пробе количественного определения токсичных компонентов (ацетона, этилацетата, лактида) в имплантатах из PLGA, в том числе скаффолдах для культивирования клеток на основе полилактид-гликолида PLGA и фосфатов кальция ФК (гидроксиапатита Ca10(PO4)6(OH)2 и β-трикальций фосфата Са3(РО4)2), методом газовой хроматографии на капиллярной колонке на основе 100% полиэтиленгликоля включает фильтрацию раствора образца скаффолда в хлороформе с использованием шприцевого фильтра с размером пор 0,45 мкм, хроматографирование полученного раствора с использованием пламенно-ионизационного детектора с температурой испарителя и детектора 250°С и температурным режимом колонки: плато 80°С – 2 мин, нагрев 10°С/мин до 170°С – плато 1 мин, нагрев 20°С/мин до 220°С – плато 17,5 мин; давлением газа-носителя (азота) 40 кПа, делением потока 1:20, в испаритель микрошприцем вводят 0,5 мкл полученного раствора, строят градуировочные зависимости для ацетона (в диапазоне 8·10-4–0,2%), лактида (в диапазоне 6·10-3–0,25%), этилацетата (в диапазоне 1·10–4–0,075%), по которым рассчитывают содержание токсичных компонентов в пробе. Техническим результатом является возможность одновременного в одной пробе количественного определения ацетона, этилацетата, лактида в имплатнатах и скаффолдах. 3 ил., 6 табл.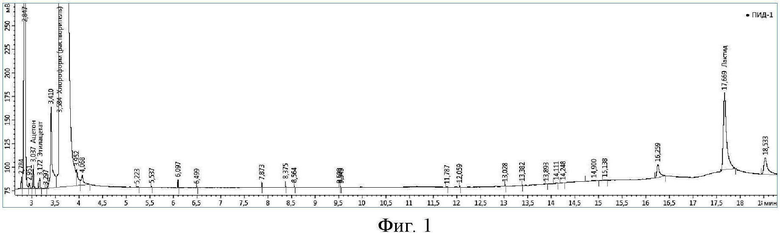
Способ одновременного определения в одной пробе количественного определения токсичных компонентов (ацетона, этилацетата, лактида) в имплантатах из PLGA, в том числе скаффолдах для культивирования клеток на основе полилактид-гликолида PLGA и фосфатов кальция ФК (гидроксиапатита Ca10(PO4)6(OH)2 и β-трикальций фосфата Са3(РО4)2), методом газовой хроматографии на капиллярной колонке на основе 100% полиэтиленгликоля, отличающийся тем, что раствор образца скаффолда в хлороформе фильтруют с использованием шприцевого фильтра с размером пор 0,45 мкм, полученный раствор хроматографируют, используя пламенно-ионизационный детектор, задавая температуру испарителя и детектора 250°С и температурный режим колонки: плато 80°С - 2 мин, нагрев 10°С/мин до 170°С - плато 1 мин, нагрев 20°С/мин до 220°С - плато 17,5 мин; задают давление газа-носителя (азота) 40 кПа, деление потока 1:20, вводят 0,5 мкл полученного раствора в испаритель микрошприцем, строят градуировочные зависимости для ацетона (в диапазоне 8·10-4-0,2%), лактида (в диапазоне 6·10-3-0,25%), этилацетата (в диапазоне 1·10–4-0,075%), по которым рассчитывают содержание токсичных компонентов в пробе.
| Опускной разборный снаряд для подводного наращивания свай | 1924 |
|
SU2313A1 |
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
| XIV, 31.10.2018 | |||
| Печь для непрерывного получения сернистого натрия | 1921 |
|
SU1A1 |
Авторы
Даты
2020-03-17—Публикация
2019-09-27—Подача