Перекрестная ссылка на родственную заявку
[0001] Настоящая заявка испрашивает приоритет из предварительной патентной заявки США № 62/800187, поданной 1 февраля 2019 г, раскрытие которой включено в настоящую заявку посредством ссылки во всей полноте.
Перечень последовательностей
[0002] Настоящая заявка содержит Перечень последовательностей, который представлен в электронном виде в ASCII формате и включен в настоящую заявку посредством ссылки во всей полноте. Электронная копия Перечня последовательностей, созданная 29 января 2020 г, имеет название 024651_WO003_SL.txt и размер 9833 байт.
Предпосылки создания изобретения
[0003] Гематологические злокачественные заболевания включают заболевания, являющиеся результатом трансформационных событий, происходящих в иммунных или гематопоэтических органах. Лимфоидные злокачественные заболевания возникают в результате аккумуляции моноклональных неопластических лимфоцитов в лимфоузлах и органах, таких как кровь, костный мозг, селезенка и печень. Варианты таких раковых заболеваний включают неходжкинские лимфомы (NHLs), включая хронический лимфоцитарный лейкоз (CLL), мелкоклеточную лимфоцитарную лимфому (SLL), мантийноклеточную лимфому (MCL), фолликулярную лимфому (FL), лимфому маргинальной зоны (MZL), диффузную крупноклеточную B-клеточную лимфому (DLBCL), лимфому с трансформацией Рихтера (RTL), лимфому Беркитта (BL), лимфоплазмацитоидную лимфому (LPL), макроглобулинемию Вальденстрема (WM), острый лимфоцитарный лейкоз (ALL) и некоторые типы T-клеточных лимфом. Острый миелоидный лейкоз (AML) является результатом аккумуляции неопластических миелоидных бластов в костном мозге, крови, центральной нервной системе и других органах.
[0004] Частично в зависимости от клетки происхождения (В-клетка или Т-клетка) пациенты с NHL могут испытывать инвалидизирующие конституциональные симптомы, лимфаденопатию и органомегалию, которые могут вызывать опасную для жизни дисфункцию органов, миелосупрессию и иммунодефицит, что может привести к восприимчивости к инфекции и кровотечению, и/или кожные проявления, которые могут быть болезненными, сильно зудящими и обезображивающими. У пациентов с LPL/WM наблюдается чрезмерная продукция плазматических клеток, продуцирующих иммуноглобулин (Ig), и у них может развиться повышенная вязкость плазмы из-за присутствия этого циркулирующего моноклонального белка IgM (M-белка). Что касается пациентов с ALL или AML, нарушение нормальной функции костного мозга из-за увеличения клона лейкозных бластов делает их предрасположенными к опасным для жизни инфекциям и кровотечениям.
[0005] Лечение этих заболеваний предназначено для индукции регрессии опухоли, задержки прогрессирования опухоли, контроля связанных с заболеванием осложнений и продления жизни. Пациентам обычно назначают химиотерапевтические и/или иммунотерапевтические средства. Терапии первой линии могут обеспечить стойкую ремиссию. Однако у многих пациентов в конечном итоге возникает рецидив заболевания; дальнейшие последовательные терапии используются, чтобы попытаться контролировать проявления заболевания. Несмотря на использование средств с различными механизмами действия, часто развивается прогрессирующая резистентность опухоли. Пациенты с множественным рецидивом прогрессирующего заболевания имеют плохой прогноз и, вероятно, умрут от рака. Таким образом, необходимы новые механизмы действия, чтобы безопасно предлагать новые варианты лечения пациентов с гематологическим раком, которые стали устойчивыми к существующим терапиям.
[0005] Подобный рецепторной тирозинкиназе орфанный рецептор 1 (ROR1) представляет собой белок клеточной поверхности, который опосредует сигналы от своего лиганда, секретируемого гликопротеина Wnt5a. В соответствии с его ролью во влиянии на судьбу стволовых клеток во время эмбриогенеза, экспрессия ROR1 наблюдается при инвазивных злокачественных новообразованиях, которые возвращаются к эмбриональной программе транскрипции, но не наблюдается в нормальных тканях взрослых. Таким образом, ROR1 предлагает благоприятный профиль селективности в качестве терапевтической мишени. ROR1 обычно экспрессируется на злокачественных клетках пациентов с гематологическими злокачественными заболеваниями, а также присутствует на поверхности клеток множественных солидных опухолей, где он, по-видимому, является маркером раковых стволовых клеток.
[0007] Ввиду высоких неудовлетворенных медицинских потребностей у многих пациентов с гематологическими и другими злокачественными заболеваниями и роли ROR1 в развитии рака, существует потребность в новых терапиях, которые могут улучшить результаты для пациентов, включая пациентов, которые не отвечают на существующие терапии, путем таргетирования ROR1.
Сущность изобретения
[0008] Настоящее изобретение относится к способу лечения страдающего раком пациента с использованием иммуноконъюгата, имеющего структуру, показанную ниже:
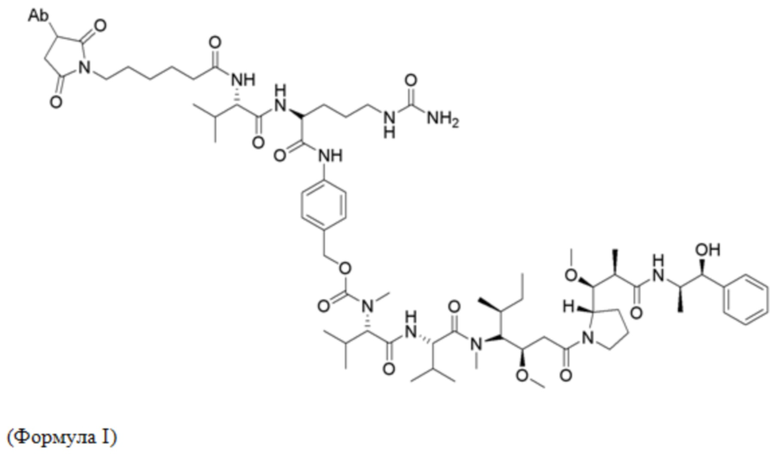
где Ab представляет собой антитело, которое специфически связывается с человеческим подобным рецепторной тиозинкиназе орфанным рецептором 1 (ROR1), где тяжелая цепь и легкая цепь антитела включают аминокислотные последовательности SEQ ID NO: 1 и 2, соответственно; и где иммуноконъюгат вводят пациенту при дозе от 0,25 до 4,00 мг/кг. Как используется в настоящей заявке, Формула I выше не предполагает, что каждое Ab может быть конъюгировано только с одной копией лекарственного компонента, показанного в формуле. В некоторых вариантах осуществления количество или копия лекарственного компонента на антитело (DAR) находится в пределах от 1 до 7, где каждый лекарственный компонент конъюгирован с антителом через линкер, как показано в формуле I.
[0009] В некоторых вариантах осуществления иммуноконъюгат вводят (например, внутривенно) в соответствии со схемой введения, описанной в настоящей заявке. Иммуноконъюгат можно вводить, например, при дозе 0,50, 0,75, 1,00, 1,25, 1,50, 1,75, 2,00, 2,25, 2,50, 2,75 или 3,00 мг/кг. В некоторых вариантах осуществления иммуноконъюгат можно вводить повторяющимися трехнедельными циклами (например, в День 1 или Дни 1 и 8 каждого цикла). В некоторых вариантах осуществления иммуноконъюгат можно вводить повторяющимися четырехнедельными циклами (например, в Дни 1, 8 и 15 каждого цикла). В некоторых вариантах осуществления количество циклов может составлять 3, 6 или больше. В конкретных вариантах осуществления иммуноконъюгат можно вводить: раз в неделю в течение первых трех, четырех, шести или восьми недель, а затем раз в три недели; или раз в три недели в течение первых трех, шести или девяти недель, а затем раз в неделю.
[0010] В некоторых вариантах осуществления иммуноконъюгат вводят пациенту с гематологическим раком, таким как лимфоидное злокачественное заболевание. В некоторых вариантах осуществления рак выбран из группы, состоящей из CLL, SLL, MCL, FL, MZL, DLBCL, RTL, BL, LPL, WM, T-клеточного NHL, ALL и AML. В конкретных вариантах осуществления пациент ранее лечился от рака и/или имеет рак, который является рецидивирующим или рефрактерным к лечению (например, к одному или более существующих лечений рака, например ко всем существующим лечениям).
[0011] В некоторых вариантах осуществления лечение иммуноконъюгатом индуцирует регрессию опухоли (например, приводит к полной эрадикации опухоли); задерживает прогрессирование опухоли; ингибирует метастазирование рака; предотвращает рецидив рака или остаточное заболевание; уменьшает размер нодальных или экстранодальных опухолевых масс; уменьшает количество злокачественных клеток в костном мозге и периферической крови; уменьшает злокачественную спленомегалию или гепатомегалию; улучшает связанную с раком анемию, нейтропению или тромбоцитопению; улучшает кожные проявления, уменьшает вероятность синдрома гипервязкости у пациентов с LPL/WM; уменьшает инвалидизирующие конституциональные симптомы и/или продлевает выживание.
[0012] Настоящее раскрытие также обеспечивает иммуноконъюгат для применения в лечении рака у пациента в способе, описанном в настоящей заявке. Кроме того, настоящее раскрытие обеспечивает применение иммуноконъюгата для получения лекарственного средства для лечения рака у пациента в способе, описанном в настоящей заявке.
Краткое описание чертежей
[0013] Фиг. 1 представляет график, показывающий кривые зависимости концентрации в плазме от времени, подтверждающий общую экспозицию в плазме ADC-A (сплошная линия) и MMAE (пунктирная линия). C: Цикл. D: День. LLQ: Нижний предел количественного определения.
[0014] Фиг. 2 представляет ряд графиков, демонстрирующих связывание ADC-A с ROR1 на циркулирующих лейкозных клетках (верхние панели) и концентрации ADC-A и MMAE в плазме (нижние панели) в динамике по времени у двух субъектов с CLL. Субъект 1: слева. Субъект 2: справа.
[0015] Фиг. 3 представляет график, показывающий корреляцию незанятых ROR1 рецепторов с концентрацией ADC-A в плазме.
[0016] Фиг. 4 представляет график, показывающий фармакокинетические имитации концентраций ADC-A в плазме в зависимости от времени с использованием схем введения Q1/3W, Q2/3W и Q3/4W.
[0017] Фиг. 5 представляет график, показывающий лучшее изменение размеров опухоли при введении начальной дозы ADC-A. TE: слишком рано для оценки. PR: частичный ответ.
Подробное описание изобретения
[0018] Настоящее изобретение обеспечивает схемы лечения с использованием иммуноконъюгата ROR1. Эти схемы лечения можно использовать для лечения различных типов рака, таких как те, которые, как ожидается, экспрессируют ROR1.
1. Иммуноконъюгаты
[0019] “Конъюгат антитело-лекарственное средство”, или “ADC”, или “иммуноконъюгат”, относится к молекуле антитела или ее антиген-связывающему фрагменту, которые ковалентно или нековалентно связаны, с линкером или без линкера, с одной или несколькими биологически активными молекулами. Иммуноконъюгаты по настоящему изобретению включают антитела или их фрагменты, которые являются специфическими для человеческого ROR1 и, таким образом, могут служить в качестве превосходных таргетирующих компонентов для доставки конъюгированных полезных нагрузок в клетки (например, RORl-положительные клетки). В некоторых вариантах осуществления иммуноконъюгат, используемый в схеме лечения по изобретению, представляет собой иммуноконъюгат, описанный в WO 2018/237335.
[0020] Ниже показаны SEQ ID NOs для аминокислотных последовательностей определяющих комплементарность областей тяжелой и легкой цепей (HCDR и LCDR), вариабельных доменов тяжелой и легкой цепей (VH и VL), а также тяжелой и легкой цепей (HC и LC) иллюстративного антитела к ROR1, используемого в иммуноконъюгатах, описанных в настоящей заявке:
[0021] В некоторых вариантах осуществления антитело или фрагмент антитела в иммуноконъюгате специфически связывается с человеческим ROR1, и его тяжелая и легкая цепи соответственно включают:
a) аминокислотные последовательности HCDR1-3 в SEQ ID NO: 1 и аминокислотные последовательности LCDR1-3 в SEQ ID NO: 2;
b) HCDR1-3, включающие аминокислотные последовательности SEQ ID NO: 5-7, соответственно, и LCDR1-3, включающие аминокислотные последовательности SEQ ID NO: 8-10, соответственно;
c) HCDR1-3, включающие остатки 26-33, 51-58 и 97-105 SEQ ID NO: 3, соответственно, и LCDR1-3, включающие остатки 27-32, 50-52 и 89-97 SEQ ID NO: 4, соответственно;
d) HCDR1-3, включающие остатки 26-32, 52-57 и 99-105 SEQ ID NO: 3, соответственно, и LCDR1-3, включающие остатки 24-34, 50-56 и 89-97 SEQ ID NO: 4, соответственно; или
e) HCDR1-3, включающие остатки 31-35, 50-66 и 99-105 SEQ ID NO: 3, соответственно, и LCDR1-3, включающие остатки 24-34, 50-56 и 89-97 SEQ ID NO: 4, соответственно.
[0022] В некоторых вариантах осуществления иммуноконъюгата, описанного в настоящей заявке, антитело может быть конъюгировано с цитотоксическим средством через линкер. В некоторых вариантах осуществления линкер представляет собой расщепляемый линкер. Расщепляемый линкер относится к линкеру, который включает расщепляемую группу и типично подвержен расщеплению в условиях in vivo. В иллюстративных вариантах осуществления линкер может включать дипептид, такой как валин-цитруллиновый (val-cit или VC) линкер. В некоторых вариантах осуществления линкер присоединен к цистеиновому остатку на антителе.
[0023] В некоторых вариантах осуществления конъюгацию линкера/полезной нагрузки с антителом или фрагментом можно осуществить путем взаимодействия с малеимидной группой (которая также может называться малеимидным спейсером). В некоторых вариантах осуществления малеимидная группа представляет собой малеимидокапроил (mс); таким образом, линкер/полезную нагрузку конъюгируют с антителом или фрагментом путем взаимодействия между остатком на антителе или фрагменте и mс группой в предшественнике линкера.
[0024] В некоторых вариантах осуществления линкер может включать бензойную кислоту или бензилокси-группу или их производное. В некоторых вариантах осуществления линкер включает пара-аминобензилоксикарбонильную (PAB) группу.
[0025] В некоторых вариантах осуществления связь между Аb и полезной нагрузкой, или лекарственным средством (D), являющимися компонентами иммуноконъюгата, может образовываться в результате взаимодействия этих компонентов с линкером, содержащим малеимидную группу, пептидную группу и/или группу бензойной кислоты (например, PAB), в любой комбинации. В некоторых вариантах осуществления малеимидная группа представляет собой малеимидокапроил (mс). В некоторых вариантах осуществления пептидная группа представляет собой Val-Cit (VC). В некоторых вариантах осуществления линкер включает группу Val-Cit-PAB. В некоторых вариантах осуществления конъюгация линкера с антителом или фрагментом может быть образована из группы mc-Val-Cit. В некоторых вариантах осуществления связь между антителом или фрагментом и лекарственным компонентом может быть образована из группы mc-Val-Cit-PAB.
[0026] Линкеры могут быть конъюгированы с анти-RORl-антителами и антиген-связывающими фрагментами по настоящему изобретению различными способами. Как правило, линкер и цитотоксический компонент синтезируют и конъюгируют перед присоединением к антителу. Один из способов присоединения конъюгата линкер-лекарственное средство к антителу включает восстановление дисульфидов, подверженных воздействию растворителя, с использованием дитиотреитола (DTT) или трис(2-карбоксиэтил)фосфина (TCEP) с последующей модификацией полученных тиолов малеимид-содержащими фрагментами линкер-лекарственное средство (например, 6-малеимидокапроил-валин-цитруллин-п-аминобензилоксикарбонил (mc-VC-PAB)). Нативное антитело содержит 4 межцепочечные дисульфидные связи и 12 внутрицепочечных дисульфидных связей, а также неспаренные цистеины. Таким образом, модифицированные таким способом антитела могут включать более одного фрагмента линкер-лекарственное средство на одно антитело. В некоторых вариантах осуществления каждый из иммуноконъюгатов включает по меньшей мере 1, 2, 3, 4, 5, 6, 7, 8, 9 или 10 фрагментов линкер-лекарственное средство. В некоторых вариантах осуществления каждый из иммуноконъюгатов включает один или несколько (например, 1-10, 1-9, 1-8, 1-7, 1-6, 1-5, 1-4, 1-3 или 1-2) фрагментов линкер-лекарственное средство. В тех случаях, когда линкер разветвлен и каждый может связываться с несколькими лекарственными компонентами, отношение лекарственного компонента к антителу будет выше, чем при использовании неразветвленного линкера.
[0027] В некоторых вариантах осуществления подходящим цитотоксическим средством для использования в иммуноконъюгате, описанном в настоящей заявке, может быть, например, анти-тубулиновое средство, такое как ауристатин. В некоторых вариантах осуществления цитотоксическое средство представляет собой монометилауристатин Е (MMAE).
[0028] В некоторых вариантах осуществления иммуноконъюгат, описанный в настоящей заявке, сконструирован следующим образом:
Анти-ROR1 антитело может представлять собой анти-ROR1 антитело, описанное в настоящей заявке, например, антитело с аминокислотной последовательностью тяжелой цепи SEQ ID NO: 1 и аминокислотной последовательностью легкой цепи SEQ ID NO: 2.
[0029] В конкретных вариантах осуществления иммуноконъюгат, используемый в схемах лечения по изобретению, имеет следующую структуру (I):
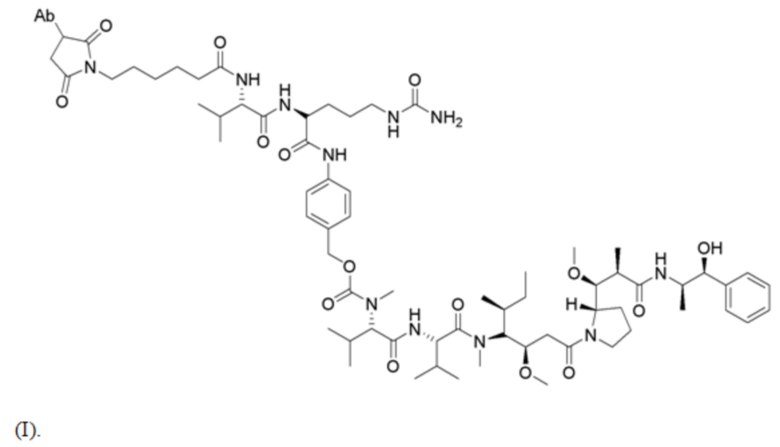
В некоторых вариантах осуществления антитело представляет собой Ab1, которое имеет аминокислотную последовательность тяжелой цепи SEQ ID NO: 1 и аминокислотную последовательность легкой цепи SEQ ID NO: 2 (Ab1); этот иммуноконъюгат может иметь DAR 3-6 и указан в настоящей заявке как “ADC-A.” См. также WO 2018/237335. Полезная нагрузка конъюгирована с Ab1 через цистеиновый остаток (остатки) в полипептидных цепях антитела.
2. Схемы лечения
[0030] В некоторых вариантах осуществления иммуноконъюгат ROR1, описанный в настоящей заявке (например, ADC-A), вводят при дозе от 0,25 до 10 мг/кг, например, 0,25-4 мг/кг. Например, иммуноконъюгат можно вводить при дозе 0,25 0,5, 0,75, 1, 1,25, 1,5, 1,75, 2, 2,25, 2,5, 2,75, 3, 3,25, 3,5, 3,75, 4, 4,25, 4,5, 4,75, 5, 5,5, 6, 6,5, 7, 8, 9 или 10 мг/кг, или с использованием любой их комбинации для нескольких доз. В некоторых вариантах осуществления иммуноконъюгат вводят при дозе 0,50, 0,75, 1,00, 1,25, 1,50, 1,75, 2,00, 2,25, 2,50, 2,75 или 3,00 мг/кг.
[0031] В некоторых вариантах осуществления иммуноконъюгат вводят повторяющимися циклами 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15 или 16 недель. В некоторых вариантах осуществления иммуноконъюгат вводят трехнедельными циклами. В некоторых вариантах осуществления иммуноконъюгат вводят четырехнедельными циклами. Схема лечения может включать 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20 или больше циклов введения (например, 3 или больше циклов, или 4 или больше циклов). В некоторых вариантах осуществления иммуноконъюгат вводят в один, два, три, четыре, пять, шесть или семь дней цикла. Дни введения могут быть последовательными, или между ними может быть один, два, три, четыре, пять или шесть дней, одна неделя, две недели, три недели или четыре недели, или любая комбинация вышеуказанных. В конкретных вариантах осуществления иммуноконъюгат вводят только в День 1 каждого цикла (например, трехнедельного цикла). В конкретных вариантах осуществления иммуноконъюгат вводят в Дни 1 и 8 каждого цикла (например, трехнедельного цикл). В конкретных вариантах осуществления иммуноконъюгат вводят в Дни 1, 8 и 15 каждого цикла (например, a четырехнедельного цикла).
[0032] Иммуноконъюгат можно вводить изначально в соответствии со схемой введения, описанной в настоящей заявке, а затем в соответствии с другой схемой введения, описанной в настоящей заявке (например, для увеличения или уменьшения частоты введения). В некоторых вариантах осуществления иммуноконъюгат вводят раз в неделю в течение первых 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11 или 12 недель, затем один раз в 3 недели. В некоторых вариантах осуществления иммуноконъюгат вводят раз в неделю в течение первых 2, 3, 4, 5 или 6 недель, а затем один раз в 3 недели. В некоторых вариантах осуществления иммуноконъюгат вводят раз в неделю в течение первых 1, 2, 3, 4, 5 или 6 недель, а затем один раз в 4 недели. Иммуноконъюгат можно вводить, например:
- раз в неделю в течение первых трех недель, а затем раз в три недели;
- раз в неделю в течение первых четырех недель, а затем раз в три недели;
- раз в неделю в течение первых шести недель, а затем раз в три недели;
- раз в неделю в течение первых восьми недель, а затем раз в три недели;
- раз в три недели в течение первых трех недель, а затем раз в неделю;
- раз в три недели в течение первых шести недель, а затем раз в неделю; или
- раз в три недели в течение первых девяти недель, а затем раз в неделю.
[0033] В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, достигает у пациента Cmax иммуноконъюгата в плазме по меньшей мере 10, 15, 20, 25, 30, 35, 40, 45, 50, 55 или 60 мкг/мл. В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, достигает у пациента значения площади под кривой концентрации иммуноконъюгата в плазме в зависимости от времени (AUC) по меньшей мере 500, 750, 1000, 1250, 1500, 1750, 2000, 2250, 2500, 2750, 3000, 3250 или 3500 час⋅мкг/мл.
[0034] В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, поддерживает по меньшей мере 30%, 40%, 50%, 60%, 70%, 75%, 80%, 85%, 90% или 95% занятости ROR1 рецептора иммуноконъюгатом у пациента. В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, поддерживает по меньшей мере 50% занятости ROR1 рецептора иммуноконъюгатом в течение по меньшей мере 20, 30, 40, 50, 60, 70, 80 или 90% времени. В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, поддерживает по меньшей мере 75% занятости ROR1 рецептора иммуноконъюгатом в течение по меньшей мере 20, 30, 40, 50, 60, 70, 80 или 90% времени. В некоторых вариантах осуществления схема введения, описанная в настоящей заявке, поддерживает по меньшей мере 90% занятости ROR1 рецептора иммуноконъюгатом в течение по меньшей мере 0,5, 1, 1,5, 2, 2,5, 3, 3,5, 4, 4,5 или 5% времени.
[0035] Иммуноконъюгат можно вводить парентеральным путем введения. Как используется в настоящей заявке, “парентеральное введение” иммуноконъюгата включает любой путь введения, характеризующийся физическим разрывом ткани субъекта и введением иммуноконъюгата через разрыв в ткани, что обычно приводит к прямому введению в кровоток, в мышцы или во внутренние органы. Парентеральное введение, таким образом, включает, но не ограничивается этим, введение иммуноконъюгата путем инъекции иммуноконъюгата, путем введения иммуноконъюгата через хирургический разрез, путем введения иммуноконъюгата через проникающую в ткань нехирургическую рану и т.п. В частности, предполагается, что парентеральное введение включает, но не ограничивается этим, подкожное, интраперитонеальное, внутримышечное, интрастернальное, внутривенное, интраартериальное, интратекальное, интравентрикулярное, интрауретральное, интракраниальное, интратуморальное и интрасиновиальное введение путем инъекции или инфузии; а также методы почечной диализной инфузии. Предполагается также регионарная перфузия. В некоторых вариантах осуществления инфузию можно вводить одним путем (например, внутривенно) для начальных доз, а затем вводить другим путем для последующих доз.
[0036] В некоторых вариантах осуществления иммуноконъюгат вводят путем внутривенной (в/в) инфузии. В/в инфузию можно вводить в течение от около 0,1 до около 4 часов (например, около 5, 10, 15, 20, 25, 30, 35, 40, 45, 50, 55, 60, 65, 70, 75, 80, 85, 90, 120 или 180). В конкретных вариантах осуществления время инфузии составляет 30 минут. Время инфузии может быть увеличено по мере необходимости с учетом индивидуальной переносимости лечения пациентом. Если иммуноконъюгат вводят более чем в одной дозе, то в некоторых вариантах осуществления время инфузии для первой дозы больше, чем время инфузии для последующих доз, или, альтернативно, время инфузии для первой дозы меньше, чем время инфузии для последующих доз.
[0037] В некоторых вариантах осуществления иммуноконъюгат вводят в виде монотерапии.
[0038] Должно быть понятно, что схемы лечения по изобретению могут включать способы лечения, описанные в настоящей заявке, иммуноконъюгат, описанный в настоящей заявке, для применения в схеме лечения, описанной в настоящей заявке, или применение иммуноконъюгата, описанного в настоящей заявке, для получения лекарственного средства для применения в схеме лечения, описанной в настоящей заявке.
3. Выбор пациента
[0039] Схемы лечения по изобретению можно использовать для лечения больного раком. В некоторых вариантах осуществления схема лечения по изобретению включает стадию выбора пациента с описанным ниже раком. В некоторых вариантах осуществления пациент мог ранее лечиться от этого рака и/или иметь рак, который рецидивирует или является рефрактерным к одному или более (или всем) существующим лечениям этого рака.
[0040] "Лечить”, “осуществлять лечение” и “лечение” относятся к способу облегчения или устранения биологического расстройства и/или по меньшей мере одного из сопутствующих ему симптомов. Как используется в настоящей заявке, “облегчение” заболевания, расстройства или состояния означает уменьшение тяжести и/или частоты возникновения симптомов заболевания, расстройства или состояния. Кроме того, ссылки в настоящей заявке на “лечение” включают ссылки на лечебное, паллиативное и профилактическое лечение. Лечение рака включает ингибирование роста рака (включая частичную или полную регрессию рака), ингибирование прогрессирования рака или метастазирования, предотвращение рецидива рака или остаточного заболевания и/или продление выживаемости пациента.
[0041] В некоторых вариантах осуществления пациент, подлежащий лечению по схеме лечения по изобретению, имеет рак, экспрессирующий ROR1. Рак, экспрессирующий ROR1, может быть определен любым подходящим методом определения экспрессии гена или белка, например гистологией, проточной цитометрией, радиофармацевтическими методами, ОТ-ПЦР или РНК-Seq. Раковые клетки, используемые для определения, могут быть получены путем биопсии опухоли или путем сбора циркулирующих опухолевых клеток. В некоторых вариантах осуществления, если используют анализ на основе антител, такой как проточная цитометрия или иммуногистохимия, ROR1-экспрессирующий рак представляет собой любой рак с клетками, которые показывают реактивность анти-RORl антитела, бóльшую, чем у изотипического контрольного антитела. В некоторых вариантах осуществления, если используют анализ на основе РНК, ROR1-экспрессирующий рак представляет собой такой, который показывает повышенный уровень РНК ROR1 по сравнению с отрицательной контрольной клеткой или раком, который не экспрессирует ROR1.
[0042] В некоторых вариантах осуществления пациент имеет гематологическое злокачественное заболевание, такое как лимфоидное злокачественное заболевание. В некоторых вариантах осуществления пациент имеет солидную опухоль. Пациент может иметь рак, выбранный из, например, лимфомы, неходжкинской лимфомы, хронического лимфоцитарного лейкоза (CLL), мелкоклеточной лимфоцитарной лимфомы (SLL), лимфомы маргинальной зоны (MZL), маргинальноклеточной В-клеточной лимфомы, лимфомы Беркитта (BL), мантийноклеточной лимфомы (MCL), фолликулярной лимфомы (FL), диффузной крупноклеточной B-клеточной лимфомы (DLBCL), неходжкинской лимфомы с трансформацией Рихтера (RTL), Т-клеточного лейкоза, Т-клеточной лимфомы (например, Т-клеточной неходжкинской лимфомы), лимфоплазмацитоидной лимфомы (LPL), макроглобулинемии Вальденстрема (WM), острого миелоидного лейкоза (AML), острого лимфоцитарного лейкоза (ALL), волосистоклеточного лейкоза (HCL), миеломы, множественной миеломы (MM), саркомы (например, остеосаркомы, саркомы Юинга, рабдомиосаркомы, саркомы мягких тканей или саркомы матки), рака головного мозга, глиобластомы, астроцитомы, медуллобластомы, краниофарингиомы, эпендимомы, нейробластомы, рака головы и шеи, рака носоглотки, рака щитовидной железы, рака молочной железы (например, ER/PR-положительного рака молочной железы, HER2-положительного рака молочной железы или тройного отрицательного рака молочной железы), рака легких (например, немелкоклеточного рака легких или мелкоклеточного рака легких), злокачественной мезотелиомы, рака желчного протока/желчного пузыря (например, холангиокарциномы), рака толстой кишки, колоректального рака, рака пищевода, рака желудка, гастрального рака, стромальных опухолей желудочно-кишечного тракта (GIST), рака печени (гепатоцеллюлярного рака), рака поджелудочной железы, почечно-клеточного рака, рака мочевого пузыря, рака предстательной железы, рака шейки матки, рака эндометрия, рака яичников, тестикульрного рака, эпителиального плоскоклеточного рака, меланомы, адренокортикальной карциномы, карциноидных опухолей желудочно-кишечного тракта, островково-клеточных опухолей, нейроэндокринных опухолей поджелудочной железы, нейроэндокринной карциномы кожи (карцинома из клеток Меркеля) и феохромоцитомы. В некоторых вариантах осуществления пациент имеет рак, рефрактерный к другим терапевтическим средствам (например, тройной отрицательный рак молочной железы).
[0043] В конкретных вариантах осуществления пациент имеет рак, выбранный из CLL/SLL, MCL, FL, MZL, DLBCL, RTL, BL, LPL/WM, T-клеточного NHL, ALL и AML. В некоторых вариантах осуществления пациент мог ранее лечиться от указанного рака и/или имеет рак, который является рецидивирующим или рефрактерным к одному или более (например, ко всем) существующим лечениям указанного рака.
[0044] В некоторых вариантах осуществления пациент резистентен к лечению или имел рецидив при лечении ибрутинибом, акалабрутинибом, аутологичной трансплантацией гемопоэтических стволовых клеток, бендамустином, бортезомибом, брентуксимабом ведотином, кармустином, Т-клетками, несущими химерный антигенный рецептор (CAR-T), цисплатином, копанлизибом, циклофосфамидом, цитарабином, даратумумабом, дексаметазоном, доксорубицином, этопозидом, гемцитабином, иделализибом, леналидомидом, мелфаланом, метотрексатом, метилпреднизолоном, мосунетузумабом, обинутузумабом, офатумумабом, оксалиплатином, пинатузумабом, полатузумабом, ритуксимабом, преднизоном, лучевой терапией, венетоклаксом, винкристином или любой комбинацией вышеуказанных (например, любой комбинацией предшествующих средств лечения, указанных в Примерах).
[0044] В некоторых вариантах осуществления схему лечения применяют для пациента-человека, например взрослого пациента (≥18 лет), подросткового пациента (≥12-17 лет) или педиатрического пациента (<18 лет) с адекватным функциональным статусом и функцией органов, который (i) имеет гистологически подтвержденное прогрессирующее гематологическое злокачественное заболевание или солидную опухоль; и/или (ii) имеет злокачественное заболевание, которое вряд ли будет отвечать на общепризнанные терапии, известные как обеспечивающие клиническую пользу, или у которого развилась непереносимость общепризнанных терапий, известных как обеспечивающие клиническую пользу. В некоторых вариантах пациент удовлетворяет обоим критериям.
4. Результаты Лечения
[0045] В некоторых вариантах осуществления лечение иммуноконъюгатом приводит к одному или более из следующих результатов;
- индуцирует частичную или полную регрессию опухоли, которая в некоторых случаях может сохраняться и после конечной дозы лечения;
- замедляет прогрессирование опухоли (например, путем ингибирования роста опухоли);
- предотвращает рецидив рака или остаточное заболевание;
- уменьшает размер нодальных или экстранодальных опухолевых масс (которые могут быть болезненными, калечащими или компрессионными);
- уменьшает количество злокачественных клеток в костном мозге и периферической крови;
- уменьшает злокачественную спленомегалию или гепатомегалию;
- облегчает связанную с раком анемию, нейтропению или тромбоцитопению (при которых пациенты могут подвергаться риску усталости, инфекции или кровотечения соответственно);
- уменьшает кожные проявления (которые могут быть болезненными, сильно зудящими или калечащими);
- снижает вероятность развития синдрома гипервязкости у пациентов с LPL/ВМ;
- уменьшает инвалидизирующие конституциональные симптомы;
- продлевает выживание.
Лечение может привести к любой комбинации вышеперечисленных результатов.
[0046] В некоторых вариантах осуществления схема лечения по изобретению уменьшает размеры опухоли у пациента с уменьшением суммы произведений перпендикулярных диаметров (SPD) по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. В некоторых вариантах осуществления схема лечения по изобретению уменьшает размеры опухоли у пациента с уменьшением суммы самых длинных диаметров целевых поражений по меньшей мере на 10%, 20%, 30%, 40%, 50%, 60%, 70%, 80% или 90%. В некоторых вариантах осуществления схема лечения по изобретению полностью ликвидирует опухоль.
[0047] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения CLL и/или SLL) приводит к одному или более (например, любому одному, двум, трем, четырем, пяти, шести или семи) из следующего:
а) отсутствие признаков нового заболевания;
b) абсолютное число лимфоцитов (ALC) в периферической крови <4 × 109/л;
c) регрессия всех индексных нодальных масс до ≤15 мм в самом длинном диаметре (LD);
d) нормальный размер селезенки ≤120 мм, как определено методом визуализации в ее самом длинном вертикальном измерении (LVD) и нормальный размер печени ≤180 мм, как определено методом визуализации в ее LVD;
e) регрессия к норме (например, менее ≤15 мм) нодального неиндексного заболевания и исчезновение всех обнаруживаемых ненодальных неиндексных заболеваний;
f) морфологически отрицательный костный мозг, определенный как <30% ядросодержащих клеток, являющихся лимфоидными клетками, и отсутствие лимфоидных узлов в образце костного мозга, который является нормоцеллюлярным для возраста;
g) периферическая кровь, отвечающая всем следующим критериям:
i) абсолютное число нейтрофилов (ANC) >1,5 × 109/л без экзогенных факторов роста за ≤2 недели до соответствующей оценки форменных элементов крови;
ii) количество тромбоцитов >100 × 109/л без экзогенных факторов роста или трансфузий тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови; и
iii) гемоглобин >110 г/л (11,0 г/дл) без экзогенных факторов роста или трансфузий эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови.
В некоторых вариантах осуществления схема лечения приводит ко всем результатам a)-g) (“полный ответ”) и может также привести к количеству злокачественных клеток в аспирате костного мозга, по данным проточной цитометрии, ≤1 × 10-4 (“полный ответ без измеримого остаточного заболевания”). В некоторых вариантах осуществления схема лечения по изобретению приводит к одному или более из следующих результатов (“полный ответ с неполным восстановлением состава крови”):
а) а)-f), g)(ii) и g)(iii), а также абсолютное число нейтрофилов (ANC) ≤1,5 × 109/л, или требуются экзогенные факторы роста за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания ANC ≥1,5 × 109/л;
b) a)-f), g)(i) и g)(iii), и количество тромбоцитов ≤100 × 109/л, или требуются экзогенные факторы роста или трансфузии тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания количества тромбоцитов≥100 × 109/л; и
c) a)-f), g) (i) и g)(ii), и гемоглобин ≤110 г/л (11,0 г/дл), или требуются экзогенные факторы роста или трансфузии эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания гемоглобина ≥110 г/л (11,0 г/дл).
[0048] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения CLL/SLL) приводит к одному или более (например, любому одному, двум, трем или четырем) из следующих:
а) отсутствие признаков нового заболевания;
b) изменение статуса заболевания, отвечающее двум или более из следующих критериев, с тем исключением, что, если при скрининге присутствует только лимфаденопатия, то только лимфаденопатия должна улучшаться в степени, указанной ниже:
i) снижение абсолютного числа лимфоцитов (ALC) в периферической крови на ≥50% от скрининга;
ii) уменьшение на ≥50% от скрининга суммы произведений диаметров (SPD) индексных нодальных поражений;
iii) у субъекта с увеличением селезенки при скрининге - уменьшение на ≥50% от скрининга (минимальное уменьшение 20 мм) увеличения селезенки в ее самом длинном вертикальном размере (LVD) или до ≤120 мм, как определено методом визуализации;
iv) у субъекта с увеличением печени при скрининге - уменьшение на ≥50% от скрининга (минимальное уменьшение 20 мм) увеличения печени в ее LVD или до ≤180 мм, как определено методом визуализации; и
v) снижение на ≥50% от скрининга инфильтрата CLL/SLL в костном мозге или В-лимфоидных узлов;
c) отсутствие индексного, селезеночного, печеночного или неиндексного заболевания с ухудшением, которое отвечает критериям характерного прогрессирующего заболевания (PD); и
d) периферическая кровь, отвечающая одному или нескольким из следующих критериев:
i) абсолютное число нейтрофилов (ANC) >1,5 × 109/л или увеличение на ≥50% по сравнению со скринингом без экзогенных факторов роста за ≤2 недели до соответствующей оценки форменных элементов крови;
ii) количество тромбоцитов >100 × 109/л или увеличение на ≥50% по сравнению со скринингом без экзогенных факторов роста или трансфузий тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови; и
iii) гемоглобин >110 г/л (11,0 г/дл) или увеличение на ≥50% по сравнению со скринингом без экзогенных факторв роста или трансфузий эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови.
В некоторых вариантах осуществления схема лечения приводит ко всем а)-d) (“частичный ответ"). В некоторых вариантах осуществления схема лечения приводит ко всем а), b)ii)- b)v), c) и d) (“частичный ответ с лимфоцитозом”).
[0049] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения CLL/SLL) приводит к одному или обоим из следующих результатов:
а) отсутствие признаков нового заболевания; и
b) отсутствие признаков роста опухоли.
В некоторых вариантах схема лечения приводит к обоим а) и b) (“стабильное заболевание”).
[0050] в некоторых вариантах осуществления схема лечения по изобретению (например, для лечения CLL/SLL) не приводит ни к одному из следующих (которые являются признаками “прогрессирующего заболевания”):
а) наличие признаков какого-либо нового заболевания, определяемого одним или более из следующих:
i) новый узел размером >15 мм в любом диаметре;
ii) LVD селезенки >140 мм согласно визуализации у пациентов с нормальным LVD селезенки ≤120 мм согласно визуализации при надире;
iii) LVD печени >200 мм согласно визуализации у субъектов с нормальным LVD печени ≤180 мм согласно визуализации при надире;
iv) гистологически подтвержденные новые выпоты, асцит или другие аномалии органов, связанные с CLL/SLL;
v) новое экстранодальное поражение >10 мм;
vi) новые фтордезоксиглюкоза (ФДГ)-авидные очаги, соответствующие скорее лимфоме, чем другой этиологии (например, инфекция или воспаление); и
vii) новое или рецидивирующее поражение костного мозга лимфомой на основании ПЭТ или биопсии костного мозга, если предыдущая ПЭТ или биопсия костного мозга была отрицательной на лимфому;
b) признаки ухудшения индексных поражений, селезенки или печени или неиндексного заболевания, определенные на основании одного или более из следующих:
i) увеличение от надира на ≥50% от надира суммы произведений диаметров (SPD) индексных поражений;
ii) увеличение от надира на ≥50% самого длинного диаметра (LD) отдельного узла или экстранодальной массы, которая в настоящее время имеет LD >15 мм и LPD >10 мм;
iii) повышение увеличения селезенки на ≥50% (минимальное увеличение 20 мм) от надира у субъектов со спленомегалией при скрининге или при надире самого длинного вертикального размера селезенки (LVD);
iv) повышение увеличения печени на ≥50% (минимальное увеличение 20 мм) от надира у субъектов с гепатомегалией при скрининге или при надире LVD печени;
v) однозначное увеличение размеров выпота, асцитов или других органных аномалий, связанных с CLL/SLL; и
vi) трансформация в более агрессивную гистологию, определенная на основании биопсии лимфоузла;
vii) снижение количества тромбоцитов или гемоглобина, которое связано с CLL/SLL, не связано с аутоиммунным явлением и подтверждено биопсией костного мозга, показывающей инфильтрат клональных клеток CLL/SLL, при этом
А) текущее количество тромбоцитов составляет ≤100 × 109/л, и произошло снижение на ≥50% по сравнению с исходным уровнем;
B) текущий гемоглобин составляет ≤110 г/л (11,0 г/дл), и произошло снижение на >20 г/л (2 г/дл) от исходного уровня.
В некоторых вариантах осуществления лечение не приводит ни к одному из вышеперечисленных результатов.
[0051] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения лимфомы) приводит к одному или более (например, любому одному, двум, трем, четырем, пяти, шести, семи или восьми) из следующих:
а) отсутствие признаков нового заболевания;
b) регрессия всех индексных нодальных поражений до ≤15 мм в LDi;
c) регрессия до ≤15 мм всех нодальных неиндексных заболеваний;
d) исчезновение всех обнаруживаемых экстранодальных индексных и неиндексных заболеваний;
e) нормальный размер селезенки ≤130 мм, как определено методом визуализации в ее самом длинном вертикальном измерении (LVD);
f) если осуществляли ПЭТ, никаких признаков остаточного заболевания - т.е. оценка 1 (отсутствие поглощения выше фона), 2 (поглощение≤средостение) или 3 (поглощение > средостение, но≤печень) по 5-балльной шкале Довиля;
g) отрицательный результат на вовлечение костного мозга на основании ПЭТ для ПЭТ-авидной опухоли или на основании морфологической оценки односторонней кор-биопсии; если биопсия костного мозга неопределенная согласно морфологической оценке, она должна быть отрицательной согласно иммуногистохимии; и
h) отсутствие сывороточного М-белка согласно данным SIFE (у пациентов с LPL/ВМ).
В некоторых вариантах осуществления схема лечения приводит ко всем из a)-g) (“полный ответ”) и a)-h) (“полный ответ” у пациентов с LPL/ВМ), и может также привести к количеству злокачественных клеток в аспирате костного мозга, по данным проточной цитометрии, ≤1 × 10-4 (“полный ответ без определяемого остаточного заболевания”). В некоторых вариантах осуществления схема лечения приводит ко всем а)-h), а также к ≥90% снижению концентрации М-белка в сыворотке крови по сравнению с исходным уровнем.
[0052] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения лимфомы) приводит к одному или более (например, любому одному, двум, трем или четырем) из следующих:
а) отсутствие признаков нового заболевания
b) ≥50% уменьшение от скрининга SPD индексных нодальных и экстранодальных поражений;
c) отсутствие увеличения от надира размера неиндексного заболевания;
d) у субъекта с увеличением селезенки при скрининге ≥50% уменьшение от скрининга (минимальное уменьшение 20 мм) увеличения селезенки в ее самом длинном вертикальном размере (LVD) или до ≤130 мм, как определено методом визуализации,
e) если осуществляют ПЭТ:
i) типично ФДГ-авидная лимфома: если скрининговое ПЭТ-сканирование не осуществляли или если ПЭТ-сканирование было положительным до терапии, при лечении ПЭТ положительна в ≥1 ранее вовлеченном участке - т.е. оценка 4 (поглощение умеренно > печень) или оценка 5 (поглощение заметно > печень) по 5-балльной шкале Довиля, но со сниженным поглощением по сравнению со скринингом. Если осуществляли скрининговую ПЭТ и она оказалась отрицательной, то новые ПЭТ-свидетельства заболевания отсутствуют. Пониженное поглощение определяется как ≥25% снижение %ΔSUVmax;
ii) вариабельно ФДГ-авидная лимфома/ФДГ-авидность неизвестна: если предварительное ПЭТ-сканирование не осуществляли или если предварительное ПЭТ-сканирование было отрицательным на лимфому, следует использовать КТ-критерии при оценке опухоли во время лечения. Если ПЭТ-сканирование было положительным до начала терапии, ПЭТ при лечении является положительной в ≥1 ранее вовлеченном участке;
f) персистентность вовлечения костного мозга у субъекта, отвечающего рентгенологическим критериям полного ответа (CR); и
g) ≥50%, но <90% уменьшение от исходного уровня концентрации М-белка в сыворотке (у субъектов с LPL/WM).
В некоторых вариантах осуществления схема лечения приводит ко всем a)-f) (“частичный ответ”) или a)-g) (“частичный ответ” у пациентов с LPL/WM). В некоторых вариантах осуществления схема лечения приводит ко всем а)-f), а также к ≥25%, но <50% уменьшению от исходного уровня концентрации М-белка в сыворотке (“неполный ответ” у субъектов с LPL/WM).
[0053] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения лимфомы) приводит к одному или более из следующих:
а) отсутствие признаков нового заболевания,
b) отсутствие признаков роста опухоли; и
c) <25% уменьшение и <25% увеличение от исходного уровня концентрации М-белка в сыворотке (у субъектов с LPL/WM).
В некоторых вариантах осуществления схема лечения по изобретению приводит к обоим а) и b) (“стабильное заболевание”) или а)-c) (“стабильное заболевание” у субъектов с LPL/ВМ). В некоторых вариантах осуществления схема лечения по изобретению приводит к обоим а) и b), а также к ≥25%, но ≤50% уменьшению от исходного уровня концентрации М-белка в сыворотке (“неполный ответ” у субъектов с LPL/WM).
[0054] В некоторых вариантах осуществления схема лечения по изобретению не приводит к одному или более из следующих (которые являются признаками “прогрессирующего заболевания”):
а) наличие признаков какого-либо нового заболевания, определяемого одним или более из:
i) новый узел, который имеет >15 мм в любом диаметре;
ii) повторное появление экстранодального поражения, которое было устранено (т.е. ранее было присвоено произведение перпендикулярных диаметров (PPD) 0 мм2);
iii) новое экстранодальное поражение >10 мм;
iv) новое неиндексное заболевание (например, выпот, асцит или другие аномалии органов) любого размера, однозначно связанные с лимфомой (например, подтвержденное ПЭТ, биопсией, цитологией или другими нерадиологическими анализами);
v) новые ФДГ-авидные очаги, указывающие на лимфому, а не другую этиологию (например, инфекцию или воспаление; если существует неопределенность в отношении этиологии новых поражений, может быть рассмотрена биопсия или интервальное сканирование); и
vi) новое или рецидивирующее поражение костного мозга лимфомой по данным ПЭТ или биопсии костного мозга, если предыдущая ПЭТ или биопсия костного мозга, осуществленная в рамках исследования, была отрицательной на лимфому;
b) признаки ухудшения нодальных или экстранодальных индексных поражений, определяемые одним или более из следующих:
i) увеличение от надира на ≥50% от надира суммы произведений диаметров (SPD) индексных поражений;
ii) признаки ухудшения индивидуальных индексных лимфатических узлов или нодальных масс с увеличением от надира на ≥50% PPD для любого отдельного узла, если узел теперь имеет LD >15 мм, увеличением на ≥50% от надира PPD и увеличением LD или SD от надира на ≥5 мм для поражений размером ≤20 мм (LD или кратчайшего размера (SDi)) или ≥10 мм для поражений размером >20 мм (LD или SDi);
iii) однозначное увеличение размера неиндексного заболевания; и
iv) повышение увеличения селезенки на ≥50% (минимальное увеличение 20 мм) от надира у пациента с LVD селезенки >130 мм согласно визуализации при надире, или LVD селезенки >150 мм согласно визуализации у пациента с LVD селезенки ≤130 мм согласно визуализации при надире;
c) трансформация в более агрессивную неходжкинскую лимфому (NHL) по гистологии? как установлено биопсией лимфатического узла;
d) если осуществляют ПЭТ, оценка 4 (поглощение умеренно > печень) или оценка 5 (поглощение заметно > печень) по 5-балльной шкале Довиля, с увеличением поглощения по сравнению с надиром вместе с анатомическим увеличением размера поражения, указывающим на прогрессирующее заболеванием (PD). Увеличение поглощения определяется как ≥50% увеличение %ΔSUVmax; и
е) увеличение от надира на ≥25% концентрации М-белка в сыворотке крови (у субъектов с LPL/WM).
В некоторых вариантах осуществления лечение не приводит ни к одному из а)-d) или не приводит ни к одному из вышеперечисленных результатов.
[0055] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого лимфоидного лейкоза) приводит к одному или более (например, любому одному, двум или трем) из следующих:
а) статус лейкозного заболевания, отвечающий всем следующим требованиям:
i) <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови;
iii) отсутствие экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и отсутствие поражения центральной нервной системы (т.е. достижение статуса ЦНС-1 (отсутствие бластов в цереброспинальной жидкости));
b) периферическая кровь, отвечающая всем следующим требованиям:
i) ANC ≥1,0 × 109/л;
ii) количество тромбоцитов ≥100 × 109/л; и
c) любое увеличение средостения показывает полную регрессию, документально подтвержденную рентгенологически.
В некоторых вариантах осуществления схема лечения приводит ко всем а)-с) (“полный ответ”) и может также привести к количеству злокачественных клеток в аспирате костного мозга, по данным проточной цитометрии, ≤1 × 10-4 (“полный ответ без определяемого остаточного заболевания”).
[0056] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого лимфоидного лейкоза) приводит к одному или более (например, любому одному, двум или трем) из следующих:
а) статус лейкозного заболевания, отвечающий всем следующим требованиям:
i) <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови;
iii) отсутствие экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и отсутствие поражения центральной нервной системы (то есть достижение статуса ЦНС-1 (отсутствие бластов в цереброспинальной жидкости)));
b) периферическая кровь, отвечающая всем следующим требованиям:
i) ANC <1,0 × 109/л;
ii) количество тромбоцитов <100 × 109/л; и
c) любое увеличение средостения регрессировало на ≥75% в сумме произведений перпендикулярных диаметров (SPD), как это было задокументировано рентгенологически.
В некоторых вариантах осуществления схема лечения приводит ко всем а)-с) (“полный ответ с неполным восстановлением форменных элементов крови” и/или “полный ответ не подтвержден”).
[0057] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого лимфоидного лейкоза) приводит к одному или более (например, любому одному, двум или трем) из следующих:
а) статус лейкозного заболевания, соответствующий одному из следующих требований:
i) ≥50% уменьшение количества бластов в костном мозге до до 5-25% (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови; и
iii) отсутствие экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и отсутствие поражения центральной нервной системы (т.е. статус ЦНС-1 (отсутствие бластов в цереброспинальной жидкости) не перешел в статус ЦНС-2 (WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости) или статус ЦНС-3 (WBC ≥5 × 109/л с присутствием бластов в цереброспинальной жидкости) или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому));
b) периферическая кровь, отвечающая всем следующим требованиям:
i) ANC 1,0 × 109/л;
ii) количество тромбоцитов ≥100 × 109/л;
c) любое увеличение средостения регрессировало на ≥50% в SPD, как это документально подтверждено рентгенографически.
В некоторых вариантах схема лечения приводит ко всем а)-с) (“частичный ответ”).
[0058] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого лимфоидного лейкоза) приводит к одному или более (например, одному, двум или трем) из следующих:
а) ни достаточного улучшения ALL по сравнению с исходным уровнем, чтобы соответствовать PR, ни достаточных доказательств ухудшения ALL, чтобы соответствовать DRP;
b) отсутствие нового или ухудшения экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и отсутствие поражения центральной нервной системы (т.е. статус ЦНС-1 (отсутствие бластов в цереброспинальной жидкости) не перешел в статус ЦНС-2 (WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости) или статус ЦНС-3 (WBC ≥5 × 109/л с присутствием бластов в цереброспинальной жидкости) или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому));
c) отсутствие развития нового увеличения средостения и отсутствие увеличения SPD существующего увеличения средостения на >25%.
В некоторых вариантах осуществления схема лечения по изобретению приводит ко всем а)-с) (“стабильное заболевание”).
[0059] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого лимфоидного лейкоза) не приводит к одному или более (например, одному, двум, трем, четырем, пяти или шести) из следующих (которые являются признаками рецидива или прогрессирования заболевания, “DRP”):
а) повторное появление бластов в костном мозге (до >5%) у субъекта, испытывавшего CR;
b) повторное появление бластов в периферической крови у субъекта, испытывавшего CR;
c) ≥25% увеличение бластов в костном мозге до ≥20% (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
d) ≥25% увеличение количества бластов в периферической крови до >1 × 109/л;
e) развитие нового или ухудшение существующего экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу, вовлечение ЦНС (т.е. статус ЦНС-1 (отсутствие бластов в цереброспинальной жидкости) перешел в статус ЦНС-2 (WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости) или в статус ЦНС-3 (WBC ≥5 × 109/л с присутствием бластов в цереброспинальной жидкости) или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому)); и
f) развитие нового увеличения средостения или увеличение SPD существующего увеличения средостения на ≥25%.
В некоторых вариантах осуществления лечение не приводит ни к одному из а)- f).
[0060] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) приводит к одному или обоим из следующих:
а) статус лейкозного заболевания, отвечающий всем следующим требованиям:
i) <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови;
iii) отсутствие бластов с палочками Ауэра; и
iv) отсутствие экстрамедуллярного заболевания; и
b) периферическая кровь, отвечающая обоим следующим требованиям:
i) ANC ≥1,0 × 109/л;
ii) количество тромбоцитов ≥100 × 109/л.
В некоторых вариантах осуществления схема лечения приводит к обоим а) и b) (“полный ответ”) и может также привести к количеству злокачественных клеток в аспирате костного мозга, по данным проточной цитометрии, ≤1 × 10-4 (“полный ответ без определяемого остаточного заболевания").
[0061] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) приводит к одному или обоим из следующих:
а) статус лейкозного заболевания, отвечающий всем следующим требованиям:
i) <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови;
iii) отсутствие бластов с палочками Ауэра;
iv) отсутствие экстрамедуллярного заболевания; и
b) периферическая кровь, отвечающая только одному из следующих критериев:
i) ANC ≥1,0 × 109/л; и
ii) количество тромбоцитов ≥100 × 109/л.
В некоторых вариантах осуществления схема лечения приводит как обоим а) и b) (“полный ответ с неполным восстановлением форменных элементов крови”).
[0062] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) приводит к одному или обоим из следующих:
а) статус лейкозного заболевания, отвечающий всем следующим требованиям:
i) <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
ii) отсутствие бластов в периферической крови;
iii) отсутствие бластов с палочками Ауэра; и
iv) отсутствие экстрамедуллярного заболевания; и
b) периферическая кровь, отвечающая обоим следующим критериям:
i) ANC ≤1,0 × 109/л; и
ii) количество тромбоцитов ≤100 × 109/л.
В некоторых вариантах осуществления схема лечения приводит к обоим а) и b) (“морфологическое состояние без лейкоза”).
[0063] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) приводит к одному или обоим из следующих:
а) статус лейкозного заболевания, соответствующий любому из следующих требований:
i) ≥50% снижение количества бластов в костном мозге до 5-25% (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и наличием спикул костного мозга);
ii) <5% бластов в костном мозге, но с присутствием палочек Ауэра (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге);
iii) отсутствие бластов в периферической крови;
iv) отсутствие нового или ухудшающегося экстрамедуллярного заболевания; и
b) периферическая кровь, отвечающая обоим следующим критериям:
i) ANC ≥1,0 × 109/л; и
ii) количество тромбоцитов ≥100 × 109/л.
В некоторых вариантах осуществления схема лечения приводит к обоим а) и b) (“частичный ответ”).
[0064] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) приводит к одному или обоим из следующих:
а) ни достаточных улучшений AML от исходного уровня, чтобы соответствовать критериям CRMRD-, CR, CRi, MLFS или PR, ни достаточных доказательств ухудшения AML, чтобы соответствовать критериям DRP; и
b) отсутствие нового или ухудшающегося экстрамедуллярного заболевания.
В некоторых вариантах осуществления схема лечения по изобретению приводит к обоим а) и b) (“стабильное заболевание”).
[0065] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения острого миелоидного лейкоза) не приводит к одному или более из следующих (которые являются признаками рецидива или прогрессирования заболевания, “DRP”):
а) повторное появление бластов в костном мозге (до >5%) у субъекта, испытывавшего CRMRD-, CR, CRi или MLFS;
b) повторное появление бластов в периферической крови у субъекта, испытывавшего CRMRD-, CR, CRi, MLFS или PR;
c) абсолютное 20% увеличение бластов в костном мозге до >25% (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге) у субъекта, испытавшего PR;
d) абсолютное 20% увеличение периферических бластов до >25% у субъекта, испытавшего PR; и
e) развитие нового экстрамедуллярного заболевания или ухудшение существующего экстрамедуллярного заболевания.
В некоторых вариантах осуществления лечение не приводит ни к одному из а)-е).
[0066] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) приводит к одному или обоим из следующих:
а) исчезновение всех целевых поражений и отсутствие новых измеримых поражений (например, поражения, которые могут быть точно измерены в ≥1 измерении (самый длинный диаметр, который должен быть зарегистрирован) как >10 мм с использованием КТ-сканирования с минимальной толщиной среза 5 мм), или >10 мм при измерении циркулем при клиническом обследовании, или >20 мм при использовании рентгенографии грудной клетки); и
b) уменьшение короткой оси до <10 мм для любых патологических лимфатических узлов, будь то целевой (например,≥15 мм по короткой оси при оценке методом компьютерной томографии (минимальная толщина среза 5 мм)) или нецелевой (например, ≥10 мм, но <15 мм).
В некоторых вариантах осуществления схема лечения приводит к обоим а) и b) (“полный ответ” для целевых поражений).
[0067] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) приводит к ≥30% уменьшению суммы диаметров целевых поражений, беря для сравнения сумму диаметров на исходном уровне и включая любые новые измеримые поражения, которые могли появиться от исходного уровня (“частичный ответ” для целевых поражений).
[0068] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) приводит к ≥30% уменьшению суммы диаметров целевых поражений, беря для сравнения сумму диаметров на исходном уровне и включая любые новые измеримые поражения, которые могли появиться от исходного уровня (“частичный ответ” для целевых поражений).
[0069] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) не приводит ни к достаточному сокращению, чтобы соответствовать критериям частичного ответа, где для сравнения берут сумму диаметров на исходном уровне, ни к достаточному увеличению, чтобы соответствовать критериям прогрессирующего заболевания, где для сравнения берут наименьшую сумму диаметров во время лечения (“стабильное заболевание” для целевых поражений).
[0070] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) не приводит к ≥20% увеличению (и абсолютному увеличению ≥5 мм) суммы диаметров целевых поражений (включая любые новые поражения), где для сравнения берут наименьшую сумму после исходного уровня (опухолевая нагрузка, надира) или сумму на исходном уровне, если это наименьшая сумма во время лечения (“прогрессирующее заболевание” для целевых поражений).
[0071] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) приводит к одному или более из следующих:
а) исчезновение всех нецелевых поражений;
b) нормализация повышенного уровня онкомаркера; и
c) все лимфатические узлы непатологического размера (<10 мм по короткой оси).
В некоторых вариантах осуществления схема лечения приводит ко всем а)-с) (“полный ответ” для нецелевых поражений). В некоторых вариантах осуществления схема лечения приводит к b) и c), но не a), или a) и c), но не b) (“неполный ответ/не прогрессирующее заболевание” для нецелевых поражений).
[0072] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) не приводит к однозначному прогрессированию существующих нецелевых поражений (“прогрессирующее заболевание” для нецелевых поражений).
[0073] В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) приводит к общему ответу, включающему:
- отсутствие целевых поражений и новых измеримых поражений; отсутствие нецелевых поражений или опухолевых маркеров; и отсутствие новых неизмеримых поражений (“полный ответ”);
- отсутствие целевых поражений и новых измеримых поражений; и стабильные нецелевые поражения или опухолевые маркеры (“частичный ответ”);
- отсутствие целевых поражений и новых измеримых поражений; и однозначное прогрессирование нецелевых поражений или опухолевых маркеров (“частичный ответ”);
- уменьшение на ≥30% целевых поражений и новых измеримых поражений; и отсутствующие, стабильные или однозначно прогрессирующие нецелевые поражения или опухолевые маркеры (“частичный ответ"); или
- уменьшение <30% до увеличения <20% целевых поражений и новых измеримых поражений; и отсутствующие, стабильные или однозначно прогрессирующие нецелевые поражения или опухолевые маркеры (“стабильное заболевание”).
В некоторых вариантах осуществления схема лечения по изобретению (например, для лечения солидной опухоли) не приводит к увеличению на ≥20% целевых поражений и новых измеримых поражений; и отсутствующие, стабильные или однозначно прогрессирующие нецелевые поражения или опухолевые маркеры (“прогрессирующее заболевание”).
[0074] В некоторых вариантах осуществления схема лечения по изобретению приводит к одному или более из следующих результатов, например, как определено выше или в Примерах:
- CLL/SLL: CR, CRi, PR или PR-L;
- FL, MZL, MCL, DLBCL или BL: CR или PR;
- LPL/WM: CR, VGPR, PR или MR;
- ALL: CR, CRi/CRu или PR;
- AML: CR, CRi или PR; или
- солидная опухоль: CR или PR.
[0075] В некоторых вариантах осуществления схема лечения по изобретению не приводит к одному или более (например, любому одному, двум, трем, четырем, пяти, шести, семи, восьми, девяти или десяти) из следующих в первом цикле лечения:
а) Фебрильная нейтропения ≥3 степени,
b) Нейтропения ≥4 степени;
c) Тромбоцитопения ≥3 степени с кровотечением ≥3 степени;
d) Тромбоцитопения ≥4 степени;
e) Синдром лизиса опухоли 3 степени (TLS), несмотря на адекватную профилактику, который не проходит в течение 72 часов с момента начала;
f) TLS ≥4 степени, несмотря на адекватную профилактику;
g) Рвота ≥3 степени, несмотря на рекомендуемую (или эквивалентную) противорвотную поддержку;
h) Негематологические лабораторные аномалии ≥3 степени, которые не улучшаются до уровня ≤1 или исходного уровня в течение 72 часов;
i) Другие негематологические возникшие в ходе лечения нежелательные явления (TEAE) ≥3 степени (за исключением слабости ≥3 степени); и
j) Невозможность восстановления до исходного уровня к ≥21 дню после последней дозы иммуноконъюгата в цикле из-за связанного с лекарственным средством TEAE,
при этом все степени определены с использованием Критериев общей терминологии для неблагоприятных событий (CTCAE), версия 5.0. В некоторых вариантах осуществления схема лечения по настоящему изобретению не приводит ни к одному из указанных результатов.
[0076] В некоторых вариантах осуществления схема лечения по настоящему изобретению не приводит к одному или более (например, одному, двум, трем, четырем, пяти или шести) из следующего:
а) любое осложнение, которое возникает в результате процедуры, установленной протоколом (например, венепункция, ЭКГ);
b) любое ранее существовавшее состояние, тяжесть которого увеличивается или изменяется по природе во время или вследствие введения лекарственного средства (например, ухудшение проявлений основного рака, такое как усиление боли, реакция обострения опухоли, TLS и т.д.);
c) любая травма или несчастный случай;
d) любая аномалия результатов физиологического тестирования или физического обследования, требующая клинического вмешательства или дальнейшего исследования (помимо назначения повторного или подтверждающего теста);
e) любое отклонение лабораторных (например, клиническая химия, гематология, анализ мочи) или исследовательских (например, ЭКГ, рентген) показателей, не зависящее от основного заболевания, требующее клинического вмешательства, приводит к дальнейшему исследованию (помимо назначения повторного или подтверждающего теста) или приводит к прерыванию или прекращению исследования лекарственного препарата, если только это не связано с уже зарегистрированным клиническим событием; и
е) осложнение, связанное с беременностью или прерыванием беременности.
В некоторых вариантах осуществления схема лечения по изобретению не приводит ни к одному из указанных результатов.
[0077] В некоторых вариантах осуществления схема лечения по изобретению не приводит к одному или более (например, любому одному, двум, трем, четырем, пяти или шести) из следующих:
а) смерть;
b) угрожающая жизни ситуация с непосредственным риском смерти;
c) госпитализация в стационар или продление существующей госпитализации;
d) персистентная или значительная недееспособность/нетрудоспособность;
e) врожденная аномалия/врожденный дефект у потомства субъекта, который принимал иммуноконъюгат; и
f) значимое с медицинской точки зрения событие, которое не может быть непосредственно опасным для жизни или привести к смерти или госпитализации, но на основе соответствующего медицинского и научного суждения может поставить под угрозу субъекта или может потребовать медицинского или хирургического вмешательства для предотвращения одного из перечисленных выше результатов (например, аллергический бронхоспазм, требующий интенсивного лечения в отделении неотложной помощи или дома, новые раковые заболевания или дискразии крови, судороги, не приводящие к госпитализации, или развитие наркотической зависимости или наркомании).
В некоторых вариантах осуществления схема лечения по изобретению не приводит ни к одному из указанных результатов.
[0078] В некоторых вариантах осуществления схема лечения по изобретению не приводит к одному или более (например, одному, двум или трем) из следующих:
а) Инфузионные реакции ≥3 степени;
b) синдром лизиса опухоли (TLS) любой степени; и
c) Периферическая нейропатия ≥3 степени;
при этом все классы определяются с использованием Критериев общей терминологии для неблагоприятных событий (CTCAE), версия 5.0.
В некоторых вариантах осуществления схема лечения по изобретению не приводит ни к одному из указанных результатов.
[0079] В некоторых вариантах осуществления схема лечения по изобретению не приводит к отклонениям одного или более (например, любого одного, двух, трех, четырех, пяти, шести, семи, восьми или девяти) из следующих показателей: мочи, сыворотки, крови, систолического кровяного давления, диастолического кровяного давления, пульса, температуры тела, насыщения крови кислородом и показаний электрокардиографии (ЭКГ). В некоторых вариантах осуществления схема лечения по изобретению не приводит к отклонениям ни одного из вышеперечисленных.
[0080] В некоторых вариантах осуществления схема лечения по изобретению не приводит к обнаруживаемым уровням циркулирующих иммуноконъюгат-реактивных антител в сыворотке крови пациента.
[0081] Должно быть понятно, что описанные схемы лечения могут быть способами лечения, описанными в настоящей заявке, иммуноконъюгатом, описанным в настоящей заявке, для использования в схеме лечения, описанной в настоящей заявке, или применением иммуноконъюгата, описанного в настоящей заявке, для получения лекарственного средства для схемы лечения, описанной в настоящей заявке.
5. Премедикация или сопутствующая лекарственная терапия
Профилактика синдрома лизиса опухоли
[0082] В некоторых вариантах осуществления пациента, которого следует лечить с применением схемы лечения по изобретению, оценивают на риск синдрома лизиса опухоли (TLS) с использованием следующих критериев:
CLL/SLL и NHL:
(i) Низкий риск: Лактатдегидрогеназа (LDH) в сыворотке ≤ верхний предел нормы (ULN), все измеримые лимфоузлы <5 см в диаметре, и абсолютное число лимфоцитов (ALC) <25 × 109/л.
(ii) Промежуточный риск: Лактатдегидрогеназа в сыворотке >1 до ≤2 × ULN, ≥1 измеримых лимфоузлов ≥5, но <10 см в диаметре, или ALC ≥25 × 109/л.
(iii) Высокий риск: Лактатдегидрогеназа в сыворотке >2 × ULN, ≥1 измеримых лимфоузлов ≥10 см в диаметре, или оба показателя ≥1 измеримых лимфоузлов с LD ≥5, но <10 см в диаметре, и ALC ≥25 × 109/л.
ALL:
(i) Низкий риск: белые клетки крови (WBC) <20 × 109/л и уровень лактатдегидрогеназы в сыворотке <2 × ULN
(ii) Промежуточный риск: WBC ≥20 × 109/л до <100 × 109/л и уровень лактатдегидрогеназы в сыворотке <2 × ULN
(iii) Высокий риск: WBC ≥100 × 109/л или уровень лактатдегидрогеназы в сыворотке ≥2 × ULN
AML:
(i) Низкий риск: Лактатдегидрогеназа в сыворотке <2 × ULN, мочевая кислота в сыворотке <5,5 мг/дл и WBC <25 × 109/л.
(ii) Промежуточный риск: Лактатдегидрогеназа в сыворотке ≥2 × ULN, или мочевая кислота в сыворотке ≥5,5 мг/дл и <7 мг/дл, или WBC ≥25 × 109/л до <100 × 109/л.
(iii) Высокий риск: мочевая кислота в сыворотке ≥7 мг/дл или WBC ≥100 × 109/л.
[0083] В некоторых вариантах осуществления, если пациент находится в группе среднего или высокого риска синдрома лизиса опухоли (TLS) и/или если TLS наблюдается во время лечения, пациент может получать аллопуринол и/или фебуксостат до или во время лечения. Пациент с гиперурикемией может дополнительно получать расбуриказу. Например, пациент может получать указанное лекарственное средство(средства) в соответствии со схемой, описанной ниже:
(i) Промежуточный риск развития TLS: Пациент может получать аллопуринол в дозе от 100 до 300 мг перорально каждые 8 часов, начиная с ≥24 до 48 часов до начала медикаментозной терапии; следует отметить, что максимальная суточная доза аллопуринола составляет 800 мг, дозы ≤300 мг делить не нужно, и дозы следует уменьшить на ≥50% для субъектов с почечной недостаточностью. Можно использовать альтернативные лекарственные средства (например, фебуксостат) при введении в соответствии с маркировкой продукта. Кроме того, пациенты с гиперурикемией могут получать расбуриказу, вводимую при 3-4,5 мг путем в/в инфузии.
(ii) Высокий риск развития ТЛС: Пациент может получать аллопуринол от 100 до 300 мг перорально каждые 8 часов, начиная с ≥24 до 48 часов до начала медикаментозной терапии; следует отметить, что максимальная суточная доза аллопуринола составляет 800 мг, дозы ≤300 мг не нужно делить (но могут быть недостаточными для пациентов с высоким риском), и дозы следует уменьшить на ≥50% для субъектов с почечной недостаточностью. Можно использовать альтернативные лекарственные средства (например, фебуксостат) при введении в соответствии с маркировкой продукта. Кроме того, пациенты с высоким риском могут получать расбуриказу, при 3-4,5 мг путем в/в инфузии, вводимую за 3-4 часа до первой дозы препарата.
[0084] В некоторых вариантах осуществления пациентов наблюдают на TLS в течение цикла 1, с Дня 1 (C1D1) по C1D3, с оценкой жизненно важных показателей, неблагоприятных явлений, и осуществляя лабораторные исследования, включающие биохимический анализ крови и общий анализ крови.
Профилактика инфузионных реакций
[0085] В некоторых вариантах осуществления до или во время приема схемы лечения по изобретению пациент может получать жаропонижающее и/или антигистаминное средство для уменьшения частоты и тяжести инфузионных реакций. В некоторых вариантах осуществления жаропонижающее можно вводить перорально или в/в путем, и оно может представлять собой, например, ацетаминофен (парацетамол) от 650 до 1000 мг или эквивалент. В некоторых вариантах осуществления антигистаминный препарат можно вводить перорально или в/в путем, и он может представлять собой, например, цетиризин в дозе 10 мг или эквивалент. В некоторых вариантах осуществления один или оба препарата вводят за 30-60 минут до каждой инфузии иммуноконъюгата. Нестероидный противовоспалительный препарат (НПВП), такой как ибупрофен, 400-800 мг перорально или эквивалент, можно добавить или использовать вместо ацетаминофена. Кортикостероид, такой как преднизолон, 100 мг или эквивалент, также может рассматриваться в качестве премедикации.
Противорвотная профилактика
[0086] В некоторых вариантах осуществления до или во время приема схемы лечения по изобретению пациент может получать противорвотное средство для лечения тошноты и/или рвоты.
Лечение нейтропении
[0087] В некоторых вариантах осуществления, до или во время получения схемы лечения по изобретению, пациент может получать G-CSF (например, филграстим, фрастим-SND, ПЭГ-филграстим или ленограстим) или GM-CSF (например, сарграмостим) для предотвращения или облегчения лекарственно-индуцированных нейтропенических осложнений и промотирования восстановления нейтрофилов.
Предотвращение синдрома гипервязкости (HVS)
[0088] HVS является клинической особенностью у 10-30% пациентов с LPL/WM из-за присутствия высоких уровней циркулирующего М-белка. Немедленное лечение симптоматического HVS обычно представляет собой плазмаферез. В некоторых вариантах осуществления, до или во время получения схемы лечения по изобретению, пациент может получать плазмаферез для предотвращения или облегчения HVS.
6. Готовые изделия и наборы
[0089] Настоящее изобретение также обеспечивает готовые изделия, например наборы, включающие один или несколько контейнеров (например, одноразовые или многоразовые контейнеры), содержащих фармацевтическую композицию иммуноконъюгата, описанного в настоящей заявке, в дозе, описанной в настоящей заявке, необязательно дополнительную биологически активную молекулу (например, другое терапевтическое средство), и инструкции по применению в соответствии с описанной в настоящей заявке схемой лечения. Иммуноконъюгат и дополнительные биологически активные молекулы могут быть упакованы вместе или по отдельности в подходящую упаковку, такую как флакон или ампула, изготовленные из нереактивного стекла или пластика. В некоторых вариантах осуществления флакон или ампула содержит жидкость, содержащую иммуноконъюгат, или лиофилизированный порошок, содержащий иммуноконъюгат; жидкость или лиофилизированный порошок необязательно могут включать дополнительное терапевтическое средство или биологически активную молекулу. В некоторых вариантах осуществления флакон или ампула содержит концентрированный исходный раствор (например, 2×, 5×, 10× или более) иммуноконъюгата и, необязательно, биологически активной молекулы. В конкретных вариантах осуществления фармацевтическая композиция иммуноконъюгата, описанного в настоящей заявке (например, ADC-А), упакована в одноразовый стеклянный флакон, содержащий 50 мг, 100 мг, 150 мг, 200 мг, 250 мг или 300 мг иммуноконъюгата (например, подходящего для использования в дозе, описанной в настоящей заявке, такой как 0,50, 0,75, 1,00, 1,25, 1,50, 1,75, 2,00, 2,25, 2,50, 2,75 или 3,00 мг/кг). В некоторых вариантах осуществления готовые изделия, такие как наборы, включают медицинское устройство для введения иммуноконъюгата и/или биологически активной молекулы (например, шприц и игла); и/или подходящий разбавитель (например, стерильная вода и физиологический раствор). Настоящее изобретение также включает способы получения указанных изделий.
[0090] Если контекст не требует иного, повсеместно в описании и формуле изобретения слово “включать” и его вариации, такие как “включает” и “включающий”, должны толковаться в открытом, инклюзивном смысле, то есть как “включая, но не ограничиваясь этим”. Как используется в настоящем описании и прилагаемой формуле изобретения, формы единственного числе, обозначаемые артиклями “a,” “an” и “the”, включают формы множественного числа, если содержание явно не требует иного. Следует также отметить, что термин “или” обычно используется в его значении, включая “и/или”, если содержание явно не требует иного. Как используется в настоящей заявке, термин “около” относится к числовому диапазону, который составляет 10%, 5% или 1% плюс или минус от заявленного числового значения в контексте конкретного использования. Кроме того, заголовки, приведенные в настоящей заявке, предназначены только для удобства и не интерпретируют объем или значение заявленных вариантов осуществления.
[0091] Все публикации и патенты, указанные в настоящей заявке, включены в нее путем ссылки в полном объеме с целью описания и раскрытия, например, описанных в публикациях конструкций и методологий, которые могут быть использованы в связи с описанными изобретениями. Публикации, обсуждаемые в настоящей заявке, представлены исключительно для их раскрытия до даты подачи настоящей заявки. Ничто в настоящей заявке не должно истолковываться как признание того, что авторы настоящего изобретения не имеют права противопоставлять такое раскрытие с более ранним приоритетом в силу предшествующего изобретения или по любой другой причине.
[0092] Если не определено иначе, все технические и научные термины, используемые в настоящей заявке, имеют то же значение, что обычно понимается специалистом, обладающим обычными навыками в области техники, к которой относятся описанные в настоящей заявке изобретения. Любые методы, устройства и материалы, аналогичные или эквивалентные описанным в настоящей заявке, можно использовать при практическом осуществлении или испытании описанных в настоящей заявке изобретений.
ПРИМЕРЫ
[0093] Следующие примеры иллюстрируют репрезентативные варианты осуществления настоящего изобретения и не предназначены для его ограничения каким-либо образом.
Пример 1: Синтез ADC-A
[0094] Конъюгацию Ab1 с MC-VC-PAB-MMAE (ADC-A) осуществляли в нескольких масштабах (от 2 мг до 200 г) с аналогичными результатами. В крупном масштабе приблизительно 200 г Ab1 (приблизительно 40 мг/мл в 50 мМ цитрата натрия, 10 мг/мл трегалозы, 0,05 мМ EDTA, 0,02% полисорбата 80, pH 5,2) обрабатывали 1,90 эквивалентами (экв.) трис(2-карбоксиэтил)фосфина (TCEP, 5 мМ) и выдерживали при 20-24°C в течение 330 минут. Затем добавляли 6,5 экв. MC-VC-PAB-MMAE в N, N-диметилацетамиде (DMA) и смесь выдерживали при 22-23°C еще в течение 60 минут. Буфер заменяли 10 мМ ацетата натрия, pH 4,8 путем ультрафильтрации/диафильтрации (UF/DF) с использованием 30 кДа UF мембранных кассет. Количество связанных молекул лекарственного средства MMAE на молекулу антитела (DAR) определяли с использованием ГИХ-ВЭЖХ. Данные ГИХ-ВЭЖХ, эксклюзионной ВЭЖХ, ОФ-ВЭЖХ и спектроскопии в УФ и видимой области представлены в Таблице 1 ниже. Достоверные результаты были получены при всех масштабах, с DAR в пределах в среднем от 3,89 до 5,09, в зависимости от используемого метода.
ADC-A Отношение лекарственное средство-антитело (DAR)
Пример 2: Исследование с повышением дозы для иммуноконъюгатов Анти-ROR1-MMAE
[0095] Ниже описан протокол оценки безопасности, фармакокинетики, фармакодинамики, иммуногенности и эффективности иммуноконъюгата ROR1 (ADC-A) в диапазоне уровней доз при введении субъектам с ранее леченными рецидивирующими или рефрактерными CLL/SLL, MCL, FL, MZL, DLBCL, RTL, BL, LPL/WM, Т-клеточный NHL, ALL или AML. ADC-A вводят внутривенно (в/в) повторяющимися 3-недельными циклами с инфузией препарата в День 1 каждого цикла (Q1/3W [Схема 1]); повторяющимися 3-недельными циклами с инфузией препарата в Дни 1 и 8 каждого цикла (Q2/3W [Схема 2]); или повторяющимися 4-недельными циклами с инфузией препарата в Дни 1, 8 и 15 каждого цикла (Q3/4W [Схема 3]) в течение запланированного времени инфузии ~30 минут. Время инфузии может быть увеличено по мере необходимости с учетом индивидуальной переносимости лечения субъектом.
Схемы введения ADC-A
Уровни доз
[0096] Начальной когорте субъектов будет назначен ADC-A при 0,50 мг/кг Q1/3W. После этого когорты субъектов будут последовательно зачислены на прогрессивно более высокие уровни начальной дозы ADC-A, которые будут вводиться Q1/3W, Q2/3W или Q3/4W (Таблицы 2 и 3). Начальную дозу 0,25 мг/кг можно вводить по схеме Q1/3W, чтобы можно было снизить дозу, если субъект испытывает TEAE, требующее изменения дозы до уровня ниже исходного уровня.
Уровни доз ADC-A
§ Можно вводить, если субъекты переносят ADC-A терапию при предшествующем уровне доз.
[0097] Планируется ускоренная эскалация дозы у одного субъекта на начальном уровне дозы с использованием схемы Q1/3W. После этого когорты от 3 до 6 субъектов будут последовательно включать в исследование, оценивая каждую схему введения при прогрессивно более высоких уровнях дозы ADC-A с использованием стандартной схемы эскалации дозы 3+3. Основываясь на паттерне дозо-ограничивающей токсичности (DTL), наблюдаемой в 1-м цикле, эскалация будет продолжаться, чтобы определить максимально переносимую дозу (MTD) и рекомендуемый режим дозирования (RDR) для каждой схемы введения, который может быть при MTD или более низкой дозе в пределах допустимого диапазона доз. MTD является самым высоким испытанным уровнем дозы, при котором ≥6 субъектов получали лечение и который связан с дозоограничивающей токсичностью (DTL) Цикла 1 у ≤17% субъектов. RDR может быть MTD или может быть более низкой дозой в пределах допустимого диапазона доз. Выбор каждого RDR будет основываться на рассмотрении краткосрочной и долгосрочной информации о безопасности вместе с имеющимися данными о фармакокинетике, фармакодинамике и эффективности и может быть определен в контексте уровня поддерживающего лечения (например, противорвотной или гематопоэтической профилактики), предоставляемого субъектам для достижения RDR. После того, как каждый RDR будет установлен, дальнейшее развитие будет рассмотрено при конкретных гематологических злокачественных заболеваниях и/или солидных опухолях.
[0098] Ожидается, что ADC-A, вводимый пациентам в соответствии с представленными схемами введения, достигнет общего ответа (OR), определяемого как достижение следующих результатов по типу заболевания:
- CLL/SLL: Полный ответ (CR), полный ответ с неполным восстановлением форменных элементов крови (CRi), частичный ответ (PR), или частичный ответ с лимфоцитозом (PR-L);
- NHL: CR или PR;
- LPL/WM: CR, очень хороший частичный ответ (VGPR), PR или неполный ответ (MR);
- ALL: CR, CRi или неподтвержденный полный ответ (CRu) (для субъектов с медиастинальным заболеванием), или PR; и
- AML: CR, CRi, морфологическое состояние без лейкоза (MLFS), или PR.
CR без измеримого остаточного заболевания (CRMRD-) определяется как достижение ≤1 × 10-4 злокачественных клеток в костном мозге (как определено проточной цитометрией) у субъекта, отвечающего всем другим критериям CR. Также ожидается, что ADC-A при введении в соответствии с представленными схемами введения приведет к улучшению процентного изменения размеров опухоли (определяемого как процентное изменение от исходного уровня суммы произведений диаметров (SPD) индексных поражений), выживаемости без прогрессирования (PFS) (определяемой как интервал от начала исследуемой терапии до более раннего из первых документально подтвержденных прогрессирования заболевания/рецидива или смерти от любой причины) и общей выживаемости (OS) (определяемой как интервал от начала исследуемой терапии до смерти от любой причины).
[0099] Схема введения ADC-A также может привести к изменению (например, увеличению или уменьшению) концентрации Wnt5a в плазме (по данным иммуноанализа), изменению (например, увеличению или уменьшению) концентрации циркулирующего ROR1 в плазме (по данным иммуноанализа) и изменению количества (например, увеличению или уменьшению) или состояния активации (например, увеличению или уменьшению) иммунных клеток, таких как циркулирующие В-клетки, Т-клетки и природные киллерные (NK) клетки.
Выбор пациента
[0100] В данном исследовании пациентами могут быть взрослые пациенты в возрасте 18 лет и старше; у которых был диагностирован CLL/SLL, MCL, FL, MZL, DLBCL, RTL, BL, LPL/WM, T-клеточный NHL, ALL или AML; которые ранее лечились, но у которых было прогрессирование во время или рецидив после предшествующей системной терапии, или которые вряд ли отвечают на установленные терапии, которые, как известно, дают клиническую пользу, или у которых развилась непереносимость установленных терапий, которые, как известно, дают клиническую пользу; и которые завершили всю предыдущее лечение (включая хирургию, лучевую терапию, химиотерапию, иммунотерапию или исследовательскую терапию) для лечения рака за ≥1 неделю до начала исследуемой терапии.
[0101] Пациенты, которые получают постоянную иммуносупрессивную терапию, отличную от кортикостероидов, могут быть исключены из лечения. Во время начала исследуемой терапии субъекты могут использовать системные кортикостероиды (при дозах ≤10 мг/день преднизолона или эквивалента), а также местные, ингаляционные или интраартикулярные кортикостероиды. Во время исследуемой терапии субъекты могут использовать системные, кишечные, местные, ингаляционные или интраартикулярные кортикостероиды по мере необходимости (например, для интеркуррентных заболеваний или противорвотной профилактики).
Премедикация
[0102] Для предотвращения синдрома лизиса опухоли (TLS) пациентам можно давать аллопуринол 100-300 мг перорально каждые 8 часов, начиная за ≥24-48 часов до начала исследуемой лекарственной терапии.
Можно использовать альтернативные препараты (например, фебуксостат) с введением в соответствии с маркировкой продукта. Кроме того, субъекты с гиперурикемией могут получать расбуриказу 3-4,5 мг путем в/в инфузии. Кроме того, субъекты с высоким риском могут получать расбуриказу 304,5 мг путем в/в инфузии, вводимой за 3-4 часа до первой дозы исследуемого препарата.
[0103] Если наблюдаются инфузионные реакции, перед инфузиями ADC-A субъектам можно обеспечить премедикацию с использованием жаропонижающих и антигистаминных средств для снижения частоты и тяжести инфузионных реакций. Эта схема может включать пероральное или в/в введение жаропонижающего средства (ацетаминофен [парацетамол], 650-1000 мг или эквивалент) и пероральное или в/в введение антигистаминного средства (цетиризин, 10 мг или эквивалент), оба вводимые за 30-60 минут до каждой инфузии ADC-A. Нестероидный противовоспалительный препарат (НПВП) (ибупрофен, 400-800 мг перорально или эквивалент) можно добавить или использовать вместо ацетаминофена. Кортикостероид (100 мг преднизолона или его эквивалент) в качестве премедикации можно рассматривать по мере необходимости.
Оценка эффективности
Хронический лимфоцитарный лейкоз/мелкоклеточная лимфоцитарная лимфома
[0104] Ответы будут классифицироваться как полный ответ без измеримого остаточного заболевания (CRMRD-), полный ответ (CR), полный ответ с неполным восстановлением форменных элементов крови (CRi), частичный ответ (PR), частичный ответ с лимфоцитозом (PR-L), стабильное заболевание (SD) или прогрессирующее заболевание (PD). Кроме того, категория ответа “неопределяемый” (NE) предусмотрена для ситуаций, в которых имеется недостаточная информация для того, чтобы иначе классифицировать статус ответа.
[0105] Будет определен наилучший общий ответ. Наилучший общий ответ представляет собой наилучший ответ, зафиксированный от начала лечения до PD/рецидива. Измеренное при скрининге значение будет взято для сравнения для определения ответа. Измеренное значение надира будет взято для сравнения для PD; это значение представляет собой наименьшее зарегистрированное значение, включая скрининговое значение, если это наименьшее значение. Там, где имеются данные визуализации, эти данные заменяют данные физического обследования при определении статуса опухоли.
(1) Полный ответ без измеримого остаточного заболевания
Для соответствия критериям для CRMRD- должны достигаться все из следующих условий:
Все критерии для CR соблюдены
Проточная цитометрия аспирата костного мозга показывает злокачественные клетки ≤1 × 10-4
(2) Полный ответ (CR)
Для соответствия критериям для CR должны достигаться все из следующих условий:
Отсутствие признаков нового заболевания
ALC в периферической крови <4 × 109/л
Регрессия всех индексных нодальных масс до нормального размера ≤15 мм в LD
Нормальный размер селезенки и печени
Регрессия к норме всех нодальных неиндексных заболеваний и исчезновение всех обнаруживаемых ненодальных неиндексных заболеваний.
Морфологически отрицательный костный мозг, определенный как <30% ядросодержащих клеток являются лимфоидными клетками, и отсутствие лимфоидных узлов в образце костного мозга, который является нормоцеллюлярным для возраста
Периферическая кровь, соответствующая всем из следующих критериев:
ANC >1,5 × 109/л без экзогенных факторов роста за ≤2 недели до соответствующей оценки форменных элементов крови;
количество тромбоцитов >100 × 109/л без экзогенных факторов роста или трансфузий тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови; и
гемоглобин >110 г/л (11,0 г/дл) без экзогенных факторов роста или трансфузий эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови.
(3) Полный ответ с неполным восстановлением форменных элементов крови
Для соответствия критериям для Cri, все критерии для CR соблюдвются за исключением того, что существует ≥1 из следующих условий:
ANC≤1,5 × 109/л, или требуются экзогенные факторы роста за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания ANC ≥1,5 × 109/л;
Количество тромбоцитов ≤100 × 109/л, или требуются экзогенные факторы роста или трансфузии тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания количества тромбоцитов ≥100 × 109/л;
Гемоглобин ≤110 г/л (11,0 г/дл), или требуются экзогенные факторы роста или трансфузии эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови для поддержания гемоглобина ≥110 г/л (11,0 г/дл).
(4) Частичный ответ
Для соответствия критериям для PR должны достигаться все из следующих условий:
Никаких признаков нового заболевания
Изменение статуса заболевания, отвечающее ≥2 из следующих критериев, за исключением того, что если при скрининге присутствует только лимфаденопатия, то только лимфаденопатия должна улучшиться в степени, указанной ниже:
Снижение ALC периферической крови на ≥50% от скрининга
Снижение на ≥50% от скрининга SPD индексных нодальных поражений
У субъекта с увеличением селезенки при скрининге (>120 мм) ≥50% снижение от скрининга (минимальное снижение 20 мм) увеличения селезенки в ее LVD или до ≤120 мм, как определено методом визуализации
У субъекта с увеличением печени при скрининге (>180 мм) ≥50% снижение от скрининга (минимальное уменьшение 20 мм) увеличения печени в ее LVD или до ≤180 мм, как определено методом визуализации
Уменьшение на 50% от скрининга CLL/SLL инфильтрации костного мозга или В-лимфоидных узлов
Отсутствие индексного, селезеночного, печеночного или неиндексного заболевания с ухудшением, которое отвечает критериям характерного PD.
Периферическая кровь, соответствующая ≥1 из следующих критериев:
ANC >1,5 × 109/л или ≥50% увеличение по сравнению со скринингом без экзогенных факторов роста (например, G-CSF) за ≤2 недели до соответствующей оценки форменных элементов крови
Количество тромбоцитов >100 × 109/л или ≥50% увеличение по сравнению со скринингом без экзогенных факторов роста или трансфузий тромбоцитов за ≤2 недели до соответствующей оценки форменных элементов крови
Гемоглобин >110 г/л (11,0 г/дл) или ≥50% увеличение по сравнению со скринингом без экзогенных факторов роста (например, эритропоэтин) или трансфузий эритроцитов за ≤2 недели до соответствующей оценки форменных элементов крови
(5) Частичный ответ с лимфоцитозом
Для соответствия критериям PR-L должны достигаться следующие условия:
Отсутствие признаков нового заболевания
Все критерии PR достигнуты, за исключением отсутствия снижения ALC периферической крови на ≥50% по сравнению со скринингом.
(6) Стабильное заболевание
Для соответствия критериям SD должны достигаться следующие условия:
Никаких признаков нового заболевания
Нет ни достаточного подтверждения уменьшения массы опухоли, чтобы соответствовать критериям PR, ни достаточного подтверждения роста опухоли, чтобы соответствовать критериям характерного PD.
(7) Прогрессирующее заболевание (PD)
Возникновение любого из следующих событий указывает на явное PD:
Подтверждение какого-либо нового заболевания:
Новый узел размером >15 мм в любом диаметре
у субъекта с нормальным LVD селезенки (т.е. LVD ≤120 мм, как определено методом визуализации) при надире LVD селезенки >140 мм, как определено методом визуализации
у субъекта с нормальным LVD печени (т.е. LVD ≤180 мм, как определено методом визуализации) при надире LVD печени >200 мм, как определено методом визуализации
Новое неиндексное заболевание (например, выпоты, асцит или другие аномалии органов, связанные с CLL/SLL)
Доказательства ухудшения индексных поражений, селезенки или печени, или неиндексного заболевания:
Увеличение от надира на ≥50% от надира SPD индексных поражений
Увеличение от надира на ≥50% LD отдельного узла или экстранодальной массы, которая теперь имеет LD >15 мм и LPD >10 мм
У субъекта с увеличением селезенки при скрининге (>120 мм) ≥50% увеличение селезенки (минимальное увеличение 20 мм) от надира
У субъекта с увеличением печени при скрининге (>180 мм) ≥50% увеличение от скрининга (минимальное увеличение 20 мм) от надира
Однозначное увеличение размера неиндексного заболевания (например, выпоты, асцит или другие аномалии органов, связанные с CLL/SLL)
Переход к более агрессивной гистологии (например, RTL), установленной биопсией лимфатических узлов (при этом дата биопсии лимфатических узлов считается датой прогрессирования CLL/SLL, если у субъекта ранее не было объективного документального подтверждения прогрессирования CLL/SLL)
Снижение количества тромбоцитов или гемоглобина, которое связано с CLL/SLL, не связано с аутоиммунным явлением и подтверждается биопсией костного мозга, показывающей инфильтрат клональных клеток CLL/SLL.
Текущее количество тромбоцитов составляет ≤100 × 109/л, и произошло снижение на 50% по сравнению с исходным уровнем.
Текущий гемоглобин составляет ≤110 г/л (11,0 г/дл), и произошло снижение на >20 г/л (2 г/дл) от исходного уровня.
Лимфома
[0106] Ответы будут классифицироваться как полный ответ без измеримого остаточного заболевания (CRMRD-), полный ответ (CR), очень хорошие частичные ответы (VGPR; только LPL/WM), частичный ответ (PR), неполный ответ (MR; только LPL/WM), стабильное заболевание (SD) или прогрессирующее заболевание (PD). Кроме того, для ситуаций, в которых имеется недостаточная информация для того, чтобы иначе классифицировать состояние ответа, предусмотрена категория неопределяемого ответа (NE).
[0107] Будет определен наилучший общий ответ. Наилучший общий ответ представляет собой наилучший ответ при лечении от скрининга, зафиксированный от начала лечения до PD/рецидива. Скрининговое значение будет взято для сравнения для определения ответа. Значение надира будет взято для сравнения для PD; это значение представляет собой наименьшее зарегистрированное значение, включая скрининговое значение, если это наименьшее значение. Для ФДГ-авидных опухолей метаболические критерии ответа, согласно ПЭТ-КТ, будут иметь приоритет над анатомическими критериями ответа, согласно контрастной КТ, при оценке CR.
(1) Полный Ответ без измеримого остаточного заболевания
Для удовлетворения критериям CRMRD- должны достигаться все следующие условия:
Все критерии для CR удовлетворены
Проточная цитометрия аспирата костного мозга показывает злокачественные клетки ≤1 × 10-4;
(2) Полный ответ
Для удовлетворения критериям для CR должны достигаться все из следующих условий:
Отсутствие признаков новых заболеваний
Регрессия всех индексных нодальных поражений до ≤15 мм в LD
Регрессия до ≤15 мм всех нодальных неиндексных заболеваний
Исчезновение всех обнаруживаемых экстранодальных и неиндексных заболеваний
Нормальный размер селезенки >130 мм при LVD по данным метода визуализации
Если осуществляют ПЭТ, никаких признаков остаточного заболевания - т.е. оценка 1 (отсутствие поглощения выше фона), 2 (поглощение≤средостение) или 3 (поглощение > средостение, но≤печень) по 5-балльной шкале Довиля.
Отрицательный результат на вовлечение костного мозга по данным ПЭТ для ПЭТ-авидной опухоли или согласно морфологической оценке односторонней кор-биопсии; если биопсия костного мозга неопределима по морфологии, она должна быть иммуногистохимически отрицательной
Отсутствие сывороточного М-белка по данным SIFE (у пациентов с LPL/WM).
(3) Очень хороший частичный ответ (только LPL/WM)
Для удовлетворения критериям VGPR должны достигаться все из следующих условий:
Соблюдены все анатомические критерии СR
Документально подтверждено ≥90% снижение концентрации М-белка в сыворотке по сравнению с исходным уровнем.
(4) Частичный Ответ
Для удовлетворения критериям PR должны достигаться все из следующих условий:
Отсутствие признаков нового заболевания
≥50% снижение от скрининга SPD индексных нодальных и экстранодальных поражений
Отсутствие увеличения от надира размера неиндексного заболевания
У субъекта с увеличением селезенки при скрининге ≥50% уменьшение от скрининга (минимальное уменьшение 20 мм) увеличения селезенки в ее самом длинном вертикальном измерении (LVD) или до ≤130 мм согласно визуализации.
Если осуществляли ПЭТ:
Типично ФДГ-авидная лимфома: если не осуществляли скрининговое ПЭТ-сканирование или если ПЭТ-сканирование было положительным до терапии, при лечении ПЭТ положительна в ≥1 ранее вовлеченном участке - т.е. оценка 4 (поглощение умеренно >печень) или оценка 5 (поглощение заметно >печень) по 5-балльной шкале Довиля, но со сниженным поглощением по сравнению со скринингом. Если скрининговую ПЭТ осуществляли и она была отрицательной, нет никаких новых ПЭТ доказательств заболевания. Снижение поглощения определяется как ≥25%снижение %ΔSUVmax.
Вариабельно ФДГ-авидная лимфома/ФДГ-авидность неизвестна: если ПЭТ-сканирование перед лечением не осуществляли или если ПЭТ-сканирование перед лечением было отрицательным на лимфому, то при оценке опухоли во время лечения следует использовать КТ-критерии. Если ПЭТ-сканирование было положительным до начала терапии, ПЭТ при лечении является положительной в ≥1 ранее вовлеченном участке.
Персистентность вовлечения костного мозга у субъекта, отвечающего рентгенологическим критериям для CR ≥50%, но <90% снижение от исходного уровня концентрации М-белка (у субъектов с LPL/WM).
(5) Неполный ответ (только LPL/WM)
Для удовлетворения критериям МР должны достигаться все из следующих условий:
Анатомические критерии заболевания для PR или SD удовлетворены
≥25%, но <50% снижение от исходного уровня концентрации М-белка документально подтверждено.
(6) Стабильное заболевание
Для удовлетворения критериям SD должны достигаться все из следующих условий:
Отсутствие признаков нового заболевания
Нет ни достаточного подтверждения уменьшения массы опухоли, чтобы соответствовать критериям PR, ни достаточного подтверждения роста опухоли, чтобы соответствовать критериям PD
При осуществлении ПЭТ результаты показывают 4 балла (поглощение умеренно > печень) или 5 баллов (поглощение заметно > печень) по 5-балльной шкале Довиля без существенных изменений поглощения по сравнению со скринингом.
<25% снижение и <25% повышение от исходного уровня концентрации М-белка (у субъектов с LPL/WM).
(7) Прогрессирующее заболевание
Возникновение любого из следующих событий указывает на PD:
Наличие какого-либо нового заболевания, которое не присутствовало при скрининге;
Новый узел размером >15 мм в любом диаметре
Повторное появление экстранодального поражения, которое было устранено (т.е. ранее присвоенный PPD 0 мм2)
Новое экстранодальное поражение >10 мм
Новое неиндексное заболевание (например, выпоты, асцит или другие аномалии органов) любого размера, однозначно относящееся к лимфоме (обычно требуется ПЭТ, биопсия, цитологическое или другое нерадиологическое подтверждение для подтверждения заболевания, связанного с лимфомой).
Новые ФДГ-авидные очаги, соответствующие скорее лимфоме, чем другой этиологии (например, инфекция, воспаление). Если существует неопределенность в отношении этиологии новых поражений, может быть рассмотрена биопсия или интервальное сканирование.
Новое или рецидивирующее вовлечение костного мозга в лимфому на основании ПЭТ или биопсии костного мозга, если предыдущая ПЭТ или биопсия костного мозга, осуществленные в рамках исследования, были отрицательными на лимфому.
Признаки ухудшения нодальных или экстранодальных индексных поражений:
Увеличение от надира на ≥50% SPD индексных поражений
Свидетельство ухудшения индивидуальных индексных лимфатических узлов или нодальных масс с увеличением от надира на ≥50% PPD для любого отдельного узла, если узел теперь имеет LD >15 мм, или увеличение на ≥50% от надира PPD или увеличение LD или SDi от надира на:
≥5 мм для поражений размером ≤20 мм (в LD или SDi) или
≥10 мм для поражений размером >20 мм (в LD или SDi)
Однозначное увеличение размера неиндексного заболевания
Повышение увеличения селезенки на ≥50% (минимальное увеличение 20 мм) от надира у пациента с LVD селезенки >130 мм согласно визуализации при надире, или LVD селезенки >150 мм согласно визуализации у пациента с LVD селезенки ≤130 мм согласно визуализации при надире;
Трансформация в более агрессивную гистологию NHL, как установлено биопсией лимфатических узлов.
Если осуществляли ПЭТ, оценка 4 (поглощение умеренно > печень) или оценка 5 (поглощение заметно > печень) по 5-балльной шкале Довиля с увеличением поглощения по сравнению с надиром в сочетании с анатомическим увеличением размера поражения, согласующимся с PD.
Увеличение поглощения определяется как ≥50% увеличение %ΔSUVmax
Увеличение от надира на ≥25% концентрации М-белка в сыворотке (у пациентов с LPL/WM).
Острый лимфоидный лейкоз
[0108] Ответы будут классифицироваться как полный ответ без измеримого остаточного заболевания (CRMRD-), полный ответ (CR), полный ответ с неполным восстановлением форменных элементов крови (CRi) (включая также неподтвержденный полный ответ [CRu] для субъектов с медиастинальным заболеванием), частичный ответ (PR), стабильное заболевание (SD), неэффективность лечения (TF) или рецидив или прогрессирование заболевания (DRP). Кроме того, предусмотрена категория ответа “неопределяемый” (NE) для ситуаций, когда недостаточно информации, чтобы классифицировать статус ответа иным образом.
[0109] Будет определен наилучший общий ответ. Наилучший общий ответ представляет собой наилучший ответ при лечении от начала лечения до DRP. Значение на исходном уровне будет взято для сравнения для определения ответа. Значение надира будет взято для сравнения для DRP; лучшим значением в ходе исследования является значение с наименьшим вовлечением опухоли, включая исходное значение, если оно является значением, соответствующим этому критерию.
(1) Полный ответ без измеримого остаточного заболевания
Для соответствия критериям для CRMRD- должны достигаться все из следующих условий:
Все критерии для CR соблюдены
Проточная цитометрия аспирата костного мозга показывает количество злокачественных клеток ≤1 × 10-4.
(2) Полный ответ
Для соответствия критериям для CR должны достигаться все из следующих условий:
Статус лейкозного заболевания, отвечающий всем следующим требованиям:
о <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и без вовлечения центральной нервной системы [т.е. достижение статуса ЦНС-1 {отсутствие бластов в цереброспинальной жидкости}])
Периферическая кровь, соответствующая всем из следующих требований:
о ANC ≥1,0 × 109/л
о Количество тромбоцитов ≥100 × 109/л
Любое увеличение средостения показывает полную регрессию, как документально подтверждено при помощи радиографии
(3) Полный ответ с неполным восстановлением форменных элементов крови и/или полный ответ не подтвержден
Для соответствия критериям для CRi/CRu должны достигаться все из следующих условий:
Статус лейкозного заболевания, отвечающий всем следующим требованиям:
о <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу и без вовлечения центральной нервной системы [т.е. достижение статуса ЦНС-1 {отсутствие бластов в цереброспинальной жидкости}]).
Периферическая кровь, соответствующая любому из следующих требований:
о ANC <1,0 × 109/л
о Количество тромбоцитов <100 × 109/л
Любое увеличение средостения регрессировало на ≥75% в сумме произведений перпендикулярных диаметров (SPD), как документально подтверждено при помощи радиографии.
(4) Частичный ответ
Для соответствия критериям для PR должны достигаться все из следующих условий:
Статус лейкозного заболевания, соответствующий любому из следующих требований:
о ≥50% уменьшение бластов в костном мозге до 5%-25% (включительно) (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие нового или ухудшения экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу или вовлечение центральной нервной системы [например, статус ЦНС-1 {отсутствие бластов в цереброспинальной жидкости} не перешел в статус ЦНС-2 {WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости} или в статус ЦНС-3 {WBC ≥5 × 109/л с присутствием бластов в цереброспинальной жидкости} или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому)
Периферическая кровь, соответствующая всем из следующих требований:
о ANC ≥1,0 × 109/л
о Количество тромбоцитов ≥100 × 109/л
Любое увеличение средостения регрессировало на ≥50% в SPD, как документально подтверждено при помощи радиографии.
(5) Стабильное заболевание/неэффективность лечения
Для соответствия критериям для SD должны достигаться все из следующих условий:
Нет ни достаточного улучшения ALL от исходного уровня, чтобы соответствовать критериям PR, ни достаточного подтверждения ухудшения ALL, чтобы соответствовать критериям DRP
Отсутствие нового или ухудшения экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу или вовлечение центральной нервной системы [например, статус ЦНС-1 {отсутствие бластов в цереброспинальной жидкости} не перешел в статус ЦНС-2 {WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости} или в статус ЦНС-3 {WBC ≥5 × 109/л с присутствием бластов в цереброспинальной жидкости} или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому)
Отсутствие развития нового увеличения средостения и отсутствие увеличения SPD существующего увеличения средостения на >25%
Субъект без DRP, который не соответствует критериям CRMRD-, CR, CRi/CRu или PR к 18 неделям (для Схем 1 и 2) или 16 неделям (для Схемы 3) от начала исследуемой терапии, будет считаться имеющим TF.
(6) Рецидив или прогрессирование заболевания
Возникновение любого из следующих событий указывает на DRP:
Повторное появление бластов костного мозга (до >5%) у субъекта, испытавшего CR
Повторное появление бластов в периферической крови у субъекта, испытавшего CR
≥25% увеличение бластов в костном мозге до ≥20% (на основе аспирата/биопсии костного мозга с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
≥25% увеличение бластов в периферической крови до >1 × 109/л.
Развитие нового или обострение существующего экстрамедуллярного заболевания (включая лимфаденопатию, спленомегалию, инфильтрацию кожи/десен, тестикулярную массу или вовлечение ЦНС, [например, статус ЦНС-1 {отсутствие бластов в цереброспинальной жидкости} перешел в статус ЦНС-2, {WBC <5 × 109/л с присутствием бластов в цереброспинальной жидкости} или статус ЦНС-3 {WBC 5 × 109/л с присутствием бластов в цереброспинальной жидкости} или к развитию паралича лицевого нерва, поражению головного мозга/глаз или гипоталамическому синдрому)
Развитие нового увеличения средостения или увеличение SPD существующего увеличения средостения на ≥25%
Острый миелоидный лейкоз
[0110] Ответы будут классифицироваться как полный ответ без измеримого остаточного заболевания (CRMRD-), полный ответ (CR), полный ответ с неполным восстановлением форменных элементов крови (CRi), морфологическое состояние без лейкоза (MLFS), частичный ответ (PR), стабильное заболевание (SD), неэффективность лечения (TF) или рецидив или прогрессирование заболевания (DRP). Кроме того, предусмотрена категория ответа “неопределяемый” (NE) для ситуаций, когда недостаточно информации, чтобы классифицировать статус ответа иным образом.
[0111] Будет определен наилучший общий ответ. Наилучший общий ответ представляет собой наилучший ответ при лечении от исходного уровня, зафиксированный от начала лечения до DRP или TF. Исходное состояние будет взято для сравнения для определения ответа. Лучшее измеренное значение в ходе исследования будет взято в качестве эталона для DRP; лучшее измеренное значение в ходе исследования представляет собой измеренное значение с наименьшим вовлечением опухоли, включая исходное значение, если оно соответствует данному критерию.
(1) Полный ответ без измеримого остаточного заболевания
Для соответствия критериям для CRMRD- должны достигаться все из следующих условий:
Все критерии для CR соблюдены
Проточная цитометрия аспирата костного мозга показывает количество злокачественных клеток ≤1 × 10-4.
(2) Полный ответ
Для соответствия критериям для CR должны достигаться все из следующих условий:
Статус лейкозного заболевания, отвечающий всем следующим требованиям:
о <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие бластов с палочками Ауэра
о Отсутствие экстрамедуллярного заболевания
Периферическая кровь, соответствующая обоим из следующих требований:
о ANC ≥1,0 × 109/л
о Количество тромбоцитов ≥100 × 109/л.
(3) Полный ответ с неполным восстановлением форменных элементов крови
Для соответствия критериям для CRi должны достигаться все из следующих условий:
Статус лейкозного заболевания, отвечающий всем следующим требованиям:
о <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие бластов с палочками Ауэра
о Отсутствие экстрамедуллярного заболевания
Периферическая кровь, соответствующая только 1 из следующих критериев:
о ANC ≥1,0 × 109/л
Количество тромбоцитов ≥100 × 109/л.
(4) Морфологическое состояние без лейкоза
Для соответствия критериям для MLFS должны достигаться все из следующих условий:
Статус лейкозного заболевания, отвечающий всем следующим требованиям:
о <5% бластов в костном мозге (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток, ≥10% насыщенности клетками и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие бластов с палочками Ауэра
о Отсутствие экстрамедуллярного заболевания
Периферическая кровь, соответствующая обоим из следующих критериев:
о ANC <1,0 × 109/л
о Количество тромбоцитов <100 × 109/л.
(5) Частичный ответ
Для соответствия критериям для PR должны достигаться все из следующих условий:
Статус лейкозного заболевания, соответствующий любому из следующих требований:
о ≥50% уменьшение бластов в костном мозге до 5%-25% (включительно) (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о <5% бластов в костном мозге, но с присутствующими палочками Ауэра (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге)
о Отсутствие бластов в периферической крови
о Отсутствие нового или ухудшения экстрамедуллярного заболевания
Периферическая кровь, соответствующая обоим из следующих критериев:
о ANC ≥1,0 × 109/л
о Количество тромбоцитов ≥100 × 109/л.
(6) Стабильное заболевание/неэффективность лечения
Для соответствия критериям для SD должны достигаться все из следующих условий:
Нет ни достаточного улучшения AML от исходного уровня, чтобы соответствовать критериям CRMRD-, CR, CRi, MLFS или PR, ни достаточного подтверждения ухудшения AML, чтобы соответствовать критериям DRP
Отсутствие нового или ухудшения экстрамедуллярного заболевания
Субъект без DRP, который не соответствует критериям CRMRD-, CR, CRi, MLFS или PR к 18 неделям (для Схем 1 и 2) или 16 неделям (для Схемы 3) от начала исследуемой терапии, будет считаться имеющим TF.
(7) Рецидив или прогрессирование заболевания
Возникновение любого из следующих событий указывает на DRP:
Повторное появление бластов костного мозга до >5% у субъекта, испытавшего CRMRD-, CR, CRi или MLFS
Повторное появление бластов в периферической крови у субъекта, испытавшего CRMRD-, CR, CRi, MLFS или PR
Абсолютное 20% увеличение бластов в костном мозге до >25% (на основании аспирата костного мозга/образца биопсии с ≥200 ядросодержащих клеток и присутствием спикул в костном мозге) у субъекта, испытавшего PR
Абсолютное 20% увеличение бластов в периферической крови до >25% у субъекта, испытавшего PR
Развитие нового экстрамедуллярного заболевания или ухудшение существующего экстрамедуллярного заболевания
Повторное появление или ухудшение MRD, как определено методом проточной цитометрии, не будет учитываться при определении DRP, но будет зарегистрировано.
Лабораторные и другие оценки
[0112] Образцы, которые должны быть получены, и параметры, которые должны быть проанализированы, показаны в Таблице 4.
Оцениваемые лабораторные и другие параметры
Микроскопия: лейкоциты, эритроциты, эпителиальные клетки, бактерии, цилиндры, кристаллы
Сывороточное антитело к HBsAg, антитело к HBc (или ДНК HBV в сыворотке, определенная методом ПЦР)
Сывороточное антитело к HCV (или РНК HCV в сыворотке, определенная методом ПЦР)
Абсолютное число лейкоцитов, нейтрофилов, лимфоцитов, моноцитов, эозинофилов, базофилов
Количество тромбоцитов
aPTT
о Общее содержание ADC-A, определенное как полный конъюгат антитело-линкер-MMAE (учитывая среднее значение DAR для получения значения общего содержания ADC-A)
о Общее содержание антитела, определенное как общее содержание ADC-A плюс любое антитело, которое не конъюгировано с MMAE
Концентрации MMAE в плазме (определенные валидированным биоаналитическим методом)
Сохранение плазмы для анализов потенциальных метаболитов
Сохранение сыворотки для альтернативного анализа параметров безопасности
Концентрации ROR1 в плазме (измеренные с использованием методов иммуноанализа)
Хемокины и цитокины, потенциально включающие (но не ограничиваясь этим): CCL2, CCL3, CCL4, CCL7, CCL17, CCL19, CCL21, CCL22, CXCL12, CXCL13, CD40 лиганд и TNFα (измеренные с использованием методов иммуноанализа)
Сохранение плазмы для потенциальных дополнительных анализов цитокинов/хемокинов, анализа концентрации ADC-A или альтернативного анализа параметров безопасности
Профилирование уровня мутации опухоли, экспрессии генов и/или экспрессии генов белков (по оценке методом NanoString)
Клетка происхождения (только DLBCL) (по оценке NanoString Lymph2Cx)
Аспират костного мозга для определения статуса MRD (по оценке методом проточной цитометрии)
Аспират костного мозга для анализа статуса заболевания ALL/AML (процент бластов, присутствие палочек Ауэра [AML]) (по оценке методом окрашивания по Райту) и статуса MRD (по оценке методом проточной цитометрии)
Биопсия костного мозга для анализа статуса заболевания гематологическим раком (по оценке методом с использованием гематоксилина и эозина, иммуногистохимией и/или FISH [как потребуется для анализа неопределенного заболевания])
[0113] Классификация тяжести неблагоприятных явлений, применимая в настоящей заявке, описана в Таблица 5 ниже.
Классификация тяжести неблагоприятных явлений
Результаты
I. Безопасность
[0114] Были получены данные от 25 пациентов с гематологическими злокачественными новообразованиями, в том числе 12 субъектов с MCL, 7 субъектов с CLL/SLL, 2 субъекта с DLBCL, 2 субъекта с FL, 1 субъект с MZL и 1 субъект с RTL. Субъекты подвергались интенсивному предварительному лечению в среднем с (диапазон) 4 (1-23) предшествующих схем системной химиотерапии, включая трансплантацию гемопоэтических стволовых клеток (HSCT) у 4 субъектов и терапию на основе химерного антигенного рецептора(CAR)-Т-клеток или природных киллерных клеток (NK) у 3 субъектов.
[0115] Было введено 96 доз ADC-A, в том числе 1 на уровне дозы 0,5 мг/кг, 9 на уровне дозы 1,0 мг/кг, 18 на уровне дозы 1,5 мг/кг, 46 на уровне дозы 2,25 мг/кг и 22 на уровне дозы 2,5 мг/кг. Количество полученных циклов терапии колебалось от 1 до 10. Все субъекты получали ADC-A по схеме введения Q1/3W (Таблица 2).
[0116] Лечение с использованием ADC-A в целом было хорошо переносимо, причем основной острой токсичностью была нейтропения. Никакой DLT при дозах 0,5, 1,0 и 1,5 мг/кг не наблюдалось. DLT, такая как нейтропения 4-й степени, в C1 была отмечена у 1 из 7 субъектов при ADC-A 2,25 мг/кг. Кроме того, у 1 субъекта, получавшего ADC-A 2,25 мг/кг, наблюдалась нейтропения 3-й степени в C1, и 1 субъект, получавший ADC-A 2,25 мг/кг, испытывал нейтропению 4-й степени в С2. В каждом из этих 3 случаев нейтропения наблюдалась примерно в День 15 цикла. Нейтропения была чувствительна к гранулоцитарному колониестимулирующему фактору (G-CSF), вводимому в качестве ответной меры или в качестве вторичной профилактики. Ни нейтропенической лихорадки, ни инфекции не было. У субъекта, начинавшего прием ADC-A в дозе 2,5 мг/кг, наблюдалась тромбоцитопения 4-й степени в C1; однако этот субъект имел историю тромбоцитопении 2-й степени на исходном уровне, ее аномалии тромбоцитов после исходного уровня явно не были связаны с лекарственными препаратами, и она продолжала С2 и С3 терапию при дозе ADC-A 2,5 мг/кг.
[0117] У одного субъекта была невропатия 2-й степени после введения 5 циклов ADC-A при 2,25 мг/кг; лечение было отложено на 1 цикл и терапия была возобновлена при дозе 1,5 мг/кг. Другие нежелательные явления, лабораторные аномалии и результаты ЭКГ были незначительными, не зависели от дозы или экспозиции и, вероятно, были вызваны основным раком, сопутствующими состояниями, интеркуррентными заболеваниями или сопутствующими лекарственными средствами. Никаких инфузионных реакций или синдрома лизиса опухоли не наблюдалось.
II. Фармакокинетика
[0118] Концентрации общего ADC-A и MMAE в плазме в зависимости от времени у 16 пациентов, получавших ADC-A, показаны на Фиг. 1. Среднее значение Tmax наблюдали сразу после окончания инфузии для ADC-A (0,5-2 часа от начала 30-минутной в/в инфузии) и через 48-89 часов после введения дозы для MMAE. Соответствующие фармакокинетические (PK) параметры приведены в Таблице 6.
Фармакокинетические параметры ADC-A
Аббревиатуры: ADC= конъюгат антитело-лекарственное средство, AUClast=площадь под кривой концентрация-время до последней измеримой концентрации, CL=клиренс, Cmax= максимальная концентрация, MMAE= монометил ауристатин E, SD=стандартное отклонение, t1/2=период полужизни, Tmax= время до максимальной концентраци, и Vz=объем распределения.
[0119] Увеличение Cmax и AUC обычно было дозо-пропорциональным для ADC-A и несколько менее дозо-пропорциональным для MMAE. Средние значения t1/2 для ADC-A варьировали от 2,1 до 3,0 дня, независимо от введенной дозы.
[0120] Фармакодинамические данные от пациентов с CLL показали концентрация- и время-зависимую ADC-A-занятость рецепторов ROR1 в циркулирующих клетках CLL (Фиг. 2). Клетки выделяли при помощи Ficoll, окрашивали LIVE/Dead реагентом, а затем окрашивали CD19, CD5, UC961-PE и 4A5 AlexaFlor647. При соответствующих дозах ADC-A 1,0 и 2,25 мг/кг только 22,7% и 12,8% рецепторов ROR1 оставались незанятыми к концу 30-минутной в/в инфузии. Незанятые рецепторы показали время-зависимое возвращение к исходному уровню, что соответствовало одновременному снижению концентрации ADC-A в плазме. При уровне дозы 2,25 мг/кг целевое покрытие, по-видимому, уменьшалось к Дню 8 и терялось к Дню 15, что соответствовало снижению экспозиции ADC в плазме.
[0121] Корреляция незанятых рецепторов ROR1 с концентрациями ADC-A в плазме, как показано на Фиг. 3, позволяет установить целевые значения концентрации в плазме. Поддержание 50% занятости рецепторов (50% незанятых рецепторов) требует концентрации ADC-A в плазме 1,7 мкг/мл. Поддержание 75% занятости рецепторов (25% незанятых рецепторов) требует концентрации ADC-A в плазме 5,8 мкг/мл. Поддержание 90% занятости рецепторов (10% незанятых рецепторов) требует концентрации ADC-A в плазме 35 мкг/мл.
[0122] Было осуществлено фармакокинетическое моделирование для дальнейшего изучения потенциальных схем введения ADC-A. Моделирование показывает, что введение ADC-A раз в неделю может быть более эффективным, чем введение один раз в три недели (Фиг. 4 и Таблица 7). Схема введения раз в неделю может обеспечить более длительную экспозицию ADC-A и целевую занятость ROR1, обеспечивая возможность миелоидного восстановления до следующего цикла лечения, и может быть полезна для индукционного режима (например, Q2/3W или Q3/4W) с последующим поддерживающим режимом с менее частым введением (например, Q1/3W).
Поддержание занятости ROR1 в течение 12 недель
недели
III. Противоопухолевый Ответ
[0123] Противоопухолевую активность наблюдали у пациентов, прошедших предварительное интенсивное лечение MCL (включая три частичных ответа) и DLBCL (включая один частичный ответ) (Фиг. 5) при лечении ADC-A с использованием схемы лечения Q1/3W.
[0124] У одного субъекта с MCL наблюдалось обширное ранее существовавшее заболевание с поражениями неба, шеи, грудной, брюшной и тазовой области. Субъект получал интенсивную предшествующую терапию R-гипер-CVAD с R/метотрексатом/цитарабином, ритуксимабом, ибрутинибом, даратумумабом, леналидомидом-ритуксимабом и лучевой терапией. У субъекта наблюдались признаки объективного ответа опухоли на лечение 2,25 мг/кг ADC-A в течение трех циклов. Все группы с измеряемыми нодальными заболеваниями показали уменьшение размеров опухоли с 53% уменьшением в SPD (сумма произведений перпендикулярных диаметров). Кроме того, поражение неба также уменьшалось в размерах и инфильтрации тканей. Величина ответа, по-видимому, квалифицируется как частичный ответ (PR). У субъекта не наблюдалось признаков какой-либо связанной с лекарственным средством гематологической или негематологической токсичности.
[0125] Другой субъект с MCL демонстрировал как небную массу, так и экстранодальное заболевание и получал интенсивную предшествующую терапию ритуксимабом, ритуксимабом/бортезомибом, R-CHOP (ритуксимаб, циклофосфамид, доксорубицин, винкристин и преднизон), BR (бендамустин и ритуксимаб, R-гипер-CVAD с интратекальной профилактикой, ибрутинибом и мосунетузумабом). Субъект продемонстрировал признаки объективного ответа опухоли на лечение 2,5 мг/кг ADC-A в течение трех циклов. Субъект сообщил, что его активность возросла и усталость в значительной степени исчезла; кроме того, поражение неба уменьшилось в размерах на 85%. Величина ответа, по-видимому, квалифицируется как частичный ответ (PR).
[0126] Еще один субъект с MCL демонстрировал поражение глазницы и экстранодальное заболевание и получал интенсивную предшествующую терапию R-CHOP, ритуксимабом, ибрутиниб-ритуксимабом и ритуксимабом-BEAM (кармустин, цитарабин, этопозид и мелфалан). Субъект продемонстрировал признаки объективного ответа опухоли на лечение 2,5 мг/кг ADC-A в течение шести циклов с 51% уменьшением SPD для опухолевых поражений. Величина ответа, по-видимому, квалифицируется как частичный ответ (PR).
[0127] У одного субъекта с DLBCL наблюдалось экстранодальное заболевание, и он ранее получал интенсивную терапию R-CHOP, R-ESHAP (ритуксимаб, этопозид, метилпреднизолон, цитарабин и цисплатин), R-GEMOX (ритуксимаб, гемцитабин и оксалиплатин), BEAM плюс аутологичный трансплантат, пинатузумаб-ритуксимаб, бендамустин-ритуксимаб и CAR-T-клетки с кондиционированием флударабином. Субъект продемонстрировал объективный ответ опухоли на лечение ADC-A в течение шести циклов (2,25 мг/кг в цикле 1, сниженная доза в цикле 2, 2,25 мг/кг в циклах 3-5 и 2,5 мг/кг в циклах 6 и 7). Обе измеряемые нодальные группы показали уменьшение размеров опухоли с уменьшением SPD на 68%. Величина ответа, по-видимому, квалифицируется как частичный ответ (PR).
[0128] Хотя предпочтительные варианты осуществления настоящего изобретения были показаны и описаны выше, специалистам в данной области техники будет очевидно, что такие варианты осуществления представлены только в качестве примера. Многочисленные вариации, изменения и замены будут очевидны специалистам в данной области без отступления от изобретения. Должно быть понятно, что различные альтернативы вариантам осуществления изобретения, описанным в настоящей заявке, могут быть использованы при практической реализации изобретения.
[0005] Аминокислотные последовательности, описанные в настоящей заявке, представлены в Таблице 8 ниже.
Перечень последовательностей
--->
ПЕРЕЧЕНЬ ПОСЛЕДОВАТЕЛЬНОСТЕЙ
<110> VELOSBIO INC.
<120> ЛЕЧЕНИЕ РАКА ИММУНОКОНЪЮГАТАМИ АНТИТЕЛ К ROR1
<130> 024651.WO003
<140>
<141>
<150> 62/800,187
<151> 2019-02-01
<160> 10
<170> PatentIn version 3.5
<210> 1
<211> 446
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 1
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ala Phe Thr Ala Tyr
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ser Phe Asp Pro Tyr Asp Gly Gly Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val
65 70 75 80
Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Trp Tyr Tyr Phe Asp Tyr Trp Gly His Gly Thr Leu Val
100 105 110
Thr Val Ser Ser Ala Ser Thr Lys Gly Pro Ser Val Phe Pro Leu Ala
115 120 125
Pro Ser Ser Lys Ser Thr Ser Gly Gly Thr Ala Ala Leu Gly Cys Leu
130 135 140
Val Lys Asp Tyr Phe Pro Glu Pro Val Thr Val Ser Trp Asn Ser Gly
145 150 155 160
Ala Leu Thr Ser Gly Val His Thr Phe Pro Ala Val Leu Gln Ser Ser
165 170 175
Gly Leu Tyr Ser Leu Ser Ser Val Val Thr Val Pro Ser Ser Ser Leu
180 185 190
Gly Thr Gln Thr Tyr Ile Cys Asn Val Asn His Lys Pro Ser Asn Thr
195 200 205
Lys Val Asp Lys Lys Val Glu Pro Lys Ser Cys Asp Lys Thr His Thr
210 215 220
Cys Pro Pro Cys Pro Ala Pro Glu Leu Leu Gly Gly Pro Ser Val Phe
225 230 235 240
Leu Phe Pro Pro Lys Pro Lys Asp Thr Leu Met Ile Ser Arg Thr Pro
245 250 255
Glu Val Thr Cys Val Val Val Asp Val Ser His Glu Asp Pro Glu Val
260 265 270
Lys Phe Asn Trp Tyr Val Asp Gly Val Glu Val His Asn Ala Lys Thr
275 280 285
Lys Pro Arg Glu Glu Gln Tyr Asn Ser Thr Tyr Arg Val Val Ser Val
290 295 300
Leu Thr Val Leu His Gln Asp Trp Leu Asn Gly Lys Glu Tyr Lys Cys
305 310 315 320
Lys Val Ser Asn Lys Ala Leu Pro Ala Pro Ile Glu Lys Thr Ile Ser
325 330 335
Lys Ala Lys Gly Gln Pro Arg Glu Pro Gln Val Tyr Thr Leu Pro Pro
340 345 350
Ser Arg Asp Glu Leu Thr Lys Asn Gln Val Ser Leu Thr Cys Leu Val
355 360 365
Lys Gly Phe Tyr Pro Ser Asp Ile Ala Val Glu Trp Glu Ser Asn Gly
370 375 380
Gln Pro Glu Asn Asn Tyr Lys Thr Thr Pro Pro Val Leu Asp Ser Asp
385 390 395 400
Gly Ser Phe Phe Leu Tyr Ser Lys Leu Thr Val Asp Lys Ser Arg Trp
405 410 415
Gln Gln Gly Asn Val Phe Ser Cys Ser Val Met His Glu Ala Leu His
420 425 430
Asn His Tyr Thr Gln Lys Ser Leu Ser Leu Ser Pro Gly Lys
435 440 445
<210> 2
<211> 214
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 2
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Gln His Asp Glu Ser Pro Tyr
85 90 95
Thr Phe Gly Glu Gly Thr Lys Val Glu Ile Lys Arg Thr Val Ala Ala
100 105 110
Pro Ser Val Phe Ile Phe Pro Pro Ser Asp Glu Gln Leu Lys Ser Gly
115 120 125
Thr Ala Ser Val Val Cys Leu Leu Asn Asn Phe Tyr Pro Arg Glu Ala
130 135 140
Lys Val Gln Trp Lys Val Asp Asn Ala Leu Gln Ser Gly Asn Ser Gln
145 150 155 160
Glu Ser Val Thr Glu Gln Asp Ser Lys Asp Ser Thr Tyr Ser Leu Ser
165 170 175
Ser Thr Leu Thr Leu Ser Lys Ala Asp Tyr Glu Lys His Lys Val Tyr
180 185 190
Ala Cys Glu Val Thr His Gln Gly Leu Ser Ser Pro Val Thr Lys Ser
195 200 205
Phe Asn Arg Gly Glu Cys
210
<210> 3
<211> 116
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 3
Gln Val Gln Leu Gln Glu Ser Gly Pro Gly Leu Val Lys Pro Ser Gln
1 5 10 15
Thr Leu Ser Leu Thr Cys Thr Val Ser Gly Tyr Ala Phe Thr Ala Tyr
20 25 30
Asn Ile His Trp Val Arg Gln Ala Pro Gly Gln Gly Leu Glu Trp Met
35 40 45
Gly Ser Phe Asp Pro Tyr Asp Gly Gly Ser Ser Tyr Asn Gln Lys Phe
50 55 60
Lys Asp Arg Leu Thr Ile Ser Lys Asp Thr Ser Lys Asn Gln Val Val
65 70 75 80
Leu Thr Met Thr Asn Met Asp Pro Val Asp Thr Ala Thr Tyr Tyr Cys
85 90 95
Ala Arg Gly Trp Tyr Tyr Phe Asp Tyr Trp Gly His Gly Thr Leu Val
100 105 110
Thr Val Ser Ser
115
<210> 4
<211> 107
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
полипептид"
<400> 4
Asp Ile Val Met Thr Gln Thr Pro Leu Ser Leu Pro Val Thr Pro Gly
1 5 10 15
Glu Pro Ala Ser Ile Ser Cys Arg Ala Ser Lys Ser Ile Ser Lys Tyr
20 25 30
Leu Ala Trp Tyr Gln Gln Lys Pro Gly Gln Ala Pro Arg Leu Leu Ile
35 40 45
Tyr Ser Gly Ser Thr Leu Gln Ser Gly Ile Pro Pro Arg Phe Ser Gly
50 55 60
Ser Gly Tyr Gly Thr Asp Phe Thr Leu Thr Ile Asn Asn Ile Glu Ser
65 70 75 80
Glu Asp Ala Ala Tyr Tyr Phe Cys Gln Gln His Asp Glu Ser Pro Tyr
85 90 95
Thr Phe Gly Glu Gly Thr Lys Val Glu Ile Lys
100 105
<210> 5
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 5
Gly Tyr Ala Phe Thr Ala Tyr Asn
1 5
<210> 6
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 6
Phe Asp Pro Tyr Asp Gly Gly Ser
1 5
<210> 7
<211> 7
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 7
Gly Trp Tyr Tyr Phe Asp Tyr
1 5
<210> 8
<211> 6
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 8
Lys Ser Ile Ser Lys Tyr
1 5
<210> 9
<211> 3
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 9
Ser Gly Ser
1
<210> 10
<211> 8
<212> Белок
<213> Искусственная последовательность
<220>
<221> источник
<223> /примечание="Описание искусственной последовательности: Синтетический
пептид"
<400> 10
Gln Gln His Asp Glu Ser Pro Tyr
1 5
<---
| название | год | авторы | номер документа |
|---|---|---|---|
| СПОСОБЫ ЛЕЧЕНИЯ С ИСПОЛЬЗОВАНИЕМ АНТИ-CD123 ИММУНОКОНЪЮГАТОВ | 2019 |
|
RU2816847C2 |
| ПРИМЕНЕНИЕ ИММУНОКОНЪЮГАТОВ К CEACAM5 ДЛЯ ЛЕЧЕНИЯ РАКА ЛЕГКОГО | 2020 |
|
RU2828374C2 |
| КОМПОЗИЦИИ АНТИТЕЛ К ROR1 И СООТВЕТСТВУЮЩИЕ СПОСОБЫ | 2017 |
|
RU2766190C2 |
| СПОСОБЫ И КОМПОЗИЦИИ ДЛЯ ВВЕДЕНИЯ ДОЗ АЛЛОГЕННЫХ T-КЛЕТОК С ХИМЕРНЫМ АНТИГЕННЫМ РЕЦЕПТОРОМ | 2018 |
|
RU2776322C2 |
| МУЛЬТИСПЕЦИФИЧЕСКИЕ АНТИТЕЛА И СПОСОБЫ ИХ ПОЛУЧЕНИЯ И ПРИМЕНЕНИЯ | 2018 |
|
RU2837770C2 |
| КОНЪЮГАТЫ АНТИТЕЛА К cMet И ЛЕКАРСТВЕННОГО СРЕДСТВА И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2017 |
|
RU2740996C2 |
| ТЕРАПЕВТИЧЕСКИЕ КОМБИНАЦИИ, СОДЕРЖАЩИЕ ИММУНОКОНЪЮГАТЫ АНТИ-CD123 | 2020 |
|
RU2832141C2 |
| СХЕМЫ ПРИМЕНЕНИЯ ИММУНОКОНЪЮГАТА АНТИ-FOLR1 | 2014 |
|
RU2801307C1 |
| КОМБИНИРОВАННАЯ ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ ДЛЯ ЛЕЧЕНИЯ ОПУХОЛИ | 2020 |
|
RU2829637C2 |
| ВОВЛЕКАЮЩИЕ NK МОЛЕКУЛЫ И СПОСОБЫ ИХ ПРИМЕНЕНИЯ | 2019 |
|
RU2812481C2 |
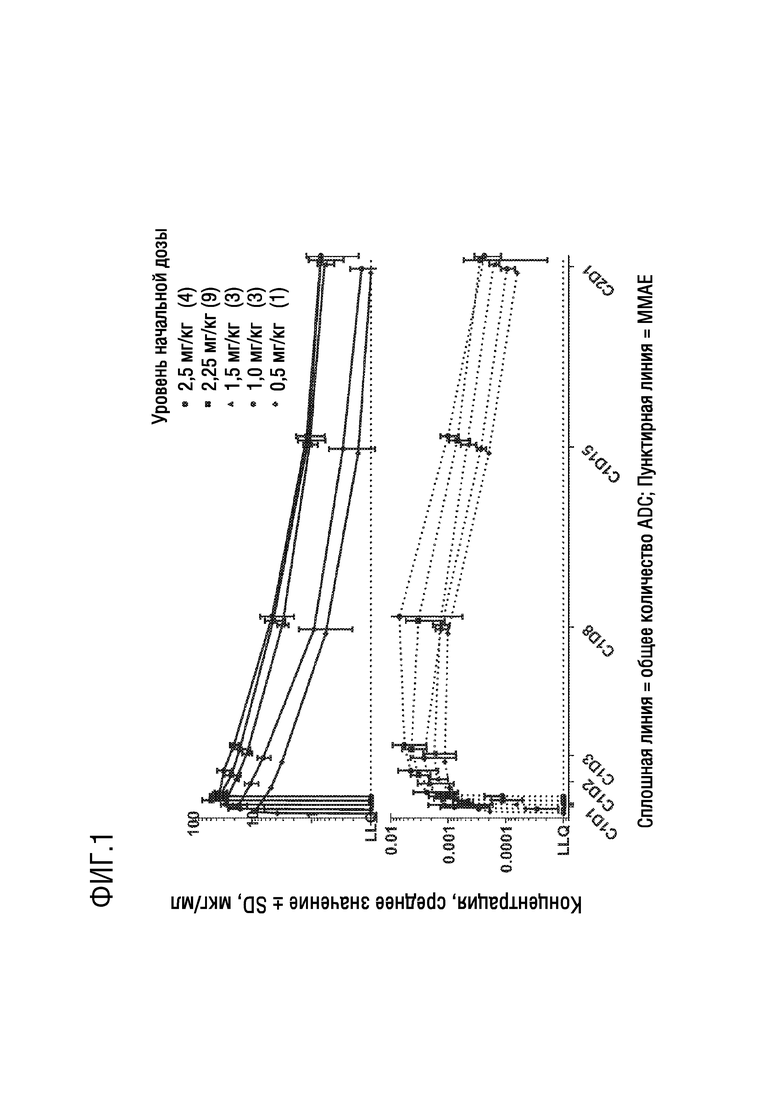
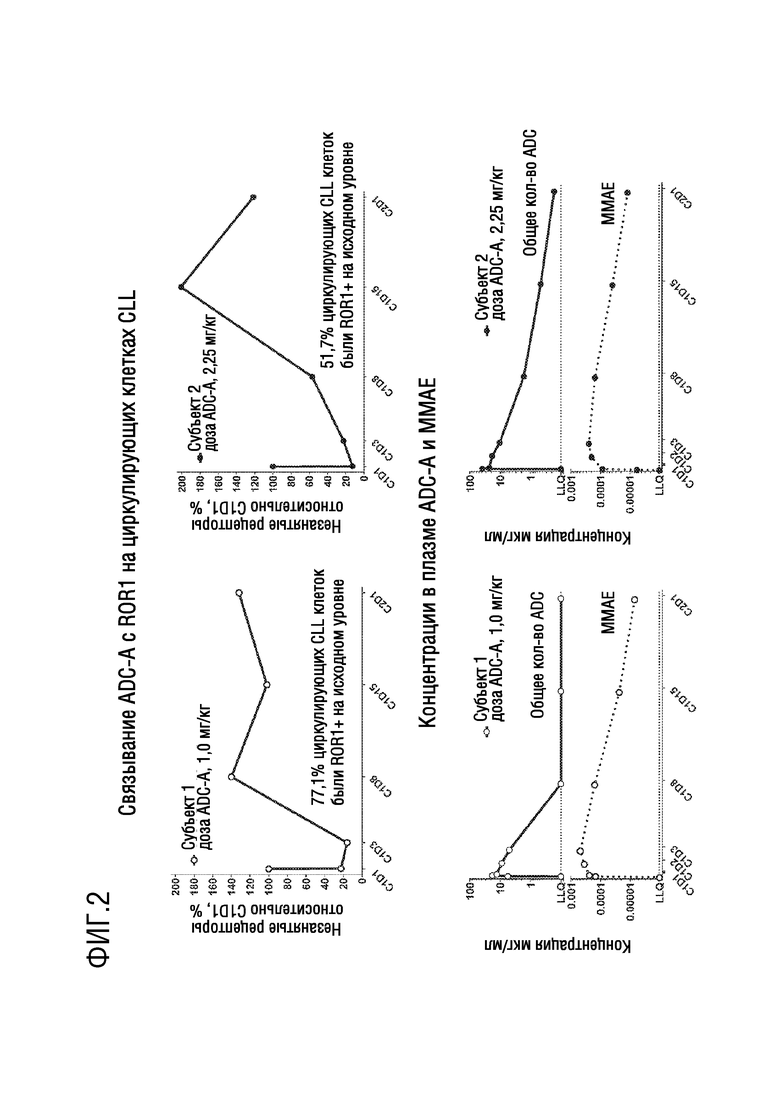
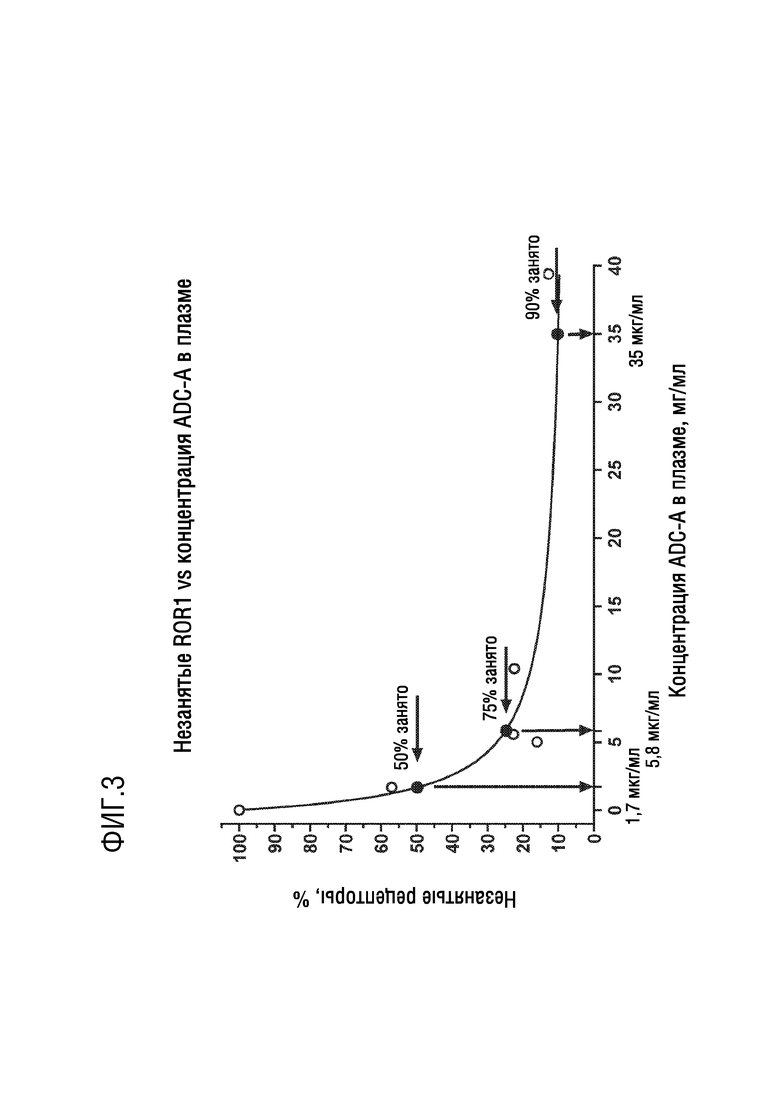
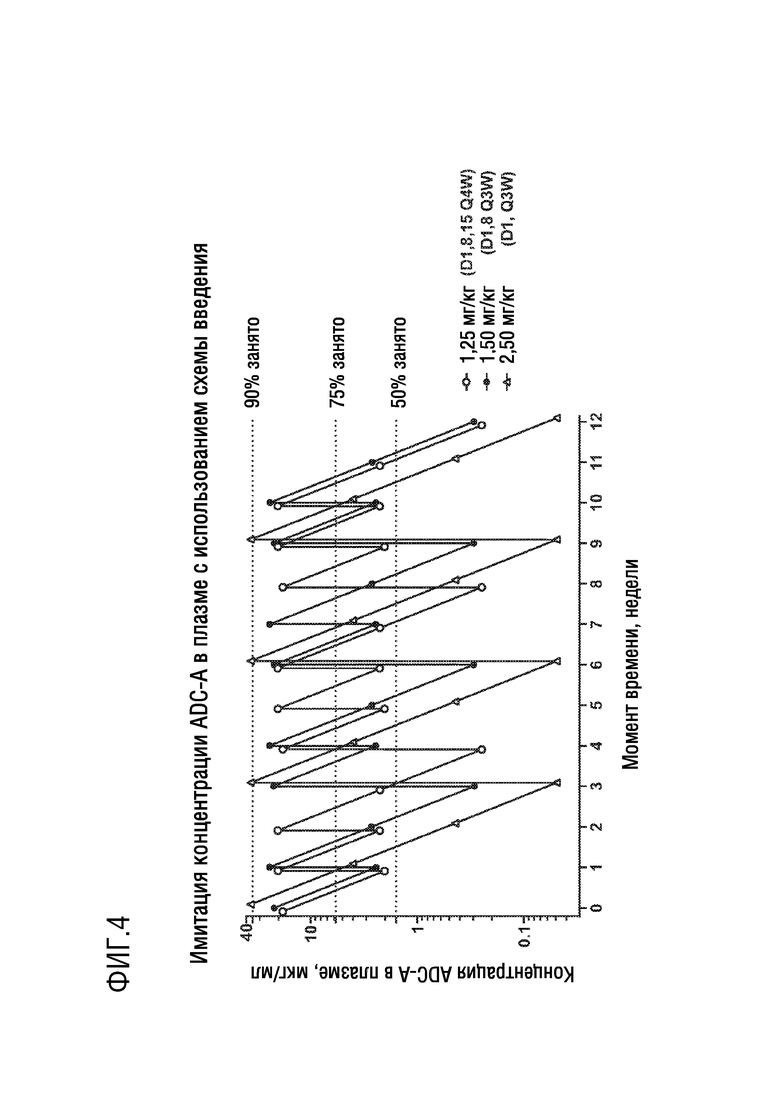
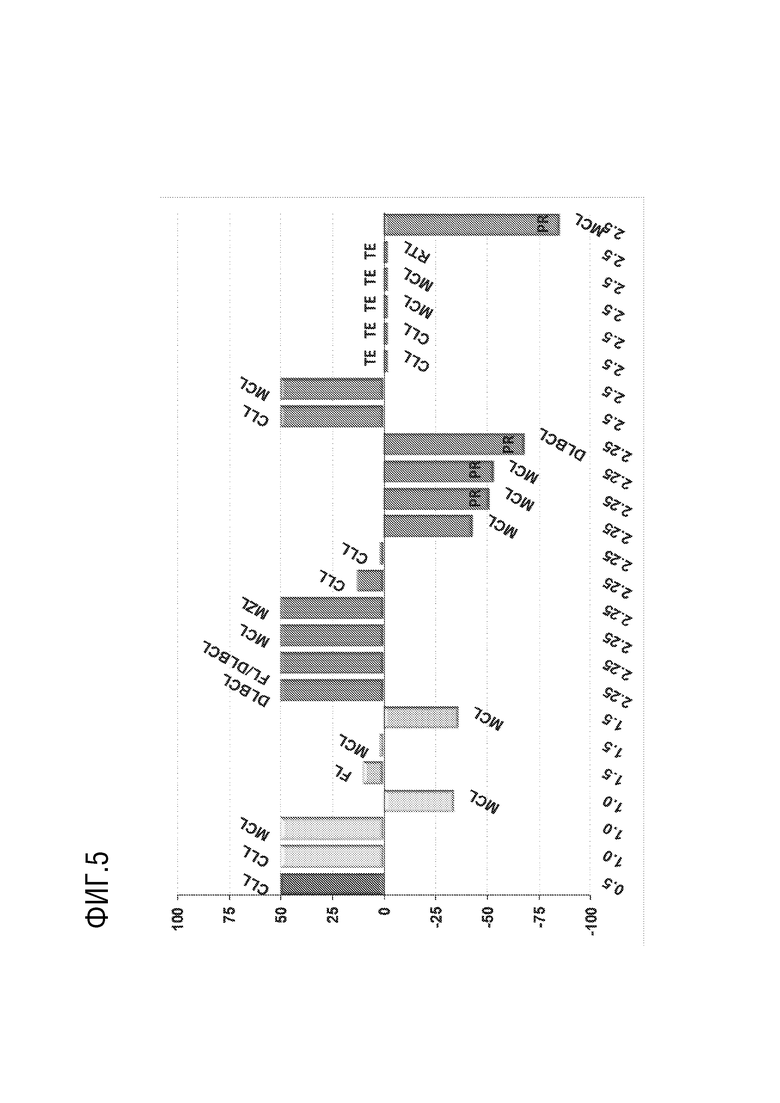
Группа изобретений относится к способу лечения страдающего раком субъекта с использованием иммуноконъюгата, включающего антитело, конъюгированное с лекарственным компонентом, где лекарственный компонент имеет структуру, показанную в Формуле (I) ниже:
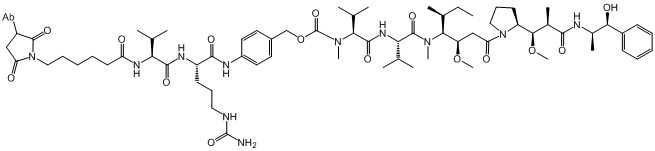 (I), где Ab в Формуле (I) представляет собой антитело и где тяжелая цепь и легкая цепь антитела включают аминокислотные последовательности SEQ ID NO: 1 и 2, соответственно; и при этом иммуноконъюгат вводят субъекту при дозе от 0,25 до 4,00 мг/кг, также относится к иммуноконъюгату для применения в лечении рака у субъекта в способе лечения страдающего раком субъекта и к применению иммуноконъюгата для получения лекарственного средства для лечения рака у субъекта в способе лечения страдающего раком субъекта. Группа изобретений обеспечивает разработку новой терапии пациентов с гематологическими злокачественными заболеваниями и другими злокачественными заболеваниями, которая улучшает результаты для пациентов, включая пациентов, которые не отвечают на существующие терапии, путем таргетирования ROR1. 3 н. и 16 з.п. ф-лы, 5 ил., 8 табл.
(I), где Ab в Формуле (I) представляет собой антитело и где тяжелая цепь и легкая цепь антитела включают аминокислотные последовательности SEQ ID NO: 1 и 2, соответственно; и при этом иммуноконъюгат вводят субъекту при дозе от 0,25 до 4,00 мг/кг, также относится к иммуноконъюгату для применения в лечении рака у субъекта в способе лечения страдающего раком субъекта и к применению иммуноконъюгата для получения лекарственного средства для лечения рака у субъекта в способе лечения страдающего раком субъекта. Группа изобретений обеспечивает разработку новой терапии пациентов с гематологическими злокачественными заболеваниями и другими злокачественными заболеваниями, которая улучшает результаты для пациентов, включая пациентов, которые не отвечают на существующие терапии, путем таргетирования ROR1. 3 н. и 16 з.п. ф-лы, 5 ил., 8 табл.
1. Способ лечения страдающего раком субъекта с использованием иммуноконъюгата, включающего антитело, конъюгированное с лекарственным компонентом, где лекарственный компонент имеет структуру, показанную в Формуле (I) ниже:
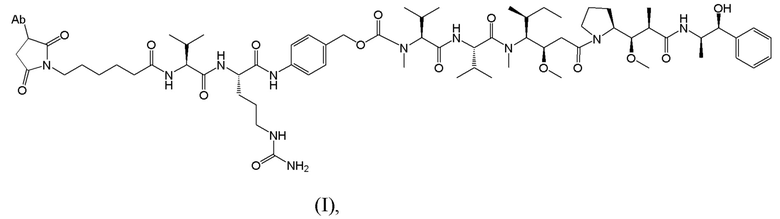
где Ab в Формуле (I) представляет собой антитело и где тяжелая цепь и легкая цепь антитела включают аминокислотные последовательности SEQ ID NO: 1 и 2 соответственно; и
при этом иммуноконъюгат вводят субъекту при дозе от 0,25 до 4,00 мг/кг.
2. Способ по п. 1, где количество лекарственного компонента на антитело (DAR) находится в пределах от 1 до 7.
3. Способ по п. 2, где количество лекарственного компонента на антитело (DAR) находится в пределах от 3 до 5 или от 3 до 6.
4. Способ по любому из пп. 1-3, где доза составляет 0,50, 0,75, 1,00, 1,25, 1,50, 1,75, 2,00, 2,25, 2,50, 2,75 или 3,00 мг/кг.
5. Способ по любому из пп. 1-4, где иммуноконъюгат вводят трехнедельными циклами и вводят в День 1 каждого цикла при указанной дозе.
6. Способ по любому из пп. 1-4, где иммуноконъюгат вводят трехнедельными циклами и вводят в Дни 1 и 8 каждого цикла при указанной дозе.
7. Способ по любому из пп. 1-4, где иммуноконъюгат вводят четырехнедельными циклами и вводят в Дни 1, 8 и 15 каждого цикла при указанной дозе.
8. Способ по любому из пп. 5-7, где количество циклов составляет 3 или больше.
9. Способ по любому из пп. 1-4, где иммуноконъюгат вводят:
a) раз в неделю в течение первых трех недель, а затем раз в три недели;
b) раз в неделю в течение первых четырех недель, а затем раз в три недели;
c) раз в неделю в течение первых шести недель, а затем раз в три недели;
d) раз в неделю в течение первых восьми недель, а затем раз в три недели;
e) раз в три недели в течение первых трех недель, а затем раз в неделю;
f) раз в три недели в течение первых шести недель, а затем раз в неделю; или
g) раз в три недели в течение первых девяти недель, а затем раз в неделю.
10. Способ по любому из пп. 1-9, где иммуноконъюгат вводят внутривенно.
11. Способ по любому из пп. 1-10, где рак представляет собой гематологический рак.
12. Способ по любому из пп. 1-10, где рак представляет собой солидную опухоль.
13. Способ по любому из пп. 1-10, где рак выбран из группы, состоящей из хронического лимфоцитарного лейкоза (CLL), мелкоклеточной лимфоцитарной лимфомы (SLL), мантийноклеточной лимфомы (MCL), фолликулярной лимфомы (FL), лимфомы маргинальной зоны (MZL), диффузной крупноклеточной B-клеточной лимфомы (DLBCL), лимфомы с трансформацией Рихтера (RTL), лимфомы Беркитта (BL), лимфоплазмацитоидной лимфомы (LPL), макроглобулинемии Вальденстрема (WM), T-клеточной неходжкинской лимфомы, острого лимфоцитарного лейкоза (ALL) и острого миелоидного лейкоза (AML).
14. Способ по любому из пп. 1-13, где субъект ранее лечился от рака.
15. Способ по любому из пп. 1-14, где рак является рецидивирующим или рефрактерным к лечению.
16. Способ по любому из пп. 1-15, где лечение иммуноконъюгатом приводит к одному или более из следующих результатов:
a) индуцирует регрессию опухоли;
b) замедляет прогрессирование опухоли;
c) ингибирует метастазы опухоли;
d) предотвращает рецидив рака или остаточное заболевание;
e) уменьшает размер нодальных или экстранодальных опухолевых масс;
f) уменьшает количество злокачественных клеток в костном мозге и периферической крови;
g) уменьшает злокачественную спленомегалию или гепатомегалию;
h) улучшает связанную с раком анемию, нейтропению или тромбоцитопению;
i) уменьшает кожные проявления;
j) снижает вероятность развития синдрома гипервязкости у пациентов с LPL/ВМ;
k) уменьшает инвалидизирующие конституциональные симптомы; и
l) продлевает выживание.
17. Способ по любому из пп. 1-16, где лечение иммуноконъюгатом приводит к полной ликвидации опухоли.
18. Иммуноконъюгат для применения в лечении рака у субъекта в способе по любому из пп. 1-16, где иммуноконъюгат включает антитело, конъюгированное с лекарственным компонентом, где лекарственный компонент имеет структуру, показанную в Формуле (I) ниже:
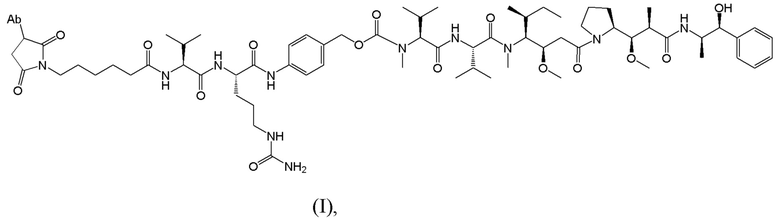
где Ab в Формуле (I) представляет собой антитело и где тяжелая цепь и легкая цепь антитела включают аминокислотные последовательности SEQ ID NO: 1 и 2 соответственно.
19. Применение иммуноконъюгата по п. 18 для получения лекарственного средства для лечения рака у субъекта в способе по любому из пп. 1-17.
| US 2015232569 A1, 20.08.2015 | |||
| Eric L Sievers et al., Antibody-Drug Conjugates in Cancer Therapy / Annual Review of Medicine, 2012, Vol.64, pp.15-29 | |||
| US 2008050310 A1, 28.02.2008. |
Авторы
Даты
2023-05-05—Публикация
2020-02-01—Подача