УРОВЕНЬ ТЕХНИКИ
[01] Хроническое воспаление связано с рядом заболеваний, включая болезнь Альцгеймера, диабет, атеросклероз и злокачественные опухоли. Аутоиммунные заболевания, такие как остеоартрит и болезнь Крона также связаны с хроническим воспалением. Для хронического воспаления может быть характерно присутствие провоспалительных факторов на уровнях выше базовой линии около очага патологии, но во много раз ниже, чем те уровни, которые выявляют при остром воспалении. Примеры этих факторов включают TNF, IL-1α, IL-1β, IL-5, IL-6, IL-8, IL-12, IL-23, CD2, CD3, CD20, CD22, CD52, CD80, CD86, белок комплемента C5, BAFF, APRIL, IgE, интегрин α4β1 и интегрин α4β7. Терапия заболеваний, связанных с хроническим воспалением, включает терапию, которая препятствует действию провоспалительных факторов, например, посредством связывания факторов или связывания с рецепторами для этих факторов.
[02] Важный класс лекарственных средств для лечения хронического воспаления и заболеваний, связанных с хроническим воспалением, включает противовоспалительные антитела. Этот класс лекарственных средств включает не только антитела, но также другие белки, которые связываются с провоспалительными факторами или рецепторами провоспалительных факторов, и включают константную область антитела. Примеры противовоспалительных антител включают абатацепт, алефацепт, алемтузумаб, атацицепт, белимумаб, канакинумаб, экулизумаб, эпратузумаб, натализумаб, окрелизумаб, офатумумаб, омализумаб, отеликсизумаб, ритуксимаб, теплизумаб, ведолизумаб, адалимумаб, бриакинумаб, цертолизумаб пегол, этанерцепт, голимумаб, инфликсимаб, меполизумаб, реслизумаб, тоцилизумаб и устекинумаб.
[03] Стареющими клетками являются клетки в состоянии необратимого блока пролиферации. Старение является четко выраженным состоянием клетки, и связано с биомаркерами, такими как активация p16Ink4a, и экспрессия β-галактозидазы. Стареющие клетки также связаны с секрецией многих факторов, вовлеченных в межклеточную сигнализацию, включая провоспалительные факторы; секрецию этих факторов обозначили термином связанный со старением секреторный фенотип, или SASP.
[04] Конечные продукты усиленного гликозилирования (AGEs; также относится к AGE-модифицированным белки, или конечным продуктам гликозилирования) возникают из неферментативной реакции сахаров с боковыми цепями белков в стареющих клетках (Ando, K. et al., Membrane Proteins of Human Erythrocytes Are Modified by advanced glycation end product during Aging in the Circulation, Biochem Biophys Res Commun., Vol. 258, 123, 125 (1999)). Этот процесс начинается с обратимой реакции между восстанавливающимся сахаром и аминогруппой для образования основания Шиффа, которая переходит к образованию ковалентно связанного продукта перегруппировки Амадори. После образования продукт Амадори претерпевает дополнительную перегруппировку для образования AGEs. Гипергликемия, вызванная сахарным диабетом (DM), и окислительный стресс запускают эту посттрансляционную модификацию мембранных белков (Lindsey JB, et al., «Receptor For Advanced Glycation End-Products (RAGE) and soluble RAGE (sRAGE): Cardiovascular Implications» Diabetes Vascular Disease Research, Vol. 6(1), 7-14, (2009)). AGEs связывали с несколькими патологическими состояниями, включая осложнения диабета, воспаление, ретинопатию, нефропатию, атеросклероз, инсульт, дисфункцию эндотелиальных клеток и нейродегенеративные нарушения (Bierhaus A, «AGEs and their interaction with AGE-рецепторы in vascular disease and diabetes mellitus. I. AGE concept» Cardiovasc Res, Vol. 37(3), 586-600 (1998)).
[05] AGE-модифицированные белки также являются маркером стареющих клеток. Эта связь между конечным продуктом гликозилирования и старением хорошо известна в данной области. См., например, Gruber, L. (WO 2009/143411, 26 ноября 2009), Ando, K. et al. (Membrane Proteins of Human Erythrocytes Are Modified by Advanced glycation End Products during Aging in the Circulation, Biochem Biophys Res Commun., Vol. 258, 123, 125 (1999)), Ahmed, E.K. et al. («Protein Modification and Replicative Senescence of WI-38 Human Embryonic fibroblasts» Aging Cells, vol. 9252260 (2010)), Vlassara, H. et al. (Advanced Glycosylation Endproducts on Erythrocyte Cell surface Induce Receptor-Mediated Phagocytosis by Macrophages, J. Exp. Med., Vol. 166, 539, 545 (1987)) и Vlassara et al. («High-affinity-receptor-mediated Uptake and Degradation of glucose-modified Proteins: A Potential Mechanism for the Removal of Senescent Macromolecules» Proc. Natl. Acad. Sci. USAI, Vol. 82, 5588, 5591 (1985)). Кроме того, Ahmed, E.K. et al. указывает, что конечные продукты гликозилирования являются «одной из главных причин спонтанного повреждения клеточных и внеклеточных белков» (Ahmed, E.K. et al., см. выше, страница 353). Таким образом, накопление конечных продуктов гликозилирования связано со старением и отсутствием функции.
СУЩНОСТЬ
[06] В первом аспекте, настоящее изобретение является композицией для лечения воспаления или аутоиммунных нарушений, содержащей: (i) антитело, которое связывается с AGE-модифицированным белком на клетке, и (ii) противовоспалительное антитело.
[07] Во второмом аспекте, настоящее изобретение является способом лечения воспаления или аутоиммунных нарушений, содержащим введение антитела, которое связывается с AGE-модифицированным белком на клетке.
[08] В третьем аспекте, настоящее изобретение является способом лечения воспаления или аутоиммунных нарушений, содержащим противодействие активности провоспалительного фактора и уничтожение стареющих клеток.
[09] ОПРЕДЕЛЕНИЯ
[10] Термин «конечные продукты усиленного гликозилирования» или «AGE-модифицированный белок» (также обозначаемый как «конечные продукты гликозилирования») относится к модифицированным белкам, которые образованы в результате реакции сахаров с боковыми цепями белков, которые дополнительно перегруппировываются и образуют необратимые перекрестные сшивки. Этот процесс начинается с обратимой реакции между восстанавливающимся сахаром и аминогруппой для образования основания Шиффа, которая переходит в образование ковалентно связанного продукта перегруппировки Амадори. После образования продукт Амадори претерпевает дополнительную перегруппировку для образования AGEs. AGE-модифицированные белки и антитела к AGE-модифицированным белкам были описаны в U.S. 5702704 (Bucala) и U.S. 6380165 (Al-Abed et al.). Эпитопы, обнаруженные на гликозилированных белках, таких как N-дезоксифруктозиллизин, обнаруженные на гликозилированном альбумине, не являются AGEs. Примеры AGEs включают 2-(2-фуроил)-4(5)-(2-фуранил)-1H-имидазол ("FFI"); 5-гидроксиметил-1-алкилпиррол-2-карбальдегид ("Пирралин"); 1-алкил-2-формил-3,4-дигликозил пиррол ("AFGP"), нефлуоресцентную модель AGE; карбоксиметиллизин; и пентозидин. ALI, другой AGE, описан в Al-Abed et al.
[11] «Антитело, которое связывается с AGE-модифицированным белком на клетке» означает антитело или другой белок, который связывается с AGE-модифицированным белком и включает константную область антител, где белок, который был AGE-модифицированным является белком, в норме обнаруживаемым связанным на поверхности клетки, предпочтительно клетки млекопитающего, более предпочтительно клетки человека, кошки, собаки, лошади, верблюдовых (например, верблюда или альпаки), крупного рогатого скота, овцы или козы. AGE-модифицированный альбумин не является AGE-модифицированным белком на клетке, потому что альбумин не является белком, в норме обнаруживаемым связанным на поверхности клеток. «Антитело, которое связывается с AGE-модифицированным белком на клетке» включает только те антитела, которые приводят к удалению, разрушению или смерти клетки. Кроме того, включены антитела, которые конъюгированы, например, с токсином, лекарственным средством или другим химическим веществом или частицей. Предпочтительно, антитела являются моноклональными антителами, но поликлональн антитела также являются возможными.
[12] «Провоспалительный фактор» означает фактор, который стимулирует воспаление. Примеры провоспалительных факторов включают TNF или TNFα, IL-1α, IL-1β, IL-5, IL-6, IL-8, IL-12, IL-23, CD2, CD3, CD20, CD22, CD52, CD80, CD86, белок комплемента С5, BAFF, APRIL, IgE, интегрин α4β1 и интегрин α4β7. Многие из этих факторов и/или их рецепторов могут иметь различную структуру у различных животных. Маленькая буква, предшествующая названию используется для обозначения того, что фактор происходит из различных животных или людей, как следует далее: люди=h, кошки=f, собаки=d, лошади=e, верблюды (или альпака)=c, крупный рогатый скот=b, овца=o, и козы=г; например, hTNF означает TNF человека. Кроме того, буква «R», следующая за названием фактора, представляет рецептор для этого фактора, например, TNF-R является рецептор для TNF человека, или IL-6R является рецептором для IL-6. Эти обозначения можно использовать в комбинации, например, hIL-6R является рецептором для IL-6 человека.
[13] «Противовоспалительное антитело» означает антитело или другой белок, которое связывается с провоспалительным фактором или рецептором провоспалительного фактора, снижает активность фактора или рецептора, и включает константную область антитела. Примеры противовоспалительных антител включают абатацепт, алефацепт, алемтузумаб, атацицепт, белимумаб, канакинумаб, экулизумаб, эпратузумаб, натализумаб, окрелизумаб, офатумумаб, омализумаб, отеликсизумаб, ритуксимаб, теплизумаб, ведолизумаб, адалимумаб, бриакинумаб, цертолизумаб пегол, этанерцепт, голимумаб, инфликсимаб, меполизумаб, реслизумаб, тоцилизумаб и устекинумаб. Предпочтительно, антителами являются моноклональные антитела, но поликлональные антитела также являются возможными.
[14] «Стареющая клетка» означает клетку, которая находится в состоянии необратимого блока пролиферации и экспрессирует один или несколько биомаркеров старения, таких как активация p16Ink4a или экспрессия β-галактозидазы. Кроме того, включены клетки, которые экспрессируют один или несколько биомаркеров старения, не пролиферируют in vivo, но могут пролиферировать in vitro в определенных условиях, такие как некоторые сателлитные клетки, обнаруженные в мышцах ALS пациентов.
ПОДРОБНОЕ ОПИСАНИЕ
[15] Хотя стареющие клетки изучали в течение некоторого времени, in vivo эффекты стареющих клеток были осуществлены только недавно. В одном недавном исследовании Baker, D.J. et al. ("Clearance of p16lnk4a-positive senescent cells delays ageing associated disorders", Nature, vol. 479, pp. 232-236, (2011)), исследовал эффекты клиренса стареющих клеток у мышей. Однако эффект на воспаление и провоспалительные факторы не был отмечен. До настоящей заявки эффекты удаления или уничтожения стареющих клеток на воспаление и провоспалительные факторы, были неизвестны.
[16] Настоящее изобретение основано на признании того, что многие клеточные сети, связанные с воспалением, имеют положительный компонент обратной связи. Поскольку стареющие клетки продуцируют провоспалительные факторы, удаление одних только этих клеток производит глубокое снижение воспаления и количества и концентрации провоспалительных факторов. Это может быть произведено посредством введения антитела, которое связывается с AGE-модифицированным белком на клетке.
[17] Кроме того, посредством объединения снижения активности провоспалительных факторов вместе со снижением числа стареющих клеток, было произведено синергическое действие: снижение воспаления будет больше, чем было бы ожидаемо, на основе эффектов каждого компонента в отдельности. Это может быть произведено, например, посредством введения как противовоспалительного антитела, так и антитела, которое связывается с AGE-модифицированным белком на клетке.
[18] Антитело, которое связывается с AGE-модифицированным белком на клетке (или «антитело к AGE») является известным в данной области. Примеры включают такие, которые описаны в U.S. 5702704 (Bucala) и U.S. 6380165 (Al-Abed et al.). Примеры включают антитело, которое связывается с одним или несколькими AGEs, такими как FFI, пирралин, AFGP, ALI, карбоксиметиллизин и пентозидин. Предпочтительно, антитело связывает карбоксиметиллизин. Предпочтительно, антитело является неиммуногенным для животного, в котором его используют, например, неиммуногенным для людей; одомашненных животных, включая кошек, собак и лошадей; и коммерчески важных животных, таких как верблюды (или альпака), крупный рогатый скот (бык), овца и козы. Более предпочтительно, антитело имеет ту же видоспецифичную константную область, что и антитела животного для уменьшения иммунного ответа против антитела, такого как гуманизированное (для людей), фелинизированное (для кошек), собачьи (для собак), лошадиные (для лошадей), верблюжьи (для верблюдов или альпаки), бычьи (для крупного рогатого скота), овечьи (для овцы) или козьи (для коз). Наиболее предпочтительно, антитело является идентичным антителу животного, у которого оно будет применено (за исключением вариабельной области), такому как антитело человека, антитело кошки, антитело собаки, антитело лошади, антитело верблюда, антитело быка, антитело овцы или антитело козы. Подробности о константных областях и других частях антител для этих животных описаны ниже.
[19] Антитело к AGE имеет низкую скорость диссоциации от комплекса антитело-антиген, или kd (также обозначаемую как kback или скорость диссоциации), предпочтительно не более чем 9 × 10-3, 8 × 10-3, 7 × 10-3 или 6 × 10-3 (сек-1). Антитело к AGE имеет высокую аффинность к AGE-модифицированному белку клетки, что можно выражать в качестве низкой константы диссоциации KD не более чем 9 × 10-6, 8 × 10-6, 7 × 10-6, 6 × 10-6, 5 × 10-6, 4 × 10-6 или 3 × 10-6 (M).
[20] Антитело к AGE может быть конъюгировано с агентом, который вызывает разрушение AGE-модифицированной клетки. Такими агентами могут быть токсин, цитотоксическое средство, магнитные наночастицы и магнитные спин-вортекс диски.
[21] Токсин, такой как порообразующие токсины (PFT) (Aroian R. et al., «Pore-Forming Toxins and Cellular Non-Immune Defenses (CNIDs)," Current Opinion in Microbiology, 10:57-61 (2007)), конъюгированный с антителом к AGE, может быть инъецирован пациенту, чтобы селективным образом достичь и удалить AGE-модифицированные клетки. Антитело к AGE распознает и связывается с AGE-модифицированными клетками. Затем, токсин вызывает порообразование на клеточной поверхности и последующее удаление клетки посредством осмотического лизиса.
[22] Магнитные наночастицы, конъюгированные с антителом к AGE, могут быть инъецированы пациенту, чтообы достичь и удалить AGE-модифицированные клетки. Магнитные наночастицы могут быть нагреты посредством применения магнитного поля, чтобы селективным образом удалить AGE-модифицированные клетки.
[23] В качестве альтернативы, магнитные спин-вортекс диски, которые являются намагниченными только когда магнитное поле применяют, чтобы избежать аутоаггрегации, которая может блокировать кровеносные сосуды, начинают вращаться, когда применяют магнитное поле, вызывая разрыв мембраны клеток-мишеней. Магнитные спин-вортекс диски, конъюгированные с антителами к AGE специфическим образом достигают AGE-модифицированные типы клеток, без удаления других клеток.
[24] Антитела, как правило, содержат две тяжелые цепи и две легкие цепи полипептидов, присоединенные для образования молекулы в форме "Y". Константная область определяет механизм, используемый для воздействия на антиген. Аминокислотная последовательность на верхушках "Y" (вариабельная область) варьирует среди различных антител. Эта вариация придает антителу его специфичность для связывания антигена. Вариабельная область, которая включает концы легкой и тяжелой цепей, дополнительно подразделена на гипервариабельные (HV - также иногда, обозначаемые как определяющие комплементарность области, или CDRs) и каркасные (FR) области. Когда антитела получают рекомбинантным образом, также возможно иметь одно антитело с вариабельными областями (или определяющими комплементарность областями), которые связываются с двумя различными антигенами, при этом каждая верхушка «Y» является специфичной для каждого антигена; их обозначают как биспецифические антитела.
[25] Гуманизированное антитело к AGE по настоящему изобретению может иметь следующую последовательность аминокислот константной области человека:

[26] Антитело к AGE может иметь одну или несколько из следующих областей, определяющих комплементарность:
[27] CDR1H (тяжелая цепь): SYTMGVS
[28] CDR2H (тяжелая цепь): TISSGGGSTYYPDSVKG
[29] CDR3H (тяжелая цепь): QGGWLPPFAX
[30] CDR1 л (легкая цепь): RASKSVSTSSRGYSYMH
[31] CDR2 л (легкая цепь): LVSNLES
[32] CDR3 л (легкая цепь): QHIRELTRS
[33] Противовоспалительные антитела хорошо известны, и многие уже были одобрены для использования у человека. Примеры противовоспалительных антител включают абатацепт, алефацепт, алемтузумаб, атацицепт, белимумаб, канакинумаб, экулизумаб, эпратузумаб, натализумаб, окрелизумаб, офатумумаб, омализумаб, отеликсизумаб, ритуксимаб, теплизумаб, ведолизумаб, адалимумаб, бриакинумаб, цертолизумаб пегол, этанерцепт, голимумаб, инфликсимаб, меполизумаб, реслизумаб, тоцилизумаб и устекинумаб. Предпочтительно, противовоспалительным антителом является антитело, которое связывается с TNF или TNF-R. Любые из выше перечисленных антител можно модифицировать для уменьшения любого возможного иммунного ответа у животного, отличного от человека, замещая ту часть, которая не связывает провоспалительный фактор или рецептор провоспалительного фактора, с помощью константной области антитела, которое происходит от данного животного, такого как константная область антитела кошек, собак, лошадей, верблюдов (или альпак), крупного рогатого скота, овцы или коз. Такие константные области, а также другие части антител этих животных хорошо известны, и некоторые можно найти в следующей работе: YaofengZhao, et al. "The bovine antibody repertoire" Developmental & Comparative Immunology, Vol. 30, Issues 1-2, 2006, Pages 175-186; Wagner B, et al. "the complete map of the Ig heavy chain constant gene region reveals evidence for seven IgG isotypes and for IgD in the horse" J Immunol. 2004 Sep 1;173(5):3230-42; Strietzel CJ, et al. "In Vitro functional characterization of feline IgGs" Vet Immunol Immunopathol. 2014 Apr 15;158(3-4):214-23; Mayuri Patel, et al. "Sequence of the dog immunoglobulin alpha and epsilon constant region genes" Immunogenetics, March 1995, Volume 4 1, Issue 5, pp 282-286; and David R. Maass, e al. "Alpaca (Lama pacos) as a convenient source of recombinant camelid heavy chain antibodies (VHHs)" J Immunol Methods. Jul 31, 2007; 324(1-2): 13-25.
[34] Противовоспалительное антитело имеет низкую скорость диссоциации от комплекса антитело-антиген, или kd (также обозначаемую как kback или скорость диссоциации), предпочтительно не более 9 × 10-3, 8 × 10-3, 7 × 10-3, 6 × 10-3, 5 × 10-3, 4 × 10-3, 3 × 10-3, 2 × 10-3, или 1 × 10-3, (сек-1). Противовоспалительное антитело имеет аффинность для связанного с ним антигена, которая может выражаться в низкой константе диссоциации KD не более 9 × 10-6, 8 × 10-6, 7 × 10-6, 6 × 10-6, 5 × 10-6, 4 × 10-6, 3 × 10-6, 2 × 10-6, 1 × 10-6, 1 × 10-7 или 1 × 10-8 (M).
[35] Примеры таких антител включают примеры из патента США № 6090382, описывающего антитела к TNF. Такие антитела могут иметь одну или несколько из следующих областей:
[36] CDR3L (легкая цепь): Gln Arg Tyr Asn Arg Ala Pro Tyr Xaa, где Xaa является Thr или Ala.
[37] CDR3H (тяжелая цепь): Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Xaa, где Xaa является Tyr или Asn.
[38] Вариабельная область легкой цепи: Asp Ile Gln Met Thr Gln Ser Pro Ser Ser Leu Ser Ala Ser Val Gly Asp Arg Val Thr Ile Thr Cys Arg Ala Ser Gln Gly Ile Arg Asn Tyr Leu Ala Trp Tyr Gln Gln Lys Pro Gly Lys Ala Pro Lys Leu Leu Ile Tyr Ala Ala Ser Thr Leu Gln Ser Gly Val Pro Ser Arg Phe Ser Gly Ser Gly Ser Gly Thr Asp Phe Thr Leu Thr Ile Ser Ser Leu Gln Pro Glu Asp Val Ala Thr Tyr Tyr Cys Gln Arg Tyr Asn Arg Ala Pro Tyr Thr Phe Gly Gln Gly Thr Lys Val Glu Ile Lys.
[39] Вариабельная область тяжелой цепи: Glu Val Gln Leu Val Glu Ser Gly Gly Gly Leu Val Gln Pro Gly Arg Ser Leu Arg Leu Ser Cys Ala Ala Ser Gly Phe Thr Phe Asp Asp Tyr Ala Met His Trp Val Arg Gln Ala Pro Gly Lys Gly Leu Glu Trp Val Ser Ala Ile Thr Trp Asn Ser Gly His Ile Asp Tyr Ala Asp Ser Val Glu Gly Arg Phe Thr Ile Ser Arg Asp Asn Ala Lys Asn Ser Leu Tyr Leu Gln Met Asn Ser Leu Arg Ala Glu Asp Thr Ala Val Tyr Tyr Cys Ala Lys Val Ser Tyr Leu Ser Thr Ala Ser Ser Leu Asp Tyr Trp Gly Gln Gly Thr Leu Val Thr Val Ser Ser.
[40] Также можно использовать биспецифичные антитела, которые являются как антителами к AGE, так и противовоспалительными антителами. Такие антитела имеют вариабельную область (или область, определяющую комплементарность) от антител к AGE, и вариабельную область (или область, определяющую комплементарность) от противовоспалительных антител.
[41] Если требуются дополнительные антитела, их можно получать с помощью хорошо известных способов. Например, поликлональные антитела (pAbs) можно индуцировать у млекопитающего хозяина посредством одной или нескольких инъекций иммуногена, и при желании, адъюванта. Как правило, иммуноген (и адъювант) инъецирован в млекопитающее посредством подкожной или интраперитонеальной инъекции. Иммуноген может быть AGE-модифицированным белком клетки, провоспалительным фактором, рецептором провоспалительного фактора или его фрагментом. Примеры адъювантов включают Полный адъювант Фрейнда, монофосфорил липид A синтетический-трегалоза дикориномиколат, гидроксид алюминия (квасцы), белки теплового шока HSP 70 или HSP96, эмульсия сквалена, содержащая монофосфорил липид A, α2-макроглобулин и поверхностно-активные вещества, включая масляные эмульсии, плюроновые полиолы, полианионы и динитрофенол. Чтобы усилить иммунный ответ, иммуноген может быть конъюгирован с полипептидом, который является иммуногенным в хозяине, таким как гемоцианин морского блюдца (KLH), сывороточный альбумин, бычий тиреоглобулин, холера токсин, лабильный энтеротоксин, частицы диоксида кремния или соевый ингибитор трипсина. Альтернативно, pAbs могут быть сделаны из курицы, продуцирующей IgY молекулы.
[42] Моноклональные антитела (mAbs) могут также быть сделаны посредством иммунизации хозяина или лимфоцитов из хозяина, сбора mAb-секретирующих (или потенциально секретирующих) лимфоцитов, слияния этих лимфоцитов для иммортализации клеток (например, миеломных клеток), и отбора тех клеток, которые секретируют желаемые mAb. Можно использовать другие методы, такие как EBV-гибридомный способ. Методы для образования химерных антител посредством сплайсинга генов, кодирующих вариабельные домены антител, с генами константных доменов иммуноглобулина человека (или другого животного) приводят к образованию "химерных антител", которые по существу являются человеческими (гуманизированными) или по существу «ized» к другому животному (такому как кошка, собака, лошадь, верблюд или альпака, крупный рогатый скот, овца или коза) на аминокислотном уровне. При желании, mAbs можно очищать от среды для культивирования или асцитной жидкости посредством общепринятых процедур, таких как белок A-сефароза, хроматография на гидроксиапатите, электрофорез в геле, диализ, осаждение сульфат аммония или аффинная хроматография. Дополнительно, моноклональные антитела человека можно получать посредством иммунизации трансгенных мышей, содержащих третью копию транс-локуса IgG человека и выключенного эндогенного локуса Ig мыши или с применением трансгенной мыши-человека. Продукция гуманизированных моноклональных антител и их фрагментов также может быть произведена посредством технологии фагового дисплея.
[43] "Фармацевтически приемлемый носитель" включает любой из и все растворители, диспергирующие среды, покрытия, антибактериальные и противогрибковые средства, изотонические и замедляющие абсорбцию агенты, и т.п., в соответствии с фармацевтическим введением. Предпочтительные примеры таких носителей или разбавителей включают воду, физиологический раствор, раствор Рингера и раствор декстрозы. Добавочные активные соединения также могут быть включены в композиции. Растворы и суспензии, применяемые для парентерального введения, могут включать стерильный разбавитель, такой как вода для инъекций, физиологический раствор, полиэтиленгликоли, глицерин, пропиленгликоль или другие синтетические растворители; антибактериальные средства, такие как бензиловый спирт или метил парабены; антиоксиданты, такие как аскорбиновая кислота или бисульфит натрия; буферы, такие как ацетаты, цитраты или фосфаты, и агенты для корректировки тоничности, такие как хлорид натрия или декстроза. pH может быть скорректирован с применением кислот или оснований, таких как соляная кислота или гидроксид натрия. Парентеральный препарат может быть заключен в ампулы, одноразовые шприцы или флаконы для многократных доз, сделанные из стекла или пластика.
[44] Фармацевтические композиции, подходящие для инъекций, включают стерильные водные растворы или дисперсии для экстемпорального получения стерильных инъецируемых растворов или дисперсии. Для внутривенного введения подходящие носители включают физиологический раствор, бактериостатическую воду, CREMOPHOR EL® (BASF; Parsippany, NJ) или фосфатно-солевой буфер (PBS). Во всех случаях, композиция должна быть стерильной и должна быть жидкой для введения с применением шприца. Такие композиции должны быть стабильными во время производства и хранения и должны быть защищены от контаминации микроорганизмами, такими как бактерии и грибы. Различные антибактериальные и антигрибковые средства, например, парабены, хлорбутанол, фенол, аскорбиновая кислота и тимеросал, могут быть контаминированы микроорганизмами. Средства придания изотоничности, такие как сахара, полиспирты, такие как манитол, сорбит и хлорид натрия, могут быть включены в композицию. Композиции, которые могут замедлять абсорбцию, включают агенты, такие как моностеарат алюминия и желатин. Стерильные инъецируемые растворы можно получать посредством включения антител, и необязательно других терапевтических компонентов, в требуемом количестве в подходящем растворителе с одним или комбинацией ингредиентов при необходимости, с последующей стерилизацией. Способы получения стерильных твердых веществ для получения стерильных инъецируемых растворов включают вакуумную сушку и лиофилизацию до твердого состояния.
[45] Для введение посредством ингаляции антитела доставляют в виде аэрозольного спрея для небулайзера или контейнера под давлением, который содержит подходящий пропеллент, например, газ, такой как диоксид углерода. Антитела могут также быть доставлены посредством ингаляции в виде сухого порошка, например, с применением системы для доставки ингаляционного лекарственного средства iSPERSETM (PULMATRIX, Lexington, Mass.). Применение антител курицы (IgY) может быть неиммуногенным у ряда животных, включая людей, при введении посредством ингаляции.
[46] Соответствующий уровень дозирования каждого типа антител, как правило, составляет приблизительно от 0,01 до 500 мг на кг массы тела пациента. Предпочтительно, уровень дозирования составляет приблизительно от 0,1 до приблизительно 250 мг/кг; более предпочтительно приблизительно от 0,5 до приблизительно 100 мг/кг. Подходящий уровень дозирования может составлять приблизительно от 0,01 до 250 мг/кг, приблизительно от 0,05 до 100 мг/кг, или приблизительно от 0,1 до 50 мг/кг. В пределах этого диапазона дозировка может составлять от 0,05 до 0,5, от 0,5 до 5 или от 5 до 50 мг/кг. Хотя каждый тип антител можно вводить по схеме лечения от 1 до 4 раз в сутки, например, один или два раза в сутки, антитела, как правило, имеют долгое время полужизни in vivo. Таким образом, каждый тип антител можно вводить один раз в сутки, один раз в неделю, один раз каждые две или три недели, один раз в месяц, или один раз каждые 60 до 90 суток.
[47] Чтобы определить эффективность лечения с применением антитела, которое связывается с AGE-модифицированным белком на клетке, или в отдельности или в комбинации с противовоспалительным антителом, или в комбинации с многочисленными противовоспалительными антителами, или в комбинации с другими противовоспалительными агентами (например, NSAIDS и/или стероидами), можно использовать наблюдение пациента или различные анализы. Например, облегчение симптомов воспаления или аутоиммунных нарушений можно наблюдать у пациента (например, снижение красноты кожи); анализы крови на предмет различных провоспалительных факторов (таких как TNF), которые демонстрируют снижение уровней по сравнению с такими уровнями до лечения; и анализы на предмет различных провоспалительных факторов (таких как TNF) в биопсиях ткани, взятых из или около очага воспаления, которые демонстрируют снижение уровней по сравнению с такими уровнями до лечения.
[48] Для облегчения введения и единообразия дозирования могут быть созданы стандартные лекарственные формы. Стандартная лекарственная форма относится к физически дискретным единицам, подходящим в качестве единичных дозировок для индивидуумов, подлежащих лечению, содержащим терапевтически эффективное количество одного или нескольких типов антител в связи с требуемым фармацевтическим носителем. Предпочтительно, стандартная лекарственная форма находится в герметичном контейнере и является стерильной.
[49] ПРИМЕРЫ
[50] Пример 1: In vivo исследование введения антитела к конечному продукту гликозилирования
[51] Для исследования эффектов антитела к конечному продукту гликозилирования антитело вводили в состарившуюся CD1(ICR) мышь (Charles River Laboratories), дважды в день посредством внутривенной инъекции, один раз в неделю, в течение трех недель (сутки 1, 8 и 15), с последующим периодом без лечения в течение 10 недель. Тестируемое антитело представляло собой коммерчески доступное антитело мыши к конечному продукту гликозилирования, индуцированное против карбоксиметил лизина, распространенного AGE эпитопа, конъюгированного с гемоцианином морского блюдца. У контрольных животных применяли физиологический раствор в качестве контрольного стандарта.
[52] Возраст мышей, относимых к «молодым» составлял 8 недель, в то время как возраст мышей, обозначаемых как «старые» составлял 88 недель (±2 суток). Никаких неблагоприятных явлений от введения антитела не было отмечено. Различные группы животных, используемых в исследовании, продемонстрированы в таблице 1.
[53] Таблица 1
-=не применимо, Pre=подгруппа животных, подвергнутых эвтаназии до начала лечения для сбора коллекции жировой ткани.
[54] P16INK4a мРНК, маркер стареющих клеток, количественно определяли в жировой ткани групп посредством qPCR в реальном времени. Результаты продемонстрированы в таблице 2. В таблице ΔΔCt=ΔCt означает контрольную группу (2) -ΔCt означает экспериментальную группу (1 или 3 или 5); кратность экспрессии= 2 -ΔΔCt.
[55] Таблица 2
[56] Таблица выше указывает, что не получавшие лечения старые мыши (контрольная группа 2) экспрессируют в 2,55 раз больше p16Ink4a мРНК, чем не получавшие лечения молодые мыши (контрольная группа 1), как и ожидалось. Это наблюдали при сравнении группы 2 не получавших лечение старых мышей, подвергнутых эвтаназии в конце восстановления на 85 сутки, с группой 1 не получавших лечение молодых мышей, подвергнутых эвтаназии в конце лечения на 22 сутки. Когда результаты от группы 2 не получавших лечение старых мышей сравнивали с результатами от группы 3 получавших лечение старых мышей, подвергнутых эвтаназии на сутки 85, наблюдали, что p16Ink4a мРНК было в 1,23 раза больше в группе 2, чем в группе 3. Таким образом, уровень экспрессии p16Ink4a мРНК был ниже, когда старых мышей обрабатывали с применением 2,5 мкг/г/BID/неделя антитела.
[57] Когда результаты от группы 2 (контроль) не получавших лечение старых мышей сравнивали с результатами от группы 5 (5 мкг/г) получавших лечение старых мышей, подвергнутых эвтаназии на 22 сутки, то наблюдали, что p16Ink4a мРНК было в 3,03 раз выше в группе 2 (контроли), чем в группе 5 (5 мкг/г). Это сравнение указывало на то, что животные группы 5 имели более низкие уровни экспрессии p16Ink4a мРНК, когда они получали 5,0 мкг/г/BID/неделя, что приводило к уровням экспрессии p16Ink4a мРНК, сравнимой с уровнями экспрессии у молодых не получавших лечение мышей (т.е. группа 1). В отличие от группы 3 (2,5 мкг/г) мыше, которых подвергали эвтаназии в конце восстановления на 85 сутки, группу 5 мышей подвергали эвтаназии в конце лечения на 22 сутки.
[58] Эти результаты указывают на то, что введение антител приводило к уничтожению стареющих клеток.
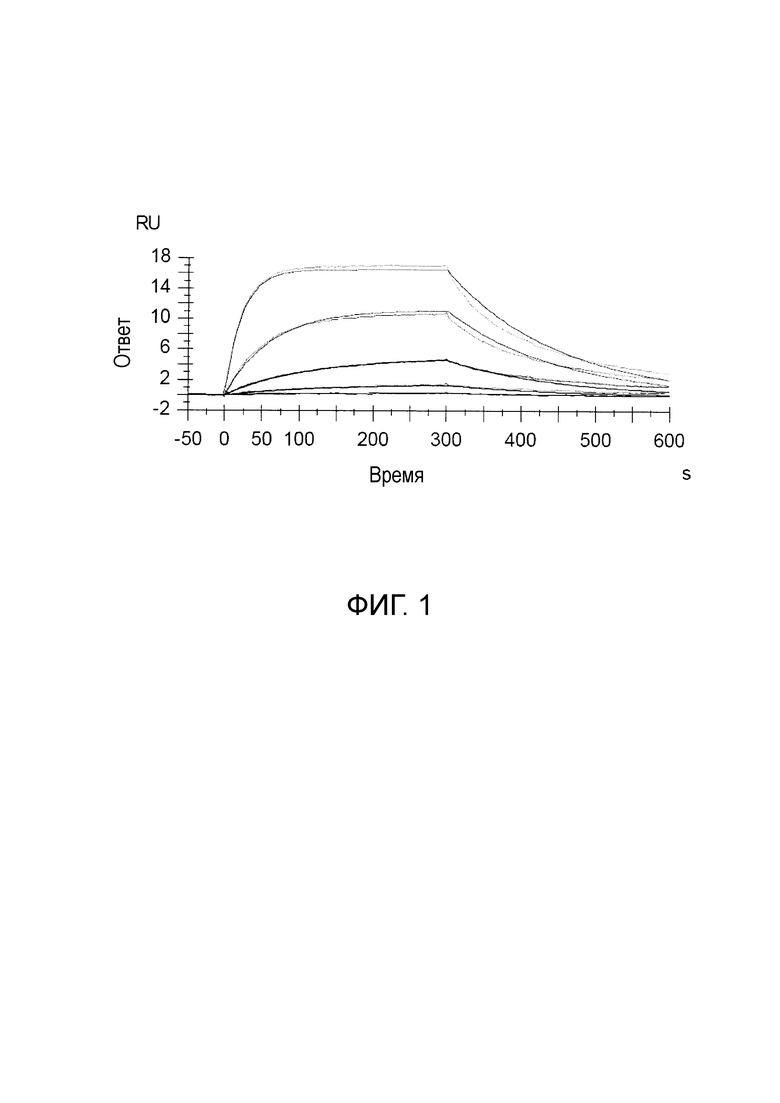
[59] Пример 2: Аффинность и кинетика тестируемого антитела
[60] Аффинность и кинетику тестируемого антитела, применяемого в примере 1, анализировали с применением Na,Na-бис(карбоксиметил)-L-лизин трифторацетатной соли (Sigma-Aldrich, St. Louis, MO) в качестве модели субстрата для AGE-модифицированного белка клетки. Анализ взаимодействия без использования меток проводили на BIACORETM T200 (GE Healthcare, Pittsburgh, PA), с применением сенсорного чипа Series S CM5 (GE Healthcare, Pittsburgh, PA), с набором Fc1 в качестве контроля, и Fc2 иммобилизованного с применением тестируемого антитела (молекулярный вес 150,000 Да). Подвижным буфером был HBS-EP буфер (10 мМ HEPES, 150 мМ NaCl, 3 мМ ЭДТА и 0,05% P-20, pH of 7,4), при температуре 25 °C. Программным обеспечением было программное обеспечение BIACORETM T200, версия 2.0. Двойной контроль (Fc2-1 и только буфер для инъекции) применяли в анализе, и данные, приспособленные для модели связывания Langmuir 1:1.
[61] Таблица 3: Постановка эксперимента анализа аффинности и кинетики
[62] График ответ против времени проиллюстрирован на фиг. 1. Следующие величины определяли из анализа: ka (1/Ms)=1,857 × 103; kd (1/s)=6,781 × 10-3; KD (M)=3,651 × 10-6; Rmax (РЕ)=19,52; и Chi2=0,114. Потому что Chi2 значение подбора составляло менее чем 10% от Rmax, сглаживание является надежным.
[63] Пример 3 (предсказательный): In vivo исследование введения антитела к конечному продукту гликозилирования и антитела мыши к TNF мыши в модели ревматоидного артрита на основе мыши с антиген-индуцированным артритом (AIA)
[64] Для изучения эффектов антитела к конечному продукту гликозилирования и антитела мыши к TNF мыши на ревматоидный артрит (классическое воспалительное заболевание, которое также является аутоиммунным нарушением), оба антитела одновременно вводят CD1(ICR) мыши, которая предварительно получала лечение с применением метилированного бычьего сывороточного альбумина, сначала посредством систематической инъекции, а затем инъекции в сустав для создания AIA мышей. Введение комбинации антитела к конечному продукту гликозилирования и антитела к TNF проводят посредством внутривенной инъекции дважды в день, один раз неделю, в течение 3 недель (сутки 1, 8 и 15). Антитело к конечному продукту гликозилирования является коммерчески доступным антителом мыши к конечному продукту гликозилирования, индуцированным против карбоксиметил лизина, распространенного AGE эпитопа, конъюгированного с гемоцианином морского блюдца. Контрольный стандарт в виде физиологического раствора применяют у первых контрольных животных, второй экспериментальной группе вводят только антитело к конечному продукту гликозилирования, и второй контрольный стандарт в виде только антитела к TNF применяют у вторых контрольных животных. Для каждого антитела применяют уровни дозирования 5 мкг/г/BID/неделя.
[65] Во время курса исследования животных наблюдают, и кровь забирают, чтобы определить уровни TNF. В конце исследования животных подвергают эвтаназии, и ткань сустава исследуют на предмет признаков повреждения, связанного с ревматоидным артритом. Результаты указывают на то, что вторая экспериментальная группа и вторая контрольная группа демонстрируют меньшее повреждение сустава и более низкие уровни TNF, чем первая контрольная группа. Кроме того, первая экспериментальная группа не только демонстрирует, по меньшей мере, повреждение сустава и наиболее низкий уровень TNF из всех исследованных групп, но снижение как повреждения суставов, так и уровней TNF является большим, чем ожидалось на основе только второй экспериментальной группы и второй контрольной группы. Результаты демонстрируют противовоспалительные эффекты антител к конечному продукту гликозилирования, а также синергическое действие применения и антитела к конечному продукту гликозилирования, и противовоспалительного антитела.
[66] ССЫЛКИ:
[67] 1. Ando K, et al., "Membrane Proteins of Human Erythrocytes Are Modified by Advanced Glycation End Products During Aging in the Circulation," Biochemical and Biophysical Research Communications, Vol. 258, 123-27 (1999).
[68] 2. Lindsey JB, et al., "Receptor For Advanced Glycation End-Products (RAGE) and soluble RAGE (sRAGE): Cardiovascular Implications," Diabetes Vascular Disease Research, Vol. 6(1), 7-14, (2009).
[69] 3. Bierhaus A, "AGEs and their interaction with AGE-receptors in vascular disease and diabetes mellitus. I. The AGE concept," Cardiovasc Res, Vol. 37(3), 586-600 (1998).
[70] 4. Meuter A., et al. "Markers of cellular senescence are elevated in murine blastocysts cultured in vitro: molecular consequences of culture in atmospheric oxygen" J Assist Reprod Genet. 2014 Aug 10. [Epub ahead of print].
[71] 5. A. Freund "Inflammatory networks during cellular senescence: causes and consequences" Trends Mol Med. 2010 May;16(5):238-46.
[72] 6. Baker, D.J. et al., "Clearance of p16lnk4a-positive senescent cells delays ageing-associated disorders", Nature, vol. 479, pp. 232-236, (2011).
[73] 7. Jana Hadrabova, et al. "Chicken immunoglobulins for prophylaxis: Effect of inhaled antibodies on inflammatory parameters in rat airways" Journal of Applied Biomedicine (in press; Available online 5 May 20 4).
[74] 8. Gianfranco Ferraccioli, er al. "Interleukin- and lnterleukin-6 in Arthritis Animal Models: Roles in the Early Phase of Transition from Acute to Chronic Inflammation and Relevance for Human Rheumatoid Arthritis" Mol Med. 2010 Nov-Dec; 16(1 1-12): 552-557.
Группа изобретений относится к медицине и касается композиции для лечения воспаления или лечения аутоиммунных нарушений, содержащей антитело, которое связывается с AGE-модифицированным белком на клетке, и противовоспалительное антитело. Группа изобретений также касается способа лечения воспаления или аутоиммунных нарушений, содержащего введение антитела, которое связывается с AGE-модифицированным белком на клетке, где указанное лечение включает уничтожение стареющих клеток. Группа изобретений обеспечивает лечение воспаления и аутоиммунных нарушений. 4 н. и 22 з.п. ф-лы, 1 ил., 3 табл., 3 пр.
1. Композиция для лечения воспаления, содержащая:
(i) антитело, которое связывается с AGE-модифицированным белком на клетке, и
(ii) противовоспалительное антитело.
2. Композиция для лечения аутоиммунных нарушений, содержащая:
(i) антитело, которое связывается с AGE-модифицированным белком на клетке, и
(ii) противовоспалительное антитело.
3. Композиция по п. 1 или 2, где противовоспалительное антитело связывается с цитокином, связанным с воспалением.
4. Композиция по п. 1 или 2, где противовоспалительное антитело связывается с по меньшей мере одним членом, выбранным из группы, состоящей из TNF, IL-1α, IL-1β, IL-5, IL-6, IL-8, IL-12, IL-23, CD2, CD3, CD20, CD22, CD52, CD80, CD86, белка комплемента С5, BAFF, APRIL, IgE, интегрина α4β1 и интегрина α4β7.
5. Композиция по любому из пп. 1 или 2, где противовоспалительное антитело является по меньшей мере одним членом, выбранным из группы, состоящей из абатацепта, алефацепта, алемтузумаба, атацицепта, белимумаба, канакинумаба, экулизумаба, эпратузумаба, натализумаба, окрелизумаба, офатумумаба, омализумаба, отеликсизумаба, ритуксимаба, теплизумаба, ведолизумаба, адалимумаба, бриакинумаба, цертолизумаб пегола, этанерцепта, голимумаба, инфликсимаба, меполизумаба, реслизумаба, тоцилизумаба и устекинумаба.
6. Композиция по любому из пп. 1 или 2, где противовоспалительное антитело связывается с TNF.
7. Композиция по любому из пп. 1 или 2, где антитело, которое связывается с AGE-модифицированным белком на клетке, является по меньшей мере одним членом, выбранным из группы, состоящей из антител, которые связываются с FFI, пирралином, AFGP, ALI, карбоксиметиллизином и пентозидином.
8. Композиция по любому из пп. 1 или 2, где антитело, которое связывается с AGE-модифицированным белком на клетке, является антителом, которое связывается с карбоксиметиллизином.
9. Композиция по любому из пп. 1 или 2, где:
антитело, которое связывается с AGE-модифицированным белком на клетке, является антителом человека, и
противовоспалительное антитело является антителом человека.
10. Композиция по любому из пп. 1 или 2, дополнительно содержащая фармацевтический носитель.
11. Композиция по любому из пп. 1 или 2, где композиция находится в стандартной лекарственной форме.
12. Композиция по любому из пп. 1 или 2, где антитело, которое связывается с AGE-модифицированным белком на клетке, представляет собой конъюгированное антитело.
13. Композиция по п. 12, где конъюгированное антитело является антителом, которое связывается с AGE-модифицированным белком на клетке, конъюгированным с членом, выбранным из группы, состоящей из токсина, цитотоксического средства, магнитных наночастиц и магнитных спин-вортексных дисков.
14. Композиция по любому из пп. 1 или 2, где противовоспалительное антитело является моноклональным антителом, и антитело, которое связывается с AGE-модифицированным белком на клетке, является моноклональным антителом.
15. Композиция по любому из пп. 1 или 2, где противовоспалительное антитело и антитело, которое связывается с AGE-модифицированным белком на клетке, оба являются антителами, которые являются неиммуногенными к видам, выбранным из группы, состоящей из людей, кошек, собак, лошадей, верблюдов, альпак, крупного рогатого скота, овец и коз.
16. Способ лечения воспаления, содержащий введение антитела, которое связывается с AGE-модифицированным белком на клетке, где указанное лечение включает уничтожение стареющих клеток.
17. Способ лечения аутоиммунных нарушений, содержащий введение антитела, которое связывается с AGE-модифицированным белком на клетке, где указанное лечение включает уничтожение стареющих клеток.
18. Способ по п. 16 или 17, дополнительно содержащий введение противовоспалительного антитела.
19. Способ по п. 18, где противовоспалительное антитело связывается с цитокином, связанным с воспалением.
20. Способ по п. 18, где противовоспалительное антитело связывается с по меньшей мере одним членом, выбранным из группы, состоящей из TNF, IL-1α, IL-1β, IL-5, IL-6, IL-8, IL-12, IL-23, CD2, CD3, CD20, CD22, CD52, CD80, CD86, белка комплемента С5, BAFF, APRIL, IgE, интегрина α4β1 и интегрина α4β7.
21. Способ по п. 18, где противовоспалительное антитело является по меньшей мере одним членом, выбранным из группы, состоящей из абатацепта, алефацепта, алемтузумаба, атацицепта, белимумаба, канакинумаба, экулизумаба, эпратузумаба, натализумаба, окрелизумаба, офатумумаба, омализумаба, отеликсизумаба, ритуксимаба, теплизумаба, ведолизумаба, адалимумаба, бриакинумаба, цертолизумаб пегола, этанерцепта, голимумаба, инфликсимаба, меполизумаба, реслизумаба, тоцилизумаба и устекинумаба.
22. Способ по п. 18, где противовоспалительное антитело связывается с TNF.
23. Способ по любому из пп. 16 или 17, где антитело, которое связывается с AGE-модифицированным белком на клетке, является по меньшей мере одним членом, выбранным из группы, состоящей из антител, которые связываются с FFI, пирралином, AFGP, ALI, карбоксиметиллизином и пентозидином.
24. Способ по любому из пп. 16 или 17, где антитело, которое связывается с AGE-модифицированным белком на клетке, является антителами, которые связываются с карбоксиметиллизином.
25. Способ по любому из пп. 16 или 17, где антитело, которое связывается с AGE-модифицированным белком на клетке, вводят в виде стерильной композиции, содержащей фармацевтический носитель.
26. Способ по п. 17, где лечение указанного аутоиммунного нарушения включает лечение ревматоидного артрита.
| US 20130131006 A1, 23.05.2013 | |||
| WO 2014136114 A1, 12.09.2014 | |||
| DRINDA S., et al., Identification of the advanced glycation end products N(epsilon)-carboxymethyllysine in the synovial tissue of patients with rheumatoid arthritis.Ann Rheum Dis | |||
| Топчак-трактор для канатной вспашки | 1923 |
|
SU2002A1 |
| US 20090022659 A1, 22.01.2009 | |||
| IKEDA K., et al., Immunochemical approaches to | |||
Авторы
Даты
2020-05-20—Публикация
2015-09-15—Подача